ATOMPHYSIK
Werbung

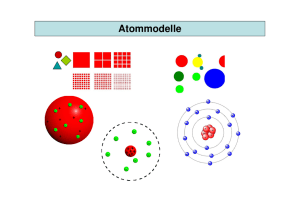
ATOMPHYSIK Gábor Talián Univ. Pécs, Institut für Biophysik 15-22. September 2016 PRÜFUNGSTHEMA Die Temperaturstrahlung. Das plancksche Wirkungsquantum. Der photoelektrische Effekt. Experimentelle Beobachtungen und Erklärung des Phänomens. Die Einstein-Gleichung. Lehrbuch: 106-113 S. Ende XIX-en Jahrhunderts Aufbau von Physik grundsätzlich beendet. Erkannte Zusammenhänge und Konstanten müssen nur genauer gemacht werden: Im XX-en Jahrhundert wird es die Physik der fünften Stelle nach dem Komma sein. Das klassische physikalische Modell Physik beruht sich auf den Gesetzen der herkömmlichen Mechanik, den Maxwell-Gleichungen in Elektromagnetischen Erscheinungen und der statistischen Verteilung von Energie in thermodynamischen Systemen. Die Bewegungsparameter und die Position der Körper – von den größten (wie Sternen und Planeten) bis ab den kleinsten (?) – ist theoretisch beliebig genau in jedem Moment zu berechnen. Die Eigenschaften eines Systems sind in jedem zustand eindeutig bestimmt und können in den nachkommenden Zuständen ebenso erkannt und vorhergesagt werden. Einige winzige, unangenehme Wolken auf dem klaren Himmel der Physik • • • • • • Radioaktivität Schwarzkörperstrahlung Photoelektrischer Effekt Linienspektrum von Elementen (H) Spezifische Wärme der Gase Konstanz der Lichtgeschwindichkeit Sie waren aber erwartet bald erklärt und in das klassische Modell gefügt zu werden. Die Grundstruktur der Materie: Gibt es Atome? • Leukipp, Demokrit atomos (ατομος) – unteilbar • Dalton (1803) – – – – Stoffe bestehen aus unteilbaren Atomen Atome können nicht geschöpft oder zerstört werden Die Atome eines Elementes sind gleich Die Atome verschiedener Elemente unterscheiden sich nur in Größe und Masse – in Verbindungen mischen sich die Atome nach konstanten Proportionen (wie ganze Zahlen) Massenerhaltung Biliardkugel-Modell • Mendelejev - periodisches System • J.J.Thomson (1897) – Entdeckung des Elektrons, Einheit von negativer elektrischer Ladung – Es entsteht aus jedem Element (Metall im Kathodenstrahlrohr) – Seine Masse ist ~1800-fach weniger als die des leichtesten Elements (H) – Das Atom kann nicht unteilbar bzw. der kleinste Baustein des Stoffes sein! „Rosinenkuchenmodell“ (1904) • Ludwig Boltzmann Er beging Selbstmord in 1906 (!), weil seine Kollegen ihm nicht abnehmen wollten, dass es Atome wirklich gibt. (heute: Einzelne Atome können mit Rastertunnelmikroskop untersucht -„gesehen“ - werden.) PROBLEM I. : SCHWARZKÖRPERSTRAHLUNG Problemstellung: Körper können EM Strahlung aufnehmen und abgeben. Wie kann das Ausstrahlungsspektrum des schwarzen Körpers erklärt werden? Schwarzkörperstrahlung ∙ 5,67 ∙ 10 Stefan-Bolzmann Konstante Wilhelm Wien, 1864-1928 Ludwig Boltzmann, 1844-1906 Jozef Stefan, 1835-1893 Schwarzkörperstrahlung „Die große Tragödie der Wissenschaft - die Erledigung einer wunderschönen Hypothese durch eine häßliche Tatsache“ Thomas Huxley ! 6,626 ∙ 10 # $% Max Planck, 1858-1947 der photoelektrische Effekt U Albert Einstein, 1879-1955 PRÜFUNGSTHEMA Der Rutherford-Versuch. Das rutherfordsche Atommodell. Die bohrschen Postulate. Das bohrsche Atommodell. Das Teilchen-Welle Modell von de Broglie. Der Franck-Hertz Versuch. Lehrbuch: 106-113 S. PROBLEM II. – LINIENSPEKTRUM VOM WASSERSTOFF Problemstellung: Das Absorptionsoder Emissionsspektrum des Wasserstoffs besteht aus diskreten Linien mit bestimmten Positionen bezüglich des kontinuierlichem weißem Lichtspektrum. Es bedeutet, dass der Wasserstoff kann Photonen nur mit gewissen Wellenlängen/Energien aufnehmen oder aussenden. Warum ist es so? 121,57 n m ultraviolett 656,3 n m 102,57 n m 1875 n m 486,1 n m 97,25 n m 4050 n m 1282 n m 434 n m 2630 n m 2170 n m 1460 n m 820 n m 1094 n m 1005 n m 955 n m 410,2 n m 397 n m 388,9 n m 365 n m 91,1 n m 94,97 n m 93,78 n m 93,07 n m 92,62 n m Das Spektrum vom Wasserstoff sichtbar Johann Balmer, 1825-1898 Johannes Rydberg, 1854-1919 infrarot Wellenlänge (nm) der Versuch von Rutherford Ernest Rutherford, 1871-1937 „Es war so ziemlich das unglaublichste Ereignis, das mir je in meinem Leben widerfahren ist. Es war so unglaublich, wie wenn man eine 15-Zoll-Granate auf ein Stück Seidenpapier abgefeuert hatte, und diese wäre zurückgeprallt und hätte den Schützen getroffen“ das Planetenmodell im Wasserstoffatom das Elektron umkreist den Atomkern Zentripetalkraft = elektrische Kraft (bei anderen Elementen: Wechselwirkung zwischen den Elektronen Dreikörperproblem, usw. ) ./ ) ∙ &'( * ∙ + ∙ ,- 0 r v m F &)1 2 ∙ 3/ 0 4 . / 2 ∙ 3/ ∙ * ∙ + ∙ ,- 0/ 0 Klassische Physik kann die Stabilität des Atoms nicht erklären bohrsche Postulate Postulat: ein Grundsatz bezeichnet für eine Theorie oder ein formales System, der keine neuen Terme einführt, aber nicht aus den gegebenen Definitionen abgeleitet werden kann. Ein Postulat gilt als Axiom, wenn sich aus ihm andere Theorien des Systems oder der Alltagserfahrung herleiten lassen, deren Geltung bereits bekannt ist oder beschlossen wurde. Niels Bohr, 1885-1962 1. Elektronen bewegen sich um den Atomkern auf Kreisbahnen nach den Gesetzen der klassischen Physik. Die Energie eines Elektrons im Atom kann nur diskrete Werte (En) annehmen. 2. Jede Energieabgabe oder -aufnahme des Elektrons kann nur durch Übergänge zwischen den stabilen Bahnen in Quanten erfolgen, die der Differenz von zwei erlaubten Bahnenenergien entsprechen. ! ∙ 5 67 − 69 3. Nur wenige stabile Atombahnen des Elektrons um den Atomkern existieren, wo es keine Energie verliert. Die Bahnen müssen die folgende Quantenbedingung erfüllen: : ∙;∙< =∙! 2> Die Gesamtenergie der Bahn ist die Summe der potentiellen und der kinetischen Energie. Elektronen in nicht erlaubten Positionen müssen sich sofort auf die energetisch nächst niedrige stabile Bahn begeben, und die Überschußenergie wird als EM Welle abgestrahlt. Nur ganz bestimmte Drehimpulse sind erlaubt: ?: ∙ ; ∙ < = ∙ @ L m • v r Teilchen als Welle A ! B Louis de Broglie, 1892-1987 Kann das man auf alle Teilchen anwenden? Ein Elektron mit 100V Beschleunigung (v = 5.9*106 m/s) ! 6.626 ∙ 10# $ ∙ % A 1.2 ∙ 10FK 0.12= ∙; 9.11 ∙ 10#F GH ∙ 5.9 ∙ 10I /% Ein geworfener Baseball (v = 40 m/s, m = 0.15 kg) A 1.1 ∙ 10# (Atomkern: 10-14 m) ELEKTRON: STOFF oder WELLE? Experiment: Davisson, Germer 1926, Nobelpreis 1937 A L m • v r Kreislauf: ! B Die rydbergsche Konstante Der Franck-Hertz Versuch (1913) James Franck, 1882-1964 Gustav Hertz, 1887-1975 PRÜFUNGSTHEMA Das quantenmechanische Atommodell, Wellenfunktion. Quantenzahlen Der Stern-Gerlach und Eintein-de Haas Versuch. Die heisenbergsche Unschärferelation. Lehrbuch: 6-18 S. PROBLEM III. – DIE WELLENNATUR DES ELEKTRONS Problemstellung: Wie kann etwas sowohl ein Teilchen als auch eine Welle sein? Was ist die „wellende” physikalische Größe in dem Elektron? Erwin Schrödinger, 1887-1961 de-Broglie-Wellenlänge λ= h = p h 2m E Quantenzahlen l ist die Nebenquantenzahl : P ∙ P M 1 ∙ ! 2∙> m (ml) ist die magnetische Quantenzahl : ∙ ! 2∙> Z-komponent des Drehimpulses in einem magnetischen Feld Spin: Eigendrehimpuls L % ∙ % M 1 ∙ ! 2∙> s ist die Spinquantenzahl N 4// ! L ∙ 2∙> Z-komponent des Drehimpulses in einem magnetischen Feld ms ist die magnetische Spinquantenzahl 2N ∓4// Stern - Gerlach Versuch Otto Stern, 1888-1969 Walter Gerlach, 1889-1979 Einstein - de Haas Versuch Wander Johannes de Haas, 1878-1960) Elektronenbahnen heisenbergsche Unschärferelation ∆p · ∆x ≥ h/4π = ħ/2 Werner Heisenberg, 1901-1976 Impuls ∆ x ∆px ≥ Ort h 2 Plancksche Konstante ∆ y ∆p y ≥ h 2 ∆z ∆pz ≥ h 2 ∆ t ∆E ≥ h 2 Zwei komplementäre Zustände (hier: Impuls und Ort) lassen sich nie mit beliebiger Genauigkeit messen Zentrale Unterschiede von klassicher und quantenmechanischer Sicht Klassische Theorien Quantenmechanik (Newtonsche Mechanik, Maxwell Elektrodynamik) •Deterministisch aus maximaler Beobachtung eindeutig auf Zukunft und Vergangenheit schliessen •Indeterministisch nur wirklichscheinlichkeitsaussagen •Teilchen: Orts&Impuls&Zeit Punkte •Teilchen: Wellenfunktion •Realität lokal •Realität nichtlokal d.h. räumlich entfernte Teilchen sind nur über Kräfte verknüpft, Lichtgeschwindigkeit •Kontinuierlich: Energie und Drehimpuls kann jeden Wert annehmen auch weitentferne Teilchen sind verschränkt (Überlichtgeschwindigkeit) •Gequantelt: Energie und Drehimpuls haben nur diskrete Werte PHYSIKALISCHE KONSTANTEN Symbol und Formel Zahlwert Größenordnung und Maßeinheit Bemerkung Symbol und Formel Lichtgeschwindigkeit in Vakuum c0, c 2,997 924 58 108 m·s–1 Zahlwert Größenordnung und Maßeinheit Konstante von Avogadro wirklich fundamental NA 6,022 141 99(47) 1023 mol–1 Gravitationskonstante G 6,673 10–11 m3·kg–1·s–2 h 4,1356 10–34 J·s 10–15 eV·s F = e·NA wirklich fundamental Elementarladung e 1,602 176 462 10–19 C 10–31 kg me 0,510 998 902 MeV Nicht wirklich fundamental; kann errechnet werden in Prinzip 8,314 472(15) J·mol–1·K–1 k = R/NA 1,380 6503 8,617269 10–23 J·K–1 10–5 eV·K–1 mp 10–27 kg 1,007 276 466 u 938,271 998(38) MeV Nicht wirklich fundamental; kann errechnet werden in Prinzip Nicht wirklich fundamental mehr wirklich fundamental Magnetische Permeabilität in Vakuum µ0 = 1/∑0c2 12,566 370 614 10–7 V·s·A–1m–1 Nicht wirklich fundamental Elektrische Susceptibilität in Vakuum Masse des Protons in Ruhe 1,672 621 58 Nicht wirklich fundamental mehr Boltzmannsche Konstante Masse des Elektrons in Ruhe 9,109 381 88 96 485,3415(39) C·mol–1 Universale Gaskonstante R wirklich fundamental ? vielleicht nicht Nicht wirklich fundamental mehr Faradaysche Konstante wirklich fundamental Plancksche Konstante 6,626 068 76 Bemerkung ∑0 = 1/µ0c2 8,854 187 817 10–12 A·s·V–1m–1 Nicht wirklich fundamental DANKE FÜR IHRE AUFMERKSAMKEIT Ψ = Wellenfunktion • • • • • • • • Die sich ausbreitende physikalische Grösse in Materienwellen, die alle messbaren Informationen über das Teilchen enthält Das Elektron wird durch die Wellenfunktion repräsentiert (Ort, Zeit), wobei ψ* ψ (= ψ2) die Wahrscheinlichkeitsdichte für das Auffinden des Teilchens am gegebenen Ort und Zeitpunkt bedeutet. ψ2 (Aufenthaltswahrscheinlichkeitsdichte) über den ganzen Raum summiert ist 1, weil die Wahrscheinlichkeit für das Auffinden eines existierenden Teilchens 1 sein muss. Ψ ist eine stetige Funktion. Die Wellenfunktion wird in der Schrödingergleichung zur Berechnungen von Energie oder des Wahrscheinlichsten Werts einer Variablen benutzt. Ψ ist für ein freies Teilchen eine Sinuswelle, mit einem exakt bestimmten Impuls und einem unbestimmten Ort (siehe später). Die Wellenfunktion beschreibt das gebundene Elektron in drei Dimensionen, somit ist sie für den Wasserstoff Kugelsymmetrisch. Mit Hilfe der Wellenfunktion spielt die Schrödingergleichung die Rolle der Newtonschen Gesetze von klassischer Mechanik in atomaren und subatomaren Systemen. Sie macht Vorhersagungen über das Verhalten eines dynamischen Systems und die Wahrscheinlichkeit von möglichen Ereignissen und Ausgängen. Kein einzelner Ausgang ist strikt festgelegt, für eine grosse Anzahl an Ereignissen jedoch sagt die Schrödingergleichung die präzise Verteilung der Ergebnisse voraus. Wichtigere Quellen http://www.grund-wissen.de/physik/atomphysik/atommodelle.html http://www.tf.uni-kiel.de/matwis/amat/mw1_ge/index.html