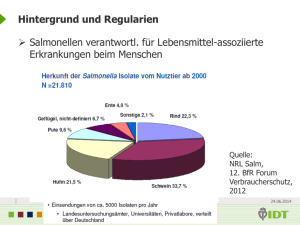
Tagungsband - Landesamt für Verbraucherschutz Sachsen
Werbung

14. Fortbildung Geflügel 2012 14. Fortbildungsveranstaltung Diagnostik und Betreuung von Wirtschafts- und Ziergeflügel 19.- 20.09.2012 Zusammenfassungen Landesamt für Verbraucherschutz Sachsen-Anhalt, Fachbereich 4 Veterinärmedizin Stendal Tierärztekammer Sachsen- Anhalt 2 „Diagnostik und Betreuung von Wirtschafts- und Ziergeflügel“ 19.- 20.09.2012 14. Fortbildungsveranstaltung des Landesamtes für Verbraucherschutz, Fachbereich Veterinärmedizin und der Tierärztekammer Sachsen-Anhalt Tagungsort: Landratsamt Stendal, Hospitalstr. 1 - 2, 39576 Hansestadt Stendal Mittwoch, 19.09.2012, 13.00 - 18.00 Uhr „Arzneimittelsicherheit, Diagnostik, Geflügelkrankheiten“ Begrüßung Herr Dr. Reckling, Fachbereichsleiter Veterinärmedizin 13.00 Uhr Referent Titel Zeit B.-A. Tenhagen (Berlin) Monitoring von MRSA und cephalosporinresistenten E. coli in der Geflügelproduktion 13.10 Uhr I. Emmerich (Leipzig) Neues zum nationalen Arzneimittelrecht 13.30 Uhr M. Wolf-Reuter (Lohne) Möglichkeiten der Arzneimittelreduktion im Rahmen der tierärztlichen Bestandsbetreuung von Puten 13.50 Uhr J. Böhme (Leipzig) Therapie der Ornithose von Ziervögeln und Tauben mit Doxycyclin 14.10 Uhr V. Stanev (Paris) The use of decoquinate in anticoccidial rotation programmes 14.30 Uhr Diskussion 1.Block 14.50 Uhr Kaffeepause 15.00 Uhr G. Fritzsch (Leipzig) Molekulare Diagnostik beim Wirtschaftsgeflügel am Beispiel der Infektion mit Influenza A Virus 15.45 Uhr V. Herwig (Stendal) Diagnostik von Geflügelkrankheiten am Fachbereich Veterinärmedizin des LAV Sachsen-Anhalt 16.05 Uhr T. Eckert (Stendal) Untersuchung von Tieren besonders geschützter Arten Organophosphatvergiftung bei Saatkrähen - ein Fallbericht - 16.15 Uhr I. Hasenbein (Stendal) Fallbericht aus der Zoovögelpopulation am Beispiel des Maguaristorches 16.25 Uhr A. Stamm (Visbek) Diagnostisch relevante Ergebnisse experimenteller Salmonelleninfektionen bei der Pute 16.45 Uhr Diskussion 2. Block 17.05 Uhr Aktuelles aus der Praxis C. Geißler (Dresden) Einsatz als Geflügelfachberater in China – ein Erfahrungsbericht Gemeinsames Abendessen im „Hotel am Bahnhof“, Bahnhofstrasse 30 in Stendal 17.15 Uhr 17.30 Uhr 19.00 Uhr 3 Donnerstag, 20.09.2012, 08.30 - 13.00 Uhr „Geflügelseuchen, Zoonosen, Geflügelkrankheiten“ Referent Titel Zeit T. Harder (Greifswald) Möglichkeiten phylogenetischer Untersuchungen bei aviärer Influenza: H9N2 Infektionen bei Geflügel und Wildvögeln in Deutschland 08.35 Uhr R. Küblböck (Penig) Ausbreitung u. Bekämpfung der niedrigpathogenen Aviären Influenza in Sachsen 08.55 Uhr K. Albrecht (Teltow) Wildvogelmonitoring im Land Brandenburg zum Nachweis aviärer Influenzaviren 09.15 Uhr K.-P. Behr (Cloppenburg) Räumung großer Geflügelbestände: Rechtslage, Konzepte, Verfahren 09.35 Uhr Diskussion 3. Block 09.55 Uhr Kaffeepause 10.00 Uhr H. M. Hafez (Berlin) Bericht über das 9. Internationale Symposium über Putenkrankheiten in Berlin 10.45 Uhr U. Noack (Stendal) Stand der Bekämpfung von Zoonosen und ihrer Erreger bei Wirtschaftsgeflügel in Sachsen-Anhalt 11.10 Uhr P. Wefstaedt (Cuxhaven) AviPro Salmonella Duo, der erste bivalente Salmonella Lebendimpfstoff für Hühner u. Enten 11.30 Uhr I. Bräunig (Cuxhaven) Tränkwasserhygiene als Teil innovativer Tiergesundheitsstrategien 11.50 Uhr L. Lauterbach (Haldensleben) Mineralisationsstörung und Minderwuchs in einem Putenbestand – ein Fallbericht 12.10 Uhr Diskussion 4. Block 12.30 Uhr Schlusswort der Organisatoren 4 Sponsoren/ Ausstellerverzeichnis Microbiology Division - Oxoid und Remel Produkte Thermo Fisher Scientific (M4) Virbac (M5) MSD Tiergesundheit Intervet Deutschland GmbH (M3) Bayer Vital GmbH (M6) Pfizer GmbH Merial GmbH (M7) ESTEVE GmbH Albrecht GmbH (M8) Lohmann Animal Health GmbH (M2) Kesla Hygiene AG (M1) Serumwerk Bernburg AG (M1) 5 Monitoring von MRSA und cephalosporinresistenten E. coli in der Geflügelproduktion Katja Alt, Bernd-Alois Tenhagen, Andreas Schroeter, Beatriz Guerra, Alexandra Fetsch, Bernd Appel und Annemarie Käsbohrer Bundesinstitut für Risikobewertung, Max-Dohrn-Str. 8-10, 10589 Berlin MRSA Methicillin-resistente Staphylococcus aureus (MRSA) sind Keime, die beim Menschen unter anderem Wundinfektionen und Entzündungen der Atemwege hervorrufen können und gegen bestimmte Antibiotika resistent sind. Bestimmte MRSA-Stämme kommen aber auch bei Lebensmittel liefernden Tieren, unter anderem bei Masthähnchen und Mastputen sowie daraus gewonnenem Fleisch vor. Die Behörden des Bundes und der Länder untersuchen seit 2009 systematisch im Rahmen des Zoonosen-Monitorings die Produktionsketten „Masthähnchen“ und „Mastpute“ von der Primärproduktion, über den Schlachthof bis hin zum Lebensmittel im Einzelhandel auf das Vorkommen von MRSA. Die Ergebnisse aus 2009 und 2010 zeigen, dass MRSA in den untersuchten Produktionsketten weit verbreitet sind. Die Nachweisraten in Staub aus Geflügelbeständen lagen zwischen 0,7 % bei Masthähnchenund 19,6 % in Mastputenbetrieben. Die Nachweisraten bei der Fleischgewinnung unterscheiden sich stark von der Situation in der Primärproduktion. Am häufigsten wurde MRSA bei Proben von Putenkarkassen am Schlachthof (61,7 % in 2009 und 65,5 % in 2010) nachgewiesen. Im Einzelhandel wurde Hähnchenfleisch und Putenfleisch untersucht. Die höchste MRSA-Nachweisrate bei Lebensmitteln wies Putenfleisch in 2009 mit 43,4 % auf. Hähnchenfleischproben waren zu 23,7 % MRSA-positiv. Das Resistenzspektrum der Isolate ist breit. Isolate aus dem Zoonosen-Monitoring 2010 aus den unterschiedlichen Lebensmittelstufen wiesen jeweils einen Anteil von über 80 % resistenter Isolate gegenüber mindestens 5 Wirkstoffklassen auf. Die höchsten Raten wiesen Isolate aus Hähnchen- und Putenfleisch (82,3 % bzw. 80,5 %) auf. Nach den ß-Laktamen waren die höchsten Resistenzraten bei den meisten Herkünften gegenüber Tetrazyklin, Erythromycin und Clindamycin festzustellen. Isolate aus der Lebensmittelkette Putenfleisch waren zudem häufig (>50%) resistent gegen Quinupristin/Dalfopristin und Tiamulin. Über 30% der Isolate aus der Putenfleischkette waren auch resistent gegen das getestete Fluorchinolon Ciprofloxacin. ESBL-Bildner Extended Spectrum Betalaktamasen (ESBL)-bildende Bakterien sind gegen Cephalosporine der 3. und 4. Generation resistent. Resistenzen gegen diese von der WHO als critically important antimicrobials eingestuften Substanzen führen zu einer Verschlechterung der Therapierbarkeit von Infektionen mit gramnegativen Keimen wie Escherichia coli, Salmonellen und Klebsiellen. Das Vorkommen solcher Keime in der Lebensmittelkette steht im Verdacht, zum Resistenzproblem in Einrichtungen des Gesundheitswesens beizutragen. In welchem Umfang dies geschieht ist allerdings nicht klar. In repräsentativen Erhebungen im Rahmen des Zoonosen-Monitorings in den Jahren 2009 und 2010 wurden bei Nutztieren und in Lebensmitteln auch ESBL-bildende Salmonellen und kommensale E. coli nachgewiesen. Dabei wurde bei E. coli-Isolaten von Masthähnchen ein Anstieg der Resistenz gegen Ceftazidim von 5,9 % in 2009 auf 13,5% in 2010 beobachtet. Auch bei Hähnchenfleisch wurden bei 6,2 % der E. coli-Isolate in 2009 Resistenzen gegen Ceftazidim, ein Cephalosporin der dritten Generation, nachgewiesen. Auch bei Legehennen, Puten und Putenfleisch wurden solche Keime nachgewiesen, allerdings seltener als in der Lebensmittelkette Hähnchenfleisch. 6 7 Neues zum nationalen Arzneimittelrecht Ilka Ute Emmerich VETIDATA am Institut für Pharmakologie, Pharmazie und Toxikologie Veterinärmedizinische Fakultät der Universität Leipzig An den Tierkliniken 15 04103 Leipzig Seit November 2011 liegt die 16. Novelle des Arzneimittelgesetzes im dritten Entwurf (18.07.2012) vor. Ziel der Novellierung ist laut Vorblatt „den sorgfältigen Einsatz und verantwortungsvollen Umgang mit Antibiotika zur Behandlung von erkrankten Tieren zu fördern und zu verbessern, um das Risiko der Entstehung und Ausbreitung von Antibiotikaresistenzen zu begrenzen sowie der Überwachung eine effektivere Aufgabenwahrnehmung insbesondere im Tierhaltungsbetrieb zu ermöglichen“. Der dritte Entwurf enthält zusätzlich ein an den Tierhalter gerichtetes verbindliches Antibiotikaminimierungskonzept, das in der Agrarministerkonferenz am 27. April 2012 gefordert wurde. Insgesamt werden mit dem Entwurf eine Reihe von Ermächtigungen geschaffen, um folgende Regelungen treffen zu können: 1. Verbindliche Beachtung bestimmter Parameter der Packungsbeilagen von Antibiotika (§ 56a Absatz 3 Nr. 2 AMG) Um den verantwortungsvollen und zulassungskonformen Umgang mit Antibiotika zu verbessern, soll die Therapiefreiheit des Tierarztes begrenzt werden. Geplant ist bei Antibiotika in bestimmten Fällen einzelne Vorgaben der Packungsbeilagen verbindlich vorzuschreiben. 2. Verpflichtung zur Erstellung eines Testes zur Bestimmung der Empfindlichkeit von Erregern in bestimmten Fällen (§ 56a Absatz 3 Nr. 3 AMG) Zur Optimierung der tierärztlichen Diagnostik, insbesondere zur nachhaltigen Verbesserung der Behandlung von Tierbeständen, soll in bestimmten Fällen ein Antibiogramm sowie die dazu notwendigen Verfahren vorgeschrieben werden. 3. Verbot der Abgabe von Antibiotika in bestimmten Fällen (§ 56a Absatz 3 Nr. 4b Doppelbuchstabe cc AMG) Bei wiederholter und erheblicher Überschreitung der Kennzahl der Therapiehäufigkeit nach § 58a [siehe Nr. 7] soll vorgeschrieben werden, dass nur noch der Tierarzt Antibiotika im landwirtschaftlichen Betrieb selbst anwenden darf. Damit dürften Tierhalter Bestände, die mehrfach durch einen stark überdurchschnittlichen Antibiotikaverbrauch aufgefallen sind, nicht mehr selbst antimikrobiell behandeln. 4. Einschränkungen der Umwidmung von in der Humanmedizin besonders bedeutsamen Antibiotika (§ 56a Absatz 3 Nr. 5 AMG) Um die Entstehung und Ausbreitung von Resistenzen insbesondere gegen Wirkstoffe der für die Humanmedizin wichtigen Gruppen der Fluorchinolone und Cephalosporine zu verhindern bzw. zu minimieren, wird geplant, die Umwidmung der genannten Antibiotika in bestimmten Fällen generell zu verbieten. 5. Zusendung von Nachweisen an die zuständige Behörde durch Tierärzte in bestimmten Fällen (§ 56a Absatz 3 Satz 3 AMG) Für den Fall, dass der Überwachungsauftrag der Behörden mit anderen Überwachungsmaßnahmen in nicht ausreichendem und gleichmäßigen Maße erfüllt oder gesichert werden kann, soll der Tierarzt durch die Behörde dazu verpflichtet werden können, 8 Nachweise über Abgabe, Verschreibung und Anwendung bestimmter Arzneimittel der zuständigen Behörde zusammengefasst zu übermitteln. 6. Nachweispflichten für bestimmte Tierhalter nicht Lebensmittel liefernder Tiere (§ 57 Absatz 3 AMG) Da sich auch aus einer unsachgemäßen Anwendung verschreibungspflichtiger Arzneimittel z. B. Antibiotika, bei Hunden oder Katzen Risiken wie die Ausbreitung von Antibiotikaresistenzen bei Tieren und Menschen ergeben können, soll für Personen, die Tiere in einem Tierheim oder gewerbsmäßig Wirbeltiere züchten oder halten, vorgeschrieben werden können, dass sie Nachweise über den Erwerb verschreibungspflichtiger Arzneimittel zu führen haben. Mit dieser Regelung kann die Überwachung dann nachvollziehen, ob die Anwendung verschreibungspflichtiger Arzneimittel auf den Tierarzt zurückgeht, der das Tier kennt und behandelt hat oder ob der Tierhalter verschreibungspflichtige Arzneimittel zur Anwendung bei Tieren im Wege des Internethandels erworben hat, ohne dass eine Verschreibung des behandelnden Tierarztes vorlag. 7. Schaffung eines verbindlichen Antibiotikaminimierungskozepts (§§ 58a und b AMG) Mit den neu eingefügten § 58a und § 58b AMG werden Reglungen für ein an Tierhalter, die Geflügel, Rinder oder Schweine zu Mastzwecken halten, gerichtetes verbindliches Antibiotikaminimierungskonzept getroffen. Dieses Konzept beinhaltet Regelungen über die Ermittlung der tierhalterbezogenen monatlichen und jährlichen sowie der bundesweiten Therapiehäufigkeit mittels einer Datenbank. Mithilfe der Daten soll der quantitative Antibiotikaeinsatzes auf Betriebsebene beurteilt werden. Liegt die tierhalterbezogene jährliche Therapiehäufigkeit über dem bundesdeutschen Durchschnitt, muss der Tierhalter einen Tierarzt hinzuziehen und ein Antibiotikaminimierungskonzept erstellen. Hält die zuständige Behörde die Bemühungen des Tierhalters für unzureichend, kann sie (gestützt auf den Stand der veterinärmedizinischen Wissenschaft) Anordnungen zur Anwendung der Antibiotika (Anwendung nur durch den Tierarzt [siehe Nr. 3]), und z.B. zu Hygiene, Impfungen, Fütterung, Mastdauer und sogar zur Unterbringung der Tiere treffen. 8. Übermittlung von Daten über Abgabemengen an Landes- und Bundesbehörden und deren Nutzung zu Monitoringzwecken (§ 67a Absatz 3a AMG) Mit dieser neu eingeführten Ermächtigung wird die Möglichkeit geschaffen, Regelungen zur Übermittlung von personen- und betriebsbezogenen Daten durch das Deutsche Institut für Medizinische Dokumentation und Information (DIMDI) an die zuständigen Behörden des Bundes und der Länder zu treffen. Damit können dann die erhobenen Daten auch zu Monitoringzwecken genutzt werden, um Risiken durch die Anwendung von Antibiotika bei Tieren zu bewerten. 9. Im Einzelfall mögliche Übermittlung von Daten der Tierschutz- und Lebensmittelüberwachungsbehörden an die Arzneimittelüberwachungsbehörden (§ 69b AMG) Zur Überprüfung der Plausibilität der Arzneimittelanwendungsdokumentation im Bestand soll es für die Überwachungsbehörde zukünftig auch möglich sein, bestimmte tierschutzrelevante oder hygienerelevante Daten heranzuziehen, um die Auswertung zu verbessern. Literatur: Entwurf eines Sechzehnten Gesetzes zur Änderung des Arzneimittelgesetzes vom 18.07.2012 Ergebnisprotokoll der Agrarministerkonferenz am 27. April 2012 in Konstanz 9 Möglichkeiten der Arzneimittelreduktion im Rahmen der tierärztlichen Bestandsbetreuung von Puten Dr. Martina Wolf-Reuter Praxis am Bergweg, Bergweg 20, 49393 Lohne Einleitung In der gesellschaftspolitischen Diskussion über eine vermehrte Resistenzbildung von humanpathogenen Keimen ist der Einsatz von Antibiotika in der Tierhaltung in den Fokus der Öffentlichkeit gelangt. Zum einen wird der mengenmäßig zu hohe Einsatz, zum anderen eine unterdosierte oder zu kurze Applikation kritisiert. Im nachfolgenden werden Einflüsse auf die gesundheitliche Situation von Putenbeständen benannt und Maßnahmen zur Gesunderhaltung und zur Krankheitsprophylaxe aufgezeigt, die auch zur Reduktion des Antibiotikaverbrauches beitragen können. Die genetischen Voraussetzungen, der Status der Elterntiere und der Verlauf der Brut unterliegen nicht dem Einfluss des Betriebsleiters. Auch das Futter sowie die standortspezifischen Umweltbedingungen sind vom Landwirt kaum zu beeinflussen. Dagegen bieten Maßnahmen aus den Bereichen Hygiene, Haltung, Immunprophylaxe, alternativer Therapie, Nahrungsergänzung sowie Therapieoptimierung vielfältige Verbesserungsmöglichkeiten. Hygiene Um den Eintrag von tier- und menschenpathogenen sowie Lebensmittel-relevanten Erregern zu verhindern bzw. zu minimieren sind zunächst bauliche Voraussetzungen zu erfüllen. Befestigte Vorplätze, intakte Boden-Wandanschlußbereiche sowie Bodenplatten erschweren pathogenen Keimen und potentiellen Keimüberträgern den Rückzug und ermöglichen erst eine ordentliche Reinigung und Desinfektion. In der Servicephase sind die Reinigungsmaßnahmen mit Akribie durchzuführen und die nachfolgenden Desinfektionsmaßnahmen an die eventuellen Krankheitsprobleme des Vordurchgangs und die Jahreszeit anzupassen. Bei Befall muss eine Käferbekämpfung durchgeführt werden, da sonst die Infektkette z.B. für Salmonellen, Mykoplasmen etc. nicht unterbrochen werden kann. „Vergessene“ Stallgerätschaften und nur kurzfristig benutzte Einrichtungsgegenstände, z.B. aus der Aufzuchtphase, im Stall genutzte Fahrzeuge sowie der Vorraum gehören in die Reinigungs- und Desinfektionsmaßnahmen. Ein zentraler kritischer Punkt ist die Wasserhygiene. In der Servicephase sollen durch Spülund Desinfektionsmaßnahmen eine optimale Keimreduktion und Entfernung des Biofilmes erreicht werden, die in der Belegungsphase durch geeignete Maßnahmen aufrecht erhalten werden muss. Eine Kontrolle der Desinfektionsmaßnahmen in der Servicephase sowie des hygienischen Status in der Belegungsphase über ein Screening schaffen Sicherheit. Haltungsbedingungen Kernpunkte bei der Optimierung der Haltungsumwelt sind die klimatischen Verhältnisse (angepasst an die Lebensphase des Tieres), die Bodenverhältnisse und eine engagierte Tierbetreuung. Auf Grund ihrer Herkunft benötigt die Pute eine sauerstoffreiche, staub- und schadstoffarme sowie zugfreie Luft. Hierbei sind die technischen Voraussetzungen, eine regelmäßige Kontrolle der Mess- und Lüftungseinrichtungen sowie die Pflege der Bausubstanz essentiell. Die Qualität der Einstreu beeinflusst das Stallklima sehr stark. Ebenso stellt eine feuchte bzw. nasse sowie zu harte Einstreu eine Infektionsquelle für die Haut dar. Generell gilt so trocken und weich wie möglich. 10 Nicht zu unterschätzen ist der Faktor Mensch. Eine engagierte Tier- und Technikkontrolle ermöglicht eine frühzeitige Reaktion auf Störungen im Stall oder gesundheitliche Probleme. Immunprophylaxe Die frühzeitige Impfung gegen potentiell pathogene Viren und Bakterien kann nicht immer eine Infektion verhindern, mildert aber den klinischen Verlauf erheblich. Aufbauend auf dem maternalen Immunstatus des Putenkükens sollte ein weitergehendes, dem Betrieb und dem Standort angepasstes Impfprogramm erstellt werden. Dies beinhaltet die Anwendung von Lebendimpfstoffen, die über das Trinkwasser, Spray oder via eyedrop appliziert werden. Zusätzlich kommen inaktivierte Adsorbatimpfstoffe per Injektion zum Einsatz. Neben kommerziellen Inaktivat-Impfstoffen werden zunehmend stallspezifische Impfstoffe verwendet. Hier kann auf die spezielle Situation eines Betriebes reagiert werden. Voraussetzung ist eine umfassende Diagnostik der vorhergehenden Durchgänge, die den Aufbau einer „Betriebsdatenbank“ ermöglicht. Eine zweifache Applikation von Inaktivatvakzinen verbessert die Immunantwort gegenüber der einmaligen Impfung. Die Applikation von Lebendimpfstoffen via eyedrop ergibt den gleichmäßigsten Impfschutz einer Herde. Dies zeigt sich in verringerten Mortalitätsraten und Verwurfszahlen sowie verbesserten Leistungsparametern wie Endgewichten, täglicher Zunahme und einem verringerten Arzneimitteleinsatz. Therapieoptimierung Für den Einsatz von Medikamenten und Impfstoffen über das Tränkewasser ist die Wasserqualität und Hygiene entscheidend. Regelmäßige Untersuchungen des Wassers und des Tränkesystems bezüglich des Keimgehaltes, dem Vorkommen pathogener Keime sowie chemischer und physikalischer Parameter sind Voraussetzung für eine exakte Applikation mit optimaler Löslichkeit und Wirksamkeit des Medikamentes. Um Fehldosierungen und damit Wirkungsverluste zu vermeiden, müssen die reelle Wasseraufnahme der Herde und die Wasserkapazität der Dosiereinrichtungen bekannt sein. Nach Beendigung einer Therapie müssen das gesamte Wassersystem inkl. Vorlaufbehälter bzw. Dosiereinrichtung gereinigt und gespült werden. Nur so können ungewollte Arzneimittelablagerungen entfernt werden, die zu einer unterdosierten Gabe von Arzneimittelresten führen würden. Nahrungsergänzung und Therapiebegleitung In bestimmten Lebensphasen kann die Ergänzung von bereits im Tierfutter enthaltenen essentiellen Bausteinen, wie Vitamine, Mineralstoffe, Spurenelemente und Aminosäuren notwendig sein. Phytotherapeutika können je nach Schwere einer Erkrankung eine allopathische Therapie ersetzen oder ergänzen. Zum Aufbau der Darmflora sowie bei Dysbioseproblemen ist der frühzeitige und kontinuierliche Einsatz von Probiotika möglich. Fazit Durch eine optimale Haltungsumwelt, Hygiene und Ernährung sowie individuelle Impfkonzepte kann der Einsatz von Antibiotika verringert werden. Aber erkrankte Tiere haben das Recht auf eine angemessene Therapie und Tierärzte haben die Aufgabe, Leiden und Krankheiten der Tiere zu verhüten, zu lindern und zu heilen. Wenn behandelt werden muss, dann sollten alle Bedingungen so sein, dass eine Therapie die Tiere optimal erreicht. 11 Therapie der Ornithose von Ziervögeln und Tauben mit Doxycyclin Julia Böhme, Josephine Stolze, Maria Elisabeth Krautwald-Junghanns Klinik für Vögel und Reptilien, Veterinärmedizinische Fakultät, Universität Leipzig An den Tierkliniken 17, 04103 Leipzig Einleitung Die Ornithose ist auch unter den Synonymen Papageienkrankheit und Papageienpest bekannt und wird durch das gramnegative Bakterium Chlamydia psittaci hervorgerufen, welches weltweit verbreitet und höchstwahrscheinlich für alle Vogelarten infektiös ist. Dieses Bakterium bildet eine infektiöse Form (Elementarkörperchen), die sich außerhalb der Zellen befindet und in der Umwelt extrem widerstandsfähig ist und vor allem im Staub über mehrere Monate hinweg ansteckend bleiben kann. Die nichtinfektiöse Form der Chlamydien stellen die Retikularkörperchen dar, die sich zwecks der Vermehrung intrazellulär aufhalten. Grundsätzlich ist eine Übertragung des Erregers vom Vogel auf den Menschen immer möglich. Einer besonderen Gefährdung unterliegen hier Personen, die beruflich oder privat ständigen Umgang mit Vögeln und Geflügel haben. Der Erreger wird kontinuierlich oder intermittierend durch Sekrete und Exkrete infizierter Tiere ausgeschieden. Die Übertragung bzw. Infektion erfolgt in der Regel aerogen durch erregerhaltigen Staub und oral durch das Füttern von Nestlingen. Der Krankheitsverlauf und die Symptomatik sind aufgrund verschiedener Serovare und vielfacher beeinflussender Faktoren sehr variabel. Im Vordergrund stehen hierbei respiratorische, gastrointestinale sowie allgemeine Symptome, wie Apathie und Leistungsdepression. Bislang galt für das Vorkommen dieser Erkrankung bei Papageienvögeln (Psittakose) in Deutschland eine Anzeige- und Bekämpfungspflichtpflicht nach der Psittakoseverordnung sowie deren Ausführungshinweisen. Das Auftreten beim Hausgeflügel und allen anderen Vogelarten (Ornithose) unterlag der Meldepflicht. Im Juli 2011 wurde die Anzeigepflicht für die Psittakose aufgehoben. Seitdem wird die Erkrankung nach einer Infektion mit Chlamydia psittaci einheitlich als Chlamydiose bezeichnet und unterliegt der Meldepflicht. Im Zuge dessen wurde im April 2012 die Psittakoseverordnung ebenfalls aufgehoben, sodass lediglich eine Meldung der Erkrankung durch die Untersuchungseinrichtungen an die zuständige Behörde erfolgt. Die Auswahl eines geeigneten Wirkstoffes zur Behandlung der Erkrankung und die Behandlungsdauer liegen nun allein im Ermessen des betreuenden Tierarztes. Diagnostik Eine ausführliche Anamnese, die klinische Symptomatik, röntgenologische pathologische Befunde können bereits hinweisend auf das Vorhandensein Chlamydieninfektion sein. Eine endgültige Diagnose kann allerdings nur durch Erreger- oder Genomnachweis gestellt werden. Als Ausgangsmaterial eignen sich Dreifachtupfer (Konjunktiva, Rachen, Kloake) Kotproben, Organproben Abklatschpräparate. sowie einer einen hierfür oder Therapie der Chlamydiose Im Erkrankungsfall haben sich bisher sowohl bei Papageienvögeln als auch bei Hausgeflügel Doxycyclin, Chlortetrazyclin und Enrofloxacin als wirksam und gut verträglich erwiesen. Auch wenn häufig lediglich Einzeltiere klinisch erkrankt und betroffen sind, sollte aufgrund des hochinfektiösen Potentials und der hohen Tenazität der gesamte Bestand behandelt werden. 12 Feldstudie zum Einsatz von Doxycyclin zur Behandlung der Ornithose bei Brief- und Rassetauben Trotz der Lockerung der gesetzlichen Rahmenbedingungen im Falle einer Chlamydiose, ist diese Erkrankung in vielen Geflügelbeständen verbreitet und stellt jederzeit eine große gesundheitliche Gefahr für den Menschen dar. Insbesondere in offenen und staubreichen Systemen, wie bspw. der Taubenhaltung sind eine weitläufige Verbreitung sowie eine Übertragung durch den engen Besitzer-Tier-Kontakt zu erwarten. Die Untersuchungen mehrerer Autoren lassen die Annahme eines erfolgreichen Einsatzes von Doxycyclin zur Therapie der Chlamydiose bei Tauben vermuten. Doxycyclin ist bereits für Brieftauben zur oralen Applikation über das Trinkwasser im Falle einer Infektion mit Salmonella typhimurium zugelassen. Nun sollte die klinische Wirksamkeit dieses Wirkstoffes in der für Brieftauben zugelassenen Formulierung im Rahmen einer nationalen Indikationserweiterung unter Praxisbedingungen in mit Chlamydia psittaci - erkrankten Taubenbeständen untersucht werden. Eine detaillierte Darstellung des Versuchsaufbaues und der Durchführung erfolgt auf der Stendaler Geflügeltagung am 19.09.2012. Die Rekrutierung teilnehmender Bestände erfolgte deutschlandweit auf freiwilliger Basis durch Aufrufe in einschlägigen Taubenzeitschriften sowie durch die Vermittlung die Bestands betreuenden Tierärzte. Ausschlaggebend war das Vorliegen einer nachweisbaren Infektion mit Chlamydia psittaci und einer klinischen Symptomatik. In 42,6 % der untersuchten Bestände wurde eine Infektion mit Chlamydien nachgewiesen; der überwiegende Anteil davon wies eine alleinige Infektion mit Chlamydia psittaci auf. Dieser Nachweis wurde signifikant häufiger bei Jungtauben gestellt (60,9 %). Bei den vorberichtlich beschriebenen Symptomen dominierten Probleme des Respirationstraktes (89,9 %) vor allgemeinen Symptomen (51,9 %) und gastrointestinalen Störungen (22 %). Bei 61,5 % der teilgenommenen und behandelten Bestände handelte es sich um Brieftauben- und bei 38,5 % um Rassetaubenbestände. Der Wirkstoff Doxycyclin wurde den Tauben über einen Zeitraum von 25 Tagen vom Halter mit dem Trinkwasser verabreicht. Über den gesamten Versuchszeitraum erfolgten drei Bestandsbesuche, in denen jeweils 10 Tiere aus dem betroffenen Schlag nach dem Zufallsprinzip klinisch untersucht wurden und eine Schlaguntersuchung erfolgte. Der Behandlungserfolg wurde anhand von Dreifachtupfern zum molekularbiologischen Nachweis von Chlamydia psittaci mittels PCR am letzten Tag der Behandlung und am letzten Tag der Nachbeobachtungsphase überprüft. Weder am letzten Tag der Behandlungsphase noch am letzten Tag der Nachbeobachtungsphase konnte Chlamydia psittaci isoliert werden. Demzufolge konnte durch die Behandlung mit Doxycyclin in einer Dosierung von 40 mg/kg Körpermasse und einer Behandlungsdauer von 25 Tagen eine Erregerfreiheit in allen teilnehmenden Taubenbeständen erzielt werden 13 The use of decoquinate in anticoccidial rotation programmes Dieter Vancraeynest, Vasil Stanev Pfizer Animal Health, 23-25 Avenue du Dr. Lannelongue, 75668 Paris Cedex 14, France Email: [email protected] Abstract A broiler floor pen trial was set up to compare the effects of two chemical anticoccidials, applied from day 0 until withdrawal time. A first group received decoquinate, which was never used in the trial facility. A second group was supplemented with robenidine, which was overused in the facility in the years preceding the trial. A control group, receiving blank feed, was also included. Each group consisted of 6 replicates of 60 broilers each, raised until day 45. Parameters assessed were body weight (BW), feed conversion rate (FCR), coccidiosis lesion scores, oocyst shedding and mortality. The group receiving decoquinate showed a significantly lower FCR than the robenidine- and the control group (1.739, 1.787 and 1.794, respectively) and led numerically to the highest final body weight (2994 g vs 2940 g and 2899 g, respectively). Eimeria oocysts were collected in the trial facility to perform an anticoccidial sensitivity test (AST). This test clearly demonstrated full sensitivity of the parasites to decoquinate, whereas they had reduced sensitivity to robenidine. This was to be expected in view of the anticoccidial history of the facility and offers an explanation for the differences in zootechnical results. Both floor pen trial and AST also demonstrate the necessity of rotating anticoccidials and shows the so-called ‘new chemical’ effect: a thorough coccidiosis clean-up when introducing a new chemical anticoccidial compound in a poultry production unit. Key words: decoquinate; broiler chicken; chemical anticoccidial Introduction Coccidiosis prevention in poultry is mostly performed using anticoccidial feed additives. These feed additives can be categorized into ionophores or chemical anticoccidials, each with their own characteristics. A big difference between both groups is that chemicals have the potential to completely block Eimeria multiplication, whereas ionophores allow for a limited excretion of oocysts known as coccidial leakage (Chapman 1984). At first sight, the high activity of chemical anticoccidials against Eimeria might make them seem the product of choice. Indeed, chemicals are hard to beat when it comes to reducing the infection pressure in a poultry house, a strategy known as chemical clean-up. This strategy has its benefits for zootechnical performance and a lot of poultry producers therefore use a chemical anticoccidial at least once per year. But the high efficacy of chemicals also bears a danger: in case part of the parasite population in a poultry house develops a reduced sensitivity to the chemical anticoccidial, the high selection pressure exerted by the product leads to a fast increase of the proportion of resistant Eimeria in the parasite population. Luckily, there are ways to slow down the development of resistance and to recover the efficacy of chemicals in case it would have decreased. One of the ways to do so is to perform correct rotation from one type of anticoccidial to one with another mode of action. The present trial describes a floor pen trial where a chemical anticoccidial (decoquinate) was introduced for the first time ever in the trial facility and – by extension – in a large geographical zone surrounding it. Therefore, the parasite population in the trial facility could be considered as ‘naive’, meaning that there was no expected reduced sensitivity to the product. In contrast therewith was a group receiving a chemical anticoccidial (robenidine) that had been overused in the facility in the years preceding the trial (an almost continuous use during two years, which is significantly longer than the advised 3 months in full 14 programme or 4.5 months in shuttle). Zootechnical and parasitological parameters were followed. Also, the floor pen results were compared to the results of an AST that was performed with the Eimeria isolate that was collected in the trial facility. Materials and methods A broiler floor pen trial was set up to compare the effects of two chemical anticoccidials, applied from day 0 until withdrawal time (WDT). A first group received decoquinate (3 days WDT), which was never used in the trial facility. A second group was supplemented with robenidine (5 days WDT), which was overused in the facility in the years preceding the trial. A control group, receiving blank feed, was also included. Each group consisted of 6 replicates of 60 broilers each, raised until day 45. Parameters assessed were body weight (BW), feed conversion rate (FCR), coccidiosis lesion scores, oocyst shedding and mortality. The AST was performed as described by Vancraeynest et al (2011). Results and discussion In the floor pen trial, the group receiving decoquinate showed a significantly lower FCR than the robenidine- and the control group (1.739, 1.787 and 1.794, respectively) and led numerically to the highest final body weight (2.994 kg vs 2.940 kg and 2.899 kg, respectively). The coccidiosis lesion scores, oocyst shedding and mortality in the floor pen trial were not significantly different between groups. Generally, lesion scores were low and the coccidiosis infection pressure therefore was therefore considered to be mild. Therefore, for the parasitological part, the AST proved a more interesting tool, since this test is based on experimental inoculation with high numbers of parasites. Both zootechnical and parasitological results in the AST demonstrated full sensitivity of the parasites to decoquinate (FCR and weight gain being not significantly different from uninfected untreated controls (UUC)), whereas they had reduced sensitivity to robenidine (FCR and weight gain being not significantly different from infected untreated controls (IUC)) (Table 2). This was to be expected in view of the anticoccidial history of the facility and offers an explanation for the differences in zootechnical results in the preceding floor pen trial, although the infection pressure in the latter was lower, as stated above. Conclusions The present trial clearly shows the positive possible zootechnical impact of the first time use of a particular chemical anticoccidial – in this case decoquinate - in a poultry facility. It also demonstrates that overusing a particular chemical anticoccidial – in this case robenidine – negatively impacts its performance. Chemical anticoccidials are very potent molecules but should be used with care to avoid reduced sensitivity to the product. The standard advice for chemical molecules is to use them for 3 months on feed mill level in a full programme or 4.5 months on feed mill level in a shuttle programme. This will correspond to one complete broiler grow-out receiving the product when used in full, or two grow-outs receiving the product when used in a shuttle programme. Moreover, the present paper demonstrated a good correlation between the results obtained in the floor pen facility and the ones obtained in the AST performed with the isolate originating from that facility. 15 References Chapman HD.1984. Drug resistance in avian coccidia (a review). Vet. Parasitol. 15: 11-27 Vancraeynest D, Marien M, Depondt W, Nérat F, Fort G, Naciri M, 2011. Efficacité du décoquinate sur la coccidiose du poulet de chair, déterminée par les tests de sensibilité aux coccidiostatiques. Journées de la Recherche Avicole, Tours, France. Table 1. Zootechnical results in the floor pen trial from day 0-45 Treatment group control decoquinate robenidine lsd P-value P<0.05 P<0.05 Body weight, g FCR 2899 2994 b a 1.794 1.739 2940 b 1.786 118.6 0.254 0.0450 0.044 Table 2: Zootechnical performances (from D13 to D22) of broiler chickens medicated or not with various anticoccidials and inoculated on day 15 with 249,000 E. acervulina sporulated oocysts isolated in the Netherlands Groups Products 1 3 3 Dose BW (g, BW (g, (mg/kg) D13) D22) 2 3 WG (g, D13-22) 4 Daily WG (g, D13-22) 4 Daily FI (g, D1322) 4 FCR (D13- 22) A UUC 462.3 a 1063.0 a² 600.7 a 66.8 a 103.4 a 1.55 b B IUC 462.8 a 904.3 b 441.6 c 49.1 b 95.4 a 1.95 a 66.4 a 103.8 a 1.56 b C Decoquinate 30 463.4 a 1061.0 a 597.6 a 5 D Nic/nar 50/50 462.9 a 940.6 b 477.6 bc 53.1 b 96.0 a 1.81 a E Diclazuril 1 463.3 a 912.4 b 449.1 c 49.9 b 94.2 a 1.89 a 510.5 b 56.7 b 97.3 a 1.72 ab F Salinomycin 60 463.4 a 973.9 b G Robenidine 33 462.5 a 940.9 b 478.4 bc 53.2 b 96.6 a 1.82 a H Toltrazuril 7 463.3 a 909.3 b 443.8 c 48.4 b 91.3 a 1.88 a 1 Each group consisted of 18 male chickens (6 birds per cage, 3 replicates) ² Doses are in mg/kg of feed, except for toltrazuril where dose is in mg/kg of BW. Taking into account an analytic error of + 20%, feed assay results from the “Institut Européen de l’Environnement de Bordeaux” were in accordance with the target values 3 Mean BW and weight gain (WG) of surviving animals 4 Parameters (daily WG, feed intake (FI) and FCR) calculated per cage, including dead birds' weight or excluded of individual performance analysis 5 A combination of nicarbazine and narasin, each included at 50 mg/kg feed 6 In a column, means not sharing a common letter differ significantly (p≤0.05) 16 17 Molekulare Diagnostik beim Wirtschaftsgeflügel am Beispiel der Infektion mit Influenza A Virus Guido Fritzsch1, Kathrin Wolf2, Lillian Roth2, Carsten Schroeder1, Jörg Gabert1 1 LDL-Labor Diagnostik GmbH Leipzig, Deutscher Platz 5b, 04103 Leipzig, [email protected] 2 QIAGEN GmbH, Qiagen Straße 1, 40724 Hilden Einleitung Influenza A-Viren gehören zur Familie Orthomyxoviridae und sind weltweit verbreitet. Es handelt sich um behüllte Viren mit einem einzelsträngigen RNA-Genom negativer Polarität. Das segmentierte Genom (8 Segmente) begünstigt die Entstehung von Reassortanten, was zur hohen genetischen Vielfalt und dem breiten Virulenzspektrum beiträgt. Influenza A Viren werden in niedrig- und hochpathogene Stämme eingeteilt. Das natürliche Reservoir für Influenza A-Viren sind aquatisch lebende Wildvögel. Hochpathogene, aviäre Influenzaviren (AIV) der Subtypen H5 oder H7 rufen bei Wirtschaftsgeflügel die Klassische Geflügelpest hervor, die zu hohen wirtschaftlichen Verlusten führen kann. Arbeitsverfahren Die molekulare Diagnostik von AIV beruht auf zwei Schritten: Isolierung von RNA (resp. DNA) und Genomnachweis mittels Polymerase-Kettenreaktion (PCR). Die Isolierung von RNA kann manuell oder automatisiert durchgeführt werden, für den Genomnachweis gibt es kommerziell erhältliche Kits wie das virotype Influenza A RTPCR Kit. Hier handelt es sich um eine real-time RT PCR zum Nachweis von Influenza Viren. Das Kit enthält alle Reagenzien zum Nachweis von Influenza A Virus-RNA, eine Positiv- und eine Negativkontrolle. Die Reverse Transkription (RT) der RNA und die anschließende Amplifikation der cDNA erfolgen in einem Ansatz, so dass die Kontaminationsgefahr minimiert ist. Die Reporter der Sonden emittiert Fluoreszenz proportional zur Menge des gebildeten Amplifikats, wodurch die Reaktion in Echtzeit (real-time PCR) verfolgt werden kann. Das virotype Influenza A RT-PCR Kit verwendet jeweils eine Primer-Sonden-Kombination spezifisch für die Virus-RNA (FAM-Fluoreszenz) sowie für die Kontroll-RNA (interne Kontrolle, HEX-Fluoreszenz). Als interne Kontrolle des Tests wird mRNA des ß-ActinHousekeeping-Gens amplifiziert, die in jeder Blut- und Gewebeprobe enthalten ist. Damit ist eine Kontrolle der Extraktion und der Amplifikation gewährleistet. Ergebnisse Für die Validierung des virotype Influenza A RT-PCR Kit wurden insgesamt 343 aviäre und porcine Tupfer- und Zellkultur-Proben (186 positive und 157 negative RNA Proben) mit bekanntem Influenza A Status getestet (Status überprüft mittels FLI-inhouse PCR: IAV-NP2(Nucleoproteingen)-PCR und IAV-M1.2-(Matrixgen)-PCR nach Spackman et al. 2002). In diesem Test zeigte das virotype Influenza A RT-PCR Kit eine diagnostische Sensitivität von 96 %, eine diagnostische Spezifität von 100 % und eine diagnostische Effektivität von 98 %. Die Nachweisgrenze liegt für die virotype Influenza A RT-PCR bei mindestens 10 Kopien pro Probe. Dabei gibt es eine hohe Übereinstimmung zwischen der Zahl der RNA-Kopien und den Ergebnissen der Amplifikation (Korrelationskoeffizient von 1,0 mit einer Effizienz von 104,7 % im virotype Protokoll). Bei einem Vergleich des Referenz-Panels für aviäre Influenza des Friedrich-Loeffler-Instituts (FLI), bestehend aus 16 HA und 9 NA Subtypen aviärer Influenza A-Viren, konnten mit der 18 virotype Influenza A RT-PCR (Ø Ct 21.08) alle bekannten Subtypen sensitiver als mit der FLI-inhouse PCR IAV-NP2 (Ø Ct 24.01) nachgewiesen werden. Außerdem konnten mit dem virotype Influenza A RT-PCR Kit zwei humane H1N1-Isolate der „Schweinegrippe“ von 2009 bis zu einer Verdünnung von 1:103 nachgewiesen werden. Es wurde keine Kreuzreaktion mit New-Castle-Disease-Viren nachgewiesen. Die Extraktion der Proben kann sowohl manuell (bei Oropharyngeal-, Tracheal- und Kloakentupferproben mit dem QIAamp Viral RNA Mini Kit, bei Gewebeproben mit dem RNeasy Kit oder dem RNeasy Fibrous Tissue Kit oder vergleichbaren, validierten Systemen) als auch automatisiert (z.B. mit dem QIAamp cador Pathogen Mini Kit auf dem QIAcube oder mit dem QIAamp Pathogen 96 Kit auf dem QIAxtractor) durchgeführt werden. Die PCR erfolgt in einem real-time Cycler wie dem Rotor-Gene oder vergleichbaren Geräten. Fazit Durch seine hohe Sensitivität ermöglicht das virotype Influenza A RT-PCR Kit den sicheren und frühzeitigen Nachweis des Erregers in Proben von Vögeln (und Schweinen) – auch den des 2009 aufgetretenen Influenza A/H1N1 Virus. Gleichzeitig können in einem Cyclerlauf z.B. neben Proben für Influenza A auch Proben auf Mg/Ms (virotype Mg/Ms PCR Kit) untersucht werden. Die Kombination der virotype® Influenza A RT-PCR mit den Extraktionsverfahren und Analysegeräten der Firma QIAGEN erlaubt ein gut aufeinander abgestimmtes Arbeitsverfahren. 19 Diagnostik von Geflügelkrankheiten am Fachbereich Veterinärmedizin des LAV Sachsen - Anhalt Volker Herwig Virologische Tierseuchendiagnostik Landesamt für Verbraucherschutz Sachsen-Anhalt Haferbreiter Weg 132-135 39576 Stendal Das Landesamt für Verbraucherschutz Sachsen-Anhalt bietet verschiedenste Dienste an. Dazu gehören: Staatliche Überwachungsprogramme (Monitoring) • Aviäre Influenza: Antikörpernachweis aus Serum (ELISA, HAH) • Newcastle–Krankheit: Impfantikörper aus Eiern und Serum (HAH) • Salmonellen (Typisierung): Bekämpfungsprogramm der Bundesrepublik Untersuchung von Tierkörpern in das LAV • Sektion und morphologische Untersuchung, Histologie, Immunhistochemie • Elektronenmikroskopie • Bakteriologie inkl. Resistenztest im Agardiffusionstest • Virologie (Anzucht in der Zellkultur und Brutei, PCR) • Parasitologie 1. Untersuchungsspektrum Atemwegserkrankungen • Paramyxoviren (auch bei Durchfallerreger bzw. Leistungsdepressionen) • Chlamydien (auch bei Durchfallerreger bzw. Leistungsdepressionen) • Aviäre Influenza (auch bei Durchfallerreger) • IBV • ILTV • Pockenviren (inkl. Kanarienpocken; auch bei Leistungsdepressionen) • Mykoplasmen (Differenzierung Mp. gallisepticum, synoviae, meleagridis) • Mykobakterien • Pasteurellen • Bordetellen • Ornithobacter rhinotracheale (Pute) • Parasiten des Respirationstraktes • Pilzinfektionen (Aspergillose) 2. Untersuchungsspektrum Enteritis/ Durchfallerreger • Parvoviren • Reoviren • Salmonellen • Pathogene E. coli (Anzucht) ggf. Verotoxinbestimmung (PCR) • Clostridium perfringens • Thermophile Campylobacter • Hefen (einschließlich Differenzierung) • Endoparasiten 20 3. Untersuchungsspektrum Leistungsdepressionen/ Allgemeinerkrankungen • IBD • Reoviren • Adenoviren • Paramyxoviren • Mareksche Krankheit • Aviäre Leukose • Mykoplasmen • Geflügeltuberkulose • Infektiöse Serositis (Riemerella anatipestifer bei der Ente) • Ektoparasiten (Vogelmilben, Federlinge, Kalkbeinmilben, Trachealmilben) • Trichomonaden (sog. „gelber Knopf“) • Histomonaden (Schwarzkopfkrankheit der Puten) Untersuchung von klinischem Material 1. Kotproben/ Kottupfer • Influenzaviren • Chlamydien • Salmonellen • Pathogene E. coli (Anzucht) ggf. Verotoxinbestimmung (PCR) • Thermophile Campylobacter • Endoparasiten, (Kokzidien, Spulwürmer) 2. Kropfabstriche/ Trachealabstriche • Trichomonaden (sog. „gelber Knopf“) • Mykoplasmen • Hefen (einschließlich Differenzierung) Untersuchung von EDTA- Blut bzw. Serum zum Antikörpernachweis Neben Influenza, Paramyxoviren und Salmonellen • Mp. gallisepticum (gemäß Richtlinie 2009/158/EG) • Mp. meleagridis (gemäß Richtlinie 2009/158/EG) • Mp. synoviae • IB • IBD • ILT 21 Untersuchung von Tieren besonders geschützter Arten Organophosphatvergiftung bei Saatkrähen - Ein Fallbericht – Tonia Eckert Landesamt für Verbraucherschutz Sachsen-Anhalt- FB 4 Veterinärmedizin Haferbreiter Weg 132 – 135, 39576 Stendal Im Rahmen des diagnostischen Alltagsbetriebes kommt es auch immer wieder mal zur Einsendung von Tieren besonders geschützter Arten. Die diagnostische Untersuchung zur Feststellung der Todesursache dieser Tiere steht im öffentlichen Interesse, weshalb sie in Sachsen-Anhalt über einen Erlass des MLU, zu letzt aktualisiert am 02.09.2011-Aktz.: 42.242011/1 geregelt wird. Einige Kernpunkte aus diesem Erlass sind: - Die Untersuchung erfolgt gemäß dem Auftrag z.B. des Veterinäramtes. Besondere Beachtung finden neben der Feststellung der Todesursache anzeigepflichtige Tierseuchen und meldepflichtige Tierkrankheiten, Zoonosen, sowie Verstöße gegen den Tier- und Naturschutz. - Es erfolgt eine Bereitstellung von Untersuchungsmaterial für Untersuchungsleistungen durch Dritte oder zur Magazinierung. - Dieser Erlass enthält eine Kostenfreistellung, d.h. die am Fachbereich 4 des LAV anfallenden Kosten trägt das LAV aus seinem Haushalt. In diesem Zusammenhang kommt es regelmäßig zu Anfragen bezüglich des Verdachtes von Fremdeinwirkungen wie Vergiftungen (Straftat). Am 10.11.2011 kam es zu einer Einsendung von sechs Krähen vom Gelände einer Agrargesellschaft durch ein Veterinäramt. Vorberichtlich war es dort zu einem plötzlichen Verenden von 50-60 Tieren gekommen, auch zwei Schleiereulen waren betroffen. Die Untersuchungen (Sektion, Histologie, Bakteriologie, Parasitologie und Virologie) erbrachten zunächst nur unspezifische Befunde, wie Hinweise auf Herzkreislaufversagen mit Stauungshyperämien der inneren Organe sowie Endoparasitennachweise. Bakterielle oder virale Infektionserreger inklusive Salmonellen und aviäres Influenzavirus wurden ausgeschlossen. Bei der ausführlichen visuellen Untersuchung des Inhalts des Verdauungstraktes fielen im Muskelmagen bei einigen Tieren vereinzelte, sehr dezent pink eingefärbte Weizenkörner auf. Im Zusammenhang mit dem Vorbericht und den bislang unspezifischen Untersuchungsbefunden erhärtete sich der Verdacht auf eine Intoxikation mit neurotoxischen Substanzen, z. B. Organophosphaten. Der Mageninhalt der sechs Tiere wurde zur toxikologischen Untersuchung an das UMG (Universitätsmedizin Göttingen) versendet. Diese Untersuchung identifizierte in allen Proben Parathion „E 605“, Carboxin, Prochloraz, Trichloranilin und Stoffwechselprodukte dieser Stoffe. Dabei handelt es sich um verschiedene Organophosphatverbindungen, die z.B. als Insektizide, Akarizide oder Fungizide wirken. Parathion ist laut Gesetz seit 2002 in Pflanzenschutzmitteln nicht mehr zugelassen. Es handelt sich um irreversible Acetylcholinesterase-Hemmer, die eine Anreicherung von Acetylcholin (Transmitter) im synaptischen Spalt von Synapsen des vegetatives NS und der motorischen Endplatte bewirken. In Folge kommt es dann zu einer Dauerreizung der betroffenen Nerven. Symptome sind z.B. Salivation, Miosis, Durchfall, Erbrechen, Erregung, Krämpfe/Zittern, Zyanose, Dyspnoe, Lähmungen. Der Tod tritt durch Atemlähmung und akutes Herzkreislaufversagen ein. 22 Nach Sichtung aktueller Berichte aus der Presse und Beiträgen des CVUA-Freiburg, Abteilung Veterinärtoxikologie zeigt sich, dass die Vergiftung von Wildtieren, insbesondere von Vögeln kein Einzelfall darstellt, sondern bundesweit eine hohe Brisanz besitzt. 23 Fallbericht aus der Zoovögelpopulation am Beispiel des Maguaristorches Hasenbein I. 1, Eckert T. 1 Grothmann P. 2 1 Landesamt für Verbraucherschutz Sachsen-Anhalt (Fachbereich 4 – Veterinärmedizin), Haferbreiterweg 132-135, D-39576 Stendal 2 Zoologischer Garten Magdeburg, Zooallee 1, D-39124 Magdeburg Im Rahmen der pathologischen Sektionsdiagnostik des Dezernates für Tierseuchendiagnostik des Landesamtes für Verbraucherschutz (Standort: Stendal) gelangte ein weiblicher, 18 Monate alter Maguaristorch (Ciconia maguari) aus dem Zoologischen Garten Magdeburg zur pathologisch-anatomischen Untersuchung. Vorberichtlich fiel das Tier durch eine pumpende Atmung auf und verendete noch vor Behandlungsbeginn 56 Tage nach Ankunft im Magdeburger Zoo. Die Aufzucht dieser exotischen Storchenart erfolgte im Zoo Berlin. Pathologie: Als spezifischer, pathologischer Hauptbefund war bei dem Storch eine hochgradige, chronische, eosinophile und hämorrhagische (blutige) Darmentzündung mit Nachweis oberflächlicher Schleimhautnekrosen sowohl im Rahmen der Sektion als auch mittels der pathohistologischen (mikroskopischen) Untersuchung festzustellen. Im Darmkanal waren makroskopisch bereits zahlreiche, rundliche, 1-2 mm große, parasitäre Entwicklungsstadien mit bloßem Auge zu erkennen. Als Nebenbefunde lagen des weiteren Entzündungsherde in der Leber vor. Eine Aktivierung der Milz mit typischer Eosinophilie war gleichfalls nachweisbar. Der Ernährungszustand des Tieres war deutlich reduziert. Parasitologie: Mittels der parasitologischen Untersuchung, die durch das Institut für Parasitologie der Universität Leipzig durchgeführt worden ist, wurde ein starker Befall mit Saugwürmern (Trematoden) der Gattung Tylodelphis festgestellt. Eine weitere Artbestimmung war nicht möglich. Weiterführende Untersuchungen: Zum Ausschluss weiterer, insbesondere bakteriell bedingter Infektionserkrankungen ist eine bakteriologische Untersuchung einzelner Organe durchgeführt worden, die mit negativem Ergebnis verlaufen ist. So wurden u. a. die differentialdiagnostisch in Frage kommenden Salmonellen sp. und Clostridien sp. als Auslöser der blutigen Enteritis ausgeschlossen. Als zusammenfassende, pathologische Gesamtdiagnose lag bei dem eingesandten Maguaristorch als offenbare Erkrankungs- und Todesursache eine Endoparasitose durch einen starken Befall mit Saugwürmern (Trematoden) vor. Gemäß den Literaturangaben werden infolge akademischer Einteilung zwei TrematodenSpezies der Gattung Tylodelphis unterschieden, die hauptsächlich in Europa als Endoparasiten verbreitet sind. Dabei handelt es sich um a) Tylodelphis excavata und b) Tylodelphis clavata. Die Morphologie beider Spezies ist sehr ähnlich. Die Saugwürmer sind zirka 1,2 bis 2,4 mm lang und besitzen in der Seitenansicht eine pantoffelähnliche Gestalt. Zum Wirtsspektrum dieser Saugwürmer, die im Darm parasitieren, gehören neben dem 24 heimischen Weiß- und Schwarzstorch noch weitere Wildvögel (u. a. Nachtreiher, Graureiher, Mäusebussard und Schwarzer Milan). Der parasitologische Befall exotischer Vogelbestände (z. B. des Maguaristorches) ist dagegen bisher nicht beschrieben. Beide Trematodenarten zeichnen sich in ihrer Entwicklung typischerweise durch einen sogenannten Drei-WirteZyklus aus, bei dem Süßwasserschnecken (z. B. die Posthornschnecke) und der Wasserfrosch als Zwischenwirte fungieren. In den oben aufgeführten Endwirten verfügen die adulten Saugwürmer über eine Lebensdauer von etwa zwei Monaten. Als pathologische Befunde sind tiefgreifende, schwere Entzündungserscheinungen am Dünndarm mit nachfolgender Abmagerung festzustellen. Die im vorliegenden Fall nachgewiesene Trematoden-Infektion stellt bei den betroffenen Störchen, insbesondere Jungstörchen, eine der häufigsten Todesursachen dar. Neben ihrer dominierenden Rolle in der heimischen Wildvögelpopulation gewinnt diese als sehr selten auftretende, parasitäre Erkrankung bei verwandten Zoovögelbeständen gleichfalls an Bedeutung. 25 Diagnostisch relevante Ergebnisse experimenteller Salmonelleninfektionen bei der Pute Andreas Stamm1*, Martina Hesse1, Dierk Rebeski2, Gerhard Glünder1 und Rita Weber1 1 Klinik für Geflügel der Tierärztlichen Hochschule Hannover, Bünteweg 17, 30559 Hannover 2 Lohmann Animal Health, Heinz-Lohmann-Straße 4, 27472 Cuxhaven Einleitung Geltende Lebensmittelkriterien für Salmonella (S.) Typhimurium und S. Enteritidis in frischem Putenfleisch erfordern eine Senkung der Prävalenz bis hin zur Eradikation dieser ZoonoseErreger bereits auf Stufe der Primärproduktion. Gemäß VO (EU) Nr. 1086/2011 der Kommission vom 27. Oktober 2011 zur Änderung des Anhangs II der Verordnung (EG) Nr. 2160/2003 sowie des Anhangs I der Verordnung (EG) Nr. 2073/2005 dürfen in 25 g frischem Geflügelfleisch S. Typhimurium und S. Enteritidis nicht nachweisbar sein. Zur erfolgreichen Bekämpfung dieser Serovare in der Primärproduktion sind Kenntnisse der Infektionsabläufe sowie der Abwehrmechanismen des Wirtes Pute von grundlegender Bedeutung. Experimentell reproduzierbare Infektionsmodelle liefern die grundlegenden Erkenntnisse zum Infektionsverlauf und stellen ein Prüfmodell für mögliche Prophylaxemaßnahmen dar. Bakteriologische Untersuchungen im Infektionsmodell Ziel dieser Studie war daher die Entwicklung eines reproduzierbaren, experimentellen Infektionsmodelles für S. Typhimurium und S. Enteritidis bei der kommerziellen Mastpute. Mastputenhennen verschiedener Altersgruppen wurden definierte Infektionsdosen Nalidixinsäureresistenz-markierter S. Typhimurium- bzw. S. Enteritidis-Stämme in den Kropf appliziert. Anschließend konnte über einen Untersuchungszeitraum von drei Wochen die Kolonisation des Zäkums bakteriologisch qualitativ und quantitativ untersucht und die Ausscheidung über den Kot verfolgt werden. Daneben wurde die systemische Ausbreitung des Erregers in Leber, Milz und Lunge geprüft. Des Weiteren ließ sich die Gewichtsentwicklung der infizierten Tiere über diesen Zeitraum mit der nicht infizierter Kontrolltiere desselben Schlupfes vergleichen. Nachweis gruppenspezifischer Salmonella-Antikörper im Infektionsmodell Eine serologische Untersuchung der Antikörperbildung nach beschriebener Infektion erfolgte mittels eines kommerziell erhältlichen gruppenspezifischen ELISA. Als Referenz für die erhobenen Parameter dienten stets Negativkontrollen des gleichen Schlupfes. In einem weiteren Versuchsabschnitt wurde kommerziellen Mastputenküken am ersten Lebenstag attenuierte Stämme von S. Typhimurium und S. Enteritidis inokuliert. Auch bei diesen Tieren erfolgte die Messung gruppenspezifischer Salmonella-Antikörper mittels ELISA. Ergebnisse über den bakteriologischen und serologischen Verlauf bei der Pute Die standardisierten Untersuchungen an verschiedenen Altersgruppen kommerzieller Mastputen zeigten den zeitlichen Verlauf der Infektion im Zäkum und den beschriebenen inneren Organen. Vom Alter der Tiere bei Infektion abhängige Parameter waren neben der minimalen infektiösen Dosis, die maximal in den untersuchten Organen erreichte Zahl Kolonie bildender Einheiten (KbE), die Eliminationsgeschwindigkeit aus den Organen und die Antikörperreaktion der Tiere: Mit steigendem Alter der Tiere stieg die minimale infektiöse Dosis von 103 KbE/Tier bei einwöchigen Puten auf mehr als 105 KbE/Tier bei sechswöchigen 26 Puten. Dagegen sank die Zahl der nachweisbaren Salmonellen in den Organen bei zunehmendem Alter der Tiere deutlich ab. Auch die Elimination der Salmonellen aus den untersuchten Organen beschleunigte sich mit steigendem Alter der Tiere bei Infektion. Zeitgleich konnte eine forcierte Antikörperproduktion eine mit dem Alter der Tiere ausreifende Immunkompetenz aufzeigen. Untersuchungen zur Salmonella-Ausscheidung zeigten eine Korrelation von der Salmonellenzahl im Zäkum und der Nachweishäufigkeit der Salmonellen mittels Kloakentupfer. Unterhalb einer Keimzahl von 105 KbE/g Blinddarmkot (S. Typhimurium) bzw. 106 KbE/g (S. Enteritidis) Blinddarmkot konnte eine Salmonelleninfektion nicht zuverlässig mittels Ausscheidung nachgewiesen werden, sondern erforderte eine Untersuchung von Blinddarminhalt um die Infektion bakteriologisch nachweisen zu können. * Adresse des Autors: Zentrallabor der PHW-Gruppe, Paul-Wesjohann-Str. 45, 49429 Visbek-Rechterfeld; 27 Studienergebnisse zur Pharmakokinetik von Amprolium (Eimeryl®) bei Pute, Broiler und Legehenne und Schlussfolgerungen für den praktischen Einsatz bei der Geflügelkokzidiose Klaus Teich1 und Eric Bousquet2 1 Virbac Tierarzneimittel GmbH, Rögen 20, 23843 Bad Oldesloe Virbac S.A., 1ère avenue 2065 m L.I.D. F-06516 Carros Cedex 2 Einleitung Amprolium ist ein Thiamin (Vitamin B1) Analogon und konkurriert damit um die Thiamin Transportmechanismen. Sein kompetetiver Antagonismus beruht auf seiner sterischen Mimikry des Thiamins (Abb 1.) ohne eigene biologische Funktionalität im Kohlenhydratstoffwechsel. Das Blockieren der Absorption von Thiamin (1) betrifft Wirts- wie Parasitenzellen, weshalb eine langfristige (Wochen) Amprolium-Medikation auch zu ThiaminMangelerscheinungen beim Wirt führen würde. Allerdings ist die Sensibilität von Kokzidien auf Amprolium ca. 50-mal höher (2), da hier Thiamin vor allem für den intensiven Kohlenhydratstoffwechsel während der asexuellen Vermehrungsphase (Schizogonie) benötigt wird. Abb. 1: Molekülstruktur vergleichend: Amprolium und Thiamin Following to data of Ruff et al., 1993 120 E . ma xima E. ne ca trix E . a ce rvulina 100 100 80 80 60 40 20 Following to data of Ruff et al., 1993 120 E. te ne lla Sporulationrate [%] Oocycst-Shedding [%] E. a ce rvulina Abb. 2: Oozystenwanddefekte nach AmproliumEinwirkung (3) E . ma xima E . ne ca trix E . te ne lla 60 40 20 0 0 control 60 pp m = 6 mg/kg bw* 120 pp m = 12 mg/kg bw* * water consumption of 1 litre/10 kg bw Abb. 3: Oozystenausscheidung 240 ppm = 24 mg/kg bw* control 60 ppm = 6 mg/kg bw* 120 ppm 240 ppm = 12 mg/kg bw* = 24 mg/kg bw* * water consumption of 1 litre/10 kg bw Abb. 4: Sporulationsrate Amprolium zeigt daher seine höchste Aktivität am 3. Tag post infectionem innerhalb des Lebenszyklus von E. tenella. Obwohl die Hauptwirkung auf die Schizonten besteht, verhindert die Anwesenheit von Amprolium auch die Ausdifferenzierung der Merozoiten. Untersuchungen haben auch Auswirkungen auf Phasen der Gamogonie zeigen können. So kommt es in Folge von Amprolium-Einwirkung zur Beeinflussung der Oozystenwandbildung (Abb. 2). Diese spielt eine entscheidende Rolle für die spätere Tenazität der Oozysten in der 28 Umwelt und ihrer dortigen Fähigkeit zur Sporulation. Die Abnormalitäten in der Oozystenwand (3) führen zu herabgesetzten Sporulationsraten (Abb. 4) und damit zu einer Reduktion der Infektiosität. Auf Herdenebene bedeutet dies neben der geringeren Menge ausgeschiedener Oozysten (Abb. 3) in Folge der reduzierten Schizogonien, eine deutliche Senkung des Infektionsdruckes. Diese Effekte erwiesen sich in Wirksamkeitsstudien jedoch als Eimerien-Art-spezifisch und abhängig von der eingesetzten Amprolium-Dosierung (4). Während Eimeria spp., wie E. acervulina und E. maxima, die in den proximalen Darmabschnitten parasitieren, weniger stark in Ihrer Oozystenausscheidung gehemmt wurden, zeigten distal parasitierende Eimeria spp., wie E. tenella oder E. necatrix, schon bei sehr geringen Dosierungen eine vollständige Oozystenausscheidungsreduktion. Im Rahmen pharmakokinetischer Studien sollten neben rückstandsrelevanter Fragestellungen auch mögliche Erklärungsansätze für das unterschiedliche Verhalten der jeweiligen Eimeria spp. gefunden werden. Material und Methode Dazu wurden 4-5 Monate alte Hühner einer Broiler Zuchtlinie beiderlei Geschlechts mit einem Amprolium 200 mg/ml Präparat (identisch mit Eimeryl® 200 mg/ml, Virbac) über das Trinkwasser behandelt. Die 75 Hühner erhielten die Medikation in einer Dosierung von 30 mg/kg KGW über 7 Behandlungstage. Die höhere Dosierung als die sonst übliche Dosierungsempfehlung von 20 mg/kg KGW erklärt sich aus dem Interesse, im Rahmen der Rückstandsuntersuchungen, eine zusätzliche Sicherheitsspanne einzubauen. Es wurden die Amprolium-Konzentrationen in den verschiedenen Darmabschnitten und im Blutplasma ermittelt (bei der Studie handelt es sich um interne Daten von Veterinaria S.P.). Ergebnisse Es konnte gezeigt werden, dass Amprolium mit Blutplasmaspiegeln von 0,096 – 0,605 µg/ml nur in Spuren enteral resorbiert wird. Im Gegensatz dazu wurden im Darmlumen der verschiedenen Darmabschnitte die eigentlichen Amprolium-Konzentrationen gemessen (Abb. 5). Dabei wurden über Duodenum, Jejunim, Ileum und Caecum ansteigende maximale AmproliumKonzentrationen (Cssmax) mit Werten von 38,01 µg/g, 65,83 µg/g, 192,46 µg/g und 675,04 µg/g nach distal hin gemessen. Es kommt demnach zu einer Kumulation von Amprolium über die Darmpassage beim Huhn. Die maximalen Wirkstoffspiegel konnten bereits innerhalb von 24 Stunden nach Beginn der Medikation gemessen werden. Broiler/ Layers 38,01 µg/g Turkeys Duodenum E. acervulina E. mivati E. mitis E. praecox E. meleagrimits 65,83 µg/g Small Intestine E. necatrix E. maxima 192,46 µg/g Large Intestine E. brunetti 675,04 µg/g Caeca E. tenella Intestinal levels of Amprolium E. adenoides Area of pararitism Abb.5: Amproliumkonzentrationen in verschiedenen Darmabschnitten bei einer Amprolium-Dosierung von 30 mg/kg KGW. 29 Schlussfolgerungen Die niedrigen Amprolium-Blutplasmaspiegel sind Indiz dafür, dass der kokzidiostatische Effekt von Amprolium nicht auf eine systemische Wirkweise zurückzuführen ist. Die sehr niedrigen Blutplasmaspiegel zusammen mit der sehr kurzen Halbwertszeit von 23 Minuten beim Geflügel, überschreiten zu keinem Zeitpunkt 20 % des ADI-Wertes (akzeptable tägliche Aufnahmemenge) des Menschen in den essbaren Geweben (Fleisch, Ei). Für den CVMP (Council of Veterinary Medicine Products) der EMA bestand daher keine Notwendigkeit, einen MRL-Wertes (Maximum Residium Level) für Amprolium festzusetzen. Statt dessen wird Amprolium Anhang II der EEC Nr. 2377/90 geführt (5). „Null Tage“ Wartezeit für Eimeryl® 200 mg/g bedeutet demnach nicht, dass verbraucherrelevante Wirkstoffspiegel nach einer Behandlung erst unterschritten werden müssten. Eimeryl® weist keinerlei Wartezeit auf. Die Kumulation von Amprolium über die Darmpassage lässt sich durch die Aufkonzentration der Ingesta insgesamt über die Darmpassage erklären. Dieser Kumulationseffekt erklärt wiederum die von Ruff et al. (1993) gemachten klinischen Beobachtungen, dass im Enddarm parasitierende Eimeria spp. wie E. tenella und E. necatrix stärker von Amprolium in niedrigeren Dosierungen in ihrer Oozystenausscheidung gehemmt werden, als die mehr proximal parasitierende Eimeria acervulina (Abb. 2). Auch der von Pittilio et al. (1981) beschriebene Oozystenwand-Deformationseffekt von Amprolum ist offensichtlich DosisWirkungs-abhängig und wird durch die Kumulation von Amprolium in den Enddarmabschnitten eher als Sporulationshemmung messbar (Abb. 3). Bei nachgewiesener E. acervulina Beteiligung sollte, aufgrund der hier vorgestellten pharmakokinetischen Daten, in jedem Fall auf eine Ausdosierung geachtet werden. Die hohe therapeutische Breite von Amprolium, sowie die vernachlässigbare Verbraucherschutzrelevanz (s. Wartezeitbemessung), erlauben dabei dem Therapeuten bei klinischem Bedarf die Dosierung großzügig zu sein. Die ausgeprägte Wirkung von Amprolium gegen die weitaus pathogeneren EnddarmKokzidien, wie E. tenella, E. brunetti oder E. necatrix ermöglichen gerade beim Broiler durch die nicht vorhandene Wartezeit erstmals die Kontrolle der ökonomisch bedeutsamsten Kokzidiosen auch in der Endmast. Gleichzeitig begünstigen gerade E. tenella-Kokzidiosen Clostridium perfringens Infektionen in besonderem Maße (6). Eine E. tenella-Kontrolle stellt damit eine entscheidende Maßnahme zur Minimierung von Antibiotika-Einsätzen in der Broilermast dar. Amprolium selbst hat keinerlei antibiotische Eigenschaften, wie andere Kokzidiostatika. Literatur 1. James, S. (1980): Thiamine uptake in isolated schizonts of Eimeria tenella and the inhibitory effects of Amprolium. Parasitology, Vol 80, No. 2, 313-322 2. Ball, S.J., R.M Pittilo, C.C. Norton, L.P. Joyner (1987): Ultrastructural changes of the effects of amprolium and dinitolmide on Eimeria acervulina macrogametes. Parasitol. Res., 73, 293-297 3. Pittilo, R.M., S.J. Ball, L.P. Joyner, C.C. Norton (1981): Ultrastructural changes in the macrogamete and early oocyst of Eimeria maxima resulting from drug treatment. Parasitology; 83: 285-91 4. Ruff, M. D., R. Garcia, M. B. Chute and T. Tamas (1993): Effect of Amprolium on Production, Sporulation, and Infectivity of Eimeria Oocysts. Avian Diseases, Vol. 37, No. 4, pp. 988-992 5. EMA (2009): www.ema.europa.eu/docs/en_GB/document_library/Maximum_Residue_ Limits_-_Report/2009/11/WC500010566.pdf 6. Alnassan, A.A., M. Kotsch, M. Krüger, B. Bangoura, M. Lendner, A. Daugschies (2012): Nekrotische Enteritis des Huhnes – Mischinfektionen verschiedener Eimerienarten mit Clostridium perfringens. VetMedReport 05/2012; Proc. DVG Parasitol., Hannover, July 2012 30 31 Evaluation of sensitivity to tylvalosin in vitro for ORT strains 1 A. Schwarz, 1M. de Gussem, J. de Gussem and 2M. Metzner 1 2 3 Vetworks, Poulpharm, Ripac lab 2 Knokstraat 38, 9880 Poeke, Flanders, Belgium, Ninovestraat 7, 9420 Erpe-Mere, Flanders, Belgium 3 Am Mühlenberg 11, 14476 Potsdam-Golm Germany 1 In turkeys, respiratory disorders are a major problem leading to high economic losses in Europe. One of the most important bacteria causing respiratory infections in turkeys is the ubiquitous present gram-negative pleomorphic rod-shaped bacterium Ornithobacterium rhinotracheale (ORT). The treatment of ORT infections with antibiotics can be very challenging because of the varying sensitivity of different field ORT strains. Acquired antibiotic resistance is unusually frequent in ORT and has been reported for several antibiotics, making the choosing of the right antimicrobial difficult. This study demonstrates the results of sensitivity testing of one novel macrolide antimicrobial, tylvalosin (Aivlosin®) for field ORT strains, which were isolated from turkey, using agar diffusion method and method of determination of Minimum Inhibitory Concentrations (MIC). For agar diffusion method disks loaded with 10µg tylvalosin were recently developed by Ripac Laboratory and validated in different European laboratories. 100 turkey field isolates were tested against the antimicrobial drugs that have been previously commonly used on the market using newly developed sensitivity discs. 42 ORT isolates from turkey, origin from Germany and Netherlands, were tested using MIC method. Of five antimicrobial drugs tested using agar diffusion method (tylvalosin, amoxicillin, penicillin, doxycycline and tylosin), tylvalosin (Aivlosin®) proved to be the only antimicrobial to which more than 50% of the tested ORT field strains were sensitive. It has also shown to be the drug to which the lowest MIC values compared to doxycycline, tylosin, tilmicosin and amoxicillin were found (MIC50 = 2 µg/ml) together with enrofloxacin. In conclusion, sensitivity discs has been developed and validated for tylvalosin, so the sensitivity profile for tylvalosin in vitro can be easily compared now to other antibiotics. Our in vitro test results demonstrate that compared to other antibiotics more than 50% of the ORT field isolates are sensitive to Aivlosin®. So tylvalosin should definitely be considered as a treatment option in case of an acute clinical ORT outbreak in turkeys. 32 33 Einsatz als Geflügelfachberater in China – ein Erfahrungsbericht Dr. Claudia Geißler, Dresden Ermittlung der Ursache der Sterblichkeit bei Gösseln und Erarbeitung von Maßnahmen zur Bekämpfung der Tierverluste bei Gösseln und zur Verbesserung der Gänseproduktion im Governement Jixi Es wurden 2 Betriebe mit Gänsemast aufgesucht und die Probleme erläutert. Betrieb 1: Yu Xiang Goose Company Dieser Betrieb ist im Aufbau befindlich mit Aufzucht, Mast, Stopfmast und Verarbeitung auf einem Standort Zum Zeitpunkt des Besuches waren ca. 4000 Mastgänse ca.70 – 80 Tage alt im Auslauf, die weitere 15 – 18 Tage mittels “ Stopfen“ weiter gemästet werden. Danach erfolgt die Schlachtung und Verarbeitung auf dem gleichen Standort zum Export der Fettlebern nach Frankreich Zustand der Anlage: Katastrophale hygienische Bedingungen im gesamten Umfeld, keine befestigten Flächen (zum Zeitpunkt der Besichtigung war eine Hitzeperiode, deshalb war der Untergrund trocken). Der Betrieb hat 1800 Elterntiere und produziert ca.30 000 Gössel im Jahr. Die Hauptverlustursache war die Parvovirusinfektion der Gössel. Die Präventionsmaßnahmen wurden von mir erarbeitet und den Mitarbeitern in einem Meeting durch den zuständigen Tierarzt erläutert und Fragen dazu beantwortet. Betrieb 2: Gänsemast Es wurden 3 Standorte besichtigt (ca. 2000 – 3000 Mastgänse). An allen 3 Standorten waren die Haltungshygiene, aber vor allem die hygienischen Bedingungen der Futter- und Wasserversorgung für unser Verständnis inakzeptabel. Am ersten Standort hatten die Tiere zum Zeitpunkt des Besuches kein Futter und Wasser (Tageszeit 10 Uhr). Nachdem ich diesen Zustand bemängelt habe wurde das Wasser aufgedreht und Futter verabreicht. Ein Managementprogramm für die Versorgung und Betreuung der Tiere gab es nicht. Zwei Standorte befanden sich an einem Wasserlauf, wobei die jüngeren Tiere am unteren Teil des Wasserlaufes standen und das mit Kot verschmutzte Wasser der älteren Tiere als Tränkwasser zur Verfügung hatten. Futtergefäße waren an beiden Standorten nicht vorhanden, das Futter wurde in Bahnen auf dem Boden verteilt. Vom zuständigen Tierarzt wurde vor Ort ein verendetes Tier geöffnet und die typischen Krankheitserscheinungen erläutert. Die Ursache für die Tierverluste – die Parvovirose – konnte den Verantwortlichen des Betriebes erläutert werden. Ein Programm zur Verbesserung der Hygiene durch entsprechendes Management im Tierbestand und zur Bekämpfung der Parvovirose mit einem Impfprogramm für die Elterntiere wurde den Verantwortlichen Managern übergeben. 34 35 Möglichkeiten phylogenetischer Untersuchungen bei aviärer Influenza: H9N2 Infektionen bei Geflügel und Wildvögeln in Deutschland. Timm Harder, Christian Grund FA; OIE und Nationales Referenzlabor für Aviäre Influenza, Institut für Virusdiagnostik, Friedrich-Loeffler Institut, Südufer 10, D-17493 Greifswald-Insel Riems Hintergrund Im laufenden Jahr traten vereinzelt Infektionen mit dem aviären Influenzavirus H9N2 in Geflügelhaltungen in Deutschland auf. H9N2 Infektionen wurden auch bei Wildvögeln in Europa und Deutschland in den vergangenen Jahren sporadisch nachgewiesen. In Asien und jüngst auch in Nordafrika (Ägypten) verursacht der endemische Status dieses Virus in den Geflügelpopulationen erhebliche wirtschaftliche Probleme, weshalb dort Impfungen routinemäßig eingeführt werden. Seit den 1990er Jahren haben sich H9N2 Viren vor allem in Asien in mehreren Linien diversifiziert. Diese Linien sind auch antigenetisch unterscheidbar und haben zum Teil Anpassungen der einzusetzenden Impfstoffe erforderlich gemacht. Einige Linien besitzen offenbar auch Potential für eine speziesübergreifende Übertragung und haben klinisch relevante Infektionen in Schweinen (China) und vereinzelt auch in Menschen (Hong Kong) verursacht. Fragestellung Können die in Deutschland nachgewiesenen H9N2 Viren bestimmten phylogenetischen Linien zugeordnet werden? Lässt eine solche Zuordnung Rückschlüsse zur Herkunft und zu Eintragswegen dieser Viren zu? Methoden Die Hämagglutinin- und Neuraminidasegene von aktuellen und älteren H9N2 Isolaten aus der Sammlung des FLI werden vollständig sequenziert. Die Sequenzen werden phylogenetisch analysiert und in den Stammbaum der in Asien und Afrika auftretenden Viruslinien eingepasst. Antigenetische Eigenschaften der in Deutschland detektierten Viren werden mittels Hämagglutinationshemmtest untersucht. Die Präsentation und Diskussion der Ergebnisse erfolgt im Rahmen des Vortrags. 36 37 Ausbreitung und Bekämpfung der niedrigpathogenen Aviären Influenza in Sachsen Roland Küblböck Sächsische Tierseuchenkasse Brückenstraße 2 09322 Penig Im Sommer 2011 kam es in einigen Geflügelhaltungen mehrerer Bundesländer zum Nachweis von niedrigpathogenen Aviären Influenzaviren. Wie in der Geflügelpestverordnung vom 18.10.2007 festgelegt, führte der Nachweis zur Bekämpfung durch die zuständigen Behörden. Dabei wurden die betroffenen Betriebe gesperrt, Kontaktbetriebe ermittelt, untersucht und alle Haltungen mit Virusnachweis geräumt. Die ersten positiven Nachweise von LPAI H7/N7 wurden Ende Mai 2011 in NordrheinWestfalen bei verschiedenen Geflügelhaltungen festgestellt. Die betroffene Region in NRW hat eine besonders hohe Geflügeldichte, wobei alle Produktionsrichtungen vertreten sind. Darunter befinden sich auch verschiedene Aufzüchter und Geflügelhändler, die ihre Tiere über Landesgrenzen verbringen und in andere Bundesländer verkaufen. In der Folge des Geschehens wurde noch jeweils ein Fall von niedrigpathogener Aviärer Influenza in Bayern und Baden-Württemberg festgestellt. Die zuständigen Behörden konnten durch Bekämpfungsmaßnahmen in den betroffenen Betrieben eine weitere Ausbreitung der Infektion auf andere Haltungen eingrenzen, so dass sich die Lage auf dem Geflügelsektor wieder zu normalisieren schien. In Sachsen wurden am 23.06.2011 bei einer Gruppe von 7 Puten erste klinische Anzeichen einer Erkrankung festgestellt. Die Tiere zeigten Atembeschwerden und Rhinitis. Aufgrund der Vorkommnisse in NRW wurden von allen Tieren Rachentupfer gezogen, die an der Landesuntersuchungsanstalt Sachsen auf AI Virus untersucht wurden. Am 27.06.2011 wurde mitgeteilt, dass eine der Proben H7 positiv sei. Die betreffende Probe wurde zur Typisierung an das nationale Referenzlabor für Aviäre Influenza des FLI weitergeleitet. Der Befund wurde bestätigt und als das niedrigpathogene Influenzavirus H7/N7 identifiziert, das auch schon in NRW festgestellt wurde. In der Zwischenzeit wurden Kontaktbetriebe ermittelt. Die betroffenen Puten wurden von einem lokalen Geflügelhändler bezogen, der diese wiederum von einem Geflügelhändler aus Nordrhein-Westfalen erworben hatte. Die Untersuchung der beim Geflügelhändler verbliebenen Puten, die jedoch klinisch unauffällig waren, ergab auch einen Nachweis von H7/N7. Daraufhin wurden alle Kunden des Geflügelhändlers ermittelt, die in dem Zeitraum von der Einstallung der Puten bis zum Nachweis der LPAI Geflügel erworben hatten. Dabei gestaltete sich die Nachverfolgung in einigen Fällen sehr schwierig und zeitaufwändig, da einzelne Käufer nur einen Teil der Tiere bei sich einstallten und einen anderen Teil wiederum an andere Halter weitergaben. Es ergab sich dadurch eine weite Verzweigung, die nicht dokumentiert war. Der Fall zeigt deutlich die Probleme bei der Erfassung und Bekämpfung der niedrigpathogenen Aviären Influenza auf. Einerseits können infizierte Herden ohne Anzeichen einer Erkrankung durchseuchen, so dass das Virus, wie hier in Sachsen, unbemerkt über den Geflügelhandel gestreut werden kann. Andererseits zeigte sich auch, dass der „Geflügelhandel“ für Klein- und Hobbyhaltungen nur sehr schwer zu kontrollieren ist, da es neben den ortsansässigen Händlern auch fahrende Händler gibt, die Ländergrenzen überschreiten. Daneben können Tiere auch auf Märkten und Geflügelschauen erworben oder zwischen Rassegeflügelzüchtern gehandelt werden. 38 39 Wildvogelmonitoring im Land Brandenburg zum Nachweis aviärer Influenzaviren Kerstin Albrecht Landesamt für Umwelt, Gesundheit und Verbraucherschutz des Landes Brandenburg 14513 Teltow, OT Ruhlsdorf, Dorfstraße 1 Aviäre Influenzaviren (AIV) kommen weltweit bei Vögeln, verschiedenen Säugetierarten und dem Menschen vor. Niedrigpathogene AIV (NPAIV) der Subtypen H5 und H7 können auf Grund einer starken Mutationsneigung von Influenzaviren hochpathogene Eigenschaften entwickeln. Von bestimmten Virusstämmen geht zudem ein zoonotisches Potential aus. Infektionen mit dem hochpathogenen AIV (HPAIV) des Subtyps H5N1 führten so in den letzten Jahren zu mehreren hundert Erkrankungen und Todesfällen beim Menschen. NPAIV sind in der Wildvogelpopulation, insbesondere bei Wasservögeln, weit verbreitet. Jedoch fanden sich seit dem Auftreten einer hochpathogenen Variante des Subtyps H5N1 seit 2005 auch bei Wildvögeln zahlreiche Infektionen bei unterschiedlicher Empfänglichkeit der einzelnen Spezies. Von diesem Wirtsreservoir geht eine mögliche Gefahr für AIV-Infektionen beim Nutzgeflügel mit der Folge von drastischen tierseuchenrechtlichen Maßnahmen und immensen wirtschaftlichen Folgen aus, wenn auch die Rolle von Wildvögeln im Rahmen der HPAI nach wie vor umstritten ist. Nicht nur HPAIV-Infektionen, sondern auch NPAIVInfektionen der Subtypen H5 und H7 sind europaweit bekämpfungspflichtig. Um Daten für genauere Risikoabschätzungen zu gewinnen, wurden zunächst freiwillige und anschließend rechtlich verbindliche Vorgaben zur Überwachung des Vorkommens von AIV bei Wildvögeln erarbeitet. Entsprechend verfeinerter Risikoeinschätzungen wurden bestimmte Arten insbesondere der Ordnungen Anseriformes und Charadriformes bevorzugt in das Überwachungsprogramm einbezogen. In Umsetzung dieser Vorgaben fand in Brandenburg ein Wildvogelmonitoring statt, welches in dieser Arbeit über einen Zeitraum von 2006-2010 ausgewertet wurde. Insgesamt gelangten 8.290 Wildvögel aus 139 heimischen Arten und 43 Familien zur Untersuchung, von denen Organe aus Tierkörpern, Rachen- und Kloakentupfer oder Kot auf AIV getestet wurden. Den größten Anteil am Untersuchungsgut machten Entenvögel mit mehr als 35% der Gesamtzahl aus. Bei 21 Vögeln, vorwiegend Schwänen, wurde eine HPAIV H5N1-Infektion mit dem Stamm „Asia“ im Zusammenhang mit europaweiten Ausbrüchen dieses Erregers bei Wildvögeln im Frühjahr 2006 festgestellt. Danach gab es in Brandenburg keine weiteren Nachweise von HPAIV. In 90 Fällen konnten innerhalb eines Zeitraumes von fünf Jahren von 2006-2010 NPAIV diagnostiziert werden, darunter auch AIV der Subtypen H5 und H7. Die Stockente war die Spezies mit der höchsten Prävalenz gefolgt von der Blessralle. Von NPAIV-Infektionen waren die Arten der Ordnungen Anseriformes (Entenvögel), Podicipediformes (Lappentaucher), Gruiformes (Kranichvögel), Accipitriformes (Greifvögel) und Strigiformes (Eulen) betroffen. Es zeigten sich deutliche Unterschiede im Verteilungsmuster der NPAIV im Hinblick auf den zeitlichen Verlauf sowohl in den einzelnen Monaten als auch zwischen den Jahren sowie in verschiedenen Regionen. Die meisten AIVInfektionen fanden sich von Spätsommer bis in den Winter hinein und insbesondere in dem im Landkreis Spree-Neiße gelegenen Ramsargebiet Peitzer Teiche. Ergänzt wurde das Wildvogelmonitoring durch Untersuchungen an Stockenten (Anas plathyrhynchos), die über einen Zeitraum von Oktober 2008 bis Oktober 2010 in einer Anlage am Felchowsee im Landkreis Uckermark bei ständigem Kontakt zu Wildvögeln der dortigen Population gehalten wurden (Sentinel-Stockenten). Eine Beprobung der Sentinels 40 fand alle zwei Wochen (Tupfer für den AIV-Nachweis) bzw. alle vier Wochen (Blut für den AIAntikörpernachweis) statt. Es konnten bei einer wesentlich höheren Nachweisrate als im flächendeckenden Wildvogelmonitoring zahlreiche AIV verschiedener Subtypen nachgewiesen werden. AI-Antikörper wurden bereits zwei Wochen nach dem Einsetzen der Stockenten festgestellt, deren Seroprävalenz zwei Wochen bis mehrere Monate anhielt. Jedoch ließ sich nur bei einem Tier mittels Hämagglutinationshemmungstest die Subtypspezifität der Antikörper (H7) bestimmen. Insgesamt konnte durch das Wildvogelmonitoring ein Überblick über die im Land Brandenburg vorkommenden AIV erzielt werden. Die Untersuchungszahlen reichten jedoch bei bestimmten Spezies, in verschiedenen Monaten und Regionen nicht immer aus, um Ausschlussbewertungen von AIV-Infektionen statistisch gesichert vornehmen zu können. Die erzielten Daten zeigen, dass die Beprobung von verendeten Tierkörpern (passives Monitoring) gegenüber der Untersuchung lebender Vögel (aktives Monitoring) bezüglich des Nachweises von HPAIV in Wildvögeln klar überlegen ist. Das aktive Monitoring dient dagegen vor allem der Detektion von NPAIV. Die Konzentration auf bestimmte Vogelarten (Stockenten, Blessrallen), Regionen (Feuchtgebiete, hier: insbesondere Region der Peitzer Teiche und Havelseen), Monate (September, Oktober und Januar bis März) und Beprobungsmodi (Jagdstrecke Stockenten) könnte zu einer Erhöhung der Effektivität der Überwachung führen. Zudem scheint das Betreiben von Sentinelanlagen im Hinblick auf Erkenntnisse zum Verlauf von AIV-Infektionen einschließlich einer Serokonversion über einen längeren Zeitraum in einem bestimmten Ökosystem als kostengünstige Alternative zum sonstigen Monitoring sinnvoll. 41 Räumung großer Geflügelbestände: Rechtslage, Konzepte, Verfahren Dr. Klaus-Peter Behr, Fachtierarzt für Geflügel, Dipl ECPVS GESEVO GmbH, Löninger Str. 66, 49661 Cloppenburg Am 1. Januar 2013 tritt die Verordnung (EG) 1099/2009 über den Schutz von Tieren zum Zeitpunkt der Tötung in Kraft. Diese VO verlangt in Art 18(1) einen Aktionsplan der zuständigen Behörde für den Fall von Bestandsräumungen einschließlich geplanter Betäubungs- und Tötungsverfahren, Standardarbeitsanweisungen und Notfallpläne. Über die durchgeführten Aktivitäten ist der KOM bis Mitte des Folgejahres zu berichten, der Bericht ist im Internet zu veröffentlichen (Art 18(4)). In der Anlage zur VO werden die zulässigen Bestandsräumungsverfahren detailliert aufgelistet. Da es sich hier um unmittelbar geltendes Recht handelt, ist eine nationale Umsetzung nicht erforderlich. Nichtsdestotrotz wird in Deutschland die nationale TierschutzSchlacht-Verordnung aktuell novelliert, um auch an dieser Stelle den EU-Rechtsrahmen einzuschränken. Unabhängig von der Entwicklung der Rechtslage gibt es seit 2005 in Deutschland eine Entwicklung zum Aufbau von Vorsorgesystemen für die tierschutzgerechte Räumung großer Geflügelbestände in Tierseuchenfällen. Inzwischen werden diese Konzepte konkret auf den Schweine- und Wiederkäuer-Bereich ausgedehnt. Entsprechend der föderalen Zuständigkeit für die Tierseuchenbekämpfung werden dabei nebeneinander unterschiedlichste Modelle entwickelt. Gleichzeitig wächst seit der umfangreichen Bekämpfung der Klassischen Geflügelpest in den Niederlanden 2003 EU-weit eine spezialisierte Dienstleistungsbranche. Das Spektrum der zur Bestandsräumung in Tierseuchenfällen zulässigen Verfahren umfasst neben mechanischen Tötungsverfahren insbesondere die Anwendung von elektrischem Strom sowie Verfahren unter Anwendung von Gas. Die bei der GESEVO GmbH aktuell etablierten Techniken und Kapazitäten zur Bestandsräumung bei Geflügel werden dargestellt. Neben Tierschutzgesichtspunkten finden in den GESEVO-Konzepten zu diesem Thema Aspekte des Arbeitsschutzes und der Vermeidung der Seuchenverschleppung im Zuge der Seuchenbekämpfung vermehrt Berücksichtigung. Die hierfür erforderlichen Konzepte der Reduzierung des Personalbedarfes und der mobilen Schleusung von Personal und Gerät werden ebenfalls dargestellt. Darüber hinaus wird am Beispiel des Vorgehens in Niedersachsen und MecklenburgVorpommern dargelegt, wie standardisierte Vertrags- und Abrechnungsverfahren im Tierseuchenfall die zügige und EU-rechtskonforme Abwicklung der Entschädigungen beschleunigen und damit nicht nur die Veterinärverwaltungen entlasten, sondern auch die EU-Kofinanzierungen beschleunigen. 42 Bericht über das 9. Internationale Symposium über Putenkrankheiten in Berlin Prof. H. M. Hafez Berlin 43 Stand der Bekämpfung von Zoonosen u. ihrer Erreger bei Wirtschaftsgeflügel in Sachsen-Anhalt Ulrich Noack u. Annette Schliephake Landesamt für Verbraucherschutz Sachsen-Anhalt - FB 4 Veterinärmedizin Haferbreiter Weg 132 – 135, 39576 Stendal 1. Gesetzliche Bestimmungen, Leitlinien, Beihilfen Gesetzliche Grundlage der Zoonosenbekämpfung bei Nutztieren in der Europäischen Union sind die RL 99/2003/EG sowie die Verordnung 2160/2003/EG, beide Vorschriften wurden vom EU Parlament verabschiedet. Überwachungspflichtige Zoonosen sind danach beim Wirtschaftsgeflügel die Salmonellose und die Campylobacteriose und ihre Erreger. Daneben wird auch das Vorkommen von MRSA in den Tierbeständen überwacht. Menschliche Salmonelloseerkrankungen konnten in den letzten Jahren deutlich reduziert worden, so wurden 2011 in Deutschland nur noch 24518 Krankheitsfälle gemeldet. Zugenommen haben jedoch die Campylobacteriosen (2011: 71309 Fälle) und auch septikämische MRSA - Erkrankungen (2011: 4226 Fälle). Die EU-Kommission hat eine Reihe von Verordnungen erlassen, die die Gemeinschaftsziele zur Senkung der Prävalenz von Salmonella - Serotypen bei Zuchtherden von Gallus gallus, bei Legehennen, bei Masthähnchen und bei Puten festlegen. Daneben wurden in weiteren Verordnungen die spezifischen Bekämpfungsmethoden im Rahmen nationaler Salmonellen-bekämpfungsprogramme sowie die Verfahrensweisen hinsichtlich des Inverkehrbringens von Eiern aus Salmonellen infizierten Legehennenherden und für frisches Geflügelfleisch festgelegt. In Deutschland spezifiziert die Hühner-SalmonellenVerordnung sowie nationale Programme für die einzelnen Geflügelarten und Nutzungsrichtungen die Vorgehensweise bei der Bekämpfung von Salmonelleninfektionen. Daneben regelt die Allgemeine Verwaltungs-vorschrift (AVV) Zoonosen Lebensmittelkette die Durchführung von Zoonosenstichproben-plänen (AVV Zoonosenmonitoring) entlang der Erzeuger- und Verabeitungsstufen sowie im Lebensmitteleinzelhandel durch die Überwachungsbehörden der Länder. Der Zentralverband der Deutschen Geflügelwirtschaft hat zur praktischen Umsetzung der nationalen Programme Leitfäden zur Salmonellenbekämpfung bei Legehennen sowie in der Hähnchen- und Putenhaltung erstellt. Die Empfehlungen des MLU Sachsen-Anhalt über Biosicherheitsmaßnahmen und Frühwarnsysteme in Geflügelhaltungen wurden im Ministerialblatt veröffentlicht. Beihilfen der Tierseuchenkasse Sachsen-Anhalt erstatten den Geflügelhaltern die Kosten der amtlich angeordneten Laboruntersuchungen auf Salmonellen in Brütereien, Zucht- und Aufzuchtbetrieben, Legehennen- und Masthähnchenbetrieben und entschädigen 50% des gemeinen Wertes von Zuchthühnern und Legehennen im Fall der Schlachtung oder Tötung salmonelleninfizierter Bestände. 2. Durchführung und Stand der Zoonosenbekämpfung in Sachsen-Anhalt (ST) Sämtliche Laboruntersuchungen im Rahmen der Amtlichen Zoonosenüberwachung der Wirtschaftsgeflügelbestände werden am Fachbereich Veterinärmedizin des Landesamtes für Verbraucherschutz durchgeführt. Zur Gewährleistung einer einheitlichen Vorgehensweise der Überwachungsbehörden wurden vom Geflügelseuchenbekämpfungsdienst (GSBD) spezielle Einsendeformulare für Untersuchungsmaterial sowie Merkblätter für amtliche Probenehmer erstellt. Der GSBD wird bei den amtlichen Bestandskontrollen in den Brütereien und Wirtschaftsgeflügelbeständen regelmäßig beteiligt und im Fall positiver Befunde zur Unterstützung der Bekämpfungsmaßnahmen hinzugezogen. 44 Ergebnisse der Zoonosenüberwachung in Zuchthühnerherden Bekämpfungspflichtig sind bei Zuchthühnerherden 5 Salmonellenserovare: S. Enteritidis, S. Typhimurium, S. Hadar, S. Virchow u. S. Infantis (TOP 5 - Salmonellen). Im Jahr 2011 wurden 732 bakteriologische Untersuchungen (BU) aus 89 Zuchthühnerherden am Fachbereich Veterinärmedizin durchgeführt und dabei keine Salmonellen nachgewiesen. Das Gemeinschaftziel von < 1% TOP 5 - positiver Zuchthühnerherden wurde in der BR Deutschland schon ab dem Jahr 2010 erreicht. Im Jahr 2011 erfolgte bundesweit nur bei 2 von 762 untersuchten Herden der Nachweis von S. Enteritidis (0,3%). Ergebnisse der Zoonosenüberwachung in Legehennenherden Bekämpfungspflichtig sind bei Legehennenherden 2 Salmonellenserovare: S. Enteritidis u. S. Typhimurium (TOP 2 - Salmonellen). Im Jahr 2011 wurden 207 bakteriologische UnterUntersuchungen (BU) aus 63 Legehennenherden am Fachbereich Veterinärmedizin durchgeführt und dabei 9 x S. Enteritidis nachgewiesen. Die Herdenprävalenz für TOP 2 betrug somit in Sachsen-Anhalt 11,1%. Im 1. Halbjahr 2012 erfolgte noch kein Salmonellennachweis! Das Gemeinschaftziel von < 2% TOP 2 - positiver Legehennenherden wurde in Deutschland schon ab dem Jahr 2010 erreicht. Im Jahr 2011 erfolgte bundesweit bei 60 von 4993 untersuchten Herden der Nachweis von TOP 2 (47 x S. Enteritidis / 13 x S. Typhimurium) das entspricht einer Herdenprävalenz von 1,2%! Im Rahmen der AVV Zoonosen Lebensmittelkette wurden im Jahr 2009 in einer von 15 im Land ST untersuchten Herden Campylobacter Coli jedoch kein MRSA nachgewiesen! In den Jahren 2008-2011 wurde der GSBD zur Salmonellenbekämpfung in 14 Legehennenbetrieben beteiligt! In 3 Farmen eines Betriebes wurde im Zeitraum 2009 - 2011 der gleiche Phagentyp von S. Enteritidis, PT 4 nachgewiesen. In den betroffenen Betrieben wurden Schwachstellenanalysen durchgeführt und Bekämpfungskonzepte erstellt! Ergebnisse der Zoonosenüberwachung in Masthähnchenherden Bekämpfungspflichtig sind auch bei Masthähnchenherden 2 Salmonellenserovare: S. Enteritidis u. S. Typhimurium (TOP 2 - Salmonellen). Im Jahr 2011 wurden 43 bakteriologische Untersuchungen (BU) aus 19 Masthähnchenherden am Fachbereich Veterinärmedizin durchgeführt und dabei 2 x S. Mbandaka nachgewiesen. Die Herdenprävalenz für TOP 2 betrug somit in Sachsen-Anhalt 0%. Das Gemeinschaftziel von 1% TOP 2- positiver Masthähnchenherden wurde in Deutschland schon seit einigen Jahren erreicht. Im Jahr 2011 erfolgte bundesweit bei 34 von 14696 untersuchten Herden der Nachweis von TOP 2 (19 x S. Enteritidis / 15x S. Typhimurium) das entspricht einer Herdenprävalenz von 0,2%! Im Rahmen der AVV Zoonosen Lebensmittelkette wurden im Jahr 2009 in einer von 39 im Land ST untersuchten Herden Campylobacter Jejuni u. Campylobacter Coli jedoch kein MRSA nachgewiesen! Ergebnisse der Zoonosenüberwachung in Truthühnerherden Bekämpfungspflichtig sind bei Zucht- und Mastputenherden 2 Salmonellenserovare: S. Enteritidis u. S. Typhimurium (TOP 2 - Salmonellen). Im Jahr 2011 wurden 57 bakteriologische Untersuchungen (BU) aus 26 Mastputenherden am Fachbereich Veterinärmedizin durchgeführt und dabei keine Salmonellen nachgewiesen. Die Herdenprävalenz für TOP 2 betrug somit in Sachsen-Anhalt 0%. Das Gemeinschaftziel von 1% TOP 2 - positiver Herden wurde in Deutschland schon seit einigen Jahren erreicht. Im Jahr 2011 erfolgte bundesweit bei 11 von 2723 untersuchten Herden der Nachweis von TOP 2 (11 x S. Typhimurium) das entspricht einer Herdenprävalenz von 0,4%! Im Rahmen der AVV Zoonosen Lebensmittel-kette wurden im Jahr 2010 in einer von 12 im Land ST untersuchten Herden MRSA jedoch kein Campylobacter nachgewiesen! In diesem Jahr wurde bisher in einer von 22 untersuchten Herden MRSA nachgewiesen. 45 Ergebnisse der Zoonosenüberwachung bei Masthähnchenschlachtkörpern Im Rahmen der bundesweiten Prävalenzerhebung für Salmonellen und Campylobacter spp. bei geschlachteten Masthähnchen im Jahr 2008 wurden in ST 28 Schlachtchargen untersucht (10 Blinddärme u. 1 Schlachtkörper je Schlachtcharge). Es waren 42,8% der Zäkumchargen und 50% der Schlachtkörper positiv für Campylobacter spp. und 3,5% der Schlachtkörper positiv für Salmonellen. Bundesweit wurden dagegen bei 54,9% der Zäkumchargen und bei 62% der Schlachtkörper Campylobacter spp. und bei 17,6% der Schlachtkörper Salmonellen nachgewiesen. Im Rahmen der bundesweiten Prävalenzerhebung für MRSA bei geschlachteten Masthähnchen im Jahr 2008 wurden in ST 10 Schlachtchargen (Halshautproben) untersucht und kein MRSA nachgewiesen. Im Jahr 2011 wurden dagegen im Rahmen des AVV Zoonosenmonitoring bei 4 von 23 Schlachtchargen (17,4%) MRSA nachgewiesen. Ergebnisse der Zoonosenüberwachung bei amtlichen Lebensmittelproben aus dem Einzelhandel Im Zeitraum 2008 -2011 wurden am Fachbereich 3 des LAV 102 Hähnchenfleischproben auf MRSA untersucht, bei 19 Proben erfolgte ein MRSA-Nachweis (18,6%). Im gleichen Zeitraum wurden 58 Putenfleischproben auf MRSA untersucht, bei 24 Proben erfolgte ein MRSA-Nachweis (41,4%). 3. Fazit Bei sämtlichen Nutzgeflügelarten, für die Salmonellenbekämpfungsprogamme aufgestellt worden sind, wurden bundesweit bereits im Jahr 2010 die Gemeinschaftszielwerte für die zulässigen Herdenprävalenzen erreicht. Dieser Erfolg spiegelt sich in kontinuierlichem Rückgang der humanen Salmonelloseerkrankungen wieder. In Sachsen-Anhalt sind weitere Anstrengungen erforderlich, um Salmonelleninfektionen in Legehennenbeständen zu reduzieren. Im Ereignisfall sind Schwachstellenanalysen durchzuführen und Bekämpfungskonzepte aufzustellen. Bundesweite Erhebungen über das Auftreten anderer Zoonoseerreger in den Erzeugerbetrieben im Rahmen des AVV - Zoonosenmonitoring erfolgten bei den verschiedenen Geflügelarten und Nutzungsrichtungen bisher überwiegend nur über den Zeitraum von einem Jahr. Aufgrund von z.T. hohen Nachweisraten von Campylobacter spp. und MRSA aus Hähnchenschlachtkörpern und Einzelhandelsproben von Hähnchen- und Putenfleisch ist die Fortsetzung des Campylobacter- u. MRSA - Monitoring in den Hähnchenu. Putenmastbeständen erforderlich. Zur Eindämmung humaner Campylobacteriosen müssen die Campylobacterinfektionen in Masthähnchenbeständen reduziert werden! Literatur: Salmonella-Bekämpfungsprogramm gemäß Verordnung (EG) Nr. 2160/2003: Ergebnisse für das Jahr 2011. Stellungnahme Nr. 029/2012 des BfR vom 13.06.2012 46 47 AviPro Salmonella Duo, der erste bivalente Salmonella Lebendimpfstoff für Hühner u. Enten Patrick Wefstaedt, Daniel Windhorst, Hans-C. Philipp Lohmann Animal Health GmbH, Heinz-Lohmann-Str.4, 27472 Cuxhaven Neueste Studien in zahlreichen Ländern weltweit bestätigen das zunehmende Aufkommen und die Ausbreitung monophasischer Salmonella Typhimurium Stämme bei Lebensmittel liefernden Tieren, Haustieren und beim Menschen. Mit AviPro Salmonella Duo steht erstmalig ein bivalenter Salmonella-Lebendimpfstoff für den Gebrauch bei Enten und Hühnern zur Verfügung, der einen homologen Schutz gegen Salmonella Enteritidis und Typhimurium sowie gegen monophasische Varianten von Salmonella Typhimurium vermittelt. Durch die aktive Immunisierung mit AviPro Salmonella Duo kann bei Hühnern die fäkale Ausscheidung und Besiedlung innerer Organe mit Salmonella Enteritidis und Salmonella Typhimurium Feldstämmen sowie eine Besiedlung der Eier mit Salmonella Typhimurium wirkungsvoll reduziert werden. Bei Enten dient die aktive Immunisierung einer Reduktion der Besiedlung innerer Organe mit Salmonella Typhimurium. Die erste Impfung erfolgt bei Hühnern vom ersten Tag an über das Trinkwasser. Wiederholungsimpfungen sind nach 6-8 Wochen sowie in der 16. Lebenswoche vorgesehen. Bei Mastenten erfolgt die einmalige Verabreichung des Impfstoffes in einfacher Dosis vom ersten Tag an. Die Selektionstrategien zur Entwicklung der AviPro Salmonellen-Impfstoffe beruhen auf dem in bakteriellen Populationen natürlich vorkommenden Prozess der Entstehung von metabolischen Driftmutationen (MDM, metabolic drift mutations). Diese Driftmutationen zeichnen sich durch herabgesetzte metabolische Aktivitäten aus, die sich in einem verlangsamten Wachstum und einer verlängerten Generationszeit auswirken. Gleichzeitig sind derartige Bakterienstämme hinsichtlich ihrer Virulenz attenuiert und damit für eine Anwendung als Impfstamm geeignet. Aufgrund der Lokalisation der genetischen Veränderungen auf dem Bakterienchromosom sind die in AviPro Salmonella Duo verwendeten Impfstämme genetisch stabil und sicher. Die Sicherheit von AviPro Salmonella Duo konnte anhand einer Anwendung bei SPF-Eintagsküken in wiederholter einfacher Dosierung, sowie einer einmaligen 10-fachen Dosierung des Impfstoffes und im Feldversuch gezeigt werden. Bei AviPro Salmonella Duo handelt es sich um einen vollständig neuentwickelten Impfstoff. Durch das innovative Kofermentationsverfahren bei der Herstellung des Impfstoffs können während aller Produktionsstufen gleiche Titer für beide im Impfstoff enthaltenen Impfstämme gewährleistet werden. Dies stellt die gleichbleibende Qualität und Zusammensetzung des ersten bivalenten Salmonella-Lebendimpfstoffs sicher und bildet damit die Voraussetzung für die Induktion eines homologen Impfschutzes gegen Salmonella Enteritidis und Salmonella Typhimurium. Reduktion der Organkolonisierung nach Challengeinfektion mit S. Typhimurium und S. Enteritidis beim Huhn Hinsichtlich der Wirksamkeitsprüfung von AviPro Salmonella Duo gegen eine induzierte Infektion von Hühnern mit Salmonella Typhimurium und Salmonella Enteritidis Feldstämmen wurden mit AviPro Salmonella Duo geimpfte Hennen zu Beginn und zum Ende der Legeperiode mit Salmonella Typhimurium und (in separaten Versuchen) mit Salmonella Enteritidis Feldstämmen infiziert. In der Folge wurde die Organpersistenz der Erreger in 48 Leber und Blinddarm 7 Tage nach der jeweiligen Infektion bestimmt und mit den Ergebnissen nicht geimpfter Kontrolltiere verglichen. Die orale Vakzinierung der Tiere erfolgte entsprechend der Zulassungsvorschriften durch Trinkwasserapplikation von AviPro Salmonella Duo am ersten Lebenstag sowie nach 6 und 16 Lebenswochen. Als Kontrollgruppe dienten ungeimpfte Legehennen. In der frühen Legeperiode (22. Woche) sowie in der Spätphase der Legeperiode (62. Woche) erfolgte die orale Applikation eines Salmonella Typhimurium Infektionsstamms. Die Infektion mit dem Salmonella Enteritidis Feldstamm erfolgte in der 21. Und 68. Lebenswoche. Sieben Tage nach den jeweiligen Infektionen erfolgte eine Keimzahlbestimmung aus Blinddarm- und Leberproben von 10 Hennen jeder Gruppe sowie eine quantitative Auswertung der jeweiligen Keimzahlreduktion. Die Ergebnisse zeigen nach oraler Challenge-Infektion mit S. Typhimurium bzw. S. Enteritidis im Falle einer vorangegangenen Impfung der Legehennen mit AviPro Salmonella Duo eine im Vergleich zur Kontrollgruppe deutlich gesenkte Keimzahl beider Erreger in Blinddarm und Leber sowohl in der frühen als auch in der späten Legeperiode. Im Falle einer Infektion mit Salmonella Typhimurium bzw. Salmonella Enteritidis kann eine vorangehende Impfung mit AviPro Salmonella Duo damit zu einer deutlichen Reduktion der Kolonisierung der Leber sowie des Blinddarms, als Hauptorte der Erregerpersistenz, führen. In weiteren Versuchen konnte nachgewiesen werden, dass der Impfstoff weder auf noch in die Eier übertragen wird und dass es nach erfolgter Impfung zu einer lediglich beschränkten Ausbreitung des Impfstoffstammes im Stall kommt. Reduktion der Organkolonisierung mit S. Typhimurium bei der Ente Die Wirksamkeit von AviPro Salmonella Duo zur Reduktion einer Organbesiedlung mit Salmonella Typhimurium bei Mastenten wurde ebenfalls anhand von ChallengeInfektionsversuchen untersucht. Dazu wurde eine Gruppe Pekingenten am 1. Lebenstag mit AviPro Salmonella Duo geimpft. Als Kontrollgruppe dienten ungeimpfte Tiere. Die orale Infektion der Tiere beider Gruppen erfolgte am 22. und 43. Lebenstag mit 1 x 109 KBE eines virulenten Salmonella Typhimurium Feldstamms. Die bakteriologische Analyse von Leber und Blinddärmen konnte im Falle der mit AviPro Salmonella Duo geimpften Pekingenten eine deutlich reduzierte Kolonisierung von Blinddarm und Leber nach der Infektion mit Salmonella Typhimurium am 22. Und 43. Lebenstag zeigen. Fazit Mit AviPro Salmonella Duo steht ein hocheffektiver Impfstoff zur Verfügung der einen homologen Schutz gegen Salmonella Enteritidis und Typhimurium bei Hühnern und Mastenten bietet, indem die Organkolonisierung wirksam reduziert wird. Darüber hinaus bietet AviPro Salmonella Duo einen zuverlässigen Schutz von Mastenten und Hühnern gegen die für Infektionen des Menschen an Bedeutung gewinnenden monophasischen Salmonella Typhimurium Stämme. 49 Tränkwasserhygiene als Teil innovativer Tiergesundheitsstrategien Dr. Ina Bräunig Lohmann Animal Health GmbH, Heinz Lohmann Str. 4, 27472 Cuxhaven Tränkwasser besitzt eine zentrale Funktion in der Aufzucht und Haltung von Geflügel. Dabei spielt nicht nur die ausreichende Menge an Wasser eine Rolle, sondern auch dessen Verwendung als Transport- und Lösungsmittel für nutritive, kurative und präventive Zwecke. Obwohl in Deutschland der überwiegende Teil der Ställe über das öffentliche Netz mit Wasser von Trinkwasserqualität versorgt wird, konnte nachgewiesen werden, dass Küken eine hohe Anzahl Mikroorganismen mit dem Tränkwasser aufnehmen. Die Menge von Mikroorganismen im aufgenommenen Wasser wird dabei wesentlich vom Management und vom Alter der Tiere beeinflusst. Diese Mikroorganismen befinden sich in der Fließphase im Wasser, sedimentieren aber auch auf Oberflächen in Tränkwassersystemen und neigen dazu, Biofilme zu bilden. Das Spektrum der in Tränkwasser nachweisbaren Mikroorganismen ist sehr breit. Neben Enterokokken und Enterobakterien wurden auch Salmonellen spp. und Campylobacter spp. in Tränkwasser und auf Oberflächen des Tränkwassersystems nachgewiesen. Damit stellt das Tränkwassersystem ein Reservoir und eine Infektionsquelle dar. Salmonellen spp. und Campylobacter spp. konnten vor allem aus Tränkelinien isoliert werden, wo persistierende Probleme mit diesen Keimen in aufeinanderfolgenden Durchgängen auftraten. Auch in Betrieben, in denen es in unregelmäßigen Abständen zum Nachweis derselben Serovare von Salmonellen mittels Sockentupfer kam, konnte das Tränksystem als Reservoir identifiziert werden. Dies trifft insbesondere für Betriebe zu, in denen S. Paratyphi B d-tartrat positiv wiederholt nachweisbar war. Neben dem Spektrum an Mikroorganismen zeigen auch die durchgeführten Untersuchungen zum Resistenzmuster der Keime gegenüber üblichen Antibiotika für Geflügel, dass die bestandsbetreuenden Tierärzte dem Tränkwassersysteme und der Tränkwasserqualität verstärkt Beachtung schenken sollten. Es konnte ebenfalls nachgewiesen werden, dass übliche Reinigungs- und Desinfektionsmaßnahmen an dem Tränkwassersystem in der Serviceperiode oft nicht zu dem gewünschten Erfolg führen. Trotz erfolgter Reinigung und Desinfektion konnte in den Tränkwassersystemen an verschiedenen Messpunkten in unterschiedlichem Ausmaß eine hohe Belastung mit unerwünschten Mikroorganismen nachgewiesen werden. Auch sind nach diesen Maßnahmen nicht in jedem Fall alle Rückstände von Arzneimitteln entfernt. Die Ergebnisse verdeutlichen, dass eine Verbesserung der Tränkwasserhygiene einen wesentlichen Beitrag zur Risikominimierung in der Geflügelhaltung beiträgt. Hier sind optimalere technische Lösungen die Tränklinien betreffend genauso erforderlich wie die Entwicklung von Reinigungs- und Desinfektionsmitteln und –verfahren für die Tierhaltung als auch das risikominimierte Management durch die Tierhalter mit Unterstützung der betreuenden Tierärzte. Nicht zuletzt leistet der verantwortungsbewusste Umgang mit jeglichen Tränkwasserzusätzen einen strategischen Beitrag zur modernen Haltung von Geflügel in naher und ferner Zukunft. 50 51 Mineralisationsstörungen und Minderwuchs in einem Putenbestand – ein Fallbericht Lutz Lauterbach, Ronald Günther Heidemark Mästerkreis GmbH & Co. KG, Veterinärlabor Jacob-Uffrecht-Straße 20 39340 Haldensleben Zusammenfassung: In einer Jungputenherde traten zwischen der 2. bis 8. Lebenswoche unspezifische klinische Symptome in Form von Apathie, verminderter Futteraufnahme, Lahmheit sowie zeitlich verzögert Beinfehlstellungen und Knochenbrüchen auf. In Ställen mit Zufütterung von hofeigenem Weizen zur Standardration zeigte sich gegenüber einer alleinigen Pelletfütterung ein klinisch abgemildertes Bild bei verbesserter, wenngleich ebenfalls nicht normgerechter Körpermasseentwicklung. Futteruntersuchungen bzgl. einer möglichen ursächlichen Pilztoxinbelastung zeigten keine Abweichungen. Pathologisch-anatomisch konnten im Alter von 6 Wochen Unregelmäßigkeiten im Bereich der Wachstumsplatten der proximalen Tibiotarsi diagnostiziert werden, welche histologisch als rachitische Veränderungen bestätigt werden konnten. Erneute Futtermittelanalysen mit Schwerpunkt auf Mineralstoffgehalt (Ca, P) sowie Phytaseaktivität zeigten temporäre, z. T. außerhalb der futtermittelrechtlichen Toleranz liegende Unterschreitungen im Bereich der P-Versorgung. Gravierendster Befund war jedoch eine über mehrere Futterchargen/-phasen nachweisbare, signifikant reduzierte Phytaseaktivität (SOLL 650 FTU/kg, IST z.T. <100 FTU/kg). Produktionsform: Der betroffene Betrieb zieht Puteneintagsküken beiderlei Geschlechtes selbst auf (Stall 1) und stallt die Hähne im Alter von ca. 5 Wochen in 3 separate Hahnenmastställe (Stall 2-4) um. Die Hennen verbleiben bis Mastende im Aufzuchtstall. Klinische Erscheinungen: Etwa ab Mitte der 2. Lebenswoche fiel die Herde durch anhaltende Klagelaute, Trägheit, eingezogene Köpfe sowie anhaltendes Kotpicken/Strohfressen auf, in dessen Folge sowohl Strohwickel im Magen als auch in verschiedenen Darmabschnitten zu beobachten waren. Die Futteraufnahme war dabei anhaltend reduziert. Symptomatische Behandlungen zeigten nur eine geringgradige Verbesserung des Allgemeinbefindens. Mit fortschreitender Zeit war ein zunehmendes Auseinanderwachsen der Herde zu beobachten (siehe Tabelle1). In der 6. Lebenswoche waren erste Beinfehlstellungen in Form von ein- und beidseitigen VarusValgusdeformationen sowie vereinzelt einseitige Tibiatorsion zu beobachten. Mit fortschreitendem Verlauf verstärkten sich die Deformationen und es traten vermehrt Knochenbrüche vorzugsweise des Femur aber auch des Tibiotarsus auf. 52 Tabelle 1: Soll- und IST-Gewichtsvergleich (20 Einzelwiegungen) zu verschiedenen Zeitpunkten der Aufzucht Alter (LeWo) Hennen Hähne Stall 1 Stall 2 Stall 3 + 4 IST (kg) IST (kg) IST (kg) SOLL (kg) SOLL (kg) 8 1,46 3,70 2,49 n.u. 4,73 12,5 4,40 8,07 5,80 7,50 11,09 Pathologische und histologische Befunde: Die Sektion gefallener / gemerzter moribunder Tiere ergab bis auf sporadische Hinweise keinerlei Anhaltspunkte für eine bakterielle Primärerkrankung. Hinweise auf eine virale Genese in Form von Darmveränderungen bzw. Veränderungen an lymphatischen Organen wurden ebenfalls nur sporadisch beobachtet. Mit fortschreitendem Krankheitsverlauf ergaben sich zunehmend Hinweise auf Mineralisationsstörungen in Form eines weichen Anschnitts im Bereich des proximalen Tibiotarsus, eines nur mäßig ausgebildeten Cortex, einer z. T. unregelmäßig verbreiterten Wachstumsplatte sowie ca. 1-2 mm starke, unregelmäßige Einschmelzungen distal der Wachstumsplatte im proximalen Tibiotarsus (Abb. 1). Histologisch konnte die Verbreiterung der Wachstumsplatte auf eine deutliche Verbreiterung der hypertrophen Zone zurückgeführt werden, wobei gleichzeitig die ungenügende Mineralisierung im Bereich der nur schwach ausgeprägten Kompakta bestätigt wurde. Diese bestand überwiegend aus nicht mineralisiertem Osteoid. Labordiagnostische Befunde: Futtermittelanalysen mit Schwerpunkt auf Mineralstoffgehalt (Ca, P) sowie Phytaseaktivität zeigten temporäre, z. T. außerhalb der futtermittelrechtlichen Toleranz liegende Unterschreitungen im Bereich der P-Versorgung. Gravierendster Befund war jedoch eine über mehrere Futterchargen nachweisbare, signifikant reduzierte Phytaseaktivität (SOLL 650 FTU/kg, IST z.T. <100 FTU/kg). Die Gegenprüfung der Rückstellmuster beim Futtermittelhersteller bestätigte den Phytasemangel im pelletierten Putenfutter. 53 3 a b Abb. 1: Links – schematische Darstellung Röhrenknochen (Günther 1997) mit den verschiedenen Strukturbereichen, Rechts – Sektionsbefund Tibiotarsus (a – vergrößerter hypertropher Zone, b – unregelmäßigen Einschmelzungen ca. 1,5 cm unterhalb der Wachstumsplatte) Diskussion und Schlussfolgerungen: Obwohl die Chargenprotokolle der Futtermühle den ordnungsgemäßen Zusatz der Phytase während der Herstellung auswiesen, wurde ein z. T. deutlich abweichender tatsächlicher Phytasegehalt im Alleinfutter festgestellt. Ursächlich für die gemessenen Abweichungen könnten nicht dokumentierte Abweichungen im Rahmen des Pelletierungsprozesses sein. Die geringere Ausprägung der Veränderungen in den Ställen mit Weizenbeifütterung zum Alleinfutter lässt sich durch den zwar begrenzten, in diesem Fall aber mildernd wirkenden Gehalt von Getreide-eigener Phytase erklären, welche im Zusammenhang mit dem Getreideeigenen Phytinphosphor einen gewissen substituierenden Effekt ausübte. Differentialdiagnostisch sollte daher bei verminderter Futteraufnahme und einsetzenden Mineralisierungsstörungen neben einer Untersuchung auf Kalzium und Phosphorgehalt eine Ermittlung des Phytasegehaltes im Futter immer mit in Betracht gezogen werden. Literatur: Günther, R. (1997): Makroskopische, histologische und histometrische Untersuchungen zum Skelettwachstum der Hintergliedmaßen von Hühnern einer Legelinie sowie Vergleich mit einer Mastlinie. Diss. FU-Berlin. Spindler, B. (2007): Pathologisch-anatomische und histologische Untersuchungen an Gelenken und Fußballen bei Puten der Linie B.U.T. 6 bei der Haltung mit und ohne Außenklimabereich. Diss. TiHo-Hannover. 54