doc - ChidS
Werbung

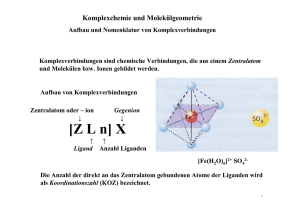
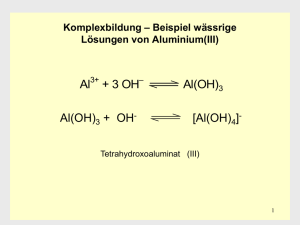
Philipps-Universität Marburg Fachbereich Chemie Lehramt Sommersemester 2007 Seminar: Übungen im Experimentalvortrag (AC) Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html Komplexchemie Experimentalvortrag vom 21.06.2007 Dörthe Fillbrandt Zeppelinstraße 17a 35039 Marburg [email protected] 2 Inhaltsverzeichnis 1 Einleitung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Seite 3 2 Einstieg in das Thema . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 2.1 Versuch 1: Das Phänomen der Komplexbildung . . . . . . . . . . . . . . . . . . . . . . 4 2.2 Definition . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 3 Geschichte der Komplexchemie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 3.1 Geschichte der Komplexchemie vor Werner . . . . . . . . . . . . . . . . . . . . . . . . . 6 3.2 Werners Koordinationstheorie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 3.2.1 Demonstration 1: Koordinationspolyeder . . . . . . . . . . . . . . . . . . 8 3.2.2 Werners Erfolge . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 4 Theorien . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 4.1 Valence-Bond-Theorie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 4.1.1 Versuch 2: Magnetische Eigenschaften. . . . . . . . . . . . . . . . . . . . . 11 4.2 Ligandenfeldtheorie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14 4.2.1 Versuch 3: Oxidationsstufen des Mangans . . . . . . . . . . . . . . . . . . 14 4.3 Vergleich der Theorien . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 5 Stabilität von Komplexen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20 5.1 Qualitative Betrachtung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20 5.1.1 Versuch 4: Ligandenaustauschreaktionen an Fe(II)-Komplexen . . 20 - Berliner Blau 5.2 Quantitative Betrachtung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 5.2.1 Versuch 5: Bestimmung der Komplexbildungskonstanten von Cu(II)-Komplexen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 - Chelateffekt 6 Demonstration 2: Bestimmung der Koordinationszahl . . . . . . . . . . . . . . . . . . . . . . . . . 30 7 Bedeutung und Verwendung von Komplexen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32 7.1 Versuch 6: Nickeltest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32 7.2 Versuch 7: Geheimtinte . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33 8 Schulrelevanz . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34 9 Literaturverzeichnis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35 3 1 Einleitung Das Gebiet der Komplexchemie ist sehr umfangreich. Nach dem hessischen Lehrplan tritt es als Wahlthema im Leistungskurs Chemie auf. Um das Thema in der Schule zu behandeln, ist eine didaktische Reduktion unerlässlich. Es sollte auf dem Wissensstand der Schüler aufgebaut werden und auf exemplarische Weise an das Thema herangegangen werden. Theoretische Aspekte können anhand von Versuchen eingeführt werden, welche sich zum Beispiel in Form schöner Farbänderungen förderlich auf die Motivation auswirken sollten. Ein lebensweltlicher Bezug kann hergestellt werden, indem auf das Vorkommen von Komplexverbindungen in der Natur und die Vielfalt der Anwendungsmöglichkeiten eingegangen wird. Im Gebiet der Komplexchemie können bereits vermittelte Unterrichtsinhalte wieder aufgegriffen und somit vertieft werden, was auch der Abiturvorbereitung zugute kommt. Ich habe in meinem Experimentalvortrag wichtige Bereiche der Komplexchemie aufgegriffen: geschichtliche Aspekte, theoretische Modelle, Farbigkeit, Stabilität und Anwendung von Komplexen. Zu jedem Gebiet werden Versuche durchgeführt und der Schüler wird dabei auch an komplizierte theoretische Aspekte herangeführt. 4 2 Einstieg in das Thema In der Schule könnte man das Thema der Komplexchemie mit einem Versuch beginnen, der auf vorhandenes Wissen der Schüler aufbaut. Das Phänomen der Komplexbildung soll an einem einfachen Beispiel demonstriert werden. 2.1 Versuch 1: Das Phänomen der Komplexbildung Material: Bürette (50 mL), Becherglas (250 mL), Magnetrührer, Rührfisch, schwarze Pappe, Stativmaterial Chemikalien: Natronlauge NaOH (aq) (c = 1 mol/L) Aluminiumnitratlösung Al(NO3)3 (aq)*9H2O (c = 0,1 mol/L) Durchführung: 100 mL der Aluminiumnitratlösung werden im Becherglas vorgelegt und mit der Natronlauge titriert. Beobachtung: Es bildet sich ein weißer Niederschlag, der zunächst an Volumen zunimmt. Bei weiterer Zugabe von Natronlauge wird die Lösung dann klarer. Bei einem Verbrauch von ca. 40 mL Natronlauge hat sich der Niederschlag wieder vollständig aufgelöst. Erläuterung: Die Aluminium-Ionen bilden mit den Hydroxid-Ionen einen Niederschlag von Aluminiumhydroxid. Al3+(aq) + 3 OH- (aq) Al(OH)3 (s) Die Fällung wird durch das Löslichkeitsprodukt bestimmt, das sich aus den Konzentrationen der Aluminium- und der Hydroxid-Ionen berechnet. K L AlOH3 c Al 3 c OH 2 10 3 33 mol 4 L4 Wenn das Löslichkeitsprodukt überschritten wird, fällt so lange Aluminiumhydroxid aus, bis das Produkt der Konzentrationen wieder dem Löslichkeitsprodukt entspricht. 5 Dies sollten die Schüler bereits gelernt haben. Für sie ist nun jedoch neu, dass sich der Niederschlag bei weiterer Zugabe von Hydroxid-Ionen wieder auflöst und es nicht zu einer weiteren Niederschlagsbildung kommt. Die Schüler könnten nun vermuten, dass die zusätzlichen Hydroxid-Ionen mit dem ausgefallenen Aluminiumhydroxid eine Reaktion eingehen. Die neue Verbindung muss wasserlöslich sein, mehr als drei Hydroxid-Ionen enthalten und negativ geladen sein. Es lässt somit zunächst die folgende vorläufige Gleichung für die Auflösung des Niederschlags aufstellen. Al(OH)3 (s) + n OH- (aq) Al(OH)3+n n- (aq) Nun wurden 40 mL Natronlauge für die Titration verbraucht. Damit lässt sich das Stoffmengenverhältnis der Aluminium- zu den Hydroxid-Ionen berechnen. n(Al 3 ) V(Al 3 Lsg.) c(Al 3 ) 0,1 L 0,1 mol/L 1 n(OH - ) V(OH - Lsg.) c(OH - ) 0,04 L 1 mol/L 4 Man erhält also ein Stoffmengenverhältnis der Aluminium- zu den Hydroxid-Ionen von 1 : 4. Damit lässt sich die folgende Reaktionsgleichung aufstellen. Al(OH)3 (s) + OH- (aq) Al(OH)4 (aq) Es hat sich ein Komplex gebildet, das Tetrahydroxoaluminat. 2.2 Definition Es ist nicht einfach eine Definition von Komplexen zu geben. Die Lehrbücher versuchen dies auf unterschiedliche Weise. Die Definitionen sind teilweise sehr umfangreich, um alle Arten von Komplexen einschließen zu können. Oft werden einfach die Eigenschaften von Komplexverbindungen aufgelistet. Wenn man den Schülern dennoch eine Antwort auf die Frage geben möchte, was ein Komplex denn eigentlich sei, so kann man folgende Definition von Kober verwenden. „Das Prinzip der Bindung in Komplexen ist die Wechselwirkung eines elektronisch ungesättigten Zentralteilchens mit Partnern (= Liganden), die mindestens ein freies 6 Elektronenpaar besitzen. Bindet dabei das Zentralteilchen mehr Bindungspartner, als dies nach dessen Ladung oder Stellung im PSE zu erwarten ist, so liegt ein Komplex vor.“ (Friedhelm Kober in „Komplex – Versuch einer Definition“, PdN-Ch. 4/34. Jahrgang 1985, S. 7) Diese Definition lässt sich auch auf das Tetrahydoxoaluminat aus Versuch 1 beziehen. Das elektronisch ungesättigte Teilchen ist das Al3+-Ion, das die Hydroxid-Ionen als Liganden bindet, und zwar mehr Hydroxid-Ionen als nach seiner Stellung in der dritten Hauptgruppe zu erwarten wäre. 3 Geschichte der Komplexchemie Wie ist die Komplexchemie im Laufe der Zeit entstanden? 3.1 Geschichte der Komplexchemie vor Werner Einzelne Substanzen, deren charakteristischer Inhaltstoff eine Komplexverbindung ist, wurden schon im Altertum verwendet, z.B. Alizarin, der Farbstoff der Krappwurzel. Der erste dokumentierte Beleg einer Komplexverbindung geht auf den Arzt Libavius im Jahr 1597 zurück. Er entdeckte in einer Lösung aus Kupferhydroxid und Ammoniumchlorid auf Bronze eine Blaufärbung, die er beschrieb, aber weder analysierte noch identifizierte. Es handelt sich dabei um den heute bekannten Tetraamminkupfer(II)-Komplex. 1704 entdeckten Diesbach und Dippel in einer Alchemisten- und Malerküche per Zufall das „Berliner Blau“. Im 19. Jahrhundert sind vor allem die Chemiker Fremy und Jørgensen zu nennen. Fremy führte die Benennung von Komplexen nach Farben ein, z.B. wurden gelbe Komplexe als Luteosalze, rote Komplexe als Purpureosalze bezeichnet. Der Däne Jørgensen war ein sehr produktiver Chemiker; er synthetisierte eine Vielzahl von Komplexverbindungen. Er war auch Anhänger eines Strukturkonzepts, das der Schwede Christian Blomstrand entwickelt hatte und das ab 1870 unter dem Begriff „Kettentheorie“ bekannt wurde. Als Beispiel ist in Abb. 1 die Vorstellung des Hexammincobalt(II)chlorid 7 aufgezeigt, welches damals als Cobaltchlorid-Ammonikat bezeichnet wurde. Das Molekül sollte Ketten enthalten, in denen fünfbindiger Stickstoff auftritt. Co NH3 Cl NH3 Cl NH3 NH3 NH3 NH3 Cl Abb. 1: Hexammincobalt(II)chlorid nach der Kettentheorie 3.2 Werners Koordinationstheorie Alfred Werner lebte von 1866 bis 1919 und wird auch als „Vater der Komplexchemie“ bezeichnet. 1 Abb. 2: Alfred Werner 1893 publizierte er die „Beiträge zur Konstitution anorganischer Verbindungen“ in der kurz zuvor gegründeten „Zeitschrift für Anorganische Chemie“. Diese Schrift entstand quasi „über Nacht“. Werner wachte eines Nachts gegen zwei Uhr plötzlich auf und hatte die Lösung eines Problems vor Augen, welches ihn schon länger beschäftigte. Er stand auf und schrieb sofort seine Gedanken bis fünf Uhr des nächsten Nachmittags nieder, mit Hilfe einiger Tassen Kaffee. Eine weitere Besonderheit seiner Theorie ist es, das Werner auf dem Gebiet der Komplexchemie bisher kein Experiment durchgeführt hatte. Ein deutscher Kollege bezeichnete seine Koordinationstheorie daher auch als „eine geniale Frechheit“. Werners Lebenswerk war es dann diese „geniale Frechheit“ auf eine empirische Grundlage zu stellen. 1 Aus: http://nobelprize.org/nobel_prizes/chemistry/laureates/1913/werner-bio.html 8 Werner postulierte eine Bindung von Liganden in erster oder zweiter Sphäre. Demnach können anionische Liganden entweder in erster Sphäre direkt an das Zentralteilchen gebunden sein oder in zweiter Sphäre als Gegenionen fungieren. Nach Werner besitzt jedes Ion Hauptvalenzen (≡ Oxidationszahl), einige außerdem Nebenvalenzen (≡ Koordinationszahl). Die Atome seien durch die Nebenvalenzen fester gebunden. Diese seien zudem räumlich gerichtet. Werner machte sich Gedanken über die räumliche Anordnung. Für die Koordinationszahl vier schlug er die tetraedrische oder die quadratisch-planare Anordnung vor. Mit der folgenden Demonstration soll Werners Gedankengang zur räumlichen Anordnung von sechsfach koordinierten Metallatomen nachvollzogen werden. 3.2.1 Demonstration 1: Koordinationspolyeder Zu Werners Zeit war bereits bekannt, dass Komplexe des Typs [MA5B] keine Isomere besitzen. Denkbare Geometrien waren daher die hexagonal-planare, die trigonal-prismatische und die oktaedrische Geometrie. Diese Koordinationspolyeder können nun von den Schülern gebastelt werden. Material: Papier, Schere, Klebe, Buntstifte Bastelvorlage: 2 Abb. 3: Bastelvorlage für Koordinationspolyeder 2 Vgl. Gelies, S. 73 9 Durchführung: Die Polyeder werden ausgeschnitten, entlang der schwarzen Linien gefaltet und entsprechend der Pfeile zusammengeklebt. Nun werden Komplexe des Typs [MA4B2] betrachtet. Im Modell liegen die Metallatome in der Mitte des gebastelten Polyeders, die Liganden an den Eckpunkten. Die Liganden B können mittels farbiger Punkte an den Ecken der Polyeder markiert werden. So werden die Polyeder auf die Anzahl der möglichen Isomere untersucht. Beobachtung: Für die planare Struktur findet man drei Isomere. Die Liganden B können sich in ortho-, meta- oder para-Stellung zueinander befinden. B A B B A A A M A B A A B A A M M A A A ortho (1,2) B meta (1,3) para (1,4) Für die trigonal-prismatische Struktur findet man ebenfalls drei Isomere. Die Liganden B können an einer Dreiecksfläche liegen, nebeneinander an einer Vierecksfläche oder einander gegenüberliegend an einer Vierecksfläche. B A B B M A A B A M A B A A M A A A A A B (1,2) (1,3) (1,4) Für die oktaedrische Struktur findet man nur zwei Isomere. Das cisIsomer, bei dem die beiden Liganden B an zwei benachbarten Eckpunkten sitzen und das trans-Isomer, bei dem die beiden Liganden B an zwei einander gegenüberliegenden Eckpunkten sitzen. 10 B B A A B A A M M A A cis (1,2) A A B trans (1,6) Erläuterung: Zu Werners Zeit ließen sich nur zwei isomere Reihen von Komplexen des Typs [MA4B2] synthetisieren. Daher hielt er die oktaedrische Koordination für diese Komplexe am wahrscheinlichsten. Tatsächlich ist die oktaedrische die häufigste Koordination von Komplexen mit sechs Liganden. Es existieren auch trigonal-prismatische Komplexe, diese sind allerdings sehr selten. Mit dieser Demonstration kann das räumliche Vorstellungsvermögen und das Isomeriedenken der Schüler geübt werden und es kann auf weitere Isomerien eingegangen werden, z.B. auf die fac-/mer-Isomerie bei oktaedrisch koordinierten Komplexen. 3.2.2 Werners Erfolge Werner wollte das Oktaedermodell durch die Synthese optisch aktiver Metallkomplexe empirisch stützen. Bei geeigneter Wahl der Liganden sollte es möglich sein, chirale Verbindungen zu erhalten. 1911 gelang schließlich Werners Doktoranden Victor King nach über 2000 Fehlversuchen die Trennung eines Racemats und somit der Beweis der stereochemischen Vorstellungen. Durch Werners Koordinationstheorie gelang außerdem 1894 die vollständige Erklärung der Ergebnisse von Leitfähigkeitsmessungen an Amminkobaltkomplexen, was zuvor nicht möglich war. 1913 wurde Werner für seine Arbeit belohnt, indem er als erster anorganischer Chemiker den Nobelpreis für Chemie erhielt. Seine Hypothesen bilden auch heute noch die theoretische Basis der Komplexchemie. 11 Der folgende Versuch soll mit der heutigen Komplexchemie fortfahren. Der Versuch zu den magnetischen Eigenschaften von Komplexen soll auf eine wichtige Theorie, die ValenceBond-Theorie hinführen. 4 Theorien 4.1 Valence-Bond-Theorie 4.1.1 Versuch 2 : Magnetische Eigenschaften Materialien: Hufeisenmagnet mit Spulen (500 Windungen) und Polschuhen, Transformator, Kabel, Stativ (2 Glasstäbe parallel zueinander befestigt, 2 Schlaufen aus Garn daran geknüpft), 2 NMR-Röhrchen, Kamera, Lampe Chemikalien: Gelbes Blutlaugensalz K4[Fe(CN)6] (s) Eisen(II)sulfat-Heptahydrat [Fe(H2O)6]SO4 (s) (beides in die NMR-Röhrchen eingeschmolzen) Durchführung: In die am Stativ befestigten Schlaufen wird ein NMR-Röhrchen mit eingeschmolzener Substanz wie in eine Schaukel eingehängt. Das mit der Substanz gefüllt Ende ist kurz vor den Spitzen der Polschuhe justiert. Die Kamera wird ebenso wie die Lampe direkt von oben auf das Röhrchen und die Polschuhe gerichtet. An den Magneten wird eine Spannung von 15 Volt angelegt. Beobachtung: Das NMR-Röhrchen mit Eisensulfat wird in das Magnetfeld hineingezogen. Beim gelben Blutlaugensalz ist keine deutliche Rektion erkennbar. Erläuterung: Jedes Elektron besitzt ein magnetisches Moment auf Grund seines Bahndrehimpulses und seines Eigendrehimpulses, des Spins. Das gesamte magnetische Moment von Stoffen 12 resultiert aus den Bahn- und Spinmomenten aller Ionen. Bei Substanzen mit abgeschlossenen Schalen oder Unterschalen kompensieren sich die magnetischen Momente. Es gibt kein resultierendes magnetisches Moment. Die durch ein Magnetfeld induzierte magnetische Polarisation ist dem äußeren Feld entgegengerichtet. Es kommt zur Schwächung im Innern des magnetischen Feldes, in Abb. 4 erkennbar an den weiter auseinander stehenden Feldlinien. Die Substanz wird aus dem Magnetfeld abgestoßen. Solche Stoffe werden als diamagnetisch bezeichnet. Substanzen mit ungepaarten Elektronen hingegen sind paramagnetisch. Sie besitzen ein permanentes magnetisches Moment. Die magnetischen Momente richten sich im Magnetfeld aus, es kommt zur Anziehung der Substanz (vgl. Abb. 4). Demnach ist das Eisensulfat paramagnetisch, das gelbe Blutlaugensalz diamagnetisch. Die Abstoßung kann unter den Versuchsbedingungen nicht beobachtet werden, da der Paramagnetismus 103- bis 104-mal größer ist als der Diamagnetismus. Es ist wichtig zu erwähnen, dass alle Substanzen auch einen diamagnetischen Anteil besitzen. Diamagnetischer Stoff Paramagnetischer Stoff K4[Fe(CN)6] [Fe(H2O)6]SO4 Binnen = Induktion im Innern des Körpers Baußen = Induktion des äußeren Magnetfelds 3 Abb. 4: Dia- bzw. paramagnetischer Stoff im Magnetfeld Bei beiden Stoffen tritt Eisen in der Oxidationsstufe +II auf. Warum ist nun die eine Substanz paramagnetisch und die andere diamagnetisch? Um dies zu erklären, möchte ich die Valence-Bond-Theorie nach Pauling vorstellen. 3 Aus: http://www.mmch.uni-kiel.de/supra_folien_2.htm 13 Valence-Bond-Theorie Nach der Valence-Bond-Theorie entstehen Bindungen durch Überlappung von gefüllten Ligandenorbitalen mit leeren Orbitalen des Zentralatoms. Die räumliche Anordnung der Liganden resultiert aus dem Hybridisierungstyp der Orbitale des Zentralatoms. Die häufigsten Hybridisierungstypen sind das sp3, das dsp2, und das d2sp3-Hybrid. sp3 dsp2 d2sp3 4 Abb. 5: Hybridorbitale Das Eisen(II)-Ion besitzt sechs d-Elektronen. Beim Übergang zum Hexaquaeisen(II)-Ion kommt es zur Hybridisierung und Besetzung der Hybridorbitale mit Ligandenelektronen (vgl. Abb. 6, die Ligandenelektronen sind hier rot markiert). Es sind ungepaarte Elektronen vorhanden, der Stoff ist also paramagnetisch. Beim Übergang zum Hexacyanoferrat(II)-Ion erfolgt eine Spinnpaarung sowie Hybridisierung und Besetzung der Hybridorbitale mit Ligandenelektronen. Es sind keine ungepaarten Elektronen vorhanden, der Stoff ist diamagnetisch. 4 Vgl. Kowoll, Protokoll zum Experimentalvortrag, S. 11 14 3d 4s 4p 4d Fe2+ [Fe(H2O)6]2+ paramagnetisch sp3d2-Hybrid [Fe(CN)6]4diamagnetisch durch Spinpaarung d2sp3-Hybrid Abb. 6: Besetzung der Orbitale mit d-Elektronen Die Valence-Bond-Theorie kann die magnetischen Eigenschaften also erklären, aber nicht vorhersagen. Dafür ist eine weiterführende Theorie nötig, auf die mit dem folgenden Versuch hingeführt werden soll. Der Versuch zeigt eine Eigenschaft von Komplexen, die auf die Schüler motivierend wirken sollte: die Farbigkeit. 3.2 Ligandenfeldtheorie 3.2.1 Versuch 3: Oxidationsstufen des Mangans Material: Magnetrührer, Rührfisch, Erlenmeyerkolben (300 mL), Pasteurpipette, Messpipette Chemikalien: Natronlauge NaOH (aq) (w = 0,3) und (c = 2 mol/L) Kaliumpermanganatlösung KMnO4 (aq) (w = 0,75) Borsäurelösung H3BO3 (aq) (c = 0,5 mol/L) Wasserstoffperoxidlösung H2O2 (aq) (c = 0,5 mol/L) 15 Durchführung: Im Erlenmeyerkolben werden 150 mL der 30%igen Natronlauge vorgelegt und mit 1,5 mL der Kaliumpermanganatlösung versetzt. Dann tropft man sofort unter Rühren eine frisch bereitete Lösung aus 4 mL Wasserstoffperoxidlösung, 25 mL Natronlauge (c = 2 mol/L) und 20 mL Borsäurelösung hinzu. Beobachtung: Die violette Farbe der Kaliumpermanganatlösung ändert sich jeweils über Mischfarben nacheinander zu grün, blau und schließlich braungelb. Erläuterung: Es laufen Redoxreaktionen ab, bei denen das Wasserstoffperoxid als Reduktionsmittel auftritt. Dabei wird das Mangan der Oxidationsstufe +VII des Permanganats schrittweise reduziert: zum grünen Manganat mit Mangan der Oxidationsstufe +VI, zum blauen Hypomanganat mit Mangan der Oxidationsstufe +V und schließlich zum braun-gelben Manganit mit Mangan der Oxidationsstufe +IV. Die Reaktionsgleichungen sind im Folgenden dargestellt. +7 2 MnO4- (aq) -1 + H2O2 (aq) +6 violett +6 2 MnO42-(aq) grün +5 -1 + H2O2 (aq) 2 MnO43-(aq) grün +5 2 MnO43-(aq) 0 2 MnO42- (aq) + O2 (g) + 2 H+(aq) 0 + O2 (g) + 2 H+(aq) blau -1 + H2O2 (aq) +4 0 2 MnO44-(aq) + O2 (g) + 2 H+(aq) blau braun-gelb Anhand der Manganat-Ionen möchte ich nun die Ligandenfeldtheorie erläutern. Ligandenfeldtheorie Die Ligandenfeldtheorie beruht auf der abstoßenden Wechselwirkung der Liganden eines Komplexes mit den d-Elektronen des Zentralatoms. Übergangsmetallionen besitzen fünf entartete d-Orbitale: dxy, dxz, dyz, dz2, dx2-y2. Diese sind in der folgenden Abbildung dargestellt. 16 dx2-y2 dxy dz2 dxz dyz Abb. 7: d-Orbitale Wenn sich nun Liganden dem Zentralteilchen nähern, so wird die Energie der d-Orbitale angehoben. Würde die Annäherung der Liganden kugelsymmetrisch erfolgen, so würde die Entartung der d-Orbitale erhalten bleiben. Bei den Tetraoxomanganat-Ionen liegt ein tetraedrisches Ligandenfeld vor, d.h. die Liganden nähern sich den Zentralteilchen in Form eines Tetraeders. Die Größe der Abstoßung bei Annäherung der Liganden ist für die unterschiedlichen d-Orbitale verschieden, die Entartung wird also aufgehoben. Stellt man sich nun vor, dass sich die Liganden entlang der Raumdiagonalen eines Würfels dem Zentralteilchen nähern (vgl. Abb. 8), dann stellt man fest, dass die dxy-, dxz- und dyzOrbitale direkt auf Orbitallappen treffen. Die Energie dieser Orbitale erhöht sich daher. Bei den dx2-y2- und dz2-Orbitalen hingegen treffen die Liganden auf die Knotenebenen. Sie nähern sich diesen Orbitalen weniger stark, ihre Energie ist daher erniedrigt. 5 Abb. 8: dx2-y2- und dxy-Orbital im tetraedrischen Ligandenfeld 5 Aus: Riedel, S. 693 17 Diese Erkenntnisse lassen sich in einem Energieniveaudiagramm darstellen. t2-Orbitale d-Orbitale dxy dxz dyz 2/5 T T 3/5 T Energie e-Orbitale dz2 dx2-y2 d-Orbitale isoliertes Ion kugelsymmetrisches Ligandenfeld tetraedrisches Ligandenfeld Abb. 9. Energieniveaudiagramm der d-Orbitale Man erkennt, dass die d-Orbitale im kugelsymmetrischen Ligandenfeld gegenüber dem isolierten Ion energetisch angehoben sind. Im tetraedrischen Ligandenfeld kommt es dann zu einer Aufspaltung bzw. Entartung der Energie der d-Orbitale. Die energetisch angehobenen dxy-, dxz- und dyz-Orbitale werden als t2-Orbitale, die energetisch abgesenkten dx2-y2- und dz2Orbitale als e-Orbitale bezeichnet. Die Aufspaltung wird als Ligandenfeldaufspaltung ΔT bezeichnet. Sie erfolgt nach dem Schwerpunktsatz, der besagt, dass sich der energetische Schwerpunkt der Orbitale beim Übergang vom kugelsymmetrischen zum tetraedrischen Ligandenfeld nicht verändert. Die t2-Orbitale sind um 2/5 ΔT angehoben, die e-Orbitale um 3/5 ΔT abgesenkt. Für den Fall, dass alle Orbitale mit zwei Elektronen besetzt sind, erhält man nach dem Schwerpunktsatz: + 6*2/5 ΔT – 4*3/5 ΔT = 0. Wenn man die d-Orbitale entsprechend der Hundschen Regel mit Elektronen besetzt, so erhält man die größtmögliche Zahl ungepaarter Elektronen, was auch als high-spin-Zustand bezeichnet wird. Für die Manganat-Ionen ist dieser Zustand in Abbildung 10 gezeigt. Das Permanganat-Ion besitzt kein d-Elektron, das Manganat-Ion eins, das Hypomanganat-Ion zwei und das Manganit-Ion drei d-Elektronen. 18 d0 im MnO4- d1 im MnO42- d2 im MnO43- d3 im MnO44- Abb. 10: d-Elektronen der Manganat-Ionen Es ist nun auch denkbar, zunächst die energetisch abgesenkten Orbitale mit d-Elektronen vollständig zu besetzen, bevor die energetisch angehobenen Orbitale besetzt werden. Dabei wird Energie entsprechend der Ligandenfeldaufspaltung frei, es muss allerdings Spinpaarungsenergie aufgewandt werden. Komplexe mit einer derartigen Besetzung der d-Orbitale entstehen daher nur, wenn die Ligandenfeldaufspaltung Δ größer als die Spinpaarungsenergie ist. Hier liegt die geringste Anzahl ungepaarter Elektronen vor, der Zustand wird daher auch als low-spin-Zustand bezeichnet. Für die d3-Elektronenkonfiguration des Manganit-Ions ist sowohl ein high- als auch ein lowspin-Zustand denkbar (vgl. Abb. 11). High-spin Low-spin Abb. 11: d3 im MnO44- Farbigkeit der Manganate Zur Farbigkeit der Manganat-Ionen kann man gleich zwei Aspekte erläutern, die für die Farbigkeit von Komplexen von Bedeutung sind. Zum einen liegen Charge-Transfer-Übergänge vom Ligand zum Metall vor (LMCT). Dabei wird durch Absorption eines Lichtquants Elektronenladung innerhalb eines Komplexes übertragen. Abbildung 12 zeigt dies am Beispiel des Permanganat-Ions. 19 O O Mn O O e- Abb. 12: LMCT des MnO4--Ions Zum anderen treten bei den Manganat-Ionen d-d-Übergänge auf, außer bei dem PermanganatIon, da dieses keine d-Elektronen besitzt. Die d-d-Übergänge sind für die Farbgebung weniger bedeutsam als die Charge-Transfer-Übergänge, da sie Laporte-verboten sind. Ein Elektron kann von einem tiefer liegenden d-Orbital in ein höher liegendes angeregt werden (vgl. Abb. 13). h* h* d1 im MnO42- d2 im MnO43- h* d3 im MnO44- Abb. 13: d-d-Übergänge der Manganat-Ionen 4.3 Vergleich der Theorien Valenzbindungstheorie Ligandenfeldtheorie Grundlage Kovalente Bindung Elektrostatische Wechselwirkung Struktur Ja Nein (keine Bindungstheorie) Magnetismus Richtig erklärt, aber Ja nicht vorhersagbar Farbigkeit Nein Ja Tab. 1: Vergleich der Theorien Die Valenzbindungstheorie betrachtet kovalente Bindungen. Sie erklärt die Struktur komplexer Verbindungen. Der Magnetismus kann richtig erklärt, aber nicht vorhergesagt werden. Es wird keine Aussage über die Farbigkeit getroffen. 20 Der Ligandenfeldtheorie liegt die Betrachtung elektrostatischer, abstoßender Wechselwirkungen zugrunde. Es wird keine Aussage über die Struktur getroffen, da die Ligandenfeldtheorie keine Bindungstheorie ist. Magnetismus und Farbigkeit können jedoch erklärt werden. Es gibt eine weitere wichtige Theorie zur Beschreibung von Komplexverbindungen: die Molekülorbitaltheorie. Diese Theorie kann alle eben genannten Eigenschaften von Komplexen deuten. Ich werde auf die Molekülorbitaltheorie allerdings nicht weiter eingehen, da sie in der Schule nie benutzt wird. Ich möchte stattdessen lieber weitere schulrelevante Experimente zeigen. 5 Stabilität von Komplexen 5.1 Qualitative Betrachtung 5.1.1 Versuch 4: Ligandenaustauschreaktionen an Fe (III)-Komplexen Material: 6 Bechergläser (250 mL), Ziegelsteine, 6 Bechergläser (50 mL) oder Reagenzglasgestell, 6 Reagenzgläser, Universal-Indikatorpapier, Pasteurpipetten Chemikalien: Eisen(III)-nitratlösung Fe(NO3)3*9H2O(aq) (c = 0,1 mol/L) Salpetersäure HNO3 (aq) (halbkonz.) Natriumchloridlösung NaCl (aq) (gesättigt) Kaliumthiocyanatlösung KSCN (aq) (c = 0,1 mol/L) Natriumfluoridlösung NaF (aq) (gesättigt) Gelbes Blutlaugensalz K4[Fe(CN)6] (s) Durchführung: Sechs Bechergläser (250 mL) stehen zur besseren Sichtbarkeit auf Ziegelsteinen erhöht. Davor befinden sich sechs Bechergläser (50 mL), in denen sechs Reagenzgläser stehen. Im ersten Becherglas befinden sich 100 mL Eisen(III)-nitratlösung. Diese wird nun immer ein Becherglas weiter gegossen. Aus jedem Becherglas wird eine Probe in ein Reagenzglas gefüllt, damit der jeweilige Farbeindruck vor Augen bleibt. Während des Versuchs wird geheim gehalten, was sich in den 21 Bechergläsern befindet. Erst bei der Erklärung des Versuchs werden die Substanzen genannt. Dies wurde im Vortrag so gestaltet, dass die Bechergläser nacheinander umgedreht wurden und die Aufschrift auf der Rückseite gezeigt wurde. Im zweiten Becherglas werden 4 mL halbkonzentrierte Salpetersäure vorgelegt, im dritten Becherglas 6 mL gesättigte Natriumchloridlösung, im vierten Becherglas ca. 5 Tropfen Kaliumthiocyanatlösung, im fünften Becherglas 50 mL gesättigte Natriumfluoridlösung und im sechsten Becherglas eine Spatelspitze gelbes Blutlaugensalz. Beobachtung: Die Eisen(III)-nitratlösung ist orange. Im zweiten Becherglas kommt es zur Entfärbung, im dritten wird eine gelbe Farbe sichtbar. Im vierten Becherglas tritt eine rote Farbe auf, die im fünften Becherglas wieder verschwindet. Hier ist außerdem eine weiße Trübung erkennbar. Im sechsten Becherglas wird die Lösung schließlich tiefblau. Abb. 14: Farbenfolge in den Bechergläsern Abb. 15: In Reagenzgläser abgefüllte Proben 22 Erläuterung: Es finden Ligandenaustauschreaktionen aufgrund der unterschiedlichen Beständigkeit der Eisen(III)-Komplexe statt. Der Hexaquaeisen(III)-Komplex ist farblos. Die orange Farbe der Eisen(III)-nitratlösung entsteht, da eine wässrige Lösung von Eisen(III)-salzen leicht sauer reagiert. Es bildet sich der Hydroxokomplex. In der Probe der Eisen(III)-nitratlösung im Reagenzglas lässt sich die saure Reaktion mit einem Streifen pH-Papier nachweisen. Es färbt sich rot. Fe(H2O)6 3+ (aq) + H2O farblos 2+ (aq) Fe(OH)(H2O)5 + H3O+(aq) orangegelb Dieses Gleichgewicht lässt sich durch Zugabe von Säure nach links verschieben. Mit dem Hydroxokomplex verschwindet auch seine Farbe. Dies ist der Fall im zweiten Becherglas, in welchem 4 mL halbkonzentrierter Salpetersäure vorliegen. Im dritten Becherglas befinden sich 6 mL einer gesättigten Natriumchloridlösung. Mit Chlorid-Ionen bilden sich gelbe Chloro-Komplexe, z.B. das tetraedrische Tetrachloroferrat. Fe(H2O)6 3+ (aq) + 4 Cl-(aq) orangegelb FeCl4 (aq) + 6 H2O gelb Im vierten Becherglas wird mit einigen Tropfen Kaliumthiocyanatlösung ein bekannter Eisennachweis gezeigt. Es bildet sich der rote, oktaedrische Triaquatrithiocyanatoeisen(III)Komplex. FeCl4 (aq) + 3 SCN-(aq) + 3 H2O Fe(SCN)3(H2O)3 gelb (aq) + 4 Cl-(aq) rot Diese Lösung wird durch Zugabe von Fluorid-Ionen entfärbt. Im fünften Becherglas liegt nämlich eine gesättigte Natriumfluoridlösung vor. Es bilden sich stabile Fluorokomplexe, in wässriger Lösung liegt überwiegend das Aquapentafluoroferrat vor. Fe(SCN)3(H2O)3 rot (aq) + 5 F-(aq) FeF5(H2O) farblos 2(aq) + 3 SCN-(aq) + 2 H2O 23 Die weiße Trübung ist dabei auf die Bildung von schwerlöslichem Eisen(III)-fluorid zurückzuführen. Im Fluorokomplex sind die Eisen(III)-Ionen gegenüber den Thiocyanat-Ionen maskiert. Dies kann man zeigen, indem man einige Tropfen Kaliumthiocyanatlösung in das Reagenzglas mit der Probe des fünften Becherglases gibt. Es tritt keine rote Farbe auf. Die rote Farbe im vierten Reagenzglas lässt sich hingegen noch intensivieren. Es lässt sich nun eine Reihe der relativen Stabilität der Eisen(III)-Komplexe aufstellen. Dabei ist der Fluorokomplex der stabilste und der Hexaquakomplex der am wenigsten stabile Komplex. [Fe(H2O)6]3+ < [FeCl4]- < [Fe(SCN)3(H2O)3] < [FeF5(H2O)]2Dieses Ergebnis lässt sich teilweise mit dem HSAB-Konzept („principle of hard and soft acids and bases“) begründen. Das Fe3+-Kation ist eine harte Säure, es bindet daher eher an harte Basen. Das Fluorid-Ion ist z.B. eine sehr harte Base, der Fluorokomplex daher sehr stabil. Das Thiocyanat bindet in dem Komplex über das relativ harte Stickstoffatom. Außerdem liegt beim Thiocyanatkomplex ein low-spin-Komplex vor und es wird Ligandenfeldstabilisierungsenergie frei. Diese unterschiedlichen Konzepte lassen sich allerdings nicht direkt miteinander vergleichen. Nun möchte ich noch den letzten Schritt der Farbreihe erläutern. Im sechsten Becherglas befand sich eine Spatelspitze gelbes Blutlaugensalz, Kaliumhexacyanoferrat(II). Mit den Eisen(III)-Ionen der Lösung bildet sich Eisen(III)-hexacyanoferrat(II), das Berliner Blau. +3 4 FeF5(H2O) 2-(aq) +2 + 3 Fe(CN)6 4-(aq) +3 +2 Fe4 Fe(CN)6 3 .n H2O + 20 F-(aq) blau n = 14-16 Die Struktur des Berliner Blau-Komplexes lässt sich folgendermaßen beschreiben. Die Elementarzelle besteht aus acht Würfeln, deren Eckpunkte abwechselnd mit Eisen(II) und Eisen(III) besetzt sind. Die Cyanidgruppen liegen entlang der Kanten der Würfel. Jedes Eisen(II) ist oktaedrisch von sechs Cyanidliganden umgeben. Ebenso ist ein Eisen(III) oktaedrisch von sechs Cyanidliganden koordiniert. Dabei sind die weicheren lewis-sauren Eisen(II)-Ionen an das weichere lewis-basische Kohlenstoffende des Cyanids und die härteren 24 lewis-sauren Eisen(III)-Ionen an das härtere lewis-basische Stickstoffende des Cyanids gebunden. Drei Eisen(III)-Ionen sind jeweils von vier Cyanidliganden und zwei Wassermolekülen koordiniert. In jedem Oktanten der Elementarzelle befindet sich ein weiteres Wassermolekül. ● Fe (II) ● Fe (III) ○HO 2 6 Abb. 16: Struktur von unlöslichem Berlinerblau Die charakteristische blaue Farbe kommt durch Charge-Transfer-Übergänge vom Metall zum Metall (MMCT) zustande, da das Eisen in zwei Oxidationsstufen vorliegt (intervalence charge-transfer). Durch gelbes Licht erfolgt der Übergang eines d-Elektrons vom low-spinFe(II) zum high-spin-Fe(III). Nach diesem Versuch zur qualitativen Bestimmung der Stabilität von Komplexen möchte ich nun einen Versuch zur quantitativen Bestimmung zeigen. 5.2 Quantitative Betrachtung 5.2.1 Versuch 5 : Bestimmung der Komplexbildungskonstanten von Cu(II)Komplexen Material: 2 Bechergläser (100 mL), Messzylinder (100 mL), Messpipette (10 mL), 2 Kupferelektroden, 2 Krokodilklemmen, 2 Kabel, Voltmeter, Papiertaschentuch, Glasstab, Stativmaterial 6 Aus Riedel, S. 834 25 Chemikalien: Kupfer(II)-sulfatlösung CuSO4 (aq) (c = 0,1 mol/L) Ammoniaklösung NH3 (aq) (w = 0,25) Ethylendiamin NH2(CH2)2NH2 (l) Kaliumnitratlösung KNO3 (aq) (w = 0,2) Durchführung: In zwei Bechergläser werden jeweils 50 mL Kupfer(II)-sulfatlösung gefüllt. Zwei blanke Kupferelektroden werden mit dem Voltmeter verbunden und in die Kupfersulfatlösungen eingetaucht. Ein Stromschlüsselrohr wird auf einfache Weise hergestellt, indem ein halbes Papiertaschentuch zusammengerollt und in der Kaliumnitrat-lösung getränkt wird. Damit werden die beiden Bechergläser verbunden. Zeigt das Voltmeter keine Spannungsdifferenz an, so werden 5,6 mL ( = 0,08 mol) Ammoniaklösung in das Becherglas gegeben, welches mit dem Minuspol des Voltmeters verbunden ist. Mit einem Glasstab wird vorsichtig umgerührt und die Spannungsdifferenz wird gemessen. Das Becherglas wird ausgetauscht, die Elektrode abgespült. In einem zweiten Versuchsteil verfährt man analog, wobei diesmal 2,7 mL (= 0,04 mol) Ethylendiamin hinzugegeben werden. Beobachtung: Nach der Zugabe der Ammoniaklösung färbt sich die Lösung dunkelblau-violett. Es wird eine Spannungsdifferenz von ca. 0,4 V gemessen. Nach der Zugabe des Ethylendiamins färbt sich die Lösung ebenfalls dunkelblau-violett (vgl. Abb. 17). Die Spannungsdifferenz beträgt ca. 0,58 V. Abb. 17: Versuchsaufbau nach Zugabe von Ethylendiamin 26 Auswertung und Erläuterung: Ich betrachte zunächst die Reaktion mit Ammoniak. In einer verdünnten Kupfer(II)salzlösung sind die Kupfer-Ionen verzerrt oktaedrisch koordiniert. Auf Grund des Jahn-TellerEffekts bei d9-Elektronenkonfiguration sind zwei H2O-Liganden weiter entfernt und schwächer gebunden. Nur bei den quadratisch koordinierten Liganden ist deswegen eine feste Bindung und damit eine dauerhafte Substitution durch H2O-Moleküle möglich. Bei der Reaktion mit Ammoniak entsteht somit der Diaquatetraamminkupfer(II)-Komplex. Cu(H2O)6 2+ (aq) + 4 NH3 (aq) Cu(H2O)2(NH3)4 2+ (aq) + 4 H2O Im Folgenden werden zur Vereinfachung der Gleichungen die koordinierten Wassermoleküle weggelassen. Eine Spannungsdifferenz ist messbar, da durch Zugabe der Liganden die Konzentration der Kupfer(II)-Ionen in der Lösung in Folge der Bildung des Komplexes stark herabgesetzt wird. In dem Becherglas bzw. der Halbzelle mit der geringeren Konzentration an Kupfer(II)-Ionen ist das Potential negativer und es kommt zur Oxidation. Hier gehen Kupfer(II)-Ionen in Lösung. In der Halbzelle mit der höheren Konzentration an Kupfer(II)-Ionen und somit mit dem positiveren Potential, d.h. in dem Becherglas ohne Zusatz des Liganden, findet eine Reduktion statt. Kupfer scheidet sich ab. Für die oben gezeigte Komplexbildungsreaktion lässt sich die Gleichung für eine Komplexbildungskonstante aufstellen, genauer gesagt die Bruttokomplexbildungskonstante. Diese berechnet sich aus den Gleichgewichtskonzentrationen des Komplexes, der Kupfer(II)Ionen und des Ammoniaks. K B CuNH3 4 2 c CuNH3 4 cCu c 2 2 4 NH3 Diese Konstante soll im Folgenden berechnet werden, um eine Aussage über die Stabilität der Komplexe treffen zu können. Die Anfangskonzentration des Ammoniaks lässt sich leicht aus der Stoffmenge und dem Volumen der Lösung berechnen. c 0 NH3 nNH3 0,08 mol mol 1,44 V Lsg. 0,0556 L L 27 Für die Halbzelle 1, d.h. die reine Kupfer(II)-sulfatlösung, lässt sich das Potential mit Hilfe der Nernstschen Gleichung berechnen. E1 E 0 Cu / Cu 2 0,059 0,059 V lg c Cu 2 0,34 V V lg 0,1 0,3105 V n 2 Damit kann dann das Potential der Halbzelle 2, d.h. der Kupfer(II)-sulfatlösung, zu der die Ammoniaklösung gefügt hinzugefügt wurde, berechnet werden, und zwar als Differenz des Potentials der Halbzelle 1 und der gemessenen Spannungsdifferenz von ΔE = 0,4 V. E 2 E1 E 0,3105 V 0,4 V 0,0895 V Die Gleichgewichtskonzentration der Kupfer(II)-Ionen lässt sich nun berechnen, indem man die Gleichung für die Halbzelle 2 nach dieser Konzentration auflöst. E 2 E 0 Cu / Cu 2 lg 2 E c Cu 2 2 0,059 V lg Cu 2 2 E 0 Cu / Cu 2 2 0,0895 V 0,34 V 0,059 V 0,059 V c Cu 2 2,76 10 15 mol / L Der erhaltene Wert ist so gering, dass man näherungsweise annehmen kann, dass praktisch alle Kupfer(II)-Ionen in komplexierter Form vorliegen. Damit entspricht dann die Konzentration des Komplexes der Anfangskonzentration der Kupfer(II)-Ionen. Die Gleichgewichtskonzentration des Ammoniaks lässt sich berechnen aus der Anfangskonzentration abzüglich der vierfachen Anfangskonzentration der Kupfer(II)-Ionen, da zur Komplexbildung vier Moleküle Ammoniak an ein Kupfer(II)-Ion gebunden werden. c CuNH3 4 2 0,1 mol / L c NH3 c 0 NH3 4 c 0 Cu 2 1,44 mol / L 4 0,1 mol / L 1,04 mol / L Mit den Gleichgewichtskonzentrationen lässt sich schließlich die Bruttokomplexbildungskonstante berechnen. 28 2 2 K B CuNH3 4 K B CuNH3 4 c CuNH3 4 c Cu c 2 2 4 3,10 10 13 NH3 0,1 mol / L 2,76 10 15 mol / L 1.04 mol / L 4 L4 / mol 4 Literaturwert: K B CuNH3 4 2 2 10 13 L4 / mol 4 Im zweiten Versuchsteil wird Ethylendiamin zur Kupfer(II)-sulfatlösung gegeben. Das Ethylendiamin ist ein zweizähniger Ligand. Es kann mit beiden Stickstoffatomen an ein Zentralatom binden. H2N NH2 Abb. 18: Ethylendiamin Die Kupfer(II)-Ionen reagieren mit Ethylendiamin zum Diaquadiethylendiaminkupfer(II)Komplex. Cu(H2O)6 2+ (aq) + 2 en (aq) Cu(H2O)2(en)2 2+ (aq) + 4 H2O Die Bruttokomplexbildungskonstante berechnet sich nach folgender Gleichung. K B Cuen 2 2 c Cuen 2 c Cu 2 c 2 en 2 Die Berechnung folgt analog der Berechnung der Komplexbildungskonstanten für den Tetraamminkupfer(II)-Komplex. Mit der gemessenen Spannungsdifferenz von ΔE = 0,58 erhält man folgenden Wert. K B Cuen 2 2 1,46 10 20 L2 / mol 2 Literaturwert: K B Cuen 2 2 0,5 10 20 L2 / mol 2 Es fällt auf, dass dieser Wert um sieben Zehnerpotenzen größer ist als der Wert für die Komplexbildungskonstante des Amminkomplexes. 29 Die größere Stabilität des Ethylendiaminkomplexes erklärt sich durch den Chelateffekt. Chelateffekt Das Wort Chelat stammt aus dem Griechischen von Chelé und bedeutet Krebsschere. Man kann sich anschaulich vorstellen, dass das Zentralteilchen in einem Chelatkomplex von mehrzähnigen Liganden wie von einer Krebsschere umfasst wird. Der Chelateffekt basiert zum einen auf einem thermodynamischen Effekt. Bei der Bildung eines Chelatkomplexes führt der Austausch von einzähnigen Liganden gegen Chelatbildner zu einer größeren Anzahl freier Teilchen. Dies ist an der Reaktionsgleichung der Bildung des Ethylendiaminkupfer(II)-Komplexes erkennbar. Cu(H2O)6 2+ (aq) + 2 en (aq) Cu(H2O)2(en)2 2+ (aq) + 4 H2O Die Entropie nimmt somit zu. Der positive Wert für die Entropieänderung hat nach der GibbsHelmholtz-Gleichung negativere Werte der freien Bildungsenthalpie zur Folge. ΔGB = ΔHB – TΔSB Nach folgender Gleichung ergibt sich demnach auch eine größere Komplexbildungskonstante. KB e GB RT Weiterhin ist ein kinetischer Effekt für den Chelateffekt von Bedeutung. Bei mehrzähnigen Liganden ist die Besetzung der zweiten Koordinationsstelle wahrscheinlicher als bei einzähnigen Liganden, da sich die zweite Bindungsstelle des Liganden bereits in der Nähe befindet (vgl. Abb. 19). Man spricht auch von einer größeren Konzentration des Liganden in der Umgebung der zweiten Koordinationsstelle. H2 N H2 N Cu N H2 Abb. 19: kinetischer Effekt NH2 30 Mit dem nächsten Versuch möchte ich noch bei den Chelatkomplexen bleiben und zeigen, dass man den Schülern nicht immer vorgeben muss, wie viele Liganden an ein Zentralteilchen koordinieren, sondern dieses auch experimentell ermitteln kann. 6 Demonstration 2: Bestimmung der Koordinationszahl Material: 5 Reagenzgläser, Reagenzglasständer, 5 Gummistopfen, Messpipette (10 mL), Spritzflasche mit entionisiertem Wasser Chemikalien: Nickel(II)-nitratlösung Ni(NO3)2 (aq) (c = 1 mol/L) oder Nickel(II)-sulfatlösung NiSO4 (aq) (c = 1 mol/L) Ethylendiaminlösung NH2(CH2)2NH2 (aq) (c = 1 mol/L) Durchführung: In fünf nummerierte Reagenzgläser wird jeweils 1 mL der Nickelsalzlösung gegeben und eine bestimmte Menge an Ethylendiaminlösung, wie in der Tabelle angegeben. Die Reagenzgläser werden mit Wasser auf das gleiche Niveau aufgefüllt und durchmischt. Nummer des Reagenzglases 0 1 2 3 4 V(Ni2+-Lösung) in mL 1 1 1 1 1 V(en-Lösung) in mL - V(H2O) in mL 5 4 3 2 1 1 2 3 4 Tab. 2: Mengenangaben für Demonstration 2 Bei Verwendung von Demoreagenzgläsern wird das Zehnfache der angegebenen Volumina verwendet. Beobachtung: Reagenzglas 0 zeigt die hellgrüne Farbe der Nickelsalzlösung. Durch Zugabe von Ethylendiaminlösung ändert sich die Farbe von blau über blauviolett nach violett. Die Violettfärbung tritt erstmalig in Reagenzglas 3 auf und bleibt im Reagenzglas 4 bestehen. 31 Abb. 20: Reagenzgläser 0 bis 4 Auswertung und Erläuterung: Die verwendete Methode zur Bestimmung der Koordinationszahl wird auch als Methode der molaren Verhältnisse bezeichnet. Bei einem molaren Verhältnis von Nickel : Ethylendiamin wie 1 : 3 tritt der endgültige Farbton des gebildeten Komplexes auf, der auch bei weiterer Zugabe von Ethylendiamin bestehen bleibt. Somit ist anzunehmen, dass die Koordinationszahl des Ethylendiaminnickel(II)-Komplexes drei beträgt. Je nachdem, wie viel Äquivalente Ethylendiamin zur Nickelsalzlösung gegeben werden, werden ein, zwei oder drei Ethylendiaminmoleküle im Komplex gebunden. Ni(H2O)6 2+ (aq) + en (aq) grün Ni(en)(H2O)4 2+ (aq) + 2 H2O blau 2+ (aq) + en (aq) blau Ni(en)2(H2O)2 blauviolett Ni(en)(H2O)4 Ni(en)2(H2O)2 2+ (aq) + 2 H2O blauviolett 2+ (aq) + en (aq) Ni(en)3 2+ (aq) + 2 H2O violett Bei Zugabe von drei oder mehr Äquivalenten Ethylendiamin liegt der endgültige Komplex vor, der violette Tris(ethylendiamin)nickel(II)-Komplex. Da Ethylendiamin ein zweizähniger Ligand ist, wird das Nickel im Komplex sechsfach koordiniert und zwar in Form eines Oktaeders (vgl. Abb. 21). 32 7 Abb. 21: Struktur des Tris(ethylendiamin)nickel(II)-Komplexes 7 Bedeutung und Verwendung von Komplexen Die Bedeutung von Komplexverbindungen ist weitreichend und die Anwendungsgebiete sind sehr vielfältig. In der Natur findet man Komplexe z.B. im Blutfarbstoff Hämoglobin, im Pflanzenfarbstoff Chlorophyll oder im Vitamin B12. In folgenden Bereichen werden Komplexe angewendet: in der Photographie (Fixiersalz), zur Bestimmung der Wasserhärte, in der Galvanotechnik, bei der Cyanidlaugerei, bei Reaktionen mit Kronenethern oder auch als „optische Thermometer“, d.h. bei der Bildung oder Zersetzung von Komplexverbindungen bei einer bestimmten Temperatur tritt eine Farbänderung auf. In meinem nächsten Versuch möchte ich eine alltäglichere Möglichkeit für die Anwendung von Komplexen zeigen. 7.1 Versuch 6: Nickeltest Material: 1- oder 2-Euro-Münze, Wattestäbchen (weiß), Tropfflasche Chemikalien: Ammoniaklösung NH3 (aq) ( w = 0,05) Lösung des Dimethylglyoxim-Dinatriumsalzes in Wasser (w = 0,03) Durchführung: Ein Wattestäbchen wird mit der Dimethylglyoximlösung befeuchtet und mit 1-2 Tropfen 5%iger Ammoniaklösung alkalisch gemacht. Anschließend reibt man damit etwa eine halbe Minute an der 7 Vgl. Krempel, S. 36 aus Asselborn, W., Jäckel, M., Risch, K.T. (Hrsg.), Chemie, 1998, S. 198 33 Oberfläche einer Euromünze (oder eines anderen nickelhaltigen Gegenstandes). Beobachtung: Es ist eine Rotfärbung zu erkennen. Erläuterung: Nickel reagiert mit Dimethylglyoxim zum Bis(dimethylglyoximato)nickel(II). Dieser Komplex besitzt eine rote Farbe. H O N OH H3C O N N CH3 +2 Ni(H2O)6 2+ + 2 OH-(aq) +2 Ni N OH H3C + 8 H2O N N O O CH3 H Bis(dimethylglyoximato)nickel(II) Ein derartiger Nickeltest ist auch in Apotheken erhältlich und dient Personen, die auf Nickel allergisch reagieren, als Schnelltest für z.B. metallische Haushaltgeräte oder Modeschmuck. 1- und 2-Euro-Münzen bestehen aus nickelhaltigen Legierungen und einem Nickelkern im Innern. Die silberfarbene Legierung besteht zu 75% aus Kupfer und zu 25% aus Nickel (Cu75Ni25), die goldfarbene Legierung besteht aus einer Nickel-Messing Legierung (Cu75Zn20Ni25). Euro-Münzen setzen rund 50mal mehr Nickel frei als bei Modeschmuck erlaubt ist. Es findet allerdings im Allgemeinen kein länger andauernder Hautkontakt statt außer bei beruflich exponierten Personen. Die meisten Bankinstitute nehmen daher keine Stellenbewerber mit Nickelallergie auf. 7.2 Versuch 7: Geheimtinte Material: weißes Papier, Glaskapillare, Becherglas (50 mL) Chemikalien: Cobalt(II)-chloridlösung CoCl2 (aq) (c = 0,5 mol/L) 34 Durchführung: Man taucht die Glaskapillare in ein Becherglas, in dem sich etwas Cobalt(II)-chloridlösung befindet und schreibt damit auf ein Stück weißes Papier. Anschließend legt man das Papier auf eine warme Heizplatte. Beobachtung: Die Schrift ist zunächst blassrosa und kaum zu erkennen. Auf der Heizplatte erscheint dann jedoch eine blaue Schrift. Erläuterung: Der Farbumschlag wird durch die Entwässerung des rosafarbenen Hexaquakomplexes zum festen blauen Cobalt(II)-chlorid verursacht. Co(H2O)6 Cl2 (s) CoCl2 (s) + 6 H2O rosa blau Diese Reaktion wird z.B. für Feuchtigkeitsmessungen im Raum angewendet und ist auch die Ursache für den charakteristischen Farbumschlag des Silicagels. Mit diesem Versuch müssten die meisten Schüler zu begeistern sein. 8 Schulrelevanz Im hessischen Lehrplan für G8 tritt das Thema Komplexchemie als Wahlthema für den Leistungskurs LK 12G.2 auf. 43 Unterrichtsstunden werden dafür eingeplant. Folgende Bereiche sollen nach dem Lehrplan behandelt werden: Eigenschaften und Reaktionen von Komplexen, Aufbau und Struktur (Polyeder, Nomenklatur, Zähnigkeit, Chelate), Stabilität von Komplexverbindungen (Komplexbildungskonstante), Modellvorstellungen zur chemischen Bindung in Komplexen mit dem Schwerpunkt auf der Valence-Bond-Theorie, Bedeutung und Verwendung von Komplexverbindungen. Die gezeigten Versuche eignen sich für eine Behandlung der Komplexchemie im Schulunterricht, da eben diese Bereiche angesprochen werden und die Durchführung mit einfachen Materialien möglich ist. Versuch 1 führt in das Thema ein und zeigt eine Komplexbildungsreaktion. Demonstration 1 stellt anschaulich Koordinationspolyeder vor und lässt die Schüler die Gedanken der Forscher zur Struktur der Komplexe nachvollziehen. Versuch 2 und 3 führen auf zwei Modellvorstellungen zur chemischen Bindung in 35 Komplexen hin, auf die Valence-Bond-Theorie und die Ligandenfeldtheorie. Versuch 4 und 5 zeigen wichtige Komplexbildungsreaktionen, anhand derer die Stabilität von Komplexen diskutiert wird. Mit Versuch 5 kann die Berechnung einer Komplexbildungskonstanten erarbeitet werden. Demonstration 2 zeigt die Bedeutung der Koordinationszahl an einem Chelatkomplex. Versuch 6 und 7 stellen einfache Möglichkeiten zur Anwendung von Komplexverbindungen dar. 9 Literaturverzeichnis - Amann, W., Eisner, G., Gietz, P. et al: Elemente Chemie II, Ernst Klett Schulbuchverlag, Stuttgart 1989. - Blume, R., Hilgers, U.: Der Chelat-Effekt, PdN-Ch. 8/41, Jahrgang 1992, S. 21-23. - Demuth, R.: Eine exemplarische Behandlung der Komplexverbindungen, PdN-Ch. 4/34, Jahrgang 1985, S. 22-29. - Demuth, R., Kober F.: Grundlagen der Komplexchemie, Sauerländer, Aarau/Frankfurt am Main/ Salzburg 1992. - Einholz, W.: Ionen – Salze – Komplexe – Welche Veränderungen ergeben sich beim Lösen?, PdN-Ch. 7/42, Jahrgang 1993, S. 12-15. - Gade, L.: „Eine geniale Frechheit“ Alfred Werners Koordinationstheorie, ChiuZ 3/36, Jahrgang 2002, S. 168-174. - Gade, L.: Koordinationschemie, Wiley-VCH, Weinheim/New York/Chichester u.a. 1998. - Gelies, F.: Didaktische Aufbereitung der Komplexchemie für die Sekundarstufen I und II anhand einfach durchführbarer Versuche unter besonderer Berücksichtigung von Stabilität und Farbigkeit, wissenschaftliche Hausarbeit 2004. - Hollemann, A.F., Wiberg, E.: Lehrbuch der Anorganischen Chemie, de Gruyter, Berlin/New York 1995. - Jäckel, M.: Aspekte des chemischen Gleichgewichts – Beispiele aus der Komplexchemie, PdN-Ch. 4/34, Jahrgang 1985, S. 13-16. - Kober, F.: Komplex – Versuch einer Definition, PdN-Ch. 4/34, Jahrgang 1985, S. 1-9. - Ludi, A.: Berliner Blau, ChiuZ 4/22, Jahrgang 1988, S. 123-127. - Kowoll, S.: Komplexchemie – Schön bunt, Experimentalvortrag 2004. - Krempel, N.: Didaktische Aufbereitung der Komplexchemie für die Sekundarstufen I und II anhand einfach durchführbarer Versuche unter besonderer Berücksichtigung 36 von Chelatkomplexen und bioanorganischer Systeme, wissenschaftliche Hausarbeit 2004. - Riedel, E.: Anorganische Chemie, de Gruyter, Berlin/New York 2002. - Probeck, G.: Spektakuläre Experimente Teil 3:Der Nickeltest, PdN-Ch. 2/45, Jahrgang 1996, S. 40. - Probeck, G.: Spektakuläre Experimente Teil 4: Das Wunder der sieben Becher, PdNCh. 3/45, Jahrgang 1996, S. 35. - Scharf, B.: Komplexchemie, Experimentalvortrag Wintersemester 1994/95. - Sirrenberg, C.: Zur magnetischen Suszeptibilität von Übergangsmetallen, PdN-Ch. 4/34, Jahrgang 1985, S. 16-21.