Nilvadipin - Institut für Pharmazie und Biochemie
Werbung

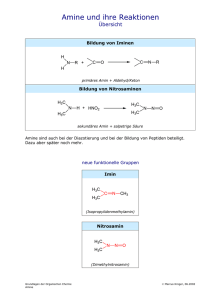
Arzneistoffdossier Nilvadipin O N + O - H3C O O H3C O O H3C N H CH3 N Erstellt von: Raissa Atamasov Michael Wissig Johannes Gutenberg-Universität Mainz Institut für Pharmazie und Biochemie 1 Inhaltsverzeichnis Titel Seite 1 Inhaltsverzeichnis Seite 2 Allgemeines und physikalische Daten Seite 3+4 Synthese Seite 5 Instrumentelle Analytik Seite 6+7 Organisch-Chemische Analytik Seite 8+9 Indikation + Dosierung und Anwendung Seite 10 Wirkungsmechanismus Seite 10 Pharmakokinetik/Bioverfügbarkeit Seite 10 Akute Toxizität Seite 11 Chronische Toxizität/Nebenwirkungen Seite 12 Kontrainduktionen Seite 13 Gegenanzeigen Seite 14+15 Quellen Seite 16 2 Allgemeines 3D-Darstellung (ChemSketch): Freiname: Nilvadipin IUPAC-Name: 5-isopropyl 3-methyl 2-cyano-6-methyl-4-(3nitrophenyl)-1,4-dihydropyridine-3,5dicarboxylate (1) Summenformel: C19H19N3O6 Patent Handelsname: Hersteller: Handelsname: Hersteller: Jahr des Erstpatents: Patentnummer: CAS-Nummer: Escor® (2) Trommsdorff GmbH & Co. KG Arzneimittel Nivadil® (2) Dolorgiet GmbH & Co. KG 2007 (1) WO 2007098390 (1) 75530-68-6 (1) 3 Physikalische Konstanten: 385,37 g/mol (1) 168 °C (3) 526.7±50.0 °C (1) Aceton 3.377±0.419 (1) Molare Masse: Schmelzpunkt: Siedepunkt: Löslichkeit: LogP-Wert: Chiralitätsbeschreibung: O + N O - H3C O O H3C * O H3C N H O CH3 N Nilvadipin ist ein monochiraler Arzneistoff, welcher als Racemat (R,S) vorliegt. 4 Synthese: 6\PPHWULVFKVXEVWLWXLHUWH3\ULGLQHZHUGHQGXUFK&\FORNRQGHQVDWLRQYRQȕOxoestern mit Aldehyden und Ammoniak unter oxidierenden Bedingungen hergestellt (Hantzsch-Synthese).Die zunächst HQWVWHKHQGHQȕ-Enaminoester und Įȕ-ungesättigte Ketone cyclisieren zum 1,4-Dihydropyridin-Derivat. O N + O - O O + CH3 O CH3 H3C H O O - 2H2O N O OH + CH3 NH3 O + N O - O O CH3 O + CH3 H3C H O -H2O O NH2 CH3 N O O + N + N O O - H3C H3C O O O H3C Cyclisierung O O H3C N N - CH3 O H H3C O O H3C N H N Nilvadipin 5 CH3 Instrumentelle Analytik: O H B + N H O E H3C L H G OH D H3C - H CO H F M O O H3C K N H CH3 J N A H-NMR-Spektrum(4) ı A: 10,3 B: 8,084 C: 7,988 D: 7,667 E: 7,621 F: 5,068 G: 4,841 J: 3,681 K: 2,324 L: 1,202 M 1,033 (s,1H,NH) (d,1H,CH) (s,1H,CH) (d,1H,CH) (t,1H,CH) (s,1H,CH) (m,1H,CH) (s,3H,CH3) (s,3H,CH3) (d,3H,CH3) (d,3H,CH3) IR-Spektrum(4) 3340 cm-1 Ȟ(N-H) Amin 3097 cm-1 v(C-H) Aromat 2983 cm-1 v(C-H) Methylgruppe 2239 cm-1 v(C-N) Nitril-Gruppe 1708 cm-1 v(C=O) Ester 1652 cm-1 v(C=O) Carbonyl 1625 cm-1 į(N-H) Amin 1527 cm-1 v(N-O) Nitrogruppe 6 C-NMR-Spektrum(4) O 9 + N 7 H3C 17 H3C O 14 3 6 8 O 12 16 19 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 2 11 O CH3 15 13 5 H3C - O 4 1 18 O N H 10 N 165,14 ppm 163,95 ppm 147,62 ppm 147,61 ppm 146,21 ppm 134,33 ppm 130,09 ppm 121,99 ppm 121,95 ppm 118,64 ppm 113,57 ppm 112,80 ppm 100,89 ppm 67,02 ppm 52,03 ppm 39,09 ppm 21,67 ppm 21,34 ppm 17,94 ppm 7 Organisch-Chemische Analytik: Nachweise der Nitrogruppe: 1. Reduktion der Nitrogruppe mit Pd/CKatalysator, anschließende Diazotierung mit Natriumnitrit und Salzsäure (salpetrige Säure) und Kupplung mit BrattonMarshall-Reagenz zum Azofarbstoff O + N O - H3C O Pd/C (H) O H3C O CH3 O H3C N H N NH2 H3C O + NaNO2/HCl O H3C O CH3 O H3C N H N + N N H3C O + Bratton-Marshall-Reagenz O H3C O CH3 O H3C N H N N N H3C O O H3C O O H3C CH3 NH NH2 N H N 8 2. Reduktion der Nitrogruppe mit Zink und Ammoniumchlorid zum Hydroxylamin. Bildung eines farbigen Chelat-Komplexes mit Benzoylchlorid und EisenIII-Salzen O + N O - H3C O +Zn/NH4Cl O H3C O O H3C N H CH3 N OH NH H3C O +Benzoylchlorid/Fe3+ O H3C O O H3C N H CH3 N + O Fe N O H3C O O H3C O O H3C N H CH3 N Farbiger Chelatkomplex 9 Indikation: Behandlung der essentiellen Hypertonie. Dosierung und Anwendung: Die Höhe der Dosis sollte individuell nach dem Ansprechen des Blutdrucks festgelegt werden. Die Startdosis sollte morgens 1× 8 mg Nivadil sein. Bei der Mehrzahl der Patienten ist in der Dauertherapie 8 mg Nilvadipin, retardiert täglich ausreichend. Etwa ein Drittel der Patienten benötigt eine Dosis von 16 mg Nilvadipin, retardiert, um eine ausreichende Blutdrucksenkung zu erreichen, wenn nach 2 – 4 Wochen mit 8 mg kein adäquater antihypertensiver Effekt nachweisbar ist. Für diese Patienten wird aus Compliance Gründen die Gabe von 1×16 mg Nivadil forte empfohlen. Bei Patienten mit Leberzirrhose soll die Dosis von 8 mg Nilvadipin, retardiert nicht erhöht werden, da der Abbau des Medikamentes verzögert sein kann. Die Hartkapsel, retardiert soll morgens unzerkaut mit etwas Flüssigkeit geschluckt werden. Sie kann nach dem Frühstück eingenommen werden. Wirkmechanismus: Der Calciumantagonist Nilvadipin gehört zu den Dihydropyridinen. Die Substanz hemmt den Einstrom von Calcium-Ionen durch den sogenannten langsamen, spannungsabhängigen L-Typ-Calciumkanal in die Zelle. Der myogene Gefäßwandtonus wird verringert und der periphere Gefäßwiderstand herabgesetzt. Dies wiederum führt zur Senkung eines erhöhten Blutdrucks. Nilvadipin beeinflusst im therapeutischen Dosisbereich nicht die Erregungsleitung im Herzen. Bei Hypertonikern führt Nilvadipin etwa 2 Stunden nach oraler Gabe zu einer dosisabhängigen Blutdrucksenkung. In der Dauertherapie wird die maximale Drucksenkung nach 3 – 4 Wochen erreicht. Pharmakokinetik: Nilvadipin wird in gelöster Form mit einer Halbwertszeit von 5 – 10 min sehr rasch aus dem Gastrointestinaltrakt resorbiert. Maximale Plasmaspiegel (Cmax) werden nach ca. 40 min (Tmax) erreicht. Für Dosen zwischen 6 und 16 mg wurde dosisabhängiges pharmakokinetisches Verhalten gefunden. Nilvadipin wird ebenso wie seine polaren Metaboliten zu etwa 98 – 99 % an Plasmaproteine gebunden. Nilvadipin verteilt sich schnell und gut im Gewebe und unterliegt einer langsamen Rückverteilung. Infolge eines ausgeprägten First-pass-Effektes, liegt die absolute Bioverfügbarkeit bei 14 – 19 %. Damit ergibt sich für das apparente Verteilungsvolumen nach einmaliger Gabe ein Wert von 1 l/kg und nach Mehrfachgabe von 3,9 l/kg. 10 Unter Dauertherapie kommt es bei einmal täglicher Applikation von Nilvadipin praktisch zu keiner Kumulation bezüglich Cmax oder AUC. Die Predose-Werte kumulieren um das 1,5fache infolge der Auffüllung des Gewebekompartiments. Der Steady-state wird nach 4 – 5 Tagen erreicht. Nilvadipin wird in der Leber fast vollständig in polare, pharmakodynamisch inaktive Metaboliten umgewandelt. Bei der Elimination erscheint im Urin nur 0,1 %, in den Faeces weniger als 0,2 % der oralen Dosis als unveränderte Substanz. Die Metaboliten werden zu 70 – 80 % renal und der Rest mit den Faeces ausgeschieden. Die terminale Halbwertzeit für die wirksame Substanz beträgt ca. 15 – 20 h. Niereninsuffizienz hat nach bisherigen Erkenntnissen keinen Einfluss auf die Elimination. Daten bei schweren Nierenfunktionsstörungen liegen bislang nicht vor. Bei älteren Personen waren keine Veränderungen der Pharmakokinetik feststellbar. Bei Leberzirrhose ist, infolge des verminderten First-Pass-Effektes, die Bioverfügbarkeit um das 2 – 3fache erhöht. Daher sollte nach bisherigen Erkenntnissen eine Tagesdosis von 1× 8 mg Nilvadipin nicht überschritten werden. Im Tierversuch (Ratte) wurde nachgewiesen, dass Nilvadipin sowohl die Blut-HirnSchranke als auch die Plazentaschranke passieren kann und in die Muttermilch übertritt. Bioverfügbarkeit: Aus der Arzneiform Retard-Pellets wird Nilvadipin pH-unabhängig freigesetzt. Die relative Bioverfügbarkeit von Nilvadipin Retard-Pellets liegt bei 60 – 70 % bezogen auf eine orale Lösung. Akute Toxizität: Die orale LD50 von Nilvadipin beträgt fürHunde 480 mg/kg. Bei Mäusen liegt sie um mehr als das Doppelte und bei Ratten um mehr als das Dreifache höher. Nach einer pharmakodynamisch durch periphere Gefäßerweiterung bedingten Rötung an Mundschleimhäuten, Conjunctiva, sowie unbehaarten Körperteilen (Ohren, Bauchhaut) traten bei den Hunden folgende Vergiftungserscheinungen auf: Hyperpnoe, Streckbewegungen, Speichelfluß, Erbrechen, Diarrhö und Kollaps. Nach hohen Dosen (ab 320 mg/kg) außerdem Ptosis, Nickhautdilatation und Schleimhautblässe. Tödlich vergiftete Tiere starben nach 6 Stunden bis zu 3 Tagen nach Anwendung. Chronische Toxizität: In mehreren Versuchen an Ratten und Hunden mit Laufzeiten von bis zu 53 Wochen zeigten sich lediglich nach extremer Überdosierung vereinzelt Hinweise auf überhöhte pharmakodynamische Effekte oder Gegenregulationen. Bei Hunden treten bei Gabe von Nilvadipin dosisabhängig Hämorrhagien, Entzündungen und Fibrosen am rechten Herzvorhof auf. Die Dosis 40 mg/Hund (etwa 9 mg/kg) wurde schädigungslos vertragen. Ein Vergleich der Serumkonzentration ergibt bei Anwendung der maximalen humantherapeutischen Dosis 11 (16 mg/Tag) einen 31fachen Sicherheitsabstand. Besondere toxische Wirkungen fehlten an beiden Spezies. Nach langfristiger Applikation von Nilvadipin in hohen Dosierungen aufgetretene Gingivahyperplasien, wie sie auch nach anderen CalciumAntagonisten und nach Hydantoin-Verbindungen an Mensch und Tier beobachtet wurden, waren nach Absetzen der Medikation reversibel. Nebenwirkungen: Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig ( Häufig (ELV Gelegentlich (ELV Selten (ELV Sehr selten (<1/10.000) Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) Begleiterscheinungen können insbesondere zu Beginn der Behandlung auftreten. Herz-Kreislauf- und Gefäßsystem Häufig: Ödeme aufgrund der Erweiterung der Blutgefäße Gelegentlich: Tachykardie, Palpitationen, Kreislauf-Fehlregulationen wie z.B. eine Bluthochdruckkrise, aber auch starker Blutdruckabfall Gelegentlich kann es, insbesondere zu Beginn der Behandlung, zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen. Sehr selten ist das Auftreten eines Herzinfarktes beschrieben worden, Erkrankungen des Blutes und des Lymphsystems Selten: Anämie Sehr selten: Leukopenie oder Thrombopenie Erkrankungen des Nervensystems Häufig: Kopfschmerzen, Schwindel Gelegentlich: Müdigkeit, weitere zentralnervöse Beschwerden wie z.B. Nervosität, Schlaflosigkeit, Augenerkrankungen Selten: Augendruck, Sehbeschwerden wie z.B. Augenflimmern, Erkrankungen des Ohrs und des Labyrinths Selten: Tinnitus, Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: Atemnot, Beschwerden im Nasen-Rachenraum wie z.B. Nasenbluten Erkrankungen des Gastroinstestinaltrakts Gelegentlich: Beschwerden des MagenDarm-Traktes wie Übelkeit, Völlegefühl, Magendruck, Durchfall, Verstopfung Selten: Erbrechen, außergewöhnlicher Appetit, sowohl Gewichtszunahme als auch -abnahme, Mundtrockenheit Sehr selten: Gingivahyperplasie, Erkrankungen der Nieren und Harnwege Selten: Pollakisurie, Erkrankungen der Haut und des Unterhautzellgewebes Häufig: Gesichts- bzw. Hautrötung mit Wärmegefühl (Flush) Gelegentlich: Hautüberempfindlichkeitsreaktionen wie Juckreiz, Exanthem, Erythem, Brennen der Haut Selten: Parästhesien Sehr selten: Kältegefühl in den Gliedmaßen, Haarausfall, Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen 12 Gelegentlich: Tremor, Muskel- und Gelenkschmerzen, schwere Arme oder Beine Selten: Nackenschmerzen, Druckgefühl im Brustbereich Allgemeine Erkrankungen Selten: Schwitzen Leber- und Gallenerkrankung Gelegentlich: Leberfunktionsstörungen (Transaminasenanstieg, Anstieg der alkalischen Phosphatase), die nach Absetzen des Arzneimittels reversibel waren. Erkrankungen der Geschlechtsorgane und der Brustdrüse Selten: Potenzstörungen Sehr selten: Gynäkomastie Kontrainduktionen: Die antihypertensive Wirkung von Nilvadipin kann durch andere blutdrucksenkende Medikamente oder trizyklische Antidepressiva verstärkt werden. Obwohl bisher in klinischen Prüfungen keine Hinweise auf eine negativ-inotrope Wirkung beobachtet wurden, ist bei gleichzeitiger Anwendung von Nilvadipin und BetaRezeptorenblockern eine sorgfältige Überwachung des Patienten angezeigt, da bei kombinierter Gabe eine Herzinsuffizienz auftreten kann. Bestimmte strukturverwandte Arzneimittel können die negativ-inotrope Wirkung von Antiarrhythmika wie Amiodaron und Chinidin verstärken. In Einzelfällen wurde bei gleichzeitiger Therapie mit anderen Arzneimitteln der gleichen Wirkstoffgruppe ein Abfall des Chinidin-Plasmaspiegels beobachtet, so dass bei kombinierter Therapie die Kontrolle des Chinidin-Plasmaspiegels empfohlen wird. Über Nivadil bzw. Nivadil forte liegen hierzu keine Beobachtungen vor. Von anderen Calciumantagonisten der Dihydropyridingruppe wurde berichtet, dass sie die Plasmakonzentration von gleichzeitig verabreichtem Ciclosporin erhöhen. Bis weitere klinische Daten bezüglich der gleichzeitigen Gabe von Nilvadipin und Ciclosporin verfügbar sind, wird empfohlen, dass Ciclosporin-Plasmaspiegel während der Komedikation von Nivadil bzw. Nivadil forte und Ciclosporin kontrolliert werden. In vitro Studien zeigen, dass Nilvadipin durch das Cytochrom P450 3A4 (CYP3A4) metabolisiert wird. Da Nilvadipin durch das Cytochrom P450 in der Leber metabolisiert wird, können andere medikamentöse Substanzen oder auch Nahrungsbestandteile, die dieses System anregen oder unterdrücken, die Plasmakonzentration von Nilvadipin beeinflussen. Nilvadipin sollte mit Vorsicht angewendet werden, wenn es gleichzeitig mit CPY3A4-Inhibitoren verwendet wird, wie: Antiproteasen (z.B. Ritonavir, Saquinavir), Ketokonazol, Itraconazol, Erythromycin und Clarithromycin, Tacrolimushydrat, Ciclosporin, Rifampicin. Obgleich keine Erfahrungen mit Nivadil bzw. Nivadil forte in dieser Hinsicht vorliegen, wird empfohlen, bei Beginn einer gleichzeitigen Verabreichung von Nivadil bzw. Nivadil forte mit diesen Substanzen den Patienten sorgfältig zu überwachen. Von Antikonvulsiva, die Cytochrom P 450 induzieren, wurde berichtet, dass sie die Bioverfügbarkeit von Dihydropyridinen verringern. Obgleich in dieser Hinsicht keine Erfahrung mit Nivadil bzw. Nivadil forte vorliegt, wird empfohlen, Nivadil bzw. Nivadil forte nicht in bei Patienten anzuwenden, die gleichzeitig mit enzyminduzierenden Antikonvulsiva behandelt werden, wie Phenytoin, Carbamazepin oder Phenobarbital. Die gleichzeitige Gabe von Cimetidin und in geringerem Ausmaß anderen strukturverwandten Stoffen führte in einer Interaktionsstudie im Durchschnitt zu 13 einer Verdoppelung des Nilvadipin-Plasmaspiegels. Daher sollte die tägliche Dosierung von 1× 8 mg Nilvadipin bei gleichzeitiger Anwendung von Nilvadipin und Cimetidin nicht überschritten werden. Bei der gemeinsamen Gabe von Nivadil bzw. Nivadil forte mit Grapefruitsaft wurde, wie bei anderen Calciumantagonisten der Dihydropyridingruppe, über stärker ansteigende Blutkonzentrationen von Nilvadipin berichtet als bei der Gabe mit Wasser. Nivadil bzw. Nivadil forte kann in seltenen Fällen eine Erhöhung des DigoxinPlasmaspiegels bewirken, so dass die Kontrolle dieses Plasmaspiegels empfohlen wird. In einer Tierstudie trat bei gleichzeitiger Gabe von Verapamil und intravenösem Dantrolen eine Hyperkaliämie auf, begleitet von ventrikulärem Flimmern und Kreislaufkollaps. Die Relevanz dieser Ergebnisse für Nilvadipin ist nicht bekannt, es kann jedoch ein Risiko nicht ausgeschlossen werden, dass diese Ereignisse klinisch auftreten, wenn Nilvadipin zusammen mit Dantrolen verabreicht wird. Schwangerschaft und Stillzeit Es liegen keine klinischen Erfahrungen mit Nilvadipin während der Schwangerschaft vor. Die Gruppe der Dihydropyridine zeigte das Potential, den Geburtsvorgang zu verlängern, was mit Nilvadipin nicht beobachtet wurde. Nilvadipin darf in der gesamten Schwangerschaft und Stillzeit nicht eingenommen werden, da noch keine ausreichenden Erfahrungen vorliegen. In vorklinischen Untersuchungen ergaben sich keine Hinweise auf eine Schädigung des Ungeborenen. Experimentelle Untersuchungen zeigten, dass der Wirkstoff Nilvadipin (oder seine Metaboliten) in die Muttermilch übertritt. Da keine Erfahrungen über mögliche Auswirkungen auf den Säugling vorliegen, sollte abgestillt werden, wenn während der Stillzeit eine Behandlung mit Nilvadipin notwendig ist. Gegenanzeigen: Nivadil bzw. Nivadil forte darf nicht angewendet werden bei: – bekannter Überempfindlichkeit gegen Nilvadipin oder einen der sonstigen Bestandteile, – Herz-Kreislauf-Schock, – innerhalb der ersten 4 Wochen nach akutem Myokardinfarkt, – bei instabiler Angina pectoris, – bei ausgeprägter Aortenstenose. Besondere Warnhinweise und Vorsichtsmaßnachmen: Nivadil bzw. Nivadil forte sollte nur bei strengster Indikation und mit Vorsicht angewendet werden bei: – Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <30 ml/min, Dialyse-Patienten), da noch keine ausreichenden Therapieerfahrungen vorliegen, – dekompensierter Herzinsuffizienz, – Patienten mit leichter Bradykardie, AV Block I. Grades oder verlängertem PRIntervall sollten genau beobachtet werden, – Patienten mit eingeschränkter Leberfunktion, – Cimetidin und in geringerem Maße andere Histamin H2-Antagonisten können zu einer Erhöhung der Nilvadipin-Plasmakonzentration führen, 14 – Nilvadipin wird durch das CYP3A4-Enzymsystem metabolisiert. Daher sollte eine Kombination mit Arzneimitteln, die CYP3A4-Inhibitoren oder –Induktoren sind, vermieden werden (siehe Abschnitt 4.5). Aus demselben Grund ist die gleichzeitige Einnahme mit Grapefruitsaft zu vermeiden. Insbesondere zu Beginn der Behandlung kann es gelegentlich zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schwere der Anfälle kommen. Sehr selten ist über das Auftreten von Myokardinfarkten berichtet worden. Sicherheit und Wirksamkeit von Nivadil bzw. Nivadil forte wurden bei Kindern nicht untersucht. 15 Quellen: (1) Scifinder Scholar (2) Rote Liste 2011 (3) Nakano, Minoru; EP 552708 A1 1993CAPLUS (4) http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi (5) Breitmaier, Jung; Organische Chemie; 5.Auflage;2005 (6) Fachinformation Nivadil, Dolorgiet (2011) 16

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)