Atmung – Respiration
Werbung
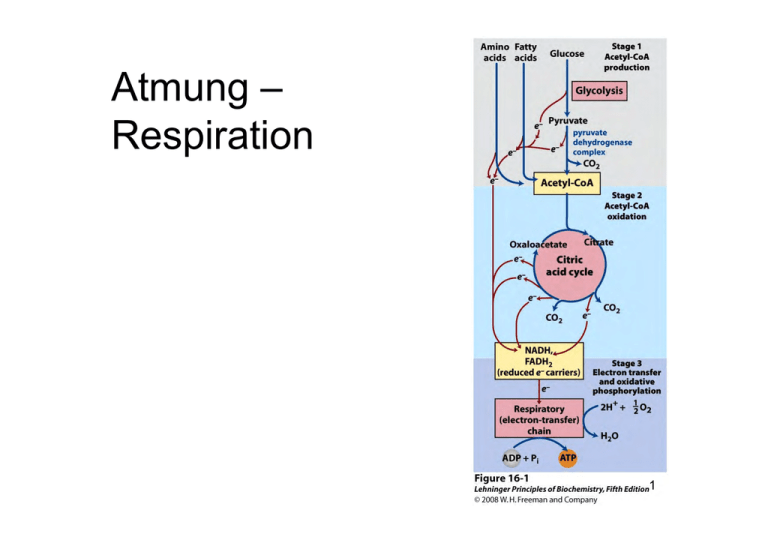
Atmung – Respiration 1 Atmung Die oxidative Phosphorylierung ist der letzte Schritt einer Serie von Energieumwandlungen, die insgesamt als Zellatmung oder einfach Atmung (Respiration) bezeichnet werden 2 Zellatmung (Übersicht) 3 Oxidative Phosphorylierung 4 Oxidative Phosphorylierung • NADH und FADH2 sind energiereiche Moleküle, da sie jeweils ein e--Paar mit hohem Übertragungspotential besitzen • Wenn diese Elektronen zur Reduktion von molekularem Sauerstoff zu Wasser benutzt werden, wird sehr viel Energie frei, die zur ATP-Erzeugung verwendet werden kann. • Dieser Prozess wird als oxidative Phosphorylierung bezeichnet; er liefert ATP, wenn Elektronen von NADH oder FADH2 über eine Reihe von Elektronen-Carriern auf O2 übertragen werden. 5 Prinzip der oxidativen Phosphorylierung Die oxidative Phosphorylierung ist im Konzept einfach, im Mechanismus jedoch komplex. 6 Nochmals Mitochondrien 7 Elektrochemische Zelle: Redoxpotenziale X– X + e– H+ + e– 0.5 H2 8 Thermodynamik • Gibbsenergie unter Nicht-Standarbedingungen ∆rGº = – R T lnK ∆rG : Gibbsenergie, freie Energie T : absolute Temperatur K : Gleichgewichtskonstante R : allgemeine Gaskonstante (8.314 J K-1 mol-1) Q : Reaktionsquotient rG ' rG ' RT ln Q rG ' aP aQ RT ln aA aB P Q A B 9 Nernst-Gleichung • r G nF E n : Anzahl Elektronen F : Faraday-Konstante (96484 C mol-1) R : allgemeine Gaskonstante (8.314 J K-1 mol-1) RT 0.059 V ' E E ln Q E log Q nF n ' 10 Redoxreaktionen Aox + 2e- Ared Normalpotential: E'0; A ox + 2e-/Ared oder Aox/Ared Redoxreaktion: Aox + Bred Ared + Box E'0 = E'0(Aox/Ared ) – E'0(Box /Bred ) 11 Halbreaktionen 12 Übung Reduziertes NADH wird mit Sauerstoff als terminalem Elektronenakzeptor während der oxidativen Phosphorylierung oxidiert. Wie gross ist rG ' dieser Reaktion? F = 96485 J mol-1 V-1 13 Energie des Protonengradienten c2 c2 trsG RT ln ZF V 2.303RT log ZF V c1 c1 Z ist die elektrische Ladung des Moleküls F = 96485 J mol-1 V-1 ∆V ist das Membranpotential, ca. 0.14 V Für die innere Mitochondrienmembran gilt: pH aussen ist 1.4 Einheiten niedriger als innen, d.h. log(c2 / c1) = 1.4 ∆trsG für die Translokation von Protonen aus der Matrix ins Cytosol beträgt +21.8 kJmolH-1 . + 14 Elektronenübertragende Gruppen • Die elektronenübertragenden Gruppen in den Proteinen der Elektronentransportkette bestehen aus: Flavinen, Eisen-Schwefel-Clustern, Chinonen, Hämgruppen und Kupferionen • Die Reduktionspotenziale werden durch spezifische Komplexierung und die Proteinumgebung moduliert. 15 Wie werden Elektronen übertragen? • Elektronen können sich durch den Raum bewegen, jedoch fällt die Geschwindigkeit des Transfers ab, je weiter Donor und Akzeptor entfernt sind • Abnahme um einen Faktor 10 pro 0.17 nm • 1013 s-1 bei Kontakt, 104 s-1 in einem für Proteine typischen Abstand von Donor und Akzeptor 16 Elektronenübertragungsraten 17 Atmungskette Komplex I Die Atmungskette besteht aus vier Komplexen: 3 Protonenpumpen 1 direkte Verbindung zum Citratzklus Komplex II Komplex III Komplex IV 18 Atmungskette 19 Atmungskette 20 Komponenten der mitochondrialen Elektrontransportkette 21 Oxidationsstufen von Chinonen Ubichinon Ubichinol 22 Komplex I: NADH-Q-Oxidoreduktase 23 Komplex I NADH-Q-Oxidoreduktase (NADH-Dehydrogenase): NADH Q 5H Matrix NAD QH 2 4H Cytosol 24 Komplex II: Succinat-Q-Reduktase Über Ubichinol treten Elektronen vom FADH2 in die Atmungskette Die Succinat-Dehydrogenase des Citratzyklus ist eine Komponente des Succinat-Q-Reduktase-Komplexes (Komplex II), ein integrales Membranprotein 25 Komplex III: Die zweite Protonenpumpe Q-Cytochrom c-Oxidoreduktase QH 2 2Cyt cox 2 H Matrix Q 2Cyt c red 4 H Cytosol 26 Struktur des QCytochrom C OxidoreduktaseKomplexes (III) Modulation des Reduktionspotentials der verschiedenen prosthetischen Gruppen Homodimer bestehend aus je 11 verschiedenen Polypeptidketten 27 Der Q-Zyklus: Transmembrantransport von Protonen Übergang von zwei-Elektronen-Carriern zu ein-Elektronen-Carrier 28 Der letzte Schritt: Oxidation von reduziertem Cytochrom c und Reduktion von molekularem Sauerstoff zu Wasser Komplex IV: Cytochrom c-Oxidase 4Cyt c red 8H Matrix O 2 4Cyt cox 2 H 2O + 4H Cytosol 29 Cytochrom c Oxidase 30 Cytochrom C-Oxidase Mechanismus 1 Blau: oxidiert Rot: reduziert 31 Cytochrom C-Oxidase Mechanismus 2 32 33 Es werden zusätzlich noch 4 Protonen gepumpt 4Cyt c red 8H Matrix O 2 4Cyt cox 2 H 2O + 4H Cytosol 34 Übung. Elektronentransport in einem Bakterium Tabelle 1. Reduktionspotentiale der Elektronentransportkomponenten eines Gram-negativen Bakteriums oxidierte Form (Oxidationsmittel) reduzierte Form (Reduktionsmittel) n E°’ (V) Flavoprotein b (ox) NAD+ Cytochrom a (+3) Ferroprotein (ox) Cytochrom c (ox) Flavoprotein b (red) NADH + H + Cytochrom a (+2) Ferroprotein (red) Cytochrom c (red) 2 2 1 2 1 –0.22 –0.32 +0.22 +0.62 +0.35 E°’ ist das Standard-Reduktions-Potential bei pH 7.0 und n die Anzahl der übertragenen Elektronen Die Analyse des Elektronentransports in einem Gram-negativen Bakterium zeigte, dass fünf Elektronentransportkomponenten an der Elektronentransportkette beteiligt sind. Die Standard-Reduktions-Potentiale dieser Komponenten sind in Tabelle 1 aufgeführt. a) Bestimmen Sie die Sequenz der Elektronentransportkomponenten in dieser Elektronentransportkette. b) Wie viele Moleküle ATP können unter Standardbedingungen höchstens gebildet werden, wenn ein Elektronenpaar die Elektronentransportkette durchläuft? c) Nehmen Sie an, dass das Bakterium mit Glucose als Substrat in einem aeroben Sediment gut wachsen kann. Mit der Zeit geht der Sauerstoff zur Neige, jedoch ist im Sediment Nitrat im Überschuss vorhanden. Kann das Bakterium mit der oben beschriebenen Elektronentransport-kette unter denitrifizierenden Bedingungen weiter wachsen? Erklären Sie Ihre Antwort. Hilfsgrössen: F = 96.5 kJ mol -1 V-1 G°’ für die Bildung von ATP: 30.5 kJ mol -1 NO3– + 2 H+ + 2e– NO2– + H2O; E°’ = 0.42 V 35 Gefahr bei der Reduktion von Sauerstoff SuperoxidAnion PeroxidDianion Superoxid, Wasserstoffperoxid und andere daraus erzeugte Verbindungen wie HO• werden als reaktive Sauerstoffverbindungen (reactive oxygen species, ROS) bezeichnet. 36 Superoxid-Dismutase 37 Katalase 38 Chemiosmotische Hypothese 39 ATP-Synthase Protonenleitende Einheit F0 Zusammensetzung: c-Ring, a und b Katalytische Einheit F1 Zusammensetzung: Rotor: c-Ring und -Stiel Stator: Rest des Moleküls 40 ATP-Synthese: Mechanismus des Bindungswechsels ATP entsteht im Enzym ohne protonenmotorische Kraft, wird aber nicht freigesetzt. Die Funktion des Protonengradienten ist nicht die ATPBildung, sondern seine Freisetzung von der Synthase. Daher Vorschlag: Mechanismus des Bindunswechsels Änderungen in den Eigenschaften der drei -Untereinheiten erlauben die aufeinander folgende ADP- und PiBindung, ATP-Synthese und ATP-Freisetzung. 41 Unterschiedliche Bidungsstellen loose open tight 42 Mechanismus des Bindungswechsels 43 ATP-Synthase Protonenleitende Einheit F0 Zusammensetzung: c-Ring, a und b Katalytische Einheit F1 Zusammensetzung: Rotor: c-Ring und -Stiel Stator: Rest des Moleküls 44 Direkte Beobachtung der Rotation fluoreszenezmarkiert His-Tags, haben Affinität zu Nickelionen Nickel-Beschichtung 45 Bestandteile der Protonenleitenden Einheit Protonenhalbkanäle 46 Protonenbewegung treibt die Rotation 47 Der Weg der Protonen 48 Stöchiometrie Die Anzahl der c-Untereinheiten scheint zwischen 10 und 14 zu schwanken. Diese Anzahl ist wichtig, da eine 360º Drehung zur Synthese und Freisetzung von 3 Molekülen ATP führt (mitochondriale ATP-Synthase aus Hefe enthält 10 Untereinheiten). 3 bis 4 Protonen pro ATP 49 ShuttleSysteme für den Transport durch mitochondriale Membranen Die innere Mitochondrienmembran muss für die meisten Moleküle impermeabel sein. Trotzdem muss ein geregelter Austausch von Molekülen möglich sein membrandurchquerende Transportproteine und Shuttle-Systeme 50 ATP-ADP-Translokation Wird durch das Membranpotential angetrieben 51 Nochmals Stöchiometrie • Beste Abschätzungen für Protonenzahl, die pro Elektronenpaar gepumpt werden bei: NADH-Q-Oxidoreduktase (Komplex I) 4 2 Q-Cyt-c-Oxidoreduktase (Komplex III) Cytochrom-c-Oxidase (Komplex IV) 4 • Für ein ATP müssen ca. 3 H+ durch die ATPase fliessen • Ein H+ wird gebraucht um ATP ins Cytosol zu transportieren • D.h. ca. 2.5 cytosolisches ATP pro NADH (2 e-) 52 ATPAusbeute für Oxidation der Glucose: ca. 30 ATP 53 Acyl-CoA-Dehydrogenase Acyl-CoA + E-FAD trans-∆2-Enoyl-CoA + E-FADH2 Aus dem FADH2, das aus dieser Dehydrogenierung entsteht werden 1.5 ATP erzeugt, wie das auch der Fall ist bei der Oxidation von Succinat zu Fumarat 54 Entkoppler der oxidativen Phosphorylierung 55 Protonengradienten als umwandelbare Form von Gibbsenergie 56