Von J. CSÁSZÁR, J. BALOG und L
Werbung

UBER DIE LICHTABSORPTION VON KOORDINATÍV
CHIOROKOMPLEXEN
GESÄTTIGTEN
(Vorläufige Mitteilung)
Von J. C S Á S Z Á R , J . B A L O G u n d L. L E H O T A I
Institut f ü r Allgemeine und Physikalische Chemie der Universität Szeged
(Eingegangen am 8. Juni 1956)
Wir haben die Extinktionskurven der koordinatív gesättigten Chloro-Komplexe
von Ti(III)-, Cr(II [)-, Mn(ll)-, Fe(IH)-, Os(IH)-, Pt(IV)-, Rh(H)-, Co(JI)-, Re(IV)-, Ni(II)-,
Pd(II)-, Au(III)- und Cu(II)-Ionen in 11,14 mol HCl bei Zimmertemperatur ausgemessen. Es wurde festgestellt, dass die Theorie der Termaufspaltung' auch f ü r diese
Komplexverbindung'en gültig ist bzw. dass die Oj, Symmetrie schon bei diesen einfachen Komplexen nur selten vorkommt.
1.
Einleitung
In m e h r e r e n A r b e i t e n [1] h a t K I S S die T h e o r i e d e r L i c h t a b s o r p t i o n v o n
Komplexverbindungen mit elektrovalenter und kovalentér Bindungsart behandelt. Mit Hilfe dieser A r b e i t e n w e r d e n die e i n z e l n e n T e i l p r o b l e m e bei d e n
k o o r d i n a t í v gesättigten C h l o r o - K o m p l e x e n b e s p r o c h e n .
2. Strukturfragen
und
Symmetrieverhältnisse
Da in k o o r d i n a t í v g e s ä t t i g t e n C h l o r o - K o m p l e x e n n u r die B i n d u n g s a r t e n
Ion — Ion v o r h a n d e n sind, so w e r d e n das Z e n t r a l i o n u n d die Liganden i h r e
eigene E l e k t r o n e n v e r t e i l u n g e n b e h a l t e n .
Die Ü b e r g a n g s m e t a l l e mit u n a u f g e f t i l l t e r d - S c h a l e bilden i h r e e l e k t r o v a i e n t e n K o m p l e x e i m a l l g e m e i n e n m i t der K o o r d i n a t i o n s z a h l sechs. S i n d alle
B i n d u n g s a b s t ä n d e gleich (a = b = c), so ist die S y m m e t r i e des K o m p l e x e s O h .
W e r d e n zwei Liganden in t r a n s - S t e l l u n g m i t a n d e r e m
Bindungsabstand
g e b u n d e n , so b e k o m m e n w i r die S y m m e t r i e D_,i,. A u c h e i n e solche S y m m e t r i e
•entsteht, w e n n ein k r i s t a l l i n e r p l a n a r - q u a d r a t i s c h e r K o m p l e x a u f g e l ö s t w i r d
u n d zwei L ö s u n g s m i t t e l m o l e k ü l e in t r a n s - S t e l l u n g g e b u n d e n w e r d e n .
3. Mechanismus
der
Lichtabsorption
Die Lichtabsorption d e r e l e k t r o v a l e n t e n K o m p l e x e v e r ä n d e r t sich m i t d e r
Z u s a m m e n s e t z u n g d e r Lösung. Bei der K o n z e n t r a t i o n s v e r ä n d e r u n g
der
k o m p l e x b i l d e n d e n Liganden e n t s t e h e n n e b e n - u n d n a c h e i n a n d e r die e i n z e l n e n
Z w i s c h e n k o m p l e x e . Die E x t i n k t i o n s k u r v e n dieser Z w i s c h e n k o m p l e x e sind n u r
UBER DIE L I C H T A B S O R P T I O N
VON C H L O R O - K O M P L E X E N 57
durch mehrere, bei verschiedener Konzentration ausgeführten Messungen
tind durch längere Rechnungen zu erhalten. Dadurch wird die Untersuchung'
des Lichtabsorptionsmechanismus der elektrovalenten Komplexe erschwert.
Bei höheren Anionkonzentrationen wird es aber erreicht, dass in der Lösung
n u r eine, und zwar die koordinatív gesättigte Komplexart vorkommt. Wenn
keine Polymerisation des koordinatív gesättigten Komplexes, vorkommt, so
k a n n diese Kurve verwertet werden.
In den Extinktionskurven der elektrovalenten Komplexe von Metallionen
mit uriaufgefüllter d-Schale, wenn die Liganden keine Eigenabsorption haben,
sind die in den f r ü h e r e n Arbeiten beschriebenen Banden b, c und d v o r handen [1].
4. Diskussion
der
Versuchsdaten
Ein ungepaartes
d-Elektron (d' und d"): [Ti(III), Cu(II)]. Der G r u n d t e r m
D gibt im Falle einer Symmetrie von Oh bzw. D4|, eine bzw. drei Banden b.
In der Absorptionskurve des Komplexes [TiCl,,] 3 " — im Gegensatz zur
Extinktionskurve des Ionhydrats, die nach HARTMANN und SCHLÄFER [2]
bei 492 m « n u r eine Bande b aufweist — wurden drei Banden b bei 620, 520
bzw. 510 m a gefunden [3]. Die D ^ - S y m m e t r i e ist das Resultat des grösseren
Bindungsabstandes der zwei C1 — Ionen in irans-Stellung.
In der K u r v e des Cu(II)-Ionhydrats, ist n u r eine breite, wahrscheinlich
zusammengesetzte Bande b bei 790 m « [ 1 ] zu finden. Im Absorptionsspektrum
des [ C u C l ( ! ] - K o m p l e x e s (Fig. 1. K. 1.) sind drei Banden b vorhanden, was auf
die D 4 |,-Symmetrie hinweist.
Die Banden bei 386 u n d 275 m « sind nach KISS [1] Elektronenübersprungsbanden, im Gegensatz zur Feststellung von FROMHERZ [5], nach welcher die Banden durch Polymerisation des Komplexes verursacht werden, welche zu den zwei folgenden Vorgänge zugehören sollten:
2
'
C u 3 + . ( C r ) « + /n/-^Cuo+.Cl.(Cr)5
C r . H 3 0 + hv — CI.HoO -
Bande d
Bande f
Da die S t r u k t u r der Absorptionskurve auch in 11,14 Mol HCl unverändert ist,
k a n n sie nicht, wie FROMHERZ [5] es annimmt, durch die Polymerisation
des Komplexes verursacht werden. Die Breite dér Banden bei'386 mw v é r ü r sachen, dass die Elektronübersprungsprozesse wegen der verschiedenen Bindungsabständen der Cl-Ionen mit verschiedener Energie vor sich gehen.
Zwei ungepaarlc
d-Elektronen
(d2 und d~): [Ni(II), Pd(II), Au(III)l.
Der
G r ú n d t e r m : 'F gibt im Falle einer Symmetrie von Oh bzw. D Jh zwei bzw. vier
Banden b.
Bei hydratisiertem Ni(II)-Ion erhalten wir vier Banden b [1], was ein
Beweis f ü r die Symmetrie D41, liefert. Die D4i, Symmetrie ist auch durch
Gitterstrukturuntersuchungen bestätigt [4]. Wie es zu erwarten war, w u r d e n
in der K u r v e des [NiCl 0 ] J— -Komplexes (Fig. 1. K. 2.) vier TermaufspaltungsBanden b gefunden. Irri kurzwelligen Gebiet sind auch die Banden d aufzufinden.'
Auch die Kurve des Pd-Komplexes weist vier Banden b auf, was f ü r eine
D4h-Symmetrie spricht. Bei 280 und 223 m«. finden wir die hohen Banden d
(Fig. 1. K. 3.).
J . CSASZÄR, J . B A L O G u n d L. L E H O T A I
58
Bei A u - K o m p l e x h a b e n w i r bei 480 bzw. 380 m i t zwei B a n d e n b g e f u n d e n .
Die h o h e n B a n d e n bei 315 bzw. 228 r n u treten w e g e n d e r f o l g e n d e n E l e k t r o n ü b e r s p r u n g s p r o z e s s e auf [1]:
A u ; i + . ( C r ) 4 + hr
Drei ungepaarte
G r u n d t e r m JF wird
geben.
A u - + . C l . ( C O , und C r . H ä O + hv — Cl.H ä CT
d-Elektronen
(d:: und d1): [Cr(ILI), Co(II), Re(IV)].
Der
bei Oi, bzw. D ^ - S y m m e t r i e zwei bzw. vier B a n d e n b
r ^
/'/ \
\
N -—>/
/
/
/
W
i
\ ^
\1 T
\
7
. . \/
V
/'
i
l
tJ
i
A; \M i/ A - : / /
¡1 // \ \\ ii i/ u
/i
M
S'ifK. v / /
i
•Vf
«
\
A
h
i
10
4
\
^
/
2/
//
/
/
10
V
1/
ls
10 (10 3cm'*)
X
SO
1
Fig. 1. K u r v e 1: (CuC1„) - (ec : 0.0774); Kurve 2: (NiCl,,) - (cc : 0,0514); K u r v e 3:
(PdClc)- 1 - (cc : 0.0309); ccHCl : 11,14 Mol, Vergleichsmittel: 11,14 Mol HCl
Das A b s o r p t i o n s s p e k t r u m des C r (III)-Komplexes — gleichwie die K u r v e
des h y d r a t i s i e r t e n A t o m i o n s [1] — e n t h ä l t bei 668 u n d 484 m « zwei B a n d e n b
(Fig. 2. K . 1.). In d e r K u r v e von [Co(H,'0)fi]-'+ sind der S y m m e t r i e Oh e n t s p r e c h e n d z w e i
B a n d e n b bei 510 u n d 460 m t t v o r h a n d e n . In d e r K u r v e v o n . [CoCl c ] J — h a b e n
w i r zwei B a n d e n b bei 1800 u n d 680 m t t g e f u n d e n . Die K u r v e n der C h l o r o K o m p l e x e m i t v e r s c h i e d e n e r Z u s a m m e n s e t z u n g w u r d e n schon d u r c h m e h r e r e
V e r f a s s e r [6], [7], [8] u n t e r s u c h t , a b e r z u r e n d g ü l t i g e n A u f k l ä r u n g des L i c h t a b s o r p t i o n s m e c h a n i s m u s dieser K o m p l e x e sind n o c h w e i t e r e
Untersuchungen nötig.
N a c h K A T O [9] zeigt die K u r v e des [ R e C l t l ] 2 - - K o m p l e x e s zwei B a n d e n ,b
bei 645 u n d 505 mtt, w a s e i n e r S y m m e t r i e O h e n t s p r i c h t .
UBER
DIE
LICHTABSORPTION
VON
59
CHLORO-KOMPLEXEN
Vier ungepaarte
d-Elektronen
(d> und d']): [Pt(IV), Rh(III)]. Die A u f s p a l t u n g des G r u n d t e r m e s °D i m Falle e i n e r S y m m e t r i e Oh bzw. D-ih gibt eine bzw.
drei B a n d e n b.
In d e r K u r v e des [PtCl,,]-- (Fig. 2. K. 2) liegen die drei B a n d e n b bei 2000,
456 u n d 360 mju, w a s auf die A u s b i l d u n g e i n e r S y m m e t r i e D41, h i n w e i s t .
N a c h S A M U E L [10] zeigt die K u r v e des R h - K o m p l e x e s bei 503 u n d 392 m u.
zwei B a n d e n b, die d r i t t e b - B a n d e sollte i m n i c h t a u s g e m e s s e n e n S p e k t r a l gebiet liegen.
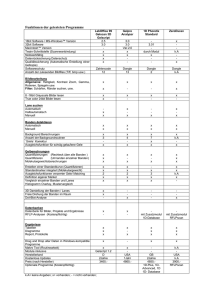
Tabelle. 1
Komplex
Banden d
Banden b
TiCir
620
668
(1.30)
CrCli'r
FeCir
520
484
(MS)
510
364
(3,52)
PtClÜ
-
>2000
—
RhClir
CoCli"
ReClrr
NiClJ"
PdCli'r
•
1800
(0.69)
6S0
(2,10)
1450
(0,16)
1780
(1.17)
645
1120
(0,20)
1 670 1
1(0,90)1
>2COO
950*
—
AuCir
CuCli;
345
—
• 456
(1,32)
503
(1,92)
505
780
(0,54)
470
(2,40)
: 480 |
iO.IO)]
313
(3,52)
260
(0,10)
385
(3,98)
237
(3,68)
227
(0,98)
0,106
0,194
0,340
0,0952
263
(3,95)
! 360 j
¡(2.20)1
392
(1,90)
•
Lit.
[6|
222
MnCli; "
OsCir
cc Mol/1
0,0970
I i 3f
233
(4,16)
0,0271
112]
—
425
(0,98)
f 340 I
|(2,60)|
; 380 1
(2,50)
(2,12)
210
385
(3,17)
280
(3,88)
315
(3,68)
275
(3,68)
(3,60)
223
(4,35)
228
(4,44)
230
(3,62)
0,0514
0,0309
0,0508
0,0774
[ ] verschmolzene Bande
* zusammengesetzte Bande
r
Fünf ungepaarte
d-Elektronen
(d ): [Mn(II),
Fe(III),
Os(III)].
Da d e r
G r u n d t e r m °S bei k e i n e r S y m m e t r i e des P o t e n t i a l f e l d e s a u f s p a l t e n w i r d , so f a l len die B a n d e n b a u s u n d erscheinen n u r die viel n i e d r i g e r e n B a n d e n c [1].
In der K u r v e des F e ( I I I ) - K o m p l e x e s f i n d e n w i r bei 364 u n d 313 m,u zwei
B a n d e n v o n gleicher Höhe. Diese B a n d e n k ö n n e n den zwischen d e m Z e n t r a l i o n
u n d den g e b u n d e n e n Cl-Ionen, bzw. zwischen Cl-Ionen u n d W a s s e r m o l e k ü l e h
vor sich g e h e n d e n E l e k t r o n ü b e r s p r u n g s p r o z e s s e n z u g e o r d n e t w e r d e n (Fig.
2. K.3.):
Fe : i + (Cl~)o + hv —* Fe- + .Cl. (Cl~).-, und C r . H 2 0 + Ar — CI.HoCT.
Die B a n d e c liegt bei 706 m u .
Ä h n l i c h e S t r u k t u r w e i s e n die K u r v e n v o n Mn(II)- bzw. Os(III)-Komplexe auf. N a c h S C H L Ä F E R [11] zeigt die K u r v e des Mn(II)-Ions a c h t niedrige
I n t e r k o m b i n a t i o n s b a n d e n c, die in d e m C h l o r o - K o m p l e x v e r w i s c h t sind.
J. CSÄSZAR, J. BAI.OG
(¡0
und
I..
LEHOTA1
' D i e E x t i k t i o n s k u r v e n der K o m p l e x e von M e t a l l i o n e n
äusseren E l e k t r o n e n s c h a l e n e n t h a l t e n n u r die B a n d e n d u n d
!
J
K
/
5
• i A
i
/
aufgefüllten
1
1
/
'
r i
j\
n1< 1 \
\
mit
/
J
\
1
u
/
I
t -
\\
r
-
i
i
X* '
[V/
h
!'f|
i i
„
r
T"
{ i
f
/
/
*1
J
T
-
-1/--J
/ /
/
"j
<M
/
/
/
•
r
/
/
/
J
i
0
10
50.
40 dO^crV)
, so
Fig. 2. Kurve 1: (CrCl,,) 3 - (cc : 0.106); Kurve 2: (PtClJ— (cc : 0,0970); K u r v e 3:
(FeClr,)3— (cc: 0,194); ccHCl : 11,14 Mol, V.ergleichsmittel: 11,14 Mol HCl
Ii
F R O M H E R Z u n d M i t a r b e i t e r [5], [12] h a b e n die E x t i n k t i o n s k u r v e n d e r
H y d r a t e u n d H a l o i d k o m p l e x e von Hg(II)-, Mg(II)-, P b ( I I ) - u n d Cd(II)-Ionen a u s gemessen. In den K u r v e n von Z n X p , C d X p , M g X f ~ u n d H g X p ( X = C l B r ~ , J — ) K o m p l e x e n w e r d e n die hohe E l e k t r o n e n ü b e r s p r u n g s b a n d e n in d e r
Reihe: C1 < B r < J , d e r E l e k t r o n a f f i n i t ä t des Haloid-Ions [1] e n t s p r e c h e n d ,
nach dem l a n g w e l l i n g e n S p e k t r a l g e b i e t v e r s c h o b e n .
Tabelle 2
Zn~'
Cl~
Br~
r
—
239
Cd"1"
Pb2-
Hg 2+
186
229
272
216
250
304
257
325
364
:
Bei d e r E n t s t e h u n g der h o h e n E l e k t r o n e n ü b e r s p r u n g s b a n d e n spielen zwei V o r gänge eine Rolle [1]:
-Me 2 + . ( X ~ ) 4 -j- hv —• Me + . X. (X~) : i und X~. H-O +
A*X.H20~.
UBER DIE
LICHTABSORPTION
5.
VON
C H L O R O - K O M P L E X E N 61
Bemerkungen
Die oben G e s a g t e n gelten n u r f ü r k o o r d i n a t í v gesättigte K o m p l e x e . Bei
k l e i n e r e r H C l - K o n z e n t r a t i o n e n t s t e h e n die Z w i s c h e n k o m p l e x e m i t v e r s c h i e d e n e r c h e m i s c h e r Z u s a m m e n s e t z u n g u n d S y m m e t r i e . Es ist zu e r w a r t e n , dass die
K u r v e n dieser Z w i s c h e n k o m p l e x e v e r s c h i e d e n s t r u k t u r i e r t sind. Z u r A u f k l ä r u n g des L i c h t a b s o r p t i o n s m e c h a n i s m u s der Z w i s c h e n k o m p l e x e sind n o c h
w e i t e r e U n t e r s u c h u n g e n nötig. Die dies b e t r e f f e n d e n V e r s u c h s r e s u l t a t e w e r d e n
in einer s p ä t e r e n A r b e i t b e h a n d e l t .
6.
Versuchsteil
Zu unseren Untersuchungen wurden Merck p. a. Chemikalien benützt. Die
Extinktionskurven wurden mit Beckman DU Spektralfotometer bei Zimmertemperatur mit 1,0, 0,1 und 0,01 cm Küvetten ausgemessen. Lösungs- und Vergleichsmittel
war in jedem Falle 11,14 mol HCl. Die Metallionkonzentrationen der Lösungeh
bzw. die Daten der Extinktionskurven sind in Tabelle 1 zusammengesetzt. Bezüglich
der Messmethcden wird es auf die Literatur [13] hingewiesen.
*
*
*
-
A u c h a n dieser Stelle wollen w i r u n s e r e n innigsten D a n k P r o f . A. K I S S
äussern, u n t e r dessen L e i t u n g diese U n t e r s u c h u n g e n a u s g e f ü h r t w u r d e n .
Literatur
[1] Kiss, A.: Z. anorg. allg. Chem., 282, 141 (1955); Sonderdruck Tagungsber. Chem.
Ges. D. D. R. Hauptjahrestagung 1954; Acta Chim. Acad. Sei. Hung. (im Drück).
Magyar Tud. Akad. Kémiai Tud. Oszt. Közi. 6, 37, 77 (1955).
[2] Hartmann, H., L. Schläfer: Z. Naturforschg., 6a, 754. 760 (1951): Z. phvs. Chem..
197, 116 (1951).
[3] Bose, D. V., S. Datta: Z. Phjis., 78, 376 (1933).
[4] Mukherjee, P. L.: Z. Krist., 91, 504 (1935).
[5] Doehlemann, E., M. Fromherz: Z. phys. Chem., A. 171, 353 (1934).
[6] Kiss, A., P. Csókán: Z. phys. Chem., A 186, 239 (1940); A 188. 27 (1941): Z. anorg.
allg. Chem., 247, 205 (1941).
[7] Kiss A., M. Richter: Z. phys. Chem., A 187, 211 (1940).
[8] Váradi, P.: Acta Chem. Phys. Univ. Szeged, 2, 157 (1949).
[9] Kató, S.: Sei. Pap. Inst. Phys. Chem. Res., 13, 49 (1930).
[10] Samuel, R., A. R. R. Despande: Z. Phys., 80, 395 (1933).
[11] Schläfer, L.: Z. phys. Chem. N. F., 4, 116 (1955).
[12] Fromherz, F., Kun-Hau Lih: Z. phys. Chem., A 153, 321 (1931); A 167, 103 (1933).
[13] Gibson, K. S., M. M. Balcon: Research Paper RP 1798. 39, 601 (1947).