DER LICHTABSORPTIONSMECHANISMUS DER a, a`
Werbung

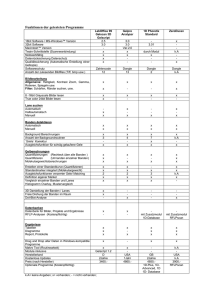
DER LICHTABSORPTIONSMECHANISMUS DER a, a' - D I P Y R I D Y L UND O - PHENATHROLIN K O M P L E X E (Vorläufige Mitteilung) Von J . C S Á S Z Á R , E. H O R V Á T H u n d L. L E H O T A I Institut f ü r Allgemeine und Physikalische Chemie der Universität Szeged (Eingegangen am 5. Juni 1956) Es wurden die Absorptionsspektren der Komplexe der Cr(III)-, Mn(II)-, Fe(II)-. Co(II)-, Ni(II)-, Cu(II)- und Zn(II)-Ionen mit' «, a'-Dypiridyl und o-Phenanthrolin im Spektralgebiet von 2000—210 bzw. 400—210 mn ausgemessen. Es wurde festgestellt, dass: 1. die f ü r elektrovalente bzw. kovalente Komplexe entwickelte Theorie der TermaufSpaltung auch bei diesen Chelat-Komplexen gültig ist; 2. der im kristallinen Zustand diamagnetische Ni(II)-Dikomplex in Lösungen paramagnetisch wird; 3. die Banden d sich mit kurzwelligeren Banden b des Zentralions sich verschmelzen, und die letzteren im allgemeinen verwischt, als Inflexión erscheinen. 1. Einleitung In einer f r ü h e r e n A r b e i t h a t K I S S [1] eine Theorie der L i c h t a b s o r p t i o n der e l e k t r o v a l e n t e r u n d k o v a l e n t e r A r t g e b u n d e n e n C h e l a t - K o m p l e x e e n t wickelt. B e i m B e a c h t e n der G r u n d g e d a n k e n dieser T h e o r i e w i r d d e r M e c h a n i s m u s d e r L i c h t a b s o r p t i o n der o - P h e n a n t h r o l i n u n d a, a ' - D i p y r i d y l - K o m plexe e i n g e h e n d e r besprochen. 2. Strukturfragen der Komplexe Von den b i d e n t a t e n o - P h e n a n t h r o l i n u n d a , a ' - D i p y r i d y l - L i g a n d e n w e r d e n durch die zwei- bzw. d r e i w e r t i g e n Metallionen zwei bzw. drei M o l e k ü l e geb u n d e n . Bei e l e k t r o v a l e n t e r Bindung' ist die e r w a r t e t e höchste S y m m e t r i e d e r K o m p l e x e w e g e n d e r p l a n a r t e t r a g o n a l e n bzw. o k t a e d r i s c h e n A n o r d n u n g d e r Liganden D<i bzw. Oi, [1]. Das Vorliegen der t e t r a e d r i s c h e n A n o r d n u n g (T<j) beim B i n d e n von zwei L i g a n d e n ist w e n i g e r wahrscheinlich. Nach den e x p e r i m e n t e l l e n D a t e n [1] b i n d e n die p l a n a r t e t r a g o n a l e n K o m plexe in t r a n s - S t e l l u n g zwei L ö s u n g s m i t t e l m o l e k ü l e . In diesem Falle w i r d die m a x i m a l e S y m m e t r i e der K o m p l e x e D41, a n s t a t t D4 [2]. W e n n aber die L i g a n den trotz der Ion-Dipol W e c h s e l w i r k u n g in v e r s c h i e d e n e m A b s t a n d g e b u n d e n w e r d e n [2], so w i r d die S y m m e t r i e n i e d r i g e r d. h. C3V bzw. C2V a n s t a t t O], bzw. D41,. Diese F r a g e k a n n d u r c h die T e r m a u f s p a l t u n g e n der u n t e r s u c h t e n Kom-. piexe b e a n t w o r t e t w e r d e n . 4 3 50 J . C S Ä S Z Ä R , E . H O R V A T H lind L . LEHOTAI Im Falle von kovalenter Bindung erwarten wir wegen des Ausgleichs der Bindungsunterschiede die höchste Symmetrie der Komplexe d. h. Oh bzw. D 4 h [2]. Die optische Aktivität der Komplexe mit drei gebundenen Liganden w u r d e von mehreren Verfassern untersucht [3], [4]. 3. Der Mechanismus der Lichtabsorption Nach f r ü h e r e n Arbeiten [1]. [2] werden in den Absorptionsspektren der Chelat-Komplexe mit elektrovalenter bzw. kovalenter Bindung dieselben Absorptionsbanden, wie bei elektrovalenten bzw. kovalenten Komplexen eine Rolle spielen. Besonders interessant sind f ü r uns die Banden b, deren Lage, bzw. Erscheinungsformen n u r durch Perturbationsrechnungen festgestellt werden können. Da auf Grund der Versuchsdaten KISS [2] festgestellt hat, dass durch die Chelat-Bindung die Art der Termaufspaltung nicht beeinflusst wird, so können wir die f ü r nicht Chelat-Komplexe gültige Theorie auch hier ohne weiteres anwenden. F ü r die Anzahl der Banden c stehen uns keine genauen Daten zur Verfügung. Die Frage wurde neulich von JÖRGENSEN [5] u n d SCHLÄFER [6] studiert. Die aromatischen Liganden können in ihren Chelat-Komplexen ihre Eigenabsorption behalten (Banden e). Es ist aber zu erwarten, dass gewisse Anregungsvorgänge der Liganden durch Elektronübersprung befolgt w e r d e n (Banden d); diese Banden liegen in dem langwelligeren Spektralgebiet, als die Banden e der nicht gebundenen Liganden [2]. Es ist a m richtigsten, w e n n wir diese Frage auf Grund der Theorie von MULLIKEN [7] behandeln, nach welcher schon die Wechselwirkung (Ion-Ligand) die Anregungsenergie des Ligands erniedrigen wird. So wird dieser Molekülteil in dem langwelligeren Gebiet absorbieren, als der Ligand im freien Zustand. Entstehen die B a n d e n d wegen sterischen Ursache nicht, so erhalten w i r die freien Banden e. Die Erscheinungen der Banden d bzw. e werden durch die Übergangswahrscheinlichkeit dieser Banden beeinflusst. Bei einem grossen aromatischen Radikal (z. B. o-Phenanthrolin und a,a'-Dipyridyl) aus sterischen Gründen k ö n n e n aber nicht alle Anregungen der Liganden zum A u f t r e t e n der Banden d f ü h r e n [2]. Hat der Ligand eine starke Elektronaffinität, so k a n n die Anregung der kurzwelligeren Banden b des Zentraiions zum Elektronenübersprung f ü h r e n : Me+"• M. + Iii'—>-Me+n • M* —• Me+<n+l) -M~. ' (l) SCHLÄFER [8] beschäftigt sich, mit der Natur der Elektronüberspungsbanden und mit dem Berechnen ihrer Lage, seine Daten können wir aber nicht verwerten. 4. Diskussion r der Versuchsdaten Das ö,a -Dipyridyl (Fig. 1. K. 6) bzw. das o-Phenanthrolin (Fig. 1. K. 5) haben nach unseren A u f n a h m e n zwei charakteristische Absorptionsbanden . bei 280 und 223 bzw. 265 und 226 mu, in guter Übereinstimmung m i t den LICHTABSORPTIONSMECHANISMUS VON KOMPLEX V E R B I N D U N G E N 51 L i t e r a t u r d a t e n [9]. Der Absorptionsmechanismus dieser V e r b i n d u n g e n werden hier nicht diskutiert, die Versuchsdaten sind auch ohnedies verständlich. a) Kovalente Chelat-Komplexe Das f r e i e Fe(II)-Ion hat vier ungepaarte d - E l e k t r o n e n (d';). Seine K o m plexe sind diamagnetisch [10]. [11], so m u s s m a n a n n e h m e n , dass die sechs Elekt r o n e n des Zentralions auf drei U n t e r n i v e a u s paarweise zusammengedrängt sind u n d dass mit einer Hybridisation 3d 2 4s4p 3 eine k o v a l e n t e B i n d u n g ents t e h t [12], [13]. Es gibt also kein ungepaartes Elektron, die B a n d e n b fallen aus u n d in den Absorptionsspektren sind n u r die Banden d u n d e zu finden. Bei d e m o - P h e n a n t h r o l i n - K o m p l e x erscheint die h o h e E l e k t r o n ü b e r s p r u n g s b a n d e d bei 520 r n u m i t einer" starken Inflexión a n der kurzwelligen Seite, welche das Einschmelzen einer anderen Bande d zeigt. Da bei dem «,a'-Dipyridyl-Komplex der Energie-Unterschied zwischen den zwei Elektronübersprungsprozessen viel grösser ist, so erscheinen die zwei B a n d e n d voneina n d e r getrennt. Z u r E r k l ä r u n g der E n t s t e h u n g dieser B a n d e n d sind noch weitere U n t e r s u c h u n g e n nötig, ob es möglich ist, dass sich die A n r e g u n g nach der Formel 1 vorgeht. Die Banden e sind in j e d e m Falle leicht erkennbar, w a s zeigt, dass der Unterschied zwischen der Anregungsenergie von Banden e bzw. derselben von Banden d so gross ist, dass diese B a n d e n voneinander scharf g e t r e n n t erscheinen können. Das Cr(III)-Ion h a t drei ungepaarte d-Elektronen. Da n a c h den Literaturd a t e n [14] der Komplex dem freien Cr(III)-Ion gleich paramagnetisch ist, so k ö n n e n w i r auch hier m i t dem, ¡bei d e m Gasion gebrauchten 4 F G r u n d t e r m arbeiten, welcher in einem Potentialfeld mit O h -Symmetrie zwei Banden b aufweist. Gleich der Absorptionskurve des [Cr(H 2 0) 6 ] 3 + Ions enthält das S p e k t r u m des a, «'-Dipyridyl- bzw. o - P h e n a n t h r o l i n - K o m p l e x e s zwei Bandén b. Die erste Bande steht im allgemeinen fest, die zweite a b e r erscheint in beiden K o m p l e x e n in einer starken Inflexión, aus welcher die B a n d e b durch eine K u r v e n a n a l y s e [16] leicht zu erhalten ist. Die charakteristischen Banden der g e b u n d e n e n Liganden erscheinen bei dem a.a'-Dipyridyl-Komplex bei u n v e r ä n d e r t e n Wellenlängen, bei dem o - P h e n a n t h r o l i n - K o m p l e x sind sie ein wenig nach den langen Wellen verschoben (Tab. 1.). Bei Cr(III)-Komplexen ist die Bindungsart nicht feststellbar [2]. b) Elektroválente Chelat-Komplexe Bei dem Cu(II)-Ion (3d°) wegen der A u f s p a l t u n g des 2 D G r u n d t e r m s erhalten wir bei einer S y m m e t r i e Q, bzw. D-ih, ein bzw. drei Banden b. In der Absorptionskurve des Ionhydrats gibt es n u r eine breite Bande, so mussm a n hier die Oh-Symmetrie a n n e h m e n [1]. Bei den a, a'-Dipyridyl- bzw. o - P h e n a n t h r o l i n - K o m p l e x e n sind gleicherweise drei Banden b zu finden, bei 1950, 972 und 741 bzw. 1610 u n d 740 m //, was die S y m m e t r i e D4h beweist, weil bei der sonst e r w a r t e t e n C3V n u r zwei Banden b a u f t r ä t e n . D u r c h die K u r v e n analyse k a n n die breite B a n d e bei 740 m u in zwei Banden g e t r e n n t werden. Wegen der n e u n Elektronen des Cu(II)-Ions k a n n n u r ein Komplex von elektrovalenter B i n d u n g entstehen [2]. Die Banden e erscheinen auch hier. r>2 J, CSÄSZÄR, E. HORVÄTH und L. LEHOTAt Tabelle 1 Komplex Banden b Banden d | 280 (4,12) 263 (4,46) 525 350 300 (3,99) (3,91) (4,82) :;: 520 264 (4,02) (4,79) «, e'-Dipyridyl o-Phenanthrolin (FeDip 3 )CI 2 -2H 2 0 (FePhen^CU^HoO 790 Cu(H,0)cf + (CuDip3) (C104)2 • 7 H 2 0 (CuPhen 2 )(C10 4 ) 2 -6H»0 Ni(H,0);i + (NiDip 3 )(C10 4 ) 2 -6H 2 0 (NiPhen,) Clo • 5H 2 0 (NiPhen 3 )(CI0 4 ) 2 -l0H 2 0 1650 (2,94) 1600 (2,56) 1150 (0,24) 1720 (2,67) 1750 (1,65) 1620 (2,74) (1,12) 970 (2,77) 740* (2,27) 730 (0,30) 840 (1,33) 950 (0,62) 850 (1,18) Cr(HäO)i!+ (CrDip, ( )Cl 3 -6H,0 (CrPhen^CI;,-61-1,0 Co(H 2 0),l + (CoDip 3 )Cl,-6H,0 (CoPhen 3 )(C10 4 ) 2 H 2 0 1730 (2,89) 1600 1000 (1,36) (2,26) (1,41) 1010 740 (2,91) 655 (0,28) 530 (1,54) 580 (0,58) 540 (1,46) 586 (0,82) 535 (1,94) 610 (2,17) 510 (0,72) 485* (1,96) [-460 I 1(1,88)] (MnDip,)Cl 2 (MnPhen 2 )(C10 4 ) 2 1650 (2,19) (ZnDipg) (C104)2 -7H 2 0 (ZnPhen 3 ) (C104)2 • 3H 2 0 * zusammengesetzte Bande Banden e 510 (1,22) 396 (0,66) j~400 1 |(2,25)] 1-385 ] 233 (4,04) 228 (4,64) 244 (4,55) 227 (4,78) 290 237 (4,66) (4,71) 273 225 (4,72) (4,73) 1(1,10) 295 245 (4,76) (4,68) 271 229 (4,74) (4,74) (1,60) (4,94) (4,93) 415 414 (0,88) [-417 1(2,30) 1-430 |(2,62) 1-460 [(0,20). 268 228 286 235 (4,08) (4,65) 276 226 (4,60) (4,68) 294 (4,64) 268 (4,84) 283 (4,60) 267 (4,68) 283 (4,48) 270 (4,84) [ ] verschmolzene Bande Das Ni (Il)-Ion h a t zwei u n g e p a a r t e d - E l e k t r o n e n . D a bei d e m I o n h y d r a t (Fig. 1, K. 1) w i r drei B a n d e n b e r h a l t e n , so sollen w i r die D 4h S y m m e t r i e a n n e h m e n , w a s auch d u r c h G i t t e r s t r u k t u r u n t e r s u c h u n g e n [22] b e w i e s e n ist. Nach L i t e r a t u r d a t e n [15] ist d e r D i k o m p l e x d i a m a g n e t i s c h . Die A b s o r p t i o n s k u r v e d e r K o m p l e x e (Fig. 1. K. 2), d i e den A b s o r p t i o n s s p e k t r e n v o n e l e k t r o v a l e n t e n K o m p l e x e n des Ni(II)-Ions s e h r ä h n l i c h ist, w i d e r s p r i c h t doch diesen, f ü r einen f e s t e n . Z u s t a n d g ü l t i g e n V e r s u c h s d a t e n . Das zeigt, d a s s das K r a f t f e l d des Lösungsmittels die E l e k t r o n e n v e r t e i l u n g des K o m p l e x e s in einer, die T e r m a u f s p a l t u n g e r l a u b e n d e n Weise b e e i n f l u s s t . LICHTABSORPTIONSMECHANISMUS VON KOMPLEX VERBINDUNGEN 53 Gleich d e m D i k o m p l e x e n t h ä l t die K u r v e des T r i k o m p l e x e s (Fig. 1, K. 3, 4) a u c h vier B a n d e n b, w e g e n d e r A u f s p a l t u n g des 3 F G r u n d t e r m s in e i n e m P o t e n t i a l f e l d m i t C3V S y m m e t r i e . Mit k l e i n e r V e r s c h i e b u n g sind auch die Bünden e a u f z u f i n d e n . Fig. 1 Kurve 1: Ni(H,.0),r+ + 6 M H C 1 0 , . . Kurve 4: (NiPhen ;l ) (C10.)).,.10H.,0. Kurve 2: (NiPhen.,)C]._..5H.,0. Kurve 5: o-Phenanthrolin. Kurve 3: (NiDip3) (ClO^.eiHoO. Kurve 6: «.«'-Dipyridyl Bei E x t i n k t i o n s k u r v e n von Ni (II)- bzw. Cr (III)-Komplexen f i n d e t m a n die langwelligeren B a n d e n b des Z e n t r a l i o n s m e h r oder w e n i g e r verschmolzen u n d m i t h ö h e r e n E x t i n k t i ö n s w e r t e n , w e g e n der A n r e g u n g der B a n d e n d. die nach der A n r e g u n g der B a n d e n b erfolgt. Das Co (Il)-Ion h a t a u c h drei u n g e p a a r t e d - E l e k t r o n e n . Nach m a g n e t i schen M e s s u n g e n ist der K o m p l e x [CoDip s ](C10 4 ) 2 .6H 2 0 m i t 4,85 B M p a r a magnetisch [12]; die drei u n g e p a a r t e n d - E l e k t r o n e n sind also a u c h in dem 54 J . CSÄSZÄR, E. HORVATH und L. L E H O T A I K o m p l e x v o r h a n d e n . In den K u r v e n v o n beiden K o m p l e x e n f i n d e n w i r v i e r T e r m a u f s p a l t u n g s b a n d e n b, m i t e i n e m a u s g e p r ä g t e n M a x i m u m bzw. I n f l e x i o n . I n gelöstem Z u s t a n d ist also die S y m m e t r i e des P o t e n t i a l f e l d e s C3 V . I n diesem F a l l e ist n ä m l i c h d e r G r u n d t e r m 4 F. u n d bei seiner A u f s p a l t u n g e n t s t e h e n vier B a n d e n b. Die c h a r a k t e r i s t i s c h e n B a n d e n d e r g e b u n d e n e n Liganden k ö n n e n a u c h hier leicht g e f u n d e n w e r d e n . Das Mn (Il)-Ion h a t f ü n f ü n g e p a a r t e d - E l e k t r o n e n . N a c h g r u p p e n t h e o r e t i schen R e c h n u n g e n w i r d sich d e r G r u n d t e r m GS bei e l e k t r o v a l e n t e n K o m p l e x e n bei k e i n e r S y m m e t r i e a u f s p a l t e n . So e r h a l t e n w i r in d e r A b s o r p t i o n s k u r v e des K o m p l e x e s k e i n e B a n d e n b, es sind n u r die B a n d e n c, d u n d c v o r h a n d e n . N a c h m a g n e t i s c h e n M e s s u n g e n [12] ist der K o m p l e x [MnDip ; ,]CL.6H.O d i a magnetisch. N a c h S C H L Ä F E R [6] h a t das M n (Il)-Salz ein typisches I n t e r k o m b i n a t i o n s s p e k t r u m . D e r flache, a u f s t e i g e n d e Ast e n t h ä l t die B a n d e n d; die B a n d e n e sind a u c h g u t zu e r k e n n e n . Das Zn (Il)-Ion h a t eine a u f g e f ü l l t e äussere E l e k t r o n e n s c h a l e , so sind seine K o m p l e x e f a r b l o s . Es gibt k e i n e ü n g e p a a r t e d - E l e k t r o n e n , u n d so sind in d e n S p e k t r e n n u r die B a n d e n d u n d c v o r h a n d e n . D i e E i g e n a b s o r p t i o n s b a n d e n d e r g e b u n d e n e n L i g a n d e n sind ein w e n i g nach den l a n g e n Wellen v e r s c h o b e n . 5. Kritische Anmerkungen Man k a n n also feststellen, dass die Theorie d e r T e r m a u f s p a l t u n g f ü r diese G r u p p e von C h e l a t - K o m p l e x e n g ü l t i g ist. Es gibt a b e r n o c h einige F r a g e n / b e i w e l c h e n noch w e i t e r e U n t e r s u c h u n g e n nötig sind. 1. Man m u s s e r k l ä r e n die W a h r s c h e i n l i c h k e i t , M e c h a n i s m u s bzw. d i e E r s c h e i n u n g s f o r m e n d e r E l e k t r o n ü b e r s p r u n g s b a n d e n d. Z. B. bei F e (II)- b z w . Ni ( I I ) - K o m p l e x e n gibt es e i n e Schwierigkeit bei d e r E r k l ä r u n g d e r B a n d e n d m i t ganz gleicher Höhe, oder bei d e m Verschmolzen d e r v i e r t e n B a n d e b des Ni (Il)-Ions. 2. Nach den bisherigen e x p e r i m e n t e l l e n u n d R e c h n u n g s d a t e n ist s e h r s c h w e r zu e r k l ä r e n , w a r u m die B a n d e n b bei K o m p l e x e n , i m G e g e n s a t z zu d e n B a n d e n d e r I o n h y d r a t e n , bis zu einem W e r t • v o n log s — 2,0 — 2,8 e r h ö h t werden. 3. Z u r E r k l ä r u n g der h o h e n B a n d e bzw. des a u f s t e i g e n d e n Astes bei 2000 m « sind n o c h w e i t e r e U n t e r s u c h u n g e n nötig. 6. Versuchsmethode Die Komplexe wurden nach Literaturangaben [17—20] aus Merck p. a. Chemikalien hergestellt und durch mehrere Umkristallisation gereinigt. Die Zusammensetzung der Verbindungen haben w i r durch Metall- und N-Analyse kontrolliert. Die Absorptionsspektren wurden mit Beckman DU Spektrophotometer, bei Zimmertemperatur, mit Küvetten von 1,0, 0,1 und 0,01 cm ausgemessen. Die Konzentration der Lösungen w a r zwischen 0,1—0,005 M. Als Lösungsmittel und Vergleichsmaterial benützten wir 96%-ige Ethanol. Betreffs der Messmethode verweisen wir auf die Literatursdaten [21]). * s s Wir isagen P r o f . Ä. K I S S f ü r die beständige, gefällige U n t e r s t ü t z u n g u n serer A r b e i t vielen D a n k . LICHTABSORPTIONSMECHANISMUS VON K O M P L E X V E R B I N D U N G E N 55 • Literatur [1] Kiss. A.: Magyar Tud: Akad. Kém. Tud. Osztályközi.. 6. 37. 77 (1955); Z. anorg. alig. Chem., 282.! 141 (1955): Sonderdruck Tagungsber. Chem. Ges. D. D. R., H a u p t j a h r e s t a g u n g 1954. [2] Kiss, A.: Acta Chim. Acad. Sei. Hung, (im Erscheinen). [3] Werner, A.: Ber., 45, 433 (1912). [4] Morgan, G. T., J. M. Burstall: J. Chem. Soc., 2213 (1931). 15] Jörgensen, K.: Dan. Mat. Fys. Medd., 29, 3 (1955),; [6] Schläfer, H. L.: Z. phys. Chem. N. F., 4, 116 (1955). ' . ' [7] Mulliken, R. S.: J. Am. Chem, Soc., 12, 600 (1950); 74. 811 (1952): J. Chem.. Phys., 56, 801 (1952). [8] Schläfer, H. L.: Z. phys. Chem. N. F.. 3, 222, 263 (1955). [9] Sone, K., P. Krumholz, H. Stammreich: J. Am. Chem. Soc, 1", 777 (1955). [10] Burstall, F. M.: J. Chem. Soc., 172 (1938). [11] Cambi, L., L. Cagnesso: Gazz. Chim. Ital., 63, 767 (1933). [12] Burstall, F. M., R. S. Nyholm: J. Chem. Soc., 3570 (1952). [13] Davies, N. R., F. P. Dwyer: Trans. Far. Soc., 49, 180 (1953). [14] Beccari, E.: Bull. Soc. Ital. Biol. Sper., 16, 214 (1941). [Í5] Martell, A. E., M. Calvin: Chem. of t h e Metal Chelat Comp. (New-York) 1952. [16] Kiss, A., C. Sándorffy: Acta Chem. Phys. Univ. Szeged, 2,' 31 (1948). ' [17] Blau, F.: Mon'atsh. Chem. 19, 647 (1898). [18] Jaeger, F. M., A. J. Dijk: Z. anorg. allg. Chem., 227, 273 (1936). [19] Pfeiffer, P. und Mitarbeiter: Z. anorg. allg. Chem.. 215. 273 (1933); 260. 84 (1949); 263, 31 (1950); Ber. 66B. 415 (1933); 67, 2667 (1931). [20] Block, R. B., J. C. Bailar: J. Am. Chem. Soc., 73, 4722 (1951). [21] Gibson, K. S., M. M. Balcon: Research P a p e r R P 1798, 38. 601 (1947). [22] Mukherjee, P. L.: Z. Krist., 91, 504 (1935).