Chemie Propädeutikum Einleitung Aufbau der Materie
Werbung

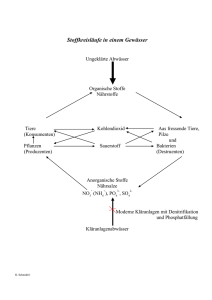
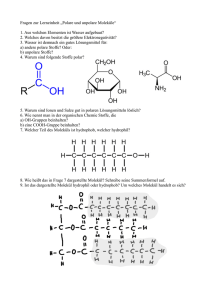
Chemie Propädeutikum Basierend auf Inhalten aus Hans Rudolf Christen Chemie Einleitung Was ist Chemie, womit beschäftigt sich diese Wissenschaft Vergleich Chemie – Physik (Erhitzen – Abkühlen mit und ohne Reaktion) Aufbau der Materie Stoffarten Mischung und reiner Stoff Homogene Stoffe (z.B. Glas, Wasser, Zucker, Benzin): einheitliches Aussehen auch bei starker Vergrößerung – eine Phase Heterogene Stoffe (z.B. Holz, Granit, Erde): uneinheitliches Aussehen – mehrere Phasen; lassen sich im allgemeinen durch physikalische Operationen in die einzelnen Phasen trennen. Auch homogene Stoffe können in einzelne Komponenten zerlegt werden (z.B. Kochsalzlösung). Substanzen, die mittels physikalischer Operationen in Komponenten zerlegt werden können, heißen Mischungen im Gegensatz zu Reinstoffen. Trennung von Mischungen Fest/Fest: Sedimentation und Aufrahmen (z.B. Goldwäscherei); Extrahieren (z.B. Salzgewinnung); Umkristallisieren Fest/Flüssig: Filtration Flüssig/Flüssig (homogen): Destillation (z.B. Reingasgewinnung) Spezielle Reinigungsmethoden: Sublimation (z.B. Iod), stufenweise Kristallisation Chromatographie Destillation Reinstoff: konst. Siedepunkt Mischung: Siedepunkt ändert sich mit der Zusammensetzung und damit der Zeit (Ausnahme: azeotrope Gemische: z.B. 96% Alkohol) Fraktionieren Chromatographie Stationäre und Mobile Phase Verteilung zwischen zwei nicht mischbaren Phasen Säulen-, Papier-, Dünnschicht-, Gas-Chromatographie Retentionszeit und Retentionsfaktor Reinstoffcharakterisierung Nur eine spezifische Eigenschaft ist meist nicht ausreichend um eine Substanz eindeutig zu identifizieren. Einteilung reiner Stoffe Metallische Stoffe Elektrisch leitfähig, Metallglanz, schwarze Farbe, Duktilität, wasserunlöslich (Ausnahme, wenn Metall mit Wasser reagiert) Flüchtige Stoffe Niedriger Schmelz- und Siedepunkt (bis 450 °C), meist farblos, durchsichtig, nicht elektrisch leitfähig, wenn fest, dann weich Salzartige Stoffe Elektrisch leitfähig, wenn flüssig oder gelöst (Begleiterscheinung Elektrolyse; z.B. Chloralkali-Elektrolyse), Hoher Schmelz- und Siedepunkt (NaCl 1440 °C), schwerflüchtig, wasserlöslich (manchmal nur in geringer Konznetration) Diamantartige Stoffe Hohe Härte, Hoher Schmelz- und Siedepunkt, noch schwerer flüchtig als Salze, wasserunlöslich, nicht elektrisch leitfähig Hochmolekulare Stoffe z.B. Eiweiß, Cellulose, Kunstharze, Plexiglas, Gummi Festkörper, harzartig, weich, keine scharfe Schmelztemperatur, meist wasserunlöslich, aber in org. Lösungsmitteln löslich bzw. quellbar Element und Verbindung Viele Reinstoffe lassen sich unter chemischen Veränderungen weiter trennen (z.B. HgO), physikalisch keine Trennung. Trennung möglich – Verbindung Keine Trennung – Element Elemente 109 Elemente zur Zeit bekannt, davon etwas weniger als 90 Metalle, rd. 15 Nichtmetalle (vorwiegend flüchtige Stoffe) Verbindungen, und einige Elemente zeigen nur einzelne Eigenschaften von Metallen („Halbmetalle“) Salze gibt es bei den Elementen nicht Abgekürzte Bezeichnung (Symbol) einheitlich festgelegt durch IUPAC, Name in versch. Sprachen unterschiedlich Zuordnung Element – Verbindung nicht immer leicht durchführbar Wichtige Metalle Gold (Au), Silber (Ag), Kupfer (Cu), Quecksilber (Hg), Platin (Pt) treten in der Natur gediegen auf Blei (Pb), Eisen (Fe), Zink (Zn), Zinn (Sn), Nickel (Ni), Chrom (Cr), Wolfram (W), Aluminium (Al), Magnesium (Mg), Calcium (Ca), Natrium (Na) in Form von chemischen Verbindungen Wichtige Nichtmetalle Sauerstoff (O), Bestandteil der Luft, Verbrennung zu Oxiden Wasserstoff (H), Knallgas Stickstoff (N), Bestandteil der Luft, Dünger Kohlenstoff (C), Hauptelement in organischen Verbindungen, Diamant und Graphit Chlor (Cl), nur in Verbindungen (NaCl, HCl) Brom (Br), flüssig, für Farbstoffe und Heilmittel Schwefel (S) Phosphor (P), nur in Verbindungen, weißer und roter Phosphor Silicium (Si), 2. häufigstes Element auf der Erde, Silicate, nur in Verbindungen Verbindungen Lassen sich mit chemischen Methoden in Elemente zerlegen (z.B. Thermolyse (HgO), Elektrolyse (Wasser, HCl)) Nicht nur Analyse, auch Synthese chemischer Vorgang Neue Eigenschaften Chemischer Vorgang mit Energieumsatz verbunden (endotherm – exotherm) Abgekürzte Bezeichnung mit Formeln Benennung von binären Verbindungen (mehr metallisches Element zuerst, dann weniger metallisches Element mit Endung –id) Trennung anorganische organische Chemie Atome Dalton-Modell Satz von Erhaltung der Masse Gesetz der konstanten Verhältnisse(definierte, konstante Zusammensetzung einer chemischen Verbindung) Atomhypothese: Materie besteht aus nicht weiter teilbaren kleinen Atomen, die weder erschaffen noch zerstört werden können. Atome verschiedener Elemente verschiedene Eigenschaften und Massen; für ein Element sind jedoch alle Atome gleich Gesetz der vielfachen Verhältnisse (A + B, oder A + 2B Massen von B müssen ein ganzzahliges Verhältnis zueinander einnehmen) Gesetz, Hypothese, Theorie Gesetz: allgemeine Feststellung auf Basis Experiment Hypothese: Erklärung, um Gesetz verständlich zu machen Theorie: Bestätigung der Hypothese durch weitere Experimente liefert Theorie Aggregatzustände Fest – flüssig – gasförmig Feste Stoffe Gitteranordnung, Kohäsionskräfte, geometrische Ordnung ist regelmäßig Folge des Gitteraufbaus ist Anisotropie (Richtungsabhängigkeit on Eigenschaften) Amorphe Stoffe und Flüssigkeiten Isotrop, Eigenschaften nicht richtungsabhängig Aggregatzustandsänderungen Kinetische Energie, Druck Atommasse Atommasseneinheit Avogadro Konstante oder Loschmidtsche Zahl (6.0220943 x 1023) Symbol und Formel Das Rutherford Modell des Atoms Die elektrische Ladung Das Coulombsche Gesetz Elementarladung (Millikan Versuch 1909) 1.602 x 10-19 C Die wichtigsten Elementarteilchen Elektronen Protonen Radioaktivität: Zerfall von Atomen unter Aussenden von Strahlung (α, β, γ) Neutronen Der Streuversuch von Rutherford Kernmodell: Atomkern und Atomhülle Isotope (z.B. Chlor) Element besteht aus Atomen der gleichen Protonenzahl Radioaktive Isotope Isotopenmarkierung Altersbestimmung Die Entstehung der Elemente Kernfusion Die Energiestufen der Elektronen Linienspektrum (Edelgase oder Metallatom) Spektralanalyse Energiequanten Ionisierungsenergien Schalen (1,2,3,4, usw.) Unterniveaus (s, p, d, f) Aufbau der Elektronenhülle 4 Quantenzahlen Haupt- = Schale Neben- = Unterniveau Magnet- = Aufspaltung der Unterniveaus Spin- = Drehimpuls (+1/2 oder -1/2) 2 Elektronen in einem Atom nie ident in allen 4 Quantenzahlen Darstellung der Elektronenkonfiguration Periodensystem Aufbau des Periodensystems Perioden und Gruppen Übergangsmetalle Gruppen des Periodensystems Alkalimetalle Erdalkalimetalle Erdmetalle Kohlenstoff-/Siliziumgruppe Stickstoff-/Phopshorgruppe Chalkogene Halogene Edelgase Modelle der Elektronenhülle Kreisbahnen Unschärfebeziehung Orbitale (Orte mit Aufenthaltswahrscheinlichkeiten) Hybridisierung (Bsp. Methan) Atomverbände Die chemischen Bindungstypen Oktettregel Die Atombindung Mehrfachbindungen Polare Atombindung Elektronegativität Bindungsenergie Ionenbindung Ionisierungsenergie Elektronenaffinität Gitterenergie Metallische Bindung Elektronengas Beziehung zwischen Struktur und Eigenschaft Molekülverbindungen Atombindungen Molekülgitter Flüchtige Stoffe Beispielhafte Verbindung (Halogenwasserstoffsäuren, Wasser, Schwefelwasserstoff, Kohlenwasserstoffe, Schwefeldioxid) Zwischenmolekulare Kräfte Van der Waals-Kräfte Wasserstoffbrücken Dipol-Dipol-Wechselwirkung Ionenverbindungen Salze sind Verbindungen, die im festen Zustand aus Ionen bestehen Koordinationszahlen Verhältnis der Radien Kation und Anion entscheidet hinsichtlich der Koordinationszahlen Fehlstellen Löslichkeit von Ionenkristallen Hydration und Hydrationsenergie Kristallwasser Elektrische Leitfähigkeit von Salzen Kationen – Anionen Abhängigkeit Stoffmenge – Stromstärke – Zeit 1 Faraday = 96486 As, ist die Menge an Ladung, die NA (Loschmidtsche Zahl) Elementarladungen (Ladung eines Elektrons oder Protons) entspricht Komplexionen (Beispiele SO2-, Cu(NH)42+) Ligandenaustausch (z.B. Wasser – Ammoniak) Wichtige komplexe Anionen (Carbonat, Nitrat, Phosphat, Sulfat, Perchlorat, Chlorat, Permanganat, Chromat, Dichromat, Hydroxid Festkörperverbindungen Diamantartige Stoffe (Diamant (C) und isoelektronische Stoffe (Bornitrid (BN), Siliziumcarbid (SiC))) Atomgitter, Atomkristall Unterscheidung Ionen- und Atomgitter nicht immer eindeutig möglich, v.a. bei Metalloxiden (z.B. TiO2) Ionendeformation, teilweiser Atombindungscharakter, abhängig von Ladung und Größe der Ionen Anionengitter (Komplexe Anionen; Abstände Zentralatom zu Liganden in Relation zu Abstand Kation zu Liganden entscheidend; abhängig von EN des Zentralatoms des komplexen Anions und dem Kation; z.B. MgAl2O4) Gerüstanionen (Silikate) Hochmolekulare Stoffe (Zahl der Atome pro Molekül bis 100 000 und darüber) Typische Vertreter (Cellulose, Plexiglas, Nylon Gummi Kräfte die Moleküle zusammenhalten (van der Waals, Wasserstoffbrücken, Dipol-DipolWechselwirkung) Lösungen Vorgang des Lösens Abhängigkeit Löslichkeit – Temperatur Siede- und Schmelzpunkte von Lösungen (Erhöhung bzw. Erniedrigung) Dampfdruckabhängigkeit - Änderungen aufgrund der Zahl der gelösten Teilchen I Wasser : II Salzlösung Osmose Die Formeln von Verbindungen Substanzformel Oxidationszahl Beispiele aus Periodensystem Die chemische Reaktion Quantitative Beziehungen Grundlegende Begriffe Definition eines mols Molvolumen eines Gases Ideale Gasgleichung Atom- und Molekülmassen Bestimmung der Molekülmassen über Erniedrigung des Schmelzpunkts bzw. über Gasverdrängung Stöchiometrische Berechnungen Stöchiometrische Reaktionsgleichung Ergebnis eines Experiments; sagt nichts über Mechanismus und Kinetik Beispiele Massen- und Volumsprozent Molarität Molalität Der Verlauf chemischer Vorgänge Energie und chemische Vorgänge Energieinhalt (Enthalpie) Elemente (Enthalpie = 0) Reaktionswärme (Differenz der Enthalpien der End- und der Ausgangsstoffe) Kalorimeter Gesetz der konstanten Wärmesummen Bestimmung der Enthalpie von Reaktionen, deren Reaktionswärme nicht direkt bestimmbar ist (z.B. C zu CO) Bildungsenthalpien Berechnung von Reaktionswärmen aus Bildungswärmen Photochemische Reaktionen Radikalreaktion angeregt durch Licht Zersetzung von Silberhalogeniden Die Triebkraft chemischer Reaktionen Exotherme Reaktionen laufen von selbst ab Prinzip vom Energieminimum Warum laufen endotherme Vorgänge freiwillig ab? Zweiter Faktor: Prinzip vom Streben nach Zunahme der Unordnung Maß für die Unordnung (= Entropie) Entropie bei 0 K ist 0 Nimmt die Unordnung zu, ist die Reaktionsentropie (Differenz der Entropien der End- und der Ausgangsstoffe) positiv. Triebkraft einer Reaktion (= freie Enthalphie) Zusammenhang freie Enthalpie, Enthalpie, Entropie (Temperaturfaktor) Exergonisch – endergonisch Reaktion freiwillig bei negativer freier Enthalpie Die Reaktionsgeschwindigkeit Trotz negativem ΔG keine Reaktion? (sagt nichts über die Zeit) Geschwindigkeitsgesetze Geschwindigkeitskonstante Konzentrationsabhängigkeit Reaktion 1., 2., n. Ordnung Temperaturabhängigkeit RGT – Regel Reaktion nur bei gewissem Minimalenergieinhalt (Aktivierungsenergie; bestimmt Reaktionsgeschwindigkeit) Unterschied reaktionsfähig und stabil Über den Ablauf (Mechanismus) chemischer Reaktionen Energie - Reaktionskoordinate Zwischenstoff Katalyse Beispiel: katalytische Zersetzung von Ameisensäure Das chemische Gleichgewicht Reaktion umkehrbar, kein vollständiger Umsatz Beispiel Iod + Wasserstoff zu Iodwasserstoff Kinetische Ableitung des Massenwirkungsgesetz Konzentrationsabhängigkeit Verschiebung von Gleichgewichten Temperaturabhängigkeit und Druckabhängigkeit Das Le Chateliersche Prinzip (Flucht vor dem Zwang) Die freie Enthalpie und das Gleichgewicht Thermodynamisch Ableitung des Massenwirkungsgesetz Heterogene Gleichgewichte Löslichkeitsprodukt Säure/Base – Reaktionen Begriffe „Säure“ und „Base“ Beispiele für Säuren (Salzsäure, Schwefelsäure, Salpetersäure, Kohlensäure) Basen (Metallhydroxide, Ammoniak, Carbonate) Definition nach Brönsted Säure/Base – Reaktion (konjugierte Säure und Base; Stärke) Der pH – Wert Messung des pH – Werts Die Stärke von Säuren und Basen Zusammenhänge zwischen Struktur und Säurestärke Säure/Base – Gleichgewichte Protolysegrad pH – Wert von Salzen Pufferungskurven Berechnung pH – Wert Indikatoren und Pufferlösungen Pufferkapazität Typische Puffer (Acetat, Phosphat, Ammoniak) Titration von Säuren und Basen Normalität Komplexreaktionen Ligandenaustausch Beispiele Amminkomplexe Anionenkomplexe Aquo- und Hydroxykomplexe Cyanokomplexe Fällungs- und Lösevorgänge Redoxreaktionen Begriffe Oxidation Reduktion Redoxvorgang Vergleich Säure/Base - Redoxreaktion Oxidationszahl Redoxreaktion Verbrennung von Metallen oder Wasserstoff Flammen Explosion Entzündungstemperatur Reduktion von Metalloxiden mit unedlen Metallen, Wasserstoff, Kohle Reaktionsgleichung Redoxpotential und Redoxreihe Strom Potentialdifferenz Normalwasserstoffelektrode Normalpotential Nichtmetalle Konzentrationsabhängigkeit Nernstsche Gleichung Bestimmung von Gleichgewichtskonstanten Potentiometrische Konzentrationsbestimmungen Galvanische Zelle; Korrosion Halbzelle Akkumulator Korrosion Elektrolyse Zersetzungsspannung Überspannung Zersetzung von Wasser Chloralkali-Elektrolyse Anodische Aluminiumoxidation (Eloxal) Galvanische Überzüge Elektrolytische Raffination Die Vielfalt der Stoffe Nichtmetalle Metalle Organische Chemie Einleitung Besonderes Verhalten des Kohlenstoffs Kinetisch inert Geringe Wärmebeständigkeit Thermodynamisch instabil Aliphaten Alicyclen Aromaten Heterocyclen Isocyclen Funktionalisierte Kohlenwasserstoffe Alkohol Aldehyd Carbonsäure Amin