Organisationsplan Mastitislabor 1. Genehmigung: Bei der
Werbung

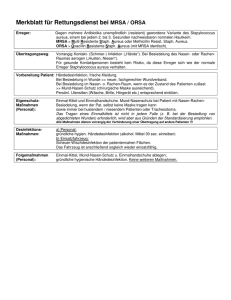
< Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda Organisationsplan Mastitislabor 1. Genehmigung: Bei der beschriebenen Diagnostik wird mit Krankheitserregern gemäß Infektionsschutzgesetz (insbesondere §44ff) gearbeitet (Risikogruppe 2). Das Infektionsschutzgesetz regelt u.a. erlaubnispflichtige (§ 44) und erlaubnisfreie (§ 45) Tätigkeiten. Darüber hinaus finden die Biostoffverordnung, die TierseuchenerregerVO und die TRAB 100 Gültigkeit. Entscheidend ist Art und Umfang der Tätigkeiten. Die zuständige Behörde ist das Landesamt für Umwelt, Gesundheit und Verbraucherschutz. Die Methode im Milchviehbetrieb oder in der Tierarztpraxis ist erlaubnisfrei, jedoch anzeigepflichtig. Dabei müssen folgende Anforderungen erfüllt sein. Die Räumlichkeit entspricht Laborbedingungen, die nach TRAB 100 für Arbeiten mit Erregern der Risikogruppe 2 gelten (gekennzeichneter seperater verschlossener Raum, Zutrittsbeschränkung, Belüftung, Hygieneplan) Der Umgang mit beimpften Platten und deren Kulturen (Bewertung, Behandlungsanweisung, Entsorgung) obliegt dem Tierarzt Es liegt ein Organisationsplan für das Labor vor, in dem die Räumlichkeiten, Hygiene, Zutritt, Verantwortlichkeit, Arbeitsanweisung, Entsorgung berücksichtigt werden Der Tierarzt übernimmt die fachliche Verantwortung für Sicherheit, Arbeitsschutz, Sicherheitsunterweisung, Hygiene und Durchführung vor Ort und muss die Diagnostik bei der Behörde anzeigen Aufgrund der einzureichenden Unterlagen prüft die Behörde, ob die Tätigkeiten mit Krankheitserregern aufgenommen werden können. DerTierarzt stellt den Antrag. Verstöße gegen die Regelungen des Infektionsschutzgesetzes entsprechend §§ 7375 können mit einer Geld- oder Freiheitsstrafe geahndet werden. 2. Räume: Die Diagnostik findet ein einem seperaten Raum statt, der verschlossen zu halten ist, belüftbar, mit Sichtfenster. Die Oberflächen sind glatt und abwischbar. Es ist ausreichend Licht vorhanden. Es werden die Anforderungen nach TRAB 100 für Biostoffe der Gefahrenstufe 2 erfüllt. Der Raum ist von außen als Labor gekennzeichnet. Zugangsberechtigt sind nur der betreuende Tierarzt und der Herdenmanager. Der Tierarzt ist der Laborleiter, stellvertretend der Vertretungstierarzt. D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda 3. Hygieneplan: Für alle Mitarbeiter liegen weiße Kittel und Handschuhe bereit. Die Arbeitsflächen sind täglich mit dem Flächenwischdesinfektionsmittel zu behandeln. Die Durchführung ist vom Laborleiter zu dokumentieren. Die Hände sind nach jeder Arbeit zu desinfizieren (Desinfektionsmittelspender „SoftaMan visco rub“). Es gelten allgemeine persönliche Hygienebestimmungen für die Arbeit in Laboren entspr. Biostoffverordnung (kein Essen und Trinken bei der Arbeit, Händedesinfektion nach jeder Arbeit mit der Diagnostik). Eine Augendusche steht bereit. Im Umgang mit Wasserstoffperoxid 3% liegt das Sicherheitsdatenblatt bereit. Der Laborleiter führt einmal jährlich eine aktenkundige Sicherheitsunterweisung nach Biostoff VO, TRAB 100 und Inf.Sch.G durch. Was Wann Wie Womit Wie lange Wer Hygienische Händedesinfektion Vor und nach der Arbeit im Labor Einreiben, trocknen lassen „Softa-Man Visco Rub“ 1 min TA, Herden manager Arbeitstischstisch 1x täglich Reinigen und desinfizieren, fertige Lösung „Medichen Desinfektionsfeuchttüchern“ 1min TA, Herden manager 4. Entsorgung: Die Entsorgung der infektiösen Platten, Tupfer, Objektträger erfolgt nach jedem Arbeitstag in einem beschrifteten Sondermüllkanister über den infektiösen Praxismüll der Tierarztpraxis. Dazu steht ein Sondermüllbehälter bereit. Ein Zugriff Dritter ist nicht möglich. Die Verantwortung liegt bei dem Tierarzt, die Bereitstellung der Materialien erfolgt ebenso nur über den betreuenden Hoftierarzt. 5. Zweck der Untersuchung: Bei der Therapie der klinischen Mastitis des Rindes kann man den aktuellen Erwartungen an einen verantwortungsvollen Antibiotikaeinsatz und eine evidenzbasierte Therapie nur mit einer schnellen Diagnostik gerecht werden. Das Ziel besteht darin, innerhalb von 20h nach Erkennung der Mastitis mittels Kultivierung im Stall oder der Tierarztpraxis, den krankmachenden Erreger zu identifizieren und ab 2. Tag der Behandlung die Therapie erregerspezifisch auszurichten. Die Erreger St. aureus, KNS, Sc+ (Str. uberis), Sc- (Str. agal., Str. dysgal., Str. canis u.a.) und E. coli können damit einfach erkannt werden. Die Wahl des Antibiotikums erfolgt nach Antibiogrammen, das man regelmäßig mind. 2x pro Jahr von akkreditierten Milchlaboren anfertigen lässt. Mit diesem Resistenzspektrum lernt man D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda jeden Erreger im Betrieb kennen. Die Wahl zur Behandlung fällt auf ein Antibiotikum, bei welchem zu keinem Zeitpunkt Resistenzen aufgetreten sind. Aus der Kenntnis des Erregers ergeben sich auch wertvolle Hinweise zur Behandlungsdauer. Bei Coliinfektionen wird die Antibiotikagabe ins Euter am Folgetag sofort beendet, weil der Erreger nur kurz im Euter verbleibt und der Schaden durch die gebildeten Toxine entstehen. Die Therapie konzentriert sich auf Schmerzmittel, Flüssigkeitsgabe (z.B. Drench) und anderes. Hier spart man Antibiotika und Wartezeit ohne das Risiko einer verminderten Ausheilungsrate. Infektionen mit Str. uberis sollten über einen längeren Zeitraum behandelt werden (5 Tage), weil damit der Erreger eliminiert werden kann und eine erneute Infektion weniger wahrscheinlich wird. Bei bakteriologisch negativem Befund (evtl. auch bei KNS) kann gänzlich auf ein Antibiotikum verzichtet werden. Alternativ stehen Enzympräperate, planzliche Stoffe oder Entzündungshemmer zur Verfügung. Die Grenzen der Betriebsdiagnostik erstrecken sich auf die Unterscheidung wichtiger Streptococcen (St. canis, St. dysgalactiae, St. agal.) und der seltenen Erreger (Mykoplasmen etc.). Bei der Milchprobenuntersuchung sollen Mastitiserreger nachgewiesen werden. Es werden folgende Erreger untersucht: - mikrobiologisch Staphylokokkus aureus Koagulase Negative Staphylokokken (KNS) Äsculin positive Streptokokken (SC+): Str. uberis Äsculin negative Streptokokken (SC-): Str. agalactiae, Str. dysgal. Escherichia coli Das Verfahren ist ebenfalls hilfreich bei der Auswahl zum selektiven Trockenstellen ohne Antibiotika. Das Verfahren wird bei jedem tierärztlichen Besuch mindestens wöchentlich vom Tierarzt durchgeführt. Das Ausstreichen und ansetzen der Kultur kann von einem geschulten Herdenmanager vorgenommen werden. Dem Tierarzt obliegt die Verantwortung zur Verfahrenskontrolle, Durchführung und Sicherheit. 6. Grenzen des Verfahrens: Enterococcen, Hefen, A. pyogenes, Prototheken, Mykoplasmen, Clamydien, Pasteurellen und Nocardien und andere müssen in Speziellaboren diagnostiziert werden. 7. Vorbereitung: Die Milchprobe sollte steril entnommen werden (Anleitung zur sterilen Milchprobenentnahme). Das Probenröhrchen wird wasserfest beschriftet (Kuhnummer, Viertel). 8. Geräte: - Sterile Milchprobe im beschrifteten Röhrchen, Folienstift - Wattestäbchen, Zahnstocher - Agarplatte von Oxoid: Columbia-CNA-Äsculin-Selektivnährboden/MacConkey Nährboden Nr. 3 mod. (Art. PB5224E, Fa. Oxoid) Tel: 0281-1520, vorzugsweise im Kühlschrank lagern - Inkubator 36°C-38°C - Objektträger D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda - UV-Lampe H2O2 3% 9. Ablauf und Durchführung: Die Petrischalen werden auf dem Deckel mit Kuhnummer, Viertel und Datum versehen. Beschriften der Agarplatte Das jeweilige Milchröhrchen wird mehrmals geschwenkt, dann wird der Stöpsel abgenommen und mit dem Wattetupfer in die Probenflüssigkeit getaucht und anschließend mit jeweils 4 Strichen auf der geteilten Petrischale beidseits ausgestrichen. D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda Ausstreichen einer Milchprobe mit dem Tupfer Die Bebrütung erfolgt im Brutschrank über mind. 20h bei 37+-1°C. Der Deckel der Petrischale befindet sich während der Lagerung immer unten. Beim Ansetzen der Probe erfolgt ein Eintrag im Laborbuch. Die Bewertung erfolgt am nächsten Tag nach dem beiliegenden Organigramm. Die Punkte 3 und 5 können vom geschulten Herdenmanager vorgenommen werden. Die Punkte 6 und 7 incl. der Entsorgung sind ausschließlich vom bereuenden Tierarzt zu übernehmen. 10. Beurteilung: Die Bewertung beginnt mit dem Ansehen der Kultur. Eine Identifizierung eines Erregers ist möglich, wenn auf allen 4 Impfstrichen ein gleichartiges Koloniebild sichtbar ist und mind. 10 Kolonien dieses Bild zeigen (DVG-Leitlinien). Wenn mehrere Kulturformen und Farben vorliegen, gilt die Probe als verunreinigt und es kann kein ursächlicher Keim identifiziert werden. E. coli: Auf der farblosen Agarhälfte wachsen nur gram- Erreger (E. Coli). Im Falle von E. coli sind die Kolonien pink und der Agar pink. Die Kulturen sind einer schmalen hellen Zone umgeben. D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda E. coli, viele Kulturen Auf der roten Agarhälfte wachsen KNS, St. aureus, SC+ (Str. uberis) und SC- (Str. agal., Str. dysgal.). Daher beginnt man bei Wachstum auf der roten Agarhälfte mit dem Katalasetest. Man nimmt mit dem Zahnstocher 2-3 Kolonien ab und hält sie in einen Tropfen H2O2 auf einem Objektträgergläschen. Wenn sich dabei Bläschen bilden, handelt es sich um Staphylokokken (Str. aureus, KNS). Wenn sich keine Bläschen bilden, handelt es sich um Streptokokken (Str. uberis, Str. dysgal., Str. agal.). Positiver Katalasetest: bei Bläschenbildung Staphylokokken (St. aureus, KNS) D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda Negativer Katalasetest (keine Bläschenbildung) bei Streptokokken (Str. uberis, SC-) KNS und Staph. Aureus: KNS und Staphylokokkus aureus wachsen auf der roten Agarhälfte mit meist großen Kolonien (1-2mm) in weiß bis gelber Farbe. Beim Katalasetest bilden sich Bläschen. Der Unterschied der beiden Erreger liegt in der Hämolyse (Blutauflösung mit Verlust der Rotfärbung um die Kolonie). KNS macht keine Hämolyse, St. aureus macht eine doppelzonige Hämolyse um der Kolonie. KNS in 11 Kulturen (auch gegen Licht keine Hämolyse) D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda St. aureus mit zweizoniger Hämolyse auf dem Blutagar gegen Licht (viele Kulturen sind aneinander gewachsen – als Strich sichtbar) Streptokokken: Streptokokken wachsen auf dem roten Agar mit kleinen grauen Kolonien. Beim Katalasetest bilden sich keine Bläschen. Die Unterscheidung von SC+ (Äsculin positive Streptokokken, Str. uberis) und SC- (Äsculin negative Streptokokken, Str. agalactiae, Str. dysgal.) wird mit der UV-Lampe vorgenommen. Str. uberis (SC+) Der floreszierende Farbstoff Äsculin wird von Str. uberis (SC+) abgebaut. Die bläuliche Fluoreszens unter UV-Licht geht verloren. Str. uberis wächst mit sehr kleinen Kolonien. D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda Str. dysgal. und Str. agal. (SC-) können den Farbstoff nicht abbauen. Unter der UVLampe fluoresziert die gesamte Agarhälfte bläulich. Str. agal., Str. dysgal., Str. canis (SC-) Wenn unterschiedliche Kolonien (in Farbe oder Form), dann liegt eine bei der Entnahme verunreinigte Probe vor. Verunreinigte Probe, keine Bestimmung möglich Erreger Staphylococcus Aussehen Allgemeine Therapieempfehlungen 1-2mm groß, gelblich, rund, kuhadaptiert, Übertragung im Melkstand, D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda aureus glänzend, Katalase +, 5 Tage lang behandeln, Infektionsgefahr, doppelzonige Hämolyse; subklinische in Trockenstehphase Oft subklinische Infektion therapieren, Reservoire: chronisch Kranke KNS (Koagulase Negative Staphylokokken) SC+ (Streptococcus uberis) unterschiedlich groß, weiß bis gelb, Katalase+, meist keine Hämolyse sehr klein, grau, Äsculin+ (unter UV-Licht anthracid fluoreszierend) nur bei schwerer Mastitis behandeln, Hautkeim, SC- (Str. dysgal., klein, grau, Äsculin Str. agal., Str. canis) E. coli Kolonie pink mit farbloser Zone um der Kolonie, stinkend, teils verlaufend mit unregelm. Form; Erkrankung mit Allgemeinstörungen, Fieber, Milch oft blutig wässrig Unterscheidung nur im Speziallabor, Achtung: kuhassoziiert, hohes Übertragungspotential, Sofort behandeln, Eutergängiges Antibiotikum spritzen, Infusion Glucose, Entzündungshemmer, Schmerzmittel, Drench, Oxytocin, sind nur kurz nachweisbar, keine Therapie ins Euter kuh- und euteradaptiert, über 5 Tage behandeln, kein Oxytocin, kein häufiges Ausmelken, bei schwerer Mastitis zusätzlich spritzen, Reservoire: Stroh 11. Therapieempfehlungen: Die Therapieempfehlungen werden vom betreuenden Tierarzt ausgesprochen. Sie richten sich nach dem Erreger, der Schwere der Erkrankung, dem Wert und Laktationsstadium des Tieres und den betriebsspezifischen Gegebenheiten. Das zu wählende Medikament richtet sich nach den gesammelten Antibiogrammen des Betriebes. 12. Vorteile für Verbraucher: Evidenzbasiert: Antibiotika nur bei bakterieller Infektion, nicht bei BU-, im Sinne der Antibiotikaleitlinien (nach Nachweis von Erregern), Gezielter Antibiotikaeinsatz durch Erregerkenntnis und dessen vorliegenden Antibiogramms aus Landeslabor aus vorherigen Untersuchungen (diese müssen damit regelmäßig durchgeführt werden) Einsparung von Antibiotika bei gleichzeitig höherem NSAID-Einsatz – Tierschutzrelevanz, Schmerzmanagement Vorteile für Tierarzt: Neues Arbeitsfeld, wöchentlich BU Auswertung, mehr ITB durch Beratung der Erreger, Ursachen, regelmäßig Antibiogrammauswertung, Beratung von Behandlung D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi < Tierärztliche Gemeinschaftspraxis Dr. G. Kreher, Dr. E. Stamnitz, Dr. M. Kreher, Bad Liebenwerda Behandlungsalternativen mit neuen Möglichkeiten: NSAID, Infusionen bei Coli, alternative Therapien (pflanzlich, homöopathisch, enzymatisch), statt weniger Antibiotika werden mehr andere Medikamente verbraucht Vorteile für Landwirt: Schnelle Erregerkenntnis führt zu Einsparung von Antibiotika, weniger Wartezeit, bei besseren Heilungschancen Rückschlüsse auf unsaubere Entnahme sieht er selber, ebenso Rückschlüsse auf zu spätes Erkennen der Mastitis (Bsp. Colimastitis: Erreger ist trotz schwerer Infektion nicht mehr nachweisbar, weil nur noch die Toxine das Tier schädigen) Nutzung zum selektiven Trockenstellen D:\GVP-Handbuch\12_35 Organisationsplan Mastitislabor.doc Erstellt am 28.10.2014 von Mi, genehmigt am 28.10.2014 von Mi, geändert am 30.10.2014, von Mi