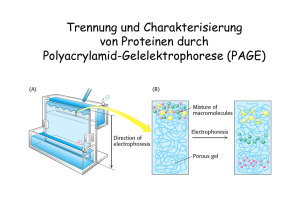
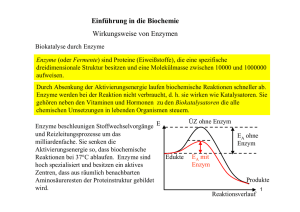
Übungsblatt 4 - Uni Regensburg
Werbung

Seite 1 von 2 uebung4_WS_1213.doc Übungsblatt 4 1. a) In Ihrem Chemikalienschrank finden sich drei Substanzen, die nur mit ein paar Codes beschriftet sind. Auf dem ersten Gefäß finden Sie die Angabe EC 4.3.1.17, während auf dem zweiten steht EC 1.1.1.224; die dritte Aufschrift lautet EC 6.2.1.4. Ermitteln Sie, warum es sich dabei jeweils handelt und für was sich die Substanzen verwenden lassen. (3 P) b) Im Folgenden sind vier Enzyme aufgeführt. In welcher Klasse würden Sie die einzelnen Enzyme jeweils suchen und welche Reaktionen katalysieren sie? (4 P) • Methionin-S-Methyl-Transferase • UDP-Glucose-4-Epimerase • L-Lysin-Oxidase • β-Glucuronidase 2. Chymotrypsin ist ein klassischer Vertreter der Serin-Proteasen, die als Endopeptidasen die hydrolytische Spaltung von Peptidbindungen in Proteinen katalysieren. a) Welche Aminosäurereste bilden die katalytische Triade von α-Chymotrypsin und welcher Typ von Katalyse wird durch den jeweiligen Rest vermittelt? Erklären Sie, wie der KatalyseMechanismus funktioniert. Wodurch werden die unterschiedlichen Spezifitäten verschiedener Serinproteasen, z.B. von Trypsin bzw. Chymotrypsin, vermittelt? (6 P) b) Welche Aminosäuregruppen befinden sich im Oxyanion-Loch der Serin-Proteasen und welche Rolle spielen sie für die Katalyse? (1 P) c) Formulieren Sie eine Reaktion, die typischerweise zur Inaktivierung von Serinproteasen wie Trypsin führt, und die zur Identifizierung des katalytisch aktiven Aminosäurerests benutzt werden kann. (2 P) 3. a) Formulieren Sie die Reduktion, die von der Alkohol-Dehydrogenase (ADH) in Kombination mit dem Redox-Coenzym NADH/H+ katalysiert wird, mit Strukturformeln (auch für den reaktiven Teil des beteiligten Coenzyms!), und machen Sie kenntlich, welches HAtom im Ethanol vom Coenzym stammt. (2 P) b) Zur Bestimmung der ADH-Aktivität wird in eine Küvette (d = 0,5 cm) das Substrat, das Coenzym und Puffer pipettiert. Das Gesamtvolumen dieser Lösungen beträgt 1,49 mL, die bei 340 nm zu Beginn der Reaktion gemessene Absorbanz A340 nm = 0,875, der Absorptionskoeffizient des bei der Reaktion verbrauchten NADH ε340 nm = 6,2 L/mol cm. Sofort nach dem Start der Reaktion durch Zugabe von 0,01 mL ADH-Lösung wird die Absorbanz 3 min lang in Abständen von 15 s gemessen. Daraus wird eine Änderung der Absorbanz von ΔA/min = –0,093 bestimmt. Die 1961 eingeführte Enzyme Unit, kurz „U“, bezeichnet diejenige Enzymmenge, die pro Minute ein µmol Substrat umsetzt. In der medizinischen Biochemie wird als davon abgeleitete Größe häufig die sog. „Volumenaktivität“ zVol benutzt, die als Enzymaktivität z bezogen auf das entsprechende Volumen V definiert ist, also zVol = Δn / Δt V = Δc / Δt mit der Einheit U/L Berechnen Sie die Volumenaktivität der gegebenen Enzymlösung. (3,5 P) c) Nach ca. 20 min blieb die Absorbanz konstant (A340 nm = 0,235). Welche Stoffmenge an Alkohol ist in der Küvette gebildet worden? (1,5 P) Seite 2 von 2 uebung4_WS_1213.doc 4. Bestätigen Sie die folgenden Aussagen mithilfe der Michaelis-Menten-Gleichung: a) Für [S] >> KM wird υ0 unabhängig von [S]. b) Bei [S] << KM ist die Reaktion erster Ordnung bezüglich S c) Bei υ0 = 1/2 υmax entspricht die Substratkonzentration der Michaelis-Menten-Konstante, (3 P) also [S] = KM. 5. a) Für die Umsetzung des Substrates (S) durch das Enzym E wurden die Anfangsgeschwindigkeiten bei sechs verschiedenen Substratkonzentrationen gemessen. Verwenden Sie die Messwerte der nachfolgenden Tabelle, um die Werte von KM und υmax für dieses Substrat so gut wie möglich abzuschätzen. (2 P) [S] / mM 0.00125 0.01 0.04 0.10 2.0 10.0 υ0 / (mM min-1) 14 35 56 66 69 70 b) Was versteht man unter der Wechselzahl kkat eines Enzyms? Wie ist die Größe kkat/KM zu interpretieren? (3 P) 6. Ein Enzym, das einer Michaelis-Menten-Kinetik folgt, besitzt eine Michaelis-Konstante von KM = 1,0 µM. Bei einer Substratkonzentration von 200 µM beträgt die Anfangsgeschwindigkeit υ0 = 0,1 µM min-1. Wie groß ist die Anfangsgeschwindigkeit bei Substratkonzentrationen von (a) 1,0 mM, (b) 1,0 µM und (c) 2,0 µM? (3 P)