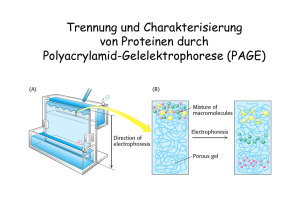
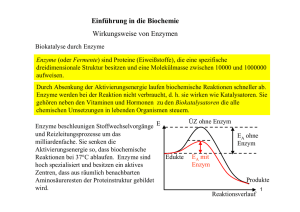
Biochemie I_3
Werbung

Biochemisches Grundpraktikum Einteilung in die Praktikumsliste: 05.11.08 und 06.11.08 von 9.00 – 11.30 und von 12.30 – 16.00 im großen Praktikumsraum im GZMB bei Frau Pia Meyer Praktikum: 14.00 – 18.00 Vorlesung: 13.00 – 14.00 Versuch Vorlesung Praktikumstermine 1. Photometrie 2. Enzymkinetik 3. Chromatographie 4. Elektrophorese 5. Proteinanalytik 6. Redoxreaktionen 12.11. 19.11. 26.11. 03.12. 10.12. 07.01. 17.11. – 20.11. 24.11. – 27.11. 01.12. – 04.12. 08.12. – 11.12. 05.01. – 08.01. 12.01. – 15.01. Trennung und Charakterisierung von Proteinen durch Polyacrylamid-Gelelektrophorese Denaturiende PAGE (SDS-PAGE) Natriumdodecylsulfat (SDS) Färbung mit Coomassie-Blau Bestimmung des Molekulargewichts eines Proteins durch SDS-PAGE Die elektrophoretische Mobilität ist umgekehrt proportional zum Logarithmus des Molekulargewichts Verlauf einer Proteinreinigung Isoelektrische Fokussierung: pH – Gradient im Gel Isoelektrische Fokussierung 2-Dimensionale Gelelektrophorese Bestimmung der AminosäureZusammensetzung eines Proteins Hydrolyse des Proteins durch 6 M HCl bei 110ºC und Trennung der Aminosäuren durch Ionenaustausch – Säulenchromatographie Nachweis und Quantifizierung der Aminosäuren Amin Derivat Nachweisgrenze: 10 pmol (ca. 1 Nanogramm) einer Aminosäure Bestimmung der N-terminalen Aminosäure Dabsylchlorid Bildung eines Sulfonamids Hydrolyse mit 6 M HCl Dabsyl-Alanin Bestimmung der Primärstruktur: Aminosäure-Sequenzanalyse Edman - Abbau Phenylthiohydantoin-Alanin Chemische Spaltung der Polypeptidkette mit Bromcyan Enzymatische Spaltung der Polypeptidkette mit Proteasen Massenspektrometrie MALDI-TOF (Matrix assisted Laser desorption Ionization) Bestimmung der drei-dimensionalen Struktur durch Röntgenkristallstrukturanalyse Kristallisation von Proteinen Proteinkristalle Vom Kristall zur 3D-Struktur Struktur und Funktion der Proteine • • • • • • • Enzymatische Katalyse Transport und Speicherung Koordinierte Bewegung Mechanische Stützfunktion Immunabwehr Erzeugung u. Übertragung von Nervenimpulsen Kontrolle von Wachstum und Differenzierung Katalytische Aktivität der Enzyme 7 Carboanhydrase: Reaktion 10 mal schneller als die unkatalysierte Übergangszustand (nicht katalysiert) (katalysiert) Freie Energie Substrat Produkt Reaktionsverlauf Einfluss eines Enzyms auf eine chemische Reaktion • Enzyme beschleunigen Reaktionen durch die Stabilisierung der Übergangszustände • Enzyme können Reaktionsgleichgewichte nicht verschieben !! Enzyme Katalysieren meist nur eine Reaktion Enzym Familie Reaktions-Typ Oxidoreduktasen Oxidation/Reduktion Transferasen Übertragung von Gruppen Hydrolasen Hydrolyse Lyasen Bildung von Doppelbindungen Isomerasen Isomerisierung (intramolekularer Gruppentransfer) Ligasen Verknüpfung von 2 Substraten Enzyme Hohe Spezifität für Substrat Beispiel: Proteasen Substrat Produkt(e) Hydrolytische Spaltung Trypsin Hydrolytische Spaltung Thrombin Katalytisches (aktives) Zentrum (Schlüssel – Schloß – Modell) Substrat Aktives Zentrum Enzym-Substrat Komplex Enzym Aktive Zentren werden von Aminosäuren gebildet, die in der Primärstruktur oft weit entfernt sind Enzyme stabilisieren den Übergangszustand der Reaktion Substratbindung mit „Induced Fit“