Übung8_Chemsiche Komplexe
Werbung
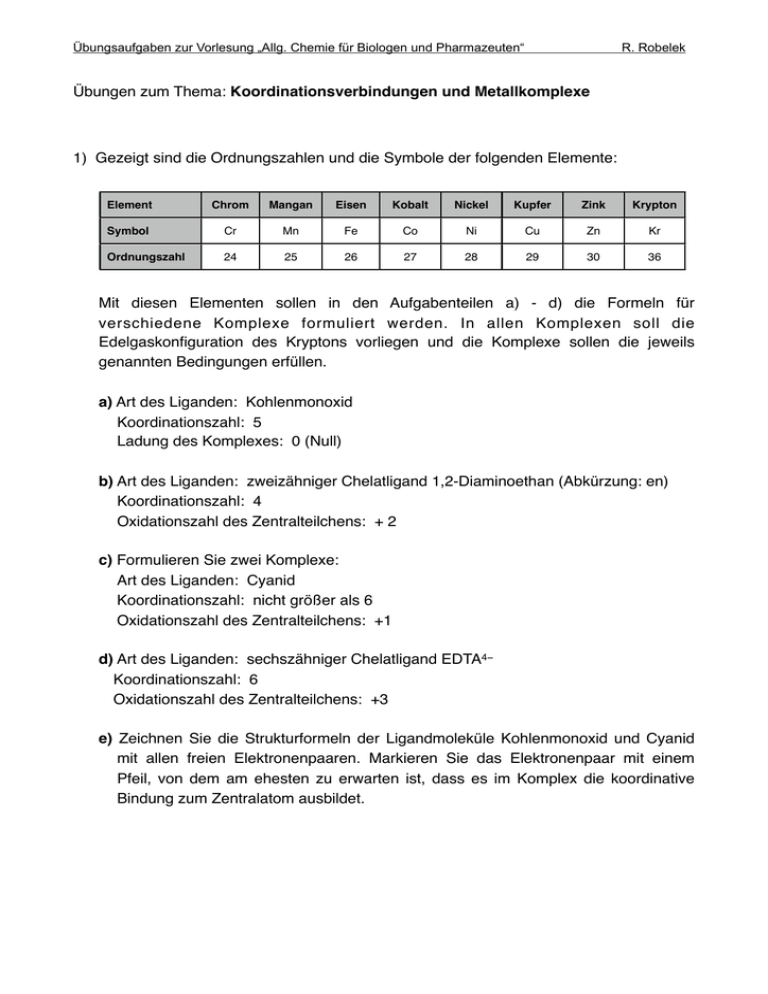
Übungsaufgaben zur Vorlesung „Allg. Chemie für Biologen und Pharmazeuten“ R. Robelek Übungen zum Thema: Koordinationsverbindungen und Metallkomplexe 1) Gezeigt sind die Ordnungszahlen und die Symbole der folgenden Elemente: Element Chrom Mangan Eisen Kobalt Nickel Kupfer Zink Krypton Symbol Cr Mn Fe Co Ni Cu Zn Kr Ordnungszahl 24 25 26 27 28 29 30 36 Mit diesen Elementen sollen in den Aufgabenteilen a) - d) die Formeln für verschiedene Komplexe formuliert werden. In allen Komplexen soll die Edelgaskonfiguration des Kryptons vorliegen und die Komplexe sollen die jeweils genannten Bedingungen erfüllen. a) Art des Liganden: Kohlenmonoxid Koordinationszahl: 5 Ladung des Komplexes: 0 (Null) b) Art des Liganden: zweizähniger Chelatligand 1,2-Diaminoethan (Abkürzung: en) Koordinationszahl: 4 Oxidationszahl des Zentralteilchens: + 2 ! c) Formulieren Sie zwei Komplexe: Art des Liganden: Cyanid Koordinationszahl: nicht größer als 6 Oxidationszahl des Zentralteilchens: +1 ! d) Art des Liganden: sechszähniger Chelatligand EDTA4− Koordinationszahl: 6 Oxidationszahl des Zentralteilchens: +3 e) Zeichnen Sie die Strukturformeln der Ligandmoleküle Kohlenmonoxid und Cyanid mit allen freien Elektronenpaaren. Markieren Sie das Elektronenpaar mit einem Pfeil, von dem am ehesten zu erwarten ist, dass es im Komplex die koordinative Bindung zum Zentralatom ausbildet. Übungsaufgaben zur Vorlesung „Allg. Chemie für Biologen und Pharmazeuten“ R. Robelek 2) Es ist generell bekannt, dass Eisenpräparate zur Behandlung von Eisenmangelanämie nicht zusammen mit Tee eingenommen werden sollen, da einige Inhaltsstoffe des Tees das medizinisch wirksame Eisen komplexieren und damit inaktivieren können. Sie wollen diese Wechselwirkung im Labor überprüfen und gehen dabei wie folgt vor: Sie nehmen eine Tablette des betreffenden Eisenpräparats und bestimmen deren Gewicht zu 3,0 g. Laut Hersteller enthält eine Tablette als Wirksubstanz 450 mg Eisen(II)gluconat-Dihydrat (M = 482 g/mol, M (Fe2+) = 55,85 g/mol). Sie zermörsern die Tablette und lösen davon 0,5 g in Wasser auf. Nach Zugabe eines geeigneten Puffers setzen Sie Dimethylglyoxim (H2DMG, zweizähniger Ligand, Struktur siehe unten) zu und füllen das Probenvolumen auf 200 ml auf. 1 ml der resultierenden weinroten Probenlösung zeigt im Photometer eine Absorbanz A1 von 0,8. Im Anschluss wiederholen Sie das oben beschriebene Vorgehen, legen jetzt aber 100 ml eines Tees vor, in denen Sie die 0,5 g der gemörserten Tablette auflösen. Sie beobachten eine Farbänderung der Teelösung ins Grau-Braune, was auf eine Komplexierung des Fe2+ aus der Wirksubstanz mit dem Polyphenol EgCg (M = 458 g/ mol, zweizähniger Ligand, Struktur siehe unten) des Tees zurückzuführen ist. Sie fügen erneut Puffer und H2DMG hinzu, füllen auf 200 ml Probenvolumen auf und messen die Absorbanz (A2) von 1 ml der Probenlösung. A2 hat einen Wert von 0,2. Beide Absorbanzmessungen werden bei einer Messwellenlänge durchgeführt, bei der nur der Fe-HDMG Komplex, nicht aber der Fe-EgCg Komplex absorbieren. Aus Ihrem Experiment sollen Sie nun folgende Fragen beantworten: a) Welche Masse an EgCg ist in einem Liter des verwendeten Tees enthalten ? b) Welches Volumen müsste eine Person bei der Einnahme einer Eisentablette trinken, um die Wirkung des enthaltenen Fe2+ komplett aufzuheben ? Strukturen der Komplexliganden: H 3C HO N C C CH3 N OH Dimethylglyoxim (H2DMG) ! ! Epigallocatechingallat (EgCg)











