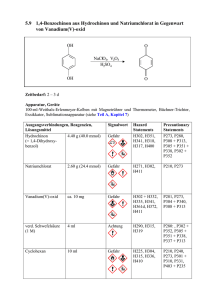
Druckversion
Werbung

Nebengruppenelemente Die Vanadiumgruppe Dirk Broßke Berlin, Juni 2006 1 5. Die Vanadiumgruppe 5.1. Gruppeneigenschaften Ordnungszahl Vanadium V Niobium Nb Tantal Ta 23 41 73 Elektronenkonfiguration [Ar] 3d3 4s2 [Kr] 4d4 5s1 [Xe] 4f14 5d3 6s2 • • • • • • • • Elektronegativität 1,5 1,2 1,3 Schmelzpunkt [°C] 1919 2468 2996 Siedepunkt [°C] 3400 4930 5425 Dichte [g cm-3] 6,09 8,58 16,68 Ohne schützende Oxidschicht glänzend silbernhell; Ta : blaugrün; resistent gegen Säuren Vanadium löst sich in konz. heißer H2SO4 oder HNO3 Niobium und Tantal sogar in Königswasser unlöslich; löslich in konz. H2SO4 / konz. HNO3 / 48%HF (2:1:1) Name: Refraktärmetalle (lat: widerspänstig) auf Grund der hohen Schmelztemperatur und Hitzebeständigkeit +V ist wichtigste Oxidationsstufe (Zunahme der Beständigkeit zum Ta: Ta(V) lässt sich in wässriger Lösung nicht reduzieren; V(V) hingegen mit Zn • [VO (H O) ]+ (gelb) [VO(H2O)5]2+ (blau) [V(H2O)6]3+ (grün) 2 2 4 [V(H2O)6]2+ (violett) In Oxidationsstufe +V Ähnlichkeit zu Nichtmetallen; keine Kationen, sondern AnionenKomplexe, Halogenide flüchtig und hydrolysieren Verwantschaft zu Gruppe 15 gering (nur der saure Charakter der Pentaoxide und Oxidationsstufe +5) Mit steigender Ordnungszahl nimmt die Beständigkeit der niedrigeren Oxidationsstufen ab 5.2. Das Vanadium • Vorkommen • 5. Stelle aller Übergangsmetalle nach Fe, Ti, Mn und Zr (0,016%) weit verbreitet in oxidischen und sulfidischen Erzen • VS4 Patronit • Pb (VO ) Cl Vanadinit (isomorph mit Apatit) 5 4 3 2 • • • • • Gewinnung • Rösten von V-Erzen bei 700-850°C mit Soda oder NaCl → NaVO ; Auslaugen mit 3 Wasser; dann Ausfällen von Polyvanadat mit H2SO4 → V2O5 • Gewinnung durch Reduktion von Vanadiumpentaoxid mit Aluminium oder Ferrosilicium → wenig reines Vanadium • Reines Vanadium durch Reduktion mit Calcium • V O + 5 Ca 2 V + 5 CaO (950°C) 2 5 • V2O5 Nebenprodukt der Urangewinnung aus Carnotit • Auch Reduktion von VCl mit Mg → Vanadiumschwamm 3 • Reindarstellung von Vanadium: van Arkel-de Boer-Verfahren über VI3 oder elektrolytische Raffination (V-Anode, geschmolzenes NaCl als Elektrolyt, Mo oder Ta Kathode) Physikalische Eigenschaften • Reines Vanadium: stahlgrau, nicht brüchig, sehr weich, kalt bearbeitbat; kubisch raumzentriertes Kristallgitter; ähnelt stark seinem Nachbarn Titan in seinen Eigenschaften Chemische Eigenschaften • An Luft Bildung einer sehr dünnen Oxidschicht die nicht den metallischen Glanz beeinträchtigt; in der Hitze Bildung von V2O5; auch mit anderen Nichtmetallen Reaktionen: mit Fluor und Chlor bei Raumtemperatur oder leicht erhöhter Temperatur → VF5 bzw VCl4; mit N und C bei Weißglut Reaktion zu VN bzw. VC; mit nichtoxidierenden Säuren (Ausnahme HF) keine Reaktion trotz des unedlen Charakters (Passivierung) in oxidierenden Säuren löslich, auch in Alkalischmelzen Physiologie • Vanadium bzw. seine Verbindungen sind für tierische und pflanzliche Organismen essentiell, im Menschlichen Organismus sind ca. 0,3 mg Vanadium je kg enthalten (Zellkerne und Mitochondrien von Leber, Milz, Nieren, Schilddrüsen) • In großen Mengen ist es jedoch giftig (MAK-Wert:0,05 mg V O m-3) 2 5 • Als VO43+ kompetitiv zu PO43- in biologischen P-Stoffwechsel (Inhibierung oder • Stabilisierung von Enzymen); katonisch al VO2+; VO2+ und V3+; Wechselwirkung mit biogenetischen Liganden (Proteine) Therapeutisch wirksam als Cytostatika: Peroxvanadate wie [VO(O2)2(ox)]3- und [VO(O2)2]22- sowie Isopolyvanadate Verwendung • Als Legierung Ferrovanadium , als Stahlzusatz → Bildung von V4C3: Erhöhung der Verschleißfestigkeit und Zähigkeit • Große Bedeutung haben Vanadiumoxide und Verbindungen als Heterokatalysatoren 3 Oxid.Zahl +2 +3 +4 +5 V2+ V3+ VO2+ VO3- Zn/Cr3+ Farbe violett grün -0,2 E°(V) Typische Verbindungen Typische Komplexe Sn2+/Ti2+ Fe2+ blau +0,36 farblos +1,0 VSO4 V2(SO4)3 VOCl2 VOSO4 V(CN)64- V(NH3)63+ VO(SCN)42- NH4VO3 Struktur von Vanadiumoxiden V2O5 Koordianation ist verzerrt Oktraedrisch V3O7, V4O9, V6O13 Phasen der Zusammensetzung VnO2n+1; komplizierte Struktur mit stark verzerrten Oktaedern, so dass die Koordinationszahl eher 5 ist VO2 Monoklin verzerrte Rutil Struktur VO1,98-VO1,75 Eine Homogene Reihe von 6 Oxiden VnO2n-1; Koordination verzerrt Oktraedrisch V3O5 Struktur nicht mit der Reihe V4O7 bis V9O17 ↑ verwant V2O3 Korund Struktur VO NaCl Defektstruktur mit Leerstellen in beiden Teilgittern; der Existenzbereich von VO0,8-VO1,3 • Vanadium(V)-oxid V2O5 Schmelztemperatur 658°C, orangerot, Darstellung durch Oxidation von Vanadium oder reiner: • 2 NH4VO3 V2O5 + 2 NH3 + H2O • Schwerlöslich in H O, Oxidationsmittel: 2 • V2O5 + 6 HCl 2 VOCl2 + Cl2 + 3 H2O • Amphoterer Charakter • Säure: Lösung unter Bildung von [VO ]+ (gelb) 2 Laugen: (pH>13): [VO4]3- (farblos) • Dazwischen in Abhängigkeit von pH und Konzentration: Isopolyanionen; Hauptspezies bei 2<pH<6: orangfarben Dekavanadanion (tritt auch in protonierter Form auf, sowie in verschiedenen Salzen (z.B. Na und Ca)) [V10O28]6- in H2O Na4V2O7 · 18 H2O; KV3O8; K3V5O14; KVO3 • • • • [V10O28]6- aufgebaut aus 10 VO6-Oktaedern In großer Zahl syntetisiert und mit struktureller Vielfalt: 4 • Vanadium(V)/Vanadium(IV)-Polyoxovanadate • V(V) in Wasser + H O → [VO (O ) ]3- gelb; in Säuren [V(O )]3+ 2 2 2 2 2 2 Vanadiumdioxid: blauschwarz, amphoter, verzerrte Rutil Struktur mit V-V-Paar (oberhalb 70°C → Aufbruch der V-V-Bindung → freiwerdendes Elektron → Anstieg der Leitfähigkeit und des Paramagnetismuses; in Säuren → [VO(H2O)5]2+ (enthält tatsächlich V=O-Gruppen); VO2+ auch in verschiedenen Salzen enthalten; z.B. [VO(NCS)4]2-; Zusammenschmelzen mir Erdalkalimetalloxiden → MeVO3; Me2VO4 • • Vanadiumtrioxid V2O3: schwarz; basisch, Korund-Struktur; Säure → [V(H2O)6]3+; V(III)Lösungen werden durch Sauerstoff oxidiert; V(III) bildet Reihen von oktraedrischen Komplexen; Zusammenschmelzen mit Erdalkalimetalloxiden → MeV2O3 Vanadiumoxid VO: schwarz; NaCl-Defektstruktur, metallischer Glanz und Leiter; Unterschreitung von kritischen V-V-Abstand in V-Verbindungen → teilweise besetztes Leitungsband → z.B. Spinell → LiV2O3 ist metallischer Leiter; VO ist basisch; Säure → [V(H2O)6]2+ (Lösung stark reduzierend; aus H2O wird H2 freigesetzt) Vanadiumhalogenide Ox.Zahl • • • • • +2 kristallin +3 kristallin +4 Fluoride VF2 blau VF3 grün Chloride VCl2 hellgrün VCl3 VCl3 rotviolett braun; flüssig Bromide VBr2 VBr3 VBr4 orangebraun schwarz purpurrot; flüssig Iodide VI2 rotviolett VI3 braun VF4 grün; fest +5 VF5 weiß; Sdp 19,5°C VI4 in Gasphase bekannt Vanadium(I)-halogenide nicht bekannt (Disproportionierung zu V(II) und reinem V) Vanadium(II)-halogenide: Darstellung aus höheren Halogeniden durch Reduktion, kristallin; paramagnetisch; Luftempfindlich; starke Reduktionsmittel; hygroskopisch; VF2 hat Rutil-Struktur; die anderen sind CdI2 Typ Vanadium(III)-halogenide: polymere Struktur mit Koordinationszahl 6 an Vanadium; VF3 wasserunlöslich, unzersetzt sublimierbar, alle anderen hygroskopisch, Disproportionierung bei hohen Temperaturen VF4 ist polymerer Feststoff; VCl4 und VBr4 sind aus tetraedrischen Monomeren aufgebaut VF5 Darstellung durch Fluorierung von Vanadium; Smp 19,5°C; Gasphase: trigonal bipyrimidale Moleküle, Kristall enthält Ketten aus VF6-Oktaedern 5 5.3. Niobium und Tantal • • • • • • Vorkommen • Niobium: Erdkruste: 0,002Gew% → 34.Stelle (zwischen Neodyn und Blei) • Tantal: Erdkruste: 2 · 10-4Gew% • (Fe,Mn)(NbO ) Eisenniobat 3 2 • (Fe,Mn)(TaO3)2 Eisentalat • Tantal: Schlacke der Zinngewinnung wichtigste Tantal Quelle Gewinnung • Technisch durch Schmelzelektrolyse der komplexen Fluoride K [NbOF ] und K [TaF ] 2 5 2 7 sowie durch chemische Reduktion dieser Fluoride mit Natrium bei 800°C oder aus den aus ihnen zugänglichen Oxiden mit Kohlenstoff bei 1700-2300°C • MF5 + 5 Na M + 5 NaF • M O +5C 2 M + 5 CO 2 5 • Die Fluoride werden durch Aufschluß der Nb und Ta-haltigen Erze mit Gemisch aus HF und H2SO4 in der Siedehitze erhalten. Trennung der komplexen Fluoride durch fraktionierte Extraktion mit Ketonen (Metylisobutylketon) • Nach Aufschluß der Erze mit Hilfe der Carbochlorierung auch Trennung der entstehenden Pentachloride durch fraktionierte Destillation möglich; anschließend Reduktion mit Natrium • Nb O + HF → [NbOF ]2- → [NbO F ]y2 5 5 x z Physikalische Eigenschaften • Niobium kristallisiert kubisch raumzentriert; hellgrau glänzendes Metall; Härte entsprechend Schmiedeeisen, lässt sich gut walzen und schmieden • Tantal zeigt gleiche chemische Widerstandsfähigkeit und stahlähnliche Festigkeit; platingraues, sehr zähes, elastisch dehnbares und polierbares Metall, das man walzen und schmieden kann Chemische Eigenschaften • Bildet an der Luft eine schützende Oxidschicht; reagiert aber bei 300°C mit O2 zu den M2O5 Pentaoxiden • Werden auch von anderen Nichtmetallen wie den Halogenen oder bei hohen Temperaturen auch von Stickstoff und Kohlenstoff oxidiert Physiologie • Nicht essentiell (im Unterschied zu Vanadium) • Mensch enthält 0,8mg Nb je kg; aber kei Ta • Gegenüber Körperflüssigkeiten indifferent (nicht löslich); Niobverbindungen gelten als toxisch Verwendung • Niobium: Hauptsächlich als Legierung; Bestandteil zur Herstellung temperaturbeständiger Werkstoffe; Supaleiter (Nb/Cu; Nb/Ti; Nb/Zr) Kernbrennstabumhüllung; Thermoelemente • Tantal: Legierung (Ta/W); temperaturbeständige Werkstoffe; große chemische Beständigkeit → Pt-Ersatz für chemische Geräte, sowie zahnärztliche und chirugische Instrumente und Materialien (Knochennägel, Prothesen) 6 • • Verbindungen Mit Sauerstoff • Niobpentaoxid Nb O und Tantalpentaoxid Ta O : weiße Pulver, schwerer zu 2 5 2 5 reduzieren als V2O5 • NbO uns TaO : blauschwarze Pulver, Rutil-Struktur; ebenfals bekannt: Phasen mit 2 2 Oxidationstufe +4 und +5 • Nb3n+1O8n-2 (n = 5, 6, 7, 8) • NbO: grau; metallisch leitend, nicht stöchometrisch (Homogenitätsbereich: NbO0,982-NbO1,008) → NaCl Defektstruktur • • Zusammenschmelzen von Ta2O5 oder Nb2O5 mit Alkalimetallhydroxiden → Auflösen in Wasser → Isopolyanionen [Me6O16]4-; Existenz von MeO43- Anionen ungewiß, unterhalb pH10(Ta) bzw. pH7(Nb) Abscheidung von wasserhaltigen Oxiden Me2O5 · n H2O • Niobate MeNbO und Tantalate MeTaO : unlöslich, Perowskit-Struktur → 3 3 Doppeloxide, keine isolierten NbO3- oder TaO3- Anionen, einige (z.B. mit Me=Li) sind wegen ferro- bzw. piezoelektrischen Eigenschaften technisch Interesant Mit Halogeniden • Pentahalogenide von allen vier Halogenen bekannt; Pentafluoride weiß, flüchtige Feststoffe; die restlichen 6 farbig, sublimierbar, wasserempfindlich • Pentafluoride NbF und TaF sind aus tetrameren 5 5 Molekülen M4F20 aufgebaut; Die Pentahalogenide NbX5 und TaX5 (X = Cl, Br, I) bestehen aus dimeren M2X10 Molekülen • Außer TaF4 alle möglichen Tetrahalogenide bekannt; NbF4: schwarz, nicht flüchtig, paramagnetisch, die anderen diamagnetisch • NbF Kristallisiert in Schichtstruktur; die Tetrahalogenide NbX und TaX 4 4 4 (X = Cl, Br, I) sind aus Ketten aufgebaut, in denen Metallpaare mit Metall-MetallBindungen auftreten; dies hat kürzere Abstände und den Diamagnetismus zur Folge • Halogenen mit niedrigeren Oxidationsstufen sind Clusterverbindungen (z.B. MX2,33 = M6X14) Aufbau aus M6X122+ Clustern: durch Halogenid-Brücken zu Schichten verknüpft; ohne Strukturänderung ist Oxidation möglich; auch Nb6F15 und Ta6X15 (dreidimensionale Verknüpfung von M6X12-Clustern über Halogen-Brücken wie beim NbO) 7