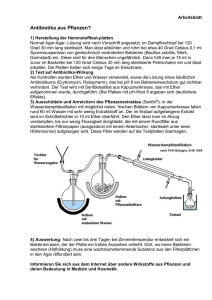
Reaktionen mit N -(1- Benzotriazolylcarbonyl)
Werbung

CROATICA CHEMICA ACTA CCACAA 58 (2) 239-243 (1985) YU ISSN 0011-1643 UDC 547.583.5 Note CCA-1575 mit N -(1- Benzotriazolylcarbonyl)-aminosam·en.IIl1• Synthese von Aminosaure-estern Reaktionen J. Matijević-Sasa, B. Zare und I. Butula Pharmazeutisch-biochemische FakuWit der Universitiit Kroatien, J1(goslawien Eingegangen am 26. September Zagreb, 41000 Zagreb, 1984 N -(l-Benzotriazolylcarbonyl)-aminosauren· (Ia-f) reagieren mit Alkoholen unter Abspaltung von Benzotriazol und Kohlendioxid zu den entsprechenden Aminosaure-Estern. (Ila-i). Die Reaktion verlauft bei Raumtemperatur und wird durch Zugabe von Triethylamin beschleunigt. Die Umsetzung von N-(l-Benzotriazolylcarbonyl)-(Btc)-aminosii.uren2 mit Aminoverbindungen fiihrte nicht wie erwartet'v' zu Hydantoinsii.uren, sondern, unter Abspaltung von Benzotriazol und Kohlendioxid zu Amiden der Aminosauren bzw. Dipeptiden. Nach dieser Reaktion, deren Mechanismus noch nicht geklii.rt ist, wurden auch durch Umsetzung mit Aminosauren die terminal freien Di- und Tripeptide hergestellt.! Es zeigte sich jetzt, dass die N-Btc-Aminosii.uren in analogen Reaktionen auch mit Alkoholen unter Bildung von Aminosii.ure-estern reagieren: R R I R'-OH Btc-NH-CH-COOH I , H2N-CH-COOR' -BtHjC02 Ia-f 8N Ste. BtH IIa-i ?r C - = benzotriazol Die Reaktion wird durch Zugabe von Triethylamin (TEA) beschleunigt und verlii.uft bei Raumtemperatur mit primaren Alkoholen, wie die Dunschichtchromatographie zeigt, fast quantitativ (die sekundii.ren Alkohole reagieren wesentlich langsamer und unvollkommen, die tertiii.ren uberhaupt nicht). Trotzdem sind zum Teil, der Isolationschwierigkeiten wegen, die Aus- I (lb) Btc-L-Tyr-OH (le) (lc) (If) Btc-L-Leu-OH Btc-L-Glu-OH Btc-L-Asp-OH I (la) Btc-L-Phe-OH (ld) (lc) Btc-L-Glu-OH Btc-D,L-Phgly-OH (lb) Btc-L-Tyr-OH " " " " " Benzyl-alkohol " " Methanol (la) Btc-L-Phe-OH B B B B B B A A A Allgemeine Vorschrift durch Umsetzung Raumtemperatur Alkohol (R'-OH) (Ila-i) hergesteUt Umgesetzte N-Btc-Aminosaure (la-i) Aminosiiureester TABELLE 22 24 48 24 24 24 24 2 4 Reaktionszeitjh (Ilc) (Ilb) . H-L-Asp-a-OBz H-L-Glu-a-OBz (Ilh) (IIi) H-L-Leu-OBz . HCl (Ilg) H-D,L-Phgly-OBz . HCl (IIf) H-L-Tyr-OBz . HCl (Ile) H-L-Phe-OBz . HCl (Ild) H-L-Glu-a-OMe H-L-Tyr-OMe . HCl bzv. 52 67 65 75 77 78 93 87 78 utejOfo Ausbe- Methanol (Ila-i) H-L-Phe-OMe (Ila) Produkt von N-Btc-aminosiiuren mit in Ggw. von Triethylamin bei 169-171 141-143 124-126 180-183 187-190 202-204 140-142 132-134 156-158 Gef. 173-17413 147-14812 1289 187-18811 189-19110 U, o 203 o r' :.> t<j .., ul :.> o <... t<j ... ..,... ~ :.> ;-< 149-1508 135-1367 159-1606 Lit. Schmp'/°C BenzylaJkohol o fl::.. t-.:l SYNTHESE VON AMINOSAURE-ESTERN beuten massig (siehe Tabelle). Wie der Vergleich hergestellten Estern II mit den Literaturwerten ohne merkliche Recemisieurng. der optischen Drehwerte von zeigt, verlauf die Reaktion Obwohl die Aminosaure-estern in Princip einfacher kčnnen-, kann die hi er beschriebene Herstellungsmethode (z. B. bei der Gewinnung von a-monoester der Glutaminvorteilhaft verwendet werden . .EXPERIMENTELLER 241 synthetisiert werden in enigen Fallen und Asparaginsaure) TEIL Die Schmelzpunkte sind unkorrigiert. Die IR-Spektreri (KBr) wurden mit einem Perkin-Elmer Gerat 457, die optischen Drehwerte mit dem photoelektrischen Polarimeter OPTON bestimmt. Die DC erfolgte auf Fertigplatten Kieselgel 60-F 254 der Fa. Merck in Chloroform/Methanol 10·: loder' in Butanol/Essigsaure/Wasser 4: 1 : 1. Das Anfarben erfolgte durch Ninhydrin oder in der Jodkammer. Fi.ir die Saulenchromatographie diente Kieselgel (0,2-0,5 mm) der Fa. Merck. Die verwendeten N-Btc-Aminosauren la-e wurden nach Vorschrift? analog dieser Vorschrift hergestellt. Die Lčsungsmittel waren wasserfrei. N -(l-Benzotriazolylcarbonyl)-L-asparaginsaure und If (If) Eine Losung von 0,27 g (1,5 mmol) 1-Benzotriazolylcarbonylchlorid16 in 20 ml Dioxan wird unter Ri.ihren zu einer Suspension von 0,40 g (3,0 mmol) L-Asparaginsaure gegeben und die Mischung 24 h bei Raumternperatur geri.ihrt. Asparaginsaurehydrochlorid wird abgenutscht, das Filtrat i. V. eingedampft und 2 mal mit Benzol nachgedampft. Der halbfeste Ri.ickstand (0.39 g, 93%) der sich schwer kristallisieren Iasst wird ohne weitere Reinigung zur Synthese vervendet. Eine Probe zeigt nach Aufschlammen in Benzol einen Schmp, von 96-98°. IR: 'Vm" = 3700-2110, 1760-1700, 1510, 750 cm-lo Herstellung von Methylestern I1a-c Allgemeine Vorschrift A: NvBtc-aminosaure (Ia-c) (cca 1,5 mm ol) wird im 20 ml Methanol gelo st, mit 1 ml 'I'riathylamin versetzt und so lange bei Raumtemperatur zu reagieren gelassen bis im DC die Ausgangsubstanz nicht mehr festzustellen ist. Nach Abdampfen im Vakuum wird in einzelnen wie folgt aufgearbeitet: L-Phenylalanin-methylester Hydrochlorid (Ila) Der člige Ri.ickstand wird in 15 ml Ethylacetat gelčst und die Losung zwecks Entfernung des Benzotriazols 3 mal mit 10 ml eiskalter l1l/o-ige Natronlauge extrahiert, mit Na2S04 getrocknet und i. V. eingedampft, Der Ri.ickstand wird in Ether gelost, von kleiner Menge entstandenen Diketopiperazin abfiltriert, und durch Einleiten von Chlorwasserstoff in das Hydrochl.orid Ila i.ibergeflihrt. [aJn20 - 3,5° (c 1,6; H20) Lit." [aJn20 - 4,5° (c 4,0; H20) IR: 'Vmax = 3300-2500, 1750, 1585, 1245, 745, 705 cm-lo L- Tyrosin-methylester (I1h) Der Ri.ickstand wird auf einer Saule mittels Chloroform/Methanol (9,5 : 0,5) chromatographiert, Zuerst wird Benzotriazol eluiert und dann (CHCI3/MeOH 9 : 1) der Ester Ilb. + [aJn20 + 23,7° (c 1,13; MeOH). LiU [aJn20 25,7° (c 4,96; MeOH). IR: j·m.x = 3700-2200, 1740, 1595, 1510, 1240, 840 cm-lo J. MATIJEVIČ-SOSA 242 L-Glutaminsii.ure-a-methylester ET AL. (Ue) Der Ruckstand wird wie oben ehromatografiert. Mit ChloroformjMethanol (8 : 2) wird zuerst das Benzotriazol und dann mit reinem Methanol der Ester Ile eluiert. 20 [a10 + 26,3° (e 1,02 MeOH). Lit." [a1025 + 29,7° (c 1,02; MeOH). IR: Ym3X = Herstellung 3750-2750, 1740, 1700-1;;40, 1410 cm-I. von Benzylestern (Ud-i)-Allgemeine Vorschfirft B NvBtc-aminosaure (ea 1,5 mmol) wird in 20 ml Aeeton, 5 ml Benzylalkohol und 1 ml Triethylamin gelost und die Losung bei Raumtemp. stehengelassen, Nach Beendingung der Reaktion werden Aeeton und Triethylamin in Vakuum entfernt und der Riiekstand wie in einzeln besehrieben aufgearbeitet: L-Phenylalanin-benzyleste1' Hydrochlorid (Ud) Der Rliekstand wird in Ether gelčst und in die Losung wird Chlorwasserstoff eingeleitet. Die ausgefallenen Hydroehloride (IId und BTH' HCI) werden abgenutseht im Ethylaeetat suspendiert und mit eiskalter 1Q/o-ige Natronlange extrahiert. Die org. Phase wird uber Na2S04 getrocknet, abgedampf't, der Rliekstand im Ether gelčst und dureh Einleiten von Chlorwasserstoff das IId ausgefallt, [a1020 - 22° (c 1,0; 0,1 M HCI). Lit.9 [a1025 - 22,5° (e 1,01; 0,1 M HCI). IR: l'mox = 3250-2000, 1735, 1600, 1480, 1225, 735, 695 cm-I. L-Tyrosin-benzylester Hydrochlorid (Ue) o: Aus dem verbliebenen werden zuerst die Hydroehloride von Benzyalkohol wie oben getrennt und dann dureh Kristallisation aus EthanoljEther das Ester Hydroehlorid Ile gewohnen (BTH . HCI bleibt in der Mutterlauge). [a1020 IR: - Ym3X 23,7° (e 0,78; 0,1 M HCI). Lit.9 [a1025 - 23,3° (c 0,97; 0,1 M HCI). = 3500-2200, 1740, 1600, 1500, 1240, 840, 755, 705 cm-I. D,L-Phenylglycin-benzylester IR: Hidrochlorid (IH) Es wird wie unter Ile aufgearbeitet. = 3200-2300, 1745, 1590, 1510, 1235, 755, 705 cm-I. Ym3X L-Leucin-benzylester Hydrochlorid (IIg) Der Riickstand wird in Ether gelo st und das Benzotriazol Hydroehlorid dureh Einleiten von Chlorwasserstoff ausgef'allt (Leucin-benzylester Hydroehlorid ist in Ether und meissten org. Lsgm, gut Ioslich), Naeh Abfiltrieren wird das Ether entfernt und das Ilg dureh Chromatographieren von Benzylalkohol getrennt: mit Chloroform wird zuerst Benzylalkohol und dann mit CHCh/MeOH (9: 1) das Ester Hydroehlorid eluiert. IIg lasst sich am besten aus Cyclohexan umkristallisieren. [aJo20 - IR: YmOX 6,4° (c 1,9; 0,1 M HCI). Lit.9 [a1025 - 6,6° (c 2,06; 0,1 M HCI). = 3300-2400, 1760, 1590, 1520, 1225,755, 705 cm-I. L-Glutaminsii.ure-a-benzylester (Uh) Der Rliekstand wird auf einer Saule chromatographiert, Mit Aceton wird Benzylalkohol und Benzotriazol und dann mit Aceton/Methanol (8 : 2) der Ester IIh eluiert. Das Produkt wird aus wassrigen Ethanol umkristallisiert. [a1020 IR: + 10.0° (c 1,0; 0,1 M HCI). Lit.14 = 3300-2000, 1755, 1620-1500, l'm., + 12,0° (e 2,7; 0,1 M HCI). 1395, 1225, 740, 690 cm-I. [a1020 SYNTHESE L-Asparaginsaure-a-benzylester VON AMINOSAURE-ESTERN 243 (Ili) Durch Chromatographie wie oben werden Benzyalkohol, Benzotriazol Ester Ili getrennt. Das Produkt wird aus Wasser kristallisiert. [aJo20 -13.9° (c 0,8; 1 M HCl). Lit.l5 [a]D18 -15.4° (c 5; 1 M HCl). IR: Prou = 3300-2000, 1750, 1630-1500, 1405, 1220, 755, 705 cm-lo und LITERATUR 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 13. 13. 14. 15. 16. 1. B u t u l a, B. Z o r c und M. L j u b i ć, Synthesis 1983 327. 1. B u tuI a, B. Z o r c und V. Ve 1a, Croat. Chem. Acta 54 (1981) 435. B. Z o r c und 1. B u t ula, Croat. Chem. Acta 54 (1981) 441. 1. B u t ula, V. V ela und B. Ive z i ć, Croat. Chem. Acta 51 (1978) 339. K. - H. Dr e ime r in H o u b e n W e y 1, Methoden der organischen Chemie (Herausgeber, Eugen Muller), Band XV/1, s. 314-404, Georg Thieme Verlag Stuttgart 1974. A. W. Sc h r e c k e r und Y. L. Ha r t well, J. A.m. Chem. Soc. 79 (1957) 3827. E. F i s c h e r und W. Sc h rau t h, Ann. Chem. 354 (1907) 34. E. K 1i e g e r, und H. G i b i a n, Ann. Chem. 655 (1962) 195. B. F. ErI a n g e r und R. M. Hall, J. Am. Chem. Soc. 76 (1954) 5781. S i O h L i und R. E. E a k i n, J. Am. Chem. Soc. 77 (1955) 1866. G. L o s s e, R. W a g ner, P. N e ula n d und J. Rat e i t s c hak, Chem. Ber. 91 (1958) 2410. P. Cor d o pat i s und D. The o dor o p o u los, Experientia 31 1255. P. Cor d o pat i s und D. The od o r o p o u los, Experientia 31 1255. C. C o u t s o g e o r g o p o u 1.0s und L. Ze r vas, J. Am. Chem. Soc. 83 (1961) 1885. P. M. Br y a n t, R. H. M o ore, P. J. P i m l o t t und G. T. You n s. J. Chem. Soe. 1959, 3868. 1. B u t u l a, M. P r o š t e n i k und V. V ela, Croat. Chem. Aeta 49 (1977) 837. SAŽETAK Reakcije s N-(l-benzotriazolilkarbonil)-aminokiselinama. aminokiselina J. Matijević-Sosa, III. Sinteza estera B. Zore i I. Butula N-(l-benzotriazolilkarbonil)-aminokiseline, I, reagiraju s alkoholima uz otcjepljenje benzotriazola i ugljik(IV)-oksida, dajući estere aminokiselina. Reakcija se odvija pri sobnoj temperaturi, a ubrzava se dodatkom trietilamina.