Kapitel 1
Werbung

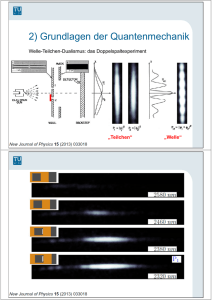
Angewandte Quantenmechanik (132.070) (132 070) Christoph Lemell Institut für Theoretische Physik http://concord.itp.tuwien.ac.at/~qm_mat/Material.html Üb i ht – Grundlagen Übersicht G dl 1) Grenzen der klassischen Physik und „Entdeckung“ der Quantisierung der Natur • Schwarzkörperstrahlung • photoelektrischer Effekt • Stabilität der Atome 2) Grundlagen der Quantenmechanik • Welle-Teilchen-Dualismus • Erraten der Schrödingergleichung Üb i ht – Grundlagen Übersicht G dl 3) Formalismus und Lösung für einfache Systeme • Superposition – Wellenpakete • Erwartungswerte • Eindimensionale Systeme: Teilchen in der Box endlich tiefer Potentialwall/ Potentialwall/-topf topf Tunneleffekt fast freie Elektronen: Elektronen im Metall Gitterschwingungen: Harmonischer Oszillator Üb i ht – Anwendungen Übersicht A d 4) Atome • das Wasserstoffatom Quantenzahlen und ihre Bedeutung numerische i h Lö Lösung d der Schrödingergleichung S h ödi l i h das Wasserstoffatom im Magnetfeld - Zeemaneffekt • Atome mit mehreren Elektronen Mehrelektronen-Wellenfunktion Näherungsverfahren g ((Hartree-Fock,, DFT)) Üb i ht – Anwendungen Übersicht A d 5) Störungstheorie • stationäre Störungstheorie: • Atome im elektrischen Feld • Bandstruktur B d t kt einfacher i f h Metalle M t ll • LCAO - das H2+-Molekül • zeitabhängige Störungstheorie: • Fermis „Goldene Regel“ • nukleare magnetische g Resonanz ((NMR)) • Raman-Spektroskopie 6)) wofür sonst noch Zeit bleibt … 1) E Entdeckung td k d der Q Quantenwelt t lt ausgehendes 19. Jahrhundert: alle Probleme der Physik gelöst, nur noch Arbeit an „Details“ notwendig unerklärbare Phänomene: • Schwarzkörperstrahlung • photoelektrischer Effekt • Linienstrahlung der Atome St hl Strahlung schwarzer h Kö Körper idealisierte Strahlungsquelle absorbiert alle auftreffende Strahlung, Emission hängt von Temperatur ab exp. Realisierung: Hohlraum mit kleiner Öffnung klassische Erklärung: stehende Wellen im Hohlraum L E 1 E c 2 t 2 2 E sin(k1x )sin(k2 y )sin(k3 z )sin t ; n12 n22 n32 4L2 ki L ni Kugeloberfläche (1/8) 2 Anzahl A hl d der M Moden d (W (Wellen) ll ) iim Frequenzintervall , +d proportional zu Volumen einer Kugelschale im k-Raum: dN 4 k 2dk 4 2 d c3 (wegen c ck ) 3e c T 2 Rayleigh-Jeans-Gesetz Wien‘sches Strahlungsgesetz Planck‘sches Strahlungsgesetz (1900) 3 e kT 1 Nobelpreis 1918 Max Planck The Nobel Prize in Physics 1918 was awarded to Max Planck "in recognition of the services he rendered to the advancement of Physics by his discovery of energy quanta". Ph t l kt i h Eff Photoelektrischer Effekt kt Elektronen müssen Oberflächenbarriere („Austrittsarbeit ( Austrittsarbeit“ W) überwinden klassisch: Licht hat Welleneigenschaften (daher Interferenz, Beugung); Energiedichte proportional zur Intensität nach einiger Zeit genug Energie für Elektronenemission deponiert Experiment: Emission sofort ( W ) oder gar nicht Einstein (1905): Licht besteht aus Teilchen (Photonen) mit Energie maximale kinetische Energie der Elektronen: Ekin W Ph t l kt i h Eff Photoelektrischer Effekt kt (6.626 x 10-27) R. A. Millikan, Phys.Rev. 7, 355 (1916) Nobelpreis 1921 Albert Einstein The Nobel Prize in Physics 1921 was awarded to Albert Einstein "for his services to Theoretical Physics, and especially for his discovery of the law of the photoelectric effect". Nobelpreis 1923 Robert Andrews Millikan The Nobel Prize in Physics 1923 was awarded to Robert A. Millikan "for his work on the elementary charge of electricity and on the photoelectric effect ". Li i Linienspektren kt - das d stabile t bil At Atom Wellenlänge [nm] Rydberg-Formel (1890) (Erweiterung der Balmer-Formel für n=2) 1 1 2 2 n m R Ritz sches Kombinationsprinzip (1908) erlaubt Vorhersage der Frequenz Ritz‘sches weiterer Linien durch Addition oder Subtraktion 1897: J.J. Thomson (Nobelpreis 1906) entdeckt das Elektron Plumpudding- oder Rosinenkuchenmodell Experimente von Geiger, Marsden (1908): Rückstreuung und starke Ablenkung von -Teilchen (Helium-Kerne) durch Gold- und Silberfolien Atommodell von Rutherford (1911): Elektronen umkreisen planetenartig einen schweren Atomkern Problem: Kreisbewegung ist beschleunigte Bewegung Abstrahlung von Photonen (vgl. Synchrotron) Elektronen müssten spiralförmig in Kern stürzen größere Geschwindigkeit Photonen höherer Energie p kontinuierliches Spektrum minimale Energie: Elektron „sitzt“ auf Proton Nobelpreis 1906 Joseph p John Thomson The Nobel Prize in Physics 1906 was awarded to J.J. Thomson “in recognition of the great merits of his theoretical and experimental investigations on the conduction of electricity yg gases". by Nobelpreis 1908 Ernest Rutherford The Nobel Prize in Physics 1908 was awarded to Ernest Rutherford "for his investigations into the disintegration of the elements, and the chemistry of radioactive substances". B h ‘ h Atommodell Bohr‘sches At d ll Niels Bohr, Philosophical Magazine Series 6, Volume 26 July 1913, p. 1-25 Behauptung: es existieren stabile Umlaufbahnen, für die bestimmte (quantisierte)) Bedingungen (q g g g gelten Nobelpreis 1922 Niels Bohr The Nobel Prize in Physics 1922 was awarded to Niels Bohr "for his services in the investigation of the structure of atoms and of the radiation emanating from them". experimentelle Bestätigung des Bohr‘schen Atommodells: Versuch von Franck und Hertz (1913): Nobelpreis 1925 Gustav Ludwig Hertz James Franck The Nobel Prize in Physics 1925 was awarded jointly to James Franck and Gustav Ludwig Hertz "for their discovery of the laws governing the impact of an electron upon an atom“. Frequenz 1 eV = 1.6 x 10-19 J,, E = h