Laborinformation
Werbung

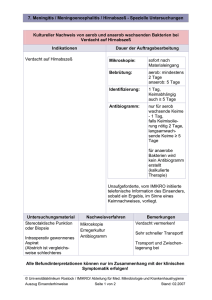
Laborinformation Gelenkpunktion – Gewinnung und notwendige Probengefäße Präanalytik Die Lokalanästhesie sollte nur bis subkutan gesetzt werden, da es sonst zur Verfälschung der Zellzahl sowie zu falsch negativen Kulturergebnissen kommen kann. Bei jedem Patienten mit Verdacht auf eine Low-grade Implantat-assoziierte Infektion sollte eine diagnostische Punktion (Kultur + Zellzahl/Zelldifferenzierung) vorgenommen werden. Bei normalen systemischen Infektparametern ist vor der Gelenkpunktion eine zweiwöchige Antibiotikapause einzuhalten. Entnahmetechnik – Empfehlungen: Die Punktion sollte unter möglichst keimarmen Bedingungen durchgeführt werden. Dies soll durch eine wirksame Desinfektion (alkoholbasiertes Mittel), steriles Abdecken, das Tragen von sterilen Handschuhen und den Gebrauch eines Mundschutzes gewährleistet werden. Es muss unbedingt vermieden werden, durch eine Hautläsion (Infektion, Psoriasis) zu punktieren! Prothetische Gelenke sollten ausschließlich im OP punktiert werden, da das Infektrisiko im Vergleich zum nativen Gelenk 100 000-fach erhöht ist. Idealerweise werden die im Rahmen der Punktion zu befüllenden Probengefäße angereicht. Die Gummistopfen der Blutkulturflaschen müssen vor dem Einbringen der Probe desinfiziert werden. Eine Stichinzision mittels Skalpell (11er Klinge) vermeidet einen Stanzzylinder mit der Punktionskanüle, der in das Gelenk geschoben werden könnte. Untersuchungsspektrum Zellzahl und Zellmorphologie haben insbesondere bei der Diagnostik von Implantat-assoziierten Infektionen einen hohen Stellenwert. Für die Untersuchung muss 1 ml Punktat in ein EDTA-Röhrchen eingebracht und durch mehrmaliges Schwenken des Röhrchens gemischt werden. Die Gramfärbung ist ein schnelldiagnostischer Parameter. Sie ist aber aufgrund der niedrigen Sensitivität von ca. 30 % nur im positivem Fall aussagekräftig. Für die aerobe und anaerobe Kultur gibt es je nach verfügbarer Punktatmenge zwei Möglichkeiten: → Verwendung von nativem Punktat (mind. 1 ml) → Probenentnahme in Blutkulturflaschen (mind. 1 ml je Flasche, ideal 3 ml je Flasche) Blutkulturflaschen bieten den Vorteil der automatisierten Verarbeitung. Es kann jedoch im Gegensatz zum Nativpunktat keine Quantifizierung des nachgewiesenen Erregers erfolgen. Kultur auf Mykobakterien: diese Untersuchung muss auf dem Probenbegleitschein extra angefordert werden. Molekularbiologische Untersuchung mittels PCR: die PCR hat insbesondere in der Diagnostik von Implantatassoziierten Infektionen Bedeutung. Sie verbessert den Nachweis von schwer kultivierbaren Erregern und reduziert die Untersuchungsdauer. Probengefäße Art EDTA-Röhrchen (violette Verschlusskappe) Steriles Röhrchen ohne Zusätze Blutentnahmeröhrchen o. Zusätze Spritze mit Verschlusskappe Blutkulturflaschen aerob/anaerob Untersuchung Mindestprobenmenge in ml Zwischenlagerung Bitte beachten! Zellzahl Zelldifferenzierung 1 ml 4-8°C Röhrchen nach dem Befüllen schwenken! Gramfärbung Kultur aerob Kultur anaerob 1 ml 4-8°C Kultur + PCR 2 ml Spritze immer OHNE Punktionsnadel einsenden! Kultur aerob Kultur anaerob 1-3 ml /Flasche Raumtemperatur Zuerst aerobe Flasche befüllen! Die Untersuchung des EDTA-Röhrchens erfolgt im klinisch-chemischen Labor. Füllen Sie dazu bitte einen eigenen Überweisungsschein/Probenbegleitschein aus. Bitte Punktat NICHT in Abstrichmedien einfüllen! November 2015 Laborinformation Gelenkpunktion – Gewinnung und notwendige Probengefäße Interpretation Zellzahl/Zelldifferenzierung Untersuchung Normal Gruppe 1 (degenerativ) Gruppe 2 (inflammatorisch) Gruppe 3 (Infektion/Kristalle) Leukozyten/µl < 200 200 – 2 000 2 000 – 20 000 > 20 000 % neutrophile Granulozyten < 25 25 - 70 70 – 90 > 90 Psoriasis Rheumatoide Arthritis Reaktive Arthritits Kollagenosen (SLE) Low Grade-Protheseninfektion November 2015