Thema: Chemie 1. GRUNDLAGEN DER CHEMIE 2
Werbung

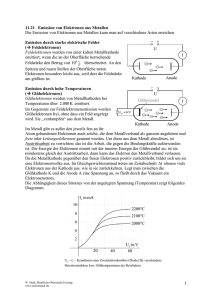
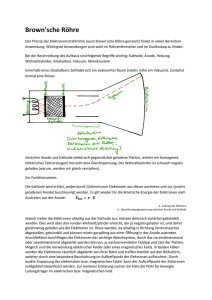
Thema: Chemie 1. GRUNDLAGEN DER CHEMIE 2 1.1 Stoffe 2 2 2 3 4 5 1.3 Bindungsarten 1.3.1 Atombindung 1.3.2 Polarisierte Atombindung 1.3.3 Metallbindung 5 6 6 7 1.4 Kohäsion, Adhäsion 7 1.5 Stoffgruppen 1.5.1 Oxide 1.5.2 Säuren 1.5.3 Basen 1.5.4 Neutralisation 1.5.5 pH – Wert 1.5.6 Salze 1.5.7 Carbide 1.5.8 Wichtige Elemente 7 7 7 8 9 9 9 9 10 pr ob e 1.2 Gemenge 1.2.1 Chemische Verbindungen 1.2.2 Elemente und Atome 1.2.3 Periodensystem 1.2.4 Molekühle 11 11 14 15 16 17 18 18 18 20 25 25 26 28 29 29 30 30 31 Le se 1.6 Elektro- Chemie 1.6.1 Elektrolyte, Dissoziation, Elektrolyse 1.6.2 Technische Anwendungen der Elektrolyse 1.6.3 Elektrochemisches Äquivalent 1.6.4 Spannungsreihe (galvanisches Element) 1.6.5 Galvanische Elemente 1.6.6 Elektrolytische Polarisation 1.6.7 Verschiedene Primärelemente 1.6.8 Galvanische Sekundärelemente 1.6.9 Entstehung von Bleiakkumulatoren 1.6.10 Wartung von Bleiakkumulatoren 1.6.11 Stahlakkumulatoren 1.6.12 Elektrisches Verhalten und elektrische Größen von elektrochemischen Elementen 1.6.13 Schaltung von elektrischen Spannungserzeugern 1.6.14 Parallelschaltung 1.6.15 Anpassungen 1.6.16 Korrosion 1.6.17 Arten von elektrochemischer Korrosion 1.6.18 Korrosionsschutz 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 1 von 34 Thema: Chemie Beispiel: Wasserstoff + Sauerstoff = Wasser Im Gegensatz dazu ist die Analyse die Zerlegung einer chemischen Verbindung. Beispiel: Wasser Quecksilberoxid = = Wasserstoff Quecksilber + + Sauerstoff Sauerstoff Chemische Reaktionen können Energie freisetzen oder welche verbrauchen. 1.2.2 Elemente und Atome Ein Element ist ein Stoff, dessen Atome die gleiche Kernladungszahl haben. Das bedeutet, ein Element ist ein Stoff, der chemisch nicht weiter zerlegt werden kann. + + Stoffe Schwefel Sauerstoff = = Eisensulfid Wasser pr ob Elemente Eisen Wasserstoff e Beispiel: Atome sind die kleinsten Teilchen der Elemente, sie sind auf chemischem Wege nicht mehr teilbar. Le se Protonen Elektronen Neutronen Atomkern K-Schale L-Schale In der Abbildung sieht man das Bohrsche Atommodel. Es besteht aus einem Atomkern, in dem die positiven Protonen und die neutralen Neutronen enthalten sind. Der Atomkern ist von 7 Schalen umgeben. Auf diesen Schalen sind die negativen Elektronen vertreten. Auf den Platz finden. K-Schale L-Schale M-Schale N-Schale O-Schale P-Schale Q-Schale = = = = = = = 2 8 18 32 32 32 32 Elektronen Elektronen Elektronen Elektronen Elektronen Elektronen Elektronen Die Schalen K und L müssen voll besetzt sein um die nächste Schale zu beginnen. Ab der Schale M reichen 8 Elektronen, damit die Schale als voll gilt. Stickstoff Atom Ein Atomkern kann man sich als kugelähnliches Gebilde vorstellen mit einem Durchmesser von ungefähr 10-14 m. 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 3 von 34 Thema: 1.2.4 Chemie Moleküle Moleküle bestehen aus mindestens 2 Atomen. Beispiel: 4H Wasserstoff + O2 + Sauerstoff = = 2 H2O Wasser Molekül 2 Mg Magnesium + O2 + Sauerstoff = = 2 MgO Molekül Magnesiumoxid Molekular vorkommende Elemente sind: 1.3 Sauerstoff; Wasserstoff; Stickstoff; Chlor Bindungsarten e Die lonenbindung kommt dadurch zustande, weil alle Atome die Edelgaskonfiguration anstreben, d.h. sie versuchen eine komplett besetzte Außenschale zu erhalten. pr ob Die Edelgase finden wir in der 8. Gruppe des Periodensystems. Atome mit 1-3, also wenig Elektronen auf der Außenschale, können diese leicht abgeben und Atome mit vielen (5-7) Elektronen auf der Außenschale können Elektronen aufnehmen, um die Edelgaskonfiguration zu erreichen. Durch dieses Aufnehmen und Abgeben von Elektronen entsteht ein ladungsmäßiges Ungleichgewicht, da die Anzahl der Protonen und Elektronen nicht mehr übereinstimmt. Elektronenabgabe: Elektronenaufnahme: Le se Daraus folgt: positiv geladenes Atom negativ geladenes Atom Es entstehen geladene Atome, diese bezeichnet man als Ionen. Protonenüberzahl: Elektronenüberzahl: positives Ion negatives Ion Beispiel: Natrium und Chlor Wenn das Element Natrium ein Elektron an des Element Chlor abgibt, erhalten beide Elemente die Edelgaskonfiguration und werden zu Ionen. Da sich aber positive und negative Ladungen anziehen, verbinden sich diese beiden Elemente zu einem Ionenkristall. Diese Ionenbindung heißt dann Natriumchlorid. Na+ + 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Cl- = Na+Cl- = NaCl Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 5 von 34 Chemie Minuspol Anode Minuspol Kathode Pluspol Kathode galvanisches Element "liefert" elektrischen Strom Elektrolysezelle "verbraucht" elektrischen Strom - Minuspol = Anode - Pluspol = Kathode pr ob Daraus folgt: Im galvanischen Element Pluspol Anode e Thema: In der Elektrolysezelle - Minuspol = Kathode - Pluspol = Anode Le se Bisher ging es um Elektrolysevorgänge, bei denen die Anode nicht angegriffen wird. Diese ist dann z.B. aus Platin, Iridium, Gold oder Tantal bzw. Kohlenstoff. Bei der technischen Nutzung der Elektrolyse wird bewusst ein Material verwendet, welches sich auflöst. Das in Lösung gegangene Material, scheidet sich dann an der Kathode nieder. Daher wird bei der Elektrolyse mit angreifbarer Anode die Anode auch als Lösungselektrode Kathode als Abscheidungselektrode bezeichnet. Bei der Elektrolyse kann an der Kathode Wasserstoff und an der Anode Sauerstoff abgeschieden werden. Ein Gemisch dieser Gase bildet das hochexplosive Knallgas. Der bei der Elektrolyse fließende Strom ist nicht der Strom welcher zur direkten Elektrolyse benötigt wird, sondern höher, d.h. bei der Elektrolyse wandelt sich ein Teil des Stromes in Wärme um, des Weiteren wird ein Teil bei der Zerlegung von Wasser benötigt. Der Nutzstrom ist demzufolge stets geringer als der Gesamtstrom. Das Verhältnis daraus wird auch als Stromausbeute bei der Elektrolyse genannt. 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 13 von 34 Thema: Chemie Die elektrochemisch abgeschiedene Stoffmasse ist umso größer, je größer das elektrochemische Äquivalent und je größer die im Stromkreis wandernde elektrische Ladung ist. Daraus ergibt sich das Faradayische Gesetz. Faradayische Gesetz: m c Q I t = = = = = m=c·I·t (mg/As · As = mg) abgeschiedene Stoffmasse elektrochemisches Äquivalent elektrische Ladung Stromstärke Zeit m=c·Q Beispiel: Welche Kupfermasse wird durch einen Gleichstrom I von Kupfersulfatlösung (CuSO4) in einer Zeit von t = 2h abgeschieden? 150A aus einer 1.6.4 mg 150A 2 3600s 355000mg 355g 0,355kg As pr ob m c I t 0,329 e geg: Cu++; I = 150A; t = 2h ges: m Spannungsreihe (galvanisches Element) Metall Le se Lithium Cäsium Kalium Kalzium Natrium Magnesium Aluminium Mangan Zink Chrom Eisen, Cadmium Kobalt Nickel Zinn Blei Kupfer Silber Quecksilber Gold Standartpotential in V - 3,05 - 3,02 - 2,92 - 2,76 - 2,71 - 2,34 - 1,67 - 1,05 - 0,76 - 0,56 - 0,44 - 0,28 - 0,23 - 0,14 - 0,12 +0,35 + 0,80 + 0,85 + 1,70 Unedel Edel Die Polarität und Höhe der Spannung jedes Metalls kann man in der Lösung seines Salzes bei festgelegter Konzentration bestimmen, und zwar gegenüber einer Elektrode die von Wasserstoff umspült ist (Normalelektrode bei 25°C und 1013mbar). 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 16 von 34 Thema: Chemie Vorgänge bei Entladen Entladestrom 2H+ 2e PbO2 -- SO 4 2H+ -- SO4 2H 2O PbSO4 e Schwefelsäure (H2SO4) ist in Wasserstoffionen (H+) und Säurerestionen (SO4--) dissoziiert. Blei (Pb) ist gegenüber dem Bleidioxid (PbO2) unedler. Zur Bleielektrode (Pb) wandern Säurerestionen (SO4--) => an der Elektrodenoberfläche bildet sich das unlösliche Bleisulfat (PbSO4), dabei bleiben Elektronen übrig => die Elektrode lädt sich negativ auf Wasserstoffionen (H+) bewegen sich zur Bleidioxidelektrode (PbO2). Bleidioxid, Wasserstoff und Schwefelsäure verbinden sich ebenfalls zu Bleisulfat (PbSO4), dabei werden Elektronen verbraucht. Die Elektrode lädt sich positiv auf. Schwefelsäure wird verbraucht und Wasser freigesetzt, Säuredichte und Säurekonzentration nehmen ab. Le se 4 pr ob PbSO - Elektrode + E lektrode 2e- Pb Vorgänge bei Laden + Ladegerät - Ladestrom 2ePbO2 PbSO4 + Elektrode 2H+ -SO4 2H+ Pb 2e- -- SO4 2H2O PbSO4 - Elektrode Zur negativen Elektrode (PbSO4) wandern Wasserstoffionen (H+). Chemische Reaktion ergibt Blei (Pb) und Schwefelsäure (H2SO4). Die dazu erforderlichen Elektronen kommen vom negativem Pol des Ladegerätes. Zur positiven Elektrode (PbSO4) gelangen Säurerestionen (SO4--). 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 21 von 34 Thema: Chemie RL << Ri Stromanpassung Bei der Stromanpassung erhält man einen hohen Laststrom. Der größte Teil der Quellenspannung fällt am Innenwiderstand der Spannungsquelle ab. Der Wirkungsgrad ist klein. 1.6.16 Korrosion Korrosion ist die Zerstörung (für den gedachten Verwendungszweck unbrauchbar werden) von Werkstoffen durch chemische oder elektrochemische Vorgänge. Entsprechend unterscheidet man zwischen chemischer und elektrochemischer Korrosion. Bei der allgemeinen Korrosion reagiert das Metall mit Sauerstoff zu einem Metalloxid. Die Korrosion ist ein Oxidationsvorgang und geht immer von der Metalloberfläche aus. Die chemische Korrosion entsteht im Zersetzen von Metallen durch Säuren, Laugen oder Salzlösungen und oxidieren durch Luftsauerstoff. Beispiel: pr ob e Qxidieren von erhitztem Stahl (Hammerschlag) Verbinden von Essigsäure mit Kupfer (Grünspan) Verbinden von schwefelhaltigen Gasen mit Silber (schwarzes Anlaufen von Silber) Zersetzen von Blei und Aluminium durch Laugen (z.B. gelöschten Kalkputz) Grundsätzlich sind glatte Oberflächen korrosionsbeständiger als raue, da sie dem Elektrolyten und dem Sauerstoff weniger Angriffsfläche bieten. Le se 1.6.17 Arten von elektrochemischer Korrosion 1.6.17.1 Berührungskorrosion (Kontaktkorrosion) Die Berührungskorrosion tritt an der Berührungsstelle von zwei verschiedenen Metallen in Verbindung mit einem Elektrolyten auf, d.h. es entsteht ein kurzgeschlossenes Element. Das unedle Metall geht in Lösung. Die Korrosion hängt von der Entfernung der beteiligten Metalle in der Spannungsreihe, von der Konzentration des Elektrolyten und der Löslichkeit des Luftsauerstoffs im Elektrolyten ab (wirkt als Depolarisator). Beispiel: Beim Übergang von einer Aluminiumleitung auf Kupferleitung in Verbindung mit Luftfeuchtigkeit entsteht Berührungskorrosion. Das Aluminium wird zerstört. Abhilfe: AlCu- Klemmen 1.6.17.2 Interkristalline Korrosion Interkristalline Korrosion tritt auf, wenn Metalle aus verschiedenen Kristallen bestehen (z.B. Legierungen, Stahl). 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 30 von 34 Thema: Chemie oder durch eine Spannungsquelle, die einen Schutzstrom in die gewünschte Richtung treibt, bewirken. Beispiel: Magnesium als Opferanode I Eisen-Öltank EisKathode en- Öltank als Magnesium als Magnes ium als aktive Opferanode als Katode e aktive Opferanode pr ob Das Magnesium bildet mit dem Eisen ein galvanisches Element. Durch den Kurzschluss auf der oderirdischen Seite fließt durch den Elektrolyten (Erdreich) ein Schutzstrom von der Opferanode zum Eisen. Die Opferanode wird hierbei in Lösung gehen. Le se z.B. Schutzstrom durch eine Gleichspannungsquelle Eisen-Öltank EisKathode en- Öltank als als Katode Graphitanode Magnesium als (Fremdstromanode) aktive Opferanode Bei dieser Anwendung wird eine Spannung an die Anode und die Kathode gelegt, damit der Strom vom edleren Graphit (Kohlenstoff) zum unedleren Eisen fließt. Hier wird der Anodenverbrauch sehr gering gehalten. Durch einen isolierenden Überzug auf dem zu schützenden Metall kann der Schutzstrom klein gehalten werden, da er nur noch die Stellen des Metalls schützen muss, an denen der Überzug (z.B. Bitumenmasse) nicht dicht gegen das Erdreich abschließt. Eine Besonderheit ist beim elektrischen Korrosionsschutz von Aluminium zu beachten. Das Aluminium muss als Anode verwendet werden, da der Anschluss an den Pluspol der Spannungsquelle die dort entstehende Oxidschicht durch den entstehenden Sauerstoff verstärkt. Am Minuspol würde der entstehende Wasserstoff diese Oxidschicht abbauen und damit das Aluminium freilegen. 01_01_Chemie_Elektrochemie_Dozent_V04.1.doc Dipl.-Ing. Michael Meering Marcel Hartmann Weitergabe sowie Vervielfältigung, Verbreitung und/oder Bearbeitung dieses Dokumentes, Verwertung und Mitteilung seines Inhaltes sind verboten, soweit nicht ausdrücklich gestattet. Zuwiderhandlungen verpflichten zu Schadenersatz. Alle Rechte für den Fall der Patenterteilung, Gebrauchsmuster- oder Geschmacksmustereintragung vorbehalten. Seite 33 von 34