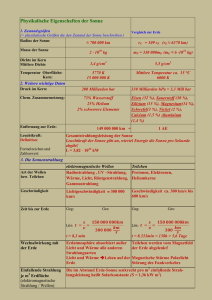
Ausarbeitung des Fragenkatalogs Medizinische Physik SS 08
Werbung

Medizinische Physik WS 07/08 und SS 08 Günther Schauberger Zusammenfassung von M-Th. Tschurlovits1 1 Kontakt: E-Mail: [email protected], Web: http://www.mth.at.tt Einleitung Diese Zusammenfassung wurde anhand des im SS 08 von Prof. Schauberger veröffentlichten Fragenkatalogs für die Diplomprüfung aus Medizinischer Physik erstellt. Die Inhalte (Text und Bilder) wurden größtenteils folgenden Quellen entnommen und wurden auch bei 1:1-Übernahme aus Zeitmangel nicht als direkte Zitate gekennzeichnet: − Schauberger, Günther: Vorlesungsfolien zu Grundlagen Medizinischer Physik (WS 07/08) − Schauberger, Günther: Vorlesungsfolien zu Medizinische Physik (SS 08) − Schneider, Gerold: Physik. Trauner Verlag, 2006 − Meyer, Lothar: Duden – Abitur Physik. Paetec, 2003 − Trautwein, Alfred: Physik für Mediziner, Biologen, Pharmazeuten. De Gruyter, 2004 − Wikipedia, die freie Enzyklopädie: http://de.wikipedia.org − Med4You: http://www.med4you.at/laborbefunde/techniken/lbef_techniken.htm − ChemgaPedia: http://www.chemgapedia.de/ 2/210 A Grundlagen 1 Freier Fall 1.1 Theorie als Modell Eine Theorie ist ein vereinfachtes Bild eines Ausschnitts der Realität. Das Bild dient zur Beschreibung und Erklärung des Ausschnitts der Realität. Die Theorie soll die Grundlage für Prognosen und Handlungsempfehlungen liefern. Jeder Theorie liegen mehr oder weniger deutlich formulierte Annahmen zugrunde. Es lassen sich Alltagstheorien und wissenschaftliche Theorien unterscheiden. Wissenschaftliche Theorien weisen einen höheren Grad von Bewusstheit, eine ausdrückliche Formulierung und einen größeren Umfang auf. Außerdem erfolgt oft eine systematische Beobachtung, die der empirischen Prüfung der Theorien dient. 1.2 Größen zur Beschreibung von Bewegungen 1.2.1 Ort Der Ort x an dem sich ein Körper befindet ist seine Lage in einem Bezugssystem zu einem bestimmten Zeitpunkt t. Darstellung: x-t-Diagramm 1.2.2 Weg Formelzeichen: s (Vektorielle Größe) SI-Einheit: Meter [m] Darstellung: Weg-Zeit-Diagramm, s-t-Diagramm Die Bahn eines Körpers wird aus allen Orten gebildet, die er bei seiner Bewegung durchlaufen hat. Bei der Bewegung eines Körpers auf einer Bahn legt er einen Weg zurück. Der Weg s gibt an, wie groß die Länge der Bahn zwischen zwei Orten bei einer Bewegung ist. Der Weg kann, muss aber nicht identisch mit der Ortsveränderung (beschrieben durch Ortsvektoren) sein. Bewegt sich ein Körper z.B. auf einer Kreisbahn legt er zwar einen Weg zurück, bei einem vollständigen Umlauf ist die Ortsveränderung aber null, da Startort und Zielort sind. 1.2.3 Geschwindigkeit Formelzeichen: v (Vektorielle Größe) SI-Einheit: Meter/Sekunde [m/s] Messung: Tachometer Die Geschwindigkeit v gibt an, wie schnell oder langsam sich ein Körper bewegt. 3/210 Durchschnittsgeschwindigkeit: Mittlere Geschwindigkeit, die sich aus dem Betrag des Weges und der dafür benötigten Zeit ergibt. Anstieg der Sekante durch zwei Punkte (Abstand Δt) eines Weg-Zeit-Diagramms. v ... Geschwindigkeit [m/s] Δs v= s ... Weg [m] Δt t ... Zeit [s] Momentangeschwindigkeit: Geschwindigkeit zu einem bestimmten Zeitpunkt. Anstieg der Tangente in einem Punkt eines Weg-Zeit-Diagramms. a ... Beschleunigung [m/s²] Δ s ds v = lim = = s' v ... Geschwindigkeit [m/s] Δt →0 Δt dt t ... Zeit [s] 1.2.4 Beschleunigung Formelzeichen: a (Vektorielle Größe) SI-Einheit: Meter/Sekunde² [m/s²] Messung: Beschleunigungsmesser Die Beschleunigung a gibt an, wie schnell oder langsam sich die Geschwindigkeit eines Körpers ändert. Bahnbeschleunigung: Beschleunigung, die sich auf Geschwindigkeitsänderungen längs einer Bahn bezieht. Sie ergibt sich aus der Änderung des Betrages der Geschwindigkeit längs der Bahn in einem Zeitintervall. Radialbeschleunigung: Beschleunigung, die durch die Änderung der Richtung der Geschwindigkeit eines Körpers zustande kommt. Mittlere Beschleunigung: Mittlere Beschleunigung, die sich aus dem Betrag der Geschwindigkeit in einem Zeitintervall ergibt. a ... Beschleunigung [m/s²] Δv a= v ... Geschwindigkeit [m/s] Δt t ... Zeit [s] Augenblicksbeschleunigung: Beschleunigung in einem sehr kleinen Zeitintervall. a ... Beschleunigung [m/s²] Δv dv d2s a = lim = = v ' = 2 = s '' v ... Geschwindigkeit [m/s] Δt →0 Δt dt dt t ... Zeit [s] 4/210 1.3 Bewegungsarten Abbildung 1: Übersicht über verschiedene Bewegungsarten 1.3.1 Gleichförmige Bewegung Gleichförmige geradlinige Bewegung Ein Körper bewegt sich auf einer geraden Bahn mit einer konstanten Geschwindigkeit. Beispiel: Packerl auf einem Förderband, Person auf einer fahrenden Rolltreppe Weg-Zeit-Diagramm: Weg und Zeit sind einander proportional. s ~ t bzw. s ... Weg [m] s = v ⋅ t + s0 v ... Geschwindigkeit [m/s] s = const t ... Zeit [s] t s0 ... Anfangsweg [m] 5/210 Abbildung 2: Im Weg-Zeit-Diagramm einer gleichförmigen geradlinigen Bewegung sind Weg und Zeit einander proportional, es ergibt sich eine Gerade. Diese entspringt bei nicht vorhandenem Anfangsweg dem Ursprung, ansonsten beginnt sie beim Wert des Anfangsweges auf der y-Achse. Der Anstieg ist gleich der Geschwindigkeit. Geschwindigkeit-Zeit-Diagramm: Der Quotient aus zurückgelegtem Weg und der dafür erforderlichen Zeit, d.h. die Geschwindigkeit, ist. v ... Geschwindigkeit [m/s] = const. s v= s ... Weg [m] t t ... Zeit [s] Abbildung 3: Geschwindigkeit-Zeit-Diagramm einer gleichförmigen geradlinigen Bewegung. Im Diagramm ergibt sich eine Gerade, die parallel zur Zeitachse t verläuft. Die Fläche unter der Kurve entspricht dem zurückgelegten Weg. Beschleunigung-Zeit-Diagramm: Die Beschleunigung längs der Bahn ist null. Im Diagramm ergibt sich daher eine Gerade, die mit der Zeitachse t zusammenfällt. 6/210 Abbildung 4: Beschleunigung-Zeit-Diagramm einer gleichförmigen geradlinigen Bewegung. Die Beschleunigung längs der Bahn ist null. Im Diagramm ergibt sich daher eine Gerade, die mit der Zeitachse t zusammenfällt. Gleichförmige Kreisbewegung Ein Körper bewegt sich mit dem gleichen Betrag der Geschwindigkeit auf einer Kreisbahn, der Bahngeschwindigkeit v [m/s]. v ... Bahngeschwindigkeit [m/s] = const. s 2π ⋅ r v= = = 2π ⋅ r ⋅ f s ... Weg [m] t τ t ... Zeit [s] r ... Radius [m] τ ... Periodendauer (Umlaufzeit) [s] f ... Frequenz [s-1] Eine gleichförmige Kreisbewegung lässt sich auch mit der Winkelgeschwindigkeit ω [s-1] beschreiben. ω ... Winkelgeschwindigkeit [s-1] = const. Δϕ 2π ω= = = 2π ⋅ f ϕ ... Winkel [ ] Δt τ t ... Zeit [s] τ ... Periodendauer (Umlaufzeit) [s] f ... Frequenz [s-1] Die Winkelgeschwindigkeit wird im Bogenmaß angegeben: π 360° 2π 180° π 90° 2 Zusammenhang zwischen Bahngeschwindigkeit und Winkelgeschwindigkeit: v = ω⋅ r v ... Bahngeschwindigkeit [m/s] ω ... Winkelgeschwindigkeit [s-1] r ... Radius [m] Da sich bei einer gleichförmigen Kreisbewegung ständig die Richtung der Geschwindigkeit ändert handelt es sich um eine beschleunigte Bewegung. Für diese Richtungsänderung ist eine Kraft erforderlich, die in Richtung Zentrum der Bewegung wirkt und eine Beschleunigung in diese Richtung hervorruft, die Zentripetalbeschleunigung. Sie ist immer senkrecht zur Bahngeschwindigkeit v und damit stets radial, d.h. in Richtung Kreismittelpunkt M gerichtet. 7/210 v2 = ω2 ⋅ r aR = r a R ... Zentripetalbeschleunigung [m/s²] v ... Bahngeschwindigkeit [m/s] r ... Radius [m] ω ... Winkelgeschwindigkeit [s-1] 1.3.2 Ungleichförmige Bewegung (Beschleunigte oder verzögerte Bewegung) Gleichmäßig beschleunigte geradlinige Bewegung Ein Körper bewegt sich mit einer konstanten Beschleunigung auf einer geraden Bahn. Weg-Zeit-Diagramm: Der zurückgelegte Weg ist dem Quadrat der Zeit proportional. s ... Weg [m] a s ~ t 2 bzw. s = t2 t ... Zeit [s] s a 2 = = const a ... Beschleunigung [m/s²] 2 t 2 Abbildung 5: Im Weg-Zeit-Diagramm einer gleichmäßig beschleunigten Bewegung ist der zurückgelegte Weg dem Quadrat der Zeit proportional. Es ergibt sich ein parabelförmiger Graph. Der Anstieg des Graphen ist gleich der Augenblicksgeschwindigkeit. Geschwindigkeit-Zeit-Diagramm: Die Geschwindigkeit ist der Zeit proportional. Der Quotient aus Geschwindigkeit und Zeit ist gleich der konstanten Beschleunigung. v = a⋅t v ~ t bzw. v ... Geschwindigkeit [m/s] a ... Beschleunigung [m/s²] = const. v = a = const t ... Zeit [s] t 8/210 Abbildung 6: Im Geschwindigkeit-Zeit-Diagramm einer gleichmäßig beschleunigten Bewegung ist die Geschwindigkeit der Zeit proportional. Es ergibt sich eine Gerade durch den Koordinatenursprung. Der Anstieg des Graphen ist gleich der Beschleunigung, die Fläche unter dem Graphen ist gleich dem zurückgelegten Weg. Mit Anfangsweg s0 und Anfangsgeschwindigkeit v0 : a 2 t + v0 ⋅ t + s0 2 v = a ⋅ t + v0 s= Beschleunigung-Zeit-Diagramm: Es ergibt sich eine Gerade die parallel zur tAchse verläuft. Die Fläche unter dem Graphen ist gleich der Geschwindigkeit. Abbildung 7: Beschleunigung-Zeit-Diagramm einer gleichmäßig beschleunigten Bewegung. Es ergibt sich eine Gerade die parallel zur t-Achse verläuft. Die Fläche unter dem Graphen ist gleich der Geschwindigkeit. 1.4 Freier Fall 1.4.1 Freier Fall ohne Reibung Der freie Fall ist eine gleichmäßig beschleunigte Bewegung, die durch das Schwerefeld der Erde bedingt ist: v ... Geschwindigkeit [m/s] dv = g = const t ... Zeit [s] dt g ... Erdbeschleunigung g = 9,81 m/s² Durch ein- bzw. zweimaliges Integrieren erhält man die Geschwindigkeit des Körpers bzw. den zurückgelegten Weg: 9/210 v = v0 + g ⋅ t s = s0 + v0 ⋅ t + v0 ... Anfangsgeschwindigkeit [m/s] s 0 ... Anfangsweg [m] g 2 2s t mit t = 2 g 1.4.2 Freier Fall mit Stokes-Reibung Für kleine Geschwindigkeiten ist der Luftwiderstand proportional zur Fallgeschwindigkeit: FR = −β ⋅ v FR ... Reibungskraft [kg m s-2] β ... Proportionalitätsfaktor [kg/s] v ... Geschwindigkeit [m/s] Beispiel: Blutsenkung (d.h. diese Gesetze sind auch auf Flüssigkeiten anwendbar) Differentialgleichung der Kräfte d 2s dv m 2 =m = mg − βv dt dt s ... Weg [m] t ... Zeit [t] v ... Geschwindigkeit [m/s] m ... Masse [kg] g ... Erdbeschleunigung g = 9,81 m/s² β ... Proportionalitätsfaktor [kg/s] Grenzgeschwindigkeit Die Grenzgeschwindigkeit ist die beim Freien Fall aufgrund der entgegengesetzt wirkenden Reibung maximal erreichbare Geschwindigkeit. mg v∞ ... Grenzgeschwindigkeit [m/s] v∞ = β m ... Masse [kg] g ... Erdbeschleunigung g = 9,81 m/s² β ... Proportionalitätsfaktor [kg/s] 1.4.3 Freier Fall mit Luftwiderstand (Turbulenter Fall) Bei höheren Geschwindigkeiten ist der Luftwiderstand proportional zum Quadrat der Fallgeschwindigkeit. Innerhalb der Luftströmung kann es auch zur Wirbelbildung kommen. FR ... Reibungskraft [kg m s-2] FR = −k ⋅ v 2 k ... Proportionalitätsfaktor [kg/m] v ... Geschwindigkeit [m/s] Beispiel: Fallschirmspringer 10/210 Differentialgleichung der Kräfte d 2s dv m 2 =m = mg − kv 2 dt dt s ... Weg [m] t ... Zeit [t] v ... Geschwindigkeit [m/s] m ... Masse [kg] g ... Erdbeschleunigung g = 9,81 m/s² β ... Proportionalitätsfaktor [kg/m] Grenzgeschwindigkeit v∞ = mg 1 mit k = c w ρA 2 k v∞ ... Grenzgeschwindigkeit [m/s] m ... Masse [kg] g ... Erdbeschleunigung g = 9,81 m/s² k ... Proportionalitätsfaktor [kg/m] c w ... Luftwiderstandsbeiwert [] ρ ... Dichte des Mediums [kg/m³] A ... Fläche des Körpers [m²] Luftwiderstandsbeiwert Dimensionsloses Maß für den Strömungswiderstand eines von einem Fluid (Gase, Flüssigkeiten) umströmten Körpers. 1.4.4 Anwendbarkeit der Gesetze Der Fall eines Steines aus 20 m Höhe oder der Sprung einer Person von einem 10-mTurm können als freier Fall betrachtet werden, da in diesen Fällen der Luftwiderstand vernachlässigt werden kann. Für einen am Fallschirm schwebenden Fallschirmspringer sind die Gesetze des freien Falls nicht anwendbar, weil in diesem Fall der Luftwiderstand nicht vernachlässigt werden kann. Auch für Regentropfen gelten die Gesetze des freien Falls nicht. So erreichen aufgrund des Luftwiderstandes ohne geöffneten Fallschirm aus großer Höhe fallende Menschen eine Geschwindigkeit von etwa 200 km/h, Regentropfen in unmittelbarer Nähe des Erdbodens je nach Größe eine Geschwindigkeit von bis zu 30 km/h. 11/210 Abbildung 8: In Luft fallen unterschiedliche Körper verschieden schnell. Pumpt man aus einer Röhre Luft aus, so fallen alle Körper gleich schnell. Abbildung 9: Bei einer Fallbewegung mit Luftwiderstand erreichen fallenden Körper eine maximale Geschwindigkeit. Die Gesetze des freien Falls sind dann nicht mehr anwendbar. 12/210 2 Funktionen 2.1 Konstante Funktion Funktion, die für alle Argumente stets denselben Funktionswert annimmt: y = f (x) = const Abbildung 10: Konstante Funktion 2.2 Lineare Funktion (Polynom 1. Ordnung) Der Graph einer linearen Funktion ist immer eine Gerade: y = f (x) = kx + d Der Proportionalitätsfaktor k gibt die Steigung der Geraden an, d den Abschnitt auf der y-Achse. Proportionalität Proportionalität besteht zwischen zwei Größen, wenn sie sich immer im gleichen Verhältnis ändern. Sie besteht wenn die eine Größe aus der anderen durch Multiplikation mit einem konstanten Faktor (Proportionalitätsfaktor) hervorgeht. Beispiel: Das Ohmsche Gesetz U = R ⋅ I beschreibt die Proportionalität von Spannung U und Stromstärke I bei konstantem Widerstand R (Proportionalitätsfaktor). 2.3 Quadratische Funktion (Polynom 2. Ordnung) Der Graph einer quadratischen Funktion ist eine Parabel: y = f (x) = ax 2 + bx + c Für a = 0 ergibt sich eine lineare Funktion. 13/210 Abbildung 11: Quadratische Funktion Beispiel: Beim Freien Fall ist der zurückgelegt Weg proportional zum Quadrat der g Zeit: s = t 2 2 Polynom Summe von Vielfachen von Potenzen einer Variablen x: n y = f (x) = a 0 + a1x + a 2 x 2 + ... + a n x n = ∑ a i x i i =0 Konstante Funktion: Lineare Funktion: Quadratische Funktion: y=a y = a + bx y = a + bx + cx 2 Potenzfunktion Funktion der Form: y = f (x) = x a Aus Potenzfunktionen mit natürlichem a werden Polynom-Funktionen zusammengesetzt. 2.4 Exponentialfunktion Funktion der Form: y = f (x) = a x Im Gegensatz zu den Potenzfunktionen, bei denen die Basis die Variable enthält, befindet sich bei Exponentialfunktionen die Variable im Exponenten (daher auch die Namensgebung). Als Exponentialfunktion im engeren Sinn wird die Exponentialfunktion mit der Eulerschen Zahl e ~ 2,72 als Basis bezeichnet: y = f (x) = e x = exp(x) 14/210 Unter Verwendung des Logarithmus lässt sich wegen der Identität a x = exp(x ⋅ ln a) jede Exponentialfunktion auf eine solche zur Basis e zurückführen. Abbildung 12: Exponentialfunktion Beispiel: Absorption von Strahlung, Radioaktives Zerfallsgesetz, Barometrische Höhenformel, Abkühlungsgesetz, Bakterienwachstum, Gedämpfte Schwingung Wachstums- und Schwächungsvorgänge Wachstums- bzw. Schwächungsvorgänge können mit Hilfe von Exponentialfunktionen beschrieben werden. Mit Hilfe der Exponentialfunktion können Vorgänge beschrieben werden, deren Änderung einer physikalischen Größe ΔN proportional zu dieser Größe N verläuft. Dabei ist c die Proportionalitätskonstante. Für ein Wachstum ist c > 0, für eine Schwächung ist c < 0. dN = c ⋅ N ⋅ dt ΔN = c ⋅ N ⋅ Δt N = N 0 exp(c ⋅ t) Radioaktives Zerfallsgesetz ⎛ ln 2 ⎞ A(t) = A 0 exp ⎜ − t⎟ ⎝ T1/2 ⎠ A 0 ... Ausgangsaktivität (Maßstab) A(t) ... Aktivität zum Zeitpunkt t T1/2 ... Halbwertszeit ln 2 − ... Formparameter (Steilheit) T1/2 15/210 Logarithmus Logarithmieren zu einem Exponenten entspricht der Suche nach dem Exponenten (der Hochzahl) bei einer festen Basis. Der Logarithmus ist die Umkehrung der Exponentialfunktion. Da die Werte der Exponentialfunktion immer positiv sind, ist der Logarithmus nur für positive Zahlen definiert. Abbildung 13: Logarithmus Logarithmische Darstellungen verwendet man, um sowohl sehr große Zahlenwerte und dazu vergleichbar sehr niedrige Zahlenwerte in einem Diagramm darstellen zu können. In manchen Fällen erhält man durch logarithmische Darstellung eine Linearisierung der Datenwerte. 16/210 2.5 Kreisfunktionen (Harmonische Funktionen) Die Funktionswerte der Funktionen Sinus und Cosinus wiederholen sich periodisch mit der kleinsten Periode τ = 2π . Abbildung 14: Sinus-Funktion Abbildung 15: Cosinus-Funktion Sinus: y = sin(x) sin(0) = 0 ⎛ 2π ⎞ y(t) = A m + A 0 sin ⎜ t + ϕ⎟ ⎝ τ ⎠ Cosinus: y = cos(x) cos(0) = 1 A m ... Mittelwert A 0 ... Amplitude τ ... Periodendauer τ = 1/ f ϕ ... Phasenlage f ... Frequenz f = 1/ τ 2π ω ... Kreisfrequenz ω = τ t ... Zeit Beispiel: Technische Wechselspannung ⎛ 2π ⎞ U(t) = U m + U 0 sin ⎜ t + ϕ⎟ ⎝ τ ⎠ U m = 0 ... Spannungsmittelwert U 0 = 2 ⋅ U eff ... Spannungsamplitude U eff = 220 V ... Effektivspannung τ = 0, 02 s ... Periodendauer τ = 1/ f ϕ = 0 ... Phasenlage f = 50 Hz ... Frequenz f = 1/ τ 2π ω ... Kreisfrequenz ω = τ t ... Zeit 2.6 Gedämpfte Schwingung Idealisierte Annahme einer harmonischen Schwingung Eine harmonische Schwingung ist eine idealisierte Annahme. Die rückstellende Kraft R ist proportional der Auslenkung A(t): R = c ⋅ A(t) 17/210 Es gibt keine Reibung, daher bleibt die Amplitude A0 unverändert: A(t) ... Auslenkung ⎛ 2π ⎞ A(t) = A 0 sin ⎜ t⎟ A 0 ... Amplitude ⎝ τ ⎠ τ ... Periodendauer τ = 1/ f t ... Zeit Gedämpfte Schwingung Bei einer gedämpften Schwingung wird ein Energieverlust (z.B. aufgrund von Reibung) berücksichtigt. Aufgrund der Reibung ändert sich die Amplitude A0 mit der Zeit. Die Einhüllende der gedämpften Schwingung entspricht einer Exponentialfunktion: A(t) ... Auslenkung ⎛ 2π ⎞ A(t) = A 0 sin ⎜ t ⎟ exp(−δt) A 0 ... Amplitude ⎝ τ ⎠ τ ... Periodendauer τ = 1/ f δ ... Dämpfungsfaktor t ... Zeit Abbildung 16: Gedämpfte Schwingung 18/210 3 Elektromagnetisches Spektrum 3.1 Begriff des Spektrums Messwertverteilung einer Messgröße in Abhängigkeit von der Wellenlänge oder der Frequenz. Der Begriff des Spektrums ist nicht mit dem visuellen Eindruck der Spektralfarben zu verwechseln. 3.2 Elektromagnetisches Spektrum (EMS) Das elektromagnetische Spektrum (EMS) beschreibt die verschiedenen Arten elektromagnetischer Wellen. Für jeden Bereich im Spektrum können folgende Werte angegeben werden: − Frequenz f [Hz]: Anzahl der Schwingungen pro Sekunde. − Wellenlänge λ [m]: Abstand zwischen zwei benachbarten Wellenbergen oder Wellentälern. − Photonenenergie E [eV]: Energie eines Photons. Abbildung 17: Das elektromagnetische Spektrum Art der Wellen Ionisierende Strahlung Gammastrahlung Röntgenstrahlung Ultraviolette Strahlung UVC UVB UVA Sichtbare Strahlung Infrarot Strahlung (Wärmestrahlung) IRA IRB IRC Mikrowellen, Radar Rundfunk Wechselströme Wellenlänge λ [m] 100 fm – 1 pm 1 pm – 100 nm (z.B. 0,3 – 3 nm) 100 – 280 nm 280 – 320 nm 320 – 380 nm 380 – 780 nm (z.B. 10 μm) 780 – 1400 nm 1400 – 3000 nm 3000 nm – 1 mm 1 mm – 1 dm (z.B. 10 cm) 1 dm – 10 km > 10 km 19/210 Elektromagnetische Wellen haben eine elektrische Feldstärke E und eine magnetische Feldstärke H, die aufeinander normal stehen und mit gleicher Frequenz schwingen. Lichtgeschwindigkeit Die Lichtgeschwindigkeit c0 im Vakuum ist die größte Geschwindigkeit mit der Energie übertragen werden kann. Die Lichtgeschwindigkeit im Medium ist kleiner als die Vakuumlichtgeschwindigkeit. Brechzahl Die Brechzahl n ist der Quotient aus Vakuumlichtgeschwindigkeit c0 und Mediumlichtgeschwindigkeit c. Die Brechzahl kennzeichnet die Brechung (Richtungsänderung) und das Reflexionsverhalten (Reflexion und Totalreflexion) einer elektromagnetischen Welle beim Auftreffen auf eine Grenzfläche zweier Medien. n ... Brechzahl der Materie [] c n= 0 c0 = 2,998.108 m/s ... Vakuumlichtgeschwindigkeit c c ... Mediumlichtgeschwindigkeit [m/s] Stoff Vakuum Luft Eis Wasser Quarzglas Diamant Brechzahl 1 nahezu 1 1,31 1,33 1,45 2,41 Photonenenergie Elektromagnetische Wellen entstehen bei Bewegung (elektrische Ströme) und beim Abbremsen elektrischer Ladungen (Elektronen). Elektromagnetische Wellen transportieren Energie in Form von Photonen. Die Photonenenergie EP ist direkt proportional der Frequenz f der Welle aber indirekt proportional der Wellenlänge λ. Sichtbare Strahlung hat eine Photonenenergie von 3,1-1,6 eV. Ein Elektronenvolt entspricht 1,6.10-19 J. EP ... Photonenenergie [eV] c EP = h ν = h h = 6,626.10-34 Js ... Planksches Wirkungsquantum λ ν ... Frequenz [Hz] c ... Mediumlichtgeschwindigkeit [m/s] λ ... Wellenlänge [m] Die Sonne ist die energiereichste Quelle elektromagnetischer Wellen für die Erde. Als Solarkonstante, ca. 1350 W/m², wird der Energiefluss auf die äußere Atmosphäre pro Quadratmeter pro Sekunde 20/210 Zusammenhang Wellenlänge und Frequenz Wellenlänge λ und Frequenz f hängen folgendermaßen zusammen: c=λν c ... Mediumlichtgeschwindigkeit [m/s] λ ... Wellenlänge [m] ν ... Frequenz [Hz] Wellenzahl Die Wellenzahl ν ist der Kehrwert der Wellenlänge λ und beschreibt die Anzahl der Wellen pro Zentimeter: ν ... Wellenzahl [cm-1] 1 ν= λ ... Wellenlänge [cm] λ 3.3 Arten von Spektren 3.3.1 Emissionsspektrum vs. Absorptionsspektrum Emissionsspektrum Ein Elektron kann durch Zufuhr von Energie (Wärme, Licht, Stoß) auf eine energiereichere Bahn angehoben werden. Nach kurzer Zeit fällt das Elektron von selbst auf eine stabilere energieärmere Bahn zurück. Dabei wird genau jene Energie in Form eines Photons abgegeben, die dem Energieunterschied der beiden Stufen entspricht. Da nur gewisse stoffabhängige Energiedifferenzen möglich sind entsteht ein Linienspektrum. Die Spektren aller Atome sind Linienspektren, die meist aus mehreren Spektrallinien bestehen, und sind charakteristisch für eine spezielle Atomart. Die Spektren von glühenden Gasen bestehen aus charakteristischen farbigen Linien (Linien- oder Atomspektrum) oder aus hellen Streifen (Molekül- oder Bandenspektrum). Aus dem Licht, das ein Gas aussendet, kann daher auf seine Zusammensetzung mit Hilfe der Spektralanalyse geschlossen werden. Absorptionsspektrum Bestrahlt man Gase mit Licht, so werden Elektronen der Gasatome in höhere Energiestufen angehoben. Diese Energien werden dem eingestrahlten Licht entzogen. Das Spektrum des Lichts weist daher an diesen Stellen dunkle Linien auf. Jedes Gas absorbiert dabei genau die Wellenlänge, die es auch emittieren kann. 3.3.2 Linien-, Banden- vs. kontinuierliches Spektrum Kontinuierliches Spektrum Ein kontinuierliches Spektrum enthält keine diskreten Linien (Banden), da es Licht in allen aufweist. Kontinuierliche Spektren werden von glühenden festen Körpern sowie von Gasen unter hohem Druck ausgesendet. Temperaturstrahler (Glühlichtquellen) emittieren kontinuierliche Spektren. Reale Temperaturstrahler besitzen diskrete Lücken im kontinuierlichen Spektrum, die durch Selbstabsorption entstehen, z. B. die so genannten Fraunhoferschen Linien im Sonnenspektrum. Beispiel: Sonne 21/210 Bandenspektrum Ein Bandenspektrum ist ein Spektrum elektromagnetischer Strahlung, das aus vielen nahe beieinander liegenden (bei atomaren Gasen) oder überlappenden Spektrallinien (bei molekularen Gasen) besteht. Linienspektrum Das Spektrum besteht aus einzelnen scharf begrenzten Linien denen eindeutig eine bestimmte Wellenlänge zugeordnet werden kann. Linienspektren werden von heißen Gasen geringerer Dichte ausgesendet. Gasentladungslampen emittieren diskontinuierliche Spektren. Beispiel: Quecksilberdampf-Lampe 3.4 Prismen vs. Gitterspektrum Prismenspektrum Ein Prismenspektrum (Dispersionsspektrum) entsteht durch Brechung und Dispersion. Gitterspektrum Das Gitterspektrum (Beugungsspektrum) entsteht durch Beugung und Interferenz. 3.5 Temperaturstrahler Jeder Körper, dessen Temperatur über dem absoluten Nullpunkt liegt sendet Wärmestrahlung aus. Ein Schwarzer Körper ist ein idealisierter Körper, der die gesamte auftreffende Strahlung absorbieren kann (Absorptionsgrad = 1). 3.5.1 Stefan-Boltzmann-Gesetz Dieses Gesetz gibt an welche Strahlungsleistung P [W] ein Schwarzer Körper der Fläche A und der absoluten Temperatur T emittiert. Die Strahlungsleistung eines Schwarzen Körpers ist also proportional zur vierten Potenz seiner absoluten Temperatur: eine Verdopplung der Temperatur bewirkt, dass die abgestrahlte Leistung um den Faktor 16 ansteigt. P ... Strahlungsleistung [W] P = A σ T4 A ... Fläche des Körpers [m²] σ = 5,67.10-8 W/(m² K4) ... Stefan-Boltzmann-Konstante T ... Absolute Temperatur [K] 3.5.2 Kirchhoffsches Strahlungsgesetz Ein schwarzer Körper kann im thermischen Gleichgewicht gleich viel Energie absorbieren wie emittieren. Ein realer Körper kann bei keiner Wellenlänge mehr thermische Strahlung aussenden als ein Schwarzer Körper, der daher eine ideale thermische Strahlungsquelle darstellt. Eine schwarze Fläche heizt sich im Sonnenlicht leichter auf als eine weiße, dafür gibt sie die Wärmestrahlung leichter ab. 22/210 Leslie-Würfel Der Lesliewürfel hat vier unterschiedliche Seitenflächen: schwarz, weiß, matt, spiegelnd. Der Würfel wird auf ca. 100°C erwärmt, indem kochendes Wasser eingefüllt, und dann die Wärmeabstrahlung mit einem Infrarotsensor gemessen wird. Dabei erkennt man, dass die schwarze Fläche stärker strahlt als die spiegelnde. Die matte Oberfläche absorbiert und emittiert hingegen mehr als die glatte Oberfläche und die weiße Fläche scheint identisch mit der schwarzen Fläche zu emittieren. Der spektrale Verlauf der abgestrahlten Energie wird durch das Plancksche Strahlungsgesetz beschrieben. 3.5.3 Plancksches Strahlungsgesetz Dieses Gesetz beschreibt die Verteilung der Strahlungsintensität der elektromagnetischen Energie (bzw. die Dichteverteilung aller Photonen) auf die einzelnen Wellenlängen eines schwarzen Körpers bei einer bestimmten Temperatur. Sie weist ein deutliches Maximum auf, dessen Lage mit dem wienschen Verschiebungsgesetz berechnet werden kann. 3.5.4 Wiensches Verschiebungsgesetz Dieses Gesetz beschreibt die Lage des Intensitätsmaximums eines Schwarzen Körpers bei einer bestimmten Temperatur. Je höher die Temperatur eines Körpers ist, desto kürzer ist die Wellenlänge, bei der das Intensitätsmaximum ausgesandt wird. Beispiel: Stahl gibt bei Raumtemperatur unsichtbares infrarotes Licht als „Wärmestrahlung“ ab, warmer glühender Stahl leuchtet dunkelrot, heißer flüssiger Stahl glüht fast weiß. 23/210 4 Ionisierende Strahlung 4.1 Radioaktivität Unter Radioaktivität versteht man den spontanen Zerfall instabiler Atomkerne (Radionuklide) unter Abgabe radioaktiver Strahlung: − Natürliche Radioaktivität: In der Natur vorkommende Radionuklide − Künstliche Radioaktivität: Künstlich erzeugt Radionuklide Die Atomkerne zerfallen um in ein niedrigeres, stabileres Energieniveau überzugehen und wandeln sich dadurch in andere Kerne um: − α-Zerfall: Aussendung von Kernteilchen − β-Zerfall: Umwandlung von Kernteilchen − γ-Zerfall: Umorientierung von Kernteilchen − Kernspaltung: Zerbrechen des Kern 4.2 Radioaktive Strahlung Bei allen Kernumwandlungen tritt radioaktive Strahlung auf. Durchdringungsvermögen Das Durchdringungsvermögen radioaktiver Strahlung ist abhängig von: − Art der Strahlung: Das Durchdringungsvermögen von α-, β- und γ-Strahlung beträgt etwa 1:100:10.000 − Energie der Strahlung − Art des durchstrahlten Stoffes − Dicke des durchstrahlten Stoffes Eigenschaften radioaktiver Strahlung − Sie ist energiereich − Sie kann Stoffe durchdringen − Sie wird durch Stoffe teilweise absorbiert (siehe Durchdringungsvermögen) − Sie breitet sich von einer Strahlungsquelle geradlinig aus 4.2.1 Alpha-Strahlung − Die Strahlung besteht aus doppelt positiv geladenen Heliumkernen (2 Protonen, 2 Neutronen), den α-Teilchen. − Aufgrund ihrer positiven Ladung sind die Teilchen durch elektrische und magnetische Felder ablenkbar. − Sie besitzt ein diskretes Energiespektrum und hat normalerweise eine Energie kleiner als 10 MeV. α-Zerfall − α-Zerfall tritt vor allem bei schweren Kernen (Massenzahl A > 170) auf. − Da beim α-Zerfall ein Heliumkern aus dem Atomkern geschleudert wird nimmt die Massenzahl des Atoms um 4, die Kernladungszahl um 2 ab. − Einige leichte Kerne können in zwei bzw. drei α-Teilchen zerfallen. 24/210 4.2.2 Beta-Strahlung − Die Strahlung besteht aus negativ geladenen Elektronen (β--Strahlung) oder positiv geladenen Positronen (β+-Strahlung), die annähernd mit Lichtgeschwindigkeit von radioaktiven Atomkernen ausgesendet werden. − Obwohl am Anfang und am Ende des Zerfallsprozesses diskrete Energieniveaus stehen ist das Energiespektrum kontinuierlich. − Die Energieverteilungsfunktion (x: Energie [MeV], y: Anzahl der β-Teilchen) beginnt etwa im Koordinatenursprung, erreicht ein Maximum (z.B. 400 keV für 40 19 K ) und schneidet die x-Achse bei der drei- bis vierfachen Energie des Maximums. Es existiert daher eine Maximalenergie. − Diese Energieverteilungsfunktion lässt sich dadurch erklären, dass neben Restkern und β-Teilchen noch ein weiteres ungeladenes Teilchen, das (Anti)Neutrino, existiert. β−-Zerfall − β−-Zerfall tritt bei Kernen mit relativ hohem Neutronenüberschuss auf. − Das emittierte Elektron entsteht bei der Umwandlung eines Neutrons in ein Proton: Neutron → Proton + Elektron + Antineutrino − Die Massenzahl bleibt gleich, die Kernladungszahl erhöht sich um 1. β+-Zerfall − β−-Zerfall tritt bei Kernen mit relativ hohem Protonenüberschuss auf (entstehen bei künstlichen Kernumwandlungen). − Das emittierte Proton entsteht bei der Umwandlung eines Protons in ein Neutron: Proton → Neutron + Positron + Neutrino − Die Massenzahl bleibt gleich, die Kernladungszahl nimmt um 1 ab. 4.2.3 Gamma-Strahlung − Die Strahlung besteht aus elektromagnetischen Wellen mit äußerst kurzer Wellenlänge (Photonen). − Sie ist nicht durch elektrische oder magnetische Felder ablenkbar. − Die Strahlung ist eine Begleiterscheinung des α- oder β-Zerfalls. Durch den spontanen oder erzwungenen Kernzerfall entstehen angeregte Nuklide. − Durch die Aussendung von γ-Strahlung geht der Atomkern von einem angeregten in einen energieärmeren Zustand über. − Die Strahlung weist ein Linienspektrum mit wenigen scharfen Linien auf. − Es handelt sich um elektromagnetische Strahlung mit einer Energie von mehr als einigen keV und Wellenlängen von 10-16 – 10-11 m. 4.3 Zerfallsreihen Die beim radioaktiven Zerfall entstehenden neuen Atomkerne sind in der Regel selber wieder radioaktiv. Dabei entstehen drei natürliche Zerfallsreihen mit Uranoder Thorium-Isotopen als Ausgangskernen. Die vierte Reihe beginnt mit dem 25/210 künstlich hergestellten Neptunium-Isotop: 206 − Uran-Radium-Reihe: 238 92 U → 82 Pb − Uran-Aktinium-Reihe: − Thorium-Reihe: Th → 232 90 − Neptunium-Reihe: 237 93 U→ 235 92 208 82 207 82 Pb Pb Np → 209 83 Bi Außerhalb der Zerfallsreihen gibt es in der Natur nur noch wenige radioaktive Isotope. Nuklid Ein Nuklid ist ein durch Massenzahl und Kernladungszahl eindeutig charakterisierter Atomkern. 4.3.1 Nuklidkarte Auf einer Nuklidkarte werden alle bekannten Atomkerne vergleichend dargestellt. Es sind über 2500 Nuklide bekannt wovon lediglich ca. 260 stabil sind. Kerne mit Neutronen- oder Protonenüberschuss zerfallen und sind daher radioaktiv. Auf der x-Achse wird die Anzahl der Neutronen auf der yAchse die Anzahl der Protonen aufgetragen: − Isotope: Kerne mit gleicher Protonenzahl (Reihen) − Isotone: Kerne mit gleicher Neutronenzahl (Spalten) − Isobare: Kerne mit gleicher Massenzahl (Diagonalen, N = Z) 4.3.2 Nuklidgenerator Nuklidgeneratoren dienen der Erzeugung von kurzlebigen Gammastrahlern für die in vivo-Diagnostik. Sie bestehen aus einer Chromatographiesäule auf deren Matrix eine längerlebige radioaktive Vorstufe (das Mutternuklid) fixiert ist. Durch laufenden radioaktiven Zerfall des Mutternuklids entstehen Tochternuklide, die aus der Säule eluiert werden. Abbildung 18: Nuklidgenerator 4.4 Zerfallsgesetz Der Zerfall eines bestimmten Atomkerns lässt sich nicht vorhersagen, er erfolgt nach statistischen Gesetzen. Wegen der großen Zahl der in einer bestimmten Stoffmenge enthaltenen Atome lässt sich ein Zerfallsgesetz formulieren. Die Anzahl der in der Zeitspanne Δt zerfallenden Kerne ΔN ist zur Zahl der noch vorhandenen Kerne N proportional. Die Anzahl der noch zerfallsfähigen Kerne nimmt mit der Zeit ab (negatives Vorzeichen): ΔN = −λ ⋅ N ⋅ Δt N ... Anzahl der noch zerfallsfähigen Kerne dN = −λ ⋅ N ⋅ dt λ ... Stoffabhängige Zerfallskonstante t ... Zeit [s] 26/210 4.4.1 Zerfallsgesetz Durch Integration des zuvor aufgestellten Zusammenhangs erhält man das radioaktive Zerfallsgesetz, das die zeitliche Abnahme der zerfallsfähigen Kerne durch eine Exponentialfunktion beschreibt: N ... Anzahl der noch zerfallsfähigen Kerne nach Zeit t N(t) = N 0 exp(−λ t) N0 ... Anzahl der zerfallsfähigen Kerne zu Beginn λ ... Stoffabhängige Zerfallskonstante t ... Zeit [s] 4.4.2 Aktivität Die Aktivität eines radioaktiven Stoffes ist die Anzahl der Kernzerfälle pro Zeiteinheit. SI-Einheit: Zerfall/Sekunde [Bq] [s-1] Veraltete Einheit: 1 Ci = 3,7.1010 Bq A ... Aktivität nach Zeit t A(t) = A 0 exp(−λ t) A0 ... Aktivität zu Beginn λ ... Stoffabhängige Zerfallskonstante t ... Zeit [s] Die Aktivität des menschlichen Körpers (ca. 70 kg) beträgt ca. 3700 Bq und stammt vor allem aus dem Zerfall von 40K und 14C. Die Aktivität in Gebäuden variiert zwischen 100 und 1000 Bq und stammt vor allem aus dem Zerfall von 222Rn, einem α-Strahler der 238U-Zerfallreihe und seinen Zerfallsprodukten. Zusammenhang zwischen Aktivität und Zerfallsgesetz A ... Aktivität nach Zeit t dN A(t) = − =λ N N ... Anzahl der zerfallsfähigen Kerne dt dN ... Zeitliche Änderung der zerfallsfähigen Kerne dt ... Zeitliche Veränderung [s] λ ... Stoffabhängige Zerfallskonstante 4.4.3 Zerfallsgesetz: Mutter-Tochter Beim radioaktiven Zerfall zerfallen instabile Atomkerne unter Aussendung radioaktiver Strahlung in andere Atomkerne, die wiederum instabil sein können und somit weiter zerfallen, usw.: λ1 λ2 Mutter ⎯⎯→ Tochter ⎯⎯→ Enkel Das Zeitgesetz der Mutter bleibt dabei unverändert, d.h. der Zerfall des Mutternuklids wird nicht durch das Tochternuklid beeinflusst. Im Gegensatz dazu wird das Zeitgesetz der Tochter durch die Speisung aus dem Zerfall der Mutter modifiziert, da zur Anzahl der zerfallsfähigen Kerne des Tochternuklids immer wieder neue Kerne aus dem Zerfall des Mutternuklids hinzukommen. 27/210 Grenzfall sehr langlebige Mutter In diesem Fall ist die Zerfallskonstante der Mutter sehr viel kleiner als die der Tochter ( λ M << λ T ) bzw. die weist die Mutter eine sehr viel höhere Halbwertszeit auf als die Tochter ( T1/2 M >> T1/2 T ). D.h. das Tochternuklid zerfällt sehr viel schneller als das Mutternuklid. Daher dominiert der Zerfall des Tochternuklids. Langsamer Zerfall Mutternuklid Schneller Zerfall Tochternuklid Grenzfall sehr langlebige Tochter In diesem Fall ist die Zerfallskonstante der Mutter sehr viel größer als die der Tochter ( λ M >> λ T ) bzw. weist die Mutter eine viel kleinere Halbwertszeit auf als die Tochter ( T1/2 M << T1/2 T ). D.h. das Mutternuklid zerfällt sehr viel schneller als das Tochternuklid. Daher dominiert der Zerfall des Mutternuklids. Schneller Zerfall Mutternuklid Langsamer Zerfall Tochternuklid 4.4.4 Halbwertszeit Physikalische Halbwertszeit Diejenige Zeitspanne, die statistisch verstreicht, bis die Menge eines bestimmten radioaktiven Nuklids auf die Hälfte gesunken ist, das heißt sich in andere Atome umgewandelt hat. Für jedes Nuklid ist die Halbwertszeit eine Konstante (z.B. für 137Cs 30,2 Jahre): ln(2) λ ... Zerfallskonstante T1/2 = λ Biologische Halbwertszeit Tbiol (Eliminationshalbwertszeit) Bezeichnet die Zeitspanne in welcher in einem biologischen Organismus der Gehalt einer inkorporierten radioaktiven, toxischen oder pharmazeutischen Substanz durch die Wirkung aller beteiligten biologischen und physikalischen Prozesse (Stoffwechsel, Ausscheidung, radioaktiver Zerfall, etc.) auf die Hälfte abgesunken ist. Effektive Halbwertszeit Teff Die effektive Halbwertszeit setzt sich aus der physikalischen und der biologischen Halbwertszeit zusammen. Durch Elimination führen beide gemeinsam zur Abnahme der Aktivität im Organismus: Teff ... Effektive Halbwertszeit 1 1 1 = + Tbiol ... Biologische Halbwertszeit Teff Tbiol T1/2 T1/2 ... Physikalische Halbwertszeit 28/210 4.5 Kosmische Höhenstrahlung Die Kosmische Höhenstrahlung wurde von dem österreichischen Physiker Victor Hess entdeckt wofür er 1936 den Nobelpreis erhielt. Bestandteile Die kosmische Höhenstrahlung ist eine hochenergetische Teilchenstrahlung aus dem Weltall. Sie besteht aus 87 % Protonen, 12 % α-Teilchen und 1 % schweren Atomkernen. Einen geringen Anteil stellen Elektronen, Neutrinos und γ-Strahlung. Die Häufigkeit der Atomkerne entspricht ungefähr der Elementhäufigkeit der Sonne. Die Verteilung der Teilchenzahl N in Abhängigkeit von der Energie E folgt einem Potenzgesetz. Entstehung Primäre Teilchen dringen in die Atmosphäre ein und reagieren mit den Atomkernen der Lufthülle (ca. 1000 Teilchen pro Quadratmeter und Sekunde). Es resultiert ein kaskadenartiger Teilchenschauer aus dem sich Sekundärteilchen als Reaktionsprodukte weiterer Wechselwirkungen nahezu mit Lichtgeschwindigkeit auf die Erdoberfläche zu bewegen. Da alle Teilchen ungefähr die gleiche Geschwindigkeit befinden sich die Teilchen innerhalb einer Kugelschale mit einer Dicke von ca. einem Meter. Die Ausdehnung der Kugelschale beträgt abhängig von der Energie des Primärteilchens wenige hundert Meter. Nur ein geringer Teil der Sekundärteilchen erreicht auch wirklich die Erdoberfläche. 4.6 Messung von radioaktiver Strahlung Man unterscheidet die Zählrate (gemessene Impulse/s) von der tatsächlichen Aktivität (Zerfälle/s). Der Wirkungsgrad eines Messgerätes entspricht dem Verhältnis der Zählrate zur tatsächlichen Aktivität. Beispiel: Werden bei einer Aktivität von A = 100 Bq nur 2 Impulse/s registriert (d.h. Registrierung jedes 50. Quants) entspricht das einem Wirkungsgrad von 2 %. 4.6.1 Geiger-Müller-Zählrohr (Geigerzähler) Der Geigerzähler besteht aus zwei Elektroden, einem zylindrischen Metallrohr und einem in der Achse des Rohres gespannten Draht. Zwischen Draht und Metallrohr wird eine elektrische Spannung angelegt. Im Inneren der Kammer befindet sich meist ein Edelgas mit einem Zusatz einer organischen Verbindung. 29/210 Abbildung 19: Geiger-Müller-Zählrohr (Geigerzähler) Gelangt nun radioaktive Strahlung durch ein dünnes Fenster in das Zählrohr so ionisiert sie eine von ihrer Energie abhängige Anzahl von Gasatomen. Diese Ionen werden im elektrischen Feld beschleunigt und durch Stoßionisation vervielfacht. Die Elektronen wandern im elektrischen Feld auf den Draht (+) zu, die positiven Ionen zur Rohrwand (-). Die Ladung wird über einen hohen Widerstand abgeleitet. Jedes elektrische geladene Teilchen erzeugt einen Stromstoß. Die Stromstöße können gezählt und über einen Verstärker als „Knacken“ hörbar gemacht werden. 4.6.2 Szintillationszähler Als Szintillationszähler bezeichnet man ein auf der Szintillation basierendes Messgerät zur Bestimmung der Energie und der Intensität von ionisierender Strahlung. Abbildung 20: Szintillationszähler Trifft ein energiereiches Teilchen oder γ-Quant auf einen Szintillationskristall (z.B. NaJ) wird seine kinetische Energie fast vollständig auf die Kristallatome übertragen wodurch die Kristallatome angeregt werden. Von diesen angeregten Kristallatomen 30/210 wird bei der Rückkehr in den Normalzustand Licht ausgestrahlt. Diese schwachen Lichtblitze werden mit Hilfe eines Fotomultipliers verstärkt. Dabei stoßen die Photonen des Lichtblitzes in einer Hochvakuumröhre auf eine Fotokatode und lösen dort Elektronen heraus. Diese werden in einem elektrischen Feld beschleunigt und treffen auf eine erste Anode (Dynode). Hier werden Sekundärelektronen herausgelöst (Vervielfachung), die wiederum beschleunigt werden, auf eine weitere Anode treffen, usw. Auf diese Weise wird der Elektronenstrom verstärkt. Die an einem nachgeschalteten Widerstand gemessene Spannung ist proportional zur Energie des ursprünglichen γ-Quants. Ein nachgeschalteter Impulshöhenanalysator kann so eingestellt werden, dass er nur für Spannungsimpulse eines bestimmten Bereichs Signale liefert. 4.7 Röntgenstrahlung 4.7.1 Entstehung der Röntgenstrahlung Wenn elektrische Ladungen beschleunigt oder abgebremst werden entsteht elektromagnetische Strahlung. Je größer die Beschleunigung ist umso größer ist die Frequenz der entstehenden Strahlung (bzw. umso kürzer die Wellenlänge). Lässt man nun Elektronen, ausgehend von einer Kathode (-), mit großer kinetischer Energie von mehreren keV auf eine Metalloberfläche, die Anode (+), auftreffen so werden sie abrupt abgebremst. Es entsteht eine kurzwellige elektromagnetische Strahlung, die Röntgenstrahlung. 4.7.2 Aufbau der Röntgenröhre Die von einer Glühkathode emittierten Elektronen werden im elektrischen Feld zwischen Kathode (-) und Anode (+) beschleunigt und beim Auftreffen auf die Anode stark abgebremst wodurch Röntgenstrahlung (Bremsstrahlung) entsteht. Abbildung 21: Aufbau einer Röntgenröhre: X ... Röntgenstrahlung, K ... Kathode, A ... Anode, C ... Wasserkühler, Uh ... Kathodenheizspannung, Ua ... Anodenspannung In Röntgenröhren werden die Elektronen meist mit elektrischen Spannungen im kVBereich beschleunigt. Die Frequenz der entstehenden Röntgenstrahlung erstreckt sich über einen weiten Bereich. Ihre obere Grenze, die Grenzfrequenz fG, ist umso 31/210 größer je größer die Beschleunigungsspannung (Anodenspannung) UB ist. Die bei einem Bremsvorgang frei werdende Energie erwärmt z.T. die Anode, z.T. wird sie in Form von Photonen frei. Im Extremfall wird die gesamte kinetische Energie des Elektrons auf ein einziges Röntgen-Photon übertragen. Die maximale Photonenenergie beträgt dann: c Emax ... Maximale Energie der Photonen [eV] E max = e ⋅ U = h ⋅ f G = h ⋅ λ G e ... Elementarladung eines Elektrons [e] U ... Beschleunigungsspannung [V] h ... Plancksches Wirkungsquantum [eVs] fG ... Grenzfrequenz [Hz] c ... Lichtgeschwindigkeit [m/s] λG ... Grenzwellenlänge [m] 4.7.3 Spektrum der Röntgenstrahlung Trägt man die Intensität I der Röntgenstrahlung über der Frequenz f auf erhält man das Spektrum der Röntgenstrahlung. Das Spektrum einer Röntgenstrahlung besteht aus einem Bremsspektrum (kontinuierliches Spektrum) und einem charakteristischen Spektrum (Linienspektrum). Frequenzbereich: 106 – 1021 Hz Wellenlängenbereich: 10-14 – 10-8 m Bremsspektrum (Kontinuierliches Spektrum) Dieses entsteht, weil die auf die Anode auftreffenden Elektronen beim Eindringen in die Atomhülle abgebremst werden und einen Teil ihrer Energie in Form elektromagnetischer Strahlung (Röntgenquanten) abgeben. Je näher das Elektron am Kern vorbeifliegt, desto stärker wird es abgelenkt und desto größer ist die Energie des abgestrahlten Quants. Da beim Vorbeifliegen vieler Elektronen an vielen Kernen statistisch alle Abstände zwischen Elektronen und Atomkernen in lückenloser Form vorkommen, haben auch die Energiequanten bzw. die entsprechenden Wellenlängen eine kontinuierliche Verteilung. Die Form des Spektrums hängt von der Geschwindigkeitsverteilung der Elektronen und dem verwendeten Metall ab. Charakteristisches Spektrum (Linienspektrum) Aufgrund der großen kinetischen Energie der auftreffenden Elektronen dringen diese bis in die Nähe des Atomkerns vor und heben kernnahe, fest gebundene Elektronen auf ein höheres Energieniveau. Auf den hinterlassenen freien Platz können schwach gebundene Elektronen nachrücken. Dabei wird Energie frei, die in Form von Röntgenquanten abgegeben wird und für das jeweilige Anodenmaterial charakteristisch ist. Grenzwellenlänge Das Bremsspektrum hat zu kurzen Wellenlängen hin eine der kinetischen Energie der Elektronen entsprechende Grenzwellenlänge, d. h. die gesamte kinetische Energie der Elektronen wird in Röntgenstrahlung umgewandelt. Diese Grenzwellenlänge hängt nur von der Beschleunigungsspannung ab, sie ist unabhängig vom Anodenmaterial. 32/210 λG = hc eU λG ... Grenzwellenlänge [m] h ... Plancksches Wirkungsquantum [Js] [eVs] c ... Lichtgeschwindigkeit [m/s] e ... Elementarladung eines Elektrons [e] U ... Beschleunigungsspannung [V] Typische Werte: Spannung UB [kV] 5 15 25 Grenzwellenlänge λG [nm] 0,2482 0,0827 0,0496 4.7.4 Parameter der Röntgenstrahlung In der Röntgendiagnostik spricht man von weicher und harter Strahlung. Ausschlaggebend ist die Spannung in Kilovolt, die der Röntgenröhre zugeführt wird. Je nach gewünschter Bildaussage wird die Röhrenspannung zwischen 38 und 120 kV gewählt. Bei weicher Strahlung (ca. 40 kV) wird viel Strahlung vom Gewebe absorbiert. Dadurch werden auch feinste Gewebeunterschiede auf dem Röntgenfilm sichtbar gemacht. Dies ist z.B. der Fall bei der Mammografie, jedoch ist die Strahlenbelastung des durchstrahlten Gewebes dadurch relativ hoch. Harte Strahlung (über 100 kV) durchdringt Gewebe und Materialien (Gips und sogar Bleischürzen von geringerer Dicke) wesentlich leichter. Kontrastunterschiede werden stark abgemildert, wie z. B. bei Lungenaufnahmen, bei denen sonst im Bereich der Rippen keine Beurteilung der Lungenstruktur möglich wäre. Röhrenstrom Durch Änderung des Röhrenstroms wird die Photonenzahl verändert. Dadurch wird die Intensität der Strahlung beeinflusst. Röhrenspannung Durch Änderung der Röhrenspannung wird die Photonenenergie verändert und damit deren Spektralverteilung. Dadurch wird die Härte der Strahlung beeinflusst. Je höher die Röhrenspannung, desto kleiner die Grenzwellenlänge, desto härter die Röntgenstrahlung: − Ultrahart: λ < 0,01 nm − Hart: 0,01 < λ < 0,1 nm − Weich: 0,1 < λ < 1 nm − Ultraweich: λ > 1 nm 4.7.5 Wirkungsgrad Der Wirkungsgrad gibt das Verhältnis zwischen abgestrahlter Röntgenleistung und angelegtem Anodenstrom und –spannung an. Er kann unter Angabe des verwendeten Anodenmaterials und der verwendeten Röhrenspannung berechnet werden: 33/210 η=k U Z= J ges IU η ... Wirkungsgrad k ≈ 1.10-9 /V U ... Beschleunigungsspannung (Anodenspannung) [V] I ... Anodenstrom [A] Z ... Ordnungszahl des Anodenmaterials Jges ... Gesamte abgestrahlte Röntgenleistung [W] Beispiel: Für Wolfram mit der Ordnungszahl Z = 74 und einer Röhrenspannung von 100 kV ergibt sich ein Wirkungsgrad von 0,7 %. 4.7.6 Nachweis Röntgenstrahlung kann ähnlich wie radioaktive Strahlung mit einem Zählrohr nachgewiesen werden. Am „Knacken“ des Zählrohrs kann man erkennen, dass die Röntgenstrahlung ihre Energie wie Licht in Quanten abgibt. 4.8 Biologische Wirkungen ionisierender Strahlung 4.8.1 Ionisierende Strahlung Ionisierende Strahlung ist eine Teilchen- oder elektromagnetische Strahlung, die aus Atomen oder Molekülen ein oder mehrere Elektronen entfernen kann, sodass positiv geladene Ionen oder Molekülreste zurückbleiben (Ionisation). Zur ionisierenden Strahlung rechnet man alle Strahlungen, deren kinetische Energie (bei Teilchen) bzw. Quantenenergie (bei Wellen) ausreicht, um Elektronen aus einem Atom oder Molekül herauszulösen. Dazu benötigt man Ionisationsenergien von mehr als etwa 5 Elektronenvolt (eV). − Im elektromagnetischen Spektrum entspricht das Wellenlängen von weniger als etwa 200 nm. z.B. Gamma- und Röntgenstrahlung − Frei fliegende Protonen oder Elektronen müssen kinetische Energien von mindestens etwa 5 eV haben. z.B. Betastrahlung und Alphastrahlung 4.8.2 Wirkung auf Gewebe Primäre Wirkungen − Energieübertragung auf Makromoleküle: o Bruch von Wasserstoffbrückenbindungen o DNA-Einzelstrangbrüche o DNA-Doppelstrangbrüche − Ionisation: Bildung von Ionen oder positiv geladenen Molekülresten − Radikalbildung aus kleineren Molekülen, z.B. Wasser Ionisierende Strahlung ionisiert Materie nicht nur, sondern kann chemische Verbindungen zerstören wodurch Radikale entstehen. Hierin liegt ihre biologisch schädliche Wirkung. Fragmente gesprengter Moleküle finden selten wieder zusammen. Sie reagieren/verbinden sich mit anderen Molekülen, wodurch diese in der Regel ebenfalls ihre biologische Funktion verlieren. 34/210 Auch durch Strahlung erzeugte Ionen sind instabil und sind bestrebt, die fehlenden Elektronen aus ihrer Umgebung zu holen, wodurch entweder die ursprünglichen Moleküle/Atome wiederhergestellt werden (Rekombination) oder auch durch Abspalten von Atomen andere Moleküle entstehen. Sekundäre Wirkungen Sekundär wirken hochreaktive Radikale auf Makromoleküle: 1. α-Strahlung hat (in der Luft) eine Reichweite von wenigen Zentimetern, kann durch Papier abgeschirmt werden und durchdringt kaum die Haut. 2. β-Strahlung hat eine Reichweite von mehreren Metern, kann z.B. von Aluminium absorbiert werden und wird auch von Gewebe absorbiert. 3. γ-Strahlung wird in der Luft kaum abgeschwächt und hat eine unendliche Reichweite. Sie kann durch Blei abgeschirmt werden. Die Strahlung durchdringt das Gewebe wird aber auch absorbiert. 4.8.3 Deterministische und stochastische Strahlenwirkungen Deterministische/Nicht stochastische/akute Strahlenwirkungen/Sofortschäden – Höhe der Dosis beeinflusst die Schwere der Schäden. – Ab Schwellwert (Dosis) – Diese können direkt auf eine bestimmte Strahlenexposition zurückgeführt werden. – Sie treten innerhalb weniger Stunden oder Tage nach Expositionen mit effektiven Dosen ab ca. 200 mSv. – Ab effektiven Dosen von ca. 1 Sv als Strahlenkrankheit. – Hautverbrennungen, Linsentrübung, Zellvernichtung (Sterilität, Leukämie, Immunsystem) Stochastische/zufallsabhängige Strahlenwirkungen – Höhe der Dosis beeinflusst die Wahrscheinlichkeit des Eintretens. – Kein Schwellwert – Sie treten mit einer bestimmten Wahrscheinlichkeit erst Jahre oder Jahrzehnte nach der Exposition auf. – Die Höhe der Dosis beeinflusst dabei nicht die Schwere der Erkrankung sondern nur die Wahrscheinlichkeit ihres Auftretens. Da diese Wahrscheinlichkeit im niedrigen Dosisbereich sehr gering ist, können solche Spätschäden aufgrund der vergleichsweise geringen Fallzahlen oft nicht statistisch nachgewiesen werden. – Krebs, bösartige Transformationen, Veränderung des Erbgutes 4.8.4 Wechselwirkung von γ-Strahlung Photoeffekt (Photoabsorption) Die gesamte Energie des einfallenden γ-Quants wird vom Atom absorbiert und auf ein in der Hülle des Atoms gebundenes Elektron übertragen. Das Elektron wird dadurch aus der Atomhülle gelöst wodurch ein freies Elektron und ein Ion entstehen. Photoabsorption tritt bei Photonenenergien im Bereich von 10-200 keV auf. 35/210 Abbildung 22: Wechselwirkungen von γ-Strahlung Comptoneffekt (Comptonstreuung) Ähnlich wie beim Photoeffekt wird ein Elektron aus der Atomhülle freigesetzt. Es wird hierbei jedoch nicht die gesamte Energie des einfallenden γ-Quants an das Elektron übertragen und somit absorbiert, sondern nur ein Teil davon. Der andere Teil der Energie verbleibt in einem energieärmeren gestreuten γ-Quant. Der Comptoneffekt ist der dominierende Wechselwirkungsprozess von Photonen mit Materie für Photonenenergien zwischen etwa 100 keV bis 10 MeV. Paarbildung Das einfallende γ-Quant wird im Feld des Atomkerns gemäß der Einsteinschen Beziehung zwischen Energie und Masse in Teilchen umgewandelt. Die Paarbildung führt also zur Erzeugung eines Elektron-Positron-Paares. Das Positron wird in einer Paarvernichtung wieder in Strahlung (2 γ-Quanten) verwandelt. Zur Paarbildung kommt es bei Photonenenergien von 1000 bis 100.000 keV. 4.8.5 Absorptionsgesetz γ-Strahlung Die Schwächung von γ-Strahlen ist durch die beschriebenen Wechselwirkungsprozesse sowie durch klassische Streuung erklärbar und kann durch eine Exponentialfunktion beschrieben werden: 36/210 D = D0 exp(−μ x) D ... Dosisleistung [J/(kg s)] D ... Dosisleistung zu Beginn [J/(kg s)] μ ... Schwächungskoeffizient (abhängig vom Absorbermaterial und der Strahlenenergie) [m-1] x ... Schichtdicke [m] α- und β-Strahlung Die Schwächung von α- und β-Strahlen ist nur annäherungsweise durch ein Exponentialgesetz beschreibbar, da die Teilchen außer durch Streuung beim Durchgang durch Materie auch durch Ionisierung ständig Energie verlieren und deshalb eine endliche Reichweite haben. Der Kehrwert des Schwächungskoeffizienten bezeichnet man bei β-Strahlen als Reichweite R [cm]. Wird die Reichweite mit der Dichte [mg/cm³] eines Stoffes multipliziert erhält man die Massenreichweite RM [mg/cm²]. Diese ist weitgehend unabhängig vom Absorbermaterial aber noch abhängig von der Energie der Strahlung. 4.8.6 Linearer Energietransfer (LET) Der LET beschreibt den Energieverlust von Strahlung pro Wegstrecke. dE LET ... Energieverlust pro Wegstrecke [keV/μm] LET = E ... Energie [keV] ds s ... Weg [μm] Wenn die mittlere Ionisierungsenergie des absorbierenden Materials bekannt ist, lässt sich aus dem LET berechnen, wieviele Ionenpaare pro Wegstrecke gebildet werden. Daraus ergibt sich ein mittlerer Abstand zwischen den Ionisierungssorten. Bei einem hohen LET ist dieser Abstand klein und man spricht von „dicht ionisierender Strahlung“ (α- und Neutronen-Strahlung). Bei einem niedrigen LET ist dieser Abstand groß (einige nm) und man spricht von „locker ionisierender Strahlung“ (Röntgen-, β- und γ-Strahlung). 4.9 Dosimetrie (Messung der Exposition) Alle Strahlenwirkungen auf den Menschen beruhen letztendlich auf der Absorption von Strahlungsenergie im Gewebe. Die fundamentale physikalische Dosisgröße ist daher die pro Massenelement absorbierte Energie, die Energiedosis. Für den Strahlenschutz werden spezielle Dosisbegriffe benötigt, die auf der Energiedosis basieren, die Äquivalenzdosis und die effektive Dosis. Dosis Menge eines Stoffes oder einer Strahlung, die zugeführt werden muss, um eine bestimmte Wirkung zu erzielen. − Körperdosis: Tatsächliche Dosis, nicht messbar → Schutzgröße − Ortsdosis: Von einem Dosimeter gemessene Dosis → Messgröße 37/210 4.9.1 Energiedosis D Ein Gray ist die durch Radioaktivität und andere ionisierende Strahlung verursachte Energiedosis und beschreibt die pro Massenelement absorbierte Energie. Die tödliche Dosis für einen Menschen beträgt ca. 4 Gy. SI-Einheit: 1 Gy = 1 J/kg = 100 rad (radiation absorbed dose) D ... Dosis [J/kg] D=Dt D ... Dosisleistung [J/(kg s)] = const. t ... Zeit [s] Die Dosisleistung D ist der Quotient aus Dosis und Bestrahlungszeit. 4.9.2 Ionendosis J Die Menge an radioaktiver Strahlung, die beim Durchgang durch ein Kilogramm Luft eine Ladung von 1 Coulomb erzeugt. 1 C/kg Ionendosis entspricht ca. 35 J/kg Energiedosis. SI-Einheit: C/kg Veraltete Einheit: Röntgen: 1 R = 2,58 . 10-4 C/kg 4.9.3 Äquivalenzdosis H Die Äquivalenzdosis H (harm = Schaden) beschreibt mit Hilfe eines Strahlungswichtungsfaktors wR und der Energiedosis D die biologische Wirkung ionisierender Strahlung auf einzelne Organe. Sie stellt außerdem einen Näherungswert für die Körperdosis dar. SI-Einheit: 1 Sv = 1 J/kg = 1 Gy (meist mSv) Veraltete Einheit: Rem = 0,01 Sv H ... Äquivalenzdosis [Sv] H = wRD wR ... Strahlungswichtungsfaktor [] D ... Energiedosis [Gy] Der Wichtungsfaktor wR ist abhängig von der Art (tlw. der Energie) der Strahlung: – Röntgen-, β-, γ-Strahlung: 1 – Neutronenstrahlung: 5-20 – α-Strahlung: 20 4.9.4 Effektive Dosis Deff Ist die Summe gewichteter Organdosen. Die Organdosen HT werden mit den GewebeWichtungsfaktoren wT des Organs T multipliziert. Deff ... Effektive Dosis [Sv] Deff = ∑ w T H T HT ... Organdosis des Organs T (Äquivalenzdosis) [Sv] T wT ... Strahlungswichtungsfaktor des Organs T [] Bei unterschiedlichen Strahlungsarten R gilt: Deff ... Effektive Dosis [Sv] Deff = ∑ w T ∑ w R DT,R T R wT ... Strahlungswichtungsfaktor des Organs T [] wR ... Strahlungswichtungsfaktor der Strahlung R [] DT,R ... Organdosis für Strahlungsart R des Organs T [Sv] 38/210 4.9.5 Expositionsdosisleistung H Die von einer punktförmigen Gamma-Quelle ausgehende Expositionsdosisleistung H nimmt nach dem quadratischen Abstandsgesetz ab: 1 H ... Expositionsdosisleistung [Sv/s] H = AΓ 2 A ... Aktivität [Bq] r Γ ... Dosisleistungskonstante [(Sv m²)/(Bq s)] r ... Radius [m] 4.9.6 Zusammenhang Dosis und inkorporierte Aktivität Der Zusammenhang zwischen der Dosis eines Stoffes und dessen inkorporierter Aktivität (d.h. Aktivität innerhalb des Körpers) kann folgendermaßen berechnet werden: H ... Dosis [Sv] T H = A F eff A ... Aktivität [Bq] T1/2 F ... Dosisfaktor abhängig vom Isotop [Sv/Bq] Teff ... Effektive Halbwertszeit T1/2 ... Physikalische Halbwertszeit 4.9.7 Strahlenbelastung Die mittlere Strahlenbelastung in Österreich beträgt 4,0 mSv/a und ist auf die natürliche Strahlenbelastung und auf die Belastungen durch Medizin, Technik, und Forschung, etc. zurückzuführen: − Natürliche Strahlenbelastung: o Kosmische Strahlung in Meereshöhe: 0,3 mSv/a o Terrestrische Strahlung: 0,4 mSv/a o Aufnahme über Nahrung, Trinkwasser: 0,3 mSv/a o „Eigendosis“ des Menschen: 1,4 mSv/a ⇒ 2,4 mSv/a − Medizin ⇒ 1,5 mSv/a − Technik, Forschung, Kernkraftwerke ⇒ 0,1 mSv/a Die Letaldosis LD gibt das Verhältnis Erkrankter zu Todesfällen über einen gewissen Zeitraum an. Beispiel: LD 10/30 bedeutet, dass nach 30 Tagen 10 % der Erkrankten gestorben sind. 39/210 Dosis > 80 Sv > 50 Sv 20-50 Sv 10-20 Sv 6-10 Sv 4-6 Sv 3-4 Sv 2-3 Sv 1-2 Sv 0,5-1 Sv 250 mSv 200 mSv 2,4 mSv/a 0,01 mSv/a Wirkung Sofortiger Todeseintritt Sofortige Desorientierung, Koma innerhalb von Sekunden/Minuten, Tod durch Versagen des ZNS LD 100/3 Massiver Durchfall, Darmblutungen, Wasserverlust, Schädigung des ZNS, Koma durch Kreislaufversagen (LD 100/7) Tödliche Dosis (LD 100/14): Knochenmark fast völlig zerstört, Magen-Darm-Gewebe schwer geschädigt 7 Sv = Letale Dosis Schwere Strahlenkrankheit: Störung der Blutbildung, stark erhöhte Infektionsbereitschaft, Tod durch Infektionen und Blutungen (LD 60/30) Durchfall, Blutungen in Mund, Haut, Nieren (LD 50/30) 4 Sv = Mittlere letale Dosis Übelkeit, Haarausfall, Verlust weißer Blutkörperchen, starker Anstieg des Infektionsrisikos, permanente Sterilität bei Frauen (LD 35/50) Nachteilige Wirkungen auf das Knochenmark, schlechtes Allgemeinbefinden (LD 10/30) Vorübergehende Strahlenkrankheit: Veränderung des Blutbilds, Hautrötungen, Übelkeit, Erbrechen 1 Sv = Subletale Dosis 0,25 Sv = Schwellendosis Erste Bestrahlungseffekte Maximale natürliche Strahlenbelastung Mittlere natürliche Strahlenbelastung (Deutschland) 3 h Flug in 10 km Höhe 4.10 Strahlenschutz Für jede Tätigkeit muss die Strahlenbelastung so niedrig wie vernünftigerweise erreichbar gehalten werden (ALARA-Prinzip – As Low As Reasonable Possible). Strahlung darf auf den Menschen nur angewandt werden, wenn dies durch den Nutzung dieser Anwendung gerechtfertigt erscheint. Man unterscheidet zwischen externer (Quelle außerhalb des Körpers) und interner Strahlenexposition (Quelle inkorporiert). Die Maßnahmen gegen die externe Strahlenexposition werden unter den 3 As zusammengefasst: – Abstand: Quadratisches Abstandsgesetz (doppelter Abstand → ¼ der Intensität) ⇒ groß – Aufenthalt(sdauer): Dosis = Dosisleistung × Zeit ⇒ kurz – Abschirmung: Absorption der Strahlung ⇒ Abschirmung, Schutzkleidung Falls beeinflussbar sollte auch ein Stoff mit möglichst geringer Aktivität genutzt werden. 40/210 5 Optik 5.1 Reflexion Reflexionsgesetz 1. Einfallender Strahl, Einfallslot und reflektierter Strahl liegen dabei in einer Ebene, der Einfallsebene. 2. Einfallswinkel ist gleich Ausfallswinkel (Reflexionswinkel). Spiegelnde (reguläre) Reflexion Bei einer glatten Oberfläche wird das Licht nur in eine Richtung nach, Einfallswinkel gleich Ausfallswinkel, reflektiert. Diffuse Reflexion Flächen mit einer großen Rauhigkeit relativ zur Wellenlänge reflektieren diffus. Der Einfallswinkel entspricht ebenfalls dem Ausfallswinkel, jedoch erfolgt durch die Strukturierung der Oberfläche keine gerichtete Reflexion. Reflektierte Strahlung Die reflektierte Strahlung I hängt von den Brechzahlen der Medien und der Geometrie ab. Bei rechtwinkeligem Einfall gilt: 2 I ... Intensität der reflektieren Strahlung ⎛ n1 − n 2 ⎞ I = I0 ⎜ I0 ... Intensität der einfallenden Strahlung ⎟ ⎝ n1 + n 2 ⎠ ni ... Brechzahl des Mediums i Reflexionsgrad Der Reflexionsgrad R gibt den Anteil der reflektieren Strahlung I zur einfallenden Strahlung Io: R ... Reflexionsgrad I R= I ... Intensität der reflektieren Strahlung I0 I0 ... Intensität der einfallenden Strahlung 5.2 Brechung Licht, welches von einem Medium mit kleinerer Brechzahl in ein Medium mit höherer Brechzahl übertritt, wird zum Lot hin gebrochen. Umgekehrt wird der Lichtstrahl beim Passieren der Grenze zu einem Medium mit kleinerer Brechzahl vom Lot weggebrochen. Das Vakuum hat eine Brechzahl von 1 (siehe Kapitel 3.2). Snelliussches Brechungsgesetz sin α n1 = sin β n 2 α ... Einfallswinkel β ... Ausfallswinkel ni ... Brechzahlen Totalreflexion Die Totalreflexion ist ein optisches Phänomen, bei dem elektromagnetische Strahlung an der Grenzfläche zweier Medien nicht gebrochen, sondern vollständig reflektiert wird. 41/210 Abbildung 23: Totalreflexion Ein Lichtstrahl, der aus einem optisch dichteren Medium (Brechzahl n1) kommt und auf die Grenzfläche zu einem optisch dünneren Medium (Brechzahl n2) fällt, wird gemäß dem snelliusschen Brechungsgesetz vom Einfallslot weg gebrochen – der Brechungswinkel θ2 ist größer als der Einfallswinkel θ1 des Lichts (grüner Strahl in Abbildung 23). Vergrößert man den Einfallswinkel θ1, so verläuft der gebrochene Strahl θ2 ab einem bestimmten Wert parallel zur Grenzfläche (gelber Strahl). Dieser Winkel wird Grenzwinkel der Totalreflexion (kritischer Winkel) θc genannt. Der Winkel der Totalreflexion lässt sich mithilfe des snelliusschen Brechungsgesetzes berechnen: θc ... Grenzwinkel der Totalreflexion ⎛n ⎞ θc = arcsin ⎜ 1 ⎟ für n1 < n 2 ni ... Brechzahlen ⎝ n2 ⎠ Für Einfallswinkel größer θc müsste der Brechungswinkel gemäß dem snelliusschen Brechungsgesetz größer als 90 Grad werden. Dies steht im Widerspruch zur Voraussetzung, dass der gebrochene Strahl in das optisch dünnere Material hindurchgeht. Die elektromagnetische Welle kann nicht mehr in das optisch dünnere Medium eindringen und wird statt des gebrochenen Strahls vollständig an der Grenzfläche reflektiert (gilt nur für vollständig transparente Materialien). Der Reflexionswinkel (Ausfallswinkel) ist wie bei der „normalen“, externen Reflexion gleich dem Einfallswinkel (roter Strahl). Man spricht daher von einer Totalreflexion. Beispiel: Bei einer Fata Morgana entstehen vermeintliche Spiegelbilder durch Totalreflexion zwischen kühlen und heißen Luftschichten. Bei einem Diamanten dringen Lichtstrahlen in den Edelstein ein, treten aber erst nach einer großen Anzahl von Totalreflexionen wieder aus was zum bekannten „Funkeln“ führt. 5.3 Dispersion Die Erscheinung, dass die Brechzahl eines Stoffes von der Wellenlänge abhängig ist wird als Dispersion bezeichnet. Eine Folge der Dispersion ist die Auffächerung von weißem Licht, also Licht unterschiedlicher Wellenlängen, in seine farbigen Bestandteile beim Durchgang 42/210 durch ein Prisma. Dabei gilt, dass für fast alle Stoffe die Brechzahl n für kurzwelliges (blaues) Licht größer ist als für langwelliges (rotes) Licht. Daher wird blaues Licht in der Regel stärker gebrochen als rotes Licht. 5.4 Abbildung mit einer Linse Strahlenarten − Parallelstrahl: Ein zur optischen Achse der Linse parallel verlaufender Strahl durchläuft den Brennpunkt im Bildraum. − Zentralstrahl (Mittelpunktsstrahl): Ein durch die Mitte der Linse verlaufender Strahl behält seine Richtung auch im Bildraum bei. − Brennstrahl: Ein durch den Brennpunkt im Objektraum verlaufender Strahl wird so gebrochen, dass er im Bildraum parallel zur optischen Achse verläuft. Vergleich Strahlengang Linse und Platte Linse Strahlengang ergibt sich aus geradliniger Ausbreitung und Brechungsgesetz Richtungsablenkung einfallender Strahlen, die Position bleibt näherungsweise konstant Die Ablenkung ist proportional zum Abstand zur Achse Platte Strahlengang ergibt sich aus geradliniger Ausbreitung und Brechungsgesetz Bei planparallelen Platten erfolgt keine Richtungsänderung Das Ausmaß der Parallelverschiebung hängt von den Brechungsindizes und der Plattendicke ab Reeles Bild − Kann auf einem Schirm abgebildet werden − Kann ohne optische Einheit betrachtet werden − Abhängig vom Verhältnis von Gegenstandsweite zu Brennweite erscheint das Objekt vergrößert, gleich groß oder verkleinert. Beispiel: Lochkamera, Sammellinse wenn g > f, TV-Schirm, Video-Beamer 43/210 Virtuelles Bild − Kann nicht auf einem Schirm abgebildet werden − Kann nur mit optischer Einheit betrachtet werden − Beobachter interpretiert ein vom tatsächlichen Bild in Größe und Position abweichendes Bild Beispiel: Lupe, Spiegel Abbildungsgleichung (Linsengleichung) Die Abbildungsgleichung setzt Brennweite f, Gegenstandsweite g und Bildweite b zueinander in folgende Beziehung: f ... Brennweite 1 1 1 = + b ... Bildweite f b g g ... Gegenstandsweite Abbildungsmaßstab A (bzw. Vergrößerung V) Der Abbildungsmaßstabs A ist das Verhältnis von Bildweite und Gegenstandsweite. A ... Abbildungsmaßstab (Vergrößerung) B b A= = B ... Bildgröße G g G ... Gegenstandsgröße b ... Bildweite g ... Gegenstandsweite Brechkraft D Die Brechkraft D ist der Kehrwert der Brennweite f. Die Brechwerte in der Einheit m-1 angegeben, die in diesem Zusammenhang als auch Dioptrie (dpt) bezeichnet wird: D ... Brechkraft [m-1] 1 D= f ... Brennweite f Förderliche Vergrößerung Bei der förderlichen Vergrößerung handelt es sich um jene Vergrößerung bei der die kleinsten Strukturen, die noch vom Objektiv aufgelöst werden können nach der Abbildung im Auge durch das Okular immer noch aufgelöst werden können. Durch eine weitere Vergrößerung (z.B. ein stärker vergrößerndes Okular) wird das Bild zwar größer aber es werden keine weiteren Details sichtbar: 500.A ≤ V ≤ 1000.A A ... Apertur des Objektivs (siehe Kapitel 13.3) V ... Vergrößerung durch das Objektiv 44/210 5.4.1 Reeles, verkleinertes und verkehrtes Bild Der Gegenstand befindet sich außerhalb der doppelten Brennweite einer Sammellinse: g > 2f G F F B 5.4.2 Reeles, gleichgroßes und verkehrtes Bild Der Gegenstand befindet sich genau in der doppelten Brennweite einer Sammellinse: g = 2f G F F B 5.4.3 Reeles, vergrößertes und verkehrtes Bild Der Gegenstand befindet sich zwischen der einfachen und der doppelten Brennweite einer Sammellinse: 2f > g > f G F F B 45/210 5.4.4 Bild im Unendlichen Der Gegenstand befindet sich genau in der Brennweite einer Sammellinse: g = f Die gebrochenen Strahlen verlaufen parallel. Die Linse ist voll mit der Farbe des Gegenstandes bedeckt. G F F Auge 5.4.5 Virtuelles, vergrößertes und aufrechtes Bild Der Gegenstand befindet sich innerhalb der einfachen Brennweite einer Sammellinse: g < f B Auge G F F Dieser Aufbau entspricht der Situation einer Lupe, die dazu dient Gegenstände vergrößert betrachten zu können. Die Normalvergrößerung einer Lupe erhält man, wenn man den Gegenstand etwa in die Brennebene der Lupe bringt und sich die Augen ca. 25 cm von der Lupe entfernt befinden: V ... Vergrößerung 25 cm V= f ... Brennweite f 5.5 Das Auge Das menschliche Auge ist das wichtigste optische System bestehend aus Hornhaut, Augenflüssigkeit, Linse und Glaskörper. Es wirkt wie eine Sammellinse mit einer hinteren Brennweite von ca. 23 mm. Die Augenlinse wird durch Muskeln so gekrümmt, dass auf der Netzhaut ein scharfes, umgekehrtes und reeles Bild entsteht. Die Anpassung an unterschiedlich weit entfernte Gegenstände (Akkommodation) erfolgt durch Krümmungsveränderung der Augenlinse. Die Anpassung an die Intensität des einfallenden Lichtes erfolgt durch die Pupille, eine Blende mit veränderlicher Öffnung (Apertur). 46/210 Ein gesundes Auge kann ohne Anstrengung Gegenstände in einer minimalen Entfernung von 25 cm (deutliche Sehweite) scharf abbilden. Sehwinkel Als Sehwinkel bezeichnet man jenen Winkel, den die äußersten von einem Gegenstand kommenden Strahlen im Auge miteinander einschließen. Er bestimmt die Größe des Netzhautbildes. Ein Gegenstand erscheint dem Auge umso größer, je größer der Sehwinkel ist, unter dem er wahrgenommen wird. Zwei Gegenstände können noch getrennt wahrgenommen werden, wenn sie unter einem Sehwinkel von mindestens 3’ (d.h. Bogenminute) erscheinen (Auflösungsvermögen des menschlichen Auges). Das entspricht ca. einem Abstand zwischen zwei Punkten von 3 mm bei einer Entfernung von 1 m bzw. einem Menschen in einer Entfernung von 2,2 km. Weitsichtigkeit Gegenstände in der Nähe können nicht scharf abgebildet werden. Das Bild entsteht hinter der Netzhaut und kann durch eine Sammellinse korrigiert werden (positive Dioptrienzahl). Kurzsichtigkeit. Gegenstände in der Ferne können nicht scharf abgebildet werden. Das Bild entsteht vor der Netzhaut und kann durch eine Zerstreuungslinse korrigiert werden (negative Dioptrienzahl). 5.6 Linsenfehler Sphärische Abberation Wie bei sphärischen Hohlspiegeln schneiden auch bei Sammellinsen achsenferne Parallelstrahlen einander nicht genau im Brennpunkt. Diese sphärische Abberation kann durch Ausblenden der Randstrahlen verhindert werden. Chromatische Abberation Aufgrund der Dispersion (siehe Kapitel 5.3) treten bei den durch Linsen erzeugten Bildern farbige Ränder auf. Diese Erscheinung nennt man chromatische Abberation. Sie kann durch Verwendung spezieller Linsensysteme (Achromate) verhindert werden. 5.7 Huygenssches Prinzip Viele Wellenerscheinungen, z.B. Brechung, Reflexion und Beugung, lassen sich mit Hilfe des Huygensschen Prinzips erklären. Die Fläche bzw. Linie um den Wellenerreger, auf der die Teilchen nach derselben Zeit in gleicher Phase schwingen, heißt Wellenfront. Die Ausbreitungsrichtung einer Wellenfront wird durch die Wellenstrahlen angegeben, die immer senkrecht auf die Wellenfront stehen. 47/210 Huygenssches Prinzip − Jeder Punkt einer bestehenden Wellenfront ist Ausgangspunkt einer neuen Elementarwelle, die die gleiche Ausbreitungsgeschwindigkeit und Frequenz wie die ursprüngliche Wellenfront hat. − Durch Interferenz schwächen oder verstärken einander die Elementarwellen, dass nur die Einhüllende als neue Wellenfront übrig bleibt. Abbildung 24: Huygenssches Prinzip Als experimentellen Nachweis kann man eine ebene Wasserwelle gegen ein Hindernis mit einem schmalen Spalt laufen lassen wodurch ein einzelner Punkt der Wellenfront herausgegriffen wird. Es zeigt sich, dass die Wellenfronten hinter dem Spalt kreisförmig sind. Ein Punkt im Spalt kann wie ein Wellenerreger aufgefasst werden, er ist also Ausgangspunkt einer Elementarwelle. 5.8 Interferenz Als Interferenz bezeichnet man die additive Überlagerung (Superposition) von Wellen. Dabei bilden sich Bereiche der Verstärkung und der Abschwächung bzw. Auslöschung aus. Entscheidend ist dabei die Phasenverschiebung zwischen den beiden Wellen. Beträgt er an einem Ort 0, ϕ oder ein Vielfaches davon dann treffen die Wellen bei gleicher Wellenlänge mit der gleichen Phase zusammen was zu einer Verstärkung, d.h. einer konstruktiven Interferenz führt: A = A1 + A 2 τ1 = τ2 ϕ1 − ϕ2 = 0 Bei einer Phasenverschiebung von ϕ/2 oder einem ungeradzahligen Vielfachen davon kommt es zu einer Abschwächung, d.h. einer destruktiven Interferenz: A = A1 + A 2 = 0 τ1 = τ2 ϕ1 − ϕ2 = π 5.9 Beugung (Diffraktion) Trifft eine Welle auf einen Spalt oder eine Kante so sind die betreffenden Stellen nach Huygens Ausgangspunkt von Elementarwellen. Damit breitet sich die Welle auch in den Raum dahinter (Schattenraum) aus. Dringt eine Welle abweichend von ihrer geradlinigen Ausbreitung an Kanten Spalten in den dahinterliegenden Raum ein spricht man von Beugung. Durch Überlagerung und dadurch bedingter Interferenz von Elementarwellen entstehen Beugungsmuster. 48/210 5.9.1 Beugung und Interferenz am Doppelspalt Eine Welle trifft auf zwei dicht beieinander liegende Spalte, dahinter überlagern sich die beiden Teilstrahlen. Bedingung für eine konstruktive Interferenz (Maximum) Es ergibt sich eine Reihe von Interferenzmaxima mit der Eigenschaft, dass der Weglängenunterschied der beiden Teilstrahlen ein ganzzahliges Vielfaches der Wellenlänge ist (Überlagerung der Wellenberge). Beträgt der Weglängenunterschied 1 handelt es sich um ein Maximum 1. Ordnung, beträgt er 2 ist es ein Maximum 2. Ordnung, usw. d sin θ = m λ Abbildung 25: Beugung am Doppelspalt d ... Spaltabstand [m] θ ... Ausfallswinkel in den Schattenraum m ... ganzzahliger Proportionalitätsfaktor λ ... Wellenlänge [m] Bedingung für eine destruktive Interferenz (Minimum) Interferenzminima ergeben sich bei folgendem Weglängenunterschied (Überlagerung von Wellenberg und Wellental): d ... Spaltabstand [m] 1⎞ ⎛ d sin θ = ⎜ m + ⎟ λ θ ... Ausfallswinkel in den Schattenraum 2⎠ ⎝ m ... ganzzahliger Proportionalitätsfaktor λ ... Wellenlänge [m] 5.10 Absorption Lambert-Beersches Gesetz Der Grad der Lichtabsorption wird durch das Lambert-Beersche Gesetz bestimmt und gilt für alle Spektralbereiche: I ... Lichtintensität nach absorbierender Schicht I = I0 exp(−ε c d) I0 ... Lichtintensität, die auf absorbierende Schicht fällt ε ... Molarer Extinktionskoeffizient [l mol-1 cm-1] c ... Konzentration [mol/l] d ... Schichtdicke [cm-1] Extinktion Die Extinktion ist die wahrnehmungsgerecht logarithmisch formulierte Lichtundurchlässigkeit, und damit ein Maß für die Abschwächung einer Strahlung in einem Medium. Beim Durchtritt von Lichtquanten durch die absorbierende Schicht wird ein Teil davon zufolge Elektronenanregung bzw. Anregung von Schwingungen und Rotationen der Moleküle zurückgehalten, wodurch der austretende Lichtstrom entsprechend geschwächt wird. 49/210 Für die Messung der Lichtabsorption verwendet man meist monochromatisches Licht (d.h. Licht einer bestimmten Wellenlänge), weil die Lichtabsorption bei verschiedenen Wellenlängen unterschiedlich ist. E ... Extinktion (optische Dichte) I I 1 E = − log = log 0 = log = ε c d I ... Lichtintensität, die auf absorbierende Schicht 0 I0 I T fällt I ... Lichtintensität nach absorbierender Schicht ε ... Molarer Extinktionskoeffizient [l mol-1 cm-1] c ... Konzentration [mol/l] d ... Schichtdicke [cm-1] Transmission Der Transmissionsgrad, das Verhältnis der Intensität nach einem Hindernis zur Intensität vor einem Hindernis, d.h. der Anteil der durchgelassenen Strahlung. Nimmt Werte zwischen 0 und 1 an. T ... Transmission I T= I ... Lichtintensität nach absorbierender Schicht I0 I0 ... Lichtintensität, die auf absorbierende Schicht fällt Absorption Die Schwächung einer Strahlung beim Durchgang durch Materie. A ... Absorption I A = 1− T = 1− T ... Transmission I0 I0 ... Lichtintensität, die auf absorbierende Schicht fällt I ... Lichtintensität nach absorbierender Schicht 5.11 Streuung Unter Streuung versteht man die Ablenkung der Strahlung ohne Änderung der Wellenlänge bzw. eine Umwandlung in eine andere Energieform. Die Summe, der von einem Streuvolumen nach allen Richtungen gestreute Strahlung entspricht der Schwächung des geradeaus weitergehenden Strahls. Rayleigh-Streuung (Dipol-Streuung) Elastische (d.h. keine Energieübertragung) Streuung elektromagnetischer Wellen an Teilchen, die einen im Vergleich zur Wellenlänge der gestreuten Wellen kleinen Durchmesser besitzen (ca. 4 nm). Die Streuung erfolgt sowohl vorwärts gerichtet als auch seitwärts. Mie-Streuung Streuung elektromagnetischer Wellen an Teilchen, deren Durchmesser in etwa der Wellenlänge der Strahlung entspricht (ca. 0,1-10 μm). Die Streuung erfolgt v.a. vorwärts gerichtet. Raman-Streuung Inelastische Streuung an Atomen, Molekülen oder Festkörpern. 50/210 5.12 Spektrale Empfindlichkeit Sinnesorgane und technische Geräte reagieren auf bestimmte Bereiche eines Spektrums entsprechend einer Empfindlichkeitsfunktion, die als Filter angesehen werden kann. Beispiel: − Das menschliche Auge nimmt elektromagnetische Strahlung in einem Wellenlängenbereich von 380-780 nm wahr (sichtbare Strahlung). Innerhalb dieses Spektralbereichs reagiert das Auge unterschiedlich empfindlich auf die einzelnen Wellenlängen. Abbildung 26: Die Spektralen Absorptionskurven beschreiben die Reizantwort der drei Zapfenarten (Farbsehen) und der Stäbchen (Dämmerungssehen) in Bezug zur Wellenlänge des Lichtreizes. S ... Blaurezeptor (short wavelength), M ... Grünrezeptor (medium wavelength), L ... Rotrezeptor (long wavelength), R ... Stäbchen (rods) − Die Hörschwelle des Menschen liegt zwischen der tiefsten hörbaren Frequenz von 20 Hz und der höchsten hörbaren Frequenz, die je nach Alter bis maximal 20 kHz beträgt. Die Hörschwelle des Menschen verläuft dabei nicht linear sondern hat zwischen der tiefsten und der höchsten Frequenz bei etwa 4 kHz den Punkt der höchsten Wahrnehmungsempfindlichkeit, jenseits dessen die Wahrnehmungsempfindlichkeit in beide Richtungen nachlässt. − Auch die Haut reagiert unterschiedlich auf die verschiedenen Wellenlängenbereiche des elektromagnetischen Spektrums. Sie reagiert weitaus empfindlicher auf kurze Wellenlängen (z.B. Sonnenbrand durch UVStrahlung) während sie für sichtbare Strahlung relativ unempfindlich ist (z.B. kein Sonnenbrand durch Glühbirne). 51/210 6 Transportvorgänge 6.1 Allgemeiner Ansatz für Transportphänomene Allgemein kann ein Fluss J eines Stoffes als Kraft X mal Leitfähigkeit L bzw. Kraft X pro Widerstand R beschrieben werden: J ... Fluss einer Größe X J=LX= X ... Kraft R L ... Leitfähigkeit R ... Widerstand 6.2 Gradient Ein Gradient einer Größe G ist die Differenz zwischen zwei Werten dieser Größe ΔG dividiert durch deren räumlichen Abstand Δx : G ... Physikalische/chemische Größe ΔG G 2 − G1 = x ... Abstand zwischen den beiden Größenausprägungen Δx x 2 − x1 Der Gradient gibt somit in jeder Richtung die Änderung der Größe G an (vektorielle Größe). Für die Bestimmung eines Gradienten im Raum ist das totale Differential zu bilden, für einen Gradienten entlang einer Koordinatenachse entsprechend das partielle Differential. Gradienten bei Zellmembranen Phasengrenzen in biologischen Systemen werden durch Zellmembranen gebildet, die eine geringe Dicke verglichen mit den sie umgebenden Räumen aufweisen. Diese Zellmembranen trennen Phasen mit unterschiedlichen Stoffkonzentrationen. Der daraus resultierende Konzentrationsgradient löst Transportvorgänge durch die Zellmembran aus. Atome und kleine Moleküle können mit Hilfe von Diffusion und Osmose durch die Zellmembran hindurchtreten. Größere Moleküle werden durch Membrankanäle geschleust wofür Energie aufgewendet werden muss (z.B. Na-KPumpe). Mechanismen zum Transport von thermischer Energie − Wärmeleitung (Konduktion) − Wärmeströmung (Konvektion) − Wärmestrahlung Anwendungen des Gradienten in biologischen Systemen Anwendungsgebiet Gradient Wärmeleitung (Konduktion) Temperaturdifferenz Flussströmung Gefälle (Höhendifferenz) Wind Druckdifferenz Elektrischer Strom Spannung (Potentialdifferenz) Konvektionsströmung Dichteunterschied Atmung Druckdifferenz Blutkreislauf Druckdifferenz 52/210 6.3 Wärmetransport durch mehrere Schichten Menschen und Tiere bzgl. Wärmetransport als „mehrschichtige“ Konstruktionen angesehen werden (z.B. Körperinneres → Haut → Fell). Diese Schichten können daher als eine serielle Schaltung von Wärmeleitwiderständen gesehen werden. Der Wärmeleitwiderstand ist der Kehrweit der Wärmeleitfähigkeit (siehe Kapitel 6.1 und 9.6): Rges ... Gesamtwiderstand 1 R ges = ∑ R i = ∑ R1 ... Einzelwiderstände λi λ1 ... Wärmeleitfähigkeiten Wärmedurchgang Wärmedurchgang wird die Wärmeübertragung von einem Fluid durch eine Wand auf ein anderes Fluid genannt. Für den Wärmetransport aus dem Körperinneren an die Umgebung setzt er sich aus folgenden Teilberechen zusammen: − Wärmeübergang vom Körperinneren auf die Haut − Wärmeleitung durch die Haut − Wärmeübergang von der Haut an die Umgebung Vereinfacht gesagt erfolgt innen und außen der Wärmetransport durch Wärmeströmung (Konvektion) und durch die Haut durch Wärmeleitung (Konduktion). Dabei ist der Wärmestrom beim Fluss durch alle Schichten immer gleich groß. Wärmedurchgangskoeffizient U Der Wärmedurchgangskoeffizient U ist ein Maß für den Wärmedurchgang durch eine ein- oder mehrlagige Materialschicht, wenn auf beiden Seiten verschiedene Temperaturen anliegen (innen Körpertemperatur, außen Umgebungstemperatur). Er gibt die Energiemenge (in Joule) an, die in einer Sekunde durch eine Fläche von 1 m² fließt, wenn sich die beidseitig anliegenden Temperaturen um 1 K unterscheiden. Der Kehrwert des Wärmedurchgangskoeffizienten ist der Wärmedurchgangswiderstand RT. Je höher der Wärmedurchgangskoeffizient, desto schlechter ist die Wärmedämmeigenschaft des Stoffs. Je höher der Wärmedurchgangswiderstand, desto besser ist die Wärmedämmeigenschaft. 53/210 Abbildung 27: Wärmetransport aus dem Körperinneren 6.4 Diffusion Unter Diffusion versteht man die Erscheinung, dass sich Teilchen eines Stoffes aufgrund ihrer thermischen Bewegung mit denen eines anderen Stoffes selbstständig vermischen. Abbildung 28: Konzentrationsausgleich durch Diffusion Die Diffusion gleich so Konzentrationsunterschiede zwischen Stoffen innerhalb einer endlichen Zeit aus. Der Diffusionsstrom (Netto-Teilchenstrom) fließt dabei von Orten höherer Konzentration zu Orten niederer Konzentration. Die Diffusion ist ein wichtiger passiver Transportvorgang über kurze Strecken hinweg. Brownsche Molekularbewegung Unter der Brownschen Molekularbewegung versteht man die Wärmebewegung von Teilchen. Dabei beschreibt jedes Atom oder Molekül bei Temperaturen über 0 Kelvin eine Bewegung. Die Moleküle befinden sich in ständiger ungeordneter Bewegung und stoßen dabei gegeneinander und versetzen so weitere Moleküle in Bewegung. Die Geschwindigkeit der Moleküle ist dabei umso größer je höher die Temperatur ist. 54/210 6.4.1 Erstes Ficksches Gesetz Nach dem ersten Fickschen Diffusionsgesetz ist der Diffusionsstrom direkt proportional dem Konzentrationsgradienten. Die Konzentration selbst ändert sich hier nicht, da der Teilchenaustausch bezogen auf die Gesamtzahl der Teilchen nur einen verschwindend kleinen Anteil ausmacht. Die Diffusionsgeschwindigkeit ist für Gase groß, für Flüssigkeiten und vor allem für Festkörper wesentlich kleiner. J ... Teilchenstromdichte [mol/(m² s)] bzw. ∂c J=D Massenstromdichte [kg/(m² s)] ∂x D ... Diffusionskoeffizient [m²/s] ∂c ... Konzentrationsgradient [mol/m4] bzw. [kg/m4] ∂x Beispiel: Wasserdampf diffundiert durch eine Stallwand entlang eines Konzentrationsgradienten. Der Austausch von Wasserdampf ist aber zu gering um die Konzentration des Wasserdampfs zu beeinflussen. 6.4.2 Zweites Ficksches Gesetz Der Konzentrationsverlauf bei einer Ionenabscheidung aus einem ungerührten Elektrolyten ist zeitlich nicht konstant und wird durch das zweite Ficksche Gesetz beschrieben. Das Konzentrationsprofil ist nicht mehr allein ortsabhängig, sondern auch eine Funktion der Zeit. D.h. man kann eine zeitliche Änderung der Konzentration bestimmen, die jetzt im Gegensatz zum ersten Fickschen Gesetz vom Quadrat des Gradienten abhängt. D ... Diffusionskoeffizient [m²/s] ∂c ∂ 2c = D 2 für D = const c ... Konzentration ∂t ∂x x ... Ort t ... Zeit Beispiel: Eine Chlor-Tablette wird zur Desinfektion in einem mit Wasser gefüllten Becken aufgelöst. Mit der Zeit ändert sich dadurch die Chlor-Konzentration innerhalb des Wassers wodurch das zweite Ficksche Gesetz zur Anwendung gelangt. Beispiel: Vergleich mit der Wärmeleitung: Steckt man einen Löffel in eine Tasse heißen Tee erwärmt sich der Löffel konstant durch Wärmeleitung entsprechend dem ersten Fickschen Gesetz, abhängig von einem Temperaturgradienten zwischen kühlem Löffel und heißem Tee. Da mit der Zeit die Temperatur des Tees abnimmt ändert sich somit auch die Wärmeleitung innerhalb des Löffels. 6.5 Osmose Die Osmose ist ein Spezialfall der Diffusion durch eine semipermeable Wand. Eine Wand heißt semipermeabel (halbdurchlässig), wenn nur das Lösungsmittel passieren kann. Osmotischer Druck Das Konzentrationsgefälle ruft einen osmotischen Druck hervor, der das Lösungsmittel solange durch die Membran treibt bis der Konzentrationsunterschied ausgeglichen ist. 55/210 Die Osmose hört auf, wenn der osmotische Druck einen gleich großen entgegengesetzten Druck kompensiert wird (z.B. hydrostatischer Druck). Für ideale Lösungen und geringe Konzentrationen gilt das Gesetz von Van’t Hoff: π=cRT π ... Osmotischer Druck [Pa] R ... Gaskonstante [J/(mol K)] T ... Temperatur [K] c ... Konzentration [mol/m³] Beispiel: − Als Hämolyse wird das Aufplatzen der Erythrozyten bezeichnet, wenn sie sich in einer hypotonen Lösung (d.h. mit geringerer Konzentration) befinden. Um die höhere Konzentration innerhalb des Erythrozyten gegenüber der umgebenden Lösung auszugleichen tritt über Osmose solange Wasser in das rote Blutkörperchen ein bis dieses platzt. − Die Filtration des Primärharns findet in den Malpighischen Körperchen der Nieren durch Osmose statt. 56/210 7 Fluiddynamik 7.1 Kompressible und inkompressible Medien Ideales Fluid Eine Substanz, die einer beliebig kleinen Verformungskraft keinen Widerstand entgegensetzt. Gase und Flüssigkeiten sind in diesem Sinne Fluide. Kompressible Medien Medien, die einer Volumensänderung keinen Widerstand entgegensetzen. Beispiel: Gase Inkompressible Medien Medien, die einer Volumensänderung einen großen Widerstand entgegensetzen. Beispiel: Flüssigkeiten, Festkörper Aggregatszustand Fest Flüssig Gasförmig − − − − − − − − − Eigenschaften Volumsbeständig Formbeständig Inkompressibel Volumsbeständig Keine bestimmte Form Inkompressibel Kein bestimmtes Volumen Keine bestimmte Form Kompressibel 7.2 Statischer Druck von Fluiden Fluide können jeden beliebigen Raum vollständig ausfüllen und Kräfte gegenüber Körpern ausüben. Die Kraft F wirkt normal zur Oberfläche des Fluids. Bezogen auf die Fläche ergibt sich der Druck: p ... Druck [Pa] F p= F ... Kraft [N] A A ... Fläche [m²] Unter Berücksichtigung der darüber befindlichen Fluidsäule der Höhe h ergibt sich der Druck an einem Punkt innerhalb des Fluids: p ... Druck [Pa] p = p0 + ρ g h p0 ... Druck an der Oberfläche [Pa] ρ ... Dichte [kg/m³] g ... Erdbeschleunigung [m/s²] h ... Höhe der Fluidsäule [m] D.h. der Druck an einer Stelle, die sich unter der Flüssigkeitsoberfläche befindet ist größer als der Druck an der Oberfläche, da das Gewicht der Flüssigkeitssäule ebenfalls einen Druck ausübt. Der Druck nimmt also mit zunehmender Tiefe zu und steigt alle 10 Meter um 1 bar. 57/210 Messung des Augeninnendrucks Die Augenkammer des Auges ist mit Kammerwasser gefüllt. Der Druck des Kammerwassers bewirkt eine Wölbung der Hornhaut. Der Augeninnendruck kann nun bestimmt werden, indem die Kraft F gemessen wird, die nötig ist um mit einem Stempel mit der Fläche A, die Hornhaut bis zu einem bestimmten Kreisdurchmesser abzuflachen. Der normale Augeninnendruck beträgt ca. 27 hPa. F Es gilt: paußen = = p Auge A Abbildung 29: Messung des Augeninnendrucks 7.3 Kontinuitätsbedingung Die Kontinuitätsbedingung besagt, dass keine Materie (Masse) bei der Bewegung eines fluiden Mediums verloren gehen darf. Inkompressibles Fluid Wenn sich ein inkompressibles Fluid (Flüssigkeiten, Dichte bleibt konstant) bewegt, so ist das Produkt aus der Geschwindigkeit v [m/s] und dem Querschnitt A [m²] konstant. Somit ist auch der Volumenstrom V konstant: V = v A = const V ... Volumenstrom [m³/s] v ... Geschwindigkeit [m/s] A ... Querschnitt [m²] Verändert man nun z.B. den Querschnitt A ändert sich aufgrund des konstanten Volumenstroms auch die Geschwindigkeit des Fluids. Bei einer Verkleinerung des Querschnitts erhöht sich dementsprechend die Geschwindigkeit des Fluids da auch bei veränderten Bedingungen immer noch dasselbe Volumen bewegt werden muss. Kompressibles Fluid Wenn sich ein kompressibles Fluid (Gas, Dichte ist variabel) bewegt, so ist das Produkt aus der Geschwindigkeit v [m/s], dem Querschnitt A [m²] und der Dichte ρ [kg/m³] konstant. Somit ist auch der Massenstrom M [kg/s] konstant: M = v A ρ = const M ... Massenstrom [kg/s] v ... Geschwindigkeit [m/s] ρ ... Dichte [kg/m³] A ... Querschnitt [m²] 7.4 Gesetz von Bernoulli Das Gesetz von Bernoulli beschreibt den Zusammenhang zwischen der Fließgeschwindigkeit eines Fluids und dessen Druck. In einem strömenden Fluid wird ein Geschwindigkeitsanstieg von einem Druckabfall begleitet. D.h. in Gebieten größerer Strömungsgeschwindigkeit ist der sich aus Außendruck und Schweredruck zusammensetzende statische Druck in der Flüssigkeit, und damit auch der Druck auf die Wände eine Rohres, kleiner als in Gebieten kleinerer Strömungsgeschwindigkeit. 58/210 Für reibungsfreie Fluide mit der Strömungsgeschwindigkeit v gilt: p ... Druck [Pa] 1 p = p0 + ρ g h + ρ v 2 = const p ... Druck zu Beginn [Pa] 0 2 ρ ... Dichte [kg/m³] g ... Erdbeschleunigung [m/s²] h ... Höhe [m] v ... Geschwindigkeit [m/s] Aus Kontinuitätsbedingung und dem Gesetz von Bernoulli folgt: Bei sich verengendem Querschnitt A steigt die Strömungsgeschwindigkeit v und der statische Druck p sinkt. Bei sich erweiterndem Querschnitt A sinkt die Strömungsgeschwindigkeit v und der statische Druck p nimmt zu. Abbildung 30: Zusammenhang zwischen Querschnitt A, Strömungsgeschwindigkeit v und Druck p Abbildung 32: Reales Medium Abbildung 31: Ideales Medium Keine innere Reibung, kein Druckabfall Viskoses Medium (d.h. innere Reibung), Druckabfall Δp 7.5 Viskosität Die Viskosität η ist ein Maß für die Zähflüssigkeit eines Fluids. Je größer die Viskosität, desto dickflüssiger (weniger fließfähig) ist das Fluid; je niedriger die Viskosität, desto dünnflüssiger (fließfähiger) ist es. Die Viskosität eines Fluids ist durch dessen innere Reibung bedingt. Beim Fließen gleiten die Moleküle aneinander vorbei und um deren „Verzahnung“ zu überwinden benötigt man eine gewisse Kraft. Die Viskosität definiert den Zusammenhang zwischen dieser Kraft und den Eigenschaften des Fluids. Die Viskosität ist abhängig von der Temperatur. Beispiel: Im Sommer wird ein dickflüssigeres Motoröl benötigt als im Winter. 7.5.1 Bestimmung der Viskosität Man stelle sich zwei im Abstand z angeordnete Platten der Fläche A vor. Zwischen 59/210 diesen Platten befindet sich eine Flüssigkeit, die an beiden Platten haftet. In unserer Vorstellung soll der Raum mit der Flüssigkeit in Schichten unterteilt sein. Wird nun die oben liegende Platte 2 mit der Geschwindigkeit v bewegt, so bewegt sich die Schicht, in unmittelbarer Nachbarschaft zu Platte 2 auf Grund der Haftung ebenfalls mit der Geschwindigkeit v. Da die untenliegende Platte 1 ruht, ruht auch ihre Nachbarschicht. Die innenliegenden Flüssigkeitsschichten gleiten mit unterschiedlichen Geschwindigkeiten aneinander vorbei. Die Geschwindigkeit nimmt von der ruhenden Platte zur bewegten zu. Im einfachsten Fall besteht eine lineare Abhängigkeit. Abbildung 33: Bestimmung der Viskosität Im Experiment lässt sich zeigen, dass die Kraft F, die nötig ist, um die obenliegende Platte 2 zu bewegen direkt proportional zu ihrer Fläche A, ihrer Geschwindigkeit v und indirekt proportional zu dem Abstand der Platten z ist: F v τ ... Scherspannung [Pa] τ= =η F ... Kraft [N] A z A ... Fläche [m²] η ... Viskosität [Pa s] [Ns/m²] v ... Geschwindigkeit [m/s] z ... Abstand [m] Abbildung 34: Newtonsches Medium Die Viskosität hängt nicht von der Scherspannung τ = F/A ab. Mit zunehmender Scherspannung τ ändert sich nichts an der Viskosität η. Abbildung 35: Nicht-Newtonsches Medium Die Viskosität hängt von der Scherspannung τ = F/A ab. Mit zunehmender Scherspannung τ nimmt die Viskosität η ab. Beispiel: Ketchup fließt erst aus der Flasche wenn man diese kräftig schüttelt und das Ketchup somit einer starken Scherspannung aussetzt und somit die Viskosität verringert. 60/210 7.5.2 Messung der Viskosität Kapillarviskosimeter Ein festgelegtes Flüssigkeitsvolumen V läuft bei gleich bleibendem Druck p durch eine Kapillare der Länge l und des Radius r. Die dazu benötigte Zeit t wird gemessen. Rotationsviskosimeter Ein Gefäß wird mit Flüssigkeit gefüllt. In dieses Gefäß wird ein zylinderförmiger Stab gesteckt und mit Hilfe eines Motors durch die Flüssigkeit gedreht. Die Kraft, die für das Drehen des Stabes aufgewendet werden muss entspricht der Viskosität der Flüssigkeit. Viskositäts-Messbecher (Ford-Becher, Auslaufbecher) Bei diesem Verfahren wird die Flüssigkeit in einen Becher gefüllt, der unten kegelförmig in ein Loch mit genau bekanntem Durchmesser ausläuft. Aufgrund des Bechervolumens, des Düsendurchmessers und der gemessenen Dauer zum Abfließen der Flüssigkeit kann deren Viskosität ermittelt werden. Fallkörperviskosimeter Diesem Messverfahren liegt das Gesetz von Stokes für die Sedimentationsgeschwindigkeit sphärischer Körper zugrunde. Die zu messende Flüssigkeit befindet sich in einem Messzylinder mit Radius R. Zur Messung fällt eine Kugel mit Radius r < R durch die Flüssigkeit. Da sich bei einer von der Viskosität abhängigen Geschwindigkeit v der Kugel ein Gleichgewicht zwischen der auf die Kugel wirkenden Gravitationskraft, der Auftriebskraft und der Reibungskraft einstellt, sinkt die Kugel mit konstanter Geschwindigkeit zu Boden. 7.6 Hagen-Poiseuillesches Gesetz Es beschreibt die laminare (langsame) Strömung eines inkompressiblen Fluids durch ein Rohr mit konstantem Querschnitt. Der Strömungswiderstand innerhalb des Rohres und somit auch der Volumendurchflusses hängen von der vierten Potenz des Rohrradius ab. Mit zunehmendem Radius verringert sich der Strömungswiderstand während gleichermaßen der Volumenstrom zunimmt. V ... Volumenstrom [m³/s] dV Δp π r 4 V= = = Δp V ... Volumen [m³] dt R 8ηl t ... Zeit [s] 8ηl R= Δp ... Druckdifferenz [Pa] π r4 R ... Strömungswiderstand r ... Rohrradius [m] η ... Viskosität [Pa s] [Ns/m²] l ... Rohrlänge [m] 61/210 Abbildung 36: Druckverlauf nach dem Hagen-Poiseuilleschen Gesetz Auch bei einem idealen Medium ohne innerer Reibung kommt es zu einem ganz geringen Druckverlust, da ein Teil der Energie für die Fließbewegung des Mediums aufgewendet werden muss (obere strichlierte Linie). Bei einem realen Medium mit innerer Reibung kommt es zu einem Druckverlust, da der Widerstand auch abhängig von der Länge des Rohres ist (quer verlaufende strichlierte Linie). Voraussetzungen für das Hagen-Poiseuillesche Gesetz − Starre Röhren − Laminare Strömung − Homogene (gleichartige) Flüssigkeiten − Benetzbare Gefäßwände − Konstante Strömung 7.6.1 Strömungswiderstände Die Strömungswiderstände lassen sich analog den Gesetzen der Elektrizitätslehre berechnen: − Serielle Widerstände: R ges = ∑ R i i − Parallele Widerstände: R ges = ∑ i 1 Ri Abbildung 37: Einfluss der Einzelwiderstände auf den Gesamtwiderstand 62/210 Beispiel: Um für das Löschen eines Feuers mit einem Feuerwehrschlauch einen möglichst geringen Widerstand zu haben, sollte der vorgeschaltete Widerstand R1 möglichst gering sein (großer Querschnitt des Schlauchs, unterstes Teilbild). 7.6.2 Rohrströmung Bei laminarer Rohrströmung lässt sich der Reibungsverlust und somit das Geschwindigkeitsprofil berechnen. Wir betrachten einen von der ausgebildeten Rohrströmung herausgeschnittenen gedachten Teilzylinder mit dem Radius r0 und der Länge l und bringen an ihm die Schubspannungen und Druckkräfte an. Druck und Reibungskräfte müssen sich das Gleichgewicht halten: Fp = R R Durch Gleichsetzen der beiden Kräfte erhält man eine Gleichung, die die Geschwindigkeitsverteilung beschreibt. Bei laminaren Strömungen (1, 2) ergibt sich ein parabolisches Geschwindigkeitsprofil (das Fluid im Zentrum des Rohres hat eine weit höhere Geschwindigkeit) da es zwischen den einzelnen „Schichten“ des Fluids nicht zu einer Mischung der Drucke kommt. Bei einer turbulenten Strömung (3) ergibt sich ein stark abgeflachtes Geschwindigkeitsprofil (d.h. im Fluid herrscht eine relativ konstante Geschwindigkeit) da sich die Drucke der einzelnen Fluidschichten aufgrund der Turbulenz vermischen. Abbildung 38: Rohrströmung Fp = π r 2 Δp FR = 2 π r l τ = 2 π r l v= ( 1 Δp r02 − r 2 4ηl ) dv dr Fp ... Druck FR ... Reibung r0 ... Rohrradius r ... Abstand von Rohrwand p ... Druck l ... Länge der Fluidschicht τ ... Scherspannung v ... Geschwindigkeit η ... Viskosität 7.7 Laminare vs. turbulente Strömung 63/210 Laminare Strömung Die Strömungsfäden sind parallel zueinander. Der Druck und der Volumensstrom sind proportional zueinander. V ... Volumensstrom Δp V= p ... Druck R R ... Strömungswiderstand Turbulente Strömung Die Strömungsfäden sind verwirbelt. Bei der turbulenten Strömung braucht man einen höheren Druck um den gleichen Volumensstrom wie bei einer laminaren Strömung zu erreichen. Δp V ... Volumensstrom V= p ... Druck R R ... Strömungswiderstand Abbildung 39: Zusammenhang Druck und Strömungsart Reynoldszahl Re Die Reynoldszahl beschreibt den Übergang vom laminaren in den turbulenten Zustand. Sie ist eine dimensionslose Kennzahl, die das Verhältnis von Druck und Viskosität darstellt: Re ... Reynoldszahl [] ρ v2 ρ v l Re = = ρ v² ... Dynamischer Druck (kinetische Energie) [Pa] v η η v l η ... Scherspannung (Reibungsarbeit) [Pa] l vl η Re = mit ν = v ... Strömungsgeschwindigkeit [m/s] ν ρ l ... Breite [m] ρ ... Dichte der Flüssigkeit [kg/m³] η ... Dynamische Viskosität [kg/(ms)] ν ... Kinematische Viskosität [m²/s] 64/210 Abbildung 40: Zusammenhang zwischen Reynoldszahl und Geschwindigkeit 65/210 8 Thermodynamik (Wärmelehre) Die Thermodynamik befasst sich mit Temperatur, Wärme und Umwandlung von Energie. Weiters werden dadurch Umwandlungsprozesse beschrieben. 8.1 System und Zustand Der Begriff „System“ hat verschiedene Bedeutungen, die jedoch alle die „Zusammenstellung“ aus mehreren Elementen, die untereinander in Wechselwirkung stehen, gemeinsam haben. Jedes System besteht aus Elementen (Komponenten, Subsystemen), die untereinander in Beziehung stehen. Meist bedeuten diese Relationen ein wechselseitiges Beeinflussen. Aus der Beziehung wird ein Zusammenhang. Ein System in diesem Sinn lässt sich durch die Definition zweckmäßiger Systemgrenzen von seiner Umwelt (den übrigen Systemen) weitgehend abgrenzen, um es modellhaft isoliert betrachten zu können. Das System selbst ist wiederum Teil eines Ensembles von Systemen und bestimmt mit ihnen die Eigenschaften eines übergeordneten Systems. Viele Systemtheoretiker verstehen ein System nicht als realen Gegenstand, sondern als Modell der Realität. Diese Beschreibung ist mehr oder weniger zweckmäßig. 8.2 Intensive vs. extensive Zustandsgrößen Zustandsgrößen Eine Zustandsgröße ist eine physikalische Größe in einer Zustandsgleichung, die nur vom momentanen Zustand betrachteten physikalischen Systems abhängt und daher vom Weg, auf dem dieser Zustand erreicht wurde, unabhängig ist. In der Thermodynamik erfolgt die eindeutige Beschreibung eines Systems unter anderem mittels folgender Zustandsgrößen: − Druck p − (Absolute) Temperatur T − Volumen V und Teilchenzahl N bzw. Stoffmenge n = N/V − Dichte ρ − Innere Energie U − Enthalpie H − Entropie S Diese Zustandsgrößen bleiben konstant, wenn sich ein System im thermodynamischen Gleichgewicht befindet. Intensive Zustandsgrößen Intensive Zustandsgrößen sind von der Größe des Systems (von der Stoffmenge) unabhängig. Beispiel: Druck, Temperatur Extensive Zustandsgrößen Extensive Zustandsgrößen sind von der Größe des Systems (von der Stoffmenge) abhängig. Beispiel: Teilchenzahl, Volumen. 66/210 8.3 Hauptsätze der Wärmelehre Nullter Hauptsatz der Wärmelehre Stehen zwei Systeme jeweils mit einem dritten im thermodynamischen Gleichgewicht so stehen sie auch untereinander im Gleichgewicht. Beispiel: Bei der Temperaturmessung ist das Thermometer im thermischen Gleichgewicht mit dem zu messenden Körper. Erster Hauptsatz der Wärmelehre (Energieerhaltung) Energie kann weder erzeugt noch vernichtet, sondern nur in verschiedene Arten umgewandelt werden. Die Summe aus der einem System von außen zugeführten Wärme ΔQ und der ihm von außen zugeführten mechanischen Arbeit ΔW ist gleich der Zunahme seiner inneren Energie ΔU: dU = dQ + dW U ... Innere Energie [J] Q ... Zugeführte Wärme [J] W ... Zugeführte mechanische Arbeit [J] Beispiel: − Die Expansion eines Gases in einer Spraydose bewirkt eine Temperaturabnahme. − Die Kompression innerhalb einer Fahrradpumpe bewirkte eine Temperaturerhöhung. − Beim Föhn kühlt sich die wärmere aufsteigende Luft ab, die kältere absteigende Luft erwärmt sich. Zweiter Hauptsatz der Wärmelehre Alternative Formulierungen: − Wärme kann niemals von selbst aus einem kälteren in einen wärmeren Körper übergehen. Ein solcher Vorgang kann nur durch Aufwendung mechanischer Arbeit erreicht werden. − In einem abgeschlossenen System nimmt die Entropie S niemals ab. Sie bleibt bei reversiblen Vorgängen konstant und vergrößert sich bei irreversiblen. − Energie ist nicht in beliebigem Maße in andere Arten umwandelbar. Dritter Hauptsatz der Wärmelehre Es ist unmöglich den absoluten Nullpunkt zu erreichen. 8.4 Wärme vs. Temperatur Wärme Wärme ist die Energie der ungeordneten thermischen Bewegung der Teilchen eines Körpers. SI-Einheit: Joule [J] Temperatur Die Temperatur ist ein Maß für den Wärmezustand, d.h. die mittlere kinetische Energie, eines Körpers. SI-Einheit: Kelvin [K] 67/210 E kin = 3 RT 2 Ekin ... Kinetische Energie eines Gasteilchens [J/mol] R ... Allgemeine Gaskonstante [J/(mol K)] T ... Absolute Temperatur [K] E kin = 3 kB T 2 Ekin ... Kinetische Energie einer Stoffmenge [J] kB ... Boltzmannkonstante [J/K] T ... Absolute Temperatur [K] Maxwell-Boltzmann-Verteilung Die Verteilung der Teilchengeschwindigkeiten in einem idealen Gas wird durch die Maxwell-Boltzmann-Verteilung beschrieben. Abbildung 41: Verschiedene Stoffe bei gleicher Temperatur Abbildung 42: Gleiche Stoffe bei verschiedener Temperatur 8.5 Temperaturskalen Eine Temperaturskala ist eine willkürliche Festlegung der Größenordnung der Temperatur und gestattet die Angabe der Temperatur in Bezug zu einem Vergleichswert. Celsius-Skala [°C] − Gefrierpunkt des Wassers: 0 °C − Siedepunkt des Wassers: 100 °C − 100 Skalenteile zwischen den beiden Fixpunkten Kelvin-Skala − Absoluter Nullpunkt: 0 K − Gefrierpunkt des Wassers: 273 K − 1 °C entspricht 1 K Fahrenheit-Skala − Salmiak/Eis-Mischung: 0 °F − Erhöhte Körpertemperatur: 0 °F 68/210 Umrechnungen Grad Celsius zu Kelvin: TK = TC + 273,15 Kelvin zu Grad Celsius: TC = TK − 273,15 8.6 Entropie Die Entropie ist eine Systemeigenschaft, die die Richtung des Prozessablaufes angibt (siehe auch Kapitel 8.3). Die Entropie... − ... ist ein Maß für die Unordnung eines Systems. Bei fast jedem spontanen physikalischen oder chemischen Vorgang entsteht Entropie von ganz alleine. − ... entsteht dort wo aus Ordnung Unordnung entsteht, d.h. z.B. beim Erwärmen, Schmelzen und Verdampfen. − ... gibt an in welchem Ausmaß von einem System nützliche Arbeit verrichtet werden kann − ... nimmt gemäß dem 2. Hauptsatz der Wärmelehre in einem abgeschlossenen System nimmt niemals ab, d.h. dS ≥ 0 . Reversible Prozesse Bei reversiblen (umkehrbaren) Vorgängen ist die Entropieänderung dS ist das Verhältnis von übertragener Wärme dQ und absoluter Temperatur T. Diese Entropieänderung ist bei Wärmezufuhr positiv, bei Wärmeabfuhr negativ. S ... Entropie [J/K] dQ dS = Q ... Wärme [J] T T ... Absolute Temperatur [K] Für reversible Kreisprozesse bleibt die Entropie insgesamt unverändert, d.h. dS = 0 . Beispiel: Durch die Wärmemenge dQ wird das Flüssigkeitsvolumen V verdunstet. Bei der Kondensation wird genau die Wärmemenge dQ wieder frei (falls keine Verluste eintreten). Irreversible Prozesse Die Entropievermehrung durch irreversible Vorgänge in einem isolierten System wird durch die Ungleichung dS > 0 beschrieben, d.h. bei solchen spontan ablaufenden Prozessen findet immer eine Entropiezunahme statt. Beispiel: − Vermischung von zwei unterschiedlichen Flüssigkeiten. − Wärmetransport von einem heißen zu einem kalten Körper. Standardentropie Da die Entropie eine temperaturabhängige Größe ist wurde der Begriff der Standardentropie eingeführt, die Entropie eines Stoffes unter Standardbedingungen. 69/210 Entropie als Wahrscheinlichkeit Die Entropie kann auch als Wahrscheinlichkeit definiert werden, mit der ein Zustand eintritt: S ... Entropie [J/K] S = k B ln W kB ... Boltzmannkonstante [J/K] W ... Zahl der Möglichkeiten Entropie und das Leben Ein Kennzeichen des Lebens besteht auch für den Menschen darin, dass er seine Struktur bewahrt, also seine Entropie nicht (wesentlich) ansteigen lässt. Durch Zufuhr von Energie können Lebewesen ihre geordnete Struktur aufrechterhalten. Stirbt ein Organismus nimmt ein spontaner Vorgang statt, der den Ordnungszustand stets verringert und damit die Entropie erhöht. 8.7 Enthalpie Die Enthalpie ist ein Maß für die Energie eines thermodynamischen Systems. Die Enthalpie setzt sich additiv aus zwei Teilen zusammen, der inneren Energie U und der Volumenarbeit pV („Hupf“): H = U + pV H ... Enthalpie [kJ/kg] U ... Innere Energie [kJ] p ... Druck [Pa] V ... Volumen [m³] Die innere Energie besteht aus der thermischen Energie - beruhend auf der ungerichteten Bewegung der Moleküle (Kinetische Energie, Rotationsenergie, Schwingungsenergie) - der chemischen Bindungsenergie und der Potentiellen Energie der Atomkerne. Sie nimmt ungefähr proportional zur Temperatur des Systems zu und ist am absoluten Nullpunkt gleich der Nullpunktsenergie. Die Volumenarbeit ist in diesem Fall anschaulich die Arbeit, die gegen den Druck p verrichtet werden muss, um das Volumen V zu erzeugen, das vom System im betrachteten Zustand eingenommen wird. 8.8 Phasenübergänge Am Phasenübergang gehen unterschiedliche Phasen (Aggregatszustände) eines Materials ineinander über. 70/210 Abbildung 43: Phasenübergänge der drei Aggregatszustände 8.8.1 Phasenübergänge des Wassers Abbildung 44: Zustandsdiagramm des Wassers − Tripelpunkt (0 °C): Punkt an dem drei Phasen eines Systems im Gleichgewicht sind. − Siedepunkt (100 °C): Punkt an dem das Wasser vom flüssigen in den gasförmigen Zustand übergeht. − Kritischer Punkt: Punkt ab dem Gas und Flüssigkeit die gleiche Dichte besitzen und damit oberes Ende der Dampfdruckkurve. Die Unterschiede zwischen beiden Aggregatzuständen hören auf zu existieren. − Dampfdruckkurve: flüssig ↔ gasförmig − Schmelzkurve: fest ↔ flüssig − Sublimationskurve: fest ↔ gasförmig 71/210 Abbildung 45: Energie/Temperatur-Diagramm für die Phasenübergänge des Wassers von Eis zu Dampf (1) Ein Eisblock mit einer Temperatur von ca. -20 °C wird durch Energiezufuhr bis zu einer Temperatur von 0 °C erwärmt. (2) Der Eisblock schmilzt und geht dadurch in den flüssigen Aggregatszustand über. Die Energie (Spezifische Schmelzwärme cs = 334 kJ/kg) wird für die Änderung des Aggregatszustands benötigt und äußerst sich nicht in einem Temperaturanstieg, d.h. die Temperatur bleibt konstant bei 0 °C. (3) Das Wasser ist nun flüssig und wird durch Energiezufuhr bis zu einer Temperatur von 100 °C erwärmt. (4) Bei einer Temperatur von 100 °C siedet Wasser und geht in den gasförmigen Zustand über. Die Energie (Spezifische Verdampfungswärme cv = 2250 kJ/kg) wird wiederum für die Änderung des Aggregatszustands benötigt. Die Temperatur bleibt konstant bei 100 °C. (5) Nachdem das Wasser nun vollständig zu Dampf geworden ist führt eine weitere Energiezufuhr wieder zu einem Temperaturanstieg. 8.8.2 Spezifische Wärmekapazität Die spezifische Wärmekapazität bezeichnet die auf die Masse bezogene Wärmekapazität. Sie gibt an, welche Wärmemenge einem Stoff zugeführt werden muss, um seine Temperatur um ein Kelvin zu erhöhen. − Spezifische Wärmekapazität von Eis: cf = 2,060 kJ/(kg K) − Spezifische Wärmekapazität von Wasser: cl = 4,183 kJ/(kg K) − Spezifische Wärmekapazität von Wasserdampf: cg = 1,870 kJ/(kg K) 8.8.3 Änderung der Umwandlungspunkte Eine Druckerhöhung bedeutet eine Erhöhung des Siedepunktes. Erhitzt man eine Flüssigkeit in einem geschlossenen Gefäß, so lastet zusätzlich zum Luftdruck noch der Druck des Dampfes auf der Flüssigkeitsoberfläche. Zum Sieden ist daher eine höhere Temperatur erforderlich. Beispiel: Druckkochtopf, Autoklav Eine Verminderung des Drucks bewirkt eine Erniedrigung der Siedetemperatur. Beispiel: Am Mount Everest (Druck ca. 0,3 bar) siedet Wasser schon bei 70 °C. 72/210 Der Siedepunkt wird durch Salzbeimengung erhöht. Der Dampfdruck von Lösungen ist kleiner als der des Lösungsmittels, daher liegt der Siedepunkt der Lösung höher. Beim Verdampfen verdampft allerdings nur das Lösungsmittel. Beispiel: Eindampfung einer Sole (Salz-Wasser-Mischung) in einer Saline zur Salzgewinnung. Der Gefrierpunkt wird durch Salzbeimengung erniedrigt. Beispiel: − Salzstreuung bei Glatteis: Bei einer Eis-Salz-Mischung im Verhältnis 3:1 schmilzt das Eis, das Salz löst sich im Wasser und die Lösung gefriert erst bei 21 °C. − Meerwasser gefriert erst bei -2,5 °C. 8.9 Luftdruck 8.9.1 Daltonsches Gesetz Betrachtet man ein Gemisch von Gasen, die sich ideal verhalten und nicht miteinander reagieren, so werden die Anteile ihrer einzelnen Komponenten durch ihre Partialdrücke wirksam. Der Partialdruck einer Komponente entspricht dem Druck, den diese Komponente ausüben würde, wenn sie sich alleine in dem betrachteten Volumen befände. Das Daltonsche Gesetz der Partialdrücke besagt, dass sich der Gesamtdruck p eines Gasgemisches additiv aus den Partialdrücken pi der Komponenten zusammensetzt. n p ... Druck [Pa] p = ∑ pi pi ... Partialdrücke [Pa] i =1 8.9.2 Barometrische Höhenformel Die barometrische Höhenformel beschreibt die Änderung des Luftdruckes mit der Höhe, d.h. einen vertikalen Druck-Gradienten. Der Luftdruck ergibt sich aus dem Gewicht (Kraft) der Luftsäule auf eine Fläche: ⎛ gρ ⎞ ⎛ z ⎞ p ... Luftdruck in der Höhe z [hPa] p(z) = p0 exp ⎜ − z ⎟ = p 0 exp ⎜ − ⎟ p0 = 1013 hPa ... Druck in der Höhe z ⎝ H⎠ ⎝ p0 ⎠ ρ = 1,15 kg/m³ ... Dichte in der Höhe z g = 9,81 m/s² ... Erdbeschleunigung z ... Höhe [m] H = 8005 m = const. 73/210 8.9.3 Eigenschaften der Luft Luft ist ein Gemisch aus verschiedenen Gasen. Nach dem Daltonschen Gesetz ergibt die Summe der Partialdrücke dieser Gase den Gesamtluftdruck. Die trockene Luft (N2, O2, CO2, etc.) ist ihrer Zusammensetzung konstant. Der Wasserdampfanteil der Luft ist variabel und bewegt sich in einem Bereich von 0-3 %. Gas N2 O2 Edelgase (z.B. Argon) CO2 H2O Volumensanteil [%] 78,1 21,0 0,9 0,033 0-3 Partialdruck [hPa] 791,1 212,3 9,42 0,334 8.10 Physik der feuchten Luft 8.10.1 Ideales Gas Im Modell des idealen Gases werden alle Gasteilchen als ausdehnungslose Massepunkte angenommen, welche sich frei durch das ihnen zur Verfügung stehende Volumen bewegen können. Ein Gasteilchen bewegt sich geradlinig mit einer konstanten Geschwindigkeit, bis es durch einen elastischen Stoß (Aufprall an eine Wand oder ein anderes Teilchen) in eine andere Richtung gelenkt und dabei beschleunigt oder abgebremst wird. 8.10.2 Thermische Zustandsgleichung Die allgemeine Zustandsgleichung beschreibt den Zustand des idealen Gases bezüglich der Zustandsgrößen Druck p, Volumen V, Temperatur T und Stoffmenge n bzw. Teilchenzahl N bzw. Masse m. Sie liefert damit den Zusammenhang zwischen Dichte ρ und Dampfdruck p. Bezogen auf die Masse [kg]: p ... Gasdruck [Pa] p p = ρ R T bzw. ρ = ρ ... Dichte des Gases [kg/m³] RT R ... Spezifische Gaskonstante des Gases [J/(kg K)] T ... Absolute Temperatur [K] Bezogen auf die Stoffmenge [mol]: p ... Gasdruck [Pa] nRT p= n ... Stoffmenge [mol] V R = 8,314 J/(kg K) ... Universelle Gaskonstante T ... Absolute Temperatur [K] V ... Gasvolumen [m³] Universelle vs. spezifische Gaskonstante Die universelle Gaskonstante geteilt durch die molare Masse eines bestimmten Gases ergibt dessen spezifische Gaskonstante. Beispiel: − Die molare Masse für trockene Luft beträgt 0,0289644 kg/mol. Somit ergibt sich für die spezifische Gaskonstante von Luft RL = 287 J/(kg K). − Die spezifische Gaskonstante für Wasserdampf: RD = 462 J/(kg K). 74/210 8.10.3 Gesetz von Boyle-Mariotte Das Gesetz von Boyle-Mariotte besagt, dass der Druck idealer Gase bei gleichbleibender Temperatur und gleichbleibender Stoffmenge umgekehrt proportional zum Volumen ist. Erhöht man den Druck auf ein Gaspaket, wird durch den erhöhten Druck das Volumen verkleinert. Verringert man den Druck, so dehnt es sich aus. Abbildung 46: Zusammenhang zwischen Druck und Volumen in einem idealen Gas Für T = const und n = const gilt: p1 V1 1 p~ pV = const = V p 2 V2 p... Gasdruck [Pa] V ... Volumen [m³] T ... Absolute Temperatur [K] n ... Stoffmenge [mol] 8.10.4 Gesetz von Gay-Lussac Das Gesetz von Gay-Lussac besagt, dass das Volumen idealer Gase bei gleichbleibendem Druck und gleichbleibender Stoffmenge direkt proportional zur Temperatur ist. Ein Gas dehnt sich also bei einer Erwärmung aus und zieht sich bei einer Abkühlung zusammen. Für p = const und n = const gilt: p... Gasdruck [Pa] V V1 T1 T~V = const = V ... Volumen [m³] T V2 T2 T ... Absolute Temperatur [K] n ... Stoffmenge [mol] 8.10.5 Dampfdruck Die Teilchen einer Flüssigkeit sind in ständiger Bewegung. Ihre mittlere Bewegungsenergie ist umso größer, je höher die Temperatur ist. Einzelne Teilchen können so hohe Bewegungsenergien erzielen, dass sie imstande sind aus der Flüssigkeit zu entweichen. In einem geschlossenen Gefäß bildet sich oberhalb der Flüssigkeit Dampf. Durch Abkühlung treten einzelne Dampfmoleküle wieder in die Flüssigkeit ein, sie kondensieren. Eine Flüssigkeit kann nur so lange verdampfen, bis der entstandene Dampf einen bestimmten Höchstdruck, den (temperaturabhängigen) Sättigungsdampfdruck erreicht hat. Im thermodynamischen Gleichgewicht halten Kondensieren (gasförmig → flüssig) und Verdampfen (flüssig → gasförmig) einander die Waage. In diesem Fall enthält der Dampf die maximale Flüssigkeitsmenge und wird als gesättigt bezeichnet. 75/210 Da die Anzahl der aus der Flüssigkeit austretenden Teilchen von der Temperatur abhängt, ist auch der Dampfdruck umso größer, je höher die Temperatur ist. Jene Temperatur, bei der der Dampfdruck einer Flüssigkeit gleich dem auf der Flüssigkeitsoberfläche lastenden Druck ist, nennt man Siedetemperatur. ⎛ 19,83 T ⎞ pD,s(T) ... Sättigungsdampfdruck bei einer p D,s (T) = p D,s (0°C) exp ⎜ ⎟ Gastemperatur T [hPa] ⎝ 273 + T ⎠ pD,s(0°C) = 6,1 hPa ... Sättigungsdampfdruck bei einer Gastemperatur von T = 0 °C T ... Temperatur (°C) 8.10.6 Partialdrücke für trockene Luft und Wasserdampf Nach dem Daltonschen Gesetz (siehe Kapitel 8.9.1) ist der Luftdruck p die Summe der Partialdrücke für Wasserdampf pD und für trockene Luft pL, d.h. p = p L + p D . p ... Gasdruck [Pa] p L = ρL R L T ρ ... Dichte des Gases [kg/m³] und R ... Spezifische Gaskonstante des Gases [J/(kg K)] p D = ρD R D T T ... Absolute Temperatur [K] 8.10.7 Absolute Feuchtigkeit Die Dichte des Wasserdampfs ρD wird auch als absolute Feuchtigkeit bezeichnet. Sie ist ein direktes Maß für die in einem gegebenen Luftvolumen enthaltene Wasserdampfmenge. pD ... Dampfdruck [hPa] p ρD = D ρD ... Dichte des Wasserdampfs [kg/m³] RD T RD ... Spezifische Gaskonstante des Wasserdampfs [J/(kg K)] T ... Absolute Temperatur [K] 8.10.8 Relative Feuchtigkeit Die Relative Feuchtigkeit f ist das Verhältnis von Dampfdruck pD und Sättigungsdampfdruck pD,s und liegt zwischen f = 0 (wenn pD = 0 hPa) und f = 1 bzw. 100 % (wenn pD = pD,s). f ... Relative Feuchte [] p f = D 100 % pD ... Dampfdruck [hPa] p D,s pD,s ... Sättigungsdampfdruck [hPa] 8.10.9 Mischungsverhältnis Das Mischungsverhältnis x ist das Verhältnis des Massenanteils (angegeben als Dichte) des Wasserdampfs zu dem der trockenen Luft. Das Mischungsverhältnis ist eine dimensionslose Größe, doch lässt sich die Maßeinheit anhand der Definition auch als kg Wasserdampf pro kg trockene Luft interpretieren. x ... Mischungsverhältnis [] p x = 0, 622 D pD ... Dampfdruck [hPa] p − pD p ... Luftdruck [hPa] 76/210 8.10.10 Spezifische Enthalpie Die spezifische Enthalpie der feuchten Luft h beschreibt den Energiegehalt bezogen auf die Masse. Auch die spezifische Enthalpie der feuchten Luft muss getrennt für Wasserdampf hD und trockene Luft hL berechnet werden, d.h. h = h L + x h D . Die spezifische Enthalpie der feuchten Luft nimmt für eine Temperatur von 0 °C und dem Fehlen von Wasserdampf (x = 0) den Wert null an. Für trockene Luft: h L = cL T Für Wasserdampf: h D = cD T + cV hL ... Spezifische Enthalpie der trockenen Luft [kJ/kg] cL = 1,006 kJ/(kg K) ... Spezifische Wärmekapazität der trockenen Luft T ... Gastemperatur [°C] hL ... Spezifische Enthalpie von Wasserdampf cL = 1,006 kJ/(kg K) ... Spezifische Wärmekapazität von Wasserdampf T ... Gastemperatur [°C] cV = 2500 kJ/kg ... Verdampfungswärme von Wasser 77/210 8.10.11 Mollier-Diagramm Das Mollier-Diagramm ist ein Hilfsmittel zur Bestimmung diverser Zustandsgrößen der feuchten Luft auf dem graphischen Weg wobei mindestens 2 Größen bekannt sein müssen. Abbildung 47: Mollier-Diagramm 78/210 9 Energiebilanz des Tieres Der Stoffwechsel (Metabolismus) steht für die Aufnahme, den Transport und die chemische Umwandlung von Stoffen in einem Organismus sowie die Abgabe von Stoffwechselendprodukten an die Umgebung. Diese biochemischen Vorgänge (z.B. innere und äußere Atmung, Transportvorgänge, Ernährung ...) dienen dem Aufbau und der Erhaltung der Körpersubstanz (Baustoffwechsel), der Energiegewinnung (Energiestoffwechsel) und damit der Aufrechterhaltung der Körperfunktionen. Abbildung 48: Überblick über den Energiehaushalt des Tieres 9.1 Erhaltungszustand Das Tier nimmt die für Aufrechterhaltung seiner Körperfunktionen (z.B. Konstanthaltung der Körpertemperatur) und für die zu verrichtende Arbeit (z.B. Bewegung, Jagd) notwendige Energie in Form von Nahrung auf. Überschüssige Energiereserven können z.B. in Form von Glykogen (tierischer Stärke) oder Fettreserven gespeichert werden: Nahrung = Erhaltung + Arbeit + Speicherung Für den Erhaltungszustand eines Tieres, d.h. ohne zusätzlich Arbeit zu verrichten oder Energie zu speichern kann folgende vereinfachte Bilanzgleichung aufgestellt werden: M + R + C + K + E + R ES = 0 M ... Metabolimus (Stoffwechsel) [W] R ... Wärmestrahlung [W] C ... Wärmeströmung (Konvektion) [W] K ... Wärmeleitung (Konduktion) [W] E ... Verdunstung [W] RES ... Atmung [W] 79/210 9.2 Stoffwechsel (Metabolismus) Tiere müssen kontinuierlich dafür sorgen ihren Stoffwechsel aufrecht zu erhalten. Ihr Energiekonsum wird als Stoffumsatz M [W] [J/s] bezeichnet. Durch die Reaktion der aufgenommenen Nahrungsmenge mit Sauerstoff werden Wärme und weitere Stoffwechselprodukte erzeugt: Nahrung + Sauerstoff = Reaktionswärme H + Reaktionsprodukte Die gewonnene Wärme H [J] wird für die Aufrechterhaltung der Lebensfunktionen (z.B. Bewegung, Wachstum, Signalübertragung, Stofftransport, etc.) benötigt. Der tägliche Stoffumsatz eines Tieres mit der Körpermasse m, bzw. die täglich notwendige Aufnahme chemischer Energie M, kann folgendermaßen bestimmt werden (siehe Abbildung 50): ΔH Joule M= 24 h/Tag . 60 min/h . 60 s/min Der Stoffwechsel M kann dabei durch folgende Formel beschrieben werden: M ... Metabolimus (Stoffwechsel) [W] M = a b mα a = 4 W/kgα ... Artspezifische Metabolismuskonstante b ... Aktivitätskonstante (2 < b < 15) m ... Körpermasse [kg] α = ¾ ... Exponent Anmerkung: Im Nenner der Einheit der artspezifischen Metabolismuskonstante a steht die Masse zum Exponenten α, um die Masse zum Exponenten α angeben zu können und trotzdem als Einheit für den Stoffwechsel Watt zu erhalten. 9.3 Mechanismen zur Steuerung des Wärmeflusses Es gibt drei Mechanismen zum Transport thermischer Energie: Wärmeleitung (Konduktion), Wärmeströmung (Konvektion) und Wärmestrahlung. Oft treten diese Transportprozesse gleichzeitig nebeneinander auf. − Wärmeleitung (Konduktion) kann Wärme zwischen Objekten transportieren, die miteinander in Kontakt stehen. Extreme Wärmeverluste oder –steigerungen können durch Wärmedämmung verhindert werden. − Wärmeströmung (Konvektion) erfordert ein Medium (z.B. Fluid, Gas), das die Wärme absorbiert und an einen anderen Ort befördert. − Wärmestrahlung befördert Energie durch die Luft oder das Vakuum. Tiere können einen gewissen Einfluss auf diese drei Prozesse ausüben. Beispiel: − Ein Vogel kann sein Gefieder aufplustern um die Dicke seiner isolierenden Schicht zu vergrößern und somit Wärmeverlust durch Wärmeleitung verhindern. − Delphine und Thunfische können ihren Blutfluss in Richtung ihrer Extremitäten regulieren und dementsprechend den Wärmeverlust durch Wärmeströmung regeln. − Insekten suchen am frühen Morgen das Sonnenlicht um ihren Körper durch die Sonnenstrahlung aufzuwärmen. 80/210 9.4 Strahlung Das Stefan-Boltzmannsche Gesetz gibt die von einem Körper thermisch abgestrahlte Leistung in Abhängigkeit von seiner Temperatur an: R ... Strahlung [W] R = A σ ε T4 A ... Körperoberfläche [m²] σ = 5,67 . 108 W/(m² K4) ... Stefan-Boltzmann Konstante ε ≈ 0,95 ... Emissionsfaktor für Haut und Kleidung Τ ... Temperatur der Körperoberfläche [K] Zwei Strahlungsströme können auch miteinander kombiniert werden. Sei R1 der Strahlungsstrom, der von einem Tier ausgeht und R2 der Strahlungsstrom von der Umgebung. Dann ist der Strahlungsstrom R = R 2 − R1 die Strahlungsleistung der Umgebung ohne jener des Tieres: R1 ... Strahlungsstrom vom Tier [W] R1 = σ ε T14 T1 ... Oberflächentemperatur des Tieres [K] R 2 = σ ε T2 4 R2 ... Strahlungsstrom von der Umgebung [W] T2 ... Oberflächentemperatur der Umgebung [K] 9.5 Wärmeströmung (Konvektion) Konvektion ist ein Mechanismus zur Wärmeübertragung von thermischer Energie über den Transport von Teilchen. Daher kann es in Festkörpern oder im Vakuum keine Konvektion geben. Konvektion tritt bei Fluiden, d.h. Gasen oder Flüssigkeiten, auf. C ... Wärmeströmung (Konvektion) [W] C = A α K (Ta − Tcl ) A ... Oberfläche [K] αΚ ... Konvektiver Übergangskoeffizient [W/(m² K)] Ta ... Lufttemperatur [°C] Tcl ... Oberflächentemperatur [°C] Freie (natürliche) Konvektion Der Teilchentransport erfolgt freiwillig aufgrund eines Temperaturunterschiedes. Erzwungene Konvektion Der Teilchentransport erfolgt aufgrund äußerer Einwirkung, z.B. durch ein Gebläse oder eine Pumpe (für Luftgeschwindigkeiten über 0,1 m/s). Beispiel: An der Außenseite des Heizkörpers tritt freie Konvektion der Luft auf: Warme Luft steigt nach oben, von unten wird kalte Bodenluft nachgesaugt. In Inneren des Heizkörpers wird durch Umwälzpumpen für erzwungene Konvektion des Wasserkreislaufes zwischen Ofen und Heizkörper gesorgt. Oberflächenvergrößerung Die Oberfläche über die die Wärmeströmung erfolgt kann, z.B. durch das Haarkleid vom thermischen Isolierungsfaktor desselben, vergrößert werden. 81/210 9.6 Wärmeleitung (Konduktion) Unter Wärmeleitung wird der Wärmefluss in einem Kontinuum (Feststoff oder ruhendes Fluid) infolge eines Temperaturunterschiedes verstanden. D.h. es handelt sich um den Transport thermischer Energie ist jedoch niemals mit dem Transport von Teilchen verknüpft. Die Wärme fließt aufgrund des zweiten Hauptsatzes der Thermodynamik immer nur in Richtung geringerer Temperatur. Abbildung 49: Wärmestrom angetrieben durch eine Temperaturdifferenz Φ= (T − Tcl ) dQ =λA m dt l Φ... Wärmestrom [W] Q ... Wärme [J] t ... Zeit [s] λ ... Wärmeleitfähigkeit [W/(m K)] A ... Fläche [m²] Tm ... Oberflächentemperatur der Materie [°C] Tcl ... Oberflächentemperatur [°C] l ... Länge [m] Wärmeleitfähigkeit (Wärmeleitzahl) λ Die Wärmeleitfähigkeit λ [W/(m K)] beschreibt das Vermögen eines Stoffes, thermische Energie mittels Wärmeleitung in Form von Wärme zu transportieren und ist eine temperaturabhängige Materialkonstante. Eine höhere Wärmeleitfähigkeit bedeutet eine bessere (schnellere) Wärmeübertragung. Stoff Silber Aluminium Glas Wasser Körperfett Rinderfell Luft Wärmeleitfähigkeit [W/(m K)] 419 237 1,0 0,56 0,2-1,0 0,1 0,024 → guter Dämmstoff Wärmestromdichte q Die Wärmestromdichte q beschreibt den Wärmestrom pro Fläche: q ... Wärmestromdichte [W/m²] Φ q= Φ... Wärmestrom [W] A A ... Fläche [m²] 82/210 9.6.1 Stationäre Wärmeleitung Im stationären Fall ändert sich die Temperatur im Lauf der Zeit nicht, d.h. dT / dt = 0 . Ausgehend von der Temperatur T1 am einen Ende des Körpers kann abhängig vom Abstand x von diesem Ausgangspunkt die Temperatur T(x) an dieser Position berechnet werden: T(x) ... Temperatur an Position x [K] Φ T(x) = x + T1 T1 ... Ausgangstemperatur [K] λA Φ... Wärmestrom [W] λ ... Wärmeleitfähigkeit [W/(m K)] A ... Fläche [m²] x ... Abstand [m] Bei Berechnung des Wärmestroms Φ muss beachtet werden, dass dieser von der Geometrie abhängt, d.h. ob es sich z.B. eher um einen hohlzylinderförmigen oder einen hohlkugelförmigen Körper handelt. 9.6.2 Instationäre Wärmeleitung Im stationären Fall ändert sich die Temperatur im Lauf der Zeit, d.h. dT / dt ≠ 0 . Beispiel: Temperaturverlauf innerhalb der Nasen durch die Atmung. 9.7 Verdunstung Den Übergang einer Flüssigkeit in den gasförmigen Zustand unterhalb der Siedetemperatur nennt man Verdunsten. Da jene Flüssigkeitsteilchen verdunsten, die eine hohe Bewegungsenergie aufweisen, sinkt dadurch die Temperatur der Flüssigkeit, d.h. es entsteht Verdunstungskälte. Die zum Verdunsten nötige Wärme kann auch der Umgebung entzogen werden. E ... Verdunstung [W] E = A c E (pa − ps ) A ... Fläche [m²] cE ... Verdunstungskonstante [W/(m² Pa)] ps ... Dampfdruck der Haut (Sättigungsdampfdruck für die Hauttemperatur Ts) [Pa] pa ... Dampfdruck der Luft (Umgebung) [Pa] Wasserverdunstung Wasser verdunstet schon bei Raumtemperatur, insofern die Luft nicht mit Wasserdampf gesättigt ist. Auf dem Prinzip der Wasserverdunstung beruht beispielsweise das Freilufttrocknen von Wäsche oder das Verschwinden von Wasserpfützen. Der Effekt der Verdunstungskühlung durch Wasser ist die Grundlage für den Effekt der Thermoregulation durch Schwitzen, indem der Haut die Verdunstungswärme entzogen und diese dadurch abgekühlt wird. 9.8 Atmung Über die Atmung RES wird Energie in Form von sensiblen (durch Erwärmung der eingeatmeten Luft) Wärmeströmen L und latenten Wärmeströmen ERES (durch die Verdunstung im Atemtrakt) abgegeben: RES = L + E RES 83/210 Sensibler Anteil L L = c L A M (Ta − Tc ) L ... Sensibler Wärmestrom durch Erwärmung [W] cL = 0,0014 /K A ... Fläche [m²] M ... Metabolismus [W] Ta ... Lufttemperatur [°C] Tc ... Körperkerntemperatur [ca. 37 °C] Latenter Anteil ERES Definition über den Dampfdruck: E ... Latenter Wärmestrom durch Verdunstung [W] E RES = c RES A M (pa − pc ) cRES = 1,72 . 10-5 /Pa A ... Fläche [m²] M ... Metabolismus [W] pa ... Dampfdruck der eingeatmeten Luft [Pa] pc ... Dampfdruck der ausgeatmeten Luft (Sättigungsdampfdruck für ca. 37 °C) [Pa] Definition über die Enthalpie: E ... Latenter Wärmestrom durch Verdunstung [W] E RES = V A ρ (h a − h c ) V ... Volumenstrom der Atmung [m³/s] A ... Fläche [m²] ρ ... Dichte der Luft [kg/m³] ha ... Spezifische Enthalpie der eingeatmeten Luft [J/kg] pc ... Spezifische Enthalpie der ausgeatmeten Luft [J/kg] Anmerkung: Für den Volumenstrom der Atmung V gelten folgende Grundannahmen: 16 Atemzüge pro Minute und 0,5 l Luft pro Atemzug. 9.9 Allometrie Bei der Allometrie (griech. allos = anders, metrie = messen) geht es um das Messen und Vergleichen von Beziehungen zwischen der Körpergröße und deren Verhältnis zu verschiedensten biologischen Größen. Die Leistung eines Organismus kann nicht so einfach von klein auf groß übertragen werden. Auch die Größenverhältnisse innerhalb einer Art können nicht 1:1 umgesetzt werden. Beispiel: Würde der Kopf vom Säugling zum Erwachsenen proportional zur Gesamtlänge des Körpers zunehmen, müsste der Kopf eines erwachsenen Menschen ca. 45 cm hoch sein. 9.9.1 Klassische Allometrieformel Die klassische Allometrieformel von Otto Snell beschreibt den Zusammenhang zwischen Körpermasse und einer davon abhängigen Größe: y ... Abhängige Größe y = a xα a, α ... Freie Parameter x ... Körpermasse [kg] Der Parameter a ist die Integrationskonstante und definiert den Schnittpunkt der Kurve mit der y-Achse. 84/210 Der Exponent α ist ein Maß für das Verhältnis der relativen Wachstumsgeschwindigkeiten, d.h. die absolute Wachstumsgeschwindigkeit dividiert durch die Wachstumsgröße zum selben Zeitpunkt: − α = 1: Isometrie − α < 1: Negative Allometrie − α > 1: Positive Allometrie Allerdings gilt diese Grenze nur bei Maßen gleicher Dimension. Ist x die Körpermasse (3-dimensional) und y eine Länge (1-dimensional) so ist α = 1/3 isometrisch. Im doppelt logarithmierten Koordinatensystem wird aus der Potenzfunktion eine Gerade: y = a x α | log log y = log a + α log x y = d + kx Abbildung 50: Zusammenhang von Körpermasse und Stoffumsatz über ein Potenzgesetz (lineare Kurve in doppelt logarithmierter Darstellung) 9.9.2 Meshsche Formel Die Meshsche Formel gibt den Zusammenhang zwischen Körpermasse und Körperoberfläche an: A ... Körperoberfläche [m²] A = a mα a = 0,1 ... Artspezifische Konstante für den Menschen [m²/kgα] α = 0,67 ... Exponent m ... Körpermasse [kg] 85/210 10 Schwingungen und Wellen 10.1 Schwingungen Eine Schwingung ist eine regelmäßig wiederkehrende (periodische) Bewegung um einen Ruhepunkt. Abbildung 51: Ungedämpfte harmonische Schwingung − Die Auslenkung (Elongation) y(t) zu einem Zeitpunkt t gibt den momentanen Wert der Größe y an. − Die Amplitude gibt den maximal möglichen Wert der Größe y an. − Die Periodendauer (Schwingungsdauer) ist die Zeit, die verstreicht, während ein schwingungsfähiges System genau eine Schwingungsperiode durchläuft, d. h. nach der es sich wieder im selben Schwingungszustand befindet. Der Kehrwert der Periodendauer T ist die Frequenz f, d.h. f = 1/ T . Beispiel: Schwingungen sind allgegenwärtig: − Natürliche Phänomene: Atome, Moleküle, Festkörper, Sonne (Tag, Jahr) − Organische Phänomene: Herzschlag, Atmung, Hören, Sprechen, Fortbewegung (Beine, Flügel) − Technische Phänomene: Musik, Uhren, Radar, Ultraschall, Kernspintomograph, Seismograph, Messgeräte Harmonische Schwingungen − Die rückstellende Kraft ist proportional der Auslenkung − kx − Die Energie pendelt zwischen zwei Energieformen − Sich selbst überlassen schwingt das System in der Eigenschwingung ω − Lassen sich durch einfache Winkelfunktionen (Sinus oder Cosinus) beschreiben Anharmonische Schwingungen − Lassen sich nicht durch einfache Winkelfunktionen beschreiben (nur als erste Näherung) − Alle realen physikalischen Vorgänge 86/210 10.2 Fadenpendel Ein Fadenpendel besteht aus einer Masse m (die in einem einzigen Punkt konzentriert ist), die am Ende eines massenlosen Fadens der Länge l befestigt ist. Wird das Pendel bewegt herrscht keinerlei Reibungswiderstand. Schwingungsdauer Die Schwingungsdauer des Fadenpendels hängt von der Länge des Fadens und der Erdbeschleunigung, jedoch nicht von der am Faden befestigten Masse ab: τ ... Schwingungsdauer [s] l τ = 2π l ... Fadenlänge [m] g g ... Erdbeschleunigung [m/s²] Abbildung 52: Fadenpendel 10.3 Federpendel Ein Federpendel ist ein aus einer Feder und einer Masse bestehendes schwingungsfähiges System. Bei einem Federpendel ist eine Masse reibungsfrei durch elastische Kräfte in einer Ruhelage fixiert. Wenn diese Masse aus ihrer Ruhelage entfernt wird, wirkt eine rücktreibende Kraft um sie wieder in diese Ruhelage zurück zu versetzen. Das führt zu einer periodischen Hin- und Herbewegung, einer Schwingung. Abbildung 53: Federpendel 10.3.1 Herleitung der Schwingungsgleichung Ein Federpendel übt eine entgegen der Auslenkung (bzw. Dehnung) x gerichtete, zu x proportionale Kraft F aus: F = −k x K ... Kraft [N] k ... Federkonstante [N/m] x ... Auslenkung [m] Anmerkung: Das Minuszeichen drückt aus, dass Kraft- und Dehnungsrichtung einander entgegengesetzt sind. Wenn an der ausgelenkten Feder eine Masse m befestigt ist, so wirkt die Federkraft nach dem zweiten Newtonschen Gesetz beschleunigend auf diese Masse: F=ma K ... Kraft [N] m ... Masse [kg] a ... Beschleunigung [m/s²] 87/210 Sowohl die Kraft als auch die Dehnung ändern sich als Funktion der Zeit t und es geht nun darum, eine dieser beiden Größen zu ersetzen, um eine einzige Gleichung für nur eine Unbekannte zu erhalten. Üblicherweise eliminiert man aus den beiden Gleichungen die Kraft und es ergibt sich die Bewegungsgleichung: a ... Beschleunigung [m/s²] k a=− x k ... Federkonstante [N/m] m m ... Masse [kg] bzw. x ... Auslenkung [m] m a = −k x Schwingungsgleichung Da die Beschleunigung die zweite Ableitung der Auslenkung nach der Zeit ist, ergibt sich die folgende Differentialgleichung: x ... Auslenkung [m] d2x k = − x t ... Zeit [s] dt 2 m k ... Federkonstante [N/m] bzw. m ... Masse [kg] d2x 2 ω ... Resonanzfrequenz [s-1] = −ω x 2 dt Abbildung 54: Bewegungsgleichungen für Auslenkung, Geschwindigkeit und Beschleunigung eines Federpendels Lösung der Schwingungsgleichung Die Lösung dieser Differentialgleichung lautet: x = A cos(ω t + ϕ) x ... Auslenkung [m] A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] t ... Zeit [s] ϕ ... Phasenlage 88/210 Resonanzfrequenz Die Resonanzfrequenz ergibt sich aus folgendem Zusammenhang zwischen Masse und Federkonstante: ω ... Resonanzfrequenz [s-1] k ω= k ... Federkonstante [N/m] m m ... Masse [kg] Die Resonanzfrequenz ω, Schwingungsdauer τ und Frequenz f verbindet folgender Zusammenhang: 1 ω ... Resonanzfrequenz [s-1] ω = 2π f = 2π f ... Frequenz [s-1] τ τ ... Schwingungsdauer [s] Schwingungsdauer Durch Umformung der obigen Gleichungen erhält man die Formel für die Schwingungsdauer τ, die von der Masse und der Federkonstanten abhängt: τ ... Schwingungsdauer [s] m τ = 2π m ... Masse [kg] k k ... Federkonstante [N/m] 10.3.2 Energiebilanz Während der Schwingung eines Federpendels erfolgt ein Übergang von kinetischer Energie Ek (Bewegungsenergie) in potentielle Energie Ep (Lageenergie). Die Gesamtenergie E bleibt konstant, d.h. E = E k + E p = const . Kinetische Energie Ek 2 Ek = 1 1 ⎛ dx ⎞ 1 mv 2 = m ⎜ ⎟ = m A 2 ω2 sin(ωt + ϕ) 2 2 ⎝ dt ⎠ 2 Potentielle Energie Ep 1 1 E p = kx 2 = k A 2 ω2 cos 2 (ωt + ϕ) 2 2 Ek ... Kinetische Energie [J] m ... Masse [kg] v ... Geschwindigkeit [m/s] x ... Weg [m] t ... Zeit [s] A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] ϕ ... Phasenlage Ek ... Kinetische Energie [J] k ... Federkonstante [N/m] x ... Weg [m] A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] t ... Zeit [s] ϕ ... Phasenlage 89/210 Gesamtenergie E 1 E = E k + E p = m A 2 ω2 2 E ... Gesamtenergie [J] Ek ... Kinetische Energie [J] Ep ... Kinetische Energie [J] m ... Masse [kg] A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] 10.4 Gedämpfte Schwingung Tatsächliche physikalische Systeme sind immer gedämpft, da sie z.B. durch Reibung immer Energie an die Umgebung abgeben. Überlässt man ein solches System sich selbst (freie Schwingung) geht aus dem 2. Hauptsatz der Thermodynamik hervor, dass das letztendlich „zum Stillstand“ führt. Perpetua Mobilia sind also nicht möglich. Schwingungsgleichung 2m d2x dx m 2 +γ + kx = 0 mit γ = dt dt τ Lösung der Schwingungsgleichung ⎛ t⎞ x(t) = A exp ⎜ − ⎟ cos(ωt + ϕ) ⎝ τ⎠ m ... Masse [kg] x ... Auslenkung [m] t ... Zeit [s] k ... Federkonstante [N/m] τ ... Schwingungsdauer [s] x ... Auslenkung [m] A ... Amplitude [m] t ... Zeit [s] τ ... Schwingungsdauer [s] ω ... Resonanzfrequenz [s-1] ϕ ... Phasenlage 10.5 Erzwungene Schwingung Bei einer erzwungenen Schwingung wird das System durch eine äußere Kraft, die meist selbst periodisch ist, angetrieben. Fast alle schwingenden Systeme unterliegen einer Dämpfung. Sie benötigen für eine dauerhafte Schwingung mit konstanter Amplitude daher immer einen äußeren Antrieb. Bei periodischem Antrieb ist es dabei wichtig, dass dieser mit der Eigenfrequenz des Systems erfolgt. Sonst wird nur ein geringer Bruchteil der Energie in das schwingende System übertragen. Weiterhin muss der Energieverlust durch die Dämpfung pro Periode (Verlustleistung) gleich der durch die äußere Kraft eingebrachten Energie (Antriebsleistung) sein. Bei zu starkem Antrieb nimmt die Amplitude der Schwingung stetig zu und es kommt über kurz oder lang zur Zerstörung des Systems durch Überlastung, die man als Resonanzkatastrophe bezeichnet. Oft erfolgt kein dauerhafter Antrieb. Das System kann einmalig (z.B. Schlagen einer Trommel) oder über einen endlichen Zeitraum (z.B. Geigenbogen) angeregt werden. Danach endet der Antrieb. In diesem Fall durchwandert das schwingende System zunächst den sogenannten Einschwingvorgang, um dann als gedämpfte Schwingung abzuklingen. 90/210 Beispiel: − Eine Kinderschaukel, die immer am höchsten Punkt durch eine Person angestoßen wird. − Bei mechanischen Uhren liefert die Unruh die Kraft für die erzwungenen Schwingungen. 10.6 Überlagerung von Schwingungen Zumeist treten mehrere Schwingungen gleichzeitig auf wodurch es zu einer Überlagerung von Schwingungen kommt. Die Darstellung dieser Schwingungsformen erfolgt durch die Überlagerung von harmonischen Schwingungen. Anharmonische Schwingungen lassen sich ebenfalls durch die Überlagerung von harmonischen Schwingungen darstellen: x ... Auslenkung [m] x(t) = ∑ A n cos(ωn t + ϕn ) n A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] t ... Zeit [s] ϕ ... Phasenlage 10.6.1 Schwebung Als Schwebung bezeichnet man die Resultierende der additiven Überlagerung (Superposition) zweier Schwingungen, die sich in ihrer Frequenz ω nur wenig voneinander unterscheiden. Die beiden Schwingungen haben weiters dieselbe Amplitude A und Phasenlage ϕ. In der Akustik ist die Schwebung deutlich zu hören: Erklingen zwei Töne, deren Frequenzen sich nur wenig unterscheiden, so ist ein Ton zu hören, dessen Frequenz dem Mittelwert der Frequenzen der beiden überlagerten Töne entspricht. Dieser Ton ist moduliert, seine Lautstärke schwankt mit der sogenannten Schwebungsfrequenz Δω, die der Differenz der Frequenzen der beiden Töne entspricht. Abbildung 55: Schwebung 10.6.2 Resonanz Als Resonanz werden in der Physik Vorgänge bezeichnet, bei denen ein schwingungsfähiges System mit seiner Eigenfrequenz durch Energiezufuhr angeregt wird. In diesem Fall beträgt die Phasenverschiebung zwischen Erreger und erzwungener Schwingung 90 Grad, die Energieübertrag auf das schwingungsfähige System ist in diesem Fall maximal. Hierdurch kann die Amplitude des angeregten 91/210 Systems auf ein Vielfaches der Erregeramplitude ansteigen. Die Resonanzkurve eines solchen Systems gibt seine Schwingungsamplitude in Abhängigkeit von der Erregerfrequenz an. Je geringer die Dämpfung ist, desto schmaler und höher wird das Maximum der Kurve, der Resonanzpeak. In extremen Fällen kann die „Aufschaukelung“ zur Zerstörung des Systems führen (Resonanzkatastrophe). Abbildung 56: Resonanz 10.7 Mechanische Wellen Eine Welle ist ein Vorgang bei dem sich eine Schwingung vom Ort ihrer Erregung infolge von Kopplungen an benachbarte schwingungsfähige Systeme im Raum ausbreitet. Die Ausbreitungsgeschwindigkeit hängt von der Stärke der Kopplung und von der Masse der schwingenden Systeme ab. 92/210 Abbildung 57: Wellenarten: (1) und (2) Transversalwelle, (3) Longitudinalwelle 10.7.1 Longitudinale Ausbreitung Eine Longitudinalwelle ist eine physikalische Welle, die in Ausbreitungsrichtung schwingt. Sie benötigt immer ein Medium, um sich fortzubewegen. Beispiel: − Schall in Luft und Wasser − Hintereinander befestigte Schaukeln Abbildung 58: Prinzip einer Longitudinalwelle 10.7.2 Transversale Ausbreitung Eine Transversalwelle ist eine physikalische Welle, bei der eine Schwingung senkrecht zu ihrer Ausbreitungsrichtung erfolgt. Im Gegensatz zu Longitudinalwellen sind nicht alle Arten von Transversalwellen an ein Medium gebunden. Beispiel: − Elektromagnetische Wellen (Licht) − Nebeneinander befestigte Schaukeln Abbildung 59: Prinzip einer Transversalwelle 93/210 10.7.3 Wellengleichung Die Ausbreitung einer Welle wird durch zwei Parameter beschrieben, die Wellenlänge λ (räumliche Ausbreitung) und die Periodendauer τ (zeitliche Ausbreitung): y(x, t) = A sin(kx − ωt) x ... Ort [m] t ... Zeit [s] 2π 2π mit k = und ω = A ... Amplitude [m] λ τ k ... Kreiswellenzahl [m-1] ω ... Resonanzfrequenz [s-1] λ ... Wellenlänge [m] τ ... Perdiodendauer [s] Anmerkung: Die Kreiswellenzahl k ist die Anzahl der Wellenlängen λ, die in die Strecke 2πx passt. Phasengeschwindigkeit Die Phasengeschwindigkeit gibt an, mit welcher Geschwindigkeit sich die Phase einer Welle ausbreitet und berechnet sich aus der Periodendauer τ und der Wellenlänge λ: ω λ ω ... Resonanzfrequenz [s-1] vp = = = λ f k ... Kreiswellenzahl [m-1] k τ λ ... Wellenlänge [m] τ ... Perdiodendauer [s] f ... Frequenz [s-1] Zeitlich harmonische Schwingung Ist der Ort fest, d.h. x = x 0 , handelt es sich um eine zeitlich harmonische Schwingung und die Gleichung vereinfacht sich folgendermaßen: x ... Ort [m] y(x, t) = A sin(kx 0 − ωt) = A sin(ωt + ϕ) t ... Zeit [s] A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] ϕ ... Phasenlage Beispiel: Ein Kork fällt ins Wasser und man beobachtet die Rauf-Runter-Bewegung des Korkens an einer festen Position auf dem Wasser. D.h. der Ort ist fest, die Zeit ist variabel. Räumlich harmonische Schwingung Ist die Zeit fest, d.h. t = t 0 , handelt sich um eine räumlich harmonische Schwingung: x ... Ort [m] y(x, t) = A sin(kx − ωt 0 ) = A sin(kx + ϕ) t ... Zeit [s] A ... Amplitude [m] ω ... Resonanzfrequenz [s-1] ϕ ... Phasenlage Beispiel: Man macht ein Foto vom Meer und hält so einen bestimmten Zeitpunkt fest. Auf dem Foto ist die räumliche Ausbreitung einer Meereswelle zu sehen. D.h. die Zeit ist fest, der Ort ist variabel. 94/210 10.7.4 Schallausbreitung in festen Körpern Klopft man z.B. auf eine feste Platte aus Holz breitet sich der Schall als Longitudinalwelle durch den Körper aus. Die Phasengeschwindigkeit einer solchen Welle lässt sich abhängig vom Elastizitätsmodul und der Dichte des Körpers bestimmen: vPh ... Phasengeschwindigkeit [m/s] E v Ph = E ... Elastizitätsmodul [Pa] ρ ρ ... Dichte [kg/m³] Abbildung 60: Longitudinalwelle durch einen festen Körper. ξ ist die Größe der Druckwelle, die den Körper durchströmt. σ ist die gemessene Größe (z.B. Spannung). A ist die Querschnittsfläche. Elastizitätsmodul Anschaulich formuliert ist der Elastizitätsmodul eines Materials diejenige Zugspannung, bei der sich ein Körper aus diesem Material in der Länge verdoppelt. Der Elastizitätsmodul beschreibt also die Verformbarkeit/Steifigkeit eines Materials. Der Betrag des Elastizitätsmoduls ist umso größer, je mehr Widerstand ein Material seiner Verformung entgegensetzt. Ein Bauteil aus einem Material mit hohem Elastizitätsmodul (z. B. Stahl) ist also steif, ein Bauteil aus einem Material mit niedrigem Elastizitätsmodul (z. B. Gummi) ist nachgiebig. 10.8 Dopplereffekt Als Dopplereffekt bezeichnet man die Veränderung der wahrgenommenen Frequenz von Wellen jeder Art, während sich die Quelle und der Beobachter einander nähern oder voneinander entfernen, sich also relativ zueinander bewegen. Nähern sich Beobachter und Quelle einander, so erhöht sich die vom Beobachter wahrgenommene Frequenz, entfernen sie sich von einander, verringert sich die Frequenz. 95/210 Abbildung 61: Änderung der wahrgenommenen Tonhöhe durch den Dopplereffekt Beispiel: Tonhöhenänderung des Martinshorns eines Krankenwagens: Solange sich das Fahrzeug nähert, ist der wahrgenommene Ton höher als im Stand (höhere Frequenz, kürzere Wellenlänge), wenn es sich entfernt, ist er tiefer (größere Frequenz, größere Wellenlänge). Anwendungen: − Bestimmung der Expansionsgeschwindigkeit des Universums − Bestimmung der Strömungsgeschwindigkeit des Blutes mit Hilfe von Ultraschall 10.9 Fourieranalyse Die harmonischen Schwingungsfunktionen Sinus und Cosinus sind Idealfälle bei denen die rückstellende Kraft exakt der Auslenkung entspricht. Reale Schwingungsverläufe sind in der Regel viel komplexer, können aber mit Hilfe der Fouriersynthese aus einer Summe von Sinus- (und Cosinus)-Funktionen approximiert werden. Ortsbereich (Schwingung) Frequenzbereich (Spektrum) Auslenkung Intensität Amplitude Amplitude Zeit Frequenz Grundfrequenz Periodendauer Abbildung 62: Vergleich der Darstellung einer Schwingung und deren Spektrum 10.9.1 Fourieranalyse Die Fourieranalyse beschreibt das Zerlegen eines beliebigen Signals in eine Summe von Sinus- und Cosinusfunktionen (eine sogenannte Fourierreihe) oder als Summe von Sinusfunktionen und einer Phasenverschiebung. Sie zerlegt ein Signal damit in seine Frequenzanteile. 96/210 Abbildung 63: Beispiel für eine Fourieranalyse Abhängig davon ob sich ein Signal in eine diskrete Anzahl einzelner Frequenzen zerlegen lässt oder aus einer großen Anzahl vieler verschiedener Frequenzen zusammengesetzt ist ergibt sich ein diskretes oder ein kontinuierliches Frequenzspektrum. Abbildung 64: Signal mit diskreten Frequenzspektrum 97/210 Abbildung 65: Signal mit kontinuierlichem Frequenzspektrum Anwendungsfall EKG Abbildung 66: Fourieranalyse eines EKGs. Links: Frequenzspektrum eines einzelnen Herzschlages. Rechts: Frequenzspektrum von ca. 60 Herzschlägen. 98/210 10.9.2 Fouriersynthese Die Fouriersynthese beschreibt das der Fourieranalyse gegensätzliche Verfahren, die Erzeugung beliebiger Signale aus Sinus- und Cosinusfunktionen. Beispiel: Rechteckspannung: Abbildung 67: Approximation einer Rechtecksspannung mit der Fouriersynthese (1) Die ideale Rechtecksspannung mit einer Frequenz f von 200 Hz, die nachgebildet werden soll. (2) Ausgangspunkt der Fouriersynthese ist eine harmonische Welle derselben Frequenz f. (3) Eine Überlagerung zweier Wellen, die Welle mit der Grundfrequenz f und eine Welle mit der dreifachen Grundfrequenz 3f, liefert eine erste Annäherung. (4) (5) Mit zunehmender Anzahl der Reihenglieder werden immer mehr Anteile mit höheren Frequenzen hinzuaddiert wodurch sich eine immer bessere Approximation der ursprünglichen idealen Rechtecksspannung ergibt. N 1 cos ⎡⎣( 2n + 1) ω t ⎤⎦ n = 0 2n + 1 U cos(3ωt) U 0 cos(5ωt) U = U 0 cos(ωt) + 0 + +… 3 5 U(t) = U 0 ∑ U(t) ... Spannung zum Zeitpunkt t [V] U0 ... Spannungsamplitude [V] n ... Laufindex ω ... Resonanzfrequenz [s-1] t ... Zeit [s] 10.9.3 Gibbsches Phänomen In der Umgebung von Sprungstellen der zu approximierenden Funktionen entstehen bei der Fourierreihe typische Über- und Unterschwinger von etwa 18 % der Sprunghöhe, da dort die Reihe nicht mehr gleichmäßig sondern nur noch punktweise konvergiert. Dieser Effekt hat weitreichende Auswirkungen in der Signalverarbeitung. 99/210 Abbildung 68: Gibbsches Phänomen an einer Rechtecksschwingung B Anwendungen 11 Röntgen 11.1 Bildentstehung Die aus der Röntgenröhre (siehe Kapitel 4.7) austretende Strahlung wird mit Hilfe einer Blende und des Kollimators zu einem Nutzstrahlbündel fokussiert, dessen Größe von der Länge des Kollimators und dem Durchmesser von Kollimator und Blende abhängen. Die Strahlung des Nutzstrahlbündels gelangt schließlich auf das zu röntgende Objekt. Hier wird sowohl Strahlung vom Objekt absorbiert, als auch an diesem gestreut, d.h. es kommt zu einer Richtungsänderung der Strahlung. Diese Streustrahlung verteilt sich einerseits im Raum (daher müssen Bleischürzen getragen werden), anderseits gelangt sie auch auf den Röntgenfilm. Die Strahlung wird nun von dem zu röntgenden Objekt, z.B. von den Knochen, absorbiert. An diesen Stellen gelangt weniger Strahlung auf den Film, dieser wird weniger geschwärzt und die Stellen bleiben heller. Bei einem Röntgenbild handelt es sich um ein Negativ. Abbildung 69: Bildentstehung beim Röntgen 100/210 11.1.1 Streuung Um die Schwärzung des Films durch Streustrahlung, die das Bild verwaschen würde, zu vermindern, befindet sich vor dem Röntgenfilm ein Lamellenraster. Dieser Raster besteht aus dünnen Bleilamellen, die allzu schräg einfallende Strahlung absorbieren. Der Akzeptanzwinkel für einfallende Röntgenstrahlen wird durch den Abstand der Lamellen und die Lamellenbreite- und länge bestimmt. Abbildung 70: Lamellenraster zur Minimierung der Streustrahlung Bei einem fokussierenden Raster werden die Lamellen zum Rand hin zunehmend schräger, da es sich bei der Röntgenstrahlung im Grunde um eine Punktquelle handelt und dadurch die Nutzstrahlung im Randbereich in einem schrägeren Winkel einfällt. Daher kann es auch im Randbereich von Röntgenaufnahmen zu Verzerrungen (d.h. Vergrößerungen) kommen. 11.1.2 Brennfleckgröße Die Bildqualität wird auch durch die Größe des Brennflecks und die Abstände zwischen Brennfleckebene und Objektebene (D) und zwischen Objektebene und Filmebene (d) bestimmt. Links im Bild wird ein im Verhältnis zum Brennfleck recht großes Objekt abgebildet. Es entsteht eine relativ große Zone des Kernschattens (Orte starker Absorption an denen keine bzw. wenig Strahlung durchdringt) aber auch Bereiche des Halbschattens. Bei einem kleineren Brennfleck wächst die Zone des Kernschattens und die Bereiche des Halbschattens nehmen ab. Je kleiner der Übergangsbereich neben dem Kernschatten wird, desto schärfer erscheint der Kernschatten und desto kontrastreicher ist das Bild. Auf der rechten Seite ist das Objekt zu klein um bei den vorgegebenen Größenverhältnissen überhaupt einen Kernschattenbereich auf der Filmebene erzeugen zu können. Auf dem Bild wäre daher nichts zu erkennen da nur kontrastloser Halbschatten abgebildet werden würde. 101/210 Abbildung 71: Einfluss der Brennfleckgröße auf die Bildqualität 11.2 Verstärkerfolien Die Filmkassette besteht aus Kunststoff mit einer Rückseite aus Blei. Ihre Größe entspricht der Größe des verwendeten Films. Direkt vor und hinter dem Film befinden sich die sogenannten Verstärkerfolien, die meist mit Verbindungen aus seltenen Erden beschichtet sind. Beim Auftreffen von Röntgenstrahlung auf die Folien wandeln sie die Röntgenstrahlung in sichtbares Licht um. Der Röntgenfilm wird dann zu ca. 95 % durch dieses Folienlicht und nur zu ca. 5 % direkt durch die Röntgenstrahlung belichtet (geschwärzt). Abbildung 72: Die Detailschärfe nimmt mit zunehmender Anzahl von Photonen zu. 102/210 Entstehung von Bildunschärfen durch Verstärkerfolien (1) Neben den erwünschten Röntgenquanten treffen aufgrund von Reflexion auch gestreute Quanten auf den Film und erzeugen ungewollte Schwärzungen. (2) Je dünner die Verstärkerfolien gewählt werden, desto geringer sind auch die ungewollten Schwärzungen durch Reflexion. Andererseits haben dünnere Verstärkerfolien eine geringere Wirksamkeit. Hier muss ein Kompromiss gefunden werden, der das im konkreten Anwendungsfall beste Resultat liefert. (3) Beim Cross-Over-Effekt entsteht eine Schwärzung durch Strahlung, die die Verstärkerfolie auf der Rückseite des Films trifft. Abbildung 73: Entstehung von Bildunschärfen durch Verstärkerfolien 11.3 Filmentwicklung Röntgenquanten treffen auf den Film und oxidieren Bromidionen, die sich in der silberbromidhältigen Emulsion befinden. Die dadurch freigewordenen Elektronen werden an Silber-„Keimen“ eingefangen. Die Elektronen reduzieren nun die Silberionen. Beim Entwickeln werden nun Millionen weiterer Silberionen reduziert und zu Silberkörnern umgewandelt. Durch das Fixieren wird überschüssiges Silberbromid aus der Emulsionsschicht herausgelöst. Die resultierende Schwärzung S des Films ist wie die Extinktion (siehe Kapitel 5.10) der negative Logarithmus der Transmission: S ... Schwärzung I I 1 S = − log = − log T = log 0 = log I ... Intensität nachher I0 I T I0 ... Intensität vorher T ... Transmission Die Schwärzungskurve zeigt einen Bereich mit nahezu linearem Anstieg in dem eine Änderung der auftreffenden Dosis an Röntgenstrahlung proportional zur Schwärzung des Films ist. In diesem Bereich ist ein ausreichender Kontrast gewährleistet. In Bereich zu niedriger Dosis kommt es zur Unterbelichtung, in Bereichen zu hoher Dosis zur Überbelichtung. In beiden Fällen sind die Schwärzungsdifferenzen bei ähnlichen Dosen zu gering für einen ausreichenden Kontrast. 103/210 Überbelichtung (ΔS sehr klein) Unterbelichtung (ΔS sehr klein) Abbildung 74: Schwärzung des Röntgenfilms 11.4 Auflösungsvermögen Das Auflösungsvermögen im Röntgenbild wird als Zahl der Linien pro Millimeter (Ortsfrequenz) angegeben, die im Röntgenbild noch erkennbar sind. Die örtliche Modulationsübertragungsfunktion (MTF) gibt an, wie sich der Kontrast einer Aufnahme mit zunehmender Ortsfrequenz (Linienpaare/mm bzw. [Lp/mm]) ändert. Das Auflösungsvermögen und die MTF sind wichtige Kennzahlen der indirekten Radiographie. Modulationsübertragungsfunktion (MTF) Die Modulationsübertragungsfunktion beschreibt die Übertragung eines Kontrastes auf dem Objekt I zu einem Kontrast I’ im Bild: M ... Modulationsgrad I M= I ... Intensität des Objekts I' I’ ... Intensität des Bildes Zur Ermittlung der MTF wird ein Liniengitter von der Bildmitte zum Bildrand verschoben und an verschiedenen Orten im Bild die Kontrastübertragung ermittelt. Abbildung 75: Ermittlung der MTF 104/210 Die gemessenen Intensitäten I’ im Bild sind dabei geringer (d.h. geringere Amplitude) als die Intensitäten I des Objekts. Durch die Verringerung der Intensitätsunterschiede verringert sich auch der Kontrast im Bild. Dieses Verfahren wird für verschiedene Ortsfrequenzen durchgeführt wodurch sich der Verlauf der MTF ergibt. Abbildung 76: Ermittlung der MTF durch Intensitätsbestimmung für verschiedene Ortsfrequenzen [Lp/mm] Die Konstrastübertragung beträgt nie wirklich 100 %, d.h. das Bild weist immer einen geringeren Kontrast auf als das Objekt. Bei zunehmender Detailfeinheit (Ortsfrequenz) nimmt der Kontrast im Bild weiter ab. Je langsamer die MTF-Kurve eines Systems bei zunehmender Ortsfrequenz abfällt, desto besser ist der Kontrast auch bei sehr detailreichen Strukturen. 11.5 Kontrastmittel Kontrastmittel dienen dazu, die Darstellung von Strukturen und Funktionen des Körpers in bildgebenden Verfahren zu verbessern und werden vor allem in der Röntgendiagnostik, der Magnetresonanztomografie (MRT) und der Sonografie eingesetzt. Die Wirkung von Kontrastmitteln besteht darin, dass sie das Signal, das in der jeweiligen Untersuchung registriert wird, modifizieren. Ziel des Einsatzes ist, bei der Untersuchung Zusatzinformationen zu gewinnen. Beispielsweise verwendet man in der Radiografie oft Kontrastmittel, die Röntgenstrahlen stärker absorbieren als normales Weichteilgewebe. 105/210 Röntgenpositive Kontrastmittel − Iodhaltige Kontrastmittel dienen zur Darstellung der Nieren und Harnwege, der Venen, der Arterien und anderer Organe. Bei der Angiografie, der Darstellung von Blutgefäßen mittels diagnostischer Bildgebungsverfahren, wird z.B. eine iodhaltige Lösung injiziert wodurch die in die die Lösung gelangt Röntgenschatten werfen und machen sie so sichtbar machen. − Bariumsulfathaltige Suspensionen, die nicht resorbiert werden und dienen zur Darstellung von Speiseröhre, Magen, Dünn- und Dickdarm. Röntgennegative Kontrastmittel − CO2 setzt im Gegensatz zu iod- oder bariumhaltigen Kontrastmitteln die Röntgendichte herab und führt damit zu einer erhöhten Strahlendurchlässigkeit. Anders als Luft kann CO2 in das Gefäßsystem injiziert werden und eignet sich für die Arteriografie als Alternative zu iodhaltigen Kontrastmitteln und zur gezielten Darstellung kleiner Verzweigungen. − Luft bei der Doppelkontrastuntersuchung des Dickdarms. 11.6 Indirektradiographie Bei der Indirektradiographie wird das Röntgen-Schattenbild mit einem Röntgenbildverstärker (RBV) in ein sichtbares Bild umgewandelt. Eine Tandemoptik mit Lichtteiler ermöglicht die Videobetrachtung sowie die Einzelbild- und die Kinoaufnahme. Abbildung 77: Prinzip der Indirektradiographie Der Röntgenbildverstärker ist eine Vakuumröhre, die das Röntgenbild in ein sichtbares Bild umwandelt. Röntgenstrahlen treffen auf einen Fluoreszenzschirm und schlagen dort Elektronen heraus. Die Elektronen werden mit einer Photokathode beschleunigt und danach fokussiert. Auf einem Ausgangsbildschirm entsteht ein verkleinertes, verkehrtes aber dafür sehr lichtstarkes optisches Bild. 106/210 Abbildung 78: Aufbau eines Röntgenbildverstärkers (RBV) Die eher teure Indirektradiographie hat einen weniger eingeschränkten Empfindlichkeitsbereich als die Aufnahme mit einem Film und kann daher z.B. in Bereichen eingesetzt werden in denen ein Film unterbelichtet wäre. 107/210 12 Bildgebende Verfahren 12.1 Tomographie Unter dem Begriff Tomographie werden verschiedene bildgebende Verfahren zusammengefasst mit denen die räumliche Struktur eines Objektes mittels einem Schichtaufnahmeverfahren ermittelt werden kann und damit volumetrische, tiefenaufgelöste Information dargestellt wird. 12.1.1 Röntgentomographie Die Röntgentomographie ist ein mittlerweile veraltetes Verfahren zur Darstellung einer Schicht innerhalb des untersuchten Objekts. Während der Belichtung werden der Röntgenfilm und die Strahlenquelle gegenläufig bewegt. Dadurch entsteht eine scharfe Abbildung der Strukturen, die in der Fokusebene liegen. Strukturen außerhalb der Fokusebene werden verwischt. 12.1.2 Computertomographie (CT) Beim herkömmlichen Röntgenverfahren wird das abzubildende Objekt von einer Röntgenquelle durchleuchtet und auf einem Röntgenfilm abgebildet (bildgebendes Verfahren). Es entsteht eine Projektion des Volumens auf eine Fläche. Bei dieser Projektion gehen Informationen, welche die dritte Dimension (Dicke) des durchleuchteten Körpers betreffen weitgehend verloren. Grund hierfür ist, dass im Nachhinein nicht mehr unterschieden werden kann, ob die im Röntgenbild sichtbare Schwächung (helle Bereiche im Bild) durch ein Material höherer Dichte oder durch eine größere Schichtdicke hervorgerufen wurde. Die Computertomographie umgeht dieses Problem, indem sie viele Röntgenbilder des Objekts aus den unterschiedlichsten Richtungen erstellt und nachträglich aus diesen vielen Abbildungen die verlorenen Volumeninformationen rekonstruiert. In der Regel setzen sich diese 3D-Rekonstruktionen aus Einzelschnitten, die quer durch das Objekt verlaufen, zusammen (schnittbildgebendes Verfahren). Auf diese Weise kann für jedes Volumenelement (Voxel) des Objektes eine Dichte ermittelt werden. Geräteaufbau Moderne Geräte arbeiten im Spiralverfahren (Spiral-CT bzw. Helix-CT), bei dem der Patient mit konstanter Geschwindigkeit entlang seiner Längsachse durch die Strahlenebene bewegt wird (Translation), während die Strahlenquellendetektoreinheit konstant rotiert (Rotation). 108/210 Abbildung 79: Prinzip des Spiral-CTs Je nach Gerät können auch mehrere Axialebenen gleichzeitig eingelesen werden (Mehrschicht- oder Multislice-Verfahren). Dadurch ist das Verfahren schneller und es lassen sich Bewegungsartefakte (z. B. durch die Atmung) reduzieren. Abbildung 80: Aufbau eines CTs Auswertung Bei der Computer-Tomographie wird ein dreidimensionales Objekt mit Strahlen der Intensität J0 aus unterschiedlichen Richtungen durchstrahlt. Es entsteht ein Überlagerungsbild bei dem alle durchstrahlten Volumselemente zur Schwächung beitragen. 109/210 P = ln J0 = ∑ μi d i JD i P ... Schwächung der Röntgenstrahlung J0 ... Strahlungsintensität vorher JD ... Strahlungsintensität am Detektor μ ... Röntgenschwächungskoeffizient d ... Schichtdicke Das am Detektor ankommende abgeschwächte Signal JD ist die Radon-Transformierte des durchleuchteten Objektes. Die Radon-Transformation lässt sich mit mathematischen Methoden (z.B. der Fourieranalyse) umkehren, sodass ein Bild des Objektes errechnet wird. Das Objekt wird dabei schichtenweise untersucht, am Ende ergeben die Bilder der Schichten ein dreidimensionales Bild des Objektes. Abbildung 81: Abschwächung des Röntgenstrahls im Laufe der Durchdringung Abbildung 82: Vereinfachtes Beispiel einer Radontransformation (1) Zu Beginn sind die Einzelwerte des Rasters unbekannt sondern nur die Messwerte I der Strahlungsintensität der Röntgenstrahlung, die Summen von Einzelwerte darstellen. Gesucht ist jedoch der Röntgenschwächungskoeffizient für jedes einzelne Volumselement (Voxel). (2) Durch Logarithmierung der Messwerte wird z.B. aus dem Wert 10 000 = 105 für die untere Zeile der Wert 5. (3) Weist man jedem Feld des Rasters eine Variable zu, lassen sich für jede Spalte und für jede Zeile lineare Gleichungen aufstellen. Hat man ein Raster mit zwei Spalten und zwei Zeilen, d.h. vier Feldern, erhält man ein Gleichungssystem mit ebensovielen Gleichungen. Dementsprechend hätte man für einen Raster mit 512 × 512 Feldern bereits 512² Gleichungen zu lösen. (4) Durch Lösung des Gleichungssystems können die Werte der einzelnen Felder ermittelt werden. 110/210 (5) Durch Umkehrung des vorherigen Logarithmierungsschritts erhält man die ursprünglichen Intensitäten der einzelnen Felder und kann somit den Röntgenschwächungskoeffizient μ der Volumselemente berechnen. Hounsfield-Skala (Fenstertechnik) Der lineare Absorptionskoeffizient μ beschreibt, wie stark Röntgenstrahlung beim Durchdringen von Materie entlang des durchstrahlten Wegs abgeschwächt wird. Die Medizin interessiert sich im Rahmen der Computertomografie besonders dafür, die Schwächung der Röntgenstrahlung bestimmten Geweben zuzuordnen und darüber pathologische Abweichungen von gesundem Gewebe feststellen zu können. In der Medizin wird die CT-Zahl (relative Houndsfield-Skala) anstelle des von der Röntgenenergie abhängigen Schwächungskoeffizienten eingesetzt. Diese hat die Einheit Hounsfield Unit [HU] und wird für ein bestimmtes Material (Gewebe) relativ zu Wasser folgendermaßen berechnet: μ − μ Wasser μrel ... CT-Zahl [HU] μ rel = Gewebe .1000 μGewebe ... Schwächungskoeffizient des Gewebes μ Wasser μWasser ... Schwächungskoeffizient des Wassers Abbildung 83: Hounsfield-Skala der Organe Der Mensch besteht zu mehr als 60 % aus Wasser. Die meisten körpereigenen Substanzen unterscheiden sich nur wenig vom Schwächungskoeffizient des Wassers weshalb die Abweichung in Promille angegeben wird. Die CT-Zahlenwerte sind in erster Näherung proportional zur Dichte der Gewebe: 111/210 − Luft absorbiert Röntgenstrahlung nahezu gar nicht und hat daher eine CTZahl von -1000 HU. − Fettgewebe absorbiert Röntgenstrahlung etwas weniger als Wasser und hat ca. -50 bis -100 HU. − Wasser hat gemäß der Definition 0 HU. − Knochen haben, je nach Dichte, Werte von 500 - 1000 HU. In der Praxis hat sich ein Wertebereich von -1024 bis 3071 HU durchgesetzt was 4096 Graustufen entspricht. Die Intensitätsunterschiede zwischen Lunge und Knochen sind groß. Die Unterschiede bei Weichteilen, Fettgewebe und Wasser sind jedoch nur gering. Um eine verbesserte Beurteilbarkeit der Bilder zu erreichen arbeitet man daher mit verschiedenen Fenstergrößen (die 4096 Graustufen entsprechen), die man durch Angabe der Fenstermitte C und der Fensterbreite W definiert: − Knochenfenster: C/W = 1000/2500 − Mediastinalfenster: C/W = -50/400 − Lungenfenster: C/W = -625/1250 Vergleich von CT und Projektionsradiographie Beide bildgebende Verfahren arbeiten mit Abbildung 84: Fenstertechnik der Röntgenstrahlung (ionisierende Strahlung) mit einer Hounsfield-Skala vergleichbaren Dosis. Bei der Projektionsradiographie ist der Kontrast gleich der Summe der Signalbeiträge entlang der Transmission. Der Kontrast ist abhängig von der Kernladungszahl Z und der Dosis. Bei der Computertomographie entspricht der Kontrast den Werten benachbarter Volumselemente (Voxel) und damit der Zusammensetzung des Gewebes. Angrenzende oder überlappende Strukturen haben keinen Einfluss auf das Ergebnis. Ein Nachteil der Computertomografie ist die Strahlenexposition. Diese ist um bis zu tausendmal höher als bei einer normalen Röntgenaufnahme. 12.1.3 Magnetresonanztomographie (MRT) Eine Alternative zur Computertomografie stellt die Magnetresonanztomografie (MRT) dar, die auch als Kernspintomografie bezeichnet wird: − Nuclear Magnetic Resonance (NMR) − Magnet Resonanz Tomografie (MRT) − Magnetic Resonance Imaging (MRI) Die beiden Hauptvorteile der MRT gegenüber der CT sind, dass keine schädliche Röntgenstrahlung verwendet wird, und die Möglichkeit, Organe und Gewebe auch ohne Kontrastmittel mit hohem Weichteilkontrast abzubilden. Methode Die MRT basiert auf sehr starken magnetischen Feldern und hochfrequenten elektromagnetischen Feldern, mit denen bestimmte Atomkerne, meistens Wasserstoffkerne (d.h. Protonen), im Körper angeregt werden. Wasserstoff weist eine hohe relative Empfindlichkeit für die Ausrichtung in einem konstanten Magnetfeld 112/210 auf. Außerdem ist Wasserstoff in einem großen Prozentsatz von Verbindungen innerhalb des Körpers vorhanden. Empfangen werden extrem schwache elektromagnetische Felder im Frequenzbereich der Kurzwelle oder Ultrakurzwelle, die von den angeregten Atomkernen ausgesendet wird. Geräteaufbau 1. Kerne mit einer ungeraden Anzahl von Protonen und besitzen einen mechanischen Eigendrehimpus (Spin) und sind dadurch magnetisch. Es wird ein starkes magnetisches Gleichfeld B0 von ca. 1 Tesla [T] angelegt. Zum Vergleich: Das Erdmagnetfeld beträgt am Äquator nur ca. 30µT. Durch dieses starke Magnetfeld richten sich alle Atome in diesem Magnetfeld aus. Abbildung 85: Anlegen eines starken magnetischen Gleichfelds B0 zur Ausrichtung der Atome. 2. Im nächsten Schritt wird ein zusätzliches hochfrequentes magnetisches Wechselfeld (Ultrakurzwelle, ca. 42,6 MHz) angelegt was dazu führt, dass die ausgerichteten Atome aus der Richtung des statischen Feldes auslenken („kippen“). 113/210 Abbildung 87: Angeregt durch ein hochfrequentes magnetisches Wechselfeld kommt es zur Rotation der Spinachse der Atome um die Magnetfeldlinien in der Larmorfrequenz. 3. Als Folge der Auslenkung beginnen die Kerne in der Larmorfrequenz um die ursprüngliche Feldrichtung zu präzidieren, d.h. die Spinachsen der angeregten Atome rotieren um die Feldlinien des statischen Magnetfelds („Kreisel“). 4. Nach Abschalten des hochfrequenten Wechselfeldes nimmt diese Magnetisierung mit einer Abklingzeit ab, d.h. die Atome „springen“ wieder in ihre Ausgangsposition zurück. Diese Abklingzeit (Relaxation) ist für verschiedene Gewebearten charakteristisch und führt zu unterschiedlichen Signalstärken (Helligkeiten) im resultierenden Bild, was einen Rückschluss auf die Verteilung der Atome erlaubt. Weiters ist die Ortskodierung der Signale durch ortsabhängige Magnetfelder entscheidend für die Bildgebung. 114/210 Abbildung 86: Die Spinachsen der angeregten Atome rotieren in der Larmorfrequenz um die Feldlinien des statischen Magnetfelds Lamorfrequenz Für die Präzessionsbewegung (d.h. Kreiselbewegung) des Kernspins existiert eine Eigenfrequenz, die Larmorfrequenz genannt wird. Sie hängt von der Stärke des Magnetfeldes B0 und vom Aufbau des Kerns (beschrieben durch das gyromagnetische Verhältnis γ) ab: ω = 2 π f = γ B0 ω ... Larmorfrequenz [s-1] f ... Frequenz des hochfrequenten Wechselfeldes [s-1] γ ... Gyromagnetisches Verhältnis [rad/(T s)] B0 ... Magnetfeldstärke [T] Der Wert des das gyromagnetische Verhältnisses ist abhängig vom verwendeten Nuklid und z.B. für Wasserstoff verhältnismäßig hoch. Weist das verwendete statische Magnetfeld B0 eine hohe Feldstärke auf ist auch die Larmorfrequenz entsprechend hoch und die Atome rotieren schnell um die Magnetfeldlinien. Durch die Wahl der Feldstärke des statischen Magnetfeldes B0 und die Wahl der Frequenz f des zusätzlichen hochfrequenten Wechselfeldes kann sehr genau bestimmt werden, welche Kerne in Resonanz geraten sollen. Relaxation Das emittierte Kernspinresonanzsignal wird von einer Empfängerspule aufgenommen. Die Amplitude des Signals nimmt durch zwei getrennte Prozesse exponentiell ab: − Longitudinale Relaxationszeiten T1 (Spin-Gitter-Relaxation) bestimmen die Einstellung der Gleichgewichtsmagnetisierung, d.h. die Rückkehr in den energieärmeren Grundzustand. − Transversale Relaxationszeiten T2 (Spin-Spin-Relaxation) bestimmen die Linienbreite der Resonanzlinien. Die Relaxationseffekte geben Aufschluss über vorhandene Wechselwirkungen und molekulare Bewegungen. Außerdem wird der Bildkontrast von den beiden Relaxationszeiten sowie von der Protonendichte bestimmt. 12.1.4 Vergleich tomografischer Verfahren Feste Strukturen mit einem geringen Wasserstoffgehalt, z.B. Knochenkalk oder luftreiche Regionen wie die Lunge können bislang besser durch Röntgen und durch die Computertomographie dargestellt werden. Dann noch unklare Fälle können oft erfolgreich durch ein Multislice-Spiral-CT des Oberbauchs abgeklärt werden. Spezialfragen rechtfertigen danach ein MRT des Oberbauches oder in Einzelfällen des gesamten Abdomen. In Notfallsituationen, z.B. bei einer schweren Kopfverletzung, wird oft eine Computertomografie durchgeführt, da diese Untersuchung innerhalb von Minuten eine sichere Diagnose liefert. Das Röntgen des Schädels zum Nachweis oder Ausschluss eines Schädelbruchs reicht hier nicht aus, da mögliche Hirnverletzungen oder eine Blutung im Kopf dabei nicht sichtbar werden können. Der Nachweis einer akuten Blutung oder eines Schädelbruchs gelingt mit der CT besser als mit der MRT. Ältere Blutungen oder Verletzungen des Gehirns sind dagegen nur mit MRT sicher nachweisbar. Sehr kranke oder unruhige Patienten können grundsätzlich wesentlich schneller und effektiver mit der CT als mit der MRT untersucht werden. 115/210 12.2 Szintigrafie Methode Die Szintigrafie ist ein bildgebendes Verfahren der nuklearmedizinischen Diagnostik. Dabei werden radioaktiv markierte Stoffe (Radionuklide), sogenannte Radiopharmaka, in den Körper eingebracht und reichern sich in dem zu untersuchenden Zielorgan an. Mit Hilfe eines Scanners oder einer Gammakamera kann die ausgesandte Strahlung ermittelt und in ein farbvisualisiertes Bild (Szintigramm) transformiert werden. Die Strahlenbelastung ist bei diesen Untersuchungen meist geringer als bei den vergleichbaren Röntgenuntersuchungen. Typische Nuklide sind das Technetium (99Tc) für Lunge, Niere, Herz und Skelett und das Iod (123I) für die Untersuchung der Schilddrüse. Die Detektion erfolgt mit Hilfe eines Szintillationskristalls, der bei Auftreffen der Gammaquanten Lichtblitze erzeugt. Die Lichtblitze werden in ein elektronisches Signal umgewandelt und entsprechend der Häufigkeit als Bildpunkt in Schwärzungsgraden dargestellt. Anwendung Anwendung findet die Szintigrafie beispielsweise in der Tumordiagnostik. Der radioaktiv markierte Tracer wird sich vorzugsweise in Gewebe anreichern, das einen erhöhten Stoffwechsel aufweist und daher auch stärker vaskularisiert (durchblutet) ist („Hot Spot“). Single-Photon-Emissions-Computer-Tomografie (SPECT) Die Darstellung der untersuchten Organe kann entweder flächig (planar) erfolgen, oder auch mittels SPECT. Beim SPECT-Verfahren werden mehrere Aufnahmen derselben Körperregion aus verschiedenen Winkeln angefertigt und aus den gewonnen Daten ein dreidimensionales Modell errechnet, das dann auch Schnittbilder wie in einer Computertomografie ermöglicht. Die SPECT gehört wie die Positronen-EmissionsTomografie (PET) zu den funktionellen bildgebenden Verfahren. Die erzeugten Bilder geben vor allem Aufschluss über Stoffwechselabläufe im Körper. Die Morphologie des Körpers lässt sich hingegen nur grob beurteilen. Abbildung 88: SPECTVisualisierung eines keilförmigen Durchblutungsausfalls im hinteren Hirnanteil Kombination SPECT und CT Es gibt weiters die Möglichkeit mehrere Verfahren zu kombinieren. Bei der Kombination von SPECT und CT können grob aufgelöste Informationen über den Stoffwechselablauf (SPECT) mit hochauflösenden Darstellungen der Organe (CT) verknüpft werden. 116/210 Abbildung 89: Kombination von SPECT und CT 12.3 Positronenemissionstomografie (PET) Methode Die PET ist eine Form der Szintigrafie auf Basis von Nukliden, die Positronen emittieren (β+-Strahlung). Basierend auf dem Prinzip der Szintigrafie wird dem Patienten zu Beginn einer PET-Untersuchung ein Radionuklid (oder eine mit einem Radionuklid markierte Substanz) verabreicht, meist als Injektion in eine Armvene. Trifft ein durch Zerfall des Radionuklids entstandenes Positron auf ein Elektron werden beide vernichtet (Annihilation) und es entstehen zwei hochenergetische Photonen (Gammastrahlung) mit einer Energie von 511 keV, die sich in einem Winkel von knapp 180° voneinander entfernen. Diese Vernichtungsstrahlung trifft gleichzeitig zwei Detektoren, was Nachweis und Ortsbestimmung der Positronenemission ermöglicht. 117/210 Abbildung 90: Positronenemissionstomografie (PET ) Anwendung − Kohlenstoff (11C): o Cholin zur Prostatakrebsdiagnostik o S-Methyl-L-Methionin für die Sichtbarmachung der Proteinsynthese o Acetat zur Visualisierung des Sauerstoffverbrauchs des Herzmuskels − Stickstoff (13N): o L-Glutaminsäure zur Darstellung des Aminosäurenstoffwechsels o Ammoniak zur Darstellung der Herzmuskeldurchblutung − Sauerstoff (15O): o Wasser zur Darstellung der Durchblutung (Perfusion) o Darstellung der Sauerstoffaufnahme und Verteilung Abbildung 91: Bestimmung der Hirnaktivität mit z.B. nach Stimulation über den Geruchssinn mit PET Kombination PET und CT Ein PET/CT kombiniert die hohe Ortsauflösung (von bis zu 0,35 mm) und detailreiche Anatomiedarstellung des CT mit den hochsensitiven Stoffwechselinformationen aus der PET. Abbildung 92: PET/CT 118/210 13 Mikroskopische Verfahren 13.1 Vergleich mikroskopischer Verfahren Methode Minimale Wellenlänge λmin [nm] Lichtmikroskopie 400 Größe der optimal auflösbaren Strukturen Δxopt [nm] 200 Röntgenmikroskopie 5 50 Rasterelektronenmikroskopie (Auflicht) REM Transmissionselektronenmikroskopie TEM Tunnelmikroskopie 0,01 3 0,001 0,3 Röntgenstrukturanalyse 0,154 0,3 0,1 Beispiele Zellen, Blutzellen, Bakterien, Mitochondrien Knochenstrukturen, lebende Zellen Gestalt von Blutzellen, Organellen von Gefrierbruchpräparaten Membranstrukturen, DNA-Strukturen Makromoleküle, Atome von Festkörpern Abstände zwischen Atomen mit hoher Genauigkeit Abbildung 93: Für die Betrachtung biologischer Objekte nötiges Auflösungsvermögen 119/210 13.2 Mikroskop 13.2.1 Aufbau eines Lichtmikroskops Abbildung 94: Aufbau eines Lichtmikroskops − Okular: Linse(nsystem) durch das man mit dem Auge (lat. oculus) in ein optisches System blickt. − Objektiv: Das dem Objekt zugewandte Linsensystem zur Erzeugung einer verzerrungs- und farbfehlerfreien Abbildung. − Präparat: Das Präparat verändert das Strahlungsfeld, welches durch Objektiv und Okular fällt. − Kondensor: Der Kondensor ist eine Linse, die die gleichmäßige Ausleuchtung des Präparats bewirkt („köhlern“ des Mikroskops). − Lichtquelle 13.2.2 Strahlengang eines Mikroskops Mit Mikroskopen kann man weitaus stärkere Vergrößerungen als mit einer Lupe erreichen. Ein Mikroskop besteht im Wesentlichen aus zwei Sammellinsen, dem Objektiv (dem Objekt zugewandt) und dem Okular (dem Auge zugewandt). Der zu vergrößernde Gegenstand wird zwischen die einfache und die doppelte Brennweite des Objektivs gebracht. Dadurch wird im Tubus ein reeles, vergrößertes und verkehrtes Bild erzeugt, das so genannte Zwischenbild. Dieses Zwischenbild wiederum befindet sich innerhalb der Brennweite des Okulars, das somit als Lupe wirkt und das bereits vergrößerte Bild noch weiter vergrößert. Das mit den Augen beobachtbare Bild ist virtuell, stark vergrößert und verkehrt und wird auf der Netzhaut zu einem reelen, stark vergrößerten und aufrechten Bild. 120/210 Die Vergrößerung eines Mikroskops ist zweistufig und hängt von den Brennweiten von Objektiv und Okular sowie von der Tubuslänge (Abstand der Brennpunkte von Objektiv und Okular) ab: V ... Vergrößerung t.s V = VObjektiv .VOkular = f ... Brennweite f Objektiv .f Okular t ... Länge des Tubus s ... deutliche Sehweite Objektiv Bild ZwischenBild G Auge B FObj FObj Okular Z FOk FOk Die Komponenten des Mikroskops sind so aufeinander abgestimmt, dass das virtuelle Bild in einem Abstand von ca. 25 zum Auge des Betrachters entsteht, damit das Auge in der Lage ist entspannt auf das Bild scharfzustellen. 13.3 Abbesche Theorie Theorie der mikroskopischen Abbildung, wonach für die Bildentstehung die Beugung des Lichtes am Objekt maßgebend ist und das Auflösungsvermögen durch die Wellenlänge des eingestrahlten Lichtes begrenzt wird. Die Theorie geht davon aus, dass jedes Objekt Beugungseffekte hervorruft. Das bedeutet, dass die Bildinformation des Objektes auf die Beugungsmaxima aufgeteilt wird. Je mehr Maxima eines Objektes nun für die Bildgebung genutzt werden können, desto mehr Informationen sind über das Objekt vorhanden und umso höher ist daher auch die Auflösung. 13.3.1 „Unbewaffnetes“ Auge Die wahrgenommene Objektgröße ist abhängig vom Sehwinkel σ. Als Sehwinkel bezeichnet man jenen Winkel, den die äußersten von einem Gegenstand kommenden Strahlen im Auge miteinander einschließen. Er bestimmt die Größe des Netzhautbildes (siehe Kapitel 5.5). Ist dieser Winkel größer als etwa 3’ (Winkelminuten), so wird das entsprechende Detail von einem normalsichtigen Auge aufgelöst. D.h. man keinen einen Menschen erkennen, der sich ca. 2,2 km entfernt befindet. 121/210 Abbildung 95: Sehwinkel und konventionelle Sehweite des Auges 13.3.2 Vergrößerung Die Vergrößerung ist das Verhältnis von Sehwinkel bei konventioneller Sehweite zum Sehwinkel bei Verwendung einer Lupe: V ... Vergrößerung σ V= σ ... Sehwinkel bei konventioneller Sehweite σ' σ' ... Sehwinkel bei Verwendung einer Lupe Abbildung 96: Vergrößerung 13.3.3 Auflösungsvermögen Die Beugungsbilder zweier Punkte müssen mindestens einen solchen Abstand haben, dass das Minimum des einen Beugungsbildes auf das Maximum des anderen Beugungsbildes fällt. Lässt man die Beugungsbilder zweier Punkte immer weiter zusammenwandern ist irgendwann ein kritischer Punkt erreicht, an dem die Beugungsbilder nicht mehr voneinander getrennt wahrgenommen werden können. Unter dem Auflösungsvermögen d versteht man den kleinsten noch wahrnehmbaren Abstand zwischen zwei Punkten, d.h. der Abstand bei dem diese beiden Punkte noch als getrennt wahrgenommen werden können (Rayleigh-Kriterium). Zwei Gegenstände im Abstand d können dann noch aufgelöst werden, wenn das Maximum 0. und 1. Ordnung innerhalb des Öffnungswinkels θ des Objektivs fallen. 122/210 Abbildung 97: Auflösung abhängig von der Überschneidung der Maxima Die Auflösung ist umso größer, je größer die Öffnung (Apertur) des Objektivs und je kürzer die Wellenlänge des Lichts: d ... Spaltbreite [m] λ λ d= = λ ... Wellenlänge des Lichts [m] n.sin α A n ... Brechzahl des Mediums zwischen Objektiv und Präparat α ... halber Öffnungswinkel A ... Apertur (Öffnung) des Objektivs 13.3.4 Öffnungswinkel Der halbe Öffnungswinkel kann auch folgendermaßen berechnet werden: α ... halber Öffnungswinkel ⎛λ⎞ λ α = arcsin ⎜ ⎟ ≈ λ ... Wellenlänge des Lichts [m] ⎝d⎠ d d ... Spaltbreite [m] Beispiel: Bei einer Wellenlänge von λ = 600 nm (rot) und einem Pupillendurchmesser d = 4 mm ergibt sich ein Mindestwinkel zwischen zwei auflösbaren Punkten von 1,5.10-4 rad. Dies entspricht einem Abstand auf der Netzhaut von ca. 4 μm. Der tatsächliche Abstand der Rezeptoren liegt auch in dieser Größenordnung. 13.4 Numerische Apertur eines Objektivs Die numerische Apertur A (Öffnung) bestimmt das Auflösungsvermögen und die Bildhelligkeit (Lichtsammelvermögen) eines Objektivs: A = n.sin(α) A ... Numerische Apertur n ... Brechzahl des Mediums zwischen Objektiv und Präparat α ... halber Öffnungswinkel 123/210 Das Auflösungsvermögen eines Objektivs ist davon abhängig wieviel Licht von einer Struktur des Präparates in das Objektiv gelangt. Diese Lichtmenge ist wiederum abhängig vom sogenannten Öffnungswinkel des entsprechenden Objektivs. Abbildung 98: Je größer der Öffnungswinkel des Objektivs desto größer die Menge des einfallenden Lichts Eine hohe numerische Apertur ergibt einen großen Winkel und damit sowohl eine hohe Lichtstärke als auch ein hohes Auflösungsvermögen und eine geringe Schärfentiefe. Befindet sich ein Medium mit einer von 1 verschiedenen Brechzahl zwischen Objektiv und Objekt (Immersionsobjektiv), geht dessen Brechzahl n als Faktor ein. 124/210 Abbildung 99: Links: Ein Objektiv mit einer kleinen numerischen Apertur, daher einem kleinen Öffnungswinkel und einem geringen Auflösungsvermögen. Mitte: Ein Objektiv mit einer größeren numerischen Apertur und einem größeren Öffnungswinkel hat ein höheres Auflösungsvermögen. Rechts: Die Auflösung kann weiter erhöht werden indem ein Immersionsobjektiv verwendet wird, wobei durch die Brechzahl n des verwendeten Mediums die numerische Apertur weiter vergrößert werden kann. 13.4.1 Maximale Auflösung Die maximale Auflösung ist der minimale Abstand dmin zwischen zwei unterscheidbaren Strukturen. Dieser ist proportional zum Verhältnis zwischen Wellenlänge λ und der numerischen Apertur A. Je kleiner die Wellenlänge und je größer die Apertur, desto kleiner der minimale Abstand zwischen zwei unterscheidbaren Strukturen und desto größer das maximale Auflösungsvermögen. d ... Minimaler Abstand unterscheidbarer λ λ d min = 0, 61 = 0, 61 Strukturen [m] A n sin(α) λ ... Wellenlänge des Lichts [m] A ... Apertur (Öffnung) des Objektivs n ... Brechzahl des Mediums zwischen Objektiv und Präparat α ... halber Öffnungswinkel Beispiel: Rotes Licht hat Wellenlängen von mehr als 610 nm, daher können Linien bis 0,5 μm aufgelöst werden. Blaues Licht hat kürzere Wellenlängen zwischen 450 und 500 nm, daher können Linien bis zu 0,4 μm aufgelöst werden. 13.4.2 Vergrößerung der numerischen Apertur durch Ölimmersion Das Präparat befindet sich meist auf einem Objektträger aus Glas mit einer Brechzahl von n = 1,5. Zwischen Präparat und Objektiv befindet sich als Medium Luft mit einer Brechzahl von n = 1,0. Beim Übergang vom optisch dichteren Medium Glas in das weniger dichte Medium Luft kommt es entsprechend des Snelliuschen Brechungsgesetzes (siehe Kapitel ) zu einer Brechung vom Lot. Daher kann es passieren, dass weniger Bildinformation in das Objektiv gelangt und sich dadurch die Auflösung verschlechtert. 125/210 Dieser Informationsverlust kann vermindert werden, wenn man ein Medium mit einem ähnlichen Brechungsindex wie Glas verwendet, z.B. Öl mit n = 1,5. Nun kommt es beim Übergang zwischen zwei optisch ungefähr gleich dichten Medien nicht mehr zu einer starken Brechung weg vom Lot und mehr Bildinformation gelangt in das Objektiv. Abbildung 100: Erhöhung der numerischen Apertur und damit der Auflösung durch Ölimmersion 13.4.3 Förderliche Vergrößerung Bei der förderlichen Vergrößerung handelt es sich um jene Vergrößerung bei der die kleinsten Strukturen, die noch vom Objektiv aufgelöst werden können nach der Abbildung im Auge durch das Okular immer noch aufgelöst werden können. Durch eine weitere Vergrößerung (z.B. ein stärker vergrößerndes Okular) wird das Bild zwar größer aber es werden keine weiteren Details sichtbar: 500.A ≤ V ≤ 1000.A A ... Apertur des Objektivs (siehe Kapitel 13.3) V ... Vergrößerung durch das Objektiv 13.5 Dunkelfeldmikroskopie 126/210 Bei der Dunkelfeldmikroskopie handelt sich um eine spezielle Variante der Lichtmikroskopie, durch die mit Hilfe speziell ausgestatteter Mikroskope insbesondere durchsichtige und kontrastarme Objekte ohne vorherige Färbung (daher auch lebende Objekte) untersucht werden können. Bei der Dunkelfeldmikroskopie wird das von der Lichtquelle des Mikroskops kommende Licht am Objektiv vorbei geleitet. Nur Licht, das durch die Präparate im Strahlengang gestreut wird (Tyndall-Effekt), gelangt in das Objektiv und erzeugt dort ein Bild mit hellen Strukturen auf dunklem Untergrund. In diesem Bild sind damit allerdings fast immer nur die äußeren Konturen der Objekte im Präparat, jedoch keine oder nur wenig innere Strukturen wie zum Beispiel zelluläre Bestandteile erkennbar. Abbildung 101: Strahlengang im Dunkelfeldmikroskop Tyndall-Effekt Der Tyndall-Effekt beschreibt die Streuung von Licht an submikroskopischen Schwebeteilchen, mit Abmessungen ähnlich der Lichtwellenlänge. 13.6 Phasenkontrastmikroskopie Amplitudenobjekte Die Amplitude des Lichts wird durch Absorption der Lichtstrahlung in einem Objekt geschwächt. Der Kontrast entsteht so durch Amplitudendifferenzen und ist direkt visuell wahrnehmbar. Die Phasenlage des Lichts bleibt unverändert. Phasenobjekte Die Brechungsindices der vom Licht durchdrungenen Objekte beeinflussen die Lichtgeschwindigkeit innerhalb dieser Medien und somit die Phasenlage der Lichtquellen untereinander. Der Kontrast entsteht hier also durch Weglängendifferenzen und ist nicht visuell wahrnehmbar. Zur Sichtbarmachung können Phasendifferenzen in Amplitudendifferenzen umgesetzt werden. 127/210 Abbildung 102: Links: Bei Amplitudenobjekten entsteht der Kontrast durch Änderung der Amplitude. Rechts: Bei Phasenobjekten entsteht der Kontrast durch die Phasenverschiebung aufgrund der Brechungindices der durchdrungenen Medien. Mit Hilfe der Phasenkontrastmikroskopie können kontrastarme Objekte (z.B. Bakterien, Geißeln, Zellkerne), die im Hellfeld nicht so gut oder kaum zu erkennen wären, kontrastreicher dargestellt werden. Beim Phasenkontrastverfahren werden die Phasenunterschiede in dem Präparat durch Eingriffe in den Strahlengang deutlich sichtbar gemacht. Dabei wird der Phasenunterschied zwischen dem das Objekt durchstrahlende Licht und dem am Objekt vorbeigehenden Licht ausgenutzt. Das Phasenkontrastmikroskop stellt Unterschiede im Brechungsindex als Helligkeitsunterschiede dar. In ein normales Mikroskop werden zwei Blenden eingebaut: eine Ringblende im Objektiv und eine Ringaperturblende im Kondensor. Die Abmessungen dieser beiden Blenden sind so beschaffen, dass sie nur einen dünnen, ringförmigen Spalt im Lichtweg freilassen, wenn die Blenden genau zentriert sind. Der Lichtstrahl hat also die Form eines Hohlkegels. 128/210 Abbildung 103: Strahlengang im Phasenkontrastmikroskop Die Kontrastbildung beruht darauf, dass Lichtstrahlen in Medien mit höherem Brechungsindex stärker verzögert werden, als in Medien mit geringerem Brechungsindex. Dadurch entsteht eine Phasenverschiebung, die von der Blendenoptik des Mikroskops als Helligkeitsänderung dargestellt wird. Da sich der Brechungsindex annähernd proportional mit der Dichte des Objekts ändert, entspricht die Helligkeitsverteilung des Bildes in etwa der Dichteverteilung im biologischen Material. Zusätzlich treten außerdem helle oder dunkle „Halos“ entlang der Kanten von Zellen und anderen Strukturen auf. Diese Halos erzeugen einen optischen dreidimensionalen Effekt, der Abbildung 104: Vergleich ohne und mit jedoch keineswegs der räumlichen Struktur des Phasenkontrast Objekts entsprechen muss. 129/210 13.7 Fluoreszenzmikroskopie Bei der Fluoreszenzmikroskopie wird das Objekt nicht durchstrahlt, sondern durch das Objektiv beleuchtet (Auflichtmikroskopie). Als Lichtquellen werden Quecksilberdampflampen oder Laser eingesetzt. Im zu untersuchenden Präparat befinden sich fluoreszierende Stoffe, die mit Licht einer bestimmten Wellenlänge zum Leuchten angeregt Abbildung 105: Stokes shift werden. Die zur Anregung notwendige Wellenlänge wird mit optischen Filtern isoliert. Das einfarbige Licht wird auf das Objekt geleitet, worauf dieses zu fluoreszieren beginnt. Aufgrund der Aufteilung der abgegebenen Energie in Wärme und Licht ist das abgestrahlte Fluoreszenzlicht immer längerwelliger, also energieärmer, als das Anregungslicht. Dieser Effekt wird als Stokesche Verschiebung (Stokes shift) bezeichnet. Farbteiler trennen das Fluoreszenzlicht vom anregenden Licht und leiten es in das Okular des Mikroskops. Abbildung 106: Strahlengang im Fluoreszenzmikroskop 130/210 13.8 Konfokalmikroskopie In einem normalen Lichtmikroskop ist das Bild eine Überlagerung aus einer scharfen Abbildung der Punkte in der Fokalebene und einer unscharfen Abbildung der Punkte außerhalb dieser. Die meisten Konfokalmikroskope sind Laser-Rastermikroskope. Bei diesen rastert ein Laserstrahl punktweise ein Objekt, wobei er in der Fokusebene der zu mikroskopierenden Probe maximal fokussiert ist. Es werden nun die Fluoreszenzmoleküle angeregt, die sich im Lichtweg des fokussierten Laserstrahles befinden. Bildet man die Fluoreszenzsignale nun wieder auf einer Bildebene ab, in der sich eine kleine Lochblende befindet, so können nur die Signale, die aus der Fokusebene kommen, exakt in dieses Loch fallen. Die Signalanteile, die aus anderen Ebenen oberhalb oder unterhalb der Fokusebene in der Probe stammen, werden dadurch ausgeblendet und es kommt zu einer Schichtaufnahme. Hinter der Lochblende befindet sich ein lichtempfindlicher Empfänger, aus dessen Signal dann punktweise ein Bild zusammengesetzt wird. Zeichnet man mehrere Schnitte in verschiedenen Fokusebenen auf, so erhält man eine Schichtung und kann daraus am Computer eine dreidimensionale Rekonstruktion des abgebildeten Objektes erstellen. Abbildung 107: Strahlengang im Konfokalmikroskop 131/210 14 Elektronenmikroskopie 14.1 Wellencharakter des Elektrons Massereiche Teilchen, und damit auch Elektronen, haben neben Teilchen- auch Wellencharakter. Daher sind auch bei Elektronen Beugungserscheinungen zu beobachten. Daher kann auch mit Elektronen Mikroskopie betrieben werden. Je höher die Beschleunigungsspannung der Elektronen, desto höher ist auch ihre Geschwindigkeit und desto kleiner ihre Wellenlänge. Je kleiner die Wellenlänge ist, desto höher die Auflösung. Allerdings gibt es eine natürliche obere Grenze, da sich mit Annäherung der Geschwindigkeit der Elektronen an die Lichtgeschwindigkeit auch deren Masse vergrößert. Beschleunigungsv/c m/m0 spannung 100 keV 0,55 (= halbe 1,20 Lichtgeschwindigkeit) 1 MeV 0,94 2,39 5 MeV 0,999 22,37 m= m0 1− 2 v c2 λ [pm] 3,7 0,88 0,11 m ... Masse des Elektrons m0 ... Ruhemasse des Elektrons v ... Geschwindigkeit des Elektrons c ... Lichtgeschwindigkeit Da schnelle Elektronen eine sehr viel kleinere Wellenlänge als sichtbares Licht haben und die Auflösung eines Mikroskops durch die Wellenlänge begrenzt ist, kann mit einem Elektronenmikroskop eine deutlich höhere Auflösung (derzeit etwa 0,1 nm) erreicht werden als mit einem Lichtmikroskop (etwa 200 nm). 132/210 14.2 Transmissionselektronenmikroskopie TEM Bei der TEM treten die Elektronen aus einer Glühkathode aus und werden im Hochvakuum mit einer Beschleunigungsspannung U (10-125 kV) von der Kathode (-) zur Anode (+) beschleunigt. Die Elektronenstrahlen werden mit Hilfe elektrischer und magnetischer Felder abgelenkt und fokussiert, wodurch eine Abbildung ermöglicht wird (~ Linse). Die auf die ultradünne Probe (70-100 nm) auftreffenden Elektronenstrahlen werden gebeugt. Ein Objektiv liefert ein vergrößertes Zwischenbild und Projektive projizieren das Zwischenbild auf einen Bildschirm. Die auf den Fluoreszenzschirm auftreffenden Elektronen erzeugen sichtbare Strahlung und somit ein Bild. Vorteile − Sehr gute Auflösung von ca. 0,1 nm, was ca. einem Atomdurchmesser entspricht. Es hat eine 100- bis 500.000-fache Vergrößerung und damit eine ca. 1000fach größere Auflösung als ein Lichtmikroskop. − Gute Schärfentiefe im Verhältnis zur Auflösung − Vergrößerung in weiten Bereichen variierbar Abbildung 108: Aufbau eines Transmissionselektronenmikroskops TEM Nachteile − Sehr aufwendige Präparation, (Schwer-)Metallbedampfung − Fixation, ultradünne Schnitte (ca. 100 nm) − Probe im Vakuum − Keine lebenden Strukturen − Strahlenschäden der Probe bei längerer Beobachtung 133/210 14.3 Rasterelektronenmikroskopie REM Bei der REM treten die Elektronen aus einer Glühkathode aus und werden im Hochvakuum mit einer Beschleunigungsspannung U (10-125 kV) von der Kathode (-) zur Anode (+) beschleunigt. Die Elektronenstrahlen werden mit Hilfe elektrischer und magnetischer Felder abgelenkt und fokussiert. Ein fein fokussierter Elektronenstrahl tastet das Objekt Punkt für Punkt ab. Es kommt zur Rückstreuung und Freisetzung von Sekundärelektronen an der Probe. Die Probe muss daher elektrisch leitfähig sein oder mit Gold bedampft werden. Die emittierten Sekundärelektronen werden von einem Detektor registriert. Die Elektronenintensität wird in einen Helligkeitswert umgesetzt. Die Helligkeitswerte pro Pixel werden auf einem Bildschirm zu einem Bild zusammengesetzt. Vorteile − Hohe Auflösung von 1-3 nm. Es hat ca. eine 1000-fach größere Auflösung als ein Lichtmikroskop. − Gute Schärfentiefe im Verhältnis zur Auflösung − Vergrößerung in weiten Bereichen variierbar − Mikroanalyse − Abbildung oberflächenmassiver Proben Abbildung 109: Aufbau eines REM Nachteile − Sehr aufwendige Präparation, (Schwer-)Metallbedampfung − Probe im Vakuum − Keine lebenden Strukturen 14.4 Röntgenmikroskopie Die Röntgenmikroskopie ist ein Mikroskopieverfahren, das statt sichtbarem Licht Röntgenstrahlung nutzt. Röntgenstrahlung bietet den Vorteil der kürzeren Wellenlänge (ca. 0,1-100 nm) was eine höhere Auflösung ermöglicht. Darüber hinaus unterscheidet sich die Wechselwirkung von Röntgenstrahlung mit Materie von der des sichtbaren Lichtes (z.B. Durchdringungsvermögen, Brechzahlen) womit ergänzende Informationen über 134/210 die Probe gewonnen werden können. Die Objektdicke der Probe ist im Gegensatz zur TEM unkritisch. Es ist kein Vakuum erforderlich und daher auch für biologische Präparate geeignet. Projektionsverfahren Ein Elektronenstrahl trifft möglichst punktförmig auf eine Metallfolie wodurch es zur Abstrahlung von Röntgenstrahlung kommt. Die Probe befindet sich darunter im aufgeweiteten Röntgenstrahl und wird auf einem Detektor abgebildet. Abbildung 110: Projektionsverfahren Rasterverfahren Beim Rasterverfahren wird das Röntgenlicht fokussiert. Die Probe wird in derselben Ebene durch den Fokus bewegt und an jeder Probenposition das gesamte von der Probe kommende Licht gemessen und als Helligkeitswert für das Bild genommen. Abbildung 111: Rasterverfahren 135/210 15 Atomare Bindung 15.1 Zusammenhang Potential und Feld Das Potential basiert auf dem Energiebegriff, das Feld basiert auf dem Kraftbegriff. 15.1.1 Feld Wird jedem Punkt eines Raumes eine physikalische Größe mit einem bestimmten Betrag zugeordnet, so nennt man den diesen Zustand des Raumes ein Feld. Man unterscheidet verschiedene Arten von Feldern: − Statisches Feld vs. Wechselfeld − Skalarfeld vs. Vektorfeld − Quellenfeld vs. Wirbelfeld − Homogenes Feld vs. Inhomogenes Feld Elektrostatische Kraft F Den Raum um eine elektrische Ladung bezeichnet man als elektrisches Feld. Die Stärke eines Feldes kann man an der elektrostatischen Kraft F erkennen, die auf eine ins Feld gebrachte sehr kleine Probeladung Q ausgeübt wird. Die Kraft F ist proportional zur Ladung Q und der Proportionalitätsfaktor wird als elektrische Feldstärke E bezeichnet. F=EQ F ... Elektrostatische Kraft [N] E ... Elektrische Feldstärke [N/C] Q ... Ladung [C] Elektrische Feldstärke E Die elektrische Feldstärke E in einem Raumpunkt, in dem sich die Ladung Q befindet, ist die Kraft F auf eine in diesem Raumpunkt befindliche Ladung Q: E ... Elektrische Feldstärke [N/C] bzw. [V/m] F E = −∇ϕ = ∇ ... Ableitung nach x, y und z Q ϕ ... Potential [V] F ... Elektrostatische Kraft [N] Q ... Ladung [C] Die Richtung der Feldstärke E ist durch die Richtung der Kraft festgelegt, die auf eine positive Probeladung q ausgeübt wird. Bei positiven Probeladungen zeigt die Kraft in Feldrichtung, bei negativen entgegengesetzt. Die Feldlinien beginnen bei positiven Ladungen (Quellen) und enden in negativen Ladungen (Senken). Sie enden jeweils senkrecht an der Oberfläche einer Ladung. Die Kräfte sind immer tangential zu den Feldlinien. Die Feldlinien stehen normal auf die Äquipotentiallinien (Punkte gleichen Potentials). 136/210 Abbildung 112: Zusammenhang zwischen Potential, Feldstärke und Abstand von der Ladung 15.1.2 Potential Die skalare Zustandsgröße des Potentials ϕ ist die Fähigkeit eines Feldes Arbeit zu verrichten. Das Potential nimmt mit zunehmendem Abstand von der Ladung ab. Q 1 ϕ ... Potential [V] ϕ= Q ... Ladung [C] 4 π ε0 r ε0 = 8,854.10-12 C/(Vm) ... Elektrische Feldkonstante r ... Abstand von der Ladung Q [m] Potentialdifferenz Die Arbeit, die ein mit der Ladung Q geladener Körper beim Übergang zwischen zwei Punkten verrichtet heißt Potentialdifferenz oder Spannung U [V]. 15.2 Coulombsches Gesetz Das Coulombsche Gesetz beschreibt die Anziehungs- und Abstoßungskräfte zwischen elektrisch geladenen Körpern. Zwischen punktförmigen elektrischen Ladungen gilt: Der Betrag der Kraft F ist dem Produkt der Ladungen Q1 und Q2 direkt proportional und dem Quadrat ihrer Entfernung r indirekt proportional: F ... Kraft [N] 1 Q1 Q 2 F= 2 ε0 = 8,854.10-12 C/(Vm) ... Elektrische Feldkonstante 4 π ε0 r Q1, Q2 ... Ladungen [C] r ... Abstand der Ladungen [m] 137/210 15.3 Dipol im elektrischen Feld Ein Dipol besteht aus zwei räumlich getrennten entgegengesetzten Ladungen und ist Quelle eines Dipolfeldes. Die Stärke des Dipolcharakters wird durch das Dipolmoment ausgedrückt. Es ist abhängig von Abstand und Stärke der beiden Ladungen. μ=Qx μ ... Dipolmoment [Cm] Q ... Ladung [Q] x ... Abstand der Ladungen [m] Induzierter Dipol Ein polares Molekül mit dem Dipolmoment μ1 besitzt um sich herum ein elektrisches Dipolfeld und kann einen induzierten Dipol mit dem Dipolmoment μ2 in einem benachbarten polarisierbaren Molekül verursachen. Abbildung 113: Induzierter Dipol Dieser induzierte Dipol wechselwirkt mit dem permanenten Dipol des ersten Moleküls und die beiden Moleküle ziehen sich an. 15.4 Bindungsenergie Bindungsenergie wird freigesetzt, wenn zwei oder mehr Bestandteile durch Anziehungskräfte zusammengebracht werden und miteinander ein gebundenes System bilden. Um die Bestandteile wieder zu trennen, muss eine gleich große Arbeit von außen geleistet, also dem System wieder zugeführt werden, um die bindenden Kräfte zu überwinden. 15.5 Bindungsarten 15.5.1 Wellenmechanisches Atommodell Die wellenmechanischen Orbitale bilden die Grundlage für die chemischen Bindungen. Das Orbital beschreibt den Aufenthaltsraum, in dem sich ein betrachtetes Elektron mit ca. 90 % Wahrscheinlichkeit aufhält. Orbitale werden anhand der vier Quantenzahlen n, l, m und s klassifiziert. Die Elektronenanordnung in einem Atom nennt man seine Elektronenkonfiguration. 138/210 Hauptquantenzahl n Wertebereich: n = 1, 2, 3, … Die Hauptquantenzahl n entspricht ungefähr den Schalen des Bohrschen Atommodells. Sie beschreibt einen Bereich, in dem die Aufenthaltswahrscheinlichkeit eines Elektrons sehr hoch ist. Je größer n wird, desto weiter entfernt vom Atomkern bewegt sich das Elektron, zudem erhöht sich dessen potentielle Energie. Die maximale Anzahl der Elektronen in einer Schale ergibt sich als 2n². Nebenquantenzahl l Wertebereich: l = 0, 1, …, (n − 1) bzw. s-, p-, d-, f-Orbital usw. Die Nebenquantenzahl l beschreibt den Bahndrehimpuls des Elektrons und damit die „Form“ des Orbitals. Magnetquantenzahl m Wertebereich: m = −l, −(l + 1), …0, …+(l − 1), +l Die Magnetquantenzahl m beschreibt die räumliche Ausrichtung, die das Orbital bezüglich eines äußeren Magnetfeldes einnimmt. Die resultierenden Orbitale sind energetisch gleich. Spinquantenzahl s Wertebereich: s = +1/2 oder −1/2 Die Spinquantenzahl s beschreibt den Eigendrehimpuls (Spin) eines Elektrons, der durch Drehung des Atoms um seine eigene Achse zustande kommt. Pauliprinzip Zwei Elektronen dürfen nicht in allen vier Quantenzahlen übereinstimmen. D.h. haben zwei Elektronen gleiche Quantenzahlen n, l und m, dann müssen sie unterschiedliche Spinquantenzahlen aufweisen. Ein Atomorbital kann höchstens mit zwei Elektronen mit antiparallelem Spin besetzt werden. Hundsche Regel Beim Einbau mehrerer Elektronen in energetisch gleichwertige Elektronenzustände werden die Orbitale zuerst mit parallelem Spin besetzt. 15.5.2 Kovalente Bindung Beispiel: H2, N2, CO2 Richtgröße: ca. 400 kJ/mol Atombindungen bilden sich besonders zwischen den Atomen von Nichtmetallen aus (mit ähnlicher Elektronegativität). Bei Atombindungen bilden die Außenelektronen (Valenzelektronen) der Elektronenhüllen der beteiligten Atome mindestens ein Elektronenpaar aus, das die Atome zusammenhält. Wenn der Energiegehalt der zusammengetretenen Atome geringer ist als der der einzelnen Atome handelt es sich um eine stabile chemische Bindung. 139/210 Abbildung 114: Kovalente Bindung zwischen zwei Sauerstoff-Atomen 140/210 Bindungsenergie Abbildung 115: Bindungsenergien kovalenter Bindungen 15.5.3 Ionenbindung Beispiel: NaCl Richtgröße: ca. 200 kJ/mol Die Ionenbindung ist eine chemische Bindung, die aus der elektrostatischen Anziehung positiv und negativ geladener Ionen resultiert. Bei einer Elektronegativitäts-Differenz größer als 1,7 liegen ionische Bindungen, darunter polare, überwiegend kovalente Bindungen vor. Die Atome streben durch Aufnahme oder Abgabe von Elektronen danach, für ihre äußerste besetzte Schale die Edelgaskonfiguration zu erreichen. Dies wird entweder durch Elektronenabgabe seitens der Elemente mit geringerer Elektronegativität erreicht (Metalle), dabei entstehen einfach oder auch mehrfach positiv geladene Kationen, oder im anderen Fall durch Elektronenaufnahme seitens der Elemente mit höherer Elektronegativität (Nichtmetalle), dabei entstehen einfach oder mehrfach negativ geladene Anionen. Bindungsenergie Aus der Coulombschen Kraft F kann die Bindungsenergie W zwischen den Ionen berechnet werden. Das ist jene Energie, die notwendig ist um zwei Ionen auseinanderzureißen. dW = F dr W ... Bindungsenergie [J] ∞ ∞ F ... Kraft [N] Q Q Q Q W = ∫ F dr = ∫ 1 22 dr = 1 2 r ... Abstand der Ladungen [m] 4πε 0 r 4πε0 r Q1, Q2 ... Ladungen [C] x x ε0 = 8,854.10-12 C/(Vm) ... Elektrische Feldkonstante 141/210 Die Bindungsenergie pro Mol beträgt: Wmol ... Bindungsenergie pro Mol [J/mol] Wmol = L W W ... Bindungsenergie [J] L = 6,02.1023/mol Für Natriumchlorid erhält man eine Bindungsenergie von 8,27.10-19 J oder 5,31 eV und eine Bindungsenergie pro Mol von 498 kJ/mol. Abbildung 116: Ionenbindung zwischen dem Metall Lithium und dem Nichtmetall Fluor 15.5.4 Van der Waals-Bindung Beispiel: Helium Richtgröße: ca. 5 kJ/mol Auch zwischen Atomen und Molekülen, die keine ionische oder kovalente Bindung eingehen können existieren Anziehungskräfte. Als Van der Waals-Kräfte bezeichnet man die relativ schwachen nicht-kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungsenergie mit etwa der sechsten Potenz des Abstandes abfällt. Vereinfacht kann man sich das so vorstellen, dass die Elektronen eines Atoms ständig 142/210 in Bewegung sind und sich an einer Stelle häufen können, was zu einer leichten negativen Ladung führt. Sobald der Schwerpunkt der positiven Ladungen vom Schwerpunkt der negativen Ladungen räumlich getrennt ist, kann man von einem Dipol sprechen. Dieser temporäre Dipol kann nun in einem benachbarten Molekül ebenfalls einen Dipol induzieren. Die kurzfristige Anziehung der beiden Dipole bezeichnet man als Van der Waals-Bindung. 15.5.5 Wasserstoffbrückenbindung Beispiel: H20 Richtgröße: ca. 40 kJ/mol Diese schwachen Wechselwirkungen entstehen aufgrund des Dipolcharakters eines Wassermoleküls, einer OH-Gruppe oder einer NH-Gruppe. Der Sauerstoff und der Stickstoff mit ihrer großen Elektronegativität ziehen jeweils das Bindungselektronenpaar zu sich heran (negative Teilladung δ-), die Wasserstoffatome werden dadurch positiv geladen (positive Teilladung δ+). Geraten diese Wasserstoffatome in die Nähe der negativen Teilladung eines anderen Dipols so kommt es zu einer Dipol-Dipol-Wechselwirkung und es entsteht eine Wasserstoffbrückenbindung. 15.5.6 Metallbindung Die Außenelektronen der Metalle sind nur schwach gebunden und können daher leicht vom Atom abgetrennt werden. Im Metall bildet sich deshalb ein Gitter aus positiv geladenen Metall-Ionen, den sogenannten Atomrümpfen. Die abgegebenen Außenelektronen sind nicht mehr einem einzelnen Atom zugeordnet und können sich innerhalb des Gitters nahezu frei bewegen, dies nennt man Elektronengas. Das bewirkt die gute elektrische Leitfähigkeit und hohe Wärmeleitfähigkeit der Metalle. Die Metallbindung wird durch die Anziehungskräfte zwischen Metall-Ionen und freien Elektronen verursacht. 143/210 16 Grenzflächen und Membranen 16.1 Potentialverlauf an der Zellmembran Abbildung 117: Potentialverlauf an einer Biomembran ϕ(x) = ϕ0 − ϕ H xH Helmholtz-Doppelschicht (Starre Doppelschicht) Taucht eine Metallelektrode in eine Lösung entsprechender Metallionen, so läuft folgende Reaktion ab: Me Me 2+ + 2e − Je nach der Gleichgewichtslage wird nun entweder die Hin- oder die Rückreaktion bevorzugt ablaufen, wodurch im Metall ein Elektronenüberschuss oder – mangel entsteht. Entsteht im Metall z.B. ein Elektronenüberschuss zieht es positive Ionen aus der Lösung an. Es kommt zur Entstehung einer elektrischen Doppelschicht aus zwei parallelen Ladungsschichten. Das Metall und die Lösung befinden sich dabei auf unterschiedlichen Potenzialen. Der Schichtabstand entspricht dem halben Durchmesser der solvatisierten Ionen aus der Lösung. Wegen der relativ festen Bindung zwischen diesen beiden Ladungen wird diese Schicht als „starre“ Doppelschicht bezeichnet. Das Potenzial der starren Helmholtz-Schicht zeigt einen linearen Verlauf. ϕ(x) ... Potential im Abstand x von der Membran ϕ0 .... Potential der Ionen an der Membran ϕH ... Potential der frei beweglichen Ionen xH ... Abstand der frei beweglichen Ionen von der Membran Gouy-Chapman Schicht (Diffuse Doppelschicht) Da das elektrische Feld der geladenen Elektrodenoberfläche aber weiter reicht, als die starre Doppelschicht dick ist, werden auch in größeren Abständen Ionen angezogen bzw. abgestoßen. Andererseits versucht die Wärmebewegung jede Ordnung der Ionen wieder aufzulösen. So entsteht die diffuse Doppelschicht. Das Potenzial der diffusen Doppelschicht zeigt einen exponentiellen Verlauf, der 144/210 durch die Poisson-Boltzmann-Gleichung beschrieben werden kann. ϕ(x) = ϕ0 exp(−κ x H ) ϕ(x) ... Potential im Abstand x von der Membran ϕ0 .... Potential der Ionen an der Membran κ ... Dicke der diffusen Doppelschicht xH ... Abstand der frei beweglichen Ionen von der Membran 16.2 Ruhepotential Alle lebenden Zellen erzeugen elektrische Spannungen (Biopotentiale). Kalium- und Natrium-Ionen wandern durch die selektiv permeable Zellmembran was zu unterschiedlichen Ionenkonzentrationen im intra- und im extrazellulären Raum führt. Dieser Konzentrationsgradient ist notwendig um die Funktion der Zelle aufrechtzuerhalten. Die Natrium-Ionen Konzentration im Inneren der Zelle ist gering, die Kalium-Ionen Konzentration im Inneren der Zelle ist hoch. Im nicht erregten Zustand besteht im Zellinneren im Vergleich zum extrazellulären Raum eine negative Ladung, d.h. die Zellmembran ist polarisiert. Die mit dieser Polarisation verbundene Spannung ist das Ruhepotential der Zellmembran. 16.3 Aktionspotential Das Aktionspotential ist eine elektrische Erscheinung, die mit der Erregung von Nerven- und Muskelzellen verbunden ist und ist abhängig vom Ruhepotential der Zelle. Bei Erregung der Zelle kommt es zu einer Veränderung der Membranpermeabilität und positive Ionen strömen in das Zellinnere. Die ursprünglich negative Ladung der Zelle (Ruhepotential) wird neutralisiert und es kommt zur Depolarisation bzw. zu einer Umpolarisation, d.h. zu einer negativen Ladung der Zelle verglichen mit dem Extrazellularraum. Dadurch, dass ein Teil der Zellmembran bereits erregt wurde, ein anderer noch nicht, kommt es zur Ausbildung eines Dipolfeldes und die Erregung greift auf benachbarte Bereiche über wodurch es zu einer fortschreitenden Erregung der Zellmembran kommt. Mit dem Nachlassen der erhöhten Permeabilität der Zellmembran kommt es zu einer Repolarisierung der Zelle und das Ruhepotential stellt sich wieder ein. 16.4 Nernst-Gleichung In biologischen Systemen trennen Zellmembranen Bereiche unterschiedlicher Ionenkonzentrationen. Ist die Membran für ein bestimmtes Ion selektiv permeabel, wird es entlang des Konzentrationsgradienten diffundieren, gleichzeitig entsteht aber, da das Ion geladen ist, eine Spannung (Ruhepotential). Mit der NernstGleichung lässt sich die Gleichgewichtslage (Ausgleich zwischen Diffusionskräften und elektrostatischen Kräften) dieses Vorgangs beschreiben: U ... Ruhespannung [U] R T ce U=− ln R ... Allgemeine Gaskonstante [J/(mol K)] F ci T ... Absolute Temperatur [K] F ... Faradaykonstante [C/mol] c ... Konzentration der Ionenart e ... extrazellulär, i ... intrazellulär 145/210 16.5 Goldman-Gleichung Die Goldman-Gleichung erlaubt die Berechnung des Membranpotentials für eine Membran, die für verschiedene Ionen (z.B. Na+, K+, Cl-) durchlässig ist. Unter Gleichgewichtsbedingungen wird die zufällige Ionenbewegung, die zu einem Ausgleich der Ionenkonzentrationen auf beiden Seiten der Zellmembran führen würde, durch eine elektrische Potentialdifferenz ausgeglichen. Die Summe aller Ionenströme ist null. Damit hängt die Gleichgewichts-Potentialdifferenz (Ruhepotential) über einer Zellmembran von den Ionenströmen aller durchgelassenen Ionen ab. In der Goldman-Gleichung wird der Ionenstrom als Funktion der Ionenkonzentration und der Leitfähigkeit (Kehrwert des Widerstandes) für diese Ionen beschrieben: R T g Na c Na,e + g K c K,e + g Cl cCl,e U ... Ruhespannung [U] U=− ln F g Na c Na,i + g K c K,i + g Cl cCl,i R ... Allgemeine Gaskonstante [J/(mol K)] T ... Absolute Temperatur [K] F ... Faradaykonstante [C/mol] g ... Leitfähigkeit für die Ionenart = 1/R c ... Konzentration der Ionenart e ... extrazellulär, i ... intrazellulär 16.6 Ionenkonzentrationen beim Menschen Abbildung 118: Physiologische Ionenkonzentrationen beim Menschen 146/210 17 Zentrifuge Eine Zentrifuge ist ein Gerät welches unter Ausnutzung der Zentrifugalkraft die Bestandteile von mehrphasigen Systemen, wie Suspensionen (fest in flüssig, z.B. Blut), Emulsionen (flüssig in flüssig) und Gasgemischen, trennen kann. Blut ist eine Suspension aus zellulären Bestandteilen (feste Phase, ca. 44 %) und Blutplasma (flüssige Phase, ca. 55 %). Die Erythrozyten können vom Blutplasma durch Sedimentation getrennt werden, da ihre Dichte höher als die des Plasmas ist. 17.1 Sedimentation Unter der Sedimentationsgeschwindigkeit versteht man die Vertikalgeschwindigkeit mit der sich ein Partikel innerhalb eines fluiden Mediums absetzt, d.h. sedimentiert. Wichtig ist die Sedimentationsgeschwindigkeit vor allem für Korngrößenanalysen und den damit verbundenen mechanischen Trennverfahren. Widerstandsbeiwert Der Widerstandsbeiwert cw ist ein dimensionsloses Maß für den Strömungswiderstand eines von einem Fluid umströmten Körpers und hängt von der Reynolds-Zahl ab, d.h. ob sich eine Flüssigkeit laminar oder turbulent verhält. Re ... Reynoldszahl [] W2r Re = W ... Sedimentationsgeschwindigkeit [m/s] ν r ... Partikelradius [m] ν ... Kinematische Viskosität des Fluids [m²/s] Allgemeine Näherung für Widerstandsbeiwert: cw ... Widerstandsbeiwert [] 24 4 cw = + + 0, 4 Re ... Reynoldszahl [] Re Re Kleine Sedimentationsgeschwindigkeiten Für kleine Sedimentationsgeschwindigkeiten mit Re < 1 gilt cw = 24/Re. Die Sedimentationsgeschwindigkeit ändert sich dann mit dem Quadrat des Partikelradius und kann mit der Stokesschen Gleichung berechnet werden. Aus dem Ansatz FR ... Reibungskraft [N] FR = F G − FA FG ... Gewichtskraft [N] FA ... Auftrieb [N] folgt: W ... Sedimentationsgeschwindigkeit [m/s] (ρp − ρf ) g 2r 2 W= ρp ... Dichte des Partikels [kg/m³] 9η ρf ... Dichte des Fluids [kg/m³] g ... Erdbeschleunigung [m/s²] r ... Partikelradius [m] η ... Dynamische Viskosität [kg/(ms)] 147/210 Größere Sedimentationsgeschwindigkeiten Für größere Sedimentationsgeschwindigkeiten mit 1000 < Re < 200.000 gilt cw = 0,44 (für Kugeln). Die Sedimentationsgeschwindigkeit ändert sich dann mit der Wurzel des Partikelradius. W ... Sedimentationsgeschwindigkeit [m/s] 3 (ρp − ρf ) g r W= ρp ... Dichte des Partikels [kg/m³] 8 ρf c w ρf ... Dichte des Fluids [kg/m³] g ... Erdbeschleunigung [m/s²] r ... Partikelradius [m] cw ... Widerstandsbeiwert [] Abbildung 119: Sedimentationsgeschwindigkeit eines Sandkorns in Wasser mit einer Dichte von ca. 3 g/cm³. Je größer der Partikelradius und damit desto schwerer das Teilchen, desto höher die Sedimentationsgeschwindigkeit. Als Referenzwerte für die Sedimentationsgeschwindigkeit der Erythrozyten im menschlichen Blutplasma gelten für den Mann 3-7 mm/h und für die Frau 7-11 mm/h. Veränderungen in der Sedimentationsgeschwindigkeit können in der Diagnostik eingesetzt werden, da sich z.B. bei Entzündungen die Viskosität des Blutplasmas und damit die Absinkgeschwindigkeit der Blutkörperchen verändert. 17.2 Zentripetalkraft Zentripetalkraft Die Zentripetalkraft ist die wirkende Kraft, die an einem Körper angreift, der sich auf einer krummlinigen Bahn bewegt. Insbesondere ist die Zentripetalkraft für kreisförmige Bahnen verantwortlich: Sie „zieht“ den Körper nach innen zum Kreismittelpunkt bzw. zur Drehachse und hält den Körper so auf einer Kreisbahn. Der Körper würde sich sonst geradlinig weiterbewegen. Die Zentripetalkraft ist eine nach innen gerichtete Kraft. Fz ... Zentripetalkraft [N] Fz = a z m az ... Zentrifugalbeschleunigung [m/s²] m ... Masse [kg] 148/210 Mit der Beschleunigung az: ν 2 (ω r) 2 = = ω2 r az = r r az ... Zentrifugalbeschleunigung [m/s²] ν ... Bahngeschwindigkeit [m/s] r ... Radius [m] ω ... Winkelgeschwindigkeit [s-1] Die Winkelgeschwindigkeit hängt mit Umdrehungszahl N zusammen: ω = 2π N ω ... Winkelgeschwindigkeit [s-1] 2π ... Umfang des Einheitskreises mit r = 1 N ... Umdrehungszahl [s-1] Beispiel: Bei gegebenem Radius r = 15 cm und Umdrehungszahl N = 1500 Umdrehungen/min, kann die Beschleunigung az eines Körpers um einen festen Punkt, d.h. eines Körpers, der sich auf einer Kreisbahn mit dem Radius r bewegt, berechnet werden: ⎛ 1500 min ⎞ −2 a z = ω2 r = (2πN) 2 r = ⎜ 2π ⎟ ⋅15,10 m = 3701 m / s² min 60 s ⎠ ⎝ Oft wird diese Beschleunigung in Bezug zur Erdbeschleunigung g angegeben: 3701 m / s² az = = 377 g 9,81 m / s² D.h. 1500 Umdrehungen pro Minute bei einem Radius von 15 cm entsprechen ca. der 370-fachen Erdbeschleunigung. Entsprechend dieses Prinzips können die Sedimentationsgeschwindigkeiten mit Hilfe einer Zentrifuge durch Erhöhung der wirkenden Beschleunigung um ein Vielfaches erhöht werden. Zentrifugalkraft Der mitbewegt Beobachter nimmt die Zentrifugalkraft wahr, die auch als Fliehkraft bezeichnet wird. Die Zentrifugalkraft ist eine nach außen gerichtete Kraft. Bahngeschwindigkeit ν=ωr Zentrifugalkraft F Abbildung 120: Zusammenhang von Zentripetal- und Zentrifugalkraft 149/210 17.3 Ultrazentrifuge Die Ultrazentrifuge ist eine für hohe Geschwindigkeiten optimierte Zentrifuge, die Beschleunigungen von bis zu 106 g erzeugen kann. Ultrazentrifugen rotieren ihren Inhalt sehr schnell, bis zu 500.000-mal in der Minute. Der Rotor bewegt sich hierbei im Vakuum, sodass die Luftreibung minimiert wird. Die Ultrazentrifuge dient der Trennung von hochmolekularen Strukturen wie z.B. Lipoproteinen, Viren oder anderen Makromolekülen. Da der Größenunterschied zwischen flüssiger Phase (z.B. Wassermoleküle) und den darin befindlichen Partikeln so gering ist (z.B. Faktor 3600 für Wasser und Serumalbumin) würde das Absinken der Partikel „ewig“ dauern würde man das Röhrchen einfach stehen lassen. 17.3.1 Aufbau der Ultrazentrifuge Die Analytische Ultrazentrifuge dient zur Untersuchung hochmolekularer Stoffe in Lösung. Infolge der Zentrifugalkraft sedimentieren die einzelnen Moleküle entsprechend ihrer Größe und Form unterschiedlich schnell. Die Sedimentationsgeschwindigkeit hängt bei konstanten äußeren Bedingungen von der Masse und Form der Partikel sowie von der Viskosität der Lösung ab. Abbildung 121: Aufbau einer Ultrazentrifuge Das Herzstück der Ultrazentrifuge ist eine Vakuumkammer, in der ein Rotor von einem Elektromotor angetrieben wird. Im Rotor sind zwei einander gegenüberliegende Bohrungen angebracht, die eine Messzelle und eine dem Gewichtsausgleich dienende Balancezelle aufnehmen. Die Messzelle hat zwei Ausschnitte, in die die Probe und reines Lösemittel als Referenz eingebracht werden. Die Zelle ist oben und unten mit Quarzglasscheiben verschlossen, um den Sedimentationsvorgang durch optische Systeme verfolgen zu können. Hierbei wird das Konzentrationsprofil innerhalb der Messzelle kontinuierlich bestimmt. Üblich sind drei verschiedene optische Systeme: UVAbsorption, Schlieren- und Interferenzmessung. Die beiden letzteren Systeme 150/210 messen Unterschiede zwischen Brechungsindex der Lösung und des reinen Lösemittels und sind vor allem für Substanzen interessant, die nicht UV-aktiv sind. 17.3.2 Sedimentationsgeschwindigkeit in der Zentrifuge W= ⎛ ρ ⎞ Mr D ⎜1 − f a z ⎟ N A kT ⎜⎝ ρp ⎟⎠ W ... Sedimentationsgeschwindigkeit [m/s] Mr ... Relative Molekülmasse [g/mol] NA ... Avogadrozahl [mol-1] k ... Konstante T ... Temperatur (therm. Bewegung der Teilchen) [°C] D ... Diffusionskonstante ρp ... Dichte des Partikels [kg/m³] ρf ... Dichte des Fluids [kg/m³] az ... Zentrifugalbeschleunigung [m/s²] Die Sedimentationsgeschwindigkeit ist abhängig von der Reibungskraft FR. Ist FR sehr groß ist die Sinkgeschwindigkeit sehr klein: Fr ... Reibungskraft [N] FR ∝ f W W ... Sedimentationsgeschwindigkeit [m/s] mit f ... Reibungskoeffizient kT f= k ... Konstante D T ... Temperatur (therm. Bewegung der Teilchen) [°C] D ... Diffusionskonstante 17.3.3 Sedimentationskoeffizient Der Sedimentationskoeffizient s beschreibt die Sedimentationsgeschwindigkeit von Teilchen in der Ultrazentrifuge im Verhältnis zur Zentrifugalbeschleunigung. Aus dem Sedimentationskoeffizienten lässt sich bei Kenntnis des Diffusionskoeffizienten D die Molmasse des gelösten Teilchens berechnen. Der Sedimentationskoeffizient hängt von Masse, Form und Dichte des Teilchens ab: s ... Sedimentationskoeffizient [s] W s= W ... Sedimentationsgeschwindigkeit [m/s] az az ... Zentrifugalbeschleunigung [m/s²] 17.3.4 Auswertung der Ultrazentrifuge Aus der Wanderungsgeschwindigkeit der Partikel kann auf die Eigenschaften der Partikel rückgeschlossen werden. Der Übergangsbereich ist durch den Konzentrationsgradienten (die Ableitung der Konzentration nach der Zeit) bestimmt, d.h. dort wo die Konzentrationsänderung ihren größten Wert annimmt. 151/210 Erdbeschleunigung Position x cklein Übergangsbereich cgroß Gefäß Konzentration c Abbildung 122: Auswertung der Ultrazentrifuge 152/210 18 Photometrie Die Photometrie ist eine Methode, bei der die Konzentration von fein verteilten oder gelösten Stoffen durch Lichtmessung ermittelt wird. 18.1 Kolorimetrie Bei einem Kolorimeter (veraltete Methode) wurde das Auge als „Messinstrument“ benutzt um ein optisches System auf „Farbgleichheit“ abzustimmen. Ein praktisches Beispiel dafür war die Hämoglobinbestimmung. Im linken Teil der Abbildung sieht man das Gerät in geöffnetem Zustand. Man erkennt den gefärbten Glaskeil (GK), links davon das Röhrchen für die Probe (Probenküvette, PK). Mit Hilfe einer verschiebbaren Schlitzblende (rechter Teil) stellt man Farbgleichheit zwischen Glas und Probe ein und kann mit dem Zeiger auf der numerischen Skala (NSK) die "SahliEinheiten" ablesen. Abbildung 123: Kolorimeter zur Bestimmung des Blutfarbstoffes 18.2 Trockenchemie Farbreaktionen können nicht nur in wässrigen Lösungen ablaufen, man kann sie auch auf ein festes Trägermaterial transferieren. Ein typisches Beispiel ist das Lackmus-Papier. Hier wird der pHIndikator Lackmus nicht in flüssiger Form dem Reaktionsgemisch zugegeben, sondern auf Papier gebunden und mit diesem in die Lösung eingetaucht. Das Resultat kann anschließend bequem mit einer mitgelieferten Farbtabelle verglichen und so die Farbe mit dem entsprechenden pH-Wert korreliert werden. Als erstes wurde versucht, die nasschemische Harnanalytik auf die sogenannte „Trockenchemie“ umzustellen. Hier war der Bedarf besonders groß, weil für die nasschemischen Verfahren eine Reihe unangenehm aggressiver Abbildung 124: Trockenchemisches Substanzen (wie z.B. konzentrierte Analysensystem Reflotron Schwefelsäure, Jodlösung etc.) verwendet wurde. Nach 1950 waren die ersten „Harnstreifen“ verfügbar, mit deren Hilfe man zunächst Eiweiß und Glukose, später 153/210 dann eine Reihe weiterer Substanzen nachweisen konnte. In der Folge versuchte man ähnliche Prinzipien auch für die Serumdiagnostik nutzbar zu machen. Ein Beispiel dafür ist das Reflotron. Die Photometereinheit (Ulbricht’sche Kugel) bestand aus einer Leuchtdiode (LED) und zwei Photodioden (Messdiode D und Referenzdiode DR). Die Ulbricht’sche Kugel ist innen optisch „ideal reflektierend“. Das Licht aus der LED fällt auf die Probe und wird dort je nach abgelaufener Reaktion mehr oder weniger reflektiert. Die Messung des reflektierten Lichts erfolgt mittels der Messdiode D, Kompensation unspezifischer Störungen mittels der Referenzdiode DR. 18.3 Aufbau eines Spektralphotometers Die Lichtquelle L liefert den Lichtstrahl, der Monochromator M (Gitter oder Prisma) macht aus dem weißen Licht ein Licht der Farbe, die für die Messung am geeignetsten ist. In der Küvette K befindet sich z.B. eine Kaliumpermanganat-Lösung (violett). Durch diese Flüssigkeit geht der Lichtstrahl durch und wird dabei abgeschwächt. Je konzentrierter der violette Stoff in der Flüssigkeit desto schwächer wird der Lichtstrahl, desto mehr Licht hat der Stoff absorbiert. Am Detektor D wird der eintreffende Lichtstrahl gemessen und angezeigt. So kann die Konzentration des Stoffes, der die violette Färbung der Flüssigkeit verursacht hat, gemessen werden. Wollen wir auch kleine Mengen des Stoffes erkennen, müssen wir ein Licht verwenden, das von dem Stoff sehr stark absorbiert wird, d.h. das Absorptionsmaximum (z.B. bei 540 nm, grün). Abbildung 125: Schematischer Aufbau eines Absorptionsphotometers 18.4 Konzentrationsbestimmung Graphische Konzentrationsbestimmung Das Photometer wird mit Hilfe zweier Flüssigkeiten kalibriert. Mit dem Leerwert (das reine Lösungsmittel) wird das Photometer auf Null zurückgesetzt. Dann wird für eine Standardlösung bekannter Konzentration die Extinktion bestimmt. Aus dem Wertepaar LW (c = 0, E = 0) und Standard (c = cStd, E = Estd) kann eine Eichgerade aufgestellt werden mit deren Hilfe die Konzentrationen weiterer Proben, deren Extinktion gemessen wurde, bestimmt werden kann. 154/210 Extinktion EPr EStd cPr cStd Konzentration Abbildung 126: Erstellung einer Eichgerade zur Konzentrationsbestimmung mit einem Photometer Rechnerische Konzentrationsbestimmung Bei konstanter Schichtdicke d ist die Extinktion E proportional zur Konzentration c der Lösung. Ist der molare dekadische Extinktionskoeffizient ε bekannt, so kann durch Messung der Extinktion mit Hilfe der Beziehung E = ε c d eine unbekannte Konzentration c bestimmt werden. 18.5 Absorption, Transmission und Extinktion Für die Definition der Begriffe Absorption, Transmission und Extinktion siehe Kapitel 5.10. Abbildung 127: Zusammenhang zwischen Konzentration und Transmission bzw. Extinktion Das Verhältnis von Konzentration c und Transmission T (Anteil der durchgelassenen Strahlung) kann in Form einer Exponentialfunktion dargestellt werden. Die Extinktion E (der dekadische Logarithmus des Kehrwerts der Transmission) und die Konzentration c zeigen einen linearen Zusammenhang. Da die Extinktion ein logarithmisches Maß ist, bedeutet eine Extinktion von 1 bereits eine Schwächung um den Faktor 10 (= 101), eine Extinktion von 2 eine Schwächung um den Faktor 100 (= 102), usw. 155/210 18.6 Filterphotometer Anstatt eines Monochromators (Gitter oder Prisma) werden Filter eingesetzt, die nur die entsprechenden Wellenlängen passieren lassen. Üblich sind z.B. 6 Filter für Wellenlängen von 230, 260, 280, 320, 562 und 595 nm. Damit können Konzentrationsbestimmungen für viele medizinisch bedeutsame Parameter durchgeführt werden, z.B. für Lactat, Glucose, Hämoglobin, Hämatokrit, Cholesterin, Triacylglyceride, Harnstoff, Proteine, Eisen, Bilirubin und Harnsäure. 156/210 19 Massenspektrometrie Die Massenspektrometrie ist ein Verfahren zum Messen des Masse-zu-LadungVerhältnisses m/z von Teilchen. Bei bekannter Ladung z kann daraus die Masse m der Teilchen ermittelt werden. Außerdem können Aussagen über das Vorhandensein und die Menge von Teilchen mit bekanntem Masse-zu-Ladung-Verhältnis gemacht werden. 19.1 Aufbau eines Massenspektrometers Ein Massenspektrometer (MS) besteht aus einer Ionenquelle, einem Analysator und einem Detektor. Abbildung 128: Aufbau eines Massenspektrometers 19.1.1 Ionenquelle In der Ionenquelle wird die zu analysierende Probe ionisiert. Dabei liegt die Probe in flüssiger Form vor und ein Molekülstrahl von etwa 1 mg wird in die Ionisationskammer geleitet. Dieser Molekülstrahl wird mit beschleunigten Elektronen mit einer Energie von 10 bis 70 eV beschossen wodurch vor allem die äußeren Ionen der Moleküle entfernt und diese dadurch ionisiert werden: M + e − = M z + + (z + 1)e − Aufgrund der nötigen Ionisierung ist es nicht möglich biologische Proben im Massenspektrometer zu analysieren ohne sie dabei zu zerstören. Der Einsatz des MS ist auch dadurch limitiert, dass nur relative Molekülmassen unter 2000 (d.h. z.B. Aminosäuren und Peptide) analysiert werden können. Proteine mit Massen um die 10.000 sind für eine MS-Analyse zu groß. 157/210 19.1.2 Analysator Die Ionen werden durch ein elektrisches Feld (abhängig von Masse und Ladung) beschleunigt: v ... Geschwindigkeit [m/s] 2(z e U) v= z = 1, 2, 3, ... Ladung der Teilchen m e ... Elementarladung eines Elektrons U ... Beschleunigungspannung [V] m ... Masse [kg] Die beschleunigten Ionen treten in ein starkes inhomogenes Magnetfeld ein und werden abhängig von ihrer Geschwindigkeit v und ihrer Ladung z kreissegmentartig abgelenkt bzw. beschleunigt: m b = (v × B) z e m ... Masse [kg] b ... Beschleunigung [m/s²] v ... Geschwindigkeit [m/s] B ... Magnetfeldstärke im Massenspektrometer [T] z = 1, 2, 3, ... Ladung der Teilchen e ... Elementarladung eines Elektrons Da große Massen eine hohe Trägheit aufweisen werden sie weniger stark abgelenkt. Je höher die Ladung der Ionen desto stärker ihre Ablenkung. Die Information über Masse und Ladung liegt nicht vollständig getrennt voneinander vor. Ein großes Teilchen mit großer Ladung kann gleich schnell sein wie ein kleines Teilchen mit kleinerer Ladung. Abbildung 129: Fiktives Resultat eines Massenspektrometers Ein fiktives Resultat: − m/z=200 Molekülart M1 mit m=200 − m/z=100 kleiner Anteil von M1 mit z=2 − m/z=150 Molekülart M2 mit m=150 − m/z=152 Molekülart M2 mit einem Isotop mit zwei zusätzlichen Neutronen m=152 − m/z=140 Molekülart M2 mit einer Abspaltung eines Fragments m=10 und dadurch reduzierter Molekülmasse m=140 19.1.3 Detektor Die Detektion in einem Massenspektrometer erfolgt meist über die Umwandlung der Ionen in Elektronen und anschließender Vervielfachung und Zählung der Elektronen. 158/210 Channeltron Ein Channeltron CEM (Kanalelektronenvervielfacher) erzeugt aus einem primären Teilchen (Elektron, Photon oder Ion) durch Sekundärelektronenemission im Vakuum eine Elektronenlawine von ca. 108 Elektronen. Diese leicht nachzuweisende Lawine erleichtert damit die Zählung der primären Teilchen. Der Channeltron besteht aus einem isolierenden Glasröhrchen. Zwischen der Kathode am offenen Ende des Röhrchens und der Anode am abgeschlossenen Ende herrscht ein Widerstand. Die Betriebsspannung in der Größenordnung von 2 kV erzeugt längs der Abbildung 130: Channeltron Röhrchenachse ein elektrisches Feld. Beim Auftreffen eines primären Teilchens auf den kathodennahen Bereich entstehen Sekundärelektronen, die von diesem Feld beschleunigt werden und nach dem Auftreffen auf die hochohmige Schicht des Glasröhrchens tertiäre Elektronen erzeugen, welche wiederum beschleunigt werden, usw. bis zum Aufprall der so entstehenden Lawine auf die Anode. 159/210 19.2 Time of flight-Massenspektrometer Teilchen gleicher kinetischer Energie fliegen mit unterschiedlicher Geschwindigkeit v, wenn sie unterschiedliche Massen m aufweisen. Abbildung 131: Aufbau eines Time of flight-Massenspektrometers Beschleunigt man Ionen in einem elektrischen Feld mit der Spannung U so haben die Ionen beim Verlassen des Feldes die kinetische Energie z e U, wobei z e die Ladung des Ions ist. z = 1, 2, 3, ... Ladung der Teilchen mv 2 mL2 zeU= = 2 e ... Elementarladung eines Elektrons 2 t U ... Beschleunigungspannung [V] m ... Masse des Teilchens [kg] v ... Geschwindigkeit des Teilchens [m/s] L ... Länge der Flugbahn [m] t ... Flugzeit [s] Durch Umformung erhält man aus dieser Beziehung die Masse des Teilchens: z = 1, 2, 3, ... Ladung der Teilchen 2 t2 z e U m= e ... Elementarladung eines Elektrons 2 L U ... Beschleunigungspannung [V] m ... Masse des Teilchens [kg] v ... Geschwindigkeit des Teilchens [m/s] L ... Länge der Flugbahn [m] t ... Flugzeit [s] 160/210 Die Flugzeit der Ionen hängt von der Masse m und der Ladung z e ab. Stärker geladene Teilchen werden stärker beschleunigt, schwerere Teilchen sind träger und werden daher weniger stark beschleunigt. TOF ... „time of flight“, ungefähre Flugzeit [s] m TOF ∝ m ... Masse des Teilchens [kg] zeU z = 1, 2, 3, ... Ladung der Teilchen e ... Elementarladung eines Elektrons U ... Beschleunigungspannung [V] Abbildung 132: Beispiel eines Time of flight-Spektrums in dem die Stärke des Ionensignals (wieviele Ionen fliegen gleich lang) gegen die Flugzeit aufgetragen wird. 19.3 MALDI MALDI steht für Matrix-unterstützte Laser-Desorption/Ionisation und ist ein Verfahren zur Ionisation von Molekülen. Durch die hohe Empfindlichkeit und die Anwendbarkeit auf große und komplexe Moleküle ist die MALDI-MS insbesondere in der Biologie wie auch in chemischen Analysen von großer Bedeutung. Die zu analysierenden Moleküle werden in die „MALDI-Matrix“ eingebaut während sich Kristalle bilden. Mit kurzen hochenergetischen Laserpulsen erfolgt die Anregung, die nach Relaxation im Kristallgitter zu explosionsartigen Teilchenablösungen an der Oberfläche des Kristalls führt. Gemeinsam mit der Matrix werden dabei die eingeschlossenen Analytmoleküle mit in das Vakuum des Massenspektrometers überführt und so der massenspektrometrischen Analyse zugänglich. 161/210 Abbildung 133: MALDI – Matrix-unterstützte Laser-Desorption/Ionisation 19.4 Quadrupol Massenspektrometer Ein weiteres Prinzip zur Auftrennung von Massen besteht – neben der Trennung im Magnetfeld und der Trennung über die Flugzeit – in der Trennung in hochfrequenten elektrischen Feldern. Die Felder regen die Ionen zu oszillierenden Flugbahnen an, die nur für einen bestimmten Massenbereich stabil sind und nur diesen Ionen erlauben, den Massenfilter zu passieren. Abbildung 134: Die Trennung in hochfrequenten elektrischen Feldern in einem Quadrupol 162/210 20 Chromatographie und Elektrophorese 20.1 Elektrophorese Elektrophorese bezeichnet die Wanderung elektrisch geladener Teilchen durch einen als Trägermaterial dienenden Stoff in einem elektrischen Feld. 20.1.1 Aufbau Durch unterschiedliche Ionenladung und Teilchenradius bewegen sich die einzelnen Moleküle unterschiedlich schnell durch das Trägermaterial und erreichen eine Auftrennung entsprechend ihrer elektrophoretischen Mobilität. Damit eignet sich die Elektrophorese sehr gut zur Trennung von Stoffgemischen. Als Trägermaterial können Flüssigkeiten, Gele (Gelelektrophorese) oder Feststoffe dienen. Abbildung 135: Aufbau einer Kapillarelektrophorese Die Wanderungsgeschwindigkeit v ist dabei proportional der Feldstärke E und der Ionenladung Q, umgekehrt zum Teilchenradius r und der dynamischen Viskosität η Es stellt sich ein Kräftegleichgewicht zwischen der elektrostatischen Kraft FE und der Reibungskraft FR, daher ist ihr Quotient proportional zur Wanderungsgeschwindigkeit v. v ... Wanderungsgeschwindigkeit [m/s] v = μE E μE ... Elektrophoretische Beweglichkeit E ... Elektrische Feldstärke [T] Die elektrophoretische Beweglichkeit μE ergibt sich aus der Wanderungsgeschwindigkeit v bezogen auf die elektrische Feldstärke E: v Q μE ... Elektrophoretische Beweglichkeit μE = = v ... Wanderungsgeschwindigkeit [m/s] E 6π η r E ... Elektrische Feldstärke [T] Q ... Ladung [C] η ... Dynamische Viskosität [kg/(ms)] r ... Teilchenradius [m] 163/210 20.1.2 Auswertung Radioaktive Markierung Die zu trennenden Moleküle werden vor der Elektrophorese radioaktiv markiert und anschließend in einer Autoradiographie (Sichtbarmachung einer chemischen Komponente durch radioaktive Isotope) nachgewiesen. Färbung Nach der Elektrophorese können die Moleküle (z.B. DNA-Fragmente) mit verschiedenen Farbstoffen gefärbt und unter UV-Licht betrachtet werden. Proteine können angefärbt werden und/oder immunlogisch nachgewiesen werden. Durch Abtasten der transparent gemachten Folie in einem Photometer oder einem Scanner entsteht aus den Unterschieden der Farbintensität die Elektrophoresekurve. Abbildung 136: Auswertung einer Elektrophoresefolie 20.2 Chromatographie Unter Chromatographie („Farbschreiben“) versteht man ein Verfahren, das die Auftrennung eines Stoffgemisches durch unterschiedliche Verteilung seiner Einzelbestandteile zwischen einer stationären (fest oder flüssig) und einer mobilen Phase (flüssig oder gasförmig) erlaubt. Die mobile Phase bewegt sich an der stationären Phase vorbei und nimmt die Stoffe dabei unterschiedlich schnell mit. Es gibt diverse Varianten dieses Verfahrens und kann daher verschiedenste Einteilungen treffen: Einteilung nach dem Chromatographie-Aufbau − Flachbettchromatographie − Säulen-Chromatographie Einteilung nach dem Trennungsziel − Analytische Chromatographie − Präparative Chromatographie Einteilung nach den verwendeten Phasen − Flüssigkeitschromatographie − Gaschromatographie Einteilung nach den Trennmechanismen − Gelfiltrations-Chromatographie (Trennung durch „Molekül-Sieb“) − Trennung durch Adsorption − Trennung durch Verteilung − Ionen-Austausch-Chromatographie − Affinitäts-Chromatographie 164/210 20.3 Einteilung nach dem Chromatographie-Aufbau 20.3.1 Flachbettchromatographie Bei der planaren Chromatographie läuft die Trennung auf Papier oder einer beschichteten Glas- bzw. Kunststoffplatte ab. Beispiel: Papierchromatographie, Dünnschichtchromatographie 20.3.2 Säulen-Chromatographie Im medizinischen Labor sind heute Techniken gebräuchlicher, bei denen sich die stationäre Phase in einer Säule befindet, durch welche die mobile Phase hindurchfließt. Beispiel: Hochdruck-Flüssigkeitschromatographie (HPLC), Gaschromatographie (GC) 20.4 Einteilung nach dem Trennungsziel Die unterschiedlichen Ziele der analytischen und der präparativen Chromatographie am Beispiel der Säulen-Chromatographie: Abbildung 137: Links: Analytische Chromatographie Rechts: Präparative Chromatographie 20.4.1 Analytische Chromatographie Der Detektor registriert den aus der Säule tretenden Stoff. Für analytische Anwendungen verwendet man eher geringere Probenmengen, die nur groß genug sein müssen um im Detektor ein klares Signal auszulösen. Aufgrund der geringen Mengen sind relativ kleine Säulen ausreichend. 20.4.2 Präparative Chromatographie Bei dieser Form der Chromatographie geht es um die Gewinnung von (großen) Mengen eines gewissen Stoffes. Um eine möglichst große Ausbeute zu haben, werden meist sehr große Stoffmengen eingesetzt was auch dementsprechend große Säulen erfordert. 165/210 20.5 Einteilung nach den verwendeten Phasen 20.5.1 Flüssigkeitschromatographie Planare Chromatographie − Papier-Chromatographie Als feste Phase wird Papier verwendet, das entweder liegt oder (meist) senkrecht in einem Glasbehälter steht. Wie auch bei der Dünnschichtchromatographie wird die mobile Phase aufgrund der Kapillarkräfte bewegt. − Dünnschichtchromatographie (DC) Als feste Phase wird z.B. Kieselgel in einer feinen Schicht auf einer flexiblen Trägerfolie aus Aluminium oder Plastik oder einer Glasplatte aufgetragen. Eine Variante ist die zirkuläre DC mit einer rotierenden beschichteten Kreisscheibe. Säulenchromatographie − Niederdruckchromatographie Die hier verwendeten Säulen weisen einen Durchmesser von einem bis mehreren Zentimetern auf. Diese Form der Flüssigkeitschromatographie wird vor allem für präparative Trennungen eingesetzt. − Hochleistungschromatographie (HPLC) Die heute in der Analytik am weitesten verbreitete Trennmethode. Hier werden bis zu 400 bar bei einer Flussrate der mobilen Phase bis zu 5 ml/min erzeugt, die jedoch mit der Trennleistung nichts zu tun haben, sondern nur der Fortbewegung des Eluentengemisches in der Säule dienen. − Elektrochromatographie In diesem Fall wird die mobile Phase durch Anlegen einer Spannung bewegt. Diese Methode befindet sich noch im Entwicklungsstadium und wird im Routinebetrieb nicht angewendet. Sie ist nicht zu verwechseln mit der Elektrophorese. Membranchromatographie Hierbei wird statt einer mit chromatographischer Matrix gefüllten Säule eine einoder mehrphasige Membran als feste Phase in einem entsprechenden Gehäuse eingesetzt. Die mobile Phase wird bei niedrigen Drucken bis zu 6 bar und bei etwas 20-fach höheren Flussraten als in der Säulenchromatographie üblich durch die Membran gepumpt. 20.5.2 Gaschromatographie Das Besondere an der Gaschromatographie ist, dass die mobile Phase ein Gas und keine Flüssigkeit ist. Daher müssen die zu analysierenden Stoffe verdampfbar sein oder in verdampfbare Verbindungen überführbar sein. Die stationäre Phase (Flüssigkeiten oder Festsubstanzen) der GC befindet sich in einer relativ langen, spiralig angeordneten Säule. Diese ist entweder mit der stationären Phase bepackt oder ihre Innenwand wird von der stationären Phase ausgekleidet. 166/210 Gepackte Säulen Das Innere einer Säule ist mit einem feinkörnigen Material gefüllt. Die stationäre Phase besteht meist aus einem dünnen Film einer weitgehend inerten und hochsiedenden Flüssigkeit, der die Pulverkörner überzieht. Kapillarsäulen Nur die Säulenwand ist mit einer dünnen Schicht aus stationärer Phase (flüssig oder fest) bedeckt. 20.6 Einteilung nach den Trennmechanismen Es gibt unzählige Variationen und Anwendungen der Chromatographie, im Grunde sind es aber nur wenige Mechanismen, die dabei ausgenutzt werden: − Gelfiltrations-Chromatographie (Trennung durch Molekül-Sieb) − Trennung durch Adsorption − Trennung durch Verteilung − Ionen-Austausch-Chromatographie − Affinitäts-Chromatographie 20.6.1 Allgemeines Trennprinzip der Säulenchromatographie (1) Am Anfang ist das Stoffgemisch am oberen Rand der stationären Phase. (2) Dann lässt man die Flüssigkeit durch die Säule fließen. (3) Die Stoffe werden von der Flüssigkeit verschieden schnell mitgenommen. (4) Die Stoffe gelangen zum Ausgang der Säule und können dort gemessen oder aufgefangen und somit aufgetrennt werden. Abbildung 138: Trennprinzip der Säulenchromatographie 167/210 20.6.2 Gelfiltrations-Chromatographie (Trennung durch „Molekül-Sieb“) Das Wesentliche der Trennung bei der Gelfiltrations-Chromatographie ist eine stationäre Phase aus einem Material mit löchriger, porentragender Oberfläche. Diese Löcher sind wie Fallen. Die Trennung der Stoffe beruht vor allem auf ihrer unterschiedlichen Molekülgröße. Fließen die zu trennenden Stoffe in der mobilen Phase daran vorbei, werden die großen Teilchen unbehindert durchfließen. Die kleinen aber werden sich in den Löchern immer wieder vorübergehend verfangen. Je kleiner die Molekülgröße umso langsamer wird er durch die stationäre Phase wandern. Abbildung 139: Gelfiltrationschromatographie (Trennung durch „Molekül-Sieb“) Beispiel: Auftrennung von Proteingemischen nach der Molekülgröße 20.6.3 Trennung durch Adsorption Die Adsorption, also Anlagerung eines Stoffes an einen anderen, wird durch Anziehungskräfte, die zwischen Stoffen bestehen können, verursacht. Diese Anziehungskräfte führen zu Anlagerungen ohne feste chemische Bindung. Die Trennung der Stoffe beruht auf der unterschiedlichen Adsorption der Stoffe an der stationären Phase (z.B. Kieselgel). Ein weiterer Faktor ist die Affinität der Stoffe zur mobilen Phase, d.h. wie stark die Stoffe in der Flüssigkeit gebunden sind. Abbildung 140: Trennung durch Adsorption Beispiel: Adsorption beeinflusst fast alle chromatographischen Trennverfahren, v.a. aber Dünnschichtchromatographie, Gaschromatographie. 168/210 20.6.4 Trennung durch Verteilung Die verteilungschromatographischen Effekte beruhen auf der unterschiedlichen Verteilung von Stoffen in zwei Flüssigkeiten (oder einem Gas und einer Flüssigkeit). Die eine Flüssigkeit ist die stationäre Phase (z.B. der Wassermantel der Zellulosefasern bei der Papier-Chromatographie). Die andere Flüssigkeit ist die mobile Phase (z.B. Butanol). Je nachdem zu welcher Flüssigkeit der Stoff mehr Affinität hat, in welcher er besser löslich ist, desto schneller oder langsamer wird er wandern. Die blauen Kugeln lösen sich besser in der stationären Phase, sie werden dadurch zurückgehalten und wandern langsamer. Die roten lösen sich kaum in Abbildung 141: Trennung durch der stationären Phase sie wandern rasch mit der Verteilung mobilen Phase mit. Beispiel: Verteilung spielt in fast allen Verfahren eine Rolle, v.a. aber Papierchromatographie, Gaschromatographie 20.6.5 Ionen-Austausch-Chromatographie Abbildung 142: Vereinfachtes Schema einer Ionen-AustauschChromatographie Bei der Ionen-Austausch-Chromatographie sind an der stationären Phase Gruppen gebunden, die eine positive oder negative Ladung tragen und daher entgegengesetzt geladene Teilchen binden und damit zurückhalten können. Ungeladene oder gleich geladene gehen schneller durch. − Kationen-AustauschChromatographie: Hat die stationäre Phase negative Ladungen werden positiv geladene Teilchen (Kationen) gebunden. − Anionen-AustauschChromatographie: Trägt die stationäre Phase positive Ladungen werden negativ geladene Teilchen (Anionen) gebunden. 169/210 Oft trennt man aber nicht ungeladene von geladenen Stoffen sondern ein Gemisch geladener Stoffe, die sich mehr oder weniger stark an die stationäre Phase binden. Daher befinden sich in der mobilen Phase ebenfalls Ionen die die Ionen der Probe von den Bindungsstellen an der stationären Phase verdrängen. Sie tauschen diese also aus. Je stärker ein Stoff an die Ladungen der stationären Phase gebunden ist, umso weniger wird er sich austauschen lassen, umso länger wird er zurückgehalten. Die in der mobilen Phase befindlichen Kationen Abbildung 143: Kationen(kleine weiße Kugeln) konkurrieren mit den roten Austausch-Chromatographie und orangenen Kationen der Probe um die negativgeladenen Bindungsstellen der stationären Phase. Die orangenen Kugeln binden dabei relativ schwach an die stationäre Phase, sie werden von den grauen Kationen leicht verdrängt und kommen daher schneller weiter. Die roten Kugeln binden sich stärker an die stationäre Phase und kommen daher nicht so schnell weiter. Beispiel: Hochdruck-Flüssigkeits-Chromatographie (HPLC) 20.6.6 Affinitäts-Chromatographie Abbildung 144: AffinitätsChromatographie Der Affinitäts-Chromatographie liegt eine ganz spezielle Wechselwirkung zwischen Strukturen der stationären Phase und den Stoffen in der mobilen Phase zu Grunde. Ein Beispiel wäre die Wechselwirkung zwischen Antigenen und Antikörpern, ein anderes die von Hormonen mit ihren Rezeptoren, oder die von Enzymen mit ihrem Substrat. An der stationären Phase sind Strukturen (schwarz eingezeichnet), die wie ein Schlüssel zum Schloss zu Strukturen auf einem Stoff in der Probe passen. Dieser Stoff (blaue Kugeln, oben) wird daher langsamer durch die stationäre Phase wandern, als Stoffe, die diesen Rezeptor nicht haben (blaue Kugeln, unten). Die Affinitäts-Chromatographie wird im Routinelabor selten eingesetzt. Für die Analyse von Stoffen wird es oft zu aufwändig sein, will man aber Stoffe isolieren, reinigen und weiter verwenden (präparative Chromatographie), könnte man die Technik einsetzen. Beispiel: Eine spezielle Anwendung, die man zur Affinitätschromatographie zählen könnte, ist der Nachweis von Antikörpern mit Hilfe von Teststreifen. 170/210 20.7 Auswertung der Chromatographie Abbildung 145: Auswertung einer Chromatographie − Die Brutto-Retentionszeit tR ist die Zeit, die von der Probenaufnahme bis zum Erreichen des Peakmaximums einer Komponente vergeht. − Die Totzeit t0 umfasst die Zeitdauer, die eine Substanz mindestens in einer chromatographischen Anlage verweilt, auch ohne Wechselwirkungen mit der stationären Phase. − Die Netto-Retentionszeit tR’ ist die Differenz aus Brutto-Retentionszeit tR und der Totzeit t0. − Die Peakbreiten (Peak-Halbwertsbreite W1/2 und Basis-Peakbreite W) dienen der Berechnung von Chromatographiekenngrößen wie Auflösung und Bodenzahl. − Die Höhe und Fläche der Peaks dienen der Quantifizierung der Komponenten. 171/210 21 Durchflusszytometrie Bei dieser Technik werden verschiedene Eigenschaften von Zellen oder anderen Teilchen untersucht, während diese Zellen hintereinander durch eine dünne Messkammer fließen. Für die meisten Anwendungen der Durchflusszytometrie ist diese Flusszelle aus Glas und die zu untersuchenden Zellen werden beim Durchfließen von der Seite von einem Laserlicht angestrahlt. 21.1 Streulichtmessung Eine Eigenschaft einer Zelle, die in der Durchflusszytometrie gemessen wird, ist das Streulicht. Solange der Laserstrahl ungehindert durch die Flusszelle geht, entsteht kein Streulicht. Quert hingegen eine Zelle den Strahl, wir das Licht in verschiedenste Richtungen gestreut. Je größer eine Zelle ist und je mehr Strukturen in ihrem Inneren sind, desto größer ist das entstehende Streulicht. Gemessen wird das Streulicht meist an zwei Stellen: − (Fast) in Richtung des ursprünglichen Strahls (Vorwärtsstreulicht) − Etwa im 90° Winkel zum ursprünglichen Strahl (Seitwärtsstreulicht) Abbildung 146: Aufbau eines Durchflusszytometers mit Streulichtmessung Vorwärtsstreuung (Forward Light Scatter oder Low Angle Scatter) Das Vorwärtsstreulicht hängt vor allem von der Größe einer Zelle ab. Das heißt, kleine Zellen verursachen ein kleines Vorwärtsstreulichtsignal, große Zellen ein großes. 172/210 Seitwärtsstreuung (Side Scatter, Orthogonal Scatter oder Right Angle Scatter) Das Seitwärtsstreulicht hängt neben der Größe auch sehr stark vom Inhalt einer Zelle ab und ist damit proportional zur Homogenität der Zelle. Finden sich in der Zelle sehr viele Lysosomen (das sind kleine, Enzym-speichernde Bläschen), dann hat sie ein großes Seitwärtsstreulicht, finden sich nur wenige, dann ist ihr Seitwärtsstreulicht gering. Darstellung als Streulicht-Dot-Plot Die Zellen werden nach ihrem Vorwärtsstreulicht und ihrem Seitwärtsstreulicht in einem Diagramm dargestellt. Man erkennt Anhäufungen von Zellen, die offenbar ähnliche Streulichteigenschaften haben: − Neutrophile Granulozyten: groß, viel Granula − Monozyten: groß, kaum Granula − Lymphozyten: klein, kaum Granula Abbildung 147: Streulicht-Dot-Plot 21.2 Fluoreszenzmessung Ein Durchflusszytometer kann auch Fluoreszenzlicht messen und erlaubt dadurch, eine Vielzahl von Merkmalen auf den Blutzellen zu untersuchen. Will man ein bestimmtes Merkmal einer Zelle untersuchen, muss man dieses Merkmal zuerst einmal markieren. Und das geschieht mit einem Antikörper, der gegen dieses Merkmal gerichtet ist. Außerdem trägt dieser Antikörper eine fluoreszierende Gruppe. Das ist ein Molekül, das aufleuchtet, wenn es mit einem Laser oder einer anderen Lichtquelle bestrahlt wird. Bringt man Antikörper und Zellen zusammen, setzt sich der Antikörper auf diejenigen Zellen, die das Merkmal auf der Oberfläche tragen. Die Zelle ist dadurch markiert und wird bei Durchqueren des Laserstrahls des Durchflusszytometers aufleuchten. Durchflusszytometer für den Routineeinsatz können neben den Streulichteigenschaften heute meist 4 bis 6 verschiedene Fluoreszenzfarbstoffe unterscheiden. Man kann also neben dem Streulicht 4 bis 6 weitere Merkmale der Zelle gleichzeitig in einem Röhrchen färben und bestimmen. 21.3 Gaten Ziel des Gatens ist es die Zellen auszuwählen, die einen wirklich interessieren. Will man z.B. wissen wieviele der Lymphozyten T-Lymphozyten und wie viele BLymphozyten sind werden sie durch das Gaten aus der weiteren Analyse ausgenommen. Die Ergebnisse der Fluoreszenzmessung werden dann nur für die ausgewählten Zellen angezeigt. 173/210 Abbildung 148: Durch das Gaten werden nur die Zellen ausgewählt, die weiter analysiert werden sollen. Anhand der Streulichtmessung erfolgte also eine Differenzierung nach der Zellgröße, bei den ausgewählten Zellen erfolgte noch eine weitere Differenzierung nach dem Zelltyp mit Hilfe der Fluoreszenzmarkierung. 21.4 Cell sorter Cell sorter sortieren Mischungen von Zellen in Fraktionen einzelner Zelltypen, die in weiterer Folge separat untersucht werden können. (1) Identifizierung des Zelltyps mit Hilfe von Streulicht und Fluoreszenz. (2) Mit Hilfe von Ultraschall werden Tröpfchen gebildet, die genau ein Teilchen einschließen (3) Die Tröpfchen werden elektrisch geladen. (4) Durch ein elektrisches können die geladenen Teilchen durch die Änderung ihrer Bahn sortiert werden. Abbildung 149: Cell sorter 174/210 22 Röntgenstrukturanalyse Die Röntgenstrukturanalyse wird zur geometrischen Vermessung von Molekülen eingesetzt. Röntgenbeugung ist die Beugung von Röntgenstrahlung an geordneten Strukturen wie Kristallen. Von jedem Atom in einem dreidimensionalen Gitter gehen Huyghensche Elementarwellen aus, die sich nur in bestimmten Richtungen nicht auslöschen. Abbildung 150: Beugung an Atomen und Entstehung von Elementarwellen 22.1 Aufbau Röntgenstrahlung wird mit Hilfe von Kollimatoren gebündelt sodass sie möglichst gerade auf den Kristall auftrifft. Man verwendet die charakteristische Röntgenstrahlung (diskretes Spektrum) um ein möglichst scharfes Bild mit wenig Schleierbildung zu erhalten. Auf der Photoplatte entsteht durch konstruktive Interferenz ein Schwärzungsmuster. Aus den Abständen zwischen den Punkten kann man auf den Abstand der Atome schließen. Dabei ist zu beachten, dass es sich bei der Analyse eines Kristalls um eine dreidimensionale Struktur handelt. Durch Überlagerung von Wellen kommt es zu äußerst komplizierten Interferenzerscheinungen, die nur mit Hilfe von Computern auf die räumlichen Strukturen schließen lassen. Abbildung 151: Aufbau für eine Röntgenstrukturanalyse 175/210 22.2 Streuung Die Röntgenstrahlung fällt auf kleine Strukturen im Vergleich zu ihrer Wellenlänge. Es kommt zur Streuung in alle Richtungen (Rayleigh-Streuung). Der Streuwinkel θ ergibt sich einerseits aus dem Streuvektor (abhängig von der Struktur) s und der Wellenlänge λ. Mit Hilfe eines Detektors kann die Intensität der Streustrahlung bestimmt werden. Abbildung 152: Streuungserscheinungen bei der Röntgenstrukturanalyse 22.3 Beugung Die Beugung, die durch die auf die Strukturen einfallende Röntgenstrahlung entsteht ist ähnlich zu verstehen wie die Beugung am Doppelspalt (siehe Kapitel 5.9.1). Atome sind punktförmige Quellen von Elementarwellen und ihr Abstand zueinander entspricht der Spaltbreite. Ist die Phasendifferenz zwischen den entstehenden Elementarwellen ein ganzzahliges Vielfaches der Wellenlänge kommt es durch Überlagerung der Wellenberge zur Entstehung von konstruktiver Interferenz, d.h. zu Maxima. Diese Maxima hängen vom Atomabstand und der Wellenlänge der Röntgenstrahlung ab. Abbildung 153: Beugungserscheinungen bei der Röntgenstrukturanalyse 176/210 23 Populationsdynamik 23.1 Modellbegriff Die mathematische Beschreibung eines Systemverhaltens führt zur Modellbildung. Ein Modell ist per Definition eine Vereinfachung der Realität und kann nur jene Fragestellungen beantworten für die es entwickelt wurde. Die Realität wird in zwei Schritten abstrahiert um nur jene Parameter zu berücksichtigen, die maßgeblich zur Lösung erforderlich sind. 23.1.1 Strukturelle Abstraktion (Qualitatives Wissen) „Was soll beantwortet werden?“ Es werden abgrenzbare Teile des Modells identifiziert (Reduktion) und wie sie miteinander verknüpft sind. Trennbarkeit (Separability) Das System wird einerseits nach außen abgegrenzt (z.B. Wachstum einer Spezies auf einer Insel), aber auch die inneren Strukturelemente (z.B. Magen-Darm-Trakt, Blutbahn, Leber, Niere) werden erfasst. 23.1.2 Phänomenologische Abstraktion (Quantitatives Wissen) „Wie läuft etwas ab?“ Hier werden die physikalischen, chemischen oder biologischen Vorgänge identifiziert, die in den Systemteilen und den Verknüpfungen ablaufen. Beobachtbarkeit (Observability) Die zu beobachtenden Parameter (Zustandsgrößen) werden festgelegt und wie diese (direkt oder indirekt) gemessen werden können. Kausalität (Causality) Durch Beschreibung des Modells in Form von Modellgleichungen werden die Zusammenhängen zwischen den Teilsystemen beschrieben. 23.1.3 Modellanwendung Modelle werden entwickelt um: − Probleme zu analysieren − Vorhandenes Wissen zu strukturieren − Zusammenhänge in vorhandenen Daten (z.B. Messdaten) zu erkennen − Vorhersagen zu erstellen − Entscheidungsfindungen zu unterstützen The DON’Ts of mathematical modelling − Don’t believe that the model is the reality: Man muss sich bewusst sein, dass ein Modell eine Vereinfachung der Realität ist. − Don’t extrapolate beyond the region of fit: Ein Modell ist nur auf bestimmte Fragestellungen anwendbar. − Don’t distort reality to fit the model: Man darf nicht z.B. die 177/210 Messergebnisse verändern um sie durch das Modell erklärbar zu machen. − Don’t retain a discredited model: Ein Modell, das sich bereits als ungeeignet erwiesen hat sollte nicht weiter verwendet werden. − Don’t fall in love with your model: Ein Modell darf nicht blind auf alle möglichen Zwecke angewendet werden nur weil es z.B. eine andere Fragestellung besonders elegant beantwortet. 23.1.4 Struktur des Modellansatzes Es können Modelle mit und ohne Rückkopplung (Ausgangswert wirkt wieder als Eingangswert) betrachtet werden, die Antworten auf verschiedene Fragestellungen liefern können. Abbildung 154: Modell ohne Rückkopplung Abbildung 155: Modell mit Rückkopplung Frage nach den Ausgangswerten Die Eingangswerte (z.B. eine Therapie) sind bekannt. Gefragt sind die Ausgangswerte (z.B. Wie wirkt diese Therapie?). Frage nach den Eingangswerten Die Ausgangswerte (z.B. eine Diagnose) sind bekannt. Gefragt sind die Eingangswerte (z.B. Welche Erkrankung ruft dieses Krankheitsbild hervor?). Frage nach dem Systemverhalten (Black Box) Man kennt Eingangswerte (z.B. Krankheit) und Ausgangswerte (z.B. Krankheitsbild). Man fragt nach der Theorie des Krankheitsbildes. 23.1.5 Kompartment-Modelle Kompartment-Modelle sind Rechenmodelle, bei denen die Verteilung eines Arzneistoffes in einem oder mehreren Kompartments dargestellt wird. Pharmakokinetisches Kompartment Ein pharmakokinetisches Kompartment ist ein fiktiver Raum in einem Körper, in dem ein Arzneistoff (Stoffmenge x) homogen verteilt vorliegt und eine einheitliche Kinetik aufweist. Mit Ausnahme des Blutgefäßsystems handelt es sich um einen fiktiven Raum, der sich je nach der betrachteten Substanz aus verschiedenen Körperflüssigkeiten bzw. Geweben zusammensetzen kann. 178/210 Kompartmentanalyse − Aus wievielen Kompartments besteht das System? − Wie sind diese Kompartments angeordnet? − Wie schnell erfolgt der Stoffaustausch zwischen den Kompartments? 23.1.6 Zustandsgröße Eine Zustandsgröße ist eine makroskopische physikalische Größe oder in Parameter einer Zustandsgleichung, die nur vom momentanen Zustand des betrachteten Systems abhängt und daher vom Weg, auf dem dieser Zustand erreicht wurde, unabhängig ist. Sie beschreibt also eine Eigenschaft des Systems in diesem Zustand. Beispiele: Energie, Entropie, Volumen, Masse, Temperatur, Druck, Dichte, Polarisation, Magnetisierung des betrachteten Systems. Abbildung 156: Die Zustandsgröße ist die Populationsgröße N. Die Wachstumsrate g und der die Sterberate s beschreiben die Zustandsänderung. 23.2 Wachstumsmodelle Die Populationsdynamik biologischer Populationen ist den größenmäßige aber auch räumliche Veränderung im Laufe der Zeit. Das Wachstum einer Population kann ohne Rückkopplung, mit Rückkopplung oder auch mit Rückkopplung bei begrenzten Ressourcen beschrieben werden. Abbildung 157: Wachstumsverlauf einer Population (I) (II) (III) (IV) (V) (VI) Keine Beschränkungen, keine Abhängigkeit von der Dichte. Exponentielles Wachstum Lineares Wachstum Verzögertes Wachstum Stationäres Wachstum Negatives Wachstum (Absterbephase) 179/210 Wachstum ohne Rückkopplung Beim Wachstum ohne Rückkopplung verändert sich die Zahl der Individuen N mit der Geburtenrate g und der Sterberate s, ist aber unabhängig von der Zahl der Individuen selbst. dN/dt ... Änderung der Populationsgröße N mit der Zeit t dN = g −s = r N0 ... Startpopulationsgröße dt g ... Geburtenrate bzw. s ... Sterberate N(t) = N + r t 0 Wachstum mit Rückkopplung Beim Wachstum mit Rückkopplung verändert sich die Zahl der Individuen N mit der Geburtenrate g und der Sterberate s, ist aber auch abhängig von der Zahl der Individuen N. dN/dt ... Änderung der Populationsgröße N mit der Zeit t dN = gN − sN = rN N0 ... Startpopulationsgröße dt g ... Geburtenrate bzw. s ... Sterberate N(t) = N 0 exp(r t) Wachstum mit Begrenzung (Logistisches Modell) Auch beim Wachstum mit Begrenzung verändert sich die Zahl der Individuen N mit der Geburtenrate g und der Sterberate s, hat aber auch eine Obergrenze für die Populationsgröße, die Kapazität K. dN/dt ... Änderung der Populationsgröße N mit der dN r = rN − N 2 Zeit t dt K r ... Wachstumsrate bzw. K ... Umweltkapazität ⎛ N ⎞ N(t + 1) = N t + r N t ⎜1 − t ⎟ K⎠ ⎝ 180/210 24 Pharmakokinetik 24.1 Aufgabe Die Pharmakokinetik beschreibt den zeitlichen Verlauf von Arzneistoffkonzentrationen im Organismus. In weiterer Folge werden darauf basierend Dosisvorschläge entwickelt. Die Konzentration eines Arzneimittels soll sich dabei innerhalb eines „therapeutischen Fensters“ befinden. Dieses Fenster wird oben von der minimalen toxischen Konzentration begrenzt bei der das Arzneimittel bereits schädliche Auswirkungen haben kann. Unten wir das Fenster von der minimalen therapeutischen Konzentration begrenzt. Darunter ist die Konzentration des Arzneimittels zu gering um die gewünschte Wirkung entfalten zu können. Abbildung 158: Konzentrations-Zeit-Verlauf eines verabreichten Arzneimittels Der Verlauf der Arzneistoffkonzentration im Körper wird durch das Zusammenspiel mehrerer Faktoren bestimmt, „ADME“: − Dosis: Verabreichte Dosis − Resorption (absorption): Aufnahme des Stoffes in den Körper − Verteilung (distribution): Verteilung des Stoffes im Körper − Metabolisierung: Änderung der Stoffkonzentration durch Stoffwechselprozesse − Elimination: Abnahme der Stoffkonzentration durch Ausscheidung 181/210 Abbildung 159: Einflussfaktoren auf die Arzneistoffkonzentration (ADME) 24.2 Grundbegriffe Kompartment Ein Kompartment ist ein Reaktionsraum innerhalb des Körpers. Je nach Modellvorstellung kann man den Körper als ein einziges großes Kompartment betrachten oder weitere Unterteilungen treffen und z.B. den Verdauungstrakt und das Blutgefäßsystem als eigene Kompartments ansehen. Abbildung 160: Schema eines Ein-Kompartment-Systems. Die Aufnahme des Stoffes wird durch die Absorptionskonstante ka beschrieben, die Elimination durch die Eliminationskonstante ke. Das Ein-Kompartment-Modell ist das einfachste pharmakokinetische Modell. Dabei wird der gesamte Körper als ein Flüssigkeitsraum angesehen. Flüssigkeits- oder Geweberegionen können dann zu einem „zentralen“ Kompartment zusammengefasst werden, wenn der Stoffaustausch innerhalb dieser Regionen im Vergleich zu anderen Transportprozessen (z.B. Ausscheidung) ausreichend schnell erfolgt. Nach der Arzneimittelgabe befinden sich alle Körperflüssigkeiten im Fließgleichgewicht. 182/210 Abbildung 161: Man kann von einem Ein-Kompartment-Modell sprechen, wenn sich das Arzneimittel unmittelbar nach der Verabreichung im gesamten Körper verteilt. Invasion Die Invasion ist die Zufuhr eines Arzneimittels aus einem Depot (z.B. Infusionsbeutel, Tablette, Spritze). Evasion Die Evasion beschreibt den Prozess der Elimination, d.h. der Entfernung des Arzneistoffes aus dem Körper, über den Metabolismus (Stoffwechsel) und die Ausscheidung. 24.3 Evasions-Ordnungen 24.3.1 Evasion 1. Ordnung Die meisten Arzneimittel weisen bei therapeutischen Stoffkonzentrationen eine Elimination der 1. Ordnung auf, d.h. die Konzentrationsänderung mit der Zeit ist proportional der Konzentration c mit der Eliminationskonstanten ke: dc/dt ... Änderung der Stoffkonzentration c mit der Zeit t dc = −k e c c ... Stoffkonzentration im Plasma dt ke ... Eliminationskonstante Abbildung 162: Kompartment-Modell für eine Evasion 1. Ordnung bei der der einzige Transportprozess die Ausscheidung ist. Dies bedeutet, dass die biologischen Prozesse der Elimination keine Sättigung aufweisen. Die metabolisierenden Enzyme (z.B. in der Leber) und die Transportsysteme (z.B. in Leber, Niere) arbeiten somit im Normalfall weit unter ihrer 183/210 maximalen Kapazität. Diese „Arbeitsreserve“ gestattet eine schnelle Anpassung an sich ändernde Anforderungen. Durch Integration erhält man den Konzentrationsverlauf mit der Zeit: c ... Stoffkonzentration im Plasma c = c0 exp(− k e t) co ... Stoffkonzentration im Plasma nach Verabreichung bzw. k e ... Eliminationskonstante ln c = ln c0 − k e t t ... Zeit Abbildung 163: Links: Die Stoffkonzentration c steigt linear mit der verabreichten Dosis. Rechts: Die Stoffkonzentration nimmt exponentiell mit der Zeit ab. Daraus ergibt sich als Zeitverlauf der Plasmakonzentration c ein exponentieller Abfall der Anfangskonzentration c0. In halblogarithmischer Darstellung stellt sich die Funktion als eine Gerade mit der Steigung –ke und Schnittpunkt mit der y-Achse bei ln co dar. Je größer die Eliminationskonstante ke, desto schneller erfolgt die Abnahme der Stoffkonzentration. Abbildung 164: Die Abnahme der Stoffkonzentration im Plasma mit der Zeit hat einen exponentiellen Verlauf (links). In halblogarithmischer Darstellung ergibt sich somit eine Gerade (rechts). 24.3.2 Evasion 0. Ordnung Manche Arzneimittel überschwemmen bei therapeutischen Konzentrationen aber die metabolisierenden Enzyme, sodass diese gesättigt sind und die maximale Arbeitsauslastung der Enzyme erreicht ist. Ist der Stoffwechsel gesättigt ist die Beziehung zwischen Dosis D und Konzentration c nicht mehr linear. Ab diesem Punkt bewirkt eine kleine Dosisänderung einen starken Anstieg der Konzentration. 184/210 Abbildung 165: Links: Ab einer bestimmten Dosis ist der Stoffwechsel gesättigt. Mitte: Somit ist der Zusammenhang zwischen Dosis und Konzentration nicht mehr linear. Rechts: Die Abnahme der Stoffkonzentration mit der Zeit ist nun nur mehr abhängig von der Eliminationskonstanten und verläuft somit linear. Daraus ergibt sich als Zeitverlauf der Plasmakonzentration c eine lineare Abnahme der Anfangskonzentration c0, da die Evasion jetzt nur mehr von der Eliminationskonstanten ke abhängt und nicht mehr von der Konzentration. dc/dt ... Änderung der Stoffkonzentration c mit der Zeit t dc = −k e ke ... Eliminationskonstante dt Die Abnahme der Alkoholkonzentration im Blut ist ein Beispiel für eine Evasion nullter Ordnung und erfolgt linear mit einer Eliminationskonstanten von ca. 0,15 Promille/Stunde. 24.4 Parameter der Pharmakokinetik Primäre pharmakokinetische Parameter − Scheinbares Verteilungsvolumen VD − Clearance CL 24.4.1 Biologische Halbwertszeit Die biologische Halbwertszeit gibt an, welche Zeit verstreichen muss, bis eine bestimmte Konzentration (und damit auch die Menge im Körper) eines Arzneimittels auf die Hälfte abgefallen ist. Sie hängt von der Eliminationskonstanten ke ab. T1/2 ... Biologische Halbwertszeit ln 2 T1/2 = ke ... Eliminationskonstante ke 185/210 24.4.2 Scheinbares Verteilungsvolumen Das scheinbare Verteilungsvolumen VD ist ein fiktives Volumen, in dem der Arzneistoff homogen verteilt sein müsste, um die im Plasma gemessene Konzentration c zu erhalten. VD ... Scheinbares Verteilungsvolumen D VD = D ... Dosis c0 c0 ... Anfangsplasmakonzentration Die Anfangsplasmakonzentration c0 eines Arzneimittels erhält man wenn man die Eliminationskurve auf den Zeitpunkt t = 0 extrapoliert. Sie ist diejenige Konzentration, die vorhanden wäre, wenn nur die Verteilung der Dosis aber noch keine Elimination stattgefunden hätte. Das scheinbare Verteilungsvolumen erlaubt Rückschlüsse auf die Verteilung eines Arzneimittels im Körper, da VD umso größer ist je mehr Arzneistoff sich außerhalb des Plasmas befindet. Ursachen für ein großes Verteilungsvolumen sind u.a. die Verteilung in periphere Kompartments (z.B. Muskel, Fettgewebe, Knochen) und die Plasmaproteinbildung. 24.4.3 Clearance Die Clearance CL ist das fiktive Volumen des Blutplasmas, das pro Zeiteinheit von einer bestimmten Substanz befreit wird. CL ... Clearance CL = k e VD ke ... Eliminationskonstante VD ... Scheinbares Verteilungsvolumen Die Clearance ist somit ein Maß für die Ausscheidungsgeschwindigkeit eines Arzneistoffes und charakterisiert die Leistungsfähigkeit der Eliminationsorgane. Gesamtkörper-Clearance Die Gesamtkörper-Clearance ist die Summe der Organ-Clearances der diversen Ausscheidungsorgane. Sie kann aber auch aus der Dosis D und der Gesamtfläche unter der Plasmaspiegelkurve AUC (area under the curve) bestimmt werden: CL ... Clearance D CL = D ... Dosis AUC AUC ... Gesamtfläche unter der Plasmaspiegelkurve 24.4.4 Beispiel für die Bestimmung pharmakokinetischer Parameter 10 ml Tinte werden in 990 ml Wasser verteilt. Es ergibt sich ein Verteilungsvolumen VD von 1000 ml. Wenn jede Minute 10 ml dieses Volumens durch Wasser ersetzt werden bedeutet das eine Clearance CL von 10 ml/min. Die Eliminationskonstante ke ergibt sich aus dem Zusammenhang zwischen Clearance CL und Verteilungsvolumen VD und beträgt 0,01 pro Minute. Daraus ergibt sich eine Halbwertszeit von 70 Minuten. 186/210 24.5 Funktionsverläufe im Ein-Kompartment-Modell 24.5.1 Dauerinfusion Der Arzneistoff wird intravenös als Dauerinfusion mit einer Infusionsrate R0 verabreicht. Der einzige Transportprozess ist die Ausscheidung beschrieben durch die Eliminationskonstante ke. Abbildung 166: Ein-Kompartment-Modell für eine intravenöse Dauerinfusion mit der Infusionsrate R0 und der Eliminationsrate ke. Die Konzentrationsänderung im Laufe der Zeit hängt somit von der aktuellen Konzentration, der Eliminationskonstanten und der Infusionsrate ab: dc/dt ... Änderung der Stoffkonzentration c mit der Zeit t dc = −k e c + R 0 c ... Stoffkonzentration im Plasma dt R0 ... Infusionsrate Der Zeitverlauf der Plasmakonzentration lässt sich folgendermaßen beschreiben: c ... Stoffkonzentration im Plasma R0 c= (1 − exp(−k e t) ) R0 ... Infusionsrate k e Vd ke ... Eliminationskonstante VD ... Scheinbares Verteilungsvolumen t ... Zeit Abhängig vom Verhältnis zwischen Infusionsrate und Clearance wird ein quasistationäres Konzentrationsgleichgewicht css erreicht: css ... Stoffkonzentrationsgleichgewicht im Plasma R0 R c ss = = 0 R0 ... Infusionsrate k e Vd CL ke ... Eliminationskonstante VD ... Scheinbares Verteilungsvolumen CL ... Clearance Abbildung 167: Konzentrationsverlauf bei einer intravenösen Dauerinfusion. Nach einer gewissen Zeit wird ein Gleichgewichtszustand der Plasmakonzentration erreicht, bei dem sich Infusionsrate und Clearance die Waage halten. 187/210 24.6 Injektion (Kurzzeitinfusion) Bei einer Kurzzeitinfusion wird das Arzneimittel nur für eine gewisse Infusionsdauer T verabreicht und die Plasmakonzentration steigt bis zu einer Maximalkonzentration cmax an: c ... Maximale Plasmakonzentration R0 cmax = (1 − exp(−k e T) ) Rmax 0 ... Infusionsrate k e VD ke ... Eliminationskonstante VD ... Scheinbares Verteilungsvolumen T ... Infusionsdauer Nach Beendigung der Infusion sinkt die Plasmakonzentration wieder ab und muss rechtzeitig durch eine erneute Injektion aufgefrischt werden um zu verhindern, dass das therapeutische Fenster verlassen wird. Der Zeitverlauf wird folgendermaßen beschrieben: c ... Plasmakonzentration R0 c= (1 − exp(−k e t) ) für t < T cmax ... Maximale Plasmakonzentration k e Vd R0 ... Infusionsrate bzw. ke ... Eliminationskonstante c = c max exp ( − k e (t − T) ) für t > T VD ... Scheinbares Verteilungsvolumen t ... Zeit T ... Infusionsdauer Abbildung 168: Links: Konzentrationsverlauf bei einer Kurzzeitinfusion (Injektion). Die Plasmakonzentration steigt durch die Injektion auf einen Maximalwert cmax und fällt danach wieder ab. Rechts: In der halblogarithmischen Darstellung ist die Konzentrationsabnahme nach der Injektion eine Gerade. 24.6.1 Orale Applikation Bei einer oralen Verabreichung des Arzneistoffs mit der Dosis D wird dieser kontinuierlich aus einem Depot (z.B. dem Gastrointestinaltrakt) mit einer Absorptionskonstanten ka resorbiert. Ausgeschieden wird der Stoff entsprechend der Eliminationskonstante ke. 188/210 Abbildung 169: Kompartment-Modell für eine orale Arzneimittelgabe. Konzentrationsänderung im Gastrointestinaltrakt cGI: dcGI/dt ... Änderung der Stoffkonzentration im dcGI = k a cGI Gastrointenstinaltrakt mit der Zeit t dt ka ... Absorptionskonstante cGI ... Konzentration im Gastrointestinaltrakt Die Arzneimittelkonzentration innerhalb des Körpers wird durch Invasion aus dem Depot im Gastrointestinaltrakt erhöht und gleichzeitig durch Evasion über die Ausscheidung erniedrigt: dc/dt ... Änderung der Stoffkonzentration im Körper mit dc = k a cGI − k e c der Zeit t dt ka ... Absorptionskonstante cGI ... Konzentration im Gastrointestinaltrakt ke ... Eliminationskonstante c ... Konzentration im Körper Bateman-Funktion Der aus Invasion und Evasion resultierende Zeitverlauf der Plasmakonzentration c ist die Differenz zweier Exponentialfunktionen und wird durch die Bateman-Funktion beschrieben: dc/dt ... Änderung der Stoffkonzentration im ka F D dc = ( exp(−k e t) − exp(−k a t) ) Körper mit der Zeit t dt VD (k a − k e ) ka ... Absorptionskonstante FD ... Resorbierte Dosis VD ... Scheinbares Verteilungsvolumen ke ... Eliminationskonstante t ... Zeit Abbildung 170: Konzentrationsverlauf bei der oralen Gabe eines Arzneimittels. Die aktuelle Stoffkonzentration setzt sich aus der Aufnahme aus dem Gastrointestinaltrakt (ka) und die Abgabe über die Ausscheidung (ke) zusammen. 189/210 25 Blut- und Atmungskreislauf 25.1 Gefäßsystem Die Gefäße mit einem großen Gefäßdurchmesser (z.B. die Aorta) weisen insgesamt eine geringe Gesamtquerschnittsfläche auf, da es weniger von ihnen gibt. Aufgrund des großen Durchmessers weist das Blut in diesen Gefäßen eine hohe Strömungsgeschwindigkeit auf, da der Widerstand innerhalb eines Gefäßes mit der vierten Potenz des Radius abnimmt (siehe Kapitel 7.6). Die Kapillaren mit einem geringen Gefäßdurchmesser sind in weitaus größerer Anzahl vorhanden und weisen daher eine größere Gesamtquerschnittsfläche auf. Aufgrund ihres geringen Querschnitts herrscht innerhalb dieser Gefäße ein hoher Strömungswiderstand was zu geringeren Strömungsgeschwindigkeiten des darin befindlichen Blutes führt. Abbildung 171: Zusammenhang zwischen Gefäßdurchmesser, Gesamtquerschnittsfläche und mittlerer Strömungsgeschwindigkeit. 190/210 25.2 Hydrostatische Indifferenzebene Das ist jene Ebene in der der Blutdruck sowohl im Stehen wie auch im Liegen identisch ist. Im Liegen ist der Blutdruck in allen Arterien etwa gleich hoch. Dasselbe gilt auch für die Venen des Körpers. Richtet sich der Mensch auf, so steigt der Blutdruck in der unteren Körperhälfte durch das Gewicht des Blutes an, in der oberen Körperhälfte dagegen sinkt der Blutdruck ab. In der hydrostatischen Indifferenzebene, ca. 5–10 cm unterhalb des Zwerchfells gelegen, bleibt er konstant. Abbildung 172: Hydrostatische Indifferenzebene 25.3 Druckverlauf im Blutkreislauf Man unterscheidet zwischen dem so genannten Niederdruck- und dem Hochdrucksystem. Das Hochdrucksystem enthält die Arterien des Körperkreislaufs. Zum Niederdrucksystem gehören die Arteriolen, Kapillaren und Venen des Körperkreislaufs, das rechte Herzseite und die Gefäße des Lungenkreislaufs. 191/210 Abbildung 173: Druckverlauf innerhalb des Blutgefäßsystems. Zwischen Hochdrucksystem (Arterieller Seite) und Niederdrucksystem (Venöser Seite) besteht eine Druckdifferenz von ca. 13 kPa. Die Hauptaufgabe des Niederdrucksystems ist seine Blutspeicherfunktion (beim Menschen ca. vier bis fünf Liter). Die Hauptaufgabe des Hochdrucksystems ist die Versorgung der Organe. Der Blutdruck ist im Verlauf des Systems großen Änderungen unterworfen. Der Druckabfall beträgt ca. 13,2 kPa. Abbildung 174: Links: Im Ruhezustand ohne die „Pumpe“ Herz würde überall im Körper derselbe Blutdruck herrschen. Rechts: Aufgrund der Herzaktivität gibt es eine Druckdifferenz zwischen der Hochdruckseite (arteriell) und der Niederdruckseite (venös). Spricht man umgangssprachlich vom Blutdruck, so meint man den Blutdruck der Arterien im Körperkreislauf. Dieser schwankt zwischen Systole und Diastole. Bei der Systole („Kontraktion“, der Auswurfphase des Herzens) wird das Blut aus der linken und der rechten Herzkammer herausgepresst. Bei der Diastole („Ausdehnung“, der Füllungsphase) erschlafft der Herzmuskel. 192/210 Abbildung 175: Systole und Diastole Umrechnung Die Einheit „Millimeter Quecksilbersäule“ findet auch heute noch in der Medizin Verwendung: 1 mmHg = 133,322 Pa 25.4 Windkesselfunktion Trotz der großen Druckunterschiede zwischen Systole und Diastole fließt das Blut relativ gleichmäßig durch den Körper. Dies liegt an der so genannten Windkesselfunktion der Aorta und der großen Arterien. Während der Systole dehnt sich die Gefäßwand aus (verhält sich dann wie ein starres Gefäß) und nimmt so einen Teil des ausgeworfenen Blutes auf, und gibt ihn in der Diastole, in der kein Blut aus dem Herzen austritt, wieder ab. Diese Volumendehnbarkeit (Compliance) wandelt also das stoßweise austretende Blut in einen gleichmäßigen Strom um. Würde der Druck nicht durch die elastischen Gefäße gespeichert werden können, so würde der Druck in der Aorta wesentlich dramatischer schwanken. Interessanterweise würde im zeitlichen Mittel aber wesentlich weniger Blut durch die Gefäße strömen, da viel Strömungsenergie für das ständige Beschleunigen des Blutes aufgezehrt würde. 193/210 Abbildung 176: Die Windkesselfunktion der Arterien sorgt für einen annähernd gleichmäßigen Blutfluss trotz der Druckunterschiede zwischen Systole und Diastole. Die Gesetze von Hagen-Poiseuille und Kirchhoff (siehe Kapitel 7.6) gelten im strengen Sinne nur bei starren Wänden, d.h. wenn die Strömungsgeschwindigkeit v linear von der Druckdifferenz Δp abhängt. Abbildung 177: Für ein dehnbares Gefäß gelten die Gesetze von Hagen-Poiseuille und Kirchhoff strenggenommen nur wenn sich dieses vollständig gedehnt hat. Zu Beginn sind die Strömungsgeschwindigkeiten noch gering, da die Energie in die Dehnung der Gefäßwände investiert wird. 25.5 Auskultatorische Blutdruckmessung (A) Die Manschette wird aufgeblasen bis der Manschettendruck M größer ist als der arterielle Druck des Blutes pa. Dadurch wird das Gefäß abgedrückt und das Blut kann nicht mehr fließen. Über das Stethoskop sind keine Geräusche zu vernehmen. (B) Der Manschettendruck wird soweit nachgelassen bis der arterielle Druck pa erreicht ist (Systole). In der Manschette ist nun ein pulsieren zu spüren und über das Stethoskop ist ein Geräusch wahrnehmbar, da nun ein bisschen Blut durch das Gefäß fließen kann. 194/210 (C) Man lässt den Manschettendruck weiter nach. Da der arterielle Druck nun höher ist als der Manschettendruck kann das Blut wieder fließen und über das Stethoskop sind deutliche Geräusche zu hören. Die pulssynchronen Geräusche, die beim langsamen Ablassen des Drucks in der Manschette hörbar werden, nennt man Korotkow-Geräusche. (D) Ist der Manschettendruck auf den Venendruck abgefallen sind keine Geräusche mehr wahrnehmbar (Diastole). Abbildung 178: Blutdruckmessung nach Riva-Rocci 25.6 Viskosität des Blutes Blut ist eine komplexe Flüssigkeit, die aus Blutplasma (flüssige Phase) und suspendierten Blutzellen (feste Phase) besteht. Der prozentuelle Anteil von Erythrozyten am gesamten Flüssigkeitsvolumen wird Hämatokritwert (Abk: Ht, Htr, Hk) genannt und liegt normalerweise bei 40-45 %. Die Viskosität (Zähflüssigkeit) des Blutes nimmt mit zunehmendem Hämatokritwert zu. 195/210 Abbildung 179: Zusammenhang zwischen Hämatokrit und Viskosität des Blutes. Blut ist eine Nicht-Newtonsche Flüssigkeit, d.h. die Viskosität hängt von der Schubspannung ab. Unter Scherung (höhere Strömungsgeschwindigkeiten) richten sich die Erythrozyten parallel aus und reduzieren die Viskosität. Abbildung 180: Links: Bei niedriger Schubspannung bilden die Erythrozyten vernetzte Aggregate. Rechts: Bei hoher Schubspannung lösen sich die Aggregate auf und die Blutkörperchen deformieren sich. Beispiel: Dreht man eine Ketchup-Flasche einfach nur um wirken keine Scherkräfte und das Ketchup kommt nicht aus der Flasche. Schüttelt man die Flasche wirken Scherkräfte wodurch das Ketchup dünnflüssiger wird und aus der Flasche fließt. 25.7 Fahraeus-Lindquist Effekt Der Fahraeus-Lindquist beschreibt den Effekt, dass sich die Viskosität des Blutes abhängig vom Gefäßdurchmesser verändert. Bei einem Gefäßdurchmesser von ca. 10 μm, dem Durchmesser der Kapillaren, ist die Viskosität der Blutkörperchen am größten. 196/210 Abbildung 181: Beim Gefäßdurchmesser der Kapillaren ist die Viskosität des Blutes am geringsten. Die eigentlich rundlichen Blutkörperchen verformen sich innerhalb der Kapillaren und nehmen eine längliche Form an. Dadurch vergrößern sie die Diffusionsoberfläche für den Gasaustausch. Abbildung 182: Die roten Blutkörperchen verformen sich innerhalb der Kapillaren und vergrößern so die Diffusionsoberfläche für den Gasaustausch. Die Reynoldszahl (siehe Kapitel 7.7) innerhalb der Kapillaren beträgt 0,05, daher besteht keine Gefahr für Turbulenzen innerhalb der Blutgefäße. Bei der Erweiterung von Blutgefäßen und bei reduzierter Viskosität (Anämie) besteht die Gefahr, dass turbulente Strömungen entstehen. 197/210 25.8 Gastransport im Körper Abbildung 183: Schematischer Ablauf des Gastransports durch den Körper Über erzwungene Konvektion wird Sauerstoff über die Luft in die Lunge aufgenommen und in den Lungenkapillaren über den passiven Transportvorgang der Diffusion an die roten Blutkörperchen gebunden. Über den Blutkreislauf gelangt das Blut durch Konvektion in alle Bereiche des Körpers. In den Blutkapillaren wird der Sauerstoff wieder per Diffusion an das Gewebe abgegeben. Innerhalb der Zellen erfolgt eine erleichterte Diffusion durch Kopplung des Sauerstoffs an das Myoglobin, das durch seine höhere Sauerstoffaffinität dafür sorgt, dass der Sauerstoff zu den Mitochondrien (Atmungskette) gelangt. Konvektion Die Konvektion beschreibt einen energieabhängigen Transport von Teilchen durch ein Trägersystem, der über große Distanzen erfolgen kann. Innerhalb des Körpers erfolgt Konvektion im Rahmen der Ventillation, d.h. der Durchlüftung der Lungen beim Atmen. Die Transportkapazität entspricht dem Atemminutenvolumen. Das ist das Volumen an Atemluft, das pro Minute ein- und wieder ausgeatmet wird. Weiters erfolgt der Transport innerhalb des Blutkreislaufs über Konvektion. Die Transportkapazität entspricht dem Herzminutenvolumen. Das ist das Blutvolumen, das in einer Minute vom Herz durch den Blutkreislauf gepumpt wird. Diffusion Die Diffusion ist ein energieunabhängiger Transport, der entlang eines Konzentrationsgradienten erfolgt. Im Gegensatz zur Konvektion ist sie nur über kurze Strecken effektiv und erfolgt über größere Distanzen nur sehr langsam. Die Überwindung einer Strecke von 1 cm würde per Diffusion ca. 1 Tag dauern. Daher sind die Kapillaren in denen der Gasaustausch erfolgt so eng, dass die Diffusionsstrecke (und damit die Diffusionsdauer) zwischen Blutkörperchen und Gefäßwand so gering wie möglich ist. 198/210 Abbildung 184: Zusammenhang zwischen Diffusionstrecke und Diffusionsdauer Gasdruck Der Gasdruck (hydrostatischer Druck) auf die Gefäßwand entsteht durch Impulsübertragung von Atomen und Molekülen in der Gasphase (siehe Kapitel 8.10). 25.9 Gasaustausch Die Aufgabe der roten Blutkörperchen ist der Sauerstofftransport im Blutgefäßsystem. Sie nehmen in den Lungenkapillaren den Sauerstoff auf und transportieren ihn über den arteriellen Kreislauf bis in die arteriellen Kapillaren der Gewebe und Organe, von wo der Sauerstoff an die Zellen abgegeben wird. 199/210 Abbildung 185: Gasaustausch zwischen Blut und Luft 25.10 Compliance Die Compliance ist ein Maß für die Elastizität von Körperstrukturen. Sie gibt an, wieviel Gas oder Flüssigkeit man in eine umwandete Struktur füllen kann, bis der Druck um eine Druckeinheit ansteigt. C ... Compliance [l/kPa] V C= V ... Volumen [l] p p ... Druck [kPa] Das Gleichgewicht zwischen den elastischen Kräften von Thorax (Muskeln, die den Brustkorb zusammenziehen) und Lunge (Luftdruck, der Lunge ausdehnt) wird als elastischer Nullpunkt bezeichnet. 200/210 Abbildung 186: Elastischer Nullpunkt 25.11 Surfactant Surfactant (surface active agent) ist die Bezeichnung für eine „grenzflächenaktive Substanz“, die innen die Lunge auskleidet. Bei einer Grenzfläche ohne Surfactant würde der Innendruck mit zunehmendem Radius abnehmen: p ... Innendruck [Pa] 4γ p= γ ... Oberflächenspannung [N/m] r r ... Radius [m] Abbildung 187: Links: Bei einer Alveole ohne Surfactant (z.B. Luftballon) wird die nach innen gerichtete Kraft umso kleiner, je größer der Radius wird. Rechts: Bei einer Alveole mit Surfactant (z.B. in der Lunge) ist die nach innen gerichtete Kraft bei kleinen Radien gering und steigt mit zunehmendem Radius an. Die Surfactant hat folgende Aufgaben: − Senkung des „Eröffnungsdrucks“ kleiner Alveolen (vgl. hoher Kraftaufwand am Beginn des Aufblasens eines Luftballons). − Erhöhung der Lungen-Compliance (Elastizität), sodass eine kleinere Druckdifferenz und weniger Arbeit zur Volumensvergrößerung nötig sind. − Verhinderung des Alveolenkollapses am Ende der Ausatmung. Der Druck innerhalb des Brustkorbs nähert sich beim Ausatmen dem Druck der Alveolaren an (ca. 0 kPa) und kann sogar leicht höher sein. Abbildung 188: Bei einer mit einem Surfactant ausgekleideten Lunge kann bereits bei einem geringen Druckaufbau innerhalb der Lunge ein großes Volumen erzielt werden. Hätte die Lunge kein Surfactant, wären zu Beginn sehr große Drucke notwendig um die Oberflächenspannung überwinden zu können um dasselbe Volumen zu erreichen. 201/210 Alveolendruck Die Alveolen haben eine Radius von ca. r = 24 μm und für Wasser beträgt die Oberflächenspannung γ = 0,072 N/m. Daraus ergibt sich nach obiger Formel ein erforderlicher Druck von 3 kPa. Der tatsächliche Druck beträgt jedoch nur ca. 0,5 kPa. 25.12 Atemvorgang Beim aktiven Einatmen kontrahiert sich das zum Brustraum gewölbte Zwerchfell und flacht dabei ab. Durch diesen Vorgang wird der Brustraum vergrößert und somit der Unterdruck in der Brusthöhle erhöht. Dadurch strömt Luft in die Lunge Abbildung 189: Atemvorgang Beim passiven Ausatmen entspannt sich das Zwerchfell und die Lunge zieht sich durch ihre elastischen Fasern wieder zusammen wodurch die Luft wieder aus der Lunge hinaus befördert wird. Der Atmungswiderstand setzt sich aus folgenden Komponenten zusammen: 1. Dehnungswiderstand von Lunge und Thorax (Compliance der Lunge) 2. Reibungs- und Deformationswiderstände der Organe 3. Trägheitswiderstand der Organe gegen Verschiebungen und Beschleunigungen 4. Strömungswiderstand der Luft in den Atemwegen Δp = − ΔV + VR C Strömung Elastizität Δp ... Druckdifferenz ΔV ... Volumendifferenz V ... Volumenstrom C ... Compliance R ... Widerstand 202/210 25.13 Bestimmung des Atemvolumens 25.13.1 Pneumotachograph/Spirometrie Der Pneumotachograph ist ein medizinisches Gerät zur Durchführung einer Spirometrie und damit der Überprüfung der Lungenfunktion. Zusätzlich zu einem Spirometer kann ein Pneumotachograph jedoch auch dynamische Atemvolumina ermitteln. Abbildung 190: Pneumotachograph Der Patient atmet durch ein Rohr in dem sich eine Vielzahl kleiner Lamellen befinden. Durch diese Lamellen entsteht ein kleiner Strömungswiderstand innerhalb des Rohres, was eine minimale Druckdifferenz zwischen Punkt A vor, und Punkt B nach den Lamellen hervorruft. Da dieser Druckabfall (A - B) bei laminarer Strömung direkt proportional zum Volumenstrom ist, lässt sich durch vorherige Kalibrierung des Gerätes die Atemstromstärke des Patienten messen. Aus dem Volumenstrom lässt sich nach Integration (siehe Gesetz von Hagen-Poiseuille, Kapitel 7.6) das Atemvolumen berechnen. 25.13.2 Ganzkörperplethysmograph Bei dieser Methode werden in einer geschlossenen Kabine bei normaler Ruheatmung die Atemwegswiderstände in der Ein- und Ausatmung gemessen. Sie sind in typischer Weise bei einer chronischen Bronchitis und bei Asthma bronchiale verändert. Abbildung 191: Ganzkörperplethysmograph 203/210 Inhaltsverzeichnis A Grundlagen.................................................................................................................. 3 1 Freier Fall ............................................................................................................ 3 1.1 Theorie als Modell........................................................................................ 3 1.2 Größen zur Beschreibung von Bewegungen................................................ 3 1.2.1 Ort ......................................................................................................... 3 1.2.2 Weg ....................................................................................................... 3 1.2.3 Geschwindigkeit.................................................................................... 3 1.2.4 Beschleunigung..................................................................................... 4 1.3 Bewegungsarten ........................................................................................... 5 1.3.1 Gleichförmige Bewegung...................................................................... 5 1.3.2 Ungleichförmige Bewegung (Beschleunigte oder verzögerte Bewegung) ........................................................................................................... 8 1.4 Freier Fall ..................................................................................................... 9 1.4.1 Freier Fall ohne Reibung ...................................................................... 9 1.4.2 Freier Fall mit Stokes-Reibung .......................................................... 10 1.4.3 Freier Fall mit Luftwiderstand (Turbulenter Fall)............................. 10 1.4.4 Anwendbarkeit der Gesetze................................................................. 11 2 Funktionen .........................................................................................................13 2.1 Konstante Funktion ....................................................................................13 2.2 Lineare Funktion (Polynom 1. Ordnung) ...................................................13 2.3 Quadratische Funktion (Polynom 2. Ordnung) .........................................13 2.4 Exponentialfunktion ...................................................................................14 2.5 Kreisfunktionen (Harmonische Funktionen).............................................17 2.6 Gedämpfte Schwingung ..............................................................................17 3 Elektromagnetisches Spektrum .........................................................................19 3.1 Begriff des Spektrums .................................................................................19 3.2 Elektromagnetisches Spektrum (EMS) ......................................................19 3.3 Arten von Spektren .....................................................................................21 3.3.1 Emissionsspektrum vs. Absorptionsspektrum ...................................21 3.3.2 Linien-, Banden- vs. kontinuierliches Spektrum ................................21 3.4 Prismen vs. Gitterspektrum....................................................................... 22 3.5 Temperaturstrahler.................................................................................... 22 3.5.1 Stefan-Boltzmann-Gesetz................................................................... 22 3.5.2 Kirchhoffsches Strahlungsgesetz........................................................ 22 3.5.3 Plancksches Strahlungsgesetz ............................................................ 23 3.5.4 Wiensches Verschiebungsgesetz ........................................................ 23 4 Ionisierende Strahlung...................................................................................... 24 4.1 Radioaktivität............................................................................................. 24 4.2 Radioaktive Strahlung................................................................................ 24 4.2.1 Alpha-Strahlung ................................................................................. 24 4.2.2 Beta-Strahlung.................................................................................... 25 4.2.3 Gamma-Strahlung .............................................................................. 25 4.3 Zerfallsreihen ............................................................................................. 25 4.3.1 Nuklidkarte ......................................................................................... 26 4.3.2 Nuklidgenerator.................................................................................. 26 4.4 Zerfallsgesetz.............................................................................................. 26 4.4.1 Zerfallsgesetz ...................................................................................... 27 4.4.2 Aktivität............................................................................................... 27 4.4.3 Zerfallsgesetz: Mutter-Tochter........................................................... 27 4.4.4 Halbwertszeit ...................................................................................... 28 4.5 Kosmische Höhenstrahlung....................................................................... 29 204/210 4.6 Messung von radioaktiver Strahlung......................................................... 29 4.6.1 Geiger-Müller-Zählrohr (Geigerzähler) ............................................. 29 4.6.2 Szintillationszähler ............................................................................. 30 4.7 Röntgenstrahlung........................................................................................31 4.7.1 Entstehung der Röntgenstrahlung ......................................................31 4.7.2 Aufbau der Röntgenröhre....................................................................31 4.7.3 Spektrum der Röntgenstrahlung........................................................ 32 4.7.4 Parameter der Röntgenstrahlung....................................................... 33 4.7.5 Wirkungsgrad ..................................................................................... 33 4.7.6 Nachweis ............................................................................................. 34 4.8 Biologische Wirkungen ionisierender Strahlung ...................................... 34 4.8.1 Ionisierende Strahlung ....................................................................... 34 4.8.2 Wirkung auf Gewebe .......................................................................... 34 4.8.3 Deterministische und stochastische Strahlenwirkungen .................. 35 4.8.4 Wechselwirkung von -Strahlung .................................................... 35 4.8.5 Absorptionsgesetz............................................................................... 36 4.8.6 Linearer Energietransfer (LET).......................................................... 37 4.9 Dosimetrie (Messung der Exposition)....................................................... 37 4.9.1 Energiedosis D .................................................................................... 38 4.9.2 Ionendosis J........................................................................................ 38 4.9.3 Äquivalenzdosis H .............................................................................. 38 4.9.4 Effektive Dosis Deff .............................................................................. 38 4.9.5 Expositionsdosisleistung H ............................................................... 39 4.9.6 Zusammenhang Dosis und inkorporierte Aktivität ........................... 39 4.9.7 Strahlenbelastung ............................................................................... 39 4.10 Strahlenschutz............................................................................................40 5 Optik ...................................................................................................................41 5.1 Reflexion......................................................................................................41 5.2 Brechung .....................................................................................................41 5.3 Dispersion .................................................................................................. 42 5.4 Abbildung mit einer Linse ......................................................................... 43 5.4.1 Reeles, verkleinertes und verkehrtes Bild.......................................... 45 5.4.2 Reeles, gleichgroßes und verkehrtes Bild........................................... 45 5.4.3 Reeles, vergrößertes und verkehrtes Bild........................................... 45 5.4.4 Bild im Unendlichen........................................................................... 46 5.4.5 Virtuelles, vergrößertes und aufrechtes Bild...................................... 46 5.5 Das Auge..................................................................................................... 46 5.6 Linsenfehler ............................................................................................... 47 5.7 Huygenssches Prinzip ................................................................................ 47 5.8 Interferenz.................................................................................................. 48 5.9 Beugung (Diffraktion)................................................................................ 48 5.9.1 Beugung und Interferenz am Doppelspalt ......................................... 49 5.10 Absorption.................................................................................................. 49 5.11 Streuung ..................................................................................................... 50 5.12 Spektrale Empfindlichkeit ..........................................................................51 6 Transportvorgänge ............................................................................................ 52 6.1 Allgemeiner Ansatz für Transportphänomene .......................................... 52 6.2 Gradient...................................................................................................... 52 6.3 Wärmetransport durch mehrere Schichten .............................................. 53 6.4 Diffusion..................................................................................................... 54 6.4.1 Erstes Ficksches Gesetz ...................................................................... 55 6.4.2 Zweites Ficksches Gesetz.................................................................... 55 205/210 6.5 Osmose ....................................................................................................... 55 Fluiddynamik..................................................................................................... 57 7.1 Kompressible und inkompressible Medien ............................................... 57 7.2 Statischer Druck von Fluiden .................................................................... 57 7.3 Kontinuitätsbedingung .............................................................................. 58 7.4 Gesetz von Bernoulli .................................................................................. 58 7.5 Viskosität.................................................................................................... 59 7.5.1 Bestimmung der Viskosität ................................................................ 59 7.5.2 Messung der Viskosität........................................................................61 7.6 Hagen-Poiseuillesches Gesetz.....................................................................61 7.6.1 Strömungswiderstände....................................................................... 62 7.6.2 Rohrströmung..................................................................................... 63 7.7 Laminare vs. turbulente Strömung............................................................ 63 8 Thermodynamik (Wärmelehre) ........................................................................ 66 8.1 System und Zustand................................................................................... 66 8.2 Intensive vs. extensive Zustandsgrößen .................................................... 66 8.3 Hauptsätze der Wärmelehre ...................................................................... 67 8.4 Wärme vs. Temperatur .............................................................................. 67 8.5 Temperaturskalen ...................................................................................... 68 8.6 Entropie...................................................................................................... 69 8.7 Enthalpie .................................................................................................... 70 8.8 Phasenübergänge ....................................................................................... 70 8.8.1 Phasenübergänge des Wassers............................................................71 8.8.2 Spezifische Wärmekapazität............................................................... 72 8.8.3 Änderung der Umwandlungspunkte.................................................. 72 8.9 Luftdruck.................................................................................................... 73 8.9.1 Daltonsches Gesetz ............................................................................. 73 8.9.2 Barometrische Höhenformel.............................................................. 73 8.9.3 Eigenschaften der Luft ....................................................................... 74 8.10 Physik der feuchten Luft ............................................................................ 74 8.10.1 Ideales Gas .......................................................................................... 74 8.10.2 Thermische Zustandsgleichung.......................................................... 74 8.10.3 Gesetz von Boyle-Mariotte ................................................................. 75 8.10.4 Gesetz von Gay-Lussac ....................................................................... 75 8.10.5 Dampfdruck ........................................................................................ 75 8.10.6 Partialdrücke für trockene Luft und Wasserdampf ........................... 76 8.10.7 Absolute Feuchtigkeit ......................................................................... 76 8.10.8 Relative Feuchtigkeit .......................................................................... 76 8.10.9 Mischungsverhältnis........................................................................... 76 8.10.10 Spezifische Enthalpie .......................................................................77 8.10.11 Mollier-Diagramm .......................................................................... 78 9 Energiebilanz des Tieres.................................................................................... 79 9.1 Erhaltungszustand ..................................................................................... 79 9.2 Stoffwechsel (Metabolismus).....................................................................80 9.3 Mechanismen zur Steuerung des Wärmeflusses.......................................80 9.4 Strahlung .................................................................................................... 81 9.5 Wärmeströmung (Konvektion).................................................................. 81 9.6 Wärmeleitung (Konduktion) ..................................................................... 82 9.6.1 Stationäre Wärmeleitung ................................................................... 83 9.6.2 Instationäre Wärmeleitung ................................................................ 83 9.7 Verdunstung............................................................................................... 83 9.8 Atmung ....................................................................................................... 83 7 206/210 9.9 Allometrie................................................................................................... 84 9.9.1 Klassische Allometrieformel............................................................... 84 9.9.2 Meshsche Formel................................................................................ 85 10 Schwingungen und Wellen ............................................................................ 86 10.1 Schwingungen ............................................................................................ 86 10.2 Fadenpendel............................................................................................... 87 10.3 Federpendel................................................................................................ 87 10.3.1 Herleitung der Schwingungsgleichung .............................................. 87 10.3.2 Energiebilanz ...................................................................................... 89 10.4 Gedämpfte Schwingung .............................................................................90 10.5 Erzwungene Schwingung ...........................................................................90 10.6 Überlagerung von Schwingungen...............................................................91 10.6.1 Schwebung ...........................................................................................91 10.6.2 Resonanz..............................................................................................91 10.7 Mechanische Wellen .................................................................................. 92 10.7.1 Longitudinale Ausbreitung................................................................. 93 10.7.2 Transversale Ausbreitung................................................................... 93 10.7.3 Wellengleichung ................................................................................. 94 10.7.4 Schallausbreitung in festen Körpern.................................................. 95 10.8 Dopplereffekt ............................................................................................. 95 10.9 Fourieranalyse............................................................................................ 96 10.9.1 Fourieranalyse .................................................................................... 96 10.9.2 Fouriersynthese .................................................................................. 99 10.9.3 Gibbsches Phänomen ......................................................................... 99 B Anwendungen.......................................................................................................... 100 11 Röntgen............................................................................................................ 100 11.1 Bildentstehung ......................................................................................... 100 11.1.1 Streuung.............................................................................................101 11.1.2 Brennfleckgröße.................................................................................101 11.2 Verstärkerfolien ....................................................................................... 102 11.3 Filmentwicklung ...................................................................................... 103 11.4 Auflösungsvermögen................................................................................ 104 11.5 Kontrastmittel .......................................................................................... 105 11.6 Indirektradiographie................................................................................ 106 12 Bildgebende Verfahren.................................................................................... 108 12.1 Tomographie ............................................................................................ 108 12.1.1 Röntgentomographie........................................................................ 108 12.1.2 Computertomographie (CT) ............................................................. 108 12.1.3 Magnetresonanztomographie (MRT)................................................ 112 12.1.4 Vergleich tomografischer Verfahren ................................................. 115 12.2 Szintigrafie ................................................................................................ 116 12.3 Positronenemissionstomografie (PET) .................................................... 117 13 Mikroskopische Verfahren ............................................................................... 119 13.1 Vergleich mikroskopischer Verfahren ...................................................... 119 13.2 Mikroskop ................................................................................................ 120 13.2.1 Aufbau eines Lichtmikroskops ......................................................... 120 13.2.2 Strahlengang eines Mikroskops ....................................................... 120 13.3 Abbesche Theorie ...................................................................................... 121 13.3.1 „Unbewaffnetes“ Auge ....................................................................... 121 13.3.2 Vergrößerung .................................................................................... 122 13.3.3 Auflösungsvermögen ........................................................................ 122 13.3.4 Öffnungswinkel..................................................................................123 207/210 13.4 Numerische Apertur eines Objektivs........................................................123 13.4.1 Maximale Auflösung ..........................................................................125 13.4.2 Vergrößerung der numerischen Apertur durch Ölimmersion..........125 13.4.3 Förderliche Vergrößerung ................................................................ 126 13.5 Dunkelfeldmikroskopie............................................................................ 126 13.6 Phasenkontrastmikroskopie .....................................................................127 13.7 Fluoreszenzmikroskopie .......................................................................... 130 13.8 Konfokalmikroskopie................................................................................ 131 14 Elektronenmikroskopie ....................................................................................132 14.1 Wellencharakter des Elektrons.................................................................132 14.2 Transmissionselektronenmikroskopie TEM ............................................133 14.3 Rasterelektronenmikroskopie REM ........................................................ 134 14.4 Röntgenmikroskopie................................................................................ 134 15 Atomare Bindung ............................................................................................ 136 15.1 Zusammenhang Potential und Feld......................................................... 136 15.1.1 Feld ................................................................................................... 136 15.1.2 Potential.............................................................................................137 15.2 Coulombsches Gesetz................................................................................137 15.3 Dipol im elektrischen Feld ....................................................................... 138 15.4 Bindungsenergie ...................................................................................... 138 15.5 Bindungsarten.......................................................................................... 138 15.5.1 Wellenmechanisches Atommodell ................................................... 138 15.5.2 Kovalente Bindung ........................................................................... 139 15.5.3 Ionenbindung .................................................................................... 141 15.5.4 Van der Waals-Bindung.................................................................... 142 15.5.5 Wasserstoffbrückenbindung ............................................................ 143 15.5.6 Metallbindung................................................................................... 143 16 Grenzflächen und Membranen ....................................................................... 144 16.1 Potentialverlauf an der Zellmembran...................................................... 144 16.2 Ruhepotential............................................................................................145 16.3 Aktionspotential........................................................................................145 16.4 Nernst-Gleichung......................................................................................145 16.5 Goldman-Gleichung................................................................................. 146 16.6 Ionenkonzentrationen beim Menschen................................................... 146 17 Zentrifuge .........................................................................................................147 17.1 Sedimentation ...........................................................................................147 17.2 Zentripetalkraft ........................................................................................ 148 17.3 Ultrazentrifuge ......................................................................................... 150 17.3.1 Aufbau der Ultrazentrifuge............................................................... 150 17.3.2 Sedimentationsgeschwindigkeit in der Zentrifuge ........................... 151 17.3.3 Sedimentationskoeffizient................................................................. 151 17.3.4 Auswertung der Ultrazentrifuge........................................................ 151 18 Photometrie ..................................................................................................153 18.1 Kolorimetrie ..............................................................................................153 18.2 Trockenchemie ..........................................................................................153 18.3 Aufbau eines Spektralphotometers ..........................................................154 18.4 Konzentrationsbestimmung .....................................................................154 18.5 Absorption, Transmission und Extinktion ...............................................155 18.6 Filterphotometer .......................................................................................156 19 Massenspektrometrie .......................................................................................157 19.1 Aufbau eines Massenspektrometers .........................................................157 19.1.1 Ionenquelle ........................................................................................157 208/210 19.1.2 Analysator ......................................................................................... 158 19.1.3 Detektor ............................................................................................ 158 19.2 Time of flight-Massenspektrometer ........................................................ 160 19.3 MALDI....................................................................................................... 161 19.4 Quadrupol Massenspektrometer ............................................................. 162 20 Chromatographie und Elektrophorese........................................................ 163 20.1 Elektrophorese ......................................................................................... 163 20.1.1 Aufbau............................................................................................... 163 20.1.2 Auswertung ....................................................................................... 164 20.2 Chromatographie.................................................................................. 164 20.3 Einteilung nach dem Chromatographie-Aufbau ......................................165 20.3.1 Flachbettchromatographie ................................................................165 20.3.2 Säulen-Chromatographie ..................................................................165 20.4 Einteilung nach dem Trennungsziel .....................................................165 20.4.1 Analytische Chromatographie ...........................................................165 20.4.2 Präparative Chromatographie ...........................................................165 20.5 Einteilung nach den verwendeten Phasen............................................... 166 20.5.1 Flüssigkeitschromatographie ........................................................... 166 20.5.2 Gaschromatographie ........................................................................ 166 20.6 Einteilung nach den Trennmechanismen.............................................167 20.6.1 Allgemeines Trennprinzip der Säulenchromatographie...................167 20.6.2 Gelfiltrations-Chromatographie (Trennung durch „Molekül-Sieb“)168 20.6.3 Trennung durch Adsorption............................................................. 168 20.6.4 Trennung durch Verteilung .............................................................. 169 20.6.5 Ionen-Austausch-Chromatographie................................................. 169 20.6.6 Affinitäts-Chromatographie ............................................................. 170 20.7 Auswertung der Chromatographie ........................................................... 171 21 Durchflusszytometrie .......................................................................................172 21.1 Streulichtmessung.....................................................................................172 21.2 Fluoreszenzmessung .................................................................................173 21.3 Gaten .........................................................................................................173 21.4 Cell sorter ..................................................................................................174 22 Röntgenstrukturanalyse ...............................................................................175 22.1 Aufbau .......................................................................................................175 22.2 Streuung ....................................................................................................176 22.3 Beugung.....................................................................................................176 23 Populationsdynamik ..................................................................................... 177 23.1 Modellbegriff............................................................................................. 177 23.1.1 Strukturelle Abstraktion (Qualitatives Wissen)................................ 177 23.1.2 Phänomenologische Abstraktion (Quantitatives Wissen) ................ 177 23.1.3 Modellanwendung ............................................................................. 177 23.1.4 Struktur des Modellansatzes .............................................................178 23.1.5 Kompartment-Modelle ......................................................................178 23.1.6 Zustandsgröße ...................................................................................179 23.2 Wachstumsmodelle...................................................................................179 24 Pharmakokinetik...........................................................................................181 24.1 Aufgabe......................................................................................................181 24.2 Grundbegriffe ........................................................................................... 182 24.3 Evasions-Ordnungen ............................................................................... 183 24.3.1 Evasion 1. Ordnung........................................................................... 183 24.3.2 Evasion 0. Ordnung.......................................................................... 184 24.4 Parameter der Pharmakokinetik ............................................................. 185 209/210 24.4.1 Biologische Halbwertszeit ................................................................ 185 24.4.2 Scheinbares Verteilungsvolumen ..................................................... 186 24.4.3 Clearance........................................................................................... 186 24.4.4 Beispiel für die Bestimmung pharmakokinetischer Parameter ...... 186 24.5 Funktionsverläufe im Ein-Kompartment-Modell ....................................187 24.5.1 Dauerinfusion ....................................................................................187 24.6 Injektion (Kurzzeitinfusion) .................................................................... 188 24.6.1 Orale Applikation.............................................................................. 188 25 Blut- und Atmungskreislauf ........................................................................ 190 25.1 Gefäßsystem ............................................................................................. 190 25.2 Hydrostatische Indifferenzebene.............................................................. 191 25.3 Druckverlauf im Blutkreislauf .................................................................. 191 25.4 Windkesselfunktion ................................................................................. 193 25.5 Auskultatorische Blutdruckmessung....................................................... 194 25.6 Viskosität des Blutes .................................................................................195 25.7 Fahraeus-Lindquist Effekt ....................................................................... 196 25.8 Gastransport im Körper ........................................................................... 198 25.9 Gasaustausch............................................................................................ 199 25.10 Compliance ...........................................................................................200 25.11 Surfactant ............................................................................................. 201 25.12 Atemvorgang ........................................................................................202 25.13 Bestimmung des Atemvolumens..........................................................203 25.13.1 Pneumotachograph/Spirometrie..................................................203 25.13.2 Ganzkörperplethysmograph .........................................................203 210/210