P33
Werbung

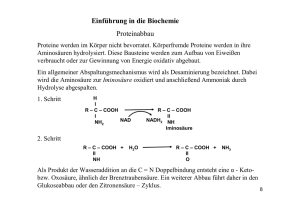
Zeitaufgelöste Lumineszenzuntersuchung von Eu3+ in Komplexen mit aliphatischen und aromatischen Carbonsäuren Bettina Marmodée1, Stefanie Kuke1, Michael U. Kumke1, Joost de Klerk2, Freek Ariese2 5G 5D 5L 4 6 5D 3 5D 2 5D 1 5D 0 660 μs 5 100 90 600 Erwartetes Verhalten, berechnet nach (1) 500 408 μs 400 300 296 μs 232 μs 200 100 111 μs 124 μs 0 140 μs 190 μs 162 μs 2 80 4 6 8 10 Zahl der verdrängten H2O-Moleküle 7F J λEmission = 592 nm λEmission = 616 nm λAnregung = 320 nm 0,2 0,4 d = 1,07 ms ⋅ -1 600 400 0,8 1,0 1 τH O − 0,62 (1) d - Zahl der am Eu3+ verbleibenden H2O-Moleküle (aus [5]) Befund: Absinken der Lebenszeit bis auf ~50 μs !! aliphatische und aromatische (Hydroxy)carbonsäuren Emissionswellenlänge [nm] im Wasser gelöster Sauerstoff entfernt 80 5 Lebenszeit des D0-Zustandes [μs] 90 OH OCH3 3-Hydroxy- 4-Hydroxy- 3-Methoxy- 4-Methoxy- Phthalsäure benzoesäure benzoesäure Benzoesäure benzoesäure (PHS) (3MB) (4MB) (4HB) (3HB) SalicylSäure (2HB) 70 586 587 588 590 50 0,10 0,15 0,20 0,25 0,30 0,35 Molenbruch 2HB Abb. 5 Lebenszeitmessung der Eu3+-Lumineszenz in Eu3+-Salicylat-Mischungen Entfernung des im Wasser gelösten Sauerstoffs mittels „pump and freeze“-Technik Æ Anzeichen für einen Sauerstoffeinfluss! COOH Glutarsäure (GS) Abb. 2 Modellliganden zur Untersuchung der Eu3+-Huminstoff- Wechselwirkung wässrige Probelösungen, 0,1M an NaClO4 pH = 5±0,1 Æ Carboxylgruppe deprotoniert 3. Lebenszeit des CT – Zustände werden als mögliche Wege zur alternativen Deaktivierung des 5L6-Zustandes des Eu3+-Ions oder eines angeregten Zustandes des Liganden in Betracht gezogen [6, 7]. S1 (34000 - 40000 cm 5L T1 (~26500 cm-1) 395 nm direkte Anregung des Eu Extinktion 0.25 5 ( L6 251 nm 7 Lumineszenz Absorption 0.30 3+ F0 - Übergang) 286 nm 0.15 317 nm ~ 579 nm 3+ direkte Anregung des Eu 5 7 ( D0 F0 -Übergang) 0.10 0.05 250 300 350 400 450 500 550 600 Ligand 380 1 Universität 2 Potsdam, Institut für Chemie (Physikalische Chemie), Karl - Liebknecht - Str. 24-25, 14476 Potsdam – Golm (email: [email protected]) Vrije Universiteit Amsterdam, Faculty of Science (ACAS), de Boelelaan 1083, 1081 HV Amsterdam 7 F1-2 360 6 (25400 5D 3 (24400 cm -1) 5D 2 (21500 cm -1) 5D 1 (19000 cm -1) 5D 0 (17250 cm-1) 7 F1-1 17240 17245 17250 400 Gl. (3) 17235 Eu3+ 17260 (a) 17265 450 Spezies c Spezies b 350 Abb.6 Lage der CT-Zustände im Energieniveauschema von Eu3+-Komplexen nach [6] 17255 500 Spezies a (b) 17240 17245 17250 17255 17260 17265 -1 Anregungsenergie [cm ] Abb. 9 a) Stark- Niveaus des 7F1- Multipletts einer Eu3+: Ligand = 1:2 – Mischung, erhalten aus den Intensitätsmaxima der Konturdarstellung. Auf der y-Achse ist ΔE (Differenz zur Anregungsenergie) dargestellt. b) Die y-Achse zeigt hier den Kristallfeldstärkeparameter Nν, berechnet aus ΔEMAX (Energiedifferenz zwischen 7F1-1 und 7F1-3 für die niedrigste bzw. die höchste Anregungsenergie einer Spezies) nach Gl. (3). Auswertung der Absorptionsspektren ergab keinen Aufschluss über die Existenz von CT-Zuständen Anregungsexperimente sowie die Aufnahme transienter Absorptionsspektren sind in Arbeit Wellenlänge [nm] Abb. 3 Absorptionsspektrum von 0,1 M EuCl3.6H2O (in 0,1 M NaClO4) F1-3 ΔEMAX 300 17235 cm -1) 6 5 4 7F J 3 2 1 0 S0 0.20 400 320 -1) 3.1 Direkte und indirekte Anregung von Eu3+ Wellenlängenbereich der indirekten Anregung 7 420 340 ET 0.35 (2) 440 CT-Zustand (Eu2+) 5D -Zustandes (Untersuchung bei RT) 0 (E A ) − E A Beteiligung von Charge-Transfer- (CT) - Zuständen ? -1 B ΔE [cm ] HOOC COOH 1-3 592 1−n 3-Hydroxypropionsäure (3HP) 1-2 7F -1 Glycolsäure (GL) 7F Abb. 8 Totales Spektrum von Eu:4HB = 3:1 (Aufnahme von Emissionsspektren für die 588 Anregungswellenlängen 578,8 nm bis 580,3 nm). Gezeigt ist die Zerlegung des 7F – Multipletts des 1 590 Eu3+ - Emissionsspektrums in Teilmatrizen anhand der einzelnen Banden 591 ΔE = E 7 F HO 1-1 Teilmatrizen: Zuordnung der Emissionsenergie E7F maximaler 1-1 Intensität zu jeder Anregungsenergie EA Korrektur der Emissionsenergie um Anregungsenergie (Berechnung von ΔE nach Gl.2 (vgl. Abb. 9a) und Berechnung der höchsten und niedrigsten Energieaufspaltung ΔEmax jeder Spezies Berechnung des Ligandenfeldstärkeparameters Nν(B2q) für die errechneten ΔEmax nach Gl. 3 [8] (vgl. Abb. 9b) Nν(B2q) [cm ] COOH 7F 589 Aliphatisch HO Spezies b 592 60 COOH OCH3 580.2 50000 COOH OH 580.0 584 Spezies a 586 100 COOH COOH 579.8 40000 COOH 579.6 30000 COOH 579.4 0 110 579.2 20000 579.0 10000 COOH OH 17280 Anregungswellenlänge [nm] 0 578.8 584 585 Aromatisch: 17270 40000 120 2.2 Modellliganden 17260 Bestätigung der Bildung von Komplexen (Symmetrieverringerung und stärkere Beeinflussung der f-Orbitale im Vergleich zu H2O als Ligand) allein die 1. Koordinationssphäre ist für die Komplexbildung relevant (aliphatische und aromatische Säuren zeigen nur kleine Unterschiede) Salicylsäure (Chelatbildner) hebt sich deutlich ab (Symmetrie: C2v) Phthalsäure (ebenfalls prädestiniert zur Chelatbildung) zeigt kein hervorstechendes Verhalten Æ nur Sechsringchelate sind so stabil, dass sich auch Komplexe höherer Ordnung bilden können 50000 Löschung des angeregten Liganden durch Sauerstoff ? A Aufspaltung der (2S+1)LJ – Terme in höchstens 2J+1Mj – Niveaus durch Ligandenfeld (STARK – Aufspaltung) 5D0 - und 7F0 – Niveau nicht entartet [2] Æ mehrere Banden/Linien im 5D 7F – Anregungsspektrum repräsentieren mehrere Komplexe [4] 0 0 Verdrängung von Wasser als Ligand Æ Verringerung der Löschung der 5D0-Lumineszenz durch OH-Oszillatoren [3, 4] 17250 Anregungsenergie [cm ] „Mikado“-Plot der 1:3 Eu3+-Ligand-Mischungsverhältnisse aller untersuchten Liganden 4.230000 Warum „Mikado“plots? – Reduktion von Totalen Spektren 20000 10000 auf 2D-Darstellungen Mögliche Ursachen: Abb. 1 Termschema des freien Eu3+ -Ions (a) und Termaufspaltung im Ligandenfeld (b) nach [3] Im Ligandenfeld: . EuCl3 6H2O (s) Wasser 200 Schlussfolgerungen: 0,6 2 STARK - Niveaus (b) 800 -1 MJ = 3 MJ = 2 MJ = 1 7F 0 1000 Abb. 7 7F 2 Terme J-Aufspaltung (Spin-Bahn(Interelektronische Kopplung) Abstoßung) Salicylsäure 1200 17240 60 0 7F 1 1400 0 0,0 j = 0-6 4.1. Ergebnisse 70 Molenbruch 3HB Abb. 4 Vergleich des gefundenen mit dem erwarteten Verhalten der 5D0-Lebenszeit von Eu3+-Komplexen bei Erhöhung der relativen Ligandenkonzentration 4f6 (a) 700 110 50 5D 1,8.10-4 cm-1 Elektronenkonfiguration 120 5 5L 4f5 5d Energie Energie 2.1 Termschema des Eu3+-Ions Nach [5] wird bei Erhöhung der relativen Ligandenkonzentration und damit der Komplexbildung eine Erhöhung der Eu3+-Lebenszeit (τH2O = (100±10) μs [3]) entsprechend Gl. (1) erwartet, sowohl bei direkter als auch bei indirekter Anregung von Eu3+. 4. Tieftemperaturlumineszenzmessung (4,5 K) „Fluorescence Line-Narrowing“- Spektroskopie Ligandenfeldstärkeparameter Nν(B2q) [cm ] 2. Eu3+ in Komplexen 3.2 Einfluss der Komplexierung von Eu3+ auf die Lebenszeit des 5D0-Zustands Lebenszeit des D0-Zustands [μs] Für Transport und (Im)mobilisierung von Schwermetallen und Radionukliden in Boden und (Grund)wasser (Deponien, Endlagerstätten, Altlasten) sind zu einem wesentlichen Teil Huminstoffe (HS) verantwortlich. Vor diesem Hintergrund ist die Charakterisierung der Art und Eigenschaften der Bindungsstellen in HS für eine zuverlässige Modellierung ihres Transportverhaltens unerlässlich. Auf Grund seines vielen anderen Metallen (z.B. Actiniden) ähnlichen Komplexierungsverhaltens und des starken Einflusses der „molekularen Umgebung“ auf seine spektroskopischen Eigenschaften, bietet sich die Verwendung von Europium(III) als Lumineszenzsonde an [1, 2]. Lebenszeit des D0-Zustands [μs] 1. Einleitung N v ( B2 q ) = π (2 + α 2 ) 0,3 ΔE (3) α= Eb − E 0 ΔE / 2 Eb – durchschnittl. Energie von 7F1 E0 – Energie des „mittleren“ STARK - Niveaus Æ Untersuchung der Lage möglicher CT-Zustände [1] Richardson, F.S. Chemical Reviews 82 (1982), S. 541 – 552 [2] Kap.155 in: Görller-Walrand, C.; Binnemans, K.: Handbook Of Physics And Chemistry of Rare Earths Bd. 23, Elsevier Science BV, 1996 [3] Kap. 7 in: Bünzli, J.-C. G. Lanthanide Probes In Life, Chemical And Earth Science, Elsevier Science BV, 1989, S. 219 - 293 [4] Shin, H. S.; Choppin, G. R. Radiochimica Acta 86 (1999) S. 167 – 174 [5] Kap. 216 in: I.Billard: Handbook on the Physics and Chemistry of Rare Earths Bd. 33, eds. K. A. Gschneidner, Jr., Bünzli, J.-C. G., Pecharsky, V.K., Elsevier Science BV, 2003 [6] Alpha, B.; Ballardini, R.; Balzani, V.; Lehn, J.-M.; Perathoner, S.; Sabbatini, N.; Photochem. Photobiol. 52 (1990), S.299-306 [7]Liu, G. K.; Jensen, M. P.; Almond, P. M. The Journal of Physical Chemistry A 110 (2006), Nr. 6, S. 2081 - 2088 [8] Lavín, V.; Babu, P.; Jayasankar, C. K.; Martín, I. R.; Rodríguez, V. D. Journal of Chemical Physics 115 (2001), Nr. 23, S. 10935 - 10944 Danksagung: Wir danken Professor Cees Gooijer (VU Amsterdam), der es ermöglichte, die Ultratieftemperaturmessungen am LASER CENTRE der Freien Universität Amsterdam durchzuführen. Das Forschungsvorhaben wurde vom Bundesministerium für Wirtschaft und Technologie (BMWi) in Zusammenarbeit mit dem Projektträger Wassertechnologie und Entsorgung, Forschungszentrum Karlsruhe gefördert.