Terminale Herzinsuffizienz: Was können implantierbare Systeme
Werbung
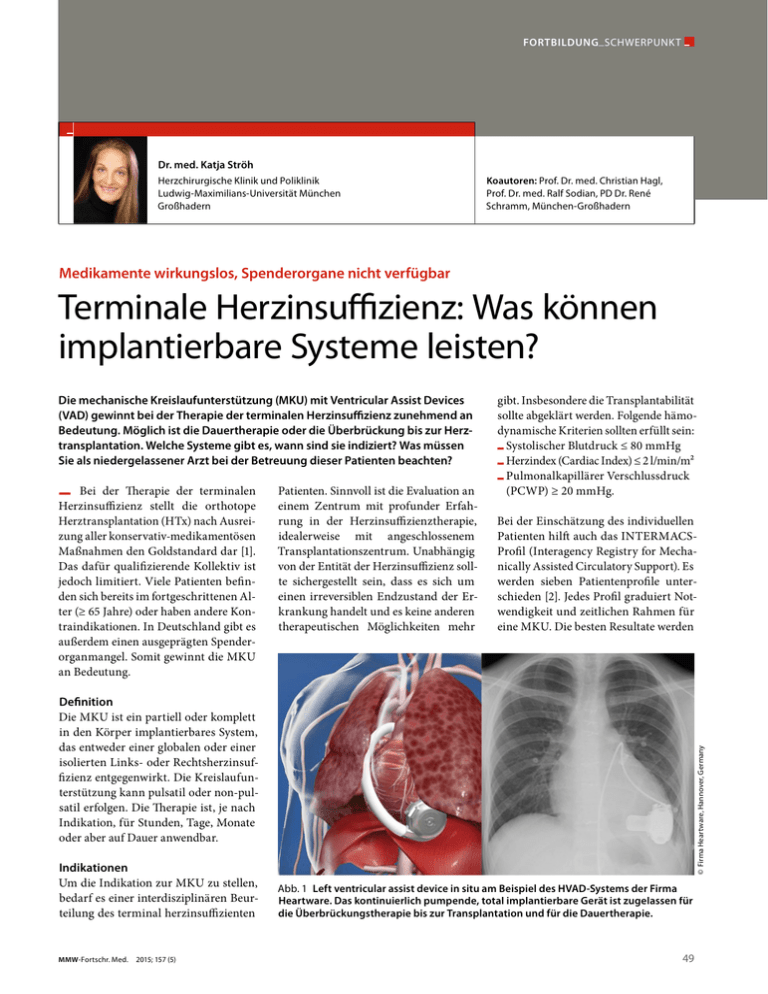
FORTBILDUNG _ SCHWERPUNKT Dr. med. Katja Ströh Herzchirurgische Klinik und Poliklinik Ludwig-Maximilians-Universität München Großhadern Koautoren: Prof. Dr. med. Christian Hagl, Prof. Dr. med. Ralf Sodian, PD Dr. René Schramm, München-Großhadern Medikamente wirkungslos, Spenderorgane nicht verfügbar Terminale Herzinsuffizienz: Was können implantierbare Systeme leisten? Die mechanische Kreislaufunterstützung (MKU) mit Ventricular Assist Devices (VAD) gewinnt bei der Therapie der terminalen Herzinsuffizienz zunehmend an Bedeutung. Möglich ist die Dauertherapie oder die Überbrückung bis zur Herztransplantation. Welche Systeme gibt es, wann sind sie indiziert? Was müssen Sie als niedergelassener Arzt bei der Betreuung dieser Patienten beachten? − Bei der Therapie der terminalen Herzinsuffizienz stellt die orthotope Herztransplantation (HTx) nach Ausreizung aller konservativ-medikamentösen Maßnahmen den Goldstandard dar [1]. Das dafür qualifizierende Kollektiv ist jedoch limitiert. Viele Patienten befinden sich bereits im fortgeschrittenen Alter (≥ 65 Jahre) oder haben andere Kontraindikationen. In Deutschland gibt es außerdem einen ausgeprägten Spenderorganmangel. Somit gewinnt die MKU an Bedeutung. Patienten. Sinnvoll ist die Evaluation an einem Zentrum mit profunder Erfahrung in der Herzinsuffizienztherapie, idealerweise mit angeschlossenem Transplantationszentrum. Unabhängig von der Entität der Herzinsuffizienz sollte sichergestellt sein, dass es sich um einen irreversiblen Endzustand der Erkrankung handelt und es keine anderen therapeutischen Möglichkeiten mehr gibt. Insbesondere die Transplantabilität sollte abgeklärt werden. Folgende hämodynamische Kriterien sollten erfüllt sein: Systolischer Blutdruck ≤ 80 mmHg Herzindex (Cardiac Index) ≤ 2 l/min/m² Pulmonalkapillärer Verschlussdruck (PCWP) ≥ 20 mmHg. −−− Bei der Einschätzung des individuellen Patienten hilft auch das INTERMACSProfi l (Interagency Registry for Mechanically Assisted Circulatory Support). Es werden sieben Patientenprofi le unterschieden [2]. Jedes Profi l graduiert Notwendigkeit und zeitlichen Rahmen für eine MKU. Die besten Resultate werden Indikationen Um die Indikation zur MKU zu stellen, bedarf es einer interdisziplinären Beurteilung des terminal herzinsuffizienten MMW-Fortschr. Med. 2015; 157 (5) © Firma Heartware, Hannover, Germany Definition Die MKU ist ein partiell oder komplett in den Körper implantierbares System, das entweder einer globalen oder einer isolierten Links- oder Rechtsherzinsuffizienz entgegenwirkt. Die Kreislaufunterstützung kann pulsatil oder non-pulsatil erfolgen. Die Therapie ist, je nach Indikation, für Stunden, Tage, Monate oder aber auf Dauer anwendbar. Abb. 1 Left ventricular assist device in situ am Beispiel des HVAD-Systems der Firma Heartware. Das kontinuierlich pumpende, total implantierbare Gerät ist zugelassen für die Überbrückungstherapie bis zur Transplantation und für die Dauertherapie. 49 FORTBILDUNG _ SCHWERPUNKT Tabelle 1 Systeme zur mechanischen Kreislaufunterstützung (MKU) Betriebsart Implantationsmodus Therapiedauer Unterstützung LV IABP pulsatil intrakorporal Stunden bis Tage Impella Abiomed ECLS non-pulsatil intrakorporal Stunden bis Tage non-pulsatil parakorporal Stunden bis Tage Berlin Heart Excor/Thoratec PVAD pulsatil parakorporal Tage bis Monate (Jahre) + Heartware HVAD non-pulsatil intrakorporal Jahre (BTT, DT) + Heartmate II non-pulsatil intrakorporal Jahre (BTT, DT) + Total artificial Heart (SynCardia) pulsatil intrakorporal Wochen bis Monate (BTT) RV BV + + + + (+) (+) + IABP = intraatriale Ballonpumpe; ECLS = extracorporeal life support; BTT = bridge-to-transplantation, DT = destination therapy, LV = links-, --, RV = rechts--, BV = biventrikulär bei Patienten erzielt, die elektiv eine MKU erhalten. Patienten mit kardiogenem Schock (INTERMACS-Level 1–2) oder einer irreversiblen Endorganschädigung (terminale Niereninsuffizienz, Leberfunktionsstörung) qualifizieren meist nicht mehr für diese Therapie. © Herzchirurgische Klinik und Poliklinik der Univ. München (LMU) Welche Systeme gibt es? Die MKUs werden unterschiedlich kategorisiert. Dabei werden Links- und Rechtsherzfunktion isoliert betrachtet. So braucht ein Patient mit Z. n. Vorderwandinfarkt und hochgradig eingeschränkter linksventrikulärer Funktion bei erhaltener rechtsventrikulärer Funktion eine isolierte Unterstützung des linken Ventrikels (sog. left ventricular assist device [LVAD]). Bei fortgeschrittener dilatativer Kardiomyopathie mit höhergradiger LV- und RV-Funktionseinschränkung ist dagegen die Unterstützung beider Ventrikel notwendig (sog. biventricular assist device [BVAD]). Selten ist die isolierte rechtsventrikuläre Funktionseinschränkung, bei der die Implantation eines right ventricular assist device (RVAD) möglich ist. Zeitraum und Ziel der Unterstützung Wichtige temporäre Systeme sind die intraatriale Ballonpumpe (IABP) oder der Extracorporeal life support (ECLS). Sie dienen zur Unterstützung der Herzfunktion bis zur Erholung (bridge-to-recovery, BTR) oder erlauben eine weitere Diagnostik bis zur Therapieentscheidung (bridge-to-decision, BTD). Hier gibt es mittlerweile auch Systeme, die durch eine nur partielle Unterstützung eine temporäre Entlastung des Herzens ermöglichen (bis 2,5 l/Min.) und über die A. femoralis bis in den linken Ventrikel vorgeschoben werden (Impella® 2.5). Für längere Therapieintervalle (bridge-to-transplantation, BTT) oder die endgültige Therapie (destination therapy, DT) stehen heute z. B. das HVADSystem der Firma Heartware® oder das Thoratec HeartMate II® zur Verfügung. Die beiden letztgenannten sind komplett implantierbare zentrifugale bzw. axiale Hochleistungspumpen (Abb. 1), die den Kreislauf langfristig unterstützen. Intra- und parakorporale Systeme Abb. 2 Parakorporale pulsatile Assist Device zur Unterstützung des linken Ventrikels am Beispiel des Berlin Heart Excor. 50 Den total intrakorporalen stehen die parakorporalen Systeme gegenüber, z. B. das Berlin Heart Excor®. Dabei befinden sich die eigentlichen Pumpkammern außerhalb des Körpers; Ab- und Zuflusskanülen führen durch die Thoraxwand nach intrakardial/intravaskulär (Abb. 2). Diese Systeme finden aktuell noch in der Kinderherzchirurgie Verwendung, da die verfügbaren intrakorporalen Systeme zu groß sind. Unterschieden werden pulsatile vs. non-pulsatile Herzunterstützungssysteme. Versuchte man anfänglich, die Pulsatilität des Herzens nachzuahmen, werden seit 2010 fast ausschließlich Geräte mit kontinuierlichem Fluss implantiert (> 95%). Die Pulslosigkeit hat zwar Effekte, das Überleben ist jedoch signifi kant besser und schwerwiegende Nebenwirkungen sind im Vergleich zu pulsatilen Systemen deutlich reduziert [3]. Tab. 1 gibt einen Überblick über aktuell verwendete MKU-Systeme. Kontraindikationen Die Internationale Gesellschaft für Herzund Lungentransplantation (ISHLT) hat 2013 Richtlinien für die Implantation von Assist Devices erarbeitet [4], die auch absolute und relative Kontraindikationen enthalten (Tab. 2). Intrakorporale linksventrikuläre non-pulsatile Systeme Die intrakorporalen non-pulsatilen Unterstützungssysteme Thoratec Heartmate II® und Heartware HVAD® sind seit 2010 die führenden Systeme weltweit. Sie werden als linksventrikuläre MKU verwendet. Beide Systeme besitzen die Zulassung als LVAD für BTT und DT. MMW-Fortschr. Med. 2015; 157 (5) FORTBILDUNG _ SCHWERPUNKT Auch die Herzchirurgische Klinik und Poliklinik der Universität München implantiert seit 2011 das HVAD-System. Im Folgenden wird auf die Bestandteile (s. Kasten unten), die Implantationstechnik, die postoperative medikamentöse Therapie und wichtige Komplikationen dieses Systems eingegangen. Implantationstechnik und operative Zugangswege Aufgrund der relativ kleinen Pumpenkopfgröße des Heartware-Systems ist eine komplett intraperikardiale Implantation möglich. Der Standardzugangsweg stellt die mediane Sternotomie dar. Die Implantation erfolgt unter Zuhilfenahme der Herz-Lungen-Maschine (HLM) oder unter laufender ECLS. In Einzelfällen wird die Implantation auch ganz ohne Unterstützung durchgeführt. Das Herz wird aus dem Perikard herausluxiert, sodass der Apex cordis freiliegt. Zur Festlegung der Implantationsstelle des Pumpenkopfes erfolgt die Identifikation der Left anterior descending (LAD) und des Interventrikularseptums. Ein Nahtring wird am Apex cordis fixiert. Dann erfolgt das Ausstanzen des Myokards innerhalb des Ringes. Die Einflusskanüle des Pumpenkopfes wird durch den entstandenen Defekt in den linken Tabelle 2 Kontraindikationen bei der VAD-Implantation Relative Kontraindikationen − − − − − − Akuter Myokardinfarkt Akute Bakteriämien Mechan. Aortenklappenersatz (Austausch mit biolog. Prothese während Implantation MKU) Adipositas (BMI ≥ 30) Eingeschränkte Compliance Fehlende soziale Integration (fehlende Pflegende/Versorgende) Absolute Kontraindikationen − − − − − − − − − Sepsis, akute Endokarditis, infizierter Schrittmacher/ICD Multiorganversagen Terminale Niereninsuffizienz Fortgeschrittene PAVK Demenz, psychiatrische Erkrankungen Suchterkrankungen (Alkohol, Drogen) Neuromuskuläre Erkrankungen Unbehandelte Tumorerkrankung, Tumorerkrankung mit Lebenserwartung ≤ 2 Jahre Diabetes mellitus mit fortgeschrittener Retino-, Nephro- oder Neuropathie Ventrikel geschoben und mittels Schraube fest mit dem Nahtring verbunden. Das Herz wird zurück in das Perikard luxiert und die Länge der Ausflussprothese bis zur Aorta ascendens ausgemessen. Es erfolgt eine Anastomose zwischen Aorta ascendens und der Ausflussprothese des LVADs. Nach Entlüftung des Systems wird die Pumpe gestartet. Alternativ zur medianen Sternotomie werden zunehmend auch minimalinvasive Techniken genutzt: die limitierte anterolaterale Thorakotomie links (ca. 5–7 cm Schnittlänge) oder eine Kombination aus anterolateraler Thorakotomie links und partieller oberer Sternotomie. Postoperative Betreuung Antikoagulation Um thrombembolische Komplikationen zu vermeiden, sind Patienten mit VADs zwingend auf eine suffiziente Antikoagulation angewiesen. Direkt postoperativ Pumpe, Batterien, Monitor etc. Das HVAD-Sytem besteht aus einem 160 g schweren Pumpenkopf (1) mit Einflusskanüle (2), die in den Apex cordis eingeführt wird, und dem Rotor, Rotor der das Blut beschleunigt. Die Pumpe ist mit zwei Motoren ausgestattet (einer als Sicherungsredundanz) und kann bis zu 10 l Blut/Minute fördern. Das Blut wird von der Pumpe durch die Ausflusskanüle (3), einer flexiblen 10 mm-Polyester-Rohrprothese mit Knickschutz, in die Aorta ascendens weitergeleitet. Zur Stromversorgung dient die sog. Drive-Line (4): Ein Stromkabel, das die implantierte Pumpe mit der extrakorporalen Steuereinheit (5) und zwei Batterien (6) mit zwölf Stunden Laufzeit verbindet. Das System kann außerdem an die Steckdose oder den Zigarettenanzünder im Auto angeschlossen werden. Die Ausleitung des Stromkabels auf Hautniveau befindet sich bei einem LVAD oberhalb der Spina iliaca anterior superior links, bei einem RVAD rechts. An der Steuereinheit befindet sich ein Display, das kontinuierlich Systemparameter (Fluss, Umdrehungen, Wattverbrauch) und Alarme anzeigt. An die Steuereinheit kann das implantierende Zentrum einen Monitor anschließen (7), um Systemparameter zu mo- MMW-Fortschr. Med. 2015; 157 (5) © Firma Heartware, Hannover, Germany Bestandteile des HVAD-Systems difizieren oder die Alarmhistorie abzufragen. Die Steuereinheit und die Batterien werden vom Patienten in einer Umhängetasche oder einem Spezialgürtel getragen (Gewicht ca. 1,5 kg). Das MVADSystem (8) wird noch kleiner als das aktuelle HVAD-System sein (9). 51 FORTBILDUNG _ SCHWERPUNKT Ausblick Die Systeme werden kleiner und leichter 2015 und 2016 werden voraussichtlich zwei neue intrakorporal non-pulsatile Systeme eingeführt. Für das Thoratec Heartmate III® wurde die CE-Zulassungsstudie bereits gestartet. Der Nachfolger des Heartmate II® ist kleiner und nun komplett intraperikardial implantierbar. Der Nachfolger des Heartware HVAD, das Heartware MVAD® (s. Kasten S. 51), wird das bisher kleinste verfügbare System sein. Das macht es auch für die Kinderherzchirurgie interessant. Weiterentwickelt wurden auch die Steuereinheit und die Batterien. Dadurch reduziert sich das Gesamtgewicht von ca. 1,5 kg auf 800 g, was sich entscheidend auf die Lebensqualität der Patienten auswirken wird. Für das Jahr 2015 sind außerdem Zulassungsstudien für das Heartware HVAD als RVAD und BVAD geplant. Bisher kann das System nur im Off-label-use verwendet werden. Verbesserte Ergebnisse werden auch durch eine sorgfältigere und frühzeitigere Evaluation von terminal herzinsuffizienten Patienten erwartet. Die Todesursachen nach Implantation einer non-pulsatilen VAD zeigen einen unterschiedlichen zeitlichen Verlauf: Stellt die Gerätefehlfunktion ein gleichbleibendes, jedoch verhältnismäßig niedriges Risiko dar, ist das Risiko, an Rechtsherzversagen, Infektion, Blutung und Multiorganversagen zu versterben, direkt postoperativ am höchsten. Drei Monate nach Implantation stellen neurologische Komplikationen den größten Risikofaktor für das 1-Jahres-Überleben dar. Literatur unter mmw.de Für die Verfasser: wird mit Heparin (pTT 60 Sek.) behandelt und im Verlauf auf eine orale Antikoagulation mit Marcumar (Ziel-INR 2–3) umgestellt. Zusätzlich erfolgt eine einfache Thrombozytenaggregationshemmung mit 100 mg ASS täglich. Für operative Eingriffe ist die Umstellung von Marcumar auf Heparin notwendig. Fällt der INR-Wert auf Werte < 2, ist eine überbrückende Heparinisierung notwendig; hier ist auch die gewichtsadaptierte Therapie mit niedermolekularem Heparin möglich. Die sog. direkten oder neuen oralen Antikoagulanzien sind für Assist Devices nicht zugelassen. Blutdruckeinstellung Nach VAD-Implantation ist die Einstellung des Blutdruckes zur Optimierung der Gerätefunktion und Vermeidung hämorrhagischer Apoplexien wichtig (Ziel-MAD [mittlerer arterieller Druck] < 90 mmHg). Die Blutdruckmessung kann nach LVAD-Implantation nur mittels Stabdoppler erfolgen, da die Patienten komplett oder teilweise pulslos sind. Antiarrhythmische Therapie und ICD Viele Patienten erhalten postoperativ eine antiarrhythmische Therapie zur Vermeidung von ventrikulären Tachykardien (VTs). Bei allen LVAD-Patienten sollte – falls nicht bereits im Vorfeld geschehen – ein implantierbarer Cardioverter-Defibrillator (ICD) erwogen werden. Wichtige Komplikationen Infektionen an der Hautaustrittsstelle der Drive-Line, intrazerebrale und gas- 52 trointestinale Blutungen aufgrund der Antikoagulation, postoperativ akutes oder protrahiertes Rechtsherzversagen und thrombembolische Ereignisse (Apoplexien, Embolien, Pumpenthrombose) sind die bedeutendsten Komplikationen nach VAD-Implantation. In der Nachsorge muss an sie gedacht werden. Ergebnisse bei VAD-Therapie Das INTERMACS-Register ist die bedeutendste und umfangreichste Datenbank zur Erfassung von Patienten mit VADs. Die Daten von mehr als 12.000 Patienten wurden dort mittlerweile analysiert [5]. Patienten, die eine non-pulsatile intrakorporale LVAD mit dem Ziel einer dauerhaften Unterstützung (DT) erhalten, machen mittlerweile die zahlenstärkste Gruppe aus (41,6%), zu Beginn der Erfassung waren es nur 14,7%. Gegenläufig ist die Entwicklung bei dem Therapieziel BTT. Hier schrumpfte der Anteil von 42,4% in den Jahren 2006 und 2007 auf 21,7% im Jahr 2013. Das 1-Jahres-Überleben mit den nonpulsatilen intrakorporalen LVADs liegt bei 80%, das 2-Jahres-Überleben bei 70%. Bei non-pulsatiler BVAD-Unterstützung ist ein 1-Jahres-Überleben von 60%, ein 2-Jahres-Überleben von 50% zu verzeichnen. Die pulsatilen VADs schneiden beim 1- und 2-Jahres-Überleben sowohl bei den LVADs (75% und 42%) als auch bei den BVADs (54% und 30%) signifikant schlechter ab. Als entscheidende Risikofaktoren für das Überleben wurden die terminale Nierenfunktion und das Rechtsherzversagen ausgemacht. Dr. med. Katja Ströh Herzchirurgische Klinik und Poliklinik Ludwig-Maximilians-Universität München Marchioninistr. 15, D-81377 München E-Mail: [email protected] Implantierbare Systeme bei HF Fazit für die Praxis 1. Es gibt verschiedene Systeme zur mechanischen Kreislaufunterstützung: die aktuell größte Bedeutung haben die intrakorporalen non-pulsatilen linksventrikulären Assist Devices (LVAD). 2. Therapieziele sind die Überbrückung bis zur Erholung der Herzfunktion (bridge-to-recovery), die Überbrückung bis zur Herztransplantation (bridge-to-transplantation) und die definitive Therapie (destination therapy). 3. Bei Indikation zur LVAD-Implantation sollte perioperativ die Implantation eines ICD erwogen werden. 4. Häufige Komplikationen sind Infektionen an der Hautaustrittsstelle der Drive-Line, Blutungsereignisse aufgrund der Antikoagulation, Thrombosen und Embolien bei unzureichender Antikoagulation sowie protrahiertes Rechtsherzversagen. Keywords The treatment of terminal heart failure with implantable ventricular assist devices Terminal heart failure – mechanical circulatory support – ventricular assist device – destination therapy – bridgeto-transplantation MMW-Fortschr. MMW -Fortschr. Med. 2015; 157 (5)