Hinweis
Werbung

Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen
des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das
eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die
Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen
Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html
eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und
Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Philipps-Universität Marburg
Fachbereich Chemie-Lehramt
Experimentalvorträge
Protokoll zum Vortrag
Elektrische Leitfähigkeit Elektrische Leiter
Silvia Kaletsch
Bahnhofstr. 10
35096 Weimar
Chemie in der Schule: www.chids.de
Inhalt
A GRUNDLAGEN
1 DEFINITION "ELEKTRISCHE LEITFÄHIGKEIT"
3
2 LEITER - NICHTLEITER - HALBLEITER
5
V 1 Elektrische Leitfähigkeiten von Kupfer, Schwefel und Silicium
3 DAS ENERGIEBÄNDERMODELL
4 ELEKTRONENLEITER - IONENLEITER
5
6
10
V 2 Wanderung von OH-- und H3 0 +-Iollen im elektrischen Feld
10
V 3 Ladungstransport in Ionenkristallen - Feste Elektrolyte
12
B TECHNISCHE ANWENDUNGEN
V 4 Keramische Leiter: NTC - Widerstand (Heißleiter)
5 ELEKTRISCH LEITFÄHIGE POLYMERE
15
16
V 5 Synthese von Polypyrrol
17
V 6 Demonstration der Leitfähigkeit von Polypyrrol
20
6 HOCHTEMPERATUR - SUPRALEITUNG: KERAMISCHE SUPRALEITER
V 7 Supraleitung - Ideale Leitfähigkeit
LITERATURVERZEICHNIS
22
23
27
2
Chemie in der Schule: www.chids.de
A
Grundlagen
1
Definition "Elektrische Leitfähigkeit"
Die elektrische Leitfähigkeit gehört neben Festigkeit, Verformbarkeit und
Magnetismus zu den wichtigsten Festkörpereigenschaften. [1 7]
Allgemein versteht man unter elektrischer Leitfähigkeit die Eigenschaft bestimmter Stoffe, elektrischen Strom zu leiten. Diese Stoffe bezeichnet man als
elektrische Leiter.
In der Physik ist die elektrische Leitfähigkeit eine exakt definierte physikalische Größe. Um sie besser veranschaulichen zu können, sollen in diesem Zusammenhang noch einmal kurz verschiedene physikalische Größen vorgestellt
werden.[l]
(1)
Der Widerstand Reines stromdurchflossenen Leiters ist der Quotient
aus der angelegten SpannungU und der Stromstärke I. Man mißt den
Widerstand in Ohm.
Es gilt: R = U / 1, ( R]
(2)
112 (Ohm)
=
Der spezifische Widerstand p (eines zylindrischen Leiters) ist das Produkt aus Widerstand R und dem Quotienten A / 1. A ist die Querschnittsfläche, I die Länge des zylindrischen Leiters.
Es gilt: p
=
R· A / I, {pi
=
1 [1. m
Durch die Einführung des Quotienten wird der Widerstand unabhängig
von der Ausdehnung des Leiters: Der spezifische Widerstand ist demnach nur noch eine materialabhängige Größe.
(3)
Unter der elektrischen Leitfähigkeit 'Y versteht man den Kehrwert des
spezifischen Widerstandes.
Es gilt:
r=
J/ p
Somit ist auch die elektrische Leitfähigkeit eine vom Material abhängige Größe.
Hat ein Material also eine hohe elektrische Leitfähigkeit, so ist sein spezifischer Widerstand gering und es fließt (unter konstanten Versuchsbedingungen) bei einer konstanten Stromstärke vergleichsweise viel Strom.
3
Chemie in der Schule: www.chids.de
Abb.1: Elektrische Leitfähigkeiten bestimmter Stoffe [14]
Elektrische
Leitfähigkeit
Anorganische Stoffe
Organische Stoffe
(al. cml)
Metalle
106
Kupfer
Eisen
10 4
Halbleiter
Leitfähige Polymere
10 2
Germanium
10- 2
10-4
10-6
Silicium
Isolatoren
10- 8
10- 10
Glas
10- 12
Diamant
10- 14
10- 16
10- 18
Schwefel
Quarz
Teflon, PVC, Polystyrol
Wie man auf diesem Schaubild erkennen kann, liegen die Werte für die elektrische Leitfähigkeit zwischen 10-18 für einen sehr guten Isolator wie Teflon
und 106 für einen sehr guten Leiter wie Kupfer. Supraleiter zeigen sogar eine
unendlich große Leitfähigkeit. Die elektrische Leitfähigkeit umfaßt damit einen derart weiten Wertebereich wie keine andere Materialeigenschaft. Um
sich dies erklären zu können, ist es notwendig, sich die Vorgänge der Leitung
elektrischen Stroms im atomaren Bereich zu verdeutlichen.
4
Chemie in der Schule: www.chids.de
2
Leiter - Nichtleiter - Halbleiter
V1
Elektrische Leitfähigkeiten von Kupfer, Schwefelund Silicium
Dieser Versuch soll zeigen, welche Elemente in der Lage sind, elektrischen
Strom zu leiten und welche nicht. Untersucht werden Kupfer, Schwefel und
Silicium.
Geräte
Substanzen
1 Voltmeter (Meßbereich 10 V - )
1 Kupfer-Blech
] Amperemeter (Meßbereich 0,3 A)
1 Stück Silicium (Polybruch)
1 Stück Schwefel (vulkanischer Her- 1 Glühbirne (6 V) mit Fassung
1 Trafo (angelegte Spannung: 5 V)
kunft)
3 x 2 Krokodilklemmen (2 x mit, 1 x
ohne Isolierung)
1 Bunsenbrenner
4 Verbindungskabel
2 Plattenstative
6 Doppelmuffen
6 Stativklammern
Versuchsaufbau / Schaltskizze
Probe
Amperemeter
Glühbirne
Trafo (SV-)
Voltmeter
In einem Stromkreis sind ein Amperemeter, die Probe und eine Glühbirne in
Reihe geschaltet. Parallel dazu geschaltet ist ein Voltmeter, welches die angelegte Spannung mißt. Zur besseren Demonstration werden die drei Proben
untereinander angeordnet jeweils über Krokodilklemme (bei Silicium ohne
Isolierung), Doppelmuffe und Stativklammer rechts und links an einem Plat5
Chemie in der Schule: www.chids.de
tenstativ befestigt, so daß bei der Versuchsdurchführung nur noch die Verbindungskabel umgesteckt werden müssen.
Versuchsdurchjührung
Man legt eine Spannung von 5 V an. Ist der Stoff in der Lage den elektrischen Strom zu leiten, so sollte das Amperemeter einen Zeigerausschlag zeigen und das Glühbirnchen aufleuchten.
Versuchsauswertung
Kupfer leitet elektrischen Strom, da sowohl ein Zeigerausschlag zu sehen ist
als auch die Glühbirne hell aufleuchtet. Bei Schwefel kann man weder Zeigerausschlag, noch ein Aufleuchten der Glühbirne beobachten: Schwefel ist
ein Isolator. Bei Raumtemperatur zeigt auch Silicium keine Leitfähigkeit. [11 ]
Erhitzt man jedoch mit dem Bunsenbrenner, so zeigt das Aufleuchten der
Glühbirne und der Zeigerausschlag des Amperemeters einen Stromfluß an.
Wie läßt sich dies auf atomarer Ebene erklären?
3
Das Energiebändermodell
Zur Erklärung dieses Phänomens wurde das Energiebändermodell entwickelt:
Zunächst stellt man sich vor, daß ein Metallkristall aus vielen einzelnen Metallatomen gebildet WÜrde. Nähern sich die Metallatome einander an, so treten
zwischen den energetisch äquivalenten Atomorbitalen der einzelnen Atome
Wechselwirkungen auf. Aus den energetisch äquivalenten Atomorbitalen entstehen im Metallkristall ebenso viele Molekülorbitale[ 15]. Da das PauliPrinzip nun nicht mehr für das einzelne Atom, sondern für den gesamten
Atomverband gilt, ist es zwingend notwendig, daß sich die Molekülorbitale
energetisch voneinander unterscheiden. So entsteht eine dichte Folge von
Energiezuständen, ein sogenanntes Energieband [17].
6
Chemie in der Schule: www.chids.de
Abb . 2 (n . Riedel, 166)
cl
Metalldampf
Metall kristall
En ergie
<:
b)
Äq uivalenle Atomorbitale
der Atom e des Melalldampfes
Energieband des
Metallkrislalls
Abbildung 2.94 a) Au s isolierten At om en eines Met aIJdampfes bildet sich ein MetalIkristall.
b) A ufspaltung von At om o rbitalen zu einem Ene rgieband im Me ta llkrista ll. A us 10 2 0 äqui va20
lent en A to morbita len vo n 10 isolierten Atome n eines Met all dampfes ents teht im festen Me20
tall ein E nergieba nd mit 10 Energiezustände n untersch iedli cher Energie (vg l. Bildung von
Molek ülorbitalen , Abschn. 2.2.12).
Abb . 3 (n. Stroppe, 420 )
w
QI
2p
!!llII!II_-------
~
QI
c:
QI
c:
QI
c:
o
'-
~
QI
Gj
25
~~------~
I
I
I
Krista//atom
Gitterkonstan ie
1s
Einze/atom
Aiomatisiond
Ortskoordinate X
Bild 6.38. Zum Energiebändermodell : a) Aufspaltung der diskreten Energieniveaus isolierter
Atome zu qu asikontinuierlichen Energiebändern im Festkörper; b) Bändermodell
In dem zweiten Sc ha ubild ist der Übergang vo n di skreten E ne rg ie niveaus in
quasiko ntinui erlich e E nergiebänder no chmal darg e st ellt . M an kann dab ei folgendes erkennen:
7
Chemie in der Schule: www.chids.de
Die in Kernnähe sehr stark gebundenen Elektronen ergeben relativ schmale
Bänder, die weiter außen liegenden Valenzelektronen treten stärker miteinander in Wechselwirkung und bilden daher breitere Bänder. Das aus 1sAtomorbitalen gebildete Energieband ist von dem aus 2s-Atomorbitalen gebildeten Energieband durch einen Energiebereich getrennt, in dem keine
Energieniveaus liegen. Man bezeichnet diesen Energiebereich als verbotene
Zone, da für Metallelektronen Energien dieses Bereichs verboten sind . Bei einer starken Aufspaltung von Energiebänder kann es auch zu Überlappungen
zwischen diesen Bändern kommen .
Für die Leitung von elektrischem Strom müssen freie Quantenzustände vorhanden sein , in die die Elektronen bei Zuführung elektrischer Energie gelangen können . Die Elektronen können sich dann quasi frei über den ganzen
Kristall bewegen und damit fließt Strom.
Anwendung des Energiebändermodells auf die im Versuch gezeigten Elemente :
(1) Kupfer
Kupfer hat die Elektronenkonfiguration 3 d 10 4
Si.
Aus den 4 s - Atomorbita-
len wird das Valenzband gebildet. Da das 4 s - Atomorbital eines KupferAtoms nur einfach besetzt ist, ist auch das Valenzband des Kup fers nur zur
Hälfte gefüllt. Ein halb gefülltes Band würde schon ausreichen, um zu erklären, warum Kupfer Strom leitet. Die besonders hohe Leitfähigkeit von Kupfer
erklärt sich jedoch nur dadurch, daß das Valenzband zusätzlich mit dem Leitungsband überlappt, welches aus den 4 p - Atomorbitalen der Kupfer-Atome
gebildet wurde .
Abb . 4: Energiebändermodell für Cu
E
Leitungsband
Überlappungsberieh
Valenzband (halb besetzt)
8
Chemie in der Schule: www.chids.de
(2) Schwefel
Schwefel hat die Elektronenkonfiguration 3 S2 p". Theoretisch müßte Schwefel leitend sein, da das p-Band nicht voll besetzt ist. Dies ist aber nicht der
Fall. Betrachten wir dazu die Struktur eines Schwefel-Moleküls. Schwefel
besteht aus gewinkelt gebauten Schwefel-Ketten oder Molekülen, das heißt,
die bindenden und nichtbindenden Elektronenpaare sind tetraedrisch angeordnet. Daraus kann man folgern, daß bei Schwefel eine Sp3 - Hybridisierung
vorliegt. Es gibt also 4 Hybridorbitale, wovon 2 vollbesetzt und 2 nur mit je
einem Elektron besetzt sind . Durch die Elektronen der benachbarten Schwefel-Atome werden aber auch diese Orbitale gefüllt und daraus resultiert ein
vollständig besetztes Valenzband, das durch eine breite verbotene Zone vom
Leitungsband getrennt ist.
Abb . 5: Energiebändermodell für S
E
[TI
Leitungsband
Verbotene Zone (breit)
Valenzband (voll besetzt)
(3) Silicium
Silicium hat die Elektronenkonfiguration 3 S2 p2. Auch hier liegt eine Sp3Hybridisierung vor. Die vier je einfach besetzten Hybridorbitale werden durch
die benachbarten Si-Atome aufgefüllt . Das Valenzband ist damit auch hier
voll besetzt. Allerdings ist es vom Leitungsband nur durch eine schmale verbotene Zone getrennt. Durch Zufuhr thermischer Energie können Elektronen
ins Leitungsband gelangen, wodurch "Löcher" im Valenzband zurückbleiben.
Sowohl Löcher-, als auch Elektronenleitung tragen zur Leitfähigkeit bei .
Während bei Halbleitern mit zunehmender Temperatur der Widerstand abnimmt , nimmt er bei Metallen zu , da durch Zusammenstöße elektrische Energie in Form von Wärme verlorengeht.
9
Chemie in der Schule: www.chids.de
Abb . 6: Energiebändermodell für Si
E
Leitungsband
Verbotene Zone (schmal)
Valenzband (voll besetzt)
4
Elektronenleiter - Ionenleiter
Man unterscheidet bei der Leitung von elektrischem Strom zwischen Elektronen- und Ionenleitung. Bei Elektronenleitern sind freie oder locker gebundene
Elektronen für die Stromleitung verantwortlich. Bei Ionenleitern, auch Leiter
2. Ordnung genannt, sind Verschiebungen von Ionen für den Stromfluß entscheidend .
V2
Wanderung von OH-- und H30+-Ionen im elektrischen Feld
In diesem Versuch soll ein solcher Ionenleiter vorgestellt werden.[3]
Substanzen
Schwefelsäure, c = 0,05 mol/l
Natronlauge, c = 0,1 molll
10 %-ige Kaliumnitrat-Lösung
Universalindikatorpapier
Haushaltswatte
Geräte
1 Voltmeter (Meßbereich 100 V - )
1 Hochspannungstrafo (angelegte
Spannung 60 V)
4 Verbindungskabel
2 Plattenstative
4 x 50ml-Bechergläser
4 Reagenzgläser
4 Stativklammern
4 Doppelmuffen
1 x 100ml-Erlenmeyerkolben
10
Chemie in der Schule: www.chids.de
Versuchsaufbau / Schaltskizze
Voltmeter
60 V-
Platin-Kathode (-)
Natronlauge
(c
~
Platin- Anode( +)
Schwefelsäure(c
==
0,05 mol/I)
0,1 mol/I)
Watte getränkt mit
10%-iger Kaliumnitratlsg.
+ Mischindikator
Versuchsdurchführung
Man füllt ein V-Rohr möglichst gleichmäßig zu zwei Dritteln mit Watte, die
man nicht zu fest zusammenpreßt. In einem 100ml-Erlenmeyerkolben wird ein
etwa 30 cm langes Band Universalindikatorpapier mit 50 ml 10%-iger Kaliumnitratlösung übergossen und mehrmals geschüttelt, bis sich die Lösung
gelb färbt. Man gießt soviel der Lösung in das V-Rohr, bis die Watte vollständig getränkt ist. Anschließend legt man in jeden Schenkel auf die Watte
ein kreisförmiges Scheibchen Filterpapier. Genauso befüllt man die beiden
Reagenzgläser, die als Vergleich dienen sollen. In je zwei der 50mlBechergläser gibt man 5 ml der Schwefelsäure bzw. der Natronlauge. Aus
den Bechergläsern läßt man gleichzeitig und mit der gleichen Geschwindigkeit
die Schwefelsäure auf der Seite der Anode und die Natronlauge auf der Seite
der Kathode in das V-Rohr laufen. An den Platinelektroden legt man eine
Spannung von 60 V an, dabei mißt man eine Stromstärke von etwa 0,3 bis 0,4
A. Die Reagenzgläser werden ebenso mit Schwefelsäure bzw. Natronlauge
gefüllt, allerdings ohne anschließend eine Spannung anzulegen. Sie sollen zeigen, inwieweit bei diesem Versuch Diffusionsvorgänge eine Rolle spielen.
11
Chemie in der Schule: www.chids.de
Versuchsbeobachtung
Die Schicht unter der Natronlauge färbt sich allmählich blau, die unter der
Schwefelsäure rot. Dagegen sind die angefärbten Schichten in den Reagenzgläsern wesentlich schmaler.
Versuchsauswertung
Zunächst kann man anhand der unterschiedlichen Schichtdicken im V-Rohr
bzw. Reagenzglas erkennen, daß bei der Wanderung der Ionen Diffusionsvorgänge nur eine untergeordnete Rolle spielen.
Die positiv H 30+-Ionen wandern zur negativ geladenen Kathode, man bezeichnet sie daher als Kationen. Die negativ geladenen Hydroxid-Ionen wandern dagegen zur positiv geladenen Anode und werden daher als Anionen bezeichnet.
Die besonders hohe Wanderungsgeschwindigkeit von OH-- und H 30+-Ionen
kommt durch Bindungsaustausch zwischen Wassermolekülen zustande, ohne
daß wirklich eine Ionenwanderung stattgefunden hat.
An beiden Elektroden kann man eine Gasbildung beobachten. Hier findet eine
elektrolytische Zersetzung von Wasser statt.
Vorgänge an den Elektroden:
Anode (== Ort der Oxidation): 3 H 20
~
1/2 O 2 t + 2 H 30+ + 2 e
Kathode (== Ort der Reduktion): H 20 + e- ~ 1/2 H 2 t + OH-
Daß auch Ionenkristalle Ionenleiter sem können, zeigt der nächste Versuch.[5]
V3
Ladungstransport in Ionenkristallen - Feste Elektrolyte
Substanzen
Ein mit CaCl 2-dotierter KCL-Einkristall
Geräte
1 Röhrenofen mit Regeltrafo
1 Temperaturfühler
1 digitale Temperaturanzeige
1 Ohmmeter
Verbindungskabel
12
Chemie in der Schule: www.chids.de
Versuchsaufbau / Schaltskizze
Röhrenofen mit Regeltrafo
TemperaturfuWeF
··.. ~-.._·---·I·_·..·-7 -\
r----,'---"':-+EI,R
J
(;
'
.~""'~.---~~ -_._.- -~:. .
KCI-Einkristall mit
Calciumchlorid dotiert
i
.: .
Ohmmeter
Ein mit Calciumchlorid dotierter KCI-Kristall wird an zwei gegenüberliegenden Flächen zwischen zwei Platinbleche eingeklemmt, so daß eine leitende
Verbindung entsteht. Die Platinbleche sind mit einem Ohmmeter verbunden,
das den Widerstand zwischen den Platinblechen mißt .
Versuchsdurchführung
Ein elektrisch beheizbarer Röhrenofen wird vorgeheizt und dann der Kristall
hineingeschoben. Über ein NiCr-Ni-Thermoelement wird die Temperatur gemessen.
Versuchsbeobachtung
Bei ca . 640 0 C, also weit unterhalb des Schmelzpunktes von KCI (Smp.(KCI)
::=
770 0 C), sinkt der Widerstand plötzlich stark ab . Der Kristall leitet elektri-
schen Strom.
Versuchsauswertung
In Ionengittern kann Ionenleitfähigkeit auftreten, wenn die Ionen klein genug
sind, um zwischen den Gitterplätzen hindurch laufen zu können (Beispiel:
Ag +-Ionen in AgBr) . Häufiger ist jedoch der Fall , daß durch unbesetzte Gitterplätze (Gitterlücken) Leitfähigkeit hervorgerufen wird . Man unterscheidet
zwischen thermischen Gitterlücken und Zusatzgitterlücken. Thermische Git-
terl ücken entstehen durch die Wärmebewegung im Kristall, wenn Gitterbausteine aus dem Innern an die Kristalloberfläche gedrängt werden . Die Anzahl
der thermischen Lücken ist temperaturabhängig. Die durch thermische L ükken ermöglichte Leitfähigkeit bezeichnet man als Eigenleitung.
13
Chemie in der Schule: www.chids.de
000 0
000
o 0 0 0
o 0 0 0
000
o 0 0 0
o 0 0 0
o 0 0 0
o
o
0 0 0
000
000
o 000
Zusatzgitterlücken treten durch den Einbau mehrwertiger, gitterfremder Ionen (hier: Calcium-Ionen) auf. Besetzt ein Ca 2+-Ion den Gitterplatz eines K+Ions, so wird ein anderer Kr-Platz nicht besetzt, da nur so die Elektroneutralität erhalten bleibt. Diese Form der Leitfähigkeit bezeichnet man als Zusatzleitung, sie ist temperaturunabhängig und wird von der Anzahl der Zusatzionen bestimmt.
K+
CI-
K+
CI-
CI-
Ca 2+ CI-
K+
K+
CI-
Cl-
CI-
K+
CI-
K+
14
Chemie in der Schule: www.chids.de
B
Technische Anwendungen
V4
Keramische Leiter: NTC - Widerstand (Heißleiter)
Substanzen
Geräte
1 NTC - Widerstand (Heißleiter)
1 Taschenbatterie (4 ,5 V)
1 Glühbirnchen mit Fassung
Kupferkabel
Versuchsaufbau / Schaltskizze
Taschenbatterie
Glühbirnchen
NTC-Widerstand (Heißleiter)
~
Feuerzeug
Der NTC-Widerstand und die Glühbirne werden in Reihe geschaltet und mit
der Spannungsquelle (hier: Taschenbatterie) verbunden .
Versuchsdurchführung
Der NTC-Widerstand wird mit einem Feuerzeug vorsichtig erwämt .
Versuchsbeobachtung
Schon nach kurzem Erwärmen beginnt das Glühbirnchen hell aufzuleuchten.
Es fließt also Strom.
Versuchsauswertung
Bei dem hier vorliegenden Schaltelement handelt es sich um einen Heißleiter
oder NTC (= Negativer Temperaturkoeffizient)-Widerstand . Bei hohen Temperaturen besitzt er einen niedrigen Widerstand. Es handelt sich hierbei um
eine Keramik. Unt er keramischen Erzeugnissen verst eht man allgemeinen
te chnische Produkte, die durch Brennen vo n Tonen bei 100 0-1500° C entste15
Chemie in der Schule: www.chids.de
hen. Speziell diese Keramik wird hergestellt durch Sintern bei 1000-1400° C.
Die Sintertemperatur ist maßgeblich für das spätere Leitfähigkeitsverhalten:
Die Zuordnung von Temperatur und Widerstand wird durch Tempern bei der
Herstellung erreicht. Die NIC-Elemente bestehen aus Mischoxidspinellen
oder dotierten Oxiden (Cu 2 0 , Al 203 mit Cr 2 0 3) .[2]
5
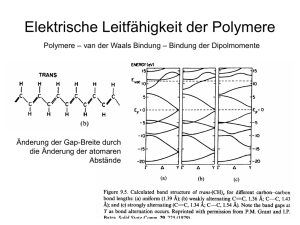
Elektrisch leitfähige Polymere
Unter Normalbedingungen sind Polymere ausgesprochene elektrische Isolatoren. So liegt zum Beispiel die elektrische Leitfähigkeit von Teflon noch unter
der des Schwefels (vgl. Abb. 1). Durch gezielte Maßnahmen können jedoch
Polymere in elektrisch leitfähige Stoffe überführt werden:
(1)
Gefüllte elektrisch leitfähige Polymere
Der klassische Weg zur Vermittlung elektrischer Leitfähigkeit ist die
Zumischung leitfähiger Füllstoffe. Dazu gehören Ruß, KohlenstoffFasern, Nickel-beschichteter Glimmmer, Stahlfasern oder Aluminiumplättchen. Die dadurch erzielte elektrische Leitfähigkeit ist jedoch
meist nur gering.
(2)
Intrinsische elektrisch leitfähige Polymere
Ein anderer Weg führt über eine Modifizierung von geeigneten Polymeren, durch die sogenannte Dotierung, zu elektrisch leitfähigen Polymeren.
Der
In
diesem
Zusammenhang
gebrauchte
Begriff
"Dotierung" ist keinesfalls mit dem aus der Halbleitertechnik gebräuchlichen Begriff gleichzusetzen, ist aber aus diesem Gebiet entlehnt worden, da in beiden Fällen die Leitfähigkeit stark verbessert
wird. Was heißt hier Dotierung? Unter Dotierung versteht man Oxidations- und Reduktionsreaktionen, die Polymere in Charge-TransferKomplexe überführen, die eine metallische elektrische Leitfähigkeitscharakteristik besitzen. Als Ausgangspolymere verwendet man solche
mit einem ausgedehnten
1t -
e'- System.
Beispiele:
(1)
Polyacetylen
(2)
(hetero)aromatische Polymere
Poly-(para- )phenylen
Polypyrrol
]6
Chemie in der Schule: www.chids.de
Dotierungsverfahren
(1)
chemisch
Beim Dotieren dieser Polymere mit starken Oxidations- oder
Reduktionsmitteln entstehen in Redoxreaktionen Polymere mit
delokalisierten ionischen Zentren und den sich aus den Dotierungsmitteln bildenden Gegenionen. Als Dotierungsmittelwerden eingesetzt: Brom, Iod, Silberperchlorat, Bortrifluorid, etc.
(2)
elektrochemisch
Andere elektrisch leitfähige Polymere werden durch elektrochemische Polymerisation hergestellt. Ein Beispiel für diese
Verfahren ist die Synthese von Polypyrrol. [4]
V5
Synthese von Polypyrrol
Substanzen
3 ml Pyrrol (Monomer)
200 ml Methanol (LM)
5 g NaCI0 4
Geräte
1 400ml-Becherglas
2 V4A-Stahlbleche (2 x 7 cm)
1 Trafo (angelegte Spannung 6V)
1 Voltmeter (10 V -)
1 Amperemeter (0,3 A -)
5 Verbindungskabel
1 Magnetrührer mit Rührfisch
2 Krokodilklemmen
17
Chemie in der Schule: www.chids.de
Versuchaufbau / Schaltskizze
Voltmeter
....-----1711-----,
Trafo (6V)
V4A-Stahlbleche
Lösung : Methanol
Pyrrol
Natriumperchlorat
Versuchsdurchführung
In einem 400ml-Becherglas wiegt man 5g Natriumperchlorat ab und löst das
Leitsalz in 200 ml Methanol (Abzug!). Nun gibt man 3 ml Pyrrol hinzu , stellt
die beiden V4A-Stahlbleche weit voneinander entfernt in die Lösung und
elektrolysiert bei etwa 6 V 30-45 Minuten lang . An der positiven Elektrode
scheidet sich zunächst auf der Vorderseite ein schwarzer Film ab. Man dreht
nach etwa 1-2 Minuten die positive Elektrode um und elektrolysiert weiter.
Nach 30-45 Minuten nimmt man die Elektroden aus der Lösung, wäscht die
Anode mit etwas Methanol und zieht mit Hilfe einer Rasierklinge den gebildeten schwarzen Kunststoff-Film von der Elektrode ab.
18
Chemie in der Schule: www.chids.de
Versuchsauswertung
Als organsiches Lösungsmittel wird Methanol eingesetzt, als Leitsalz Natriumperchlorat.
Reaktionsmechanismus:
Anode:
(1) Bildung eines Radikal-Kations
H
H
H
H
HJO-H · HV-H
+e-
I
J
H
H
(2) Dimerisierung
H
H
H
+
H
H
H
H
H~H
H H
H
...
H
H
HH
I
H
(3) Deprotonierung
H
H H
H
H
H H
H
+2 H+
H
H
H
H
(4) Bildung eines Radikal-Kations
H
H H
H
H
H
H
H
HH
H
H
Zum Ladungsausgleich werden negativ geladene Perchlorat-Ionen in das Gitter miteingebaut. Sie stammen aus dem Leitsalz.
Kathode:
(1) Reduktion
CH 30H + e
-)
(2) Oxidation
CH 30- + H]O+
19
Chemie in der Schule: www.chids.de
V6
Demonstration der Leitfähigkeit von Polypyrrol
Substanzen
Geräte
selbsthergestellte Polypyrrol-Folie
1 Ohmmeter
2 Verbindungskabel
2 Krokodilklemmen
Versuchsaufbau / Schaltskizze
Polypyrrolfolie
------.--t
_I~~
Ohmmeter
Versuchsdurchführung
Die selbsthergestellte Polypyrrolfolie wird zwischen zwei Krokodilklemmen
eingespannt, die wiederum über Verbindungskabel mit dem Ohmmeter verbunden sind.
Versuchsbeobachtung
Der Widerstand der Polypyrrolfolie liegt im Ohm-Bereich.
Versuchsauswertung
Die in Laboratorien technisch einwandfrei hergestellten Folien zeigen eine
noch wesentlich bessere Leitfähigkeit. Zu begründen ist es damit, daß die
Qualität nicht unerheblich durch Verunreinigungen, Elektrodenmaterial,
Druck, Konzentration, Temperatur und Comonomere beeinflußt wird.
20
Chemie in der Schule: www.chids.de
Worauf beruht die elektrische Leitfähigkeit von Polypyrrol?
(1 )
Elektrische Leitfähigkeit entlang der Kette
Die Leitfähigkeit von Polypyrrol beruht zum einen auf dem Vorhandensein sogenannter Bipolaronen; in der Chemie würde man von dimerisierten Radikal-Kationen sprechen. Diese Bipolaronen sind längs
der Kette beweglich und sorgen so für einen Ladungstransport.
(2)
Elektrische Leitfähigkeit quer zur Kette
Die Struktur von dotiertem, metallisch leitfähigem Polypyrrol ist mit
"molekularen Bretterstapeln" vergleichbar, zwischen denen die Gegenionen eingebettet sind. Zwischen den planaren Molekülketten kann es
durch die Dotierung zu einer so weiten Annäherung kommen, daß
Charge-Transfer-Wechselwirkungen auftreten.
21
Chemie in der Schule: www.chids.de
6
Hochtemperatur - Supraleitung: Keramische Supraleiter
Um das Phänomen der Supraleitung zu verstehen, soll an dieser Stelle kurz
der Vorgang der Stromleitung in einem Metall wiederholt werden.
Der metallische Festkörper stellt ein Kristallgitter dar. Die Atome eines solchen Kristallgitters sind regelmäßig angeordnet. Genauer betrachtet stellt das
Kristallgitter ein Gitter aus Atomkernen dar, die von einem Elektronengas
umgeben sind. Unter elektrischem Strom versteht man nun fließende Elektronen, die sich in einem Potentialfeld bewegen. Da die Atomrümpfe durch Zufuhr thermischer Energie immer um ihre Ruhelage schwingen, können sich die
Elektronen nicht ungehindert bewegen. Sie stoßen mit den Atomkernen zusammen und verlieren Energie. Das ist die atomare Ursache des elektrischen
Widerstandes. Daraus folgt zum einen, daß sich der elektrische Widerstand
mit der Temperatur ändert: Bei metallischen Leitern nimmt er mit steigender
Temperatur zu. Zum anderen dürfte ein widerstandsloser Strom nur am absoluten Nullpunkt (0 K oder -273,15° C) fließen, da nur dann die Atome still
stehen und die Elektronen sich ungehindert bewegen können.
Entdeckung der Supraleitung
1911
entdeckt der holländische Wissenschaftler Kammerlingh Onnes, der
sich eigentlich mit der Verflüssigung von Helium und der Frage beschäftigt, wie sich die Eigenschaften von Stoffen bei diesen tiefen
Temperaturen verhalten, daß der elektrische Widerstand von metallischem Quecksilber bei einer Temperatur von etwa 4 K plötzlich
auf Null abfallt. Damit ist er auf das Phänomen der Supraleitung
gestoßen.
1957
stellen die amerikanischen Physiker Bardeen, Cooper und Schriefer
die nach ihnen benannte, bis heute gültige BCS-Theorie auf, die
dieses Phänomen zu erklären versucht.
1972
erhalten diese drei Wissenschaftler dafür den Nobel-Preis.
1985/86 liegt die bis dahin höchste Sprungtemperatur noch bei 23 K (für
Nb.Ge-Legierungen). Da man, von der Theorie ausgehend, eine
Sprungtemperatur von über 30 K für unmöglich hält, stellen einige
große Firmen Anfang der achtziger Jahre ihre Supraleitungsforschung ein.
22
Chemie in der Schule: www.chids.de
1986
Karl Alex Müller und Johannes Georg Bednorz vom Schweizer
IBM-Laboratorium Rüschlikon beschreiten mit ihrer Supraleitungsforschung einen wenig erfolgversprechenden Weg. Sie setzen sich
mit keramischen Supraleitern auseinander. Durch Kombination unterschiedlicher Metalloxide unter Zusatz kleiner
Mengen
an
Fremdmetallen gelingt ihnen im März 1986, eine Verbindung mit
einer Sprungtemperatur von 35 K herzustellen. Sie hat die Zusammensetzung La1,8SBaO,SCu04. Damit haben sie es geschafft, die
Grenze von 30 K zu überwinden. Als sie im Dezember des gleichen
Jahres ihre Ergebnisse veröffentlichen, nachdem sie auf ihre Reproduzierbarkeit überprüft worden sind, lösen sie damit eine Forschungswelle auf dem Gebiet der keramischen Supraleiter aus. Man
arbeitet zum einen an der Zusammensetzung des "Züricher Oxids"
und zum anderen an den Reaktionsbedingungen bei der Herstellung
(Sintertemperatur, Sinterdauer, Sinteratmosphäre).
1987
Der technische Durchbruch kommt mit der Entdeckung von
YBa 2Cu307 , wegen dem Verhältnis Y:Ba: Cu auch als
1-2-3-
Supraleiter bezeichnet, mit einer Sprungtemperatur von 90 K, so
daß man statt in flüssigem Helium in flüssigem Stickstoff arbeiten
kann.
Im gleichen Jahr erhalten Müller und Bednorz für die Entdeckung
der "Züricher Oxide" den Nobel-Preis.
V7
Supraleitung - Ideale Leitfähigkeit
Substanzen
Geräte
1-2-3-Supraleiter-Element aus dem
lnteratom-Baukasten (bezogen über
die Firma Siemens)
flüssiger Stickstoff
1 Trafo (1 0 V - )
1 Voltmeter (30 V - )
1 Voltmeter (200 mV - )
1 Amperemeter (30 mA - )
1 Widerstand (1 kD)
Verbindungskabel
1 Dewar
23
Chemie in der Schule: www.chids.de
Versuchsaufbau / Schaltskizze
Voltmeter (30 V)
_----I
~
t-----_
Trafo (10 V -)
Amperemeter
(30 rnA)
Widerstand
Voltmeter (200 m V)
Versuchsdurchj1lhrung
Man baut die Versuchapparatur wie oben angegeben auf. Das SupraleiterElement wird in einen mit flüssigem Stickstoff gefüllten Dewar gehalten.
Versuchsbeobachtung
Man kann an dem Voltmeter (mit dem Meßbereich bis 200 mV) einen Spannungsabfall beobachten.
Versuchsauswertung
Es gilt:
R==U/I
R·I==U
Im supraleitenden Zustand:
R => wird Null
U => geht gegen Null
24
Chemie in der Schule: www.chids.de
Kristallstruktur von YBa 2 CU 3 0 7
Die Kristallstruktur des I -2-3-Supraleiters leitet sich von der PerowskitStruktur ab (Calcium-Titanat) .
o
()
GD
~
CuO-Band
~
CuO-Band
Yttrium-, BariumKupfer-,
Sauerstoff-Ionen
Man erkennt, daß sich Kupferoxid-Bänder und -Ebenen ausbilden. Diese sollen maßgeblich am supraleitenden Zustand beteiligt sein .
Bardeen, Cooper, Schriefer (1957): BCS-Theorie
In einem normalleitenden Metall driften die Elektronen
In
unkontrollierter
Bewegung in Richtung der treibenden Kraft des elektrischen Feldes. Im Supraleiter wird die Bewegung der Elektronen durch Gitterschwingungen koordiniert. Die Elektronen paaren sich zu sogenannten Cooper-Paaren und bewegen sich ohne Energieverlust durch das Kristallgitter.
Wie kommt es zur Bildung von Cooper-Paaren?
Zwei Elektronen mit entgegengesetztem Spin und Impuls koppeln zu einem
Quasiteilchen. Die zwischen den beiden Elektronen wirkende Anziehungskraft
muß größer sein als die abstoßende Coulomb-Kraft aufgrund ihrer negativen
Ladungen . Sie beruht auf einer schwachen Wechselwirkung mit der positiven
25
Chemie in der Schule: www.chids.de
Literaturverzeichnis
[1] Joachim Berber: Physik in Formel und Tabellen, Teubner Verlag, Stuttgart 5 1991,72 f
[2] Bergmann, Schäfer: Lehrbuch der Experimentalphysik, Band 6 Festkörper, Walter de
Gruyter & Co, Berlin 1992,440.
[3] Franz Bukatsch, Wolfgang Glöckner: Experimentelle Schulchemie (Studienausgabe in 9
Bänden): Physikalische Chemie I (Band 5), Aulis
Verlag Deubner und Co KG, Köln 1977, 10f
[4] B. Flintjer, W. Jansen: Polypyrrol und Polypyrrol-Batterien, in: Praxis der Naturwissen-
schaften - Chemie, 3/38,7-11, 1989.
[5] Horst-Dieter Försterling: Praxis der physikalischen Chemie, VCH Verlagsgesellschaft mbH,
Weinheim 6 1991, 240 ff
(6] Michael Hanack, Georg Pawlowski: OrganischeLeiter, in: Naturwissenschaften 69,266275, 1982.
[7] Harald Heimgärtner Kunststoffeals elektrischeLeiter, in: Praxis der Naturwissenschaften Chemie, 6/37, 27-29, 1988.
[8] Hollemann, Wiberg: Lehrbuch der Anorganischen Chemie, de Gruyter, Berlin 91-100 1985,
731 ff
[9] R Holze, J. Lippe: Leitfähige Polymere - neuartige vielversprechende Werkstoffe, in: Praxis
derNaturwissenschaften- Chemie, 6/41, 38-43,1992.
[10] Richard B. Kaner, Alan G. MacDiarmid: Elektrisch leitende Kunststoffe, in: Spektrum der
Wissenschaft, 54-59, April 1988.
[11] Friedhelm Kober: Die Stellung des Siliciums in der IV. Hauptgruppe, in: Praxis der
Naturwissenschaften - Chemie, 5/37, 8-10,1988.
[12] Klaus Menke, Sigmar Roth: Metallisch leitfähige Polymere I, in: Chemie in unserer Zeit,
1/20, 1-10, 1988.
(13] Klaus Menke, Sigmar Roth: Metallischleitfähige Polymere II, in: Chemiein unserer Zeit,
2/20, 33-43, 1988.
[14] Herbert Naarmann: Polymers,Electrically Conducting, in: UllmannsEncyclopedia of
Industrial Chemistry, Vol. A21, 1992.
[15] Erwin Riedel: Anorganische Chemie, de Gruyter, Berlin 2 1990, 164 ff
[16] Lothar Schuh: Keramische Supraleiter, Markt & Technik Verlag, München 1988.
[17] Heribert Stroppe: Physik für Studenten der Natur- und Technikwissenschaften, Carl Hanser
Verlag, München 8 1990, 418 f
[18] W. Waleher: Praktikum der Physik, B.G. Teubner Verlag, Stuttgart
6
1989, 221 f
[19] R G. Weißenhorn: Zur Eingliederung oxidischer Supraleiter in den Chemieuntenicht, in:
Praxis der Naturwissenschaften-Chemie, 6/38, 22-31, 1989.
27
Chemie in der Schule: www.chids.de