Handout zum¨Ubungsblatt Nr.1 - E-Mail Abruf lässt Accounts nicht
Werbung

Handout zum Übungsblatt Nr.1
Aufgabe 1
a)
• Größe des Wasserstoffatoms: Atomare Größenordnungen liegen im Å-Bereich, wobei 1 Å = 10−10 m.
• Größe des Atomkerns von Wasserstoff: Die Größe eines Protons (Kern des gewöhnlichen Wasserstoffisotops) liegt bei R0 = 1 fm = 10−15 m, was auch als
√ ”ein Fermi“ bezeichnet wird. Die Größe des Atomkerns
hängt vom Element ab. Es gilt hierbei RK = 3 AR0 , wobei A die Anzahl der Nukleonen des Elements
ist.
• Masse des H-Atoms:
mH = 1, 007 u ≈ 10−27 kg .
(1)
Der Wert liegt nicht genau bei 1 u, weil die atomare Masseneinheit als der zwölfte Teil des KohlenstoffIsotops 12
6 C definiert ist. Das Proton (von der Masse her etwa das Wasserstoffatoms) ist im gebundenen
Zustand (stabiler Zustand!), also im Kohlenstoffkern, jedoch etwas leichter als im ungebundenen Zustand
und daher ergibt sich die Differenz.
• Hinter der Größenordnung von 1 mol stecken etwa NA = 6, 023·1023 Teilchen. Um die Anzahl der Moleküle
in einem Liter Wasser zu bestimmen, müssen wir wissen, dass mH2 O = 18 u. Die relative Atommasse in
Gramm enthält 1 mol Teilchen. Damit gilt:
N = n · NA =
103 g
· 6, 023 · 1023 ≈ 3, 346 · 1025 Teilchen .
18 g
(2)
• Da die Elementarladung bei e = 1, 602 · 10−19 C liegt, macht 1 A = 1 C/s etwa 6, 246 · 1018 Elektronen
aus.
• Kondensator:
∧
Q = C · U = 10−12 F · 10 V = 10−11 C = 10−11 · 6, 246 · 1018 = 6, 246 · 107 Elektronen .
(3)
b)
Die Loschmidt-Zahl gibt die Anzahl der Moleküle eines idealen Gases unter Normbedingungen pro Volumeneinheit an:
NL = 2, 69 · 1025
1
.
m3
(4)
Die Loschmidt-Zahl wird jedoch fälschlicherweise auch synonym zur Avogadro-Zahl NA = 6, 022 · 1023 verwendet (auch im Schulbuch: elemente Chemie I“)!
”
c)
Die Einheit Elektronenvolt (eV) gibt an, welche Energie ein Elektron beim Durchlaufen der Spannung 1 V
erhält. Daher gilt 1 eV = 1, 602·10−19 J und damit 1 MeV = 1, 602·10−13 J. Zur Berechnung der Geschwindigkeit
eines Protons der Energie Ep = 5 GeV benötigen wir die relativistische Energiegleichung
Ep = γmp c2 ,
1
γ=p
1 − β2
,
β=
v
.
c
Aus der Proton-Ruhemasse mp = 938 MeV/c2 ergibt sich dann mit
s
γ2 − 1
Ep
β=
, γ=
,
γ2
mp c2
(5)
(6)
ein Zahlenwert β ≈ 0, 98. Also bewegt sich das Proton dann mit 98% der Lichtgeschwindigkeit. Analog folgt
für ein Elektron der Energie Ee = 1 MeV eine Geschwindigkeit von 87% der Lichtgeschwindigkeit.
Für ein Elektron der kinetischen Energie Ee = 10 eV ¿ 511 keV = me können wir nichtrelativistisch rechnen.
Aus
Ee =
1
me v 2 ,
2
(7)
ergibt sich dann v = 0, 0063c ≈ 1, 89 · 106 m/s. Diese Energie ist typisch für die Bindungsenergie der Elektronen
im Wasserstoffatom.
Aufgabe 2
Hier macht man am Besten eine Tabelle zur Übersicht:
Verfahren
Laue
Kristall
Einkristall
Licht
Röntgenlicht, kontinuierliches Spektrum
Durchführung
fester Einfallswinkel
Bragg
Einkristall
monochromatisches
Licht
Drehung des Kristalls
Debye-Scherrer
polykristalline monochromatisches
Probe
Licht
fester Winkel
Ergebnis
konstruktive
Interferenz
für
bestimmte
Wellenlängen, sichtbare
Punkte auf Schirm
konstruktive Interferenz
für bestimmte Netzebenen, sichtbare Punkt auf
Schirm
jede Netzebene kommt
gleichzeitig vor, Interferenzringe auf Schirm
Aufgabe 3
Wir nutzen die Tatsache aus, dass Helium der Masse 4, 003 g aus 1 mol = NA ≈ 6, 023 · 1023 Teilchen besteht.
Mittels der Dichte ergibt sich dann das Volumen, welches nur die Atome einnehmen (dichteste Kugelpackung!):
V = 0, 74
mHe
4, 003 g
3
= 0, 74
g ≈ 22, 79 cm .
%He
0, 13 cm
3
(8)
Dann folgt mit dem Kugelvolumen VK = 4πR3 /3:
r
3 V
RHe = 3
≈ 2, 083 · 10−10 m .
4π NA
(9)
Aufgabe 4
Die optische Auflösung kann mittels
d=
λ
,
n sin α
(10)
berechnet werden, wobei n der Brechungsindex der Umgebung (also zwischen Linse und Probe) und α der
Öffnungswinkel ist, unter dem das Licht maximal auf die Linse einfallen kann. Da jedoch keine genauen Werte
für n und α angegeben sind, begnügen wir uns mit der Näherung, dass das Auflösungsvermögen d etwa der
Wellenlänge der verwendeten elektromagnetischen Wellen entspricht. Dann gilt (prinzipiell ist es einfach die
Tabelle aus Haken-Wolf auf Seite 21):
Elektromagnetische Welle/Teilchen
d (theoretisch)
d (praktisch)
Sichtbares Licht
Röntenlicht
ca. 5000 Å
ca. 500 Å
ca. 5000 Å
ca. 500 Å
Elektronen (100 000 eV)
≈ 0, 037 Å
≈ 0, 04 Å
Gründe
beschränkt wegen n = 1
für hohe Frequenzen
elektrische/magnetische
Felder als Linsen verwendet, Linsenfehler!
2
Zur Beobachtung von Kernen würde man Strahlung der Wellenlänge λ = 1 fm benötigen. Aus c = λν ergibt
sich dann eine Frequenz von 3 · 1023 Hz; man bräuchte als sehr hochenergetische Strahlung. Strahlung dieser
Energie wird an heutigen Beschleunigern problemlos erzeugt, wodurch sich schon lange die Kernstruktur und
sogar die Struktur der Teilchen untersuchen lassen, aus denen sich Kerne zusammensetzen.
Aufgabe 5
Aufgenommen ist hier die Struktur von Hexadeka-Chlor-Kupfer-Phthalocyanin
C32 N8 Cl16 Cu mittels eines Elektronenmikroskops, das Elektronen der Energie
500 keV erzeugt, wobei eine hochauflösende Technik verwendet wurde. Das erste
Bild zeigt die Intensitätsverteilung direkt durch die Messung. Das zweite Bild
ergibt sich aus dem ersten durch eine spezielle Methodik der Weiterverarbeitung.
Das dritte Bild zeigt die theoretisch berechnete Struktur.
Für die experimentelle Bestimmung der atomaren Struktur benötigt man allein
die gemessene Intensität und die chemische Zusammensetzung der kristallinen
Probe. Unter anderem braucht man zur Umrechnung der gemessenen Intensitätsverteilung in den strukturellen Aufbau des Kristalls die Kenntnis darüber, wie
Elektronen an bestimmten Atomen streuen (Streufaktoren); diese sind jedoch
bekannt. Die Bilder stammen aus dem Artikel Image Deconvolution of a Sin”
gle High-Resolution Electron Micrograph“ von L. Yi-Wei, X. Shi-Bin, F. Hai-Fu,
T. Dong, L. Fang-Hua, P. Qing, N. Uyeda, Y. Fujiyoshi aus der Zeitschrift Acta
Cryst. A46 (1990), 459-463.
Aufnahme einer mit Bariumatomen besetzen Spitze
eines Wolframdrahtes mittels Feldemission. Die Aufnahme wurde mittels einer evakuierten modifizierten
Glühlampe (∼ 108 mbar) durchgeführt. An der Spitze
befindet sich die Anode, eine Drahtwendel mit Blech,
welche mit metallischem Barium gefüllt ist. Der Wolframdraht stellt die Kathode dar, an der eine negative Spannung von mehreren Tausend Volt anliegt.
Aufgrund dieser Spannung werden Elektronen aus der
Spitze des Wolframdrahts ausgelöst, im elektrischen
Feld beschleunigt und erzeugen auf dem mit Phosphor überzogenen Leutschirm eine 500 000-fache Vergrößerung der Kathodenoberfläche. Da die Feldemission von der Struktur der Oberfläche abhängt, wird eine
Abbildung derselbigen mittels dieser Technik möglich.
Die Bilder sind dem Artikel Feldelektronenmikrosko”
pie von Barium-Adatomen an Wolframspitzen“ von
R. Schwankner (PdN-Ch. 10/84) entnommen.
Mittels der Rastertunnelmikroskopie erstellte Aufnahme von KupferPhthalocyanin-Molekülen auf einer Kupfer-Oberfläche (zusätzlich mit einer
theoretisch berechneten Ladungsdichte). Das Mikroskop tastet die Oberfläche
mittels einer elektrisch leitenden Nadel ab, an der eine Spannung anliegt. Diese
Art der Mikroskopie nutzt den quantenmechanischen Tunneleffekt, bei dem
Elektronen durch die Potentialwällen der Atome der Oberfläche tunneln, auf
die Nadel gelangen und dort als sogenannter Tunnelstrom nachgewiesen werden
können. Der Tunnelstrom hängt dabei von der Oberflächenbeschaffenheit ab,
womit die atomare Struktur der Oberfläche abgebildet werden kann. Das Bild
stammt aus dem Artikel High-Resolution Imaging of Copper-Phthalocyanine by
”
Scanning-Tunneling Microscopy“ von P. H. Lippel, R. J. Wilson, M. D. Miller,
Ch. Wöll und S. Chiang in der Zeitschrift Rhys. Rev. Lett 62 (1989) 171.
3
Handout zum Übungsblatt Nr.2
Aufgabe 1
Der Winkel für die Bragg-Reflexion (Glanzwinkel θB ) ergibt sich aus der Bedingung der konstruktiven Interferenz für die Beugung von elektromagnetischer Strahlung der Wellenlänge λ an Netzebenen.
Der Gangunterschied zwischen den beiden an benachbarten Netzebenen (mit Abstand dhkl ) reflektierten Strahlen beträgt δ = 2s = 2dhkl sin θB . Damit konstruktive Interferenz stattfindet, muss dies ein ganzzahliges
Vielfache der Wellenlänge sein:
2dhkl sin θB = nλ ,
sin θB =
nλ
,
2dhkl
n ∈ Z.
(1)
Aufgabe 2
a)
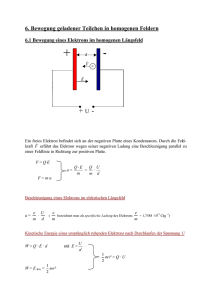
Diese Anordnung aus einem gekreuzten E- und B-Feldern, die aufeinander senkrecht stehen, ist nichts anderes
als ein Geschwindigkeitsfilter. Teilchen gelangen genau dann ohne Ablenkung durch diesen Filter, sofern sich
elektrische Kraft und Lorentzkraft gegenseitig aufgeben:
!
Fe = FL ⇔ eE =
U
8000 V
m
eU !
= evB ⇒
=
= 2 · 108 .
d
dB
4 · 10−3 k · 10 · 10−3 T
s
(2)
Dabei handelt es sich um 2/3 der Lichtgeschwindigkeit, also muss man relativistisch rechnen.
1
γ=q
1−
v2
c2
3
=√ .
5
(3)
b.)
Mittels des Satzes von Pythagoras
(r − a)2 + L2 = r2 ,
(4)
ergibt sich der Radius des Kreises, welchen das Teilchen im Magnetfeld beschreibt, zu:
r=
a2 + L2
(4, 5 · 10−3 m)2 + (1, 6 m)2
=
≈ 284, 5 m .
2a
2 · 4, 5 · 10−3 m
(5)
Der Radius ist also sehr groß; das Teilchen wird nur schwach abgelenkt. Damit das Teilchen die Kreisbahn
beschreibt, muss die (relativistische) Zentripetalkraft von der Lorentzkraft aufgebracht werden:
!
FZ = FL ⇔
√3 · 2 · 108 m
γmv 2 !
e
γv
C
s
5
= evB ⇒
=
=
≈ 9, 43 · 107
.
r
m
rB
284, 5 m · 10−2 T
kg
(6)
c)
Durch das Beschleunigen im Zyklotron gewinnt das Teilchen kinetische Energie. Die relativistische Gesamtenergie lässt sich berechnen über Erel = γmc2 . Davon ist die Ruheenergie des Teilchens E0 = mc2 abzuziehen
und es ergibt sich die relativistische kinetische Energie:
µ
¶
3
Ekin = (γ − 1)mc2 = √ − 1 · 0, 938 GeV ≈ 0, 320 GeV .
(7)
5
Man kann sich vergewissern, dann man mit dem relativistischen Pythagoras
p
Erel = (mc2 )2 + (pc)2 ,
(8)
auf denselben Zahlenwert kommt. Damit können wir die Anzahl N der Umläufe angeben, wenn wir beachten,
b = 40 · 103 eV liegt:
dass der Zuwachs an kinetischer Energie pro Umlauf bei E
N=
Ekin
0, 320 · 109 eV
=
≈ 8011 .
b
40 · 103 eV
E
(9)
d)
Erneut ergibt sich aus FZ = FL der Radius der Kreisbahn:
γmv
r=
.
Be
(10)
Aus der Umlaufzeit T = 2πr/v folgt die Umlauffrequenz:
ω(t) =
2π
v(t)
Be
=
=
.
T (t)
r(t)
γ(t)m
(11)
Die Zeitabhängigkeit von ω(t) kommt vom Lorentzfaktor γ(t). Im nichtrelativistischen Grenzfall ist γ = 1
und deshalb kann dann ω als zeitunabhängig betrachtet werden. Wir drücken γ(t) mittels des Zuwachses an
kinetischer Energie pro Umlauf aus:
Ekin (t) + mc2
1
γ(t) =
=1+
mc2
mc2
Zt
0
t
b Z
E
0
0
b
Eω(t ) dt =
ω(t0 ) dt0 .
mc2
(12)
0
Im Wesentlichen wurde der Energiezuwachs über das Integral mathematisch so behandelt, also folge er kontinuierlich über die ganze Bewegung des Teilchens und nicht nur abrupt durch die Bewegung im elektrischen
b rührt von der Potentialdifferenz (des elektrischen Feldes her) und hängt somit
Feld. Der Energiezuwachs E
nicht von der Zeit ab. Damit kommen wir auf die Integralgleichung
ω(t) =
Bec2
.
t
bZ
E
ω(t0 ) dt0
mc2 +
π
(13)
0
Es ist geschickt, den Kehrwert zu bilden und nach der Zeit abzuleiten, um auf eine Differentialgleichung zu
kommen:
t
t
µ
¶
b Z
b Z
1
m
E
d
1
d
m
E
=
+
ω(t0 ) dt0 ⇒
=
+
ω(t0 ) dt0 ,
(14)
ω(t)
Be Bec2 π
dt ω(t)
dt Be Bec2 π
0
0
2
also
b
b
−ω̇(t)
E
ω̇(t)
E
=
ω(t) ⇒ − 3
=
.
2
2
ω (t)
Bec π
ω (t)
Bec2 π
(15)
Dies ist nun eine gewöhnliche Differentialgleichung, die sich durch Trennung der Veränderlichen und anschließende Integration lösen lässt:
Z
Z
b
b
E
dω
E
dω
=
dt
⇒
−
=
dt0 ,
3
2
3
ω
Bec π
ω
Bec2 π
ω
−
t
ω0
(16)
0
also
1
2
µ
1
1
− 2
2
ω
ω0
¶
=
b
b
1
1
2E
E
t⇒ 2 =
t+ 2 .
2
2
Bec π
ω
Bec π
ω0
(17)
Das Endergebnis lautet:
ω(t) = q
ω0
b 2
2Eω
0
Bec2 π t
.
(18)
+1
Aufgabe 3
a)
Das Proton der kinetischen Energie Ekin hat dann seinen kleinsten Abstand rmin zum Kern erreicht, wenn die
gesamte kinetische Energie in potentielle Energie umgewandelt wurde, also
!
Ekin = Epot =
Ze2
Ze2
⇒ rmin =
.
4πε0 rmin
4πε0 Ekin
(19)
Dann gilt
Energie
rmin
1 MeV
1, 14 · 10−13 m
10 MeV
1, 14 · 10−12 m
1
Berechnen wir den Radius eines Goldkerns über R = 1, 3A 3 fm (wobei A die Anzahl der Nukleonen, also die
Summe von Ordnungszahl (Protonenzahl) N und Neutronenzahl N ist), so erhält man RAu ≈ 7, 6 fm wegen
A = 197. Dann ergibt sich
E=
Ze2
≈ 1, 50 · 107 eV .
4πε0 rAu
(20)
b)
Als anomale Rutherfordstreuung bezeichnet man die Abweichung des gemessenen Wirkungsquerschnitts (bzw.
der damit zusammenhängenden Größen wie die Anzahl der gestreuten Teilchen) vom theoretischen RutherfordWirkungsquerschnitt.
3
Eine solche Abweichung tritt bei entweder bei festem Streuwinkel ab einer bestimmten Energie des streuenden
α-Teilchens (links) bzw. ab einem bestimmten Winkel bei fester Energie des α-Teilchens (rechts) auf. Der
Wirkungsquerschnitt genügt ab einem bestimmten Punkt nicht mehr der Rutherford-Formel, sondern fällt
exponentiell ab. Dieses Verhalten lässt sich dadurch erklären, dass bei hoher Energie bzw. großen Streuwinkel
das α-Teilchen dem Atomkern sehr nahe gekommen sein muss.
Die Rutherford-Streuformel berücksichtigt nur das elektromagnetische Coulomb-Potential des Kerns, vernachlässigt jedoch quantenmechanische Effekte, wie beispielsweise solche der Kernphysik. Diese werden wichtig,
wenn das α-Teilchen dem Kern sehr nahe kommt, was auch aus folgendem Bild klar wird:
4
Hier wurden experimentell gemessene Wirkungsquerschnitte σ für
die Streuung eines α-Teilchens an Goldatomen aus verschiedenen
Experimenten mit dem erwarteten Rutherford-Wirkungsquerschnitt
σ0 verglichen und zwar durch Bildung des Quotienten (aus
H. E. Wegner, R. M. Eisberg und G. Igo: Elastic Scattering of
”
40-Mev Alpha Particles from Heavy Elements“, Phys. Rev. 99,
825 - 833 (1955)). Aufgetragen sind diese über dem kleinsten Abstand der klassischen Flugbahn bei gegebener Energie und gegebenem Streuwinkel. Die Abweichung von der Rutherford-Formel tritt
ein bei einem Abstand, welcher der Summe auf dem Radius des
α-Teilchens, dem Goldatom und zusätzlichen 1 - 2 fm entspricht.
Dies bedeutet, dass die gemessenen Werte dann abweichen, wenn
das α-Teilchen den Kern fast berührt, weil dann quantenmechanische/kernphysikalische Effekte wie die starke Wechselwirkung wichtig werden. Der zusätzliche Unterschied von 1 - 2 fm entspricht der
kurzen Reichweite der starken Kraft.
c)
Der Streuwinkel der Rutherford-Streuung ist gegeben durch
µ
¶
4πε0
ϑ = π − 2 arctan
·
b
·
E
,
kin
Ze2
(21)
mit dem Stoßparameter b. Einsetzen der Werte b = 2, 6 · 10−13 m und Ekin = 4 · 106 eV führt auf ϑ ≈ 0, 22 (im
Bogenmaß) bzw. ϑ ≈ 12, 5◦ .
Aufgabe 4
a)
Zur Zeit als das Experiment des Photoeffekts zum ersten mal durchgeführt wurde, war bekannt, dass Licht
eine elektromagnetische Welle ist, eine Welle, die aus elektrischen und magnetischen Feldern besteht. Diese
Felder induzieren sich gegenseitig, womit sich die Welle durch das Vakuum bewegen kann ohne einen Träger,
wie dieser bei mechanischen Wellen erforderlich ist. Die schon bekannten Maxwellschen Gleichungen lieferten
die mathematische Beschreibung von elektromagnetischen Wellen. Hieraus folgt auch, dass die Lichtintensität
I proportional zum Betragsquadrat der elektrischen Feldstärke ist, also I ∼ |E|2 . Wollte man das Herauslösen
der Elektronen aus dem Metall mit Hilfe der Maxwellschen Gleichungen beschreiben, so müsste man annehmen,
dass die Elektronen durch das elektromagnetische Feld Lichtwelle selbst zu Schwingungen angeregt werden.
Dies würde so lange passieren, bis sie aus dem Metall herausgerissen werden. Dann müsste jedoch die Energie
der Elektronen von der Feldstärke und somit auch der Intensität des Lichts abhängen, was jedoch eben nicht
der Fall ist. Außerdem kann man auch nicht erklären, warum das Licht eine minimale Frequenz haben muss,
damit Elektronen ausgelöst werden. Nach den Maxwellschen Gleichungen sollte ja eine einfache Erhöhung der
Lichtintensität ausreichen, um Elektronen zu befreien. Somit konnten mit Hilfe der klassischen Wellentheorie
des Lichts die Ergebnisse des Experiments nicht erklärt werden und eine neue Theorie war notwendig.
Die Erklärung wurde erst von Einstein geliefert, wofür er den Nobelpreis für Physik erhielt. Er nahm an, dass
die Energie einer Lichtwelle in kleine Portionen eingeteilt, also gequantelt ist. Diese Energiequanten wurden
Photonen genannt. Die Energie eines solchen Photons hängt von der Frequenz ν (bzw. Wellenlänge λ) des
Lichtes ab und ist gegeben durch:
h·c
,
(22)
λ
wobei c die Lichtgeschwindigkeit und h eine Proportionalitätskonstante (das Plancksche Wirkungsquantum)
ist. Mit dieser Annahme war es möglich, den Photoeffekt zu erklären. Ein Elektron kann demnach aus dem
Metall herausgelöst werden, wenn es ein Photon aufnimmt, das genügend Energie besitzt. (Zum Herauslösen
eines Elektrons wird eine bestimmte Ablöseenergie Wa benötigt, die vom Metall abhängt.) Der Rest, also die
Energie h · ν − Wa steht dem Elektron als kinetische Energie
E =h·ν =
Wkin =
1
mv 2 ,
2
(23)
5
zur Verfügung. Damit ist klar, dass die Energie der Elektronen von der Frequenz des Lichts abhängt, nicht
aber von dessen Intensität. Ändert man die Intensität des Lichts, ändert sich auch die Anzahl der Photonen
und damit auch die Zahl der Elektronen, die aus dem Metall herausgelöst werden. Dies führt zu einem Anstieg
oder Abfall des gemessenen elektrischen Stroms.
Die Erklärung des Photoeffekts führte zu den Anfängen der Quantenmechanik.
b)
ν [1014 1/s]
eU [eV]
13,8889
2,83
11,5385
1,86
9,46372
1,00
8,15217
0,45
7,44417
0,16
Theoretisch liegen die Werte auf einer Geraden eU = hν − WA , wobei h das Plancksche Wirkungsquantum
und WA die Austrittarbeit der Elektronen ist. Mittels GnuPlot lässt sich eine Ausgleichgerade an die Daten
legen.
Man erhält dann
h = (4, 14645 · 10−15 ± 5, 994 · 10−18 ) eV · s ,
WA = (2, 92687 ± 0, 006215) eV .
(24)
Hieraus ergibt sich der bekanntere Wert
h = (6, 6261 · 10−34 ± 9, 60239 · 10−37 ) Js .
(25)
6
Handout zum Übungsblatt Nr.3
Aufgabe 1
a)
Nach der Energie-Massen-Äquivalenz von Einstein gilt:
m=
E
Pt
100 W · 365 · 24 · 3600 s
= 2 =
≈ 3, 5 · 10−8 kg .
¡
¢2
c2
c
3 · 108 ms
(1)
b)
Die Energie breitet sich in alle Richtungen gleich (isotrop) aus. Damit ist die Energie pro Fläche in einer
Entfernung r von der Glühlampe gegeben durch E/(4πr2 ). Damit das Auge das Licht noch wahrnehmen kann,
muss die Energie, welche in die Pupille der Fläche π(d/2)2 fällt, der Energie von fünf Photonen grünen Lichts
entsprechen:
E
·π
4πr2
µ ¶2
d
hc
!
=5 .
2
λ
(2)
Dies führt auf
s
r
1
Eλ
1
100 J · 500 · 10−9 m
r= √ d
= √ · 8 · 10−3 m ·
≈ 1, 42 · 107 m = 14200 km .
ch
3 · 108 ms · 6, 626 · 10−34 Js
4 5
4 5
(3)
c)
Nach dem Wienschen Verschiebungsgesetz gilt folgender Zusammenhang:
λmax · T = const. = 2897, 8 · 10−6 m · K .
(4)
Dies führt dann auf
T =
2897, 8 · 10−6 m · K
≈ 5800 K .
500 · 10−9 m
(5)
Aufgabe 2
Herleitung der Compton-Formel
• Energieerhaltung:
Eγ + Ee = Eγ0 + Ee0 ⇒ hν + mc2 = hν 0 +
p
(mc2 )2 + p2 c2 ,
(6)
und für p ¿ m (nicht-relativistischer Fall):
µ
¶
1
1
p2
hc
− 0 =
.
λ λ
2m
(7)
• Impulserhaltung:
Hier sei ~k der Impuls des einlaufenden Photons, ~k0 der Impuls des gestreuten Photons und p der
Impuls des Elektrons.
– in x-Richtung:
µ
~kx =
~kx0
0
+ px ⇒ ~k = ~k cos θ + p cos φ ⇒ h
1
1
− 0 cos θ
λ λ
¶
= p cos φ .
(8)
– in y-Richtung:
~ky = ~ky0 + py ⇒ 0 = −~k 0 sin θ + p sin φ ⇒
h
sin θ = p sin φ .
λ0
(9)
Quadrieren und Addition der Gleichungen (8) und (9) führt auf
1
2 cos θ
1
p2
−
+ 02 (sin2 θ + cos2 θ) = 2 (sin2 φ + cos2 φ) ,
2
0
λ
λλ
λ
h
(10a)
1
2 cos θ
1
p2
−
+
=
.
λ2
λλ0
λ02
h2
Einsetzen von Gl. (10b) in Gl. (7) ergibt:
¶
µ
¶
µ
1
h2
1
2 cos θ
1
1
−
=
−
+ 02
hc
λ λ0
2m λ2
λλ0
λ
(10b)
(11)
Compton leitete die nach ihm benannte Formel im Grenzfalle her, dass die Änderung der Wellenlänge sehr
klein ist: λ0 − λ ≡ ∆λ ¿ λ. Dazu sind die folgenden Entwicklungen hilfreich:
µ
¶
1
1
1
1
∆λ
∆λ2
¡
¢
=
=
=
−
+
O
,
(12a)
λλ0
λ(λ + ∆λ)
λ2
λ3
λ4
λ2 1 + ∆λ
λ
1
1
=
=
02
λ
(λ + ∆λ)2
Ã
1
¡
λ 1+
!2
∆λ
λ
¢
µ
=
1
∆λ
− 2 +O
λ
λ
µ
∆λ2
λ3
¶¶2
1
2∆λ
= 2 − 3 +O
λ
λ
µ
∆λ2
λ4
Damit ergibt sich weiter:
µ
¶
∆λ
h2
2
2 cos θ
h2 1
hc 2 =
−
=
(1 − cos θ) ,
2
2
λ
2m λ
λ
m λ2
¶
.
(12b)
(13)
also schlussendlich
∆λ =
h
(1 − cos θ) .
mc
(14)
a)
Die kinetische Energie Ekin des Elektrons ergibt sich direkt aus der Herleitung und zwar aus Gl. (13). Die
Größe auf der rechten Seite nämlich Ekin :
Ekin =
h2 1
(1 − cos θ) .
m λ2
(15)
Die kinetische Energie wird maximal für einen Streuwinkel θ des Photons von θ = π. Dann gilt
Ekin =
2h2 1
.
m λ2
(16)
Der Streuwinkel φ des Elektrons ergibt sich aus Gl. (9) zu φ = nπ mit n ∈ Z. Es muss jedoch auch noch Gl.
(8) berücksichtigt werden. Unter der Näherung, dass ∆λ ¿ λ ergibt sich
√
h
2h √
(1 − cos θ) =
1 − cos θ cos φ ,
(17)
λ
λ
was für θ = π schließlich auf den Winkel φ = 0 führt.
2
b)
Prinzipiell könnten wir Gl. (16) verwenden. Genauer ist jedoch folgende Abschätzung, die sich mittels der
Photonenergien Eγ und Eγ0 ergibt:
Ekin = Eγ − Eγ0 = hc
Eγ Eγ0
Eγ Eγ0
∆λ
h
=
hc
·
(1
−
cos
θ)
·
=
(1 − cos θ) ,
λλ0
mc
(hc)2
mc2
(18)
also
Eγ0 =
1+
Eγ
Eγ
mc2 (1 −
cos θ)
.
(19)
Die kinetische Energie ergibt sich dann zu
Ekin = Eγ − Eγ0 =
Eγ Eγ0
(1 − cos θ) =
mc2
1+
Eγ
mc2
Eγ (1−cos θ)
.
(20)
Einsetzen der Zahlenwerte in Gl. (16) führt auf
Ekin =
2 · (6, 626 · 10−34 J)2
1
eV
·
J ≈ 4, 2 · 10−5 eV .
−31
−9
2
−19
9, 11 · 10
kg · (400 · 10 m) 1, 602 · 10
(21)
Gl. (20) führt auf den Zahlenwert Ekin ≈ 3, 8 · 10−5 eV .
c)
Damit die Energie des Photons komplett auf das Elektron übertragen wird, muss h/λ0 = 0 sein. Aus Gl. (8)
folgt dann φ = nπ mit n ∈ Z und aus Gl. (9) ergibt sich h/λ = p. Eingesetzt in (6) liefert dies
p
hν + mc2 = (mc2 )2 + (hν)2 .
(22)
Quadrieren führt auf
(hν)2 + (mc2 )2 = (mc2 )2 + 2hν(mc2 ) + (hν)2 ,
(23)
was nur für ν = 0 zu erfüllen ist.
d.)
Aus Eγ0 = Eγ − Ekin ergibt sich die Wellenlänge des gestreuten Photons:
λ0 =
6, 626 · 10−34 · 3 · 108 ms
hc
=
≈ 3, 10 · 10−12 m .
Eγ − Ekin
(500 · 103 − 0, 1 · 106 ) · 1, 602 · 10−19 J
(24)
Die Wellenlänge des einlaufenden Photons beträgt λ ≈ 2, 48 · 10−12 m. Aus der Compton-Formel ergibt sich
der Streuwinkel des Photons:
µ
¶
¶
µ
9, 11 · 10−31 k · 3 · 108 ms · 6, 20 · 10−13 m
mc∆λ
= arccos 1 −
≈ 41, 9◦ .
θ = arccos 1 −
(25)
h
6, 626 · 10−34 Js
Aufgabe 3
a.)
Im Folgenden sei Vtr das Volumen und mtr die Masse eines Tröpfchens. Ein Tröpfchen werde als kugelförmig
mit Radius r angenommen. Dann gilt Vtr = 4/3πr3 und mtr = Vtr %Öl . Prinzipiell sind folgende Kräfte bei der
Bewegung der Tröpfchen zu berücksichtigen:
• Gewichtskraft der Tröpfchen: Fg = mg
• Auftriebskraft der Tröpfchen in der Luft: Nach dem Archimedes’schen Prinzip ist die Auftriebskraft so
groß wie die Gewichtskraft der verdrängten Luft, also Fauf = Vtr %Luft = 4/3πr3 %Luft .
3
• Reibungskraft der Tröpfchen: Diese lässt sich mittels der Stokesschen Reibung
0
Fstokes = 6πηLuft
rv ,
0
ηLuft
=
ηLuft
,
1 + C λr
(26)
mit der Cunningham-Korrektur C. Der angegebene Zahlenwert C = 0, 83 wird erst am Ende eingesetzt.
• Elektrostatische Kraft auf das geladene Tröpfchen: Fel = qE mit Ladung q und elektrischem Feld E mit
Betrag E = U/d
b.)
• Steigendes Tröpfchen: |Fg | + |Fstokes | − |Fauf | − |Fel | = 0
4
U
4
U
4 3
0
0
πr %Öl + 6πηLuft
rv1 − πr3 %Luft − q = 0 ⇒ 6πηLuft
rv1 + πr3 (%Öl − %Luft ) = q .
3
3
d
3
d
(27)
• Sinkendes Tröpfchen: |Fg | − |Fstokes | − |Fauf | + |Fel | = 0
4
4
U
4 3
U
0
0
πr %Öl − 6πηLuft
rv2 − πr3 %Luft + q = 0 ⇒ −6πηLuft
rv2 + πr3 (%Öl − %Luft ) = −q .
3
3
d
3
d
(28)
Zunächst müssen wir den unbekannten Radius r des Tröpfchens eliminieren. Dazu ist es sinnvoll, die Gleichungen (27) und (28) zu addieren:
6π
ηLuft
4
4
4
(v1 − v2 ) + πr2 ∆%g = 0 ⇒ 6πηLuft (v1 − v2 ) + π∆%gr2 + πCλ∆%gr = 0 .
λ
3
3
3
1+Cr
(29)
Dies führt auf folgende quadratische Gleichung
r2 + Cλr +
9 ηLuft (v1 − v2 )
= 0,
2
∆%g
(30)
mit der Lösung
q
r1/2 =
−Cλ ±
(Cλ)2 −
9ηLuft (v1 −v2 )
∆%g
2
Cλ
=−
±
2
sµ
Cλ
2
¶2
−
9 ηLuft (v1 − v2 )
.
4
∆%g
(31)
Nur die erste Lösung ist physikalisch sinnvoll, denn die zweite ist negativ. Subtraktion der Gl. (27) und (28)
führt auf:
6π
ηLuft
U
r(v1 + v2 ) − 2q = 0 ,
λ
d
1+Cr
(32)
was sich nach q auflösen lässt:
q = 3π
ηLuft
d
r(v1 + v2 ) =
λ
U
1+Cr
= 3πr2
d
ηLuft
(v1 + v2 ) ,
r + Cλ
U
r=−
Cλ
+
2
sµ
Cλ
2
¶2
−
9 ηLuft (v1 − v2 )
,
4
∆%g
(33)
mit dem Zahlenwert C = 0, 83 für die Cunningham-Korrektur.
Nun gibt es auch konkrete Zahlenwerte ;-)
−7
Radius (C = 0) [10 m]
Ladung (C = 0) [10−19 C]
Radius (C = 0, 83) [10−7 m]
Ladung (C = 0, 83) [10−19 C]
(1)
3,14
1,86
2,75
1,26
(2)
4.52
5,30
4,13
4,03
(3)
2,86
2.34
2.48
1,52
(4)
3.93
3.90
3.54
2,84
(5)
5.08
7.01
4,69
5.49
(6)
4.01
3.51
3,62
2.57
(7)
3.03
2.09
2.65
1.39
Einteilung der Ladungen in Gruppen und Bildung der Mittelwerte führt auf e = 1, 87 · 10−19 C (mit C = 0)
und e = 1, 36 · 10−19 C (mit C = 0, 83). Die Fehlerrechnung schenke ich mir jetzt hier ;-)
4
Handout zum Übungsblatt Nr.4
Aufgabe 1
Die Heisenbergsche Unbestimmtheitsrelation besagt zum Beispiel zwischen Ort und Impuls:
∆x · ∆p ≥
~
.
2
(1)
Schränken wir die Unbestimmtheit des Orts des Elektrons auf den Bereich des Kerns ein, so ist ∆x = 2rK =
1
2, 6 · 10−15 A 3 m mit der Nukleonenzahl A. Dann ist die Unbestimmtheit seines Impulses:
∆p ≥
6, 626 · 10−34 Js
2, 03 · 10−20 kg · m
~
=
.
≈
1
1
2∆x
s
8π · 1, 3 · 10−15 A 3 m
A3
(2)
Dies führt zu einer Unbestimmtheit der kinetischen Elektrons:
³
´2
−20 kg·m
2,
03
·
10
2
s
(∆p)
1
eV
1, 41 · 109
≥ 2
≈
∆Ekin =
·
eV .
2
−19
2m
J
A 3 · 2 · 9, 10 · 10−31 kg 1, 602 · 10
A3
(3)
Um dafür zu sorgen, dass das Elektron auf diesen Bereich beschränkt bleibt, müsste die kinetische Energie
durch eine ebenso große Bindungsenergie ausgeglichen werden, die auch für sehr schwere Kerne im Bereich von
MeV liegen würde. Die Bindungsenergie von Elektronen im Atom liegt jedoch im eV-Bereich!
Aufgabe 2
Zunächst berechnen wir die Masse der Gasmoleküle über die mittlere kinetische Energie:
hEkin i =
3
! 1
kB T = mhv 2 i .
2
2
(4)
Daraus folgt
m=
J
· 320 K
3 · 1, 38 · 10−23 K
3kB T
=
≈ 5, 32 · 10−26 kg .
¡
¢
2
m 2
hv i
499
(5)
s
Mit der atomaren Masseneinheit 1 u = 1, 66 · 10−27 kg ergibt sich dann eine Molekülmasse von 32, 1 u , also
handelt es sich wahrscheinlich um O2 . Dann können wir noch die de-Broglie-Wellenlänge berechnen:
λdB =
h
h
h
6, 626 · 10−34 Js
= p
=√
=q
mv
3mkB T
m hv 2 i
3 · 5, 32 · 10−26 kg · 1, 38 · 10−23
J
K
≈ 2, 50 · 10−11 m .
· 320 K
(6)
Aufgabe 3
a)
Damit Beugungseffekte auftreten, sollte die de-Broglie-Wellenlänge des Körpers der Größe der Beugungsöffnung
entsprechen:
λdB =
h
6, 626 · 10−34 Js
h
=
=
≈ 1, 66 · 10−33 m .
p
mv
4 · 10−3 kg · 100 ms
(7)
Da die Größe von Atomen im Bereich von 10−10 m und die Atomkernen bei 10−15 m liegt, kann kein normaler
Körper durch eine solche Öffnung passen.
b)
Da die kinetische Energie schon einen nicht unbedingt kleinen Bruchteil der Ruhemasse des Neutrons ausmacht,
rechnen wir relativistisch. Aus der Gleichung Ekin = (γ − 1)mc2 ergibt sich
γ=
100 · 106 eV
Ekin
+
1
=
≈ 1, 11 .
mc2
940 · 106 eV
(8)
Damit folgt weiter v ≈ 0, 43c und
λdB =
h
6, 626 · 10−34 Js
=
mv
1, 67 · 10−27 kg · 0, 43 · 3 · 108
m
s
≈ 3, 09 · 10−15 m .
(9)
Man könnte also mit solchen Neutronen Atomkerne untersuchen.
c)
Das Elektron nimmt beim Durchlaufen der Spannung eine Energie von 200 eV auf. Da 200 eV ¿ 511 keV =
me c2 können wir nichtrelativistisch rechnen. Die Geschwindigkeit des Elektrons ist gegeben durch:
s
r
¢2
¡
2 · 200 eV · 3 · 108 ms
2Ekin
m
v=
=
≈ 8, 39 · 106 .
(10)
m
511 · 103 eV
s
Dann ergibt sich die de-Broglie-Wellenlänge zu
λdB =
h
6, 626 · 10−34 Js
=
mv
9, 10 · 10−31 kg · 8, 39 · 106
m
s
≈ 8, 68 · 10−11 m .
(11)
Der Abstand liegt also bereits im Bereich von 1 Å, was der Größenordnung von Atomen entspricht, also auch
dem Gitterabstand in Festkörpern.
Aufgabe 4
a)
Mit dem angegebenen Integral ergibt sich die Normierungskonstante:
+∞
+∞
µ 2¶
√
Z
Z
x
π !
2
2
2
2
= 1,
|φ(x)| dx = N
x exp − 2 = N
σ
2σ 3
−∞
(12)
−∞
also
√
|N | = √
4
2
3
πσ 2
.
(13)
Die Normierungskonstante ist nur betragsmäßig festgelegt, also bis auf eine globale Phase exp(iϕ).
b)
Der Ort, an dem sich das Teilchen am wahrscheinlichsten befindet, ist der mit maximaler Wahrscheinlichkeitsdichte %(x) = |φ(x)|2 . Damit ergibt sich:
Ã
!
½
µ 2¶
µ 2 ¶¾
µ
¶
3
2
22
d%(x)
d|φ(x)|2
x
2x
x
x
x
!
=
= N 2 2x exp − 2 − 2 exp − 2
= 2N 2 x 1 − 2 exp −
= 0 . (14)
dx
dx
σ
σ
σ
σ
σ
Damit ergeben sich die Extremwerte bei x1 = 0 und x2/3 = ±σ. Mittels der zweiten Ableitung kann man noch
nachprüfen, dass x1 ein Minimum und x2/3 Maxima sind ;-)
Der Mittelwert des Teilchenorts ist gerade der Erwartungswert des Ortsoperators, also hb
xi. In der Ortsdarstellung gilt x
b = x und damit
hb
xi =
+∞
+∞
+∞
µ 2¶
Z
Z
Z
x
φ∗ (x)b
xφ(x) dx =
|φ|2 x dx = N 2
x3 exp − 2 = 0 ,
σ
−∞
−∞
(15)
−∞
2
da es sich um das Integral über eine zum Ursprung punktsymmetrische Funktion handelt, wobei das Integrationsintervall symmetrisch ist.
Anmerkung: Zwar handelt es sich bei den oben berechneten Werten x2/3 um Orte, an denen sich das Teilchen mit größter Wahrscheinlichkeit aufhält. Bei einer Ortsmessung bestimmt man jedoch nach wie vor den
Ortserwartungswert hb
xi und man wird x = 0 als Mittelwert bzw. wahrscheinlichsten Wert der Messung
erhalten.
Aufgabe 5
Bohrsche Postulate
1) Es sind nur bestimmte Elektronenbahnen, denen diskrete Energieniveaus En (mit n = 1, 2, . . . ) zugeordnet werden, stabil. Diese ergeben sich aus der Quantisierungsbedingung des Drehimpulses (Auswahlregel):
Ln = n~ ,
n ∈ N ∪ {0} .
(16)
Eine Verallgemeinerung dieser Quantisierungsbedingung ist die Bohr-Sommerfeld-Bedingung
I
p dq = nh ,
(17)
für ein Paar (p, q) von kanonisch konjugierten Variablen, wobei das Integral über einen geschlossenen
Weg im (p, q)-Phasenraum zu berechnen ist. Im Falle der kanonisch konjugierten Variablen (L, ϕ) und
bei Integration über einen Kreis ergibt sich daraus gerade Gl. (??). Benutzen wir hier zusätzlich die
de-Broglie-Bedingung λ = h/p, so ergibt sich
I
I
h
!
dq = nh ⇒ dq = nλ ,
(18)
λ
also hängt die Quantisierungsbedingung in Gl. (??) mit der anderen Formulierung zusammen, dass die
de-Broglie-Wellenlänge des Elektrons ganzzahlig auf die Kreisbahn passen muss.
2) Der Radius der Elektronenbahn ändert sich sprunghaft unter Emission bzw. Absorption eines Lichtquants,
dessen Energie hνnm der Differenz zwischen zwei Energieniveaus En und Em entspricht, also hνnm =
En − Em .
Dieses Postulat wurde vom Ritzschen Kombinationsprinzip von Atomspektren motiviert, das verschiedene Emissions- bzw. Absorptionslinien miteinander in Verbindung bringt. Betrachten wir beispielsweise drei Niveaus der Energien E1 < E2 < E3 , so sind Übergange 1 7→ 2 und 2 7→ 3 durch Einstrahlung
von Lichtquanten der folgenden Frequenz möglich:
ν17→2 =
E2 − E1
,
h
ν27→3 =
E3 − E2
.
h
(19)
Andererseits gibt es jedoch auch noch eine dritte Absorptionslinie, welche dem direkten Übergang 1 7→ 3
entspricht:
ν17→3 =
E2 − E1
E3 − E2
E3 − E1
=
+
= ν17→2 + ν27→3 .
h
h
h
(20)
Sommerfeld-Modell
Im Sommerfeld-Atommodell ist eine erlaubte Elektronenbahn nicht nur durch ihre Bohrsche Quantenzahl n
charakterisiert, sondern es wird noch eine zweite Quantenzahl (Nebenquantenzahl) l = 0, 1, . . . , n−1 benötigt,
so dass Energie und Drehimpuls festgelegt sind. Die Bahnen mit n > 0 und l = 0 entsprechen den Bohrschen
Kreisbahnen, während die mit p
l > 0 Ellipsen sind. Es gilt außerdem der Zusammenhang L = (l + 1)~ (welcher
jedoch von der Gleichung L = l(l + 1)~ der modernen Quantenmechanik abweicht).
Rydberg-Atome
Rydberg-Atome sind sehr stark angeregte Atome, die sich in Zuständen mit der Hauptquantenzahl n & 100
befinden. Solche Atome besitzen folgende Eigenschaften:
3
• Die Elektronen sind sehr weit vom Kern entfernt und es nur eine sehr kleine Ionisierungsenergie
E=
Z 2 Ry hc
,
n2
Ry =
me4
,
8ε20 h3 c
(21)
benötigt, um das Elektron aus dem Atom zu schlagen“. Es Ab n = 23 reicht bereits thermische Energie
”
kB T bei Zimmertemperatur (T = 293 K) aus, um solche Atome zu ionisieren. Deshalb findet man diese
auch nur in der oberen Atmosphäre oder im Weltall.
• Die Elektronen können in guter Näherung klassisch betrachtet werden. Dies entspricht dem Korrespondenzprinzip, welches besagt, dass für große Quantenzahlen die quantenmechanische Beschreibung in
die klassische Beschreibung übergeht.
• Solche Atome sind sehr langlebig, da sich Ortswellenfunktionen (und damit die Aufenthaltswahrscheinlichkeitsräume im Ortsraum) der Zustände hoher n nur sehr geringfügig überlappen und damit spontane
Übergänge in Zustände mit kleinerem n nur eine kleine Wahrscheinlichkeit haben.
4
Handout zum Übungsblatt Nr.5
Aufgabe 1
Wurde schon auf dem letzten Blatt behandelt :-)
Aufgabe 2
a)
Das ist sinnvoll, weil die Wellenlänge vom Medium abhängt: λmed = λ0 /n, wobei λ0 die Wellenlänge im
Vakuum und n die Brechzahl des Mediums ist.
b)
Die Frequenz hängt im Gegensatz zur Wellenlänge (sowie auch der Ausbreitungsgeschwindigkeit elektromagnetischer Wellen) nicht vom Medium ab. Beispielsweise gilt für den Übergang von einem Medium mit Brechungsindex n1 in eines mit Brechungsindex n2 :
ν=
c1
c2
=
,
λ1
λ2
c1 =
c0
,
n1
c2 =
c0
,
n2
λ1 =
λ0
,
n1
λ2 =
λ0
,
n2
(1)
wobei c0 die Vakuum-Lichtgeschwindigkeit ist.
c)
Die Wellenzahl k ist definiert über k = 2π/λ. Da λ vom Medium abhängt, gilt das auch für k:
kmed =
2π
2π
=
n = k0 n .
λmed
λ0
(2)
Aus E = ~ω und ω(k) = ck (für elektromagnetische Wellen) folgt der Zusammenhang E = ~ck.
Aufgabe 3
a)
Die Ionisierungsenergie entspricht Eion = E∞ − E1 = 15, 6 eV.
b)
Aus den üblichen Beziehungen ergibt sich:
λ=
3 · 108 ms · 6, 626 · 10−34 Js
2π
2πc
2πc~
ch
=
=
=
=
≈ 9, 93 · 10−8 m .
k
ω
∆E
E3 − E1
12, 5 · 1, 602 · 10−19 C
(3)
c)
Um das Atom anzuregen, müsste das Elektron mindestens eine Energie von E2 − E1 = 10, 3 eV haben. Da dies
nicht der Fall ist, hat das Elektron auch nach dem Stoß noch die Energie von 6 eV.
d)
Das Elektron kann entweder das Atom auf den zweiten Zustand anregen und damit eine Energie von 10, 3 eV
verlieren. Dann verbleiben dem Elektron 1, 7 eV. Die andere Möglichkeit ist, dass das Elektron das Atom
nicht anregt. Dann wird es einfach aufgrund der negative geladenen Elektronenhülle zurück gestreut und ihm
verbleibt seine komplette kinetische Energie von 12 eV.
Aufgabe 4
Wir betrachten das Problem unter Berücksichtigung von Energie- und Impulserhaltung und ziehen verschiedene
Grenzfälle in Betracht:
1) Nicht-relativistische Rechnung, Photonenergie soll vollständig in kinetische Energie des Atoms umgewandelt werden:
1
h
hν
hν = mv 2 ,
=
= mv .
(4)
2
λ
c
Einsetzen der zweiten Gleichung in die erste führt auf
hν =
h2 ν 2
⇒ ν1 = 0 ,
2c2 m
ν2 =
2mc2
.
h
(5)
Der Prozess ist also nur möglich für ein Photon der Energie hν2 . Doch muss man beachten, dass mc2
bereits im GeV-Bereich liegt, weshalb unsere nicht-relativistische Näherung eigentlich nicht mehr gerechtfertigt ist. Deshalb rechnen wir das Ganze gleich nochmal relativistisch.
2) Relativistische Rechnung, Photonenergie soll vollständig in kinetische Energie des Atoms umgewandelt
werden:
hν
hν = (γ − 1)mc2 ,
= γmv .
(6)
c
Die zweite Gleichung führt auf
p
(hν)2 + (mc2 )2
v
hν
1
, γ=q
=
= ±p
.
(7)
2
c
(mc2 )2
(hν)2 + (mc2 )2
1− v
c2
Einsetzen in die erste Gleichung ergibt dann weiter
Ãp
!
2 + (mc2 )2 − mc2
p
(hν)
2
·
mc
=
hν = (γ − 1)mc2 =
(hν)2 + (mc2 )2 − mc2 .
mc2
(8)
Diese Gleichung ist nur zu erfüllen für ν = 0. Damit ist gezeigt, dass der Prozess so nicht möglich ist.
3) Relativistische Rechnung, Photonenergie soll teilweise in kinetische Energie umgewandelt werden
Ein Elektron im Atom soll auf einen höheren Zustand der Energie E 0 < hν angeregt werden. Dann gilt
für Energie- und Impulserhaltung:
hν = (γ − 1)mc2 + E 0 ,
hν
= γmv .
c
(9)
Eine analoge Rechnung wie bei (2), die ihr selbst als Übung durchführen könnt ;-) führt dann auf:
0
hν =
E
E 0 (E 0 − 2mc2 )
0 1 − 2mc2
.
=
E
E0
2(E 0 − mc2 )
1 − mc
2
(10)
Da Anregungsenergien E 0 im Bereich von eV und mc2 im Bereich von GeV liegt, ist der Prozess also nur
möglich für hν ' E 0 , wenn also die Photonenergie praktisch der Anregungsenergie entspricht. (Deshalb
und auch wegen des Doppler-Effekts sind Spektrallinien ein bisschen verwaschen.) Die Absorption eines
Photons, dessen Energie sehr stark von E 0 abweicht, ist nicht möglich und damit ist auch das Problem
aus dem Tutorium gelöst :-)
Zusätzlich ist die sogenannte Raman-Streuung möglich. Damit wird die inelastische Streuung eines Photons
and einem Atom/Molekül bezeichnet. Inelastisch heißt, dass die Energie des Photons hν nicht genau der
Differenz zweier Energieniveaus Ei+1 − Ei des Atoms entspricht. Dann kann es passieren, dass
• ein Photon bei der Streuung Energie verliert (Stokes-Raman-Streuung)
hν 0 = hν − (Ei+1 − Ei ) ,
(11)
• oder dass das Photon Energie gewinnt (Stokes-Raman-Streuung):
hν 0 = hν + (Ei+1 − Ei ) .
(12)
Nur, damit die Begriffe mal gefallen sind ;-)
2
Aufgabe 5
Die Balmer-Serie wird gebildet aus Übergängen E27→3 , E27→4 , . . . , E27→∞ . Um diese Absorptionslinien zu erzeugen, sollten sich genügend Atome in einem Balmer-Zustand mit n = 2 befinden. Im thermodynamischen
Gleichgewicht ist dieser Zustand nach dem Boltzmann-Gesetz jedoch exponentiell stark unterdrückt bei Zimmertemperatur (kB T ≈ 0, 025 für T = 293 K):
µ
µ
¶
¶
E2 − E1
10 eV
Nn=2 = N exp −
= N exp −
= N exp(−400) ≈ 1, 9 · 10−174 N .
(13)
kB T
0, 025 eV
Selbst, wenn wir Teilchenzahlen N im Molbereich betrachten, ist Nn=2 praktisch gleich null. Man kann die
exponentielle Boltzmann-Unterdrückung jedoch mildern, indem man zu höheren Temperaturen übergeht. Beispielsweise würde auf der Sonnenoberfläche mit TS = 5800 K gelten (mit kB T ≈ 0, 500 für TS = 5800 K):
¶
µ
10 eV
= N exp(−20) ≈ 2, 1 · 10−9 N .
Nn=2 = N exp −
(14)
0, 500 eV
Dieser Wert ist nun nicht mehr unerheblich klein im Gegensatz zu vorher. Deshalb kann man Balmer-Übergänge
in Sternen vermuten.
Aufgabe 6
Die zeitabhängige Schrödingergleichung ist gegeben durch
∂
b
H|ψ(x,
t) = i~ ψ(x, t) .
∂t
Mittels des Separationsansatzes
µ
¶
i
ψ(x, t) = ψ(x) exp − Et ,
~
(15)
(16)
folgt
µ
¶
µ
¶
i
i
b
Hψ(x)
exp − Et = Eψ(x) exp − Et ,
~
~
(17)
und wenn man die Exponentialfunktion herausdividiert die Eigenwertgleichung für die Energie, also die stationäre Schrödingergleichung:
b
Hψ(x)
= Eψ(x) .
(18)
Man kann das Problem noch allgemeiner angehen. Macht man einen Separationsansatz der Form
ψ(x, t) = φ(x)χ(t) ,
(19)
so folgt durch Einsetzen in die zeitabhängige Schrödingergleichung:
∂χ(t)
b
Hφ(x)χ(t)
= i~φ(x)
.
∂t
(20)
bzw. durch Division durch χ(t) 6= 0:
1 ∂χ(t)
b
Hφ(x)
= i~φ(x)
.
χ(t) ∂t
(21)
Die linke Seite der Gleichung hängt nur von x ab, womit auch die rechte Seite nur von x abhängen darf. Da
der Ausdruck
i~
1 ∂χ(t)
,
χ(t) ∂t
(22)
nicht von x abhängt und nicht von t abhängen darf, muss er konstant sein. Diese Konstante ist die Energie E:
i~
1 ∂χ(t)
=E.
χ(t) ∂t
(23)
3
Damit folgt die zeitunabhängige Schrödingergleichung (18). Betrachtet man außerdem noch die Differentialgleichung (23) für χ(t), so erkennt man die Lösung
µ
¶
i
χ(t) = exp − Et ,
(24)
~
in Einklang mit (17) und außerdem χ(t) 6= 0, was wir bei der Division durch χ(t) benötigt haben.
Aufgabe 7
a)
Wir unterteilen die x-Achse in zwei Gebiete, nämlich I1 = (0, a) und I2 = (−∞, 0] ∪ [a, +∞). Da das Potential
für x ∈ I2 unendlich hoch ist, handelt es sich bei I2 sogar um einen quantenmechanisch verbotenen Bereich, in
dem die Aufenthaltswahrscheinlichkeit, also |ψ(x)|2 (und damit auch die Wellenfunktion ψ(x)) eines Teilchens
verschwindet. Für x ∈ I1 müssen wir die Schrödinger-Gleichung lösen, die für diesen potentialfreien Bereich
wie folgt lautet:
~2 d2 ψ(x)
= Eψ(x) .
(25)
2m dx2
Dabei handelt es sich um eine homogene lineare Differentialgleichung 2. Ordnung bezüglich ψ(x) (analog zum
harmonischen Oszillator aus der klassischen Mechanik). Wir kennen deren Lösungen und zwar lassen sich
diese entweder als Linearkombination von komplexen Exponentialfunktionen {exp(ikx), exp(−ikx)} oder von
trigonometrischen Funktionen {cos(kx), sin(kx)} schreiben. Wir wählen die zweite Variante mit trigonometrischen Funktionen aus Gründen, die ein paar Zeilen später klar werden ;-) Also machen wir den Ansatz
ψ(x) = A cos(kx) + B sin(kx) mit noch zu bestimmenden Konstanten A, B und k.
Aufgrund der Forderung nach Stetigkeit der Wellenfunktion muss diese an den Rändern x1 = 0 und x2 = a
auf null abfallen, also sind die Randbedingungen ψ(x1 = 0) = 0 und ψ(x2 = a) = 0 zu erfüllen. Aus der ersten
Bedingung folgt sofort A = 0 und aus der zweiten lässt sich k bestimmen:
nπ
!
B sin(ka) = 0 ⇒ ka = nπ ⇒ k =
, n ∈ Z \ {0} .
(26)
a
Wir schließen n = 0 von vorn herein aus, da dies zu ψ(x) = 0 führt, was einem leeren (und damit auch
physikalisch uninteressantem Potentialtopf) entspricht. Wir bezeichnen die Wellenfunktion ab sofort mit dem
Index n, also als ψn (x). Unbestimmt ist jetzt nur noch die Konstante B. Diese ergibt sich durch Normierung
der Wellenfunktion:
+∞
Z
Za
³ nπ ´
2
2
x dx .
(27)
|ψn (x)| dx = B
sin2
a
−
−∞
0
Das Integral bestimmt man am Geschicktesten durch Umformung trigonometrischer Funktionen:
1
cos(2x) = cos2 (x)−sin2 (x) = cos2 (x)+sin2 (x)−2 sin2 (x) = 1−2 sin2 (x) ⇒ sin2 (x) = (1−cos(2x)) . (28)
2
Damit folgt
r
¶¾
·
µ
¶¸a
µ
Za ½
B2
B2
a
2nπ
B2 !
2
2nπ
1 − cos
x
dx =
x−
sin
x
=
a = 1 ⇒ |B| =
.
(29)
2
a
2
4πn
a
2
a
0
0
Damit gilt also
r
ψn (x) =
³ nπ ´
2
sin
x .
a
a
Einsetzen in die Schrödingergleichung liefert dann noch die Energieniveaus des Potentialtopfes:
)
(r
³ nπ ´
~2 d2 ψ(x)
~2 ³ nπ ´2
2
~2 ³ nπ ´2
!
−
=
sin
x
=
ψ(x) = Eψ(x) .
2
2m dx
2m a
a
a
2m a
Damit lässt sich E direkt ablesen:
~2 ³ nπ ´2
~2 k 2
=
.
E=
2m
2m a
(30)
(31)
(32)
Zeichnen könnt ihr die Wellenfunktionen selber ;-) (oder in die Musterlösung schauen)
4
b)
Wir interessieren uns für den Erwartungswert des Ortsoperators x
b für alle n. In der Ortsdarstellung gilt x
b=x
und damit:
+∞
+∞
Z
Z
Za
³ nπ ´
nπ
x=y
2
∗
2
hb
xin =
ψn (x)b
xψn (x) dx =
x|ψn (x)| dx =
x dx a =
x sin2
a
a
−∞
−∞
0
Znπ
2 ³ a ´2
= ·
y sin2 (y) dy .
a
nπ
(33)
0
Zur Berechnung des Integrals verwenden wir die Formel aus (a) und anschließende partielle Integration:
½
¾
Z
Z
Z
1
1 1 2 1
1
2
y sin (y) dy =
(y − y cos(2y)) dy =
y − y sin(2y) +
sin(2y) dy =
2
2 2
2
2
¾
½
1
1
=
y 2 − y sin(2y) − cos(2y) .
(34)
4
2
Damit gilt also
½
¾
Znπ
1
1
1
(nπ)2
y sin2 (y) dy =
(nπ)2 −
+ =
,
4
2
8
4
(35)
0
und somit
hxin =
2a
(nπ)2
a
·
=
.
2
(nπ)
4
2
(36)
Also werden viele Ortsmessungen des Elektrons im Potentialtopf ergeben, dass sich dieses im Mittel in der
Mitte des Topfes, also bei x = a/2 aufhält und das vollkommen unabhängig davon, in welchem Zustand (in
Abhängigkeit von n) sich das Elektron befindet.
c)
Die Energieniveaus des Potentialtopfes haben wir bereits in (a) berechnet. Der Grundzustand sei der mit n = 1
und der erste angeregte Zustand der mit n = 2, also:
¢ 3π 2 ~2
~2 π 2 ¡ 2
∆E = E2 − E1 =
2 − 12 =
=
2
2m a
2 ma2
³
´2
6,626·10−34 Js
2π
3π 2
eV
=
≈ 112, 8 eV .
−31
−10
2
2 9, 11 · 10
kg · (10
m) 1, 602 · 10−19 J
(37)
Zur Berechnung der Wahrscheinlichkeit, müssen wir über die Wahrscheinlichkeitsdichte |ψ1 (x)|2 des Grundzustands integrieren und zwar für das Intervall [x1 , x2 ] mit x1 = 0, 49 · 10−10 m und x2 = 0, 51 · 10−10 m.
Außerdem sollen wir die Näherung verwenden, dass wir die variable Wellenfunktion ψ(x) durch ihren Wert in
der Mitte des Intervalls, also ψ(x0 = 0, 5 · 10−10 m) ersetzen. Dies ist für den Grundzustand und im Bereich
der Mitte des Topfes sicher eine gerechtfertigte Näherung, da hier die Wellenfunktion wenig von x abhängt.
Dies liefert dann:
Zx2
Zx2
¯ ³ a ´¯2
¯
¯
2
P = |ψ1 (x)| dx ' |ψ1 (x0 )|2 dx = |ψ1 (x0 )|2 (x2 − x1 ) = ¯ψ1
¯ (x2 − x1 ) =
2
x1
x1
³π a´
2(x2 − x1 )
2 · (0, 51 − 0, 49) · 10−10 m
2
·
(x2 − x1 ) =
=
= 0, 04 .
= sin2
a
a 2
a
10−10 m
(38)
Aufgabe 8
Wir verwenden die folgende Formel für das allgemeine Gaußsche Integral (folgt durch quadratische Ergänzung,
Nachrechnen als Übung ;-)
+∞
r
µ 2
¶
Z
π
b
exp
+c ,
exp(−ax2 + bx + c) dx =
a
4a
(39)
−∞
5
welche sich aus dem Hinweis (quadratische Ergänzung plus anschließende Substitution) ergibt. Für t = 0 ist
zuerst die Wellenfunktion zu normieren.
Ã
!
+∞
¶
µ
Z
2
√
k2
x
exp(ikx) dk = N 2π∆k 2 exp −
=
ψ(x, t = 0) = N
exp −
1
2(∆k)2
4 · 2(∆k)
2
−∞
¶
µ
√
x2
= N 2π∆k exp −
.
(40)
2(∆k)2
Das ist genau das Zwischenergebnis. Nun zur Normierung:
+∞
+∞
µ
¶
Z
Z
p
x2
!
2
2
dx = 2πN 2 π(∆k)2 = 2π 3/2 N 2 (∆k) = 1
|ψ(x, t = 0)| dx = 2πN
exp −
2
(∆k)
−∞
(41)
−∞
Daraus folgt dann
|N | = √
1
.
2∆kπ 3/4
(42)
Um für t > 0 die Aufenthaltswahrscheinlichkeitsdichte |ψ(x, t)|2 zu bestimmen, müssen wir zunächst ψ(x, t)
berechnen. Dies funktioniert wie zuvor, ist jetzt aber ein bisschen aufwendiger. Betrachtet werden freie Teilchen
der Masse m; diese besitzen die Dispersionsrelation (Materiewellen)
E=
~2 k 2
,
2m
(43)
die sich direkt aus der freien Schrödinger-Gleichung ergibt. Nun ist
+∞
µ
Z
ψ(x, t) = N
exp −
−∞
k2
2(∆k)2
¶
½ µ
¶¾
~k 2
exp i kx −
t
dk =
2m
+∞
½
µ
Z
2
=N
exp −k
−∞
s
=N
π
+
1
2(∆k)2
s
=N
π
+
1
2(∆k)2
¶
¾
1
i~
+
t + ikx dk =
2(∆k)2
2m
x2
³
´
exp
−
=
i~
1
i~
4
+
t
2m t
2
2(∆k)
2m
µ
¶
2
x
1
i~
´
=
exp − ³
−
t
i~
2
~2 2
1
2(∆k)
2m
t
4
2m
4 +
2t
s
2πm
m + i~(∆k)2 t
= N ∆k
4(∆k)
½ µ
exp −
4m
1
i~
−
t
2(∆k)2
2m
¶
m2 (∆k)4 x2
2
m + ~2 (∆k)4 t2
¾
.
(44)
Prinzipiell könnte man diesen Ausdruck nun noch stark vereinfachen. Da wir aber nur an der Aufenthaltswahrscheinlichkeitsdichte |ψ(x, t)|2 interessiert sind, können wir damit weiter rechnen:
µ
¶
2πm
m2 (∆k)2
2
|ψ(x, t)|2 = N 2 (∆k)2 p
exp − 2
x
.
(45)
m + ~2 (∆k)4 t2
m2 + ~2 (∆k)4 t2
Mit dem zuvor bestimmten Normierungsfaktor gilt dann:
m∆k
|ψ(x, t)|2 = p
π(m2 + ~2 (∆k)4 t2 )
µ
exp −
m2 (∆k)2
x2
2
m + ~2 (∆k)4 t2
¶
.
(46)
• Dabei handelt es sich um eine Gaußfunktion mit zweiabhängiger Breite:
p
(∆x)(t) = 2
m2 + ~2 (∆k)4 t2
.
m∆k
(47)
6
Dies bedeutet, dass das Wellenpaket im Ortsraum mit der Zeit zerfließt. Dies geschieht für Dispersionsrelationen, die von quadratischer oder höherer Ordnung sind. Man kann außerdem nachrechnen, dass die
Breite des Wellenpakets im Impulsraum zeitlich konstant ist. Die Zeitabhängigkeit kommt erst durch die
Fourier-Transformation in den Ortsraum zustande.
• Die Fläche unter dem Wellenpaket hängt nicht von der Zeit ab:
+∞
Z
|ψ(x, t)|2 dx = p
−∞
m∆k
π(m2
+
~2 (∆k)4 t2 )
s
π
m2 (∆k)2
m2 +~2 (∆k)4 t2
= 1.
(48)
Darin steckt gerade die Erhaltung der Wahrscheinlichkeit (Unitarität).
7
Handout zum Übungsblatt Nr.6
Aufgabe 1
• Korrespondenzprinzip: Dieses besagt, dass für große Quantenzahlen sich quantenmechanische Systeme
klassisch verhalten. Beispielsweise lässt gehorcht ein Elektron in einem Atom, das sich in einem stark
angeregten Zustand mit n À 1 befindet (Rhydbergatom) mit sehr guter Näherung den klassischen
Bewegungsgleichungen à la Newton.
• Ehrenfest-Theorem: Dieses besagt, dass die quantenmechanischen Erwartungswerte (unter gewissen Voraussetzungen) die klassischen Bewegungsgleichungen erfüllen. Beispielsweise erfüllen hpi und hxi die klassischen Bewegungsgleichungen, sofern es sich um ein System mit einem Potential V (x) handelt, das
höchstens quadratisch in x ist.
Aufgabe 2
Das Positronium kann zunächst im klassischen Sinne als Zweikörperproblem aufgefasst werden. Dabei wird die
Bewegung in eine Bewegung bezüglich der Schwerpunktkoordinaten und eine bezüglich der Relativkoordinaten
zerlegt. Im allgemeinen ist die Schwerpunktsbewegung charakterisiert durch die Koordinate des Schwerpunkts
m1 r1 + m2 r2
,
M
R=
(1)
mit der Schwerpunktsmasse M = m1 + m2 . Der Schwerpunkt des Positroniums sei jedoch in Ruhe und somit
findet die Dynamik in den Relativkoordinaten r = |r1 − r2 | mit der effektiven Masse
m1 m2
,
m1 + m2
µ=
(2)
statt. Speziell für das Positronium gilt
m2e
me
=
.
2me
2
µ=
(3)
Betrachten wir nun das Problem im Zuge der alten Quantenmechanik“, also nach dem Bohrschen Atommodell.
”
In diesem ist der Drehimpuls quantisiert:
r
m 2 !
2~
Lz = ωr = n~ ⇒ r =
n.
(4)
2
mω
Aus dem Kräftegleichgewicht zwischen Coulomb-Kraft und Zentripetalkraft
!
FC = FZ ⇔
1 e2 ! m 2
= ω r,
4πε0 r2
2
(5)
lässt sich nun über Gl. (4) die Kreisfrequenz bestimmen:
ω2 =
√
1 e2 ³ m ´ 32 3
1 e2
1 e2 ³ m ´ 32
=
ω2 ⇒ ω =
,
3
2πε0 mr
2πε0 m 2~n
2πε0 m 2~n
(6)
also
ω=
1 e4 m3
me4
1
=
.
2
2
2
3
3
4π ε0 m 8~ n
32π 2 ε20 ~3 n3
(7)
Setzen wir dies nun wieder in den Radius r von Gl. (4) ein, so führt das auf:
r=
8πε0 ~2 2
n .
e2 m
(8)
Die gesamte Energie setzt sich zusammen aus der kinetischen und der potentiellen Energie im Coulomb-Feld.
Damit gilt
s
1 2 2
e2
1 2 ~n
e2
1
e2
m
e4 m
E = Ekin + Epot = µω r −
= µω
−
= ω~n −
·
=
2
2
4πε0 r
2
µω 4πε0 r
2
4πε0 2~n 32π ε20 ~3 n3
=
1
e4 m
e2
e2 m
e4 m
1
−
·
=
−
.
2
2
2
2
2
2
2
2
2
2 32π ε0 ~ n
4πε0 8πε0 ~ n
64π ε0 ~ n2
(9)
Einsetzen der Zahlenwerte liefert dann noch
E=
(1, 602 · 10−19 C)4 · 9, 11 · 10−31 kg
eV
1
6, 80
≈ − 2 eV ,
³
´
2
−19
2
¢
¡
−34 Js
1, 602 · 10
Jn
n
Vs 2
· 6,626·10
64π 2 8, 854 · 10−12 Am
2π
(10)
und
r = 1, 06 · 10−10 m ,
ω = 2, 07 · 1016
1
.
s
(11)
Aufgabe 3
a)
Eine analoge Rechnung wie zuvor mit der effektiven Masse
µ=
207me mp
207 · 9, 11 · 10−31 kg · 1, 637 · 10−27 kg
≈
≈ 1, 69 · 10−28 kg ,
207me + mp
207 · 9, 11 · 10−31 kg + 1, 637 · 10−27 kg
(12)
führt auf die Energie des Myoniums:
E=−
µe4
1
,
32π 2 ε20 ~2 n2
(13)
mit dem Zahlenwert
E=−
1, 69 · 10−28 kg · (1, 602 · 10−19 C)4
eV
1
2525
≈ − 2 eV .
´2 ·
³
−19
2
¡
¢
−34
2
1, 602 · 10
Jn
n
Js
Vs
32π 2 · 8, 854 · 10−12 Am
· 6,626·10
2π
(14)
b)
Für den Radius der Bohrschen Bahn mit n = 1 gilt (analog zur Aufgabe 3):
³
2
r=
4πε0 ~ 2
n =
e2 µ
4·
6,626·10−34 Js
2π
´2
π · 8, 854 · 10−12
As
Vm
(1, 602 · 10−19 C)2 · 1, 69 · 10−28 kg
≈ 2, 85 · 10−13 m .
(15)
c)
Die Energie des Photons entspricht der Differenz der Energieniveaus
∆E = E(n = 2) − E(n = 1) =
3µe4
,
128π 2 ε20 ~2
(16)
mit den Zahlenwert
∆E =
3 · 1, 69 · 10−28 kg · (1, 602 · 10−19 C)4
eV
¡
¢2 ³ 6,626·10−34 Js ´2 1, 602 · 10−19 J ≈ 1893 eV .
As
128π 2 · 8, 854 · 10−12 Vm ·
2π
(17)
2
Aufgabe 4
a)
Ein Minimum im Anodenstromverlauf deutet auf eine Anregung der Gasatome durch die Elektronen hin. Bei
einer Spannung UB = 4 V ist mit ∆UB = 2, 104 ist eine einzige Anregung möglich. Die Wellenlänge des Lichts,
das dann emittiert wird, entspricht der Energie dieser Anregung. Damit gilt
λ=
6, 626 · 10−34 Js · 3 · 108 ms
hc
eV
=
≈ 5, 90 · 10−7 m = 5, 90 nm .
−19
e∆UB
1, 602 · 10
C · 2, 104 V 1, 602 · 10−19 J
(18)
Dies entspricht gelbem Licht. Bei UB = 5 V können zwei Atome nacheinander angeregt werden, die dann aber
ebenfalls gelbes Licht abstrahlen.
b)
Natriumdampf oder das Edelgas
der beiden Gase handeln.
86
Krypton leuchten im gelben Spektralbereich; damit kann es sich um eines
c)
Damit eine Anregung stattfinden kann, muss die kinetische Energie der Elektronen der Anregungenergie e∆UB
entsprechen. Dies führt auf
r
2e∆UB
m
v=
≈ 8, 60 · 105 .
(19)
m
s
Wegen v ¿ c ist eine nicht-relativistische Rechnung gerechtfertigt.
Aufgabe 5
Schon das Heliumatom ist mit seinen zwei Elektronen quantenmechanisch (und auch klassisch) nicht exakt
lösbar. Der angegebene Wert der gesamten Ionisierungsenergie Ei = 79 eV wurde entweder durch Näherungsmethoden bestimmt oder ist ein experimenteller Wert. Ist dieser jedoch bekannt, kann die Energie zum Ablösen
des ersten bzw. zweiten Elektrons leicht bestimmt werden. Zum Ablösen des ersten Elektrons brauche man eine
Energie Ei,1 , die wir zunächst nicht kennen. Danach handelt es sich bei dem Heliumatom um ein Wasserstoffähnliches Atom mit der Kernladungszahl Z = 2 und dessen Ionisierungsenergie Ei,2 ist bekannt (siehe Wasserstoffatom und auch Aufgabe 3):
Ei,2 =
Z 2 e4 m
≈ 54, 4 eV .
32π 2 ε20 ~2
(20)
Daraus folgt dann sofort Ei,1 , denn die Summe aus Ei,1 und Ei,2 muss der gesamten Ionisierungsenergie Ei
entsprechen. Damit ist Ei,1 = Ei − Ei,2 ≈ 24, 6 eV.
Aufgabe 6
Das Atom befinde sich anfangs im Zustand mit n = 2 und nach der Emission im Zustand mit n = 1. Die
Energieerhaltung liefert
E(n = 2) = E(n = 1) + hν + TR ,
TR =
p2
,
2m
(21)
wobei hν die Energie des emittierten Photons und TR die Rückstoßenergie des Atoms ist. Der Rückstoßimpuls
p ergibt sich aus der Impulserhaltung und entspricht dem Impuls des Photons:
p=
hν
.
c
Löst man nun Gl. 21 nach ν auf, so ergibt sich mit ∆E = E(n = 2) − E(n = 1):
Ã
!
´ mc2 r
c ³p
2∆E
−1 .
ν=
(mc)2 + 2m∆E − mc =
1+
h
h
mc2
(22)
(23)
3
Wegen ∆E ¿ mc2 und
ν≈
√
1 + x = 1 + x/2 + O(x2 ) geht dies über in
mc2 ∆E
∆E
·
=
.
h
mc2
h
(24)
Damit können wir nun die Rückstoßenergie berechnen:
p2
1
TR =
=
2m
2m
µ
hν
c
¶2
≈
∆E 2
.
2mc2
(25)
Nun zu den Zahlenwerten:
∆E = E(n = 2) − E(n = 1) = −
e4 m
32π 2 ε20 ~2
µ
¶
1
−1
4
≈ 10, 2 eV .
(26)
Damit ergibt sich dann
TR = 5, 53 · 10−8 eV ,
(27)
also eine (sogar in der Einheit eV) sehr kleine Energie, die man gewöhnlicherweise vernachlässigen kann.
Nach der Energie-Zeit-Unbestimmtheitsrelation erhalten wir mittels der angegebenen Lebensdauer eine Energieunschärfe ∆E = ~/(2∆t) ≈ 1, 65 · 10−7 eV. Diese Unschärfe entspricht einer Linienbreite des Übergangs.
Damit die Resonanzabsorption stattfinden kann, muss die Frequenz des Photons eine Unschärfe besitzen (diese
entspricht der halben Linienbreite), so dass diese dazu dienen kann, um die nötige Rückstoßenergie für den
Kern zu liefern, also ∆E ≥ 2TR . Dies ist hier erfüllt, also ist Resonanzabsorption möglich.
4
Handout zum Übungsblatt Nr.7
Aufgabe 1
a)
Die in der Aufgabe angegeben Gleichung
X
εijk Li Lj = (L × L)k = i~Lk ,
(1)
i,j
ist eine andere Form des Kommutators
[Li , Lj ] = i~εijk Lk ,
(2)
den wir verwenden wollen. (Die Tatsache, dass das Kreuzprodukt von L mit sich selbst nicht verschwindet,
weist auf den Operatorcharakter des Drehimpulses hin.) Wir bezeichnen im Folgenden Lx := L1 , Ly := L2
und Lz := L3 . Damit folgt dann
"
#
3
3
3
3
X
X
X
X
2
2
[L3 , L ] = L3 ,
Li =
[L3 , L2i ] =
(Li [L3 , Li ] + [L3 , Li ]Li ) =
(Li ε3ik Lk + ε3ik Lk Li ) =
i=1
=
3
X
i=1
i=1
i=1
(3)
ε3ik (Li Lk + Lk Li ) = 0 .
i=1
Da ε3ik antisymmetrisch gegenüber einer Vertauschung von i und k und der Ausdruck Li Lk +Lk Li symmetrisch
ist, verschwindet das Produkt aus beiden, was zu zeigen war.
b)
Es sei F (ϑ, ϕ) ≡ Fl,m eine Eigenfunktion zu L2 . Auf diese wenden wir den Aufsteigeoperator L+ = Lx + iLy
und danach den Absteigeoperator L− = Lx − iLy an:
L− L+ Fl,m = (Lx − iLy )(Lx + iLy )Fl,m = (L2x + L2y + i[Lx , Ly ])Fl,m = (L2x + L2y − ~Lz )Fl,m =
= (L2 − Lz (Lz + ~))Fl,m .
(4)
Verwenden wir nun den Ansatz L2 Fl,m = ~2 ω 2 Fl,m und außerdem Lz Fl,m = ~mFl,m so führt dies auf
(L2 − Lz (Lz + ~))Fl,m = ~2 (ω 2 − m(m + 1))Fl,m .
(5)
Setzen wir m = mmax = l, so verschwindet die linke Seite der Gleichung, denn L+ Fl,mmax = L+ Fl,l = 0. Dann
muss auch die rechte Seite verschwinden:
!
ω 2 − mmax (mmax + 1) = ω 2 − l(l + 1) = 0 ,
(6)
was also auf
ω=
p
l(l + 1) ,
(7)
führt.
Aufgabe 2
Der Betrag des Drehimpulses ergibt sich zu
b =
|hLi|
p
l=3 √
l(l + 1)~ = 2 3~ .
(8)
Die Werte von m sind gegeben durch {−l, −l+1, . . . , l}, also für diesen speziellen Fall ist m ∈ {−3, −2, −1, 0, 1, 2, 3}.
Die Winkel zur z-Achse sind
Ã
!
m
ϑm = arccos p
.
(9)
l(l + 1)
Einsetzen führt auf ϑ1 = −ϑ−1 ≈ 73, 2◦ , ϑ2 = −ϑ−2 ≈ 54, 7◦ und ϑ3 = −ϑ−3 = 30◦ . Das Schaubild sieht dann
wie folgt aus:
Aufgabe 3
Für allgemeines n sind die Werte {0, 1, . . . , n − 1} für l möglich und für jeden Wert von l wiederum die Werte
{−l, −l + 1, . . . , l} wiederum für m. Das sind (2l + 1) Werte von m für ein bestimmtes l. Die Summe aller
möglichen Zustände ist dann
n−1
X
(2l + 1) = 2
n−1
X
l=0
l=0
1
+n = 2 · (n − 1)n + n = n2 − n + n = n2 .
2
(10)
Berücksichtigt man dann zusätzlich noch den Spin, so führt dies insgesamt zu 2n2 möglichen Zuständen. Nun
zu den Spezialfällen:
• n = 3: l ∈ {0, 1, 2}; l = 0: m = 0, l = 1: m ∈ {−1, 0, 1}, l = 2: m ∈ {−2, −1, 0, 1, 2}; 18 mögliche
Zustände
• n = 4: l ∈ {0, 1, 2, 3}; zusätzlich l = 3: m ∈ {−3, −2, −1, 0, 1, 2, 3}, 32 mögliche Zustände
Aufgabe 4
Der Drehimpuls ist gegeben durch
L = Θω = 10−3 kg · m2 · 2π · 33, 3
kg · m2
1
≈ 3, 49 · 10−3
.
60 s
s
(11)
Da es sich
handelt, ist diesem eine sehr große Quantenzahl l nach
√
p dabei um einen makroskopischen Drehimpuls
hLi = l(l + 1)~ zugeordnet. Dann gilt hLi ≈ l2 ~ = l~ und somit
l≈
3, 49 · 10−3
kg·m2
s
6,626·10−34
2π
Js
≈ 3, 31 · 1031 .
(12)
2
Aufgabe 5
a)
Die Schrödingergleichung für das Wasserstoffatom lautet
·
µ
¶
¸
~2 1 ∂
e2
~2 l(l + 1)
2 ∂
−
r
−
+
Ψ(r) = EΨ(r) ,
2m r2 ∂r
∂r
4πε0 r
2mr2
Ψ(r) = Rnl (r)Ylm (ϑ, ϕ) ,
(13)
mit dem Radialanteil Rnl (r) und dem Winkelanteil (Kugelflächenfunktion) Ylm (ϑ, ϕ). √
Die Radialeigenfunktion
stimmt für den 1s-Zustand (Zustand mit l = 0) bis auf eine Konstante (Y00 = 1/ 4π) mit der gesamten
Wellenfunktion überein. Für die angegebene Wellenfunktion
µ
¶
r
Ψ(r) = R00 (r) = a exp −
,
(14)
r1
lautet die Schrödingergleichung:
·
µ
¶
¸
~2 1 ∂
e2
2 ∂
−
r
−
Ψ(r) = EΨ(r) .
2m r2 ∂r
∂r
4πε0 r
(15)
Nun müssen wir noch die Ableitungen berechnen:
¶
¾
µ
½
½
¾
¢
1 ∂ ¡ 2
1
1
∂
∂
∂
r2
r2 Ψ(r) = −
r Ψ(r) = −
2rΨ(r) + r2 Ψ(r) = −
2r −
Ψ(r) .
∂r
∂r
r1 ∂r
r1
∂r
r1
r1
Dann gilt weiter
¶
µ 2
¶
µ
~ 1
e2
1
~2 1
− E Ψ(r) = 0 .
−
Ψ(r) + −
m r1
4πε0 r
2m r12
(16)
(17)
Beide Klammern müssen unabhängig voneinander verschwinden. Aus der ersten Klammer folgt
r1 =
4πε0 ~2
,
e2 m
(18)
und aus der zweiten
E=−
~2
~2 1
e4 m
e4 m
=
−
·
=
−
.
2m r12
2m 16π 2 ε20 ~4
32π 2 ε20 ~2
(19)
b)
Die Aufenthaltswahrscheinlichkeit bestimmt man über
Z
Z2π Zπ
Z∞
Z∞
2
2
2
P =
|Ψ(r)| = dϕ dϑ sin ϑ r |Ψ(r)| dr = 4π r2 |Ψ(r)|2 dr ,
R3
0
0
0
(20)
0
also ist die Aufenthaltswahrscheinlichkeitsdichte gegeben durch
µ
¶
2r
2
2
2 2
W (r) = 4πr |Ψ(r)| = 4πr a exp −
.
r1
(21)
c)
Die Aufenthaltswahrscheinlichkeitsdichte wird dann maximal, wenn die erste (aber nicht die zweite) Ableitung
verschwindet:
µ
¶
µ
¶
dW (r)
2r
r2 2
2r !
2
= 8πra exp −
− 8π a exp −
= 0.
(22)
dr
r1
r1
r1
Daraus folgt die Gleichung
µ
¶
r
r 1−
,
r1
(23)
und somit r = 0 oder r = r1 . Nachrechnen mit der zweiten Ableitung (oder durch Betrachtung des Schaubilds)
ergibt, dass r = 0 ein Minimum und r = r1 ein Maximum ist. Damit ist die Aufenthaltswahrscheinlichkeitsdichte bei r = r1 am größten.
3
d)
Sowohl Ψ(r) und W (r) werden für a = 1 und r = 1 skizziert:
Aufgabe 6
Prinzipiell muss man nur die oberen Zahlen addieren, da diese die Elektronen in den jeweiligen Orbitalen
angeben. Dies führt dann auf:
• 14 Elektronen: Silizium
• 20 Elektronen: Kalzium
Aufgabe 7
a)
Das magnetische Moment m des Elektrons wird durch den Kreisstrom desselbigen verursacht:
I=
−e
eω
=−
.
T
2π
(24)
Also gilt mit A = πr2 ez :
m = IA = −
eω
e
e
· πr2 ez = −
(mωr2 ez ) = −
L,
2π
2m
2m
(25)
wenn wir den Drehimpuls L = mωr2 ez einführen.
Bemerkung:
In der Theorie definiert man das magnetische Moment durch
Z
1
m=
d3 r [r × j(r)] ,
2
(26)
mit der Stromdichte j(r) = jδ(r − r0 ). Legen wir das Koordinatensystem so, dass der Stromdichtevektor j in
der x-y-Ebene liegt, so folgt d3 r j(r) = I dr und somit für einen geschlossenen Stromverlauf:
I
I
m=
dr (r × dr) = IA .
(27)
2
C
Noch schneller kommt man von Gl. (26) auf Gl. (25):
Z
1
e
e
e
m=
d3 r [r × (−e)v(t)δ(r − r(t))] = − r(t) × v(t) = −
r(t) × p(t) = −
L(t) .
2
2
2m
2m
(28)
4
b)
Die Kraft eines Magnetfelds B(r) auf eine Stromdichte j(r) (mit dem oben definierten magnetischen Moment)
kann näherungsweise wie folgt berechnet werden:
Z
F = d3 r [j(r) × B(r)] ≈ (m × ∇) × B(r = 0) .
(29)
Setzen wir B(r = 0) ≡ B, so ergibt sich (nachrechnen!):
F = −m(∇ · B) + ∇(m · B)
∇·B=0
=
∇(m · B) .
(30)
Die Kraft ist also der Gradient eines Potentials und damit kann man ihr die potentielle Energie E = −m · B
zuordnen. Magnetische Momente stellen sich in Magnetfeldern so ein, dass die potentielle Energie minimal
wird, also parallel zu B.
Eine Magnetisierung bis zur Sättigung bedeutet nichts anderes als dass alle atomaren magnetischen Momente
in dieselbe Richtung (parallel zum äußeren Magnetfeld) ausgerichtet sind. Durch Umpolen dreht man die
Ausrichtung und damit ändert sich auch das magnetische Moment jedes einzelnen Atoms. Die Änderung
entspricht dann dem doppelten des magnetischen Moments vor dem Umpolen:
∆m =
e
LAtom ,
m
(31)
wobei LAtom der Drehimpuls eines Atoms ist. Eine Änderung des magnetischen Moments geht mit einer Änderung des Drehimpulses einher; analog gilt auch hier ∆L = 2LAtom pro Atom. Aufgrund der Drehimpulserhaltung muss das durch einen entgegengesetzten (mechanischen) Drehimpuls Lmech = ΘFe ω des zylindrischen
Stabes ausgeglichen werden. Damit muss also 2LAtom NAtom = Lmech (mit der Anzahl der Atome NAtom ) sein
und so kommen wir auf ω:
ω=
Fe
2LAtom · M
2NA MFe LAtom
2LAtom NAtom
mFe NA
=
=
,
ΘFe
ΘFe
ΘFe mFe
(32)
mit der molaren Masse mFe von Eisen.
c)
Aus der Gleichung
ω=
2LAtom NAtom
,
ΘFe
(33)
von Aufgabenteil (b) ergibt sich das sogenannte gyromagnetische Verhältnis:
γ=
|m|
|M|
2|M|
=
=
,
LAtom
NAtom · LAtom
ωΘFe
(34)
mit dem Betrag |M| des magnetischen Moments des Eisenstabs. Wie oben schon festgestellt, erfährt ein magnetisches Moment im Magnetfeld eine Kraft, also gilt hier für die Kraft, welche der gesamte Eisenstab erfährt:
FFe = ∇(M · B). Diese kann prinzipiell mittels der Verdrillung (Torsion) eines Fadens gemessen werden.
Der Magnetismus kann sowohl durch den atomaren Drehimpuls als auch durch den atomaren Spin (den der
Elektronen) ausgelöst werden. Dann gilt allgemein
γ=g
e
,
2m
(35)
mit dem Landé-Faktor g. Für den Bahnmagnetismus ist gl = 1 und für den Spinmagnetismus gs ≈ 2, 002.
(Die Tatsache, dass gs = 2 nicht exakt gilt rührt von Korrekturen her, da jedes Elektron mit seinem eigenen Strahlungsfeld wechselwirkt (Korrekturen der Quantenelektrodynamik).) Auf jeden Fall kann mittels
des Einstein-de-Haas-Versuchs das gyromagnetische Verhältnis gemessen und damit bestimmt werden, ob der
Magnetismus auf Spin oder Bahndrehimpuls (oder beide) zurückzuführen ist.
5
d)
Unter Verwendung der Ergebnisse des Bohrschen Atommodells aus dem vorherigen Übungsblatt (für r und ω)
ergibt sich der Drehimpuls:
Lz =
m 2
m
me4
1 64π 2 ε20 ~4 4
ωr =
·
·
n = ~n .
2
2
3
2
2 32π ε0 ~ n3
e4 m
(36)
Laut Aufgabenstellung sei LAtom = ~ (mit n = 1, also der ersten Bohrschen Bahn). Weiter gilt
MFe = %Fe V = %Fe πr2 l ,
r2 =
MFe
,
π%Fe l
(37)
und somit für das Trägheitsmoment des Stabs:
ΘFe =
2
1
MFe
MFe r2 =
.
2
2π%Fe l
(38)
Somit erhalten wir
ω=
=
2NA MFe LAtom
4π~NA %Fe l
=
=
ΘFe mFe
MFe · mFe
´
³
−34
Js
1
4π · 6,626·10
· 6, 022 · 1023 mol
· 7, 87 · 103
2π
10−3
kg · 55, 8 ·
kg
10−3 mol
kg
m3
· 10−2 m
≈ 1, 13 · 10−3
1
.
s
(39)
6
Handout zum Übungsblatt Nr.8
Aufgabe 1
a)
In einem Ofen wird Silber zum Verdampfen gebracht, so dass aus einem Loch Silberatome austreten. Diese Silberatome werden mittels zweier Lochblenden zu einem Strahl fokussiert. Der Strahl durchläuft ein inhomogenes
Magnetfeld und trifft auf einen Schirm; auf diesem entstehen zwei silberne Flecken.
Silberatome bestehen aus einem positiv geladenen Atomkern (mit 47 Protonen und Neutronen, deren Anzahl
vom betrachteten Isotop abhängt) und einer Elektronenhülle mit 47 Elektronen. Die Elektronen sind in Aufenthaltswahrscheinlichkeitsräumen (Orbitalen) angeordnet. Diese Orbitale kennzeichnet man wiederum durch
ihre charakteristischen Quantenzahlen, nämlich der Hauptquantenzahl n, der Drehimpulsquantenzahl l und der
magnetischen Quantenzahl ml . Elektronen, die sich in Orbitalen mit l 6= 0 befinden, besitzen einen Drehimpuls
L und damit ein sogenanntes magnetisches Moment:
µ=
e
L,
2me
µz =
e
Lz .
2me
(1)
In einem inhomogenen Magnetfeld erfahren Teilchen mit einem magnetischen Moment eine Kraft.Schon 1922,
als dieser Versuch von Stern und Gerlach zum ersten mal durchgeführt wurde, war bekannt, dass Silber ein
äußerstes Elektron trägt und dass dieses die Drehimpulsquantenzahl l = 0 besitzt. Weiterhin wusste man,
dass sich die Drehimpulse der restlichen Elektronen, die in den inneren Orbitalen sitzen, gegenseitig aufheben
(Hundsche Regeln). Man würde also keine Ablenkung der Silberatome im inhomogenen Magnetfeld erwarten,
da diese kein magnetisches Moment besitzen dürften. Wie oben bereits erwähnt, stellt man jedoch nicht nur
eine Ablenkung fest, sondern diese ist außerdem nicht kontinuierlich und es sind zwei einzelne diskrete Flecken
erkennbar. Damit muss es sich um einen bisher unbekannten quantenmechanischen Effekt handeln, würde man
klassisch höchstens eine kontinuierliche Verteilung – also einen ganzen Silberstreifen – erwarten.
Die Interpretation dafür, dass zwei abgetrennte Silberflecken entstehen, ist, dass ein Elektron zusätzlich zum
bekannten Drehimpuls L noch einen (bisher unbekannten) Eigendrehimpuls besitzt. Man bezeichnet diesen
Eigendrehimpuls als Spin S. Der Spin ist eine rein quantenmechanische Erscheinung und besitzt kein Analogon
in der klassischen Physik. Er ist nämlich eine feste Eigenschaft eines jeden Teilchens und unabänderlich. Wie
dem Drehimpuls ordnet man auch dem Spin eine Quantenzahl zu, die man gewöhnlich als s bezeichnet.
b)
Wie schon erwähnt, wirkt auf die Elektronen mit dem magnetischen Moment
b = gs
m
µB b
L,
~
(2)
eine Kraft. Laut der klassischen Elektrodynamik ist diese (bzw. deren Mittelwert) gegeben durch:
hFi = h∇(m · B)i = hmx i∇Bx + hmy i∇By +imz i∇Bz .
(3)
Die mittleren magnetischen Momente in x- und y-Richtung verschwinden, also hmx i = hmy i = 0. Damit gilt,
sofern wir zusätzlich annehmen, dass Bz nur von z (und nicht von x und y) abhängig ist:
0
.
0
hFi = hmz i∇Bz =
(4)
hmz i(∂B/∂z)
Damit besitzt die Kraft nur eine Komponente in z-Richtung. Je nach magnetischem Moment werden die
Elektronen dann nach oben oder unten abgelenkt, wobei die Ablenkung nach oben der Ablenkung nach unten
entspricht. Da es sich um ein s-Elektron handelt, wird das magnetische Moment in z-Richtung durch die
Spineinstellung in z-Richtung verursacht. Dabei gibt es zwei mögliche Eigenzustände |+i, |−i des Spinoperators
in z-Richtung:
~
Sbz |+i = |+i ,
2
~
Sbz |−i = − |−i .
2
(5)
Wir nehmen an, dass sich das Elektron im Zustand |+i befindet, was einer Ablenkung nach oben entspricht:
hmz i+ = 2
µB
µB ~
· hSz i+ = 2
· = µB .
~
~ 2
(6)
Damit ergibt sich die Kraft
Fz = µB
∂B
.
∂z
(7)
Diese ist konstant und es handelt sich um eine gleichmäßig beschleunigte Bewegung in z-Richtung. Laut
Aufgabenstellung nehmen wir an, dass in x-Richtung die Atome mit konstanter Geschwindigkeit fliegen:
r
r
2Ekin
3kB T
v=
=
.
(8)
me
me
Dann folgt für die in z-Richtung zurückgelegte Strecke, sofern sich das Atom noch im B-Feld befindet:
z1 =
1 2
1 Fz
at = ·
·
2 1
2 me
µr
¶2
me
µB ∂B
me 2
µB a2 ∂B
a =
·
a =
.
3kB T
2me ∂z 3kB T
6kB T ∂z
µB ∂B
z2 = vt2 = at1 · t2 =
·
me ∂z
r
me
a·
3kB T
r
me
µB
b=
ab .
3kB T
3kB T
(9)
(10)
Weiter ergibt sich dann der gesamte Abstand zwischen den Mittelpunkten der beiden Flecken:
2(z1 + z2 ) = 2
´
´
ae~ ∂B ³ a
aµB ∂B ³ a
+b =
+b .
3kB T ∂z 2
3me kB T ∂z 2
(11)
c)
Wir erkennen, dass Gl. (11) nur von der Elektronmasse me , aber nicht von der Masse des Kerns abhängt.
Damit ergibt sich für unterschiedliche Isotope (mit unterschiedlicher Neutronenzahl und damit Kernmasse)
kein Unterschied. Wichtig ist nur, dass das magnetische Moment von einem einzigen s-Elektron erzeugt wird.
d)
Die Silberatome im Ofen genügen der thermischen Maxwell-Boltzmann-Geschwindigkeitsverteilung. Damit
haben sie unterschiedliche Geschwindigkeiten, was dazu führt, dass keine scharfen Punkte aus Silberatomen
auf dem Schirm entstehen, sondern ausgewaschene Flecken.
2
Aufgabe 2
Es gelten folgende Zusammenhänge zwischen den magnetischen Momenten und den jeweiligen Drehimpulsen:
µS = −gs
µB
S,
~
µL = −gl
µB
L,
~
(12)
mit J = S + L und gs = 2, gl = 1. Wir betrachten das Ganze im Vektorgerüstmodell:
Das magnetische Moment µJ ergibt sich wiederum durch Addition von µS und µL : µJ = µS + µJ ; dieses
zeigt jedoch dann nicht mehr in Richtung von J. Der Anteil (µJ )J in Richtung von J ist wie analog wie µS
und µJ wie folgt definiert:
(µJ )J = −gj
µB
J.
~
(13)
Zu bestimmen ist also gj . Der Anteil (µJ )J kann ebenso als Summe von µ1 und µ2 bestimmt werden, also
müssen wir zunächst diese berechnen. Hierbei ist
µ1 = −
µB
J,
~
1
J
µB
J
µ2 = − |µS | cos α
= − |S cos α
.
2
|J|
~
|J|
(14)
Damit ergibt sich weiter:
(µJ )J = µ1 + µ2 = −
µ
¶
µB
|S|
J 1+
cos α .
~
|J|
(15)
Durch Quadrieren von L = J − S (Kosinussatz) ergibt sich
L2 = J2 + S2 − 2|J||S| cos α ,
(16)
und daraus lässt sich der Winkel α bestimmen:
cos α =
J2 + S2 − L2
.
2|J| · |S|
Dann erhalten wir schließlich
µ
¶
µ
¶
hJ2 i + hS2 i − hL2 i
µB
j(j + 1) + s(s + 1) − l(l + 1)
µB
= − hJi 1 +
.
h(µJ )J i = − hJi 1 +
~
2hJ2 i
~
2j(j + 1)
(17)
(18)
Vergleichen wir dies mit
h(µJ )J i = −gJ
µB
hJi ,
~
(19)
so kommen wir auf:
gj = 1 +
j(j + 1) + s(s + 1) − l(l + 1)
.
2j(j + 1)
(20)
3
c)
Einsetzen von l = 1, s = 1/2 und j
Andererseits führt l = 0, s = 1/2 und
½
2µB |B|/3 für
∆Emj ,mj −1 =
2µB |B|
für
= 1/2 (für p1/2 ) in die hergeleitete Formel für gj führt auf gj = 2/3.
j = 1/2 (für s1/2 ) auf gj = 2. Dies führt zu den Zeeman-Aufspaltungen
p1/2
s1/2
.
(21)
Für reinen Bahnmagnetismus (also mit s = 0 und j = l) ergibt sich gj = 1 und für reinen Spinmagnetismus
(mit l = 0, s = 1/2 = j) folgt gj = 2, was auch zu erwarten war.
Aufgabe 3
a)
Die Erwartungswert der Energieverschiebung aufgrund der Spin-Bahn-Kopplung lässt sich schreiben wie folgt:
h∆El,s i =
α4 me c2
hs · li
.
2
3
2~
n l(l + 1/2)(l + 1)
(22)
Wegen
hj2 i = h(s + l)2 i = hs2 i + hl2 i + 2hs · li ,
⇔ hs · li =
(23)
1 2
~2
(hj i − hs2 i − hl2 i) =
(j(j + 1) − s(s + 1) − l(l + 1)) ,
2
2
(24)
α4 me c2 j(j + 1) − s(s + 1) − l(l + 1)
.
4
n3 l(l + 1/2)(l + 1)
(25)
ergibt sich:
h∆El,s i =
Weiterhin gilt:
½
j(j + 1) − l(l + 1) − s(s + 1) =
l
−(l + 1)
für
für
j = l + 1/2, s = 1/2
,
j = l − 1/2, s = 1/2
(26)
und damit ergeben sich die folgenden Energieverschiebungen:
h∆El,s ij=l+1/2 =
α4 me c2
1
,
4
n3 (l + 1/2)(l + 1)
h∆El,s ij=l−1/2 = −
α4 me c2
1
.
4
n3 l(l + 1/2)
(27)
b)
n
l
1
0
2
1
h∆El,s ij=l+1/2
h∆El,s ij=l−1/2
0
0
eV
1, 51 · 10−5
−3, 03 · 10−5
3
1
1/cm
0, 122
−0, 244
eV
4, 48 · 10−6
−8, 97 · 10−6
3
2
1/cm
0, 036
−0, 072
eV
1, 79 · 10−6
−2, 69 · 10−6
1/cm
0, 014
−0, 022
• Aufspaltungen sehr gering, aufgrund der Dopplerverbreiterung deshalb mit konventionellen Methoden
meistens nicht messbar
• bei bestimmten Atomen (wie beispielsweise Lithium mit einem Elektron in der nicht-abgeschlossenen
äußeren Schale) doch messbar, da die Aufspaltung mit Z 4 skaliert (bei Lithium führt dies zu einem
Faktor 34 = 81)
4
c)
Das zugehörige Termschema sieht wie folgt aus:
Die Aufspaltungen der Niveaus wurden um mehrere Zehnerpotenzen skaliert.
• für l = 0: nur Spin-Magnetismus, deshalb keine Spin-Bahn-Kopplung und daher auch keine Spin-BahnAufspaltung
• Spin-Bahn-Aufspaltung hebt sowohl l- als auch j-Entartung auf
Aufgabe 4
a)
Es handelt sich dabei um relativistische Korrekturen zur Elektronmasse (Dirac-Gleichung) und Korrekturen
zum elektrischen Feld.
b)
Die gesamte Feinstrukturaufspaltung berechnet sich durch
µ
¶
α2
1
3
13, 6 eV
h∆EFS i = h∆En,j i = En
−
, En = −
.
n j + 1/2 4n
n2
(28)
Die Werte n ∈ {1, 2, 3} sollen untersucht werden. Dabei ist l ∈ {0, 1, . . . , n−1} und j = l +1/2 bzw. j = l −1/2.
Machen wir dazu eine Tabelle:
n
l
j
h∆EFS i [10−5 eV]
1
0
1/2
-18,12
2
0
1/2
-5,66
2
1
3/2
-1,13
2
1
1/2
-5,66
3
0
1/2
-2,01
3
1
3/2
-0,67
3
1
1/2
-2,01
3
2
3/2
-0,67
3
2
5/2
-0,22
• Feinstruktur-Aufspaltung senkt alle Niveaus (auch das s-Niveau)
• hebt die l-Entartung auf und bewahrt die j-Entartung
Das Spektrum des Wasserstoffatoms
Wir betrachten die Eigenschaften des Spektrums des Wasserstoffatoms (mit Feinstruktur-Aufspaltung):
5
• Die Zustände n = 1, 2, 3 (gestriche Linien) entsprechen dem Bohr-Modell, die Zustände l = 1 (S), l = 2
(P) und l = 3 (D) dem Sommerfeld-Modell.
• Inneratomare Wechselwirkungen im Wasserstoffatom:
– Coulomb-Wechselwirkung zwischen Kern und Elektron, führt zur Energieniveaus En,l = −Ry Z 2 /n2 ,
wobei Ry ∼ α2 mit der Feinstrukturkonstanten
α=
e2
1
≈
.
4πε0 ~c
137
(29)
– Energieniveaus liegem im eV-Bereich
– Kopplung von Spin S und Drehimpuls L des Elektrons (Spin-Bahn-Kopplung): ein Beitrag der
Feinstruktur-Aufspaltung; die relativistische Elektronenmasse ist ein weiterer Beitrag
– Kopplung von Gesamtdrehimpuls J = L+S des Elektrons und Kernspin I: führt zur HyperfeinstrukturAufspaltung
– Effekte der Quantenelektrodynamik (QED): Wechselwirkung des Elektrons mit seinem eigenen
Strahlungsfeld, Erzeugung virtueller Elektron-Positron-Paare (oft auch anschaulich als Zitterbewegung des Elektrons bezeichnet aufgrund der Emission und Absorption virtueller Photonen)
führt zu einer Abänderung des Coulomb-Potentials, der erste Beitrag führt zu einem Potential der
Form
V (r) =
α2
e2
+C · 2 ,
4πε0 r
me
(30)
mit einer Konstanten C.
• Niveaus sind infolge der Feinstruktur-Aufspaltung abgesenkt
• Aufspaltung allein durch die Spin-Bahn-Kopplung führt zur Aufhebung der L- und der J-Entartung
• Feinstruktur (Spin-Bahn-Kopplung plus relativistische Korrekturen zur Energie-Impuls-Beziehung des
Elektrons (Darwin-Term): Berücksichtigung der Diracgleichung) führt zur Aufhebung der L-Entartung,
bestehende J-Entartung, ∆EFS ∼ Ry Z 4 α4 , also zusätzliche Unterdrückung mit 1/1372 im Vergleich zu
den Niveaus En,l
6
• Hyperfeinstruktur: Unterdrückung von ∆EHFS mit α2 und dem Inversen der Kernmasse 1/mK
• Lamb-Shift führt zur Aufhebung der J-Entartung
• Erlaubt sind Übergänge mit ∆L ∈ {−1, +1}; ∆J ∈ {−1, 0, +1}, ∆MJ ∈ {−1, 0, +1}
7
Handout zum Übungsblatt Nr.9
Aufgabe 1
a)
Allgemein bedeutet der Zeeman-Effekt eine Auspaltung von Spektrallinien in einem externen Magnetfeld.
Diese Aufspaltung rührt von der zusätzlichen Energie her, die ein Elektron mit magnetischen Moment (µj )j
im Magnetfeld besitzt, nämlich ∆E = −(µj )j · B. Legen wir das Magnetfeld in z-Richtung, so ergibt sich:
∆E = −(µj )j · B = −gj
muB
µB
j · B = −gj
jz B .
~
~
(1)
Damit folgt dann
h∆Ei = −gj µB Bhji = −gj µB Bmj .
(2)
• Normaler Zeeman-Effekt: Elektron besitzt nur ein magnetisches Bahnmoment, also ist gj = gl = 1. Dann
gilt h∆Ei = −µB Bml . Wegen der Auswahl-Regel ∆ml = {−1, 0, 1} (da das Photon ein Vektorteilchen mit
Spin 1 ist) Damit ergeben sich immer drei Spektrallinien (Zeeman-Triplet), welche der Energiedifferenz
∆E(∆ml = 1) = ∆E(n2 − n1 , l2 − l1 ) + µB B ,
(3a)
∆E(∆ml = 0) = ∆E(n2 − n1 , l2 − l1 ) ,
(3b)
∆E(∆ml = 1) = ∆E(n2 − n1 , l2 − l1 ) − µB B .
(3c)
und
• Anomaler Zeeman-Effekt: Das Elektron besitzt sowohl magnetisches Bahn- als auch Spinmoment. Damit
ist gj der allgemeine komplizierte Ausdruck, den wir auf dem vorigen Blatt bestimmt haben, und es
ergibt sich somit ein reichhaltigeres Aufspaltungsbild.
b)
Beim normalen Zeeman-Effekt spaltet ein Niveau mit l = 3 auf in 2l + 1 = 7 Niveaus, da es genau so
viele ml -Quantenzahlen gibt. Der Energieunterschied zwischen zwei benachbarten Niveaus (∆ml = 1) ist
∆(∆E) = gl µB B = µB B .
c)
Beim normalen Zeeman-Effekt spaltet – wie oben bereits erwähnt – jede Spektrallinie in drei Linien auf. Dies
gilt auch für den Übergang von l = 3 nach l = 2. ∆ml = 0 entspricht der Emission eines Photons mit linearer
Polarisation, während ∆ml = ±1 der Emission eines Photons mit zirkularer Polarisation entspricht.
d)
Der Spin des Photon folgt direkt aus der Auswahlregel ∆ml = 0, ±1 für das Zeeman-Triplett. Infolgedessen
kann nämlich nur ∆l = 1 sein und damit ist das Photon ein Spin-1-Teilchen (Vektorteilchen).
Aufgabe 2
Die Hyperfeinstruktur hat drei Ursachen:
1) Kopplung des Gesamtdrehimpulses j des Elektrons mit dem Kernspin I.
2) endliche Ausdehnung des Kerns
3) relativistische Bewegung des Elektrons
Die Punkte (1) und (2) unterscheiden sich daher zur Feinstruktur, Punkt (3) ist bei beiden Effekten wichtig.
b)
Die Anzahl der Komponenten ergibt sich aus der Anzahl der möglichen Werte der Quantenzahl F , die sich aus
der Kopplung von j und I ergibt. Allgemein sind die Werte F ∈ {j + I, j + I − 1, . . . , |j − I|} möglich.
• 3 H(2 s1/2 , I = 1/2): Hier ist j = 1/2 und I = 1/2, also ist F ∈ {1, 0} und es gibt zwei Komponenten.
• 3 H(2 s1/2 , I = 1): Aus j = 1/2 und I = 1 folgt F ∈ {3/2, 1/2}, also auch hier gibt es zwei Komponenten.
14
•
N(4 s3/2 , I = 1): Hier gilt j = 3/2 und I = 1, also F ∈ {5/2, 3/2, 1/2}, also gibt es drei Komponenten.
• 4 H(4 s3/2 , I = 1/2): Für diese Konfiguration ist j = 3/2 und I = 1/2. Wegen F ∈ {2, 1} gibt es zwei
Komponenten.
c)
Die Hyperfeinstrukturverschiebung ist gegeben durch
∆EHyperfein =
a
hI · ji ,
~2
a=
2µ0
1
ge µB gp µK · 3 .
3πa30
n
(4)
Zunächst müssen wir den Erwartungswert des Skalarprodukts I · j umschreiben. Mittels
F 2 = (j + L)2 = j 2 + I 2 + 2j · I ,
(5)
ergibt sich dann:
h∆EHyperfein i =
a
a
(hF 2 i − hj 2 i − hI 2 i) = (F (F + 1) − j(j + 1) − I(I + 1)) .
2~2
2
(6)
Der Grundzustand von atomarem Wasserstoff besitzt die Quantenzahlen j = 1/2 und I = 1/2. Damit sind
die Werte F ∈ {1, 0} möglich. Die Hyperfeinaufspaltung, also die Energiedifferenz zwischen E(F = 1) und
E(F = 0) ist mit
ge = 2, 002 ,
µK = 5, 051 · 10−27 Am2 ,
a0 = 5, 292 · 10−11 m ,
µ0 = 1, 257 · 10−6
µB = 9, 274 · 10−24 Am2 ,
(7a)
Vs
,
Am
(7b)
gegeben durch:
∆(∆EHyperfein ) ≈ 1, 47 · 10−6 eV − (−4, 41 · 10−6 eV) = 5, 88 · 10−6 eV .
(8)
Mittels E = hν und λ = c/ν folgt zusätzlich
∆(∆νHyperfein ) ≈ 1, 42 · 109 Hz ,
∆(∆λHyperfein ) = 21, 1 cm .
(9)
Zusätzlich können wir mit a = 5, 88 · 10−6 eV die Intervallregel
∆EF =1 − ∆EF =0 = a ,
(10)
(für F = 0) bestätigen.
Aufgabe 3
Beim Beschuss einer Elektrode mit Elektronen nach Durchlaufen einer Beschleunigungsspannung U entsteht
Röntgenlicht. Dieses lässt sich spektral zerlegen (beispielsweise nach Frequenzen) und man erhält dabei:
1) das kontinuierliche Röntgen-Bremsspektrum als Folge der Ablenkung von Elektronen im Coulomb-Feld
von Atomkernen
2) und ein Spektrum diskreter Linien – das sogenannte charakteristische Spektrum.
2
In dieser Aufgabe interessieren wir uns nur für das charakteristische Spektrum. Dieses zeichnet sich durch viele
Gruppen von Linien aus, wobei die Linien innerhalb einer Gruppe nahe beieinander liegen und gegen eine
Grenzfrequenz (die Kante“) konvergieren. Die Gruppen werden der Reihe nach mit den Buchstaben K, L, M,
”
N usw. und die einzelnen Linien einer Gruppe mit griechischen Buchstaben α, β, γ usw. bezeichnet. Man kann
sich diese am einfachsten am Bohrschen Atommodell erklären:
Die einzelnen Linien entsprechen den Übergängen zwischen verschiedenen Schalen. Die Kante entspricht der
Ionisierungsenergie bezüglich einer Schale. Dabei gibt es folgende Unterschiede zum Wasserstoffatom:
a) Die Elektrode besteht typischerweise aus einem Metall (beispielsweise Wolfram) mit einer komplizierten
Elektronenkonfiguration. Solche Atome lassen sich quantenmechanisch im Rahmen des Schrödingermodells nicht analytisch behandeln (numerisch oder mit Näherungsmethoden).
b) Infolge der Kernladungszahl werden die Energieniveaus erhöht und liegen jetzt nicht mehr im Sichtbaren,
sondern im Röntgenbereich.
c) Durch innere Elektronen wird ein Teil der Kernladung abgeschirmt.
a)
√
Die Linien der Kanten des charakteristischen Röntgenspektrums erfüllen die Proportionalität hνKante ∼ Z − s
(Moseley-Geraden), mit einer Konstanten s, welche die Abschirmung durch die inneren Elektronen beschreibt.
Damit man alle Linien einer jeweiligen Serie erhält, muss die Energie, welche der Kante entspricht, aufgewendet
werden. Es handelt sich dabei um die Ionisierungsenergie bezüglich einer jeweiligen Schale im Bohrschen
Atommodell. Speziell für die K-Serie von Wolfram gilt mit Z = 74:
EK = hcR∞ (Z − 1)2 = 13, 61 eV · 732 ≈ 72, 5 keV .
(11)
b)
Das Termschema ergibt sich aus den in (a) angegebenen Wellenlängen mit E = hν/λ:
EK = 69, 7 keV ,
EK,α = 59, 1 keV ,
EK,β = 67, 4 keV ,
EK,γ = 69, 3 keV .
(12)
c)
Die L-Schale ist die energetisch höhere Schale, welche direkt auf die K-Schale folgt. Um die Energie der L-Kante
zur erhalten, muss von der Energie der K-Kante die Energiedifferenz zwischen der L- und K-Schale abgezogen
werden (siehe dazu obiges Bild):
EL = EK − EK,α = 10, 4 keV .
(13)
3
Analog ergibt sich die Energie der Lα -Linie zu
EL,α = EK,β − EK,α = 8, 3 keV .
(14)
d)
Die Energie wird dann frei, wenn ein Elektron aus der K-Schale entfernt wird und eines aus der P-Schale das
entstandene Loch in der K-Schale auffüllt. Das Elektron in der P-Schale sieht nur eine effektive Kernladung
Zeff = 74 − 72 = 2, da alle verbleibenden Elektronen (bis auf das betrachtete Elektron in der P-Schale selbst)
die Kernladung abschirmen. Mit n = 6 ist die Energie des Elektrons in der P-Schale gegeben durch
EP = −hc
2
R∞ Zeff
4
= − R∞ ≈ −6, 04 eV .
n2
36
(15)
Die Energie des Übergangs von der P- zur K-Schale ist dann
∆E = EP − EK = 69, 5 keV − 6, 04 eV ≈ 69, 5 keV ,
(16)
und entspricht damit im Großen und Ganzen der Energie der K-Kante. Die zugehörige Wellenlänge folgt aus
λ = hc/E zu 1, 79 · 10−11 m.
e)
Die freiwerdende Energie der Lα -Linie kann dazu genutzt werden, ein Elektron aus dem Atom herauszuschlagen.
Ein solches Elektron bezeichnet man als Auger-Elektron (und den physikalischen Effekt als Auger-Effekt). Ein
P-Elektron ist am schwächsten gebunden, hat also, nachdem es vom Atom getrennt wurde, die größte kinetische
Energie:
Ekin = EL,α − |EP | = 8, 3 keV − 6, 04 eV ≈ 8, 3 keV ,
(17)
also kommt es auf die Bindungsenergie |EP | fast wieder nicht an.
Aufgabe 4
Schematischer Aufbau eines ESR-Spektrometers:
Mittels der ESR-Resonanz (Elektronenspin-Resonanz) werden Übergänge zwischen verschiedenen Niveaus, welche durch die Quantenzahl m charakterisiert sind, angeregt. Besitzt beispielsweise ein Atom nur das (durch ein
Elektron) verursache magnetisches Spinmoment, so spaltet ein Energieniveau E0 in einem äußeren Magnetfeld
B durch den (anomalen) Zeeman-Effekt in zwei Niveaus auf:
E1 = E0 + gs µB Bms ,
E2 = E0 − gs µB Bms ,
(18)
mit ms = 1/2 und gs ≈ 2, 002. Die Energiedifferenz zwischen beiden Niveaus entspricht der sogenannten
Larmorfrequenz:
∆E = E1 − E2 = gs µB B = hνLarmor = ~ωLarmor .
(19)
Durch ein zweites magnetisches Wechselfeld (beispielsweise von der Form B1 cos(ωt)) kann der Übergang
zwischen beiden Niveaus angeregt werden, sofern ω der Larmorfrequenz entspricht.
4
Handout zum Übungsblatt Nr.10
Aufgabe 1
Es gibt folgende Beiträge zum Potential in einem Mehrelektronenatom (siehe Mayer-Kuckuk):
1) Coulomb-Anziehung zwischen Kern und Elektronen:
VKern = −
N
X
Ze2
ri
i=1
,
(1)
2) Coulomb-Abstoßung Ve−e zwischen den Elektronen:
Ve−e =
N X
i−1
X
i=1 j=1
e2
,
|ri − rj |
(2)
3) Spin-Bahn-Kopplung (ein Beitrag der Feinstruktur)
Vs−l = −
N
X
i=1
1 1 dV (r)
(si · li ) ,
2m2 c2 ri dri
(3)
4) Spin-Spin-Wechselwirkungen unter der Elektronen:
Vs−s =
¸
N X
i−1 2 ·
X
e
σi · σj
(σ i · (ri − rj ))(σ j · (ri − rj ))
−
3
,
m2 |ri − rj |3
|ri − rj |5
i=1 j=1
(4)
5) Wechselwirkung zwischen den magnetischen Momenten der Elektronen:
Vl−l =
N X
i−1
X
cij (li · lj ) ,
(5)
i=1 j=1
6) Kopplung zwischen Spin der Elektronen und Kernspin (ein Beitrag der Hyperfeinstruktur)
6) Kopplung zwischen Drehimpuls der Elektronen und Kernspin (ein weiterer Beitrag der Hyperfeinstruktur)
7) relativistische Korrekturen (Beitrag zu Feinstruktur und Hyperfeinstruktur)
8) Antisymmetrie der Wellenfunktion (Pauli-Prinzip)
9) Ausdehnung des Kerns (Beitrag zur Hyperfeinstruktur)
Aufgabe 2
a)
Beim Wasserstoffatom hängt das Kernpotential (wenn man einmal von der inneren Struktur des Kerns in Form
von Elementarteilchen wie Quarks) absieht nur von r ab, ist also rotationssymmetrisch. Aus der Rotationssymmetrie folgt klassisch die Erhaltung des Drehimpulses und quantenmechanisch die l-Entartung der Energieeigenzustände. Das Potential des Kerns ist jedoch bei Alkaliatomen nicht kugelsymmetrisch, da es teilweise
von den inneren Elektronen abgeschirmt wird und die Orbitale der inneren Elektronen nicht notwendigerweise
kugelsymmetrisch sind.
b)
Vergleichen wir Termschama von Wasserstoff- und einem Alkaliatom:
Beim Wasserstoffatom liegt j-Entartung vor, sofern man nur die Feinstruktur (Spin-Bahn-Kopplung + relativistische Bewegung des Elektrons) und nicht die Hyperfeinstruktur oder die Lamb-Verschiebung berücksichtigt.
Bei Alkaliatomen liegt jedoch weder l-Entartung noch j-Entartung vor.
c)
Untersucht werden soll die Zeeman-Aufspaltung der Niveaus 3p3/2 und 3s1/2 :
Durch das äußere Magnetfeld wird die mj -Entartung aufgehoben. Einerseits spaltet das 3p3/2 -Niveau damit
in vier Niveaus auf mit mj ∈ {−3/2, −1/2, 1/2, 3/2}. Der Abstand zwischen den Niveaus ist ∆(∆E) = gj µB B.
Anderseits spaltet das 3s1/2 -Niveau in zwei Niveaus mit mj ∈ {−1/2, 1/2} auf, wobei der Abstand zwischen
beiden ∆(∆E) = gs µB B (gs ≈ 2, 002) beträgt. Übergänge mit ∆mj = 0, ±1 sind erlaubt und es gibt insgesamt
sechs zwischen den beiden erwähnten Niveaus. Weiterhin handelt es sich um den anomalen Zeeman-Effekt, da
offensichtlich der Spin des Elektrons beiträgt.
d)
Wir berechnen die Wellenzahlen der erlaubten Übergänge zwischen den Niveaus 3p1/2 und 3s1/2 :
¡
¢ ¡
¢
∆(∆E) = Ep1/2 + gj µB Bmj − Es1/2 + gs µB Bmj 0 = ∆E(p1/2 7→ s1/2 ) + µB B (gj mj − gs mj 0 ) .
(6)
2
Mit
gj = 1 +
j(j + 1) + s(s + 1) − l(l + 1)
2j(j + 1)
ergibt sich dann:
1
1
∆(∆E) ≈ 16963, 8
+ 0, 606
cm
cm
µ
j=1/2,s=1/2,l=1
=
2
mj − 2, 002mj 0
3
2
,
3
gs ≈ 2, 002 ,
(7)
¶
.
(8)
Speziell für mj ∈ {−1/2, 1/2} und mj 0 ∈ {−1/2, 1/2} ergibt sich dann für den zweiten Term und für die
gesamte Energie des Übergangs (in der Einheit 1/cm):
PP
PP
PP mj
PP mj
-1/2
1/2
-1/2
1/2
PP
PP
0
mj 0
m
j
P
P
P
P
-1/2
0,405
0,809
-1/2
16964,2 16964,6
1/2
-0,809 -0,405
1/2
16962,9 16963,4
Aufgabe 3
a)
Eine Röhre, die einen Kondensator enthält, wird mit Wasserstoffgas gefüllt. Durch Anlegen einer elektrischen
Spannung an den Kondensator lässt sich eine Aufspaltung von Spektrallinien beobachten.
b)
1) Quadratischer Stark-Effekt:
Hier hängt die Aufspaltung von Spektrallinien, also die Energieverschiebung von Energieniveaus, quadratisch von der elektrischen Feldstärke ab.
a) anschauliche Erklärung: Das elektrische Feld induziert ein Dipolmoment in den Atomen: P = αE,
wobei α die Polarisierbarkeit ist. Dieses Dipolmoment besitzt im elektrischen Feld die Energie
ZE
∆E = −
0
1
dE · P = − P E 2 ,
2
(9)
mit E = |E| und P = |P|.
b) theoretische Erklärung: Die Korrektur 1. Ordnung in quantenmechanischer Störungstheorie, welche
linear zum elektrischen Feld ist, verschwindet für alle Wellenfunktionen ψnlm . Dabei handelt es sich
um den Erwartungswert des Dipolmomentoperators:
Z
hVb i = −eEhb
z i = −eE d3 x z|ψnlm |2 .
(10)
Die Wellenfunktion ψnlm hat bezüglich Raumspiegelung (Paritätsoperation) den Eigenwert (−1)l
und damit ist |ψnlm |2 eine gerade Funktion, während z eine ungerade Funktion ist. Somit verschwindet der Erwartungswert des Dipolmomentoperators für alle n, l und m. Was nicht verschwindet,
sind Beiträge von zweiter Ordnung Störungstheorie und die sind quadratisch im elektrischen Feld.
Der quadratische Stark-Effekt tritt bei allen Atomen auf.
2) Linearer Stark-Effekt:
Hier hängt die Aufspaltung von Spektrallinien linear von der elektrischen Feldstärke ab.
a) anschauliche Erklärung: Dies ist dann der Fall, wenn ein Atom ein permanentes elektrisches Dipolmoment besitzt, das also nicht von der Stärke des elektrischen Feldes abhängt. Dieses besitzt im
elektrischen Feld dann die Energie ∆E = −P E.
b) theoretische Erklärung: Beiträge in erster Ordnung Störungstheorie, also ein nicht-verschwindender
Erwartungswert zum Dipolmomentoperator, können nur dann ungleich Null sein, wenn entartete
Energieniveaus existieren. Der zugehörige Energieeigenzustand ist nämlich dann eine Linearkombination (Mischung) von Eigenzuständen und eine solche Linearkombination muss kein Eigenzustand des Paritätsoperators sein. Dann ist |ψnlm |2 nicht notwendigerweise eine gerade Funktion und
der Beitrag in erster Ordnung Störungstheorie verschwindet dann nicht! Im Folgenden wird das
Schaubild der Linearkombination |Y00 (ϑ, ϕ) + Y10 (ϑ, ϕ)|2 gezeigt (aufgrund der l-Entartung beim
Wasserstoffatom gehören diese Winkelanteile zu Wellenfunktionen derselben Energie):
3
Die Asymmetrie der Wahrscheinlichkeitsdichte im Winkelbereich ist eindeutig erkennbar und deutet
auf ein permanentes Dipolmoment hin.
Der lineare Stark-Effekt tritt nur bei Atomen auf, in welchen eine Entartung vorliegt. Dies ist prinzipiell
nur beim Wasserstoffatom (und bis zu einem gewissen Grade noch beim Lithiumatom) der Fall.
c)
Der Stark-Effekt ist experimentell schwerer zu beobachten, weil man starke elektrische Magnetfelder erzeugen
muss, ohne dass es einen Überschlag gibt. Außerdem muss der in der Röhre entstehenden Kanalstrahl (positiver
Ionen) abgesaugt werden, weil diese sonst Wasserstoffatome ionisieren.
d)
Die Aufspaltung ist für mj und −mj dieselbe im Gegensatz zum Zeeman-Effekt. Somit gibt es j + 1 Aufspaltungen (bei ganzzahligem j) und j + 1/2 Aufspaltungen (bei halbzahligem j).
Aufgabe 4
a)
Die Hundschen Regeln lauten wie folgt:
1) Voll aufgefüllte s-, p-, d- und f-Unterschalen liefern stehts L = 0 und S = 0 (und somit auch J = 0).
2) In einer abgeschlossenen s-, p-, d- und f-Unterschale liegen Terme mit maximalen S energetisch am
tiefsten.
3) Von den Termen mit maximalem S liegen solche mit maximalem (und damit versträglichem) L am
tiefsten.
4) Ist die s-, p-, d- und f-Unterschale weniger als halbgefüllt, so bildet der Term mit J = |L − S| den
Grundzustand. Ist sie mehr als halbgefüllt, so ist dies für J = L + S der Fall.
b)
Eisen besitzt 26 Elektronen mit der Elektronenkonfiguration [Ar] 3d6 4s2 . Hierbei ist [Ar] die Elektronenkonfiguration des Edelgases Argon und es handelt sich dabei also um vollständig abgeschlossene Schalen, die nach
der ersten Hundschen Regel keine Rolle spielen. Dies gilt ebenso für 4s2 ; betrachtet werden muss also nur den
Anteil 3d6 . Wegen l = 2 gibt es 2l + 1 = 5 ml -Zustände, nämlich ml ∈ {−2, −1, 0, 1, 2}. Die sechs Elektronen
müssen unter Berücksichtigung ihres Spins so verteilt werden, dass zunächst S und dann L maximal wird.
Dies erreicht man, indem fünf Elektronen mit Spin-Up (ms = 1/2) auf diese fünf Zustände verteilt werden.
Das letzte Elektron setzt man mit Spin-Down (ms = −1/2) auf den Zustand mit ml = 2. Dann ist L = 2 und
S = 2, also ist der Grundzustand 5 D4 (in der Nomenklatur 2S+1 L“ J ).
”
4
Handout zum Übungsblatt Nr.11
Aufgabe 1
• Die metallischen Eigenschaften eines Elements nehmen zu, wenn die Ionisierungsenergie des entsprechenden Atoms abnimmt. Dann können äußere Elektronen leichter abgelöst werden.
– Elektronenabgabe entweder an andere Atome (wie beispielsweise Cl), so dass sich Ionenbindungen
ausbilden (beispielsweise in NaCl).
– Bei einem reinen Metall bildet sich ein Elektronengas, über das alle Atomrümpfe miteinander gebunden sind.
• Die letztere Tatsache führt zu den typischen Charakteristiken eines Metalls:
– Biegsamkeit, gut zu bearbeitende Werkstoffe
– Oberflächenglanz, Reflexion von sichtbarem Licht durch freie Elektronen
– sehr gute elektrische Leitfähigkeit und Wärmeleitfähigkeit
– breite Absorptionsbereiche
• Typische Metalle: Wion < 8 eV, typische Nichtmetalle: Wion > 10 eV, typische Eigenschaften von Nichtmetallen:
– Sprödigkeit (zum Beispiel Salze)
– schmale Absorptionsbereiche
– schlechte elektrische Leitfähigkeit und Wärmeleitfähigkeit
• Anzahl von Metallen nimmt von oben nach unten im Periodensystem zu.
2
• Innere Elektronen reduzieren die Kernladung zu Zeff ; es gilt dann Wion = WH Zeff
/n2 . Um dies zu verstehen, ist das Bohr-Sommerfeld-Modell hilfreich. Jedes innere Elektron schirmt umso mehr Kernladung
für ein äußeres Elektron ab, je enger die Bahn des inneren Elektrons dem Kern und je weniger eng die
Bahn des äußeren Elektrons dem Kern kommt.
• p- (l = 1) und d-Elektronen (l = 2) haben nach Bohr-Sommerfeld langgestreckte Bahnen und halten sich
eher fern vom Kern auf. Dahingegen besitzen s-Elektronen (l = 0) Kreisbahnen und schirmen nahezu
eine vollständige Kernladung für äußere Elektronen ab.
• Zeff nimmt weniger schnell zu als n, so dass Wion abnimmt. Dies führt dazu, dass bei der Auffüllung der
d-Schale alle Elemente Metalle bleiben. Solche Elektronen sind locker gebunden. Dies gilt noch mehr für
die f-Schale.
• Wion sinkt stark, wenn eine neue Schale angelegt wird (Alkalimetalle).
• Wion ist kurz vor oder beim Abschluss einer Schale am größten (Edelgase).
• Bestimmung von Atomabständen in Festkörpern durch Röntgenbeugung und für isolierte Atome durch
das van-der-Waals-Kovolumen.
• Der Bohr-Radius RB = RH n2 /Zeff liefert keine gute Abschätzung für den Atomradius. Entweder reichen
die quantenmechanischen Elektronenwolken über den Bohr-Radius hinaus (Edelgase) oder die Atome
sind durch Bindungen näher beieinander (wie beispielsweise in Metallen).
• Elektronen benachbarter Atome von Übergangsmetallen in Mitte oder hinter der Mitte der d-SchalenAuffüllung sind stark gekoppelt.
– spontane Ausrichtung der Elektronenspins: Ferromagnetismus bei Fe, Ni, Co
– hohe Schmelz- und Siedetemperatur bei W, Ta, Ra, Hf
– große Dichte und kleiner Atomradius bei Os, Ir, Pt
Aufgabe 2
a)
Die Energieniveaus sind für Abschirmkonstante σ = 1 gegeben durch
E = −Ry hc(Z − 1)2
1
.
n2
(1)
Die K-Schale entspricht n = 1 und somit erhalten wir:
E = −13, 61 · (74 − 1)2 ≈ 72, 50 · 103 eV .
(2)
b)
Da das experimentell bestimmte Energieniveau für n = 1 bei E = −69, 5 · 103 eV liegt, können wir die wirkliche
Abschirmkonstante bestimmen:
s
E
E
2 1
2
2
E = −Ry hc(Z − σ) 2 ⇒ (Z − σ) = −
n ⇒ |Z − σ| = −
n2 ,
(3)
n
Ry hc
Ry hc
s
⇒ σ± = Z ±
−
E
n2 .
Ry hc
(4)
Einsetzen der Zahlenwerte liefert σ+ ≈ 145, 47 und σ− ≈ 2, 53. Die erste Lösung σ+ ist unphysikalisch, da sie
Energien E > 0 liefert. Damit ist die korrekte Abschirmkonstante σ ≈ 2, 53.
Aufgabe 3
a)
Die entsprechenden Energien sind gegeben durch:
E1 =
6, 626 · 10−34 Js · 3 · 108
hc
=
λ
766, 41 · 10−9 m
m
s
eV
≈ 1, 619 eV ,
1, 602 · 10−9 J
(5a)
E2 =
6, 626 · 10−34 Js · 3 · 108
hc
=
λ
769, 90 · 10−9 m
m
s
eV
≈ 1, 612 eV .
1, 602 · 10−9 J
(5b)
b)
Die Energiedifferenz zwischen den Niveaus 4P3/2 und 4P1/2 lautet damit
∆E = E1 − E2 ≈ 7, 34 · 10−3 eV .
(6)
c)
Es handelt sich dabei um die Feinstrukturaufspaltung. Die Energieverschiebung der Hyperfeinstruktur kann
wie folgt berechnet werden. Das Magnetfeld am Ort des Elektrons lautet
Bl =
Zeµ0
l,
4πr3 m
(7)
und damit ergibt sich (mit der Thomas-Korrektur, die einen zusätzlichen Faktor 1/2 liefert):
Ze2 µ0
a
µB
hs · Bl i = gs
hs · li = 2 hs · li =
2
3
~
16πm r
~
a
Ze2 µ0 ~2
= (j(j + 1) − l(l + 1) − s(s + 1)) , a = gs
.
2
16πr3 m2
h∆Ei = −hµs · Bl i = gs
Die Aufspaltung ist dann
½
µ
¶¾
1 3
1 3
1 3
3
a 3 5
· −1·2− · −
· −1·2− ·
= a.
∆h∆Ei =
2 2 2
2 2
2 2
2 2
2
(8)
(9)
2
Somit erhalten wir (mit l = 1):
h|B|i =
2a 1
4 ∆E p
l(l + 1) ≈ 102, 32 T .
µB h|l|i =
2
~ gs ~
3 gs µB
Prinzipiell kann man B auch direkt berechnen:
p
¿ À
µ0 e ~ l(l + 1)
µ0 e |l|
µ0 e h|l|i
≈
≈ 17, 6 T .
h|B|i =
≈
4πm r3
4πm hr3 i
4πm
a0
(10)
(11)
Bei dieser Abschätzung wurden einige grobe Näherungen verwendet und zwar:
• Korrelationen nicht berücksichtigt: habi =
6 haihbi, h1/r3 i 6= 1/hr3 i
• Annahme von hri = a0
Diese grobe Abschätzung weicht um einen Faktor 5 vom zuvor bestimmten Magnetfeld ab. Dies liegt an den
Näherungen, die wir gemacht haben.
Aufgabe 4
Laserlicht hat die folgenden Eigenschaften:
• hohe Intensität, gute Fokussierung des Strahls möglich
• bei kontinuierlichen Lasern: in sehr guter Näherung monochromatisches Licht, also kleine spektrale Breite:
∆λ/λ ¿ 1
• hohe zeitliche Kohärenz, sehr lange kohärente Wellenzüge von der Gestalt (1), bei normalen Glühlampen
nur inkohärente Wellenzüge (2), (3)
Die sehr guten Kohärenzeigenschaften, die wichtig sind zur Erzeugung von Interferenzphänomenen, gehen auf
die Tatsache zurück, dass bei einem induzierten Emissionsprozess Atome mit einer festen Anregungsenergie
gleichphasig emittieren.
3
Handout zum Übungsblatt Nr.12
Aufgabe 1
a) und b)
Nach der Heisenbergschen Unbestimmtheitsrelation gilt ∆x · ∆p ≥ ~/2. Hierbei sind ∆p und ∆x prinzipielle
Unbestimmtheiten von Impuls und Ort, die aus den Eigenschaften der Quantentheorie heraus folgen. Die Relation besagt im Wesentlichen, dass Ort und Impuls gleichzeitig nicht beliebig genau gemessen werden können.
Das ist eine Folge der Nichtvertauschbarkeit des Orts- und Impulsoperators. Analog lässt sich die Beziehung
∆E · ∆t ≥ ~/2 ableiten, die jedoch anders aufgefasst werden muss als die erstere Unbestimmtheitsrelation
zwischen Ort und Impuls. Hier sind ∆E und ∆t keine Ungenauigkeiten, weil man der Zeit auch in der Quantenmechanik keinen Operator zuordnet; diese ist wie auch in der klassischen Mechanik ein einfacher Parameter.
In einem quantenmechanischen System ist ∆E die Abweichung vom mittleren Wert der Energie hEi, die das
System über ein Zeitintervall ∆t annehmen kann. Hierbei muss
~
,
(1)
2∆E
sein, so dass die Wahrscheinlichkeitsdichte ψ ∗ ψ der Wellenfunktion ψ (welche diesen Zustand der Energie
hEi + ∆E beschreibt) konstant (stationär, also von der Zeit unabhängig) ist. Damit ist es beispielsweise
möglich, dass aus dem Vakuum heraus ein virtuelles Teilchen entsteht, dass sich nach der Zeit ∆t ∼ ~/(2∆E)
wieder vernichtet. (Man spricht dabei von Vakuumfluktuationen.) Der klassische Energieerhaltungssatz ist also
für einen sehr kurzen Zeitraum ∆t verletzt, denn das Vakuum hat hEi = 0.
Die Lebensdauer τ der Teilchen ist damit gegeben durch ∆W · τ = ~/2 und somit folgt:
∆t ¿
τ=
~
~
=
,
2∆W
4γ(v)mc2
1
γ(v) = p
,
1 − β2
β=
v
.
c
(2)
Mit v = 0 ist die Lebensdauer der Teilchen maximal. Die Teilchen stehen dann jedoch still und legen keine
Weglänge zurück. Die Weglänge
r
~v
v2
~
∆x = τ v =
=
v 1− 2 ,
(3)
2
2
4γ(v)mc
4mc
c
maximal werden, also die erste Ableitung verschwinden:
µ
¶
d(∆x)
~
v2
1
!
q
= 0.
=
1
−
2
2
2
dv
4mc
c
v2
1−
(4)
c2
√
Dies ist der Fall für v = c/ 2.
Aufgabe 2
Hier kann man in zwei Schritten argumentieren:
• Das 1s-Orbital des Heliumatoms (Edelgas!) ist voll besetzt mit zwei Elektronen, die entgegengesetzte
Spineinstellung haben. Zwei solcher Orbitale können also nicht überlappen, um darin weitere Elektronen
unterzubringen, weil dies dem Pauliprinzip widersprechen würde.
• Es wäre höchstens möglich, dass zwei der vier Elektronen in den nächst höheren Energiezustand wechseln.
Dabei handelt es sich jedoch um ein antibindendes Orbital. Der bindende Effekt zweier Elektronen hebt
sich dann mit dem antibindenden Effekt der anderen beiden Elektronen auf. Letzterer zieht die beiden
Atome wieder auseinander.
Aufgabe 3
Man bildet durch Linearkombination der Wasserstoffwellenfunktionen gleicher Energie neue Wellenfunktionen.
In der Sprache der Molekülphysik sagt man, dass durch Hybridisierung neue Orbitale geformt werden (LCAO:
Linear Combination of Atomic Orbitals). Prinzipiell werden jedoch nicht die Orbitale linearkombiniert (weil
diese ja bereits die Betragsquadrate der Wellenfunktionen sind, es sich also um Aufenthaltswahrscheinlichkeitsräume handelt), sondern die Wellenfunktionen.
• sp3 -Hybridisierung: Linearkombination der |2, 0, 0i-, |2, 1, −1i-, |2, 1, 0i- und |2, 1, 1i-Zustände (geschrieben als |n, l, mi). Chemiker sprechen dann immer von der Hybridisierung der s-, px -, py - und pz -Orbitale.
Dadurch entstehen vier neue Orbitale und damit sind vier Bindungen möglich. Ein Beispiel dafür ist CH4 .
• sp2 -Hybridisierung: Hybridisierung der s-, px -, py -Orbitale. Beispiel: H2 − C = C − H2 .
• sp-Hybridisierung: Hybridisierung von s- und pz -Orbitale. Beispiel: HC ≡ CH
Hier ist ein Beispiel für die Linearkombination von |2, 0, 0i-, |2, 1, −1i-, |2, 1, 0i- und |2, 1, 1i-Zuständen (in
Abhängigkeit von ϑ, ϕ-Abhängigkeit unterdrückt) skizziert:
2