Glossar
Werbung

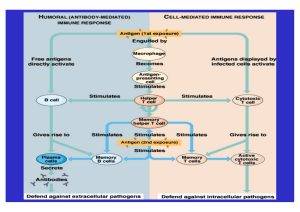
Glossar Antigene: Substanzen, die eine Immunreaktion induzieren. Antigen-präsentierende Zellen (APC): aktivierte B-Zellen, dendritische Zellen, Makrophagen u. a. können Antigene erkennen und an ihrer Oberfläche anderen Immunzellen präsentieren. Unter Mitwirkung u. a. von T-Helfer-Zellen kommt es zu einer Kaskade entzündlicher Prozesse (ggf. mit T-Zell-Aktivierung) gegen die Antigen-tragende Struktur. Antikörper (Ak): Gegen Antigene gebildete Immunglobuline (Ig), die an Antigene binden und diese zerstören können. Sie sind wichtigster Träger der humoralen Abwehr. Apoptose: Biologisch sinnvoller „programmierter Zelltod“, der intrinsisch oder extrinsisch ausgelöst wird, z. B. durch den Tumornekrosefaktor (TNF) und andere Zytokine. ARR (Annualized Relapse Rate): Rate an MS-Schüben, bezogen auf ein Jahr. Autoimmunität: Autoaggressiver Prozess, bei dem autoreaktive Antikörper oder Immunzellen (z. B. T-Zellen) körpereigene Strukturen angreifen. Für Anfragen zum Unternehmen: Dr. Nina Schwab-Hautzinger Head of Communications & Public Affairs Für Anfragen zu Produkten: Ulla Satzger Team Lead Product Communications [email protected] Tel. 07624 /14 - 4030 Axon: Nervenzell-Fortsatz, der Aktionspotenziale auf andere Neurone oder Effektorzellen (z. B. Muskeln, Drüsen) überträgt. Benigne MS: Umstrittener Begriff für einen „gutartigen“ MS-Verlauf, der sich durch sehr wenige klinische Schübe bzw. gute Symptom-Rückbildung, geringe MS-Aktivität im MRT und eine sehr langsame oder fehlende Zunahme der Behinderung auszeichnet. B-Zellen (B-Lymphozyten): Immunzellen, die je nach Differenzierung verschiedene Funktionen ausüben. Das ist neben der Produktion von Antikörpern durch Plasmazellen und der langfristigen immunologischen Informationsspeicherung (Gedächtniszellen) u. a. die – in der MS-Pathophysiologie wichtige – Antigen-Präsentation (APC). CD (Clusters of Differentiation): Protein-Merkmale auf verschiedenen Zellen (u. a. B-Zellen), die sehr verschiedene Funktionen (Regulierung von Zellaktivierung, -proliferation und -differenzierung, Adhäsion, Migration etc.) ausüben (z. B. CD20, CD52). Demyelinisierung (Entmarkung): Diffuse oder herdförmige Schädigung der Myelinscheiden der Axone, welche die Signalübertragung verlangsamt oder blockiert. Depletion: Die (mehr oder weniger vollständige) Reduzierung bestimmter Zellpopulationen, z. B. bei der MS selektiv der T- und/oder B-Zell-Populationen durch AntikörperPräparate. EDSS (Expanded Disability Status Scale): Skala zur Erfassung der neurologischen Defizite bzw. des Behinderungsgrades. Dieser wird auf einer Skala von 0 („keine Schädi- Roche Pharma AG Emil-Barell-Straße 1 79639 Grenzach-Wyhlen Tel. +49 7624 14 - 0 Fax +49 7624 14 – 3366 www.roche.de 1/6 gung bzw. Behinderung“) bis 10 („Tod durch MS“) in 20 halben Schritten angegeben. Die EDSS ist stark auf die Gehfähigkeit fokussiert, ein wichtiger Grenzwert liegt bei 6,0 (= Gehstrecke ohne Hilfsmittel < 100 m). Ektopische lymphoide follikelartige Strukturen (ELFS): In verschiedenen Organstrukturen (z. B. Darmschleimhaut, Tonsillen, Lymphknoten, Milz) kommen Lymphfollikel vor, in denen sich nach Antigen-Kontakt u. a. B-Lymphozyten differenzieren und vermehren. ELFS sind Ansammlungen von Lymphgewebe, die sich an anderen, nicht-physiologischen Orten („ektop“) bilden und ebenfalls Kolonien von B-Zellen enthalten können. Sie werden z. B. bei Patienten mit chronisch progressiver MS in den Meningen beobachtet und scheinen den Entzündungsprozess im Hirn zu fördern. Fatigue: Bezeichnet in erster Linie die vorschnelle Erschöpfbarkeit, im weiteren Sinne aber auch eine anhaltende Müdigkeit, Schwäche und Antriebslosigkeit. Gadolinium (Gd): Bestandteil eines Kontrastmittels, das im T1-gewichteten MRT umschriebene Zonen einer pathologisch durchlässigen Blut-Hirn-Schranke als hyperintense Areale sichtbar macht und Hinweise auf akute entzündliche Vorgänge gibt. Graue Substanz (GM): Die Regionen im ZNS, die hauptsächlich aus Nervenzellkörpern bestehen. Hirnatrophie: Schwund von Hirngewebe. Humorale Abwehr: Oberbegriff für die immunologischen Abwehrfunktionen in Körperflüssigkeiten, wie z. B. Bildung/Transport von Antikörpern. Sie wird der zellulären Abwehr gegenübergestellt. Immunglobuline: siehe Antikörper. Immunmodulation: Hemmende oder stimulierende Beeinflussung des Immunsystems durch Medikamente. Viele MS-Medikamente sind Immunmodulatoren. Von ihr abgegrenzt wird die Immunsuppression. Immunsuppression: Die Unterdrückung des körpereigenen Immunsystems durch Medikamente (z. B. gegen die Abstoßung transplantierter Organe). Bei der MS werden heute mehr oder weniger selektive immunsupprimierende Medikamente angewendet. Interferon beta (IFN-β): Ein Zytokin, das als erstes Medikament zur immunmodulatorischen, verlaufsmodifizierenden Therapie der schubförmig remittierenden MS (RRMS) eingesetzt wurde. Interleukine (IL-1 bis IL-35): Peptidhormone aus der Gruppe der Zytokine, die steu- 2/6 ernd/regulierend in Immunprozesse eingreifen, indem sie u. a. die Proliferation und Aktivität von T- und B-Zellen verändern. Sie werden in vorwiegend pro- und antiinflammatorische IL eingeteilt (s. Zytokine). KIS (Klinisch isoliertes Syndrom): Wird bei einem ersten klinischen (demyelinisierenden) Ereignis diagnostiziert, das auf eine MS hinweist. Läsionen (syn.: Herde, Plaques): Entstehen bei der MS im ZNS durch entzündliche und degenerative Prozesse, werden hauptsächlich mittels MRT dargestellt. Liquor (Cerebrospinal fluid, CSF): Körperflüssigkeit im ZNS. Bei MS-Patienten wird er auf pathologische Bestandteile, vor allem Antikörper (MS-charakteristische „oligoklonale Banden“) untersucht. Lymphozyten: Untergruppe der Leukozyten, die B-Zellen und T-Zellen sowie natürliche Killerzellen umfasst. Als Teil des adaptiven Immunsystems machen sie in den Körper eingedrungene Fremdstoffe und Erreger unschädlich. mAb (monoclonal Antibodies): Antikörper eines Zellklons. Biosynthetisch hergestellt werden sie als Medikamente eingesetzt. McDonald-Kriterien: Aktuelle Kriterien, nach denen die MS unter bestimmten Bedingungen (zeitliche und räumliche Dissemination im MRT; ein klinisches Symptom) bereits nach einem ersten MS-verdächtigen Schub diagnostiziert werden kann (letzter Stand: 2010). MSFC (Multiple Sclerosis Functional Composite): Skala zur Beurteilung des Schweregrades der Behinderungen – umfasst die Gehstrecke, die Handmotorik und die Kognition. Myelin: Eine aus Lipiden (70 %) und Proteinen (30 %) bestehende biologische Membran, die als Scheide Axone umhüllt. Sie dient der elektrischen Isolation und der schnellen Weiterleitung von Aktionspotenzialen. Natürliche-Killer (NK)-Zellen: Unterform der Lymphozyten, die pathologisch veränderte Zellen (z. B. Krebszellen) zerstören können. Als Teil des angeborenen Immunsystems reagieren sie nicht Antigen-spezifisch, da sie keine Antigen-spezifischen Rezeptoren haben. Neurodegeneration: Die fortschreitende Schädigung/Zerstörung von Axonen, Neuronen und anderen Zellen, ohne dass klassische Entzündungsprozesse feststellbar sind. Bei MSPatienten dominiert sie eher die späten bzw. progredienten Erkrankungsstadien (SPMS, PPMS). 3/6 Neuroinflammation: Die akute oder chronische Entzündung von Nervengewebe mit Schädigung/Zerstörung von Axonen, Neuronen und anderen Zellen. Bei MS-Patienten beherrscht sie eher die frühen Erkrankungsstadien. PML (progressive multifokale Leukenzephalopathie): Eine schwere akut-entzündliche Entmarkungserkrankung des Gehirns, insbesondere der weißen Substanz. Sie wird durch eine Aktivierung des latent vorhandenen JC (John Cunningham)-Virus verursacht und kann unter einigen immunmodulierenden MS-Medikamenten als opportunistische Infektion auftreten. PPMS (primär progrediente MS): Verlaufsform, mit der 10 % bis 15 % aller MSErkrankungen beginnen. Von Anfang an ist kaum eine akut-entzündliche Aktivität (z. B. abgrenzbare Schübe) zu beobachten, stattdessen dominieren schon initial neurodegenerative ZNS-Veränderungen mit stetiger, teils rasanter Behinderungszunahme. RRMS (relapsing-remitting MS): Schubförmig remittierende Verlaufsform der MS, mit der etwa 85 % aller MS-Erkrankungen beginnen. Sie ist gekennzeichnet durch wiederholte, zeitlich mehr oder weniger lang auseinanderliegende, abgrenzbare Schübe und dazwischen-liegende schubfreie Intervalle. Die RRMS geht bei etwa der Hälfte der unbehandelten Patienten nach 10- bis 20-jähriger Erkrankungsdauer in die sekundär progrediente MS (SPMS) über. Schub: Bezeichnet das akute (Wieder-)Auftreten eines oder mehrerer MS-Symptome bzw. deren Verschlimmerung. Definitionsgemäß müssen diese mindestens 24 Stunden andauern und mindestens 30 Tage nach dem letzten Schub aufgetreten sein. SF-36: Der Short Form (36) Gesundheitsfragebogen ist ein krankheitsunspezifisches Messinstrument zur Erhebung der gesundheitsbezogenen Lebensqualität. Er wird häufig zur Therapiekontrolle oder Verlaufsmessung eingesetzt. SPMS (sekundär progrediente MS): Verlaufsform, die aus einer schubförmig remittierenden MS (RRMS) hervorgeht, bei der die akut-entzündliche Aktivität in Form abgrenzbarer Schübe immer seltener wird oder ganz fehlt. Die neurodegenerativen ZNSVeränderungen dominieren immer stärker und die Behinderung nimmt stetig zu. T1-Läsionen: Zonen, die sich im T1-gewichteten MRT wie folgt darstellen: a) nach Kontrastmittelgabe als (anreichernde) hyperintense Areale, die für einen akuten MS-Herd mit Störung der Blut-Hirn-Schranke stehen. b) als hypointense Areale im Sinne eines „Black Hole“, die – bei längerer Persistenz – einen irreversiblen Gewebeverlust anzeigen. T2-Läsionen: Zonen, die sich im T2-gewichteten MRT (ohne Kontrastmittel) als hyperintense Areale darstellen. Neue T2-Läsionen stehen für frische MS-Herde, in denen 4/6 Entzündung, Ödem und/oder Nekrose vorliegen. T1-/T2-Wichtung: Zwei unterschiedliche MRT-Kontrastdarstellungen, bei denen die Gewebeunterschiede vor allem anhand ihrer T1- bzw. T2-Relaxationszeit dargestellt werden. T-Helfer-Zellen (TH): Subgruppe der T-Zellen mit einer Helferfunktion: Sie erkennen Antigene an den Antigen-präsentierenden Zellen, sind selbst aber weder direkt zytotoxisch noch phagozytieren sie. Sie wirken hauptsächlich über die Sezernierung von Zytokinen, die ihrerseits andere Immunzellen wie zytotoxische T-Zellen, Antikörper-bildende B-Zellen oder Makrophagen aktivieren. TH1-Zellen: Subgruppe der T-Helfer-Zellen, die nach Aktivierung vorwiegend stimulierend auf die Immunprozesse einwirkt, indem sie proinflammatorische Zytokine wie IFN-, IL-2 und TNF-α freisetzt. TH1-Zellen sind bei der Erregerabwehr sehr aktiv und interagieren intensiv mit Antigen-präsentierenden Makrophagen. TH2-Zellen: Subgruppe der T-Helfer-Zellen, die ein bestimmtes Muster anti- und proinflammatorischer Zytokine (z. B. IL-4, IL-6 bzw. IL-10) sezerniert. Sie interagieren besonders mit B-Zellen, die sie zur Aktivierung, Proliferation und Differenzierung und damit letztlich zur Antikörperbildung anregen. Sie wirken auch (antiinflammatorisch) der T H1Reaktion entgegen. TH17-Zellen: Subgruppe der T-Helfer-Zellen, die nach Aktivierung stimulierend auf das Immunsystem wirkt, indem sie u. a. das proinflammatorische Zytokin IL-17 freisetzt. Sie aktivieren neutrophile Granulozyten und bewirken damit Entzündungsprozesse. Timed 25-Foot Walk (T25FWT; T25W): Test zur Erfassung der Gehfähigkeit. Gemessen wird, wie schnell ein Proband eine Strecke von ca. 8,5 m zurücklegen kann. Treg (regulatorische T-Zellen; syn. Suppressor-T-Zellen): Spezialisierte Untergruppe der T-Zellen, welche die Aktivität des Immunsystems herunterreguliert. Sie wirken u. a. hemmend auf aktivierte T-Zellen und beugen der Autoimmunität vor. T-Zellen (T-Lymphozyten): Leukozyten, die Antigene erkennen können. Sie sind Teil der zellulären Abwehr und haben große Bedeutung für die Einleitung einer Immunantwort. Es existieren ganz unterschiedliche T-Zell-Typen mit verschiedenen Funktionen wie z. B. direkt zytotoxische T-Zellen, T-Helfer-Zellen, regulatorische T-Zellen etc. Weiße Substanz (White Matter, WM): Die Regionen im ZNS, die hauptsächlich aus myelinisierten (markhaltigen) Nervenfasern bestehen. Zelluläre Abwehr: Oberbegriff für Abwehrmechanismen, die von den Zellen des Immunsystems, v. a. von Lymphozyten und natürlichen Killerzellen, getragen werden. 5/6 Zytokine: Körpereigene Peptide, die u. a. die Proliferation und die Differenzierung verschiedener Zell-Typen regulieren. Sie umfassen fünf Typen: Interferone (IFN; z. B. IFN-α, IFN-β und IFN-), Interleukine (IL; IL-1 bis IL-35), Kolonie-stimulierende Faktoren (CSF; u. a. Granulozyten-Kolonie-stimulierender Faktor = G-CSF), Tumornekrosefaktoren (TNF) und Chemokine, die Immunzellen anlocken. Von Immunzellen gebildete Zytokine fördern oder hemmen als Mediatoren verschiedene Prozesse der Immunreaktion. Zytokine, proinflammatorisch: Entzündungsfördernde Botenstoffe. Dazu gehören u. a. die Interleukine IL-1β, IL-6, IL-8 und IL-12 sowie der Tumornekrosefaktor (TNF). Sie vermitteln die Kommunikation mit Lymphozyten und anderen Immunzellen, die sie u. a. zu Wachstum und Proliferation anregen können. Zytokine, antiinflammatorisch: Entzündungshemmende Botenstoffe. Dazu gehören u. a. die Interleukine IL-4, IL-10, IL-11 und IL-35 sowie der Transforming Growth Factor beta (TGF-β), die dafür sorgen, dass eine Immunreaktion nicht überschießend ausfällt. Eindeutige Kennzeichnung von biologischen Arzneimitteln in der medizinischen Kommunikation Für die Patientensicherheit ist es wichtig, biologische Arzneimittel durch ihren Handelsnamen klar zu kennzeichnen. Nur so kann gewährleistet werden, dass mögliche Nebenwirkungen eindeutig einem bestimmten Produkt zugeordnet und zurückverfolgt werden können. Analog europäischer behördlicher Vorgaben für die Dokumentation des Handelsnamens in der Patientenakte nennt Roche in Publikationen, Texten und Presseinformationen deshalb neben dem internationalen Freinamen auch den Handelsnamen. 6/6