Diagnostik im Dialog
Werbung

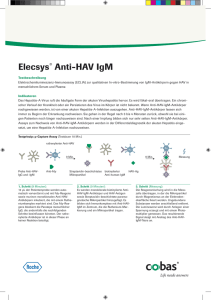
Ausgabe 17 • 02 /2008 Diagnostik im Dialog Newsletter der Roche Diagnostics GmbH S abe ogie g s u a r iol onde nfekt I m einsa Gem ektiven Persp n! ffe scha Editorial Liebe Leserinnen und Leser, mit der 17. Ausgabe unseres Newsletters „Diagnostik im Dialog“ begrüße ich Sie im Jahr 2008 und wünsche Ihnen viel Erfolg und Gesundheit für das neue Jahr. Gemäß unserem Konzernversprechen „Roche – Innovation für die Gesundheit“ verfolgen wir auch in diesem Jahr das Ziel, Sie mit neuen Lösungen und Konzepten in Ihrer Arbeit im Labor und im Krankenhaus zum Wohle Ihrer Patienten zu unterstützen. In unserem Fokus steht die kontinuierliche Schaffung eines medizinischen Mehrwertes bei gleichzeitiger Optimierung effizienter Prozesse. Das gilt auch für die Infektiologie, der wir hiermit eine Sonderausgabe widmen. Die von Roche erworbene Lizenz für den Anti-HCV-Test auf Elecsys Systemen für die In-vitro-Diagnostik bedeutet einen entscheidenden Schritt in Richtung Konsolidierung der Infektionsroutine und eine weitere Verbesserung der ProzessDr. Uwe Oberländer abläufe für den Serumarbeitsplatz. Lesen Sie mehr über die Testspezifikationen des Elecsys Anti-HCV-Tests, der unser Hepatitis-Menü komplettiert, auf Seite 6. Die durch eine HCV-Infektion bedingte Entstehung von Leberzirrhose und Lebertumoren gehört – wie alle Infektionskrankheiten – zu den häufigsten Todesursachen. Dem Nachweis von Bakterien und Viren mit Hilfe hochsensitiver Testverfahren kommt deshalb eine hohe Bedeutung zu. Schaffen Sie gemeinsam mit uns Perspektiven in der Infektionsdiagnostik! Folgende Artikel erwarten Sie heute: • Dienstleister für den Außendienst heißt Dienstleister für Sie • Für Sie gelesen: Automatisierte Real-Time PCR Assays ermöglichen high-throughput Analytik mit minimaler hands-on-Zeit • HCV: State of the Art in Diagnostik und Therapie • Elecsys Anti-HCV: Wenn hohe Anforderungen übertroffen werden • Konsolidierung um jeden Preis? Interview mit Dr. med. Josef van Helden • Eine einfache (Erfolgs-)Formel: Portfolio = Konsolidierung = Effizienz • Ausgewählte Veranstaltungen und Termine: März bis Juni 2008 Ich wünsche Ihnen viel Freude beim Lesen dieser Ausgabe und interessante Einblicke in die Welt der Diagnostik, der Therapie und des Monitorings von Infektionserkrankungen! Ich freue mich auf eine intensive und gute Zusammenarbeit mit Ihnen in diesem Jahr und verbleibe mit den besten Grüßen für 2008! Ihr Dr. Uwe Oberländer, Leiter Marketing Labordiagnostik, Roche Diagnostics GmbH Roche Diagnostics Intern Dienstleister für den Außendienst heißt Dienstleister für Sie Nord/Ost West Mitte Mannheim Süd Penzberg Mannheim: Vertrieb – Logistik – Produktion – Entwicklung mit ca. 7.000 Arbeitsplätzen Penzberg: Einer der größten BiotechnologieStandorte Europas, Forschung – Entwicklung – Produktion mit ca. 4.000 Arbeitsplätzen 2 Nah bei unseren Außendienstkollegen in den Regionen Nord / Ost, West, Mitte und Süd, die sich in den vorausgegangenen Ausgaben des Newsletters vorgestellt haben (vgl. „Diagnostik im Dialog“, Ausgaben 13-16), sind wir, der Verkaufsinnendienst, mit elf kompetenten und motivierten Damen und Herren für Sie aktiv. Die Unterstützung bei Ausschreibungen, die Erstellung von Angeboten und das Management von Verträgen sind unsere Kernaufgaben. Ebenso kümmern wir uns um die Korrespondenz mit Ihnen sowie die Organisation interner und externer Veranstaltungen in den Regionen. So ist der Verkaufsinnendienst Ansprechpartner vor Ort für Sie genauso wir für unsere Kolleginnen und Kollegen aus Verkauf und Service: Dienstleister für den Außendienst heißt Dienstleister für Sie! Haben Sie Fragen oder Anregungen? Dann sprechen Sie uns an! Unsere Nähe – Ihr Vorteil! Der Roche Diagnostics Verkaufsinnendienst Obere Reihe von links nach rechts: Christine Boutaleb, Sebastian Fritsche, Christian Heininger, Daniela Klein, Ursula Krumtünger, Petra Markhoff // Untere Reihe von links nach rechts: Martine Moll, Salvatore Quarta, Gitta Remy, Karin Speerschneider, Erika Voswinckel // Nicht auf dem Bild: Anja Büchler Ihre Ansprechpartnerin: Erika Voswinckel 01 73 – 58 61 235 erika.voswinckel @roche.com Markt und Medizin Für Sie gelesen: Automatisierte Real-Time PCR Assays ermöglichen high-throughput Analytik mit minimaler hands-on-Zeit Vergleich: Real-Time PCR Systeme von Abbott und Roche für HCV und HIV D. Wolff, A. Gerritzen: Comparison of the Roche COBAS AMPLICOR Monitor, Roche COBAS AmpliPrep / COBAS TaqMan and Abbott Real-Time Test assays for quantification of hepatitis C virus and HIV RNA. Medizinisches Labor Bremen, Clin Chem Lab Med 2007; 45: 917-922. Die Autoren vergleichen in dieser Publikation die beiden neu entwickelten automatisierten Real-Time PCR Analysensysteme von Abbott (m2000sp /m2000rt) und Roche (COBAS AmpliPrep / COBAS TaqMan ) für die Parameter HCV und HIV. Als Referenzsystem dient das System COBAS AMPLICOR mit Endpunkt-PCR Technologie. Verwendete Probenmaterialien 102 Proben von HCV-infizierten Patienten und 109 Proben von HIV-1-infizierten Patienten aus dem Standard-Einsenderkollektiv wurden analysiert. 84 % der Patienten waren Deutsche, 16 % stammten aus anderen europäischen Ländern. Die dominierenden Genotypen in dieser Kohorte waren HIV Typ B (98 %) und HCV Genotyp 1 (58 %), 2 (5 %), 3 (32 %), 4 (5 %). Ergebnisse Die Ergebnisse der Studie bestätigten die hohe Sensitivität und den breiteren dynamischen Bereich der Real-Time PCR im Vergleich zu konventionellen Endpunkt-Amplifikationsmethoden. Beide Real-Time PCR Testsysteme zeigten gute Korrelationskoeffizienten zum COBAS AMPLICOR. Die höchsten Korrelationskoeffizienten gab es bei dem Vergleich der beiden Real-Time Systeme für die Parameter HCV und HIV untereinander. Die Ergebnisunterschiede zwischen den Real-Time PCR Assays waren gering (max. 0,5 log), auch in Bezug auf die genutzten Referenzpanels. Bei den HIV Gruppe M und Subtyp N spezifischen Panels gab es eine gute Konkordanz, der Subtyp O wurde erwartungsgemäß nur vom Abbott Real-Time Assay erkannt. Die Real-Time PCR Assays zeichneten sich durch einen sehr breiten dynamischen Bereich aus, der Verdünnungen wie bei Endpunkt-Amplifikationsmethoden weitgehend überflüssig macht. 3 Ein besonderer Schwerpunkt war die Analyse der notwendigen Laborarbeit für die beiden Real-Time Systeme. Dazu wurde die turnaround- und die hands-on-Zeit bestimmt, in dem eine Simulation einer Tagesschicht unter Vollauslastung durchgeführt wurde. Für HCV- und HIV-Tests bedeutete dies eine kürzere turnaround- und hands-on-Zeit für das Roche COBAS AmpliPrep / COBAS TaqMan System im Vergleich zum Real-Time-System von Abbott: In einer Tagesschicht konnte der COBAS AmpliPrep / COBAS TaqMan 72 Patientenproben analysieren, das m2000-System von Abbott 48 Proben. Der Unterschied beruhte auf der signifikanten Reduktion manueller Eingriffe, da das Probenvorbereitungssystem COBAS AmpliPrep über die AMPLILINK-Software mit dem Analysensystem COBAS TaqMan verbunden ist. Andererseits müssen die extrahierten Proben per Hand vom m2000sp zum m2000rt Thermocycler transportiert und die Daten zwischen den separaten Datenstationen ausgetauscht werden. Für beide Real-Time PCR Systeme wurde eine sehr gute Eignung für das diagnostische Routinelabor festgestellt. Die Automation beider Systeme ermöglicht high-throughput PCR Analytik mit einem Minimum an hands-on-Zeit für das Roche COBAS AmpliPrep / COBAS TaqMan System. Workflow-Analyse Roche CAP / CTM und Abbott m2000sp / m2000rt Roche 0 1 2 3 4 Zeit (h) 5 6 CAP 1 2 m2000sp 65’ 52’ 65’ 10 10’ 390’ 3 4 Zeit (h) 5 m2000rt m2000sp 135’ 6 7 8 9 m2000rt m2000sp 65’ 11 Wartung 1. Lauf: 24 HIV-Proben 2. Lauf: 24 HCV-Proben 3. Lauf: 24 HIV-Proben CTM 10’ Abbott 0 9 CTM CAP 80’ 8 CTM CAP 97’ 7 178’ 10 m2000rt 5’ 11 Wartung 1. Lauf: 24 HIV-Proben 2. Lauf: 24 HCV-Proben 3. Lauf: 24 HIV-Proben 175’ Hands-on-Zeit Hands-off-Zeit CAP = COBAS AmpliPrep; CTM = COBAS TaqMan Ihr Ansprechpartner: Dr. Michael Herlt 06 21 – 7 59 47 27 michael.herlt @roche.com Quelle: in Anlehnung an Wolff, Gerritzen (2007) HCV: State of the Art in Diagnostik und Therapie von: Prof. Dr. med. Christoph Sarrazin, Klinikum der J. W. Goethe-Universität Frankfurt, Medizinische Klinik I, Theodor-Stern-Kai 7, 60590 Frankfurt, E-Mail: [email protected] Diagnostik Nach der Infektion mit dem Hepatitis C Virus (HCV) kommt es innerhalb von vier bis sechs Wochen zur Ausbildung von HCV-Antikörpern (HCV-AK). In der Mehrzahl der Fälle (50-80 %) verläuft eine HCV-Infektion chronisch. Als Marker einer vorhandenen Replikation des HCV dient der Nachweis der HCV RNA. Zum Ausschluss einer akuten HCV-Infektion ist immer eine HCV RNA Untersuchung notwendig, da HCV-AK in den ersten Wochen noch fehlen können. Im Falle einer spontanen oder therapie-induzierten Ausheilung persistieren HCV-AK häufig über viele Jahre, so dass der Nachweis der HCV RNA auch zur Diagnose einer chronischen Hepatitis C notwendig ist. 4 Exakte Bestimmung der HCV RNA ist der Schlüssel für das erfolgreiche Management einer HCV-Therapie HCV-AK dienen also als Screening-Marker, die einen stattgefundenen Kontakt mit dem HCV anzeigen, aber keine Aussage über eine akute, chronische oder ausgeheilte Infektion zulassen. Der Nachweis von HCV-AK gelingt verlässlich mit Antikörper-Assays der 3. Generation und sowohl falsch positive als auch falsch negative Testergebnisse sind in der klinischen Routine sehr selten. HCV RNA dagegen ist nur nachweisbar, wenn eine Replikation des HCV vorliegt und dient somit als Bestätigung der aktiven HCV-Infektion. Der Nachweis der HCV RNA kann mit verschiedenen molekularbiologischen Methoden erfolgen. Die unterschiedlichen qualitativen und quantitativen HCV RNA Assays wiesen jedoch diverse Mängel auf und waren für den Einsatz in der klinischen Praxis nicht optimal. In den letzten Jahren hat daher eine Umstellung der Assays auf Real-Time PCR basierte Verfahren begonnen. Mit der Real-Time PCR ist es möglich, geringste Mengen an HCV RNA (um 10 IU / ml) noch verlässlich anzuzeigen und gleichzeitig die HCV RNA Konzentration über einen weiten Bereich von ca. 30 IU / ml bis 10 Millionen IU / ml exakt zu messen. Gleichzeitig wurde teilweise ein hoher Automatisierungsgrad der HCV RNA Assays erreicht. Der COBAS Ampliprep / COBAS TaqMan Assay beispielsweise war der erste kommerziell erhältliche Real-Time PCR-basierte Test zum Nachweis von HCV RNA von ca. 10 IU / ml bis 69 Millionen IU / ml und erreichte dabei ebenfalls zum ersten Mal eine vollständige Automatisierung von der Probenvorbereitung bis zum Ablesen des Ergebnisses. Neben dem COBAS TaqMan Assay von Roche, der von der Europäischen Union CE-zertifiziert wurde und weltweit am häufigsten eingesetzt wird, wurde in der Zwischenzeit von Abbott ein Real-Time HCV Assay zugelassen und Siemens plant ebenfalls die Einführung eines Real-Time PCR-basierten HCV RNA Assays (vgl. Abbildung). International kommerziell erhältliche HCV RNA Assays IU / ml 108 107 106 105 104 103 102 101 100 5-10 615 bDNA TMA Versant TM Siemens (ehemals Bayer) 50 qual. 600 15 real-time quant. Amplicor TM Roche Diagnostics 12 real-time real-time HCV TM Abbott Therapie Die Behandlung der chronischen Hepatitis C hat sich seit der Entdeckung des HCV im Jahr 1989 ganz wesentlich verbessert und die exakte Bestimmung der HCV RNA ist der Schlüssel für das erfolgreiche Management einer HCV-Therapie. Die Standardtherapie der chronischen Hepatitis C besteht in der Gabe von Interferon alfa in einer pegylierten Form (PEG-Interferon ), wodurch eine einmal wöchentliche Gabe ermöglicht wird. Zusätzlich erhalten die Patienten täglich Tabletten mit dem Nukleosidanalogon Ribavirin. Auf der Grundlage zahlreicher Studien konnte eine Individualisierung in Form einer maßgeschneiderten Therapie für den einzelnen Patienten realisiert werden. Dazu sind zum einen Stoppregeln, die bei Patienten ohne eine weitere Chance auf eine Heilung einen Abbruch der Behandlung erlauben, und zum anderen Regeln zur Festlegung der Therapiedauer, eingeführt worden: Stoppregeln: Kommt es nach zwölf Wochen nicht zu einem Abfall der HCV RNA Konzentration um mindestens 2 log10 Stufen bzw. nach 24 Wochen Therapie nicht zu einer Negativierung der HCV RNA mit einem sensitiven Assay (< 50 IU / ml), dann ist eine Heilung sehr unwahrscheinlich (1-2 %) und die Therapie kann nach zwölf bzw. 24 Wochen vorzeitig abgebrochen werden, wodurch eine unnötige weitere Behandlung mit entsprechenden Nebenwirkungen und nicht zuletzt auch Kosten vermieden wird. 5 Therapiedauer: Kommt es bereits nach vier Wochen Therapie zu einer Negativierung der HCV RNA mit einem sensitiven Assay bei Patienten mit einer niedrigen Ausgangsviruslast (< 400.000 bis 800.000 IU / ml – bei Genotyp 2,3) dann kann die Dauer der Therapie auf 16 Wochen (Genotyp 2 oder 3) bzw. 24 Wochen (Genotyp 1) gegenüber sonst 24 bzw. 48 Wochen bei gleichzeitig exzellenten Heilungschancen von 80 bis 90 % verkürzt werden. Umgekehrt ist bei Patienten mit einer fehlenden HCV RNA Negativierung zu Woche 4 (Genotyp 2 oder 3) bzw. 12 (Genotyp 1) eine Verlängerung der Therapie auf 48 bzw. 72 Wochen zu empfehlen, da hierdurch die Rückfallraten vermindert und damit die Heilungsraten letztlich erhöht werden können (vgl. Abbildung). Individualisierte Therapiedauer mit PEG-Interferon alfa und Ribavirin bei Patienten mit einer HCV Genotyp 1 Infektion in Abhängigkeit der Ausgangsviruslast und dem Zeitpunkt der ersten Negativierung der HCV RNA HCV-RNA (log10 IU / ml) 6 Rapid-Responder 5 (nur bei Ausgangsviruslast < 600.000 bis 800.000 IU/ml) Normal-Responder 4 Slow-Responder 3 HCV-RNA negativ (< 50 IU / ml) 2 1 0 Wo. 4 Wo. 8 Wo. 12 Therapiedauer: 24 Wochen Wo. 16 Wo. 20 Therapiedauer: 48 Wochen Wo. 24 Therapiedauer: 72 Wochen Die Therapiemöglichkeiten der HCV-Infektion werden sich in den nächsten Jahren durch die Entwicklung von direkt antiviral wirksamen Substanzen (HCV-Protease- und Polymeraseinhibitoren zur spezifischen Hemmung der HCV-Replikation) ganz erheblich erweitern. Ihr Ansprechpartner: Dr. Aribert Stief 06 21 – 7 59 30 46 aribert.stief @roche.com Produkte und Services Elecsys Anti-HCV: Wenn hohe Anforderungen übertroffen werden Die Infektionsserologie ist ein diagnostischer Stützpfeiler bei der Diagnostik viraler Lebererkrankungen. Insbesondere die Diagnose und Verlaufskontrolle der Hepatitis C erfordert immer den Antikörpernachweis, denn ein HCV-RNA-Nachweis kann in der chronischen Phase der Erkrankung durchaus negativ ausfallen. Die Anforderungen an einen Anti-HCV-Assay sind hoch: Einerseits muss der Test sehr sensitiv sein. Je früher die Serokonversion angezeigt wird, desto kleiner ist das diagnostische Fenster, und akute Infektionen können erfolgreicher therapiert werden. Auch HCV-infizierte Personen werden früher erkannt, um einer weiteren Verbreitung des Virus entgegenzuwirken. Antikörper gegen alle bekannten Genotypen sollten zuverlässig detektiert werden. Andererseits ist eine hohe Spezifität erforderlich: Die Anzahl falschpositiver Ergebnisse sollte so gering wie möglich sein, um unnötige Nachtestungen zu vermeiden. Elecsys Anti-HCV erfüllt die hohen Anforderungen der modernen Infektionsserologie. Der Test wurde in unserem Entwicklungszentrum in Penzberg auf Basis der Elektrochemilumineszenz-Technologie neu entwickelt. Die eingesetzten Antigene stammen aus Regionen, die für die hoch immunogenen Proteine „Core“, „NS3“ und „NS4“ codieren. Die Einbeziehung von Antigenen aus der „NS5“ Region wurde geprüft. Es wurde jedoch durch „NS5“ keine Verbesserung der diagnostischen Eigenschaften festgestellt. 6 Elecsys® Anti-HCV: Klinische und analytische Performance Sensitivität Es gibt verschiedene „Kennzahlen“ einer Assay-Sensitivität. Neben analytischer und diagnostischer Sensitivität ist bei infektionsserologischen Tests die Serokonversions-Sensitivität von großer Bedeutung, da sie ein Maß für die Früherkennung einer Infektion darstellt. Ein Serokonversionspanel umfasst mehrere Proben eines infizierten Probanden, die in definierter zeitlicher Abfolge während der frühen Phase einer Infektion gewonnen wurden. Diese Panels werden vermessen, und es wird bewertet, ab welcher Probenentnahme das Serum des Infizierten als „positiv“ beurteilt wird. Je mehr positive Proben in der Gesamtheit der verschiedenen Panels gefunden werden, desto größer ist die Serokonversions-Sensitivität einzuschätzen. Elecsys Anti-HCV: Überzeugende Serokonversions-Sensitivität 2) Assay Anzahl SerokonversionsPanels Anzahl positiver Proben Quotient aus: Anzahl SerokonversionsPanels / Anzahl positiver Proben Elecsys Anti-HCV 50 174 0,287 Assay O 30 80 0,375 Assay P 34 99 0,343 Assay M 22 64 0,344 Die Daten zu den anderen Immunoassays wurden den Angaben des Herstellers der entsprechenden Serokonversionspanels entnommen. Die Serokonversions-Sensitivität von 15 CE-markierten Anti-HCV-Assays wurde in einer Vergleichsstudie des PaulEhrlich-Institutes (PEI) an 30 Serokonversions-Panels ermittelt. Elecsys Anti HCV rangiert in diesem Ranking in der Spitzengruppe der fünf sensitivsten Assays.1) Auch interne Vergleichsuntersuchungen bestätigen die Ergebnisse des PEI2) – vgl. Abbildung. Nach den derzeit verfügbaren Daten ist Elecsys Anti-HCV einer der sensitivsten HCV-Assays im Diagnostikmarkt. Spezifität Zur Beurteilung der Spezifität eines Assays sind zwei Dinge besonders zu beachten: Die Anzahl der untersuchten Proben sollte auf Grund der niedrigen Prävalenz sehr hoch sein. Außerdem sollten auch potenziell interferierende Proben eingeschlossen werden – wie z. B. Proben von Dialyse-Patienten oder Schwangeren. Die internationale Multicenter-Evaluierung ermittelte an 6.137 Proben eines Blutspender-Kollektivs für Elecsys Anti-HCV eine hohe Spezifität von 99,71 % (RR > 1,0 s/co)2), RR = Repeated Reactive (auch bei Wiederholung „reaktiv“) s/co-ratio = Quotient Signal/Cut-Off. Bei Untersuchung eines PatientenKollektivs aus der klinischen Routine (n = 2.246 hospitalisierte Patienten, Dialyse-Patienten und Schwangere) wurde für Elecsys Anti-HCV eine Spezifität von 99,17 % gefunden.2) Bei Untersuchung sogenannter „Problemproben“ mit potentiell interferierenden oder kreuzreaktiven Substanzen, konnte kein bestimmter Störfaktor ermittelt werden. Die Spezifität bei diesen Proben betrug 99,42 %.2) Die hohe Spezifität von Elecsys Anti-HCV trägt somit dazu bei, die Anzahl von Nachtestungen und Bestätigungs-Tests zu verringern. Erkennung von Antikörpern gegen HCV-Genotypen Die biologische Varianz des HCV stellt besondere Anforderungen an die Diagnostik. Elecsys Anti-HCV wird in allen Erdteilen zum Einsatz kommen und muss daher Antikörper gegen alle wichtigen HCVGenotypen zuverlässig erkennen. Serumproben aus Infektionen mit verschiedenen HCV-Genotypen aus unterschiedlichen Erdteilen wurden daher mit Elecsys Anti-HCV untersucht. Das Ergebnis: Alle untersuchten Proben wurden als Anti-HCV-positiv erkannt. Die Sensitivität zur Erkennung von Antikörpern gegen die wichtigen HCV-Genotypen 1 bis 6 beträgt demnach 100 %. Elecsys Anti-HCV: Antikörper-Nachweis aller wichtigen HCV-Genotypen 2) 1b 1 (1a) (1b) 2 1b 1 (1b), 2, 3 1b 1b, 2 2c 6 4 3, 1c 1a, 1b, 2 5 1a, 1b, 2 HCV-Genotyp Anzahl Proben untersucht / positiv 1 a/b 63 / 63 2 a/b/c 45 / 45 3 a/b 42 / 42 4 a/c/d/f/h 70 / 70 5 13 / 13 6/6 a 11 / 11 Total 244 / 244 7 Analytische Performance Elecsys Anti-HCV vereint hohe klinische Performance mit den Testeigenschaften für eine effiziente Labororganisation und hohe Ergebnisqualität: Schnell: 18 Minuten – derzeit schnellster Anti-HCV-Assay im Markt! Robust: Sehr geringe Interferenz durch Rheumafaktor und Antikörper gegen andere Erreger, wie z. B. HBV, HAV, HEV, EBV, CMV, HSV, HIV Präzise: Schwach positives Serum: VK 3,0 % in der Serie, 3,3 % von Lauf zu Lauf Auf einen Blick: Elecsys Anti-HCV Test für die In-Vitro-Diagnostik • Rekombinante Antigene und synthetische Peptide aus den Regionen „Core“, „NS3“ und „NS4“ • Sehr hohe Serokonversions-Sensitivität • 100 % Sensitivität in bestätigten Anti-HCV-positiven Proben • 99,71 % Spezifität in Blutspender-Kollektiv • Antikörper-Nachweis aller wichtigen HCV-Genotypen (1–6) • Sehr geringe Interferenzen • Kurze Testdauer: 18 Minuten Aus den Daten der Internationalen Multicenter-Evaluierung2) und den Untersuchungen des PEI1) ist klar erkennbar: Die „Testschmiede“ in Penzberg hat einmal mehr gezeigt, wo derzeit der Maßstab für moderne und zuverlässige Labordiagnostik liegt. Quellen: 1) Nick S, Scheiblauer H. Sensitivities of CE-Marked HIV, HCV and HBsAg Assays. J Med Virol 2007, 79: 59–64. 2) Daten in den Akten von Roche Diagnostics. Einzelheiten auf Anfrage. Konsolidierung um jeden Preis? Der Wettbewerb im Privatlabormarkt nimmt kontinuierlich zu. So stellt die Optimierung von Laborprozessen im niedergelassenen Laborbereich eine ständige Herausforderung dar. Die resultierende Effizienzsteigerung erhält die Wettbewerbsfähigkeit und sichert Arbeitsplätze. Vor diesem Hintergrund sprachen wir mit Herrn Dr. med. Josef van Helden (Medizinisches Versorgungszentrum Labor Dr. Stein und Kollegen, Mönchengladbach, vgl. Foto) über die Bedeutung der Konsolidierung serologischer Analysen im niedergelassenen Laborinstitut. DiD: Herr Dr. van Helden, ist die moderne Labordiagnostik schon am Ende aller Prozessoptimierungen angelangt? Dr. J. van Helden: Das haben wir schon oft gedacht. Aber stellt man sich dann die Frage „Geht es nicht noch einfacher oder besser?“, finden sich doch immer wieder neue Ansatzpunkte für eine Verbesserung. Aber auch Sie, die Diagnostika-Industrie, ist aufgefordert, uns mit neuen Produkten und Lösungen neue Möglichkeiten der Prozessoptimierung anzubieten. DiD: Wie haben Sie denn derzeit innerhalb des Laborinstitutes den Arbeitsbereich der immunologischen Labormethoden strukturiert? Dr. J. van Helden: Wir haben hier die Endokrinologie, Allergologie, Tumordiagnostik und die automatisierte Infektionsdiagnostik zusammengefasst. Die Hauptlast des täglichen Probenaufkommens arbeiten meine Mitarbeiter an zwei MODULAR ANALYTICS <EEEE> Systemen ab. Die Systeme sind 8 Ihr Ansprechpartner: Dr. S. Schneider-Hirsch 06 21 – 7 59 63 53 stefan.schneider-hirsch @roche.com Prozess-Management und Qualität immunologischer Laboranalytik spiegelbildlich belegt und verarbeiten 3.000 bis 5.000 Proben am Tag, das entspricht etwa 8.000 bis 12.000 immunologischen Analysen täglich. Neben den MODULAR ANALYTICS Systemen hatten wir zwei Hochdurchsatz-Analyzer für Anti-HCV und TORCH im Einsatz. In der Allergologie arbeiten wir mit drei und im Bereich der weiteren Spezialparameter mit vier kleineren Analysensystemen. Konsolidierter Arbeitsplatz für die immunologische Labordiagnostik: 50 Parameter an zwei MODULAR ANALYTICS <EEEE> DiD: Bei so viel Automation, gibt es da für Ihre Mitarbeiter noch etwas zu pipettieren? Dr. J. van Helden: Ja, natürlich! Das Labor Dr. Stein und Kollegen versteht sich als Gesamtanbieter für Labordiagnostik. Das heißt, wir bieten auch viele Spezialuntersuchungen an – und das bedeutet in vielen Fällen Handarbeit! DiD: Nun zur Infektionsserologie – was war für Sie der wichtigste Grund, auch diese Analytik auf den Systemen MODULAR ANALYTICS <EEEE> zu konsolidieren? Dr. J. van Helden: Allein auf die Routine-Infektionsserologie inklusive Toxo und Rubella entfallen in unserem Labor ca. 2.500 Analysen pro Tag. Das bedeutet, die separate Abarbeitung dieser Analytik nähme ein bis zwei zusätzliche Arbeitsplätze in Anspruch. Das sind Arbeitskräfte, die wir in der Spezialanalytik oder z. B. für unsere Zertifizierungen sehr viel dringender benötigen. Außerdem wird für diese Proben oft nicht nur die Infektionsserologie, sondern auch andere immunologische Laboranalytik angefordert. Durch die Konsolidierung der Infektionsserologie mit der übrigen Routine-Immunologie konnten wir die Abläufe wesentlich vereinfachen und Personal sinnvoller einsetzen. DiD: Das bedeutet Konsolidierung um jeden Preis? Schematische Darstellung des Hepatitis B Virus Dr. J. van Helden: Nein, nicht um jeden Preis. Die Qualität muss natürlich stimmen! DiD: Und wie beurteilen Sie die Qualität der Infektionsserologie von Roche Diagnostics? Dr. J. van Helden: Ich bin in der glücklichen Lage, viele der Elecsys Tests im Vergleich zu anderen Testsystemen aus der klinischen Evaluierung zu kennen, z. B. HBsAgII, Toxo, Rubella oder den jetzt neuen Anti-HCV-Test. Zusammen mit der Erfahrung aus der täglichen Praxis kann ich behaupten, dass im Elecsys Infektionsserologie-Sortiment einige Tests qualitativ besonders herausragen, beispielsweise Anti-HAV, HBsAg, Anti-HBs oder HBeAg. Insbesondere die enorm hohe Sensitivität einiger Assays, wie etwa HBsAg, Toxo IgG oder Anti-HCV, sind beeindruckend. Aber auch die anderen Tests der Infektionsserologie habe ich mir bei der Umstellung natürlich genau angeschaut. Und alle Tests erfüllten die hohen Anforderungen, die ich an diese besonders sensible Analytik stelle. Schematische Darstellung des Hepatitis C Virus 9 DiD: Sie erwähnten die Umstellung infektionsserologischer Tests. Wie beurteilen Sie in diesen Fällen die Vergleichbarkeit der Testsysteme? Dr. J. van Helden: Das ist in der Tat oft ein Problem, insbesondere bei Parametern mit geringem Anteil reaktiver und bestätigt positiver Ergebnisse. Über den üblichen Methodenvergleich mit 20 bis 50 Proben erhält man natürlich keine vernünftigen Aussagen. Die Validation solcher Tests muss an vielen hundert Proben erfolgen. Allerdings ist eine Validation durch Serokonversions-Panels oder AnalytStandards normalerweise nicht zu leisten. Hier sind wir auf wissenschaftliche Publikationen und Kongressbeiträge angewiesen. Aber natürlich auch auf die Zuverlässigkeit und Gründlichkeit des Herstellers bei der Evaluierung der Tests. Und in diesem Punkt kann ich Roche Diagnostics in der Tat ein großes Lob aussprechen! DiD: Herr Dr. van Helden, vielen Dank für das Gespräch! Das Medizinische Versorgungszentrum Labor Dr. Stein und Kollegen in Mönchengladbach Eine einfache (Erfolgs-)Formel: Portfolio = Konsolidierung = Effizienz Das Screening, die Primärdiagnose und die Verlaufskontrolle von Infektionserkrankungen erfordert sowohl serologische Marker als auch Methoden auf Nukleinsäure-Basis (NAT). Dabei ist ein lückenloses Portfolio äußerst wichtig: Reibungslose Laborprozesse ohne Probensplitting werden dadurch erst möglich und alle Testergebnisse stammen „aus einer Hand“. Auf der nächsten Seite finden Sie unser Testmenü in der Serologie und der Molekularen Diagnostik im Überblick. Sie möchten weitere Informationen zur Infektionsdiagnostik von Roche? Dann fordern Sie mit beigefügtem Faxantwortformular kostenlos folgende Informationsmaterialien an: Broschüre „Hepatitis-Diagnostik“ Broschüre „HIV-Diagnostik“ Broschüre „TORCH-Diagnostik“ Portfolio-Übersicht „Diagnostik, Therapie und Monitoring von Infektionserkrankungen“ • • • • Oder nutzen Sie folgende Webseiten mit Informationen zur Infektionsdiagnostik sowie zur Therapie der Hepatitis C: www.roche.de/diagnostics/infektionsdiagnostik www.hepatits-care.de • • 10 Ihr Ansprechpartner: Dr. S. Schneider-Hirsch 06 21 – 7 59 63 53 stefan.schneider-hirsch @roche.com Das umfassende Portfolio in der Infektiologie von Roche Diagnostics Das Testmenü von Roche Diagnostics Serologie Molekulare Diagnostik Elecsys 2010 cobas e 411 MODULAR ANALYTICS cobas e 601 Anti-HAV Anti-HAV IgM HBsAg HBsAg-Bestätigung Anti-HBs Anti-HBc Anti-HBc IgM HBeAg Anti-HBe Erreger/Indikation Parameter Hepatitis A-Virus COBAS AMPLICOR/ AMPLICOR COBAS TaqMan HAV RNA Hepatitis B-Virus RUO HBV DNA quant. Hepatitis C-Virus Anti-HCV CA man. CA man./aut. HCV RNA quant. CA man. HCV-Genotypisierung Rubella Cytomegalie-Virus CTM man./aut. LINEAR ARRAY HIV combi HIV Ag HIV Ag-Bestätigung Toxo IgM Toxo IgG Rubella IgM Rubella IgG CVM IgM Q3 2008 Q3 2008 CVM IgG Q3 2008 Q3 2008 HIV-1 RNA quant. Toxoplasmose CTM man./aut. April 2008 HCV RNA Humanes Immundefizienz-Virus LightCycler 2.0 CA man./aut. CMV DNA Quant. CTM man./aut. CA man. Herpes-Simplex-Virus HSV 1/2 DNA Epstein-Barr-Virus EBV DNA quant. Varizella-Zoster-Virus VZV DNA Humanes Papiloma-Virus HPV DNA Parvovirus B19 Parvo B19 DNA Syphilis TPLA Chlamydia trachomatis C. trachomatis DNA CA man. Neisseria gonorrhoeae N. gonorrhoeae DNA CA man. Mycobacterium tuberculosis M. tuberculosis DNA CA man. Sepsiserreger Panel von 25 Pathogenen (LightCycler SeptiFast Test) Staphylokokken Staph. aureus und Koagulase-negative Staphylokokken RUO Methicilin-resistenter Staph. aureus (MRSA) mecA Resistenzgen RUO Vancomycin-resistente Enterokokken (VRE) vanA, vanB und vanB2/3 Gene RUO MTP HPV-Genotypisierung LINEAR ARRAY RUO MODULAR <P > CA aut. COBAS AMPLICOR mit automatisierter Probenvorbereitung CA man. COBAS AMPLICOR mit manueller Probenvorbereitung CTM man. COBAS TaqMan 48 mit manueller Probenvorbereitung CTM aut. COBAS TaqMan / COBAS TaqMan 48 mit automatisierter Probenvorbereitung MTP AMPLICOR Test auf Mikrotiterplatte RUO For Research Use Only CTM man. CTM man. Ihr Ansprechpartner: Dr. S. Schneider-Hirsch 06 21 – 7 59 63 53 stefan.schneider-hirsch @roche.com 11 Ausgewählte Veranstaltungen und Termine 03.-07.03., Mannheim Ausbildungskurs zum POCT-Koordinator 05.-08.03., Heidelberg Jahrestagung der Gesellschaft für Virologie (GfV): Molekulare Diagnostik: Virologie 27.-29.03., Mannheim 74. Jahrestagung der Dt. Gesellschaft f. Kardiologie, Herz- und Kreislaufforschung (DGK): CoaguCheck XS und cobas h 232 System; Satellitensymposium: „Neue Biomarker zum Management von Patienten mit Verdacht auf ACS“ Ausgewählte Kongresse und Veranstaltungen: März bis Juni 2008 29.03-02.04., Wiesbaden 114. Kongress der Dt. Gesellschaft für Innere Medizin (DGIM): Satellitensymposium „Kardiale Biomarker für das Management von Patienten mit Verdacht auf Herzinsuffizienz oder Myokardinfarkt“ 01.-04.04., München Analytica 2008: Systemlösungen und Reagenzien für die Life Science Forschung 10.04., München Mini-Symposium „Zukunft der Patientennahen Sofortdiagnostik (POCT)“ 13.-14.04., Würzburg 5. Würzburger Infektiologisches Symposium: Infektionsdiagnostik: Serologie und Molekulare Diagnostik 16.04., Berlin Roche Laborforum 2008 26.-29.04, Nürnberg 55. Jahrestagung der Dt. Gesellschaft für Anästhesiologie und Intensivmedizin: Blutgasdiagnostik und LightCycler SeptiFast Test 30.04.-03.05, München 43. Jahrestagung der Dt. Diabetes Gesellschaft: Accu-Check Produkte und Services, CoaguChek XS und cobas h 232 System 15.-16.05., Mannheim MTA-Intensivkurs „Hämostaseologische Labordiagnostik“ 23.-24.05, Berlin 35. Jahrestagung der Dt. Gesellschaft für Prävention und Rehabilitation von Herz- und Kreislauferkrankungen: CoaguChek XS und cobas h 232 System 04.-06.06., Berlin Hauptstadtkongress: Blutgasdiagnostik und LightCycler SeptiFast Test 11.06., Frankfurt Roche Laborforum 2008 18.-19.06., Mannheim „Diagnostik von Heute bis Übermorgen“ im Rahmen der Roche Tage 26.-27.06., Mannheim MTA-Intensivkurs „Hämostaseologische Labordiagnostik Unseren ausführlichen Kongresskalender 2008 finden Sie unter: www.roche.de/diagnostics/labor/kalender-kongresse.htm HERAUSGEBER: Roche Diagnostics GmbH, Dr. Uwe Oberländer, Marketing Labordiagnostik CHEFREDAKTION: Caroline Krumholz, Konzept-Marketing Labordiagnostik „Diagnostik im Dialog“ können Sie jederzeit über eine kurze Mitteilung per E-Mail abbestellen. Es fallen selbstverständlich keine weiteren, als die für Sie üblichen Online- Ihre Ansprechpartnerin: Ute Reimann 06 21 – 7 59 40 78 ute.reimann @roche.com Gebühren an. Nutzen Sie dafür, ebenso wie für mögliche Rückfragen, gerne folgende Newsletter-E-Mail-Adresse: [email protected] Die dargestellten Informationen geben die subjektive Einschätzung der Autoren wieder. Die Roche Diagnostics GmbH übernimmt keine Gewähr für die Richtigkeit der im Newsletter dargestellten Informationen. Die Weitergabe der Daten in jedweder Form bedarf der schriftlichen Zustimmung der Roche Diagnostics GmbH. © 2008 Roche Diagnostics GmbH. Alle Rechte vorbehalten. ACCU-CHEK, AMPLICOR, AMPLIPREP, COAGUCHEK, COBAS, ELECSYS, LIGHTCYCLER, LIFE NEEDS ANSWERS, MODULAR, SEPTIFAST und TAQMAN sind Marken von Roche. Andere Marken sind Marken der jeweiligen Eigentümer. Roche Diagnostics GmbH Sandhofer Straße 116 D-68305 Mannheim www.roche.de