1. Valenzbindungstheorie (VB-Theorie) 2
Werbung

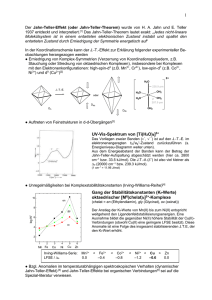
Die Bindung von Komplexen und ihre Effekte Es gibt drei Theorien um die Bindung in den Komplexen zu erklären: 1. Valenzbindungstheorie (VB-Theorie) 2. Kristallfeldtheorie (CF-Theorie) 3. Molekülorbitaltheorie (MO-Theorie) Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Kristallfeldtheorie (CF-Theorie) ☞ Die CF-Theorie wurde von Physikern Hans A. Bethe und John H. van Vleck entwickelt! ☞ Die CF-Theorie geht Wechselwirkung zwischen Zentralatom aus. von einer elektrostatischen den Liganden und dem ☞ Die Liganden werden als negative Punktladungen behandelt und am Metallion werden nur die d-Orbitale betrachtet. ☞ Die CF-Theorie erlaubt ein gutes Verständnis von elektronischen Spektren, Farben, magnetischen Eigenschaften und Strukturen der Übergangsmetallkomplexen. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Kristallfeldtheorie (CF-Theorie) ☞ In einem freien Ion in der Gasphase sind alle fünf dOrbitale energetisch gleichwertig. ☞ Die Elektronen besetzen gemäß der Hundschen Regel die d-Orbitale mit maximaler Spinmultiplizität. ☞ Unter dem Einfluss eines sphärischen Kristallfeldes (d.h. kugelsymmetrischer Ladungsverteilung), werden die entarteten d-Orbitale energetisch angehoben. ☞ Falls die Liganden sich auf spezielle Punkte befinden, z.B. an den Eckpunkten eines Oktaeders um das Metallion, erfolgt eine Aufspaltung der d-Orbitale wegen der repulsiven Wechselwirkungen der d-Elektronen mit den Liganden. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Im freien Metallion sind die d-Orbitale entartet, d.h. sie besitzen die gleiche Energie. ☞ Bringt man das Ion in ein kugelsymmetrisches Ligandenfeld, bleibt die Entartung erhalten, aber dir Energie steigt aufgrund der repulsiven Wechselwirkung zwischen dElektronendichte und Liganden. ☞ In Komplexen ist kein kugelsymmetrisches Ligandenfeld gegeben. Die Liganden destabilisieren einige d-Orbitale stärker als die anderen. So kommt es zu einer Aufspaltung. ☞ Die Größe der Aufspaltung hängt von der Anzahl der beteiligten Liganden, der Stärke des Kations und der Stärke der Liganden ab. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Aufspaltung der d-Orbitalen Anhebung der d-Orbitale freies Ion Ion im sphärischen Kristallfeld Ion im oktaedrischen Kristallfeld ☞ In einem Komplex im oktaedrischen Ligandenfeld sind die d-Orbitale nicht mehr auf dem selben Energieniveau. Die Orbitale werden aufgespaltet: zwei d-Orbitale werden energetisch angehoben und drei d-Orbitale abgesenkt. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Um die CF-Theorie zu verstehen muss man die Gestalt und die Richtung der d-Orbitale betrachten. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Man muss aber auch die Geometrie von einem oktaedrischen Komplex (Komplex mit 6 oktaedrisch angeordneten Liganden) betrachten. X Y Z Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Die d-Orbitale d(x2-y2) und dz2 sind entlang der X-Y-ZAchsen ausgerichtet, d.h. sie sind räumlich auf die Liganden gerichtet, und sie werden energetisch angehoben. dx2-y2 Dr. Tsierkezos dz2 Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Die nicht auf die Liganden gerichtete d-Orbitale (dxy, dxz und dzy) werden energetisch abgesenkt. dzy dxy dxz Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Oktaedrischer Kristallfeld ☞ In einem oktaedrischen Kristallfeld zeigen zwei der fünf dOrbitale des Metallions direkt auf die negativen Punktladungen, nämlich das dz2 und das dx2-y2 Orbital. Deswegen werden Sie bei einer Elektronenbesetzung destabilisiert oder energetisch angehoben (für die Orbitale dz2 und dx2-y2 wird das Symbol eg verwendet). dx2-y2 Dr. Tsierkezos dz2 Spezielle anorganische Chemie (Wintersemester 2015/2016) Oktaedrischer Kristallfeld ☞ Die zwischen den Achsen liegenden Orbitale, dxy, dxz und dzy werden energetisch stabilisiert, weil ihre Wechselwirkung mit den orientierten Punktladungen geringer ist (als bei einer sphärischen Ladungsverteilung) (für die dxy, dxz und dzy Orbitale wird das Symbol t2g verwendet). dzy dxy dxz Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Energiediagramm im oktaedrischen Ligandenfeld Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Aufspaltung Kristallfeld der d-Orbitalen im oktaedrischen ☞ Die Größe der Aufspaltung ∆o zwischen den t2g- und egOrbitalen in einem oktaedrischen Kristallfeld liegt zwischen den Wellenzahlen 7000 und 40000 cm-1. ☞ Der Energiebereich erstreckt sich vom nahen Infrarot (IR) (1400 nm) über das sichtbare Spektrum (VIS) bis in das nahe Ultraviolett (UV) (200 nm). ☞ Die Aufspaltungsenergie kann experimentell aus den UV/VIS (d→d) Spektren von Übergangsmetallkomplexen entnommen werden (Elektronen-übergängen zwischen verschiedenen Zuständen zur dn-Konfiguration im Ligandenfeld). Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Tetraedrischer Kristallfeld ☞ Im tetraedrischen Kristallfeld liegen die dxy-, dxz- und dzyOrbitale näher an den vier Punktladungen der Liganden als die dx2-y2- und dz2-Orbitale. ☞ Deswegen werden die dxy-, dxz- und dzy-Orbitale energetisch angehoben und die dx2-y2- und dz2-Orbitale energetisch abgesenkt. ☞ Im Vergleich zum Oktaeder ergibt sich eine umgekehrte Reihenfolge der Aufspaltung. Die Aufspaltung der d-Orbitale beim tetraedrischen Kristallfeld ist aber kleiner als beim oktaedrischen Kristallfeld (∆Τ= 4/9 ∆ο). ☞ Auf Symmetriegründen heißen die Orbitalgruppen beim Tetraeder t2 und e. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Energiediagramm im tetraedrischen Ligandenfeld Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) tetraedrischer Kristallfeld freies Ion oktaedrischer Kristallfeld ☞ Die Aufspaltung ∆Τ= 4/9 ∆ο bedingt, dass beim Tetraeder nur high-spin-Zustände für d3- bis d6-Konfigurationen von Bedeutung sind. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Vergleich zwischen Oktaeder und Tetraeder ☞ Vergleicht man die Orientierung der Orbitale relativ zu den Punktladungen zwischen Oktaeder und Tetraeder, so erkennt man, dass beim Tetraeder die destabilisierten Orbitale (dxy, dxz, dzy) nicht direkt auf die Liganden zeigen im Unterschied zu denen im Oktaeder (dx2-y2 und dz2). ☞ Die Wechselwirkung zwischen den Punktladungen und den Orbitalen und damit die d-Orbitalaufspaltung im Kristallfeld ist beim Tetraeder geringer als beim Oktaeder. ☞ Bei gleicher Ladung des Metallions und gleichen MetallLigand-Abständen ist die Aufspaltungsenergie 10DqT kleiner als 10Dqo (∆T = 4/9 ∆o). Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Elektronenbesetzung der Orbitale beim Oktaeder Komplexe mit 1 bis 3 d-Elektronen ☞ Das erste bis dritte Elektronen besetzen nach der Hundschen Regel (maximale Spinmultiplizität) die t2gZustände, dass jedes Orbital im Grundzustand einzeln besetzt ist. ☞ Die Energie des Ions im Ligandfeld ist kleiner als im freien Ion mit sphärischem Kristallfeld. Dieser Energiegewinn wird als Kristallfeldstabilisierungsenergie bezeichnet. Für die Konfiguration t2g1 die Kristallfeldstabilisierungsenergie beträgt -4Dqo, für t2g2 beträgt -8Dqo und für t2g3 beträgt -12Dqo. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Kristallfeldstabilisierungsenergie - CFSE Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Besetzung der d-Orbitale im d3 Komplexion ☞ Im oktaedrischen Ligandenfeld werden immer zuerst die dxy, dxz und dyz-Orbitale nacheinander mit 1 Elektron besetzt, weil sie energetisch günstiger (energetisch niederer) sind. Dies erfolgt nach der Hundschen Regel: Man besetzt die Orbitale einer Unterschale immer mit maximaler Anzahl ungepaarter Elektronen. Cr3+ besitzt die Konfiguration 3d3 t2g3 Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Elektronenbesetzung der Orbitale beim Oktaeder Komplexe mit 4 bis 7 d-Elektronen ☞ Für die Komplexe mit vier bis sieben Elektronen am Metallatom gibt es zwei Möglichkeiten der Orbitalbesetzungen. ☞ In der d4-Konfiguration kann das vierte Elektron entweder ein Orbital von den leeren eg-Orbitale (Konfiguration t2g3 eg1) oder ein Orbital von den t2g-Orbitale (Konfiguration t2g4) besetzen. ☞ Die Spinpaarungsenergie P spielt eine wichtige Rolle. Nämlich, wenn sie größer als die Aufspaltungsenergie ist, so werden zuerst die eg-Orbitale besetzt. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Elektronenbesetzung der Orbitale beim Oktaeder Komplexe mit 4 d-Elektronen ☞ Im ersten Fall (t2g3 eg1) liegen vier ungepaarte Elektronen mit gleichem Spin im Grundzustand vor. Man spricht von einer High-Spin-Konfiguration. ☞ Bei der t2g4-Konfiguration sind die Spins der zwei Elektronen im doppelt besetzten Orbital gepaart (PauliPrinzip) und sind nur zwei ungepaarte Elektronen vorhanden. Man spricht von einer Low-Spin-Anordnung. ☞ Entsprechend wird der Komplex als High-Spin- oder als Low-Spin-Komplex bezeichnet. Die Kristallfeldstabilisierungsenergie beträgt für d4-High-Spin-Komplex (t2g3eg1) -6Dqo und für Low-Spin-Komplex (t2g4) -16Dqo. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Komplexe mit 5 bis 7 d-Elektronen ☞ Die beiden unterschiedlichen Möglichkeiten der Orbitalbesetzungen finden sich in analoger Weise auch bei den d5-, d6- und d7-Metallionen. ☞ Die Konfiguration mit der maximalen Zahl an ungepaarten Elektronen wird jeweils High-Spin-Form genannt, die mit der minimalen Zahl an ungepaarten Elektronen Low-Spin-Form. ☞ Die verschiedene Zahl von ungepaarten Elektronen in der High-Spinund Low-Spin-Form führt zu unterschiedlichen magnetischen Momenten, die über entsprechende Messungen ermittelt werden können. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Bei Übergangsmetallionen mit 4 bis 7 d-Elektronen gibt es im oktaedrischen Ligandenfeld zwei verschiedene Anordnungen. Fe2+ besitzt die Konfiguration 3d6 t2g4 eg2 t2g6 Es liegt ein High-Spin-Komplex vor. Die Elektronen sind hauptsächlich nicht gepaart. Dr. Tsierkezos Es liegt ein Low-Spin-Komplex vor. Die Elektronen sind hauptsächlich gepaart. Spezielle anorganische Chemie (Wintersemester 2015/2016) Komplexe mit 8 bis 10 d-Elektronen ☞ Für die Elektronenkonfigurationen d8, d9 und d10 im Oktaeder kann keine Unterscheidung zwischen Low-Spinund High-Spin-Anordnung mehr getroffen werden. Zum Beispiel: Ni2+ besitzt die Konfiguration: t2g6 eg2 Cu2+ hat die Konfiguration t2g6 eg3 Zn2+ hat die Konfiguration t2g6 eg4 Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) High-Spin und Low-Spin 3d-Komplexe ☞ Die High-Spin- oder Low-Spin-Konfiguration in einem Komplex hängt von der Größe der Aufspaltungsenergie ∆o=10Dqo (aufgewendete Energie für die Besetzung der energetisch höher liegenden Orbitale) und von der Spinpaarungsenergie P (benötigte Energie für die doppelte Besetzung eines Orbitals) ab: High-Spin Komplex → ∆o klein (P > ∆o) Low-Spin Komplex → ∆o groß (P < ∆o) ☞ Ist die Aufspaltung der Energieniveaus sehr groß, so bildet sich ein Low-Spin Komplex, umgekehrt bildet sich ein High-Spin Komplex wenn die Aufspaltung klein ist. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Aufspaltung der d-Orbitale ☞ Die Aufspaltung ist abhängig vom jeweiligen Liganden. Liganden, die eine kleine Aufspaltung bewirken, also ein schwaches Kristallfeld ausbilden und damit zu einem HighSpin-Komplex führen, werden als schwache Liganden bezeichnet. ☞ Umgekehrt nennt man starke Liganden die Liganden, die über ein starkes Kristallfeld zu einer großen Aufspaltung und damit zu einem Low-Spin Komplex führen. ☞ In Bezug auf das Donoratom des Ligandes gibt es die folgende Abhängigkeit: ∆ zunehmend → I < Br < S < Cl < F < O < N < P < C Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Spektrochemische Reihe ☞ Die Liganden lassen sich unabhängig vom Metallion nach steigender Aufspaltung in der so genannten spektrochemischen Reihe anordnen: ☞ Die spektrochemische Reihe lässt sich mit dem elektrostatischen CF-Modell nicht erklären. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Aufspaltung der d-Orbitale ☞ Die Aufspaltung ist abhängig von der Ladung des Zentralatoms. Die Aufspaltung nimmt mit der Oxidationsstufe des Metalls zu, weil der Ionenradius abnimmt. ∆ zunehmend → M2+ < M3+ < M4+ ☞ Die Aufspaltung ist bei 4d- und 5d-Metallen viel größer als bei 3d-Metallen. Die Ausbildung von oktaedrischen HighSpin-Komplexen ist nur bei den 3d-Übergangsmetalle von Bedeutung. Für die oktaedrischen 4d- und 5d-Metallionen findet man nur Low-Spin-Komplexe. ∆ zunehmend → M(3d) < M(4d) < M(5d) Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Aufspaltung der d-Orbitale ☞ Bei gegebenem Ligand findet man für die Änderung der Aufspaltung mit dem Metallion die folgende Reihung (für diese Reihung gibt es keine einfache Erklärung): ∆ zunehmend → Mn2+ < Ni2+ < Co2+ < Fe2+ < V2+ < Cr2+ ∆ zunehmend → Fe3+ < Cr3+ < Co3+ < Mn3+ Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) Magnetismus ☞ Je mehr ungepaarte Elektronen am Kation vorliegen, umso paramagnetischer ist es. ☞ Anhand der Besetzung der d-Orbitale können die magnetischen Eigenschaften vieler Komplexen geklärt werden. ☞ Die Formulierung von High Spin- und Low SpinKomplexe erklärt z.B. den hohen Paramagnetismus von Eisen- und Kobalt-Komplexe mit schwachen Liganden und den niedrigen Paramagnetismus bei starken Liganden. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016) ☞ Das magnetische Moment eines Elektrons hängt direkt von dessen Spin und damit von der Spinquantenzahl ab. Die magnetischen Momente μ lassen sich nach der spinonly-Formel berechnen: μ = g √S (S+1) μB mit g ≈ 2.002 S = Gesamtspin S = ½ n (n = Zahl der ungepaarten Elektronen) μB = Bohrsches Megneton 1 μB = 9.274015(3) 10-24 J/T Bei den Ionen der ersten Hälfte der 3d-Elemente (bis d5) stimmen die experimentell gefundenen magnetischen Momente gut mit den spinonly-Werten überein. Dr. Tsierkezos Spezielle anorganische Chemie (Wintersemester 2015/2016)