Alkanone und Alkanale - Unterrichtsmaterialien Chemie
Werbung

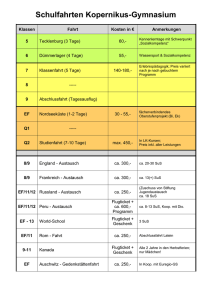
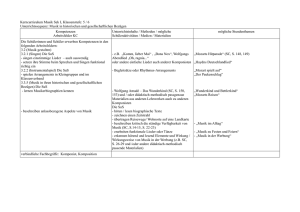
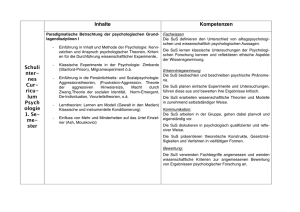
Schulversuchspraktikum AnsgarMisch Sommersemester2016 Klassenstufen11&12 Alkanone und Alkanale AufeinenBlick: Dieses Protokoll zum Thema „Alkanone und Alkanale“ enthält zwei Lehrer- und zwei Schülerversuche,diedieMöglichkeitenzurDarstellungvonAldehydenausAlkoholenbzw.dieNachwei sevonAldehydendarstellen.AlsLehrerversuchewerdeneinerseitsdieDarstellungvonEthanal aus Ethanol sowie der Nachweis von Aldehyden mit der Schiffschen Probe präsentiert. In den SchülerversuchenwerdenweitereNachweise(Fehling-undTollens-Probe)fürAldehydevorge stellt. Inhalt 1 BeschreibungdesThemasundzugehörigeLernziele...............................................................................1 2 RelevanzdesThemasfürSuSderJahrgangsstufen11und12unddidaktischeReduktion....2 3 Lehrerversuche..........................................................................................................................................................3 4 5 3.1 V1–DarstellungvonAcetaldehydausEthanol.................................................................................3 3.2 V2–SchiffscheProbe....................................................................................................................................5 Schülerversuche........................................................................................................................................................8 4.1 V3–Fehling-Probe........................................................................................................................................8 4.2 V4–Tollens-Probe......................................................................................................................................11 DidaktischerKommentarzumSchülerarbeitsblatt................................................................................15 5.1 Erwartungshorizont(Kerncurriculum).............................................................................................15 5.2 Erwartungshorizont(Inhaltlich)..........................................................................................................16 1BeschreibungdesThemasundzugehörigeLernziele 1 BeschreibungdesThemasundzugehörigeLernziele Alkanone und Alkanale spielen in unserer heutigen Lebenswelt nur noch eine untergeordnete Rolle. Diese Klassen von Verbindungen, die noch vor einigen Jahren beispielsweise in Lacken und Klebstoffen enthalten waren, wurden von Seiten der chemischen Industrie inzwischen durchandere,wenigerschädlicheKomponentenersetzt. Im Rahmen der schulischen Ausbildung im Fach Chemie erscheint es dennoch sinnvoll, den Themenbereich„AlkanoneundAlkanole“imUnterrichtzuthematisieren.ImTeilgebiet„Organische Chemie“ ist es unbedingt erforderlich, dass SuS ein umfassender Überblick über die verschiedenen Stoffgruppen und ihre funktionellen Gruppen vermittelt wird. Dazu gehören auch die Aldehyde und Ketone, wie diese beiden Stoffklassen ebenfalls genannt werden. Dies wird auch im Kerncurriculum für die Jahrgangsstufen 11 und 12 im Rahmen des Basiskonzeptes „Stoff-Teilchen“ gefordert. Demnach sollen die SuS vor allem in der Qualifikationsphase diese Stoffklassen kennen und ihnen ihre funktionelle Gruppe (Carbonylgruppe) zuordnen können. DesWeiterensollenanhandderMolekülstrukturenauchdieexplizitgenanntenStoffklassender Alkanale und Alkanone in Form von homologen Reihen angeordnet und nach der IUPACNomenklaturbenanntwerden. Neben der Kenntnis der Molekülstruktur und der Anwendung der Nomenklatur für diese VerbindungensollendieSuSaberauchdieeinzelnenStoffklassenzueinanderinBeziehungbringen könnenundihreDarstellbarkeitausihnenbereitsbekanntenStoffklassenkennenlernen.DieSuS sollen demzufolge im Verlauf einer Unterrichtseinheit zum Thema „Aldehyde und Ketone“ lernen,dassAldehyde(Alkanale)durchdieOxidationvonprimärenAlkoholengebildetwerdenund Ketone (Alkanone) durch die Oxidation von sekundären Alkoholen entstehen. Um dem Entstehen von Fehlvorstellungen entgegenzuwirken, sollte an dieser Stelle hervorgehoben werden, dasstertiäreAlkoholenichtinentsprechenderWeiseoxidiertwerdenkönnen. FüreineumfassendeBetrachtungderAldehydeundKetonesindauchMethodenzurIdentifikationdieserVerbindungenvonessentiellerBedeutung.DieSuSsollenfolglichauchexperimentelleNachweisefürdieseStoffklassenkennenlernenunddieseanwenden.Dabeiistvorallemdie Fehling-Probehervorzuheben,diealsNachweisfürverschiedenereduzierendwirkendeorganische Verbindungen dienen kann (beispielsweise auch für Zucker). Als Alternativen bieten sich danebenauchdieTollens-Probebzw.dieSchiffscheProbean.Hierbeisollteaberbesondersauf Sicherheitsaspekte und die Durchführbarkeit von Experimenten für SuS geachtet werden, da beispielsweisebeiderSchiffschenProbeimSchiff-ReagenzFuchsinenthaltenist,fürdaseinerseitseinTätigkeitsverbotfürSuSbesteht,dasaberauchandererseitsvongebärfähigenFrauen nichtverwendetwerdendarf. 1 2RelevanzdesThemasfürSuSderJahrgangsstufen11und12unddidaktischeReduktion 2 Relevanz des Themas für SuS der Jahrgangsstufen 11 und 12 und didaktischeReduktion AldehydeundKetonespielenfürSuSinihremalltäglichenLeben,wennüberhaupt,nureineuntergeordneteRolle,dadieseStoffklassenindenheuteverwendetenHaushaltschemikalienmeist durch andere weniger gefährliche Stoffe ersetzt wurden. So werden beispielsweise Nagellackentferner oder Klebstoffe heutzutage kaum noch auf Acetonbasis hergestellt, da Aceton beispielsweisekünstlichaufgeklebteAcrylnägelangreifenkann.EinigeSuSkönntenjedochbereits nachdurchzechtenNächtenunangenehmeErfahrungenmitdembeiderOxidationvonEthanol gebildetenEthanalgesammelthaben.Ethanal,einerfürdenmenschlichenKörpergiftigenVerbindung, werden nach exzessivem Alkoholgenuss viele unangenehme Nachwirkungen zugeschrieben. FüreineDurchführungderUnterrichtseinheit„AlkanaleundAlkanone“kanndirektandasVorwissenderSuSausdemThemenbereichAlkaneundAlkoholeangeknüpftwerden.Dabeiwerden vorallemdieKenntnissevonderMolekülstrukturderStammalkaneunddieNomenklaturregeln zurBenennungdieserStammalkanevorausgesetzt.DieMolekülstrukturderStammalkanekann auchdazugenutztwerden,einigephysikalischeEigenschaften(Schmelz-undSiedepunkte)dieser Verbindungen im Vergleich zueinander zu erklären. So gilt beispielsweise für die Schmelz- und Siedepunkte, dass diese mit der Kettenlänge des Stammalkans steigen (Butan-2-on < Pentan-2-on<Hexan-2-on). BeiderErarbeitungderOxidationvonAlkoholenzudenentsprechendenCarbonylverbindungen wirdandasVorwissenderSuSausdemBereichRedoxreaktionenangeknüpft.Diesgiltauchfür vieleNachweisreaktionen(beispielsweisedieFehling-Probe),dadieseebenfallsalsRedoxreaktion ablaufen. Die Betrachtung der Darstellung von Aldehyden und Ketonen aus den entsprechenden Alkoholen und deren Nachweisreaktionen eignet sich daher auch zur Wiederholung undFestigungdesWissensvondiesemReaktionstyp. 2 3Lehrerversuche 3 Lehrerversuche 3.1 V1–DarstellungvonAcetaldehydausEthanol IndiesemVersuchwirdmithilfeeinesKupferblechs,dasdurchErhitzenübereinerBrennerflamme mit einer Schicht Kupferoxid überzogen wird, aus Ethanol Ethanal gebildet. Dabei wirddasKupferoxidzuelementaremKupferreduziert.DieserVersuchkannalsEinstiegsversuchindasThemengebietAldehydeundKetoneverwendetwerdenundknüpftdirektandas VorwissenderSuSüberAlkoholesowieüberRedoxreaktionenan. Gefahrenstoffe Ethanol H:225 P:210 Ethanal H:224-351-319-335 P:210-233-280-305+351+338 Materialien: Gasbrenner, Tiegelzange, dünnes Kupferblech oder Kupferdraht, BecherglasoderPetrischale Chemikalien: Ethanol Durchführung: DasKupferblechwirdinderrauschendenBrennerflammesolangeerhitzt, bis sich eine schwarze Schicht auf dem Blech gebildet hat. Anschließend wirddasnochheißeBlechineinmitEthanolgefülltesReagenzglasgehalten. Beobachtung: Die Oberfläche des Kupferblechs verfärbt sich schwarz. Wird das heiße Blech anschließend in Ethanol getaucht, verschwindet diese Verfärbung wiederunddasBlecherscheintwiedermattglänzend.KurznachdemEintauchendesKupferblechsinEthanolkanneinstechenderGeruchwahrgenommenwerden. 3 3Lehrerversuche Abbildung1:EinKupferblechwirdinEthanolgehalten. Deutung: WirddasKupferblechinderBrennerflammezurRotgluterhitzt,bildetsich schwarzesKupfer(II)-oxid. 2 Cu(s) + O2 (g) ⌦ 2 CuO(s) Beim Eintauchen des verfärbten Kupferblechs in Ethanol findet eine Redoxreaktionstatt.DabeiwirdEthanolzuEthanaloxidiert,wobeizweiProtonenabgespaltenwerden. Oxidation: CH3 I C H2 OH (l) ! CH3 +I C HO (g) + 2H +(sol) + 2e KupferoxidwirddabeiwiederzumetallischmattglänzendemKupferreduziert. Reduktion: +II 0 CuO (s) + 2e + 2H +(sol) ! Cu (s) + H2 O (l) Gesamt: CH3 Entsorgung: CH2 OH (l) + CuO (s) ! CH3 CHO (g) + Cu (s) + H2 O (l) DieEntsorgungderLösungerfolgtüberdieorganischenLösungsmittelabfälle. Literatur: [1]Asselborn,W.,Jäckel,M.undRisch,K.T.;ChemieheuteSIIGesamtband, AuflageA5,SchroedelVerlag,2011,S.316 4 3Lehrerversuche DieserVersuchkannzuBeginneinerUnterrichtseinheitmitdemSchwerpunkt„Aldehydeund Ketone“ durchgeführt werden. Er thematisiert die Darstellung von Ethanal aus Ethanol und kann dabei vor allem als Problemexperiment eingesetzt werden, bei dem die SuS ermitteln sollen,welcheStoffgruppebeiderOxidationvonAlkoholenentsteht.Alternativließensichhier auchandereAlkoholeeinsetzen,wiebeispielsweisePropanol. 3.2 V2–SchiffscheProbe In diesem Versuch wird mithilfe von Schiffs Reagenz ein Aldehyd nachgewiesen. Der Nachweisberuhtdarauf,dassderinSchiffsReagenzenthaltenenFuchsinschwefligenSäure,dasdie Lösung farblos erscheinen lässt, durch das Aldehyd Hydrogensulfit entzogen wird, wodurch dieLösungeinefuchsinroteFärbungannimmt. Gefahrenstoffe P:201-202-280-308+313-405- H:351 Fuchsin 501.1 P:234-260-305+351+338- H:314-335-290 Konz.Salzsäure 303+361+353-304+340308+311-501.1 Butan-2-on H:225-319-336 P:210-305+351+338-403+233 Acetaldehyd H:332-312-302-412 P:273-302+352 Materialien: Wasserbad oder Gasbrenner mit Dreifuß, Becherglas, Rührstab, Reagenzgläser,Pasteurpipette Chemikalien: Fuchsin, Natriumsulfit, konzentrierte Salzsäure, Acetaldehyd, Butan-2-on, destilliertesWasser Durchführung: HerstellendesSchiffsReagenz: In100mLWasserwerdenunterErwärmen0,1gFuchsingelöst.Nachdem LösevorganglässtmandieLösungerkalten.Anschließendwirdein1gNatriumsulfithinzugegebenundmit1mLkonz.Salzsäureangesäuert. 5 3Lehrerversuche NachweisdesAldehyds: Man nehme drei Reagenzgläser und befülle diese wie folgt: Reagenzglas I mit 2 mL destilliertem Wasser, Reagenzglas II mit 2 mL Butan-2-on und Reagenzglas III mit 2 mL Acetaldehyd. Nun wird zu den Lösungen in den Reagenzgläsern I-III jeweils 1 mL des hergestellten Schiffs Reagenz gegeben. Beobachtung: HerstellendesSchiffsReagenz: Beim Lösen des Fuchsins in Wasser tritt zunächst eine fuchsrote Lösung auf. Diese wird aber nach Zugabe von Natriumsulfit und konz. Salzsäure entfärbt. NachweisdesAldehyds: Bei den Lösungen in Reagenzglas I und II ist keine Änderung zu beobachten.DieLösungensindfarblosundklar. Die Lösung in Reagenzglas III zeigt kurz nach Zugabe von Schiffs Reagenz einefuchsroteFarbe. Abbildung2:EinefuchsinroteFärbungdesSchiffsReagenzdientalsNachweisfürAldehyde. Deutung: BeimAnsetzendesSchiffsReagenzwirdausFuchsineinsogenannterLeukofarbstoff gebildet. Ein Hydrogensulfition greift das zentrale C-Atom des Fuchsinsnucleophilan.DasentstehendeAddukt(FuchsinschwefligeSäure) weist dann ein sp3-hybridisiertes C-Atom auf, ist damit tetraedrisch koordiniertunddieLösungentfärbtsich. 6 3Lehrerversuche Wird ein Aldehyd zu der Lösung gegeben, so bindet das HydrogensulfitAnionandasAldehyd.DieAdditiondesHydrogensulfitsistdemnachreversibel,wasanhandderRotfärbungderLösungerkanntwerdenkann. NH2 Cl NH2 CH3 + HSO3- HO3S C NH2 - ClC CH3 H 2N NH2 NH2 fuchsinrot farblos Abbildung3:GleichgewichtdesFuchsins(linkeSeite)mitderFuchsinschwefligenSäure(rechteSeite). Die Reaktion des Fuchsins (Fu) mit einem Aldehyd kann folgendermaßen dargestelltwerden: Fu SO32 (aq) + Aldehyd(sol) ⌦ F u(aq) + Aldehyd SO32 (aq) Entsorgung: DieEntsorgungderLösungenerfolgtüberdieorganischenLösungsmittelabfälle. Literatur: [1]Robins,J.H.,Abrams,G.D.andPincock,J.A.;ThestructureofSchiffreagentaldehydeadductsandthemechanismoftheSchiffreactionasdeterminedbynuclearmagneticresonancespectroscopy;CanadianJournalof Chemistry,Vol.58,Seiten339-347;1980 [2]BlumeR.,Prof.BlumesBildungsserverfürChemie; http://www.chemieunterricht.de/dc2/r-cho/c-schiff.htm;zuletztgeöffnet am06.08.2016um15:22 DieSchiffscheProbekannimVerlaufeinerUnterrichtsreihe alsLehrerdemonstrationsexperimenteingesetzt werden,umden SuS einerseitsdieVielfalt derMethoden zumNachweisvon Aldehydenvorzustellen. Andererseitskann sienacheiner Vorstellung desMechanismusauch alsBestätigungsexperimentfürdasAuftretenvon Aldehydenverwendetwerden. Wobeiaber stets geprüft werden sollte, ob nicht anstelle dieses Versuchs alternativ andere Nachweise durchgeführt werden können, beispielsweise die Fehling- oder Tollens-Probe oder ein Nach- weismitIod-Kaliumiodid. Die Schiffsche Probe darf höchstens als Lehrerdemonstrationsexperiment eingesetzt werden, daSchiffsReagenzFuchsinenthält,dasvonSuSimUnterrichtnichtverwendetwerdendarf. 7 4Schülerversuche 4 Schülerversuche 4.1 V3–Fehling-Probe EinweitererNachweisfür Aldehyde,deraufderoxidierenden Wirkungvon KupferimbasischenMilieubasiert,istdiesogenannteFehling-Probe.DabeiwerdenzunächstzweiLösungen miteinander vermischt, eine Kupfersulfatlösung (Fehling I) und eine KaliumNatriumtartratlösung mit verdünnter Natronlauge (Fehling II). Ein roter Niederschlag von Kupfer(I)-oxiddientalsNachweisfürAldehyde. Gefahrenstoffe Kupfer(II)-sulfat H:302-315-319-410 Natriumhydroxid H:314-290 Butan-2-on H:225-319-336 P:210-305+351+338-403+233 Acetaldehyd H:332-312-302-412 P:273-302+352 P:273-305+351+338-302+352 P:280-301+330+331305+351+338-308+210 Materialien: Wasserbad, 100mL-Becherglas, 250 mL-Becherglas, Spatel, Glasstab, Reagenzgläser,Messzylinder Chemikalien: Kupfersulfatlösung, Natriumhydroxid, Kaliumnatriumtartrat, Acetaldehyd, Butan-2-on,destilliertesWasser Durchführung: HerstellendesFehling-Reagenz Zur Herstellung des Fehling-Reagenz werden zunächst zwei Lösungen angesetzt(FehlingIundFehlingII),diespätervereinigtwerden. DieLösung„FehlingI“wirdhergestellt,indem0,7gblauesKupfersulfatin 10mLdestilliertemWassergelöstwerden. Die Herstellung der Lösung „Fehling II“ erfolgt, indem in 10 mL destilliertem Wasser 3,5 g Kaliumnatriumtartrat und 1 g Natriumhydroxid gelöst werden. 8 4Schülerversuche Die Lösungen „Fehling I“ und „Fehling II“ werden zum Fehling-Reagenz vereinigt. NachweisdesAldehyds Drei Reagenzgläser werden mit den folgenden Lösungen befüllt: ReagenzglasIwirdmit2mLdestilliertemWassergefüllt,ReagenzglasIImit2mL Butan-2-onundReagenzglasIIImit2mLAcetaldehyd.NunwirdzudenLösungen in den Reagenzgläsern I-III jeweils das gleiche Volumen (2 mL) Fehling-Reagenz gegeben. Nach Zugabe von Fehling-Reagenz werden die ReagenzgläserunterdemAbzugimWasserbadfüreinigeMinutenerhitzt. DieTemperaturdesWasserbadessolltebeimindestens70°Cliegen. Beobachtung: DieLösungenindenReagenzgläsernIundIIfärbensichnachZugabe des Fehling-Reagenzblau.NachdemErhitzenimWasserbadistallerdingskeineweitereVeränderungzubeobachten. DieLösunginReagenzglasIIIfärbtsichnachZugabevonFehling-Reagenz ebenfalls zunächst blau. Wenn die Probe etwa fünf Minuten lang im Wasserbaderhitztwird,färbtsichdieLösunggrün-gelblichundbildetrascheinenrötlichspiegelndenNiederschlagaus. Abbildung3:DiepositiveFehling-ProbezeigtdieAnwesenheitvonAldehydenan. 9 4Schülerversuche Deutung: Beim Erhitzen wird der Aldehyd mit Fehling-Reagenz zur Carbonsäure oxidiert, wobei gleichzeitig zweiwertiges Kupfer zu rotem Kupfer(I)-oxid reduziertwird.DieswirddurchdenrötlichenNiederschlagangezeigt. DieReaktionläuftnachfolgenderGleichungab: Oxidation: Reduktion: 2𝐶𝑢 %& (()) + 2𝑒 - → 2𝐶𝑢 & (()) Gesamt: Unter Berücksichtigung der Bildung von rotem Kupfer(I)-oxid lässt sich auchfolgendeReaktionsgleichungformulieren. Entsorgung: DieEntsorgungderLösungerfolgtüberdieorganischenLösungsmittel. Literatur: [1]Wollrab,A.,OrganischeChemie–EineEinführungfürLehramts-undNebenfachstudenten,4.Aufl.,Springer-Verlag,Berlin,Heidelberg,2014,Seiten 546-547 [2]BlumeR.,Prof.BlumesBildungsserverfürChemie; http://www.chemieunterricht.de/dc2/r-cho/c-nw-cho.htm;zuletztgeöffnetam06.08.2016um16:37 10 4Schülerversuche DieFehling-ProbeisteinNachweisfürAldehyde,derinnerhalbderUnterrichtsreihe„Aldehy- deundKetone“alsSchülerexperimenteingesetztwerdenkann,umdasAuftretenvonAldehyden zu bestätigen. Wenn den SuS der Mechanismus dieser Reaktion bekannt ist, hat dieses ExperimentdenCharaktereinesBestätigungsexperiments.BeimAufstellenderReaktionsgleichungkannauchderUmgangmitRedoxreaktionenwiederholtundgefestigtwerden. Esbietetsichteilweisean,dennachzuweisendenAldehydzuersetzen.Diesbedarfallerdings einer vorherigen Gefahrstoffprüfung. Die Verwendung von Formaldehyd ist beispielsweise striktuntersagt. Die Fehling-Probe kann auch zu anderen Unterrichtsthemen in Bezug gebracht werden. Sie kannbeispielsweiseals Nachweisfür Zuckerangewendetwerdenundkönntedaher auchim RahmeneinesZuckernachweisesdurchgeführtwerden. 4.2 V4–Tollens-Probe DieTollens-ProbeisteinNachweisfürAldehyde,deraufderreduzierendenWirkungdesAldehydsbasiert.DabeiwerdenSilberionenzuelementaremSilberreduziert,welchessichdann anderInnenwanddesReaktionsgefäßesabscheidet.EsentstehteinSilberspiegel,weshalbdie ProbeauchalsSilberspiegel-Probebezeichnetwird. Gefahrenstoffe Silbernitratlösung(w=5%) H:315-319-410 Ammoniaklösung(w=10%) H:314-335-400 Natronlauge H:314-290 Butan-2-on H:225-319-336 P:210-305+351+338-403+233 Acetaldehyd H:332-312-302-412 P:273-302+352 P:273-302+352-305+351+338 P:273-280-301+330+331305+351+338-309+310 P:280-301+330+331305+351+338-308+310 Materialien: 100mL-Becherglas,Tropfpipetten,Reagenzgläser,Wasserbad 11 4Schülerversuche Chemikalien: Silbernitratlösung, Ammoniaklösung, Acetaldehyd, Butan-2-on, Natronlauge,destilliertesWasser Durchführung: HerstellendesTollens-Reagenz Zu 20 mL einer Silbernitratlösung (w = 5 %) wird so lange tropfenweise Ammoniaklösunghinzugegeben,bissichderentstandeneNiederschlaggeradewiederlöst.DannwerdeneinigeTropfenNatronlaugehinzugegeben. NachweisdesAldehyds IndreiReagenzgläserwerdendiefolgendenLösungeneingefüllt:ReagenzglasIwirdmit3mLdestilliertemWassergefüllt,ReagenzglasIImit3mL Butan-2-onundReagenzglasIIImit3mLAcetaldehyd.NunwirdzudenLösungenindenReagenzgläsernI-IIIjeweils5mLTollens-Reagenzgegeben. NachZugabedesTollens-ReagenzwerdendieReagenzgläserkurzgeschüttelt und unter dem Abzug im Wasserbad für etwa 10 Minuten erhitzt. Die TemperaturdesWasserbadessolltebeimindestens70°Cliegen. Beobachtung: BeidenLösungenindenReagenzgläsernIundIIistnachZugabedesTollens-Reagenz keine Veränderung festzustellen. Auch beim Erhitzen im WasserbadistkeineweitereVeränderungzubeobachten. WirdTollens-ReagenzzuderLösunginReagenzglasIIIgegeben,istebenfallszunächstkeineVeränderungzubeobachten.BeimErhitzenderProbe im Wasserbad entsteht allerdings schnell ein dukelbrauner bis schwarzer Niederschlag. Nach etwa 10 - 15 Minuten im Wasserbad kann beobachtet werden, dass sich ein Silberspiegel an der Innenwand des Reagenzglases gebildethat. Abbildung4:DerdurchelementaresSilberentstandeneSilberspiegelistderpositiveNachweisfürAldehyde. 12 4Schülerversuche Deutung: Beim Herstellen des Tollens-Reagenz löst sich der Niederschlag durch Komplexierung der Silberionen auf. Es bildet sich ein SilberdiamminKomplex,derinWasserleichtlöslichist. 𝐴𝑔&() + 2𝑁𝐻3(()) → 𝐴𝑔 𝑁𝐻3 & % (()) DieserKomplexverhindertauch,dassimbasischenMilieuschwerlösliches Ag2Ogebildetwird. Die Entstehung eines schwarzen Niederschlags, der später einen SilberspiegelanderGefäßwandbildet,lässtdaraufschließen,dassbeiderReaktion des Tollens-Reagenz mit dem Aldehyd elementares Silber entstanden ist,Silberalsoreduziertwurde.DemnachwirdderAldehydzurCarbonsäure oxidiert. Die Oxidation läuft analog zur Fehling-Probe nach folgender Gleichungab. Oxidation: BeiderReduktionwirdelementaresSilbergebildet. Reduktion: 2𝐴𝑔& (()) + 2𝑒 - → 2𝐴𝑔 InsgesamtkanndamitdiefolgendeReaktionsgleichungaufgestelltwerden. Gesamt: 4 ↓ Entsorgung: DieEntsorgungderLösungerfolgtüberdieorganischenLösungsmittel. RestedesTollens-ReagenzkönnenüberdieanorganischenLösungenentsorgtwerden. Literatur: [1]Wollrab,A.,OrganischeChemie–EineEinführungfürLehramts-undNebenfachstudenten,4.Aufl.,Springer-Verlag,Berlin,Heidelberg,2014,Seiten 544-545 13 4Schülerversuche [2]BlumeR.,Prof.BlumesBildungsserverfürChemie; http://www.chemieunterricht.de/dc2/haus/v021.htm;zuletztgeöffnetam 06.08.2016um17:18 DiereduzierendeWirkungderAldehydewirdbeivielenNachweisenausgenutzt.DieTollens Probe ist ein Nachweis für Aldehyde, der neben der Fehling- oder Benedict-Probe innerhalb der Unterrichtsreihe „Aldehyde und Ketone“ als Schülerexperiment eingesetzt werden kann, umeinerseitsdasAuftretenvonAldehydenzubestätigen,andererseitsaberauchdiereduzie- rende WirkungderAldehydedarzustellen.Analog zurFehling-ProbehatdieserNachweisfür dieSuSderdenCharaktereinesBestätigungsexperiments.BeimAufstellenderReaktionsgleichungkannauchderUmgangmitRedoxreaktionenwiederholtundgefestigtwerden. WiedieFehling-ProbekannauchdieTollens-ProbealsNachweisfürZuckerangewendetund daherebenfallsimRahmeneinesZuckernachweisesdurchgeführtwerden. 14 AldehydeundKetone 1. 2. 3. Nomenklatur BenennenSiediefolgendenAldehydeundKetone. OxidationvonAlkoholen ErläuternSie,welchederfolgendenAlkoholeoxidiertwerdenkönnen.BestimmenSieauch fürjedenAusgangsstoff,welcheArtvonCarbonylverbindungentstehtundzeichnenSiedie entsprechendeStrukturformel. ReduktionvonCarbonylverbindungen Begründen Sie, welche der folgenden Carbonylverbindungen zu primären und welche zu sekundärenAlkoholenreduziertwerdenkönnenundzeichnenSiejeweilsdieStrukturdes entstehendenAlkoholmoleküls. 5DidaktischerKommentarzumSchülerarbeitsblatt 5 DidaktischerKommentarzumSchülerarbeitsblatt MithilfedesArbeitsblattessollendieSuSihrinderUnterrichtsreihe„AldehydeundKetone“erworbenes Wissen zu Nomenklatur und Reaktionen von Aldehyden und Ketonen wiederholen undfestigen.DieSuSwiederholenbeiderBearbeitungderAufgabendasPrinzip,dasssichprimäreAlkoholezuAldehydenundsekundäreAlkoholezuKetonenoxidierenlassenundtrainierendabeiauchdasLesenundZeichnenvonLewis-Strukturformeln. Zur Bearbeitung der Aufgaben auf dem gegebenen Arbeitsblatt sollten die SuS bereits über KenntnissederNomenklaturvonAlkanenverfügen,umdasStammalkanderjeweiligenzugrundeliegendenVerbindungbenennenzukönnen.AußerdemsolltensiedieanzuhängendenEndungen für Alkanale (-al) und Alkanone (-on) kennen. Des Weiteren sollten die SuS bereits Erfahrungen im Zeichnen von Lewis-Strukturformeln gesammelt haben und wissen, dass aus CarbonylverbindungendurchReduktionAlkoholedargestelltwerdenkönnen.Umgekehrtsolltedie SuSebenfallswissen,dassdieOxidationvonprimärenundsekundärenAlkoholenzuAldehyden bzw.KetonenführtundeineZuordnungvonEduktenundProduktenvornehmenkönnen. Aufgrund der erwarteten Voraussetzungen kann das Arbeitsblatt direkt nach der Bearbeitung derThemenbereiche„OxidationvonAlkoholenzuCarbonylverbindungen“und„Reduktionvon Carbonylverbindungen zu Alkoholen“ eingesetzt werden. Es bietet sich allerdings auch als ArbeitsblattzurWiederholungundFestigungamEndeeinerUnterrichtsreihean. 5.1 Erwartungshorizont(Kerncurriculum) Aufgabe1:DieersteAufgabekanninnerhalbdesBasiskonzepts„Stoff-Teilchen“alsÜbungsaufgabe zur Unterscheidung der Strukturen von Alkanalen und Alkanonen angesehen werden. Es werdenallerdingsauchdiegrundlegendenKenntnissederNomenklaturvonAlkanen(Stammalkane) wiederholt und gefestigt. Dabei wenden die SuS die IUPAC-Nomenklatur zur Benennung organischerVerbindungenanundunterscheidenbeimVergleichderErgebnissezwischenFachspracheundAlltagssprache(evtl.Trivialnamen)beiderBenennungchemischerVerbindungen. Aufgabe1istdemAnforderungsbereichIzuzuordnen,dadenSuSdieRegelnderNomenklatur beimBenennenbekanntsindunddiesesWissenhierlediglichangewendetwird. Aufgabe 2: Die zweite Aufgabe dient innerhalb des Basiskonzepts „Struktur-Eigenschaft“ dazu, die Kenntnisse von Reaktionsmöglichkeiten organischer Moleküle anhand ihrer funktionellen Gruppenzufestigen.AnhandderOxidationvonAlkoholenlernendieSuSmöglicheSynthesewegekennen,umeinegegebeneStoffklasse(Alkohole)ineineandereStoffklasse(Carbonylverbindungen)zuüberführen.Aufgabe2kanndemAnforderungsbereichIIzugeordnetwerden,dadie 15 5DidaktischerKommentarzumSchülerarbeitsblatt SuShieranhandvongegebenenAlkoholendasReaktionsprinzipzudenCarbonylverbindungen erläuternundVorhersagenzumöglichenProduktentreffensollen. Aufgabe 3: Die dritte Aufgabe dient genau wie Aufgabe 2 dem Training der im Basiskonzept „Struktur-Eigenschaft“gefordertenKompetenzdieReaktionsmöglichkeitenorganischerMoleküle anhand ihrer funktionellen Gruppen abzuschätzen. Das Augenmerk der SuS wird hierbei allerdings vorrangig auf die Molekülstruktur und die Anordnung der funktionellen Gruppe gelenkt,anhanddererbegründetwerdensoll,welcheProduktebeiderReduktionentstehen.Aufgabe3kannAnforderungsbereichIIIzugeordnetwerden,dahierbeivondenSuSdieAbläufeder Reaktionen auf die Molekülstruktur der Edukte zurückgeführt werden sollen, wobei kausale Zusammenhänge hinsichtlich der Anordnung der funktionellen Gruppe als Begründung dargelegt werden sollen. Zusätzlich wird in allen Aufgaben das Erstellen und Lesen von LewisStrukturformelnwiederholtundgefestigt. 5.2 1. Erwartungshorizont(Inhaltlich) Nomenklatur AMethanal(Formaldehyd) BButan-2-on(Ethylmethylketon) D2-Methylhexan-4-on E4-Methylhexanal Cn-Pentanal 2. OxidationvonAlkoholen AlleabgebildetenAlkoholekönnenzuCarbonylverbindungenoxidiertwerden.AundCergeben nachOxidationAldehyde,BeinKeton. 3. ReduktionvonCarbonylverbindungen DieVerbindungenA,DundEwerdenzuprimärenAlkoholenreduziert,daessichbeidenAusgangsverbindungenumAldehydemiteinerendständigenCarbonylgruppehandelt.BundCwerdenzusekundärenAlkoholenreduziert. 16 5DidaktischerKommentarzumSchülerarbeitsblatt 17