Lösung zur Übung Nr.11 , verteilt am Dienstag, 13. Mai 2008 Teil A
Werbung

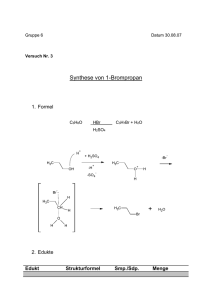
Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Sommersemester 2006 Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Sommersemester 2006 Lösung zur Übung Nr.11 , verteilt am Dienstag, 13. Mai 2008 stabilisieren über die elektronenziehende Ketogruppe, aber 2-Oxo-pentylchlorid kann die Ladung viel besser stabilisieren, da eine Grenzstruktur mit der Ladung auf O möglich ist. b) Hier geht es alleine um die Qualität der Abgangsgruppen. Fluorid ist weder für SN1 noch SN2-Reaktionen eine Abgangsgruppe (zur Erinnerung: Die Magnetrührfische sind mit Teflon, (CF2)n, beschichtet. Wäre Fluorid eine Abgangsgruppe, wären die Rührfische nach kurzer Zeit blank). Grund ist die sehr stabile C-F-Bindung und die vergleichsweise geringe Stabilität von F-. (Vergleichen Sie die Bindungsenergien C-X im Skript S. 184: C-F: 117 kcal/mol, C-I: 52 kcal/mol). c) Auch hier geht es hauptsächlich um die Qualität der Abgangsgruppe. CF3SO2OH ist eine stärkere Säure als CH3SO2OH, damit ist TfO- die bessere Abgangsgruppe. Teil A: 1. Reaktionsgeschwindigkeiten a) Die folgenden substituierten Benzylbromide reagieren mit KOEt in Ethanol zu den entsprechenden Ethern. Nehmen Sie an, daß sie alle nach einem reinen SN1Mechanismus reagieren. Ordnen Sie sie nach ihrer Hydrolysegeschwindigkeit, beginnend mit der langsamsten Verbindung! Begründen Sie kurz! Br KOEt Ethanol X OEt 2. SN1 oder SN2? + KBr Finden die folgenden Umsetzungen eher nach einem SN1 oder einem SN2Mechanismus statt? X X Br NO2 O2N O2N Br Br Br A Br C D E Im Intermediat liegt eine positive Ladung vor (Carbokation, SN1-Mechanismus). Die Hammet-Reaktionskonstante ρ ist daher negativ, und Donorsubstituenten beschleunigen die Reaktion durch Stabilisierung des Kations, während Akzeptoren sie verlangsamen. A: zwei Nitrogruppen als starke Akzeptoren destabilisieren positive Ladung im Intermediat. B: eine Nitrogruppe in para-Position zieht Elektronen. C: eine Nitrogruppe in meta-Position kann nicht als π-Akzeptor, sondern nur als σAkzeptor wirken. D: eine Methylgruppe ist ein schwacher Donor und stabilisiert positive Ladung. E: eine Methoxygruppe ist ein sehr starker π-Donor. b) Ordnen Sie die Verbindungen jeder Gruppe nach ihrer Reaktionsgeschwindigkeit in der Umsetzung mit Natriumcyanid in DMF, beginnend jeweils mit der langsamsten! O a) Cl O Cl Cl c) OMs O NaI ii) N3 iii) 2 I O OTs Aceton I DMF NaI, H2SO4 aq. iv) OH i) Eindeutig SN2: Es findet eine Inversion des Stereozentrums, aber keine Racemisierung statt. Außerdem: Azid ist ein gutes (weich, polarisierbar) Nucleophil (-> SN2 bevorzugt), und DMF ein dipolar-aprotisches Lösungsmittel. ii) Stereochemie: keine Aussage möglich, da kein Chiralitätszentrum. Lösungsmittel: Polar-aprotisch. Nucleophil: weich. Ausserdem kann eine negative Partialladung in einer SN2-Reaktion gut stabilisiert werden. Damit kann man annehmen, daß eine SN2-Reaktion vorwiegt. iii) Recht eindeutig SN2: Ein primäres Carbokation einer SN1-Reaktion wäre sehr instabil. Das Lösungsmittel ist polar-aprotisch und das Nucleophil S2- weich. iv) Das Nucleophil I- ist weich (gut für SN2). Das Lösungsmittel ist aber extrem polar und protisch. Das Carbokation wäre gut stabilisiert (tertiär) -> recht eindeutig SN1. Teil B: Br I OTf Betrachten Sie die im Folgenden aufgeführten Reaktionen. Finden sie statt wie angegeben? Wenn nein, geben Sie das zu erwartende Produkt an! Begründen Sie jeweils kurz. a) Es ist ein SN2-Mechanismus zu erwarten. n-Pentylchlorid kann die negative Partialladung im Übergangszustand nicht stabilisieren. Die Reaktion ist daher langsam. 3-Oxohexylchlorid kann die negative Ladung zwar schon etwas besser Übung 11 Seite 1 von 4 Na2S NaN3, DMF 3. Finden diese Reaktionen so statt? b) F Cl Ms: Methansulfonyl Tf: Trifluormethylsulfonyl i) H3CO NO2 B Br Übung 11 Seite 2 von 4 S I Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Sommersemester 2006 O Dimethylamin OTf Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Sommersemester 2006 Komplex aus Metallion und Ligand nicht zerfällt, muss die Bindung aber stark genug sein, sonst verdrängt u. U. schon das Lösungsmittel den Liganden. O Hexan NMe2 Br KOH, t-BuOH O-t-Bu (R)-1-Phenylethylamin MeCN OMs AgNO3, H2O Br NH OH + HO i) o.k. Inversion am Stereozentrum; Lösungsmittel aprotisch. ii) Dieses Produkt ist nicht zu erwarten. 1. Wenn schon Substitution, dann wird das kleine Nucleophil OH- und nicht das sterisch anspruchsvolle t-BuO- angreifen, auch, weil t-Butanol soviel weniger sauer als H2O ist, daß praktisch kein t-BuO- vorhanden ist. 2. Eine Substitution dieses Brom-Atoms ist sehr langsam oder findet sogar gar nicht statt, weil der obligate Rückseitenangriff stark gehindert ist (Neopentylstellung). iii) Die Reaktion findet so statt: es ist eine SN2-Reaktion am Cyclohexanring zu erwarten. Die gezeigte Konformation (Substituent axial) ist zwar nicht die stabilste, steht aber im Gleichgewicht mit der Konformation mit äquatorialem Substituenten (in der Reaktion selber entsteht die äquatoriale Konformation). iv) Ja, die Reaktion ist korrekt. Die Substitution in der Neopentylstellung ist zwar sehr langsam oder gar nicht möglich, doch mit Silbernitrat läuft sie trotzdem ab, da AgBr ausfällt und so ein Carbokation zurückläßt, das entweder direkt mit Wasser als Nucleophil reagiert oder zuerst umlagert. NO3- ist ein sehr schlechtes Nucleophil und wird darum nicht angreifen. 4. HSAB-Prinzip Pd0 ist sehr weich und wird daher das ebenfalls weiche Triphenylphosphin bevorzugen. Der Komplex Pd(PPh3)4 ist eine häufig genutzte Form von gelöstem Pd0. Gold(I) ist ebenfalls sehr weich und wird daher an Triphenylphosphin viel besser binden als an ein Alkoholat. Titan(IV) ist sehr hart und koordiniert daher besonders gut an harte Liganden wie Alkoholat. Palladium(II) ist ebenfalls weich. Scandium(III) ist ähnlich hart wie Titan(IV). Weshalb interessiert es überhaupt, welcher Ligand an welches Metall gut bindet? Übergangsmetallionen spielen eine wichtige Rolle in der organischen Synthese als Katalysatoren für vielfältige Umsetzungen. Oft ist aber das Metallion nur mit einem geeigneten Liganden fähig, die gewünschte Umsetzung durchzuführen. Damit der Übung 11 Seite 3 von 4 Übung 11 Seite 4 von 4