GRUNDLAGEN ORGANISCHEM CHEMIE
Werbung

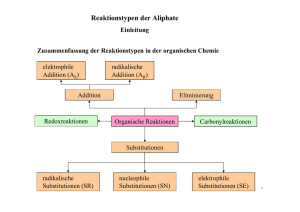
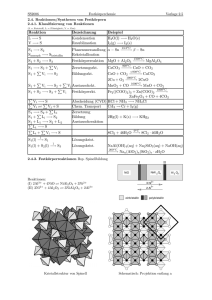
Dr. sc. nat. Hans Rudolf Christen GRUNDLAGEN ORGANISCHEM CHEMIE Otto Salle Verlag Frankfurt am Main - Berlin - München Verlag Sauerländer Aarau • Frankfurt am Main • Salzburg IX Inhaltsverzeichnis Vorwort VII 1 Einleitung 1.1 Die wellenmechanische Beschreibung des Atoms 1.2 1.3 1.4 1.5 1.6 1.7 Die Kovalenzbindung Die «Sonderstellung» der organischen Chemie; funktionelle Gruppen Reindarstellung organischer Verbindungen Physikalische Eigenschaften organischer Verbindungen Quantitative Elementaranalyse und Molekularformel Strukturermittlung 2 11 29 34 40 55 59 I.Teil: Überblick über die wichtigsten organischen Stoffgruppen 2 Kohlenwasserstoffe 2.1 2.1.1 2.1.2 2.1.3 2.1.4 2.1.5 2.1.6 2.1.7 Gesättigte offenkettige Kohlenwasserstoffe Die homologe Reihe der Alkane Molekülbau Physikalische Eigenschaften Reaktionen Gewinnung Beispiele Halogenalkane («Alkylhalogenide») 65 65 68 71 73 80 82 85 2.2 2.2.1 2.2.2 2.2.3 2.2.4 2.2.5 Cycloalkane (Cycloparaffine) Physikalische Eigenschaften, Molekülbau Stereoisomerie bei substituierten Cycloparaffinen Ringstabilität und Baeyersche Spannungstheorie Polyzyklische Ringsysteme Herstellung und Reaktionen 89 89 94 95 96 97 2.3 2.3.1 2.3.2 2.3.3 2.3.4 2.3.5 Alkene (Olefine) Molekülbau Physikalische Eigenschaften Chemische Reaktionen und Gewinnung Polyene Ungesättigte Halogenkohlenwasserstoffe 100 100 104 106 115 120 2.4 2.4.1 2.4.2 Alkine Molekülbau, Eigenschaften Reaktionen und Herstellung 123 123 124 ' X Inhaltsverzeichnis 2.5 2.5.1 2.5.2 2.5.3 2.5.4 2.5.5 2.5.6 2.5.7 2.5.8 Aromatische Kohlenwasserstoffe Das Benzen (Benzol) ; Kriterien des aromatischen Zustandes Mehrkernige aromatische Kohlenwasserstoffe Spektroskopische Eigenschaften aromatischer Kohlenwasserstoffe Reaktionen aromatischer Verbindungen Aliphatisch-aromatische Kohlenwasserstoffe Halogenierte Aromaten und Umwelt Technische Gewinnung aromatischer Kohlenwasserstoffe 128 129 136 152 155 159 160 162 164 2.6 2.6.1 2.6.2 2.6.3 Nomenklatur organischer Verbindungen Trivialnamen Systematische Nomenklatur: Substitutionsnamen Systematische Nomenklatur: Genfer oder lUPAC-Nomenklatur 168 168 168 169 3 Verbindungen mit einfachen funktionellen Gruppen 3.1 3.1.1 3.1.2 3.1.3 Alkohole, Phenole, Ether Alkohole Phenole Ether 178 178 192 196 3.2 3.2.1 3.2.2 3.2.3 Schwefelverbindungen Thiole und Thioether Sulfoxide und Sulfone Sulfen-, Sulfin- und Sulfonsäuren 203 203 205 206 3.3 3.3.1 3.3.2 Stickstoffhaltige Verbindungen Amine Weitere Stickstoffverbindungen 208 208 216 3.4 3.4.1 3.4.2 3.4.3 3.4.4 3.4.5 Spiegelbildisomerie Einige Begriffe Molekülchiralität und optische Aktivität Racemate Reaktionen chiraler Moleküle Historisches 221 221 222 237 245 251 4 Verbindungen mit ungesättigten funktionellen Gruppen 4.1 4.1.1 4.1.2 4.1.3 Carbonylverbindungen: Aldehyde und Ketone Nomenklatur und physikalische Eigenschaften Reaktionen Herstellung und wichtige Beispiele 253 254 259 264 4.2 4.2.1 4.2.2 4.2.3 4.2.4 Carbonsäuren und ihre wichtigsten Derivate Nomenklatur und physikalische Eigenschaften Reaktionen Herstellung und wichtige Beispiele Salze der Carbonsäuren 269 269 273 274 277 Inhaltsverzeichnis XI 4.2.5 4.2.6 4.2.7 4.2.8 Derivate der Carbonsäuren Dicarbonsäuren Hydroxy- und Ketosäuren Aminocarbonsäuren 4.3 Derivate der Kohlensäure 293 4.4 Nitrile 296 4.5 4.5.1 4.5.2 4.5.3 4.5.4 4.5.5 Spektroskopie und Struktur Ultraviolettspektroskopie Infrarotspektroskopie Kernresonanzspektroskopie Massenspektroskopie Kombinierter Einsatz spektroskopischer Methoden zur Strukturaufklärung . . 298 298 301 308 328 335 . 277 281 283 288 2. Teil: Organische Reaktionen 5 Allgemeines 5.1 5.2 5.3 5.4 5.5 Die Triebkraft chemischer Reaktionen Die Geschwindigkeit chemischer Reaktionen Zum Ablauf organischer Reaktionen Der Übergangszustand Methoden zur Untersuchung von Reaktionsabläufen 6 Struktur und Reaktivität 6.1 6.2 6.3 6.4 6.5 Bindungsenthalpien Induktive und mesomere Effekte (a- bzw. jr-Akzeptoren und -Donatoren) . . Die Stärke von Säuren und Basen Quantitative Beziehungen zwischen Struktur und Reaktivität Tautomerie 7 Nucleophile Substitutionen an gesättigten C-Atomen 7.1 7.2 7.3 7.4 7.5 7.6 7.7 Allgemeines Zum Ablauf der nucleophilen Substitutionen Reaktivität bei nucleophilen Substitutionen Nebenreaktionen Reaktionen von Alkylhalogeniden und -Sulfaten bzw. -sulfonaten Nucleophile Substitutionen an Alkoholen und Ethern Weitere nucleophile Substitutionen 355 359 362 370 381 389 390 395 407 416 423 424 440 450 453 462 466 XII Inhaltsverzeichnis 8 Eliminationsreaktionen 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Allgemeines Mechanismen bei ß-Eliminationen Die Richtung der Elimination (Saytzew- und Hofmann-Elimination) Sterischer Verlauf der Elimination Präparative Anwendungen Pyrolytische (zyklische) Eliminationen et- Eliminationen 9 Additionen an C—C-Mehrfachbindungen 9.1 9.2 9.3 9.4 9.5 9.6 Allgemeines . Addition von Halogenen Addition unsymmetrisch gebauter Addenden (Halogenwasserstoff, Säuren, Wasser) Weitere wichtige Additionsreaktionen Weitere syn-Additionen Nucleophile Additionen an C—C-Mehrfachbindungen 10 Perizyklische Reaktionen 10.1 10.2 10.3 10.4 Allgemeines über den Verlauf perizyklischer Reaktionen Elektrozyklische Reaktionen Cycloadditionen Sigmatrope Verschiebungen 11 Nucleophile Substitutionen an ungesättigten C-Atomen 11.1 11.2 11.3 Verlauf der SN-Reaktionen an Carbonyl-C-Atomen Substitutionen an Carbonsäuren und ihren Derivaten Substitutionen an Vinyl-C-Atomen 12 Nucleophile Additionen an Kohlenstoff-Hetero-Mehrfachbindungen 12.1 12.2 12.3 12.4 12.5 12.6 12.7 12.8 12.9 Allgemeines über Additionen an C=O-Gruppen Addition von Wasser und Alkoholen Addition von Anionen Addition von N-haltigen Nucleophilen Addition metallorganischer Verbindungen Addition von Yliden Reaktionen von Carbonylverbindungen mit C—H-aciden Verbindungen . . . 1,2- und 1,4-Additionen Additionen an C—N-Mehrfachbindungen 470 471 476 481 489 493 497 505 506 517 525 536 539 546 548 554 570 584 588 608 612 617 624 627 634 637 640 655 656 Inhaltsverzeichnis 13 Elektrophile Substitutionen an aliphatischen C-Atomen 13.1 13.2 13.3 13.4 Zum Ablauf elektrophiler Substitutionen Beispiele elektrophiler Substitutionen Reaktionen metallorganischer Verbindungen Elektrophile Substitutionen an Alkanen 14 Aromatische Substitution I: Elektrophile Substitution 14.1 14.2 14.3 14.4 14.5 14.6 14.7 Mechanismus der elektrophilen Substitution an aromatischen Ringen Orientierung und Reaktivität Bildung von C—C-Bindungen durch elektrophile Substitution Bildung von C—N-Bindungen durch elektrophile Substitution Halogenierung Sulfonierung Über die Synthese von Benzenderivaten mit bestimmter Orientierung der Substituenten 15 Aromatische Substitution I I : Nucleophile Substitution 15.1 15.2 15.3 15.4 15.5 Allgemeines Hydrid-Ionen als Abgangsgruppe Andere Anionen als Abgangsgruppen Substitutionen an Diazoniumionen Nucleophile aromatische Substitutionen waArine 16 Radikalreaktionen 16.1 16.2 16.3 16.4 16.5 16.6 Bildung und Stabilität von Radikalen Allgemeines über Radikalreaktionen Radikalsubstitutionen Radikaladditionen Autoxidation und Verbrennung Kombinationen und Umlagerungen von Radikalen 17 Oxidationen und Reduktionen 17.1 17.2 17.3 17.4 17.5 17.6 17.7 17.8 17.9 17.10 17.11 17.12 Allgemeines Oxidation von Kohlenwasserstoffen (C—H-Bindungen) Oxidation von Halogeniden und Aminen Oxidationen sauerstoffhaltiger Verbindungen Oxidative Kupplungen Oxythallierung Oxidation aromatischer lodide Hydrierung von Alkenen, Alkinen und Aromaten Hydrogenolyse Reduktion von Aldehyden und Ketonen Reduktion von Carbonsäuren und ihren Derivaten Reduktion stickstoffhaltiger funktioneller Gruppen XIII 662 667 672 675 ' 678 682 694 705 710 711 713 719 723 724 726 727 733 741 746 753 757 759 762 766 776 779 787 789 790 790 794 795 802 806 XIV Inhaltsverzeichnis 18 Umlagerungen 18.1 18.2 18.3 18.4 18.5 Allgemeines Wanderungen zu C-Atomen Wanderungen zu N- oder O-Atomen Kationotrope Umlagerungen Umlagerungen an aromatischen Ringen 814 818 831 833 836 19 Zur Planung organischer Synthesen 842 3. Teil: Einige spezielle Kapitel der organischen Chemie 20 Heterozyklische Verbindungen 20.1 20.2 20.3 20.4 20.5 20.6 Allgemeines, Nomenklatur Fünfgliedrige Heterozyklen mit einem Heteroatom Fünfgliedrige Heterozyklen mit mehreren Heteroatomen Pyridin und Pyran Sechsgliedrige Heterozyklen mit mehreren Heteroatomen Alkaloide 21 Lipoide, Terpene, Steroide 21.1 21.2 21.3 21.4 Lipoide Terpene Steroide Biosynthese von Terpenen und Steroiden 22 Kohlenhydrate 22.1 22.2 22.3 Monosaccharide Disaccharide Polysaccharide 23 Proteine und Proteide 23.1 23.2 23.3 23.4 Allgemeines Peptide Proteine Proteide 855 857 873 877 886 890 899 907 914 929 934 953 957 965 967 979 983 Inhaltsverzeichnis 24 XV Synthetische hochmolekulare Stoffe 24.1 Allgemeines 24.2 24.3 24.4 24.5 24.6 Allgemeine Eigenschaften Polymerisate Polykondensate Polyaddukte Ausblicke auf neuere Entwicklungen 25 Farbstoffe 25.1 25.2 25.3 25.4 25.5 Historisches Begriff und Einteilung Unterscheidung von Farbstoffen nach Art des Färbeprozesses Chemische Einteilung der Farbstoffe Indikatoren 26 Photochemie 26.1 26.2 26.3 26.4 26.5 26.6 Lichtabsorption und Anregung von Molekülen Allgemeines über organische photochemische Reaktionen C/s/frans-lsomerisierung von Alkenen Photodissoziationsreaktionen Photoreduktion von Ketonen Photochemische Zyklisierungen 27 Metallorganische Verbindungen 27.1 27.2 27.3 Allgemeines Beispiele einfacher metallorganischer Verbindungen Organische Verbindungen der Übergangsmetalle 998 1001 1006 1017 1022 1024 1028 1029 1032 1037 1046 1051 1055 1055 1057 1059 1060 1064 1065 1067 Anhang A: Zusammenstellungen einiger für die präparative Arbeit wichtiger Reaktionen Anhang B: Elektrozyklische Reaktionen und Cycloadditionen (Konzept des HOMO und der Erhaltung der Orbitalsymmetrie) Anhang C: Die organisch-chemische Literatur Anhang D: Literaturangaben zu einzelnen Kapiteln des Buches Anhang E: Lösungen ausgewählter Übungsaufgaben 1080 1087 1097 1114 Sachregister 1121 Syntheseregister 1155 1077