Enzyme Referat von Rolf H. Viehmann
Werbung

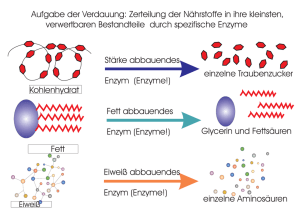
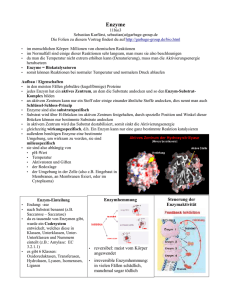
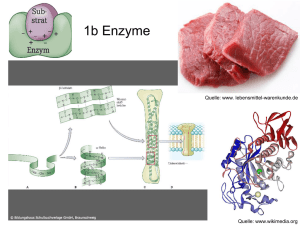
[email protected] Enzyme Referat von Rolf H. Viehmann Enzyme (Fermente) sind Biokatalysatoren, die in jedem lebenden Organismus vorkommen, und dort die Aktivierungsenergie für chem. Reaktionen herabsetzten, was viele Reaktionen erst ermöglicht, da in den Zellen des Organismus niedrigere Temperaturen herrschen, als die Reaktion (ohne Kat.) benötigen würde. Die Substanz, die vom Enzym umgesetzt wird, heißt Substrat, wobei viele Enzyme auf ein bestimmtes Substrat spezialisiert sind (Schlüssel-Schloß-Prinzip). Dieses Prinzip ist dadurch verwirklicht, dass nur bestimmte Moleküle in das Aktive Zentrum des Enzyms passen, wobei ein Enzym jeweils in der Lage ist, genau eine mögliche Reaktion des Substrates zu katalysieren. Durch Regulation der Enzymaktivitäten kann fast der ganze Stoffwechsel reguliert werden, da, wie gesagt, Enzyme für viele biochemische Reaktionen notwendig sind. Die Enzymologie, ein Hauptgebiet der Biochemie, befasst sich mit der Entwicklung und Anwendung von Methoden, mit denen Enzyme isoliert werden können, und mit der Untersuchung ihrer strukturellen und funktionellen Eigenschaften. Das Molekulargewicht eines Enzyms liegt bei ca. 104 bis 106 U. Mit bestimmten Stoffen kann die Neusynthese von Enzymen stimuliert werden (u.a. Steroidhormone), oder auch gehemmt werden. (s.u.) Ca. 3000 Enzyme, die allesamt genauso wie andere Proteine auch aufgebaut sind, nämlich aus Aminosäuren, sind heute beschrieben. Die meisten Enzyme bestehen aus zwei Teilen: • dem Apo-Enzym, dem eigentlichen Eiweißanteil • und dem Co-Enzym, (im einfachsten Falle nur ein Ion) das an das Apo-E. entweder fest oder leicht dissoziabel gebunden ist. Beide Teile zusammen werden als Holo-Enzym bezeichnet und können nur zusammen wirksam sein, wenn bei der Reaktion Elektronen oder Ionen vom Substrat abgespalten oder daran angelagert werden sollen. Manchmal wird auch noch ein Cofaktor benötigt, der z.B. ein Metallion sein kann. Alle Enzyme, die für eine Reaktions-folge (od. -kette)(z.B. Zitronensäurezyklus, Glycolyse) notwendig sind, werden als Enzymsystem bezeichnet, in dem das Substrat der Reihe nach alle Enzyme durchläuft. Enzyme liegen häufig als (inaktive) Vorstufen vor, die durch Spaltung (mittels anderer Enzyme) zu aktiven Enzymen gemacht werden. E + S -> ES -> EP -> E + P Das Enzym bindet das Substrat an sich (im aktiven Zentrum), wodurch ein Enzym-Substrat-Komplex entsteht, wandelt es um und gibt es wieder frei. Die Reaktionsgeschwindigkeit ist abhängig vom pH-Wert und nimmt außerdem mit der Konzentration des Enzyms zu, allerdings nur bis zu einem bestimmten Maximalwert (Schwellenwert). Der Grund für die pH-Abhängigkeit des Enzyms besteht darin, dass durch eine Veränderung des pH-Wertes auch die Ladungsmuster, die zusammen mit der Primär-, Sekundär-, Tertiär-, Quartärstruktur die Eigenschaften des Enzyms bestimmen, verändert werden, was zu einer Reaktionsfähigkeitsänderung führt. Proteinmoleküle (also auch Enzyme) haben eine bestimmte räumliche Gestalt, die Kette ist in bestimmter Weise "gefaltet". Diese Art der Faltung ist durch die Aminosäuresequenz festgelegt. Sie ist eine Folge bindender Kräfte zwischen verschiedenen Abschnitten der Peptidkette. [email protected] Die Reihenfolge der Aminosäuren in einer Polypeptidkette heißt Primärstruktur oder Aminosäurensequenz. Die Aminosäure besitzt ein Ende mit freier Aminogruppe und ein Ende mit freier Carboxylgruppe, das Polypeptid hat also eine Richtung. Diese Primärstruktur ist für die räumliche Struktur ausschlaggebend. Wenn man die räumliche Gesamtstruktur von Peptidbindungen zueinander betrachtet, können nur wenige Stellungen der Peptidbindungsebenen zueinander eine stabile Struktur ergeben. Die Polypeptide verbinden sich in verschiedenen Ebenen zu schraubenförmig angeordneten Helixstrukturen oder auch zu Faltblattstrukturen. Diese sind durch Wasserstoffbrücken stabil. Solche Strukturen bezeichnet man als Sekundärstruktur der Polypeptidkette. Durch weitere chemische Wechselwirkungen bekommt die Polypeptidkette eine spezifische Raumgestalt - die Tertiärstruktur des Proteins. Die letzte Struktur ist die Quartärstruktur, die durch Wechselwirkung zwischen mehreren Polypeptidketten eines Proteinmoleküls entstehen kann. Durch manche Stoffe, die eine strukturelle Ähnlichkeit zum Substrat haben, kann eine Hemmung der Reaktion hervorgerufen werden, indem diese Stoffe mit den eigentl. Substraten konkurrieren, und so den Substratabbau behindern, wobei Schwermetalle aus dem gleichen Grund sehr gefährlich für den Organismus sein können, die Schwermetallionen binden sich an das Enzym und "schalten es aus", es ist blockiert, wobei die ganze Reaktionskette (falls das Enzym ein Teil davon ist/war) evtl. nicht mehr ablaufen kann und der Organismus schwer geschädigt werden kann. Bei manchen Enzymen ist durch Effektoren eine genaue Steuerung möglich, indem die Effektoren an bestimmte Stellen (allosterisches Zentrum) des Enzyms "andocken" (nicht im aktiven Zentrum!), und die Gestalt des Enzyms verändern (auch die des akt. Zentrums). Die offizielle Einheit für die Enzym-Aktivität ist das Katal (kat): Die Menge Enzyme, die gebraucht wird, um in 1 Sekunde 1 Mol Substrat umzusetzen; außerdem gibt es noch die Einheit 1Enzymeinheit = 1Unit(U):Die Menge Enzyme, die 1µmol Substrat pro Min. umsetzt. Als Wechselzahl bezeichnet man die Anzahl der pro Min. von einem Enzymmolekül umgesetzten Substratmoleküle, gängige Werte liegen bei ca. 100 000. Viele Stoffwechselanomalien werden durch den genetisch bedingten (erblichen) Funktionsausfall bestimmter Enzyme hervorgerufen, wobei die Fehlfunktion oder der Ausfall eines Enzyms dazu führen kann, dass eine ganze Stoffwechselkette blockiert ist. (Albinismus...) In der Technik werden ebenfalls Enzyme eingesetzt, z.B. in der Arzneimittelherstellung, in der Lebensmittelverarbeitung, zur Prozeßkontrolle... (Enzyme sind auch außerhalb lebender Organismen funktionsfähig, wenn die Bedingungen stimmen: pH-Wert, Temperatur...) Enzyme werden mit der Endung -ase gekennzeichnet, allerdings sind auch noch alte (Trivial-) Namen im Gebrauch, vor allem bei schon lange bekannten Enzymen. (Endung meistens -in, z.B. Pepsin (Magen), Ptyalin (Speichel)) Ein Grund, warum die meisten Lebewesen bei zu hoher Temperatur nicht existieren können, besteht darin, dass bei etwa 60°C Eiweiße zerstört werden (normale Arbeitstemp.: unter 50°C), und da Enzyme zum einen Eiweiße und zum anderen lebensnotwendig sind, wären höhere Temperaturen fatal / letal. Quellen: • Pschyrembel (257. Auflage) • Brockhaus • Linder Biologie (19. Auflage) • Ein mehrbändiges Chemie- und ein ebenfalls mehrbändiges Biologielexikon aus der Schülerbücherei