19. Wärme und Temperatur
Werbung

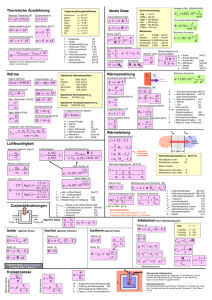
Wärmelehre – Wärme und Temperatur 19. Wärme und Temperatur 19.1. Einleitung − Wärme ist die ungeordnete Bewegung der Teilchen (in Gasen, Flüssigkeiten oder im Festkörper). Je nach den gegebenen Bedingungen ist diese Bewegung mehr oder weniger intensiv. ! − Wir beschreiben die „Intensität der ungeordneten Bewegung“ über die mittlere Translationsenergie der Teilchen und definieren so die Temperatur: ! m 2 3 v = k BT 2 2 kB ... BOLTZMANN-Konstante (kB = 1,381 ž 10-23 JžK-1) Wkin = (1) Maßeinheit für die Temperatur ist das Kelvin: [T] = K SI − Aus Gl. (1) folgt die Existenz eines nicht unterschreitbaren Nullpunkts der Temperatur. ! − Stoffmengen ν werden meist in Mol gemessen: [ν] = Mol SI 1 Mol ist die Menge eines Stoffes, die genau so viele Teilchen (Atome, Moleküle) enthält wie 12 g des Kohlenstoffnuklids 12 C. Dies sind: ! NL = 6,022134 ž 1023 Teilchen NL (N A) ist die LOSCHMIDT-Zahl (Avogadro’s number). 19.2. Wärmeausdehnung − Gase, Flüssigkeiten und Festkörper dehnen sich bei Temperaturerhöhung aus bzw. es steigt der Druck, wenn das Volumen konstant gehalten wird. − Für Festkörper gilt näherungsweise lineare Ausdehnung: l = l o (1 + α ⋅ ∆T) mit ! (2) α ... linearer Ausdehnungskoeffizient Beispiele: Glas Eisen Kupfer α = (5 ... 10) ž 10-6 K-1 α= 12,0 ž 10-6 K-1 α= 16,7 ž 10-6 K-1 bei 100 °C n 2 Wärmelehre – Wärme und Temperatur u Kommentar: · · · − Streng genommen ist α = α(T), oft ist jedoch die lineare Näherung ganz gut. 10 ž 10-6 ist eine gute „Hausnummer“ für viele feste Stoffe ⇒ für ∆T = 100 K ∆l beträgt = 10 −3 ⇒ merkliche Ausdehnung ∆l von 1 cm pro l = 10 m l Beispiele: Bimetallstreifen, Bahnschienen, Dehnungsbogen Für Flüssigkeiten gilt mit Gl. (2): V = l (∆T) 3 = l 30 (1 + α ⋅ ∆T ) 3 ≈ l 30 (1 + 3α ⋅ ∆T) (α 2 , α3 ≈ 0) V = Vo (1 + γ ⋅ ∆T) mit (3) γ = 3α ... Raumausdehnungskoeffizient Beispiele: Wasser Ethanol γ = 207 ž 10-6 K-1 γ = 1100 ž 10-6 K-1 α ≈ 70 ž 10-6 K-1 α ≈ 370 ž 10-6 K-1 bei 18 °C ⇒ Wärmeausdehnung bei Flüssigkeiten ist um eine Größenordnung größer! Beispiel: Flüssigkeitsthermometer ⇒ relativ großer Effekt der Flüssigkeitsausdehnung, n ! n da die der Röhre viel geringer ist. 19.3. Freiheitsgrade − − Moleküle können neben der Translationsenergie auch andere Formen der Bewegungsenergie haben: · Rotationsenergie · Schwingungsenergie ! wichtig: 2-atomige Gase (H2 , O2 , N2 , ...) haben 5 Freiheitsgrade, und zwar 3 Freiheitsgrade der Translation + 2 Freiheitsgrade der Rotation. 3 Wärmelehre – Wärme und Temperatur − Gleichverteilungssatz: Auf jeden Freiheitsgrad eines Moleküls entfällt im thermischen Gleichgewicht im Mittel die gleiche Energie, und zwar WFG ⇒ − = WTrans = 1 k BT 2 3 k B T , da 3 Freiheitsgrade der Translation 2 ! (4) ≡ Gl. (1)! Die gesamte Bewegungsenergie eines 2-atomigen Moleküls (bei nicht zu hohen Tempe5 raturen, wenn noch keine Vibration angeregt wird) ist aber gleich k B T , da auch noch 2 zwei Freiheitsgrade der Rotation existieren! Wir werden darauf noch zurückkommen. 19.4. Spezifische Wärmekapazität − Erwärmung eines Körpers um ∆T erfordert die Zufuhr einer Energie ∆W ∆W lt. Gl. (4) Teilchen ⋅ Freiheitsg rad ã ä M 1 ∆W = ⋅ f ⋅ k B ⋅ ∆T m 2 M ... Masse des Körpers, m ... Masse eines Teilchens, f ... Zahl der Freiheitsgrade. Zahl der Teilchen N mit − Wir definieren die Wärmekapazität des Körpers: ⇒ − C = ∆W 1 M 1 = N ⋅ f ⋅ kB = ⋅ f ⋅ kB ∆T 2 m 2 (6) spezifische Wärme(kapazität) ⇒ − (5) c ≡ C 1 f ⋅ kB = ⋅ M 2 m Kommentar: · C ist eine Eigenschaft des Körpers, also große Masse bedeutet große Wärmekapazität (Beispiel: thermische Trägheit). · c ist eine Materialeigenschaft. Materialien mit kleinen Atom- bzw. Molekülmassen haben großes c. („Weil es eben auf die Anzahl der Teilchen ankommt“) · In jedem Fall gilt: C, c ~ f! · Flüssiges Wasser hat hohe spezifische Wärme(kapazität) (großes f, kleines m)! (7) u ! ! 4 Wärmelehre – Wärme und Temperatur − Es ist zweckmäßig (erst recht bei Gasen!), C und c auf die Stoffmenge zu beziehen. Aus Gl. (6) folgt mit N = NL die molare Wärmekapazität 1 C mol = N L ⋅ f ⋅ k B 2 å æ [ C] [Atome ] Mol Mol ⇒ (8) − Bei Gasen ist zu unterscheiden: · spezifische Wärmekapazität bei konstantem Volumen: cV · spezifische Wärmekapazität bei konstantem Druck: cp − cV ist die bisher besprochene spezifische Wärmekapazität („Erhöhung der Energie der Einzelteilchen“). − cp enthält zusätzlich die vom Gas bei der Ausdehnung geleistete Arbeit. ⇒ cp > cV ! − Beispiele für θ = 0 °C (C in J ž (Mol ž K)-1): n f Gas Cmol, p Cmol, V 3 He Ar O2 N2 H2 N2O 20,9 20,7 29,3 29,0 28,5 34,1 12,6 12,4 21,0 20,7 20,2 26,5 5 6 Cmol,p C mol,V 1,66 1,67 1,40 1,40 1,41 1,29 1 C mol,V 2 f 4,2 4,1 4,2 4,1 4,0 4,4 Cmol, p - Cmol, V3 8,3 8,3 8,3 8,3 8,3 7,6 (Bei f wurde neben der Translation nur die Rotation berücksichtigt, da dort laut Quantenmechanik die typischen Anregungsenergien ∆E ≈ 0,001 eV sind. Die Anregungsenergien der Schwingungszustände dagegen sind mit ∆E ≈ 0,1 eV so groß, dass sie bei 0 °C praktisch nicht angeregt werden. Ebenso ist bei der Rotation um die Molekülachse das Trägheitsmoment so klein, dass die Energie ∆E ~ J-1 viel zu groß ist, um angeregt zu werden. Daher haben die zweiatomigen Moleküle nur zwei Rotationsfreiheitsgrade, das N2 O aber drei.) 1 2 3 Cmol, p /Cmol, V ist der später eingeführte Adiabatenexponent γ (vgl. <20.3.>). Cmol, V ž f-1 = 1/2žNA žkB = 1/2žR (lt. Gl. (6) bzw. (8), vgl. <20.1.>) Cmol, p - C mol, V ≈ R (vgl. <20.3.>) 5