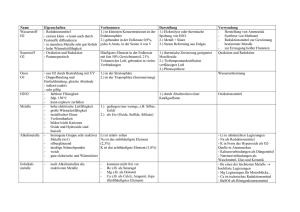
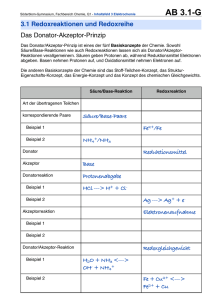
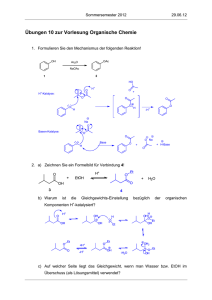
Lösung zur Übung Nr.2, verteilt Montag, 03. März 2008. 1
Werbung

Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Frühjahrssemester 2008 Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Frühjahrssemester 2008 Lösung zur Übung Nr.2, verteilt Montag, 03. März 2008. Bortrifluorid ist eine sehr starke Lewis-Säure. Der Elektronenmangel ist so gross, dass die Verbindung in der gezeigten Form gar nicht stabil ist – Bor holt sich einen vierten Bindungspartner (siehe Anorganische Chemie, Struktur von Bor und Aluminiumverbindungen). Gleiches gilt für Boran (BH3), das aber auch ein Reduktionsmittel ist, indem es Hydrid-Anionen überträgt. Das Proton ist das einfachste Elektrophil, außerdem eine starke Lewis-Säure. Ein Amid wie auch das hier gezeigte Thioamid ist sowohl an O (bzw. S) wie an N nucleophil. Dichlorodicyanobenzochinon ist ein Oxidationsmittel, denn das entstehende Produkt (nach formaler Wasserstoffübertragung) ist aromatisch und damit stabilisiert. Also nimmt es gerne Elektronen auf. Lithium-Aluminiumhydrid ist eines der stärksten Reduktionsmittel und eine Quelle von H-. Li+ hingegen ist eine Lewis-Säure (und ein Elektrophil, wenn auch ein schlechtes). Schwefelwasserstoff ist nicht nur eine Brönsted-Säure, sondern auch Reduktionsmittel (wird zu Schwefel oxidiert). Besonders in deprotonierter Form (als HS- oder S2-) ist es ein gutes Nucleophil. Aldehyde sind nicht nur Elektrophile, sondern auch Reduktionsmittel, wobei eine Carbonsäure entsteht. Diisobutylaluminiumhydrid ist wie Boran eine Lewissäure, aber dennoch ein Reduktionsmittel. Benzylbromid (BnBr) ist ein Elektrophil, denn die C-Br-Bindung ist stark polarisiert, so dass ein Nucleophil leicht an diesem Kohlenstoffatom angreifen und Br- ersetzen kann (die Bindung C-Br ist schwach). 1. Reduktionsmittel, Oxidationsmittel, Nucleophil, Elektrophil Aufgabe: Bezeichnen Sie in den folgenden Molekülen/Ionen das oder die elektrophilen oder nucleophilen Zentren. Reduktionsmittel O AgNO3 Carbonsäure + Silberspiegel E E Ester Al(iBu)2H + Li [AlH4] N - H2S Aldehyd oder Alkohol + Al(iBu)2OR Ester Alkohol + LiAl(OH)4 SO2 N elementarer Schwefel Carbonsäure Alkohol Na+[BH4]Oxidationsmittel Allylalkohol MnO2 Mn(II) + Aldehyd E O CN Cl RO CN Cl E + ROH OH Sonstige BF3 O O CN Cl O E 2. Reaktionstypen OH O CN Cl E N - MeO H + E BnBr NH2 N N N S Bn N E H N O O E OH O N HO OH OH O HO E OH glucose E: Elektrophile Position N: Nucleophile Position Es sind nicht alle elektrophilen/nucleophilen Zentren markiert, sondern nur eine Auswahl, die für die häufigsten Reaktionen der organischen Chemie relevant sind. Wie und wann diese reagieren, wird im Verlauf der Vorlesung noch besprochen werden. Aufgabe: Bestimmen Sie den Reaktionstyp der folgenden Reaktionen. a) Eliminierung. Es wird ein H+ durch die starke Base -O-t-Bu abgespalten und TsOverläßt das Molekül. N.B. in Wirklichkeit wird zu gleichen Teilen auch das andere Enantiomer gebildet werden, bei dem die Doppelbindung auf die andere Seite entsteht. Die Reaktion ist nämlich nicht enantioselektiv. b) Nucleophile Substitution. Natriumhydroxid kann Chlorid durch OH ersetzen. c) Elektrophile Addition. Br2 kann formal als Br+ und Br- betrachtet werden. Br+ greift die Doppelbindung an, anschließend folgt Br-. d) Nucleophile Addition an ein Keton; Bildung eines Cyanhydrins. Ein solches Cyanhydrin wird in e) zum Aminoalkohol reduziert. THF: Tetrahydrofuran, ein cyclischer Ether, der gern als Lösungsmittel verwendet wird, weil er polare wie apolare Stoffe gut löst. f) Im ersten Schritt wird Wasser eliminiert, dann folgt eine Umlagerung. Der genaue Grund, weshalb diese Umlagerung auftritt, wird in einigen Wochen in der Vorlesung besprochen werden. N.B. die Reaktion ist so natürlich noch nicht zu Ende – das Carbokation wird versuchen, wieder zu einem neutralen Molekül zu werden. Diese Reaktionen und ihre Mechanismen werden im Verlauf der Vorlesung noch im Detail besprochen werden. Hier geht es im Moment nur um das Erkennen des Reaktionstyps. Die Beispielreaktionen für Reduktionen und Oxidationen dienen nur der Illustration und sind kein Prüfungsstoff. Lösung zur Übung 2 Seite 1 von 4 Lösung zur Übung 2 Seite 2 von 4 Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Frühjahrssemester 2008 Vorlesung Allgemeine Chemie II Teil Organische Chemie Prof. R. Peters – Frühjahrssemester 2008 3. Selektivitäten c) O Aufgabe: Bestimmen Sie die Selektivitäten. O O a) Regioselektivität (oder Chemoselektivität, das hängt vom Standpunkt ab): Ethylmagnesiumbromid könnte auch direkt am Ester angreifen. Enantioselektivität: Es entsteht nur eines der zwei möglichen Enantiomeren. b) Regioselektivität: Die primäre OH-Gruppe reagiert bevorzugt in Gegenwart der tertiären OH-Gruppe. Man könnte dies aber auch als Chemoselektivität bezeichnen. HN O d) OH O O O Teil B: O SO3X N EtOOC R Ts Ts N H Base PhMe, 0 °C N Ph N EtOOC O Ts + R O N EtOOC R 1 : 1 Da der Kat achiral ist, entstehen die beiden Enantiomere im Verhältnis 1:1. Man hat also keine Enantioselektivität. Hingegen ist die Reaktion diastereoselektiv, denn die Reste R und COOEt stehen zu 100% trans zueinander (gäbe es eine 1:1 Mischung cis:trans, so hätte man keine Diastereoselektivität). b) MeO CF3 N PhH2CH2C MeO Pd(II) O + chiraler Ligand CF3 N PhH2CH2C MeO O CF3 N O PhH2CH2C 99,85 : 0,15 Da ein chiraler Ligand verwendet wird, ist Enantioselektivität zu erwarten. Die beiden Enantiomere werden nicht im Verhältnis 1:1, sondern 99,85 zu 0,15 gebildet. Von Diastereoselektivität zu sprechen macht keinen Sinn, da keine anderen Diastereomere denkbar sind. Lösung zur Übung 2 Seite 3 von 4 Esterase OH O OH O O Eine Esterase ist ein Enzym, das Ester zu Carbonsäuren spalten kann. Das Startmaterial ist eine achirale Meso-Verbindung, das Produkt ist chiral, da das chirale Enzym die beiden enantiotopen Ester-Gruppen unterscheiden kann und nur eine von beiden hydrolysiert. Es liegt also Enantioselektivität vor. 4. Noch mehr Selektivitäten a) Cl O HN CCl3 CCl3 Hier wird ein achirales Reagenz verwendet, es ist also keine Enantioselektivität zu erwarten. Es wird hingegen selektiv nur ein mögliches Diastereomer gebildet, also ist die Reaktion diastereoselektiv. c) Das Startmaterial ist chiral, die Produkte sind Diastereomere. Es handelt sich also um Diastereoselektivität (ein Diastereomer wird in deutlichem Überschuß gebildet). d) Das Startmaterial wie auch das Endprodukt ist achiral. Es entstehen aber gleichzeitig zwei neue Stereozentren, womit die Reaktion diastereoselektiv ist. Auch die Tatsache, dass das Produkt eine (achirale) Meso-Verbindung ist, ändert daran nichts. O O Pd(II) Lösung zur Übung 2 Seite 4 von 4