57 4.7.4 Geschwindigkeit enzymatisch katalysierter Reaktionen
Werbung

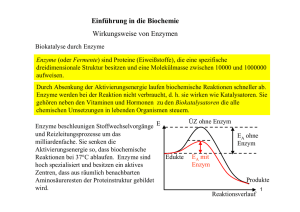
4.7.4 Geschwindigkeit ­enzymatisch katalysierter Reaktionen geschieht allerdings sehr langsam, da die Substratmoleküle erst den Berg der Aktivierungsenergie überwinden müssen, bevor sie auf der anderen Seite hinunterrutschen können. Merke! Eine Reaktion läuft immer dann freiwillig ab, wenn ∆G negativ ist. Einen sehr effektiven Weg, Reaktionen zu beschleunigen, hat der Körper durch die Verwendung von Enzymen gefunden (s. Abb. 72 b). Der Vorteil hierbei ist, dass die äußeren Faktoren wie Temperatur und pH-Wert gleichbleiben können. Das Enzym kannst du dir als Bagger vorstellen, der kurzerhand die Spitze des Berges abträgt. Über den flacheren Berg können die Substratmoleküle leichter wandern und die Reaktion von S nach P verläuft schneller. Letztendlich kommen aber nicht mehr Substratmoleküle bei P an; die Gleichgewichtslage ändert sich also NICHT. Das Gleichgewicht der Reaktion stellt sich nur schneller ein. Ganz genau genommen läuft eine enzymkatalysierte Reaktion so ab (s. a. Abb. 69, S. 52): –– Durch Bindung von Enzym und Substrat zum Enzym-Substrat-Komplex (ES) wird die Aktivierungsenergie erniedrigt. –– Aus ES entsteht durch Umwandlung des Substrats der Enzym-Produkt-Komplex (EP), der schnell zu Enzym und freiem Produkt zerfällt. E + S g ES g EP g E + P E = Enzym, S = Substrat, ES = Enzym-Substrat-Komplex, EP = Enzym-Produkt-Komplex und P = Produkt. Im Physikum wollte man schon öfter wissen, ob die Geschwindigkeit einer enzymkatalysierten Reaktion durch die Bildung des Produkts aus dem Enzym-Substrat-Komplex (ES) limitiert wird (Der ES muss zum EP umgewandelt werden). www.medi-learn.de Eine enzymatische Reaktion läuft so lange ab, bis sich ein Gleichgewicht zwischen Substrat und Produkt einstellt. An diesem Punkt kommt die Reaktion E + S g ES g EP g E + P zum Stillstand. Verhindert man die Einstellung eines solchen Gleichgewichts, indem man z. B. das Produkt kontinuierlich entfernt (z. B. durch eine nachgeschaltete Reaktion), spricht man von einem Fließgleichgewicht. Hierbei wird kontinuierlich das Substrat zum Produkt umgewandelt. In einem Fließgleichgewicht sind lediglich die Konzentrationen der Intermediate ES und EP konstant. 4.7.4 Geschwindigkeit ­enzymatisch katalysierter Reaktionen 4 Ein in bisher jedem schriftlichen Physikum mindestens einmal gefragter und nicht nur deshalb wichtiger Abschnitt ist die Aktivität von Enzymen und deren Regulation. Jeder Stoffwechselprozess des Körpers ist an irgendeiner Stelle reguliert. So wird eine flexible Anpassung an äußere Anforderungen gewährleistet. Diese Regulation erfolgt an Enzymen, die ihrer Bedeutung entsprechend Schlüsselenzyme genannt werden. Durch Beeinflussung dieser Schlüsselenzyme kann der Körper den Substratdurchfluss an den herrschenden Bedarf anpassen. Doch bevor du dich mit der veränderten Aktivität von Enzymen beschäftigst, musst du dich zunächst wieder mit den Grundlagen auseinandersetzen. Dabei geht es im Einzelnen um so spannende Geschichten wie –– Maximalgeschwindigkeit, –– Halbmaximalgeschwindigkeit, –– Substratsättigung, –– Affinität, –– Michaelis-Menten-Konstante und –– Lineweaver-Burk-Diagramm. Um diesen Begriffen den Schrecken zu nehmen, werden sie hier sehr detailliert besprochen und durch Beispiele verdeutlicht. Fangen wir also ganz behutsam an. 57