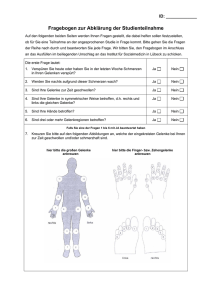
Medikamentöse Therapie 5 - Deutsche Gesellschaft für
Werbung

5 Medikamentöse Therapie 5.1 Nichtsteroidale Antirheumatika z 5.1 Nichtsteroidale Antirheumatika 5.1.1 Klassische nichtsteroidale Antirheumatika Definition Nichtsteroidale Antirheumatika (NSAR) haben entzündungshemmende, schmerz stillende und fiebersenkende Eigenschaften. Sie sind mit Ausnahme der meisten zugelassenen COX-2-selektiven Inhibitoren (s. Kap. 5.1.2) saure Verbindungen, die im Plasma zu über 99% an Proteine gebunden sind. Chemisch weisen NSAR heterogene Strukturen auf (s. u.). Ihr Wirkungsmechanismus ist komplex. Die Hemmung der Prostaglandinsynthese via Cyclooxygenase-(COX-)Inhibition gilt als ihr wichtigster und bestuntersuchter Wirkmechanismus. Einige NSAR sollen ihre Wirkung zusätzlich durch Inhibition von Lipoxygenasen (LOX) entfalten. Andere sollen Einfluss auf die Zytokinsynthese nehmen. NSAR sind bei den meisten schmerzhaften rheumatischen Erkrankungen Mittel der Wahl, wenn saure Analgetika wie Parazetamol nicht ausreichend wirksam sind. Substanzklassen z Salizylsäurederivate Azetylsalizylsäure (ASS, Aspisol [wasserlöslich]), sonstige Salizylate (Salizylamid, Salacetamid), z Essigsäurederivate (Indometacin, Acemetacin, Diclofenac), z Propionsäurederivate (Ibuprofen, S-Ibuprofen, Ketoprofen, S-Ketoprofen, [S-] Naproxen, Tiaprofensäure), z Oxicame (Piroxicam, Tenoxicam, Meloxicam, Lornoxicam), z Pyrazolone (Phenylbutazon, Azapropazon), z Anthranilsäurederivate (Mefenaminsäure, Flufenaminsäure), z sonstige Verbindungen, z COX-2-selektive Inhibitoren (s. Kap. 5.1.2). Indikationen z akute Arthritiden (einschließlich Gichtanfall), z chronische Arthritiden, insbesondere rheumatoide Arthritis (chronische Polyarthritis), z ankylosierende Spondylitis und andere entzündliche Wirbelsäulenleiden, z Reizzustände bei degenerativen Gelenk- und Wirbelsäulenleiden, z akute und chronische weichteilrheumatische Schmerzsyndrome. 193 194 z 5 Medikamentöse Therapie z Beachte: Phenylbutazon sollte nur kurzzeitig bei akuten Schüben entzündlich-rheumatischer Krankheiten angewendet werden. Kontraindikationen z Überempfindlichkeit gegen die einzelne Substanz, z ASS/NSAR-induziertes Asthma, z Schwangerschaft, 3. Trimenon; Geburt. Anwendung mit besonderer Vorsicht z z z z z ungeklärte Blutbildungsstörungen, vorausgegangene Magen-Darm-Ulzera, vorausgegangene GI-Blutungen, arterielle Hypertonie, Herzinsuffizienz, schwere Leber- und Nierenschädigung, höheres Lebensalter. z Beachte: Bei der Entwicklung von gastrointestinalen Komplikationen ist das Absetzen der Präparate nicht immer möglich. Die NSAR-Therapie kann unter strenger Überwachung und Abwägen des Nutzen-Risiko-Verhältnisses unter Schutz durch einen Protonenpumpeninhibitor oder ein Prostaglandinanalogon fortgesetzt werden (s. Kap. 5.1.3). Nebenwirkungen Häufig vorkommende Nebenwirkungen z Dyspepsie, Nausea, Bauchschmerz, Stuhlverstopfung, Kopfschmerzen, Schwindel, Benommenheit, Hautausschlag, Urtikaria, Transaminasenerhöhung, Flüssigkeitsretention, Tinnitus. Schwere Nebenwirkungen z Anaphylaxie, z gastrointestinale Blutung und Perforation, z akutes Nierenversagen, z interstitielle Nephritis, z Hepatotoxizität, z Bronchospasmus, z Thrombozytopenie, z Agranulozytose, z Stevens-Johnson Syndrom, z kardiovaskuläre Ereignisse (Myokardinfarkt, zerebrovaskulärer Insult). 5.1 Nichtsteroidale Antirheumatika z Interaktionen Interaktionen mit anderen Medikamenten sind im Allgemeinen nur gering ausgeprägt. Sie können Ursache für eine Steigerung der Plasmakonzentration und der Wirkung z. B. bei oralen Antidiabetika, Phenytoin, Lithium oder Antikoagulanzien sein. Oder sie vermindern die Wirkung beispielsweise von Digitoxin, Furosemid oder Antihypertensiva. In der Langzeitbehandlung sind deshalb bei bestimmten Kombinationstherapien häufigere Kontrollen und ggf. Dosisanpassungen notwendig. Medikamenteninteraktionen mit NSAR sind insbesondere bekannt geworden bei folgenden Substanzen oder Substanzgruppen: AT1-Blocker, AT2-Rezeptor-Blocker, ACE-Inhibitoren, Hydrothiazide, Schleifendiuretika, kaliumsparende Diuretika, Parazetamol, Antikoagulanzien, Diclopidine, Aspirin (ASS), Betablocker, Kortikosteroide, Cyclosporin, Alkohol, Hydralazin, Leflunomid, Lithium, Methotrexat, Probenecid, Chinolone, Thrombolytika, Valproinsäurederivate. Allgemeine Verordnungsregeln z NSAR sind in Wirksamkeit und Verträglichkeit patientenindividuell unterschiedlich. Darum ist das Austesten des für den Patienten besten Mittels notwendig. z Im Allgemeinen beginnt man mit der vollen Wirkungsdosis, die später ggf. durch Dosisreduktion dem tatsächlichen Bedarf angepasst werden kann. Ein „Einschleichen“ ist nicht angebracht. z NSAR sollten wegen der kardiovaskulären Risiken in der niedrigsten ausreichend wirksamen Dosis und so kurz wie notwendig eingenommen werden. z Ein festes Dosierungsregime ist der Bedarfsmedikation vorzuziehen. z Die synchrone Kombination verschiedener Antiphlogistika ist nicht sinnvoll. z Bei entzündlich-rheumatischen Erkrankungen ist meist eine 24-Stunden Entzündungshemmung notwendig, bei degenerativen Veränderungen und Weichteilrheumatismus kann die Dosierung an die Schmerzmaxima im Laufe des Tages angepasst werden. z Die Kombination von niedrig dosierten Glukokortikoiden und NSAR ist bei besonders sorgfältiger Überwachung möglich. z Das Risiko gastrointestinaler Nebenwirkungen wächst im höheren Lebensalter, darum sollten hier möglichst niedrige Dosierungen verordnet und bevorzugt besser steuerbare Substanzen mit kurzer Halbwertszeit (s. u.) gewählt werden. z Die Effektivität der medikamentösen Behandlung kann durch Information des Patienten verbessert werden. Darum sollten die angestrebten Therapieziele (Schmerz- und Entzündungslinderung, indirekt auch die Verbesserung der Funktion) sowie die für den Patienten individuell wichtigsten möglichen Nebenwirkungen aufgezeigt werden. Es sollten die beiden häufigsten Missverständnisse ausgeräumt werden, dass diese „Antirheumatika“ die rheumatische Grunderkrankung beseitigen würden und dass bei längerfristiger Anwendung von NSAR mit einer Gewöhnung gerechnet werden müsse, die zum Wirkverlust führen. 195 196 z 5 Medikamentöse Therapie Auswahl des optimalen Präparates z Wichtigster Maßstab für die Beurteilung der Richtigkeit der getroffenen Präparatewahl ist der Grad der Zufriedenheit des Patienten mit dem erreichten Therapieziel. Gegebenenfalls muss durch Dosisanpassung oder nötigenfalls Präparatewechsel das Optimum gesucht werden. z Gleich bedeutsam bei der Präparatewahl ist die Verträglichkeit des NSAR. Diese kann der Patient selbst im Gegensatz zur erwünschten Wirkung nicht sicher beurteilen. Selbst bedrohliche Nebenwirkungen (wie die gastrointestinale NSAR-Blutung oder Perforation) treten nämlich oft ohne subjektiv fassbare Vorankündigung auf. Deshalb müssen je nach der individuellen Risikokonstellation des Behandelten ggf. gastrointestinale Prophylaxemaßnahmen z. B. durch Komedikation mit einem Protonenpumpeninhibitor (PPI) bzw. einem Prostaglandinanalogon (Misoprostol) oder durch Wechsel auf ein COX-2-selektives Antirheumatikum in Erwägung gezogen werden. Andere schwerwiegende Nebenwirkungen können in Frühphasen ihrer Entstehung durch geeignete Kontrolluntersuchungen erkannt werden. Bei der Verordnung ist zu bedenken, dass die Verträglichkeit eines bestimmten NSAR im Vergleich zu anderen NSAR weniger von der Substanz selbst als vielmehr von individuellen Reaktionsweisen des Patienten auf diese Substanz bestimmt wird, sodass geeignete Maßnahmen wie z. B. ein Medikamentenwechsel oder die Einleitung einer anderen Schmerztherapie veranlasst werden können. z Auch die Halbwertszeit kann über die Medikamentenwahl mitentscheiden. – Kurze Halbwertszeit (gut steuerbar, hohe Plasmaspitzen, häufigere Einnahme erforderlich): Azetylsalizylsäure, Diclofenac, Ibuprofen, Indometacin, Ketoprofen, Lonazolac, Proglumetacin, Pirprofen, Tiaprofensäure, Tolmetin. – Mittlere Halbwertszeit: Azapropazon, Fenbufen, Naproxen, Sulindac, Nabumeton. – Lange Halbwertszeit (schlechter steuerbar, große individuelle Unterschiede der Plasmakonzentrationen, seltenere Einnahme erforderlich): Piroxicam, Tenoxicam, Phenylbutazon. Kontrolluntersuchungen z Zu den wichtigsten Sicherheitsmaßnahmen im Verlauf einer NSAR-Therapie gehört die optimale Patienteninformation, sorgfältige Anamneseerhebung und die aufmerksame klinische Untersuchung. z Es sollten regelmäßige (z. B. in mehrwöchigen/mehrmonatigen Abständen), anfangs häufigere (z. B. wenige Wochen) gezielte Befragungen über Nebenwirkungen, eine körperliche Untersuchung und Laborkontrollen (hämatologisches Profil mit rotem Blutbild, Leukozyten- und Thrombozytenzahl, GammaGT, Kreatinin, Urinstatus) durchgeführt werden. Die Untersuchungsintervalle richten sich nach dem individuellen Risikoprofil. Sie sind bei begleitenden Organinsuffizienzen oder anderweitig erhöhtem individuellem Risiko kürzer. Über ihre genauen zeitlichen Abstände gibt es keine mit wissenschaftlichen Methoden gesicherte Empfehlung. 5.1 Nichtsteroidale Antirheumatika z z Literatur 1. Mutschler E, Geisslinger G, Kroemer HK, Schäfer-Korting M (2001) Mutschler Arzneimittelwirkungen: Lehrbuch der Pharmakologie und Toxikologie, 8. Aufl. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2. Schmidt KL (1991) Checkliste Rheumatologie. Thieme, Stuttgart New York 3. Tannenbaum H, Bombardier C, Davis P, Russell AS (2006) An evidence-based approach to prescribing nonsteroidal antiinflammatory drugs. Third Canadian Consensus Conference. J Rheumatol 33:140–157 4. Bolten WW (2005) Recommendations for treatment with nonsteroidal antiinflammatory drugs. MMW Fortschr Med 147:24–27 197 198 z 5 Medikamentöse Therapie 5.1.2 COX-2-spezifische Inhibitoren (Coxibe) Definition Nichtsteroidale Antirheumatika (NSAR) vermindern die Prostaglandinsynthese durch Hemmung des Enzyms Cyclooxygenase. Um 1990 wurde die Erkenntnis publiziert, dass dieses Enzym tatsächlich aus 2 Isoenzymen (COX 1/COX 2) mit unterschiedlichen Funktionen besteht: COX 1 ist als konstitutives, nicht regulierbares Isoenzym vorwiegend für die Propagierung der physiologischen Prostaglandinwirkungen (z. B. Schutzfunktionen für die Magen-Darm-Schleimhaut, Thrombozytenaggregation) verantwortlich. Die Expression der steuerbaren COX 2 wird vorwiegend durch Entzündungsmediatoren induziert, dieses Isoenzym ist maßgeblich für die entzündungsfördernden Prostaglandinwirkungen und findet sich dementsprechend in Entzündungsarealen im Überschuss. Aufbauend auf dieser Erkenntnis wurde in der Folge intensiv nach Substanzen gesucht, die dadurch definiert sind, dass sie z ihre hemmende Wirkung vorwiegend bzw. therapeutische Dosierung ausschließlich auf das Isoenzym COX 2 ausüben und z deshalb eine gute antiphlogistische Wirkung vergleichbar den herkömmlichen NSAR und – wegen der fehlenden COX-1-hemmenden Wirkung – eine bessere gastrointestinale Verträglichkeit aufweisen. Substanzen Bisher sind in Deutschland drei COX-2-spezifische Inhibitoren (Coxibe) zugelassen: z Celecoxib – maximale Tagesdosis 2-mal 200 mg z Etoricoxib – maximale Tagesdosis 1-mal 120 mg z Lumiracoxib – empfohlene Tagesdosis bei Arthrose 100 mg Indikationen Der Indikationsbereich der Coxibe entspricht praktisch dem Indikationsspektrum der etablierten NSAR. Die vergleichsweise höheren Kosten der COX2-Selektiven begrenzt ihre Verordnungsmöglichkeit im klinischen Alltag. Wegen ihrer günstigeren gastrointestinalen Verträglichkeit ist ihr Einsatz besonders bei Patienten mit einem erhöhten gastrointestinalen Risiko sinnvoll. Kontraindikationen z z z z z z Überempfindlichkeit gegen die Substanz, ASS-/NSAR-induziertes Asthma, ASS-/NSAR-induzierte Urtikaria, schwere Nierenfunktionsstörung, Leberinsuffizienz (Child-Pugh-Klasse C), Schwangerschaft, 3. Trimenon; Geburt. 5.1 Nichtsteroidale Antirheumatika z Nach den Empfehlungen der europäischen Arzneimittelbehörde (EMEA) sollen alle COX-2-hemmenden Substanzen nicht eingesetzt werden bei Patienten mit ischämischer Herzerkrankung und/oder nach Schlaganfällen und/oder bei schweren arteriellen Durchblutungsstörungen. Anwendung mit besonderer Vorsicht z z z z z z z z z ungeklärte Blutbildungsstörungen, anamnestisch Magen-Darm-Ulzera, GI-Blutungen, anamnestisch Nieren- oder Leberinsuffizienz, arterielle Hypertonie, Herzinsuffizienz, Diabetes mellitus, Dehydratation, Flüssigkeitsretention, Asthma, höheres Lebensalter. z Beachte: z Bisher liegen keine ausreichenden Erfahrungen zum Einsatz von Coxiben bei Kindern vor. z Zwar treten unter der Behandlung mit Coxiben signifikant weniger häufig schwere gastrointestinale Nebenerscheinungen auf als unter konventionellen NSAR; dennoch muss (ähnlich wie unter Plazebo) in geringer Häufigkeit mit solchen Ereignissen gerechnet werden. z Die Kombination mit ASS hebt die gastrointestinalen Sicherheitsvorteile zumindest teilweise wieder auf. Deswegen muss bei gesicherter Indikation ASS in der niedrigst möglichen Dosierung verordnet werden. z Es gibt bisher keine Erfahrungen über die Kombination von Coxiben mit Analgetika. Wichtigste Nebenwirkungen Nebenwirkungen traten insgesamt in Studien unter Coxiben nur mit einer gering höheren Rate als unter Plazebo auf. Relativ am häufigsten fanden sich: z Nausea/Dyspepsie/Diarrhöe, z Ödeme, z Hypertonie, z Erhöhung der Transaminasen, z Infektionen des oberen Respirationstraktes. Die Abheilung gastrointestinaler Ulzera ist bei gleichzeitiger Therapie mit COX-2-selektiven ebenso wie mit herkömmlichen NSAR verzögert. 199 200 z 5 Medikamentöse Therapie Kontrolluntersuchungen Die Empfehlungen für Kontrollmaßnahmen entsprechen denen bei herkömmlicher NSAR Therapie (s. Kap. 5.1.1). z Literatur 1. Hawkey CJ (1999) COX-2-Inhibitors. Lancet 353:307–314 2. Hinz B, Brune K (1999) Spezifische COX-2-Inhibitoren: Perspektiven einer Therapie mit neuen analgetischen und antiinflammatorischen Wirkstoffen. Wien Klin Wochenschr 111:103–112 3. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, Makuch R, Eisen G, Agrawal NM, Stenson WF, Burr AM, Zhao WW, Kent JD, Lefkowith JB, Verburg KM, Geis GS (2000) Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib Long-term Arthritis Safety Study [see comments]. JAMA 284[10]:1247–1255 4. Singh G, Fort JG, Goldstein JL, Levy RA, Hanrahan PS, Bello AE, Andrade-Ortega L, Wallemark C, Agrawal NM, Eisen GM, Stenson WF, Triadafilopoulos G (2006) Celecoxib versus naproxen and diclofenac in osteoarthritis patients: SUCCESS-I Study. Am J Med 119:255–266 5. Fitzgerald GA (2004) Coxibs and cardiovascular disease. N Engl J Med 351: 1709– 1711 5.1 Nichtsteroidale Antirheumatika z 5.1.3 Prophylaxe und Therapie von gastrointestinalen NSAR-Nebenwirkungen Häufigkeit und Risiko Unter der NSAR-Therapie ist das Risiko, ein Magen- oder (seltener) ein Duodenalulkus zu entwickeln, etwa 3-fach erhöht. Zusätzliche Risikofaktoren sind: z ein Lebensalter von über 60 Jahren, z eine positive Ulkusanamnese, z eine Begleittherapie von über 10 mg/Tag Prednisonäquivalent z eine hohe NSAR-Tagesdosierung, z die Einnahme von Antikoagulanzien. In der Anfangsphase der Behandlung (1–3 Monate) ist das Risiko ebenfalls erhöht. Bei Langzeit-NSAR-Behandlung treten meist asymptomatische Ulzera bei 15–30% und schwere Ulkuskomplikationen (Blutung, Perforation) in 1,0–1,5% auf. Endoskopische Veränderungen (Erosionen, Ulzera) und gastrointestinale Symptome korrelieren nicht. Allgemeine Regeln zur NSAR-Ulkusprophylaxe und Therapie z Der Patient darf keinesfalls wegen seiner gastrointestinalen Problematik ohne ausreichende analgetisch-antiphlogistische Therapie gelassen werden. Andererseits ist die Indikation zur Verordnung von NSAR immer wieder kritisch zu überprüfen und z. B. bei Arthrose oder weichteilrheumatischen Erkrankungen eine analgetische Behandlung mit Analgetika wie dem nicht gastrotoxischen Paracetamol zu versuchen. z In jedem Fall ist die geringste mögliche Tagesdosis einzusetzen, kurzzeitige Therapieunterbrechungen sind zu vermeiden. z Bei Auftreten von gastrointestinalen Nebenwirkungen sollte der Wechsel zu weniger lokal mukosatoxischen Präparaten erwogen werden. Als solche gelten u. a. Retardformen, dünndarmlösliche Tabletten, Prodrugs, Piroxicameinschlussverbindungen, spezifische „COX-2-Hemmer“, nichtazetylierte Salizylate. z Für den Einsatz von Suppositorien gilt, dass die NSAR unabhängig von der Art der Applikation (oral, rektal, parenteral) nach Resorption systemisch und damit auch am Gastrointestinaltrakt verfügbar sind und dort Ulzera verursachen können. Weiter sind die unzuverlässige Absorption und der lokaltoxische Effekt im Rektum zu bedenken. z Bei Patienten mit Ulkusanamnese sollte generell die Kombination von Glukokortikoiden und NSAR vermieden werden. Andererseits ist bei Auftreten eines Ulkus unter NSAR-Therapie und weiter bestehender Indikation zur antirheumatischen Behandlung die alleinige Therapie mit einem Glukokortikoid bis zu 10 mg/Tag Prednisolonäquivalent angezeigt (siehe Kapitel 5.2). z Alle nichtmedikamentösen Behandlungsmaßnahmen einschließlich der Physio- und Ergotherapie oder orthetischer Versorgung sind zu nutzen. 201 202 z 5 Medikamentöse Therapie z Die Indikation zur Gastroduodenoskopie, inkl. Beurteilung der Dignität von Schleimhautdefekten, besteht – vor Beginn einer NSAR-Therapie bei Patienten mit Ulkusanamnese, – bei klinischem Ulkusverdacht, – zur Verlaufsbeurteilung des manifesten Magenulkus nach 6 und des Duodenalulkus nach 4 Wochen. Hämoccult- oder Röntgenuntersuchungen sind zum Ulkusnachweis unzureichend! Medikamentöse Prophylaxe des NSAR-Ulkus Protonenpumpenhemmer und Misoprostol (2- bis 4-mal 200 lg) schützen Magen und Duodenum vor der Entstehung und den Komplikationen eines Ulkus. Eine medikamentöse Prophylaxe ist angezeigt bei NSAR-Therapie wenn z die Patienten über 60 Jahre alt sind, z eine positive Magen-Darm- und insbesondere Ulkusanamnese oder z eine schwere Allgemeinerkrankung besteht. z Beachte: Misoprostol bessert nicht die NSAR-induzierten Oberbauchsymptome. Dosisabhängig können unter Misoprostol vorübergehend milde Diarrhöen auftreten. In Einzelfällen limitiert die Diarrhöe den Misoprostoleinsatz. Bei Gebärfähigen ist Misoprostol mit kontrazeptiven Maßnahmen zu kombinieren. z H2-Antagonisten in Standarddosen schützen lediglich vor den selteneren NSAR-Duodenalläsionen, nicht aber vor Magenulzera. z Eine Prophylaxe der Dyspepsie ist nicht zu empfehlen. Behandlung der NSAR-Dyspepsie NSAR-assoziierte Oberbauchbeschwerden (Dyspepsie, Bauchschmerzen, Verdauungsstörungen, Sodbrennen, Übelkeit) werden mit Prokinetika, Antacida oder H2-Blockern für ca. 2 Wochen behandelt. Bei Beschwerdepersistenz ist die Gastroskopie indiziert. z Literatur 1. Gabriel SE, Jaakkimainen L, Bombardier C (1991) Risk for serious gastrointestinal complications related to use of nonsteroidal anti-inflammatory drugs. A metaanalysis. Arm Int Med 115:787–796 2. Graham DY, Agrawl NM, Roth SH (1988) Prevention of NSAID-induced gastric ulcer with misoprostol: multicentre double blind, placebo-controlled trial. Lancet 11: 1277–1280 3. Bolten W, Häntzschel H, Hengels KJ, Stockbrügger R (1991) Management der NSAR-assoziierten Gastropathie. Akt Rheumatol 16:171–174 5.1 Nichtsteroidale Antirheumatika z 4. Kneitz C, Tony HP, Kruger K (2006) NSAIDs and COX-2-inhibitors: current status. Internist (Berl) 47:533–540 5. Bolten WW (2005) Recommendations for treatment with nonsteroidal antiinflammatory drugs. MMW Fortschr Med 147:24–27 6. Spiegel BM, Farid M, Dulai GS, Gralnek IM, Kanwal F (2006) Comparing rates of dyspepsia with Coxibs vs NSAID+PPI: a meta-analysis. Am J Med 119:448–536 7. Laine L (2004) Proton pump inhibitor co-therapy with nonsteroidal antiinflammatory drugs – nice or necessary? Rev Gastroenterol Disord 4(suppl 4):S33– 41 203 5.2 Glukokortikoide z 5.2 Glukokortikoide 5.2.1 Allgemeine Hinweise zu Glukokortikoiden z Definition z Glukokortikosteroide werden diejenigen physiologischen Nebennierenrindenhormone genannt, die in erster Linie auf den Glukosestoffwechsel einwirken, also Kortisol und Kortikosteron. z Als Glukokortikoide bezeichnet man die synthetisch hergestellten Abkömmlinge des Kortisol, die heute zur pharmakologischen Therapie verwendet werden. In der ärztlichen Umgangssprache spricht man nur von Kortikoiden. z Wirkungen z Kortikoide wirken in überphysiologischen Dosen verabreicht entzündungshemmend und immunsuppressiv sowie antiödematös. z sie hemmen auch in niedriger Dosis die Gelenkdestruktion bei rheumatoider Arthritis z Neben den bekannten genomischen Wirkungen, deren Wirkungsmaximum nach 6–8 Stunden erreicht wird, sind auch nichtgenomische Effekte gesichert, die sehr hohe Dosen voraussetzen und eine Wirkung in Sekunden bis Minuten auslösen. z Unerwünschte Wirkungen Endogener Hypokortisolismus z Blockade des adrenalen Regelkreises: Nebennierenrindeninsuffizienz, Stressunfähigkeit. Exogener Hyperkortizismus (iatrogenes Cushing-Syndrom) z Bewegungsapparat: Osteoporose, Wachstumsretardierung, Myopathie, Osteonekrose, Sehnenrupturen; z metabolisch: Obesitas, Fettverteilungsstörung, Hyperglykämie, Kalium- und Kalziumverlust, Natriumretention mit Hypervolämie und Hypertonie; z Behinderung der Infektionsabwehr; 205 206 z 5 Medikamentöse Therapie z Haut: Gesichtserythem, Atrophie, Petechien, Striae, Wundheilungsstörungen, Akne, Hirsutismus, Alopezie; z gastrointestinal: Perforation von Dickdarmdivertikeln (keine Ulkusentstehung durch Kortikoidmonotherapie); z Endokrinium: Regel- und Potenzstörungen; z Psyche: Euphorisierung, Depression, Psychose; z Augen: Katarakt, Glaukom. Das Ausmaß unerwünschter Wirkungen hängt ab von z Art des Präparates, z Höhe der Dosierung, z dem Zeitpunkt der Einnahme, z Dauer der Therapie, z individuellen Gegebenheiten wie Grundkrankheit, genetischen Prädispositionen, Begleitkrankheiten, gleichzeitig genommenen Medikamenten, Alter und Geschlecht, Ernährungsgewohnheiten. Wertigkeit der unerwünschten Wirkungen Die meisten unerwünschten Wirkungen bilden sich nach Beendigung der Therapie wieder zurück. Gravierend sind Osteoporose, weshalb bei jeder Langzeittherapie eine dem Knochenstatus (Knochendichtemessung!) angepasste Prophylaxe durchgeführt werden muss, und Wachstumsretardierung bei Kindern, weshalb bei Langzeittherapie alternierende Gabe empfohlen wird. Die Spätkomplikation der aseptischen Knochennekrose kann nur bei frühzeitiger Erkennung konservativ beherrscht werden. z Auswahl des Präparates Alle wirksamen Kortikoide haben die gleiche Pharmakodynamik. Sie unterscheiden sich jedoch in ihrer Wirkungsstärke (s. Tabelle 1) sowie in der PharTabelle 1. Approximative Dosenäquivalenzen für die systemische Therapie Kortikoid Dosis z Prednison/Prednisolon z Prednyliden z 6-Methylprednisolon z Deflazacort z Cloprednol z Fluocortolon z Triamcinolon z Dexamethason z Betamethason 5 mg 6 mg 4 mg 6–9 mg 2,5–5 mg 5 mg 4 mg 0,75 mg 0,75 mg 5.2 Glukokortikoide z Tabelle 2. Pharmakokinetik der verschiedenen Kortikoide. Plasmaeliminationshalbwertszeit bzw. biologische Halbwertszeit der verschiedenen Kortikoide (Approximativwerte, meist Mittelwerte verschiedener Untersuchungen) Plasma t1/2 Biologische t1/2 Charakterisierung z Prednison z Prednisolon z 6-Methylprednisolon z Prednyliden z Deflazacort z Cloprednol 2–3 h 2–3 h 1,5–3 h 2–3 h 3h 2h 18–36 h 18–36 h 18–36 h 18–36 h (?) (?) kurz wirkend z Fluocortolon z Triamcinolon 1,3–2 h 3–5 h 24–48 h 28–48 h mittellang wirkend z Dexamethason z Betamethason 3,5 h 5–7 h 36–72 h 37–72 h lang wirkend makokinetik (s. Tabelle 2), woraus sich das Ausmaß der Hemmwirkung auf den adrenalen Regelkreis ergibt. z Vorsichtsmaßregeln Bei bestimmten Risikogruppen bzw. -situationen sollen folgende Maßnahmen beachtet werden: z florides Ulkus: Therapie mit Protonenpumpenhemmern oder Misoprostol; z Osteoporoserisikogruppen bzw. manifeste Osteoporose: Empfehlungen zur Ernährung und körperlichen Aktivität sowie angepasste medikamentöse Therapie; z latenter oder manifester Diabetes: engmaschige Überwachung, angepasste Einstellung, keine alternierende Therapie; z bakterielle Infekte: gezielte antibiotische Therapie; z alte, nichtaktive TBC: regelmäßige pulmologische Kontrollen, evtl. INH-Prophylaxe; z Bluthochdruck: häufige Kontrollen, optimale medikamentöse Einstellung mit kaliumsparenden Präparaten; z Kinder im Wachstumsalter: alternierende Gabe in der Langzeittherapie; z Glaukom: regelmäßige augenärztliche Überwachung und Therapie. 207 208 z 5 Medikamentöse Therapie z Kontraindikationen Eine systemische Kortikoidtherapie ist kontraindiziert bei z chronisch-aktiven Virushepatitiden, z anderen akuten Virusinfektionen, z systemischen Mykosen, z Parasitosen. z Grundsätzliches zur Dosierung z Die Dosierung richtet sich nach Art und Schwere der Erkrankung und der Reaktion des Patienten. Generell beginnt man mit einer relativ hohen Initialdosis, welche nach Wirkungseintritt kontinuierlich abgebaut wird. z Die Höhe der Initialdosis hängt von der Akuität und Ausbildung des entzündlichen Prozesses ab: Je schwerer und akuter die Krankheit, um so höher, je chronischer der Verlauf, um so niedriger kann die Dosis gewählt werden. z Als Erhaltungsdosis bei chronischen Krankheiten soll die kleinste eben noch wirksame Dosis austitriert werden. Sie ist je nach Krankheit und individueller Situation verschieden, liegt aber meist £ 7,5 mg/die Prednisolon (sog. Lowdose-Therapie). z Bei gleichzeitiger Behandlung mit anderen Medikamenten können Interaktionen auftreten, die eine Änderung der Dosierung erforderlich machen (s. u.). z Die Behandlungsdauer hängt ebenfalls vom Krankheitsbild ab: Akute Krankheiten erfordern meist nur eine kurzzeitige, chronische eine Langzeittherapie. z Initialdosen und ihre Indikationen in der Rheumatologie z Hochdosierte intravenöse Stoßtherapie sog. pulse-Therapie (intravenöse Kurzinfusion von ³ 250 mg Prednisonäquivalent an 1–5, meist 3 Tagen). Diese Therapieform sollte grundsätzlich stationär, ambulant nur bei besonders großer Erfahrung des Therapeuten durchgeführt werden. Als Indikationen gelten: – schwere, fieberhafte, bedrohliche und therapierefraktäre Phasen aller Systemkrankheiten und Systemvaskulitiden, insbesondere bei drohender Erblindung in Folge Riesenzellarteriitis. z Hochdosierte orale Therapie (> 30 bis £ 100 mg Prednisonäquivalent). Sie wird angewandt bei – aktiven Formen der Systemkrankheiten (SLE, PM, DM, Antisynthetasesyndrom, Sjögren-Syndrom, Polychondritis), – aktiven Systemvaskulitiden, – Arteriitis capitis bei Riesenzellarteriitis. z Mittlere Dosierung (> 7,5 bis £ 30 mg Prednisonäquivalent) ist indiziert bei – leichten Verlaufsformen des SLE, – akuter ödematöser Alterspolyarthritis, 5.2 Glukokortikoide z – Polymyalgia rheumatica ohne Hinweis auf Riesenzellarteriitis, – viszeralen Manifestationen der rheumatoiden Arthritis (z. B. Perikarditis, Pleuritis, Pneumonitis), – Uveitis im Zusammenhang mit Spondyloarthritis (s. Kap. 3.3), – anderweitig nicht ausreichend therapeutisch beeinflussbaren reaktiven Arthritiden (cave: Erregerreaktivierung!). z Niedriger Dosisbereich sog. Low-dose-Therapie (Tagesdosis von £ 7,5 mg Prednisonäquivalent) ist indiziert bei – aktiver rheumatoider Arthritis mit schneller Progression insbesondere bei – beginnende aktive rheumatoide Arthritis, – Alterspolyarthritis. z Abbau der Initialdosen z Die Initialdosis soll erst nach deutlich erkennbarem Wirkungseintritt langsam und schrittweise in Abhängigkeit von der jeweiligen Krankheitssituation reduziert werden. Ein streng individuelles Vorgehen ist erforderlich. z Im höher dosierten Bereich kann schneller und in größeren Schritten reduziert werden. z Je niedriger die Dosis wird und je länger die Behandlungszeit, um so kleiner müssen die Schritte und um so größer die Intervalle werden. Ab Tagesdosen von 10 mg Prednisolon Abbau in 1-mg-Schritten alle 2–4 Wochen und ab 6 mg/Tag in 0,5-mg-Schritten alle 1–2 Monate. z Erhaltungsdosis Als Erhaltungsdosis bezeichnet man die kleinste im Einzelfall wirksame Dosis für die Langzeittherapie. Sie wurde früher zwischen 10 und 7,5 mg/Tag Prednisolon angenommen. Heute ist gesichert, dass in der überwiegenden Mehrzahl aller chronisch-entzündlichen Krankheiten eine Dosis um 5 mg/Tag ausreicht, um den erreichten therapeutischen Effekt aufrechtzuerhalten. Diesen sog. Low-dose-Bereich erreicht man allerdings nur bei Abbauschritten von 1 bzw. 0,5 mg in größer werdenden Zeitintervallen (s. o.). Bei schweren Krankheitsbildern, insbesondere bei Systemkrankheiten, ist dieses Ziel erst nach Monaten zu erreichen. z Absetzprozedere z Bei kurzfristiger Therapie (bis zu einer Woche) kann selbst bei hoher Dosierung sofort abgesetzt werden. z Bei einer Behandlungsdauer von etwa 4 Wochen Beendigung der Therapie durch kontinuierliche Dosisreduktion wie oben. 209 210 z 5 Medikamentöse Therapie z Ist wegen einer Komplikation sofortiges Absetzen während einer höher dosierten Therapie nötig: Übergang auf Substitutionsdosen von Hydrokortison (morgens 10 mg, mittags 5 mg, abends 5 mg). z Bei Langzeit-low-dose-Therapie Beendigung in 0,5-mg-Schritten alle 2 Monate. z Einnahmemodus z Bei Dosen von 30 mg/Tag Prednisolon und darunter soll die Tagesdosis grundsätzlich morgens auf einmal eingenommen werden (zirkadiane Therapie). z Die für das Endokrinium noch schonendere alternierende Therapie (Gabe der für 2 Tage nötigen Dosis alle 48 Stunden morgens) ist in der Rheumatologie nur selten durchführbar. Sie eignet sich jedoch für die Langzeitbehandlung chronisch-fibrosierender Erkrankungen. Alternierende Gabe ist auch indiziert bei Kindern im Wachstumsalter, die langfristig mit Kortikoiden behandelt werden müssen. z Bei manchen schweren Krankheitsbildern genügt die einmalige morgendliche Gabe nicht. Dann soll die Dosis gesplittet werden: 2 Drittel morgens, 1 Drittel nachmittags. Der Dosisabbau soll immer bei der zweiten Dosis beginnen. z Die in früheren Jahren vielfach geübte intramuskuläre Injektion einer Kortikoidkristallsuspension als „Depotspritze“ gilt als obsolet. Nachhaltige Störungen des adrenalen Regelkreises und schwere lokale Schäden können die Folge sein. z Interaktionen Änderungen der Anwendung oder Dosierung sind erforderlich bei gleichzeitiger Gabe von z nichtsteroidalen Antirheumatika: Wegen des stark erhöhten Ulkusrisikos möglichst keine gleichzeitige Therapie; wenn unverzichtbar, Kortikoid morgens und kurz wirkendes NSAR abends. z Rifampicin: doppelte Kortikoiddosis, da Kortikoidabbau und -ausscheidung beschleunigt werden. z Hydantoinen und Barbituraten: Dosiserhöhung der Kortikoide entsprechend individueller Austestung. z Diuretika und Laxantien: cave: Kaliumverlust. z Überwachung einer Langzeittherapie Der Patient muss über mögliche unerwünschte Folgen einer Langzeittherapie aufgeklärt sein und sich bei jedem Verdacht auf eine Komplikation sofort melden. Bei Dauertherapie mit über 5 mg/Tag Prednisolon sowie bei gesplitteter Dosierung sollte der Patient einen Kortikoidausweis mit sich führen. 5.2 Glukokortikoide z z Vor Therapiebeginn ist eine vollständige körperliche Untersuchung mit Ausschluss bakterieller Infektionen sowie einer Analyse des Knochenstatus erforderlich. z Im Abstand von 2 Wochen, bei Low-dose-Langzeittherapie alle 1–2 Monate, ist – auf äußere Merkmale von Nebenwirkungen (Gesicht, Gewichtszunahme, Haut) zu achten, – nach abdominellen und Rückenbeschwerden zu fragen, – Blutdruck und Temperatur zu messen. z Alle 3 Monate, bei Low-dose-Langzeittherapie alle 6 Monate, sind angezeigt – Kontrollen von Blutsenkung, Blutbild, Urinstatus, evtl. -kultur, Blutzucker, – augenärztliche Untersuchung von Augeninnendruck, Hornhaut und Linse. z Im Abstand von 12 Monaten sollten eine kardiologische Untersuchung und eine Kontrolle des Fettstoffwechsels durchgeführt werden. z In jährlichen Intervallen soll der Knochenstatus (Knochendichtemessung) überprüft werden. z Bei Beschwerden oder hinweisenden Symptomen sollten Gastroskopie bzw. Röntgenaufnahme des Thorax veranlasst werden. z Ständig ist zu überprüfen, ob die Dosis reduziert oder die Behandlung beendet werden kann. z Literatur Buttgereit F, Da Silva JA, Boers M, Burmester GR, Cutolo M et al (2002) Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann Rheum Dis 61: 718–722 Kaiser H (2000) Corticoide in der Rheumatologie – gestern – heute – morgen. Z Rheumatol 59:75–85 Kaiser H, Kley HK (2002) Cortisontherapie, 11. Aufl. Thieme, Stuttgart 211 5.3.1 Einführung zur Behandlung mit sog. Basistherapeutika z 5.3 Basistherapie 5.3.1 Einführung zur Behandlung mit sog. Basistherapeutika z Synonyma. Remissionsinduzierende, krankheitsmodifizierende („disease modifying antirheumatic drugs“, DMARD), lang- oder langsamwirkende Antirheumatika („long“ bzw. „slow acting antirheumatic drugs“). z Grundsätzliche Regeln Die Behandlung mit Basistherapeutika kann zu teilweisen oder vollständigen Remissionen des klinischen Krankheitsbildes der rheumatoiden Arthritis führen. Es gelten die folgenden Prinzipien: z Basistherapeutika sollten nach sicherer Diagnosestellung so früh wie irgend möglich eingesetzt werden. z Die Wahl des Präparates ist von der entzündlichen Prozessaktivität, der zu erwartenden Prognose und eventuellen Begleitkrankheiten abhängig zu machen. Die Beurteilung der Effektivität einer Basistherapie beruht in erster Linie auf klinischen Untersuchungsergebnissen (Gelenkindex, Beurteilung des funktionellen Vermögens und der Schmerzintensität), in zweiter Linie auf dem Verlauf von BSG und CrP sowie in der Langzeitbeurteilung auf der Röntgenprogredienz. Deshalb ist eine sorgfältige und umfassende Befunddokumentation unter Einschluss der Röntgenaufnahmen von Händen und Vorfüßen unverzichtbar. z Die Wirksamkeit der Basistherapie ist in der Regel erst nach 3 bis 6 Monaten, abhängig von dem eingesetzten Präparat, zu beurteilen. Falls nach diesem Zeitpunkt keine Besserung erkennbar wird (vollständige oder zumindest teilweise Remission), ist die Fortsetzung dieser Behandlung nicht sinnvoll. Die Umstellung auf ein anderes Präparat oder bei persistierender hoher Prozessaktivität eine Kombinationstherapie mit 2 oder 3 Basistherapeutika ist dann ebenso indiziert wie operative Eingriffe (insbesondere präventive Eingriffe in frühen Krankheitsstadien). z Ist die Behandlung mit einem Basistherapeutikum effektiv, sollte zunächst die Begleittherapie reduziert werden (Kortikosteroide, nichtsteroidale Antirheumatika). Danach kann bei fortbestehender Remission die Reduzierung der Basistherapiedosis versucht werden. Absetzversuche sind nur nach sehr sorgfältiger Abwägung und lang dauernder vollständiger Remission zu erwägen. 213 214 z 5.3 Basistherapie z Voraussetzungen für eine Basistherapie sind neben der gesicherten Diagnose – umfassende Aufklärung des Patienten über Risiken und Nebenwirkungen, – engmaschige klinische und Laborkontrollen sowie – die Kooperationsbereitschaft des Patienten. Die Durchführung der Kontrolluntersuchungen durch den Arzt der Primärbetreuung ersetzt nicht die Überwachung der Erkrankung durch den Rheumatologen (s. Kap. 16)! z Fragen der Kontrazeption – ggf. auch bei Männern – müssen berücksichtigt werden. z Der Einsatz von Basistherapeutika ist auch in fortgeschrittenen Stadien indiziert, wenn noch deutliche Zeichen der Krankheitsaktivität vorliegen. z Die Behandlung mit Basistherapeutika muss von physio- und ergotherapeutischen, rheumachirurgischen und rehabilitativen Maßnahmen flankiert werden („Komplextherapie“). Die nachfolgenden Hinweise zu den Einzelsubstanzen wurden gemeinsam von der Kommission „Pharmakotherapie“ der Deutschen Gesellschaft für Rheumatologie und der Projektgruppe „Diagnose- und Therapierichtlinien“ der Arbeitsgemeinschaft der Regionalen kooperativen Rheumazentren in der DGRh erarbeitet. Falls sie zu der Versendung an den behandelnden Arzt gedacht sind, sollten sie z die Anschrift und Telefonnummer der verordnenden Stelle, z die Indikation zur Behandlung und z eine genaue, individuelle Dosisempfehlung enthalten. Ferner ist bei allen immunmodulierenden Behandlungen der Hinweis angebracht, dass die Überwachung nicht der Budgetierung des Labors unterliegt, wenn in der Abrechnung zusätzlich die Ziffer 32023 angegeben ist. 5.3.2 Antimalariamittel z 5.3.2 Antimalariamittel Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Antimalariamitteln Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: [ ] Chloroquin _______________________________________ [ ] Hydroxychloroquin _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie Gewicht (kg) Chloroquin (Tbl. à 250 mg) Chloroquin (Resochinjunior Tbl. à 81 mg) Hydroxychloroquin (Tbl. à 200 mg) 30–39 40–49 50–64 ab 65 1/2 – – 1 – 2 2 1/2 – 1 1 1, jeden 2. Tag 2 2 Die Dosierung von Antimalariamitteln muss so gewählt werden, dass die wesentliche Nebenwirkung, eine Retinopathie, vermieden werden kann. Diese Dosis hängt vom Körpergewicht ab (bei stark Übergewichtigen ist das Idealgewicht zugrunde zu legen); in Bezug zur kumulativen Gesamtdosis besteht nicht. z Wirkungseintritt: Ein Wirkungseintritt ist nach etwa 3 bis 6 Monaten zu erwarten. Wenn nach 6 Monaten keine Besserung eingetreten ist, sollte die Therapie überprüft werden. z Vor Therapie: Augenärztliche Untersuchung. 215 216 5.3 Basistherapie z Überwachungsprogramm während der Therapie In den ersten 4 Monaten alle 14 Tage, danach alle 2 Monate. z – – – Befragung und klinische Untersuchung: Farbsehstörungen, Gesichtsfeldausfälle, Flimmerskotome, Exantheme; Kopfschmerzen, Schwindel, Schlaflosigkeit, Muskelschwäche; gastrointestinale Symptome. z Laborbestimmungen: – Blutbild einschl. Thrombozyten und Differenzialblutbild, bei Bedarf CK. z Augenärztliche Untersuchung: Bei Einhalten der o. g. Maximaldosierungen alle 6 Monate, bei Dosierungen > 4 mg Chloroquin/kg oder >6,5 mg Hydroxychloroquin/kg Körpergewicht alle 4 Monate. Die Überwachung einer immunmodulierenden Behandlung mit Antimalariamitteln ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Indikation zur Unterbrechung einer Therapie mit Antimalariamitteln z Dermatologie z Gastroenterologie z Hämatologie z Ophthalmologie Exanthem schwere gastrointestinale Symptome Leukopenie <3000/ll Granulopenie <2000/ ll Thrombopenie <100 000/ll Retinopathie – sonstige Sehstörungen in Abhängigkeit vom Schweregrad 5.3.2 Antimalariamittel z z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig z Dermatologie z Gastroenterologie Nausea Appetitlosigkeit Diarrhö z Hämatologie z Kardio-/Pulmologie z Neurologie z Ophthalmologie selten Exanthem (vor allem nach Sonnenbestrahlung) Pigmentanomalien Pruritus Verschlechterung einer Psoriasis tox. Leberschaden Thrombozytopenie (sehr selten) Agranulozytose (sehr selten) Panzytopenie (sehr selten) Kardiomyopathie RR-Abfall Kopfschmerzen Schwindel Parästhesien Schlafstörungen Neuromyopathie Provokation von Krampfanfällen (sehr selten) Akkommodationsstörung Korneaeinlagerungen Lichtempfindlichkeit Störung des Farbsehens Retinopathie (sehr selten) z Anmerkung: Mit Ausnahme der Retinopathie sind die genannten ophthalmologischen Nebenwirkungen reversibel, allerdings können sie vor allem zu Behandlungsbeginn die Fähigkeit zur aktiven Teilnahme am Straßenverkehr beeinträchtigen. In aller Regel sind sie trotz Beunruhigung des Patienten kein Grund zum Absetzen. Dies gilt auch für geringe Korneaeinlagerungen. z Kontraindikationen: Augenerkrankungen mit Gesichtsfeldausfällen, Retinopathien, Myastenia gravis, Knochenmarkdepression, Glukose-6-Ph-Dehydrogenasemangel, bekannte Allergie gegen die Substanzen, Stillzeit. Nur unter strenger Indikationsstellung sollten sie verwendet werden bei eingeschränkter Leber- und Nierenfunktion, Porphyrien, Psoriasis, Anfallsleiden, bei gleichzeitiger Einnahme von MAO-Hemmern, in der Schwangerschaft. z Wechselwirkungen mit anderen Medikamenten: Das Risiko für Nebenwirkungen erhöht sich durch die gleichzeitige Einnahme von: Indometacin, MAO-Hemmern, Cimetidin, Metronidazol, Probenecid, Trimethoprim-Sulfamethoxazol und Alkohol. Antimalariamittel vermindern die Ampicillinresorption, erhöhen den Digitalisspiegel und verstärken die Methotrexatwirkung. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org. 217 218 z 5.3 Basistherapie 5.3.3 Sulfasalazin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Sulfasalazin Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Sulfasalazin _______________________________________ z Dosierung: Einschleichend nach folgendem Schema; die Behandlung erfolgt als kontinuierliche Langzeittherapie 1. Woche: 0–0–1 Tbl./Tag 2. Woche: 1–0–1 Tbl./Tag 3. Woche: 1–0–2 Tbl./Tag 4. Woche: 2–0–2 Tbl./Tag Eine schnellere Aufsättigung ist in bestimmten Fällen möglich. Dosisreduktion bei eingeschränkter Nieren- oder Leberfunktion: 2 max. 3 Tbl./Tag z Wirkungseintritt: Ein Wirkungseintritt ist nach 4 bis 12 Wochen zu erwarten. Bei nicht ausreichender Wirkung ist nach 3 Monaten eine Erhöhung auf 3 mal 2 Tbl./Tag möglich. Bei Wirkungslosigkeit auch nach Dosissteigerung sollte das Medikament nach 6 Monaten abgesetzt werden. Überwachungsprogramm während der Therapie In den ersten 3 Monaten alle 14 Tage, vom 4. bis 6. Monat alle 4 Wochen, danach alle 3 Monate. z Befragung und klinische Untersuchung: Exanthem, gastrointestinale/zentralnervöse Symptome, Fieber. z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild, alk. Phosphatase, GPT, Kreatinin, Urinstatus. Die Überwachung einer immunmodulierenden Behandlung mit Sulfasalazin ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. 5.3.3 Sulfasalazin z z Indikation zur Unterbrechung einer Therapie mit Sulfasalazin z Dermatologie Exanthem, Stomatitis z Gastroenterologie stärkere gastrointestinale Beschwerden Hepatitis Cholestase (Cave: ein Anstieg der cholestaseanzeigenden Enzyme ist fast immer durch NSAR, z. B. Diclofenac, bedingt) z Hämatologie Leukopenie < 3000/ll Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplastische Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie!) z Nephrologie anhaltende Proteinurie > 0,3 g/l, Kreatininanstieg, Hämaturie zSonstiges pulmonale Infiltrate, stärkere neurologische Beschwerden oder allergische Symptome, Schwangerschaft, Kinderwunsch z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig selten z Dermatologie Exanthem Pruritus Erythema exsudativum multiforme Stevens-Johnson-Syndrom Lyell-Syndrom Photosensibilität z Gastroenterologie Nausea abdominelle Schmerzen Appetitlosigkeit Cholestase Hepatitis Pankreatitis Diarrhöen z Hämatologie Hyperchromasie Thrombopenie Leukopenie (Agranulozytose) hyperchrome/hämolytische Anämie Met-/Sulfhämoglobinämie z Pulmologie fibrosierende Alveolitis, eosinophiles Infiltrat z Nephro-/Urologie Oligospermie reversible Fertilitätsstörung beim Mann Proteinurie, nephrotisches Syndrom interstitielle Nephritis Hämaturie/Kristallurie z Neurologie Kopfschmerzen Schwächegefühl Müdigkeit Polyneuropathie Schlafstörungen Tinnitus Schwindel, Depressionen, Psychosen z Sonstiges Arthralgien Serumkrankheit Quincke-Ödem Fieber 219 220 z 5.3 Basistherapie z Anmerkungen: Insgesamt ist die Inzidenz der schweren Nebenwirkungen gering. – Die Spermatogenese normalisiert sich in der Regel nach Absetzen innerhalb von 3 Monaten. Eine Beeinflussung der Potenz oder eine teratogene Schädigung sind nicht bekannt. z Kontraindikationen: Überempfindlichkeit gegen Sulfonamide oder Salizylate, höhergradige Nieren- oder Leberfunktionsstörungen, Ileus, Knochenmarkdepression, manifester Mangel an Glukose-6-phosphat-Dehydrogenase, akut intermittierende Porphyrie, Erythema exsudativum multiforme. Eine sorgfältige Risikoabwägung bei Schwangerschaft besonders im ersten Trimenon ist erforderlich. z Wechselwirkungen mit anderen Medikamenten: Sulfasalazin vermindert die Folsäureabsorption. Eisenpräparate und Sulfasalazin bilden Chelate und behindern wechselseitig die Resorption. Antibiotika und Anionenaustauscher verringern die Resorption von Sulfasalazin. Eine Wirkungsverstärkung von Cumarinderivaten, Sulfonylharnstoffen, Phenytoin und Methotrexat und eine Wirkungsabschwächung von Herzglykosiden ist für die Gruppe der Sulfonamide insgesamt beschrieben. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.3.4 Orale Goldsalztherapie z 5.3.4 Orale Goldsalztherapie Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Orale Goldsalztherapie Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Auranofin (Goldgehalt 29%) _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie Auranofin 2-mal 1 Tbl./Tag. Bei Frauen sollte während der Goldbehandlung eine Kontrazeption erfolgen. z Wirkungseintritt: Nach frühestens 3 Monaten. Wenn nach 6 Monaten keine Besserung eingetreten ist, sollte die Behandlung nicht fortgesetzt werden. Überwachungsprogramm während der Therapie In den ersten 3 Monaten alle 14 Tage, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Exanthem, Stomatitis, Diarrhö, Luftnot, Husten, Blutungen. z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild, Gamma-GT, alk. Phosphatase, GPT, Kreatinin, Urinstatus. Die Überwachung einer immunmodulierenden Behandlung mit Auranofin unterliegt nicht der Laborbudgetierung, wenn in der Abrechnung zusätzlich die Ziffer 32023 angegeben ist. 221 222 z 5.3 Basistherapie z Indikation zur Unterbrechung einer Therapie mit Auranofin z Dermatologie z Gastroenterologie z Hämatologie z Nephrologie z Sonstiges Exanthem, Stomatitis Transaminasenanstieg um das 3 fache, schwere Diarrhön, Enterokolitis Leukopenie < 3000/ll Granulopenie < 2000/ll persistierende Eosinophilie > 12% Thrombopenie < 100 000/ll Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie!) Kreatininanstieg, Zylindurie, Hämaturie, anhaltende Proteinurie > 0,3 g/l schwerer Infekt, Schwangerschaft bzw. Kinderwunsch z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) z Dermatologie z Gastroenterologie häufig selten Dermatitis Stomatitis Pruritus Diarrhö Nausea Alopezie z Hämatologie z Nephrologie z Ophthalmologie z Pulmologie Enterokolitis Cholestase path. Leberwerte Thrombopenie Granulopenie Eosinophilie Anämie Proteinurie Konjunktivitis Bronchiolitis Lungenfibrose z Kontraindikationen: Knochenmarkdepression jeglicher Genese, Schwangerschaft und Laktation, Polyarthritiden bei Kollagenosen (z. B. Sklerodermie, systemischer Lupus erythematodes, Vaskulitiden), schwere Leber- und Niereninsuffizienz, schwere Allgemeinerkrankungen, Colitis ulcerosa, Schwermetallallergie, bekannte Goldallergie. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.3.5 Parenterale Goldtherapie z 5.3.5 Parenterale Goldtherapie Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Parenterale Goldtherapie Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Aurothiomalat (Goldgehalt 46%) _______________________________________ z Dosierung (Standardschema): Die Behandlung erfolgt als kontinuierliche Langzeittherapie. Sog. Goldkuren werden nicht mehr durchgeführt. Aufsättigungsphase Erhaltungstherapie 1. Woche 2. Woche 3. bis ... Woche ab ... 2. Woche 10 mg (4,6 mg) 20 mg (9,2 mg) 50 mg (23 mg) 50 mg jede 2. Woche (23 mg) z Art der Anwendung: Injektion nur intramuskulär (tief intraglutäal); Ampullen nicht erwärmen. Vor Gebrauch die Ampullen kräftig schütteln. Zur Therapiekontrolle sollte der Patient einen Goldpass erhalten, in dem die Einzel- und die Gesamtdosis und die Kontrolluntersuchungen eingetragen werden. Während der Goldtherapie sollte bei Frauen eine Kontrazeption erfolgen. z Wirkungseintritt: Nach frühestens 3 Monaten, spätestens nach 6 Monaten. Wenn nach 6 Monaten keine Besserung eingetreten ist, sollte die Behandlung wegen Wirkungslosigkeit beendet werden. 223 224 z 5.3 Basistherapie Überwachungsprogramm während der Therapie In den ersten 3 Monaten alle 14 Tage, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Pruritus, Stomatitis, Metallgeschmack, Blutungen, Diarrhöen. z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild, Gamma-GT, alk. Phosphatase, GPT, Kreatinin, Urinstatus. Die Überwachung einer immunmodulierenden Behandlung mit parenteralem Gold ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Indikation zur Unterbrechung einer Therapie mit parenteralem Gold z Dermatologie z Gastroenterologie z Hämatologie z Nephrologie z Sonstiges Exanthem, Stomatitis Hepatitis, Enterokolitis Leukopenie < 3000/ll persistierende Eosinophilie > 12% Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplast. Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie!) anhaltende Proteinurie > 0,3 g/l Zylindurie, Hämaturie pulmonale Infiltrate, schwerer Infekt 5.3.5 Parenterale Goldtherapie z z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) z Dermatologie häufig selten Dermatitis Stomatitis Pruritus Alopezie Chrysiasis Photosensibilität? Diarrhö Enterokolitis cholestatische Hepatitis path. Leberwerte Thrombopenie Granulopenie Anämie aplast. Anämie (hohe Letalität) Anaphylaxie Synkope Bronchiolitis Lungenfibrose Hämaturie neph. Syndrom Niereninsuffizienz Konjunktivitis Iritis Korneaulzera periphere Neuritis Kopfschmerzen z Gastroenterologie z Hämatologie Eosinophilie z Kardio-/Pulmologie z Nephrologie Proteinurie z Ophthalmologie Ablagerungen Kornea/Linse bei Golddosis > 1500 mg (harmlos) z Sonstiges Metallgeschmack z Anmerkung: Nach i.m. Gabe von Aurothiomalat kann es zu Kreislaufreaktionen (Blutdruckabfall, Übelkeit, Erbrechen, Flush) kommen. z Kontraindikationen: Knochenmarkdepression jeglicher Genese, Schwangerschaft und Laktation, Polyarthritiden bei Kollagenosen (z. B. Sklerodermie, SLE, Vaskulitiden), schwere Leber- und Niereninsuffizienz, schwere Allgemeinerkrankungen, Colitis ulcerosa, Schwermetallallergie, bek. Goldallergie, Blutungsneigung und Antikoagulationstherapie (i. m. Injektionen). z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 225 226 z 5.3 Basistherapie 5.3.6 D-Penicillamin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit D-Penicillamin Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: D-Penicillamin (150/300 mg Tbl.) _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie. Zur Vermeidung unerwünschter Wirkungen ist zu Beginn der Therapie eine langsame Dosissteigerung zu empfehlen. 1. und 2. Woche: 150 mg D-Penicillamin pro Tag 3. und 4. Woche: 300 mg D-Penicillamin pro Tag 5. und 6. Woche: 450 mg D-Penicillamin pro Tag 7. bis 16. Woche: 600 mg D-Penicillamin pro Tag Die individuelle tägliche Erhaltungsdosis liegt i. A. bei 450–600 mg in der Dauertherapie. Eine Dosissteigerung auf 900 mg D-Penicillamin pro Tag ist bei mangelndem Effekt möglich. z Art der Anwendung: Die Einnahme sollte zur besseren Resorption über den Tag verteilt 30 bis 60 Minuten vor den Mahlzeiten und unabhängig von anderen Medikamenten erfolgen. z Kontrazeption: Bei Frauen ist eine sichere Kontrazeption angezeigt. z Wirkungseintritt: Wirkungseintritt frühestens nach 3 Monaten. Besteht nach 6 Monaten keine Besserung, sollte die Therapie überprüft werden. 5.3.6 D-Penicillamin z Überwachungsprogramm während der Therapie In den ersten 3 Monaten alle 14 Tage, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Exanthem, Muskelschwäche (Doppelbilder), Blutungen, Geschmacks-/Sehstörungen, Stomatitis. z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild, alk. Phosphatase, GPT, Kreatinin, Urinstatus. Die Überwachung einer immunmodulierenden Behandlung mit D-Penicillamin ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Indikation zur Unterbrechung einer Therapie mit D-Penicillamin z Dermatologie z Hämatologie z Nephrologie z Immunologie Dermatitis, ausgeprägte Stomatitis, Pemphigus Leukopenie < 3000/ll Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplast. Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie!) Kreatininanstieg, Hämaturie, Zylindurie, anhaltende Proteinurie > 0,3 g/l Myasthenie, Lupus erythematodes, Polymyositis, Goodpasturesyndrom, Lyell-Syndrom 227 228 z 5.3 Basistherapie z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig selten z Dermatologie Exanthem Stomatitis Pruritus z Gastroenterologie Übelkeit Erbrechen z Hämatologie Thrombopenie z Immunologie Myasthenie Dermatitis Epidermiolyse Pemphigus Gingivitis Alopezie Diarrhö Cholestase gastrointestinale Blutung Eosinophilie Leukopenie Granulopenie hämolytische Anämie syst. Lupus erythematodes Goodpasturesyndrom Polymyositis Sicca-Syndrom Alveolitis Bronchitis Hämaturie nephrotisches Syndrom Niereninsuffizienz Tinnitus Polyneuropathie Fieber Mammahyperplasie Polyarthralgien z Pulmologie z Nephrologie Proteinurie z Neurologie Hypo-/Ageusie z Sonstiges z Anmerkungen: Am häufigsten wird eine Proteinurie 6 bis 9 Monate nach Therapiebeginn beobachtet. Hämatologische Nebenwirkungen treten oft nach einer Dosiserhöhung auf. z Kontraindikationen: Knochenmarkdepression, Niereninsuffizienz, Schwangerschaft und Laktation, bekannte Goldnephropathie, systemischer Lupus erythematodes. z Wechselwirkungen mit anderen Medikamenten: Die Einnahme von Antacida kann die Resorption verschlechtern. Eine Senkung des Digoxinspiegels ist möglich, sodass ggf. eine Kontrolle erfolgen sollte. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.3.7 Methotrexat z 5.3.7 Methotrexat Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Methotrexat Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Methotrexat _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie ____ mg Methotrexat p.o. 1-mal pro Woche unabhängig von den Mahlzeiten ____ mg Methotrexat i.v., s.c. oder i.m. 1-mal pro Woche. Bei älteren Menschen empfiehlt sich zu Beginn eine niedrige Dosierung mit vorsichtiger Dosiserhöhung und Anpassung an die Nierenfunktion. z Kontrazeption: Bei Frauen muss während der Methotrexatbehandlung und bis zu 3 Monaten nach Therapieende eine sichere Kontrazeption erfolgen. Auch Männer dürfen während der Behandlung mit Methotrexat und bis zu 3 Monate nach Therapieende keine Kinder zeugen. z Wirkungseintritt: Nach ca. 4 bis 8 Wochen ist mit einem Eintritt der Wirkung zu rechnen. Wenn nach 4 Monaten trotz Dosissteigerung bis auf 15–25 mg/Woche keine Wirkung eingetreten ist, sollte die weitere Behandlung überprüft werden. Nach Absetzen von Methotrexat kann ein Krankheitsschub auftreten. Überwachungsprogramm während der Therapie In den ersten 4 Wochen wöchentlich, im 2. und 3. Monat alle 14 Tage, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Exanthem, Stomatitis, gastrointestinale Symptome, Fieber, Luftnot, Husten (cave: Pneumonitis), Blutungen. z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild Gamma-GT, alk. Phosphatase, GPT, Kreatinin. 229 230 z 5.3 Basistherapie Die Überwachung einer immunmodulierenden Behandlung mit Methotrexat ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Indikation zur Unterbrechung einer Therapie mit Methotrexat z Dermatologie z Gastroenterologie z Hämatologie z Nephrologie z Pulmologie z Sonstiges Exanthem, Stomatitis Transaminasenanstieg über das 3 fache der Norm, histologisch nachgewiesene fortschreitende Leberfibrose oder Leberzirrhose, Cave: ein Anstieg der cholestaseanzeigenden Enzyme ist fast immer durch NSAR (z. B. Diclofenac) bedingt Leukopenie < 3000/ll Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplast. Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie!) Kreatininanstieg Pneumonitis, bei akuter Dyspnoe und unproduktivem Husten sofortige Abklärung erforderlich! Schwere Infektionen, Schwangerschaft bzw. Kinderwunsch Vor einer Operation ist eine Therapieunterbrechung nicht zwingend erforderlich. Nehmen Sie Kontakt mit dem behandelnden Rheumatologen auf. Nach Absetzen des Methotrexat kann ein Krankheitsschub auftreten. z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig selten z Dermatologie Stomatitis Haarausfall z Gastroenterologie Übelkeit Erbrechen Transaminasenanstieg Leukopenie Anämie Exanthem Vaskulitis Photosensibilität Leberfibrose/-zirrhose Verzögerung der Ulkusheilung, ggf. Ulkuskomplikationen Leukopenie/Granulopenie (makrozytäre) Anämie Thrombopenie Pneumonitis Nierenfunktionsstörung Oligospermie Fieber Kopfschmerzen Konzentrationsstörungen Depression Rheumaknoten z Hämatologie z Pulmologie z Urogenital z Sonstiges teratogen Abort vermehrte Infektanfälligkeit 5.3.7 Methotrexat z z Anmerkungen: Übelkeit und Erbrechen lassen sich vermeiden, wenn das Medikament zur Nacht eingenommen wird. Häufig werden parenterale Gaben besser vertragen als orale. Zur Verringerung von Nebenwirkungen empfiehlt sich die Gabe von 5 mg Folsäure einen Tag nach der Methotrexatgabe. Bei Leukozytensturz wirkt Folinsäure in hoher Dosis als Antidot zu Methotrexat. z Kontraindikationen: Allergie gegen Methotrexat, Gravidität bzw. Kinderwunsch, ungenügende Kontrazeption, aktive Lebererkrankung, Ulzera des Magen-Darm-Traktes, Niereninsuffizienz, Alkoholabusus, Knochenmarkdepression, schwerer Diabetes mellitus bei Adipositas, schwere Allgemeinerkrankung, Unzuverlässigkeit des Patienten. z Wechselwirkungen mit anderen Medikamenten: indirekte Dosiserhöhung u. a. durch Barbiturate, Phenylbutazon, andere nichtsteroidale Antirheumatika, Phenytoin, Salizylsäure, Sulfonamide und Sulfonamidkombinationen (Trimethoprim/Sulfametoxazol, Sulfasalazin), Tranquilizer, Penicillin, Insulin, Tetrazykline. Wirkungsabschwächung durch nicht-resorbierbare Antibiotika, Allopurinol. z Sonstiges: Eine aktive Immunisierung sollte während der Therapie mit Methotrexat nicht durchgeführt werden. Alkohol sollte während der MTX-Behandlung vermieden werden. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 231 232 z 5.3 Basistherapie 5.3.8 Azathioprin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Azathioprin Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Azathioprin _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie ____-mal 1 Tbl. pro Tag (1 Tbl.= 25 mg), entsprechend ____ mg als Tagesdosis. ____-mal 1 Tbl. pro Tag (1 Tbl.= 50 mg), entsprechend ____ mg als Tagesdosis. z Dosierungsanpassung: Keine gleichzeitige Therapie mit Allopurinol! Sollte diese jedoch dringend erforderlich sein, ist eine Dosisreduktion für Azathioprin um 75% erforderlich. Bei Verträglichkeitsproblemen kann die Bestimmung der Thiopurin-S-Methyltransferase (TPMT) sinnvoll sein. Vor Beginn der Therapie ist eine solche Bestimmung nur in Ausnahmefällen angezeigt. Dosisreduktion bei eingeschränkter Nierenfunktion: Bei einer Kreatininclearance < 20 ml/min maximal 1,5 mg/kg KG, bei Werten > 20 ml/min ist keine Dosisreduktion notwendig. z Kontrazeption: Bei Frauen sollte während der Behandlung mit Azathioprin und bis zu 6 Monaten nach Therapieende eine sichere Kontrazeption erfolgen. Auch Männer dürfen während der Behandlung und bis zu 6 Monaten nach Therapieende keine Kinder zeugen. z Wirkungseintritt: Frühestens nach 4 bis 8 Wochen. Wenn nach 3 bis 6 Monaten keine Wirkung eingetreten ist, sollte die Behandlung überprüft werden. 5.3.8 Azathioprin z Überwachungsprogramm während der Therapie In den ersten 2 Monaten alle 8 bis 14 Tage, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Exanthem, gastrointestinale Symptome, Fieber, Infekt, Blutungen. z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild, Gamma-GT, alk. Phosphatase, GPT, Kreatinin, Urinstatus. Die Überwachung einer immunmodulierenden Behandlung mit Azathioprin ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungschein angegegeben wird. z Indikation zur Unterbrechung einer Therapie mit Azathioprin z Dermatologie z Gastroenterologie z Hämatologie z Sonstiges Exanthem Transaminasenanstieg um das 3fache, Ikterus, Pankreatitis Leukopenie < 3000/ll Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplast. Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie bzw. (bei SLE) zur Immunthrombozytopenie!) pulmonale Infiltrate, schwerer Infekt, Azathioprinfieber Schwangerschaft bzw. Kinderwunsch Nach Absetzen der Therapie mit Azathioprin kann ein Krankheitsschub auftreten. z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig z Dermatologie z Gastroenterologie z Hämatologie Übelkeit Erbrechen Diarrhö Leukopenie Anämie z Kardio-/Pulmologie z Sonstiges Infektion Arzneimittelfieber selten Exanthem Haarausfall akute Pankreatitis Ikterus Erhöhung der Leberenzyme Panzytopenie Thrombopenie Makrozytose megaloblastäre Anämie akute Alveolitis Blutdruckabfall Herzrhythmusstörungen Myalgie Arthralgie 233 234 z 5.3 Basistherapie z Spätfolgen: Nach den bisherigen Untersuchungen zur Frage der Kanzerogenität von Azathioprin scheint ein leicht erhöhtes Risiko für das Auftreten maligner Lymphome und Leukämien vorzuliegen. z Kontraindikationen: Schwere Leber-, Nieren- und Knochenmarkschäden, bekannte Allergie gegen Azathioprin und/oder 6-Mercaptopurin (wirksamer Metabolit des Azathioprin), Infektionserkrankung (Tbc, akute/chron. bakterielle oder virale Infekte, Mykosen), Gravidität bzw. Kinderwunsch, Laktation. z Wechselwirkungen mit anderen Medikamenten: Die Kombination mit Allopurinol (Xanthinoxidasehemmer) sollte vermieden werden. Wenn therapeutisch zwingend notwendig, muss die Dosis von Azathioprin auf 25% der üblichen Menge reduziert werden (besser: Kombination vermeiden). Die Wirkung polarisierender Muskelrelaxanzien (z. B. Tubocurarin, Pancuronium) kann aufgehoben sein. Die Wirkung von Suxamethonium kann verstärkt sein. Durch Sulfamethoxazoltrimethoprim (z. B. Bactrim®) kann die Wirkung von Azathioprin verstärkt sein. Ferner kann die gerinnungshemmende Wirkung von Warfarin inhibiert werden. z Sonstiges: Eine aktive Immunisierung mit Lebendimpfstoffen sollte während der Therapie mit Azathioprin nicht durchgeführt werden. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org. 5.3.9 Leflunomid z 5.3.9 Leflunomid Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Leflunomid Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Leflunomid _______________________________________ z Dosierung: 1. ___ Tag 100 mg/Tag ab dem ___ Tag empfehlen wir bei Ihrer/m Patient/in eine Einnahme von ___ mg/Tag. Die Einnahme ist jederzeit möglich, die Resorption von Leflunomid wird durch gleichzeitige Nahrungsaufnahme nicht beeinträchtigt. z Wirkungseintritt: Meistens nach 4 bis 6 Wochen. Wenn nach 4 Monaten noch keine Wirkung eingetreten ist, sollte die Indikation zur weiteren Behandlung überprüft werden. Überwachungsprogramm während der Therapie In den ersten 6 Monaten im Abstand von 2 Wochen, danach alle 4 bis 8 Wochen. Bei Grenzwerten sind engmaschigere Kontrollen erforderlich. z Befragung und klinische Untersuchung: – Blutdruck, Hautveränderungen, gastrointestinale Befunde, Gewichtsabnahme. z Laborbestimmungen: – Blutbild einschl. Differenzialblutbild und Plättchenzahl, GOT und GPT, AP, GGT, Kreatinin. 235 236 z 5.3 Basistherapie Die Überwachung einer immunmodulierenden Behandlung mit Leflunomid ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Kontraindikationen: Schwangerschaft und Kinderwunsch! (wirksame Kontrazeption erforderlich!), Stillzeit, Gesamtleukozytenzahl <3500 bzw. Granulozyten <2500 und Thrombozyten <100 000 (falls nicht Folge der Systemerkrankung), schwere Infektionen, schwerer Immundefekt, ausgeprägter Leberschaden, schwere Niereninsuffizienz, schwere Hypoproteinämie, schwer einstellbarer Hypertonus. Bei Absetzen der Medikation sollte unbedingt überlegt werden, ob eine schnelle Elimination gewünscht wird. Diese wird mittels eines der unten genannten Eliminationsverfahren durchgeführt. z Indikation zur Unterbrechung einer Therapie mit Leflunomid z Hämatologie z Gastroenterologie < 2500 < 1500 absolut < 800 und/oder < 80 000 absolut bzw. Abfall um mehr als 100 000 vom Ausgangswert Transaminasen (GOT/GPT) > 3fache der Norm Leukozytopenie Granulozytopenie Lymphozytopenie Thrombozytopenie Vor einer Operation ist eine Therapieunterbrechung nicht zwingend erforderlich. Bitte nehmen Sie ggf. Kontakt mit dem behandelnden Rheumatologen auf. z Mögliche unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig z Gastroenterologie z Hämatologie z Pulmologie z Neurologie z Kardiologie z Dermatologie z Allergische Reaktionen z Sonstiges Durchfall, Übelkeit, Erbrechen, Bauchschmerzen, Mundulzera, erhöhte Leberparameter Leukozytopenie Kopfschmerzen, Schwindel, Asthenie Hypertonie Ekzem, verstärkter Haarausfall Hautausschlag, Juckreiz Gewichtsverlust Mutagenität, Teratogenität (beides im Tierversuch) selten Anämie; sehr selten Panzytopenie Interstitielle Lungenerkrankung sehr selten Stevens-Johnson-Syndrom Nesselsucht z Wechselwirkungen mit anderen Medikamenten: Die gleichzeitige Gabe von Aktivkohle oder Colestyramin zu Leflunomid sollte (außer zur Elimination) vermieden werden, da dies zu einer Abnahme des Wirkspiegels von Leflunomid führt. Bei der Einnahme von Medikamenten, die ebenfalls wie Leflunomid über das Cytochrom P 450 5.3.9 Leflunomid z 2C9 metabolisiert werden, wie z. B. Cimetidin, Rifampicin, kann eine Erhöhung des Wirkspiegels von Leflunomid auftreten. Es sind keine klinisch relevanten Wechselwirkungen mit oralen Kontrazeptiva, NSAR und Glukokortikoiden bekannt. Bei kurz zurückliegender oder gleichzeitiger Gabe von Leflunomid und hepato- bzw. hämatotoxischen Arzneimitteln sowie bei Einnahme solcher Arzneimittel nach einer Leflunomidtherapie können verstärkte Nebenwirkungen auftreten. Leflunomid kann die Marcumarwirkung erheblich verstärken, engmaschige Kontrollen sind insbesondere zu Beginn einer Leflunomidtherapie erforderlich. z Schwangerschaft: Aufgrund der langen Halbwertszeit muss vor einer geplanten Schwangerschaft die Leflunomidtherapie 2 Jahre beendet sein oder ein Eliminationsverfahren (s. u.) durchgeführt werden. Bei bereits eingetretener Schwangerschaft ist ein sofortiger Therapieabbruch und eine Elimination (s. u.) empfohlen. Da es bereits zu Fruchtschäden gekommen sein kann, sollte dann auch ein Schwangerschaftsabbruch erwogen werden. Obwohl es keine spezifischen Daten gibt, sollten Männer unter der Behandlung mit Leflunomid keine Kinder zeugen (sichere Kontrazeption!). Bei Kinderwunsch ist wie bei einer geplanten Schwangerschaft zu verfahren. z Eliminationsverfahren: Gabe von Colestyramin (3-mal 8 g/Tag über 11 Tage) oder Aktivkohle (4-mal 50 g/Tag über 11 Tage). Nach Beendigung des Auswaschverfahrens und noch einmal nach 14 Tagen muss der Serumspiegel des aktiven Metaboliten von Leflunomid (A771726) bestimmt werden. (Der Test wird von der Herstellerfirma kostenlos angeboten. Die Kontaktadresse entnehmen Sie bitte der Packungsbeilage.) Liegen beide Werte unter 0,02 mg/l, empfiehlt es sich nochmals 3 Monate zu warten, um ein Risiko für den Fetus auszuschließen. z Sonstiges: Eine aktive Immunisierung mit Lebendimpfstoffen sollte während der Therapie mit Leflunomid nicht durchgeführt werden. Alkohol sollte während der Behandlung vermieden werden. z Bei weiteren Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 237 238 z 5.3 Basistherapie 5.3.10 Ciclosporin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Ciclosporin Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Ciclosporin _____________________________ [ ] Gelatinekapseln [ ] Trinklösung z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie. 2-mal ________ mg/Tag. z Dosisanpassungen können unter Therapie erforderlich werden. Bei Kreatininanstieg um >30% des Ausgangswertes ist eine Dosisreduktion um 25%, bei arterieller Hypertonie eine Dosisreduktion oder ein Therapieversuch mit Ca-Angonisten möglich. z Kontrazeption: Ciclosporin wirkt nicht teratogen. Über die Sicherheit der Anwendung bei Schwangeren liegen keine ausreichenden Erfahrungen vor. z Wirkungseintritt: Nach ca. 4 bis 8 Wochen ist mit einem Eintritt der Wirkung zu rechnen. Wenn nach 6 Monaten keine Wirkung eingetreten ist und für 3 Monate mit der maximalen Dosis behandelt wurde, sollte die weitere Behandlung beendet werden. Überwachungsprogramm während der Therapie In den ersten 2 Monaten alle 1 bis 2 Wochen, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Hypertrichose, Gingivahyperplasie, Blutdruckkontrolle, Tremor, Parästhesien, gastrointestinale Beschwerden. z Laborbestimmungen: Blutbild einschl. Thrombozyten, alk. Phosphatase, GPT, Kreatinin, Kalium, Urinstatus. 5.3.10 Ciclosporin z Die Überwachung einer immunmodulierenden Behandlung mit Ciclosporin ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Indikation zur Unterbrechung einer Therapie mit Ciclosporin z Dermatologie z Gastroenterologie z Nephrologie z Neurologie ausgeprägte Hypertrichose oder Gingivahyperplasie Leberfunktionsstörung diast. RR > 95 mmHg Kreatininanstieg > 130% des Wertes vor Therapie Tremor, Parästhesien z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) z Dermatologie z Gastroenterologie häufig selten Hypertrichose Gingivahyperplasie Nausea Inappetenz Erbrechen Durchfall Leberfunktionsstörung allergisches Exanthem z Hämatologie z Nephrologie z Neurologie z Sonstiges Niereninsuffizienz RR-Anstieg Tremor Müdigkeit Parästhesien Pankreatitis Anämie Thrombopenie Hyperkaliämie Hypomagnesiämie Kopfschmerzen Konvulsionen reversible Dys-/Amenorrhö Myopathie Ödeme Gewichtzunahme Hyperlipidämie Hyperurikämie Infekt-, Lymphom- und Malignomrisiko z Kontraindikationen: Allergie gegen Ciclosporin, floride Infekte, Malignome (auch anamnestisch), unkontrollierte arterielle Hypertonie, Leber- und Nierenfunktionsstörung. z Wechselwirkungen mit anderen Medikamenten: Vorsicht bei Kombination mit anderen Immunsuppressiva oder nephrotoxischen Substanzen (Aminoglykoside, Amphotericin B, Ciprofloxazin, Melphalan, Trimethoprim, NSAR). z Erhöhung des Blutspiegels durch Ketoconazol, Makrolidantibiotika, Doxycyclin, orale Kontrazeptiva, Propafenon, Ca-Antagonisten. 239 240 z 5.3 Basistherapie z Erniedrigung des Blutspiegels durch Barbiturate, Carbamazepin, Phenytoin, Metamizol, Rifampicin, Nafcillin, i.v. Sulfadimidin und Trimethoprim. z Sonstiges: Eine aktive Immunisierung sollte während der Therapie mit Ciclosporin nicht durchgeführt werden. Dieses Medikament enthält Alkohol! z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.3.11 Cyclophosphamid z 5.3.11 Cyclophosphamid Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Cyclophosphamid Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Cyclophosphamid _______________________________________ z Dosierung: [ ] CYC-Dauertherapie („FAUCI-Schema“): Dosis: 2 mg/kg/Tag (Standard-„FAUCI-Schema“). Bei foudroyanten Kranheitsverläufen kann die Dosis für einige Tage bis wenige Wochen auf 3–4 mg/kg/d (intensiviertes „FAUCI-Schema“) gesteigert werden mit dauerhafter Leukozytensuppression um 4000/ll (CYC-Dosis nach Leukozyten, große Dosissprünge meiden). [ ] CYC-Bolustherapie („AUSTIN-Schema“): Dosis: 15–20 mg/kg als Infusion mit reichlich parenteraler Flüssigkeitszufuhr und parenteral Uromitexan (Mesna) nach 0, 4. und 8. Stunde. Der Abstand zwischen 2 Boli beträgt i. A. 3 Wochen. Nach jedem Bolus ist zwischen dem 8. und 12. Tag mit einem Leukozytenabfall zu rechnen (Nadir), der unbedingt dokumentiert werden muss. Hiervon hängt die Dosis des nächstfolgenden Bolus ab. z Anmerkungen: Eine erhöhte CYC-Empfindlichkeit besteht bei eingeschränkter Nierenfunktion und im höheren Lebensalter. Zur Therapiekontrolle müssen fortlaufend die tägliche CYC-Dosis und das Blutbild dokumentiert werden (z. B. Therapiepass). Auf eine ausreichende Trinkmenge (mindestens 2–3 l/Tag!) und tägliche Cystitisprophylaxe mit Uromitexan® (Mesna) ist bei der Dauer- und Bolustherapie zu achten: Mesnadosis: 60% der CYC-Dosis als bioverfügbares Mesna (orale Resorption = 50%!). Dies entspricht bei der CYC-Dauertherapie einer dosisgleichen (mg) Mesnaprophylaxe (1/2 morgens, 1/2 abends). Bei der CYC-Bolustherapie sollte die Mesnadosis auf 3 Tagesdosen – Stunde 0, 4 und 8 – verteilt werden. (Cave: seltene, schwere Mesnaallergie bei Autoimmunkrankheiten). 241 242 z 5.3 Basistherapie z Kontrazeption: Während und über die CYC-Therapie hinaus ist eine zuverlässige Kontrazeption notwendig. z Wirkungseintritt: Bei der CYC-Dauertherapie nach ca. 2–4 Wochen, bei der CYCBolustherapie ab 2.–3. Bolus. Überwachungsprogramm während der Therapie CYC-Dauertherapie: __-mal/Woche BB (Therapiepass) __-mal/Woche Urinstatus/-sediment CYC-Bolustherapie: BB am 8., 10. und 12. Tag nach der Bolusgabe z Befragung und klinische Untersuchung: Infektzeichen (cave: Krankheitsaktivität), cystitische Beschwerden. Die Überwachung einer immunmodulierenden Behandlung mit Cyclophosphamid unterliegt nicht der Laborbudgetierung, wenn in der Abrechnung zusätzlich die Ziffer 32023 angegeben ist. z Indikation zur Unterbrechung einer Therapie mit Cyclophosphamid Kontaktaufnahme mit Tel. z Hämatologie z Urologie z Sonstiges Leukopenie < 3000/ll Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplast. Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie!) nicht-glomeruläre Hämaturie Zystitis Infektion z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig z Dermatologie z Gastroenterologie z Hämatologie Leukopenie MCV-Anstieg z Pulmologie z Urologie z Sonstiges Infekte (cave: begleitend Prednisolon!) dauerhafte Infertilität Teratogenität selten Haarausfall Übelkeit Leberwerterhöhung Thrombopenie myelodysplastisches Syndrom Lungenfibrose hämorrhagische Zystitis Blasenkarzinom Karzinogenität z Kontraindikationen: Schwere Knochenmarkdepression, akute Infektionen, Schwangerschaft und Stillzeit 5.3.11 Cyclophosphamid z z Wechselwirkungen mit anderen Medikamenten: CYC kann in seltenen Fällen die Wirkung von Insulin und oralen Antidiabetika verstärken. Die gleichzeitige Gabe von CYC und Allopurinol kann die Knochenmarkdepression verstärken. z Sonstiges: Bei der oralen CYC-Dauertherapie sollte die gesamte Dosis morgens eingenommen werden. Die Einleitung einer CYC-Therapie sollte möglichst nur stationär erfolgen. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand September 1996) 243 244 z 5.3 Basistherapie 5.3.12 Mycophenolsäure Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Mycophenolsäure Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Mycophenolsäure _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie. ___ ´ ___ Tbl. pro Tag (1 Tbl. à ___ mg), entsprechend ___ mg als Tagesdosis. z Dosierungsanpassung: Eine Dosisreduktion für Mycophenolsäure ist bei Nierenoder Leberfunktionsstörung innerhalb der empfohlenen Höchstdosis von 2 g (MMF) bzw. 1,48 g (Mycophenolat-Na) nicht erforderlich. In Studien wurden bis zu 3 g MMF als Tagesdosis eingesetzt. z Kontrazeption: Bei Frauen sollte während der Behandlung mit Mycophenolsäure und bis zu 6 Wochen nach Therapieende eine sichere Kontrazeption erfolgen. Mycophenolsäure geht bei Ratten in die Muttermilch über. Auch Männer dürfen während der Behandlung und bis zu 6 Wochen nach Therapieende keine Kinder zeugen. z Wirkungseintritt: Frühestens nach 4–8 Wochen. Wenn nach 3–6 Monaten keine Wirkung eingetreten ist, sollte die Behandlung überprüft werden. 5.3.12 Mycophenolsäure z Überwachungsprogramm während der Therapie In den ersten 2 Monaten alle 8–14 Tage, danach alle 4 Wochen. z Befragung und klinische Untersuchung: Infekt, gastrointestinale Symptome, Fieber, Exanthem, Kandidose z Laborbestimmungen: Blutbild einschl. Thrombozyten und Differenzialblutbild Gamma-GT, alk. Phosphatase, GPT Kreatinin, Elektrolyte, Urinstatus Die Überwachung einer immunmodulierenden Behandlung unterliegt nicht der Laborkostenpauschale, wenn in der Abrechnung zusätzlich die Ziffer 32023 angegeben ist. z Indikation zur Unterbrechung einer Therapie mit Mycophenolsäure: Kontaktaufnahme mit Tel. z Dermatologie z Gastroenterologie z Hämatologie z Sonstiges schwere Hautinfektion, Exanthem Anhaltende Diarrhö, membranöse/hämorrhagische Kolitis, Transaminasenanstieg um das 3fache, Ikterus, Pankreatitis Leukopenie < 3000/ll Granulopenie < 2000/ll Thrombopenie < 100 000/ll aplast. Anämie (Abgrenzung zu Entzündungs- und Blutungsanämie bzw. bei SLE) schwerer Infekt Schwangerschaft bzw. Kinderwunsch Nach Absetzen der Therapie mit Mycophenolsäure kann ein Krankheitsschub auftreten. 245 246 z 5.3 Basistherapie z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig z Dermatologie z Gastroenterologie z Hämatologie Übelkeit Erbrechen, Diarrhö membranöse/hämorrhagische Kolitis schwere Gastritis, Infektionen Erhöhung der Leberenzyme Leukopenie Anämie Thrombozytopenie z Kardio-/Pulmologie z Sonstiges Infektion und Sepsis Kopfschmerzen selten Exanthem Haarausfall Akute Pankreatitis Ikterus Panzytopenie Hypertonie Blutdruckabfall Herzrhythmusstörungen Antikörpermangel z Spätfolgen: Nach den bisherigen Untersuchungen zur Frage der Kanzerogenität von Mycophenolsäure scheint ein erhöhtes Risiko für das Auftreten von Hautkrebs, malignen Lymphomen und Leukämien vorzuliegen. z Kontraindikationen: Schwere Leber-, Nieren- und Knochenmarksschäden, bekannter Inosinphosphatdehydrogenasemangel, Infektionserkrankung (Tbc, akute/chron. bakterielle oder virale Infekte, Mykosen), Gravidität bzw. Kinderwunsch, Laktation. z Wechselwirkungen mit anderen Medikamenten: Einnahme vor den Mahlzeiten und mit 2 Stunden Abstand zu Antazida und Eisenpräparaten, vermehrte Myelotoxizität bei gleichzeitiger Einnahme von ACE-Hemmern. z Sonstiges: Eine aktive Immunisierung mit Lebendimpfstoffen sollte während der Therapie mit Mycophenolsäure nicht durchgeführt werden. Der Impfschutz der Immunisierung mit abgetöteten Impfstoffen ist fraglich. Eine passive Immunisierung ist möglich. Vermehrte UV-Lichtexposition sollte vermieden werden. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien (Stand Januar 2006) 5.3.13 Infliximab z 5.3.13 Infliximab Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Infliximab Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Infliximab _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie. ______ mg/kg Körpergewicht als intravenöse Infusion in Woche 0, 2 und 6, danach alle 8 Wochen. Infliximab wird bei Erwachsenen intravenös als Infusion über 2 Stunden verabreicht. Bei der Durchführung der Infusion ist auf die Verwendung des der Packung beigelegten Filters zu achten. Alle Patienten, denen Infliximab verabreicht wurde, sind nach Infusionsende 1 bis 2 Stunden hinsichtlich des Auftretens von Nebenwirkungen zu beobachten, da es sich bei Infliximab um ein Fremdeiweiß mit Mausanteil handelt. Eine Notfallausrüstung muss zur Verfügung stehen. Infliximab ist in der Kombinationsbehandlung mit Methotrexat zugelassen. z Wirkungseintritt: Nach ca. 2 bis 3 Wochen ist mit einem Wirkungseintritt zu rechnen. Ist nach 8 bis 12 Wochen (2 Wochen nach der 3. Infusion) kein Wirkungseintritt erfolgt, sollte die weitere Behandlung überprüft werden. Eine Dosissteigerung auf 5 mg/kg Körpergewicht Infliximab oder eine Intervallverkürzung ist in Einzelfällen zu überlegen. Nach Absetzen von Infliximab oder Methotrexat kann ein Krankheitsschub auftreten. 247 248 z 5.3 Basisterapie Überwachungsprogramm z Empfehlung: Aufnahme in die Langzeitdokumentation „Rabbit“ des DRFZ. Weitere Informationen unter www.rheumanet.org/tnf/doku/ Vor Therapie – Ausschluss einer klinisch aktiven Infektion; Durchführung eines Röntgenbildes des Thorax (falls letzte Kontrolle älter als 3 Monate) insbesondere zum Ausschluss einer durchgemachten Tuberkulose und Tuberkulinhauttest (bei Hinweisen auf eine durchgemachte Tbc – alte spezifische Veränderungen, pos. Tuberkulintest – strenge Indikationsstellung und regelmäßige Kontrollen angeraten). Unter Therapie z Befragung und klinische Untersuchung: – Infektionszeichen, Abszesse, Fieber, Luftnot, Husten, B-Symptomatik, Lymphknotenstatus, Zeichen eines SLE, Zeichen der akuten oder verspäteten Infusionsreaktion wie Urtikaria, Pruritus, Exanthem, Luftnot, Engegefühl der Brust, Blutdruckabfall, Fieber, Myalgien und Arthralgien. z Laborbestimmungen: Nicht routinemäßig erforderlich, bei entsprechender Symptomatik z. B. ANA. z Während der Infusion: Sind während der Infusion akute Infusionsreaktionen zu beobachten, ist die Infusion zu verlangsamen oder zu unterbrechen. Bei Abklingen der Symptome kann sie mit verlangsamter Infusionsgeschwindigkeit wieder gestartet werden. Bei leichten und vorübergehenden Infusionsreaktionen (Flush, Engegefühl, Hautausschlag) ist keine weitere medizinische Behandlung notwendig und die Therapie kann fortgesetzt werden. Bei mäßiggradigen und schweren akuten wie verspäteten Infusionsreaktionen muss das Absetzen der Infusion mit Infliximab erwogen werden. Notfallausrüstung und Notfallmedikation zur Behandlung einer allergischen Reaktion müssen zum sofortigen Gebrauch zur Verfügung stehen. Die Überwachung einer immunmodulierenden Behandlung mit Infliximab ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird z Kontraindikationen: Sepsis, klinisch manifeste unkontrollierte Infektion, Abszess und Überempfindlichkeit gegen Infliximab, SLE, Schwangerschaft oder Kinderwunsch. 5.3.13 Infliximab z z Indikation zur Unterbrechung einer Therapie mit Infliximab z Sonstiges: Zeichen einer schweren Infusionsreaktion, einer verzögerten Überempfindlichkeitsreaktion, einer schweren Infektion oder Sepsis, aktive Tbc. z Immunologie: Zeichen eines SLE und gleichzeitige Entwicklung von Antikörpern gegen doppelsträngige DNS. Es liegen noch keine Daten bzgl. des Infektionsrisikos bei chirurgischen Eingriffen unter Infliximabtherapie vor. Insofern sollte eine Infliximabtherapie bei elektiven Eingriffen mindestens 4 Wochen vorher pausiert werden. Cave: Nach Absetzen oder Pausieren der Therapie mit Infliximab kann es zu einem Krankheitsschub kommen. z Mögliche unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig selten z Immunsystem Infusionsreaktionen z Infektionen Virusinfektionen, Fieber, Infektionen des oberen und unteren Respirationstrakts z Dermatologie Hautausschlag, Pruritus, Urtikaria Übelkeit, Bauchschmerzen Autoantikörper, lupusähnliches Syndrom Abszess, Zellulitis, Kandidose, Sepsis, bakterielle Infektionen, Pilzinfektion, Harnwegsinfektionen, Pyelonephritis Mykosen, Furunkulose z Gastroenterologie z Sonstiges Divertikulitis, Cholezystitis Myalgien, Arthralgien z Wechselwirkungen mit anderen Medikamenten: Methotrexat scheint bei subtherapeutischen Dosierungen von Infliximab (1 mg/kg) die Bildung von Antikörpern gegen Infliximab zu verhindern und eine erhöhte Plasmakonzentration zu bewirken. Es ist unklar, ob diese Beobachtung auch für therapeutische Dosen von Infliximab gilt. Wegen der beobachteten Häufung schwerer Infektionen bei der gleichzeitigen Behandlung des TNF-Antagonisten Etanercept mit dem IL-1 Rezeptor-Antagonisten Anakinra sollte auch Infliximab nicht gleichzeitig mit Anakinra gegeben werden. Es liegen keine Erkenntnisse zu möglichen Wechselwirkungen zwischen Infliximab und anderen Arzneimitteln vor. z Kontrazeption/Schwangerschaft: Über mögliche fruchtschädigende Wirkungen einer Infliximabtherapie bei Mann und Frau liegen bisher keine ausreichenden Daten vor. Frauen sollten deshalb vorsichtshalber bis zu 6 Monate nach Therapieende eine sichere Kontrazeption durchführen. z Sonstiges: Eine Vaccination mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. 249 250 z 5.3 Basisterapie z Dokumentation: Für alle Patienten, die mit sog. Biologicals wie z. B. Infliximab behandelt werden, wird eine standardisierte Langzeitdokumentation empfohlen; weitere Informationen dazu finden sich unter www.rheumanet.org/tnf_doku/. z Bei weiteren Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006). Weitere Informationen zur Behandlung mit TNFa-Blockern finden Sie unter www.rheumanet.org 5.3.14 Etanercept z 5.3.14 Etanercept Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Etanercept Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Etanercept _______________________________________ z Dosierung: Die empfohlene Dosis beträgt _____ mg _____ mal Woche. z Wirkungseintritt: Eine Besserung der Schmerzen und Schwellungen wird frühestens nach 1 bis 2 Wochen eintreten. Sollte keine Besserung 8 bis 16 Wochen nach Beginn der Therapie eintreten, ist prinzipiell die Indikation für Etanercept zu überprüfen. Überwachungsprogramm z Empfehlung: Aufnahme in die Langzeitdokumentation „Rabbit“ des DRFZ. Weitere Informationen unter www.rheumanet.org/tnf/doku/ Vor Therapie Ausschluss einer klinisch aktiven Infektion; Durchführung eines Röntgenbildes des Thorax (falls letzte Kontrolle älter als 3 Monate) und ggf. Tuberkulintest. Unter Therapie z Befragung und klinische Untersuchung: – Infektionszeichen, Abszesse, Fieber, Luftnot, Husten, B-Symptomatik, Lymphknotenstatus, Zeichen eines SLE oder einer multiplen Sklerose, Reizung an der Injektionsstelle. z Laborbestimmungen: – Blutbild: in den ersten 3 Monaten alle 14 Tage, vom 4. bis 6. Monat alle 4 Wochen, danach alle 3 Monate; bei entsprechender Symptomatik z. B. ANA. 251 252 z 5.3 Basistherapie Die Überwachung einer immunmodulierenden Behandlung mit Etanercept ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Kontraindikationen und Abbruchgründe: Vorliegen ernster lokalisierter oder generalisierter Infektionen. Das gilt sowohl für akute als auch chronische Infektionen. Alte tuberkulöse Veränderungen sowie schwere chronische Virusinfektionen erfordern eine sorgfältige Nutzen-Risiko-Abwägung. Patienten mit Tumorerkrankungen und multipler Sklerose sollten nur nach Abwägung der individuellen Risiken behandelt werden. Sollte unter einer Therapie eine Tumorerkrankung neu auftreten, muss individuell über die Fortführung der Etanercepttherapie entschieden werden. z Indikation zur Unterbrechung einer Therapie mit Etanercept Auftreten einer „lupus like disease“ oder einer multiplen Sklerose Infekte, Zytopenie, aktive Tbc. Es liegen noch keine Daten bezüglich des Infektionsrisikos bei chirurgischen Eingriffen unter Etanercepttherapie vor. Insofern sollte eine Etanercepttherapie bei elektiven Eingriffen mindestens 1 Woche vorher pausiert werden. Cave: Nach Absetzen der Therapie mit Etanercept kann es zu einem Krankheitsschub kommen. z Mögliche unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig z Gastroenterologie Durchfall, Verstopfung, Übelkeit, Erbrechen, Bauchschmerzen, Mundulzera, erhöhte Leberparameter Kopfschmerzen, Benommenheit, Demyelinisierung/multiple Sklerose Zytopenie z Neurologie z Hämatologie z Dermatologie z Sonstiges selten Reizungen an der Injektionsstelle Infekte Rhinitis, Sinusitis; Halsschmerzen, verstärktes Husten allergische Reaktionen, „lupus like disease“ Fieber, Schwächegefühl z Schwangerschaft: Über mögliche fruchtschädigende Wirkungen einer Etanercepttherapie bei Mann und Frau liegen bisher keine ausreichenden Daten vor. Frauen sollten vorsichtshalber bis zu 3 Monaten nach Therapieende eine sichere Kontrazeption durchführen. 5.3.14 Etanercept z z Sonstiges: Eine Vaccination mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. Etanercept sollte wegen beobachteter Häufung von schweren Infektionen bei kombinierter Gabe nicht gleichzeitig mit dem Interleukin-1-Antagonisten Anakinra (Kineret®) verabreicht werden. Die Behandlung der aktiven polyartikulären chronischen Arthritis ist bei Kindern im Alter von 4 bis 17 Jahren möglich. Etanercept wurde bislang nicht bei Kindern unter 4 Jahren untersucht. z Dokumentation: Für alle Patienten, die mit sog. Biologicals wie z. B. Etanercept behandelt werden, wird eine standardisierte Langzeitdokumentation empfohlen; weitere Informationen dazu finden sich unter www.rheumanet.org/tnf_doku/. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 253 254 z 5.3 Basistherapie 5.3.15 Adalimumab Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Adalimumab Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Adalimumab _______________________________________ z Dosierung: Die Behandlung erfolgt als kontinuierliche Langzeittherapie. Die empfohlene Dosierung von Adalimumab beträgt 40 mg 14-tägig. Adalimumab wird als subkutane Injektion verabreicht. Um eine maximale Wirksamkeit zu gewährleisten, wird Adalimumab in der Regel in Kombination mit Methotrexat eingesetzt. Patienten, die eine Unverträglichkeit gegenüber Methotrexat aufweisen, oder bei denen die weitere Behandlung mit Methotrexat aus anderen Gründen nicht sinnvoll ist, können Adalimumab als Monotherapie oder auch in Kombination mit anderen Basistherapeutika erhalten. z Wirkungseintritt: Nach ca. 2 bis 3 Wochen ist mit einem Wirkungseintritt zu rechnen. Ist nach 12 Wochen kein klinisches Ansprechen festzustellen, sollte die Fortsetzung der Behandlung nochmals sorgfältig überdacht werden. Patienten, die ausschließlich mit Adalimumab behandelt werden und nur unzureichend auf die Therapie ansprechen, können von einer Dosiserhöhung auf 40 mg wöchentlich profitieren. Nach Absetzen oder Pausieren der Therapie kann es zu einem Krankheitsschub kommen. 5.3.15 Adalimumab z Überwachungsprogramm z Empfehlung: Aufnahme in die Langzeitdokumentation „Rabbit“ des DRFZ. Weitere Informationen unter www.rheumanet.org/tnf/doku/ Vor Therapiebeginn z Befragung und klinische Untersuchung – Allgemeinstatus zum Ausschluss einer mäßigen bis schweren Herzinsuffizienz (NYHA Klasse III/IV) und einer aktiven Infektion, – Bestimmung der Krankheitsaktivität möglichst mit Hilfe validierter Aktivitäts- und Funktionsscores, – zeitnahe Röntgenaufnahme (Hände, Füße und Thorax innerhalb der letzten 3 Monate vor Behandlungsbeginn), – Untersuchung auf aktive oder latente Tuberkulose mit geeigneten Screeningtests (z. B. Tuberkulin-Hauttest-GT10); bei Hinweisen auf eine latente Tuberkulose Durchführung einer Tuberkuloseprophylaxe mit INH und Vitamin B6 über 9 Monate, strenge Indikationsstellung und regelmäßige Kontrollen werden angeraten. z Laborbestimmungen – BSG, C-reaktives Protein, großes Blutbild, SGOT, AP und Kreatinin. Während der Therapie z Befragung und klinische Untersuchung – Klinisch-rheumatologische Dokumentation (mit validierten Aktivitätsscores) in der Regel nach 3, 6 und 12 Monaten, danach jährlich, – Röntgenbilder relevanter Gelenke jährlich, – Besonders wichtig: Infektionszeichen, Abszesse, Fieber, Husten, Kräfteschwund/Gewichtsverlust, B-Symptomatik, Lymphknotenstatus, Zeichen eines SLE. z Laborbestimmungen – Sicherheits- und Aktivitätsparameter (BSG, CrP, großes Blutbild, SGOT, AP, Kreatinin) nach 2 und 4 Wochen, nach 2 und 3 Monaten, danach jährlich, bei entsprechender Symptomatik z.B. ANA. Die Überwachung einer immunmodulierenden Behandlung mit Adalimumab ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. z Kontraindikationen: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. Aktive Tuberkulose oder andere schwere lokalisierte oder generalisierte Infektionen (Sepsis, opportunistische Infektion). Alte tuberkulöse Veränderungen erfordern eine sorgfältige Nutzen-Risiko-Abwägung und eine regelmäßige klinische und röntgenologische Kontrolle, auch unter INH-Prophylaxe. Weitere Kontraindikationen stellen chronische Virusinfektionen (HIV, aktive oder persistierende Hepatitis B, wahrscheinlich auch Hepatitis C) und bekannte opportunistische Infektionen (z. B. atypische Mykobakteriosen) dar. Bei mäßiger bis schwerer Herzinsuffizienz (NYHA Klasse III/IV) sollte Adalimumab nicht angewandt werden. Patienten mit Tumor- 255 256 z 5.3 Basistherapie erkrankungen und multipler Sklerose sollten nur nach Abwägung der individuellen Risiken behandelt werden. Sollte unter einer Adalimumabtherapie eine Tumorerkrankung neu auftreten, muss individuell über die Fortführung der Therapie entschieden werden. Die gleichzeitige Gabe von Adalimumab und Lebendimpfstoffen wird nicht empfohlen. z Kontrazeption/Schwangerschaft und Stillzeit: Über mögliche fruchtschädigende Wirkungen einer Adalimumabtherapie bei Mann und Frau liegen bisher keine ausreichenden Daten vor. Frauen sollten vorsichtshalber bis zu 3 Monaten nach Therapieende eine sichere Kontrazeption durchführen. z Indikation zur Unterbrechung einer Therapie mit Adalimumab: Zeichen einer schweren Infektion (Sepsis, opportunistische Infektionen, aktive Tuberkulose u. a.), Symptome einer demyelinisierenden Erkrankung, Auftreten schwerwiegender allergischer Reaktionen, Auftreten neuer oder sich verschlechternder Symptome einer dekompensierten Herzinsuffizienz. Es liegen noch keine Daten bezüglich des Infektionsrisikos bei chirurgischen Eingriffen unter Adalimumabtherapie vor. Deshalb sollte die Adalimumabtherapie mindestens 14 Tage vor einem geplanten operativen Eingriff abgesetzt und erst nach Abschluss des Wundheilungsprozesses, frühestens jedoch 14 Tage nach dem Eingriff, fortgesetzt werden. Cave: Nach Absetzen oder Pausieren der Therapie mit Adalimumab kann es zu einem Krankheitsschub kommen. z Mögliche unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) häufig (> 1/100 bis £ 1/10) gelegentlich (> 1/1000 bis £ 1/100) z Blutbildendes System Abfall der Hämoglobinkonzentration z Stoffwechselstörungen Hyperlipidämie z Nervensystem Kopfschmerzen, Schwindel/Benommenheit z Respiratorisches System Infektionen der oberen Atemwege, Rhinitis, Sinusitis, Bronchitis, verstärkter Husten, Pneumonie z Verdauungssystem Übelkeit, Diarrhö, Halsschmerzen z Haut Hautausschlag, Pruritus, Herpes simplex z Urogenitalsystem Harnwegsinfektion z Sonstiges Reaktionen an der Einstichstelle, abnorme Laborwerte, starker Gewichtsverlust, Grippesyndrom, Abdominalschmerzen, Infektion Nachweis antinukleärer Antikörper Gestörte Wundheilung Parästhesien, Neuralgien, Tremor Pharyngitis Erbrechen, Dyspepsie, Obstipation, Gastritis, Gastroenteritis, Stomatitis Vermehrte Schweißsekretion, Urtikaria, Ekzem Vaginale Candidamykose, Zystitis Fieber, Arthralgie, Myalgie, Synovitis, Hypertonie, Sepsis, Konjunktivitis, Sehstörungen, allergische Reaktion 5.3.15 Adalimumab z z Wechselwirkungen mit anderen Medikamenten: Bei gleichzeitiger Anwendung von Adalimumab und Methotrexat war die Bildung von substanzspezifischen Antikörpern niedriger (< 1%) als unter Monotherapie. Die Anwendung von Adalimumab ohne Methotrexat führte zu einer gesteigerten Bildung von Antikörpern und einer erhöhten Clearance von Adalimumab. Es liegen keine Erfahrungen vor über die Wirksamkeit und Unbedenklichkeit bei Patienten, die vorher mit anderen TNF-Antagonisten behandelt wurden. Adalimumab sollte wegen beobachteter Häufung von schweren Infektionen bei kombinierter Gabe nicht gleichzeitig mit dem Interleukin-1-Antagonisten Anakinra (Kineret®) verabreicht werden. z Lagerung und Aufbewahrung: Bei +2 bis +8 8C (im Kühlschrank) lagern und die Fertigspritze in der Faltschachtel aufbewahren. Nicht einfrieren. z Bei weiteren Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen zur Behandlung mit TNF-a-Blockern finden Sie unter www.rheumanet.org 257 258 z 5.3 Basistherapie 5.3.16 Anakinra Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Anakinra Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Anakinra _______________________________________ z Dosierung: 100 mg/Tag. Die empfohlene Dosis wird als subkutane Injektion 1-mal täglich angewendet, möglichst zur gleichen Tageszeit. Anakinra ist in der Kombinationsbehandlung mit Methotrexat zugelassen. z Wirkungseintritt: Meistens nach 2 Wochen. Wenn nach 8 bis 12 Wochen noch keine Wirkung eingetreten ist, sollte die Indikation zur weiteren Behandlung überprüft werden. 5.3.16 Anakinra z Überwachungsprogramm In der Kombinationsbehandlung mit Methotrexat sind die MTX-spezifischen Kontrollen zusätzlich zu beachten. z Empfehlung: Aufnahme in die Langzeitdokumentation „Rabbit“ des DRFZ. Weitere Informationen unter www.rheumanet.org/tnf/doku/ Vor Therapie z Infektionszeichen z Laborbestimmung: – Ausschluss einer schweren Nierenfunktionsstörung, – Ausschluss einer Neutropenie. Unter Therapie z Befragung und klinische Untersuchung: – Reaktionen an der Injektionsstelle, Infektionszeichen, – Abszesse, Fieber, Luftnot, Husten, – Lymphknotenstatus. z Laborbestimmungen: – Blutbild (Neutrophile): in den ersten 6 Behandlungsmonaten monatlich, danach vierteljährlich, Kreatinin vierteljährlich. Die Überwachung einer immunmodulierenden Behandlung mit Anakinra ist von der Budgetierung des Labors ausgenommen, wenn die Ziffer 32023 auf dem Abrechnungsschein angegeben wird. Die bei bis zu 70% der Patienten nach 10 bis 14 Tagen auftretenden Reaktionen an der Injektionsstelle erfordern unter Umständen eine Lokaltherapie mit steroidhaltigen Salben oder Eis, bedingen aber in der Regel kein Absetzen der Behandlung und verschwinden unter Fortsetzung der Therapie meist nach Ablauf eines Monats von selbst. z Indikation zur Unterbrechung einer Therapie mit Anakinra z schwere allergische Reaktionen z schwere Infektionen z Neutropenie < 1,5 ´ 109/l. z Mögliche unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) sehr häufig (> 10%) z Haut und Subkutangewebe z Nervensystem z Blut- und Lymphsystem z Infektionen häufig (1–10%) Reaktionen an der Einstichstelle Kopfschmerzen Neutropenie schwere Infektionen 259 260 z 5.3 Basistherapie z Wechselwirkungen mit anderen Medikamenten: In klinischen Studien wurden keine Interaktionen zwischen Anakinra und anderen Arzneimitteln (einschließlich nichtsteroidalen Antiphlogistika, Kortikosteroiden und Basistherapeutika (DMARD)) beobachtet. Anakinra sollte wegen beobachteter Häufung von schweren Infektionen bei kombinierter Gabe nicht gleichzeitig mit TNF-Inhibitoren verabreicht werden. z Kontrazeption/Schwangerschaft: Über die Auswirkungen einer Anakinratherapie in der Schwangerschaft und beim Stillen liegen keine ausreichenden Erfahrungen vor. Eine Schwangerschaft muss deshalb während der Anakinrabehandlung und in den ersten 3 Monaten nach Absetzen des Anakinra sicher verhütet werden. Männer dürfen während der Anakinrabehandlung und in den ersten 3 Monaten nach dem Absetzen des Anakinra kein Kind zeugen. z Sonstiges: Eine Vaccination mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. z Kontraindikationen: Überempfindlichkeit gegenüber Anakinra, einen der sonstigen Bestandteile des Arzneimittels oder gegenüber aus E. coli gewonnenen Proteinen. Schwere Nierenfunktionsstörung (CLCR < 30 ml/min). z Dokumentation: Für alle Patienten, die mit sog. Biologics wie z. B. Anakinra behandelt werden, wird eine standardisierte Langzeitdokumentation empfohlen; weitere Informationen dazu finden sich unter www.rheumanet.org/tnf_doku/default_tnf.htm. Empfohlene radiologische Dokumentation: Vor Therapiebeginn Röntgenbild des Thorax, der Hände und Vorfüße (falls nicht innerhalb der letzten 3 Monate erfolgt). Röntgenkontrolle der Hände und Vorfüße in der Regel nach einem Jahr. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.3.17 Rituximab z 5.3.17 Rituximab Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Therapie mit Rituximab Eine praxisorientierte Information für den behandelnden Arzt, ersetzt nicht die Fachinformation Name: ____________________________ Indikation: Geb.-Dat.: _________________________ __________________________________ Für diesen Patienten wird folgendes Medikament empfohlen: Rituximab _______________________________________ Rituximab ist ein Anti-CD20-Antikörper, der zu einer mehrmonatigen Elimination von B-Lymphozyten im peripheren Blut führt. Rituximab ist in der Kombination mit Methotrexat zugelassen bei Patienten, die auf andere Basistherapien, einschließlich einer oder mehrerer Therapien mit TNF-a-blockierenden Substanzen, nicht angesprochen haben oder diese nicht vertragen. z Dosierung: Die Behandlung erfolgt als 2-malige Infusionstherapie mit jeweils 1 000 mg im Abstand von 14 Tagen. Weitere Behandlungszyklen können im Abstand von 6 bis 12 Monaten erforderlich werden. Vor Beginn der Infusion werden jeweils 100 mg (Methyl-)Prednisolon i.v. verabreicht, um etwaige Unverträglichkeitsreaktionen abzuschwächen. Während der Infusion muss eine kontinuierliche Überwachung sichergestellt und eine Notfallausrüstung vorhanden sein. z Schwangerschaft und Stillzeit: Über mögliche fruchtschädigende Wirkungen einer Rituximabtherapie bei Mann und Frau liegen bisher keine ausreichenden Daten vor. Männer und Frauen sollten vorsichtshalber bis zu 12 Monate nach Therapieende eine sichere Kontrazeption durchführen und Frauen nicht stillen. z Wirkungseintritt: Nach 2 bis 8 Wochen. Wenn nach 16 bis 24 Wochen keine Wirkung eingetreten ist, wird eine Wiederholung des Behandlungszyklus nicht empfohlen. 261 262 z 5.3 Basistherapie Überwachungsprogramm Vor der Therapie Ausschluss einer klinisch aktiven Infektion, Ausschluss einer Hepatitis B. Patienten mit bekannter Allergie gegen Mausproteine (z. B. schwere allergische Reaktion auf Infliximab) dürfen kein Rituximab infundiert bekommen. Eine kardiovaskuläre Vorerkrankung oder eine Herzinsuffizienz (NYHA III) stellen ein erhöhtes Risiko dar, besonders beim Auftreten von Infusionsreaktionen. Eine schwere Herzinsuffizienz (NYHA IV) stellt wegen der erforderlichen Infusionsmenge eine Kontraindikation dar. Während und nach der Infusion Zeichen einer akuten oder verzögerten Infusionsreaktion wie Urtikaria, Pruritus, Exanthem, Luftnot, Angina pectoris, Blutdruckabfall, Fieber, Myalgien und Arthralgien. Langzeitbeobachtung Nach der Infusion ist durch die Verminderung der B-Lymphozyten mit einer langfristigen Immunsuppression zu rechnen. Deshalb müssen Infektzeichen besonders ernst genommen werden und frühzeitig eine entsprechende Diagnostik und Therapie veranlasst werden. Unter der Behandlung mit Rituximab sind keine speziellen Laborkontrollen erforderlich. Die zur Überwachung der Begleittherapie z. B. mit Methotrexat erforderlichen Kontrollen müssen aber beachtet werden. z Unerwünschte Wirkungen (die Aufstellung enthält die wichtigsten Nebenwirkungen, kann aber keinen Anspruch auf Vollständigkeit erheben) z Pulmologie häufig selten Infektion der Atemwege Bronchospasmus, interstitielle Pneumonie Dyspepsie, Oberbauchschmerzen Diarrhö Reaktivierung einer Hepatitis B Leukopenie, Panzytopenie Ödem Blutdruckabfall Herzrhythmusstörungen Herzinsuffizienz und Myokardinfarkt schwere anaphylaktische Infusionsreaktionen Kopfschmerzen z Gastroenterologie z Hämatologie z Kardiologie z Sonstiges Infusionsreaktionen, grippeähnliche Symptome Infektionen Vorübergehende Hyperurikämie (15%) z Spätfolgen: Bisher fanden sich keine Hinweise auf ein erhöhtes Malignomrisiko. Eine abschließende Beurteilung auch hinsichtlich anderer Langzeitrisiken ist zurzeit noch nicht möglich. 5.3.17 Rituximab z z Kontraindikationen: Schwere Infektionserkrankung (Tbc, akute/chronische bakterielle oder virale Infekte, speziell chronische Hepatitis B, Mykosen), Herzinsuffizienz (NYHA IV), Gravidität bzw. Kinderwunsch, Laktation. z Sonstiges: Eine aktive Immunisierung mit Lebendimpfstoffen darf während der Therapie mit Rituximab nicht durchgeführt werden. Vor Beginn der Therapie sollte der vorhandene Impfschutz überprüft und ergänzt werden, da das Ansprechen auf eine Impfung nach der Infusion erheblich reduziert ist. Eine passive Immunisierung ist möglich. Die gebrauchsfertige Infusionslösung ist bei 2 bis 8 8C 24 Stunden, bei Raumtemperatur 12 Stunden stabil. z Wechselwirkungen mit anderen Medikamenten: Bisher liegen keine Erkenntnisse zu Wechselwirkungen mit anderen Medikamenten vor. z Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org. 263 264 z 5.3 Basistherapie 5.3.18 Kontrolluntersuchungen bei der Basistherapie der rheumatoiden Arthritis Diese Empfehlungen basieren auf Daten aus der Literatur und einem Expertenkonsensus über Häufigkeit, Schweregrad und zeitliches Auftreten von unerwünschten Wirkungen der einzelnen Substanzen. Im Einzelfall können vor Vorliegen von Risikofaktoren der Therapie (eingeschränkte Nierenfunktion, Alter, Komorbidität u. a.) häufigere und andere Kontrollen erforderlich sein (Tabelle 1). z Hinweise z In jedem Fall sind die Vorwerte zu bestimmen. z Die Information des Patienten durch ein Merkblatt sowie die ärztliche Befragung nach der Arzneimittelverträglichkeit zu den Kontrollzeitpunkten werden vorausgesetzt. Tabelle 1. Zeitliche Intervalle von Laborkontrollen bei den verschiedenen Formen der Basistherapie Substanzen Hämatologisches SGOT, Profil (rotes Blut- Gamma-GT bild, Leuko- und oder AP Thrombozytenzahl) Kreatinin z Chloroquin/ Hydroxychloroquin 4-wöchentlich bis 3 Monate, danach vierteljährlich 4-wöchentlich bis 3 Monate, danach vierteljährlich 4-wöchentlich – bis 3 Monate, danach vierteljährlich Augenarzt: initial und alle 6 Monate z Sulfasalazin 2/6 2/6 2/6 Alle 3 Monate ANA **, Haptoglobin alle 6 Monate z Auranofin 2/6 2/6 6 6 – z Parenterale Goldsalze * 2/4 2/4 4 4 Immunglobuline, ANA ** alle 3 Monate z D-Penicillamin 2/4 2/4 4 4 Immunglobuline, ANA ** alle 3 Monate z Methotrexat 2/4 2/4 4 Alle 3 Monate – z Azathioprin 2/4 2/4 4 Alle 3 Monate – Urinstatus Sonstiges 5.3.18 Kontrolluntersuchungen bei der Basistherapie der rheumatoiden Arthritis z Tabelle 1 (Fortsetzung) Substanzen Hämatologisches SGOT, Profil (rotes Blut- Gamma-GT bild, Leuko- und oder AP Thrombozytenzahl) Kreatinin Urinstatus Sonstiges z Leflunomid 2/4 2/4 2/4 Alle 3 Monate GOT/GPT> Dreifache der NormBeendigung der Therapie und Elemination durch Cholestysamin z Ciclosporin A 4 4 1/2/4 4 Blutdruckmessung alle 14 Tage; Kalium, Lipide alle 4 Wochen; initial evtl. Bestimmung des Blutspiegels z Endoxan 1/2/4 1/2/4 2/4 2/4 – z Mycophend- 1–2/4 säure 1–2/4 1–2/4 1–2/4 – z Etanercept Alle 2 Wochen für 3 Monate, anschließend alle 4 Wochen für weitere 3 Monate, danach alle 3 Monate – *** – *** – *** ANA ** Unterbrechung der Therapie bei Infektion, Sepsis, aktiver Tbc, „lupus like disease“ z Infliximab – *** – *** – *** – *** Unterbrechung der Therapie bei schweren Infektionen, Sepsis, aktiver Tbc, SLE und gleichzeitig AK gegen ds-DNA z Anakinra Alle 2 Wochen für 3 Monate, anschließend alle 4 Wochen für weitere 3 Monate, danach alle 3 Monate – *** – *** – *** Unterbrechung der Therapie bei Neutropenie und schweren Infektionen * Injektion i. m. erst nach Laborkontrolle!; ** Untersuchung nur bei Verdacht auf Induktion von ANA bzw. zur Kontrolle bereits bestehender ANA; *** Nicht routinemäßig vorgesehen Erklärung: 1 = wöchentlich für 1 Monat; 2 = zweiwöchentlich für 3 Monate oder dauernd; 4 = primär oder anschließend alle 4 Wochen; 6 = primär oder anschließend alle 6 Wochen 265 5.4 Patientenaufklärungsbögen 268 z 5.4 Patientenaufklärungsbögen 5.4.1 Antimalariamittel Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Antimalariamitteln Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament ein Antimalariamittel empfohlen: Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 3 bis 4 Monaten. Bei manchen kann es auch bis zu 6 Monaten dauern, bis eine Wirkung zu spüren ist. z Wie wird die Behandlung mit Antimalariamitteln durchgeführt? Antimalariamittel gibt es nur als Tabletten. Im Allgemeinen wird eine bis zwei Tabletten täglich verordnet. 5.4.1 Antimalariamittel morgens z abends [ ] Chloroquin [ ] Hydroxychloroquin z Woran merken Sie, dass die Behandlung mit Antimalariamitteln wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit Antimalariamitteln durchgeführt? Es ist notwendig, dass die Behandlung mit Antimalariamitteln langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Antimalariamittel regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit Antimalariamitteln nicht wirkt? Erst nach 6 Monaten kann sicher beurteilt werden, ob die Wirkung von Antimalariamitteln ausbleibt. Wenn die Behandlung mit Antimalariamitteln nicht wirkt, wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Antimalariamitteln. Daher ist eine Kontrolle der Behandlung durch Ihren Hausarzt und Ihren Augenarzt notwendig. Der Hausarzt überprüft deshalb in den ersten 4 Monaten alle 2 Wochen, danach alle 2 Monate das Blut. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede Nebenwirkung zwingt zum Abbruch der Therapie. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Die meisten Nebenwirkungen sind ungefährlich. Einige Patienten klagen über Übelkeit und Erbrechen. Andere haben Kopfschmerzen oder Schwindelgefühl oder sind außergewöhnlich müde. Diese Beschwerden treten vor allem in den ersten Wochen der Behandlung auf. Deshalb ist es günstiger, wenn Sie die Tabletten vor dem Schlafengehen einnehmen. Wenn sie zu schlimm sind, sprechen Sie mit Ihrem Arzt darüber. Manchmal kommt es zu Juckreiz oder Hautausschlag. Vermeiden Sie deshalb eine zu intensive Sonneneinstrahlung. z Beeinträchtigen Antimalariamittel die Augen? In den ersten Tagen kommt es manchmal zu Sehstörungen, wie z. B. Verschwommensehen, Lichtempfindlichkeit oder Störungen des Farbsehens. Diese Veränderungen bilden sich nach kurzer Zeit zurück. Sie sind ungefährlich. Möglicherweise behindern sie beim Autofahren. z Gibt es gefährliche Nebenwirkungen an den Augen? Vor Beginn und während der Behandlung mit Antimalariamitteln müssen Sie regelmäßig vom Augenarzt untersucht werden. Bei bestimmten schweren Augenerkrankungen rät er von vornherein von einer Einnahme ab. Während der Behandlung 269 270 z 5.4 Patientenaufklärungsbögen können sehr selten Netzhautveränderungen entstehen. Sie sind abhängig von der Dosis. Darüber sollten Sie nicht erschrecken: Der Augenarzt kann diese Veränderungen erkennen, bevor bleibende Schäden auftreten. Deshalb müssen Sie alle 6 Monate zum Augenarzt gehen. Sie selbst merken von diesen Veränderungen nichts. Nur der Augenarzt kann sie rechtzeitig entdecken. z Vor Beginn der Therapie und während der Therapie alle 6 Monate augenärztliche Untersuchung! z Was ist außerdem noch während der Behandlung zu beachten? – Während der Behandlung mit Antimalariamitteln sollten Frauen nicht schwanger werden. Ob die Behandlung in der Schwangerschaft und Stillzeit fortgesetzt werden kann, entscheidet Ihr Arzt. – Informieren Sie Ihren Arzt über alle Medikamente, die Sie außerdem noch einnehmen. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org. 5.4.2 Sulfasalazin z 5.4.2 Sulfasalazin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Sulfasalazin Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament Sulfasalazin empfohlen. Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 12 Wochen. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine Dosissteigerung. z Wie wird die Behandlung mit Sulfasalazin durchgeführt? Sulfasalazin gibt es als Tabletten. Die Dosis wird langsam erhöht, damit Sie das Medikament besser vertragen. Manchmal kann es aber erforderlich sein, dass gleich 2-mal 2 Tabletten eingenommen werden. 271 272 z 5.4 Patientenaufklärungsbögen ___ Woche täglich ___ Woche täglich ___ Woche täglich ab der ____ Woche täglich morgens abends 1 1 2 1 1 2 2 z Woran merken Sie, dass die Behandlung mit Sulfasalazin wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit Sulfasalazin durchgeführt? Es ist notwendig, dass die Behandlung mit Sulfasalazin langfristig erfolgt. Sie wirkt nur, wenn Sie Ihre Tabletten regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht, sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit Sulfasalazin nicht wirkt? Wenn Sulfasalazin nach 3 Monaten nicht ausreichend gewirkt hat, entscheidet Ihr Arzt über eine mögliche Dosiserhöhung: morgens, mittags und abends je 2 Tabletten. Erst nach insgesamt 6 Monaten kann sicher beurteilt werden, ob die Wirkung von Sulfasalazin ausbleibt. Dann wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Sulfasalazin. Daher ist eine regelmäßige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede unerwünschte Wirkung zwingt zu einem Abbruch der Therapie. Die meisten im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Die meisten Nebenwirkungen sind ungefährlich. Einige Patienten klagen über Übelkeit, Erbrechen, Durchfall und Bauchschmerzen. Andere haben Kopfschmerzen oder Schwindelgefühl oder sind außergewöhnlich müde. Diese Beschwerden treten vor allem in den ersten Wochen der Behandlung auf. Manchmal kommt es zu Juckreiz, Hautausschlag, schmerzhaften Bläschen im Mund-/Rachenbereich oder Haarausfall. Wenn Sie Fieber oder Luftnot haben, informieren Sie umgehend Ihren Arzt darüber. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Auch eine Urinuntersuchung ist notwendig. Gefährliche Nebenwirkungen sind außerordentlich selten. 5.4.2 Sulfasalazin z z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1.–3. Monat: alle 2 Wochen 4.–6. Monat: alle 4 Wochen ab 6. Monat: alle 3 Monate Wenn Sie ungewohnte Beschwerden während der Sulfasalazintherapie bemerken, dann sollten Sie Ihren Hausarzt informieren. z Was ist außerdem noch während der Behandlung zu beachten? – Während der Behandlung mit Sulfasalazin sollten Frauen nicht schwanger werden. Ob die Behandlung in der Schwangerschaft und Stillzeit fortgesetzt werden kann, entscheidet Ihr Arzt. – Bei Männern kann die Zeugungsfähigkeit beeinträchtigt sein. Das Sexualempfinden wird davon nicht betroffen. Bei Kinderwunsch sollte Sulfasalazin nach Rücksprache mit Ihrem Arzt abgesetzt werden. Die Zeugungsfähigkeit kehrt innerhalb von 3 Monaten vollständig zurück. – Vermeiden Sie eine intensive Sonneneinstrahlung. – Informieren Sie Ihren Arzt über alle Medikamente, die sie außerdem noch einnehmen. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen zur Behandlung finden Sie unter www.rheumanet.org 273 274 z 5.4 Patientenaufklärungsbögen 5.4.3 Goldtabletten Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Goldtabletten Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen werden als lang wirksames Rheumamedikament Goldtabletten empfohlen. Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 3 Monaten. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine Dosissteigerung. z Wie wird die Behandlung mit Goldtabletten durchgeführt? Dosis: morgens: 1 Tbl. abends: 1 Tbl. z Woran merken Sie, dass die Behandlung mit Goldtabletten wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. 5.4.3 Goldtabletten z z Wie lange wird die Behandlung mit Goldtabletten durchgeführt? Es ist notwendig, dass die Behandlung mit Goldtabletten langfristig erfolgt. Sie wirkt nur, wenn Sie Ihre Goldtabletten regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. Über ein Absetzen der Behandlung entscheidet Ihr Arzt. z Was passiert, wenn die Behandlung mit Goldtabletten nicht wirkt? Erst nach 6 Monaten kann man sicher beurteilen, ob die Wirkung der Behandlung mit Goldtabletten ausbleibt. Wenn die Behandlung nicht ausreichend wirkt, entscheidet Ihr Arzt über eine mögliche Dosiserhöhung auf 3-mal 1 Tablette täglich, oder er ändert Ihre Therapie. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Goldtabletten. Daher ist eine ständige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Häufig kommt es zu Durchfällen, weichem Stuhl oder Blähungen. Dies ist zwar unangenehm, aber selten so schlimm, dass die Goldtabletten abgesetzt werden müssen. Beobachten Sie, ob ein Juckreiz oder ein Hautausschlag auftritt. Achten Sie auf schmerzhafte Bläschen oder Entzündungen im Mund und/oder Rachen. Informieren Sie Ihren Arzt über diese Symptome. Falls bei Ihnen ein ungewohntes Zahnfleischbluten oder nicht erklärliche „blaue Flecke“ auftreten, sollten Sie unverzüglich Ihren Arzt aufsuchen. Diese Veränderungen können Zeichen für einen bedrohlichen Mangel an Blutplättchen sein. Glücklicherweise tritt diese Nebenwirkung von Goldtabletten äußerst selten auf. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und/oder Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Besonders wichtig ist auch eine Urinuntersuchung. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Einnahme von Goldtabletten auftreten, entscheidet Ihr Arzt über die weitere Behandlung. z Wie oft müssen Sie Ihren Hausarzt aufsuchen? 1.–3. Monat: alle 2 Wochen ab 4. Monat: alle 4 Wochen Wenn Sie ungewohnte Beschwerden während der Goldtherapie bemerken, informieren Sie unverzüglich Ihren Hausarzt. z Was ist außerdem noch während der Behandlung mit Goldtabletten zu beachten? – Während der Behandlung ist bei Frauen eine sichere Empfängnisverhütung notwendig. 275 276 z 5.4 Patientenaufklärungsbögen – In der Schwangerschaft und Stillzeit darf die Goldbehandlung nicht fortgesetzt werden. – Solange Sie Goldtabletten einnehmen, sollten Sie eine intensive Sonnenbestrahlung vermeiden. Es kann sonst zu Hautausschlägen kommen. – Informieren Sie Ihren Arzt über alle Medikamente, die sie außerdem noch einnehmen. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand September 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.4.4 Goldinjektionen z 5.4.4 Goldinjektionen Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit „Goldspritzen“ Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen werden als langwirksames Rheumamedikament Goldspritzen empfohlen. Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 6 bis 8 Wochen. Bei einigen kann es bis zu 3 Monaten dauern, bis eine Wirkung zu spüren ist. z Wie wird die Behandlung mit Goldspritzen durchgeführt? Die Behandlung erfolgt in 3 Stufen. Zunächst erhalten Sie eine Testdosis. Damit wird eine mögliche Goldallergie festgestellt. Danach beginnt die Sättigungsphase. In dieser Zeit bekommen Sie in jeder Woche 1 oder 2 Spritze(n). Diese Phase dauert _____ Wochen. Anschließend folgt die Erhaltungstherapie. Jetzt bekommen Sie in jeder 2. Woche eine Spritze. Die Goldspritzen werden in den Gesäßmuskel gegeben. 277 278 z 5.4 Patientenaufklärungsbögen Aufsättigungsphase Erhaltungstherapie 1. Woche 2. Woche 3.– ___ Woche jede Woche Ab ____ Woche jede 2. Woche 1 Spritze 10 mg 1 Spritze 20 mg 1 Spritze 50 mg 1 Spritze 50 mg z Wozu dient der Therapiepass (Goldpass)? Zur Überwachung der Behandlung erhalten Sie einen Pass, in dem jede Spritze mit Datum und Dosis eingetragen wird. Auch Kontrolluntersuchungen werden darin vermerkt. z Woran merken Sie, dass die Behandlung mit Goldspritzen wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit Goldspritzen durchgeführt? Es ist notwendig, dass die Behandlung mit Goldspritzen langfristig erfolgt. Sie wirkt nur, wenn Sie Ihre Goldspritzen regelmäßig bekommen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. Über ein Absetzen der Behandlung entscheidet Ihr Arzt. z Was passiert, wenn die Behandlung mit Goldspritzen nicht wirkt? Erst nach 6 Monaten kann man sicher beurteilen, ob die Wirkung der Behandlung mit Goldspritzen ausbleibt. Wenn die Behandlung nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Goldspritzen. Daher ist eine ständige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Beobachten Sie, ob ein Juckreiz oder ein Hautausschlag auftritt. Achten Sie auf schmerzhafte Bläschen oder Entzündungen im Mund und/oder Rachen. Informieren Sie Ihren Arzt über diese Nebenwirkungen. Falls bei Ihnen ein ungewohntes Zahnfleischbluten oder nicht erklärliche „blaue Flecken“ auftreten, sollten Sie unverzüglich Ihren Arzt aufsuchen. Diese Veränderungen können ein Zeichen für einen bedrohlichen Mangel an Blutplättchen sein. Glücklicherweise tritt diese Goldnebenwirkung äußerst selten auf. Manchmal tritt ein Metallgeschmack auf, der aber eher harmlos ist. Am Tag der Injektion können Gliederschmerzen spürbar sein. Diese Beschwerden sind nicht gefährlich und eher ein Zeichen der Wirkung. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung fest- 5.4.4 Goldinjektionen z stellen. Besonders wichtig ist auch eine Urinuntersuchung. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Goldbehandlung auftreten, entscheidet Ihr Arzt über die weitere Behandlung. z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1.–3. Monat: alle 2 Wochen ab 4. Monat: alle 4 Wochen Wenn Sie ungewohnte Beschwerden während der Goldtherapie bemerken, informieren Sie Ihren Hausarzt spätestens vor der nächsten Spritze. z Was passiert, wenn Sie eine Spritze verpasst haben? Wenn Sie wirklich einmal eine Spritze versäumt haben, muss diese nachgeholt werden. Allerdings darf die Spritze nicht häufiger vergessen werden, da sonst der Behandlungserfolg gefährdet ist. z Was ist außerdem noch während der Behandlung zu beachten? Während der Behandlung ist bei Frauen eine sichere Empfängnisverhütung notwendig. In der Schwangerschaft und Stillzeit sollte die Goldbehandlung nicht fortgesetzt werden. Solange Sie Goldspritzen bekommen, sollten Sie eine intensive Sonnenbestrahlung vermeiden, sonst kann es zu Hautausschlägen kommen. Informieren Sie Ihren Arzt über alle Medikamente, die Sie einnehmen. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 279 280 z 5.4 Patientenaufklärungsbögen 5.4.5 D-Penicillamin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit D-Penicillamin Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament D-Penicillamin empfohlen: Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 12 Wochen. Manchmal kann es auch bis zu 6 Monaten dauern, bis eine Wirkung zu spüren ist. Wenn die Wirkung nicht ausreicht, entscheidet Ihr Arzt über eine Dosissteigerung. 5.4.5 D-Penicillamin z z Wie wird die Behandlung mit D-Penicillamin durchgeführt? D-Penicillamin gibt es nur als Tabletten. Die Dosis wird langsam um 150 mg gesteigert. Dadurch vertragen Sie das Medikament besser. morgens 1. 3. 5. 7. und 2. Woche und 4. Woche und 6. Woche bis 16. Woche 1´ 1´ 1´ 2´ mittags abends 1´ 1´ 1´ 2´ z Was ist bei der Tabletteneinnahme zu beachten? Die Tabletten sollten 30 bis 60 Minuten vor einer Mahlzeit und nicht mit anderen Medikamenten zusammen eingenommen werden. z Wie geht die Behandlung mit D-Penicillamin nach der 16. Woche weiter? Wenn die Behandlung mit D-Penicillamin gut wirkt, wird Ihr Arzt gemeinsam mit Ihnen versuchen, die Dosis zu verringern. Er will herausfinden, mit welcher Dosis Sie noch gut behandelt werden. Das Risiko unerwünschter Wirkungen nimmt dadurch ab. z Was passiert, wenn die Behandlung mit D-Penicillamin nach 16 Wochen nicht ausreichend wirkt? Sollte sich nach der 16. Woche zeigen, dass noch keine ausreichende Besserung durch die Behandlung mit D-Penicillamin eingetreten ist, wird Ihr Arzt Ihnen eine Steigerung der Dosis empfehlen. Sie wird alle 2 Wochen um je 150 mg gesteigert, bis die Höchstdosis von 900 mg erreicht ist. z Woran merken Sie, dass die Behandlung mit D-Penicillamin wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit D-Penicillamin durchgeführt? Es ist notwendig, dass die Behandlung mit D-Penicillamin langfristig erfolgt. Sie wirkt nur, wenn Sie Ihre Tabletten regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht, sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit D-Penicillamin nicht wirkt? Erst nach 6 Monaten kann man sicher beurteilen, ob die Wirkung der Behandlung mit D-Penicillamin ausbleibt. Wenn die Behandlung mit D-Penicillamin nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit D-Penicillamin. Daher ist eine regelmäßige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede 281 282 z 5.4 Patientenaufklärungsbögen unerwünschte Wirkung zwingt zu einem Abbruch der Therapie. Die meisten im Beipackzettel erwähnten Nebenwirkungen sind selten. z Auf welche Nebenwirkungen müssen Sie selbst achten? Manchmal kommt es zu Geschmacksstörungen. Diese Nebenwirkung ist zwar unangenehm, aber nicht gefährlich. Sie bildet sich nach 2 bis 3 Monaten zurück. Beobachten Sie, ob ein Juckreiz oder ein Hautausschlag auftritt. Achten Sie auf schmerzhafte Bläschen oder Entzündungen im Mund und/oder Rachen. Informieren Sie Ihren Arzt über diese Nebenwirkungen. Sofort sollten Sie Ihren Arzt aufsuchen, wenn Sie eines der folgenden Warnzeichen bemerken: Fieber, Sehschwäche/Doppelbilder, ungewohntes Zahnfleischbluten, „blaue Flecken“. Glücklicherweise sind diese Nebenwirkungen äußerst selten. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Besonders wichtig ist auch eine Urinuntersuchung, um die Nierenfunktion zu prüfen. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Behandlung mit D-Penicillamin auftreten, entscheidet Ihr Arzt über die weitere Behandlung. z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1.–3. Monat: alle 2 Wochen ab 4. Monat: alle 4 Wochen Sollten Sie ungewohnte Beschwerden während der Behandlung mit D-Penicillamin bemerken, dann müssen Sie unverzüglich Ihren Hausarzt informieren. z Was ist außerdem noch während der Behandlung zu beachten? – Während der Behandlung ist bei Frauen eine sichere Empfängnisverhütung notwendig. In der Schwangerschaft und Stillzeit sollte die Behandlung mit D-Penicillamin nicht fortgesetzt werden. – Informieren Sie Ihren Arzt über alle Medikamente, die Sie außerdem noch einnehmen. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.4.6 Methotrexat z 5.4.6 Methotrexat Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Methotrexat Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament Methotrexat empfohlen. Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 4 bis 8 Wochen. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine Dosissteigerung. z Wie wird die Behandlung mit Methotrexat durchgeführt? Methotrexat wird nur 1-mal pro Woche entweder als Tablette unabhängig von den Mahlzeiten oder als Spritze gegeben. Das ist anders als bei anderen Medikamenten. Dosis: ______ mg 1-mal pro Woche z Was müssen Sie während der Methotrexatbehandlung besonders beachten? Sie sollten während der Methotrexatbehandlung möglichst keinen Alkohol trinken. Informieren Sie Ihren Arzt über alle Medikamente, die Sie einnehmen. Eine Schwan- 283 284 z 5.4 Patientenaufklärungsbögen gerschaft muss während der Methotrexatbehandlung und in den ersten 3 Monaten nach Absetzen des Methotrexat sicher verhütet werden. Männer dürfen während der Methotrexatbehandlung und in den ersten 3 Monaten nach dem Absetzen des Methotrexat kein Kind zeugen. z Woran merken Sie, dass die Behandlung mit Methotrexat wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit Methotrexat durchgeführt? Es ist notwendig, dass die Behandlung mit Methotrexat langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Methotrexat regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit Methotrexat nicht wirkt? Erst nach 4 Monaten kann man die Methotrexatbehandlung sicher beurteilen. Wenn das Methotrexat nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Methotrexattherapie. Daher ist eine ständige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. Zur besseren Verträglichkeit kann Ihr Arzt Ihnen eine Tablette Folsäure am Tag nach der Methotrexateinnahme geben. z Auf welche Nebenwirkungen müssen Sie selbst achten? Sofort müssen Sie sich in ärztliche Behandlung begeben, wenn eines der folgenden Warnzeichen auftreten sollte: – Fieber, Luftnot, Reizhusten. Relativ häufig kommt es zu Entzündungen der Mundschleimhaut. Es können auch Übelkeit, Erbrechen und Durchfall auftreten. Manche Patienten nehmen an Gewicht ab. Selten kann ein leichter Haarausfall auftreten. Wenn Sie eine dieser Erscheinungen beobachten, sollten Sie Ihren Arzt spätestens vor der nächsten Tabletteneinnahme oder Spritze informieren. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Auch eine Urinuntersuchung ist notwendig, um die Nierenfunktion zu prüfen. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Methotrexatbehandlung auftreten, entscheidet Ihr Arzt über die weitere Behandlung. Nicht jede unerwünschte Wirkung zwingt zum Abbruch der Therapie. 5.4.6 Methotrexat z z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1. Monat: jede Woche 2. und 3. Monat: alle 2 Wochen ab 4. Monat: alle 4 Wochen Wenn Sie ungewohnte Beschwerden während der Methotrexattherapie bemerken, informieren Sie Ihren Arzt spätestens vor der nächsten Tabletteneinnahme bzw. Spritze. z Was passiert, wenn Sie eine Tabletteneinnahme vergessen oder eine Spritze verpasst haben? Sollten Sie wirklich einmal eine Tabletteneinnahme oder Spritze versäumt haben, sollten Sie diese so schnell wie möglich nachholen. Die nächste Einnahme oder Spritze verschiebt sich entsprechend. Falls Sie sich wegen der weiteren Behandlung unsicher sind, fragen Sie Ihren Arzt. Die Tabletteneinnahme bzw. die Spritze darf allerdings nicht häufiger vergessen werden, da sonst der Behandlungserfolg gefährdet ist. z Was ist außerdem noch während der Behandlung zu beachten? Impfungen sollten während der Methotrexatbehandlung nur nach Rücksprache mit Ihrem Arzt erfolgen. Eine Impfung mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. Vermeiden Sie eine intensive Sonneneinstrahlung. Nach Absetzen von Methotrexat kann ein Krankheitsschub auftreten. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 285 286 z 5.4 Patientenaufklärungsbögen 5.4.7 Azathioprin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Azathioprin Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament Azathioprin empfohlen. Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 4 bis 8 Wochen. Bei manchen kann es auch bis zu 6 Monaten dauern, bis eine Wirkung zu spüren ist. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine Dosissteigerung. z Wie wird die Behandlung mit Azathioprin durchgeführt? Azathioprin wird i. A. in Form von Tabletten verordnet, die 2- bis 3-mal täglich genommen werden. Dosis: _____ Tablette(n) Azathioprin à _____ mg täglich. z Was müssen Sie während der Behandlung mit Azathioprin besonders beachten? – Informieren Sie Ihren Arzt über alle Medikamente, die Sie einnehmen. Besonders vorsichtig müssen Sie sein bei Medikamenten gegen erhöhte Harnsäure. Dazu 5.4.7 Azathioprin z gehören z. B. Zyloric®, Bleminol®, Allo-Puren®. Diese Medikamente enthalten Allopurinol. Azathioprin sollte nicht mit Allopurinolpräparaten zusammen eingenommen werden. – Eine Schwangerschaft sollte während der Behandlung mit Azathioprin und in den ersten 6 Monaten nach Absetzen des Medikamentes sicher verhütet werden. – Männer dürfen während der Behandlung mit Azathioprin und in den ersten 6 Monaten nach dem Absetzen des Azathioprin kein Kind zeugen. z Woran merken Sie, dass die Behandlung mit Azathioprin wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit Azathioprin durchgeführt? Es ist notwendig, dass die Behandlung mit Azathioprin langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Azathioprin regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit Azathioprin nicht wirkt? Erst nach 6 Monaten kann man sicher beurteilen, ob die Wirkung von Azathioprin ausbleibt. Wenn die Behandlung mit Azathioprin nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. Nach Absetzen von Azathioprin kann es zu einem Krankheitsschub kommen. Er lässt sich durch entsprechende Behandlungsmaßnahmen abfangen. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Azathioprin. Daher ist eine häufige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede Nebenwirkung zwingt zum Abbruch der Therapie. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Nicht selten kommt es zu Übelkeit, Erbrechen und Durchfall. Manche Patienten nehmen an Gewicht ab. Wenn Sie eine dieser Erscheinungen beobachten, sollten Sie Ihren Arzt spätestens bei der nächsten Untersuchung informieren. Sofort müssen Sie sich in ärztliche Behandlung begeben, wenn Fieber auftritt. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Auch eine Urinuntersuchung ist notwendig. z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1.–2. Monat: alle 1–2 Wochen ab 3. Monat: alle 4 Wochen 287 288 z 5.4 Patientenaufklärungsbögen Wenn Sie ungewohnte Beschwerden während der Behandlung mit Azathioprin bemerken, dann sollten Sie Ihren Hausarzt unverzüglich informieren. z Was ist außerdem noch während der Behandlung zu beachten? Während der Behandlung mit Azathioprin sollten Impfungen nur nach Rücksprache mit Ihrem Arzt erfolgen. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.4.8 Leflunomid z 5.4.8 Leflunomid Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Leflunomid Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Diese Erkrankung wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach einigen Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als langwirksames Rheumamedikament Leflunomid empfohlen. Ihr Präparat heißt: ____________________________ z Wann tritt die Wirkung ein? Die meisten Patienten verspüren eine Besserung bereits nach 4 bis 6 Wochen. z Wie wird die Behandlung mit Leflunomid durchgeführt? Die Gabe von Leflunomid erfolgt in der Regel als tägliche Einnahme einer Tablette. Die Einnahme ist zu jeder Zeit möglich. Ihre Dosis beträgt __________mg/Tag. Ein schnellerer Wirkungseintritt kann durch die anfängliche Gabe von 100 mg über 3 Tage erreicht werden. 289 290 z 5.4 Patientenaufklärungsbögen z Woran merken Sie, dass die Leflunomidbehandlung wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Leflunomidbehandlung durchgeführt? Es ist notwendig, dass die Leflunomidbehandlung langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Leflunomid regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit wieder verschlimmern. z Was passiert, wenn die Leflunomidbehandlung nicht wirkt? Frühestens nach 4 Monaten kann man die Leflunomidbehandlung sicher beurteilen. Wenn Leflunomid nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Leflunomidtherapie. Daher ist eine ständige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Die meisten der im Beipackzettel erwähnten Nebenwirkungen treten nur selten auf. z Auf welche Nebenwirkungen müssen Sie selbst achten? Es können bei einigen Patienten Appetitlosigkeit, Übelkeit, Erbrechen, Bauchschmerzen, Durchfall, Kopfschmerzen, Müdigkeit, Haarausfall oder Hautrötungen auftreten. Manche Patienten zeigen einen leichten Anstieg des Blutdrucks oder verlieren vorübergehend gering an Gewicht. Wenn Sie eine dieser Erscheinungen beobachten, sollten Sie Ihren Arzt informieren. Er wird dann über die weitere Behandlung entscheiden. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen sowie Veränderungen des Blutdrucks. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Diese Untersuchungen können durch Ihren Hausarzt vorgenommen werden. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Leflunomidbehandlung auftreten, entscheidet Ihr Arzt über die weitere Behandlung. Nicht jede unerwünschte Wirkung zwingt zum Abbruch der Therapie. z Wie oft sollen die Kontrolluntersuchungen durchgeführt werden? In den ersten 6 Monaten: alle 2 Wochen Ab dem 6. Behandlungsmonat: alle 4–8 Wochen Wenn Sie ungewohnte Beschwerden unter der Leflunomidtherapie bemerken, informieren Sie Ihren Arzt. z Was passiert, wenn Sie eine Tabletteneinnahme vergessen haben? Sollten Sie wirklich einmal eine Tabletteneinnahme versäumt haben, sollten Sie diese so schnell wie möglich nachholen, es sei denn, es ist fast schon Zeit für die nächste 5.4.8 Leflunomid z Dosis. Verdoppeln Sie die nächste Dosis als Ausgleich für die Ausgelassene nicht! Falls Sie sich wegen der weiteren Behandlung unsicher sind, fragen Sie Ihren Arzt. Die Tabletteneinnahme darf allerdings nicht häufiger vergessen werden, da sonst der Behandlungserfolg gefährdet ist. z Schwangerschaft Wie bei den meisten anderen Basistherapien ist auch bei Leflunomid eine Gefährdung des ungeborenen Lebens möglich. Eine Schwangerschaft muss daher während der Leflunomidbehandlung und wegen der sehr langen Verweildauer im Körper bis zu 2 Jahre nach Absetzen des Präparates sicher verhütet werden. Wenn Kinderwunsch besteht – auch vielleicht erst in einigen Jahren – sollten Sie Ihren Arzt informieren. Der Arzt wird dann nach Beendigung der Leflunomidbehandlung ein Präparat (Colestyramin oder Aktivkohle) verordnen, welches die Ausscheidung von Leflunomid beschleunigt (s. u.). Im Falle einer bereits eingetretenen Schwangerschaft ist die Therapie sofort zu beenden und das weitere Vorgehen mit dem behandelnden Arzt zu besprechen. Männer sollten während der Leflunomidbehandlung keine Kinder zeugen. Bei Kinderwunsch auch bis zu 2 Jahre nach Beendigung der Leflunomidbehandlung sollte nach Rücksprache mit dem behandelnden Arzt ein Auswaschverfahren durchgeführt werden. Stillzeit: Da Leflunomid in die Muttermilch übergeht, darf unter der Behandlung mit Leflunomid nicht gestillt werden. z Was ist außerdem noch während der Behandlung zu beachten? Sollten Sie während der Behandlung unter Durchfall leiden, so nehmen Sie bitte keine aktivkohlehaltigen Präparate ein, da diese die Wirkung von Leflunomid beeinträchtigen. Leflunomid kann die Marcumarwirkung erheblich verstärken. Wenn Sie Marcumar zur Blutverdünnung einnehmen, sind engmaschige Kontrollen der Gerinnungswerte insbesondere zu Beginn einer Leflunomidtherapie erforderlich. Impfungen sollten während der Leflunomidbehandlung nur nach Rücksprache mit Ihrem Arzt erfolgen. Alkohol sollte während der Behandlung vermieden werden. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 291 292 z 5.4 Patientenaufklärungsbögen 5.4.9 Ciclosporin Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Ciclosporin Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament Ciclosporin empfohlen: Ihr Präparat heißt: __________________________________ z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 4 bis 8 Wochen. Bei manchen kann es auch bis zu 6 Monaten dauern, bis eine Wirkung zu spüren ist. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine Dosissteigerung. z Wie wird die Behandlung mit Ciclosporin durchgeführt? Ciclosporin gibt es als Gelatinekapseln oder als Trinklösung. Die Dosis richtet sich nach Ihrem Körpergewicht. Sie kann sich während der Behandlung ändern. Dosis: morgens: ___ mg abends: ___ mg 5.4.9 Ciclosporin z z Woran merken Sie, dass die Behandlung mit Ciclosporin wirkt? Nach einigen Wochen gehen die Schmerzen und Schwellungen zurück. Morgensteifigkeit und Müdigkeit nehmen ab. Die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie z. B. die Blutsenkung. z Wie lange wird die Behandlung mit Ciclosporin durchgeführt? Es ist notwendig, dass die Behandlung mit Ciclosporin langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Ciclosporin regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht; sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit Ciclosporin nicht wirkt? Erst nach 3 Monaten kann man den Erfolg einer Behandlung mit Ciclosporin sicher beurteilen. Wenn das Ciclosporin nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Ciclosporin. Daher ist eine häufige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er eventuell auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede Nebenwirkung zwingt zum Abbruch der Therapie. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Relativ häufig kommt es zu Veränderungen des Zahnfleisches. Es können auch Übelkeit, Erbrechen und Durchfall auf treten. Manche Patienten nehmen an Gewicht ab. Die Körperbehaarung kann zunehmen. Wenn Sie eine dieser Erscheinungen beobachten, sollten Sie Ihren Arzt informieren. z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen und kontrolliert Ihren Blutdruck. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Auch eine Urinuntersuchung ist notwendig, um die Nierenfunktion zu prüfen. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Ciclosporinbehandlung auftreten, entscheidet Ihr Arzt über die weitere Behandlung. Nicht jede unerwünschte Wirkung zwingt zum Abbruch der Therapie. z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1.–2. Monat: alle 1–2 Wochen ab 3. Monat: alle 4 Wochen Wenn Sie ungewohnte Beschwerden während der Therapie mit Ciclosporin bemerken, informieren Sie Ihren Arzt. 293 294 z 5.4 Patientenaufklärungsbögen z Was ist außerdem noch während der Behandlung zu beachten? – Während der Behandlung mit Ciclosporin sollten Impfungen nur nach Rücksprache mit Ihrem Arzt erfolgen. – Eine Schwangerschaft sollte während der Behandlung vermieden werden. – Dieses Medikament enthält Alkohol! Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.4.10 Cyclophosphamid z 5.4.10 Cyclophosphamid Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Cyclophosphamid Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die immunsuppressiven Medikamente, die helfen, Ihre Erkrankung langfristig zu bessern. z Was sind immunsuppressive Medikamente? Ihre Erkrankung wird durch eine Fehlsteuerung Ihrer Abwehr (Immunsystem) verursacht. Es bilden sich Stoffe, die körpereigene Substanzen angreifen. Daraus entsteht eine chronische Entzündung. Immunsuppressive Medikamente können diese Fehlsteuerung des Immunsystems unterdrücken. Ihnen wird als immunsuppressives Medikament Cyclophosphamid empfohlen: Ihr Präparat heißt: ____________________________ z Wie wird die Behandlung mit Cyclophosphamid durchgeführt? Die Behandlung mit Cyclophosphamid kann entweder mit Tabletten (Cyclophosphamiddauertherapie) oder als Infusion (Cyclophosphamidbolustherapie) erfolgen. Über die für Sie richtige Therapieform entscheidet Ihr Arzt. [ ] Cyclophosphamiddauertherapie: [ ] Cyclophosphamidbolustherapie: Dosis: ____ Tabletten morgens Sie erhalten in der Regel alle 3 Wochen eine Infusion 295 296 z 5.4 Patientenaufklärungsbögen z Was müssen Sie während der Behandlung mit Cyclophosphamid besonders beachten? Cyclophosphamid kann die Blase schädigen. Deswegen müssen Sie während der Therapie viel trinken! Besprechen Sie die notwendige Trinkmenge mit Ihrem Arzt. Zusätzlich bekommen Sie ein Medikament, das die Blasenschleimhaut schützt. Der Wirkstoff heißt Mesna. [ ] Mesna ___________bei Cyclophosphamiddauertherapie morgens Dosis abends [ ] Mesna ___________bei Cyclophosphamidbolustherapie bei Infusion nach 4 Stunden Dosis nach 8 Stunden z Wann tritt die Wirkung ein? Bei der Cyclophosphamiddauertherapie merken die meisten Patienten eine Besserung nach etwa 2–4 Wochen, bei der Cyclophosphamidbolustherapie ist eine Wirkung nach der 2. oder 3. Infusion zu erwarten. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine höhere Dosis. z Wie lange wird eine Cyclophosphamidbehandlung durchgeführt? Es ist notwendig, dass die Cyclophosphamidbehandlung langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Cyclophosphamid regelmäßig einnehmen bzw. Ihre Infusion regelmäßig bekommen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit wieder verschlimmern. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Cyclophosphamidtherapie. Daher ist eine ständige Kontrolle der Behandlung durch Ihren Arzt notwendig. Nur so kann er eventuell auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. z Auf welche Nebenwirkungen müssen Sie selbst achten? Sofort müssen Sie sich in ärztliche Behandlung begeben, wenn eines der folgenden Warnzeichen auftreten sollte: – Fieber – blutiger Urin – Luftnot/Husten – Schmerzen/Brennen beim Wasserlassen – Halsentzündung Außerdem kann Übelkeit auftreten, die sich aber medikamentös bessern lässt. Gelegentlich kommt es zu Haarausfall, der sich nach Therapieende in der Regel zurückbildet. Bei der Cyclophosphamidtherapie besteht ein erhöhtes, dosisabhängiges Risiko für spätere Tumorerkrankungen. Deshalb ist auch nach Abschluss der Behandlung eine weitere Kontrolle durch Ihren Arzt notwendig. 5.4.10 Cyclophosphamid z z Welche Nebenwirkungen bemerkt Ihr Arzt? Durch Blutuntersuchungen kann er Veränderungen an der Blutbildung und an der Leber feststellen. Achten Sie mit auf die weißen Blutkörperchen (Leukozyten). Sie dürfen nicht unter 3000/ll sinken. Auch eine Urinkontrolle ist notwendig. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Cyclophosphamidbehandlung auftreten, entscheidet Ihr Arzt über die weitere Behandlung. Nicht jede unerwünschte Wirkung zwingt zum Abbruch der Therapie. z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? [ ] Cyclophosphamiddauertherapie __-mal pro Woche Blutuntersuchung (Leukozyten < 3000/ll?) __-mal pro Woche Urinuntersuchung [ ] Cyclophosphamidbolustherapie Blutuntersuchung am 8., 10. und 12. Tag nach der Infusion, eventuell in Abhängigkeit von den Werten auch häufiger, Urinuntersuchung Zur Kontrolle Ihrer Behandlung werden die Medikamentendosis und die Laborwerte in einen Therapiepass eingetragen. z Was ist außerdem noch während der Behandlung zu beachten? Impfungen sollten während der Behandlung mit Cyclophosphamid nur nach Rücksprache mit Ihrem Arzt erfolgen. Eine Schwangerschaft muss während der Behandlung vermieden werden. Informieren Sie Ihren Arzt über alle Medikamente, die Sie einnehmen. Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2002) 297 298 z 5.4 Patientenaufklärungsbögen 5.4.11 Mycophenolsäure Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Mycophenolsäure Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament Mycophenolsäure empfohlen. Ihr Präparat heißt: __________________________________ Mycophenolsäure ist nur zur Kombinationsbehandlung bei Patienten nach Organtransplantation zugelassen. Ein individueller Heilversuch rechtfertigt sich bei Rheumaerkrankungen mit bedrohlicher Beteiligung innerer Organe. Hier konnte in Studien bei Patienten, die auf die konventionelle Therapie nicht ausreichend angesprochen oder Nebenwirkungen entwickelt haben, eine deutliche Besserung erzielt werden. Erfahrungen bei Kindern liegen nicht vor. z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 4 bis 8 Wochen. Wenn die Wirkung nicht ausreicht, dann entscheidet Ihr Arzt über eine Dosissteigerung. 5.4.11 Mycophenolsäure z z Wie wird die Behandlung mit Mycophenolsäure durchgeführt? Mycophenolsäure wird im Allgemeinen in Form von Tabletten verordnet, die 2- bis 3-mal täglich genommen werden. Dosis: ___ -mal ___ Tablette(n) Mycophenolsäure à ___ mg täglich z Was müssen Sie während der Behandlung mit Mycophenolsäure besonders beachten? – Informieren Sie Ihren Arzt über alle Medikamente, die Sie einnehmen. Mycophenolsäure sollte vor dem Essen und mit 2 Stunden Abstand zu Eisenpräparaten und Medikamenten gegen Magensäure eingenommen werden. – Eine Schwangerschaft sollte während der Behandlung mit Mycophenolsäure und in den ersten 6 Wochen nach Absetzen des Medikamentes sicher verhütet werden. Es darf während der Behandlung nicht gestillt werden. – Männer dürfen während der Behandlung mit Mycophenolsäure und in den ersten 6 Wochen nach dem Absetzen des Mycophenolsäure kein Kind zeugen. – Aus der Transplantationsmedizin ist als Spätfolge eine erhöhte Krebsrate besonders für Hautkrebs bekannt. Es ist ungeklärt, ob dies auch auf die Therapie rheumatischer Krankheiten zutrifft. z Woran merken Sie, dass die Behandlung mit Mycophenolsäure wirkt? Nach einigen Wochen gehen die Beschwerden zurück. Die Müdigkeit nimmt ab, die Belastbarkeit steigt. Oft bessern sich auch die Entzündungszeichen im Blut, wie zum Beispiel die Blutsenkung. z Wie lange wird die Behandlung mit Mycophenolsäure durchgeführt? Es ist notwendig, dass die Behandlung mit Mycophenolsäure langfristig erfolgt. Sie wirkt nur, wenn Sie Ihr Medikament regelmäßig einnehmen. Die Behandlung muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. z Was passiert, wenn die Behandlung mit Mycophenolsäure nicht wirkt? Im Allgemeinen kann man nach 3 Monaten beurteilen, ob die Mycophenolsäure wirkt. Wenn die Behandlung mit Mycophenolsäure nicht ausreichend wirkt, wird Ihr Arzt die Therapie ändern. Nach Absetzen von Mycophenolsäure kann es zu einem Krankheitsschub kommen. Er lässt sich durch entsprechende Behandlungsmaßnahmen abfangen. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Mycophenolsäure. Daher ist eine regelmäßige Kontrolle der Behandlung durch Ihren Arzt notwendig. Nur so kann er eventuell auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede Nebenwirkung zwingt zum Abbruch der Therapie. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Nicht selten kommt es zu Übelkeit, Erbrechen und Durchfall. Manchmal treten auch Blutungen aus dem Darm bei starkem Durchfall auf. Infektionen von Haut, Schleimhäuten, Atemwegen und Magen-Darm-Trakt wurden häufiger beobachtet. Wenn Sie eine dieser Erscheinungen beobachten, sollten Sie Ihren Arzt umgehend informieren. 299 300 z 5.4 Patientenaufklärungsbögen z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Haut- und Schleimhautveränderungen. Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und Blutbildung feststellen. Auch eine Urinuntersuchung ist notwendig. z Wie oft müssen die Kontrolluntersuchungen durchgeführt werden? 1.–2. Monat: alle 1–2 Wochen ab 3. Monat: alle 4 Wochen Wenn Sie ungewohnte Beschwerden während der Behandlung mit Mycophenolsäure bemerken, dann sollten Sie Ihren Hausarzt unverzüglich informieren. z Was ist außerdem noch während der Behandlung zu beachten? Während der Behandlung mit Mycophenolsäure sollten keine Impfungen mit Lebendimpfstoffen erfolgen. Auch andere Impfungen können zu Problemen führen oder einen unzureichenden Schutz bieten und sollten daher nur nach Rücksprache mit Ihrem Arzt erfolgen. Vermeiden Sie intensive Sonnenbestrahlung! Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand Januar 2006) 5.4.12 Infliximab z 5.4.12 Infliximab Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Infliximab Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung, die mit verschiedenen Medikamenten behandelt wird. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. Ihnen wird als Rheumamedikament Infliximab empfohlen. Ihr Präparat heißt: ____________________________ Infliximab ist ein Medikament, das in der Fachsprache als TNF-Blocker bezeichnet wird und zu den sog. Biologicals gehört. Biologicals sind Medikamente, die in biologischen Systemen, meist in Zellkulturen, hergestellt werden. z Was sind TNF-Blocker und wie wirken sie? Die Hemmung von TNF-alpha ist ein neues Behandlungsprinzip in der Rheumatologie. TNF-alpha-Blocker binden den Tumornekrosefaktor-a (TNF-a), einen Botenstoff des Immunsystems, und verhindern dessen biologische Wirkung. TNF-a ist bei entzündlich-rheumatischen Erkrankungen wesentlich an der Gelenkentzündung beteiligt. Seine Hemmung vermindert Schmerzen, Schwellungen und das Fortschreiten der Erkrankung. z Für welche Patienten kommt die Therapie mit Infliximab in Frage? Das Medikament wurde zur Behandlung entzündlich rheumatischer Krankheiten zugelassen, wenn das Ansprechen auf andere Basistherapeutika unzureichend ist oder diese zu Nebenwirkungen führen. z Wie wird die Behandlung mit Infliximab durchgeführt? Der Wirkstoff Infliximab wird Ihnen als eine Infusion über eine Vene zu Beginn der Behandlung und dann zu den Zeitpunkten nach 2 und 6 Wochen und dann alle 6 bis 8 Wochen gegeben. Sie erhalten Infliximab normalerweise in der Dosierung von 301 302 z 5.4 Patientenaufklärungsbögen 3 mg/kg Körpergewicht. In Einzelfällen kann eine Dosissteigerung auf 5 bis 10 mg pro kg Körpergewicht oder eine Verkürzung der Zeitintervalle zwischen den Infusionen notwendig sein. Die Dauer der Infusion beträgt ca. 2 Stunden. Während und bis mindestens 1 Stunde nach der Infusion müssen Sie überwacht werden. Zumeist wird Ihnen Ihr Arzt gleichzeitig zur Therapie mit Infliximab eine Behandlung mit Methotrexat vorschlagen. Die Kombination aus Methotrexat und Infliximab verstärkt die Wirkung der Behandlung und scheint die Bildung von Antikörpern gegen Infliximab zu vermindern. z Wann tritt die Wirkung ein? Die Wirkung kann schon am ersten Tag eintreten. Spätestens ist nach 2 bis 3 Wochen mit einem Wirkungseintritt zu rechnen. Eine spürbare Wirkung tritt bei mindestens der Hälfte der behandelten Patienten auf. z Können Nebenwirkungen auftreten? Alle erwähnten Nebenwirkungen sind mit üblichen Medikamenten im Regelfall problemlos unter Kontrolle zu bringen. Die häufigsten unerwünschten Wirkungen unter Infiximabtherapie sind Kopfschmerzen, Übelkeit, Husten, Hitzewallungen und Hautausschlag. Nicht ausgeschlossen ist ein vermehrtes Auftreten von Harnwegs- oder Atemwegsinfekten. Unter der Behandlung sind auch vereinzelt Fälle von Tuberkulose aufgetreten. Infliximab stellt ein Fremdeiweiß für den Organismus dar. Deshalb ist die Entwicklung von Antikörpern gegen Infliximab möglich und es kann unter der Therapie mit Infliximab zu allergischen Reaktionen kommen, vor allem nach mehrmaliger Behandlung. Diese Reaktionen können evtl. schwerwiegend verlaufen. Teilen Sie daher Ihrem Arzt bitte auf jeden Fall mit, ob Sie früher schon einmal mit Infliximab behandelt worden sind. Sehr selten auftretende Nebenwirkungen sind Symptome, die denen bei der Krankheit Lupus erythematodes (einer Bindegewebserkrankung) ähneln. Hierbei handelt es sich um vorübergehende Haut- und Gelenkentzündungen, die nach Beendigung der Infliximabbehandlung wieder abklingen. In vereinzelten Fällen wurde in den bisher durchgeführten Studien die Bildung von Lymphomen (bösartige Neubildungen des lymphatischen Gewebes) beobachtet, ohne dass ein ursächlicher Zusammenhang vorliegen muss. Dabei handelte es sich um Patienten, welche einen langen Krankheitsverlauf hatten und bereits andere immunsupprimierende Therapien erhalten hatten. Es ist bekannt, dass unter Therapien, die das Immunsystem beeinflussen, Lymphome häufiger auftreten können. Eine abschließende Bewertung bezüglich einer möglichen Verursachung von Lymphomen durch Infliximabtherapie ist zur Zeit noch nicht möglich. z Welche Wechselwirkungen mit anderen Medikamenten können auftreten? Kortisonpräparate führen nach bisherigen Erkenntnissen nicht zu unerwünschten Wechselwirkungen mit Infliximab. Erkenntnisse über Wechselwirkungen von Infliximab mit anderen Medikamenten liegen nicht vor. z Schwangerschaft Über die Auswirkungen einer Infliximabtherapie in der Schwangerschaft und beim Stillen liegen keine ausreichenden Erfahrungen vor. Eine Schwangerschaft muss deshalb während der Infliximabbehandlung und in den ersten 6 Monaten nach Absetzen des Infliximab sicher verhütet werden. Männer dürfen während der Infliximab- 5.4.12 Infliximab z behandlung und in den ersten 6 Monaten nach dem Absetzen des Infliximab kein Kind zeugen. z Was ist außerdem noch während der Behandlung zu beachten? Infliximab wird erst seit 1998 zur Behandlung von Patienten eingesetzt. Damit fehlen wie bei allen neuen Medikamenten Langzeiterfahrungen. Eine Impfung mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. Informieren Sie Ihren Arzt über alle Medikamente, die Sie außerdem noch einnehmen. Nehmen Sie zusätzlich andere Rheumamedikamente, müssen deren mögliche Nebenwirkungen wie bisher berücksichtigt werden. Informieren Sie Ihren Arzt, wenn Sie vor einem größeren operativen Eingriff stehen. Dann muss individuell über eine Therapiepause entschieden werden. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006). Weitere Informationen zur Behandlung mit TNF-a-Blockern finden Sie unter www.rheumanet. org 303 304 z 5.4 Patientenaufklärungsbögen 5.4.13 Etanercept Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Etanercept Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung, die mit verschiedenen Medikamenten behandelt wird. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. Ihnen wird als Rheumamedikament Etanercept empfohlen. Ihr Präparat heißt: __________________________________ Etanercept ist ein Medikament, das in der Fachsprache als TNF-Blocker bezeichnet wird und zu den sog. Biologicals gehört. Biologicals sind Medikamente, die in biologischen Systemen, meist in Zellkulturen, hergestellt werden. z Was sind TNF-Blocker und wie wirken sie? Die Hemmung von TNF-alpha ist ein neues Behandlungsprinzip in der Rheumatologie. TNF-alpha-Blocker binden den Tumornekrosefaktor-a (TNF-a), einen Botenstoff des Immunsystems, und verhindern dessen biologische Wirkung. TNF-a ist bei entzündlich-rheumatischen Erkrankungen wesentlich an der Gelenkentzündung beteiligt. Seine Hemmung vermindert Schmerzen, Schwellungen und das Fortschreiten der Erkrankung. z Wie wird die Behandlung mit Etanercept durchgeführt? Etanercept gibt es nur als Spritze, die unter die Haut (= subkutan) gegeben wird. Dosis: ___ mg ___ mal pro Woche subkutan. Die Injektion kann von Ihnen selbst, einer ausgebildeten Hilfsperson oder Ihrem Arzt durchgeführt werden. Wenn Sie das Spritzen selbst durchführen wollen, müssen Sie die Zubereitung der Substanz und die Technik beherrschen. Die Etanerceptfläschchen, die Trockensubstanz beinhalten, müssen im Kühlschrank bei +2 bis +8 8C gelagert werden, sie dürfen nicht einfrieren. Zur Injektion muss eine Injektionslösung hergestellt werden (vgl. die den Fläschchen beilie- 5.4.13 Etanercept z gende Gebrauchsanweisung der Firma). Sollte sich das gesamte Pulver in der Durchstechflasche nicht innerhalb von 10 Minuten aufgelöst haben, dann dürfen Sie die Lösung nicht spritzen, sondern müssen eine neue herstellen. Die Etanerceptlösung sollte unverzüglich verwendet werden. Bei Unklarheiten, insbesondere auch, wenn Sie einen neuen Arzt besuchen, nehmen Sie immer den Arzneimittelkarton oder den Beipackzettel mit. z Woran merken Sie, dass die Behandlung mit Etanercept wirkt? Eine Besserung der Schmerzen und Schwellungen wird nach 1 bis 2 Wochen eintreten, evtl. auch erst später. Die Morgensteifigkeit nimmt ab. z Wie lange wird die Behandlung mit Etanercept durchgeführt? Es ist notwendig, dass die Behandlung mit Etanercept langfristig erfolgt. Sie wirkt nur, wenn Sie die Behandlung regelmäßig bekommen. Sie muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. Falls Sie einmal eine Injektion vergessen haben, sollten Sie die nächste Etanerceptinjektion sobald wie möglich nachholen. z Was passiert, wenn die Behandlung mit Etanercept nicht wirkt? Ein Teil der Patienten spricht nicht ausreichend auf eine alleinige Etanercepttherapie an. In diesen Fällen kann eine Kombination mit lang wirksamen Rheumamedikamenten erfolgen. Die Auswahl der in Frage kommenden Medikamente erfolgt durch Ihren Rheumatologen. z Auf welche Nebenwirkungen müssen Sie achten? Bei jeder Behandlung können unerwünschte Begleiterscheinungen auftreten, dies gilt auch für die Therapie mit Etanercept. Daher sind regelmäßige Kontrolluntersuchungen durch Ihren Arzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Die häufigsten Nebenwirkungen sind zumeist harmlose Reaktionen an der Injektionsstelle wie Jucken, Wundgefühl, Rötung oder Schmerzen, die sich durch Kühlen oder eine Allergiesalbe bessern lassen. Im Allgemeinen nehmen diese Reaktionen nach dem ersten Behandlungsmonat ab. Die Injektionsstelle sollte gewechselt werden. Falls nach einer Injektion ein ausgedehnter Hautausschlag, ein geschwollenes Gesicht oder Schwierigkeiten beim Atmen auftreten, suchen Sie unverzüglich Ihren Arzt oder eine Krankenhausnotaufnahme auf. Andere Nebenwirkungen während einer Etanercepttherapie können lästig sein, zwingen aber nicht zum Absetzen der Behandlung. Dazu können zum Beispiel gehören: eine verstopfte Nase, Kopfschmerzen, Benommenheit oder ein Schwächegefühl. Wenn verstärkte Übelkeit, Erbrechen oder eine Blutungsneigung auftreten, sollten Sie Ihren Arzt informieren. Wichtig ist, dass Sie Ihren Arzt bei Fieber und Infekten fragen, ob Sie die Etanercepttherapie fortsetzen dürfen. Da die Substanz den Tumornekrosefaktor-a, der auch zur Abwehr von Erregern benötigt wird, blockiert, kann es bei Ihnen unter der Therapie zu vermehrten Infektionen kommen. Sie dürfen Etanercept nicht injizieren, wenn eine schwerwiegende Infektion bei Ihnen vorliegt. 305 306 z 5.4 Patientenaufklärungsbögen Der derzeitige Wissensstand kann nicht ausschließen, dass Tumorerkrankungen (Krebs) durch die Etanercepttherapie fortschreiten. Deshalb sollten Patienten mit Tumorerkrankungen nur nach Abwägung der individuellen Risiken behandelt werden. Sollte bei Ihnen während der Therapie eine Tumorerkrankung neu auftreten, muss individuell über die Fortführung der Etanercepttherapie entschieden werden. Unklar ist zurzeit auch, ob das Risiko eine multiple Sklerose (Erkrankung des zentralen Nervensystems) zu bekommen, durch die Behandlung erhöht ist. z Wie oft müssen Kontrolluntersuchungen durchgeführt werden? 1.–3. Monat: alle 14 Tage 4.–6 Monat: alle 4 Wochen ab 7. Monat: alle 3 Monate z Welche Nebenwirkungen können durch den Arzt festgestellt werden? Der Arzt wird festlegen, ob bestimmte Risiken für die Anwendung der Etanercepttherapie vorliegen. Unter der Etanerceptbehandlung werden regelmäßig Blutbildkontrollen durchgeführt. Bei nicht abheilenden Infekten, insbesondere der oberen Atemwege, oder bei Fieber sollte eine Röntgenaufnahme der Lunge durchgeführt werden. Vereinzelt wurde über eine Verminderung der Blutzellen berichtet. z Schwangerschaft Über die Auswirkungen einer Etanercepttherapie in der Schwangerschaft und beim Stillen liegen keine ausreichenden Erfahrungen vor. Eine Schwangerschaft muss deshalb während der Etanerceptbehandlung und in den ersten 3 Monaten nach Absetzen des Etanercept sicher verhütet werden. Männer dürfen während der Etanerceptbehandlung und in den ersten 3 Monaten nach dem Absetzen des Etanercept kein Kind zeugen. z Was ist außerdem noch während der Behandlung zu beachten? Etanercept wird erst seit wenigen Jahren zur Behandlung von Patienten eingesetzt, damit fehlen Langzeiterfahrungen. Eine Impfung mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. Informieren Sie Ihren Arzt über alle Medikamente, die sie außerdem noch einnehmen. Nehmen Sie zusätzlich andere Rheumamedikamente, müssen deren mögliche Nebenwirkungen wie bisher berücksichtigt werden. Informieren Sie Ihren Arzt, wenn Sie vor einem größeren operativen Eingriff stehen. Dann muss individuell über eine Therapiepause entschieden werden. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen zur Behandlung mit TNF-a-Blockern finden Sie unter www.rheumanet.org 5.4.14 Adalimumab z 5.4.14 Adalimumab Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Adalimumab Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung, die mit verschiedenen Medikamenten behandelt wird. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. Ihnen wird als Basistherapeutikum Adalimumab empfohlen: Ihr Präparat heißt: ____________________________ Adalimumab ist ein Medikament, das in der Fachsprache als TNF-alpha-Blocker bezeichnet wird und zu den sog. Biologicals gehört. Biologicals sind Medikamente, die in biologischen Systemen, meist in Zellkulturen, hergestellt werden. z Was sind TNF-alpha-Blocker und wie wirken sie? Die Hemmung von TNF-alpha ist ein neues Behandlungsprinzip in der Rheumatologie. TNF-alpha-Blocker binden den Tumornekrosefaktor-a (TNF-a), einen Botenstoff des Immunsystems, und verhindern dessen biologische Wirkung. TNF-a ist bei entzündlich-rheumatischen Erkrankungen wesentlich an der Gelenkentzündung beteiligt. Seine Hemmung vermindert Schmerzen, Schwellungen und das Fortschreiten der Erkrankung. z Wie wird die Behandlung mit Adalimumab durchgeführt? Die übliche Dosis für Erwachsene mit rheumatoider Arthritis beträgt 40 mg Adalimumab und wird alle 2 Wochen unter die Haut injiziert. Nach einer Einweisung in die Injektionstechnik und mit Einverständnis Ihres Arztes können Sie sich Adalimumab selbst injizieren. Um eine optimale Wirksamkeit der Behandlung zu gewährleisten, wird die Anwendung von Methotrexat in der Regel während der Behandlung mit Adalimumab fortgesetzt. Sollten Sie eine Unverträglichkeit gegenüber Methotrexat aufweisen oder die Behandlung mit Methotrexat aus anderen Gründen nicht weiterführen können, kann Adalimumab auch alleine angewandt werden. 307 308 z 5.4 Patientenaufklärungsbögen Sollten Sie kein Methotrexat begleitend zu Ihrer Adalimumabbehandlung erhalten, kann Ihr Arzt sich für eine wöchentliche Gabe von 40 mg Adalimumab entscheiden. z Wann tritt die Wirkung ein? Die Wirkung kann schon am ersten Tag eintreten. Spätestens nach 2 bis 3 Wochen ist mit einem Wirkungseintritt zu rechnen. z Können Nebenwirkungen auftreten? Bei jeder Behandlung können unerwünschte Begleiterscheinungen auftreten, dies gilt auch für die Therapie mit Adalimumab. Die häufigsten unerwünschten Wirkungen der Adalimumabtherapie sind Reaktionen an der Einstichstelle. Unerwünschte Arzneimittelwirkungen können auch andere allergische Reaktionen sein wie Hautausschlag, Nesselsucht, Juckreiz, Schwierigkeiten beim Atmen oder Schlucken. Hinweise auf eine unerwünschte Wirkung am Herzen oder an der Lunge können Kurzatmigkeit in Ruhe oder bei Belastung oder Schwellungen der Füße sein. Auch wenn Kribbeln, Taubheit, Doppeltsehen, Schwäche in Armen oder Beinen auftreten oder Zeichen einer Infektion wie Husten, Fieber, Unwohlsein, schlecht heilende Wunden, Zahnprobleme, Brennen beim Wasserlassen, Gefühl der Schwäche oder Müdigkeit, kann dies eine Nebenwirkung der Therapie sein. Die meisten Nebenwirkungen sind leicht bis mäßiggradig ausgeprägt und mit üblichen Medikamenten ausreichend zu behandeln. Manchmal sind sie aber so schwerwiegend, dass sie ein Absetzen der Therapie erfordern. Daher ist es wichtig, dass Sie auch im Zweifelsfall Ihren Arzt benachrichtigen. z Was müssen Sie bei der Anwendung anderer Medikamente beachten? Adalimumab kann zusammen mit Methotrexat oder anderen Basistherapeutika (Sulfasalazin, Hydroxychloroquin, Leflunomid und injizierbaren Goldzubereitungen), Steroiden oder Schmerzmitteln, einschließlich nichtsteroidaler entzündungshemmender Arzneimittel, verwendet werden. Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Medikamente einnehmen oder bis vor kurzem eingenommen haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. z Schwangerschaft und Stillzeit Über die Auswirkungen einer Adalimumabtherapie in der Schwangerschaft und beim Stillen liegen keine ausreichenden Erfahrungen vor. Eine Schwangerschaft muss deshalb während der Adalimumabbehandlung und in den ersten 3 Monaten nach Absetzen des Adalimumab sicher verhütet werden. Männer dürfen während der Adalimumabbehandlung und in den ersten 3 Monaten nach dem Absetzen des Adalimumab kein Kind zeugen. z Was ist außerdem während der Behandlung mit Adalimumab noch zu beachten? Während der Behandlung mit Adalimumab sollten einige Impfstoffe (Lebendimpfstoffe) nicht verwendet werden. Bitte besprechen Sie jede Impfung vorher mit Ihrem Arzt. Informieren Sie auch Ihren Arzt, wenn Sie vor einem operativen Eingriff stehen, damit er individuell über eine Therapiepause entscheiden kann. Da vereinzelt Fälle von Tuberkulose bei mit Adalimumab behandelten Patienten berichtet wurden, wird Ihr Arzt Sie vor Beginn der Behandlung mit Adalimumab auf Anzeichen und Symptome einer auch früher durchgemachten Tuberkulose untersuchen. Wenn Sie früher eine Tuberkulose durchgemacht haben, sollte Adalimumab nur gegeben werden, wenn gleichzeitig eine Tuberkuloseprophylaxe mit dem geeigneten Medikament (INH in Kombination mit Vitamin B6) über 9 Monate erfolgt. 5.4.14 Adalimumab z Auch wenn Sie multiple Sklerose haben, wird Ihr Arzt sorgfältig abwägen müssen, ob Sie Adalimumab erhalten. z Lagerung und Aufbewahrung: Die Adalimumabfertigspritzen müssen in der Faltschachtel, bei +28 bis +88 C im Kühlschrank gelagert werden, sie dürfen nicht einfrieren. z Transport und Reisen: Sie können die Adalimumabfertigspritzen in einer Kühltasche mit Kühlelement, z. B. auf Reisen, transportieren. Eine geeignete Kühltasche erhalten Sie über Ihren Arzt oder Apotheker. Die Einfuhr von Medikamenten unterliegt häufig besonderen Regularien. Über Ihren Arzt oder Apotheker können Sie einen mehrsprachigen „HUMIRA-Reisepass“ beziehen, der alle für Auslandsreisen notwendigen Informationen enthält. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2006). Weitere Informationen zur Behandlung mit TNFa-Blockern finden Sie unter www.rheumanet.org 309 310 z 5.4 Patientenaufklärungsbögen 5.4.15 Anakinra Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Anakinra Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung, die mit verschiedenen Medikamenten behandelt wird. Besonders wichtig sind die lang wirksamen Rheumamedikamente, die sog. Basistherapie. Ihnen wird als Rheumamedikament Anakinra empfohlen: Ihr Präparat heißt: ____________________________ Anakinra ist ein Medikament, das in der Fachsprache als Interleukin-1-Rezeptor-Antagonist bezeichnet wird. z Was ist ein Interleukin-1-Rezeptor-Antagonist und wie wirkt er? Zytokine sind Eiweiße, die der Körper als Botenstoffe zwischen Zellen einsetzt. Einer dieser Botenstoffe, das Interleukin-1 (IL-1), spielt eine wichtige Rolle bei der Auslösung und Unterhaltung der Entzündung. Ein anderer körpereigener Botenstoff, der Interleukin-1-Rezeptor-Antagonist (IL-1Ra), kontrolliert die Wirkung des IL-1, indem er den Kontakt von IL-1 mit der Zielzelle blockiert. Bei der rheumatoiden Arthritis wird IL-1 in so großen Mengen gebildet, dass der körpereigene IL-1Ra nicht mehr ausreicht, um die Wirkung von IL-1 zu hemmen. Anakinra ist ein gentechnisch hergestellter IL-1Ra, der in therapeutischen Dosen den Überschuss an IL-1 aufhebt. Dadurch wird bei der rheumatoiden Arthritis die mit Schmerzen, Schwellungen und fortschreitender Gelenkzerstörung verbundene Entzündung in den Gelenken gebessert. z Für welche Patienten kommt die Therapie mit Anakinra in Frage? Anakinra wird zur Behandlung der rheumatoiden Arthritis in Kombination mit einem anderen Arzneimittel, Methotrexat, verwendet. Anakinra kann bei Patienten eingesetzt werden, die nicht ausreichend auf Methotrexat allein ansprechen. 5.4.15 Anakinra z Anakinra ist ausschließlich zur Anwendung bei Erwachsenen (18 Jahre und älter) bestimmt. z Wie wird die Behandlung mit Anakinra durchgeführt? Anakinra wird als Fertigspritze 1-mal täglich unter die Haut (subkutan) gespritzt, möglichst immer zur gleichen Tageszeit. Die Injektion kann von Ihnen selbst, einer ausgebildeten Hilfsperson oder Ihrem Arzt durchgeführt werden. Wenn Sie das Spritzen selbst durchführen wollen, müssen Sie die Technik beherrschen. Die Anakinrafertigspritzen müssen im Kühlschrank bei +28 bis +8 8C gelagert werden; bewahren Sie Anakinra in der Originalpackung auf, um den Inhalt vor Licht zu schützen. Sobald eine Fertigspritze aus dem Kühlschrank entnommen worden ist und Raumtemperatur (bis zu 25 8C) erreicht hat, muss sie entweder innerhalb von 12 Stunden verwendet oder verworfen werden. Bei Unklarheiten, insbesondere auch, wenn Sie einen neuen Arzt besuchen, nehmen Sie immer den Arzneimittelkarton oder den Beipackzettel mit. z Woran merken Sie, dass die Behandlung mit Anakinra wirkt? Eine Besserung der Symptome der rheumatoiden Arthritis tritt nach ca. 2 Wochen, evtl. auch erst später ein. z Wie lange wird die Behandlung mit Anakinra durchgeführt? Anakinra wirkt nur, wenn Sie die Behandlung regelmäßig bekommen. Sie muss auch dann fortgeführt werden, wenn es Ihnen besser geht. Sonst kann sich die Krankheit verschlimmern. Falls Sie einmal eine Injektion vergessen haben, sollten Sie die nächste Anakinrainjektion nach Rücksprache mit Ihrem Arzt sobald wie möglich nachholen. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Anakinratherapie. Daher ist eine ständige Kontrolle der Behandlung durch Ihren Hausarzt notwendig. Nur so kann er evtl. auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Auf welche Nebenwirkungen müssen Sie selbst achten? Sofort müssen Sie sich in ärztliche Behandlung begeben, – wenn Warnzeichen einer Infektion auftreten sollten wie Fieber, Husten sowie Rötungen und Schmerzempfindlichkeit der Haut, – wenn Sie nach der Injektion von Anakinra einen Hautausschlag am ganzen Körper bekommen, kurzatmig werden, Pfeifgeräusche beim Atmen bemerken, einen schnellen Puls bekommen oder schwitzen. Dies können Anzeichen dafür sein, dass Sie gegen Anakinra allergisch sind. Sehr häufige Nebenwirkungen sind Kopfschmerzen und vor allem Hautreaktionen (Rötungen, Schwellungen, Bluterguss oder Juckreiz) an den Einstichstellen. Hautreaktionen treten bei mehr als der Hälfte der Patienten auf. Sie sind in der Regel leicht bis mäßig und kommen häufiger zu Beginn der Behandlung mit Anakinra vor. 311 312 z 5.4 Patientenaufklärungsbögen z Welche Nebenwirkungen bemerkt Ihr Arzt? Der Arzt achtet auf Infektionszeichen. Eine häufige Nebenwirkung ist die Verminderung weißer Blutkörperchen, welche das Risiko für eine Infektion erhöhen kann. Durch Blutuntersuchungen kann er Veränderungen an der Blutbildung feststellen. Falls bei Ihnen Nebenwirkungen im Zusammenhang mit der Anakinrabehandlung auftreten, entscheidet Ihr Arzt über die weitere Behandlung. Nicht jede unerwünschte Wirkung zwingt zum Abbruch der Therapie. z Schwangerschaft und Stillzeit Über die Auswirkungen einer Anakinratherapie in der Schwangerschaft und beim Stillen liegen keine ausreichenden Erfahrungen vor. Eine Schwangerschaft muss deshalb während der Anakinrabehandlung und in den ersten 3 Monaten nach Absetzen des Anakinra sicher verhütet werden. Männer dürfen während der Anakinrabehandlung und in den ersten 3 Monaten nach dem Absetzen des Anakinra kein Kind zeugen. z Was ist außerdem bei der Behandlung zu beachten? Anakinra wird außerhalb von klinischen Studien erst seit kurzer Zeit zur Behandlung bei Patienten eingesetzt. Damit fehlen wie bei allen neuen Medikamenten Langzeiterfahrungen an größeren Patientenkollektiven. Sprechen Sie mit Ihrem Arzt, wenn Sie eine Vorgeschichte wiederkehrender Infektionen haben oder an Asthma leiden. Anakinra kann diese Zustände verschlimmern. Sprechen Sie mit Ihrem Arzt, wenn Sie Krebs haben. Ihr Arzt muss entscheiden, ob Sie Anakinra dennoch verwenden dürfen. Eine Impfung mit Lebendimpfstoffen sollte während der Therapie nicht erfolgen. Informieren Sie Ihren Arzt über alle Medikamente, die Sie außerdem noch einnehmen. Nehmen Sie zusätzlich andere Rheumamedikamente, müssen deren mögliche Nebenwirkungen wie bisher berücksichtigt werden. Informieren Sie Ihren Arzt, wenn Sie vor einem größeren operativen Eingriff stehen. Dann muss individuell über eine Therapiepause entschieden werden. Bei weiteren Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand August 2006) Weitere Informationen finden Sie unter www.rheumanet.org 5.4.16 Rituximab z 5.4.16 Rituximab Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Rituximab Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Sie wird mit verschiedenen Medikamenten behandelt. Besonders wichtig sind die lang wirksamen Rheumamedikamente. z Was sind lang wirksame Rheumamedikamente? Diese Medikamente sollen Ihre Erkrankung langfristig verbessern. Sie sollen das Fortschreiten Ihrer Erkrankung aufhalten. Diese Behandlung wirkt nicht sofort, sondern erst nach mehreren Wochen. Dafür hält ihre Wirkung auch länger an. Ihnen wird als lang wirksames Rheumamedikament Rituximab empfohlen: Ihr Präparat heißt: ____________________________ Rituximab ist ein Medikament, das zu den sog. Biologicals gehört. Biologicals sind Medikamente, die mit gentechnischen Methoden in biologischen Systemen, meist in Zellkulturen, hergestellt werden. Heute wissen wir viel mehr über die beteiligten Abwehrzellen, die an der Aufrechterhaltung des Entzündungsprozesses bei entzündlich-rheumatischen Krankheiten beteiligt sind. Dazu gehören auch die B-Zellen, die das Merkmal CD20 auf ihrer Oberfläche tragen. Diese B-Zellen produzieren neben vielen anderen Autoantikörpern auch den sog. Rheumafaktor. Rituximab blockiert diese CD20-positiven B-Zellen und unterbindet damit auch den Entzündungsprozess. z Wann tritt die Wirkung ein? Die meisten Patienten merken eine Besserung nach 2 bis 8 Wochen. 313 314 z 5.4 Patientenaufklärungsbögen z Wie wird die Behandlung mit Rituximab durchgeführt? Rituximab wird eingesetzt, wenn eine vorherige Therapie mit anderen Basistherapien (z. B. Methotrexat) und/oder anderen Biologicals (z. B. TNF-a-Blockern) nicht ausreichend wirksam war. Rituximab wird in aller Regel in Kombination mit Methotrexat gegeben. Rituximab wird als intravenöse Infusion über ca. 4 Stunden gegeben. In aller Regel werden 2 Infusionen im Abstand von 2 Wochen gegeben. Es kommt meist zu einer monatelangen Blockade der CD20-positiven B-Zellen und damit zu einer lang andauernden Wirkung. Wenn die CD20-positiven B-Zellen wieder aktiv werden und sich die Krankheit wieder verschlechtert, können erneut eine oder zwei Rituximabinfusionen gegeben werden. z Welche Nebenwirkungen können auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit Rituximab. Während der Infusion (in aller Regel nur bei der ersten Infusion) kann es zu einer Infusionsreaktion kommen, die meist mild ist und mit grippeähnlichen Beschwerden verläuft. Es können Hautausschlag, Juckreiz, Übelkeit, Erbrechen Kopfschmerzen, Fieber, Schüttelfrost, leichter Blutdruckanstieg oder -abfall auftreten. Weniger als 1% der Patienten erleiden eine schwerwiegende Infusionsreaktion mit starkem Blutdruckabfall, Atemnot, Schwellungen des Gesichtes. Um dieses Risiko zu verringern, erhalten Sie vor der Infusion Medikamente gegen Fieber und allergische Reaktionen, unter anderem auch einmalig Kortison. Außerdem werden Sie während der Infusion und ggf. danach sorgfältig überwacht. Schon beim Verdacht auf eine Infusionsreaktion wird die Infusionsgeschwindigkeit verlangsamt oder die Infusion kurz unterbrochen. Nach Abschluss der Rituximabinfusion sind Nebenwirkungen selten. Es besteht ein geringfügig erhöhtes Risiko für Infektionen, insbesondere der Atem– und Harnwege. In Einzelfällen kann es zu Blutbildveränderungen kommen. z Was müssen Sie bei der Behandlung mit Rituximab noch beachten? – Eine Schwangerschaft sollte während der Behandlung mit Rituximab sicher verhütet werden, da es keinerlei Informationen zur Sicherheit für das ungeborene Kind gibt. Es wird eine Wartezeit von 12 Monaten nach der letzten Infusion empfohlen. Für männliche Patienten sollte bis zur Zeugung eines Kindes das gleiche Intervall eingehalten werden. – Das Ansprechen auf Impfungen (z. B. Grippeimpfung) kann schlechter sein. Dies sollte Sie jedoch nicht davon abhalten, bestimmte gerade für Sie empfohlene Impfungen (z. B. Grippeimpfung) durchführen zu lassen. Am besten sollten schon vor dem Beginn der Rituximabtherapie notwendige Impfungen durchgeführt werden. Während der Behandlung mit Rituximab sollten keine Impfungen mit Lebendimpfstoffen erfolgen. z Welche Kontrollen sind unter Rituximab nötig? Sie sollten besonders auf jegliche Anzeichen eines Infektes achten, der länger als üblich dauert, und dann umgehend Ihren Arzt aufsuchen. Wenn Sie Rituximab in Kombination mit Methotrexat oder einem anderen Basistherapeutikum bekommen, werden die entsprechenden Kontrollen wie dort empfohlen fortgesetzt. Darüber hinaus werden keine regelmäßigen Blut- oder Urinkontrollen empfohlen. Bei weiteren Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der Arbeitsgemeinschaft kooperativer regionaler Rheumazentren in der DGRh (Stand Januar 2007) Weitere Informationen finden Sie unter www.rheumanet.org 5.4.17 Kortison z 5.4.17 Kortison Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit Kortison Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Bei Ihnen ist eine Behandlung mit Kortison erforderlich. z Was ist Kortison? Kortison ist ein lebensnotwendiges Hormon, das der Körper selbst in der Nebennierenrinde herstellt. In hohen Dosen wirkt dieses Hormon stark entzündungshemmend. Das wird in der Behandlung Ihrer Erkrankung genutzt. Kortison, Glukokortikoide und Steroide sind verschiedene Namen für die gleiche Medikamentengruppe. Die einzelnen Präparate unterscheiden sich in ihrer Wirkstärke und in ihren Nebenwirkungen. Ein häufig eingesetzter Kortisonwirkstoff heißt Prednisolon. z Ihnen wird folgendes Kortisonpräparat empfohlen: ___________________________ z Wann tritt eine Wirkung ein? Eine Besserung tritt sehr rasch innerhalb von Stunden bis Tagen ein. z Wie wird die Behandlung mit Kortison durchgeführt? Die für Sie erforderliche Dosis richtet sich nach Ihrer Erkrankung. In der Regel wird mit einer hohen Kortisondosis begonnen, um Ihre Erkrankung schnell zu bessern. So bekommen Sie zu Beginn zum Beispiel 30 mg oder auch 250 mg Prednisolon täglich. Wenn eine Wirkung eingetreten ist, wird Ihr Arzt die Dosis reduzieren und, wenn möglich, die Behandlung auch beenden. z Was ist eine Low-dose-Therapie? Darunter versteht man eine längerfristige Kortisonbehandlung mit einer möglichst niedrigen Dosis. Ihr Arzt wird mit Ihnen gemeinsam die für Sie gerade noch wirksame Kortisonmenge ermitteln. Dazu wird er in kleinen Schritten die Dosis abbauen, zum Beispiel alle 4 Wochen um 1 mg Prednisolon. Die Dosis sollte so niedrig wie möglich sein, um das Risiko unerwünschter Wirkungen zu verringern. Inzwischen weiß man, dass selbst geringe Kortisonmengen wie z. B. 3–6 mg Prednisolon wirksam sind. 315 316 z 5.4 Patientenaufklärungsbögen z Was müssen Sie bei einer Kortisonbehandlung unbedingt beachten? Sie nehmen Ihre Kortisontabletten morgens auf einmal ein, am besten in der Zeit zwischen 6 und 8 Uhr. Der Körper produziert in den frühen Morgenstunden das meiste Kortison, sodass eine Einnahme morgens die körpereigene Hormonbildung am wenigsten stört. Manchmal ist es erforderlich, dass auch abends noch eine geringe Kortisondosis eingenommen werden muss. Darüber entscheidet Ihr Arzt. z Wie lange wird die Behandlung mit Kortison durchgeführt? Die Behandlungsdauer richtet sich nach Ihren Beschwerden und Ihren medizinischen Befunden. Bei Besserung kann die Dosis nach Rücksprache mit Ihrem Arzt reduziert oder die Behandlung ganz beendet werden. Häufig ist aber gerade bei chronischen Erkrankungen eine längerfristige, niedrigdosierte Kortisontherapie erforderlich. z Können Nebenwirkungen auftreten? Da Kortison nicht nur bei rheumatischen Erkrankungen, sondern auch zum Beispiel bei Asthma oder entzündlichen Darmerkrankungen eingesetzt wird, haben viele Patienten schon etwas über die Kortisonbehandlung gehört. Sie haben häufig Angst vor möglichen Nebenwirkungen. Kortisonschäden sind heute aber viel seltener als in der Anfangszeit der Kortisonbehandlung, weil mittlerweile bekannt ist, dass gerade die Dosierung und die Behandlungszeit eine große Bedeutung für das Auftreten von unerwünschten Wirkungen haben. Kurzfristig können auch höhere Dosen ohne Bedenken eingenommen werden. Für eine längerfristige Therapie wird Ihr Arzt stets versuchen, eine möglichst geringe Dosis zu wählen. Die Nebenwirkungen sind inzwischen gut bekannt und können durch entsprechende Untersuchungen rechtzeitig erfasst werden. Dies erfordert allerdings, dass Sie regelmäßig die Kontrolluntersuchungen bei Ihrem Arzt durchführen lassen. Sollte eine unerwünschte Wirkung bei Ihnen eintreten, so bildet sich diese nach Absetzen der Kortisonbehandlung oft zurück. Beenden Sie aber niemals Ihre Kortisontherapie ohne Rücksprache mit Ihrem Arzt! z Welche Nebenwirkungen können auftreten? Unerwünschte Wirkungen treten vor allem bei langfristiger und hochdosierter Kortisonbehandlung auf, bei niedrigeren Dosen sind sie seltener. Viele Patienten berichten über ein stärkeres Hungergefühl. Es kann auch zu einem runderen Gesicht oder einer Muskelschwäche kommen. Einige Patienten bemerken Veränderungen an der Haut, wie z. B. vermehrt Pickel oder kleinere Blutungen. Gelegentlich kommt es zu psychischen Reaktionen auf eine Kortisontherapie. Einige fühlen sich euphorisch, seltener sind Depressionen. Sollten Sie schon einmal an einer Depression erkrankt sein, sagen Sie dies ihrem Arzt. Eine Entkalkung der Knochen, eine sog. Osteoporose, kann sich besonders bei einer längeren und höher dosierten Kortisontherapie entwickeln. Deswegen erhalten viele zusätzlich Kalzium und Vitamin D, um einer Osteoporose vorzubeugen. Gelegentlich kommt es auch zu Blutzuckersteigerungen, die eine entsprechende Behandlung erfordern. Magenschleimhautentzündung und Magengeschwüre treten meist auf, wenn gleichzeitig andere Medikamente, wie z. B. kortisonfreie Entzündungshemmer (NSAR) oder Azetylsalizylsäure (z. B. Aspirin, ASS) eingenommen werden. Wenn Sie Fieber haben oder wenn andere Hinweise auf eine Infektion vorliegen, suchen Sie Ihren Arzt umgehend auf. Ungewöhnlich starker Durst und häufiges Wasserlassen können auf eine Zuckerkrankheit hinweisen. Sollten bei Ihnen solche Beschwerden auftreten, informieren Sie ebenfalls Ihren Arzt darüber. 5.4.17 Kortison z z Worauf sollten Sie selbst während einer Kortisontherapie achten? Eine Kortisonbehandlung darf niemals ohne Rücksprache mit Ihrem Arzt abgebrochen werden, denn durch die Therapie ist die körpereigene Kortisonproduktion möglicherweise unterdrückt. Es kann sonst zu gefährlichen Mangelerscheinungen kommen, da Ihr Körper nicht in der Lage ist, sofort wieder eine ausreichende Kortisonmenge herzustellen. Außerdem wird sich Ihre Erkrankung verschlechtern. Durch eine kalziumreiche Ernährung können Sie dazu beitragen, dass sich eine Osteoporose möglichst nicht entwickelt oder, falls bei Ihnen schon eine Osteoporose bestehen sollte, nicht verschlechtert. Jeden Tag sollten Sie etwa 1–1,5 g Kalzium zu sich nehmen. Viel Kalzium ist zum Beispiel in Milch (1 l Milch = 1,2 g Kalzium) und Milchprodukten, wie Käse oder Jogurt, enthalten. Außerdem sollten Sie besonders während einer Kortisontherapie auf eine ausgeglichene eiweiß- und vitaminreiche Ernährung achten. Wichtig ist eine salzarme Kost, um Wassereinlagerungen zu vermeiden. Sie sollten sich einmal wöchentlich wiegen und Ihr Gewicht aufschreiben. Bei einer Gewichtszunahme überprüfen Sie Ihre Ernährung: Wieviel Kalorien habe ich täglich zu mir genommen? Sprechen Sie außerdem mit Ihrem Arzt, ob möglicherweise Wassereinlagerungen vorliegen können. z Wie oft müssen die Kontrolluntersuchungen bei Ihrem Arzt durchgeführt werden? Die notwendigen Kontrollen richten sich nach Ihrer Erkrankung und der deswegen erforderlichen Kortisondosis. Ihr Arzt entscheidet, wie oft Sie zu einer Untersuchung in die Praxis kommen sollen. Zusätzlich sollte bei längerfristiger Kortisontherapie einmal im Jahr eine augenärztliche Untersuchung erfolgen. z Was ist außerdem noch während der Behandlung zu beachten? z Informieren Sie Ihren Arzt über alle Medikamente, die sie außerdem noch einnehmen. z Sie sollten regelmäßig Aufzeichnungen über Ihre Medikation führen (z. B. in einem Medikamentenpass) und diese mit sich führen. z Die Behandlung mit Kortison kann auch während einer Schwangerschaft oder Stillzeit fortgesetzt werden. Sprechen Sie mit Ihrem Arzt. z Fragen Sie bei jeder Spritze, die Sie wegen Ihrer Gelenkbeschwerden in den Muskel bekommen sollen, ob sie Kortison enthält. Diese Behandlungsform ist veraltet, da sie stärkere Nebenwirkungen als eine Therapie mit Kortisontabletten hat. Bei Fragen rufen Sie uns bitte an: Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand August 2002) 317 318 z 5.4 Patientenaufklärungsbögen 5.4.18 Kortisonfreie Entzündungshemmer – nichtsteroidale Antirheumatika Tragen Sie bitte in diesem Feld den Briefkopf ein: Arbeitsgemeinschaft Regionaler Kooperativer Rheumazentren in der Deutschen Gesellschaft für Rheumatologie Behandlung mit kortisonfreien Entzündungshemmern – nichtsteroidalen Antirheumatika Eine Information für den Patienten Name: ____________________________ Geb.-Dat.: _________________________ Liebe Patientin, lieber Patient, Sie leiden an einer rheumatischen Erkrankung. Ihre Krankheit heißt: ____________________________ Ihnen wird ein nichtsteroidales Antirheumatikum (NSAR) empfohlen. Dieses Medikament gehört zur Gruppe kortisonfreier Entzündungshemmer. In der Fachsprache heißen sie Antirheumatika (NSAR). z Was sind nichtsteroidale Antirheumatika? Diese Medikamente sollen Ihre Beschwerden möglichst rasch verbessern. Sie wirken entzündungshemmend und schmerzlindernd, enthalten aber kein Kortison. Der langfristige Verlauf Ihrer Erkrankung wird durch die NSAR nicht geändert. z Wie wird die Behandlung mit NSAR durchgeführt? In Abhängigkeit von der Art und der Schwere der Erkrankung wird eine Therapie mit nichtsteroidalen Antirheumatika entweder bei Bedarf oder regelmäßig durchgeführt. Für Sie ist folgende Behandlung empfohlen: [ ] Bedarf: [ ] regelmäßig: (max.: ____ pro Tag) morgens mittags abends zur Nacht z Woran merken Sie, dass die Behandlung mit NSAR wirkt? Innerhalb von Stunden bessern sich Schmerzen und Schwellungen. Morgensteifigkeit und Müdigkeit nehmen ab. Spritzen sind weder stärker noch besser verträglich als 5.4.18 Kortisonfreie Entzündungshemmer – nichtsteroidale Antirheumatika z Tabletten oder Zäpfchen. Die Wirkung Ihres Medikaments hält nur so lange an, wie Sie es einnehmen. z Wie lange wird die Behandlung mit NSAR durchgeführt? Die Behandlungsdauer richtet sich nach Ihren Beschwerden. Bei Besserung kann die Dosis nach Rücksprache mit Ihrem Arzt verringert oder die Behandlung ganz beendet werden. z Was passiert, wenn die Behandlung mit NSAR nicht wirkt? Wenn Ihr Medikament nicht ausreichend wirkt, entscheidet Ihr Arzt über eine mögliche Dosiserhöhung oder er verordnet Ihnen ein anderes Präparat. z Können Nebenwirkungen auftreten? Bei jeder wirksamen Behandlung können unerwünschte Wirkungen auftreten. Das gilt auch für die Therapie mit NSAR. Daher ist eine regelmäßige Kontrolle der Behandlung durch Ihren Arzt notwendig. Nur so kann er eventuell auftretende Nebenwirkungen rechtzeitig erkennen und die erforderlichen Maßnahmen ergreifen. Dann bilden sich die Nebenwirkungen in der Regel vollständig zurück. Nicht jede unerwünschte Wirkung zwingt zum Abbruch der Therapie. Da sich die einzelnen Medikamente in ihren Nebenwirkungen unterscheiden, kann schon ein Wechsel des Präparates zu einer besseren Verträglichkeit führen. Die meisten der im Beipackzettel erwähnten Nebenwirkungen sind selten. z Welche Nebenwirkungen können auftreten? Viele Nebenwirkungen sind ungefährlich. Einige Patienten klagen über Übelkeit, Erbrechen, Durchfall und Bauchschmerzen. Ursache dafür kann eine Magenschleimhautentzündung oder seltener ein Magengeschwür sein. Dies gilt besonders für Patienten, die außer NSAR auch Kortison einnehmen. Wenn bei Ihnen schon einmal eine Magenerkrankung bestanden hat, teilen Sie dies Ihrem Arzt mit. Andere haben Kopfschmerzen oder Schwindelgefühl oder sind außergewöhnlich müde. Diese Beschwerden treten vor allem in den ersten Wochen der Behandlung auf. Gelegentlich kommt es zu Juckreiz, Hautausschlag, schmerzhaften Bläschen im Mund-/Rachenbereich oder Haarausfall. Es können auch Wassereinlagerungen oder eine Blutdrucksteigerung auftreten. In Abhängigkeit von der Dauer und Dosis der Einnahme kann das Risiko für einen Herzinfarkt oder Hirnschlag steigen. NSAR sollten deshalb nur so lange, wie ihre Wirkung nötig ist, eingenommen werden. Wenn Sie Fieber, Blut im Stuhl oder schwarzen Stuhl haben, informieren Sie umgehend Ihren Arzt darüber. z Welche Nebenwirkungen bemerkt Ihr Arzt? Durch Blutuntersuchungen kann er Veränderungen an der Leber, an den Nieren und an der Blutbildung feststellen. Auch eine Urinuntersuchung ist notwendig. Bei länger anhaltenden Magenbeschwerden wird Ihr Arzt eine Magenspiegelung veranlassen. Sollte bei Ihnen eine Magenschleimhautentzündung oder ein Geschwür nachgewiesen werden, dann entscheidet Ihr Arzt über die weitere Behandlung. 319 320 z 5.4 Patientenaufklärungsbögen z Was ist außerdem noch während der Behandlung zu beachten? – Informieren Sie Ihren Arzt über alle Medikamente, die sie außerdem noch einnehmen. – Fragen Sie Ihren Arzt, ob Sie zusätzlich andere Schmerzmedikamente einnehmen dürfen. – Die Behandlung mit einigen NSAR kann in bestimmten Zeitintervallen auch während einer Schwangerschaft oder Stillzeit fortgesetzt werden. Einige NSAR sollen von Frauen mit Schwangerschaftswunsch nicht eingenommen werden. Sprechen Sie mit Ihrem Arzt. – Fragen Sie bei jeder Spritze, die Sie wegen Ihrer Gelenkbeschwerden bekommen sollen, was sie enthält. Bei Fragen rufen Sie uns bitte an. Verfasser: Projektgruppe Diagnose- und Therapierichtlinien der AG Regionaler Kooperativer Rheumazentren in der DGRh (Stand 2007) 5.5.1 Rheumatoide Arthritis z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.1 Rheumatoide Arthritis (ICD-Nr. M 05.0 bis .9, M 06.0) z Grundsätzliche Bemerkungen zur Therapiestrategie Die rheumatoide Arthritis (RA; chronische Polyarthritis) ist eine chronische entzündliche Systemerkrankung unbekannter Ursache, die bevorzugt die Membrana synovialis von Gelenken und Sehnenscheiden betrifft, seltener auch die Haut, Blutgefäße und innere Organe. Die entzündlichen Veränderungen äußern sich in schmerzhaften Schwellungen – meist in symmetrischer Verteilung – vorwiegend an den Gelenken von Händen, Füßen und der oberen Halswirbelsäule und führen durch Destruktion der befallenen Strukturen häufig zu Deformitäten und fortschreitendem Funktionsverlust sowie zu Behinderungen und sozialen Nachteilen. Die Lebenserwartung ist verkürzt. Charakteristisch ist der Nachweis von Rheumafaktoren und/oder Antikörpern gegen cyclisches citrulliniertes Peptid (CCP). Primärziel der Behandlung ist die Verminderung und Beseitigung von entzündungsbedingten Schmerzen, Schwellungen und Funktionseinschränkungen an Gelenken und Sehnenscheiden, um eine Teil- oder Vollremission [10] der Krankheit zu erreichen. Die Therapie versucht darüber hinaus im Sinne der Sekundärprävention, entzündungsbedingte Gelenk- und Sehnenscheidendestruktionen mit Deformität und Funktionsverlust zu vermeiden [1] und die psychosozialen Folgen zu minimieren. Die Strategie besteht in der möglichst frühen, remissionsinduzierenden und erhaltenden Therapie mit Kombination verschiedener medikamentöser und anderer Therapieverfahren orientiert an Krankheitsaktivität und Schadensentwicklung. z Voraussetzungen Die Diagnose der chronischen Polyarthritis sollte gesichert sein. Als Orientierung können hierzu die Kriterien des American College of Rheumatology verwendet werden [3] (s. Kap. 3.1) und die Leitlinie der DGRh [4 a]. Voraussetzung für die meist lebenslange Therapie ist eine gründliche Information und Schulung des RA-Patienten über seine Krankheit und die Möglichkeiten der Behandlung (s. Kap. 17). 321 322 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Notwendig sind regelmäßige ärztliche Kontrolluntersuchungen [2] zur z Krankheitsaktivität (Zahl schmerzhafter und geschwollener Gelenke, DAS – „disease activity score“, Dauer der morgendlichen Gelenksteifigkeit, Blutsenkung und/oder C-reaktives Protein u. a.), z Arzneimittelverträglichkeit (Anamnese, körperliche Untersuchung, Labortests s. Kap. 5.3.13), z Progredienz von radiologischen Gelenkveränderungen (Hände/Füße dorsoventral; in den ersten 3 Krankheitsjahren alle 12 Monate [5]), z Funktionskapazität (Beweglichkeit, Kraft; Fähigkeiten im täglichen Leben). Notwendig ist eine enge Kooperation zwischen dem z Primärarzt z Rheumatologen (Sicherung der Diagnose, Abstimmung und Anpassung des Therapie- und Rehabilitationsplanes u. a.; s. Kap. 14 bis 16) und z Rheumachirurgen (s. Kap. 7) sowie z Funktionstherapeuten – Physiotherapeut, Ergotherapeut (s. Kap. 8 und 9), z Sozialarbeiter (s. Kap. 12) und z evtl. dem Psychotherapeuten (s. Kap. 11). Die Wahl der Therapie und die Behandlungsstrategie sollten sich orientieren z an der Krankheitsaktivität und Ausdehnung der Polysynovitis, z an Art und Schweregrad extraartikulärer Manifestationen (z. B. Rheumaknoten, Vaskulitis, u. a.), z am bereits eingetretenen strukturellen und funktionellen Schaden, z an prognostischen Indikatoren des zu erwartenden Verlaufs (Rheumafaktortiter, CCP-Antikörper, Zahl schmerzhafter und geschwollener Gelenke, Destruktionstendenz (Erosivität)), z am psychosozialen Status, z am Alter des Patienten, z an allgemeinen und therapiespezifischen Risikofaktoren (z. B. eingeschränkte Nierenfunktion). Zur Vermeidung oder Begrenzung von irreversiblen Gelenkdestruktionen und von Funktionsverlust sollte die systemische medikamentöse Therapie möglichst früh und wirksam mit dem Ziel einer Vollremission (s. Kapitel 4) erfolgen. Dies bedeutet in den meisten Fällen eine Kombinationsbehandlung mit Arzneimitteln verschiedener Substanzgruppen. Hierdurch sind nicht nur unmittelbar entzündungsbedingte Veränderungen (Schmerz, Schwellung) zu bessern, sondern in der Regel auch destruierende Prozesse mittelfristig deutlich zu verlangsamen. z Medikamentöse Therapie Für die systemische medikamentöse Therapie stehen als rasch wirksame Entzündungshemmer zahlreiche nichtsteroidale Antirheumatika (NSAR) bzw. Antiphlogistika (vorwiegend Cyclooxigenasehemmer; s. Kap. 5.1) sowie Gluko- 5.5.1 Rheumatoide Arthritis z kortikosteroide (s. Kap. 5.2) zur Verfügung. Auch die Tumornekrosefaktor-Alpha (TNF-a) hemmenden Substanzen (Infliximab, Etanercept, Adalimumab) (1.11) und der IL-1- Rezeptorantagonist (Kineret®) haben einen schnellen Wirkungseintritt. Substanzen mit verzögertem Wirkungseintritt („slow acting antirheumatic drugs“, SAARD) sind die sog. Basistherapeutika (s. Kap. 5.3), von denen einige (Goldsalze, Methotrexat, Leflunomid, Salazopyrin, Ciclosporin A) auch die Progredienz destruierender Gelenkveränderungen hemmen. Zytotoxische Substanzen (Cyclophosphamid u. a.) werden vorwiegend bei Patienten mit schwerer rheumatoider Vaskulitis oder bei schwerer rheumatoider Arthritis eingesetzt, die auf konventionelle Maßnahmen nicht ansprechen (sog. „therapieresistente“ RA). Lokale medikamentöse Therapiemaßnahmen ergänzen die systemische Therapie. Im Vordergrund stehen intraartikuläre und peritendinöse Injektionen von Glukokortikosteroiden und Radio-, seltener Chemosynoviorthesen. Diese Verfahren kommen vorwiegend dann zum Einsatz, wenn einzelne Gelenke bzw. Sehnenscheiden auf die systemische Medikation nicht ausreichend angesprochen haben oder wenn an den betroffenen Gelenken zu Therapiebeginn entzündliche Veränderungen stark ausgeprägt sind. Als ergänzende lokale Therapiemaßnahmen werden in Abhängigkeit von der lokalen Entzündungsaktivität und anderen Faktoren (s. Kap. 8) auch verschiedene Formen der physikalischen Therapie zur Entzündungshemmung (z. B. Kryotherapie), Schmerzlinderung (z. B. analgesierende Elektrotherapie) oder zur Behandlung von Ödemen (z. B. Lymphdrainage) eingesetzt. Operative Therapiemaßnahmen (Synovektomien, s. Kap. 7.2 ff.) kommen vor allem dann zum Einsatz, wenn die systemische und lokale medikamentöse Therapie zu keiner ausreichenden Rückbildung der Synovitis führt und progrediente Gelenkschäden erkennbar sind. In Abhängigkeit von Beschwerden und Funktionseinschränkungen durch bereits eingetretene Gelenkschäden ist die Durchführung arthroplastischer und endoprothetischer Maßnahmen zu prüfen. Sie umfassen die aktivitätsangepasste krankengymnastische und ergotherapeutische Funktionstherapie, Orthesen-, Hilfsmittel- und Schuhversorgung sowie verhaltensmodifizierende Interventionen (z. B. Gelenkschutztraining, Schmerzbewältigungstraining u. a.). z Therapie verschiedener Verlaufsformen und Manifestationen der rheumatoiden Arthritis Medikamentöse Therapie bei Beginn der rheumatoiden Arthritis Es besteht Einigkeit darüber, Patienten mit einer RA nach Diagnosestellung möglichst frühzeitig mit einer Kombination aus kurz wirksamen und langsam wirksamen Medikamenten (Basistherapeutika) zu behandeln, mit dem Ziel eine Remission zu erreichen. Verschiedene Basistherapeutika (s. Kap. 5.3) unterscheiden sich in ihrem Wirkungseintritt. Ein vergleichsweise früher Wirkungseintritt (nach 4 bis 8 Wochen) ist bei Methotrexat, Leflunomid und bei Salazopyrin zu erwarten. 323 324 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Abb. 1. Therapiestrategie bei rheumatoider Arthritis Eine allgemein akzeptierte Rangordnung der Wirksamkeit für die Basistherapeutika bei der RA existiert nicht. Antimalariamittel und Auranofin werden jedoch allgemein als weniger wirksam angesehen. Ein gutes Ansprechen liegt vor, wenn der Disease Activity Score (DAS) um mehr als 1,2 gesenkt werden kann. Eine Hemmung der Progression erosiver Gelenkveränderungen ist für diese Substanzen bisher nicht nachgewiesen. Die Metaanalyse zahlreicher Langzeittherapiestudien mit Basistherapeutika [6] zeigt, dass Patienten mit einer Methotrexattherapie am längsten unter dieser Behandlung bleiben. Wegen der höheren Rate des Ansprechens der parenteralen (subcutanen) Methotrexat-Therapie ist insbesondere bei hoher Krankheitsaktivität zu Therapiebeginn die parenterale Applikation sinnvoll. Regelmäßige Kontrollen der Verträglichkeit und Wirksamkeit der Basistherapie (s. Kap. 5.1.16 und 4) sind erforderlich. Wegen des unterschiedlich lange dauernden Wirkungseintritts der Basistherapie ist eine „Überbrückungstherapie“ mit einem nichtsteroidalen Antiphlogistikum und/oder einem oral verabreichten Glukokortikoidpräparat sinnvoll. Die Notwendigkeit einer gleichzeitigen systemischen Glukokortikoidtherapie ergibt sich aus der Krankheitsaktivität; der initiale Einsatz von Kortikosteroiden vermindert die Gelenkdestruktion. Auch bei hoher Krankheitsaktivität sind Tagesdosen von bis zu 30 mg Prednisonäquivalent meist ausreichend; dabei wirkt sich die zeitlich befristete Verabreichung in geteilten Dosen (2/3 morgens, 1/3 abends) günstig vor allem auf die morgendliche Gelenksteifigkeit aus. Das erhöhte Risiko peptischer Läsionen einer kombinierten Behandlung mit NSAR und Glukokortikosteroiden insbesondere bei älteren Menschen ist zu beachten (Gastroprotektion; s. Kap. 5.1.3). Bei älteren Patienten ist daher oft die Kombination von Analgetika (z. B. Paracetamol) mit Glukokortikosteroiden in dieser Situation vorzuziehen. 5.5.1 Rheumatoide Arthritis z Im Behandlungsverlauf wird die Glukokortikosteroiddosis je nach Krankheitsaktivität und nach Wirkung der Basistherapie reduziert. Die Glukokortikosteroidtherapie wird nach Erreichen einer Remission ausschleichend beendet, das NSAR als Bedarfs- ggf. auch als niedriger dosierte Dauermedikation weitergeführt. Die Empfehlungen des 5. Workshops der Arbeitsgemeinschaft der Regionalen Kooperativen Rheumazentren der DGRh sind in Abb. 1 dargestellt. Einzelheiten sind in der interdisziplinären Leitlinie der DGRh [4 a] „Management der frühen rheumatoiden Arthritis“ dargestellt (www.dgrh.de). Remissionserhaltende Therapie Auch nach Eintritt einer Remission (s. Kapitel 4; DAS < 1,6 [10]) soll die Basistherapie fortgeführt werden. Das Absetzen der Therapie führt insbesondere bei rheumafaktorpositiven Patienten mit initial hoher Entzündungsaktivität nach Wochen bis Monaten regelmäßig (> 80%) zu einer erneuten Zunahme der Krankheitsaktivität der RA. Ein Konsensus über die Dosisreduktion von Basistherapeutika oder die Dauer der remissionserhaltenden Therapie besteht nicht. Bei der parenteralen Goldtherapie kann ein Wirkungsverlust bei Vergrößerung der Injektionsabstände auf mehr als 14 Tage auftreten. Medikamentöse Therapie bei Teilremission der rheumatoiden Arthritis In der Mehrzahl der Fälle wird durch eine Monotherapie mit Methotrexat oder anderen Basistherapeutika nur eine Teilremission erreicht. Eines oder mehrere Gelenke und/oder Sehnenscheiden sind noch aktiv entzündet, im Blut finden sich noch entzündliche Veränderungen. Mehrere Optionen stehen zur Verfügung: z die lokale Behandlung mit intraartikulären Glukokortikoiden (z. B. mit Triamcinolonhexacetonid), z eine Radiosynoviorthese mit 90-Yttrium, 186-Rhenium, 169-Erbium u. a. (s. Kap. 5.6), z evtl. die Synovektomie (Gelenke, Sehnenscheiden), z eine Low-dose-Glukokotikoidtherapie (bis 7,5 mg Prednisolonäquivalent/Tag), z die Dosiserhöhung des Basistherapeutikums (z. B. beim Methotrexat, alternativ parenterale Gabe), z der Wechsel des Basistherapeutikums, z die zusätzliche Gabe eines weiteren Basistherapeutikums. Es empfiehlt sich in Abhängigkeit von der Gesamtbeurteilung der Krankheitsaktivität, zuerst die Lokalmaßnahmen auszuschöpfen, ehe man sich zu einer weiteren systemischen Langzeittherapie mit den entsprechenden Risiken unerwünschter Wirkungen entschließt. Über den Nutzen der Kombination verschiedener langsam wirkender Arzneimittel (Basistherapeutika) liegen teilweise noch keine ausreichenden Daten vor [5]. Kombinationen von Methotrexat mit Chloroquindiphosphat und Sulfasalazin oder von Methotrexat und Ciclosporin A haben sich in kontrollierten 325 326 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Studien den Einzelsubstanzen gegenüber als überlegen erwiesen. Auch die Kombination von Methotrexat mit TNF-a-hemmenden Substanzen zeigt additive Effekte auf die Krankheitsaktivität. Für andere Kombinationen sind die bisherigen Studien negativ, nicht ausreichend oder widersprüchlich. Zum Vorgehen bei anhaltend hoher Krankheitsaktivität siehe unten. Therapie des entzündlichen Schubs unter laufender Basistherapie Von einem polysynovitischen Schub der RA wird gesprochen, wenn an zahlreichen Gelenken oder Sehnenscheiden (> 6) schmerzhafte Schwellungen auftreten mit morgendlicher Gelenksteife (> 1 Stunde) und Zunahme von Entzündungszeichen im Blut. Vergleichende wissenschaftliche Untersuchungen verschiedener Vorgehensweisen beim Auftreten einer polysynovitischen Schubsituation der RA existieren nicht. Im Einzelfall ist mangelhafte Compliance auszuschließen. Zu entscheiden ist über die Beibehaltung oder den Wechsel der Basistherapie und über den Einsatz zusätzlicher Maßnahmen. Bei der Entscheidung über eine Änderung der Basistherapie sind die Häufigkeit, Intensität und Dauer vorausgegangener Krankheitsschübe und die radiologische Progression zu berücksichtigen. Die zusätzliche Gabe oder Dosiserhöhung von Glukokortikosteroiden (bis 30 mg Prednisonäquivalent) evtl. mit verteilten Dosen über 3 bis 6 Wochen in absteigender Dosierung (s. Kap. 5.2) und die Lokaltherapie (intraartikuläre Injektionen von Glukokortikoiden) werden in erster Linie eingesetzt. Bei Zunahme der Entzündungsaktivität eines oder weniger Gelenke kommt zuerst die Anwendung von Lokalmaßnahmen zum Zuge (Kryotherapie, topische NSAR, intraartikuläre Glukokortikosteroide, evtl. Radiosynoviorthese). Behandlung bei anhaltend aktiver rheumatoider Arthritis Eine anhaltend aktive Polysynovitis zahlreicher Gelenke und Sehnenscheiden (DAS > 5,1) mit rascher Progredienz destruierenden Gelenkveränderungen und persistierend hohen Entzündungswerten im Blut wird als „therapieresistente“ RA bezeichnet, wenn sie auf mehrere verschiedene Basistherapeutika auch in Kombination nicht zufriedenstellend angesprochen hat und weiterhin einen hohen Glukokortikoidbedarf aufweist (> 10 bis 20 mg Prednisonäquivalent/Tag). Mögliche therapeutische Vorgehensweisen sind z hochdosierte perorale (1 bis 2 mg Prednisolonäquivalent pro kg Körpergewicht und Tag) oder intravenöse Glukokortikoidtherapie („pulse therapy“ mit (100) 250 bis 1000 mg 6-Methyl-Prednisolon als Infusion an 3 aufeinander folgenden Tagen) mit nachfolgender niedrigdosierter peroraler Glukokortikoidtherapie [8] und/oder z intravenöse Methotrexattherapie 15 bis 30 mg i. v. pro Woche [12], z TNF-a-blockierende Substanzen oder IL-1-Rezeptor-Antagonist in Kombination mit Methotrexat, bei unzureichender Wirkung Rituximab oder Abatacept 5.5.1 Rheumatoide Arthritis z z Cyclophosphamid 1 bis 2 mg pro kg Körpergewicht und Tag peroral oder 1 g i. v. als Infusion alle 4 Wochen [13]. Therapie der Rheumaknoten Rheumaknoten treten fast ausschließlich bei aktiver und erosiver rheumafaktorpositiver RA auf. Eine spezifische medikamentöse Therapie existiert nicht. Von einigen Therapeuten werden parenterale Goldsalze zur Basistherapie bevorzugt. In Einzelfällen ist chirurgisches Vorgehen erforderlich. Therapie der rheumatoiden Vaskulitis Besonderer medikamentöser Therapie bedürfen in der Regel gravierende vaskulitische Manifestationen der rheumatoiden Arthritis wie die vaskulitische Gangrän der Finger, vaskulitische Ulzera der Haut oder des Magen-DarmTrakts oder die vaskulitische Polyneuropathie. z Hochdosierte perorale (1 bis 2 mg Prednisolonäquivalent pro kg Körpergewicht und Tag) oder intravenöse Glukokortikoidtherapie („pulse therapy“ mit 250 bis 1000 mg 6-Methyl-Prednisolon als Infusion an 3 aufeinander folgenden Tagen) mit nachfolgender peroraler Glukokortikoidtherapie und z Cyclophosphamid 1 bis 2 mg pro kg Körpergewicht und Tag peroral oder 1 g i. v. als Infusion alle 2 bis 4 Wochen [11] oder z Azathioprin 2 mg pro kg Körpergewicht und Tag peroral [7] oder evtl. z intravenöse Methotrexattherapie 15 bis 30 mg i. v. pro Woche [12]. Besondere Probleme der medikamentösen Behandlung der rheumatoiden Arthritis Die medikamentöse antirheumatische Therapie muss einige besondere Probleme und Situationen berücksichtigen. Hierzu zählen vor allem z die arterielle Hypertonie (Verschlimmerung durch NSAR, Glukokortikoide und Leflunomid, Interferenz von NSAR mit Antihypertensiva), z die Herzinsuffizienz (Verschlimmerung durch NSAR), z die nicht dialysepflichtige Niereninsuffizienz (Kumulation renal ausscheidungspflichtiger Arzneimittel), z der Diabetes mellitus (Verschlimmerung durch Glukokortikoide), z die Ulkuskrankheit bzw. die NSAR-Gastropathie (s. Kap. 5.1.2), z die Hyperlipidämie bzw. Hypercholesterinämie bei progredienter koronarer Herzkrankheit (Zunahme der Hypercholesterinämie durch Ciclosporin und Genkokortikoide). 327 328 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Besondere Situationen der medikamentösen Therapie der rheumatoiden Arthritis Therapie im Alter Die antirheumatische Therapie im Alter muss den besonderen Risiken des Organismus und den pharmakokinetischen Besonderheiten in dieser Lebensphase Rechnung tragen. Wegen des erhöhten Risikos von peptischen Läsionen und gastrointestinalen Ulkuskomplikationen sollten NSAR so kurz und niedrig dosiert wie möglich gegeben werden. NSAR sollten mit systemischen Glukokortikoiden nur unter Gastroprotektion verabreicht werden. COX-2-selektive Antirheumatika (Coxibe) sind vorzuziehen. Bei Vorliegen besonderer Risiken ist eine Gastroprotektion erforderlich (s. Kap. 5.1.3). Alternativ können Analgetika (z. B. Paracetamol) in Kombination mit Glukokortikoiden verordnet werden. Unter den glukokortikoidbedingten unerwünschten Wirkungen (s. Kap. 5.2) muss im Alter neben dem Diabetes mellitus und der arteriellen Hypertonie insbesondere die Osteoporose beachtet werden. Regelmäßige Kontrollen (Körpergröße, evtl. Knochendichtemessung) und prophylaktische Maßnahmen (kalziumreiche Ernährung, Kalziumsupplement von 1 bis 1,5 g/Tag, Gabe von Vitamin D (500 bis 1000 I.E./Tag oder aktivem Vitamin-D-Metabolit) sind auch bei Langzeit-low-dose-Glukokortikoidtherapie erforderlich. Für die Therapie mit Basistherapeutika im Alter sind bei Beachtung der Nierenfunktion keine besonderen Einschränkungen bekannt. Therapie während der Schwangerschaft Während der Schwangerschaft geht die Entzündungsaktivität der RA bei über 80% der Patientinnen meist deutlich zurück und nimmt in der Regel schon wenige Wochen nach der Geburt wieder zu [9]. NSAR kurz vor der Entbindung verabreicht können die Schwangerschaft und Geburt verlängern und das Blutungsrisiko bei Mutter und Kind erhöhen. NSAR (nur von kurzer biologischer Halbwertszeit) sollten nicht nach der 34. Schwangerschaftswoche und nur so kurz und niedrig dosiert wie möglich verabreicht werden. Glukokortikoide wie Prednison oder Prednisolon können während der Schwangerschaft verabreicht werden. Frühgeburten sind beobachtet worden. Ohne besondere Risiken ist die intraläsionale bzw. intraartikuläre Injektion von Glukokortikoiden. Eine Basistherapie während der Schwangerschaft ist selten notwendig. Bei Planung einer Schwangerschaft gelten die Vorsichtsregeln für die einzelnen Substanzen in Kapitel 5.3. Ein prophylaktisches Absetzen mindestens 3 Monate vor der Schwangerschaft ist mit Ausnahme von Methotrexat, Leflunomid, Cyclophosphamid und Chlorambucil nicht erforderlich. 5.5.1 Rheumatoide Arthritis z Rheumachirurgische Probleme Sowohl im frühen Stadium, jedoch insbesondere in den fortgeschrittenen Stadien der RA kommen rheumachirurgische Maßnahmen zum Einsatz (s. Kap. 7.2). Voraussetzung ist, dass nichtoperative Maßnahmen einschließlich der systemischen und lokalen medikamentösen Therapie bzw. der Funktionstherapie, Orthetik und Hilfsmittelversorgung hinsichtlich der Lösung des jeweiligen konkreten Problems (Funktionsstörung, Schmerz) nicht ausreichend erfolgversprechend sind oder nicht erfolgreich waren. Typische Probleme für rheumachirurgische Interventionen im frühen Stadium sind: z neurologische Engpasssyndrome (z. B. Karpaltunnelsyndrom), z rupturierte Bakerzysten, z proliferative Artikulosynovitis mit unzureichendem Ansprechen auf lokale medikamentöse Maßnahmen einschließlich Radiosynoviorthese, z proliferative Tenosynovitis der Handbeuger mit Funktionsbehinderung. Probleme für rheumachirurgische Lösungen im fortgeschrittenen Stadium sind Funktionsbehinderungen oder Schmerzen an den peripheren Gelenken und an der oberen Halswirbelsäule durch z Schäden der Gelenkflächen und des darunter liegenden Knochens, z Fehlstellungen, z Instabilitäten. z Literatur 1. American College of Rheumatology Ad Hoc Committee on Clinical Guidelines (1996) Guidelines for the management of rheumatoid arthritis. Arthritis Rheum 39:713–722 2. American College of Rheumatology Ad Hoc Committee on Clinical Guidelines (1996) Guidelines for monitoring drug therapy in rheumatoid arthritis. Arthritis Rheum 39:723–731 3. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, Healey LA, Kaplan SR, Liang MH, Luthra HS, Medsger TA, Mitchell DM, Neustadt DH, Pinals RS, Schaller JG, Sharp JT, Wilder RI, Hunder GG (1988) The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 31:315–324 4. Csuka ME, Carrera GF, McCarty DJ (1986) Treatment of intractable rheumatoid arthritis with combined cyclophosphamide, azathioprine, and hydroxychloroquine. J Am Med Assoc 255:2315–2319 4a.DGRh-Leitlinie: Management der frühen rheumatoiden Arthritis (2007) Schneider M, Lelgemann M, Abholz H, Caratte R, Flügge C, Jäniche H, Krüger K, Rehart S, Specker C. 2. überarbeitete Auflage, Steinkopff Verlag Darmstadt 5. Felson DT, Anderson JJ, Meenan RF (1994) The efficacy and toxicity of combination therapy in rheumatoid arthritis. A meta-analysis. Arthritis Rheum 37:1487–1491 6. Hawley DJ, Wolfe F (1991) Are the results of controlled clinical trials and observational studies of second line therapy in rheumatoid arthritis valid and general- 329 330 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 9. 10. izable as measures of rheumatoid arthritis outcome: analysis of 122 studies. J Rheumatol 18:1008–1014 Heurkens AHM, Westedt ML, Breedfeld FC (1991) Prednisone plus azathioprine treatment in patients with rheumatoid arthritis complicated by vasculitis. Arch Intern Med 151:224–254 Iglehart IW, Sutton JD, Bender JC, Shaw RA, Ziminski CM, Holt PA, Hochberg MC, Zizic TM, Engle EW, Stevens MB (1990) Intravenous pulsed steroids in rheumatoid arthritis: a comparative dose study. J Rheumatol 17:159–162 Ostensen M (1996) Medikation and Schwangerschaft. Rheumatol Europa 25:70–73 Pinals RS, Masi AT, Larsen RA (1981) Preliminary criteria for clinical remission in rheumatoid arthritis. Arthritis Rheum 24:1308–1315 Scott DGI, Bacon PA (1984) Intravenous cyclophosphamide plus methyl-prednisolone in treatment of systemic rheumatoid vasculitis. Am J Med 76:377–384 Shiroky JB, Neville C, Skelton JD (1992) High dose intravenous methotrexate for refractory rheumatoid arthritis. J Rheumatol 19:247–251 Williams HJ, Reading JC, Ward JR, O’Brian WM (1980) Comparison of high and low dose cyclophosphamide therapy in rheumatoid arthritis. Arthritis Rheum 23:521–527 7. 8. 11. 12. 13. 5.5.2 Juvenile chronische Arthritis z 5.5.2 Juvenile chronische Arthritis (ICD-Nr. M 08.X) z Grundsätzliche Bemerkungen zur Therapiestrategie Die juvenile chronische Arthritis (JCA) 1 ist eine ätiologisch ungeklärte Gruppe von Erkrankungen, für die bislang keine ursächliche oder kurative Therapie zur Verfügung steht. Mit Hilfe eines mehrdimensionalen Therapieansatzes, der gleichberechtigt medikamentöse und nichtmedikamentöse Maßnahmen umfasst und ein interdisziplinäres Handeln erfordert, kann jedoch für die meisten Kinder ein befriedigender therapeutischer Weg gefunden werden. Unmittelbares Therapieziel ist die Behandlung von Entzündung und Schmerzen sowie die Aufrechterhaltung der normalen Gelenkfunktionen. Zu den langfristigen therapeutischen Herausforderungen gehören die Verhinderung z von irreversiblen Gelenkschäden, z von Visuseinschränkungen als Folge einer rheumatischen Iridozyklitis, z von lokalen und allgemeinen Wachstumsstörungen, z von Organversagen, insbesondere der Niere und des Darmes, als Folge einer Amyloid A-(AA-)Amyloidose, z nicht zuletzt auch von therapiebedingten Schäden. Die Therapie wird problemorientiert durchgeführt, weist subgruppenabhängige Unterschiede auf und muss darüber hinaus die Phase der Erkrankung, z. B. immunologisch aktives Anfangsstadium oder „ausgebranntes“ Spätstadium, berücksichtigen. Immer sollte die aussichtsreichere Frühbehandlung angestrebt werden. Das therapeutische Risiko darf gerade bei Kindern niemals das Risiko durch die Erkrankung selbst übersteigen. Schließlich soll eine optimale Behandlung eine altersgemäße psychosoziale Entwicklung gewährleisten. Jeder Behandlungsplan muss individuell zusammengestellt werden und auf die spezifische Situation des Kindes ausgerichtet sein. z Medikamentöse Therapie Grundsätzlich stehen dieselben Medikamente zur Verfügung wie in der Erwachsenenrheumatologie, nämlich nichtsteroidale Antirheumatika, „Basistherapeutika“ im engeren Sinne, Immunsuppressiva/Zytostatika, Glukokortikoide sowie neuerdings die sog. „biologicals“. Therapeutische Ein- und wenn nötig 1 Nach dem Vorschlag eines internationalen Gremiums soll der Begriff „juvenile idiopathische Arthritis“ (JIA) die bislang verwendeten Klassifikationen „juvenile rheumatoide Arthritis“ (JRA) (USA) und JCA (Europa) ersetzen. Die neue Klassifikation weist noch Schwächen auf und hat sich insbesondere in den USA bislang nicht durchgesetzt [16]. 331 332 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Umstellungen sind in aller Regel Sache des Kinderrheumatologen. Regelmäßige Verlaufskontrollen mit Erhebung der Zwischenanamnese, des klinischen Befundes und relevanter Laborparameter durch den Kinder- bzw. Hausarzt, in größeren Abständen und bei Problemen durch den Kinderrheumatologen, müssen sicherstellen, dass unerwünschte Wirkungen rechtzeitig erkannt werden und sollen das Ausmaß des Therapieerfolges registrieren. Nichtsteroidale Antirheumatika Alle Kinder mit idiopathischen persistierenden Arthritiden erhalten nichtsteroidale Antirheumatika [4, 18]. In der pädiatrischen Rheumatologie hat sich die Beschränkung auf einige wenige, vom Therapeuten gut abschätzbare Substanzen bewährt. Da die therapeutische Breite der Azetylsalizylsäure, des am längsten bekannten und preiswertesten Präparates, geringer zu sein scheint als die anderer Substanzen, werden diese in der Kinderrheumatologie bevorzugt eingesetzt, am häufigsten Ibuprofen, Naproxen, Indomethazin und Diclofenac (Tabelle 1). In einer Phase I/II-Studie erwies sich auch Meloxicam als anwendbar und wirksam [8]. Untersuchungen über den Einsatz von Coxiben im Kindesalter werden gegenwärtig durchgeführt bzw. ausgewertet; veröffentlichte Daten liegen jedoch bislang nicht vor. Im Kleinkindalter wird vorzugsweise auf Präparate, die als flüssige Zubereitung zur Verfügung stehen, zurückgegriffen, da diese eine präzise Dosierung pro Kilogramm Körpergewicht und eine individuelle Verteilung der Einzeldosen über den Tag erlauben und auch besser akzeptiert werden. Hinsichtlich unerwünschter Wirkungen der nichtsteroidalen Antirheumatika ist bei Kleinkindern zu beachten, dass sie ihre Beschwerden oft nicht in einer unmittelbar erkennbaren Weise zum Ausdruck bringen. Ein wenig beachtetes, durchaus nicht seltenes Problem bei Kindern ist, dass mit Schmerzen verbundene Erkrankungen wie Otitis media unter der antiphlogistischen Therapie verspätet in einem fortgeschrittenen Stadium diagnostiziert werden mit allen für den Patienten damit verbundenen Nachteilen. Dem ist mit vorausschauender klinischer Aufmerksamkeit zu begegnen. Tabelle 1. Bei Kindern mit JCA gebräuchliche nichtsteroidale Antirheumatika Substanz Tagesdosis (mg/kgKG/Tag) Einzeldosen pro Tag Flüssige Zubereitung verfügbar? Azetylsalizylsäure Diclofenac Ibuprofen Indomethazin Naproxen 50–80 2–3 20–40 2–3 10–15 3–4 3–4 3–4 3–4 2 Brausetabletten wasserlösliche Tbl. verfügbar + + + 5.5.2 Juvenile chronische Arthritis z Tabelle 2. Subgruppenbezogene Verwendung von „Basistherapeutika“, Immunsuppressiva/Zytostatika und Etanercept bei JCA. Gehen die oligoarthritischen Beginnformen in einen polyarthritischen bzw. destruktiv-progredienten Verlauf über, so können die bei den polyarthritischen Subgruppen verwendeten Substanzen auch hier indiziert sein Substanz Hydroxy-/Chloroquin 1 Sulfasalazin Gold (i. m.) 1 Azathioprin Methotrexat Ciclosporin A Etanercept 1 Chlorambucil Beginnform/Subgruppe Oligo I Oligo II RFnegPoly RFposPoly SJCA + – – bei Uveitis 3 bei Uveitis 3 bei Uveitis 3 – – – + – – + + – – ± + + + + + +4 – ± ± + + + + +4 – ±2 – – + + + + 4, 5 bei Amyloidose 6 für die Therapie der JCA zugelassen; 2 evtl. in Kombination mit Immunsuppressiva; 3 Option, wenn kein befriedigendes Ansprechen auf Lokaltherapie nach 6 bis 8 Wochen; 4 wenn übrige Basistherapeutika und Immunsuppressiva ineffektiv oder unverträglich; 5 nach Übergang in einen polyarthritischen Verlauf; 6 die AA-Amyloidose kommt am häufigsten bei SJCA vor, seltener bei den übrigen Subgruppen, bei denen im Falle einer Amyloidose Chlorambucil ebenfalls indiziert sein kann Oligo I Oligoarthritis I; Oligo II Oligoarthritis II; RFnegPoly rheumafaktornegative Polyarthritis; RFposPoly rheumafaktorpositive Polyarthritis; SJCA systemische juvenile chronische Arthritis; + ? Indikation gegeben; – ? meist nicht indiziert; ± ? bei blanden Verläufen oder in Kombination mit anderen Substanzen verwendbar 1 „Basistherapeutika“ und Immunsuppressiva/Zytostatika Blande oligoarthritische Verläufe bedürfen keiner „Basistherapie“. Andererseits zeichnet sich auch in der Kinderrheumatologie bei aktiven polyarthritischen und/oder destruktiven sowie bei systemischen Verläufen die Tendenz zu einem frühen, subgruppenbezogenen Einsatz dieser Medikamente ab [5, 35] (Tabelle 2). Erwünschte und unerwünschte Wirkungen sind in Kapitel 5.3 ausführlicher dargelegt. Hier sollen einige für die Kinderrheumatologie wichtige Gesichtspunkte herausgestellt werden. z Hydroxy-/Chloroquin kann die Schwelle für zerebrale Anfälle herabsetzen. Deshalb sollte es nur nach Ableitung eines normalen EEG und bei diesbezüglich unauffälliger Anamnese angewendet werden. Wegen der potenziellen Gefahr irreversibler Netzhautschäden sind vierteljährliche augenärztliche Kontrollen und eine Begrenzung der Anwendung auf 2 bis 3 Jahre empfehlenswert. Nach zu abruptem Absetzen kommt es nicht selten zu Rezidiven. 333 334 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Sulfasalazin wird vor allem bei HLA-B27-positiven Kindern mit JCA als wirksam angesehen [41, 43]. Bei der systemischen Beginnform („Morbus Still“) gilt es als kontraindiziert, da u. a. Einzelfälle beobachtet wurden, bei denen ein zeitlicher Zusammenhang mit der Entstehung eines makrophagenaktivierenden Syndroms (MAS) bestand [21]. z Goldpräparate werden bei JCA derzeit nur noch selten eingesetzt. Verwendbar sind sie bei aktiven polyarthritischen Krankheitsbildern. Die therapeutische Einstellung erfordert insbesondere während der Aufsättigungsphase spezielle Erfahrungen. Auch Goldpräparate können bei Still-Syndrom die Entstehung eines MAS begünstigen und sind während der systemischen Phase dieser Beginnform kontraindiziert. z D-Penicillamin wird bei JCA kaum noch verwendet, was auf die nicht seltenen und gelegentlich gravierenden unerwünschten Wirkungen bei eher mäßiger Effektivität zurückzuführen sein dürfte. z Azathioprin wird in der pädiatrischen Rheumatologie unterschiedlich beurteilt [18, 24, 26]. Bei der Systemform, bei hochaktiven polyarthritischen Verläufen sowie bei therapierefraktären chronischen Uveitiden hat es sich seit über 30 Jahren bewährt. Wie die übrigen Immunsuppressiva wird es auch wegen seines steroidsparenden Effektes eingesetzt. Bei der Ersteinstellung akut auftretendes Fieber und Myelodepression können auf einem angeborenen Thiopurinmethyltransferasemangel beruhen; dies würde Absetzen der Therapie erfordern. z Methotrexat ist das bei JCA derzeit am häufigsten eingesetzte Langzeitantirheumatikum. Trotz Wirksamkeitsnachweises bei JCA in einer kontrollierten Doppelblindstudie [11] ist es in Deutschland für diese Indikation bislang nicht zugelassen. Seinen guten Therapieeffekten bei polyarthritischen Krankheitsbildern stehen relativ häufige Rezidive nach Absetzen und eine nicht selten unzureichende Wirksamkeit auf die extraartikuläre Symptomatik der systemischen JCA gegenüber [15]. Unerwünschte Wirkungen beziehen sich bei Kindern insbesondere auf den Gastrointestinaltrakt, auf Leukopenien einschließlich Begünstigung von Infektionen und auf Hepatopathien, nur selten auf die Lunge [12]. Vorläufige Beobachtungen scheinen auf eine insgesamt gute Langzeitverträglichkeit hinzuweisen. Nur in Einzelfällen wurde über maligne Komplikationen berichtet [23]. Für definitive Aussagen erforderliche prospektive Langzeitstudien liegen jedoch bislang nicht vor. Bei dem häufig auftretenden heftigen Ekelgefühl, das nicht selten zum Absetzen führt, können folgende Maßnahmen versucht werden: vorherige Gabe von Dimenhydrinat (Vomex A®) oder von Ondansetron (Zofran®), orale Verabreichung der Injektionslösung zusammen mit Tee oder Säften, parenterale Verabreichung. z Ciclosporin gilt als Reservemedikament, das zum Einsatz kommt, wenn Methotrexat oder Azathioprin nicht ausreichend effektiv sind [2, 9, 34, 38]. Bei chronischer Iridozyklitis scheint Ciclosporin A vergleichsweise gut wirksam zu 5.5.2 Juvenile chronische Arthritis z sein [22, 39]. Eine spezielle Indikation ist bei Entwicklung eines „makrophagenaktivierenden Syndroms“ (MAS) gegeben, einer gelegentlich medikamentös oder viral ausgelösten lebensbedrohlichen, mit Panzytopenie einhergehenden Komplikation einer JCA [33, 37]. Langzeitbeobachtungen bei Kindern mit JCA, auch zur Abschätzung des Risikos, fehlen bislang. Nur vereinzelt wurden maligne Komplikationen berichtet [23]. z Etanercept ist seit Februar 2000 in Deutschland für Kinder ab einem Alter von 4 Jahren mit polyarthritischer, therapiefraktärer JCA zugelassen. Lovell et al. hatten in einer kontrollierten Studie eine überzeugende Wirksamkeit bei Kindern gefunden, die gegenüber MTX therapierefraktär waren [28]. Wegen der erst kurzen Erfahrungen mit dieser Substanz und auch wegen des hohen Preises wurden seitens der Pharmakotherapiekommission der Arbeitsgemeinschaft für Kinder- und Jugendrheumatologie Empfehlungen für den Einsatz von Etanercept gegeben [19]. z Anakinra kann aufgrund vieler überzeugender Fallberichte bei aktiver systemischer Arthritis (Still-Syndrom) empfohlen werden. z Chlorambucil, das zu den effektivsten antirheumatisch wirksamen Substanzen in der Kinderrheumatologie zählt, ist wegen der Gefahr einer Induktion maligner Erkrankungen nur bei AA-Amyloidose indiziert, wenn sich bei diesen Patienten die Serumamyloid A- und/oder CRP-Konzentrationen anderweitig nicht ausreichend senken lassen [6]. z i.v. Immunglobuline wurden erstmals 1988 bei systemischer JCA eingesetzt [14]. Seither wurden mehrere Studien durchgeführt [13, 36, 40, 42]. Als Dosierung werden * 2 g/kg Körpergewicht alle 4 Wochen vorgeschlagen. Es handelt sich um eine sehr teure Behandlung, die insgesamt die in sie gesetzten Hoffnungen nicht erfüllt hat. Unerwünschte Wirkungen beziehen sich vor allem auf Überempfindlichkeitsreaktionen bei zu schneller Infusion. Seit den bekannten Fällen mit Übertragung von Hepatitis C wurde über weitere infektiöse Komplikationen nicht mehr berichtet. Glukokortikoide Absolute Indikationen für eine Therapie mit Glukokortikoiden stellen die lokale Applikation bei rheumatischer Iridozyklitis und die systemische Gabe bei schwerer rheumatischer Myokarditis und bei zystoidem Makulaödem dar [18, 29]. Sehr hilfreich können intraartikulär verabreichte Glukokortikoide (Triamcinolonhexacetonid) sein [1, 3, 20]. Bei der aktiven SJCA kommt man meist ohne eine längerfristige systemische Glukokortikoidtherapie nicht aus. Wegen der drohenden Wachstumsstörungen, aber auch wegen der zahlreichen anderen unerwünschten Wirkungen (s. Kap. 5.2) und der sich rasch entwickelnden „Kortisonpflichtigkeit“ („Zauberlehrlingseffekt“ der Glukokortikoide, die man „nicht mehr los wird“) sollten Glukokortikoide systemisch nur mit größter Zurückhaltung als antiarthritische Therapie bei JCA verwendet werden. Bei 335 336 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern längerfristiger Verabreichung sollten möglichst nicht über 0,15 mg Prednisolonäquivalent/kg Körpergewicht/Tag geben, die Tagesdosis vorzugsweise in einer morgendlichen Dosis verabreicht und eine alternierende Gabe angestrebt werden. Als Verlaufsparameter für die Abschätzung, ob die Dosis zu hoch ist, kann die Wachstumsgeschwindigkeit gelten. Sofern keine vitale Indikation besteht, sollte die Kortikosteroiddosis so gewählt werden, dass sie die Wachstumsgeschwindigkeit nicht vermindert [30]. Eine Pulstherapie mit Megadosen, z. B. 10 bis 20 mg/kg Körpergewicht an 3 aufeinander folgenden oder auch alternierenden Tagen [32], kann in der Einstellphase auf ein Langzeitantirheumatikum die Zeit bis zu dessen Wirkungseintritt überbrücken helfen oder sonst schwer beeinflussbare Iridozyklitiden zum Abklingen bringen. Eine Reduktion und schließlich Beendigung der medikamentösen Therapie ist indiziert, wenn die Erkrankung 4 bis 6 Monate klinisch und humoral zur Ruhe gekommen ist. Da eine abrupte Therapiebeendigung von einer erhöhten Rezidivgefahr bedroht ist, sollte das Absetzen ausschleichend über Monate unter Supervision eines erfahrenen Kinderrheumatologen erfolgen. z Nichtmedikamentöse Therapien Physio- und Ergotherapie Physio- und Ergotherapie sind unentbehrliche Säulen im Gesamtbehandlungsplan der JCA und stehen gleichberechtigt neben der medikamentösen Behandlung [17, 18]. Die Krankengymnastik wird als Einzeltherapie unabhängig vom Alter, also auch bei Kleinkindern, so früh wie möglich durchgeführt, auch im Krankheitsschub. Sie erfolgt gezielt passiv-assistiv und soll verkürzte Muskeln, die das Gelenk in eine Fehlhaltung bringen, dehnen und dann schrittweise auf eine Erweiterung des Bewegungsumfanges hinarbeiten. Entzündete Gelenke werden in Entlastung bewegt, was bei den Hüftgelenken besonders gut im Schlingenkäfig möglich ist. Therapieroller, -fahrräder, -dreiräder und Schedepferdchen ermöglichen eine altersadäquate Fortbewegung in Entlastung. Gelenkschützende Maßnahmen werden den Kindern durch die Ergotherapie vermittelt. Die Funktions- und Lagerungsschienen sollen die Entwicklung von Fehlstellungen vermeiden bzw. begrenzen helfen und den Behandlungsfortschritt sichern. Adäquates Schuhwerk, korrigierende weiche Einlagen, Abrollhilfen, ggf. auch orthopädische Schuhe stellen eine wesentliche Ergänzung in der Behandlung der Arthritiden der unteren Extremitäten dar. Deren sachgerechte Herstellung erfordert viel Erfahrung mit JCA-Patienten sowie eine vertrauensvolle Zusammenarbeit zwischen Kinderrheumatologen, Physiotherapeuten und Orthopädiemechaniker. Bei Befall der Kiefergelenke kommt es nicht nur zur Malfunktion, sondern auch zu Wachstumsstörungen mit Unterkieferhypoplasie und Gesichtsasymmetrie. Eine frühzeitige Mitbetreuung durch kompetente Kieferorthopäden und Anwendung von Hilfsmitteln wie Aufbissschienen sind hier dringend erforderlich. Weitere Hilfsmittel können bei schwerer behinderten Kindern die Aktivitäten des täglichen Lebens erleichtern. Physikalische Maßnahmen wie lokale Kälteanwendungen unterstützen die medikamentöse antiphlogistische Therapie. 5.5.2 Juvenile chronische Arthritis z Rheumachirurgische Eingriffe Ziel der konsequenten, mehrdimensionalen Frühbehandlung der JCA ist die Vermeidung operativer Maßnahmen. Auch bei bester Behandlung mit den heute zur Verfügung stehenden konservativen Therapien sind rheumachirurgische Eingriffe in bestimmten Situationen jedoch unverzichtbar. Die günstigsten Ergebnisse werden erzielt, wenn der Rheumachirurg mit den Problemen der JCA vertraut ist, die Indikation in Teamarbeit zwischen Rheumachirurgen und Kinderrheumatologen gestellt wird, der Patient bzw. die Familie motiviert sind und eine ausreichende postoperative Nachbehandlung garantiert ist. Gelenk- und Sehnenscheidensynovialektomien kommen infrage, wenn trotz intensiver systemischer und lokaler Behandlung die Synovialitis persistiert. Sie werden heute auch bei Kindern mit gutem Erfolg als arthroskopische Eingriffe durchgeführt. Im Kleinkindalter sind sie im Allgemeinen kontraindiziert, da sich postoperativ bei der meist nicht ausreichenden Mitarbeit der Kinder nicht selten Funktionseinschränkungen mit schwer behandelbaren Beugekontrakturen etwa der Knie entwickeln. Diese Einschränkung gilt umso mehr, als sich die Gonarthritiden dieser Kinder durch intraartikuläre Applikation von Triamcinolonhexacetonid in Verbindung mit der spezifischen Krankengymnastik meist effektiv behandeln lassen. Weitere chirurgische Behandlungsmöglichkeiten stellen Umstellungsosteotomien, die operative Behandlung von Gelenkkontrakturen, nach Wachstumsbeendigung auch der endoprothetische Gelenkersatz und kosmetische Eingriffe (z. B. Beseitigung der Unterkieferhypoplasie) dar. Augenchirurgie Irreversible visusmindernde Iridozyklitisfolgeschäden können Katarakt- und Glaukomoperationen, die Korrektur einer bandförmigen Keratopathie oder eine Vitrektomie erforderlich machen. Augenchirurgische Eingriffe bei Kindern mit rheumatischer Iridozyklitis erfordern nicht nur eine exzellente Technik, sondern setzen insbesondere hinsichtlich der Indikationsstellung und der Wahl des optimalen Zeitpunktes auch große Erfahrung mit dieser Erkrankung voraus. Andernfalls drohen ungünstige Langzeitergebnisse mit Visusverlust. Durch Frühdiagnose und Frühtherapie der Iridozyklitis lässt sich die Zahl der irreversiblen Augenschäden und damit auch der Augenoperationen erheblich reduzieren [31]. z Prophylaktische Maßnahmen Eine vorausschauende optimale Behandlung der JCA muss durch Integration prophylaktischer Maßnahmen die im Erkrankungsverlauf drohenden irreversiblen Folgeschäden verhindern. Hierzu gehören vor allem die je nach Risikogruppe 4-wöchentlichen bis halbjährlichen augenärztlichen Spaltlampenuntersuchungen zum rechtzeitigen Erkennen einer rheumatischen Iridozyklitis. Im Rahmen einer engmaschigen Verlaufsbeobachtung muss den subgruppenspezi- 337 338 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern fischen Risikofaktoren (s. Kap. 3.3) besondere Aufmerksamkeit gewidmet werden, damit eine entsprechende Frühbehandlung gewährleistet ist. z Verhaltenshinweise für den Patienten bzw. für die Eltern Je nach Problematik kann die Behandlung eine Ergänzung durch psychologische, sozialpädagogische und schulische Hilfen erfordern. Wesentliche Unterstützung und Erfahrungsaustausch ermöglichen Selbsthilfegruppen bzw. Elternkreise. Besondere Fragen für den Alltag daheim betreffen am häufigsten die Schule, Sport und Urlaub, ab der Pubertät die Sexualität, die Ausbildung mit Berufswahl, die Ernährung, Impfungen und psychologische Probleme. Ausführliche Hinweise, die den Rahmen dieser Zusammenstellung sprengen würden, finden sich in der kostenfrei durch die Deutsche Rheumaliga abgegebenen Broschüre „Mein Kind hat Rheuma – was kann ich tun?“ [7]. z In Erprobung befindliche Therapieformen Bei therapierefraktären Verläufen werden in spezialisierten Zentren derzeit folgende in Erprobung befindliche Therapieformen versucht: z Höher dosierte parenterale Methotrexattherapie. Die hier zur Diskussion stehenden Dosierungen liegen bei bis zu 30 mg/qmKOF/Woche bzw. bei 1 mg Methotrexat/kg Körpergewicht/Woche. Gerade wurde in Europa im Rahmen der PRINTO (Pediatric Rheumatology International Trials Organization) eine diesbezügliche multizentrische Studie beendet, deren Ergebnisse noch nicht zur Verfügung stehen. z Kombination von Langzeitantirheumatika. Bei Kindern liegen keine kontrollierten Studien über Kombinationen von Langzeitantirheumatika vor, sodass die Datenlage unzureichend ist. Dennoch ist diese Strategie mittlerweile auch in der pädiatrischen Rheumatologie sehr verbreitet. Die verwendeten Kombinationen lehnen sich an die in der Erwachsenenrheumatologie bewährten Konzepte an [35]. z Neuere zytotoxische Medikamente. Für Leflunomid (Arava®) liegen nur Einzelberichte für die JCA vor. Zur Zeit wird eine multizentrische, multinationale diesbezügliche Studie durchgeführt. – FK506 (Tacrolimus) wurde bei Kindern mit junveniler chronischer Arthritis eingesetzt, die nicht auf Methotrexat oder Ciclosporin A angesprochen hatten. Kontrollierte Studien liegen nicht vor. Das Spektrum der unerwünschten Wirkungen ist dem von Ciclosporin A vergleichbar. – Für Mycophenolat Mofetil (Cellcept®) liegen nur Einzelfallerfahrungen vor. 5.5.2 Juvenile chronische Arthritis z z Infiximab und weitere Antizytokine. Erste Pilotstudien zeigen, dass Infliximab auch in der Kinderrheumatologie eine interessante Therapieoption sein kann [10, 25, 44]. Es ist für Kinder noch nicht zugelassen. Ähnlich verhält es sich mit anderen Antizytokinen. z Autologe Stammzelltransplantation. Trotz der Berichte über teils eindrucksvolle Therapieergebnisse wird dieses Behandlungsverfahren wegen der deutlichen Letalität derzeit nur in sonst ausweglosen Fällen erwogen [45]. z Literatur 1. Allen RC, Gross KR, Laxer RM, Malleson PN, Beauchamp RD, Petty RE (1986) Intraarticular triamcinolon hexacetonide in the management of chronic arthritis in children. Arthritis Rheum 29:997–1001 2. Ansell BM (1993) Cyclosporin A in paediatric rheumatology. Clin Exp Rheumatol 11:113–115 3. Breit W, Frosch M, Meyer U, Heinecke A, Ganser G (2000) A subgroup-specific evaluation of the efficacy of intraarticular triamcinolone hexacetonide in juvenile chronic arthritis. J Rheumatol 27:2696–2702 4. Cassidy JT, Petty RE (2001) Juvenile rheumatoid arthritis. In: Cassidy JT, Petty RE (eds) Textbook of pediatric rheumatology. WB Saunders Company, Philadelphia, pp 218–321 5. Cron RQ, Sharma S, Sherry DD (1999) Current treatment by United States and Canadian pediatric rheumatologists. J Rheumatol 26:2036–2038 6. David J, Vouyiouka O, Ansell BM, Hall A, Woo P (1993) Amyloidosis in juvenile chronic arthritis: a morbidity and mortality study. Clin Exp Rheumatol 11:85–90 7. Deutsche Rheumaliga, Elternkreise rheumakranker Kinder (1993) Mein Kind hat Rheuma – was kann ich tun? Druck Carl Weyler KG, Bonn 8. Foeldvari I, Thon A, Burgos-Vargas R (2000) 70% der Patienten mit juveniler rheumatoider Arthritis sprachen nach 12 Wochen auf eine Therapie mit Meloxicam-Suspension im Rahmen einer Phase I/II Studie an. Z Rheumatol 59 (suppl 3):III/49 9. Gattinara M, Lomater C, Gerloni V, Fatini F (1994) Cyclosporin in pediatric rheumatology; a seven years experience. Acta Univ Carol 40:105–108 10. Gerloni V, Pontikaki I, Desiati F, Gattinara M, Fantini F (2000) Infliximab in the treatment of persistently active refractory juvenile idiopathic (chronic) arthritis: a short-term pilot study. Arthritis Rheum 43(suppl):S 256 11. Giannini EH, Brewer EJ, Kuzmina N, Shaikov A, Maximov A, Vorontsov I, Fink CW, Newman AJ, Cassidy JT, Zemel LS, for the Pediatric Rheumatology Collaborative Study Group and the Cooperative Children’s Study Group (1992) Methotrexate in resistant juvenile rheumatoid arthritis. Results of the USA-USSR double-blind, placebo-controlled trial. N Engl J Med 326:1043–1049 12. Giannini EH, Cassidy JT (1993) Methotrexate in juvenile rheumatoid arthritis. Do the benefits outweigh the risks? Drug Saf 9:325–329 13. Giannini EH, Lovell DJ, Silverman ED, Sundel RP, Tague BL, Ruperto N (1996) Intravenous immunoglobulin in the treatment of polyarticular juvenile rheumatoid arthritis: a phase I/II study. Pediatric Collaborative Study Group. J Rheumatol 23:919–924 339 340 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 14. Groothoff JW, van Leeuwen EF (1988) High dose intravenous gammaglobulin in chronic systemic juvenile arthritis. Br Med J 296:1362–1363 15. Halle F, Prieur AM (1991) Evaluation of methotrexate in the treatment of juvenile chronic arthritis according to the subtype. Clin Exp Rheumatol 9:297–302 16. Häfner R (2002) Juvenile idiopathische Arthritis. Die neue Nomenklatur und Klassifikation der chronischen Arthritis im Kindesalter. Akt Rheumatol 27:18–21 17. Häfner R, Spamer M (1998) Rehabilitation of children. In: Maddison PJ, Isenberg Da, Woo P, Glass DN (eds) Oxford Textbook of Rheumatology. Oxford University Press, Oxford, pp 1737–1755 18. Häfner R, Truckenbrodt H, Michels H, von Altenbockum C (1991) Therapie der juvenilen chronischen Arthritis. Dt Ärzteblatt 88:2402–2407 19. Horneff G, Forster J, Seyberth HW, Michels H, für die Arbeitsgemeinschaft Kinderund Jugendrheumatologie (2000) Empfehlungen der Arbeitsgemeinschaft Kinderund Jugendrheumatologie zur Therapie mit Etanercept (P75 TNF-alpha-RezeptorImmunglobulinfusionsprotein). Kommission Pharmakotherapie. Z Rheumatol 59: 365–369 20. Huppertz HI, Tschammier A, Horwitz A, Schwab O (1995) Intraarticular corticosteroids for chronic arthritis in children: efficacy and effects on cartilage and growth. J Pediatr 127:317–321 21. Jung JH, Jun JB, Yoo DH, Kim TH, Jung SS, Lee IH, Bae SC, Kim SY (2000) High toxicity of sulfasalazine in adult-onset Still’s disease. Clin Exp Rheumatol 18: 245–248 22. Kilmartin DJ, Forrester JV, Dick AD (1998) Cyclosporin A therapy in refractory non-infectious childhood uveitis. Br J Ophthalmol 82:737–742 23. Krugmann J, Sailer-Hock M, Muller T, Gruber J, Allerberger F, Offner FA (2000) Epstein-Barr virus-associated Hodgkin’s lymphoma and legionella pneumophila infection complicating treatment of juvenile rheumatoid arthritis with methotrexate and cyclosporine A. Hum Pathol 31:253–255 24. Kvien TK, Hoyeraal HM, Sandstad B (1986) Azathioprine versus placebo in patients with juvenile rheumatoid arthritis: a single center double blind comparative study. J Rheumatol 13:118–123 25. Lahdenne P, Honkanen V (2000) Infiximab vs. etanercept in the treatment of severe juvenile chronic arthritis (JCA). Arthritis Rheum 43(suppl):S 381 26. Lehmann TJA (1993) Aggressive therapy for childhood rheumatic diseases. When are immunosuppressives appropriate? Arthritis Rheum 36:71–74 28. Lovell DJ, Giannini EH, Reiff A, Cawkwell GD, Silverman ED, Nocton JJ, Stein LD, Gedalia A, Ilowite NT, Wallace CA, Whitmore J, Finck BK (2000) Etanercept in children with polyarticular juvenile rheumatoid arthritis. N Engl J Med 342: 763–769 29. Michels H (1997) Is there a renaissance of corticosteroid therapy? Rev Rhum 64:183S–185S 30. Michels H (2000) What is low-dose corticosteroid therapy in juvenile idiopathic arthritis? Z Rheumatol 59 (suppl 2):II/127–II/130 31. Michels H, Truckenbrodt H (1987) Improved prognosis for iridocyclitis in juvenile chronic arthritis. Clin Exp Rheum 5 (suppl):20 32. Miller III JJ (1980) Prolonged use of large intravenous steroid pulses in the rheumatic diseases of children. Pediatrics 65:989–994 33. Mouy R, Stephan JL, Pillet P, Haddad E, Hubert P, Prieur AM (1996) Efficacy of cyclosporine A in the treatment of macrophage activation syndrome in juvenile arthritis: report of five cases. J Pediatr 129:750–754 5.5.2 Juvenile chronische Arthritis z 34. Oppermann J (1999) Literaturübersicht über Erfahrungen mit Ciclosporin in der Kinderrheumatologie. In: Ciclosporin in der Kinderrheumatologie. 2. Wörlitzer Expertengespräche. Wörlitz bei Dessau, 17./18. April 1999. 14.–16. April 1999, Nürnberg, Novartis Pharma GmbH. Ref Type: Conference Proceeding 35. Oppermann J (2000) Therapie rheumatischer Erkrankungen im Kindesalter. Innorvatis 1:18–24 36. Prieur AM (1996) Intravenous immunoglobulins in Still’s disease: still controversial, still unproven. J Rheumatol 23:797–800 37. Ravelli A, De Benedetti F, Viola S, Martini A (1996) Macrophage activation syndrome in systemic juvenile rheumatoid arthritis successfully treated with cyclosporine. J Pediatr 128:275–278 38. Reiff A, Rawlings DJ, Shaham B, Franke E, Richardson L, Szer IS, Bernstein BH (1997) Preliminary evidence for cyclosporin A as an alternative in the treatment of recalcitrant juvenile rheumatoid arthritis and juvenile dermatomyositis. J Rheumatol 24:2436–2443 39. Schlote T, Dannecker G, Thiel HJ, Zierhut M (1996) Cyclosporin A in der Therapie der chronischen Uveitis im Kindesalter. Ophthalmologe 93:745–748 40. Silverman ED, Cawkwell GD, Lovell DJ, Laxer RM, Lehmann TJ, Passo MH, Zemel LS, Giannini EH (1994) Intravenous immunoglobulin in the treatment of systemic juvenile rheumatoid arthritis: a randomized placebo controlled trial. Pediatric Rheumatology Collaborative Study Group. J Rheumatol 21:2353–2358 41. Suschke HJ (1992) Die Behandlung der juvenilen Spondylarthritis und der reaktiven Arthritis mit Sulfasalazin. Monatsschr Kinderheilk 140:658–660 42. Uziel Y, Laxer RM, Schneider R, Silverman ED (1996) Intravenous immunoglobulin therapy in systemic onset juvenile rheumatoid arthritis: a followup study. J Rheumatol 5:910–918 43. van Rossum MA, Fiselier TJ, Franssen MJ, Zwinderman AH, ten Cate R, van Suijlekom-Smit LW, van Juijk WH, van Soesbergen RM, Wulffraat NM, Oostveen JC, Kuis W, Dijkstra PF, van Ede CF, Dijkmans BA (1998) Sulfasalazine in the treatment of juvenile chronic arthritis: a randomized, double-blind, placebo-controlled, multicenter study. Dutch Juvenile Chronic Arthritis Study Group. Arthritis Rheum 41:808–816 44. Vinje O, Obiora E, Forre O (2000) Juvenile chronic polyarthritis treated with infliximab. Ann Rheum Dis 59:745 45. Wulffraat NM, Brinkman D, Prieur AM (2000) Autologous stem cell transplantation for refractory juvenile idiopathic arthritis. Z Rheumatol 59 (suppl 3):13 341 342 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.3 Spondyloarthritiden (ICD-Nr. M 45.-, M 46.8*1. . . +, M 46.9) Da sich Klinik und Symptomatik der Spondyloarthritiden in vielen Punkten überlappen, ist es sinnvoll, auch die Therapie dieser Erkrankungen zusammengefasst darzustellen. Besonderheiten bei der Behandlung der Spondylitis ankylosans sind im Kapitel 5.5.4. aufgeführt. z Grundsätzliche Bemerkungen zur Therapiestrategie Die Therapie von Patienten mit Spondyloarthritiden ist im Wesentlichen beschwerde- und symptomorientiert. Zu unterscheiden sind verschiedene therapeutische Angriffspunkte: Neben den Wirbelsäulenmanifestationen wie Sakroiliitis, Spondylitis und Diszitis treten periphere Arthritis, Enthesopathie und extraartikuläre Manifestationen, z. B. die anteriore Uveitis, auf. Die therapeutischen Optionen umfassen neben der lokalen und systemischen medikamentösen Behandlung mit nichtsteroidalen Antiphlogistika, Analgetika, Muskelrelaxanzien, Steroiden und lang wirksamen Antirheumatika v. a. auch physikalische Therapieformen. z Zur Behandlung von Wirbelsäulenmanifestationen sind primär nichtsteroidale Antiphlogistika, bei ausgeprägter Sakroiliitis evtl. auch lokale Steroide indiziert. z Bei peripherer Gelenkbeteiligung ist zusätzlich eine Behandlung mit Sulfasalazin erfolgversprechend. z Bei Weichteilmanifestationen wie Enthesopathie, Tenosynovialitis und Bursitis stehen mit der topischen Applikation nichtsteroidaler Antiphlogistika und lokalen Steroidinjektionen zusätzliche therapeutische Möglichkeiten zur Verfügung. z Die im Rahmen von Spondyloarthritiden recht häufig auftretende anteriore Uveitis wird in der Regel lokal antiphlogistisch behandelt, seltener besteht die Indikation zu einer systemischen Therapie mit Kortikoiden. Sulfasalazin kann die Schwere und Häufigkeit des Auftretens der Iridozyklitis vermindern. z Medikamentöse Therapie Nichtsteroidale Antiphlogistika Die Behandlung mit nichtsteroidalen Antiphlogistika sollte sich an Beschwerdeintensität, tageszeitlicher Rhythmik (z. B. abendliche Gabe eines lang wirksamen Präparates bei Nachtschmerz) und Verträglichkeit orientieren. Schmerz- und Entzündungszustände an axialen und peripheren Gelenken sind durch nichtsteroidale Antiphlogistika meist ausreichend behandelbar. Eine Dauerbehandlung ohne klinische Indikation ist aber nicht sinnvoll, zumal es keine Hinweise darauf gibt, dass eine Dauerbehandlung mit nichtsteroidalen Antiphlogistika prognostisch Vorteile bringt. Die verfügbaren nichtsteroidalen Antiphlogistika 5.5.3 Spondyloarthritiden z unterscheiden sich hinsichtlich ihrer Pharmakokinetik und Wirkungsintensität. Die Dosierung ist vom jeweiligen Präparat abhängig. Bei sehr intensiven Schmerzen müssen z. T. sehr hohe Dosen gewählt werden, die jeweils empfohlene Tageshöchstdosis sollte aber nur passager überschritten werden. Basistherapeutika Da Langzeitstudien zur Wirksamkeit von Basistherapeutika bei den undifferenzierten Spondyloarthritiden noch nicht zur Verfügung stehen, basieren die folgenden Empfehlungen auf Ergebnissen von Studien mit 6-monatiger Dauer. Bei Spondyloarthritiden mit peripherer Gelenkbeteiligung hat sich Sulfasalazin in einer Tagesdosis von 2–3 g/Tag als effektiv bezüglich der Behandlung der peripheren Arthritis erwiesen [2]. Diese Therapie wird daher in solchen Fällen empfohlen. Da über eine sichere Wirkung von Sulfasalazin auf die reinen Achsenskelettmanifestationen zwar tendenziell berichtet wurde, diese insgesamt aber nicht hinreichend belegt ist, kann dessen Einsatz für diese Indikation ohne periphere Gelenkbeteiligung nicht generell empfohlen werden. In Fällen nachgewiesener Darmbeteiligung und/oder persistierend hoher Krankheitsaktivität ist ein Behandlungsversuch mit Sulfasalazin in der o. g. Dosierung gerechtfertigt. Die Wirksamkeit anderer lang wirksamer Antirheumatika in der Therapie der undifferenzierten Spondyloarthritiden ist bislang nicht hinreichend belegt. Systemische Kortisontherapie Eine systemische Kortisontherapie ist zur Behandlung der Spondyloarthritiden in der Regel nicht erforderlich und meist auch nicht hilfreich. In bestimmten Fällen mit peripherer Gelenkbeteiligung kann eine vorübergehende systemische Kortikoidgabe erforderlich werden. Ansonsten kann der Einsatz auf besondere klinische Indikationen wie hohe Krankheitsaktivität, sonst nicht beherrschbare schwere Schübe oder eine assoziierte chronisch-entzündliche Darmerkrankung beschränkt werden. Analgetika Analgetika können und sollten bei sehr erheblichen akuten Schmerzzuständen und bei schweren chronischen Verläufen von Spondyloarthritiden nach dem WHO-Stufenschema eingesetzt werden (s. Kap. 5.7). Muskelrelaxanzien Muskelrelaxanzien haben keinen festen Platz in der Therapie der Spondyloarthritiden. Bei Tendomyosen, die nicht ausreichend auf physikalische Therapie und nichtsteroidale Antiphlogistika ansprechen, können Myotonolytika als Zusatztherapie über einen begrenzten Zeitraum eingesetzt werden. 343 344 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Lokale medikamentöse Therapie Die lokale paratendinöse Injektion von Steroiden zeigt in 70–80% der Fälle eine gute Wirkung. Nebenwirkungen sind bei korrekter Durchführung selten. Patienten mit Sakroiliitis wurden jüngst im Rahmen von offenen Studien erfolgreich mit intraartikulären Kortikoidinjektionen behandelt, die unter Bildwandler oder computertomographiegesteuert appliziert wurden. Von dieser Maßnahme profitierten in einer offenen Studie 80% der so behandelten Patienten. Die deutliche Beschwerdebesserung hielt im Mittel 8,5 Monate an [3]. Diese aufwändige Therapieform wird zwar nicht generell empfohlen, stellt aber eine Option bei hartnäckigen Verlaufsformen und Unwirksamkeit oder Unverträglichkeit von nichtsteroidalen Antiphlogistika dar. Bei hartnäckigen Verläufen mit persistierender Synovitis einzelner peripherer Gelenke kann in Analogie zur chronischen Polyarthritis auch eine Radiosynoviorthese (z. B. lokale intraartikuläre Behandlung einer persistierenden Gonarthritis mit 111–222 MBq Yttrium-90) durchgeführt werden. z Nichtmedikamentöse Therapie Physikalische Therapie Neben der analgetischen und antiphlogistischen Medikation stellt die physikalische Therapie die Basis jeder Behandlung von Patienten mit Spondyloarthritis dar und ist als kontinuierliche Behandlungsmaßnahme Grundlage der Behandlung v. a. der chronischen, z. T. aber auch der akuten Verlaufsformen. Trotz des allgemein anerkannten hohen Stellenwertes physikalischer Therapieverfahren bei Spondyloarthritiden ist deren exakter Nutzen jedoch durch Studien nicht konsequent belegt. Dies betrifft auch die Auswahl der Therapieformen bei verschiedenen Krankheitsstadien, sodass die dargestellte Vorgehensweise nur Anhaltspunkte für die Behandlung des Einzelfalles geben kann. z Sakroiliitis/Spondylitis: Bei Frühstadien von Sakroiliitis sind Diadynamik und Niederfrequenztherapie in Form von hydrogalvanischen Vollbädern (sog. Stanger-Bäder) zu empfehlen. Bei chronischer Sakroiliitis kann neben der Niederfrequenztherapie auch eine hyperämisierende Hochfrequenztherapie (UKW, Dezimeterwellen) der angrenzenden Muskulatur eingesetzt werden. Bei chronischer Spondylitis ist eine kontinuierliche krankengymnastische Behandlung der gesamten Wirbelsäule wichtig (s. auch Kap. 5.5.4.). z Periphere Arthritis: Bei akuter Symptomatik steht neben der medikamentösen antiphlogistischen Therapie die passagere Ruhigstellung und Kryotherapie entsprechend der Vorgehensweise bei anderen Arthritiden im Vordergrund. Bei prolongiertem Verlauf und im chronischen Stadium sind verschiedene Techniken der Krankengymnastik einschließlich isometrischer Übungen wesentlich. 5.5.3 Spondyloarthritiden z z Enthesopathie: Zur analgetischen Behandlung einer Enthesopathie sind Ultraschallbehandlung (0,5–1,5 W/cm2, 4–8 min) und Gleichstrombehandlung, z. B. als Iontophorese oder in Form diadynamischer Ströme zu empfehlen. Daneben sind krankengymnastische Bewegungsübungen zum Erlernen ergonomisch günstiger Bewegungsmuster und eine adäquate Hilfsmittelversorgung (z. B. Schuheinlagenanpassung bei Entesitis) notwendig. In therapierefraktären Einzelfällen kann eine lokale Röntgenbestrahlung indiziert sein, die in älteren Kasuistiken mit 10 Bestrahlungen bei kumulativer Dosis von 10,0 bis 25,0 Gy beschrieben wird. z Operative Maßnahmen Die Indikation zu rheumachirurgischen Eingriffen an peripheren Gelenken (arthroskopische bzw. offene Synovektomie, Korrekturosteotomie, Endoprothetik, Arthrodese) unterscheidet sich generell bei Spondyloarthritiden nicht von der Vorgehensweise bei anderen Arthritisformen. z Prophylaktische Maßnahmen Es gibt keine bekannten Maßnahmen, die grundsätzlich in der Lage sind, das Auftreten von Spondyloarthritiden zu verhindern. In einigen speziellen Situationen sind präventive Maßnahmen aber von großer Bedeutung, um eine weitere Verschlechterung verschiedener Symptome und das Auftreten von Komplikationen zu verhindern, wie z. B. regelmäßige Krankengymnastik zur Mobilitäts- bzw. Funktionserhaltung, Medikation mit Magenschleimhautprotektiva und mit Osteoporoseprophylaktika jeweils bei Risikopatienten. z Verhaltenshinweise für den Patienten Da Spondyloarthritiden häufig chronisch bzw. chronisch-rezidivierend verlaufen, ist eine sorgfältige Information des Patienten über die Prognose der Erkrankung, Erfolgsaussichten und Nebenwirkungsmöglichkeiten der Therapie wichtig, um eine gute Compliance bei der Langzeitbetreuung der Patienten zu gewährleisten. Ein multimodales Patientenschulungsprogramm für Patienten mit ankylosierender Spondylitis hat positive Effekte in Bezug auf Krankheitswissen, Selbstwirksamkeit und Funktionskapazität. Wegen des z. T. unberechenbaren Verlaufes und des breiten Spektrums an Symptomen, die im Rahmen einer Spondarthritis auftreten können, ist es wichtig, bei neu auftretenden Krankheitserscheinungen den Rheumatologen erneut zu konsultieren. Der Patient sollte zur konsequenten Durchführung der krankengymnastischen Übungen als häusliche täglich selbstständig durchgeführte Krankengymnastik ermuntert werden. Für den Verlauf von Spondyloarthritiden gibt es noch keine allgemein akzeptierten prognostischen Parameter. Ein größerer Teil der Patienten mit 345 346 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Spondyloarthritiden, v. a. mit undifferenzierter Spondarthritis, entwickelt im Verlauf von mehreren Jahren eine definitive ankylosierende Spondylitis. Ein Erkrankungsbeginn vor dem 12. Lebensjahr ist prognostisch ebenfalls ungünstig. Nach Untersuchungen von Amor und Mitarbeitern [2] ist davon auszugehen, dass (relative Bedeutung der einzelnen Parameter in Klammern) eine Beteiligung der Hüftgelenke (4), eine persistierende BSG-Beschleunigung (3), das schlechte Ansprechen auf nichtsteroidale Antiphlogistika (3), die Einschränkung der Wirbelsäulenbeweglichkeit (3), die Daktylitis (2) und die periphere Arthritis (1) mit einer schlechteren Prognose hinsichtlich eines allgemein schwereren Krankheitsverlaufes einhergehen. Wenn diese Probleme in den ersten beiden Krankheitsjahren nicht auftreten, kommt es nach den Untersuchungen von Amor nur in 8% der Fälle zu einem schweren Krankheitsverlauf. z In Erprobung befindliche Therapieformen Der Einsatz von Sulfasalazin bei früher Spondarthritis mit reiner Wirbelsäulenmanifestation bedarf noch der klinischen Prüfung. Eine Substanz, die ein Fortschreiten der Erkrankung in die Richtung einer Spondylitis ankylosans aufhält, ist bisher nicht bekannt. z Literatur 1. Amor B, Dougados M, Khan MA (1955) Management of refractory ankylosing spondylitis and related spondylarthropathies. Rheum Dis Clin North Am 21: 117–128 2. Amor B, Santos RS, Nahal R, Listrat V, Dougados M (1994) Predictive factors for the longterm outcome of spondyloarthropathies. J Rheumatol 21:1883–1887 3. Braun J, Bollow M, Seyrebasan F, Häberle HJ, Eggens U, Mertz A, Distler A, Sieper J (1996) Computed tomography corticosteroid injection of the sacroiliac joint in the patients with spondylarthropathy with sacroiliitis: clinical outcome and followup by dynamic magnetic resonance imaging. J Rheumatol 23:659–664 4. Dougados M, van der Linden S, Leirisalo Repo M, Huitfeldt B, Juhlin R, Veys E, Zeidler H, Kvien TK, Olivieri I, Dijkmans B (1995) Sulfasalazine in the treatment of spondylarthropathy. A randomized, multicenter, double-blind, placebo-controlled study. Arthritis Rheum 38:618–627 5.5.4 Spondylitis ankylosans z 5.5.4 Spondylitis ankylosans (ICD-Nr. M 45) Die Therapie der Spondylitis ankylosans stimmt im Wesentlichen mit der in Kap. 5.5.3 dargestellten Vorgehensweise bei den Spondyloarthritiden überein. Im Kap. 5.5.4 werden Besonderheiten der Therapie der Spondylitis ankylosans dargestellt, wobei die Wirbelsäulensymptomatik im Vordergrund steht. Die Behandlung der peripheren Arthritis und der anterioren Uveitis unterscheidet sich nicht von der Vorgehensweise bei den anderen Spondyloarthritiden. z Grundsätzliche Bemerkungen zur Therapiestrategie Die Therapie der Spondylitis ankylosans ist v. a. beschwerde- und symptomorientiert. Physikalische Therapieformen sowie die lokale und systemische medikamentöse Behandlung mit nichtsteroidalen Antiphlogistika, Analgetika, Muskelrelaxanzien, Steroiden und lang wirksamen Antirheumatika stehen zur Verfügung. Zur Behandlung der Wirbelsäulenmanifestationen wie Sakroiliitis, Spondylitis und Diszitis sind primär nichtsteroidale Antiphlogistika, bei ausgeprägter Sakroiliitis evtl. auch lokale Steroide und Analgetika indiziert. Die auch im Rahmen einer Spondylitis ankylosans oft auftretende anteriore Uveitis wird in der Regel kokal antiphlogistisch behandelt, seltener besteht die Indikation zu einer systemischen Therapie mit Kortikoiden. Systemische Manifestationen der Spondylitis ankylosans wie Aortitis und eine kardiale Beteiligung in Form eines Vitiums werden wie kardiologisch üblich therapiert. Die gelegentlich zu beobachtende Lungenoberlappenfibrose bedarf keiner spezifischen Behandlung. Die Therapie einer sekundär auftretenden Amyloidose folgt etablierten Prinzipien. z Systemische Medikation Die Behandlung mit systemischen und lokalen Medikationen, nichtsteroidalen Antiphlogistika, Analgetika und Muskelrelaxanzien entspricht der Vorgehensweise bei den übrigen Spondyloarthritiden. Basistherapeutika Da eine sichere Wirkung lang wirksamer Antirheumatika auf die reinen Achsenskelettmanifestationen bei der Spondylitis ankylosans nicht eindeutig belegt ist, kann deren Einsatz bei reiner Wirbelsäulenmanifestation ohne periphere Gelenkbeteiligung nicht generell empfohlen werden. Über tendenziell positive Effekte von Sulfasalazin bei der Behandlung der Wirbelsäulensymptomatik bei Spondylitis ankylosans über einen Zeitraum von 6 Monaten ist in einer Metaanalyse allerdings berichtet worden [1]. Analog zu den in Kap. 5.5.3 347 348 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern gemachten Empfehlungen ist bei hoher Krankheitsaktivität ein Therapieversuch mit Sulfasalazin in einer Dosis von 2–3 g/Tag gerechtfertigt. Bei Spondylitis ankylosans-Patienten mit peripherer Gelenkbeteiligung gelten die in Kap. 5.5.3 gemachten Empfehlungen. Radiumchlorid steht für die Therapie der ankylosierenden Spondylitis nicht mehr zur Verfügung. In den letzten Jahren gab es zunehmend Hinweise, dass TNFa eine zentrale Rolle in der Pathogenese der ankylosierenden Spondylitis (AS) und der anderen Spondyloarthritiden spielt. Der erste für die Therapie der AS im Mai 2003 in Europa zugelassene spezifische Inhibitor von TNFa ist Infliximab, ein chimärer human-muriner monoklonaler Antikörper der Klasse IgG1. Die Dosis beträgt 3–5 mg/kg/KG i. v. alle 6–8 Wochen. Die Therapie mit Etanercept, dem TNFa-75KD-Rezeptor-IgG1-Fusionsprotein, Dosierung 2-mal 25 mg s. c., ist bei AS ebenfalls wirksam. Alle Anti-TNF-Präparate haben eine anhaltende Wirksamkeit auf die Krankheitsaktivität bei schwer betroffenen AS-Patienten. Für alle Präparate wurde in kontrollierten Studien auch eine Wirksamkeit bei Psoriasisarthritis nachgewiesen. Bei der undifferenzierten SpA liegen mehrere offene Studien, ebenfalls mit einem positiven Ergebnis, vor. Nach den vorliegenden Studien werden die verschiedenen Manifestationsformen der SpA (axialer Befall, periphere Arthritis und Enthesitis) ähnlich günstig beeinflusst. Die entzündlichen MRT-Veränderungen unter anti-TNFTherapie schon nach 3 Monaten deutlich gebessert sind. Eine routinemäßige zusätzliche Mitbehandlung bei der Infliximab-Therapie der AS mit Immunsuppressiva wie Methotrexat scheint nicht erforderlich zu sein. Diese Aussage gilt für die kontinuierliche Behandlung mit Infliximab 5 mg/kg. Der voll humanisierte monoklonale Antikörper Adalimumab ist ebenfalls für diese Indikation zugelassen. Die lokale Therapie mit Anti-TNF-Substanzen muss zum jetzigen Zeitpunkt noch als experimentell bezeichnet werden. Im Rahmen von internationalen Empfehlungen, die im Juni 2003 von der ASAS-Gruppe vorgeschlagen wurden, sind die folgenden Punkte für die Indikationsstellung einer Anti-TNF-Therapie bei der schweren ankylosierenden Syondylitis gefragt: 1. „in der Regel“ Diagnose einer ankylosierenden Syondylitis auf Grundlage der modifizierten NY-Kriterien von 1984 [6]; 2. Krankheitsaktivität > 4 auf einer Skala von 0–10 (BASDAI) [3] über mindestens 4 Wochen plus Expertenurteil (lokal zu definierender Rheumatologe mit Kenntnissen in entzündlichen Rückenschmerzen und Biologikatherapie); 3. bei allen 3 Manifestationsformen (axialer Befall, periphere Arthritis und Enthesitis) vorhergegangene Therapie mit mindestens 2 NSAR in maximaler oder maximal tolerierter Dosis über 3 Monate; bei peripherer Arthritis und Enthesitis plus 2 Steroidinjektionen, bei peripherer Arthritis plus Sulfasalazintherapie 2–3 g/Tag über 4 Monate; 4. Abwesenheit von bekannten Kontraindikationen gegen Anti-TNF-Therapie; 5. Monitoring mittels BASDAI und „ASAS-core-set“ [5]; 5.5.4 Spondylitis ankylosans z 6. Therapieabbruch, wenn nach 6–12 Wochen nicht eine relative 50%ige Verbesserung des BASDAI oder eine absolute > 2 auf der 0–10-Skala erreicht wird. z Nichtmedikamentöse Therapie Physikalische Therapie Die Grundlagen der physikalischen Therapie, die neben der analgetischen und antiphlogistischen Medikation die Basis jeder Behandlung von Patienten mit Spondyloarthritis darstellt, wurden in Kap. 5.5.3 erläutert (s. dazu auch Kap. 8). In chronischen Fällen einer Wirbelsäulenbeteiligung bzw. Spondylitis ist eine kontinuierliche krankengymnastische Behandlung der gesamten Wirbelsäule wesentlich. Hierzu zählen u. a. die korrekte Lagerung zur Kontrakturprophylaxe, dynamische Schwung- und statistische Dehngymnastik (Stretching), Mobilisationsübungen und isometrisches Training zur Muskelkräftigung und Beseitigung entzündlich bedingter Dysbalancen der LWS. Die Physiotherapie ist über die krankengymnastische Einzel- und Gruppenbehandlung unbedingt auch als tägliche Heimgymnastik durchzuführen. Daneben ist regelmäßige sportliche Betätigung wichtig, wozu sich Ausdauersportarten mit gleichmäßiger rhythmischer Belastung wie Waldlauf auf weicher Unterlage, Schwimmen, Radfahren und Rudern eignen. Hydro-(Bäder-)therapie hat Monate anhaltende Wirkung auf Schmerzen. Operative Therapie Bei der Spondyloarthritis sind in einigen Fällen operative Maßnahmen erforderlich, die über konventionelle rheumachirurgische Eingriffe hinausgehen; dies betrifft v. a. die Aufrichtungsosteotomie. Die Operationsindikation zur Wirbelsäulenaufrichtung ist vor dem Hintergrund nicht unerheblicher Risiken streng zu stellen und auf besonders schwer verlaufende Krankheitsfälle mit erheblicher, die Lebensqualität stark einschränkender Kyphosierung begrenzt. Patientenschulung Analog der rheumatoiden Arthritis wurde ein Schulungsprogramm für Bechterew-Kranke entwickelt, das mehrmonatige positive Effekte auf Krankheitswissen, Schmerzen, Arbeitsunfähigkeit und Selbstwirksamkeit hat. Patientenselbsthilfeorganisationen Die Deutsche Vereinigung Morbus Bechterew e.V. organisiert und betreut in Deutschland an vielen Stellen Therapiegruppen und führt Informations- und Beratungsveranstaltungen durch. Möglichkeiten zur Zusammenarbeit mit dieser Organisation sollte von Rheumatologen und anderen Ärzten, die Bechterew-Patienten betreuen, genutzt werden. 349 350 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Präventive Maßnahmen Die wesentliche Vorbeugung gegen eine zunehmende Bewegungseinschränkung und Funktionsminderung ist die regelmäßige Krankengymnastik. Ansonsten gelten die Empfehlungen des Kap. 5.5.3. z Verhaltensweisen für den Patienten Ein Patient mit Spondyloarthritis sollte über den meist chronischen/chronisch rezidivierenden Charakter seiner Erkrankung aufgeklärt werden. Er sollte zu regelmäßigen krankengymnastischen Übungen zu Hause und in Gruppen aufgefordert und ermutigt werden. Analog zu den in Kap. 5.5.3 gemachten Empfehlungen ist eine regelmäßige konsiliarische Betreuung zu empfehlen. Definierte prognostische Kriterien für die Spondyloarthritis gibt es bislang noch nicht. Die von Carette und Mitarbeitern vorgelegten Langzeitergebnisse (1983) üben den Verlauf der Spondyloarthritis sagen aus, dass letztlich nur weniger als 20% der über fast 40 Jahre verfolgten Patienten den Steinbrocker-Funktionsklassen II bis IV zugeordnet werden mussten. Daher gibt es keinen Grund, Patienten mit Spondyloarthritis grundsätzlich mit einer schlechten Prognose zu belasten. Von Interesse für den Patienten ist auch, dass sich die wesentliche Krankheitsentwicklung in dieser Studie in den ersten 10 Jahren abspielte, danach traten kaum noch wesentliche Verschlechterungen auf. Die Diagnose einer Spondyloarthritis ist kein Grund, einen Kinderwunsch zurückzustellen. Spezifische Schwangerschaftskriterien für Patientinnen mit Spondyloarthritis sind nicht bekannt. Das Risiko der Kinder eines HLAB27-positiven Spondyloarthritispatienten, selbst eine Spondyloarthritis zu entwickeln, ist allerdings gegenüber der Normalbevölkerung deutlich erhöht. z In Erprobung befindliche Therapieformen Während es Anhaltspunkte für eine Wirksamkeit von Sulfasalazin bei Spondyloarthritis-Patienten mit einer mittleren Krankheitsdauer von mehr als 10 Jahren gibt, ist der Einsatz von Sulfasalazin bei früher Spondyloarthritis mit reiner Wirbelsäulenmanifestation noch weiter klinisch zu prüfen. Die bisher einzige Studie, in der Patienten mit Spondyloarthritis in einer relativ frühen Krankheitsphase (mittlere Krankheitsdauer < 10 Jahre) mit 3 g Sulfasalazin/Tag behandelt wurden, hat eine signifikante Verminderung auch der auf die Wirbelsäule bezogenen Beschwerden ergeben [4]; in der Verumgruppe wurden auch deutliche Verbesserungen hinsichtlich der Dauer der Morgensteifigkeit und der Blutkörperchensenkungsgeschwindigkeit nachgewiesen. Weitere Studien in frühen Krankheitsphasen liegen bisher nicht vor. 5.5.4 Spondylitis ankylosans z z Obsolete Maßnahmen Die Bestrahlung der Wirbelsäule mit Röntgenstrahlen oder Thorium-X wird heute nicht mehr durchgeführt. z Literatur 1. Bosi Ferraz M, Tugwell P, Goldsmith CH, Atra E (1990) Meta-analysis of sulfasalazine in ankylosing spondylitis. J Rheumatol 17:1482–1486 2. Carette S, Graham DC, Little H (1993) The natural disease course of ankylosing spondylitis. Arthritis Rheum 26:186–190 3. Garrett S, Jenkinson T, Kennedy LG, Whitelock H, Gaisford P, Calin A (1994) A new approach to defining disease status in ankylosing spondylitis: The bath ankylosing spondylitis disease activity index A new approach to defining disease status in ankylosing spondylitis: the Bath Ankylosing Spondylitis Disease Activity Index. J Rheumatol 21:2286–2291 4. Nissilä M, Lehtinen K, Leirisalo Repo M, Luukkainen R, Mutru O, Yli Kerttula U (1988) Sulfasalazine in the treatment of ankylosing spondylitis. A twenty-six-week, placebo-controlled clinical trial. Arthritis Rheum 31:1111–1116 5. van der Heijde D, Calin A, Dougados M, Khan MA, van der LS, Bellamy N (1999) Selection of instruments in the core set for DC-ART, SMARD, physical therapy, and clinical rescord keeping in ankylosing spondylitis. Progress report of the ASAS Working Group, Assessments in Ankylosing Spondylitis. J Rheumatol 26: 951–954 6. van der Linden S, Valkenburg HA, Cats A (1984) Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York Criteria. Arthritis Rheum 361–368 351 352 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.5 Psoriasisarthritis (ICD-Nr. M 0.7*/L 40) z Grundsätzliche Bemerkungen zur Therapiestrategie Die Therapie der Gelenkmanifestationen orientiert sich an den Regeln für die Behandlung der rheumatoiden Arthritis bzw. der Spondylitis ankylosans. Variationen ergeben sich durch die außerordentlich unterschiedlichen Verläufe der Erkrankung sowie durch die Möglichkeit, dass Therapieformen die Hautsymptome verschlechtern können und dass aggressivere Behandlungsmethoden sowohl Haut- als auch Gelenksymptome beeinflussen. Bei jeder Problemsituation vonseiten einer der beiden Hauptlokalisationen des Krankheitsbildes ist die Überweisung zum Dermatologen bzw. Rheumatologen indiziert. Darüber hinaus sollte bei schwer verlaufenden Fällen eine fachpsychologische Mitbetreuung angestrebt werden. z Medikamentöse Therapie Die symptomatische Therapie der Psoriasisarthritis erfolgt in Anlehnung an die Therapie der rheumatoiden Arthritis initial mit nichtsteroidalen Antirheumatika (NSAR). Eine Exazerbation von Hauterscheinungen durch NSAR ist selten. Basistherapie Eine Behandlung mit Basistherapeutika ist nur bei progredienten Verläufen mit oligo- bis polyartikulärem Befall indiziert, wenn der Einsatz von NSAR keinen ausreichenden Erfolg zeigt. In den letzten Jahren sind bei der medikamentösen Behandlung der polyartikulären Formen der Psoriasisarthritis die Substanzen Methotrexat und Sulfasalazin in den Vordergrund getreten. z Methotrexat wird seit über 30 Jahren zur Behandlung der Psoriasisarthritis verwendet. Mit einer Dosis von bis zu 25 mg/Woche ist bei einem hohen Prozentsatz der Patienten eine Verbesserung der Gelenk- und Hautsymptomatik zu verzeichnen. z Sulfasalazin führt in einer Dosis von 2 (bis 3) g/Tag zu einer Verbesserung der Gelenksymptomatik, die serologischen Entzündungsparameter nehmen ab; eine Exazerbation der Psoriasis gilt als selten. z Ciclosporin kann bei therapierefraktären Formen einer Psoriasisarthritis verordnet werden. Es bewirkt eine rasche Besserung der Hauterscheinungen mit Verzögerung auch der Gelenksymptomatik. Als Dosis werden initial 2,5 mg/kg/Tag und dann höchstens 5 mg/kg/Tag verabreicht, wobei die Dosis im weiteren Verlauf der Krankheitsaktivität angepasst wird. 5.5.5 Psoriasisarthritis z z Über die Wirksamkeit von Azathioprin bei der Psoriasisarthritis liegen nur geringe Erfahrungen vor. z Leflunomid in einer Dosis von 20 mg/Tag ist wirksam sowohl auf die Polyarthritis als auf auf die Psoriasis. z Antimalariamittel sollten nur zurückhaltend verwendet werden, da Exazerbationen der Haut wie akute Erythrodermien bis zur Dermatitis exfoliativa beschrieben wurden. z Der Einsatz von Fumaraten und anderen Systemantipsoriatika sollte unter dermatologischer Indikation und Überwachung erfolgen [7]. z TNF-a-Antagonisten (Etanercept, Infliximab, Adalimumab) haben in offenen und in kontrollierten Studien bei Patienten, die trotz Methotrexat weiterhin eine hohe Krankheitsaktivität aufwiesen, beeindruckende Erfolge gezeigt [8, 9]. Prinzipiell sind auch für den Einsatz bei der Psoriasisarthritis die Empfehlungen der Deutschen Gesellschaft für Rheumatologie zum Einsatz von TNF-a-Antagonisten, die für die rheumatoide Arthritis erstellt wurden, zu beachten. Die empfohlene Dosierung von Etanercept ist auch bei der Psoriasisarthritis 2 ´ 25 mg/Woche s. c. Glukokortikoide Die Indikation zum Einsatz von oralen Kortikosteroiden sollte kritisch gestellt werden. Sie können die Hauterscheinungen einer Psoriasis bessern, führen jedoch nach Dosisreduktion oder nach Therapiebeendigung gelegentlich zu einer Verschlechterung der dermatologischen Symptome. Bei rasch progredienten Formen sind sie oft das Mittel der letzten Wahl. Die intraartikuläre Applikation von kristallisierten Glukokortikoiden ist bei allen mon- bzw. auch oligoartikulären Verläufen eine außerordentlich günstige Behandlungsform. Bei Beherrschung der Technik, Einhaltung der aseptischen Kautelen und zeitlichen Abständen von mehreren Monaten zwischen den einzelnen Injektionen handelt es sich um ein nebenwirkungsarmes Verfahren, das oft andere medikamentöse Therapien überflüssig macht. z Nichtmedikamentöse Therapien Wie bei der rheumatoiden Arthritis spielt die Physiotherapie – in erster Linie eine intensive Bewegungsbehandlung, aber auch andere Formen, wie die Anwendung von lokaler Wärme und Kälte, die Ultraschall- und Elektrotherapie – eine sehr wichtige Rolle (s. Kap. 8). Das komplexe Programm ist individuell zu erstellen. Wenn die Wirbelsäule beteiligt ist, gelten die Regeln wie bei Spondylitis ankylosans. Bei noch ausreichendem Allgemeinzustand können geeignete Formen des Patientensports empfohlen werden. Sowohl für die Hautals auch für die Gelenksymptomatik ist die Einleitung stationärer Rehabilitationsmaßnahmen in Fachkliniken oder in Rehabilitationskliniken vorzugsweise mit Seeklima (Thalassotherapie) zu empfehlen. Operative Eingriffe (Synovialektomie, Gelenkersatzoperationen) werden nach den gleichen Kriterien wie bei anderen entzündlich-destruktiven Arthro- 353 354 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern pathien durchgeführt. Bei Verläufen, die nur Arthralgien ohne objektive Gelenkveränderungen oder humorale Entzündungszeichen aufweisen, kann auf Medikamente verzichtet werden. Hier genügen meist alleinige physikalische Therapiemaßnahmen zur Behandlungsführung. z Literatur 1. Brückle W, Dexel T, Grasedyck K, Schattenkirchner M (1994) Treatment of psoriatic arthritis with auranofin and gold sodium thiomalate. Clin Rheumatol 13: 209–216 2. Cuellar MI, Silveira LH, Espinoza LR (1994) Recent developments in psoriatic arthritis. Curr Opin Rheumatol 6:378–384 3. Dougados M, van der Linden S, Leirisalo-Repo M (1995) Sulfasalazine in the treatment of spondylarthropathy. A randomized, multicenter, doubleblind-placebo-controlled study. Arthr Rheum 38:618–627 4. Gladman DD, Blake R, Brubacher B, Farewell VT (1992) Chloroquine therapy in psoriatic arthritis. J Rheumatol 19:1724–1726 5. Goupille P, Soutif D, Valant JP (1992) Treatment of psoriatic arthropathy. Sem Arthr Rheum 21:355–367 6. Kaltwasser JP, Nash P, Gladman D, Rosen CF, Behrens F, Jones P, Wollenhaupt J, Falk FG, Mease P (2004) Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial. Arthritis Rheum 50:1939–1950 7. Lehmann P, Ruzicka T (1996) Neue Entwicklungen in der Psoriasistherapie. Dtsch Ärztebl 93:A-3188–3193 8. Mease PJ, Goffe BS, Metz J, Van der Stoep A, Fink B, Burge DJ (2000) Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomised trial. Lancet 356:385–390 9. Antoni C, Kavanaugh A, Kirkham B et al (2002) The Infliximab multinational psoriatic arthritis controlled trial (IMPACT). Arthritis Rheum 46:381 10. Pigatto PD, Gibelli E, Ranza R, Rossetti A (1994) Methotrexate in psoriatic polyarthritis. Acta Derm Venerol (suppl) (Stockh) 186:114–115 11. Steinsson K, Jonsdottier I, Valdimarsson H (1990) Ciclosporin A in psoriatic arthritis: an open study. Ann Rheum Dis 49:603–606 12. Stroehmann I, Wüstenhagen E, Martini M (1987) Die Therapie seronegativer Oligoarthritiden mit Salazopyrin. Z Rheumatol 46:21–24 13. Willkens RF, Williams HJ, Ward JR (1984) Randomized double-blind placebo controlled trial of low-dose pulse methotrexate in psoriatic arthritis. Arthr Rheum 27:376–381 5.5.6 Reaktive Arthritiden z 5.5.6 Reaktive Arthritiden (ICD-Nr. M 02) z Grundsätzliche Bemerkungen zur Therapiestrategie Reaktive Arthritiden haben grundsätzlich eine bessere Prognose als die meisten anderen entzündlich-rheumatischen Erkrankungen. Die mittlere Dauer der Erkrankung liegt bei einem Jahr, aber zwischen 20 und 50% der Patienten entwickeln chronische Arthralgien, Arthritiden oder Enthesopathien bzw. erleiden spätere Rezidive. Die Therapiestrategie muss diesen beiden Besonderheiten Rechnung tragen. z Medikamentöse Therapie Im Vordergrund der medikamentösen Therapie steht eine symptomadaptierte, ausreichende und kontinuierliche Therapie mit nichtsteroidalen Antirheumatika (NSAR). Bei ausgeprägter Schmerzsymptomatik sollten ergänzend Analgetika (nach dem WHO-Schema zur Schmerztherapie) verabreicht werden. Bei urogenitalem Chlamydiennachweis ist – unabhängig von einer chlamydieninduzierten reaktiven Arthritis – in jedem Fall eine kurzfristige antibiotische Behandlung inklusive Partnerbehandlung indiziert (z. B. mit Doxycyclin 2-mal 100 mg/Tag, Ofloxacin 2-mal 200 mg/Tag, Ciprofloxacin 2-mal 500 mg/ Tag oder Makrolidantibiotika wie Erythromycin 4-mal 500 mg/Tag für 10 bis 14 Tage). Diese Therapie dient v. a. der Erregerelimination an der Eintrittspforte. Ein Einfluss auf das Risiko späterer Rezidive und/oder den Arthritisverlauf wird kontrovers beurteilt. Bei Patienten mit postenteritischen reaktiven Arthritiden, bei denen der auslösende Erreger in Stuhlkulturen nachgewiesen wurde, ist eine 14-tägige Therapie mit Gyrasehemmern zu empfehlen. Auch diese kurzfristigen Antibiotikatherapien haben jedoch keinen Einfluss auf Arthritisdauer oder -intensität. Bei systemischem Befall mit erheblichen extraartikulären Manifestationen, hochflorider Polyarthritis oder Fieber ist eine systemische Kortikoidbehandlung zu empfehlen, deren Dosis individuell von der Schwere der Krankheitsaktivität abhängig zu machen ist (Bereich 0,2–1,5 mg Prednisolonäquivalent pro kg KG). Bei Persistenz der Arthritis über mindestens 3 Monate und fehlendem Ansprechen auf die beschriebenen allgemeinen Maßnahmen einschließlich der NSAR-Therapie ist die Einleitung einer Behandlung mit sog. Basistherapeutika (langwirksame Antirheumatika) zu erwägen. In retrospektiven bzw. offenen Studien und Kasuistiken hat sich Sulfasalazin als effektiv erwiesen, kontrollierte Studien hierzu stehen jedoch noch aus. Der Stellenwert anderer Basistherapeutika in der Therapie chronischer reaktiver Arthritiden ist noch nicht zu beurteilen. Generell ist die Indikation zu einer derartigen Behandlung jedoch gegen die Remissionstendenz reaktiver Arthritiden innerhalb 6 Monaten abzuwägen. 355 356 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Nichtmedikamentöse Therapie Bei Ineffektivität der beschriebenen Maßnahmen und Persistenz der Arthritis über 6 bis 9 Monate ist die Indikation zur Synovektomie zu prüfen, die vom bisherigen Verlauf, radiologischem Befund und operativem Zugangsweg abhängt. Im Akutstadium der Arthritis kann zusätzlich zur Kryotherapie eine passagere Ruhigstellung mit passiven entlastenden Bewegungsübungen zum Erhalt der Muskelkraft und zur Kontrakturprophylaxe notwendig werden. Bei wenig florider Arthritis oder im chronischen Stadium soll eine aktive krankengymnastische Übungsbehandlung zur Funktionssteigerung bzw. zum Funktionserhalt erfolgen. Bei persistierendem Reizerguss oder einer persistierenden Arthritis ist eine erneute Entlastungspunktion und – nach Ausschluss einer bakteriellen Arthritis – eine intraartikuläre Kortikoidinstillation zu erwägen. z In Erprobung befindliche therapeutische Maßnahmen Derzeit wird in verschiedenen Studien der Stellenwert einer prolongierten, d. h. mehrmonatigen Antibiotikatherapie geprüft. Bis heute ist die Effektivität einer entsprechenden Therapie nicht eindeutig belegt. Die vorhandenen Daten geben keinen Hinweis auf einen positiven Effekt einer prolongierten Antibiotikagabe bei postenteritischen Verlaufsformen und erlauben für die chlamydieninduzierte Arthritis trotz einzelner positiver Berichte ebenfalls noch keine entsprechende Therapieempfehlung. z Obsolete Therapien Eine Antibiotikatherapie allein aufgrund positiver serologischer Befunde ist nicht indiziert. z Literatur 1. Bardin T, Enel C, Cornelis F, Salski C, Jorgensen C, Ward R, Lathrop GM (1992) Antibiotic treatment of venereal disease and Reiter’s syndrome in a Greenland population. Arthritis Rheum 35:190–194 2. Braun J, Eggens U, Sieper J (1994) Grundlagen der Therapie der reaktiven Arthritis. Wien Klin Wochenschr 106:259–264 3. Fryden A, Bengtsson A, Foberg U, Svenungsson B, Castor B, Kärnell A, Schvarcz R, Lindblom B, Kihlström E (1990) Early antibiotic treatment of reactive arthritis associated with enteric infection. Clinical and serological study. Br Med J 301: 1229–1302 4. Hammer M, Wollenhaupt J (1994) Reaktive Arthritiden. In: Gerok W, Hartmann F, Pfreundschuh M, Philipp T, Schuster H-P, Sybrecht GW (Hrsg) Klinik der Gegenwart, XIV, 3. Urban und Schwarzenberg, München Wien Baltimore, S 1–48 5.5.6 Reaktive Arthritiden z 5. Lauhio A, Leirisalo-Repo M, Lähdevita J, Saikku P, Repo H (1991) Double-blind, placebo-controlled study of three-month treatment with lymecycline in reactive arthritis, with special reference to Chlamydia arthritis. Arthritis Rheum 34:6–14 6. Mielants H, Veys EM (1985) HLA-B27 related arthritis and bowel inflammation. Part 1. Sulfasalazine in HLA-B27-realted reactive arthritis. J Rheumatol 12:287–293 7. Pott HG, Wittenborg A, Junge-Hülsing G (1988) Long-term antibiotic treatment in reactive arthritis. Lancet i:245–246 8. Sieper J, Braun J (1993) Möglichkeiten und Grenzen der Diagnostik bei der reaktiven Arthritis. Dtsch Med Wschr 118:712–718 9. Sieper J, Braun J, Reichardt M, Eggens U (1993) The value of specific antibody detection and culture in the diagnosis of reactive arthritis. Clin Rheumatol 12:245–252 357 358 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.7 Akutes rheumatisches Fieber (ICD-Nr. I 00 bis I 02) z Grundsätzliche Bemerkungen zur Therapiestrategie Das akute rheumatische Fieber ist bei Kindern und insbesondere bei Erwachsenen in Mitteleuropa sehr selten geworden. Die Behandlung hat 3 Ziele: die symptomatische Therapie von Krankheitsmanifestationen, die antibiotische Therapie zur Erregerelimination und die Rezidivprophylaxe. Die antientzündliche Therapie orientiert sich an den klinischen Manifestationen. Bei Erwachsenen steht die entzündliche Gelenkbeteiligung im Vordergrund, extraartikuläre Manifestationen fehlen meist. Über die Notwendigkeit einer mehrjährigen Antibiotikaprophylaxe bei Erwachsenen gibt es keine ausreichenden Daten. z Medikamentöse Therapie Im Vordergrund der medikamentösen Therapie steht eine symptomorientierte, ausreichende und kontinuierliche Therapie mit nichtsteroidalen Antirheumatika (NSAR). Bei ausgeprägter Schmerzsymptomatik sollten ergänzend Analgetika (nach dem WHO-Schema zur Schmerztherapie) verabreicht werden. Die Behandlung des rheumatischen Fiebers unterscheidet sich von der Therapie anderer reaktiver Arthritiden. Bei akutem rheumatischem Fieber ohne wesentliche Organmanifestationen sollten nichtsteroidale Antirheumatika, bei schwerer Erkrankung mit hohem Fieber, hochflorider Polyarthritis und erheblichen extraartikulären Manifestationen, insbesondere bei schwerer Karditis stattdessen Glukokortikoide (1 mg Prednisolonäquivalent/kg KG) eingesetzt werden. Die symptomatische Behandlung erfolgt bis zur Rückbildung der Manifestationen und der Entzündungsparameter im Blut. Zur Sanierung des Streptokokkeninfektes erfolgt eine mindestens 10-tägige Antibiotikatherapie mit Penizillin V (bei Kindern 3-mal 250 mg, bei Erwachsenen 3-mal 500 mg/Tag oral) oder Benzylpenizillin (1- bis 2-mal 1 Mio. E/Tag i.v.), ersatzweise Clemizol-Penizillin G (1-mal 1 Mio. E/Tag i.m.) bzw. Erythromyzin (20–25 mg/kg KG/Tag). Bei Persistenz der Arthritis über mindestens 3 Monate und fehlendem Ansprechen auf die beschriebenen allgemeinen Maßnahmen einschließlich der NSAR-Therapie ist die Einleitung einer Behandlung mit sog. Basistherapeutika (langwirksame Antirheumatika) zu erwägen. In retrospektiven bzw. offenen Studien und Kasuistiken hat sich Sulfasalazin als effektiv erwiesen. Der Stellenwert anderer Basistherapeutika in der Therapie chronischer reaktiver Arthritiden ist noch nicht zu beurteilen. 5.5.7 Akutes rheumatisches Fieber z z Nichtmedikamentöse Therapie Im Akutstadium der Arthritis kann zusätzlich zur Kryotherapie eine passagere Ruhigstellung mit passiven entlastenden Bewegungsübungen zum Erhalt der Muskelkraft und zur Kontrakturprophylaxe notwendig werden. Bei wenig florider Arthritis oder im chronischen Stadium soll eine aktive krankengymnastische Übungsbehandlung zur Funktionssteigerung bzw. zum Funktionserhalt erfolgen. Bei persistierendem Reizerguss oder einer persistierenden Arthritis ist eine erneute Entlastungspunktion und – nach Ausschluss einer bakteriellen Arthritis – eine intraartikuläre Kortikoidinstillation zu erwägen. z Obsolete Therapien Eine Antibiotikatherapie allein auf Grund positiver serologischer Befunde ist nicht indiziert. z Rezidivprophylaxe An die Akutbehandlung schließt sich eine antibiotische Rezidivprophylaxe an. Rezidive treten am häufigsten in den ersten 2 Jahren nach Erstmanifestation auf und sind im Erwachsenenalter selten. Die Rezidivprophylaxe erfolgt entweder oral mit Penizillin V 250 mg 2-mal täglich oder Sulfadiazin 500–1000 mg täglich oder parenteral Benzazhin-Penizillin 1,2 Mio. E. i.m. alle 4 Wochen. Die Dauer der Rezidivprophylaxe ist nicht gut definiert. Sie wird abhängig gemacht vom Rezidivrisiko (Anzahl der Attacken, Expositionsrisiko für Streptokokkeninfekte), vom Alter des Patienten und vom Bestehen einer kardialen Beteiligung. Bei Kindern wird die Rezidivprophylaxe mehrheitlich bis zum Beginn des Erwachsenenalters durchgeführt. Bei Herzbeteiligung, insbesondere mit mehreren Rezidiven, wird eine Rezidivprophylaxe auch im erwachsenen Alter empfohlen. Zur Antibiotikaprophylaxe bei streptokokkenreaktiver Arthritis gibt es keine validen Empfehlungen. z Literatur 1. Cilliers AM (2006) Rheumatic fever and its management. BMJ 333:1153–1156 2. Carapetis JR, McDonald M, Wilson NJ (2005) Acute rheumatic fever. Lancet 366: 155–168 3. Keitzer R (2005) Acute rheumatic fever (ARF) and poststreptococcal reactive arthritis (PSRA) – an update. Z Rheumatol 64:295–307 4. Robertson KA, Volmink JA, Mayosi BM (2005) Antibiotics for the primary prevention of acute rheumatic fever: a meta-analysis. BMC Cardiovasc Disord 5:11 5. Gibofsky A, Zabriskie JB (1995) Rheumatic fever and poststreptococcal reactive arthritis. Curr Opin Rheumatol 7:299–305 6. Berrios X, del Campo E, Guzman B, Bisno AL (1993) Discontinuing rheumatic fever prophylaxis in selected adolescents and young adults. A prospective study. Ann Intern Med 401–406 359 360 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.8 Lyme-Arthritis (ICD-Nr. A 69.2 + M 01.29 *) z Grundsätzliche Bemerkungen zur Therapiestrategie Die Lyme-Arthritis ist eine oft über Jahre intermittierend auftretende und z. T. chronisch verlaufende entzündliche Gelenkerkrankung. Antibiotika gelten als Mittel der Wahl bei ihrer Behandlung. Die antibiotische Therapie soll auch das Auftreten weiterer Spätmanifestationen einer Lyme-Borreliose verhindern. In einigen Fällen bleibt die antibiotische Therapie der Arthritis jedoch wirkungslos. Dabei stellt sich die Frage einer auch von der Persistenz vitaler Erreger unabhängigen Autoimmunpathogenese. Die Prognose der Lyme-Arthritis ist allgemein als günstig zu bezeichnen, da es selbst nach langjährigem Krankheitsverlauf (auch nach offensichtlich ineffektiver antibiotischer Therapie) noch spontan zu einer Remission kommen kann. z Medikamentöse Therapie Antibiotika Bei Studien zur Therapie der Lyme-Arthritis wurden sowohl orale als auch parenterale Antibiotika als effektiv erachtet (Tabelle 1). Die Erfolgsrate war bei beiden Applikationsformen etwa gleich; bislang wurde noch keine Vergleichsstudie oral versus parenteral durchgeführt. Es scheint somit vernünftig, zunächst eine orale Behandlung zu versuchen. Dabei ist Doxycyclin das Mittel der Wahl; bei Amoxicillin sind die erforderlichen Einnahmemodalitäten kritisch. Meist kommt es erst im Verlauf von einigen Monaten nach antibiotischer Therapie zu einer allmählichen Remission. Somit ist zunächst Geduld ratsam. Therapieresistente Fälle sind möglicherweise noch mit einer parenteralen Antibiotikatherapie zu heilen. Diese Beobachtung ist allerdings kritisch hinsichtlich eines tatsächlichen Therapieeffektes oder des Spontanverlaufs zu hinterfragen. Es gibt keine überzeugenden Argumente für eines der verschiedenen parenteral zu verabreichenden Antibiotika. Die nur einmal täglich notwendige Gabe bei Ceftriaxon ist bei einer ambulant zu behandelnden Erkrankung allerdings ein gewichtiges Entscheidungskriterium. Tabelle 1. Empfehlungen zur antibiotischen Therapie der Lyme-Arthritis Dosis (täglich) Dauer Oral Doxycyclin Amoxicillin 1-mal 200 mg 4-mal 500 mg 30 Tage 30 Tage Parenteral Ceftriaxon Penicillin G Cefotaxim 1-mal 2 g 4-mal 5 Mio I. E. 3-mal 2 g 14 Tage 14 Tage 14 Tage 5.5.8 Lyme-Arthritis z Der Erfolg der Therapie ist nur klinisch zu beurteilen. Serologische Verlaufskontrollen nach antibiotischer Therapie der Lyme-Arthritis ergeben keine relevanten Befunde. Weder die Persistenz spezifischer IgM-Antikörper, die in wenigen Fällen auch bei der Lyme-Arthritis nachweisbar sind, noch unveränderte spezifische IgG-Titer begründen isoliert betrachtet weitere therapeutische Konsequenzen. Bei Therapieversagern werden verschiedentlich antibiotische Langzeittherapien (z. T. in Form von Pulstherapien) propagiert. Hierfür gibt es aber keine rationale Grundlage. Bei der Mehrzahl der vermeintlichen Nonresponder ist eine kritische Überprüfung der Diagnose angezeigt. Sonstige Medikamente z Nichtsteroidale Antirheumatika besitzen allenfalls einen symptomatischen Effekt. z Kortikosteroide (oral oder intraartikulär) sollten keineswegs vor einer antibiotischen Behandlung angewandt werden, da sie so möglicherweise zu einer Unwirksamkeit von Antibiotika beitragen. Nach einer nicht ausreichend wirksamen antibiotischen Behandlung können intraartikuläre Kortikosteroidinjektionen aber eine Besserung oder Remission bewirken. z Es gibt keine überzeugenden Hinweise für die Wirksamkeit von Basistherapeutika bei der chronischen Lyme-Arthritis. z Nichtmedikamentöse Therapien Im akuten Stadium der Arthritis sind die üblichen Lokalmaßnahmen (Kryotherapie, Entleerung eines großen Ergusses, Gelenkschutz) angezeigt. Bei therapieresistenten chronischen Verlaufsformen kann letztlich eine Synovialektomie erforderlich werden. Insbesondere sollte diese in den seltenen Fällen, bei denen radiologisch Zeichen einer erosiven Arthritis festzustellen sind, durchgeführt werden. z Literatur 1. Dattwyler RJ, Halperin JJ, Volkman DJ, Luft BJ (1988) Treatment of late Lyme borreliosis: randomized comparison of ceftriaxone and penicillin. Lancet I:1191–1194 2. Herzer P (1993) Therapy of joint manifestations. In: Weber K, Burgdorfer W (eds) Aspects of Lyme borreliosis. Springer, Berlin Heidelberg New York, pp 340–343 3. Schoen RT, Aversa JM, Rahn DW, Steere AC (1991) Treatment of refractory chronic Lyme arthritis with arthroscopic synovectomy. Arthritis Rheum 34:1056–1060 4. Steere AC, Greene J, Schoen RT, Taylor E, Hutchinson GJ, Rahn DW, Malawista SE (1985) Successful parenteral penicillin therapy of established Lyme arthritis. N Engl J Med 312:869–874 5. Steere AC, Levin RE, Molloy PJ, Kalish RA, Abraham JA III, Liu NY, Schmid CH (1994) Treatment of Lyme arthritis. Arthritis Rheum 37:878–888 6. Wormser GP, Nadelman RB, Dattwyler RJ et al (2000) Practice guidelines for the treatment of Lyme disease. Clin Infect Dis 31(suppl 1):S1–S14 361 362 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.9 Sjögren-Syndrom (ICD-Nr. M 35.0) z Grundsätzliche Bemerkungen zur Therapiestrategie Das Sjögren-Syndrom (SS) ist eine chronische Erkrankung mit einer Vielzahl klinischer Manifestationen. Die Therapie des SS ist auf die Sicca-Symptome und ihre Komplikationen sowie die extraglandulären Manifestationen auszurichten. Gründliches Überwachen zum rechtzeitigen Erfassen der Vielzahl extraglandulärer Krankheitssymptome und einer malignen Lymphomentwicklung ist angebracht. Beim sekundären SS ist gleichzeitig die Grunderkrankung – meist eine rheumatoide Arthritis oder ein systemischer Lupus erythematodes – zu behandeln. Bei der Therapie des SS haben im Hinblick auf die Sicca-Symptome die klassischen DMARD keinen Effekt. Lediglich Hydroxychloroquin scheint neben der Beeinflussung extraglandulärer Symptome, besonders Arthralgien und Myalgien, auch bei Xerostomie und Xerophthalmie wirksam zu sein [2]. TNFa scheint in der Pathogenese des SS eine wesentliche Rolle zu spielen. Er wird in den Epithelien der kleinen Speicheldrüsengänge exprimiert und induziert die Freisetzung von Matrixmetalloproteinasen sowie die Expression von Endotheladhäsionsmolekülen und er unterstützt die Bildung von Lymphozytenagglomeraten. In einer Pilotstudie mit Infliximab verbesserten sich Müdigkeit, Schmerzen im Bewegungsapparat, Xerostomie und Xerophthalmie signifikant [5, 6]. Zur Xerophthalmie- und Xerostomietherapie steht jetzt ein Pilocarpinpräparat (Salagen®) zur Verfügung (Dosierung: 4-mal 5 mg/Tag). Eine Neuentwicklung ist das Cevimelinhydrochychlorid, das in Deutschland noch nicht zugelassen ist. Das Präparat ist ein Quinuclidinderivat des Azetylcholins und bindet an den Muscarin-Azethylcholin-Rezeptor, der auch in exokrinen Drüsen exprimiert wird. Die Substanz hat eine längere Halbwertszeit als das Pilocarpin und scheint diesem daher überlegen, 3-mal 30 mg/Tag führen zu einer signifikanten Verbesserung der Symptome der Xerostomie und Xerophthalmie [4]. z Keratokonjunktivitis Allgemeinmaßnahmen Exogene Noxen, die zu starker Austrockung oder Schädigung der Hornhaut beitragen, sind zu meiden (Rauchen, Aufenthalt in zentralgeheizten Räumen mit zu geringer Luftfeuchtigkeit, staubiges Umfeld, Luftstrahl der Gebläseheizung des Autos). Brillen mit großen Gläsern bieten einen gewissen Schutz vor Austrocknung. Medikamente, die die Sicca-Symptomatik verstärken, sind möglichst zu meiden. Nachts sind Vitamin-A haltige Augensalben sinnvoll. 5.5.9 Sjögren-Syndrom z Tränenersatzmittel Aus der Vielzahl angebotener Präparate ist das für den Patienten verträglichste auszuwählen. Die Tränenersatzmittel unterscheiden sich v. a. durch ihre Viskosität. Polyvinylalkohlpräparate (z. B. Lacrimal®, Arufil®) für geringe Schweregrade, Carboxymethylzellulosepräparate (z. B. Ocultect®) für schwerere Formen oder Gele mit längerer Verweildauer können empfohlen werden. Häufig entwickeln sich Unverträglichkeitserscheinungen gegenüber den Konservierungsstoffen. Bei chronischem Gebrauch kann zusätzlich eine Atrophie der Becherzellen auftreten. In diesen Fällen sind Einmaldosisbehältnisse ohne Konservierungsmittel angebracht. Stimulation der Tränensekretion Cevimelin, topisches Ciclosporin A und Biologicals werden zur Zeit geprüft. Pilocarpin (Salagen®) ist erhältlich, seine Kontraindikationen (unerwünschte Miosis) und unerwünschte Wirkungen (Rhinitis, Kopfschmerzen, verstärkter Harndrang, Gefäßerweiterung, Übelkeit, Schwindel u. a.) sind zu beachten und limitieren seinen Einsatz [7]. Operative Maßnahmen Bei schweren Fällen mit zu hoher notwendiger Tropffrequenz (öfter als 1-mal pro Stunde) kann der Ductus nasolacrimalis temporär (Cutgutfaden, Kunststoffplomben) oder permanent verschlossen werden. Es gelingt dadurch, das Gleitmittel länger im Auge zu halten. Eine laterale Tarsorrhaphie verringert die Augenoberfläche und muss bei schwerster Keratokonjunktivitis in Erwägung gezogen werden. z Xerostomie Allgemeinmaßnahmen Eine gründliche orale Hygiene kann das erhöhte Kariesrisiko mindern. Der Konsum von Zucker ist zu meiden. Fluoride sind als fluoridhaltige Zahnpasta oder als Mundspülung vor dem Schlafengehen 2 Minuten dauernde Spülungen mit 0,05%igem Natriumfluorid) zur Kariesprophylaxe ebenfalls sinnvoll. Die Behandlung einer Candidiasis erfolgt mit Nystatin oder Clotrimazol. Durch das Kauen von zuckerfreiem Kaugummi wird die Sekretion aus dem restlichen Speicheldrüsengewebe stimuliert. Das Rauchen ist zu unterlassen. Medikamente, die die Sicca-Symptomatik verstärken, sind möglichst zu vermeiden (Antidepressiva, Anticholinergika, Antihistaminika). 363 364 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Stimulation der Speichelsekretion Bromhexin (48 mg/Tag) kann die Konsistenz des Speichels verändern und damit das Trockenheitsgefühl vermindern. Pilocarpin (Salagen®) ist effektiv. Für die lokale Anwendung als Pastillen wird Interferon alpha (150 IU 3-mal/Tag) geprüft [3]. Speichelersatz Bester Speichelersatz ist das häufige Trinken kleiner Schlucke Wasser. Kommerzielle Speichelersatzpräparate (Spray, Lösungen) wirken nur kurze Zeit. z Trockene Scheide, trockene Haut Hier sind Scheidengele, bei der postmenopausalen Frau auch östrogenhaltige Salben und für die Haut fetthaltige Lotionen nützlich. z Extraglanduläre Manifestationen z Arthralgien, Arthritiden und Myalgien werden mit nichtsteroidalen Antirheumatika (NSAR) therapiert. Bei Unverträglichkeit, Kontraindikationen oder Ineffektivität kann Hydroxychloroquin (200–400 mg/Tag) angewandt werden. Letzteres soll auch bei Anämie und Thrombozytopenie, trockenen Augen und trockenem Mund wirksam sein. Das Raynaud-Phänomen wird durch die Gabe von Nifedipin (bis 3-mal 10 mg/Tag) verbessert, daneben ist ein wirksamer Kälteschutz erforderlich. z Weitere extraglanduläre Manifestationen werden in Abhängigkeit von ihrem Schweregrad immunsuppressiv behandelt. So erfordert eine leichte interstitielle Lungenkrankheit im Sinne einer Lungenfibrose meist keine Immunsuppression; besteht jedoch eine Progredienz, sind Glukokotikoide (initial 1 mg/kg KG/Tag) indiziert. Auch bei einer interstitiellen Pneumonie ist die gleiche Therapie angezeigt. z Häufig besteht bei einem Sjögren-Syndrom ein unproduktiver Husten, der jedoch auf eine Xerotracheitis und -bronchitis zurückgeht. Eine Inhalationstherapie kann zweckmäßig sein. z Eine Hilusvergrößerung oder noduläre Verschattungen im Lungenparenchym machen den Ausschluss maligner Lymphome durch Biopsie erforderlich. z Bei einer renalen Manifestation im Sinne einer tubulären Azidose kann die Gabe von 3-mal 1 g/Tag Natriumhydrogenkarbonat notwendig sein (pHKontrolle!). Bei gastrointestinaler Unverträglichkeit ist auch die Verabreichung von Natriumzitratlösung möglich. Bei der selteneren Glomerulonephritis, die häufig mit einer monoklonalen Kryoglobulinämie und einer Hypokomplementämie einhergeht, werden Glukokortikoide und bei Therapieresistenz Cyclophosphamid als Bolustherapie angewandt. 5.5.9 Sjögren-Syndrom z z Schwere nekrotisierende Vaskulitiden, die die Gefäße mittleren Kalibers betreffen und einer Panarteriitis nodosa ähnlich sind, erfordern den Einsatz von Glukokortikoiden und Cyclophosphamid (Bolustherapie). Eine leukozytoklastische Vaskulitis kleiner Gefäße, die mit einer Hypergammaglobulinämie assoziiert ist, verläuft meist leicht und benötigt häufig keine spezifische Therapie. z Eine periphere Polyneuropathie geht meist auf eine Vaskulitis zurück und kann ebenfalls mit Cyclophosphamid behandelt werden. z Die mögliche Kombination des SS mit einer primären biliären Zirrhose macht die zusätzliche Therapie der Letzteren notwendig. z Bei Entwicklung eines maligen Lymphoms ist die Chemotherapie durch den Onkologen erforderlich. Sie ist abhängig von Histologie, Lokalisation und Ausdehnung des malignen Prozesses. z Verhaltenshinweise für den Patienten Beim SS ist die Patientenaufklärung von besonderer Bedeutung. Zur Therapie der Sicca-Symptome und zum Vermeiden weiterer Komplikationen benötigen die Patienten viele praktische Ratschläge, um mit den subjektiv sehr quälenden Symptomen fertig zu werden; es empfiehlt sich ein Hinweis auf Selbsthilfegruppen. Eine psychologische Mitbetreuung kann sinnvoll sein. z Literatur 1. Fox R (2003) Sjögren’s syndrome: evolving therapies. Expert Opin Investig Drugs 12:247–254 2. Fox RI, Dixon R, Guarrasi V, Krubel S (1996) Treatment of primary Sjögren’s syndrome with hydroxychloroquine: a retrospective, open-label study. Lupus 5 (suppl 1):31–36 3. Khurshudian AV (2003) A pilot study to test the efficacy of oral administration of interferon-alpha lozenges to patients with Sjögren’s syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 95:38–44 4. Petrone D, Condemi JJ, Fife R et al (2002) A double-blind, randomized, placebocontrolled study of cevimeline in Sjögren’s syndrome patients with xerostomia and keratoconjunctivitis. Arthritis Rheum 46:748–754 5. Steinfeld SD, Demols P, Salmon et al (2001) Infliximab in patients with primary Sjögren’s syndrome: a pilot study. Arthritis Rheum 44:2371–2375 6. Steinfeld SD, Demols P, Appelboom T (2002) Infliximab in primary Sjögren’s syndrome: one-year followup. Arthritis Rheum 46:3301–3303 7. Vivino FB, Al-Hashimi I, Khan Z et al (1999) Pilocarpine tablets for the treatment of dry mouth and drey eye syndroms in patients with Sjögren syndrome: a randomized placebo-controlled, fixed-dose, multicenter trial. P92-01 Study Group. Arch Int Med 159:174–181 365 366 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.10 Systemischer Lupus erythematodes (ICD-Nr. M 32) z Grundsätzliche Bemerkungen zur Therapiestrategie Die Diagnose eines gesicherten systemischen Lupus erythematodes (SLE) (s. Kap. 3.11) stellt allein noch keine Therapieindikation dar. Die Behandlung orientiert sich vielmehr an den vorliegenden Manifestationen und am Krankheitsverlauf. Serologische Krankheitsmerkmale sind nur im Zusammenhang mit dem klinischen Bild zu interpretieren und dürfen nicht überbewertet werden. So begründet z. B. der Nachweis von antinukleären Antikörpern per se keine therapeutischen Maßnahmen. Jede Therapieentscheidung erfordert ein Abwägen der Gefährdung des Patienten durch die Erkrankung und möglicher Schäden durch die Behandlungsmaßnahmen, z. B. schwerer Infektionen infolge einer immunsuppressiven Therapie [10]. Ziel der Therapie muss es auch sein, irreversibele Schäden (z. B. terminales Nierenversagen, vorzeitige Arteriosklerose) zu verhindern, da diese für die Langzeitprognose entscheidend sind [15]. Zum Therapiemonitoring sollten validierte Instrumente der Krankheitsaktivitätsmessung (z. B. ECLAM, SLAM, SLEDAI) und eine Messung der krankheitsbedingten Organschädigungen (ACR/SLICC-Score) eingesetzt werden. z Medikamentöse Therapie Die medikamentöse Therapie des SLE stützt sich im Wesentlichen auf 4 Substanzgruppen: z nichtsteroidale Antirheumatika, z Antimalariamittel, z Kortikosteroide und z Immunsuppressiva. Der Einsatz dieser Medikamente orientiert sich am jeweiligen Schweregrad der Erkrankung. Der milde SLE mit geringer Allgemeinsymptomatik ist nicht unbedingt therapiepflichtig. Bei stärkeren Schmerzen des Bewegungsapparates können nichtsteroidale Antirheumatika zum Einsatz kommen. Wenn symptomatische Maßnahmen nicht ausreichen, v. a. bei persistierenden Arthralgien und Hautveränderungen, können Antimalariamittel Krankheitsaktivität und Schubhäufigkeit reduzieren [3]. Sie sind sinnvoll insbesondere bei nichtviszeralem SLE. Es handelt sich um eine Langzeittherapie mit Chloroquin bis zu 4 mg/kg KG/ Tag oder Hydroxychloroquin (bis zu 6,5 mg/kg KG/Tag, die der regelmäßigen Überwachung bedarf (siehe Kap. 5.3.2). Glukokortikoide sind eine wichtige Säule der SLE-Therapie. Phasen stärkerer Krankheitsaktivität sprechen auf Dosierungen von etwa 1 mg/kg KG Pred- 5.5.10 Systemischer Lupus erythematodes z nisolonäquivalent als initiale Tagesdosis an. Innerhalb von 8–12 Wochen ist eine Reduktion auf Dosierungen im Low-dose-Bereich anzustreben. Bei unzureichender Kontrolle der Krankheitsaktivität durch die bisher genannten Maßnahmen und bei primär bedrohlichen Organmanifestationen ist der Einsatz von Immunsuppressiva zu erwägen. Aufgrund seiner relativ geringen Nebenwirkungsfrequenz ist hierfür Azathioprin (ca. 2 mg/kg KG/Tag) ein geeignetes Präparat [13]. Als Alternative hierzu haben andere Immunsuppressiva wie Methotrexat [9], Ciclosporin A [14], Mycofenolat mofetil [4] in offenen Studien oder Studien mit kleinen Patientenzahlen therapeutische Effektivität gezeigt letzteres insbesondere bei der proliferativen Glomerulonephritis und therapieresistenten Hautmanifestationen. Eine schwere viszerale Beteiligung (z. B. Nieren-, ZNS-Beteiligung) stellt eine Indikation zur intravenösen Pulstherapie mit Cyclophosphamid (750 ± 250 mg/m2) dar. Die Effektivität niedriger Dosierungen für die Pulscyclophosphamidtherapie wird derzeit geprüft. Zur Remissionsinduktion wird in der Regel eine monatliche Cyclophosphamid-Pulstherapie über 6 Monate durchgeführt [2, 11, 12]. Zur Remissionserhaltung wird die Behandlung über 2 Jahre in vierteljährlichen Abständen fortgesetzt; alternativ wird eine remissionserhaltende Therapie mit anderen Immunsuppressiva (Azathioprin, Methotrexat, Ciclosporin A, Mycofenolat mofetil) geprüft. In lebensbedrohlichen Akutsituationen haben sich hoch dosierte Kortikosteroide, z. B. Methylprednisolon, in einer Dosis von 250–500 mg/Tag i.v. über 3–5 Tage bewährt. Generell sollte vor Einleitung dieser oder anderer intensivierter immunsuppressiver Therapieformen das Vorliegen einer Infektion als Ursache der klinischen Symptomatik ausgeschlossen werden. z Schwangerschaft Zu den Besonderheiten des SLE während der Schwangerschaft wird auf Kap. 3.11 verwiesen. z Systemischer Lupus erythematodes mit Antiphospholipidsyndrom In Ergänzung zur immunsuppressiven Therapie bedürfen Patienten mit SLE mit begleitendem Antiphospholipidsyndrom einer entsprechenden Therapie, wie in Kap. 18 ausgeführt [5, 8]. z UCTD, Mischkollagenose (MCTD) und andere Überlappungssyndrome Undifferenzierte Kollagenosen (UCTD) und Überlappungssyndrome mit klinischen Manifestationen eines SLE (Kap. 3.11) weisen in der Regel eine bessere Prognose und eine geringere Häufigkeit von schweren viszeralen Manifestationen auf. Die medikamentöse Therapiestrategie bei diesen Erkrankungen folgt den oben ausgeführten Grundsätzen zur Behandlung des SLE, ohne dass 367 368 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern hierfür Daten aus kontrollierten Studien vorliegen. Die Therapie einer Siccasymptomatik oder eines Raynaud-Syndroms unterscheidet sich nicht von der des Sjögren-Syndroms bzw. der systemischen Sklerose (s. Kap. 5.5.9 und 5.512). z Begleitende Therapie Die symptomatische Behandlung und die Therapie zusätzlicher Erkrankungen von SLE-Patienten unterscheidet sich prinzipiell nicht von der bei Nicht-SLEPatienten. Allerdings ist zu berücksichtigen, dass zahlreiche Medikamente (Antihypertensiva, Antibiotika, Antikonvulsiva, Hormone etc.) die Krankheitsaktivität verstärken können. Zur Verbesserung der Langzeitprognose und zur Vermeidung von Organschädigungen ist insbesondere auf eine konsequente Therapie einer begleitenden arteriellen Hypertonie, Hyperlipidämie und einer diabetischen Stoffwechsellage zu achten [7]. Bei Einsatz einer Glukokortikoidtherapie ist eine medikamentöse Osteoporoseprophylaxe bzw. -therapie erforderlich. Wie bei anderen immunsuppremierten Patienten ist eine Immunisierung mit Pneumokokken- und Haemophilus-influenzae-Vakzinen sinnvoll. Unter intensivierter Immunsuppression ist auch eine Prophylaxe gegen Pneumocystis carinii zu erwägen und bei geplanten Eingriffen (z. B. Zahnextraktion) eine Antibiotikaprophylaxe erforderlich. z Verhaltenshinweise für den Patienten Die sorgfältige Aufklärung des Patienten über Gründe, Erfolgsaussichten und Nebenwirkungen der Therapie ist eine entscheidende Voraussetzung für den Therapieerfolg wie auch für die sichere Durchführung der Therapie. Die Notwendigkeit der regelmäßigen Therapieüberwachung sollte ebenfalls ausführlich dargestellt werden. Die Manifestation der Erkrankung oder das Auftreten von Schüben können von Östrogenen und UV-Strahlen begünstigt werden. Daher sollten sonnenempfindliche Patienten eine Bestrahlung durch UV-Licht meiden und Sonnenschutzcremes mit hohem Lichtschutzfaktor (> 15) benutzen. Bei der Empfängnisverhütung sollten östrogenhaltige Präparate vermieden werden. Als Alternativen stehen reine Gestagenpräparate oder mechanische Barrieren zur Verfügung. z In Erprobung befindliche Therapiemaßnahmen Es existieren Einzelberichte zum erfolgreichen Einsatz der immunablativen Hochdosischemotherapie mit und ohne Stammzelltransplantation sowie zur Therapie mit hochdosierten i.v. Immunglobulinen [6]. Darüber hinaus sind zahlreiche neue Ansätze einer spezifischen Lupustherapie in klinischer Erpro- 5.5.10 Systemischer Lupus erythematodes z bung, von denen der Versuch einer Toleranzinduktion mit einem DNA-Konstrukt am weitesten fortgeschritten ist [1]. z Literatur 1. Alarcon-Segovia D, Tumlin JA, Furie RA, McKay JD, Cardiel MH, Strand V, Bagin RG, Linnik MD, Hepburn B (2003) LJP 394 for the prevention of renal flare in patients with systemic lupus erythematosus: results from a rondomized, doubleblind, placebo-controlled study. Arthritis Rheum 48:442–454 2. Boumpas DT, Austin HA, Vaughn EM, Klippel JH, Steinberg AD, Yarboro CH, Balow JE (1992) Controlled trial of pulse methylprednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis. Lancet 340:741–745 3. Canadian Hydroxychloroquine Study Group (1991) A randomized study of the effect of withdrawing hydroxychloroquine sulfate in systemic lupus erythematosus. N Engl J Med 324:150–154 4. Chan TM, Li FK, Tang CS, Wong RW, Fang GX, Ji YL, Lau CS, Wong AK, Tong MK, Chan KW, Lai KN (2000) Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis. Hong Kong-Guangzhou Nephrology Study Group. N Engl J Med 343:1156–1162 5. Derksen RHWM, de Groot PhG, Kater L, Nieuwenhuis HK (1993) Patients with antiphospholipid antibodies and venous thrombosis should receive longterm anticoagulant treatment. Ann Rheum Dis 52:689–692 6. Francioni C, Galeazzi M, Fioravanti A, Gelli R, Megale F, Marcolongo R (1994) Long term i.v. Ig treatment in systemic lupus erythematosus. Clin Exp Rheumatol 12:163–168 7. Ginzler EM, Felson DT, Anthony JM, Anderson JJ (1993) Hypertension increases the risk of renal deterioration in systemic lupus erythematosus. J Rheumatol 20:1694–1700 8. Khamashta MA, Cuadrado MJ, Mujic F, Taub NA, Hunt BJ, Hughes GRV (1995) The management of thrombosis in the antiphospholipid-antibody syndrome. N Engl J Med 332:993–997 9. Kimberley W, Abeles M (1994) A 2 year, open ended trial of methotrexate in systemic lupus erythematosus. J Rheumatol 21:1674–1677 10. Klippel JH (1990) Systemic lupus erythematosus. Treatment-related complications superimposed on chronic disease. JAMA 263:1812–1815 11. Steinberg AD, Gourley MF, Klinman DM, Tsokos GC, Scott DE, Krieg A (1991) Systemic lupus erythematosus. Ann Intern Med 115:548–559 12. Steinberg AD, Steinberg SC (1991) Long-term preservation of renal function in patients with lupus nephritis receiving treatment that includes cyclophosphamide versus those treated with prednisone only. Arthritis Rheum 34:945–950 13. Sztejnbok M, Stewart A, Diamond H, Kaplan D (1971) Azathioprine in the treatment of systemic lupus erythematosus. A controlled study. Arthritis Rheum 14:639–645 14. Tokuda M, Kurata N, Mizoguchi A, Inoh M, Seto K, Kinashi M, Takahara J (1994) Effect of low-dose Ciclosporin A on systemic lupus erythematosus disease activity. Arthritis Rheum 37:551–558 15. Urowitz MB, Bookman AA, Koehler BE, Gordon DA, Smythe HA, Ogryzlo MA (1976) The bimodal mortality pattern of systemic lupus erythematosus. Am J Med 60:221–225 369 370 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.11 Antiphospholipidsyndrom (ICD D 68.8) z Grundsätzliche Bemerkungen und Therapiestrategie Das Antiphospholipidsyndrom (APS) ist definiert durch rezidivierende arterielle oder venöse Thrombosen oder Aborte in Verbindung mit Antikörpern gegen verschiedene Proteine, die an anionische Phospholipide gebunden sein können (Lupusantikoagulans, Anticardiolipin, Anti-b2-Glykoprotein-I). Anhand klinischer und serologischer Kriterien wird zwar eine Risikogruppe für thromboembolische Komplikationen charakterisiert, hinsichtlich der klinischen Bedeutung dieses Syndroms und der sich daraus ergebenden therapeutischen Konsequenzen herrscht aber mangels prospektiver Daten und großer Unterschiede in der Definition von Krankheitsmanifestationen sowie von Patienten- und Kontrollgruppen in retrospektiven Untersuchungen relative Unklarheit [10]. Es gibt Patienten mit Antiphospholipidantikörpern (aPL) ohne klinische Manifestationen eines APS [15] und bei unselektionierten Patienten mit thromboembolischen Ereignissen finden sich kaum Assoziationen mit aPL. Therapeutische Empfehlungen beruhen ausschließlich auf retrospektiven Daten [4, 10, 16]. Die Therapiestrategie besteht in der Akutbehandlung thromboembolischer Komplikationen und der Sekundärprophylaxe weiterer Ereignisse oder von Schwangerschaftskomplikationen. z Prognostische Einschätzung des Thromboserisikos Das Risiko für thromboembolische Ereignisse kann bei APS-Patienten kaum vorhergesagt werden. Dies liegt vor allem an dem Fehlen prospektiver klinischer Studien zum Krankheitsverlauf und Therapie des APS [3]. Bekannt ist, dass das Risiko, ein thromboembolisches Ereignis zu erleiden, mit der Anzahl schon stattgehabter Komplikationen steigt [7], was das prognostische und therapeutische Dilemma beim APS betont. Die Inzidenz thromboembolischer Komplikationen bei APS-Patienten schwankt nach verschiedenen, nur eingeschränkt vergleichbaren Studien zwischen 5 und 40 thromboembolischen Manifestationen pro 100 Patientenjahren (Übersicht in [19]). Dabei gibt es Untersuchungen, welche eine Abhängigkeit der Rate thromboembolischer Komplikationen von dem Titer der aPL nahe legen [9, 20]. In dieser Hinsicht signifikante aPL liegen über 3–5 SD oberhalb des Mittelwerts eines Normalkollektivs, was ca. 40–50 GPU/ml für Anticardiolipinantikörper (IgG-Isotyp) entspricht. Es gibt aber auch Patienten mit hohen aPL-Titern, die nie entsprechende Komplikationen erleiden [15]. Frauen mit APS und rezidivierendem Abort haben ein erhöhtes Risiko für thromboembolische Ereignisse [6]. 5.5.11 Antiphospholipidsyndrom z z Medikamentöse Therapie des APS Weitgehender Konsens herrscht inzwischen darüber, dass eine Immunsuppression beim APS keinen Effekt und keinen Einfluss auf die Rate thromboembolischer Komplikationen zeigt [4]. Beim sekundären APS im Rahmen eines SLE ist aber gerade deshalb eine genaue Abgrenzung zwischen den immunologisch-entzündlichen „vaskulitischen“ Krankheitserscheinungen und den „vaskulopathischen“ thrombembolischen Komplikationen des APS wichtig, da sie ganz unterschiedliche therapeutische Konsequenzen hat (Immunsuppression versus Antikoagulation) [2]. Diese Unterscheidung kann bei Manifestationen des ZNS (Zerebritis versus zerebraler Durchblutungsstörungen) und der Nieren (Glomerulonephritis versus obliterierende Glomerulosklerose) schwierig sein. z Akuttherapie thrombembolischer Komplikationen Thrombosen werden bei APS genauso behandelt wie bei anderen Ursachen. Zunehmend wird die konventionelle i.v. Heparintherapie (gesteuert nach PTT, was bei positivem Lupusantikoagulans größere Schwierigkeiten bereitet) durch die subkutane Gabe niedermolekularer Heparine (NMH) in „effektiver“ Dosierung ersetzt [17]. Hierbei ist eine Steuerung über die Anti-Faktor-Xa-Aktivität anzuraten mit einem Ziel von 0,35–0,7 Anti-Faktor-Xa U/ml 3 Stunden nach der Injektion. In der niedrigen Dosierung (Thromboseprophylaxe) wird von der überwiegenden Anzahl der Autoren eine fixe Gabe 1-mal täglich empfohlen: Enoxaparin 40 mg/Tag, Dalteparin 2500 IE/Tag und Nadroparin 0,3 ml/ Tag. In der hohen (therapeutischen) Dosierung wird entweder die prophylaktische Dosis 2-mal täglich verabreicht oder entsprechend der Behandlung der akuten Venenthrombose körpergewichtsadaptiert 2-mal täglich injiziert. Bei Gabe von NMH sollte zur Osteoporoseprophylaxe Kalzium 1000 mg/Tag gegeben werden. Eine regelmäßige Kontrolle der Thrombozyten zur frühzeitigen Erkennung einer evtl. HIT wird auch unter NMH empfohlen. Die NMH-Gabe ist 12 Stunden vor einem elektiven operativen Eingriff zu unterbrechen und sollte frühestens 4 Stunden nach Beendigung wieder angesetzt werden. Beim „catastrophic“ APS werden zur Antikoagulation hohe Dosen Glukokortikoide, Plasmapherese und/oder intravenöse Immunglobuline empfohlen [4]. z Prophylaxe thromboembolischer Ereignisse Nach der Akuttherapie thrombembolischer Komplikationen besteht die Therapie des APS vor allem in der (Sekundär-)Prophylaxe weiterer Ereignisse [11]. Eine antikoagulatorische Therapie ist in der Lage, das Risiko für thromboembolische Ereignisse beim APS zu senken, dies gilt auch für schwere Verläufe mit Multiorganbefall („catastrophic APS“). Hierfür stehen derzeit Thrombozytenaggregationshemmer (ASS), Heparin und Cumarine zur Verfügung. Letztere scheinen zwar die effektivste Prophylaxe zu sein, dennoch werden unter Cumarintherapie pro Jahr in 7,1%–10,7% thromboembolische Ereignisse be- 371 372 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern obachtet [4, 12]. Cumarine haben den Nachteil, mit einem Risiko von zum Teil schweren Blutungskomplikationen belastet zu sein [13, 18], zumal es Hinweise darauf gibt, dass nur eine relativ „strenge“ Einstellung mit INR-Werten zwischen 2,6 und 3,0 eine signifikante prophylaktische Wirkung hat [12]. Dies lässt eine prophylaktische Antikoagulation bei allen Patienten mit aPL obsolet erscheinen. Es gibt Patienten mit APS, bei denen schon die Gabe von Thrombozytenaggregationshemmern auszureichen scheint, weitere Thrombosen zu verhindern [5], sodass diese gar keinem höheren therapeutischen Risiko ausgesetzt werden müssen und es gibt auch Überlegungen, die Notwendigkeit einer effektiven Antikoagulation nach Zahl und Schwere der thromboembolischen Komplikationen bzw. nach der Höhe der aPL zu stratifizieren [4]. Bei weniger bedrohlichen Manifestationen wird z. B. keine lebenslange Cumarintherapie, sondern – trotz hierfür unsicherer Datenlage – eine spätere Umstellung auf niedrig dosierte Azetylsalizylsäure (75–100 mg/Tag) empfohlen, auch wenn es sich um venöse Ereignisse gehandelt hat [17]. Zu dem evtl. Stellenwert von ADP Antagonisten beim APS gibt es noch keine Studien. Schwere Ereignisse werden als Indikation für eine lebenslange Antikoagulation angesehen, bei hierunter weiter eintretenden Komplikationen wird diese um eine Thrombozytenaggregationshemmung ergänzt, sofern eine effektive therapeutische Einstellung vor dem Ereignis bestand. Bei der seltenen Normalisierung von aPL im Langzeitverlauf einzelner Patienten kann eine Reduktion bzw. ein Absetzen der Antikoagulation erwogen werden [4]. Bei fehlender Kontraindikation für Aspirin wurde die Low-dose-Aspirineinnahme für asymptomatische, nicht schwangere, nicht ASS-allergische Individuen mit erhöhten aPL empfohlen [1], insbesondere bei Patienten mit begleitendem SLE. z Prophylaxe von Aborten Frauen mit APS haben ein gesteigertes Risiko für wiederholte Aborte, insbesondere nach der 10. Schwangerschaftswoche. Hier haben sich ASS (bereits vor der Konzeption) und NMH bewährt. Die Kombination von ASS und Heparin hat sich gegenüber der alleinigen Gabe von ASS in einigen Studien als vorteilhaft zur Verhinderung erneuter Aborte erwiesen. z Hinweise für Patienten Betroffene sollten über die Risiken der Antikoagulantientherapie und die erforderlichen Sicherheitsmaßnahmen informiert werden. z Literatur 1. Alarcon-Segovia D, Boffa MC, Branch W, Cervera R, Gharavi A, Khamashta M, Shoenfeld Y, Wilson W, Roubey R (2003) Prophylaxis of the antiphospholipid syndrome: a consensus report. Lupus 12:499–503 5.5.11 Antiphospholipidsyndrom z 2. Ames PR, Khamashta MA, Hughes GR (1995) Clinical and therapeutic aspects of the antiphospholipid syndrome. Lupus. 4 (suppl 1):S23–S25 3. Barbui T, Finazzi G (1994) Clinical trials on antiphospholipid syndrome: what is being done and what is needed? Lupus 3:303–307 4. Bermas BL, Schur PH, Kaplan AA (2006) In: Rose BD (ed) Treatment of the antiphospholipid syndrome. Uptodate 10/2006, USA 5. Cohen MG, Lui SF (1992) Multiple complications of the antiphospholipid syndrome with apparent response to aspirin therapy. J Rheumatol 19:803–806 6. Erkan D, Merrill JT, Yazici Y, Sammaritano L, Buyon JP, Lockshin MD (2001) High thrombosis rate after fetal loss in antiphospholipid syndrome: effective prophylaxis with aspirin. Arthritis Rheum 44:1466–1467 7. Finazzi G, Brancaccio V, Moia M, Ciaverella N, Mazzucconi MG, Schinco PC, Ruggeri M, Pogliani EM, Gamba G, Rossi E et al (1996) Natural history and risk factors for thrombosis in 360 patients with antiphospholipid antibodies: a fouryear prospective study from the Italian Registry. Am J Med 100:530–536 8. Fischer-Betz R, Specker C (2003) Antiphospholipid-Antikörper und Schwangerschaft. Akt Rheumatol 28:131–137 9. Ginsburg KS, Liang MH, Newcomer L, Goldhaber SZ, Schur PH, Hennekens CH, Stampfer MJ (1992) Anticardiolipin antibodies and the risk for ischemic stroke and venous thrombosis. Ann Intern Med 117:997–1002 10. Hughes GR (1993) The antiphospholipid syndrome: ten years on. Lancet 342:341–344 11. Khamashta MA (1996) Management of thrombosis in the antiphospholipid syndrome. Lupus 5:463–466 12. Khamashta MA, Cuadrado MJ, Mujic F, Taub NA, Hunt BJ, Hughes GR (1995) The management of thrombosis in the antiphospholipid-antibody syndrome. N Engl J Med 332:993–997 13. Petri M (1997) Pathogenesis and treatment of the antiphospholipid antibody syndrome. Med Clin North Am 81:151–177 14. Petri M, Qazi U (2006) Management of antiphospholipid syndrome in pregnancy. Rheum Dis Clin North Am 32:591–607 15. Piette JC (1996) 1996 diagnostic and classification criteria for the antiphospholipid/cofactors syndrome: a „mission impossible“? Lupus 5:354–363 16. Rosove MH, Brewer PM (1992) Antiphospholipid thrombosis: clinical course after the first thrombotic event in 70 patients. Ann Intern Med 117:303–308 17. Roubey RA (2002) Treatment of the antiphospholipid syndrome. Curr Opin Rheumatol 14:238–242 18. Ruiz-Irastorza G, Khamashta MA, Hunt BJ, Escudero A, Cuadrado MJ, Hughes GR (2002) Bleeding and recurrent thrombosis in definite antiphospholipid syndrome: analysis of a series of 66 patients treated with oral anticoagulation to a target international normalized ratio of 3.5. Arch Intern Med 162:1164–1169 19. Specker C (2002) Inzidenz thromboembolischer Komplikationen beim APS. Das Antiphospholipidsyndrom – Bedeutung der Antiphospholipid-Antikörper für Diagnose, Differentialdiagnose, Prognose und Therapie des systemischen Lupus Erythematodes. Habilitationsschrift, Kap. 1.4.5. Shaker, Aachen, S 18–19 20. Specker C, Rademacher J, Sohngen D, Sitzer M, Janda I, Siebler M, Steinmetz H, Schneider M (1997) Cerebral microemboli in patients with antiphospholipid syndrome. Lupus 6:638–644 373 374 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.12 Systemische Sklerose z Grundsätzliche Bemerkungen zur Therapiestrategie Am pathogenetischen Prozess der systemischen Sklerose sind im Wesentlichen 3 verschiedene Zellsysteme und die von ihnen sezernierten Mediatoren beteiligt: immunkompetente Zellen (aktivierte T-Zellen, Monozyten/Makrophagen), Endothelzellen und Fibroblasten. Die therapeutischen Optionen konzentrieren sich daher auf Immunsuppression, Hemmung des Fibroseprozesses und Verbesserung der Mikrozirkulation. Es gibt z. Z. keine für alle Stadien und Verlaufsformen der systemischen Sklerose etablierte Therapie. Für die Mehrzahl der bisher eingesetzten Medikamente liegen Ergebnisse kontrollierter Studien nicht vor [17]. Relativ sichere therapeutische Empfehlungen können derzeit nur für bestimmte Symptome und Stadien des in Manifestation und Verlauf stark differenten Krankheitsbildes gegeben werden. Insbesondere in späten Stadien sowie bei limitierter Verlaufsform besteht die Neigung zu spontanem Stillstand der Erkrankung. Daher ist es bei der längerfristigen Effektivitätsbeurteilung therapeutischer Maßnahmen schwierig, Spontanverlauf und Therapieeffekt zu differenzieren. Voraussetzung für die interdisziplinäre Therapieplanung und die Definition des Therapieziels ist die möglichst genaue und frühzeitige, unter prognostischen Gesichtspunkten erfolgende Zuordnung zu diffuser oder limitierter (akraler) Verlaufsform und der Nachweis bzw. Ausschluss einer viszeralen Beteiligung. z Medikamentöse Therapie Die Planung der medikamentösen Therapie macht die Unterscheidung zwischen prognostisch günstiger (akraler Hautbefall, seltener Beteiligung lebenswichtiger Organe) sowie ungünstiger (diffuse Sklerodermie, rasche Progredienz, häufige Beteiligung von Lunge, Herz oder Nieren) Verlaufsform erforderlich. Da sich Hinweise auf die Effektivität der meisten Immunsuppressiva sowie von D-Penicillamin nur aus unkontrollierten Studien ergeben und diese Pharmaka potenziell zu ernsten Nebenwirkungen führen können, sollten sie nur bei diffuser Hautsklerose, rascher Progredienz und viszeraler Beteiligung zur Anwendung kommen. Daneben sind spezielle Therapieprobleme wie Motilitätsstörungen im Bereich des Gastrointestinaltraktes, fibrosierende Alveolitis, hypertone Krisen bei renaler Beteiligung sowie die primäre oder sekundäre pulmonale Hypertonie zu beachten. 5.5.12 Systemische Sklerose z z Limitierte (akrale) Verlaufsform der systemischen Sklerose ohne Beteiligung lebenswichtiger Organe Bei der limitierten Verlaufsform ohne Beteiligung lebenswichtiger Organe sind unter engmaschiger Überwachung der Organfunktion medikamentöse Maßnahmen zur Verbesserung der Mikrozirkulation (Raynaud-Symptomatik) sowie physikalische Maßnahmen häufig ausreichend. z Kalziumantagonisten. Zur Verbesserung der Mikrozirkulation kann z. B. Nifedipin in einer Dosierung von 20–30 mg/Tag als Dauertherapie gegeben werden [40, 45]. z Prostaglandinanaloga. In 7 kontrollierten Studien konnte gezeigt werden, dass die zyklische parenterale Applikation von Prostaglandinanaloga die Ausprägung der Raynaud-Symptomatik vermindert und die Entwicklung von Fingerkuppennekrosen verhindert bzw. deren Abheilen beschleunigt [28, 44]. Eingesetzt werden Infusionen mit Carboprostacyclin (Iloprost) (initial 1,0–2,0 ng/ kg/min über 6–8 h an 3–5 aufeinander folgenden Tagen, wiederholte Infusionen über 1–2 Tage alle 3–7 Wochen) oder Alprostadil (Prostavasin) 60 lg in 3h über 10–14 Tage [4]. Eine gefäßwirksame Therapie ist auch mit Calcitonin als i.v.-Infusion in einer Dosierung von 100 IE über 10 Tage möglich [2]. Für den Alpharezeptorenblocker Prazosin in einschleichender Dosierung und Steigerung auf 4–5 mg/Tag konnte in kontrollierten Studien ein positiver Effekt auf die Raynaud-Symptomatik nachgewiesen werden [29]. Glukokortikoide in einer Dosierung beginnend mit 20–30 mg/Tag sind nur im frühen ödematösen Stadium der Erkrankung und bei durch nichtsteroidale Antirheumatika nicht beherrschbaren Arthritiden und Arthralgien indiziert. z Der Endothelin-1-Rezeptorantagonist Bosentan vermindert das Auftreten digitaler Ulerza. z Diffuse Verlaufsform der systemischen Sklerose sowie Beteiligung lebenswichtiger Organe Bei Patienten mit diffusem Hautbefall, rascher Progredienz und Beteiligung lebenswichtiger Organe (Lunge, Herz, Niere) ist insbesondere im Frühstadium der Erkrankung unter Abwägung des Risiko-Nutzen-Verhältnisses der Einsatz von Immunsuppressiva gerechtfertigt. z Cyclophosphamid. Positive Effekte von Cyclophosphamid (1–2,5 mg/kg/Tag [1] kontinuierlich oral oder intravenöse Pulstherapie alle 3–4 Wochen) in Kombination mit Prednisolon in unterschiedlichen Dosierungen wurden in mehreren unkontrollierten Studien [1, 20] im Hinblick auf die fibrosierende Alveolitis beschrieben (s. dort). Teilweise wurde auch eine Verbesserung des Hautscores beobachtet. 375 376 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Methotrexat. In einer doppelblinden plazebokontrollierten Studie konnte eine signifikante Besserung des Hautscores unter Therapie mit 15–20 mg/Woche Methotrexat beobachtet werden [43]. z Azathioprin in einer Dosierung von 2 mg/kg/Tag zeigte in einer unkontrollierten Studie eine günstige Beeinflussung der Hautsklerose [21]. z Ciclosporin hatte ebenfalls Einfluss auf die kutane Manifestation; allerdings ist unter dieser Behandlung mit einem höheren Risiko renaler Komplikationen (malige Hypertonie, Niereninsuffizienz) zu rechnen [9, 32]. z Glukokortikoide. Bei hoher entzündlicher Aktivität, insbesondere bei Alveolitis, Myositis sowie bei Overlappingsymptomatik kommt zusätzlich Prednisolon in einer Dosierung von 30 mg/Tag bis 1 mg/kg/Tag initial zum Einsatz. Eine Glukokortikoidpulstherapie mit Applikation von 100 mg Dexamethason monatlich führte im Vergleich zu Plazebo zu einer signifikanten Besserung des Hautscores [33]. Das Risiko der Entwicklung einer Niereninsuffizienz ist bei hochdosierter Anwendung von Kortikoiden bei der systemischen Sklerose erhöht [17]. z D-Penicillamin. Die antifibrotische Behandlung mit D-Penicillamin ist mit einer hohen Rate teils schwerer Nebenwirkungen (ca. 40%) verbunden und in ihrer Wertigkeit stark umstritten [16, 25]. Der Therapieeffekt tritt i. A. erst nach ca. 1-jähriger Behandlungsdauer ein, die von vielen Patienten wegen Nebenwirkungen gar nicht erst erreicht wird. In einer retrospektiven sowie einer nicht plazebokontrollierten prospektiven Studie wurde ein günstiger Einfluss auf die Hautmanifestation sowie eine Verbesserung der Gesamtprognose beschrieben [22, 38]. Der Effekt einer hochdosierten Therapie mit 750–1000 mg/d war nicht different von dem einer Therapie mit nur 125 mg/Tag umtägig, wonach die Wirksamkeit der Low-dose-Therapie und damit überhaupt der Therapie mit D-Penicillamin bezweifelt werden muss [8, 16]. Der Einsatz vasoaktiver Pharmaka zur Behandlung der Raynaud-Symptomatik sowie zur Verbesserung der Mikrozirkulation im viszeralen Bereich kann auch bei der diffusen Verlaufsform empfohlen werden. z Organspezifische medikamentöse Therapie Fibrosierende Alveolitis Die fibrosierende Alveolitis ist die häufigste vital bedrohliche Manifestation der systemischen Sklerose und gehört zu den häufigsten Todesursachen. Sowohl für die kontinuierliche orale Therapie mit 1–2,5 mg/kg/Tag Cyclophosphamid [1, 37, 39] als auch für die Cyclophosphamidpulstherapie [18, 26, 33] in Kombination mit Prednisolon in verschiedenen Dosierungen wurde eine Verbesserung oder Stabilisierung von pulmonaler Funktion und/oder des radiologischen Befundes der Lunge beschrieben. Dies gilt auch für die Kombina- 5.5.12 Systemische Sklerose z tion von Cyclophosphamidpuls- (15 mg/kg) und Methylprednisolonpulstherapie (10 mg/kg) alle 3–4 Wochen (20). In Kombination mit einer Cyclophosphamidpulstherapie hat sich eine initial hochdosierte Prednisolontherapie (1 mg/kg/Tag für 4 Wochen, dann Reduktion) im Vergleich zu einer von Beginn an niedrig dosierten Prednisolontherapie im Hinblick auf Lungenfunktion und radiologischen Befund als effektiver erwiesen [26]. Primäre und sekundäre pulmonale Hypertonie Unter oraler Therapie mit dem Endothelin-1-Antagonisten Bosentan (2-mal 62,5 mg/Tag für die ersten 4 Wochen, dann Steigerung auf 2-mal 125–250 mg/ Tag) konnte gegenüber Plazebo eine signifikante Verbesserung der körperlichen Belastbarkeit sowie der kardialen Hämodynamik („cardiac index“, pulmonal-vaskulärer Widerstand) beobachtet werden [7, 30]. Auch für die kontinuierliche intravenöse Gabe von Epoprostenol wurde in einer kontrollierten Studie eine signifikante Verbesserung der Belastbarkeit und der hämodynamischen Parameter gezeigt [3]. Ähnlich positive Effekte wurden in einer nicht kontrollierten Studie für die inhalative Therapie mit Epoprostenol beschrieben [26]. Renale Hypertonie Durch maligne Hypertonie gekennzeichnete renale Krisen bei systemischer Sklerose können durch ACE-Hemmer beherrscht werden. Mit einer Blutdrucksenkung lässt sich häufig eine Verbesserung der renalen Funktion erreichen [35]. Insbesondere bei diffusen Verlaufsformen der systemischen Sklerose sind regelmäßige Blutdruckkontrollen erforderlich; bereits bei grenzwertigen Blutdruckwerten sollte eine Therapie mit ACE-Hemmern eingeleitet werden. Beteiligung des Gastrointestinaltraktes Bei den häufig beobachteten Ösophagusmotilitätsstörungen empfiehlt sich der Einsatz von Prokinetika wie z. B. Metoclopramid 3-mal 10 mg, falls sich noch keine schwere Atrophie der glatten Muskulatur des Ösophagus entwickelt hat [6]. Bei Refluxösophagitis ist zuätzlich die Gabe von Protonenpumpenhemmern (z. B. Omeprazol 40–60 mg/Tag) angezeigt [6]. Es ist zu beachten, dass Nifedipin den gastroösophagealen Reflux verstärken kann. Bei intestinaler Beteiligung mit intestinaler Pseudoobstruktion hat sich die subkutane Gabe des Somatostatinanalogons Octreotid (50–75 lg/Tag) bewährt [11, 23]. Außerdem ist bei Dünndarmbeteiligung eine entsprechende Substitutionstherapie des Malassimilationssyndroms sowie eine antibiotische Therapie bei bakterieller Fehlbesiedelung erforderlich. 377 378 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Nichtmedikamentöse Therapie Auch die physikalische Therapie erfordert abhängig von den Erscheinungsformen der systemischen Sklerose einen differenzierten Einsatz der Mittel. Sowohl das spezielle Symptom als auch der Allgemeinzustand des Patienten sind für die Indikationsstellung wesentlich [42]. Einige Hinweise dazu finden sich nachfolgend. z Raynaud-Syndrom: hydroelektrisches Teilbad – CO2-Bad – ansteigendes Teilbad – Bindegewebsmassage (neuraltherapeutischer Aufbau) – Sauna; z Limitierte Verlaufsform: Ultraschall (Phonophorese) – Bindegewebsmassage (Unterhautfasziengriff) – Unterwassermassage – Bewegungstherapie (Mobilisation); z Akrosklerose: Bewegungstherapie (Mobilisation, Hausübungsprogramm, Ergotherapie) – Ultraschall – hydroelektrisches Teilbad – manuelle Lymphdrainage – ansteigendes Teilbad; z Stammbefall: Bewegungstherapie (Schwimmen, Hausübungsprogramm) – CO2-Bad – hydroelektrisches Vollbad – Unterwasserstrahlmassage – Sauna; z Restriktive Ventilationsstörung: Atemtherapie (Dehnlagerung, periphere Atemantriebe). z In Erprobung befindliche Therapieformen Die Therapie mit extrakorporaler Photophorese hat zu widersprüchlichen Ergebnissen [10, 12, 14, 30, 46] geführt und bedarf einer weiteren Evaluierung. Eine Verbesserung der kutanen Befunde und eine Stabilisierung der Veränderungen an inneren Organen wurde nach autologer Stammzelltransplantation beobachtet [5, 15, 24, 41]. Interessante neue Aspekte in der Behandlung verschiedener Manifestationen der systemischen Sklerose ergeben sich durch die Anwendung von AT1-Rezeptor-Antagonisten. Eine im Vergleich zu 40 mg Nifedipin signifikant bessere Beeinflussung der Raynaud-Symptomatik wurde für eine Therapie mit 50 mg Losartan gezeigt [13]. z Obsolete Therapieformen Für die Zytostatika Chlorambucil und 5-Fluorourazil konnte in kontrollierten Studien keine Effektivität nachgewiesen werden [17]. Auf Grund der onkogenen Potenz sollten sie daher nicht zur Anwendung kommen. Auch für Aminobenzoatkalium wurde in einer prospektiven, randomisierten, doppelblinden, plazebokontrollierten Studie bei 146 Patienten Ineffektivität nachgewiesen [17]. Darüber hinaus sind Paragruppenallergien als Kontraindikation anzusehen. Eine Behandlung mit Penizillin, Isotretionin oder Ketotifen kann nicht 5.5.12 Systemische Sklerose z empfohlen werden. Auch für die Therapie mit Gammainterferon liegt keine genügende Evidenz für Wirksamkeit vor [17, 19]. z Verhaltenshinweise für den Patienten Im Hinblick auf die bestehende Mikrozirkulationsstörung ist die Vermeidung von Kälte und Feuchtigkeit (Schutz der Akren), von Nikotin sowie Clonidinund ergotaminhaltigen Pharmaka bedeutsam [6]. Die sehr umfassende Schulung der Patienten, insbesondere im Hinblick auf die Haut- und Schleimhautpflege, die Mund- und Zahnhygiene, die Warnung vor hautreizenden Mitteln sowie das Verhalten bei Hautulzerationen ist am besten durch die Vermittlung geeigneter Aufklärungsliteratur oder den Verweis der Patienten an Selbsthilfegruppen zu erreichen. z Literatur 1. Akesson A, Scheja A, Lundin A, Wollheim FA (1994) Improved pulmonary function in systemic sclerosis after treatment with cyclophosphamide. Arthritis Rheum 37:729 2. Albrecht HP, Hiller D, Hornstein OP, Buhler-Singer S, Muck M, Gruschwitz M (1993) Microcirculatory functions in systemic sclerosis: additional parameters for therapeutic concepts? J Invest Dermatol 1001:211–215 3. Badesch DB, Tapson VF, McGoon MD, Brundage BH, Rubin LJ, Wi FM, Rich S, Barst RJ, Barrett PS, Kral KM, Jobsis MM, Loyd JE, Murali S, Frost A, Girgis R, Bourge RC, Ralph DD, Elliott CG, Hill M, Langleben D, Schilz RJ, McLaughlin VV, Robbins IM, Groves BM, Shapiro S, Medsger TA Jr (2000) Continuous intravenous epoprostenol for pulmonary hypertension due to scleroderma spectrum of disease. A randomized, controlled trial. Ann Intern Med 132:425–434 4. Bartolone S, Trifiletti A, De Nuzzo G, Scamardi R, Larosa D, Sottilotta G, Raffa A, Barbera N (1999) Efficacy evaluation of prostaglandin E1 against placebo in patients with progressive systemic sclerosis and significant Raynaud’s phenomenon. Minerva Cardioangiol 47:137–143 5. Binks M, Passweg JR, Furst D, McSweeney P, Sullivan K, Besenthal C, Finke J, Peter HH, van Laar J, Breedveld FC, Fibbe WE, Farge D, Gluckman E, Locatelli F, Martini A, van den Hoogen F, van de Putte L, Schattenberg AV, Arnold R, Bacon PA, Emery P, Espigado I, Hertenstein B, Hiepe F, Kashyap A, Kotter I, Marmont A, Martinez Pascula MJ, Gratwohl A, Prentice HG, Black C, Tyndall A (2001) Phase I/II trial of autologous stem cell transplantation in systemic sclerosis: procedure related mortality and on skin disease. Ann Rheum Dis 60:577–584 6. Black CM, Denton CP (1995) The management of systemic sclerosis. Br J Rheumatol 34:3–7 7. Channik RN, Simmoneau G, Sitbon O, Robbins IM, Frost A, Tapson VF, Badesch DB, Roux S, Rainiso M, Bodin F, Rubin LJ (2001) Effects of the dual endothelinreceptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. Lancet 358:1119–1123 8. Clements PJ, Furst DE, Wong WK, Mayes M, White B, Wigley F, Weisman MH, Barr W, Moreland LW, Medsger TA Jr, Steen V, Ma RW, Collier D, Weinstein A, 379 380 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. Lally E, Varga J, Weiner S, Andrews B, Abeles M, Seibold JR (1999) High-dose versus low-dose D-penicillamine in early diffuse systemic sclerosis: analysis of a two year, double-blind, randomized, controlled clinical trial. Arthritis Rheum 42:1194–1203 Clements PJ, Lachenbruch PA, Sterz M, Danovitch G, Hawkins R, Ippoliti A, Paulus HE (1993) Cyclosporine in systemic sclerosis. Results of a forty-eight-week open safety study in ten patients. Arthritis Rheum 36:75–83 Cribier B, Faradji T, Le Coz C, Oberling F, Grosshans E (1995) Extracorporal photochemotherapy in systemic sclerosis and severe morphea. Dermatology 191:25–31 Descamps V, Duval X, Crickx B, Bouscarat F, Coffin B, Belaich S (1999) Global improvement of systemic scleroderma under long-term administration of octreotide. Eur J Dermatol 9:446–448 Di Spaltro FX, Cotrill C, Cahill C, Degnan E, Mulford GJ, Scarborough D, Franks AJ Jr, Klainer ASS, Biasaccia E (1993) Extracorporeal photochemotherapy in progressive systemic sclerosis. Int J Dermatol 32:417–421 Dziadzio M, Denton CP, Smith R, Howell K, Blann A, Bowers E, Black CM (1999) Losartan therapy for Raynaud’s phenomenon and scleroderma: clinical and biochemical findings in a fifteen week randomized, parallel-group, controlled trial. Arthritis Rheum 42:2646–2655 Enomoto DN, Mekkes JR, Bossuyt PM, Yong SL, Out TA, Hoekzema de Rie MA, Schellekens PT, ten Berge IJ, de Borgie CA, Bos JD (1999) Treatment of patients with systemic sclerosis with extracorporeal photochemotherapy (photopheresis). J Am Acad Dermatol 41:915–922 Farge D, Marolleau JP, Zohar S, Marjanovic Z, Cabane J, Mounier N, Hachulla E, Phillipe P, Sibilia J, Rabian C, Chevret S, Gluckman E, Intensification of Autogreffe dans les Maladies Auto Immunes Resistantes (ISAMAIR) Study Group (2002) Autologous bone marrow transplantation in the treatment of refractory systemic sclerosis: early results from a French multicentre phase I–II study. Br J Haematol 119:726–739 Furst DE, Clements PJ (2001) D-penicillamine is not an effective treatment in systemic sclerosis. Scand J Rheumatol 30:189–191 Genth E (2001) Evidenz-basierte Therapie der systemischen Sklerose. Z Rheumatol 60:464–468 Giacomelli R, Valentini G, Salsano F, Cipriani P, Sambo P, Conforti ML, Fulminis A, De Luca A, Farina G, Candela M, Generini S, De Francisci A, Tirri E, Proietti M, Bombardieri S, Gabrielli A, Tonietti G, Cerinic MM (2002) Cyclophosphamide pulse regimen in the treatment of alveolitis in systemic sclerosis. J Rheumatol 29:731–736 Grassegger A, Schuler G, Hessenberger G, Walder-Hantich B, Jabkowski J, MacHeiner W, Salmhofer W, Zahel B, Pinter G, Herold M, Klein G, Fritsch PO (1998) Interferon-gamma in the treatment of systemic sclerosis: a randomized controlled multicentre trial. Br J Dermatol 139:639–648 Griffiths B, Miles S, Moss H, Robertson R, Veale D, Emery P (2002) Systemic sclerosis and intestitial lung disease: a pilot study using intravenous methylprednisolone and cyclophosphamide to assess the effect on high resolution computed tomography and lung function. J Rheumatol 29:2371–2378 Jansen GT, Barraza DF, Steen VD (1968) Generalized scleroderma: treatment with a immunosupressive agent. Arch Dermatol 97:690–698 Jimenez SA, Sigal SH (1991) A 15-year prospective study of treatment of rapidly progressive systemic sclerosis with D-penicillamine. J Rheumatol 18:1496–1503 5.5.12 Systemische Sklerose z 23. Lecomte T, Cavicchi M, Delchier JC (2000) Small bowel pseudo-obstruction revealing in early scleroderma. Long-term efficacy of octreotide and erythromycin. Gastroenterol Clin Biol 24:361–363 24. McSweeney PA, Nash RA, Sullivan KM, Storek J, Crofford LJ, Dansey R, Mayes MD, McDonagh KT, Nelson JL, Gooley TA, Holmberg LA, Chen CS, Wener MH, Ryan K, Sunderhaus J, Russell K, Rambharose J, Storb R, Furst DE (2002) Highdose immunosuppressive therapy for severe systemic sclerosis: initial outcomes. Blood 100:1602–1610 25. Medsger TA Jr, Lucas M, Wildy KS, Baker C (2001) D-penicillamine in systemic sclerosis? Yes! Scand J Rheumatol 30:192–194 26. Pakas I, Ioannidis JP, Malagari K, Skopouli FN, Moutsopoulos HM, Vlachoyiannopoulos PG (2002) Cyclophosphamide with low or high dose prednisolone for systemic sclerosis lung disease. J Rheumatol 29:298–304 27. Parameswaran K, Purcell I, Farrer M, Holland C, Taylor IK, Keaney MP (1999) Acute effects of nebulised epoprostenol in pulmonary hypertension due to systemic sclerosis. Respir Med 93:75–78 28. Pope J, Fenlon D, Thompson A, Shea B, Furst D, Wells G, Silman A (2000) Iloprost and cisaprost for Raynaud’s phenomenon in progressive systemic sclerosis. Cochrane Database Syst Rev (2):CD000953 29. Pope J, Fenlon D, Thompson A, Shea B, Furst D, Wells G, Silman A (2000) Prazosin for Raynaud’s phenomenon in progressive systemic sclerosis. Cochrane Database Syst Rev (2):CD000956 30. Rook AH, Freundlich B, Jegasothy BV, Perze MI, Barr WG, Jimenez SA, Rietschel RL, Wintroub B, Kahaleh MB, Varga J (1992) Treatment of systemic sclerosis with extracorporeal photochemotherapy: results of a multicenter trial. Arch Dermatol 128:337–346 31. Rubin LJ, Badesch DB, Barst RJ, Galie N, Black CM, Keogh A, Pulido T, Frost A, Roux S, Leconte I, Landzberg M, Simonneau G (2002) Bosentan therapy for pulmonary hypertension. N Engl J Med 346:896–903 32. Russell ML, Schachter RK (1988) Cyclosporin treatment of scleroderma (PSS). Arthritis Rheum 31:S51 33. Schnabel A, Reuter M, Gross WL (1998) Intravenous pulse cyclophosphamide in the treatment of interstitial lung disease due to collagen vascular diseases. Arthritis Rheum 41:1215 34. Sharada B, Kumar A, Kakker R, Adya CM, Pande I, Uppal SS, Pande JN, Sunderam KR, Malaviya AN (1994) Intravenous dexamethasone pulse therapy in diffuse systemic sclerosis. A randomized placebo-controlled study. Rheumatol Int 14:91–94 35. Shor R, Halabe A (2002) New trends in the treatment of scleroderma renal crisis. Nephron 92:716–718 36. Seibold JR, Korn JH, Simms R, Clements PJ, Moreland LW, Mayes MD, Furst DE, Rothfield N, Steen V, Weisman M, Collier D, Wigley FM, Merkel PA, Csuka ME, Hsu V, Erikson M, Hannigan J, Harkonen WS, Sanders ME (2000) Recombinant human relaxin in the treatment of scleroderma. A randomized, placebo-controlled trial. Ann Intern Med 132:871–879 37. Silver RM, Warrick JH, Kinsella MB, Staudt LS, Baumann MH, Stange C (1993) Cyclophosphamide and low-dose prednisone therapy in patients with systemic sclerosis (scleroderma) with interstitial lung disease. J Rheumatol 20:838–844 38. Steen VD, Medsger TA Jr, Rodnan DP (1982) D-penicillamine therapy in progressive systemic sclerosis (scleroderma). An Intern Med 97:652–658 381 382 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 39. Steen VD, Lanz JK, Conte C, Owens GR, Medsger TA Jr (1998) Therapy for severe interstitial lung disease in systemic sclerosis. A retrospective study. Arthritis Rheum 37:1290–1296 40. Sturgill MG, Seibold JR (1998) Rational use of calcium-channel antagonists in Raynaud’s phenomenon. Curr Opin Rheumatol 10:584–588 41. Tyndall A, Koike T (2002) High-dose immunoablative therapy with hematopoietic stem cell support in the treatment of severe autoimmune disease: current status and future direction. Intern Med 41:608–612 42. Uhlemann C (1993) Physiotherapie der Kollagenosen mit besonderer Berücksichtigung der Sklerodermie. Z Hautkr 68:678–683 43. Van den Hoogen FH, Boerbooms AM, Swaak AJ, Rasker JJ, van Lier HJ, van de Putte LB (1996) Comparison of methotrexate with placebo in the treatment of systemic sclerosis: a 24 week randomized double-blind trial followed by a 24 week observational trial. Br J Rheumatol 35:364–372 44. Wigley FM, Wise RA, Seibold JR, McCloskey DA, Kujala G, Medsger TA Jr, Steen VD, Jimenez S, Mayes M (1994) Intravenous iloprost infusion in patients with Raynaud phenomenon secondary to systemic sclerosis: a multicenter, placebocontrolled, double-blind study. Ann Intern Med 120:19–206 45. Wollersheim H, Thein T, van’t Laar A (1987) Nifedipine in primary Raynaud’s phenomenon and in scleroderma: oral versus sublingual hemodynamic effects. J Clin Pharmacol 27:907–913 46. Zachariae H, Bjerring P, Heickendorff L, Moller B, Wallervik K, Angelo H (1993) Photopheresis in systemic sclerosis: clinical and serological studies using markers of collagen metabolism. Acta Derm Venereol (Stockh) 73:356–361 5.5.13 Poly- und Dermatomyositis z 5.5.13 Poly- und Dermatomyositis (ICD-Nr. M 33.0, M 33.1, M 33.2) z Grundsätzliche Bemerkungen zur Therapiestrategie Ziel der Therapie ist eine Remission der Erkrankung mit Abnahme der Muskelschwäche, Rückbildung der extramuskulären Symptome und Normalisierung der Kreatinkinase (CK) und die Verhinderung bleibender Schäden. Der Erfolg der Therapie ist abhängig von der Dauer bis zum Zeitpunkt des Therapiebeginns, von der klinischen Gruppe und vom Nachweis bestimmter Autoantikörper. Bei Patienten mit Antisynthethetase oder SRP-Antikörper wird nur teilweise eine Remission erreicht. Glukokortikoide sind die Therapie der ersten Wahl. Immunsuppressive oder immunmodulierende Medikamente sollen bei schwerem Verlauf und bei Patienten mit Antisynthetaseantikörpern frühzeitig eingesetzt werden und bei anhaltend hohem Glukokortikoidbedarf. Zur Kontrolle der Krankheitsaktivität und Schadenentwicklung werden die manuelle Prüfung der Muskelkraft verschiedener Muskelgruppen (Kraftgrade), die Messung skelettmuskeltypischer Enzyme im Serum (Kreatinkinase), die Ausprägung extramuskulärer Manifestationen und Funktionsskalen eingesetzt. Zur Unterscheidung von noch aktiver Muskelentzündung von muskulären Schäden können elektromyografische Untersuchungen hilfreich sein. z Medikamentöse Therapie Es besteht ein Mangel an randomisierten, kontrollierten Studien mit standardisierten Outcomes und Messinstrumenten [4]. Gegenwärtig können Therapieempfehlungen nur für die gesamte Gruppe der Polymyositis und Dermatomyositis gegeben werden. Folgendes Therapiekonzept ist gegenwärtig zu empfehlen: z Kortikosteroide. Sie sind im Schub der Erkrankung dringlich indiziert mit einer Initialdosis von Prednisolon 1 mg/kg KG (60–100 mg) mit langsamer Reduktion, nach 2–4 Wochen beginnend um ca. 10 mg pro Monat auf eine Erhaltungsdosis je nach klinischem Befund. In ausgesprochen schweren Fällen kann ein Kortikosteroidbolus von 1 g Methylprednisolon über 3 Tage gegeben werden. Der Therapieeffekt ist spätestens nach 3–4 Tagen zu erwarten. Auf die Entwicklung einer Glukokortikosteroidmyopathie ist zu achten. z Methotrexat. Es kann als steroidsparendes Medikament eingesetzt werden, wenn noch eine Prednisolondosis von über 10 mg/Tag nach 3 Monaten erforderlich ist. Die Dosierung beträgt 10–15 mg 1 ´ pro Woche. In schweren Fällen ist kurzfristig über 4–6 Wochen die maximale Gabe von 40 mg/Woche i.v. angezeigt. Ein Ansprechen ist spätestens nach 3–4 Monaten zu erwarten. Als Therapieerfolg kann der Grad der Steroideinsparung angesehen werden [9]. 383 384 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Ciclosporin. In Einzelbeobachtungen, besonders bei Patienten mit Overlapsyndrom, führt Ciclosporin zu einer Besserung des Befundes (Dosierung zu Beginn 3 mg/kg/Tag). Langsame Steigerungen sollten in kleinen Schritten unter sorgfältiger Kontrolle der Nierenretentionswerte und des Blutdruckes vorgenommen werden. Ein Therapieeffekt tritt nach etwa 6–8 Wochen ein [6, 7]. z Immunglobulintherapie. Die Gabe von Immunglobulinen als Intervalltherapie zeigt in größeren Kollektiven sowohl bei Poly- als auch Dermatomyositis einen positiven Effekt, der oft auch länger anhält. Die Dosierung ist je nach Studienprotokoll unterschiedlich (meist 1 g/kg KG 2(–5) Tage pro Monat), die Verträglichkeit gut. Ernsthafte Komplikationen sind selten. Daher ist die Therapie trotz der Kostenintensität insbesondere bei jungen Patienten über einen umschriebenen Zeitraum zu empfehlen [3, 5]. z Azathioprin. Es scheint insbesondere bei der Polymyositis effektiv zu sein, wobei auch hier das individuelle Ansprechen nicht vorhergesagt werden kann. Die Dosierung beträgt in der Regel 2 mg/kg/Tag. Der Wirkungseintritt ist nach 6–8 Wochen zu erwarten [7]. z Cyclophosphamid. Es liegen keine größeren Patientenstudien vor. Wahrscheinlich ist die Substanz bei einer Myopathie auf dem Boden einer Vaskulitis wirksam. Sofern diese Pathogenese gesichert ist, sollten die Therapieempfehlungen bei der Behandlung systemischer Vaskulitiden beachtet werden (s. Kap. 5.5.11 bis 5.5.14). Kombinationen von Azathioprin und Methotrexat können in refraktären Fällen wirksam sein. Einzelbeobachtungen oder kleine Untersuchungsserien mit positivem Ergebnis existieren für Leflunomid, Mycophenolatmofetil, Tacrolimus, Rapamycin, TNF-Inhibitoren (Infliximab, Etanercept) und Rituximab [4]. z Nichtmedikamentöse Therapie Kontinuierliche krankengymnastische Behandlung mit dosiertem isometrischem Muskeltraining und Atemgymnastik sowie physikalische Therapie sind erforderlich [4]. Gezieltes Muskelaufbautraining sollte erst nach Inaktivierung des Prozesses begonnen werden. z Verhaltenshinweise für den Patienten Die Erkrankung führt im aktiven Stadium zu einer spürbaren Leistungsminderung, die insbesondere durch Müdigkeit und rasch eintretende Erschöpfung auffällt. Die körperliche Aktivität sollte entsprechend dosiert erfolgen. Ein Austesten der Leistungsgrenze ist nicht sinnvoll. 5.5.13 Poly- und Dermatomyositis z z Literatur 1. Alexanderson H (2005) Exercise: an important component of treatment in the idiopathic inflammatory myopathies. Curr Rheumatol Rep 7:115-124 2. Baer AN (2006) Advances in the therapy of idiopathic inflammatory myopathies. Curr Opin Rheumatol 18:236-241 3. Cherin P, Herson S, Wechsler B, Piette JC, Godeau P (1991) Efficacy of intravenous gammaglobulin therapy in chronic refractory polymyositis and dermatomyositis. Am J Med 91:162–168 4. Choy EH, Hoogendijk JE, Lecky B, Winer JB (2005) Immunosuppressant and immunomodulatory treatment for dermatomyositis and polymyositis. Cochrane Database Syst Rev 20; CD003643 5. Dalakas MC, Illa I, Dambrosia JM, Soulidan SA, Stein DP, McCrosky S (1993) A controlled trial of high-dose intravenous immune globulin infusions as treatment for dermatomyositis. New Engl J Med 329:1993–2000 6. Gran JM, Herrero C, Urbano-Marquez A (1994) Cyclosporin A as first choice therapy for dermatomyositis. J Rheumato1 21:381–382 7. Keen RW, Gumpel JM (1993) Cyclosporin A in adult dermatomyositis. Brit J Rheumatol 32:439 8. Medsger TA, Oddis CV (1995) Classification and diagnostic criteria for polymyositis and dermatomyositis. J Rheumatol 22:581–585 9. Miller LC, Sisson BA, Tucker LB, Schaller JG (1992) Methotrexate treatment of recalcitrant childhood dermatomyositis. Arthr Rheum 35:1143–1149 385 386 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.14 Polymyalgia rheumatica und Riesenzellarteriitis (ICD-Nr. M 35.5) z Grundsätzliche Bemerkungen zur Therapiestrategie Bei klinisch unterschiedlich imponierendem Krankheitsbild treten beide Krankheiten assoziiert auf und sprechen auf die gleiche Therapiestrategie an. Neben der klinischen Besserung gelten die Blutkörperchensenkungsgeschwindigkeit und das CrP als sensitive Verlaufsparameter zur Beurteilung der Krankheitsaktivität und damit zur Therapiesteuerung. In der Regel sollte die Kortisontherapie zu einer dramatischen Besserung der Beschwerden innerhalb weniger Tage führen. Insbesondere bei der Polymyalgia rheumatica muss ein ausbleibender Behandlungserfolg die Diagnose anzweifeln lassen. z Medikamentöse Therapie Beide Erkrankungen werden durch Glukokortikoide therapiert. Für die Polymyalgia rheumatica werden initial 10 bis 20 mg Prednisolonäquivalent/Tag gegeben, die innerhalb weniger Tage auf 10 mg/Tag, später (in Abhängigkeit vom klinischen Bild etwa nach 3 bis 6 Monaten) auf eine Erhaltungsdosis von 5 bis 7,5 mg/Tag reduziert werden kann. Die Riesenzellarteriitis wird initial mit höheren Kortikoiddosen behandelt. Empfohlen werden 1 mg/kg Körpergewicht/Tag. Bei drohender Erblindung durch eine Beteiligung der Augenarterien sind Höchstdosen gerechtfertigt und die zusätzliche Gabe von 100 mg ASS. So werden mehrere Tage 250 bis 500 mg Prednisonäquivalent/Tag intravenös appliziert. Die Dosisabsenkung orientiert sich dann an der klinischen Situation, sollte aber generell vorsichtiger als bei der Polymyalgia rheumatica erfolgen. Die Behandlung sollte über 1 bis 2 Jahre aufrecht erhalten werden. Bei den meisten Patienten ist ein Auslassversuch mit vorsichtigem Ausschleichen der Therapie erfolgreich, ein Teil erhält auch bei chronischem Verlauf bei Bedarf eine entsprechende Langzeitbehandlung. Falls mit der alleinigen Steroidtherapie eine ausreichende Aktivitätskontrolle der Erkrankung nicht möglich ist, so kann in einzelnen Fällen die Kombination mit einem Basistherapeutikum versucht werden. Allerdings ist die Datenlage hierzu widersprüchlich. Wie einige Studien, insbesondere einen steroidsparenden Effekt von Methotrexat, zeigen, wird dies von anderen Autoren nicht bestätigt. Neuerdings wurde bei kleinen Fallzahlen sehr erfolgreich der TNF-a-Blocker Infliximab eingesetzt. Da sich gezeigt hat, dass die Patienten durch die Steroidtherapie ein mehrfach erhöhtes Risiko besitzen, Diabetes oder Osteoporose mit Hüft- oder Wirbelkörperkompressionsfrakturen zu bekommen, ist eine adäquate begleitende Osteoporoseprophylaxe bzw. -therapie notwendig. 5.5.14 Polymyalgia rheumatica und Riesenzellarteriitis z z Literatur 1. Cohen MD, Ginsburg WW (1990) Polymyalgia rheumatica. Rheum Dis Clin North Am 16:325–329 2. Gabriel SE, Sunku J, Salvarani C et al (1997) Adverse outcomes of antiinflammatory therapy among patients with polymyalgia rheumatica. Arthritis Rheum 40: 1873–1878 3. Hunder GG (1990) Giant cell aarteritis. Rheum Dis Clin North Am 16:399–409 4. Jover JA, Hernandez-Garcia C, Morado IC et al (2001) Combined treatment of giant-cell arteritis with methotrexate and prednisone. Ann Intern Med 134: 106–114 5. Kaiser H, Kley HK (1992) Cortisontherapie (9. Aufl). Urban & Schwarzenberg, München 6. Langford CA, Sneller MC (2003) Biologic therapies in the vasculitides. Curr Opin Rheumatol 15:3–10 7. Levine MS, Hellman DB (2002) Giant cell arteritis. Curr Opin Rheumatol 14:3–10 8. Richter C, Schnabel A (2000) Riesenzell-(Temporal-)Arteriitis (GCA) und Takayasu-Arteriitis (TA). In: Gross WL (Hrsg) Therapie der Immunvaskulitiden. UNIMED-Verlag, Bremen, S 64–65 9. Wollenhaupt J (2003) Gerontorheumatologie. Thieme, Stuttgart, S 22–30 387 388 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.15 Takayasu-Arteriitis (ICD-Nr. 177.6) z Grundsätzliche Bemerkungen zur Therapiestrategie Die Problematik der Therapie der Takayasu-Arteriitis liegt darin, dass die Aktivitätsbeurteilung unsicher ist. Eine aktive Erkrankung liegt selbst dann noch häufig vor, wenn keine systemischen Beschwerden bestehen, eine normale BKS gemessen und stabile angiographische Befunde erhoben werden. Zunehmende Bedeutung für Diagnose und Verlaufskontrolle gewinnen die Kernspintomografie, die 18-PDG-Positronentomographie und MRT-Angiografie. z Medikamentöse Therapie Mittel der Wahl für die medikamentöse Therapie der Takayasu-Arteriitis sind Glukokortikoide, die je nach Schwere der Erkrankung zunächst hochdosiert (1 mg Prednisolonäquivalent/kg Körpergewicht) eingesetzt und dann soweit als möglich reduziert werden sollten. Wenn die alleinige Steroidmedikation nicht ausreicht, ist eine zusätzliche Therapie mit zytostatischen Substanzen notwendig. Die tägliche Gabe von 50 bis 150 mg Cyclophosphamid ist effektiv und führt in ca. 2 Drittel der Fälle zur deutlichen Einsparung von Kortikoiden. Ausreichende Erfahrungen bestehen auch mit Methotrexat, das in einer wöchentlichen Dosis von 10 bis 25 mg verabreicht wird. Auch hier hat sich ein deutlich steroidsparender Effekt gezeigt. Es ist auch zur Remissionserhaltung nach erfolgreicher Cyclophosphamidtherapie geeignet. In einigen Fällen wurde für Mycophenolat Mofetil eine gute Wirkung beobachtet, aber auch andere Immunsuppressiva mögen im Einzelfall erfolgreich sein. Bei der adjuvanten nichtkausalen Therapie steht die Kontrolle der Hypertonie bei chirurgisch nicht korrigierbarem Hochdruck im Vordergrund. Hierbei werden Betablocker und ACE-Hemmer empfohlen. Die Langzeitkortikoideinnahme erfordert die Durchführung einer Osteoporoseprophylaxe, ggf. auch -therapie. z Nichtmedikamentöse Therapien Aufgrund des stenosierenden Charakters der Gefäßentzündung kommt gefäßchirurgischen Maßnahmen ein großer Stellenwert für die Therapie der Takayasu-Arteriitis zu. Ischämien bei Befall zervikaler, koronarer oder peripherer Gefäße bei unzureichender Kollateralisierung machen Bypassoperationen oder Dilatationen notwendig. Bei ausgeprägter Aortenwurzelerweiterung mit Regurgitation durch die Aortenklappe muss eine Aneurysmaresektion mit entsprechender Deckung durch ein Gefäßimplantat durchgeführt werden. Die zeitgerechte Indikationsstellung bei fehlendem oder nur leichtgradigem Aortenvitium kann sehr schwierig sein. 5.5.15 Takayasu-Arteriitis z Ca. 2 Drittel der Patienten weisen durch einen stenotischen Befall der Nierenarterien eine arterielle Hypertonie auf. Hier ist die perkutane Ballondilatation des betroffenen Arterienabschnittes ein in den meisten Fällen erfolgreiches Vorgehen, das allerdings innerhalb von 1 bis 2 Jahren in vielen Fällen zur Restenosierung führt. Langzeitergebnisse über Stentimplantationen liegen noch nicht vor. z Literatur 1. Daina E, Schieppati A, Remuzzi G (1999) Mycophenolate mofetil for the treatment of Takayasu arteritis: report of three cases. Ann Intern Med 130:422–426 2. Hoffmann GS, Leavitt RY, Kerr GS, Rottem M, Sneller MC, Fauci AS (1994) Treatment of glucocorticoid-resistant or relapsing Takayasu arteritis with methotrexate. Arthr Rheum 37:578–582 3. Kerr G, Hallahan C, Leavitt R, Fauci A, Hoffmenn G (1993) A study of 60 patients with Takayasús arteritis: presentation, treatment and long-term outcome. Arthr Rheum 36 (suppl):R5 4. Ohtecki H, Itoh T, Natsuaki M, Minato N, Ueno T, Suda H, Naito K, Norita H, Sakai H (1992) Aortic valve replacement for Takayasús arteritis. J. Thorac Cardiovasc Surg 104: 82–486 5. Richter C, Schnabel A (2000) Riesenzell-(Temporal-)Arteriitis (GCA) und Takayasu-Arteriitis (TA). In: Gross WL (Hrsg) Therapie der Immunvaskulitiden. UNIMED-Verlag, Bremen, S 65–66 6. Sharma S, Saxena A, Talwar KK, Kaul U, Mehta SN, Rajani M (1992) Renal artery stenosis caused by nonspecific arteritis (Takayasu disease): Results of treatment with percutaneous transluminal angioplasty. Am J Roentgenol 158:417–422 389 390 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.16 Polyarteriitis nodosa (ICD-Nr. M 30.0) z Grundsätzliche Bemerkungen zur Therapie Während die Klassifikationskriterien der Amerikanischen Gesellschaft für Rheumatologie (ACR) von 1990 noch keine Trennung zwischen der Polyarteriitis nodosa (PAN) und der mikroskopischen Polyangiitis (mPA) vornehmen [9], wird nach den Definitionen der Chapel Hill Consensus Conference (CHC) von 1992 [7] die PAN als Vaskulitis mittelgroßer Arterien definiert. Somit schließt die Aussparung kleinster Gefäße bei der PAN definitionsgemäß auch eine Glomerulonephritis oder auch Kapillaritis der Lunge aus. Damit wurde das Krankheitsbild der PAN wesentlich eingeengt und von der mPA mit Befall größerer und kleinster Gefäße, meist MPA-ANCA-assoziiert, abgetrennt. Die PAN ist dagegen nur in ca. 10% ANCA-assoziiert [7]. Diese Neudefinition der PAN bringt das Problem mit sich, dass die ganz überwiegende Mehrzahl der vorliegenden Therapiestudien für die PAN vor Erstellung der CHC-Definitionen durchgeführt wurde und diese somit auch die mPA, häufig sogar auch das Churg-Strauss-Syndrom subsummieren. Während schon lange eine Assoziation zur Hepatitis B (zwischen 30 und 50%) bekannt ist, beschränkte sich diese aber in der Vergangenheit ganz wesentlich auf den Nachweis des HBsAg. Inzwischen konnten die Erregernachweismethoden erheblich verbessert werden (z. B. PCR-Methode). Durch zunehmende Verbreitung der Hepatitis-B-Impfung wird dieser Anteil vermutlich heute unter 10% sein. Es häufen sich zudem Berichte auch über eine Assoziation zu Hepatitis C mit oder ohne Kryoglobuline (meist Typ II) [1, 8, 10]. Lange wurde von der systemischen Form der PAN die sog. Panarteriitis nodosa cutanea benigna chronica als „isolierte“ Hautmanifestation abgegrenzt. Da aber in den meisten Kasuistiken – größere Studien liegen nicht vor – neben Hautveränderungen rheumatische und neurologische Manifestationen, sogar Gangränbildungen im Bereich der Extremitäten beschrieben werden, müssen Zweifel an der Einheitlichkeit dieses Krankheitsbildes aufkommen. z Medikamentöse Therapie Hier muss man streng zwischen Hepatitis-B- oder -C-assoziierter PAN und nicht Hepatitis-assoziierter PAN trennen, da beide offenbar hinsichtlich ihrer Pathogenese und damit auch Therapie zwei völlig unterschiedliche Krankheitsbilder darstellen. Nicht viral assoziierte PAN Solange es für die PAN keine kontrollierten Therapiestudien gibt, die auf Grund der Seltenheit auch kaum durchführbar sind, orientiert sich das thera- 5.5.16 Polyarteriitis nodosa z peutische Vorgehen an dem der ANCA-assoziierten primären Vaskulitiden (s. Kap. 5.5.17). Entscheidend für das therapeutische Vorgehen sind auch hier Krankheitsausdehnung und -aktivität. Bei schweren Verläufen sollte man initial kombiniert mit Prednisolon (beginnend mit 1 mg/kg/Tag und nachfolgend allmählicher Dosisreduktion) und Cyclophosphamid (2 bis 4 mg/kg/Tag) behandeln [4]. Eine additive Plasmapherese bringt keine zusätzlichen Effekte [3]. Das anschließende Vorgehen zur Remissionserhaltung ist mit dem der ANCAassoziierten Vaskulitiden vergleichbar (s. Kap. 5.5.18). Virusassoziierte PAN Bei Nachweis einer Assoziation zwischen replikativer Hepatitis B und PAN werden Erfolge einer kombinierten Therapie von Plasmapherese und antiviraler Behandlung mit Vidarabin bei 5 von 8 Patienten beschrieben. Sie wurde in diesen Fällen entweder initial oder bei nicht ausreichendem Effekt einer kombinierten Therapie von Prednisolon und Cyclophosphamid [5] eingesetzt. In den letzten Jahren wird bei einer Hepatitis-B- oder -C-assoziierten PAN z.T. mit begleitender Kryoglobulinämie in erster Linie die Therapie mit Interferon Alpha 2a/2b in Kombination mit Ribavirin bzw. bei der Hepatitis-B-Infektion Lamivudine [2, 6, 8, 11, 12] durchgeführt. Ob in diesen Fällen eine zusätzliche Plasmapherese von Nutzen ist, muss offen bleiben [5]. Bei vital- oder organbedrohenden Verläufen ist initial zunächst eine immunsuppressive Therapie erforderlich (s. o.). z Verhaltenshinweise für den Patienten Hier gelten hinsichtlich Schulung, Krankheits- und Therapieüberwachung die gleichen Richtlinien wie bei den ANCA-assoziierten Vaskulitiden (s. Kap. 5.5.18). z In Erprobung befindliche Therapieformen Da es weder für die nicht viral noch für die Hepatitis-B- und -C-assoziierte PAN größere kontrollierte Therapiestudien an einer homogenen Patientengruppe gibt, müssen alle oben aufgeführten therapeutischen Maßnahmen als in Erprobung befindlich bezeichnet werden. Bei therapierefraktären Krankheitsverläufen kommen, vergleichbar mit den ANCA-assoziierten Vaskulitiden, additiv hochdosiert i. v. Immunglobuline bzw. monoklonale Antikörper (AntiCD4/Campath 1H) zum Einsatz. 391 392 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Obsolete Therapieformen Als obsolet muss bei der PAN heute das Nichtausschöpfen der modernen Virusdiagnostik gelten. Damit vergibt man eine der wenigen Chancen einer vermutlich kausalen Vaskulitisbehandlung. z Literatur 1. Carson CW, Conn DL, Czaja AJ, Wright TL, Brecher ME (1993) Frequency and significance of antibodies to hepatitis C virus in polyarteritis nodosa. J Rheumatol 20:304–309 2. Durand JM, Kaplanski G, Fefevre P et al (1992) Effect of Interferon alpha 2b on cryoglobulinemia related to hepatitis C virus infection. J Infect Dis 165:778–779 3. Guillevin L, Fain O, Lhote F, Jarrousse B, Le Thi Huong Du D, Bussel A, Leon A (1992) Lack of superiority of steroids plus plasma exchange to steroids alone in the treatment of polyarteritis nodosa and Churg-Strauss Syndrome. Arthritis Rheum 35:208–215 4. Guillevin L, Jarousse B, Lok C, Lhote F, Jais JP, Le Thi Huong Du D, Bussel A (1991) Longterm followup after treatment of polyarteritis nodosa and ChurgStrauss angiitis with comparison of steroids, plasma exchange and cyclophosphamide to steroids and plasma exchange. A prospective randomized trial of 71 patients. J Rheumatol 18:567–574 5. Guillevin L, Lhote F, Leon A, Fauvelle F, Vivitski L, Trepo C (1993) Treatment of polyarteritis nodosa related to hepatitis B virus with short term steroid therapy associated with antiviral agents and plasma exchanges. A prospective trial in 33 patients. J Rheumatol 20:289–298 6. Guillevin L, Lhote F, Cohen P et al (1995) Polyarteritis nodosa related to hepatitis B virus. A prospective study with long-term observation of 41 patients. Medicine (Baltimore) 74:238–253 7. Jenette JC, Falk RJ, Andrassy K, Bacon A, Churg J, Gross WL, Hagen EC, Hoffman GS, Hunder GG, Kallenberg CGM, McCluskey RT, Sinicio RA, Rees AJ, van Es LA, Waldherr R, Wiik A (1994) Nomenclature of systemic vasculitides: the proposal of an international consensus conference. Arthr Rheum 37:187–192 8. Lamprecht P, Gause A, Gross WL (1999) Cryoglobulinemic vasculitis. Arthritis Rheum 42:2507–2516 9. Lightfood RW, Michel BA, Bloch DA, Hunder GG, Zwaifler NJ, McShane DJ, Arend WP, Calabrese LH, Leavitt RY, Lie JT, Masi AT, Mills JA, Stevens MB, Wallace SL (1990) The American College of Rheumatology 1990 criteria for the classification of polyarteritis nodosa. Arthr Rheum 33:1088–1093 10. Quint L, Deny P, Guillevin L, Granger B, Jarrousse B, Lhote F, Scavizzi M (1991) Hepatitis C virus in patients with polyarteritis nodosa. Prevalence in 38 patients. Clin Exp Rheumatol 9:253–257 11. Reichard O, Norkrans G, Fryden A, Braconier J-H, Sönnerborg A, Weiland O (1998) Randomised, double-blind, placebo-controlled trial of interferon a-2b with and without ribavirin for chronic hepatitis C. Lancet 351:83–87 12. Trepo C, Guillevin L (2001) Polyarteriitis nodosa and extrahepatic manifestations of HBV infection: The case against autoimmune intervention in pathogenesis. J Autoimmunol 16:269–274 5.5.17 Morbus Kawasaki z 5.5.17 Morbus Kawasaki (ICD-Nr. M 30.3) z Grundsätzliche Bemerkungen zur Therapiestrategie Beim Morbus Kawasaki handelt es sich um eine akute, fieberhafte, zeitlich begrenzte systemische Vaskulitis bei Kleinkindern mit nach wie vor ungeklärter Ätiopathogenese (s. Kap. 3.17). Bis zu 25% der unbehandelten Kinder können im Rahmen einer Koronararterienvaskulitis Aneurysmen, Thromben und Stenosen, Rhythmusstörungen, Myokardinsuffizienz und sogar einen Myokardinfarkt entwickeln [1, 2]. Dringendes Therapieziel ist deshalb, durch Frühdiagnose und Frühtherapie bleibende Vaskulitisschäden zu verhindern, was in über 95% auch gelingt, wenn innerhalb der ersten 10 Erkrankungstage Gammaglobuline intravenös verabreicht werden [3–6]. In der Praxis kann die rechtzeitige Diagnosestellung vor allem dann ein Problem darstellen, wenn es sich vom klinischen Bild her um „inkomplette“ Fälle handelt [7]. In Anbetracht der schwerwiegenden Konsequenzen sollte im Zweifel auch bei Verdacht behandelt werden. Verwendet man allerdings moderne Untersuchungstechniken einschließlich neuerer Echokardiografiegeräte mit an die Körpergröße adjustierten Messungen, so finden sich höhere Inzidenzen für Koronararterienerweiterungen als bisher angenommen sowie auch Hinweise auf chronische Alterierungen der Endothelzellfunktion. Deshalb werden gegenwärtig zusätzliche Therapiestrategien, insbesondere der zusätzliche Einsatz hochdosierte Glukokortikoide, untersucht [3]. Glukokortikoide werden auch bei gegenüber Immunglobulinen therapieresistenten Fällen zunehmend eingesetzt [6, 8, 9]. Befürchtungen, Glukokortikoide könnten das Risiko für die Entwicklung von Koronararterienschädigungen erhöhen [10], wurden zwischenzeitlich von anderen Untersuchern nicht bestätigt. Die Therapie wird ergänzt durch Azetylsalizylsäure sowie je nach klinischen Erfordernissen durch Antiarrhythmika, Digitalis, Diuretika und nichtmedikamentöse Maßnahmen bis hin zur Bypassoperation. Eine frühzeitige stationäre Einweisung ist unbedingt anzustreben, da nur so die notwendige Diagnostik, ggf. mit Lumbalpunktion, eine kontinuierliche Überwachung und die erforderliche intensive Behandlung gewährleistet sind. z Medikamentöse Therapie Intravenös verabreichte Gammaglobuline (IVGG) stellen nach wie vor die Therapie der Wahl dar [3–5, 11–15]. Die Gabe von 2 g/kg Körpergewicht an einem Tag in ca. 10 Stunden scheint dabei der Verabfolgung von 400 mg/kg Körpergewicht an 4 oder 5 aufeinander folgenden Tagen leicht überlegen zu sein [11, 13]. Bei Kindern mit trotz IVGG-Gabe weiter persistierendem Fieber kann eine erneute Gammaglobulingabe den Verlauf verbessern [14, 16]. Die IVGG sollen auf jeden Fall innerhalb der ersten 10 Tage gegeben werden; danach ist die Wirkung unsicher [4, 12, 13]. Kinder, die bereits Koronararterienaneurysmen 393 394 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern entwickelt haben, können von Immunglobulinen noch profitieren [17]. Die Frage, ob unterschiedliche Immunglobulinpräparate unterschiedlich erfolgreich sind, wurde bislang nicht untersucht [4, 12]. Jedoch sollten saccharosehaltige Präparate wegen möglicher unerwünschter Wirkungen auf die Nieren mit Vorsicht verwendet werden [18]. Die 1994 nach Behandlung mit einem Immunglobulinpräparat beobachteten Hepatitis-C-Fälle hatten eine Verunsicherung ausgelöst [19, 20]. Nach Erweiterung des Reinigungsprozesses um einen weiteren Reinigungsschritt wurden neue Hepatitis-C-Fälle nicht mehr berichtet. Wenn die empfohlene Infusionsgeschwindigkeit (s. o.) eingehalten wird und das Präparat vor Infusionsbeginn auf Körperwärme angewärmt wird, werden reversible unerwünschte Wirkungen wie Fieber, Schüttelfrost, Kopfschmerzen oder Hautausschlag eher selten gesehen. Bis zur Entfieberung wird zusätzlich eine Behandlung mit Azetylsalizylsäure (ASS) in einer Dosierung von 40 bis 50 mg/kg Körpergewicht/Tag aufgeteilt in 4 Dosen empfohlen, danach noch für mindestens 6 Wochen zur Thromboseprophylaxe 3 bis 5 mg/kg Körpergewicht/Tag [21]. Bei Vorliegen von großen Aneurysmen (³ 8 mm Æ) muss eine gleichzeitige Behandlung mit Antikoagulantien erwogen werden [22]. Ungeachtet der guten Effekte der ASS auf das akute Krankheitsgeschehen ist bislang noch offen, ob ASS die Prävalenz der Koronararterienschäden und deren Folgen senken kann. CAVE: Intoxikation infolge einer durch Hypalbuminämie verminderten Proteinbindung der ASS [23]. Eine Kombination der Immunglobulintherapie mit dem Vasodilatator Pentoxifyllin kann hilfreich sein [24]. In Fällen, die auf die oben beschriebene Therapie nicht ansprechen, wird die IVGG-Gabe wiederholt. Zusätzlich kommen dann hochdosierte Glukokortikoide, evtl. auch Immunsuppressiva/Zytostatika in Frage [5, 6, 8, 9]. z Nichtmedikamentöse Therapien Bei ungünstigen Verläufen können in Einzelfällen invasive bzw. chirurgische Eingriffe wie Koronararteriendilatation, Bypassoperation, ausnahmsweise auch eine Herztransplantation erforderlich werden [15, 25]. z Verlaufskontrollen Für die rechtzeitige Adaptation der therapeutischen Maßnahmen an die aktuelle klinische Situation und für die Beurteilung der Prognose sind regelmäßige klinische, Labor- und vor allem echokardiografische Kontrollen wichtig, die bei unkomplizierten Verläufen etwa über 8 Wochen, ansonsten entsprechend den klinischen Erfordernissen durchzuführen sind [12]. 5.5.17 Morbus Kawasaki z z Literatur 1. Burns JC (2001) Kawasaki disease. Adv Pediatr 48:157–177 2. Nakamura Y, Fujita Y, Nagai M, Yanagawa H, Imada Y, Okawa S, Kawasaki T, Kato H (1991) Cardiac sequelae of Kawasaki disease in Japan: statistical analysis. Pediatrics 88:1144–1147 3. American Academy of Pediatrics (1988) Intravenous gamma-globulin use in children with Kawasaki disease. Pediatrics 82:122–123 4. Rowley AH, Shulman ST (1991) Current therapy for acute Kawasaki syndrome. J Pediatr 118:987–991 5. Sundel RP (2002) Update on the treatment of Kawasaki disease in childhood. Curr Rheumatol Rep 4:474–482 6. Wallace CA, French JW, Kahn SJ, Sherry DD (2000) Initial intravenous gammaglobulin treatment failure in Kawasaki disease. Pediatrics 105:E78 7. Fukushige J (1994) Incidence and clinical features of incomplete Kawasaki disease. Acta Paediat 83:1057–1060 8. Shinohara M, Sone K, Tomomasa T, Morikawa A (1999) Corticosteroids in the treatment of the acute phase of Kawasaki disease. J Pediatr 135:465–469 9. Wright DA, Newburger JW, Baker A, Sundel RP (1996) Treatment of immune globulin-resistant Kawasaki disease with pulsed doses of corticosteroids. J Pediatr 128:146–149 10. Kato H, Koike S, Yokoyama T (1979) Kawasaki disease: effect of treatment on coronary artery involvement. Pediatrics 63:175–179 11. Durongpisitkul K, Gururaj VJ, Park JM, Martin CF (1995) The prevention of coronary artery aneurysm in Kawasaki disease: a meta-analysis on the efficacy of aspirin and immunoglobulin treatment. Pediatrics 96:1057–1061 12. Leung DYM (1993) Kawasaki disease. Curr Opin Rheumatol 5:41–50 13. Newburger JW, Takahashi M, Beiser AS, Burns JC, Bastian J, Chung KJ, Colan SD, Duffy CE, Fulton DR, Glode MP, Mason WH, Meissner C, Rowley AH, Shulman ST, Reddy V, Sundel RP, Wiggins JW, Colton T, Melish ME, Rosen F (1991) A single intravenous infusion of gamma globulin as compared with four infusions in the treatment of acute Kawasaki syndrome. N Engl J Med 324:1633–1639 14. Sundel RP, Burns JC, Baker A, Beiser AS, Newburger JW (1993) Gamma globulin re-treatment in Kawasaki disease. J Pediatr 123:657–659 15. Takahashi M (1997) Kawasaki disease. Curr Opin Pediatr 9:523–529 16. Dajanai AS, Taubert KA, Gerber MA, Shulman ST, Ferrierei P, Freed M, Takahashi M, Bierman FZ, Karchmer AW, Wilson W et al (1993) Diagnosis and therapy of Kawasaki disease in children. Circulation 87:1776–1780 17. Marasini M, Pongiglione G, Gazzolo D, Campelli A, Ribaldone D, Caponnetto S (1991) Late intravenous gamma globulin treatment in infants and children with Kawasaki disease and coronary artery abnormalities. Am J Cardiol 68:796–797 18. Ahsan N, Palmer BF, Wheeler D, Greenlee RG Jr, Toto RD (1994) Intravenous immunoglobulin-induced osmotic nephrosis. Arch Int Med 154:1985–1987 19. Bjoro K, Froland SS, Yun Z, Samdal HH, Haaland T (1994) Hepatitis C infection in patients with primary hypogammaglobulinemia after treatment with contaminated immune globulin. N Engl J Med 331:1607–1611 20. Bresee JS, Mast EE, Coleman PJ, Baron MJ, Schonberger LB, Alter MJ, Jonas MM, Yu MY, Renzi PM, Schneider LC (1996) Hepatitis C virus infection associated with administration of intravenous immune globulin. A cohort study. JAMA 276:1563–1567 21. Cremer H (2002) Kawasaki-Syndrom – ein Update. Akt Rheumatol 27:270 395 396 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 22. Petty RE, Cassidy JT (2001) Kawasaki disease. In: Cassidy JT, Petty RE (eds) Textbook of pediatric rheumatology. WB Saunders Company, Philadelphia, pp 580–594 23. Koren G, Silverman E, Sundel R, Edney P, Newburger JW, Klein J, Robieux I, Laxer R, Giesbrecht E, Burns JC (1991) Decreased protein binding of salicylates in Kawasaki disease. J Pediatr 118:456–459 24. Furukawa S, Matsubara T, Umezawa Y, Motohashi T, Ino T, Yabuta K (1994) Pentoxifylline and intravenous gamma globulin combination therapy for acute Kawasaki disease. Eur J Pediatr 153:663–667 25. Checcia PA, Pahl E, Shaddy RE, Shulman ST (1997) Cardiac transplantation for Kawasaki disease. Pediatrics 100:695–699 5.5.18 ANCA-assoziierte Vaskulitiden z 5.5.18 ANCA-assoziierte Vaskulitiden (ICD-Nr. M 31.3, 177.6) z Grundsätzliche Bemerkungen zur Therapiestrategie Nach wie vor ist das (empirische) sog. „FAUCI-Schema“ vom NIH bei schweren Verläufen ANCA-assoziierter Vaskulitiden der sog. „Goldstandard“ [7]. Durch Einführung dieses Therapieregimes hat sich die mittlere Überlebenszeit von 5 Monaten auf über 20 Jahre [19] erhöht. Anfang der 90er Jahre traten die Schattenseiten dieses Therapieprotokolles zu Tage mit einer alarmierend hohen therapiebedingten Morbidität und Mortalität [7]. Andererseits zeigte sich bei verlängertem Überleben, dass diese Krankheitsbilder in aller Regel chronisch-rezidivierend sind und nur selten Dauerheilungen möglich sind [7, 19]. Bei dem therapeutischen Vorgehen ist zudem der sehr variable Krankheitsverlauf innerhalb der einzelnen Vaskulitisentitäten zu berücksichtigen. Mit heute deutlich verbesserter Diagnostik werden häufiger auch blande und Abortivformen von Vaskulitiden erkannt. Dies hat zu dem Konzept der stadien- und aktivitätsadaptierten Therapie geführt [6]. Voraussetzung dafür ist ein Staging [19]. Als Vorbereitung für europaweite kontrollierte Studien wurden erstmals Assessmentinstrumente für Vaskulitiden erarbeitet. Zur Beurteilung der Krankheitsausdehnung wird der „Disease Extent Index“ (DEI) herangezogen, der die Anzahl der involvierten Organe mit therapierbarer Aktivität widerspiegelt, zu einem aktuellen Zeitpunkt sowie als kumulativer DEI über den gesamten Krankheitsverlauf mit Erfassung aller jemals betroffenen Organe [1]. Die Krankheitsaktivität wird mit dem „Birmingham Vasculitis Activity Score“ (BVAS) erfasst, der die Schwere der Aktivität in einzelnen Organen berücksichtigt [13]. Beide Indizes sind als komplementär anzusehen und deshalb kombiniert anzuwenden. Abzugrenzen sind nicht mehr rückbildungsfähige Schäden (z. B. terminale Niereninsuffizienz, residuelle Polyneuropathie), die in einem „Vasculitis Damage Index“ (VDI) erfasst werden [4]. Analog zur Onkologie werden in der Behandlung ANCA-assoziierter Vaskulitiden folgende Therapieziele verfolgt (s. Tabelle 1): z Remissionsinduktion, z Remissionserhaltung nach Erzielen einer Voll- oder stabilen Teilremission, z Notfalltherapie bei lebensbedrohlichen Verläufen oder drohendem Organversagen, z Behandlung refraktärer Verläufe. z Remissionsinduktion Bei der Initialphase der WG („localized“ WG) mit Begrenzung der Krankheitsaktivität ausschließlich auf den oberen und/oder unteren Respirationstrakt ohne Zeichen einer systemischen Vaskulitis bzw. Allgemeinsymptome kann Cotrimoxazol (2-mal 960 mg/Tag) unter entsprechend engmaschigen Kontrol- 397 398 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Tabelle 1. Stadien- und aktivitätsadaptierte Therapie der Wegener-Granulomatose und anderer ANCA-assoziierter Vaskulitiden (mod. n. [19]) Remissionsinduktion Remissionserhaltung Aktiv z Schwer generalisiert (organ-/lebensbedrohend) Modifiziertes „FAUCI-Schema“ * (oCYC 2–4 mg/kg/Tag ** + Uromitexan) z Refraktär Additiv TNFalpha-Blocker *** Additiv i.v. Immunglobuline (150 g/Monat) Interferon alpha (3–10 Mio./ Woche s.c.) # z Generalisiert (nicht organ-/lebensbedrohend) Nierenbeteiligung + CYC-Bolus i.v. 15–20 mg/kg + Uromitexan (alle 21 Tage) ** z Nierenbeteiligung – MTX 0,3 mg/kg/Woche i.v. ** (+ Folsäure dosisgleich am Folgetag) z Initialphase Cotrimoxazol 2-mal 960 mg/Tag oral Komplette/Partielle Remission z Residuelle Nierenfunktionseinschränkung Azathioprin 2 mg/kg/Tag oral Leflunomid 20–30 mg/Tag oral Mycophenolat mofetil 2 g/Tag oral z Keine Nierenfunktionseinschränkung MTX 0,3 mg/kg/Woche i.v. (+ Folsäure dosisgleich am Folgetag) Cotrimoxazol 2-mal 960 mg/Tag oral * 6–12 Monate; ** immer in Kombination mit Prednison, beginnend mit 1 mg/kg/Tag mit nachfolgender Reduktion in den Cushingschwellenbereich innerhalb der ersten 3–6 Monate, dann Reduktion um 1 mg/Monat bis zum vollständigen Absetzen; *** Infliximab: 5 mg/kg Körpergewicht alle 2–6 Wochen. Etanercept: 2-mal 25 mg/Woche s.c.; # Nur für Churg-Strauss-Syndrom len eingesetzt werden [16]. Auf den Übergang in eine Generalisationsphase auch nach jahrelanger Therapie mit Cotrimoxazol sei hingewiesen. Bei der schwer verlaufenden Generalisationsphase oder lokal destruierenden bzw. organbedrohenden ANCA-assoziierten Vaskulitiden gibt es momentan keine Alternative zum primären Einsatz des „FAUCI-Schemas“ (oCYC 2 mg/ kg/Tag + Prd 1 mg/kg/Tag mit nachfolgend allmählicher Dosisreduktion) als remissionsinduzierende Therapie [7, 19]. Im Gegensatz zum „Original-NIH-Protokoll“, welches die Dauer der CYC-Therapie für noch ein weiteres Jahr nach Erreichen einer Remission vorsieht, wird die orale CYC-Dauertherapie in 5.5.18 ANCA-assoziierte Vaskulitiden z Kenntnis schwerwiegender Spätkomplikationen heute deutlich kürzer durchgeführt [7, 19]. In aller Regel ist nach 6 bis spätestens 12 Monaten eine stabile Teil- oder auch Vollremission erreicht, die dann den Übergang auf eine weniger aggressive remissionserhaltende Therapie erlaubt. Die begleitende Prednisontherapie sollte in den ersten 3 bis 6 Monaten in die Nähe der Cushingschwellendosis gesenkt werden zur Vermeidung von infektiösen Komplikationen [7, 8, 19]. Die weniger toxische CYC-Bolustherapie (15 mg/kg alle 3 Wochen) scheint weniger effektiv zu sein als die orale CYC-Dauertherapie. Zum Vergleich der Effektivität der oralen CYC-Dauertherapie vs. CYC-Bolustherapie läuft derzeit im Rahmen der EU-Arbeitsgruppe EUVAS eine kontrollierte, prospektiv randomisierte Studie [3]. Bei primär nicht lebens- oder organbedrohenden Verläufen, insbesondere ohne Nierenbeteiligung, kann zur Remissionsinduktion „low-dose“-Methotrexat angewandt werden (0,3 mg/kg/Woche) [2, 12]. Das CSS galt lange in seinem Verlauf und therapeutischem Vorgehen als milder eingestufte Vaskulitis (Prednisonmonotherapie), auf Grund der meist fehlenden gravierenden Nierenbeteiligung. Hier hat sich die Therapie vorrangig an der Herzbeteiligung bzw. an der häufig sehr schweren Polyneuropathie zu orientieren. In diesen Fällen ist ein mit der WG oder MPA vergleichbares therapeutisches Procedere zu empfehlen [5, 6]. z Remissionserhaltende Therapie Bei den meisten Patienten ist nach 6- bis maximal 12-monatiger CYC-Therapie eine Voll- bzw. stabile Teilremission erzielt und der Übergang auf eine weniger toxische, remissionserhaltende Therapie möglich (s. Tabelle 4). Low-dose-Methotrexat hat sich bei normaler oder wiederhergestellter Nierenfunktion als gut verträgliche Therapie zur Remissionserhaltung erwiesen [11, 17]. Es sei jedoch auf die hohe Rate renaler Rezidive hingewiesen, z. T. im Sinne einer RPGN [17], die allerdings in einer Studie vom NIH nicht beobachtet wurde [11]. Dies ist besonders zu unterstreichen, da es bei Einschränkung der Nierenfunktion zu einem Anstieg der Nebenwirkungen des überwiegend renal eliminierten MTX kommt. Entsprechend engmaschige Kontrollen von Nierenfunktionsparametern und Urinsediment sind deshalb notwendig. Erste Ergebnisse einer kontrollierten Studie zum Einsatz von Azathioprin als Remissionserhaltung im Vergleich zur Fortsetzung der CYC-Therapie ab dem 3. bis 6. Behandlungsmonat haben keine Unterschiede in der Rezidivhäufigkeit über einen Beobachtungszeitraum von 18 Monaten ergeben (CYCAZAREM) [9]. Der Vorteil von Azathioprin ist der uneingeschränkte Einsatz bei Nierenfunktionseinschränkung, die Nachteile jedoch häufig eine Zytopenieneigung nach vorausgegangener CYC-Therapie und die lange Anlaufzeit bis zum Wirkeintritt. In diese therapeutische Lücke könnte Leflunomid springen. Leflunomid kann bei eingeschränkter Nierenfunktion eingesetzt werden, macht deutlich seltener Zytopenien als MTX oder Azathioprin und wirkt in aller Regel nach 4 bis spätestens 6 Wochen. Darüber hinaus wurden zur Remissionserhaltung MMF und Cotrimoxazol eingesetzt [15, 16]. 399 400 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Notfalltherapie und Behandlung therapierefraktärer Verläufe Bei Patienten mit foudroyantem Krankheitsverlauf, z. B. beim lebensbedrohlichen pulmorenalen Syndrom, können sowohl die CYC- als auch die Prednisontherapie intensiviert werden. Empfohlen werden dann sog. Megadosen von Prednison, z. B. initial an 3 aufeinander folgenden Tagen i. v. 1 g/Tag. Des Weiteren ist eine passagere Steigerung der CYC-Dosis auf 3 bis 4 mg/kg/Tag möglich. Diese aggressive Form der Immunsuppression ist nur über einen kurzen Zeitraum von wenigen Wochen zu empfehlen. Ob eine additive Plasmapherese einen zusätzlichen Nutzen in dieser Situation hat, ist ebenfalls Gegenstand einer noch laufenden kontrollierten Studie. z In Erprobung befindliche Therapieformen Bei Ineffektivität der Standardtherapie können zur laufenden Immunsuppression hochdosierte i. v. Immunglobuline additiv gegeben werden (400 mg/kg an 5 aufeinander folgenden Tagen, ggf. Wiederholung alle 4 Wochen). Zumindest bei einem Teil der Patienten kann ein Progressionsstop bzw. eine Teilremission erzielt werden [20]. Erste Erfahrungen gibt es mit additiv zur Standardtherapie eingesetzten TNF-alpha-Blockern und mit Rituximab (anti-CD20) bei refraktären Krankheitsverläufen der WG und CSS zur Remissionsinduktion. Beim refraktären Churg-Strauss-Syndrom konnte eine Behandlung mit Interferon alpha (3 bis 10 Mio. pro Woche s. c.) bei einigen Patienten Remissionen erzielen [5]. z Allgemeine Maßnahmen und Verhaltenshinweise für den Patienten Eine intensive Aufklärung von Patienten im Rahmen einer strukturierten Patientenschulung an einem ausgewiesenen Zentrum über die Natur der Krankheit, die verschiedenen therapeutischen Möglichkeiten und deren Nebenwirkungen ist Voraussetzung für ein ausgewogenes Verhältnis von Nutzen und Risiken [18]. Der betreuende Arzt außerhalb des Zentrums bedarf ebenfalls der genauen Aufklärung über die erforderlichen Kontrollen der eingeschlagenen Therapie. Dabei ist zu beachten, dass im ambulanten Bereich in aller Regel aus Unsicherheit im Umgang mit diesen Krankheitsbildern keinerlei Therapieänderungen vorgenommen werden, auch wenn diese empfohlen wurden. So werden z. B. nur selten die Empfehlungen zur schrittweisen Reduktion der Prednisontherapie im ambulanten Bereich umgesetzt [18]. Bei Entlassung aus dem stationären Bereich sollte deshalb die Prednisondosis nur in Ausnahmefällen mehr als 15 mg/Tag betragen. Bezüglich infektiöser Komplikationen (Cave: opportunistische Infekte, z. B. CMV-Reaktivierungen, Pneumocystis-carinii-Infektion) ist in erster Linie eine Assoziation zu Höhe und Dauer der begleitenden Prednisondosis festzustellen. Zur Prophylaxe einer PCP-Infektion hat sich die Gabe von Cotrimoxazol (3-mal pro Woche 960 mg/Tag) bewährt [11, 12], insbesondere bei der Gabe von höheren Predison-Dosen (> 15 mg/Tag). 5.5.18 ANCA-assoziierte Vaskulitiden z Die Patienten sollten bestimmte Verhaltensregeln einhalten (z. B. bei Infektionsgefahr) sowie hinsichtlich der Frühsymptome eines Rezidivs oder Therapiekomplikationen geschult werden (z. B. wöchentliche Urinstixuntersuchungen). Sämtliche Untersuchungsbefunde und Therapieüberwachungen (z. B. Leukozytenzahlen unter oCYC) sollten fortlaufend in einem Vaskulitispass dokumentiert werden. Die Blasentoxizität unter der täglichen CYC-Therapie kann neben einer reichlichen Flüssigkeitszufuhr durch den konsequenten Einsatz von Mesna in CYC-äquivalenter Dosis deutlich reduziert werden [18]. Die Teilnahme an einer entsprechenden Patientenschulung ist sinnvoll. z Obsolete Therapien Auf Grund des sehr variablen Verlaufes kann bei ANCA-assoziierten Vaskulitiden ein starres therapeutisches Vorgehen nicht mehr empfohlen werden. Die Behandlung erfolgt heute orientiert an Krankheitsaktivität und -ausdehnung. z Literatur 1. De Groot K, Gross WL, Herlyn K, Reinhold-Keller E (2001) Development and validation of a disease extent index for ANCA-associated vasculitides. Clin Nephrol 55:31–38 2. De Groot K, Mühler M, Reinhold-Keller E, Paulsen J, Gross WL (1998) Induction of remission in Wegener’s granulomatosis with low-dose methotrexate. J Rheumatol 25:492–495 3. De Groot K, Adu D, Savage CO (2001) The value of pulse cyclophosphamide in ANCA-associated vasculitis. Meta-analysis and critical review. Nephrol Dial Transplant 16(10):2018–2027 4. Exley AR, Bacon PA, Luqmani RA, Kitas GD, Banbury P, Gordon C, Savage COS, Adu D (1997) Development and initial validation of the Vasculitis Damage Index (VDI) for the standardized clinical assessment of damage in the systemic vasculitides. Arthritis Rheum 40:371–380 5. Gross WL (2002) Churg Strauss syndrome: update on recent developments. Curr Opin Rheumatol 14:11–14 6. Gross WL (1999) New concepts in treatment protocols for severe systemic vasculitis. Curr Opin Rheumatol 11:41–46 7. Hoffman GS, Kerr GS, Leavitt RY, Hallahan CW, Lebovics RS, Travis WD, Rottem M, Fauci AS (1992) Wegener’ granulomatosis: an analysis of 158 patients. Ann Intern Med 116:488–498 8. Guillevin L, Cordier JF, Lhote F, Cohen P, Jarrousse B, Royer I, Sesavre P, Jacquot C, Bindie P, Bielefeld P, Desson JF et al (1997) A prospective multicenter, randomized trial comparing steroids and pulses cyclophosphamide in the treatment of generalized Wegener’s granulomatosis. Arthritis Rheum 40:2187–2198 9. Jayne DRW, Gaskin D, for EUVAS (1999) Randomized trial of cyclophosphamide versus azathioprine during remission in ANCA-associated vasculitis (CYCAZAREM). J Am Soc Nephrol 10:105 A 401 402 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 10. Jayne DRW, Rasmussen N, for the European Community Systemic Vasculitis Clinical Trials Study Group (1997) Treatment of antineutrophil cytoplasm autoantibody-associated systemic vasculitis: initiatives of the European Community System Vasculitis Clinical Trials Study Group. Mayo Clin Proc 72:737–747 11. Langford CA, Talar-Williams C, Barron KS, Sneller MC (1999) A staged approach to the treatment of Wegener’s granulomatosis. Induction of remission with glucocorticoids and daily cyclophosphamide switching to methotrexate for remission maintenance. Arthritis Rheum 42:2666–2673 12. Langford CA, Talar-Williams C, Sneller MC (2000) Use of methotrexate and glucocorticoids in the treatment of Wegener’s granulomatosis. Long-term renal outcome in patients with glomerulonephritis. Arthritis Rheum 43:1836–1840 13. Luqmani RA (2002) Assessing disease activity in the systemic vasculitides. Curr Opin Rheumatol 14:23–28 14. Metzler C, Fink COE, Lamprecht P, Gross WL, Reinhold-Keller E (2001) Pilot Study of the Safety and Efficacy of Leflunomid (LEF) in Patients with Wegener’s Granulomatosis (WG) in Remission. Ann Rheum Dis 60(suppl 1):p 133 15. Nowack R, Göbel U, Klooker P, Hergesell O, Andrassy K, van der Woude FJ (1999) Mycophenolate mofetil for maintenance therapy of Wegeners granulomatosis and microscopic polyangiitis: a pilot study in 11 patients with renal involvement. J Am Soc Nephrol 10:1965–1971 16. Reinhold-Keller E, de Groot K, Rudert H, Nölle B, Heller M, Gross WL (1996) Response to trimethoprim/sulfamethoxazole in Wegener’s granulomatosis depends on the phase of disease. Q J Med 89:15–23 17. Reinhold-Keller E, Fink COE, Herlyn K, Gross WL, de Groot K (2002) High rate of renal relapses in 71 patients with Wegener’s granulomatosis under maintenance of remission with low-dose methotrexate. Arthritis Care Res (in press) 18. Reinhold-Keller E, Herlyn K (2001) Interdisziplinäre Betreuung von VaskulitisPatienten: Der Internist/Rheumatologe. Z Rheumatol 60:208–218 19. Reinhold-Keller E, Beuge N, Latza U, de Groot K, Rudert H, Nölle B, Heller M, Gross WL (2000) An interdisciplinary approach to the care of patients with Wegener’s granulomatosis. Arthritis Rheum 43:1021–1032 20. Richter C, Schnabel A, Csernok E, de Groot K, Reinhold-Keller E, Gross WL (1995) Treatment of anti-neutrophil cytoplasmic antibody (ANCA)-associated systemic vasculitis with high-dose intravenous immunoglobulin. Clin Exp Immunol 101:2–7 21. Tervaert CJW, Stegemann CA, Kallenberg CG (2001) Novel therapies for antineutrophil cytoplasmic antibody associated vasculitis. Curr Opin Nephrol Hypertens 2:211–217 5.5.19 Schönlein-Henoch Purpura z 5.5.19 Schönlein-Henoch Purpura (ICD-Nr. 177.9) z Grundsätzliche Bemerkungen zur Therapiestrategie Die Behandlung der Schönlein-Henoch Purpura ist wegen der guten Prognose in erster Linie supportiv und beinhaltet adäquate Hydratation sowie Kontrolle von Vitalzeichen. In seltenen Fällen kommt es zu einer chronischen Erkrankung, wobei prognostisch ungünstig schwere blutige Stühle, eine persistierende Purpura über mehrere Monate sowie die Nierenbeteiligung sind. In ca. 1% der Fälle entwickelt sich auch eine terminale Niereninsuffizienz. z Medikamentöse Therapie Kortikosteroide (0,5 mg/kg Körpergewicht) werden häufig bei schmerzhaften Ödemen und vor allem auch bei Kindern mit ausgeprägten Leibschmerzen eingesetzt, obwohl ein gesicherter Effekt nicht feststeht. Begleitende Arthralgien können mit nichtsteroidalen Antiphlogistika therapiert werden. Zurückhaltung ist allerdings bei gleichzeitig bestehender Nierenbeteiligung geboten. Die prophylaktische Gabe von Steroiden zur Vermeidung einer Nephropathie bei Kindern wird kontrovers diskutiert. Für die Behandlung der möglichen Begleitnephritis oder schweren hämorrhagischen Kolitis existieren ebenfalls keine gesicherten Therapieempfehlungen. Bei entsprechender Krankheitsschwere finden Induktions- und Remissionstherapieschemata analog den nekrotisierenden Vaskulitiden Anwendung. So wurden neben Glukokortikoiden auch Cyclophosphamid, Methotrexat, Ciclosporin und Azathioprin eingesetzt. Kontrollierte Studien existieren kaum, die mögliche Wirkung ist unklar, da diese Patientengruppe eine hohe Spontanheilungsrate aufweist. Erfolgreiche Fallberichte gibt es auch für Immunglobuline und Plasmapherese. z Literatur 1. Foster BJ, Bernard C, Drummond KN et al (2000) Effective therapy for severe Henoch-Schönlein purpura nephritis: a clinical and histolopathologic study. J Pediatr 136:370–375 2. Frank T, Saulsbury MD (2001) Henoch-Schönlein purpura. Curr Opin Rheumatol 13:35–40 3. Mollica F, Li Volti S, Garozzo R, Russo G (1992) Effectiveness of early prednisone treatment in preventing the development of nephropathy in anaphylactic purpura. Eur J Pediatr 151:140–144 4. Niaudet P, Habib R (1998) Methylprednisolone pulse therapy in the treatment of severe forms of Schönlein-Henoch purpura nephritis. Pediatr Nephrol 12:238–243 403 404 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5. Schulz H, Grabbe J, Trabandt A (2000) Henoch-Schönlein Purpura and leukozytoklastische Angiitis. In: Gross WL (Hrsg) Therapie der immunvaskulitiden. UNIMED-Verlag, Bremen, S 130–132 6. Szer IS (1994) Henoch-Schönlein purpura. Curr Opin Rheumatol 6:25–31 7. Szer IS (1999) Gastrointestinal and renal involvement in vasculitis: management strategies in Henoch-Schönlein purpura. Cleve Clin J Med 66:312–317 5.5.20 Kryoglobulinämische Vaskulitis z 5.5.20 Kryoglobulinämische Vaskulitis (ICD-Nr. 177.9) z Grundsätzliche Bemerkungen zur Therapiestrategie Die meisten Kryoglobulien treten im Rahmen einer primären Erkrankung (z. B. Myelom) auf oder sind mit chronischen, meist viralen Infekten assoziiert, während primäre gemischte Kryoglobulinämien seltener vorkommen. Es gilt heute als gesichert, dass ein Großteil der früher als essenzielle Kryoglobulinämie eingestuften Gefäßentzündungen mit dem Auftreten einer chronischen Hepatitis-C-Virus-Infektion assoziiert sind. Bei allen sekundären Formen der Erkrankung richtet sich die Therapie gegen die Grundkrankheit, während bei essenziellen Kryoglobulinämien die immunsuppressive Therapie im Vordergrund steht. z Medikamentöse Therapie Bei der primären Kryoglobulinämie richtet sich die Wahl des eingesetzten Medikaments nach dem klinischen Ausmaß der Erkrankung. In milden Fällen reichen symptomatische Maßnahmen aus, dagegen benötigen Patienten mit progressiver Nierenerkrankung oder Neuropathie eine aggressivere Therapie. Analog der Behandlung von nekrotisierenden Vaskulitiden kann die Durchführung einer Induktionstherapie mit Cyclophosphamidbolus oder die Dauertherapie plus hochdosierten Kortikoiden notwendig sein. Bei milderen Verläufen bzw. zur Remissionserhaltung nach Induktionstherapie eignen sich mittelpotente Immunsuppressiva. Hier liegen Erfahrungen insbesondere für Methotrexat und Azathioprin vor. Bei sekundären Kryoglobulinämien wird die Grundkrankheit behandelt. Die HCV-assoziierte kryoglobulinämische Vaskulitis wird erfolgreich mit Interferon a (1,5 bis 3 Mio. Einheiten subkutan 3-mal/Woche) in Kombination mit Ribavirin therapiert. Für eine evtl. notwendige Akuttherapie aller Kryoglobulinämieformen eignet sich die Plasmapherese. z Prophylaktische Maßnahmen und Verhaltenshinweise für den Patienten Patienten mit milder Purpura und Arthralgien bedürfen lediglich einer symptomatischen Behandlung. Hierbei sind vor allem Kälteschutzmaßnahmen sinnvoll. 405 406 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Literatur 1. Agnello V, Chung RT, Kaplan LM (1992) A role for hepatitis C virus infection in type II cryoglobulinemia. N Engl J Med 327:1490–1495 2. Cacoub P, Costedoat-Chalumeau N, Lidove O, Alric L (2002) Cryoglobulinemia vaskulitis. Curr Opin Rheumatol 14:29–35 3. Geltner D (1988) Therapeutic approaches in mixed cryoglobulinemia. Springer Seminar Immunopathol 10:103–113 4. Lamprecht P, Gause A (2000) Kryoglobulinämische Vaskulitis. In: Gross WL (Hrsg) Therapie der Immunvaskulitiden. UNI-MED-Science-Verlag Bremen, S 120–123 5. Langland DR, Dowkins RL, Matz LR, Cobain TJ, Goatcher P, Papadimitriou JM (1980) Arthritis associated with a crystallizing cryoprecipitable IgG paraprotein. Am J Med 68:461–470 6. Misiani R, Bellavista P (1996) Mixed cryoglobulinemia. A guide to drug treatment. Clin Immunother 5:115–121 5.5.21 Kutane leukozytoklastische Vaskulitis z 5.5.21 Kutane leukozytoklastische Vaskulitis (ICD-Nr. 177.9) z Grundsätzliche Bemerkungen zur Therapiestrategie Die kutane leukozytoklastische Vaskulitis ist definitionsgemäß auf die Haut beschränkt und tritt vornehmlich in Zusammenhang mit Infektionen oder anderen auslösenden Ereignissen wie Medikamenteneinnahmen auf. Eine Suche nach Grunderkrankungen wie Kollagenosen oder Neoplasmen bei anderweitig nicht erklärbarer kutaner leukozytoklastischer Vaskulitis ist sinnvoll. Die Therapie richtet sich dann gegen die Grunderkrankung. Wegen der sehr guten Prognose ist in der Regel keine massive immunsuppressive Therapie notwendig. Im Vordergrund stehen die Elimination möglicher auslösender Noxen, wie z. B. von Medikamenten oder die Therapie von bestehenden Infekten. z Medikamentöse Therapie In schweren Fällen ist die niedrig dosierte Gabe von Glukokortikoiden erfolgreich. In besonderen und hartnäckigen Fällen wurde für eine Reihe unterschiedlicher Substanzen, wie beispielsweise Colchicin, Dapsone, Pentoxifyllin etc., eine günstige Wirkung auf den Verlauf der kutanen Vaskulitis beschrieben. z Externe Therapie In Zusammenarbeit mit dem Dermatologen werden lokale Maßnahmen wie Kompressionen und Externabehandlungen durchgeführt. z Literatur 1. Hiltz RE, Cupps TR (1994) Cutaneous vasculitis. Curr Opin Rheumatol 6:20–24 2. Lotti T, Ghersetich I, Comacchi C, Jorizzo JL (1998) Cutaneous small-vessel vasculitis. J Am Acad Dermatol 39:667–687 3. Sais G, Vdaller A, Jucgala A, Gallardo F, Peyri J (1995) Colchicine in the treatment of cutaneous leukocytoclastic vasculitis. Results of a prospective, randomized controlled trial. Arch Dermatol 131:1399–1402 4. Schulz H, Grabbe J, Trabandt A (2000) Purpura und kutane leukozytoklastische Angiitis. In: Gross WL (Hrsg) Therapie der Immunvaskulitiden. UNI-MED-Verlag, Bremen, S 130–132 407 408 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.22 M. Behçet (ICD-Nr. M 35.2) z Grundsätzliche Bemerkungen zur Therapiestrategie Der M. Behçet (Behçet-Syndrom) verläuft häufig mono- bis oligosymptomatisch, eine spezifische Therapie steht bislang nicht zur Verfügung. Die Behandlung ist deshalb symptomorientiert und richtet sich nach dem jeweiligen Organbefall und der Ausprägung der Symptomatik, wobei eine Lokaltherapie zeitweilig durchaus im Vordergrund stehen kann. z Medikamentöse Therapie Immunsuppressiva, wie Azathioprin, Ciclosporin, Chlorambucil, Cyclophosphamid und Methotrexat [14], wurden bei schwerer Erkrankung, vor allem Vaskulitis und Augenbeteiligung, angewandt. Eine plazebokontrollierte Studie liegt jedoch nur für Azathioprin vor [13]. Bei systemischer Behandlung von Haut-/Schleimhautulzerationen und neurologischen Symptomen stehen Kortikosteroide im Vordergrund. Colchicin hatte in einer plazebokontrollierten Studie definitiv keinen Effekt auf Haut-/Schleimhautulzerationen, lediglich beim Erythema nodosum und Arthralgien schien es eine günstige Wirkung zu haben [1]. z Spezielle Therapie Augenbeteiligung Die unkomplizierte anteriore Uveitis kann lokal mit Kortikosteroiden und Mydriatika behandelt werden. Schwere Augenentzündungen und retinale Vaskulitis erfordern die systemische Gabe von Kortikosteroiden und/oder Azathioprin. In der einzigen plazebokontrollierten Studie war Azathioprin bei Behandlung der akuten Augenbeteiligung effektiv, insbesondere konnte jedoch die Rezidivrate gesenkt und der Einbezug des anderen Auges verhindert werden [13]. Ciclosporin (5 mg/kg/Tag) in Kombination mit Kortikosteroiden stellt eine Behandlungsalternative dar, es war einer Stoßtherapie mit Cyclophosphamid (1 g/Monat) überlegen [3, 4, 12]. Aufgrund nephrotoxischer Wirkungen und Auftreten eines Reboundeffektes ist nach Besserung die Weiterbehandlung mit niedrigerer Erhaltungsdosis zu empfehlen [5]. Die Wirksamkeit von Chlorambucil 0,1 bis 0,2 mg/kg/Tag wurde schon früher gezeigt [7], aufgrund der unerwünschten Wirkungen ist es jedoch als Reservemedikament einzustufen [10]. Cyclophosphamid wurde in verschiedenen Dosierungen angewendet (z. B. mit 200 mg/48 Stunden). Ob Cyclophosphamid mit anderen Dosierungsintervallen einen Vorteil bietet, ist offen, ein Reboundeffekt wurde unter 200 mg/ 48 Stunden jedoch nicht beobachtet [8]. 5.5.22 M. Behçet z Haut-/Schleimhautbeteiligung In leichteren Fällen von Ulzerationen an Haut und Schleimhaut ist eine Lokaltherapie mit Anästhetika und Kortikosteroiden ausreichend, ggf. können topische Antibiotika notwendig sein. Schwere Formen, insbesondere der Genitalulzera, rechtfertigen eine systemische Behandlung mit Kortikosteroiden (20 bis 50 mg Prednison) u./o. Azathioprin (2,5 mg/kg/Tag). Ciclosporin (5 mg/kg/Tag) bringt einen raschen Effekt bei der Abheilung von Haut-/Schleimhautulzera [9]. Beim Erythema nodosum ist eine Lokaltherapie mit Zinkleimverband möglich, hinsichtlich der systemischen Behandlung erwies sich Colchicin als effektiv [1]. Gelenkbeteiligung Die symptomatische Behandlung mit Kryotherapie und nichtsteroidalen Antirheumatika steht im Vordergrund, da es sich meist um einen nichterosiven, remittierend-rezidivierenden Verlauf handelt. Die Lokaltherapie mit Kortikosteroidinjektionen kann die Episoden bei selteneren Rezidiven abkürzen. Bei häufigeren Rezidiven oder anhaltender Arthritis kommt eine Synovialektomie in Betracht. Arthralgien sprechen auf Colchicin an. Gefäßbeteiligung Leichtere Fälle der Thrombophlebitis können lokal mit Antiphlogistika und Zinkleimverband behandelt werden. Bei tiefen Thrombosen wird eine Lysetherapie oder Antikoagulation nicht empfohlen, da die Thrombosen meist adhärent und embolische Komplikationen selten, während zerebrale oder pulmonale Blutungen auf dem Boden koinzidenter Vaskulitis häufig sind [14]. Eine Behandlung mit Azetylsalizylsäure ist hingegen zu empfehlen. Im Übrigen wird die Vaskulitis bei schwerem Verlauf wie andere systemische Vaskulitiden behandelt (s. Kap. 5.5.14 bis 5.5.20). Beteiligung des Nervensystems Kontrollierte Beobachtungen zur Therapie liegen nicht vor. Immunsuppressiva finden Anwendung unter Annahme der vaskulitischen Genese. Hirndrucksymptome sprechen am besten auf Kortikosteroide (1,5 mg/kg/Tag) an. Zerebrale Krampfanfälle werden konventionell antikonvulsiv behandelt. z In Erprobung befindliche Therapie Für die Behandlung mukokutaner Manifestationen und Arthritis liegen Berichte über die Effektivität von Interferon Alpha 2a/2b vor [2, 6, 15], wobei – abgesehen von der Arthritis – ein Reboundeffekt beobachtet wurde. Thalidomid zeigte einen günstigen Effekt auf die Haut- und Schleimhautulzerationen, es 409 410 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern spielt jedoch aufgrund der Teratogenität, mangelnder Verfügbarkeit und wirksamer Behandlungsalternativen eine untergeordnete Rolle im Therapiespektrum. Zur Behandlung mit TNF-a-Blockern liegen zwischenzeitlich ebenfalls Berichte vor, wobei die Einmalgabe von 5 mg/kg KG Infliximab einen raschen Effekt auf die Augenentzündung, neurologische Manifestationen sowie die Schleimhautulzerationen zeigte. z Literatur 1. Aktualga E, Altac M, Özyazgan Y, Pazarli H, Tüzün Y, Yalçin B, Yasici H, Yurdakal S (1980) A double blind study of colchicine in Behçet’s disease. Haematologica 65:339–402 2. Alpsoy E, Yilmaz E, Basaran E (1984) Interferon therapy for Behçet’s disease. J Am Acad Dermatol 31:617–619 3. Bayraktar S, Izgi B, Tugal Tukun I, Urgancioglu M (1993) Low dose cyclosporine A plus methyl-prednisolone versus colchicine, cyclophosphamide plus methylprednisolone therapy in ocular involvement of Behçet’s disease. Medical Bulletin of Istanbul Medical Faculty 43:76–83 4. Chavis PS, Antonios SR, Tabbara KF (1992) Cyclosporine effects on optic nerve and retinal Behçet’s disease. Arch Ophthalmol 80:133–142 5. Faulds D, Goa KL, Benfield P (1993) Cyclosporine. A review of its pharmacodynamic and pharmacokinetic properties, an therapeutic use in immunoregulatory disorders. Drugs 45:953–1040 6. Hamuryuda V, Moral F, Yurdakul S, Mat C, Tuzun Y, Özyazgan Y, Direskeneli H, Akoglu T, Yasici H (1994) Systemic interferon Alpha 2b treatment in Behçet’s syndrome. J Rheumatol 21:1098–1100 7. O’Duffy, JD, Robertson DM, Goldstein NP (1084) Chlorambucil in the treatment of uveitis and meningo-encephalitis of Behçet’s disease. Am J Med 76:75–84 8. Oniki S, Kurakazu K, Kawata K (1976) Immuno-suppressive treatment of Behçet’s disease with cyclophosphamide. Jap J Ophthalmol 20:32–40 9. Suess R, Al-Ayoubi M, Ruzicka T (1993) Cyclosporine in Behçet’s disease. J Am Dermatol 29:101–102 10. Tabbara K (1983) Chlorambucil in Behçet’s disease. A reappraisal. Ophthalmology 90:906–908 11. Towler HMA, Whiting PH, Forrester JV (1990) Combination low dose cyclosporine A and steroid therapy in chronic intraocular inflammation. Eye 4:514–520 12. Whitcup SM, Salvo EC, Nussenblatt RB (1994) Combined cyclosporine and corticosteroid therapy for sight-threatening uveitis in Behçet’s disease. Am J Ophthalmol 118:39–45 13. Yasici H, Pazarli H, Barnes CG, Tüzün Y, Özyazgan Y, Silman A, Serdaroglu S, Oguz V, Yurdakul S, Lovatt GE, Yazici B, Somani S, Müftüoglu A (1990) A controlled trial of azathioprine in Behçet’s syndrome. N Engl J Med 322:281–285 14. Yasici H, Barnes CG (1991) Practical treatment recommendations for pharmacotherapy of Behçet’s syndrome. Drugs 42:796–804 15. Zouboulis CC, Treudler R, Orfanos CE (1993) Morbus Adamantiades-Behçet. Therapeutischer Einsatz von systemischem rekombinantem Interferon alpha 2a. Hautarzt 44:440–445 5.5.23 Gicht z 5.5.23 Gicht (ICD-Nr. M 10) z Grundsätzliche Bemerkungen zur Therapiestrategie Das Behandlungsziel am akuten Gichtanfall besteht zunächst in der raschen Beendigung der Entzündungsvorgänge. Nach deren Abklingen muss konsequent versucht werden, die Hyperurikämie unter Kontrolle zu bringen und damit im Sinne einer Sekundärprophylaxe das Auftreten neuer Anfälle sowie weitere Komplikationen der Hyperurikämie zu verhindern. Dieses Ziel erreicht man mit einem nichtmedikamentösen Basistherapieprogramm, zu dem in aller Regel aber noch eine Pharmakotherapie hinzukommen muss. z Medikamentöse Therapie Behandlung des akuten Gichtanfalles Geeignet sind alle Antiphlogistika/nichtsteroidalen Antirheumatika (NSAR), das Colchicin sowie Kortikosteroide. Beachte: Grundsätzlich sollte die Behandlung des akuten Gichtanfalles so früh wie möglich und – gleich, welche Form der antiphlogistischen Therapie gewählt wird – in nicht zu niedrigen Dosen erfolgen. z Nichtsteroidale Antirheumatika sind die Mittel der ersten Wahl. Es sollten Präparate mit kurzer Halbwertszeit und schnellem Wirkungseintritt bevorzugt werden, also etwa Diclofenac oder Indometazin in Dosen von 25 bis 50 mg alle 4 bis 6 Stunden (Tagesmaximaldosen und Nierenfunktion beachten!). Diese Dosierung wird für die Dauer der Entzündungssymptomatik – in der Regel 2 bis 3 Tage – beibehalten und dann mit einer reduzierten Erhaltungsdosis von 25 bis 30 mg/Tag für bis zu 3 Monate fortgeführt. Alle anderen Präparate dieser Gruppe besitzen bei entsprechender Dosierung eine vergleichbare Wirkung. z Colchicin ist ein bei der Gicht weitgehend spezifisch wirksames Pflanzenalkaloid, welches den Vorteil besitzt, dass es bei akuten Arthritiden unklarer Ätiologie im Fall der Wirksamkeit diagnostische Bedeutung erlangen kann. Die Wirkung setzt aber meist später als die der NSAR ein, es besteht die Gefahr der Überdosierung. Üblicherweise wird anfangs 1 mg, danach in 2-stündlichen Intervallen 0,5 bis 1 mg Colchicin (Tagesmaximaldosis: 8 mg!) bis zum Eintreten der Wirkung oder von deutlichen Nebenwirkungen (Nausea, Erbrechen, Diarrhoe) verabreicht. Die Dosisreduzierung erfolgt entsprechend dem Rückgang der klinischen Symptome. z Kortikosteroide (z. B. in Form eines Prednisolonstoßes beginnend mit 30 bis 40 mg/Tag) sind nur in den seltenen Fällen indiziert, wenn die bisher 411 412 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern beschriebenen Maßnahmen nicht zum Erfolg geführt haben. Bei Befall größerer Gelenke ist die intraartikuläre Injektion mit Kortisonoidkristallsuspensionen (Triamcinolonacetonid, -hexacetonid) ein nahezu sicheres und relativ nebenwirkungsarmes Mittel, um den Anfall innerhalb von etwa 12 Stunden zu beenden. Anschließend sollten jedoch auch hier noch kleinere Erhaltungsdosen eines NSAR oder von Colchicin verabfolgt werden, um Rezidive zu verhüten. Sekundärprophylaxe (Kontrolle der Hyperurikämie) Dazu gelten folgende Regeln: z Nach Beendigung des akuten Gichtanfalles sollte unbedingt unmittelbar eine Behandlung der Hyperurikämie angeschlossen werden. z Dafür stehen die beiden Präparategruppen der Urikosurika (= Erhöhung der renalen Harnsäureausscheidung) und der Urikostatika (= Verminderung der Bildungsrate der Harnsäure) zur Verfügung. z Beide Substanzgruppen können ein Anfallsrezidiv induzieren. Sie sind daher einschleichend zu dosieren und in den ersten Monaten ihrer Anwendung mit antiphlogistisch wirksamen Präparaten in niedrigen Dosen (s. o.) zu kombinieren. z Die Therapie der Hyperurikämie ist in der Regel lebenslang fortzusetzen, das Ziel besteht in der dauerhaften Erzielung normaler Harnsäurewerte um 5,5 mg/dl; niedrigere Werte sprechen für eine Überdosierung und sollten vermieden werden. Für die Differenzialtherapie und die Dosierung sind folgende Punkte von Bedeutung: z Urikosurika sind in der Regel bei Patienten mit vermehrter Harnsäureproduktion und eingeschränkter Nierenfunktion nicht indiziert, da sie die Bildung von Harnsäuresteinen begünstigen. Als Präparate stehen zur Verfügung das Benzbromaron (Dosierung 25 bis 50 bis 100 mg/Tag) sowie – heute kaum noch gebräuchlich – Probenezid (initial 0,25, 0,5, später bis 3 g/Tag). z Als Urikostatikum ist Allopurinol das Mittel der Wahl. Es ist weitgehend unabhängig von der Pathogenese der Hyperurikämie und auch bei Patienten mit Nierensteinen und Einschränkung der Nierenfunktion anwendbar. In letzterem Fall und bei gleichzeitiger Behandlung mit Azathioprin muss eine Dosisreduktion erfolgen. Die Regeldosierung erfolgt anfangs mit 100 bis 200 mg/Tag, die notwendige Erhaltungsdosis richtet sich nach der Beeinflussung des Harnsäurespiegels (s. o.) und beträgt selten mehr als 200 bis 300 mg/Tag. Die Tagesdosis kann wegen der langen Halbwertszeit des Präparates auf einmal eingenommen werden. z Kombinationsbehandlungen (z. B. 100 mg/Tag Allopurinol und 20 mg/Tag Benzbromaron) werden häufig angewendet, da sie eine geringe Dosierung der Einzelpräparate gestatten. Sie besitzen dafür das Risiko der Nebenwirkungen jedes Einzelpräparates. Für ihre Anwendung besteht eine relative Indikation zu Therapiebeginn und bei tophösen Verlaufsformen. 5.5.23 Gicht z z Besondere therapeutische Situationen Therapie der Gichtniere und der Nephrolithiasis Neben der Verordnung von Allopurinol und der Gewährleistung einer ausreichenden Diurese (Trinkmenge von 2 bis 3 Litern täglich) sollte eine Alkalisierung des Urins durchgeführt werden. Sie erfolgt mit Eisenbergscher Lösung oder mit den Präparaten Uralyt-U® bzw. Blemaren ®. Die Wirksamkeit ist täglich vom Patienten mittels Indikatorpapier zu kontrollieren (erwünschtes Harn-pH zwischen 6,5 und 6,8). Symptomlose Hyperurikämie Eine medikamentöse Therapie ist in der Regel nicht erforderlich. Nur wenn unter Einhaltung aller diätetischen Verhaltensregeln der Harnsäurespiegel in hochpathologischen Bereichen bei > 9 mg/dl verharrt, kann eine urikostatische Behandlung in Erwägung gezogen werden. z Nichtmedikamentöse Therapie Wie bei jeder chronischen Erkrankung ist zur Sicherung der Mitarbeit des Patienten zunächst dessen Aufklärung erforderlich. Da in der Sprechstunde dafür meist nur eine begrenzte Zeit zur Verfügung steht, sollte dies ergänzend über Merkblätter oder Literaturempfehlung geschehen. Der Kranke muss informiert sein, wie er durch Beachtung der wichtigsten Diätvorschriften (s. u.), Reduktionskost bei Adipositas, Einschränkung des Alkoholkonsums, Kontrolle des Harn-pH und Einhaltung der notwendigen Trinkmenge, eine sinnvolle sportliche Betätigung, Stressbewältigung und Vermeidung hyperurikämisch wirksamer Medikamente die Pharmakotherapie unterstützen kann. Ihm ist zu raten, ein Antiphlogistikum immer mit sich zu führen, um es im Bedarfsfall sofort bei den ersten Anzeichen eines Anfalles einnehmen zu können. Diät Allgemein rückt man heute von zu strengen Diätvorschriften ab. Alkohol in kleinen Mengen kann gestattet werden, ein absolutes Verbot gilt nur für Alkoholarten, nach deren Genuss bei den betreffenden Patienten schon einmal Anfälle aufgetreten sind. Die Nahrungsmittel werden nach ihrem Puringehalt in 3 Gruppen eingeteilt: z Hoher Puringehalt, verboten: Fischrogen, Anchovis, Innereien wie Leber, Niere, Milz und Herz. z Mittlerer Puringehalt, begrenzt erlaubt: Fleisch und Fisch, außer den vorgenannten Arten, Hülsenfrüchte und Spargel. z Niedriger Puringehalt, unbegrenzt erlaubt: Eier, Milch, Getreideprodukte, Süßigkeiten, Gemüse mit den vorgenannten Ausnahmen, Früchte. 413 414 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Das „unbegrenzt erlaubt“ gilt selbstverständlich mit der Einschränkung des jeweiligen Energiebedarfs. Neben dem Puringehalt der Speisen sollte der Kranke auch auf fettarme Ernährung achten. Physikalische Behandlung Bettruhe ist auch im Anfall im Allgemeinen nicht erforderlich, die örtliche Anwendung von Kälte (seltener Wärme) kann zur Schmerzlinderung beitragen. Die Patienten sind zu einer ausreichenden körperlichen Aktivität anzuhalten, größere Anstrengungen sollten aber vermieden werden. Operative Therapie Störende Gichtknoten sind ohne große Schwierigkeiten operativ zu entfernen; durch Operationen können auch die seltenen Finger- und Zehendeformitäten korrigiert werden. z Literatur 1. Gresser U (2001) Gicht (M 10) In: Zeidler H, Zacher J, Hiepe F (Hrsg) Interdisziplinäre Rheumatologie. Springer, Berlin 2. Gröbner W, Walter-Sack I (1993) Gichttherapeutika – Physiologische Grundlagen, Klinik und Pharmakologie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 3. Rosenthal AK (1998) Crystal arthropathies. In: Maddison PJ, Isenberg DA, Woo P, Glass DN (eds) Oxford Textbook of Rheumatology. Oxford Univ Press, Oxford New York Tokyo 4. Zhang W, Doherty M, Bardin T, Pascual E, Barskova V et al (2006) EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee For International Clinical Studies Including Therapeutics (ESCISIT). Annals of the Rheumatic Diseases 65:1312–1324 5. Zöllner N (Hrsg) unter Mitarbeit von Gresser U (1990) Hyperurikämie, Gicht und andere Störungen des Purinhaushaltes, 2. Aufl. Springer, Berlin Heidelberg New York London Paris Tokyo Hongkong Barcelona 6. Zöllner N (1994) Klinik und Therapie der Gicht. Dtsch Ärztebl 91:A-2234–2245 5.5.24 Chondrokalzinose z 5.5.24 Chondrokalzinose (ICD-Nr. M 11.2) z Grundsätzliche Bemerkungen zur Therapiestrategie Eine verursachende Stoffwechselstörung ist nicht bekannt, daher gibt es keine Möglichkeit einer spezifischen Beeinflussung. Bei den hereditären und idiopathisch-sporadischen Formen zielt die Therapie generell auf eine schnelle Beendigung des Anfalles und eine rasche Mobilisation des Patienten. Ersteres kann mitunter schon durch Punktion des betroffenen Gelenkes und Entleerung des Ergusses erreicht werden. Bei den sekundären Formen ist zusätzlich soweit möglich eine Behandlung der Grundkrankheit (u. a. Hyperparathyreoidismus, Hämochromatose, Hypothyreose, Amyloidose, Gicht, Hypophosphatasie, Hypermagnesiämie) angezeigt. Im interkritischen Stadium, bei chronischen Verläufen gestaltet sich die Behandlung symptomatisch. Sichere Möglichkeiten einer Anfallsprophylaxe sind nicht bekannt. Medikamentöse Therapie z Im akuten Anfall besteht die wirksamste Behandlung in der intraartikulären Verabfolgung von Kortisonoidkristallpräparaten (z. B. Triamcinolonhexacetonid, Triamcinolonacetonid). Eine vorherige Gelenkspülung mit physiologischer Kochsalzlösung kann den Effekt der Lokalinjektion verlängern. z Eine zusätzliche oder alleinige Gabe von nichtsteroidalen Antirheumatika bzw. Analgetika ist wirksam, sollte aber wegen des meist hohen Alters der Patienten nur intermittierend und mit möglichst geringen Dosen durchgeführt werden. z Bei jüngeren Patienten wird eine orale Colchicingabe – im Anfall über 1 bis 2 Tage bis 5 mg/Tag, zur Anfallsprophylaxe 0,5 mg/Tag – empfohlen, obwohl ein therapeutischer Effekt nicht in gleicher Regelmäßigkeit wie bei der Gicht zu erwarten ist. z Nichtmedikamentöse Therapie Zusätzliche physiotherapeutische Maßnahmen, wie lokale Kryotherapie, sind geeignet, die Rückbildung der Symptome zu beschleunigen. Sie gehören in jedem Fall zum therapeutischen Repertoire. z Bei Patienten mit chronisch entzündlicher oder destruktiver Arthropathie, besonders der Knie- oder der Hüftgelenke, werden je nach Lokalbefund Synovialektomien oder Gelenkersatzoperationen erforderlich. In seltenen Fällen kann eine operative Behandlung auch bei Beteiligung der oberen Halswirbelsäule indiziert sein. 415 416 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Prophylaktische Maßnahmen und Verhaltenshinweise Gewichtsreduktion bei Adipositas, die Vermeidung von Überlastung der Gelenke durch frühzeitigen Gebrauch einer Stockstütze, ein Muskeltraining durch regelmäßige Krankengymnastik sind geeignet, den Allgemeinzustand zu verbessern. z In Erprobung befindliche bzw. in Einzelfällen wirksame Therapiemaßnahmen Dazu gehören u. a. z die Radiosynoviorthese, z eine orale Kortikoid-Behandlung bei schweren polyartikulären Attacken, z eine orale Magnesiumtherapie sowie z Probenecid. z Literatur 1. Doherty M (1998) Calciumpyrophosphate dihydrate. In: Klippel JH, Dieppe PA (eds) Rheumatology. 2nd edn. Mosby, London Philadelphia St. Louis Sydney Tokyo 2. Fam AG (2000) What is new about crystals other than monosodium urate? Curr Opin Rheumatol 12:228–234 5.5.25 Infektiöse Arthritiden z 5.5.25 Infektiöse Arthritiden (ICD-Nr. M 00.0 bis 00.9) z Grundsätzliche Bemerkungen zur Therapiestrategie Da bei septischen Arthritiden eine hohe Lebensgefahr besteht, ist ein entschlossenes und konsequentes Vorgehen bei Diagnostik und Therapie erforderlich. In den meisten Fällen ist eine operative Behandlung unumgänglich. Nur in wenigen Ausnahmen werden Beschwerden und klinisches Bild allein durch eine konservative Behandlung zurückgebildet. Die Therapiestrategie wird durch die Grundkrankheit und die Ausdehnung bzw. Lokalisation des septischen Prozesses wesentlich beeinflusst. Es sind zu unterscheiden z Pyarthrose eines oder mehrerer Gelenke ohne rheumatische Erkrankung, z. B. im Rahmen einer Sepsis, z Gelenkinfektion bei rheumatoider Arthritis. Führendes lokales Symptom kann beim Polyarthritiker allein der heftige Gelenkschmerz in Verbindung mit einer Verschlechterung des Allgemeinzustandes sein. Rötung und Gelenkschwellungen können infolge einer immunsuppressiven Therapie fehlen oder wenig ausgeprägt sein. Auch der Aussagewert der Entzündungsparameter ist dabei weniger eindeutig. Besonders problematisch sind die Fälle mit polyartikulärer Sepsis, die klinisch relativ wenig Symptomatik bieten. Differenzialdiagnostisch muss bei dem klinischen Bild einer hochakuten Arthritis auch an eine Kristallarthritis (Chondrokalzinose bzw. Gicht, s. Kap. 3.27 und 3.28) gedacht werden. Bei jedem klinischen Verdacht auf eine septische Arthritis ist neben der Bestimmung der Entzündungsparameter BSG, CrP, Leukozytenzahl, die sofortige Gelenkpunktion – vor Beginn einer antibiotischen Therapie! – aller auffälligen Gelenke unerlässlich. Dieses sollte optimalerweise dort durchgeführt werden, wo das Punktat einer sofortigen Synoviaanalyse einschließlich Gramfärbung zugeführt werden kann. Lässt sich dabei trotz sicherer intraartikulärer Lage der Nadel kein Punktat gewinnen, ist die Punktion mit einer großvolumigen Kanüle zu wiederholen (evtl. mit Kochsalzspülung), da das entzündliche Exsudat fibrinbedingt hochviskös sein kann. Anschließend müssen eine Synoviaanalyse (Leukozytenzahl, Gramfärbung, Suche nach Kristallen; s. Kap. 2.2) einschließlich der obligatorischen mikrobiologischen Untersuchung (Keimbestimmung, Resistogramm) erfolgen. Das Ziel aller Maßnahmen ist die Beherrschung des akuten Infektes innerhalb von 10 Tagen. z Medikamentöse Therapie Das Ergebnis der Synoviaanalyse bestimmt in erster Linie Art und Ausmaß der Therapie. 417 418 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Punktat ohne Kristallnachweis. Bei Leukozytenzahlen von 20 000–30 000 mm3 wird das betroffene Gelenk ruhig gestellt und gekühlt. Die antibiotische Therapie erfolgt intravenös – vorzugsweise mit einem Breitspektrumcephalosporin oder einer Kombinationstherapie – bis zum Vorliegen von Keimbestimmung und Resistogramm. Die Verlaufsbeurteilung wird anhand der täglichen Bestimmung von CRP, Leukozyten im Serum, BSG sowie der Leukozytenzahl im Gelenkpunktat vorgenommen. Steigen CrP und Leukozytenzahl weiter an oder fallen sie nicht innerhalb von 3 Tagen eindeutig ab, muss der konservative Behandlungsversuch abgebrochen werden. Zeigt bereits das Erstpunktat eine Leukozytenzahl über 35 000/mm3, empfiehlt sich zur Vermeidung einer hämatogenen Streuung eine sofortige operative Revision. z Punktat mit Kristallnachweis. Bei Kristallnachweis im Gelenkpunktat und gleichzeitig fehlendem Keimnachweis darf auch bei einer Leukozytenzahl über 35 000 mm3 weiter konservativ behandelt werden. z Operative Therapie Bei konservativ nicht schnell (d. h. innerhalb von 3 Tagen) beherrschbaren akuten Infektionen ist eine operative Therapie erforderlich. z Frühinfekt. Bei fehlender massiver synovialer oder ossärer Beteiligung ist eine ausgiebige arthroskopische Spülung, ggf. mit Teilsynovektomie, möglich. Lokale Antibiotikumanwendungen (Schwämme oder Ketten) sowie das Einlegen mehrerer Drainagen sind indiziert. Erneute arthroskopische Revisionen mit Spülung des Gelenkes können bei auffälligem Verlauf – fehlende Rückbildung der Entzündungsparameter und der lokalen Symptomatik – erforderlich werden. Nach höchstens 3 arthroskopisch kontrollierten Revisionen ist das offene Vorgehen in Erwägung zu ziehen. Arthroskopisch nicht therapierbare Gelenke werden nach konventioneller Gelenkeröffnung in gleicher Weise behandelt. z Spätinfekt. Bei eindeutig ossärer oder massiver synovialer Beteiligung ist primär das offene Vorgehen zu bevorzugen. Die operative Therapie besteht in einem sorgfältigen Debridement mit Synovektomie. Zusätzlich können eine Spül-Saug-Drainage, lokale Antibiotikaeinlagen (s. o.) vorgenommen werden. Transkutan herausgeleitete Gentamyzinketten dürfen knorpelige Bereiche nicht tangieren. Bei jedem Eingriff werden von verschiedenen Lokalisationen Synovialisproben zur erneuten Keim- und Resistogrammbestimmung entnommen, um das vorliegende Keimspektrum vollständig zu erfassen und die systemische Antibiotikatherapie anzupassen. Gleichzeitig werden möglichst mehrere Redondrainagen eingelegt. Die Verlaufskontrolle ist über die Leukozytenbestimmung im Sekret der Redonschläuche und Abstriche aus dem Gelenksekret möglich. Auch das CrP 5.5.25 Infektiöse Arthritiden z kann für die Beurteilung der Infektbeherrschung herangezogen werden (Kontrolle jeden zweiten Tag), wobei allerdings das Operationstrauma allein diesen Wert einige Tage ansteigen lässt. Die BSG reagiert langsam. Die transkutan herausgeleiteten Ketten werden nach wenigen Tagen in Kurznarkose, die Redondrainagen nach einigen weiteren Tagen entfernt. In gleicher Narkose kann das Gelenk passiv mobilisiert werden, anschließend wird die intensive Bewegungstherapie (aktiv und passiv einschließlich Bewegungsschiene) aufgenommen. Der akute Infekt eines alloplastisch versorgten Gelenkes rechtfertigt bei schneller Intervention einen gleichartigen Behandlungsversuch, wobei aber hier nur die offene Revision aussichtsreich erscheint. Chronische Infekte hingegen erfordern in aller Regel das offene Gelenkdebridement mit Ketteneinlage und beim alloplastisch versorgten Gelenk die Entfernung des Implantates und evtl. vorhandenen Zementes. Danach kann bei einem zweizeitigen Wechsel die Gelenkhöhle mit Gentamyzinketten sowie evtl. einem Platzhalter ausgefüllt werden. Bei einzeitigem Wechsel wird das ausgetauschte Implantat mit einer dem vorliegenden Keim angepassten Zement-Antibiotikum-Mischung fixiert. Saug-Spül-Drainagen können als Alternative zur Ketteneinlage in Betracht gezogen werden. z Physikalische Therapie Begleitend sollte frühzeitig mit Kryotherapie (mehrfach täglich und nachts), Wechsellagerung und dosierten Bewegungsübungen zur Kontrakturprophylaxe begonnen werden. Je nach Verlauf ist eine CPM-Schiene angezeigt. z Obsolete Therapien Längere Immobilisation des Gelenkes, eine Behandlung ohne Entlastung bzw. Spülung sind unbedingt zu vermeiden. z In Erprobung befindliche therapeutische Maßnahmen Über den Effekt einer intraartikulären Applikation von Telcoplanin mittels Kollagenvlies kann zurzeit noch keine Aussage getroffen werden. z Literatur 1. Esterhai JL, Gelb I (1991) Adult septic arthritis. Orthop Clin North Amer 22: 503–514 2. Härle A, Tscheme H, Weissauer W (1988) Behandlungsstrategien bei Verdacht und beim Nachweis einer Gelenkinfektion nach intraartikulärer Injektion und Punktion. Z Unfallchir Berufskr 81:1–16 3. Härle A (1989) Infection management in total hip replacement. Arch Orthop Trauma Surg 108:63–71 4. Härle A (1991) Die Infektion bei Knieendoprothesen. Orthopäde 20:227–238 5. Kusswetter W (ed) (1991) Infection in total hip replacement: clinical relevance and prophylaxis. Thieme, Stuttgart 419 420 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.26 Arthrosen der Hand (ICD-Nr. M 15.1) z Grundsätzliche Bemerkungen Bisheriger Verlauf, Ausprägungsgrad der Arthrose, klinischer und röntgenologischer Befund, die Schmerzsymptomatik und das Alter des Patienten sowie ggf. vorhandene Begleiterscheinungen bestimmen im Wesentlichen die Wahl der Therapie. Der Patient muss über die Chronizität des Leidens aufgeklärt werden. Wichtig ist dabei auch der Hinweis auf präventive Maßnahmen. Hier kommt insbesondere dem Gelenkschutz (Ergotherapie) eine besondere Bedeutung zu. Die optimale Behandlung umfasst individualisierte nichtmedikamentöse, medikamentöse (systemisch, topisch, intraartikulär) und ggf. chirurgische Maßnahmen. Evidenz basierte Empfehlungen wurden vor kurzem von der EULAR veröffentlicht [6]. z Medikamentöse Therapie In leichteren Fällen mit beginnender Schmerzsymptomatik ist die Verordnung von Externa empfehlenswert. Insbesondere kommen hier topische Antiphlogistika (Diclofenac, Piroxicam, Ibuprofen, Indometacin, Etofenamat) in Betracht. Diese Präparate sollten auch über einen längeren Zeitraum angewandt werden. Bei stärkerer Beschwerdesymptomatik, insbesondere bei Auftreten von Aktivierungszuständen (Schwellung des Daumengrundgelenkes bis zu Langfingermittel- und -endgelenken) ist auch die orale Gabe von nichtsteroidalen Antiphlogistika notwendig. Steht der Schmerz im Vordergrund, ohne entzündlichen Reizzustand, sind analgetisch wirkende Präparate wie z. B. Paracetamol zu bevorzugen. In seltenen Fällen mit hochgradiger Entzündungsaktivität, die durch die vorgenannten Maßnahmen nicht beherrschbar sind (cave: Differenzialdiagnose Pfropfarthritis!) ist auch gelegentlich die Indikation zur intraartikulären Kortikoidinjektion zu überprüfen. Die Dosierung richtet sich nach der anatomischen Größe des betroffenen Gelenkes. Sie beträgt bis zu 5 mg. Die Wirksamkeit sog. chondroprotektiver Substanzen bei der Polyarthrose der Hand ist umstritten. Die medikamentöse Therapie wird oftmals kombiniert mit anderen Behandlungsverfahren anzubieten sein. 5.5.26 Arthrosen der Hand z z Nichtmedikamentöse Therapie Physikalische Therapie Die Wärmetherapie ist bei schmerzhaften Affektionen ohne Zeichen eines entzündlichen Aktivierungszustandes indiziert. Wärmeanwendungen können in Form von Fangokneten, lokalen Bädern mit verschiedenen Zusätzen, Wickel bis hin zur Bestrahlung (Infrarot) und schließlich auch zu verschiedenen Arten der Elektrotherapie reichen. Bei aktiveren Formen der Fingerarthrosen kommt gelegentlich eine Kryotherapie in Betracht. Von einigen Autoren wird auch die Röntgenreizbestrahlung empfohlen. Krankengymnastische Behandlung Die krankengymnastische Behandlung hat zum Ziel, beginnende oder bereits etablierte Kontrakturen zu beheben oder zumindest zu verhindern. Die Funktion soll verbessert werden. Bei der Erarbeitung des Gelenkspiels kommen manuelle Techniken zur Anwendung. Periartikuläre Befunde werden hauptsächlich mit „deep friction“ unter Eisabdeckung behandelt. Hinzu kommen Muskeldehnungen und Bewegung in warmem Wasser als Selbstbehandlung (s. auch Kap. 8). Orthopädische Hilfsmittel Für die Rhizarthrose ist bei hartnäckigen Schmerzzustäden eine Daumenorthese in Betracht zu ziehen. Es handelt sich hierbei nur um eine vorübergehende Maßnahme, die ergänzt und zu den vorbeschriebenen Behandlungen zur Anwendung kommt. Gelegentlich kann auch die Verordnung einer Fingerschiene bei hochgradigen Reizzuständen und destruierenden Formen der Langfingerarthrose angezeigt sein. Operative Therapie Die operative Behandlung der Rhizarthrose gliedert sich in Maßnahmen ohne Knochenresektion und solche, die mit einer Knochenresektion einhergehen. Bei Behandlungsmaßnahmen ohne Knochenresektion unterscheidet man kapsel- und ligamentverstärkende Operationen, Denervierung zur Schmerzausschaltung und die sog. Cheilotomie (Gelenktoilette). Zum anderen ist, wenn auch sehr selten, die Ruhigstellung eines über einen längeren Zeitraum schmerzenden Gelenkes durch eine Arthrose ins Auge zu fassen. Die Wahl des operativen Verfahrens wird durch die Anamnese und den aktuellen klinischen und röntgenologischen Befund bestimmt. Die operative Therapie der Heberden- und Bouchard-Arthrosen bietet sich bei therapieresistenten hochschmerzhaften Befunden an, die oftmals mit einer Instabilität des betroffenen Gelenkes einhergeht. Es ist dann eine Arthrodese des betroffenen Mittel- oder Endgelenkes indiziert. Diese operativen Maßnahmen werden nur selten angewandt. Mit arthroplastischen Eingriffen (Mittelgelenk) liegen nur geringe Erfahrungen 421 422 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern vor. Hier muss von erfahrener Seite im Einzelfall entschieden werden. Bei den Arthrosen des Daumensattelgelenkes (sog. Rhizarthrosen) sind mit Interpositionsplastiken oder Endoprothesen sehr gute Ergebnisse zu erzielen (s. Kap. 7). z Prophylaxe und Verhaltensweise für den Patienten Vordergründig ist bei der sekundären Prävention der Langfinger- und Daumensattelgelenksarthrose die Ergotherapie (Gelenkschutz!) zu nennen. Ziel ist die Vermeidung von Gelenkschmerzen, Fehlstellungen und Funktionsverschlechterungen. In einer möglichst umfassenden Beratung und Unterweisung wird der Patient auf die Wichtigkeit achsengerechter Gelenkbewegungen hingewiesen. Die täglichen Bewegungsmuster müssen auf die Deformierung und Fehlstellung der bedrohten Gelenke abgestimmt sein. Jede Dauerbeanspruchung und Überbelastung ist zu vermeiden, wobei jedoch gezielte aktive Bewegungsübungen zum Behandlungskonzept gehören. Ein weiterer Schwerpunkt ist die ergonomische Gestaltung des Arbeitsplatzes in Haushalt und Beruf sowie die Erarbeitung berufsspezifischer Tätigkeiten unter arbeitstherapeutischen Gesichtspunkten. Die Versorgung mit Hilfsmitteln beinhaltet die Beratung, das Üben und den Umgang mit den Adaptationshilfen sowie die Entwicklung und Herstellung neuer, der individuellen Situationen angepasster Hilfsmittel. z Literatur 1. Eggers P, Cooper C, Hart DJ, Doyl DV, Coggon D, Spector TD (1995) Patterns of joint involvement in osteoarthritis of the hand: the Chingford Study. J Rheumatol 22:1509–1513 2. Elsner G, Nienhaus A, Beck W (1995) Arthrosen der Fingergelenke und der Daumensattelgelenke und arbeitsbedingte Faktoren. Gesundheitsw 57:786–791 3. Jäger M, Wirth CJ (1992) Praxis der Orthopädie. Thieme, Stuttgart New York 4. Rudigier J (1990) Kurzgefasste Handchirurgie. Hippokrates, Stuttgart 5. Treves R, Maheu E, Dreiser RL (1995) Therapeutic trials in digital osteoarthritis. A critical review. Rev Rhum Engl Edit 62:338–341 6. Zhang W et al (2007) EULAR evidence based recommendations for the management of hand osteoarthritis: report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 66:377–388 5.5.27 Coxarthrose z 5.5.27 Coxarthrose (ICD-Nr. M 16.0/16.1)) z Grundsätzliche Bemerkungen Die Ursache einer Coxarthrose kann vielfältig sein und ist nicht immer klärbar. Im fortgeschrittenen Stadium der Coxarthrose spielt die Ursache der Krankheit im Therapieregime eher eine untergeordnete Rolle. Allgemein kann man sagen, dass die Therapie orientiert an den Erfordernissen des individuellen Patienten eine Kombination von nichtmedikamentösen und medikamentösen Maßnahmen darstellt.. Da der subjektive Schweregrad der Erkrankung nicht immer mit dem Röntgenbefund oder sonstigen bildgebenden Befunden korrelliert, beginnt die Therapie der Coxarthrose grundsätzlich als konservative. Auch bei röntgenologisch stark ausgeprägten Coxarthrosen können konservative Maßnahmen zu einer ausreichenden Linderung der Beschwerden führen. Umgekehrt findet man röntgenologisch wenig ausgeprägte Gelenkveränderungen, die dennoch unter konservativer Therapie nicht gelindert werden können und Indikationen zum endoprothetischen Gelenkersatz darstellen. z Medikamentöse Therapie Ziel der medikamentösen Therapie ist v. a. die Schmerzlinderung. z Paracetamol und nichtsteroidale Antiphlogistika sind nach wie vor die Mittel der Wahl bei der medikamentösen Therapie der Coxarthrose. Letztere sind v. a. dann erfolgversprechend, wenn eine begleitende Synovialitis Ursache der geklagten Beschwerden ist. z Opioidanalgetika werden bei NSAR-Unverträglichkeit oder -Kontraindikation eingesetzt. z So genannte Chondroprotektiva haben geringe symptomatische Effekte. z Nichtmedikamentöse Therapie Physikalische Therapie Wärmeanwendungen in den unterschiedlichsten Applikationsweisen (heiße Bäder, Sauna, Fangopackungen), Unterwasserstrahlmassagen können muskuläre Verspannungen lindern. Krankengymnastische Behandlung Die krankengymnastische Behandlung soll eine Kräftigung der Becken- und Oberschenkelmuskulatur, v. a. des Musculus glutaeus medius, herbeiführen. 423 424 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Die Krankengymnastik ist so Kontrakturprophylaxe gegen eine Beuge- und Adduktionskontraktur und auch Kontrakturtherapie. Sie zielt gleichzeitig auf eine Beweglichkeitsverbesserung und ein Koordinationstraining ab. Orthopädische Hilfsmittel Schuhzurichtungen mit Pufferabsätzen und weichen Sohlen sollen den Auftritt beim Gehen dämpfen. Ein Beinlängenausgleich im Schuh ist nur bei reellen Beinlängendifferenzen über 1 cm indiziert. Bei manifesten Kontrakturen und Bewegungseinschränkungen können Toilettenaufsatz, An- und Ausziehhilfen usw. hilfreich sein. Ein Handstock bzw. eine Unterarmgehstütze wird auf der Gegenseite geführt. Operative Therapie Umstellungsosteotomien beziehen sich sowohl auf den coxalen wie auf den azetabulären Gelenkpartner. Sie sind dann indiziert, wenn bei einer ausgeprägten Fehlstellung die resultierende Arthrose noch nicht fortgeschritten ist. Korrekturosteotomien am Azetabulum werden bei der Pfannendysplasie angewendet in Form von Schwenkosteotomien der gesamten Gelenkpfanne. Die Art der Korrekturosteotomie am proximalen Femur ist abhängig von der Art der Fehlstellung (valgisierende, varisierende oder derotierende Osteotomie). Resezierende Arthroplastiken haben am Hüftgelenk, anders als an den Gelenken der oberen Extremitäten, keine Bedeutung mehr. Arthrodesen des Hüftgelenkes führen zu einer deutlichen Beeinträchtigung der Lebensqualität und sind bei jungen Menschen mit körperlich belastenden Berufen noch in besonderen Situationen indiziert. Der endoprothetische Gelenkersatz des Hüftgelenkes gehört zu den am weitesten verbreiteten endoprothetischen Operationen. Bei der Totalendoprothese wird sowohl die femorale wie die azetabuläre Komponente ersetzt. Bei den Verankerungstechniken der Implantate unterscheidet man zementfreie, zementierte und hybride Varianten. Schließlich bestehen erhebliche Unterschiede bei den Implantaten hinsichtlich der verwendeten Materialien. z Prophylaxe und Verhaltenshinweise für den Patienten Die Prophylaxe der sekundären Coxarthrose besteht in der frühzeitigen Therapie des Grundleidens, z. B. der Therapie der chronischen Polyarthritis und anderer synovialer Krankheiten. Korrekturosteotomien sollen im Frühstadium durchgeführt werden. Hat sich eine Coxarthrose entwickelt, kann körperliche Belastung zur sog. Aktivierung der Arthrose mit Schmerzzunahme führen. Dementsprechend sind körperliche Belastungen den individuellen Gegebenheiten anzupassen. 5.5.27 Coxarthrose z z Literatur 1. Hackenbroch MH (1989) Coxarthrose. In: Fehr K, Miehle W, Schattenkirchner M, Tillmann K (Hrsg) Degenerative Gelenkerkrankungen. Thieme, Stuttgart 2. Hochberg MC, Altman RD, Brand KD, Clark BM, Dieppe PA, Griffin MR, Moskowitz RW, Schnitzer TJ (1995) Guidelines for medical management of osteoarthritis. Part I Osteoarthritis of the hip. Arthr Rheum 38:1535–1540 3. Klippel JH, Dieppe PA (1994) Rheumatology. Mosby, St. Louis 4. Zhang W et al (2005) EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 64:669–681 425 426 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 5.5.28 Gonarthrose (ICD-Nr. M 17.0/17.1) z Grundsätzliche Bemerkungen Die Ursache einer Gonarthrose kann vielfältig sein und ist individuell nicht immer klärbar. Im fortgeschrittenen Stadium der Gonarthrose spielt die Ursache der Krankheit im Therapieregime eher einer untergeordnete Rolle. Allgemein kann man sagen, dass optimale Therapie eine Kombination von medikamentösen und nichtmedikamentösen Maßnahmen darstellt orientiert an indivuellen Notwendigkeiten, Risikofaktoren und Begleitentzündungen. Auch bei röntgenologisch stark ausgeprägten Gonarthrosen können konservative Maßnahmen zu einer ausreichenden Linderung der Beschwerden führen. Umgekehrt findet man röntgenologisch wenig ausgeprägte Gonarthrosen, die dennoch durch eine konservative Therapie nicht gelindert werden und zum endoprothetischen Gelenkersatz führen. z Medikamentöse Therapie Ziel der medikamentösen Therapie ist v. a. die Schmerzlinderung. z Topisch angewendete Antiphlogistika (Zubereitung mit Diclofenac, Piroxicam, Ibuprofen, Indometacin, Etofenamat) spielen ebenso eine Rolle wie systemische nichtsteroidale Antiphlogistika. Beide Anwendungsformen sind v. a. dann erfolgversprechend, wenn eine begleitende Synovialitis Ursache der geklagten Beschwerden ist. z So genannte Chondroprotektiva ebenso wie Hyaluronsäurezubereitungen haben nur geringe symptomatische Effekte. z Injektionen von Kortisonkristallsuspensionen lindern bei fortgeschrittenen Gonarthrosen vorübergehend die Schmerzsymptomatik, indem sie auf die begleitende Synovialitis Einfluss nehmen. z Nichtmedikamentöse Therapie Physikalische Therapie Kälteanwendungen in Form von Eispackungen finden v. a. dann Anwendung, wenn ein begleitender Gelenkerguss besteht. Wärmeanwendungen sind indiziert bei peripatellären tendinotischen Zuständen. Krankengymnastische Behandlung Die krankengymnastische Behandlung soll eine Kräftigung der Oberschenkelmuskulatur, v. a. des Musculus quadriceps herbeiführen. Krankengymnastik ist 5.5.28 Gonarthrose z auf der einen Seite Prophylaxe gegen eine Beugekontraktur, zum anderen auch Kontrakturtherapie. Sie zielt gleichzeitig auf eine Beweglichkeitsverbesserung und auf ein Koordinationstraining ab. Orthopädische Hilfsmittel Schuhzurichtungen mit Pufferabsätzen und weichen Sohlen sollen den Auftritt beim Gehen dämpfen. Kniegelenkbandagen in den unterschiedlichen Macharten führen in manchen Fällen zu einer Schmerzerleichterung. Operative Therapie z Umstellungsosteotomien sind bei unikompartementer Arthrose im Femorotibialgelenk besonders bei Achsenfehlstellungen indiziert. Variationen werden meist als suprakondyläre Osteotomie, Valgisationen meist als Tibiakopfosteomie durchgeführt. Umstellungsosteotomien sind dann indiziert, wenn bei einer ausgeprägten Fehlstellung die resultierende Arthrose noch nicht fortgeschritten ist. z Die endokopisch durchgeführte Lavage des Gelenkes lässt Detritus aus dem Gelenk ausspülen, sodass die sekundäre Synovialitis günstig beeinflusst wird. Mechanisch wirksame Knorpelfragmente, die zu Blockierungen oder zu blockadeähnlichen Zuständen Anlass geben, können hierbei entfernt werden. z Die Arthrotomie mit offenem Debridement des Gelenkes verfolgt das gleiche Ziel wie die endoskopische Lavage. Gleichzeitig lassen sich auch größere osteophytäre Randzacken abtragen. z Arthrodesen des Kniegelenkes führen zu einer deutlichen Beeinträchtigung der Lebensqualität, sind aber dennoch in besonderen Situationen indiziert. z Der endoprothetische Gelenkersatz des Kniegelenkes gehört zu den am weitesten verbreiteten endoprothetischen Operationen. Bei den unikompartimentären Prothesen (Schlittenprothesen) wird lediglich das mediale oder laterale Femorotibialgelenk ersetzt. Der alleinige Femoropatellargelenkersatz kommt nur in Ausnahmefällen in Betracht. Ein Oberflächenersatz des gesamten Femorotibialgelenkes und des Femoropatellargelenkes setzt voraus, dass die Seitenbänder stabil geführt werden und Achsenabweichungen und Kontrakturen nur in limitierter Ausprägung vorliegen. Gestielte Endoprothesen weisen meist auch gleichzeitig eine mechanische Koppelung zwischen der femoralen und tibialen Prothesenkomponente auf und kommen bei instabilen Bandverhältnissen, ausgeprägten Achsenabweichungen und größeren Knochendefekten zum Einsatz. Entsprechende Therapieempfehlungen wurden von EULAR veröffentlicht [3]. 427 428 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Literatur 1. Hackenbroch MH (1989) Gonarthrose. In: Fehr K, Miehle W, Schattenkirchner M, Tillmann K (Hrsg) Degenerative Gelenkerkrankungen. Thieme, Stuttgart 2. Hochberg MC, Altman RD, Brand KD, Clark BM, Dieppe PA, Griffin MR, Moskowitz RW, Schnitzer TJ (1995) Guidelines for medical management of osteoarthritis. Part II Osteoarthritis of the knee. Arthr Rheum 38:1541–1546 3. Jordan KM et al (2003) EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report fo a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 62:1145–1155 4. Klippel JH, Dieppe PA (1994) Rheumatology. Mosby, St. Louis 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) (ICD-Nr. M 54.4, M 54.6) z Therapiebedarf in den Phasen der Verlaufs z Akute Kreuzschmerzen klingen in der Mehrheit der Fälle innerhalb weniger Tage bis Wochen weitgehend ab [54]. Bei einigen Betroffenen persistieren sie aber während mehrerer Wochen bis Monate, auch wenn keine klare Ursache gefunden werden kann [51]. z Nach Ausschluss einer spezifischen Ursache ist das Hauptziel der Behandlung die rasche schrittweise Wiedererlangung des früheren oder eines allenfalls modifizierten Funktionsniveaus trotz vorerst persistierender Schmerzen. Dazu sind einfache schmerzstillende Maßnahmen (v. a. Analgetika, s. u.) angezeigt. z In der akuten Phase (erste 3 bis 4 Wochen) erübrigen sich in unkomplizierten Fällen spezielle Behandlungsmaßnahmen, da sie die Wiederaufnahme der Arbeit eher verzögern und unnötige Kosten verursachen [9, 17, 22, 24, 33, 58]. z In der subakuten Phase (über 4 bis 12 Wochen persistierende Schmerzen) sind aktive Maßnahmen angezeigt (s. u.), wobei auch hier noch Zurückhaltung angezeigt scheint [17]. Eine gründliche klinische Untersuchung und eine anschließende intensive Beratung über die Ungefährlichkeit der Wiederaufnahme der gewohnten Aktivitäten erwiesen sich als effizientere Maßnahme als die „übliche medizinische Behandlung“ [22, 24]. Dabei muss die Angst, eine schwerwiegende Pathologie zu haben und durch eine Aktivierung möglicherweise noch mehr Schaden anzurichten, mit guter Beratung und klarer, konsequenter Führung überwunden werden [24]. Durch diese Beratung soll der Patient lernen, „harmlose“ von „gefährlichen“ Schmerzen zu unterscheiden, indem die Umstände von Verschlechterungen gemeinsam analysiert werden. z Bei protrahierten (chronischen) Verläufen (über 12 Wochen Arbeitsunfähigkeit) sind intensive rehabilitative Maßnahmen angezeigt („functional restoration“, s. u.), weil zu diesem Zeitpunkt ein erhebliches Risiko der Chronifizierung und Invalidisierung besteht [58]. Konventionelle Behandlungsmaßnahmen scheinen zu diesem Zeitpunkt ineffizient [20]. Nach 6 Monaten Arbeitsunfähigkeit haben rehabilitative Maßnahmen bereits keine große Chance mehr, den Patienten wieder in den Arbeitsprozess zurückzubringen. Daher sind ein Verständnis des Chronifizierungsprozesses und frühzeitiges Handeln wichtig. z Problem der Chronifizierung z Chronische Verläufe von unspezifischen Rückenschmerzen stellen nicht nur für die Patienten selbst eine große Belastung dar, sondern auch für das So- 429 430 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern zialversicherungssystem. Sie sind in industrialisierten Ländern [39] in den letzten Jahren zu einem der häufigsten Gründe für eine vorzeitige Invalidität und Invalidenrente geworden [6]. z Die Chronifizierung hängt nicht vom Schweregrad des somatischen Befundes ab (siehe Tabelle 1). Eine Schmerzausstrahlung in die Beine ist zwar ein prognostisch ungünstiger Faktor, aber umfangreiche Forschungsarbeiten belegen, dass rein medizinische (einschließlich arbeitsmedizinische) Faktoren für die Zunahme der invalidisierenden Verläufe nicht verantwortlich gemacht werden können [27]. Chronische Verläufe sind trotz Fortschritten in Diagnostik und Therapie sowie erleichterten Arbeitsbedingungen im Steigen begriffen [39, 57], wobei dieses Phänomen weitgehend auf hochindustrialisierte Länder beschränkt bleibt, wie internationale Vergleiche [53] oder eine Untersuchung bei australischen Aborigines zeigen [23]. z Die Persistenz der Beschwerden kann nicht auf bestimmte Einzelursachen zurückgeführt werden, sondern kommt durch eine komplexe Interaktion von biologischen, somatischen, psychosozialen und beruflichen Faktoren zustande. Tabelle 5 zeigt eine Reihe von individuellen Faktoren, welche den chronischen Verlauf begünstigen können. Tabelle 1. „Risikofaktoren“ für die Chronifizierung von Rückenschmerzen Schmerzsymptomatik: z frühere Schmerzepisoden 1 z Schmerzausstrahlung ins Bein, v. a. unterhalb Knie 1 z Zeichen der Nervenwurzelreizung 1 Andere Symptome: z schlechter allgemeiner Trainingszustand 2 z allgemein schlechte Gesundheit 2 z starker Nikotinkonsum 1 z Alter über 50 Jahre 2 Psychosoziale Faktoren: z Zeichen von Angst und Depressivität 2 z ungünstige Selbstprognose 2 z ungünstiges Coping: Katastrophisieren 1 z belastende Lebensprobleme (Familie, Beruf) 1, 2 Arbeitssituation: z geringe Schulbildung, unqualifizierte Arbeit 1 z Unzufriedenheit mit der Arbeit 1 z fehlende Vertrauensperson am Arbeitsplatz 1 z unsicherer Arbeitsplatz 1, 2 z Verlust der Arbeitsstelle 3 z Rentenwunsch/Rechtsstreit 3 Wahrscheinlicher (hauptsächlicher) zeitlicher (kausaler) Zusammenhang: 1 eher primär vorhanden, 2 möglicherweise sekundäres Phänomen, 3 eher Folge des chronischen Verlaufs 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z z Weitere Einflüsse liegen in der medizinischen Versorgung und der wirtschaftlichen Lage: Je besser das medizinische Angebot und die Versicherungsleistungen, umso mehr werden Leistungen in Anspruch genommen [19]. Je mehr Behandlung, desto länger dauert die Arbeitsunfähigkeit [24, 33] und entsprechend steigen die Kosten. z Das Angebot von Leistungen scheint deren Inanspruchnahme in bedenklicher Weise mitzubestimmen, wie ein Vergleich der Operationshäufigkeit in verschiedenen Ländern zeigt. So werden in den USA bezogen auf die Einwohnerzahl 5-mal mehr Rückenoperationen als in England und Schottland durchgeführt, wobei in 10 der 12 untersuchten Länder oder Teilstaaten praktisch eine lineare Korrelation zwischen der Anzahl von Wirbelsäulenchirurgen und Häufigkeit der Eingriffe festgestellt wurde [10]. Diagnostische und therapeutische Maßnahmen werden offenbar weniger in Abhängigkeit vom Beschwerdebild als nach Spezialgebiet des Arztes eingesetzt [9, 11], was sehr unterschiedliche Kosten bei praktisch gleichen Resultaten zur Folge hat. z Die wirtschaftliche Lage und die Situation in der Arbeitswelt haben einen Einfluss: In Boomzeiten und bei Verschlechterung der Arbeitsbedingungen (erhöhter Stress durch Leistungsdruck) nehmen die Krankheitsfälle und -tage wegen Rückenschmerzen besonders stark zu [3]. Rezession führt zu einem Rückgang [5]. z Die Rolle des Arztes bei der Chronifizierung Diagnostik: Die meist vergebliche, unermüdliche Suche nach einer Einzelursache Das traditionelle linear-kausale Krankheitsmodell, das in der Akutmedizin sehr hilfreich ist, stößt für das Verständnis persistierender unspezifischer Kreuzschmerzen an seine Grenzen. Wenn keinerlei ernsthafter Verdacht auf eine spezifische Ursache besteht, fördert die fortgesetzte Suche nach einer Einzelursache die Chronifizierung iatrogen. Weitere Abklärungen ohne klare Indikation fördern oft irrelevante Anomalien oder degenerative Veränderungen der Wirbelsäule zutage, die dann als alleinige Ursache der Schmerzen interpretiert werden [44]. Dies kann dazu führen, dass Arzt und Patient die Bedeutung dieser vermeintlichen strukturellen Läsion überbewerten und die Behandlung und das Verhalten daran orientieren, was neben entsprechenden schmerztherapeutischen Maßnahmen vor allem die Verordnung von Ruhe und Schonung bedeutet. Die Effizienz dieses Vorgehens – nach Ablauf der akuten Schmerzphase von wenigen Tagen – wird, wie eingangs erwähnt, zunehmend angezweifelt [58]. 431 432 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Entweder körperlich oder psychisch bedingt? Die Falle der Dichotomie Soma/Psyche Kann keine organische Ursache, welche die Symptome erklären könnte, gefunden werden, wird oft eine psychische Einzelursache vermutet („psychogener Schmerz“). Dieses dichotome Denken („wenn nicht somatisch bedingt, dann psychogen“) geht von veralteten oder einseitigen Konzepten der Psychosomatik aus. Eine fassbare psychische Einzelursache liegt nämlich selten vor, sondern meist eine komplexe Interaktion von körperlichen, psychischen, sozialen und iatrogenen Faktoren. Wird auch keine psychische Ursache gefunden, fällt der Patient „zwischen Stuhl und Bank“ und gewinnt den Eindruck, dass niemand ihm glaubt, dass er wirklich Schmerzen habe. Der Arzt wehrt seine eigene Hilflosigkeit vielleicht damit ab, dass er die Schuld dafür dem Patienten zuschiebt, indem er diesem mangelnde Kooperation oder Simulation vorwirft. Diese Frustrationen und Missverständnisse führen zu einer rapiden Verschlechterung der Arzt-Patient-Beziehung und begünstigen die Chronifizierung. z Auswege aus der Gefahr der Chronifizierung Paradigmawechsel: biopsychosoziale Sicht Um dieser ungünstigen Entwicklung entgegenzuwirken, ist für den Umgang mit Kreuzschmerzen eine ganzheitliche biopsychosoziale Sicht notwendig, die verschiedene biologische, psychologische und soziale (einschließlich berufliche) Dimensionen des Leidens in einem systemischen Modell zusammenführt [42]. Dies setzt einen Wechsel von der traditionellen hierarchischen Arzt-Patient-Beziehung zu einer therapeutischen Haltung voraus, welche von Partnerschaft und Zusammenarbeit mit dem Patienten geprägt ist. Anstelle einer Behandlung mit dem Ziel der Schmerzfreiheit tritt eine Beratung für ein möglichst beschwerdearmes Leben mit dem Schmerz sowie die Wiedererlangung einer größtmöglichen Funktionsfähigkeit (s. u.). Klare Leitlinien: Den chronischen Verlauf frühzeitig erkennen und verhindern Um dem chronischen Verlauf vorzubeugen, sollen Richt- oder Leitlinien, welche auf dem aktuellen Wissensstand beruhen, zur Anwendung gebracht werden. Eine ausgezeichnete Übersicht über die Problematik findet sich bei Waddell in einem kürzlich erschienenen Buch [58]. Darin und andernorts sind verschiedene in den letzten Jahren publizierte Leitlinien für die Abklärung und Behandlung von Rückenschmerzen dargestellt. Die folgenden Ausführungen basieren weitgehend auf den Empfehlungen für Abklärung und Behandlung von Kreuzschmerzen [2] der Verbindung der Schweizer Ärzte (FMH). Sie wurden im Rahmen einer fachlich breit abgestützten Präventionskampagne aufgrund der internationalen Literatur, anerkannten ausländischen Richtlinien [48, 59] sowie den Erfahrungen eines Schweizer Forschungsprogrammes [27] 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z verfasst. Die einzelnen Therapieempfehlungen wurden weitgehend der Basisdokumentation [26] dieser Kampagne entnommen. Kernpunkte dieses Abklärungs- und Behandlungskonzeptes für akute Kreuzschmerzen sind: z Warnzeichen, welche weitere Abklärungen nötig machen, müssen rasch erkannt werden. Ohne solche Warnzeichen sind über eine gezielte klinische Untersuchung hinaus keine weiteren Untersuchungen (z. B. Röntgen oder Labor) nötig; z Risiko eines chronischen Verlaufs frühzeitig erkennen und entsprechend handeln; z den Schmerz nicht nur in seinen somatischen, sondern auch psychosozialen und kulturellen Dimensionen erfassen, ohne ihn dabei zu verharmlosen; z die therapeutischen Maßnahmen auf das Ziel der Erhaltung der Funktionstüchtigkeit ausrichten; passive Behandlungen oder die Verordnung von Ruhe und Schonung auf das absolut notwendige Minimum beschränken; z eine partnerschaftliche Arzt-Patient-Beziehung etablieren und dadurch seine aktive Beteiligung an der Behandlung sowie die Mobilisation der Ressourcen fördern; z die Möglichkeiten einer interdisziplinären Zusammenarbeit nützen und den Patienten wenn nötig für eine multimodale, integrierte Intensivrehabilitation oder eine begleitende Psychotherapie motivieren; z Beherrschung der zur Erreichung dieser Ziele notwendigen Kommunikations- und Beratungstechniken; Reflexion der eigenen Rolle bei Beziehungsschwierigkeiten oder Kommunikationsstörungen (Umgang mit „schwierigen Patienten“). Richtlinien vergleichbaren Inhalts wurden in mehreren Studien auf ihre Wirksamkeit, Sicherheit und das Kosten-Nutzen-Verhältnis untersucht. Schmerz, Behandlungsbedürftigkeit, Krankheitstage und Kosten gingen signifikant stärker zurück als bei konventioneller Behandlung. Die nach Richtlinien betreuten Patienten erlebten die Behandlung öfters als sehr hilfreich und wurden häufiger ganz von ihren Schmerzen befreit [36]. Nicht zu früh, nicht zu spät: Die richtigen Maßnahmen zum richtigen Zeitpunkt Die Empfehlungen für die Abklärung und Behandlung von akuten und persistierenden Kreuzschmerzen sind in Form von kommentierten Entscheidungsbäumen (Algorithmen; Tabelle 2) aufgrund eines Zeitplans in 4 Schritte unterteilt: Akuter Kreuzschmerz: initiale Beurteilung Bei einer akuten Schmerzepisode soll mit einer gezielten Anamnese und Untersuchung nach Hinweisen für eine spezifische Ursache gesucht und allenfalls entsprechende Abklärungsmaßnahmen in die Wege geleitet werden. Liegen keine Warnzeichen (Tabelle 3) für neurologische Ausfälle, eine Fraktur, ein 433 434 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Tabelle 2. Ziele der 4 Entscheidungsbäume (Algorithmen) 1) Akuter Kreuzschmerz – initiale Beurteilung: – spezifische und folgenschwere Ursachen ausschließen – Probleme der kranken Person als Ganzes verständlich machen (somatisch – psychisch – sozial) – Untersuchungsbefunde festhalten – nötige Zusatzuntersuchungen beurteilen und entscheiden 2) Akuter unspezifischer Kreuzschmerz – Vorgehen und Behandlung: – Problem gemeinsam definieren („shared understanding“) – Schmerzen lindern – geeignete Behandlungsmöglichkeiten wählen – Zurückführen zur normalen Alltagsaktivität – Andauern des Funktionsverlustes vermeiden 3) Kreuzschmerz von über 4 Wochen Dauer – Beurteilung: – mit Zusatzuntersuchungen spezifische Ursache ausschließen – mit positiven Kriterien Diagnose des unspezifischen Kreuzschmerzes sichern – biopsychosoziale Faktoren beurteilen – Risiken für einen chronischen Verlauf erkennen 4) Kreuzschmerz von über 4 Wochen Dauer – therapeutisches Vorgehen: – Maßnahmen zum raschen Wiedererlangen der Funktionstüchtigkeit einleiten (Frührehabilitation) – bei Bedarf für multimodale, integrierte Intensivrehabilitation vorbereiten Tabelle 3. Hinweise für eine spezifische Ursache (Warnzeichen) z z z z z z z z z z z z z Alter < 20 Jahre, > 50 Jahre Malignom in der Anamnese unerklärbarer Gewichtsverlust adäquates Trauma zunehmender Schmerz keine Besserung mit Bettruhe vorwiegender Nachtschmerz Morgensteifigkeit über eine Stunde intravenöser Drogenkonsum lang dauernde Kortisonbehandlung gleichzeitige Urininfektion gleichzeitige Hautinfektion Blasen- und Mastdarmfunktionsstörung entzündliches Leiden oder eine Neoplasie vor, so sind vorerst keine weiteren Abklärungen indiziert. Normale Abklärungsresultate vermögen dabei den Patienten oft nicht zu beruhigen und kompensieren möglicherweise die Angst nicht, welche durch ihre Verordnung erzeugt wurde [35]. 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z Akuter unspezifischer Kreuzschmerz: Vorgehen und Behandlung Auch wenn eine spezifische Ursache ausgeschlossen ist, muss der Patient mit seinen Beschwerden ernst genommen werden. Der Arzt muss durch ein verständiges Eingehen auf den scheinbar unerklärbaren Schmerz Einfühlungsvermögen zeigen. Er darf den Patienten nicht mit einer plumpen Mitteilung des Fehlens fassbarer Befunde verunsichern. Im Gegenteil: Eine angemessene Information über das Fehlen von Indizien einer schwerwiegenden Erkrankung ist wichtig. Es muss dem Patienten eine einleuchtende Erklärung für die Beschwerden gegeben werden, wobei beunruhigende oder missverständliche medizinische Fachausdrücke wie Arthrose, Diskusdegeneration usw. mit großer Vorsicht verwendet werden sollten („normale, altersentsprechende Abnutzungserscheinungen“). Einfach verständliche Begriffe wie Muskelverspannung, Überlastung des Rückens usw. sind zu bevorzugen. Der Patient braucht Erklärungen zur Gutartigkeit des Leidens und muss wissen, dass der Spontanverlauf von akuten Kreuzschmerzen mehrheitlich günstig, wenn auch oft wellenförmig ist. Der Arzt muss deutlich darauf hinweisen, dass Anamnese und Untersuchung eine schwere Erkrankung ausschließen lassen und daher Zusatzuntersuchungen (Röntgen, Labor) vorerst nicht notwendig sind. Das weitere Vorgehen (Zielsetzung der Behandlung) muss mit ihm besprochen werden einschließlich der Notwendigkeit einer aktiven Beteiligung und Übernahme von Selbstverantwortung. An einem gemeinsamen Verständnis des Problems muss gearbeitet werden. Einmalige Erklärungen reichen dazu meist nicht. Die Beratung schließt die Besprechung von ergonomischen Prinzipien zur Vermeidung weiterer Schmerzreizung ein (Tabelle 4). Der Patient muss aufgeklärt werden, dass es ungefährlich ist, unter Beachtung der erwähnten Verhaltensregeln die körperlichen Aktivitäten selbst mit gewissen Schmerzen möglichst bald wieder aufzunehmen. Dies soll nach Bedarf medikamentös unterstützt werden (s. u.). Falsche Zurückhaltung ist dabei ungünstig, denn die rasche Wiederaufnahme normaler Aktivitäten ist wichtig, ebenso das Vermeiden von übermäßigen Schmerzen, da solche aufgrund der Neuroplastizität von Rückenmark und Gehirn eine Generalisierung der Schmerzen begünstigen können. Bettruhe ist nicht oder allenfalls nur für wenige Tage in schmerzarmer Stellung zu empfehlen [1, 22]. Eine allfällige Arbeitsunfähigkeit soll für eine kurze, klar begrenzte Dauer festgelegt werden. Selbstbehandlungen z. B. mit kalten oder warmen Packungen sind hilfreich und kostengünstig. Wirbelsäulenmobilisationen und -manipulationen können länger dauernde SchmerTabelle 4. Ergonomische Prinzipien zur Vermeidung weiterer Schmerzreizung z z z z z z Pausen einlegen, Entlastungshaltungen einnehmen Drehbewegungen des Körpers vermeiden, insbesondere bei zusätzlicher Belastung Vorwärtsbeugen des Körpers vermeiden In die Hocke gehen beim Aufheben eines Gegenstandes Abstützen des Beckens oder der oberen Extremitäten zur Entlastung der Wirbelsäule Gegenstände möglichst körpernah heben und halten (Hebelgesetz beachten) 435 436 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern zen günstig beeinflussen und das Wiedererlangen der Funktionstüchtigkeit beschleunigen (s. u.). Nach Abklingen der Beschwerden ist für die Sekundärprävention der Besuch einer Rückenschule ratsam. Kreuzschmerz von über 4 Wochen Dauer: Beurteilung Gehen die Schmerzen nicht innerhalb von 4 Wochen zurück, so ist rasches Handeln gefordert. Mit zusätzlichen Untersuchungen müssen bei entsprechenden Warnhinweisen erneut eine spezifische Schmerzursache ausgeschlossen oder entsprechende Maßnahmen eingeleitet werden. Das Risiko eines chronischen Verlaufes muss jetzt erkannt werden, um entsprechende Maßnahmen in die Wege zu leiten (s. u.). Kreuzschmerz von über 4 Wochen Dauer: therapeutisches Vorgehen Ist eine spezifische Ursache erneut ausgeschlossen worden, so soll eine Beratung erfolgen, die hilft, den Schmerz in seiner ganzen biopsychosozialen Bedeutung zu erfassen, ihn zu verstehen und mit ihm so umzugehen, dass er wegen übertriebener angstbedingter Schonung [24, 42] („fear-avoidance“) nicht übermäßig behindernd wird. Voraussetzung dafür ist ein gutes Vertrauensverhältnis, das durch ein vertieftes Eingehen auf den Patienten gefördert werden kann. Dazu hilft eine spezielle therapeutische Grundhaltung, wie sie in der Gesprächspsychotherapie oder der Technik des „aktiven Zuhörens“ zur Anwendung kommt (in der Basisdokumentation näher ausgeführt, s. Tabelle 5) [26]. Wichtig ist es, die somatische Dimension der Beschwerden weiterhin ernst zu nehmen und bei jedem neuen Symptom die angemessenen Untersuchungen durchzuführen. Für eine ganzheitliche Erfassung der Symptomatik sind eine ausführliche Schmerzanamnese (einschließlich Sozialanamnese) sowie eine umfassende körperliche Untersuchung nötig, um auch andere funktionelle Beschwerden (z. B. Kopfschmerzen, Magen-Darm-Symptome, Schlafstörungen) sowie Einflüsse des Verhaltens auf den Schmerzverlauf (z. B. mit Hilfe eines Schmerztagebuches) zu erfassen. Dies erlaubt positive Hinweise auf ein funktionelles Leiden zu finden und bietet Ansatzpunkte für die Behandlung, welche allerdings nicht kausal, sondern nur symptomatisch sein kann. Passive schmerzlindernde Maßnahmen sollen zurückhaltend eingesetzt werden, das Tabelle 5. Grundlagen der ärztlichen Beratung z Voraussetzungen: Echtheit, positive Wertschätzung des Patienten z Grundhaltung: Partnerschaft, Empathie, Respekt, Legitimation, Support (PERLS) z Gesprächstechnik: – verstehendes Zuhören – Zeit lassen für Antworten (Pausen) – aktives Zuhören: offene Fragen, bestätigende Rückäußerungen, gezieltes Nachfragen, Zusammenfassen des Gesagten, Spiegeln von Gefühlen 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z Schwergewicht liegt auf der Aktivierung trotz persistierender Schmerzen und dem Erlernen von psychologischen Schmerzbewältigungstechniken. Um eine Entwöhnung von der Arbeit und einen Konditionsverlust zu vermeiden, soll möglichst viel körperliche Aktivität aufrechterhalten und täglich gesteigert werden. Eine stufenweise Aufnahme der Arbeit, evtl. bei ganztägiger Arbeit mit halber Leistung, kann den Wiedereinstieg erleichtern. Dazu sind klare Absprachen mit dem Arbeitgeber sowie evtl. eine Beratung und Abklärung bezüglich Entlastungsmöglichkeiten (ergonomische Anpassungen, Hilfsmittel, Rückenschule) notwendig. Arbeitsunfähigkeitszeugnisse sollen befristet ausgestellt werden. Gute Führung (evtl. psychologische Beratung) ist nötig, um einerseits übertriebene Schmerzangst (Angst vor gefährlicher Verschlechterung bei Belastung) abzubauen oder andererseits Schmerzprovokation durch unvernünftiges Leistungsverhalten (Tendenz zu Selbstüberforderung) zu vermeiden. Sind mehrere Ärzte und Therapeuten involviert, muss ein gemeinsames Konzept verfolgt und abgesprochen werden, wer für die Krankschreibung oder Zuweisungen für Zusatzabklärungen oder Spezialbehandlungen zuständig ist. Die Wahl des Behandlungsmodus (ambulant/stationär) hängt vom Ausmaß der Probleme, vom Risiko des chronischen Verlaufs und den Therapiemöglichkeiten vor Ort ab. Vor allem, wenn noch Teilarbeitsfähigkeit besteht und der Arbeitsplatz erhalten werden kann, sollte zuerst eine ambulante Intervention erfolgen. Bei einem hohen Risiko des chronischen Verlaufs (Tabelle 1) und/ oder Arbeitsunfähigkeit von über 4 Wochen Dauer sollen rasch eine interdisziplinäre Beurteilung und – sofern indiziert – intensive multimodale Rehabilitationsmaßnahmen (s. u.) in die Wege geleitet werden. Chronische Verläufe sind häufig mit auffälligem Krankheitsverhalten und einer Störung der ArztPatient-Beziehung assoziiert. Dazu gehören eine allgemeine Unzufriedenheit mit der Behandlung, angeblich widersprüchliche Beurteilungen, gleichzeitige Konsultation verschiedener Ärzte für das gleiche Problem oder Arztwechsel sowie ein passiver oder aktiver Widerstand gegen die Behandlung. z Therapiemethoden für akuten und persistierenden Kreuzschmerz Medikamente zur Schmerzlinderung (Näheres zu den Medikamenten in Kap. 5.1, 5.2, 5.7) z Analgetika, z. B. Paracetamol; z bei Nichtansprechen NSAR, die zusätzlich zu analgetischen noch eine antiinflammatorische Wirkung haben; z bei stärkeren Schmerzen Opioide; z Muskelrelaxanzien stellen bei verspannungsbedingten Schmerzen eine wirksame Alternative dar [12]. Die einzelnen Substanzen können unter Berücksichtigung der Interaktionen miteinander kombiniert werden; z Kortikosteroide sind allenfalls bei Nervenwurzelkompression mit Reizentzündung indiziert. Sie werden oral, intramuskulär und vor allem epidural angewandt (s. u.); 437 438 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Antidepressiva: Ein positiver Effekt ist besonders bei chronischen Schmerzen (Kopf- und Gesichtsschmerz und Fibromyalgiesyndrom) nachgewiesen [40]. Für Rückenschmerz wird die Effizienz bezweifelt [48]. Eine neuere Metaanalyse berichtet von positiven Ergebnissen [43]. Am besten dokumentiert sind die Substanzen Amitriptylin und Doxepin. Diese wirken auch gegen Nervosität, Reizbarkeit und Schlafstörungen. Die schmerzdämpfende und sedierende Wirkung stellt sich schon bei niedrigeren Dosen ein als der antidepressive Effekt; z bei persistierendem Kreuz- und Beinschmerz mit spezieller Symptomatologie sind u. U. Infiltrationen mit Kortikosteroiden (oder Lokalanästhetika) als lokale Weichteilinjektionen, Fazettengelenkinfiltrationen [8, 16] oder epidurale Injektionen [61] angezeigt. Die Wirksamkeit ist sowohl beim akuten wie beim chronischen Kreuzschmerz noch nicht überzeugend belegt [52]. Manipulationen Manipulationen führen oft zu einer raschen Symptomlinderung bei akutem unspezifischem Kreuzschmerz [25, 28, 37] und bei Sekundärphänomenen (z. B. Muskelverspannungen), allerdings ohne klare Überlegenheit gegenüber anderen Therapieverfahren. Bei chronischen Schmerzen ist die Überlegenheit gegenüber passiven Maßnahmen oder Plazebo belegt, allerdings nur kurzfristig [45], nur wenige Studien berichten von Langzeiterfolgen [25, 49]. Chirurgische Eingriffe Die chirurgische Behandlung kommt nur für Patienten mit neurologischen Ausfällen und in den bildgebenden Verfahren bestätigter entsprechender Pathologie in Frage, wenn die konservative Behandlung nicht zum Ziel führt. Dies betrifft lediglich etwa 1% aller behandlungsbedürftigen Personen mit Rückenschmerz [55]. Seltene, aber klare Operationsindikationen sind rasch zunehmende neurologische Ausfälle und das Cauda-equina-Syndrom. Funktionelle Bewegungstherapie Die initiale funktionelle Bewegungstherapie ist besser als Bettruhe [31, 38]. Zu einzelnen Behandlungskonzepten liegen wenige Daten vor, am besten dokumentiert sind die Extensionsübungen nach McKenzie [29, 47]. Beim akuten Kreuzschmerz ist die rasche Wiederaufnahme normaler Alltagsaktivitäten ebenso erfolgreich wie eine Bewegungstherapie [22, 52]. Eine frühe Aktivierung bringt bessere Ergebnisse als eine eher konservative Behandlung [46]. Beim chronischen Schmerz ist die Effizienz klar erwiesen, wobei kein Verfahren einem anderen klar überlegen scheint [48]. Die funktionelle Bewegungstherapie umfasst die Korrektur der Haltung, die Detonisierung und Dehnung der Muskulatur, Mobilisationsübungen, die Kräftigung der Rumpfmuskulatur, die Steigerung der allgemeinen Fitness (Trainingstherapie, s. u.) sowie evtl. ein Arbeitstraining, alles stets unter dem Blickwinkel der ergonomischen Kontrol- 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z le. Auch Entspannungsverfahren sind angezeigt. Näheres zu den einzelnen Verfahren s. Kap. 8. Medizinische Trainingstherapie Zur Konditionsverbesserung muss ein stufenweiser Wiederaufbau von ausreichender Beweglichkeit, Rumpfkraft, allgemeiner Ausdauer und guter Koordination erfolgen. Ziel ist es, bei gleich bleibenden oder vorübergehend stärkeren Schmerzen wieder zu normalen Alltagsfunktionen zurückzukehren. Dazu sind Information, Anleitung und ein Übungsplan notwendig. Täglich müssen kleine Leistungssteigerungen möglich sein, auch wenn dies zu einer vorübergehenden Zunahme der Schmerzen führt. Konkrete Möglichkeiten sind: Förderung der Bewegung im Alltag (Arbeitsweg zu Fuß oder per Fahrrad, Änderung der Arbeitsabläufe), medizinische Trainingstherapie oder allgemeines Kraftausdauertraining, Ausdauersport (Gehen, Laufen, Fahrradfahren, Schwimmen usw.) sowie rückenspezifische Übungen zur Verbesserung von Beweglichkeit, Kraft, Ausdauer, Koordination. Die Effizienz von Trainingsinterventionen beim chronischen Kreuzschmerz ist nachgewiesen [32, 34, 52]. Rückenschule Der Besuch einer Rückenschule ist vor allem für Personen mit abgeklungenen akuten Episoden angezeigt und dient vorwiegend zur Sekundärprävention [13]. Er sollte aber auch beim akuten, unspezifischen Kreuzschmerz zusätzlich zu den übrigen Maßnahmen erwogen werden. Damit wird versucht, erneutes oder häufigeres Auftreten sowie die Persistenz von Rückenschmerzen zu verhindern, aber auch den Schweregrad von erneuten Schmerzepisoden zu mindern. Die Rückenschule fördert die Übernahme von Selbstverantwortung und Steigerung der Belastungstoleranz durch rückengerechtes Verhalten im Alltag, Erlernen von Schmerzbewältigungsstrategien sowie Entdramatisierung durch adäquate Aufklärung. Ein ergänzendes, anschließendes Trainingsprogramm ist vorteilhaft, da Schulungsprogramme allein sich als ineffizient erwiesen haben [14]. Die Rückenschulen unterscheiden sich bezüglich Zielpublikum und inhaltlichen Schwerpunkten. Einzelne signifikante Besserungen konnten zwar in ca. 20 kontrollierten Studien gezeigt werden, der eindeutige wissenschaftliche Beweis für die Wirksamkeit der Rückenschule steht jedoch noch aus [12, 52]. Ergonomische Beratung (s. Tabelle 4) Die optimale Anpassung von Arbeitshaltung und -abläufen verringert den Kraft- und Bewegungsaufwand und verhindert vorzeitige Ermüdung, Verkrampfung oder einseitige Belastung. Sowohl das Halten des Körpers in der gleichen, ruhenden Position als auch das Bewegen von Lasten vor allem in vorgebeugter Haltung können Schmerzen provozieren. Merkblätter über ergonomische Schutzmaßnahmen sind bei verschiedenen Organisationen erhältlich. Ihre Durchsetzung scheitert jedoch oft an den Arbeitsbedingungen und der Arbeitseinstellung der Betroffenen. Zeitdruck und hohe Leistungs- 439 440 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern ansprüche verleiten zu schonungsloser Überlastung des Rückens. Eine Reduktion des Arbeitstempos, Einschalten von Pausen sowie Entlastung durch Hilfsgeräte oder Hilfspersonen können Schmerzen verhüten. Kontakt mit dem Arbeitgeber oder ein beratender Besuch am Arbeitsplatz durch Physio- oder Ergotherapeuten können weiterhelfen. Multimodale, interdisziplinäre Rehabilitationsprogramme In der Rehabilitation steht die Wiedererlangung der gestörten Funktionen im Vordergrund [4]. Multimodale intensive Rehabilitationsprogramme dauern in der Regel mindestens 4 Wochen und können teilstationär oder stationär durchgeführt werden [41]. Im Rahmen der Trainingstherapie stehen die Förderung von Kraft, Ausdauer, Beweglichkeit, Koordination und Entspannung im Zentrum (Näheres dazu Kap. 8). Zur Trainingssteuerung, Erfassung und Förderung der Motivation sowie Verlaufsbeurteilung sind Leistungstests notwendig. Eine wichtige Rolle in solchen Programmen spielen Psychologen, welche sowohl Patienten wie Therapeuten motivierend, modulierend und moderierend zur Verfügung stehen. Die Effizienz solcher Rehabilitationsprogramme ist erwiesen [14, 21, 25, 41] und umso besser, je früher sie einsetzen [30, 56]. Anleitung zur Prävention und Selbstbehandlung künftiger Episoden Da die Schmerzen zu Rezidiven neigen, kommt der Sekundärprävention weiterer Attacken eine zentrale Rolle zu. Sie hat zum Ziel z über Risiken des Wiederauftretens zu informieren, z mit dem Patienten zu erarbeiten, welche Überlastungen vermieden werden können, z Quellen von besonderen Fehlbelastungen physischer und psychischer Natur aufzudecken und zu Verhaltensveränderungen anzuleiten, die vor solchen Belastungen schützen sowie z zu regelmäßiger körperlicher Aktivität (Training, Dehnungsübungen etc.) zu motivieren. Entlastende Hilfen, ergonomische Maßnahmen, körperliches Training und Dehnungsgymnastik helfen die Schmerzanfälligkeit des Rückens zu verringern. Wichtig ist auch die Reflexion des eigenen Verhaltens und der Erwartungen an sich selbst. Bei neuen Schmerzepisoden sollen frühzeitig einfache Selbstbehandlungsmaßnahmen erfolgen. Um sich die Zeit für solche Maßnahmen gönnen zu können, muss der Patient vor allem das Neinsagen lernen und seine Leistungsbereitschaft für eigene hohe Ziele oder die anderer herunterschrauben. Mit dem chronischen Schmerz leben lernen – Anleitung zur Selbsthilfe Sind alle Möglichkeiten gescheitert, den Patienten völlig von seinem Schmerz zu befreien, so muss man ihm unmissverständlich klar machen, dass er mit diesen lästigen und behindernden aber letztlich ungefährlichen Schmerzen leben muss. Damit vollzieht der Arzt den eingangs erwähnten Rollen- oder Paradigmawechsel: Der Arzt wird vom „Heiler“ zum Berater, der „Hilfe zur 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z Selbsthilfe“ vermittelt. Dieses scheinbar bescheidene Ziel kann sehr viel beinhalten. Gelingt es dem Patienten nämlich, seine Schmerzen als Botschaft des Körpers zu verstehen, so können diese ihre Bedrohlichkeit verlieren und zu einem hilfreichen Wegweiser für ein entspannteres und genussvolleres Leben werden. Indem der Patient lernt, auf seinen Rücken mehr Rücksicht zu nehmen, kann er auch zu einem rücksichtsvolleren Umgang mit sich selbst finden. Um den Rücken vor Überlastung schützen oder ihm den nötigen Ausgleich in Form von regelmäßiger Bewegung und Erholung gönnen zu können, ist es nötig, andere zeitraubende Belastungen abzubauen und sich vor übermäßigem Stress zu schützen. Dazu müssen jene Verhaltensweisen verändert werden, welche zu einer Selbstüberforderung führen können, womit ein fließender Übergang zu einer eigentlichen Psychotherapie erfolgen kann. Intensive Psychotherapie Psychologische Maßnahmen werden mit Vorteil in ein umfassendes, ganzheitliches Rehabilitationsprogramm integriert. Sie dienen einerseits der Motivationsförderung durch Information und Erfahrungsaustausch, andererseits vermitteln sie verschiedene Möglichkeiten der Schmerz- und Stressbewältigung in Form von kognitiven Strategien und Entspannungstechniken. Die erwähnten Verhaltensveränderungen (mehr Rücksicht auf sich selbst) können ein Gefühl von Selbstkontrolle über den Schmerz vermitteln, welches in der Psychotherapie vertieft und auf andere Lebensbereiche übertragen werden kann. Sie werden am besten durch Fachpsychotherapeuten (Psychiater, Psychologen) vermittelt, doch können auch entsprechend geschulte und supervisierte Hausärzte oder Physiotherapeuten einen Teil dieser Aufgaben übernehmen. Ihre Wirksamkeit ist nachgewiesen [50]. Neben den motivationsfördernden Maßnahmen sollen folgende Ziele verfolgt werden: z Förderung der Selbstreflexionsfähigkeit: Bewusstwerden der Rolle des eigenen Verhaltens beim Schmerz, wobei der Schwerpunkt primär auf konkreten schmerzbezogenen Verhaltensänderungen und erst sekundär auf allgemeinen Verhaltensveränderungen beruht; z Erkennen und Überwinden von Hindernissen in der Rehabilitation: auffälliges Schmerzverhalten wegen bedeutender Psychopathologie, sekundärem Krankheitsgewinn oder anderen Verstärkerbedingungen (z. B. Verhalten der Angehörigen, Arbeitsplatzprobleme); z allenfalls Schaffung der Vertrauensbasis und Motivation für eine intensivere, aufdeckende Psychotherapie. Oft liegen stark abgewehrte traumatische Kindheitserfahrungen vor, welche das auffällige Leistungsverhalten (Tendenz zur Selbstüberforderung) erklären können. 441 442 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Literatur 1. Atlas SJ, Volinn E (1997) Classics from the spine literature revisited: a randomized trial of 2 versus 7 days of recommended bed rest for acute low back pain. Spine 22:2331–2337 2. BACK in time (1997) Kreuzschmerzen: Empfehlungen für Abklärung und Behandlung. FMH, Bern 3. Badura B (2000) Fehlzeiten-Report 1999. Springer, Berlin 4. Bendix T, Bendix AF, Busch E, Jordan A (1996) Functional restoration in chronic low back pain. Scand J Med Sci Sports 6:88–97 5. Brooker AS, Frank JW, Tarasuk VS (1997) Back pain claim rates and the business cycle. Soc Sci Med 45:429–439 6. Burnier D (1997) Après les nouveaux pauvres, voici les nouveaux invalides. Médecine et Hygiène 55:99–101 7. Burton AK, Waddell G (1998) Clinical guidelines in the management of low back pain. Baillieres Clin Rheumatol 12:17–35 8. Carette S, Marcoux S, Truchon R, Grondin C, Gagnon J, Allard Y, Latulipe MA (1991) Controlled trial of corticosteroid injections into facet joints for chronic low back pain. N Engl J Med 325:1002–1097 9. Carey TS, Garrett J, Jackman A, McLaughlin C, Fryer J, Smucker DR (1995) The outcomes and costs of care for acute low back pain among patients seen by primary care practitioners, chiropractors, and orthopedic surgeons. The North Carolina Back Pain Project. N Engl J Med 333:913–917 10. Cherkin DC, Deyo RA, Loeser JD, Bush T, Waddell G (1994) An international comparison of back surgery rates. Spine 19:1201–1206 11. Cherkin DC, Deyo RA, Wheeler K, Ciol MA (1994) Physician variation in diagnostic testing for low back pain. Who you see is what you get. Arthr Rheum 37:15–22 12. Cherkin DC, Wheeler KJ, Barlow W, Deyo RA (1998) Medication use for low back pain in primary care. Spine 23:607–614 13. Cohen JE, Goel V, Frank JW, Bombardier C, Peloso P, Guillemin F (1994) Group education interventions for people with low back pain. An overview of the literature. Spine 19:1214–1222 14. Daltroy LH, Iversen MD, Larson MG, Lew R, Wright E, Ryan J, Zwerling C, Fossel AH, Liang MH (1997) A controlled trial of an educational program to prevent low back injuries (see comments). N Engl J Med 337:322–328 15. Di Fabio RP (1995) Efficacy of comprehensive rehabilitation programs and back school for patients with low back pain: a meta-analysis. Phys Ther 75:865–878 16. Dreyfuss PH, Dreyer SJ, Herring SA (1995) Contemporary concepts in spine care. Lumbar zygapophysial (facet) joint injections. Spine 20:2040–2047 17. Frank JW, Brooker AS, DeMaio SE, Kerr MS, Maetzel A, Shannon HS, Sullivan TJ, Norman RW, Wells RP (1996) Disability resulting from occupational low back pain. Part II: What do we know about secondary prevention? A review of the scientific evidence on prevention after disability begins. Spine 21:2918–2929 18. Guzman J, Esmail R, Karjalainen K, Malmivaara A, Irvin E, Bombardier C (2001) Multidisciplinary rehabilitation for chronic low back pain: systematic review. BMJ 322:1511–1516 19. Hadler NM (1995) The disabling backache. An international perspective. Spine 20:640–649 5.5.29 Unspezifischer lumbaler Rückenschmerz („Kreuzschmerz“) z 20. Hansson TH, Hansson EK (2000) The effects of common medical interventions on pain, back function, and work resumption in patients with chronic low back pain. Spine 25:3055–3064 21. Hazard RG (1995) Spine update – functional restoration. Spine 20:2345–2348 22. Hofstee D (2002) Westindia sciatica trial: randomized controlled study of bed rest and physiotherapy for acute sciatica. J Neurosurg 96:45–49 23. Honeyman PT, Jacobs EA (1996) Effects of culture on back pain in Australian aboriginals. Spine 21:841–843 24. Indahl A, Velund L, Reikeraas O (1995) Good prognosis for low back pain when left untampered. Spine 20:473–477 25. Karjalainen K, Malmivaara A, van Tulder MW, Roine R, Jauhiainen M, Hurri H, Koes BW (2001) Multidisciplinary biopsychosocial rehabilitation for subacute low back pain in working-age adults. Spine 26:262–269 26. Keel P, Weber M, Roux E, Gauchat MH, Schwarz H, Jochum H (1998) Kreuzschmerzen: Hintergründe, Prävention, Behandlung – Basisdokumentation (BACK in time). FMH, Bern 27. Keel PJ, Perini Ch, Schütz-Petitjean D (1996) Chronifizierung von Rückenschmerzen – Hintergründe, Auswege. Eular, Basel 28. Koes BW, Assendelft WJ, van der Heijden GJ, Bouter LM, Knipschild PG (1991) Spinal manipulation and mobilisation for back and neck pain: a blinded review. BMJ 303:1298–1303 29. Koes BW, Bouter LM, Beckerman H, van der Heijden GJ, Knipschild PG (1991) Physiotherapy exercises and back pain: a blinded review. BMJ 302:1572–1576 30. Linton SJ, Bradley LA, Jensen I, Spangfort E, Sundell L (1989) The secondary prevention of low back pain: a controlled study with follow-up. Pain 36:197–207 31. Linton SJ, Hellsing AL, Anderson DJ (1993) A controlled study of the effects of an early intervention on acute musculoskeletal pain problems. Pain 54:353–359 32. Ljunggren AE, Weber H, Kogstad O, Thom E, Kirkesola G (1997) Effect of exercise on sick leave due to low back pain. A randomized, comparative, long-term study. Spine 22:1610–1616, discussion 1617 33. Malmivaara A, Hakkinen U, Aro T, Heinrichs ML, Koskenniemi L, Kuosma E, Lappi S, Paloheimo R, Servo C, Vaaranen V (1995) The treatment of acute low back pain – bed rest, exercises, or ordinary activity? N Engl J Med 332:351–355 34. Manniche C (1995) Assessment and exercise in low back pain. With special reference to the management of pain and disability following first time lumbar disc surgery. Dan Med Bull 42:301–313 35. McDonald I, Daly J, Jelink V, Panetta F, Gutman J (1996) Opening Pandora’s box: the unpredictability of reassurance by a normal test result. BMJ 313:329–332 36. McGuirk B, King W, Govind J, Lowry J, Bogduk N (2001) Safety, efficacy, and cost effectiveness of evidence-based guidelines for the management of acute low back pain in primary care. Spine 26:2615–2622 37. Meade TW, Dyer S, Browne W (1990) Low-back pain of mechanical origin: randomized comparison of chiropractic and hospital outpatient treatment. Eur J Chiropractic 38:92–107 38. Mitchell RI, Carmen GM (1990) Results of a multicenter trial using an intensive active exercise program for the treatment of acute soft tissue and back injuries. Spine 15:514–521 39. Nachemson AL (1994) Chronic pain – the end of the welfare state? Qual Life Res 3 (suppl 1):S11–S17 443 444 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 40. Onghena P, Van Houdenhove B (1992) Antidepressant-induced analgesia in chronic non-malignant pain: a meta-analysis of 39 placebo-controlled studies. Pain 49:205–219 41. Pfingsten M, Hildebrandt J, Leibing E, Franz C, Saur P (1997) Effectiveness of a multimodal treatment program for chronic low-back pain. Pain 73:77–85 42. Pincus T, Vlaeyen JW, Kendall NAS, Von Korff M, Kalauokalani DA, Reis S (2002) Cognitive-behavioral therapy and psychosocial factors in low back pain. Spine 27:E133–E138 43. Salerno S, Browning R, Jackson RP (2002) The effect of antidepressant treatment on chronic back pain. Arch Intern Med 162:19–24 44. Savage RA, Whitehouse GH, Roberts N (1997) The relationship between the magnetic resonance imaging appearance of the lumbar spine and low back pain, age, and occupation in males. Eur Spine J 6:106–114 45. Shekelle PG, Adams AH, Chassin MR, Hurwitz EL, Brook RH (1992) Spinal manipulation for low-back pain. Ann Intern Med 117:590–598 46. Sinclair SJ, Hogg Johnson SH, Mondloch MV, Shields SA (1997) The effectiveness of an early active intervention program for workers with soft-tissue injuries. The Early Claimant Cohort Study. Spine 22:2919–2931 47. Stankovic R, Johnell O (1995) Conservative treatment of acute low back pain. A 5-year follow-up study of two methods of treatment. Spine 20:469–472 48. Task Force on Pain in the Workplace of the IASP (1995) Back pain in the workplace – management of disability in nonspecific conditions. IASP Press, Seattle 49. Triano JJ, McGregor M, Hondras MA, Brennan PC (1995) Manipulative therapy versus education programs in chronic low back pain. Spine 20:948–955 50. Turk DC, Okifuji A (1998) Psychological approaches in pain management: what works? Curr Opin Rheumatol 11:547–552 51. Van den Hoogen HJ, Koes BW, van Eijk JT, Bouter LM, Deville W (1998) On the course of low back pain in general practice: a one year follow up study (see comments). Ann Rheum Dis 57:13–19 52. Van Tulder MW, Koes BW, Bouter LM (1997) Conservative treatment of acute and chronic nonspecific low back pain. A systematic review of randomized controlled trials of the most common interventions. Spine 22:2128–2156 53. Violinn E (1997) The epidemiology of low back pain in the rest of the world. Spine 22:1747–1754 54. Von Korff M (1994) Studying the natural history of back pain. Spine 19: 2041S–2046S 55. Waddell G (1987) A new clinical model for the treatment of low-back pain. Spine 12:632–644 56. Waddell G (1992) Biopsychosocial analysis of low back pain. Baillieres Clin Rheumatol 6:523–557 57. Waddell G (1996) Low back pain: a twentieth century health care enigma. Spine 21:2820–2825 58. Waddell G (1998) The Back Pain Revolution. Churchill Livingstone, Edinburgh 59. Waddell G, Feder G, McIntosh A, Lewis M, Hutchinson A (1996) Low back pain evidence review. Royal College of General Practitioners, London 60. Wahlgren DR, Atkinson JH, Epping Jordan JE, Williams RA, Pruitt SD, Klapow JC, Patterson TL, Grant I, Webster JS, Slater MA (1997) One-year follow-up of first onset low back pain. Pain 73:213–221 61. Weinstein SM, Herring SA, Derby R (1995) Contemporary concepts in spine care. Epidural steroid injections. Spine 20:1842–1846 5.5.30 Fibromyalgiesyndrom z 5.5.30 Fibromyalgiesyndrom (ICD-Nr. M 79.0) z Grundsätzliche Bemerkungen und Therapiestrategie Die Fibromyalgie ist eine chronische Schmerzkrankheit mit ausgedehnten muskuloskelettalen Schmerzen, erhöhter Schmerzempfindlichkeit und häufig auch begleitenden dysfunktionellen und psychischen Störungen, oft mit deutlicher Beeinträchtigung der Alltagaktivitäten, der Selbstaktivität und der Fähigkeit zur Krankheitsbewältigung [15]. Therapieziele sind die Besserung von Schmerzen, Schlafstörungen, Erschöpfung und anderen Symptomen, die Verbesserung von Selbstaktivität und Selbstmanagement [8] und evtl. die Therapie relevanter psychischer Störungen. Die Therapie der Fibromyalgie ist komplex, die Wirksamkeit oft gering und in vielen Bereichen unbefriedigend [5, 18]. Die Maßnahmen beziehen sich vor allem auf medikamentöse Strategien, Physiotherapie und edukative und evtl. psychotherapeutische Ansätze. Edukative Strategien stehen im Vordergrund [12]. z Medikamentöse Therapie Kontrollierte Studien liegen für Antidepressiva, nichtsteroidale Antirheumatika, Analgetika, Myotonolytika, Schlafmittel und Tranquilizer vor. Die meisten Studien wurden dabei vorwiegend plazebokontrolliert für Antidepressiva durchgeführt und hier wiederum an erster Stelle mit der Substanz Amitriptylin. z Nichtsteroidale Antirheumatika sind in den USA die am häufigsten eingesetzten Medikamente bei Fibromyalgie überhaupt [31]. Am häufigsten wird dabei wiederum Ibuprofen eingesetzt [24]. Ihre Verwendung wird kontrovers diskutiert. In plazebokontrollierten Studien mit Naproxen und Ibuprofen zeigten sich nur eine geringe Wirkung. Dyspeptische Beschwerden sind häufig. Entsprechend werden magenprotektive Substanzen in nahezu der Hälfte der Fälle mehr oder weniger regelmäßig von Patienten mit Fibromyalgie eingenommen [31]. Die Wirkung von Coxiben wurde bisher nicht untersucht. z Analgetika werden entsprechend dem Hauptmerkmal der Erkrankung, dem Schmerz, häufig eingesetzt. Zu Parazetamol gibt es keine plazebokontrollierten Studien. Tramadol ist einzeln [4] oder in Kombination [3] effektiv in der Behandlung der Schmerzen bei Fibromyalgiesyndrom. Die intravenöse Gabe von Lignocain und Lidocain bei Patienten mit Fibromyalgie ergab einen signifikanten Effekt auf die Scores für Schmerz und Stimmung [5]. z Unter den Muskelrelaxanzien erwies sich Cyclobenzaprin in mehreren plazebokontrollierten Studien in den USA als wirksam gegen Schmerzen [2]. Einzelbeobachtungen mit positiver Wirkung bei Fibromyalgie liegen für das Muskelrelaxans Tolperison vor. 445 446 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Trizyklische Antidepressiva, insbesondere Amitryptilin [13] haben in kontrollierten Studien bei 25–45% der Patienten eine klinisch bedeutsame Besserung gezeigt (Dosierung zwischen 25–50 mg/Tag, in der Regel abendlich eingenommen). Ein Startdosis von 5–10 mg ist empfehlenswert. Ein Nachteil ist das gelegentliche Auftreten bzw. die Zunahme von Müdigkeit, Mundtrockenheit, Obstipation und Gewichtzunahme. Andere Antidepressiva, wie Trimipraminmesilat oder Mirtazapin scheinen ebenfalls wirksam zu sein. z Serotonin-Reuptake-Hemmer (SSRI). Fluoxetin (20 mg morgens) alleine [30] oder in Kombination mit Amitryptilin (25 mg abends) [14] war in kontrollierten Studien wirksam bei Schmerzen und Depression bei Fibromyalgie. Die Ergebnisse mit Citalopram sind widersprüchlich. Der duale Serotoninund Noradrenalin-Reuptake-Hemmer (SNRI) Duloxetin (2-mal 60 mg) war in plazebokontrollierten Studien wirksam bei Schmerzen [1], ebenso Milnacipran [27, 29]. z Die 5-HT-3-Rezeptor-Antagonisten Ondansetron und Tropisetron scheinen wirksam zu sein. Tropisetron wurde deshalb in einer großen multizentrischen Studie bei über 400 Patienten mit Fibromyalgie in 3 verschiedenen Dosen 5, 10 und 15 mg oral gegenüber Plazebo geprüft [11]. Für die niedrigste Dosierung 5 mg wurde eine signifikante Wirkung beschrieben. Eine erste offene Studie mit 5 mg parenteraler Gabe von Tropisetron über 5 Tage ergab deutliche Effekte auf die Variable Schmerz [26]. z Antikonvulsiva. Pregabalin kann sich auf Schmerzen bei Fibromyalgie günstig auswirken. In einer plazebokontrollierten Studie reduzierte Pregabalin in einer Dosis von 450 mg den durchschnittlichen Schweregrad von Schmerzen [3, 9]. z Benzodiazepine werden in den USA bei Fibromyalgie häufig eingenommen (40%). Zu der Substanzgruppe gibt es keine ausreichenden klinischen Studien. Die Untersuchung des Benzodiazepins Alprazolam in Kombination mit Ibuprofen doppelblind und plazebokontrolliert ergab eine signifikante Reduktion der Anzahl der Hauptschmerzpunkte [24]. Eine weitere Studie, die das Benzodiazepin Bromazepam in Kombination mit Tenoxicam verwendete [23], fand wiederum randomisiert doppelblind und plazebokontrolliert nur sehr geringe Effekte verglichen mit Plazebo in Bezug auf die Dimension des Schmerzes und anderer Symptome der Fibromyalgie. In der ambulanten Dauertherapie sollten sie wegen des Suchtpotenzials jedoch streng vermieden werden. z Schlafmittel wie Chlorpromazin, das in einer Dosis von 100 mg als wirkungsam geprüft wurde, oder Zolpidem und Zopiclon verbesserten den Schlaf bei Fibromyalgie [21]. Wegen der Gefahr der Gewöhnung ist nur der kurz dauernde Einsatz sinnvoll. z Lokalanästhetika. Die intravenöse Gabe von Lignocain und Lidocain bei Patienten mit Fibromyalgie ergab einen signifikanten Effekt auf die Scores für Schmerz und Stimmung [27]. 5.5.30 Fibromyalgiesyndrom z z Nichtmedikamentöse Therapien z Durch Aerobic-Fitness-Training als kardiovaskuläres Ausdauertraining [7] haben sich in mehreren kontrollierten Studien bei einem Teil der Patienten die körperliche Leistungsfähigkeit, Schmerzen und Schmerzempfindlichkeit verbessert. Patienten sollten angeleitet werden die Belastung langsam zu steigern, um nicht durch Schmerzen und Erschöpfung die Trainingsmotivation zu mindern. Empfohlen wird ein Fitnesstraining von 30 Minuten mindesten 3-mal pro Woche. Auch Krafttraining zeigt positive Effekte [16]. z Krankengymnastik mit Anleitung zum Selbstüben bezieht sich vor allem auf Dehnungsübungen, Übungen zur Verbesserung der Körperwahrnehmung, Übungen zur Muskelkräftigung und Haltungsverbesserung. Studien wurden überwiegend zu Komplexprogrammen durchgeführt (Rehabilitation, Sebstmanagementtraining), nicht zu Einzelmaßnahmen [19]. z Lokale oder Ganzkörperwärmeanwendungen werden von den meisten als vorrübergehend schnerzlindernd angegeben [10]. Einzelne Patienten reagieren jedoch mit Schmerzverstärkung. Kontrollierte Studien zeigen positive Effekte der Balneotherapie [22]. z Schmerzlindernde Wirkungen von Ganzkörperkälteanwendungen (Kältekammer) wurden in einer Studie veröffentlicht [25]. Darüber hinaus wird die lokale Applikation von Kälte, z. B. als Spray, im Bereich von lokalen Schmerzen angewendet. z Klassische Massagen in milder Form haben bei Patienten ebenfalls eine hohe Präferenz. Sie sind Bestandteil zahlreicher multidisziplinärer Behandlungskonzepte. Als Einzelmaßnahme bei Fibromyalgie wurden sie nicht ausreichend untersucht. z Für die klassische Akupunktur wurden positive Effekte angegeben [20]. Bei allen bislang durchgeführten Studien hinsichtlich therapeutischer Effekte beim Fibromyalgiesyndrom ist immer wieder die relativ hohe Rate von Plazeboeffekten auffällig. Plazeboeffekte sind in bis zu 40% der Fälle zu beobachten. Unter diesem Gesichtspunkt müssen alle sog. alternativen Methoden kritisch bewertet werden. z Psychotherapie Kontrollierte Studien bzgl. Psychotherapie liegen vor für kognitiv-verhaltenstherapeutische Ansätze [28] insbesondere im Sinne der psychologischen Schmerzbewältigung. Die bislang durchgeführten verhaltenstherapeutischen Programme für Fibromyalgiepatienten waren in der Regel Teile eines multidisziplinären Programms, die neben diesen psychologischen Verfahren der Schmerzbewältigung vor allem auch physikalische Therapie und Patienteninformationsprogramme beinhalteten [17]. Gruppentherapie wie progressive Muskelentspannung, die sog. geführte Imagination, Entspannungstherapien kombiniert mit EMG-Biofeedback, psychologische Schmerzbewältigungsprogramme erscheinen aufgrund von Erfah- 447 448 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern rungen und Untersuchungen im Rahmen von Studien mit multidiszipinären Behandlungsprogrammen sinnvoll [6]. Psychotherapie im Sinne aufdeckender Therapie wird von den Patienten häufig abgelehnt, entsprechende Therapieversuche vorzeitig abgebrochen. Dennoch sollte in Einzelfällen bei stark im Vordergrund stehender Depression die nervenärztliche/psychologische Mitbetreuung angestrebt werden (s. Kap. 11). z Obsolete Therapien Nicht angewendet werden sollen systemische oder lokale Glukokortikoide. Eine Wirksamkeit konnte nicht nachgewiesen werden. z In Erprobung befindliche Therapieformen Studien zur Substitution von Hormonen wegen niedriger Serumkonzentrationen (Wachstumshormon, Schilddrüsenhormone, Dehydroepiandrosteron) oder gestörter Regulation waren bisher nicht ausreichend erfolgreich, um die Substitution generell zu empfehlen. z Prophylaktische Maßnahmen Eine Prophylaxe beim FMS existiert bislang nicht. z Verhaltenshinweise für den Patienten Die Einbeziehung des Patienten mittels Information und Schulung in das Behandlungskonzept entscheidet bei FMS oft über Erfolg oder Misserfolg der Therapie. Die Nennung und Erläuterung der Diagnose ist insbesondere bei Patienten, die verunsichert und hilflos sind, ein erster wichtiger Schritt. Hilfreich ist eine möglichst schriftlich fixierte Patienteninformation, welche die Schmerzen des Patienten glaubhaft anerkennt bzw. ein Erklärungsmuster für diese mitteilt, dabei aber gleichzeitig auf den prinzipiell benignen Charakter der Störung auch in der Prognose verweist. Letzteres ist eine häufig wiederkehrende Aufgabe des Arztes, um durch rationalisierende Argumentation den diffusen Ängsten der Patienten, an einer schwerwiegenden somatischen Erkrankung zu leiden, zu begegnen. Neben der Patienteninformation ist die Patientenschulung ein weiterer allgemeiner Aspekt der Therapie, was alle Maßnahmen in eigenverantwortlicher Initiative, wie Fragen des Lebensstils, häusliche Übungsprogramme, einschließt. Verschiedene Patientenschulungsprogramme (s. Kap. 17) haben sich in Bezug auf Beschwerden und Selbsteinschätzung der Funktionskapazität als wirksam erwiesen. 5.5.30 Fibromyalgiesyndrom z z Literatur 1. Arnold LM, Rosen A, Pritchett YL, D’Souza DN, Goldstein DJ, Iyengar S, Wernicke JF (2005) A randomized, double-blind, placebo-controlled trial of duloxetine in the treatment of women with fibromyalgia with or without major depressive disorder. Pain 119:5–15 2. Bennett RM, Gatter RA, Campbell SM, Andrews RP, Clark SR, Scarola JA (1988) A comparison of cyclobenzaprine and placebo in the management of fibrositis. A double-blind controlled study. Arthritis Rheum 31:1535–1542 3. Bennett RM, Kamin M, Karim R, Rosenthal N (2003) Tramadol and acetaminophen combination tablets in the treatment of fibromyalgia pain: a double-blind, randomized, placebo-controlled study. Am J Med 114:537–545 4. Biasi G, Manca S, Manganelli S, Marcolongo R (1998) Tramadol in the fibromyalgia syndrome: a controlled clinical trial versus placebo. Int J Clin Pharmacol Res 18:13–19 5. Brückle W, Lautenschlager J (1995) Die Therapie der generalisierten Tendomyopathie (Fibromyalgie-Syndrom). Akt Rheumatol 20:13–19 6. Burckhardt CS (2006) Multidisciplinary approaches for management of fibromyalgia. Curr Pharm Des 12:59–66 7. Busch A, Schachter CL, Peloso PM, Bombardier C (2002) Exercise for treating fibromyalgia syndrome. Cochrane Database Syst Rev CD003786 8. Cedraschi C, Desmeules J, Rapiti E, Baumgartner E, Cohen P, Finckh A, Allaz AF, Vischer TL (2004) Fibromyalgia: a randomised, controlled trial of a treatment programme based on self management. Ann Rheum Dis 63:290–296 9. Crofford LJ, Rowbotham MC, Mease PJ, Russell IJ, Dworkin RH, Corbin AE, Young JP Jr, LaMoreaux LK, Martin SA, Sharma U (2005) Pregabalin for the treatment of fibromyalgia syndrome: results of a randomized, double-blind, placebo-controlled trial. Arthritis Rheum 52:1264–1273 10. Donmez A, Karagulle MZ, Tercan N, Dinler M, Issever H, Karagulle M, Turan M (2005) SPA therapy in fibromyalgia: a randomised controlled clinic study. Rheumatol Int 26:168–172 11. Farber L, Stratz T, Bruckle W, Spath M, Pongratz D, Lautenschlager J, Kotter I, Zoller B, Peter HH, Neeck G et al (2000) Efficacy and tolerability of tropisetron in primary fibromyalgia – a highly selective and competitive 5-HT3 receptor antagonist. German Fibromyalgia Study Group. Scand J Rheumatol Suppl 113: 49–54 12. Goldenberg D (2006) Treatment of fibromyalgia in adults. Uptodate 14.3 13. Goldenberg DL, Felson DT, Dinerman H (1986) A randomized, controlled trial of amitriptyline and naproxen in the treatment of patients with fibromyalgia. A randomized, controlled trial of amitriptyline and naproxen in the treatment of patients with fibromyalgia. Arthritis Rheum 29:1371–1377 14. Goldenberg D, Mayskiy M, Mossey C, Ruthazer R, Schmid C (1996) A randomized, double-blind crossover trial of fluoxetine and amitriptyline in the treatment of fibromyalgia. Arthritis Rheum 39:1852–1859 15. Goldenberg DL, Burckhardt C, Crofford L (2004) Management of fibromyalgia syndrome. JAMA 292:2388–2395 16. Jones KD, Burckhardt CS, Clark SR, Bennett RM, Potempa KM (2002) A randomized controlled trial of muscle strengthening versus flexibility training in fibromyalgia. J Rheumatol 29:1041–1048 17. Keel PJ, Bodoky C, Gerhard U, Muller W (1998) Comparison of integrated group therapy and group relaxation training for fibromyalgia. Clin J Pain 14:232–238 449 450 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern 18. Lautenschlager J (2000) Present state of medication therapy in fibromyalgia syndrome. Scand. J Rheumatol Suppl 113:32–36 19. Lemstra M, Olszynski WP (2005) The effectiveness of multidisciplinary rehabilitation in the treatment of fibromyalgia: a randomized controlled trial. Clin J Pain 21:166–174 20. Mayhew E, Ernst E (2007) Acupuncture for fibromyalgia – a systematic review of randomized clinical trials. Rheumatology Oxford 46(5):801–804 21. Moldofsky H, Lue FA, Mously C, Roth-Schechter B, Reynolds WJ (1996) The effect of zolpidem in patients with fibromyalgia: a dose ranging, double blind, placebo controlled, modified crossover study. J Rheumatol 23:529–533 22. Offenbacher M, Stucki G (2000) Physical therapy in the treatment of fibromyalgia. Scand J Rheumatol Suppl 113:78–85 23. Quijada-Carrera J, Valenzuela-Castano A, Povedano-Gomez J, Fernandez-Rodriguez A, Hernanz-Mediano W, Gutierrez-Rubio A, de la Iglesia-Salgado JL, Garcia-Lopez A (1996) Comparison of tenoxicam and bromazepan in the treatment of fibromyalgia: a randomized, double-blind, placebo-controlled trial. Pain 65: 221–225 24. Russell IJ, Fletcher EM, Michalek JE, McBroom PC, Hester GG (1991) Treatment of primary fibrositis/fibromyalgia syndrome with ibuprofen and alprazolam. A double-blind, placebo-controlled study. Arthritis Rheum 34:552–560 25. Samborski W, Stratz T, Sobieska M, Mennet P, Muller W, Schulte-Monting J (1992) Intraindividual comparison of whole body cold therapy and warm treatment with hot packs in generalized tendomyopathy. Z Rheumatol 51:25–30 26. Samborski W, Stratz T, Lacki JK, Klama K, Mennet P, Muller W (1996) The 5-HT3 blockers in the treatment of the primary fibromyalgia syndrome: a 10-day open study with Tropisetron at a low dose. Mater Med Pol 28:17–19 27. Sorensen J, Bengtsson A, Backman E, Henriksson KG, Bengtsson M (1995) Pain analysis in patients with fibromyalgia. Effects of intravenous morphine, lidocaine, ketamine. Scand J Rheumatol 24:360–365 28. Thieme K, Gromnica-Ihle E, Flor H (2003) Operant behavioral treatment of fibromyalgia: a controlled study. Arthritis Rheum 49:314–320 29. Vitton O, Gendreau M, Gendreau J, Kranzler J, Rao SG (2004) A double-blind placebo-controlled trial of milnacipran in the treatment of fibromyalgia. Hum Psychopharmacol 19 (suppl 1):S27–S35 30. Wolfe F, Cathey MA, Hawley DJ (1994) A double-blind placebo controlled trial of fluoxetine in fibromyalgia. Scand J Rheumatol 23:255–259 31. Wolfe F, Anderson J, Harkness D, Bennett RM, Caro XJ, Goldenberg DL, Russell IJ, Yunus MB (1997) A prospective, longitudinal, multicenter study of service utilization and costs in fibromyalgia. Arthritis Rheum 40:1560–1570 5.5.31 Osteoporose z 5.5.31 Osteoporose (ICD-Nr. M 80, M 81) z Grundsätzliche Bemerkungen zur Therapiestrategie Der Osteoporosepatient leidet an chronischen Rückenschmerzen, die im Verlauf mit wechselnder Intensität exazerbieren. Ziel der Behandlung ist es Schmerzen zu beseitigen, Mobilität und Aktivität im Alltag zu erhalten und weitere Frakturen zu verhindern. Die Behandlungsstrategie besteht aus einer Reihe allgemeiner Maßnahmen (Basismaßnahmen), einer konsequenten Schmerztherapie, der medikamentösen antiosteoporotischen Therapie und evtl. anderer Maßnahmen. Eine ausführliche Information und Beratung mit psychosozialer Betreuung der Patienten ggf. in einer qualifizierten Selbsthilfegruppe ist wesentlich. Dabei müssen die beiden Hauptziele der Therapie Schmerzbekämpfung und Vermeidung weiterer Frakturen, deutlich herausgearbeitet werden. Risikofaktoren der Osteoporose (s. Kap. 3.35) sind, sofern dies möglich ist, zu vermindern oder zu beseitigen (sekundärprophylaktische Maßnahmen s. u.). Bei der glukokortikoidinduzierten Osteoporose ist außerdem auf eine ausreichende Kontrolle der Krankheitsaktivität und Einsparung von systemischen Glukokortikoiden durch lokale Glukokortikoidapplikation oder Basistherapeutika wesentlich. Das Vorgehen ist in der Leitlinie zur „Prophylaxe, Diagnostik und Therapie der Osteoporose bei Frauen ab der Menopause, bei Männern ab dem 60. Lebensjahr“ und der „glukokortikoidinduzierten Osteoporose“ beschrieben (www.lutherhaus.de/osteo/leitlinien-dvo/index.php). Medikamentöse Therapie z Medikamentöse Schmerztherapie. Bei Frakturen sind zur medikamentösen Schmerztherapie nach dem WHO-Schema verschiedene Analgetika geeignet. Die erste Stufe der Schmerztherapie beinhaltet die Gabe von Azetylsalizylsäure, Parazetamol oder Metamizolnatrium bzw. auch Kombinationen mit Kodein oder Muskelrelaxanzien. Ebenso kann primär mit einem nichtsteroidalen Antirheumatikum oder Opioiden behandelt werden. Oft ist bei chronischem Osteoporoseschmerz eine Langzeittherapie mit diesen Medikamenten nötig. Zu beachten ist, dass schmerzbedingte Immobilität zur Osteoporoseprogredienz beiträgt und daher nicht aus Angst vor Nebenwirkungen an Analgetika gespart werden sollte. Subkutanen Gaben von Kalzitonin können zur Einsparung oder rascheren Reduktion der zentral wirksamen Analgetika beitragen. z Medikamentöse antiosteoporotische Therapie. Zur Vermeidung weiterer Frakturen durch medikamentöse Therapie muss der Knochenabbau (Hemmung der Osteoklasten) gehemmt und der Aufbau von Knochensubstanz (Stimulierung der Osteoblasten) gefördert werden. 451 452 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern Tabelle 1. Übersicht über die therapeutischen Möglichkeiten zur positiven Beeinflussung von Kalziumbilanz und Knochenumbau Kalziumbilanz z Konsum kalziumreicher Nahrung, orale Kalziumsupplemente z Vitamin D3, aktive Vitamin-D-Metabolite z Thiaziddiuretika, Kaliumzitrat Knochenumbau z Bisphosphonate z Strontium-Ranelat z Monofluorphosphat, Natriumfluorid z Raloxifen, Östrogene z Anabolika z Teriparatid z Kalzitonine Tabelle 2. Empfehlungen für eine spezifische medikamentöse Therapie nach DVO-Leitlinien 2006 Ohne WK-Fraktur bei T-Wert (nur anwendbar auf DXA-Werte) Lebensalter (Jahre) Frau Mann –2,0 bis –2,5 –2,5 bis –3,0 –3,0 bis –3,5 –3,5 bis –4,0 <-4,0 50–60 60–70 nein nein nein nein ja 60–65 70–75 nein nein nein ja ja 65–70 75–80 nein nein ja ja ja 70–75 80–85 nein ja ja ja ja ja ja ja ja ja > 75 > 85 Mit WK-Fraktur Ja – rasche Therapie wichtig, da hohes Folgerisiko für WK-Frakturen Die verschiedenen Möglichkeiten zur Beeinflussung von Kalzium- und Knochenbilanz sind in Tabelle 1 aufgelistet. Bei jedem Osteoporosetherapieschema sollte eine optimale Kalziumzufuhr sichergestellt sein. Kombiniert aus diätetischer Zufuhr und Supplementen sollte eine Aufnahme von 1000–1500 mg/Tag Kalzium erreicht werden. Kleine Dosen von Vitamin D (400–800 Einheiten/Tag) können die Resorption dieser Kalziumgaben verbessern. Dies gilt vor allem im höheren Lebensalter. Bei nachgewiesener Hyperkalzurie kann diese durch Thiaziddiuretika bzw. nach neueren Studien auch durch Kalziumzitrat auf Normalwerte gesenkt werden. Kann keine deutliche Verminderung des Frakturrisikos alleine durch Basismaßnahmen oder durch Therapie von Ursachen einer sekundären Osteoporose erwartet werden, ist entsprechend der Knochendichtewerte eine medikamentöse Therapie erforderlich (Tabelle 2). Die Therapiestrategie muss stets indivi- 5.5.31 Osteoporose z duell geplant werden, unter Berücksichtigung von Alter, Beschwerdebild, bisherigen Therapien sowie eigener Erfahrung des Therapeuten. Bei Vorliegen mehrerer Risikofaktoren wie periphere Fraktur, Schenkelhalsfraktur des Elternteils, Nikotinkonsum, multiple Stürze oder Immobilität wird eine maximal um einen T-Wert erhöhte Therapieschwelle empfohlen. In Abhängigkeit von der klinischen Gesamtsituation ist eine maximal um einen T-Wert niedrigere Therapieschwelle möglich. Bei Frauen ist eine Verminderung von Wirbelkörperfrakturen nachgewiesen durch Alendronat, Ibandronat, Risedronat, Strontium-Ranelat, Östrogene, Raloxifen und Teriparatid, eine Verminderung von peripheren Frakturen durch Alendronat, Risedronat, Strontium-Ranelat und Teriparatid. Bei Männern ist eine Verminderung von Wirbelkörperfrakturen nachgewiesen durch Alendronat. Weitere Medikamente, die zur Behandlung der Osteoporose zugelassen sind, haben einen niedrigeren Evienzgrad in Bezug auf eine Verminderung von Wirbelkörperfrakturen. Sie werden dann eingesetzt, wenn Unverträglichkeiten gegen die genannten Präparate mit Empfehlungsgrad A bestehen. Hierzu zählen: Alfakalzidol, Kalzitonin, Etidronat, Fluoride und Nandrolon-Decanoat. Die Verminderung peripherer Frakturen ist nur für Alfakalzidol ausreichend belegt. Es gibt derzeit keine Belege für eine präferenzielle fraktursenkende Wirkung der aufgeführten Medikamente bei bestimmten Patientengruppen. Die Auswahl der Substanzen orientiert sich vor allem an Kontraindikationen und bekannten Unverträglichkeiten. Östrogene sollten in der Regel nur dann eingesetzt werden, wenn anderweitig nicht ausreichend zu behandelnde vasomotorische Beschwerden der Haupteinnahmegrund sind. Bei Patienten unter sysemischer Glukokortikoidtherapie sollen eine Prophylaxe mit 1,0–1,5 g Kalzium und 400–1200 E Vitamin D erhalten. Bei Patienten, die mehr als 3 Monate systemische Glukokortikoide einnehmen oder eine osteoporotische Fraktur aufweisen, soll eine Knochendichtemessung durchgeführt werden. Liegt der T-Wert < –1,5 ist bei postmenopausalen Frauen eine medikamentöse antiosteoporotische Therapie mit Alendronat, Risedronat oder zyklisch verabreichtem Etidronat erforderlich, bei prämenopausalen Frauen und bei Männern wird eine allgemeine Prophylaxe mit Kalzium und Vitamin D empfohlen. Für einige weitere antiosteoporotisch wirksame Medikamente ist die Hemmung der Abnahme der Knochendichte gesichert, nicht jedoch die der Frakturrate. Die Therapie mit einer dieser Substanzen sollte mindesten 3–5 Jahre erfolgen mit anschließender Reevaluation. Verlaufskontrollen der klinischen Befunde sollten 3–6 Monate nach Therapieeinleitung, danach 12-monatlich erfolgen. Laborkontrollen sind bei Auffälligkeiten im Basislabor notwendig oder bei begründetem Verdacht auf Änderungen. Bei Verdacht auf neue Frakturen (Größenabnahme > 2 cm, neu aufgetretene Schmerzen) sollte eine Röntgenaufnahme erfolgen. Die erneute Osteodensitometrie ist nicht vor einem Jahr sinnvoll. 453 454 z 5.5 Therapieempfehlungen zu speziellen Krankheitsbildern z Nichtmedikamentöse Therapie Zur Schmerzminderung sind neben der medikamentösen Schmerztherapie physikalische Therapiemaßnahmen, evtl. auch eine Stabilisierung durch eine wirbelsäulenaufrichtende Orthese, geeignet. Bei therapieresistenten Schmerzen durch Wirbelkörperfrakturen von mehr als 3-monatiger Dauer sollte die Indikation zur Vertebro- bzw. Kyphoplastie geprüft werden. Eine schnellstmögliche Mobilisierung ist wichtig mit Physiotherapie und Funktionstraining. Dabei sollte der Schwerpunkt auf der Kräftigung der Rücken- und Bauchmuskulatur liegen („Muskelkorsett“ für die Wirbelsäule). Eine Komplextherapie mit Information und Schulung, Ernährungsberatung, physikalischer Therapie, Krankengymnastik und Ergotherapie im Rahmen einer ambulanten oder stationären Rehabilitation ist insbesondere bei Osteoporose mit proximaler Femurfraktur zu empfehlen. Die physikalische Therapie wird von Osteoporosepatienten individuell sehr unterschiedlich toleriert und akzeptiert, so dass im Einzelfall erprobt werden muss, was als schmerzlindernd, entspannend oder wohltuend empfunden wird. Prinzipiell sollte jedoch stets von passiven Anwendungen zu aktivierenden Therapien übergegangen werden. Regelmäßige Gymnastik, initial unter Anleitung und im weiteren Verlauf täglich selbstständig zu Hause oder auch in Selbsthilfegruppen durchgeführt, ist besonders wichtig. Eine kurzzeitige Versorgung mit einem elastischen Mieder kann im Rahmen der Schmerztherapie indiziert sein, eine langzeitige Entlastung der Wirbelsäule führt zu Muskelatrophie und Progredienz der Osteoporose. z Prophylaktische Maßnahmen Risikofaktoren der Osteoporose (s. Kap. 3.35) sind, sofern dies möglich ist, zu vermindern oder zu beseitigen. Hierzu zählen Faktoren der Ernährung (Beseitigung von Untergewicht, kalziumreiche Ernährung, ggf. Supplementierung mit 1,0–1,5 g Kalzium pro Tag; Vitamin D 400–1200 E/Tag, ausreichend Sonnenlichtexposition) und des Lebensstils (ausreichend körperliche Aktivität, Nikotinkarenz). Insbesondere das Sturzrisiko und damit das Frakturrisiko muss durch komplexe Maßnahmen (Beseitigung von Barrieren, Verbesserung von Muskelkraft und Koordination, Überprüfung der Arzneimitteleinnahme) vermindert werden. In Altenheimen konnte durch Tragen von Hüftprotektoren die Häufigkeit von proximalen Femurfrakturen gesenkt werden. Gymnastik, Gangschulung und Maßnahmen zur Sturzprophylaxe sind unterstützend wirksam. z Verhaltenshinweise für Patienten Aus den dargestellten Möglichkeiten der Osteoporosetherapie und -prävention sind folgende Verhaltensratschläge für Risikofälle oder Patienten mit Osteoporose abzuleiten: 5.5.31 Osteoporose z z regelmäßige körperliche Aktivität (Gymnastik, Sport usw.), z kalziumreiche Ernährung, evtl. Kombination mit Kalziumsupplementen und Vitamin D, z Diätanpassung zum Vermeiden erhöhter intestinaler oder renaler Kalziumverluste, z Reduktion von Alkohol- und Nikotinkonsum, z Vermeidung von Stürzen, gezielte Therapie von Sturzursachen (z. B. Hypertonie, Hypotonie), z Vorstellung beim Arzt bei neu aufgetretenen oder zunehmenden Rückenschmerzen. z Literatur 1. Compston J (2005) Prevention of vertebral fractures by strontium ranelate in postmenopausal women with osteoporosis. Osteoporos Int 16 (suppl 1):S4–6:S4–S6 2. O’Neill S, MacLennan A, Bass S, Diamond T, Ebeling P, Findlay D, Flicker L, Markwell A, Nowson C, Pocock N, Sambrook P, Singh MF (2004) Guidelines for the management of postmenopausal osteoporosis for GPs. Aust Fam Physician 33:910–919 3. Pfeilschifter J (2005) Postmenopausal and steroid-induced osteoporosis guidelineorientated prevention and treatment. Internist (Berl) 46 (suppl 1):S31–7:S31–S37 4. Ringe JD (1995) Osteoporose. Thieme, Stuttgart New York www.lutherhaus.de/osteo/leitlinien-dvo/index.php 455 5.6 Radiosynoviorthese z 5.6 Radiosynoviorthese Die intraartikuläre Injektion von b-strahlenden Radionukliden (Radiosynoviorthese, RSO) mit 90-Yttrium, 186-Rhenium oder 169-Erbium ist ein lokales antientzündliches Therapieverfahren. Ziel der Behandlung ist eine Minderung der Intensität und Rezidivhäufigkeit der Synovialitis. Die Radiosynoviorthese wird oft in Kombination mit kristallinen Glukokortikosteroiden angewendet. Es besteht ein Mangel an randomisierten, kontrollierten Studien mit standardisierten Untersuchungsmethoden und Outcomes. z Indikationen Indikationen für die Radiosynoviorthese mittlerer und größerer Gelenke mit 186-Rhenium und 90-Yttrium sind chronische Synovialitiden bei z rheumatoider Arthritis, z Spondyloarthritis, z pigmentierter villonodulärer Synovialitis (nach erfolgter Operation), z Hämophilie mit Arthropathie (zur Blutungsprophylaxe). Zur Radiossynoviorthese kleiner Gelenke (MCP-, PIP, DIP- und MTP-Gelenke) mit rezidivierenden Gelenkergüssen wird 169-Erbium verwendet bei z rheumatoider Arthritis, z seronegativer Polyarthritis. Die Radiosynoviorthese soll dann eingesetzt werden, wenn eine vorausgegangene 3- bis 6-monatige systemische medikamentöse Therapie und intraartikuläre Glukokortikoidinjektionen zu keiner ausreichenden Besserung geführt haben. Nach vorausgegangener Synovektomie (insbesondere bei villonodulärer Synovitis) verbessert die nachfolgende Radiosynoviorthese das Behandlungsergebnis. Der Stellenwert der RSO bei aktivierten Arthrosen ist nicht ausreichend geklärt und wird unterschiedlich bewertet. z Kontraindikationen Als Kontraindikationen für Radiosynoviorthesen gelten Schwangerschaft und Laktation. Bei massivem Hämarthros, Frakturen der Gelenke, rupturierter Poplitealzyste oder rupturierter Rotatorenmanchette sowie bei fortgeschrittenen 457 458 z 5 Medikamentöse Therapie entzündlichen Gelenkdestruktionen sollte die RSO nicht durchgeführt werden wegen der Gefahr des unkontrollierten Abstroms des Radionuklids. Die Gelenkinjektion sollte bei Infektion an der Injektionsstelle nicht durchgeführt werden. Relative Kontraindikation für die Radiosynoviorthese ist jugendliches Lebensalter der Patienten. z Durchführung Nach Punktion des Gelenks entsprechend den Empfehlungen der Deutschen Gesellschaft für Rheumatologie und der Deutschen Gesellschaft für Orthopädie und Unfallchirurgie und Sicherung der intraartikulären Lage der Punktionskanüle wird das Radionuklid injiziert und anschließend zur Vermeidung von Stichkanalnekrosen eine 0,9ige Kochsalzlösung oder ein Glukokortikoidpräparat injiziert. Nach anschließender passiver Bewegung des Gelenks zur Verteilung des Radionuklids werden die behandelten Gelenke für 48 Stunden ruhig gestellt, um die Wirkung der Radionuklide zu erhöhen und die Rate möglicher Nebenwirkungen zu senken. Zur Therapie großer Gelenke (Hüften, Knie) eignen sich Radionuklide mit größerer Reichweite (90 Yttrium), mittelgroße Gelenke (Schultern, Ellbogen, Sprunggelenke) werden vorwiegend mit 186-Rhenium behandelt, kleine Gelenke mit 169-Erbium (www.eanm.org). z Erfolgsaussichten In Abhängigkeit vom behandelten Gelenk, der Grunderkrankung und der Vorschädigung des Gelenks weist die Synoviorthese in ca. 50–80% der Fälle gute bis sehr gute Langzeiteffekte im Hinblick auf Schmerzreduktion und antientzündliche Wirkung auf, die häufig bis zu mehreren Jahren anhalten. Einzelne Studien zeigen einen Rückgang der synovitischen Veränderungen im MRT, mit der Sonografie und der Skelettszintigrafie, eine verminderte Destruktion im Röntgenbild. Dies gilt in erster Linie für die rheumatoide Arthritis. Wiederholungsbehandlungen werden frühestens nach 3 Monaten empfohlen, wenn die erste RSO eine Besserung zeigte. z Literatur 1. Bernau A, Heeg P (2003) Intraarticular punctures and injections: indications – prevention of infection – technique – complications. Orthopade 32:548–569 2. Fischer M, Modder G (2002) Radionuclide therapy of inflammatory joint diseases. Nucl Med Commun 23:829–831 3. Kampen WU, Voth M, Pinkert J, Krause A (2007) Therapeutic status of radiosynoviorthesis of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications. Rheumatology (Oxford) 46:16–24 4. Kerschbaumer F, Kandziora F, Herresthal J, Hertel A, Hor G (1998) Combined arthroscopic and radiation synovectomy in rheumatoid arthritis. Orthopade 27: 188–196 5.6 Radiosynoviorthese z 5. Kresnik E, Mikosch P, Gallowitsch HJ, Jesenko R, Just H, Kogler D, Gasser J, Heinisch M, Unterweger O, Kumnig G, Gomez I, Lind P (2002) Clinical outcome of radiosynoviorthesis: a meta-analysis including 2190 treated joints. Nucl Med Commun 23:683–688 6. Rau R, Schütte H (1983) Ergebnisse der Radiosynoviorthese mit Yttrium 90 bei chronischen Synovitiden – Eine prospektive Langzeituntersuchung. Teil 1: Gesamtergebnis und Einfluß lokaler Faktoren. Z Rheumatol 42:265–270 7. Seidel W (2006) Radiosynoviorthesis. Z Rheumatol 65:239–244 8. van der Zant FM, Jahangier ZN, Moolenburgh JD, Swen WA, Boer RO, Jacobs JW (2006) Clinical effect of radiation synovectomy of the upper extremity joints: a randomised, double-blind, placebo-controlled study. Eur J Nucl Med Mol Imaging www.eanm.org 459 460 z 5 Medikamentöse Therapie 5.7 Medikamentöse Schmerztherapie Die medikamentöse Schmerztherapie des rheumatischen Formenkreises stützt sich im Wesentlichen auf zwei verschiedene Säulen: Analgetika und die als Basistherapeutika bezeichneten Remissionsinduktoren. Die Analgetika werden weiter unterteilt in Opioide und Nichtopioidanalgetika, z. B. nicht-steroidale Antirheumatika (NSAR). z Schmerzdokumentation Die Dokumentation chronischer Schmerzzustände dient neben der Verlaufsdarstellung der „Übersetzung“ eines objektiv nicht messbaren Zustandes. Sie ist Voraussetzung für die Verständigung zwischen Patient und Therapeut. Schmerzen sind als subjektiver Zustand schwer zu erfassen. Erst eine exakte Dokumentation ermöglicht eine sinnvolle Therapieplanung. Da Schmerzen aber oftmals ein interdisziplinäres Problem darstellen, ermöglicht die Dokumentation auch eine funktionierende Kommunikation zwischen verschiedenen Therapeuten. Schmerztagebücher erlauben die Schmerzerfassung durch den Patienten. Sie geben dem Patienten ein Kontrollinstrument zu seinem Leiden und sind ein möglicher Schritt aus der passiven Rolle zu einer aktiven Kooperation. Sie bieten aber insbesondere dem behandelnden Arzt eine Reihe von Zusatzinformationen über Therapieerfolg, zusätzliche Risikofaktoren und Medikamentenverbrauch. z Compliance Mehr noch als bei anderen Leiden ist bei Erkrankungen des rheumatischen Formenkreises die Mitarbeit des Patienten von entscheidender Bedeutung für den Behandlungserfolg. Notwendig ist dabei unter anderem die eingehende Aufklärung über Krankheitszusammenhänge und das Aufzeigen sinnvoller Möglichkeiten der Einflussnahme durch den Kranken. Gerade Patienten mit einer langen Erkrankungsdauer verwenden oft zusätzliche Medikamente. Etwa ein Viertel aller chronisch Schmerzkranken nehmen heimlich zusätzliche Medikamente ein, insbesondere Psychopharmaka und Mischanalgetika. z Praktische Schmerztherapie Modellhaften Charakter für die Schmerzbehandlung hat seit einigen Jahren das WHO-Stufenschema [4] für die Behandlung tumorbedingter Schmerzen. 5.7 Medikamentöse Schmerztherapie z Bei diesem Schema wird stufenweise ein Nichtopioidanalgetikum, ein schwaches Opioid und schließlich ein stark wirkendes Opioid eingesetzt. Begleitend dazu kann ein adjuvantes Medikament die analgetische Wirkung verstärken. Es ist ohne weiteres möglich, die therapeutischen Grundsätze dieses Konzeptes auch bei rheumatischen Erkrankungen einzusetzen. Dabei ist wichtig, sehr diszipliniert die folgenden Regeln einzuhalten. Orale oder transdermale Medikation Diese gewährleistet einen gleichmäßigen Plasmaspiegel des verwendeten Medikamentes. Nebenwirkungsreiche Spitzen- und wirkungslose Talspiegel werden so am ehesten vermieden. Es macht außerdem den Patienten unabhängig vom Arzt, was für alle chronischen Erkrankungen in der Langzeittherapie essenziell ist. Medikamenteneinnahme streng nach Zeitschema Es entstehen keine Lücken, in denen es zu Durchbruchschmerzen kommt, die dann nur mit wesentlich höheren Analgetikagaben beherrscht werden können. Individuelle Dosisanpassung Die Erkrankung selbst ist ein dynamischer Prozess. Patienten sind unterschiedlich und Schmerz ist eine individuell sehr unterschiedliche Empfindung. Ebenso ist das Ansprechen auf Schmerzmittel, insbesondere bei den Opioiden, individuell sehr unterschiedlich. Prophylaktische Behandlung der Nebenwirkungen Praktisch jede Form der medikamentösen Schmerztherapie ist mit Nebenwirkungen belastet. Eine entsprechende Prophylaxe gewährleistet eine Fortsetzung der Therapie und dient der Patientencompliance. Die Wahl des Analgetikums richtet sich zum einen nach der Schmerzursache, zum anderen nach der Intensität des Schmerzzustandes. Am Anfang des Stufenschemas stehen die Nichtopioidanalgetika, beim Rheumaschmerz insbesondere die NSAR. z Nichtopioidanalgetika Aufgrund ihrer entzündungshemmenden Eigenschaften eignen sich die NSAR in besonderem Maße zur Behandlung von Schmerzzuständen mit entzündlicher Komponente, z. B. bei rheumatoider Arthritis, Spondylitis ankylosans, aktivierten Arthrosen. Bei diesen Erkrankungen haben NSAR auch eine kausale therapeutische Wirkung. Bei chronischen Schmerzen sind lang wirkende, retardierte NSAR von Vorteil. Alternativen zu den NSAR sind die COX-2-Inhibitoren, die sich durch ähnliche analgetische und antiphlogistische Eigenschaften bei besserer gastroin- 461 462 z 5 Medikamentöse Therapie testinaler Verträglichkeit auszeichnen (s. Kap. 5.1). Auch Metamizol und Paracetamol stellen Alternativen dar, allerdings ohne antiphlogistische Komponente. Auswahl des Präparates Wegen der unterschiedlichen Nebenwirkungen und Kontraindikationen der Nichtopioidanalgetika ist die individuelle Auswahl besonders wichtig. Die Dosierung ist eine Standarddosis; diese wird vom ersten Tag an verabreicht und nicht einschleichend gesteigert. z Opioidanalgetika Hierunter versteht man Analgetika, die ihre Wirkungen durch Bindung an spezifische Opiatrezeptoren entfalten. Entgegen früheren Annahmen sind diese Rezeptoren nicht nur im Zentralnervensystem angesiedelt, sondern auch in der Körperperipherie zu finden. Die Opioidanalgetika werden in schwach und stark wirksame Opioide eingeteilt. In der Therapie rheumatisch bedingter Schmerzzustände gelten Opioide allgemein nicht als Substanzen der ersten Wahl. Sie kommen insbesondere dann zum Einsatz, wenn nach Ausschöpfung anderer Mittel eine ausreichende Schmerzlinderung nicht zu erreichen ist. Ihr Einsatz ist aber auch dann zu erwägen, wenn unter den NSAR schwere Nebenwirkungen auftreten und die Dosis daher herabgesetzt werden muss. Eine Kombination verschiedener Nichtopioidanalgetika ist bei einer Dauertherapie nicht sinnvoll. Bei chronischen Schmerzzuständen ist die Verwendung von retardierten Präparaten vorzuziehen. Bei den schwachen Opioiden bieten sich hier das Dihydrocodein oder die retardierten Zubereitungen von Tilidin-Naloxon und Tramadol an. Bei den stark wirksamen Opioiden sind neben dem retardierten Morphin andere retardierte Zubereitungen oder die transdermalen Systeme mit Fentanyl bzw. Buprenorphin als Alternative vorhanden. z Praktisches Vorgehen Wenn eine ausreichende Analgesie mit NSAR allein nicht zu erreichen ist, kann zusätzlich die Gabe schwacher Opioide erfolgen. Wenn auch unter der kombinierten Gabe von NSAR und einem schwachen Opioid der Schmerz nicht ausreichend beeinflusst wird, kann das schwache gegen ein stark wirkendes Opioid ausgetauscht werden. Dabei muss man keinesfalls eine Zunahme der Nebenwirkungen fürchten, denn diese sind bei starken und schwachen Opioiden im Grundsatz gleich. Exemplarisch soll hier die Einstellung mit Fentanyl-TTS und retardiertem Morphin dargestellt werden. Bei einer Wirkdauer des Morphins von 8 bis 12 Stunden beginnt man zunächst mit dem größeren Intervall, also 12 Stunden. Man gibt in exakt 5.7 Medikamentöse Schmerztherapie z 12-stündigem Abstand, z. B. um 8 und 20 Uhr, eine Tablette. Reicht die Schmerzlinderung nicht aus, wird die Dosis am Anfang verdoppelt, also hier 2-mal 2 Tabletten. Gegebenenfalls weitere Erhöhung auf 2-mal 3 oder 2-mal 4 Tabletten. Reicht die Schmerzdämpfung nicht über 12 Stunden, sondern lässt schon vorher wieder nach, wird das Applikationsintervall auf 8 Stunden verkürzt, also 6.00, 14.00, 22.00 Uhr. Bei Fentanylpflastern beginnt man mit der kleinsten Pflastergröße von 25 lg/Stunde. Reicht die Schmerzlinderung nicht aus, so ist zu prüfen, ob die Dosis unzureichend oder das Applikationsintervall zu lang ist. Bei unzureichender Dosis wird beim nächsten Pflasterwechsel nach 3 Tagen das nächst größere Pflaster (50 lg/Stunde) aufgelegt. Bei zu früh nachlassender Wirkung wird schon nach 2 Tagen ein Pflasterwechsel vorgenommen. Beachte: Exakte Einnahme nach der Uhr. Niemals Unterschreitung der minimalen Wirkdauer (Morphin retard 8 Stunden, Fentanyl-TTS 48 Stunden) Die Dosisintervalle sind streng einzuhalten, ggf. muss sich der Patient zur Medikamenteneinnahme wecken lassen. Nebenwirkungen Am häufigsten treten auf: Obstipation – Übelkeit und Erbrechen – Müdigkeit (Sedierung) – Schwitzen – Hustendämpfung – Hautjucken. Die meisten Nebenwirkungen lassen nach kurzer Zeit (2 bis 3 Wochen) nach und bedürfen höchstens in dieser Zeit einer Therapie. Dagegen hält die Obstipation an und muss evtl. während der gesamten Opioidtherapie behandelt werden. Eine Atemdepression oder die Entwicklung einer psychischen Abhängigkeit treten bei richtiger Therapie (zeitkontingente Gabe, individuelle Dosis) praktisch nicht auf. Kontraindikationen Opioide sollten nicht verabreicht werden bei bestehender Medikamentenabhängigkeit und zentraler Atemdämpfung Koanalgetika Bei bestimmten schmerzhaften Erkrankungen zeigen einige Medikamente, die eigentlich keine Analgetika sind, dennoch analgetische Eigenschaften. Hierzu gehören die folgenden Substanzen mit jeweils typischen Indikationen: z Antidepressiva: neuropathische Dauerschmerzen, z Antiepileptika: neuropathische Attackenschmerzen, z Kortikoide: Schmerzen durch Nervenkompression, Entzündungsschmerz. Bei den Antidepressiva ist zwischen sedierenden und antriebssteigernden Substanzen zu unterscheiden. 463 464 z 5 Medikamentöse Therapie z Sedierendes Antidepressivum: Amitriptylin; Dosierung 25 bis 50 mg (abends) oder 2-mal 25 mg (mittags und abends). Alternativ kann Doxepin verordnet werden (Dosierung 2-mal 10 bis 50 mg mittags und abends), wegen der sedierenden Wirkung sollte möglichst morgens keine Einnahme erfolgen. z Antriebssteigerndes Antidepressivum: Clomipramin; Dosierung 10 mg (morgens) bis 2-mal 25 mg (morgens und abends). Bei einschießenden neuralgiformen Schmerzen können Antiepileptika verwendet werden, z. B. Carbamazepin. Es erfolgt eine langsame Dosissteigerung bis zu einer Erhaltungsdosis von 800 bis 1200 mg/Tag. Die wirksame Dosis wird über den Serumspiegel kontrolliert, der angestrebte Serumspiegel liegt bei 5 bis 10 mg/l. Alternativen sind Gabapentin, das ebenfalls einschleichend bis zu einer Dosis von 2400 mg/Tag gesteigert wird und Pregabalin (bis 600 mg/Tag). z Fazit Wenn bei rheumatischen Erkrankungen keine primäre und kausale Therapie möglich oder wirksam ist, sollte eine symptomatische Schmerztherapie dem Patienten nicht vorenthalten werden. Vor Einstellung auf stark wirksame Opioide sollte auch interdisziplinär das Spektrum der Therapie ausgeschöpft sein. Begleitend zu jeder Behandlung ist eine Physiotherapie wichtig. z Literatur 1. American Pain Society (2002) Clinical guideline for treatment of arthritis pain. www.ampainsoc.org 2. Sorge J, Menninger H, Thoden U, Hackental E (1992) Medikamentöse Schmerztherapie bei rheumatischen Erkrankungen. Der Schmerz 6:212–214 3. Zenz M, Jurna I (1993) Lehrbuch der Schmerztherapie: Grundlagen, Theorie und Praxis für Aus- und Weiterbildung. Wissenschaftliche Verlagsgesellschaft, Stuttgart 4. Zenz M (1995) Taschenbuch der Schmerztherapie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 5.8 Antirheumatische extern topische Therapie z 5.8 Antirheumatische extern topische Therapie An die Stelle einer systemischen risikoreicheren NSAR-Therapie können in geeigneten Fällen Topika treten. Lokal extern anwendbare Topika mit nichtsteroidalen Antirheumatika (NSAR) (Salben, Kremes, Gele, Linimente, Öle, alkoholische Lösungen) gehören zu den meist verordneten Arzneimitteln. Sie werden bei der Behandlung von umschriebenen weichteilrheumatischen Erkrankungen (z. B. Überlastungsschäden der Muskeln, Sehnen, Bänder oder anderer periartikulärer Gewebe) oder unproblematischen traumatisch bedingten Beschwerden nach Sportverletzungen (z. B. Zerrungen, Prellungen) und bei Arthrosen eingesetzt. Sie erfreuen sich einer hohen Akzeptanz bei Ärzten und Patienten. Aussagefähige Daten über eine länger als 2 Wochen dauernde Anwendung von topischen NSAR liegen aber nicht vor. Einige Topika enthalten in der Grundsubstanz durchblutungsfördernde Mittel oder sog. „Penetrationsbeschleuniger“ wie Dimethylsulfoxid (DMSO), das selbst analgetisch wirksam ist. z Wirkmechanismen Die integumentale Penetration der Wirkstoffe hängt von der Region und Beschaffenheit der Haut ab. Eine nennenswerte direkte Penetration der NSAR in tiefere Gelenkkompartimente findet nicht statt. Dagegen erreichen in der Subcutis die Wirkstoffspiegel gleiche Konzentrationen wie nach systemischer NSAR-Therapie. Möglicherweise interagieren die Inhaltsstoffe über die zahlreichen neurophysiologischen Verbindungen in der Haut mit tiefer gelegenen Gewebestrukturen und nehmen so auf das Schmerz- und Entzündungsgeschehen Einfluss. Bei Anwendung auf vorgeschädigter Haut besteht die Gefahr einer erhöhten systemischen Aufnahme des NSAR. Die Anwendung von Okklusionsverbänden, Iontophorese oder Phonophorese erhöht ebenfalls die systemische Verfügbarkeit und setzt sowohl die lokale als auch die systemische Verträglichkeit deutlich herab. DMSO ist nach Hautpenetration systemisch verfügbar und kann deswegen zu Veränderungen der Geschmackswahrnehmung und zu Foetor ex ore führen. z Wirksamkeit In randomisierten Interventionsstudien wurden positive klinische Effekte der Topika nachgewiesen. Der Plazeboeffekt war immer auffällig hoch. Die Eigenwirkung des Massageeffektes bei der Einreibung, die mit der Gelbehandlung verbundene Kühlwirkung oder der Überwärmungseffekt bei hyperämisierenden Salben dürfte eine wesentliche Rolle bei der Topikabehandlung spielen 465 466 z 5 Medikamentöse Therapie und für Unterschiede in der individuellen Wirksamkeit bzw. der Akzeptanz beim Patienten mitverantwortlich sein. Statistische Unterschiede in der Wirksamkeit verschiedener NSA-Topika sind methodisch nur schwer nachzuweisen. z Anwendung Die Häufigkeit der täglichen Topikaapplikation kann den individuellen Bedingungen angepasst 1- bis 4-mal täglich erfolgen. Durch „großzügiges“ Auftragen wird die resorbierte Menge des Wirkstoffes nicht erhöht und die Wirkung nicht messbar verbessert. Die resorbierte Wirkstoffmenge wird nur von der Größe des zu behandelnden Areals bestimmt. Die topische Therapie verliert dadurch den Charakter einer ausschließlich lokalen Therapie und wird zum „transdermalen therapeutischen System“ (TTS). Dadurch können unerwünschte systemische NSAR-Wirkungen auftreten. z Nebenwirkungen Unerwünschte systemische Wirkungen sind bei regulärer Anwendung möglich, in der Praxis aber kaum zu erwarten. Lokale, nicht schwerwiegende Hautreizungen treten in 1,5 bis 6% der behandelten Patienten auf. Sie können vermehrt auftreten und klinisch höhere Bedeutung erlangen, wenn Kombinationsarzneimittel verwandt werden, die zusätzlich hyperämisierende oder andere hautreizende Arzneistoffe enthalten. Bei intensiver Lichteinwirkung (Sonne, UV-Licht) kann es zu Blasenbildung der behandelten Hautareale kommen. z Literatur 1. Moore RA, Trainer MR, Carroll D, Wiffen PJ, McQuay HJ (1998) Quantitative systematic review of topically applied non-steroidal anti-inflammatory drugs. BMJ 316:333-338 2. Bolten W, Waldorf-Bolten E, Sarfert D, Lehmann M, Miehlke W (1990) Pharmakokinetische Untersuchungen nach zwei- bzw. vierwöchiger Felbinac-Gel-Applikation am Kniegelenk. Z Rheumatol 49:374–377 3. Kidd BL, Mapp PI, Blake DR, Gibson SJ, Polak JM (1990) Neurogenic influences in arthritis. Ann Rheumat Dis 49:649–652 4. Petersen U (1994) Statement für topische Antirheumatika. Dtsch Ärztebl 91:B2608–2610 5. Radermacher J, Jentsch D, Scholl MA, Lustinetz T, Frölich C (1991) Diclofenac concentrations in synovial fluid and plasma after application in inflammatory and degenerative joint disease. Br J Clin Pharmac 31:537–541 6. Vaile JH, Davis P (1998) Topical NSAIDs for musculoskeletal conditions. Drugs 56(5):793–799 5.9 Experimentelle Therapieprinzipien entzündlicher Gelenkerkrankungen z 5.9 Experimentelle Therapieprinzipien entzündlicher Gelenkerkrankungen Die Therapie entzündlicher Gelenkerkrankungen hat in den letzten Jahren große Fortschritte gemacht. Die Einführung der TNF-Inhibitoren hat die Optionen auch für schwer zu therapierende Verläufe bereichert. Parallel dazu hat sich das Instrumentarium für klinische Studien der rheumatoiden Arthritis, der juvenilen idiopathischen Arthritiden und der Spondyloarthropathien deutlich verbessert. International validierte Scoresysteme und Outcomekriterien haben die Standards klinischer Studien vervollkommnet und die Einführung neuer Therapieformen beschleunigt. Ungeachtet dieser positiven Entwicklung gibt es Bedarf für verbesserte Therapien. Neben der Entwicklung völlig neuer Pharmaka gehen wissenschaftliche Bestrebungen dahin, existierende Therapieformen gezielter und indikationsgerechter einzusetzen. Die Pharmakogenetik befasst sich mit der Frage, welche Patienten von einer Behandlung mit TNF-Inhibitoren am besten profitieren. Allerdings konnte die Untersuchung genetischer Polymorphismen von Zytokingenen, insbesondere von TNF-Promoter-Polymorphismen, bisher noch keine Antworten zu dieser Frage liefern. Fortschritte in der molekularbiologischen Technologie, welche die parallele Analyse einer Vielzahl von genetischen Polymorphismen erlaubt, lassen hier langfristig Erfolge erwarten [10]. Es gibt gegenwärtig zahlreiche Trends bei der Entwicklung zukünftiger Therapien. Nur einige von ihnen können hier genannt werden: z Zytokinantagonisten Nach dem großen Erfolg der TNF-Inhibitoren war es nur eine Frage der Zeit, wann weitere Zytokinantagonisten in die Therapie der RA eingeführt werden würden. Neue TNF-Inhibitoren (pegyliertes Fab-Fragment (Certilizumab), TNF-converting-enzyme (TACE)-Inhibitoren) sind in Erprobung. Neben TNFalpha ist Interleukin-6 ein Schlüsselzytokin in der Entzündungskaskade. Erste Studien zur Behandlung der RA [2] und der JIA [11] mit Antikörpern (Tocilizumab) gegen den Interleukin-6-Rezeptor verliefen positiv, auch wenn der Stellenwert dieser Behandlung noch definiert werden muss. Interleukin-1 spielt eine wesentliche Rolle in der Knorpel- und Knochendestruktion bei der rheumatoiden Arthritis; neue Inhibitoren von IL-1 sind in Erprobung. 467 468 z 5 Medikamentöse Therapie z Hemmung von Transkriptionsfaktoren Inflammatorische Zytokine aktivieren ihre Zielzellen durch die Vermittlung von sog. Transkriptionsfaktoren, die im Zellkern Gene aktivieren oder blockieren können. Einer der am besten untersuchten Faktoren ist NF-kappaB, der eine Vielzahl von Genen beeinflusst. Eine Reihe konventioneller Basistherapeutika (z. B. MTX und Leflunomid) wirkt partiell über die Hemmung von NF-kappaB. Pharmaka zur gezielten Modulation dieses Faktors werden derzeit entwickelt [7]. Sowohl bei der Antizytokintherapie als auch bei der Hemmung von Transskriptionsfaktoren ist die pharmakologische Forschung stark an der Entwicklung von kleinmolekularen Substanzen interessiert. Die Verwendung von Antikörpern ist mit Nachteilen behaftet (Antigenität, parenterale Applikation, hohe Herstellungskosten), die durch oral resorbierbare Medikamente umgangen werden können. Ein Ansatz, der zumindest bei der rheumatoiden Arthritis in das Stadium der klinischen Prüfung gelangte, ist die Hemmung des Konversionsenzyms von Interleukin-1beta (ICE) [9]. Auch Steroidrezeptoren gehören in die Familie der Transskriptionsfaktoren. Steroide wirken allerdings ausgesprochen pleiotrop, d. h. sie vereinigen entzündungshemmende mit zahlreichen metabolischen Effekten. Hier ist in den nächsten Jahren möglicherweise mit Medikamenten zu rechnen, die selektiver an bestimmte Steroidrezeptoren binden (sog. „selective glucocorticoid receptor antagonists“, SEGRAs) und damit gezielter entzündungshemmend wirken [1]. z Hemmung der Aktivierung von T-Zellen T-Zellen benötigen für ihre Aktivierung ein sog. zweites Signal (neben dem ersten, dem präsentierten Antigen). Die Hemmung dieses Signals durch das Molekül CTLA-4 stellt einen wichtigen Regulationsmechanismus der T-ZellFunktion dar. Das rekombinante Fusionsprotein aus CTLA-4 und dem Fc-Fragment von IgG (Abatacept) erwies sich in einer randomisierten Doppelblindstudie als vergleichbar effektiv für die RA-Therapie wie die TNF-Inhibitoren [4]. IL-15, das von Makrophagen produziert wird, aktiviert T-Zellen; Anti-IL-15 zeigt in Phase I/II-Studien ein gutes Ansprechen auf die rheumatoide Arthritis. Weitere Inhibitoren (Efalizumab) der Interaktion von T-Zellen und antigenpräsentierenden Zellen sind in Erprobung bei der rheumatoiden Arthritis. z Hemmung der B-Zell-Funktion B-Zellen spielen in der Pathogenese von Autoimmunerkrankungen eine bedeutende Rolle. Neben der Produktion von Autoantikörpern tragen sie durch ihre Fähigkeit zur Antigenpräsentation und zur Stimulation der Bildung ektopen lymphatischen Gewebes zur Entstehung chronisch-entzündlicher Erkrankungen bei [8]. Die gezielte Ausschaltung von aktivierten B-Zellen durch die Hemmung des B-Zell-spezifischen Oberflächenmoleküls CD20 ist in der The- 5.9 Experimentelle Therapieprinzipien entzündlicher Gelenkerkrankungen z rapie von B-Zell-Lymphomen seit Jahren etabliert. Vor kurzem wurde der monoklonale Anti-CD20-Antikörper Rituximab zur Therapie der rheumatoiden Arthritis zugelassen. Die Anwendung für den SLE, möglicherweise auch bei anderen B-Zell-vermittelten Autoimmunerkrankungen, ist absehbar [5]. Ein humanisierter monoklonaler Antikörper ist in Erprobung (Ocrelizumab). Ein monoklonaler Antikörper gegen CD22 (Epratuzumab), der B-Zellen nicht depletiert, hat sich in ersten Studien bei SLE und Sjögren-Syndrom als wirksam erwiesen. B-Lymphozyten werden durch den B-Lymphozyten-Stimulator BLyS/ BAFF aktiviert. Belimumab, ein humaner monoklonaler Antikörper gegen BLyS, verbessert in ersten Studien die Krankheitsaktivität bei SLE und hat möglicherweise Einfluss auf die Autoantikörperbildung. z Hemmung von Matrixmetalloproteinasen Matrixmetalloproteinasen (MMP) sind maßgeblich an der Zerstörung von Gelenkstrukturen bei rheumatoider Arthritis beteiligt. Allerdings sind sie auch für den physiologischen Bindegewebsstoffwechsel unverzichtbar. Die Mitglieder der MMP-Familie ähneln sich im Aufbau – vor allem in ihrem aktiven Zentrum – sehr stark, sodass eine selektive Hemmung einer MMP sehr schwierig ist. Trotz dieser Hindernisse gibt es Ansätze für die Entwicklung von MMP-Hemmstoffen. Die Umsetzung in die Humanmedizin scheiterte bisher jedoch an Effizienz- und Sicherheitsproblemen [6]. z Gentherapie Unter Gentherapie versteht man das Einbringen zellfremder oder das selektive Ausschalten zelleigener Gene. Bei entzündlich-rheumatischen Erkrankungen kommt es zur Fehlsteuerung einer Vielzahl von Genen, sodass es nicht einfach ist, ein Kandidatengen für die Gentherapie zu identifizieren. Schwierig ist die Entwicklung eines geeigneten Vektors, (meist ein modifiziertes Virus), welcher das Einbringen der fremden DNA in die Zelle ermöglicht, ohne selbst immunogen oder zelltoxisch zu wirken. Neben einer Reihe von In-vitro-Modellen und Tierexperimenten für rheumatoide Arthritis und Arthrose existiert eine Studie an bisher 9 RA-Patientinnen, die mit einem Vektor für den Interleukin1-Rezeptor-Antagonisten behandelt worden sind. Das Genprodukt konnte erfolgreich in den lokal behandelten Gelenken nachgewiesen werden. Über krankheitsmodifizierende Effekte oder Langzeitrisiken ist bisher nichts bekannt [3]. Die Entwicklung neuer Therapien für entzündliche Gelenkerkrankungen wird durch die Tatsache erschwert, dass die Krankheitsursachen weiterhin im Dunkeln liegen. Die Notwendigkeit zur Spezialisierung führt dazu, dass sich Wissenschaftler oft sehr selektiv mit einzelnen Zytokinen, Oberflächenmarkern o. Ä. befassen. Dies kann – wie am Fall der TNF-Inhibitoren nachweisbar – durchaus zu Erfolgen führen, verstellt aber gelegentlich auch den Blick auf die Komplexität rheumatischer Erkrankungen. Es ist in den letzten Jahren deut- 469 470 z 5 Medikamentöse Therapie lich geworden, dass inflammatorische Vorgänge unterschiedlicher entzündlicher Krankheitsbilder – wie die multiple Sklerose, die Colitis ulcerosa oder die RA – ähnliche genetische und pathophysiologische Mechanismen aufweisen können. Nicht selten ergibt sich daher der Fortschritt in der Medizin aus der „indikationsfremden“ Anwendung von Medikamenten, wie der erfolgreiche Einsatz von TNF-Inhibitoren bei Patienten mit Sarkoidose, Colitis ulcerosa und entzündlichen Augenerkrankungen beweist. z Literatur 1. Buttgereit F, Song IH, Straub RH, Burmester GR (2005) Aktueller Stand zur Entwicklung neuer Glucocorticoid-Rezeptorliganden. Z Rheumatol 64(3):170–176 2. Choy EH, Isenberg DA, Garrood T, Farrow S, Ioannou Y, Bird H, Cheung N, Williams B, Hazleman B, Price R, Yoshizaki K, Nishimoto N, Kishimoto T, Panayi GS (2002) Therapeutic benefit of blocking interleukin-6 activity with an anti-interleukin-6 receptor monoclonal antibody in rheumatoid arhtritis: a randomized, double-blind, placebo-controlled, dose-escalation trial. Arthritis Rheum 46(2): 3143–3150 3. Evans CH, Robbins PD, Ghivizzani SC, Wasko MC, Tomaino MM, Kang R, Muzzonigro TA, Vogt M, Elder EM, Whiteside TL, Watkins SC, Herndon JH (2005) Gene transfer to humanjoints: progress toward a gene therapy of arthritis. Proc Natl Acad Sci USA 102(24):8698–8703 4. Kremer JM, Dougados M, Emery P, Durez P, Sibilia J, Shergy W, Steinfeld S, Tindall E, Becker JC, Li T, Nuamah IF, Aranda R, Moreland LW (2005) Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept: twelve-month reults of a phase IIb, double-blind, randomized, placebo-controlled trial. Arthritis Rheum 52(8):2263–2271 5. Leandro MJ, Edwards JC, Cambridge G (2002) Clinical outcome in 22 patients with rheumatoid arthritis treated with B lymphocyte depletion. Ann Rheum Dis 61(10):883–888 6. Milner JM, Cawston TE (2005) Matrix metalloproteinase knockout studies and the potential use of matrix metalloproteinase inhibitors in the rheumatic diseases. Curr Drug Targets Inflamm Allergy 4(3):363–375 7. Okazaki Y, Sawada T, Nagatani K, Komagata Y, InoueT, Muto S, Itai A, Yamamoto K (2005) Effect of nuclear factor-kappa B inhibition on rheumatoid fibroblast-like synoviocytes and collagen induced arthritis. J Rheumatol 32(8):1440–1447 8. Park YW, Pryshchep S, Seyler TM, Goronzy JJ, Weyand CM (2005) B cells as a therapeutic target in autoimmune diseases. Expert Opin Ther Targets 9(3): 431–445 9. Randle JC, Harding MW, Ku G, Schonharting M, Kurrle R (2001) ICE/Casepase-1 inhibitors as novel anti-inflammatroy drugs. Expert Opin Investig Drugs 10(7): 1207–1209 10. Ranganathan P (2005) Pharmacogenomics of tumor necrosis factor antagonists in rheumatoid arthritis. Pharmacogenomics 6(5):481–490 11. YokotaS, Miyamae T, Imagawa T, Iwata N, Katakura S, Mori M, Woo P, Nishimoto N, Yoshizaki K, Kishimoto T (2005) Therapeutic efficacy of humanized recombinant anti-interleukin-6 receptor antibody in children with systemic-onset juvenile idiopathic arthritis. Arthritis Rheum 52(3):818–825 5.10 Therapie in der Schwangerschaft z 5.10 Therapie in der Schwangerschaft Die meisten entzündlichen rheumatischen Erkrankungen betreffen bevorzugt das weibliche Geschlecht. Viele dieser Frauen sind im gebärfähigen Alter. Trotzdem liegen kontrollierte Studien über Sicherheit und Effizienz von Antirheumatika in der Schwangerschaft nur in geringer Zahl vor. Dies liegt zum einen daran, dass bei 75% der Frauen mit chronischer Polyarthritis die Krankheitsaktivität deutlich nachlässt, zum anderen für Erkrankungen wie den systemischen Lupus erythematodes erst seit wenigen Jahren Therapiekonzepte vorliegen, welche die Prognose so weit verbessert haben, dass über die Möglichkeit einer Schwangerschaft überhaupt erst nachgedacht wird. Zudem ist eine genaue Vorhersage über den Verlauf der Schwangerschaft für den Einzelfall nicht möglich. Immer mehr betroffene Frauen können sich heute ihren Kinderwunsch erfüllen. Die Therapie während der Gravidität ist darauf auszurichten, die Erkrankung in einem möglicht stabilen Zustand zu erhalten: Sie soll das Befinden der Mutter optimieren, ohne dabei dem Fetus zu schaden. In einigen Fällen dient eine Therapie auch der Behandlung des Feten. z Nichtsteroidale Antirheumatika (NSAR) Die Fertilität wird durch eine NSAR-Einnahme möglicherweise in Einzelfällen vermindert. Einsatz in der Schwangerschaft Über ihre Thrombozytenaggregationshemmung verstärken NSAR die Blutungsneigung von Mutter und Kind. Die tokolytische Wirkung kann zu einer prolongierten Schwangerschaft und Geburt führen. NSAR sind plazentagängig. Bei längerer Einnahme ist eine reversible verminderte renale Durchblutung mit geringerer fetaler Urinproduktion und Oligohydramnie möglich. Ferner ist eine Konstriktion des Ductus arteriosus im Uterus (v. a. um die 30. Schwangerschaftswoche) mit persistierender pulmonaler Hypertonie (mit und ohne Trikuspidalinsuffizienz) beschrieben. 471 472 z 5 Medikamentöse Therapie z Beachte: Somit gilt für den Einsatz der NSAR in der Gravidität: z Wahl der niedrigsten effektiven Dosis, z Bevorzugung von Präparaten mit kurzer Halbwertszeit, z Anwendung nur bis zur 32. Schwangerschaftswoche. z Über Coxibe fehlen Daten in der Schwangerschaft. Sie sollten daher nicht angewendet werden. Besonderheiten Azetylsalizylsäure bis 100 mg/Tag wird bei dem Antiphospholipidsyndrom zur Abortprophylaxe empfohlen. In einer amerikanischen Studie mit über 10 000 prospektiv untersuchten Schwangerschaften mit regelmäßiger oder vorübergehender Einnahme von ASS wurde kein erhöhtes Missbildungsrisiko festgestellt [16]. Stillen unter NSAR mit kurzer Halbwertszeit kann bei reifen Kindern erlaubt werden. Es scheint dabei günstig, das NSAR zum Zeitpunkt des Stillens einzunehmen, da dann die geringsten Mengen in der Milch nachgewiesen wurden [9, 17]. z Glukokortikoide Die Fertilität unter Glukokortikoiden ist nicht bedeutsam verändert. Einsatz in der Schwangerschaft Zu Glukokortikoiden liegen die meisten Erfahrungen in der Gravidität vor. Bei Gabe von Prednisolon beträgt die Nabelschnurkonzentration aufgrund des Plazentametabolismus etwa 20% der Konzentration im mütterlichen Blut. Prednison kann von der unreifen fetalen Leber nicht in den aktiven Metaboliten Prednisolon verwandelt werden. Dexamethason und Betamethason passieren hingegen ungehindert die Plazenta und sind im Bedarfsfall bei der Therapie des Fetus (z. B. Prophylaxe des kongenitalen AV-Blocks bei Kindern von Müttern mit Anti-SSA/Ro- und Anti-SSB/La-Antikörpern) einsetzbar. Ein Nutzen einer präventiven Gabe von Glukokortikoiden zur Verhinderung eine Exazerbation bei systemischem Lupus erythematodes (SLE) konnte nicht nachgewiesen werden [3]. Die Glukokortikoidgabe kann bei der Mutter dosisabhängig zu Diabetes mellitus, Hypertonie oder Präeklampsie führen. Infektionen, Osteoporse und vorzeitiger Blasensprung sind weitere Komplikationen. Eine intrauterine Wachstumsretardierung und eine Frühgeburt sind möglich. Einzelfälle mit fetalen Infektionen, adrenalen Insuffizienzen (1 : 1000) und neonatalem Katarakt sind beschrieben. Ein erhöhtes Missbildungsrisiko besteht nicht. 5.10 Therapie in der Schwangerschaft z z Beachte: Somit gilt für den Einsatz von Glukokortikoiden in der Gravidität: z Therapie der Wahl bei Exazerbationen von rheumatischen Systemerkrankungen, z Wahl der niedrigsten effektiven Dosis, z keine prophylaktische Gabe, z Bevorzugung von Prednison bzw. Prednisolon zur Therapie der Mutter, z Osteoporoseprophylaxe mit Calcium und Vitamin D, z Dexamethason bzw. Bethason zur Therapie des Kindes. Stillen unter Prednison ist erlaubt. Bei Dosen über 20 mg/Tag ist nach Applikation der Medikamente möglichst eine Zeitdifferenz von 4 Stunden bis zum nächsten Stillen einzuhalten. z Chloroquin/Hydroxychloroquin Die Fertilität wird durch die Antimalariamittel nicht sicher beeinflusst. Einsatz in der Schwangerschaft Chloroquin und Hydroxychloroquin sind plazentagängig. In Tierversuchen sind die Wirkstoffe in hohen Dosen embryotoxisch und teratogen. Beim Menschen wurden in Einzelfällen unter hohen Dosen Retinaveränderungen und Innenohrmissbildungen des Kindes beschrieben [4]. Bei Dosen unter 6,5 mg/kg/Tag beobachtete man in 900 Schwangerschaften kein erhöhtes Missbildungsrisiko [18]. Durch die lange Halbwertszeit der Antimalariamittel ist ein Absetzen bei bereits eingetretener Schwangerschaft für den Feten nicht mehr bedeutsam, da in der Organogenese noch eine Exposition vorliegt. Beim Absetzen in der Schwangerschaft wurden Aktivierungen des SLE beobachtet [3, 14]. z Beachte: Somit gilt für den Einsatz der Antimalariamittel in der Gravidität: z Bei geplanter Schwangerschaft sollte je nach klinischer Situation entweder nach Absetzen der Präparate 3–6 Monate vor Konzeption abgewartet werden oder die Schwangerschaft unter der Medikation geplant werden. z Tritt eine ungeplante Schwangerschaft unter der Therapie auf, wird empfohlen, die Therapie fortzusetzen, da eine Aktivierung der Erkrankung für den Ausgang der Schwangerschaft unvorteilhaft sein kann. Beide Präparate sind allerdings in Deutschland außer zur Malariaprophylaxe und- therapie in der Schwangerschaft nicht zugelassen. Stillen Hydroxychloroquin kann in der Muttermilch nachgewiesen werden [10]. Da es zu Kumulationen kommen kann und damit Wirkungen auf das Kind möglich sind, wird Stillen unter Chloroquin- oder Hydroxychloroquintherapie nicht empfohlen! 473 474 z 5 Medikamentöse Therapie z Sulfasalazin Sulfasalazin kann beim Mann zu einer reversiblen Oligospermie führen. Einsatz in der Schwangerschaft Die Kenntnisse über die Anwendung von Sulfasalazin in der Gravidität stammen vorwiegend aus dem Einsatz bei chronisch-entzündlichen Darmerkrankungen. Obwohl Sulfasalazin und seine Metaboliten die Plazenta passieren, zeigen Untersuchungen an mehr als 2000 Schwangerschaften keinen negativen Einfluss auf das Kind und Schwangerschaftsoutcome [8]. Bei chronischer Polyarthritis ist der Einsatz des Präparates – falls erforderlich – in der Gravidität möglich mit Folsäuresupplementation. Kurz vor der Geburt ist jedoch die Therapie zu beenden, da – wie bei anderen Sulfonamiden auch – die Möglichkeit des Auftretens einer Gelbsucht und eines Kernikterus gegeben ist. Unter Sulfasalazin scheinen keine größeren Risiken für das Stillen des Kindes zu bestehen [7]. z Gold (Aurothiomalat) Zur Fertilität unter Goldtherapie existieren keine Daten. Einsatz in der Schwangerschaft Es existieren nur sehr wenig Daten bzgl. der Anwendung in der Schwangerschaft. Goldsalze passieren die Plazenta. Aus Tierstudien sind dosisabhängige Wachstumsstörungen und Missbildungen unter Aurothiomalat bekannt. Beim Menschen gibt es wenig Hinweise auf teratogene Effekte. Die Anwendung ist in der Gravität nicht zugelassen. Bei strikter Indikationsstellung wegen aktiver chronischer Polyarthritis ist die Anwendung in Ausnahmefällen möglich. Dabei wird empfohlen, die Dosierungsintervalle zu verlängern und die Dosis zu reduzieren [1, 11]. z Beachte: Somit gilt für den Einsatz von Aurothiomalat in der Gravidität: z Es sollte 6 Monate vor einer geplanten Schwangerschaft abgesetzt werden. Vom Stillen wird unter oraler Goldtherapie abgeraten, da signifikante Dosen in der Muttermilch nachgewiesen wurden. Eine i. m.-Goldtherapie scheint dagegen weiter fortgeführt werden zu können [11]. 5.10 Therapie in der Schwangerschaft z z Methotrexat Die Fertilität der Frauen wird durch Methotrexat nicht beeinträchigt. Bei Männern kann eine reversible Oligospermie entstehen. Einsatz in der Schwangerschaft Im Tierversuch sind bei Methotrexatgabe sowohl intrauteriner Fruchttod als auch Missbildungen beschrieben. Methotrexat ist plazentagängig und wirkt insbesondere im ersten Trimenon abortiv. Es besteht eine strikte Kontraindikation für den Einsatz der Substanz in der Schwangerschaft [5, 6]. z Beachte: Somit gilt für den Einsatz von Methotrexat in der Gravidität: z Eine Methotrexattherapie muss mindestens 3 Monate, besser 6 Monate vor einer geplanten Schwangerschaft abgesetzt werden. Entsprechend gilt dies auch für die Behandlung des männlichen Partners. Stillen ist unter Methotrexat wegen eines Nachweises in der Muttermilch nicht möglich [15]. z Azathioprin Die verminderte Effektivität eines Intrauterinpessars ist unter Azathioprintherapie beschrieben [2]. Einsatz in der Schwangerschaft In Tierversuchen war Azathioprin in hohen Dosen teratogen (Skelett- und ZNS-Abnormalitäten). Beim Menschen scheint das Risiko für kindliche Anomalien nach den bisher publizierten Daten nicht erhöht zu sein, in einer Recherche bzgl. 700 nierentransplantierter Patientinnen wurden bei 4,3% kindliche Anomalien beobachtet (gegenüber einer Häufigkeit zwischen 1 und 4% ohne Azathioprin [2, 5]. Berichte über die Anwendung von Azathioprin in der Schwangerschaft beim SLE zeigen keine erhöhte Missbildungsrate bei den Neugeborenen. Azathioprin ist plazentagängig, die fetale Leber kann die Umwandlung in den aktiven Metaboliten 6-Mercaptopurin nicht leisten. Mögliche Auswirkungen auf das Kind sind Wachstumsretardierung und Immunsuppression. Frühgeburten wurden häufiger beschrieben [5]. Azathioprin ist in Deutschland während der Schwangerschaft nicht zugelassen. z Beachte: Somit gilt für den Einsatz von Azathioprin in der Gravidität: z Empfohlen wird, das Medikament 6 Monate vor einer geplanten Gravidität abzusetzen. Entsprechendes gilt auch für den Mann, der Azathioprin erhält. 475 476 z 5 Medikamentöse Therapie Unter Abwägung von Nutzen für die Mutter und den anscheinend kleinen Risiken für den Feten kann in Einzelfällen von diesem Vorgehen abgewichen werden. Dies gilt insbesondere für eine bereits eingetretene Schwangerschaft. Stillen unter Azathioprin ist wegen der Gefahr einer Immunsuppression beim Kind nicht erlaubt [7]. z Cyclophosphamid Unter Cyclophosphamid ist mit Amenorrhö und Infertilität zu rechnen. Einsatz in der Schwangerschaft Cyclophosphamid ist in der Schwangerschaft wegen Fetotoxizität und Teratogenität kontraindiziert. Das Präparat ist 6 Monate vor der geplanten Schwangerschaft abzusetzen. Tritt unter einer Therapie eine Schwangerschaft ein, besteht eine Indikation zur Interruptio. Cyclophosphamid ist während der Stillzeit kontraindiziert. z Ciclosporin Durch Ciclosporin wird die Fertilität nicht sicher beeinflusst. Einsatz in der Schwangerschaft Ciclosporin A kann in der Schwangerschaft in der niedrigsten effektiven Dosis fortgeführt werden unter regelmäßigen Kontrollen von Blutdruck und Nierenfunktion. Im Tierversuch wurde keine Teratogenität nachgewiesen. Über die Sicherheit der Anwendung bei Schwangeren liegen keine ausreichenden Erfahrungen vor. Bei nierentransplantierten Schwangeren wurden in 40% eine Wachstumsretardierung und Frühgeburten beschrieben. Es wird auch über vereinzelte Missbildungen bei Neugeborenen, deren Mütter in der Schwangerschaft Ciclosporin erhielen, berichtet [1]. Die Langzeiteffekte auf das Kind, das im Uterus eine entsprechende Exposition erhielt, sind noch völlig unbekannt. Eine eindeutige Empfehlung kann daher nicht gegeben werden. Stillen unter Ciclosporin ist aufgrund der immunsuppressiven Auswirkungen auf das Kind kontraindiziert [7]. z Mycofenolsäure Mycofenolsäure ist während der Schwangerschaft kontraindiziert. Es sollte 6 Wochen vor Beginn einer Schwangerschaft abgesetzt werden. 5.10 Therapie in der Schwangerschaft z z Etanercept, Infliximab und Adalimumab Zum Einfluss von Etanercept und Infliximab auf die Fertilität gibt es keine validen Daten. Einsatz in der Schwangerschaft Im Gegensatz zu vielen anderen krankheitsmodifizierenden Medikamenten konnte im Tierversuch keine Teratogenität oder Fetotoxizität nachgewiesen werden. Einzelne Fallberichte zu Frauen, die unter Therapie mit Etanercept oder Infliximab schwanger geworden sind, zeigen keine Hinweise auf eine höhere Komplikations- oder Missbildungsrate. Ausreichende Erfahrungen mit der Therapie während einer Schwangerschaft liegen aber zur Zeit nicht vor. Bei Frauen muss daher während der Behandlung mit Etanercept und vorsichtshalber bis zu 3 Monaten (Infliximab: bis zu 6 Monaten) nach Therapieende eine sichere Kontrazeption erfolgen. Auch Männer sollten während der Behandlung und bis zu 3 Monate (Infliximab: bis zu 6 Monate) nach Therapieende keine Kinder zeugen. Für eine unter Therapie eingetretene Schwangerschaft existiert nach heutiger Datenlage keine absolute Indikation zur Interruptio. Bei Wunsch der Betroffenen nach Aufklärung über die zur Zeit unsichere Datenlage kann eine Interruptio aus medizinischer Indikation aber befürwortet werden. Vom Stillen unter Etanercept, Infliximab und Adalimumab ist aufgrund der bislang nicht bekannten Auswirkungen auf das Kind abzuraten. z Immunadsorption und Plasmapherese In Ausnahmefällen können bei unzureichender Wirkung von z. B. Steroiden extrakorporale Verfahren in der Schwangerschaft durchgeführt werden. z Immunglobuline Bei Exazerbationen können auch Immunglobuline in der Schwangerschaft eingesetzt werden [12, 13]. Planung einer Schwangerschaft Die Behandlungsstrategie hängt davon ab, ob die rheumatische Erkrankung bereits vor der Schwangerschaft bekannt ist. In diesem Fall sollte die Schwangerschaft mit dem behandelnden Arzt geplant werden, um einen möglichst günstigen Zeitpunkt zu wählen. Die Schwangerschaft sollte in eine möglichst inaktive Phase fallen. Bei einer Erkrankung in Remission stellt auch die Schwangerschaft keine Notwendigkeit zur Therapie dar. Eine bereits bestehen- 477 478 z 5 Medikamentöse Therapie de Therapie wird auf ihre Notwendigkeit hin überprüft. Wenn es die Krankheitsaktivität erlaubt, können Medikamente gezielt abgesetzt werden. Die Schwangerschaft sollte frühestens nach 3–4 Monaten nach Beendigung der Therapie beginnen, da das Absetzen der Medikamente einen Schub auslösen kann. Falls eine Aktivierung eintritt, ist die Planung einer Schwangerschaft evtl. auch unter einer Therapie (Kortison, Hydroxychloroquin, Azthioprin) möglich. Tritt ein Schub der Erkrankung auf, sollte zunächst ein Steroidstoß durchgeführt werden. Diese Behandlung unterdrückt die Symptomatik ausreichend gut. Reicht diese Medikation nicht aus, stehen mit Immunglobulinen, Azathioprin und extrakorporalen Verfahren ergänzende Maßnahmen zur Verfügung. In aktiven Phasen von Organbeteiligungen, z. B. einer behandlungspflichtigen Nierenbeteiligung beim SLE, sollte von einer Schwangerschaft abgeraten werden: Es besteht ein zu hohes Risiko für eine Verschlechterung bis hin zur terminalen Niereninsuffizienz. Eine absolute Kontraindikation gegen eine Schwangerschaft stellen schwere Funktionseinschränkungen von Organen und eine zentralnervöse Beteiligung (z. B. ein vorangegangener Insult) beim Antiphospholipidsyndrom dar. Unter Immunsuppression ist die Indikation zur Aminozentese eher großzügig zu stellen, sonographische Untersuchungen an gynäkologischen Zentren zum Ausschluss von Missbildungen werden in der 18.–20. Schwangerschaftswoche empfohlen. Bei Bewegungseinschränkungen im Hüftgelenk oder aktiver Symphysitis bzw. Sakroiliitis sollte der Entbindungsmodus festgelegt werden. Die Schwangerschaft sollte insgesamt als Risikogravidität aufgefasst und ein regelmäßiges immunologisches und gynäkologisches Monitoring in jedem Trimenon der Schwangerschaft sowie post partum durchgeführt werden. z Literatur 1. Antoni CE, Furst D, Manger B et al (2001) Outcome of pregnancy in women receiving Remicade (infliximab) for the treatment of Crohn’s disease or rheumatoid arthritis (abstract) Arthritis Rheum 44(suppl):S 153 2. Brooks PM, Needs CJ (1990) Antirheumatic drugs in pregnancy and lactation. Baillieres Clin Rheumatol 4:157–171 3. Chakravarty EF, Sanchez-Yamamoto D, Bush TM (2003) The use of disease modifying antirheumatic drugs in women with rheumatoid arthritis of childbearing age: a survey of practice patterns and pregnancy outcomes. J Rheumatol 30(2):241–246 4. Davidson JM, Lindheimer MD (1982) Pregnancy in renal transplant recipients. J Reprod Me 27:613–621 5. Derksen RHWM, Bruinse HW, de Groot PG, Kater L (1994) Pregnancy in systemic lupus erythematosus: a prospective study. Lupus 3:149–155 6. Hart CN, Naunton RF (1964) The ototoxicity of chloroquine phosphate. Arch Otolaryngol Head Neck Surg 80:407–412 7. Jarvis B, Faulds D (1999) Etanercept: a review of its use in rheumatoid arthritis. Drugs 57:945–966 5.10 Therapie in der Schwangerschaft z 8. Johns DG, Rutherford LD, Leighton PC, Vogel CL (1972) Secretion of methotrexate into human milk. Am J Obstet Gynecol 112:978–980 9. Needs CJ, Brooks PM (1985) Antirheumatic medication in pregnancy. Br J Rheumatol 24:282–290 10. Ostensen M (2006) Antirheumatic therapy and reproduction. The influence on fertility, pregnancy and breast feeding. Z Rheumatol 65:217–224 11. Ostensen M (1994) Optimization of antirheumatic drug treatment in pregnancy. Clin Pharmacokinet 27:486–503 12. Ostensen M (1998) Nonsteroidal anit-inflammatory drugs during pregnancy. Scand J Rheumatol Suppl 107:128–132 13. Ostensen M, Brown ND, Chiang PK, Aarbakke J (1985) Hydroxychloroquine in human breast milk. Eur J Clin Pharmacol 28:357 14. Ostensen M, Skavdal K, Myklebust G, Tomassen Y, Aarbackke J (1986) Excretion of gold into human breast milk. Eur J Clin Pharmacol 31:251–252 15. Parke A (1992) The role of IVIG in the management of patients with antiphospholipid antibodies and recurrent pregnancy losses. Clin Rev Allergy 10:105–118 16. Parke AL (1998) Intravenous gammaglobulin in pregnancy, the Connecticut experience. Scand J Rheumatol Suppl 107:103–104 17. Parke A, West B (1996) Hydroxychloroquine in pregnant patients with systemic lupus erythematosus. J Rheumatol 10:1715–1718 18. Roubenoff R, Hoyt J, Petri M et al (1988) Effects of antiinflammatory and immunosuppressive drugs on pregnancy and fertility. Sem Arthr Rheum 18:88–110 19. Slone D, Heinonen OP, Kaufmann DW et al (1976) Aspirin and congenital malformations. Lancet 1373–1375 20. Townsend RJ, Bendetti TJ, Erickson SH, Cengiz C, Gillespie WR, Gschwend J, Albert KS (1984) Exretion of ibuprofen in breast milk. Am J Obstet Gynecol 149:184–186 21. Wolfe MS, Cordero JF (1985) Safety of chloroquine in chemosuppression of malaria during pregnancy. Br Med J 290:1466–1467 479