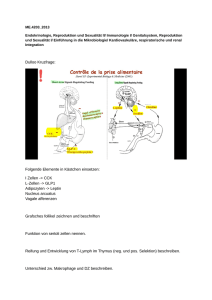
Prävalenz antineuronaler Antikörper bei Patienten mit Multipler
Werbung

Aus der Neurologischen Universitätsklinik der Albert-Ludwigs-Universität Freiburg i. Br. Prävalenz antineuronaler Antikörper bei Patienten mit Multipler Sklerose INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. vorgelegt 2008 von Constanze Murek geboren in Müllheim Dekan: 1. Gutachter: 2. Gutachter: Jahr der Promotion: Professor Dr. med. Christoph Peters Professor Dr. med. Sebastian Rauer Professor Dr. med. Almut Zeeck 2009 Meinen lieben Eltern in Dankbarkeit gewidmet Inhaltsverzeichnis 1 Einleitung 1.1 Multiple Sklerose: Inzidenz und Krankheitsbild 1.1.1 Pathogenese 1.1.2 Diagnostik 2 3 1 1 3 5 1.2 Paraneoplastische neurologische Syndrome: Krankheitsbild 1.2.1 Pathogenese 1.2.2 Diagnostik 1.2.3 Spezifischer Antikörperindex 7 8 9 11 1.3 13 Fragestellung Patienten, Material, Methoden 14 2.1 Patientenkollektiv 2.1.1 Kriterien zur Unterteilung des Patientenkollektivs: 2.1.2 Kontrollkollektive 14 14 15 2.2 Versuchsmaterialien 2.2.1 Antigene 2.2.2 Chemikalien 2.2.3 Geräte 16 16 16 16 2.3 Methoden 2.3.1 Funktionsprinzip des ELISA 2.3.2 Durchführung des ELISA 2.3.3 Immunoblot mit rekombinanten Antigenen (Ravoblot) 2.3.4 Immunfluoreszenz 2.3.5 Spezifischer Antikörperindex 2.3.6 Bestimmung des Antikörperindexes 18 18 19 21 21 22 23 Ergebnisse 25 3.1 Demographische Daten 25 3.2 Patienten mit Krebserkrankungen 25 3.3 Sensitivität und Spezifität des ELISA 26 3.4 Prävalenz antineuronaler Antikörpern bei Patienten mit Multipler Sklerose 27 3.5 Positivkontrollen 32 3.6 Antikörperspezifitätsindex 32 4 Diskussion 33 5 Zusammenfassung 44 6 Literaturverzeichnis 45 7 Anhang 51 7.1 Materialien für ELISA 51 7.2 Abbildungsverzeichnis 52 7.3 Tabellenverzeichnis 52 8 Abkürzungsverzeichnis 53 9 Lebenslauf 54 10 Danksagung 55 Einleitung 1 Einleitung 1.1 Multiple Sklerose: Inzidenz und Krankheitsbild Die Multiple Sklerose (MS) zählt zu den häufigsten atraumatischen neurologischen Erkrankungen junger Erwachsener [46]. In Deutschland erkranken jährlich 3,5 bis 5 pro 100 000 Einwohner neu an MS (Inzidenz), wobei Frauen etwa doppelt bis dreifach so häufig betroffen sind wie Männer [11], [13]. Weltweit ist etwa eine Million Menschen an MS erkrankt [11], in Deutschland wird die Zahl der Erkrankten auf 100 000-120 000 geschätzt [32]. In den nördlichen und südlichen Breitengraden scheint die MS häufiger aufzutreten als in den äquatornahen Zonen, was auf verschiedene Faktoren wie genetische Disposition, Klima, Ernährung und unterschiedlichen Hygienestandards zurückzuführen sein kann [13]. Bei den meisten Patienten liegt das durchschnittliche Alter bei Erkrankungsbeginn zwischen dem 20. und 40. Lebensjahr, in einigen Fällen kann sich die MS aber auch schon vor dem zehnten Lebensjahr und selten nach dem 60. Lebensjahr manifestieren [13]. Die Multiple Sklerose ist eine chronische Erkrankung unklarer Ätiologie, deren Charakteristika die Entzündung und Demyelinisierung der Nervenbahnen in Gehirn und Rückenmark sind. Diese Schädigungen können an den unterschiedlichsten Stellen des zentralen Nervensystems (ZNS), vor allem jedoch in der weißen Substanz auftreten, so dass es zu einer Vielzahl unterschiedlicher Symptome kommen kann [53]: Häufige Frühsymptome sind Sehstörungen, Störungen der Augenbewegungen mit Doppelbildern, Gefühlsstörungen, Gangunsicherheit und erste Lähmungserscheinungen an Armen und Beinen. Im weiteren Verlauf können neben Schmerzsyndromen, Gleichgewichtsstörungen und Miktionsstörungen auch Sprech- und Schluckstörungen hinzukommen [19], [34]. Neben dem Krankheitsbild ist auch der Verlauf der MS sehr variabel. Grundsätzlich kann man drei verschiedene Verlaufsformen unterscheiden: 1. den primär chronisch progredienten Verlauf (primary progressive MS, PPMS) 2. den schubförmig remittierenden Verlauf (relapsing-remitting MS, RRMS) 1 Einleitung 3. den sekundär chronisch progredienten Verlauf (secondary progressive MS, SPMS) Die primär chronisch progrediente MS ist durch eine schleichende Zunahme der neurologischen Symptome über einen Zeitraum von mindestens zwölf Monaten definiert [48]. Während des Krankheitsverlaufes kommt es zu keinen schubartigen Episoden oder einer Rückbildung der Symptome. Die Diagnose der PPMS wird eher bei älteren Personen gestellt [34]. Von dieser Verlaufsform sind etwa 10 - 15% der MS-Erkrankten betroffen Behandlungsoptionen [14]. vor, Für bei die PPMS liegen überlagernden keine Schüben etablierten kann ein Behandlungsversuch mit Interferon beta 1b unternommen werden und bei maßgeblicher Bedrohung der Gehfähigkeit wird probatorisch eine immunsuppressive Behandlung (z.B. mit Mitoxantron oder Cyclophosphamid) empfohlen [11]. Bei über 80% der Patienten ist die Erkrankung durch einen schubförmigen Verlauf charakterisiert. Als Schub wird ein akuter neurologischer Ausfall bzw. die Verschlechterung einer vorbestehenden Symptomatik definiert, die mindestens 24 Stunden lang anhält und mit einem Zeitintervall von mindestens 30 Tagen zum Beginn vorausgegangener Schübe auftritt. Gleichzeitig sollen keine Infekte oder Fieber nachweisbar und die Symptome nicht Körpertemperatur (Uthoff-Phänom) erklärbar sein. durch eine Änderung der Häufig können initial eine einseitige Optikusneuritis, eine belastungsabhängige Schwäche der Beine oder Sensibilitätsstörungen beobachtet werden. Im Verlauf können sich die Symptome vollständig oder zumindest teilweise zurückbilden [11]. Diese Verlaufsform ist die häufigste und betrifft initial vor allem jüngere Menschen zwischen dem 20. und 40. Lebensjahr. Therapie der Wahl eines Schubes ist eine Steroid-Hochdosistherapie über drei bis fünf Tage. Für die Schubprophylaxe stehen Immunmodulatoren wie Interferon beta und Glatirameracetat sowie seit kurzem auch der monoklonale Antikörper Natalizumab zur Verfügung [11]. Bei etwa 30 - 40% der Erkrankten kommt es nach zehn bis 15 Jahren zu einer schleichenden Progredienz der Symptome auch ohne zusätzliche Schübe. Man spricht dann von einem sekundär chronisch progredienten Verlauf [11], [14]. 2 Einleitung Therapeutisch werden bei relevanter Verschlechterung der Gehfähigkeit überwiegend Immunsuppressiva eingesetzt. Das erstmalige Auftreten eines klinischen Ereignisses mit MS-typischen Symptomen wird als „klinisch isoliertes Syndrom“ (clinically isolated syndrome, CIS) bezeichnet [11]. Die Diagnose einer MS nach den McDonald-Kriterien kann jedoch erst nach einer zeitlichen Dissemination im Sinne eines zweiten Schubes oder einer subklinischen Progression der Erkrankung (neue T2-Läsion) in einem zweiten, nach 30 Tagen durchgeführten MRT festgestellt werden [48]. 1.1.1 Pathogenese Kennzeichnend für die Pathogenese der MS sind die Entstehung multipler Entzündungsherde und die Demyelinisierung und axonale Schädigung der Nervenbahnen im ZNS [46]. Zu Beginn der Erkrankung steht vor allem der Nachweis entmarkter Plaques im Vordergrund [5]. Dabei können histopathologisch vier unterschiedliche Subtypen der Demyelinisierung unterschieden werden, wobei die Entmarkungsmuster bei verschiedenen MS-Patienten unterschiedlich sein können, während verschiedene Läsionen beim gleichen Patienten dasselbe Muster aufweisen: Die beiden ersten Muster sind durch Makrophagen-vermittelte (Typ I) und Komplement- und Antikörpervermittelte (Typ II) Entzündungsreaktionen gekennzeichnet. Bei den beiden anderen Mustern (Typ III und IV) ist die Schädigung der myelinbildenden Zellen (Oligodentrozyten) ein wesentliches Merkmal [5], [11]. Neben der Demyelinisierung treten zu diesem Zeitpunkt auch bereits axonale Schädigungen und Remyelinisierungsprozesse auf, der Endzustand eines MSHerdes ist durch die makroskopisch sichtbare Vernarbung (Sklerose) charakterisiert [5], [11]. Die Läsionen treten multifokal auf, vor allem sind aber die periventrikuläre weiße Substanz, der Nervus opticus, der Hirnstamm, das Cerebellum und das Rückenmark betroffen [46]. Man nimmt an, dass die Schädigung des ZNS initial auf eine T-Zell-vermittelte Autoimmunreaktion gegen die Myelinschicht der Neurone zurückzuführen ist [5], [18], [39]: Aktivierte T-Lymphozyten durchdringen die Blut-Hirn-Schranke und erkennen 3 Einleitung Myelinantigene, welche ihnen von Mikrogliazellen (MHC Cd8+) präsentiert werden. Daraufhin induzieren die T-Lymphozyten eine Entzündungsreaktion und setzen Zytokine (INF-γ, TNF-α, IL-2) und Proteasen frei, die zu einer Öffnung der BlutHirnschranke und damit zum Einstrom von weiteren Immunzellen und Antikörpern führen. Die Zytokine aktivieren außerdem weitere Mikrogliazellen und Astrozyten, so dass auch diese Antigene präsentieren können [39]. Während T-Zellen wahrscheinlich für die Initiation der Inflammation durch Überwindung der Blut-Hirn-Schranke verantwortlich sind, erfolgt die Demyelinisierung durch weitere Immunmechanismen der zellulären und humoralen Immunantwort [39]: Dabei spielen Autoantikörper, die sich gegen eine Vielzahl von Myelinproteinen wie beispielsweise dem Myelin-Oligodentrozyten-Antigen (MOG) oder dem basischen Myelinprotein (MBP) richten, eine mögliche Rolle [4]. Des Weiteren tragen Mechanismen wie aktivierte Makrophagen oder myelinolytische Zytokine zum Abbau des Myelins bei [39]. Immunologischer Ausdruck des entzündlichen Prozesses im ZNS ist bei der Mehrheit der MS-Patienten eine intrathekale Immunglobulinproduktion. Der Nachweis von sog. oligoklonalen Immunglobulin-G-Banden (OKB) überwiegend oder ausschließlich im Liquor spielt in der MS-Diagnostik eine maßgebliche Rolle [34]. In letzter Zeit wurde auch die axonale Schädigung als Faktor bei der Entstehung der MS diskutiert [15], [46], [35], [52], [56]: Dabei soll es durch die Freisetzung von Stickstoffmonoxid und Glutamat, aber auch durch B-Zell-Antikörper, die zu einer Unterversorgung der Axone mit ATP führen, zur Schädigung und zum Untergang der Axone kommen. Nach Meinung der Experten korrelieren die entzündlichen und demyelinisierenden Prozesse und die axonale Schädigung mit den progredienten und den schubförmigen Phasen der MS, während sie die Remission nach einem Schub als einen Rückgang der Entzündungsreaktion, als eine Remyelinisierung und eine vermehrte Ausbildung von Natriumkanälen entlang der geschädigten Nervenfaser bewerten [46]. 4 Einleitung 1.1.2 Diagnostik Die Diagnosestellung der MS erfolgt nach den McDonald-Kriterien, die im Jahr 2001 veröffentlicht und im Jahr 2005 überarbeitet und revidiert wurden [38], [48]. Es soll hervorgehoben werden, dass die Diagnose „MS“ eine Ausschlussdiagnose ist, da eine Vielzahl weiterer Autoimmunerkrankungen (z.B. Kollagenosen) sowie Infektionen das Bild der MS phänomenologisch imitieren können. In Tabelle 1 ist ein Schema zur Diagnosefindung nach den McDonald-Kriterien dargestellt. Darin steht vor allem der MRT-Nachweis einer räumlichen und zeitlichen Dissemination im Vordergrund. Für den Nachweis einer räumlichen Dissemination sollen drei der vier folgenden Kriterien erfüllt sein [48]: 1. Mindestens eine Gadolinium anreichernde Läsion oder neun hyperintense Läsionen in der T2-Gewichtung. 2. Mindestens eine infratentorielle Läsion. 3. Mindestens eine juxtakortikale Läsion. 4. Mindestens drei periventrikuläre Läsionen. Zusätzlich gilt nach der Revision 2005 [48]: - Eine Läsion im Rückenmark kann eine infratentorielle Läsion ersetzen. - Eine Kontrastmittel aufnehmende Läsion im Rückenmark kann eine Kontrastmittel aufnehmende Läsion im Gehirn ersetzen. - Um die neun erforderlichen T2-Läsionen zu erreichen, kann eine Läsion im Rückenmark dazu addiert werden. Eine zeitlichen Dissemination gilt als nachgewiesen, wenn: 1. Eine Gadolinium anreichernde Läsion mindestens drei Monate nach erstmaligem Auftreten der Erkrankung auftritt und diese Läsion eine andere Lokalisation hat als die des vorausgegangen Schubes oder 5 Einleitung 2. zu einem beliebigen Zeitpunkt eine neue T2-Läsion im Vergleich zu einer Voruntersuchung auftritt, die mindestens 30 Tage nach erstmaligem Auftreten der Erkrankung durchgeführt wurde. Tabelle 1 - McDonald Kriterien zur Diagnosefindung einer MS [48] Klinik Nachweisbare Läsionen Zwei oder mehr Schübe Zwei oder mehr Schübe Zwei oder mehr Ein Schub Zwei oder mehr Ein Schub Eine PPMS Eine Zusätzliche Anforderungen zur Diagnosestellung • keine weitere Anforderung nötig • MRT-Befund hinsichtlich einer räumlichen Dissemination oder • Nachweis von zwei oder mehr MS-typischen Läsionen im MRT plus positiver Liquorbefund oder • ein weiterer Schub, der eine andere Stelle des ZNS betrifft • MRT-Befund hinsichtlich einer zeitlichen Dissemination oder • klinischer Nachweis eines zweiten Schubes • MRT-Befund hinsichtlich einer räumlichen Dissemination oder • Nachweis von zwei oder mehr MS-typischen Läsionen im MRT plus positiver Liquorbefund und • MRT-Befund hinsichtlich einer zeitlichen Dissemination oder • klinischer Nachweis eines zweiten Schubes Kontinuierliches Fortschreiten der Erkrankung über 12 Monate und zwei der folgenden Kriterien: A: mindestens 9 Läsionen im T2 gewichteten MRT oder mindestens vier T2 Läsionen mit pathologischen visuell evozierten Potentialen (VEP) B: zwei Läsionen des Rückenmarks in der T2 Gewichtung des MRT C: positiver Liquorbefund Tabelle 1 - McDonald Kriterien zur Diagnosefindung einer MS [48] Die revidierten McDonald-Kriterien von 2005 schlagen auch für die Diagnosestellung einer PPMS Neuerungen vor: Diese Verlaufsform gilt nun nach Ausschluss anderer Differentialdiagnosen als gesichert, wenn die Erkrankung über mindestens zwölf Monate kontinuierlich fortschreitet und zwei weitere Kriterien zutreffen (s. Tabelle 1). Hierbei ist der Nachweis eines positiven Liquorbefundes nicht mehr zwingend 6 Einleitung erforderlich, vielmehr erhält ein positiver Befund im MRT einen höheren Stellenwert [48]. 1.2 Paraneoplastische neurologische Syndrome: Krankheitsbild Als paraneoplastische neurologische Syndrome (PNS) bezeichnet man neurologische Erkrankungen, die mit einem Tumor assoziiert sind. Die Ursache der PNS kann dabei jedoch nicht direkt auf den Tumor selbst, seine Metastasen oder die Therapie des Tumorleidens zurückgeführt werden. PNS sind sehr seltene Erkrankungen, die Inzidenz beträgt nur etwa 0,5-3% der Tumorpatienten [29]. Am häufigsten liegen PNS ein kleinzelliges Bronchial-, Mamma- oder Ovarialkarzinom zu Grunde, auch Hodentumoren, Prostatakarzinome, Thymome und Hodgkin- Lymphome sind häufig mit PNS assoziiert [21], [29], [61]. Anhand von klinisch-anatomischen Gesichtspunkten lässt sich eine Einteilung der PNS in Syndrome des ZNS, des peripheren Nervensystems sowie Syndrome der neuromuskulären Übertragung und des Muskels vornehmen [21]. Die sog. klassischen PNS sind in Tabelle 2 aufgezählt: Tabelle 2: Klinisch-anatomische Klassifikation paraneoplastischer neurologischer Syndrome Syndrome des ZNS: - Enzephalomyelitis - Limbische Enzephalitis - Subakute Kleinhirndegeneration - Opsoklonus-Myoklonus-Syndrom Syndrome des peripheren Nervensystems: - Subakute sensorische Neuronopathie - Chronische gastrointestinale Pseudoobstruktion Syndrome der neuromuskulären Übertragung und des Muskels: - Dermatomyositis, Polymyositis - Lambert-Eaton-Myastheniesyndrom Tabelle 2 - Klinisch-anatomische Klassifikation paraneoplastischer neurologischer Syndrome 7 Einleitung 1.2.1 Pathogenese Der Pathogenese der PNS liegt wahrscheinlich ein Autoimmunprozess zu Grunde. Man nimmt an, dass es im Tumor zu einer ektopen Expression von Proteinen kommt, die physiologischerweise nur im Nervengewebe exprimiert werden [39]. Diese Proteine induzieren als onkoneurale Antigene eine Immunantwort, bei der sich kreuzreaktive Autoantikörper sowohl gegen die Tumorzellen als auch gegen Nervenzellen richten und so zu einer Nervenzellschädigung führen. Dieser pathophysiologische Mechanismus wurde bisher allerdings nur für drei PNS (das Lambert-Eaton-Syndrom, die Neuromyotonie und die tumorassozierte Retinopathie) nachgewiesen, indem die Erkrankung durch passive Immunisierung bei Labortieren auf diese übertragen werden konnte. Bei den anderen PNS konnte die pathophysiologische Bedeutung der Autoantikörper bislang nicht gezeigt werden [29], bei ihnen vermutet man einen T-Zell-Effektor-Mechanismus als pathogenetische Grundlage [1], [50], [62]. Es finden sich auch Hinweise darauf, dass eine Expression von onkoneuralen Antigenen seitens des Tumors alleine nicht ausreicht, um eine Autoimmunantwort zu induzieren. Laut Dalmau und Kollegen sind auch immunmodulierende Faktoren wie der Major Histocompatibility Complex (MHC) bei der Präsentation der Tumorantigene (Hu-Protein) und der damit resultierenden anti-Tumorantwort beteiligt [7]. Des Weiteren wird Apoptose-induzierenden Proteinen der TNF-Rezeptor-Superfamilie (Fas-Proteinen) eine immunregulative Rolle zugeschrieben: Eine Störung der immunsuppressiven Funktion dieser Proteine wie der Induktion der Apoptose und der Unterdrückung der T-Zell-Proliferation führt zu einer mangelnden T-Zellsuppression und damit möglicherweise zu einer gesteigerten Autoimmunantwort [23]. Da die gegen den Tumor gerichtete Immunantwort dazu beizutragen scheint, dass der Tumor sich für einige Zeit nicht ausdehnt und die Erkrankung auf diese Weise einen „gutartigeren Verlauf“ nimmt [29], könnte der Sinn der paraneoplastischen Autoimmunreaktion in der Abwehr des Tumors durch das Immunsystem vermutet werden. In einigen Studien konnte eine Assoziation zwischen einem positiven Antikörperbefund und einem längerem Überleben der untersuchten Patienten gefunden werden [20], [64]. Für die Behandlung der PNS wird eine frühzeitige Entfernung des Tumors und damit der ektopen Antigene empfohlen [61]. 8 Einleitung Aufgrund ihrer hohen Spezifität für einen zu Grunde liegenden Tumor gelten antineuronale Antikörper als wichtiger Indikator für einen noch nicht entdeckten Tumor [29], [61]. In vielen Fällen zeigt sich das PNS bevor sich der Tumor klinisch manifestiert [9], [29]. Aus diesem Grund misst man in der Tumorfrühdiagnostik dem Nachweis antineuronaler Antikörper eine wichtige Bedeutung bei. 1.2.2 Diagnostik Die Diagnosestellung eines PNS erfolgt hauptsächlich anhand der klinischen Symptomatik des Patienten in Assoziation mit einem (latenten) Tumor und dem Nachweis spezifischer Autoantikörper mittels Immunoblot oder in einem Enzymlinked immunosorbant-assay (ELISA). Voraussetzung ist, dass andere z.B. infektbedingte Ursachen eines neurologischen Syndroms ausgeschlossen werden können [61]. Zur Sicherung des Befundes erfolgt ein Bestätigungstest mit einem zweiten Verfahren, z.B. der indirekten Immunfluoreszenz. Von einer europäischen Konsensusgruppe wurden Diagnosekriterien und eine Einteilung in eine definitive und mögliche PNS vorgeschlagen [21]. Diese Kriterien basieren auf dem Vorhandensein eines neurologischen Syndroms, dem Nachweis sog. gut charakterisierter antineuronaler Antikörper sowie der Diagnosestellung eines für das PNS typischen Tumors. Hierbei wird zwischen gut charakterisierten antineuronalen Antikörpern und nicht gut charakterisierten Antikörpern unterschieden: Die Bezeichnung „gut charakterisiert“ beinhaltet, dass die Antikörper von mindesten zwei Arbeitsgruppen bestätigt und an einer ausreichenden Anzahl von Patienten und Kontrollgruppen getestet wurden [61]. Zu diesen Antikörpern zählen anti-HuD, anti-Yo, anti-Ma2, anti-Ri, anti-CV2 und anti-Amphiphysin. Kriterien, die zur Diagnose eines definitiven PNS führen: 1. Ein neurologische Syndrom (klassisch oder nicht klassisch) und Nachweis gut charakterisierter antineuronaler Antikörper. 2. Ein klassisches PNS und eine Tumordiagnose innerhalb von fünf Jahren. 9 Einleitung 3. Ein nicht klassisches Syndrom, Nachweis antineuronaler Antikörper (gut charakterisiert oder nicht gut charakterisiert) und eine Tumordiagnose innerhalb von fünf Jahren. 4. Ein nicht klassisches Syndrom bei bekanntem Tumorleiden und Besserung des neurologischen Syndroms nach Tumortherapie. Kriterien eines möglichen PNS: 1. Ein klassisches PNS, keine antineuronalen Antikörper, aber ein hohes Tumorrisiko (Risikofaktoren sind z.B. Rauchen, Alter über 40 Jahre oder keine Besserung der neurologischen Symptomatik nach Immuntherapie). 2. Ein neurologisches Syndrom (klassisch oder nicht klassisch) und Nachweis (noch) nicht gut charakterisierter Antikörper. 3. Ein nicht klassisches Syndrom, keine antineuronalen Antikörper, aber Tumordiagnose innerhalb von zwei Jahren. Die Kriterien zur Diagnosefindung der PNS zeigen, welchen hohen Stellenwert der Nachweis antineuronaler Antikörper in den letzten Jahren erlangt hat. Daher ist es nachvollziehbar, dass neben der Einteilung der PNS nach klinisch-anatomischen Gesichtspunkten (s. Tabelle 2) eine Klassifikation anhand des Antikörperbefundes zunehmend an Bedeutung gewonnen hat. In Tabelle 3 ist eine Übersicht der sechs gut charakterisierten antineuronalen Antikörper, die dieser Arbeit zu Grunde liegen, und den damit assoziierten Tumoren zusammengefasst [29], [61]. 10 und häufig einhergehenden PNS Einleitung Tabelle 3 - Gut charakterisierte antineuronale Antikörper Antikörper Häufig assoziierte Tumore Neurologisches Syndrom Anti-Hu - Kleinzelliges BronchialCa (- Neuroblastom) (- Prostata-Ca) Anti-Ri - Mamma-Ca - Kleinzelliges BronchialCa - Ovarial-Ca - Mamma-Ca - Seminom - Bronchial-Ca - Limbische Enzephalitis - Hirnstammenzephalitis - Paraneoplastische Enzephalomyelitis - Subakute sensorische und autonome Neuropathie - Chronisch gastrointestinale Pseudoobstruktion - Kleinhirndegeneration - Opsoklonus-MyoklonusSyndrom - Myelitis - Kleinhirndegeneration Anti-Yo Anti-Ma2 Anti-CV2 - Kleinzelliges BronchialCa - Thymom Anti-Amphiphysin - Mamma-Ca - Kleinzelliges BronchialCa - Limbische Enzephalitis - Hirnstammenzephalitis - Kleinhirndegeneration - Limbische Enzephalitis - Kleinhirndegeneration - Sensible Polyneuropathie - Chronisch gastrointestinale Pseudoobstruktion - Lambert-Eaton-Syndrom - Stiff-Person-Syndrom - Neuropathie Tabelle 3 - Gut charakterisierte antineuronale Antikörper 1.2.3 Spezifischer Antikörperindex Der Nachweis antineuronaler Antikörper kann sowohl im Serum als auch im Liquor erfolgen [16]. Aus dem Quotienten der spezifischen Antikörper beider Kompartimente im Verhältnis zum Quotienten des Gesamt-IgG in Liquor und Serum lässt sich der spezifische Antikörper-Index (AI) berechnen. Dieser dient als Maßstab zur Quantifizierung der intrathekalen Synthese spezifischer antineuronaler Antikörper. In einigen Fällen konnte beobachtet werden, dass die Antikörperkonzentration im Liquor höher war als im Serum [16]. Vega et al. beschreiben in einer Studie, dass bei Patienten mit einem anti-Hu assoziierten PNS und einer klinischen Manifestation des Krankheitsbildes im ZNS eine intrathekale anti-Hu Synthese aufgezeigt werden 11 Einleitung konnte, wohingegen bei Patienten mit einer isolierten paraneoplastischen sensorischen Neuropathie keine intrathekale Antikörpersynthese nachweisbar war [60]. Dies lässt vermuten, dass eine klinisch-immunologische Korrelation zwischen einer zentralen Manifestation bei positivem Antikörperindex einerseits und einer peripheren Manifestation bei fehlendem Nachweis einer spezifischen intrathekalen Synthese andererseits existiert. 12 Einleitung 1.3 Fragestellung Den Krankheitsbildern MS und PNS liegen höchstwahrscheinlich Autoimmunprozesse zu Grunde, deren Ursachen für beide Erkrankungen nicht vollständig geklärt sind. Bei der Erstmanifestation beider Erkrankungen können die Symptome der MS und PNS einander ähneln, so dass sich die Unterscheidung für den Kliniker als schwierig erweisen kann. So konnte bislang die Frage, ob das Krankheitsbild der MS in manchen Fällen durch eine antineuronale Immunreaktion eines PNS imitiert werden kann, nicht sicher beantwortet werden [39]. PNS sollten daher als mögliche Differentialdiagnose der MS in Erwägung gezogen werden. Sowohl bei der MS als auch den PNS ist es möglich, im Liquor und Serum der Patienten eine Vielzahl von Autoantikörpern nachzuweisen. Während solche Antikörper bei der MS allerdings nicht spezifisch sind, sondern auch bei anderen demyelinisierenden Erkrankungen vorkommen können [4], [19], liefert der Nachweis antineuronaler Antikörper einen direkten Hinweis auf eine paraneoplastische Genese [21], [61]. Bislang wurde noch kein größeres Kollektiv an MS-Patienten systematisch auf die Prävalenz der gut charakterisierten paraneoplastischen antineuronalen Antikörper untersucht. Das Hauptziel der vorliegenden Arbeit ist deshalb die retrospektive Analyse der Seren eines großen Kollektives an MS-Patienten der Universitätsklinik Freiburg auf die Prävalenz der sechs gut etablierten Antikörper anti-Hu, anti-Yo, antiMa2, anti-Ri, anti-CV2 und anti-Amphiphysin. Ferner soll bei Seren, die einen positiven Antikörperbefund aufweisen, der spezifische Antikörperindex bestimmt werden und so eine Quantifizierung der intrathekalen Antikörpersynthese ermöglicht werden. Dabei liegen der vorliegenden Arbeit folgende Hypothesen zu Grunde: Sollte sich bei einem der MS-Patienten retrospektiv eine hohe antineuronale Aktivität nachweisen lassen, muss bei diesem Patienten die Diagnose „MS“ reevaluiert werden und differentialdiagnostisch an ein PNS gedacht werden. Ferner stellt sich die Frage, ob bei der MS der Neuronenuntergang durch die entzündlich-degenerativen Prozesse zu einer sekundär-unspezifischen Erhöhung der gut etablierten antineuronalen Antikörper im Sinne eines Epiphenomens führen kann. 13 Patienten, Material, Methoden 2 Patienten, Material, Methoden In der vorliegenden Arbeit wurden retrospektiv die Seren von 247 Probanden auf die Prävalenz der antineuronalen Antikörpern anti-HuD, anti-Yo, anti-Ma2, anti-Ri, antiCV2 und anti-Amphiphysin untersucht. Der Antikörpernachweis erfolgte mittels ELISA, bei zweimalig positivem Testergebnis im ELISA wurden die Seren mit einem Bestätigungstest (Immunoblot und Immunfluoreszenz) untersucht. 2.1 Patientenkollektiv Im Zeitraum vom 01.01.1996 bis zum 31.12.2005 wurden in der neurologischen Abteilung der Universitätsklinik Freiburg 684 Patienten mit der Diagnose Multiple Sklerose (ICD G35.-, 341.-) erfasst. Aus dieser Patientengruppe wurde ein Kollektiv von 247 Probanden zusammengestellt, bei denen im Rahmen von Routineuntersuchungen in der Universitätsklinik Freiburg Serum und gegebenenfalls Liquor entnommen und bei -80°C tief gefroren worden war. Es erfolgte eine telefonische und schriftliche Kontaktaufnahme mit diesen Patienten, um über die Ziele und Inhalte der Studie aufzuklären. Des Weiteren wurde um eine mündliche und schriftliche Zustimmung zur retrospektiven Untersuchung der asservierten Proben gebeten. Die Studie wurde von der Ethikkommission der Universitätsklinik Freiburg genehmigt (Antragsnummer Ethikkommission Freiburg: 214/09; Votum vom 09. Oktober 2006). 2.1.1 Kriterien zur Unterteilung des Patientenkollektivs: Ausgehend von den Arztbriefen und Krankenakten der Patienten wurde das Kollektiv im Weiteren in folgende vier Gruppen unterteilt: Gruppe 1: Patienten mit primär chronisch progredient verlaufender MS (PPMS) Gruppe 2: Patienten mit schubförmig remittierender MS (RRMS) Gruppe 3: Patienten mir sekundär chronisch progredient verlaufender MS (SPMS) Gruppe 4: Patienten mit wahrscheinlicher MS (CIS) 14 Patienten, Material, Methoden Die Unterteilung des Patientenkollektivs in die vier Untergruppen orientierte sich an den unterschiedlichen Verlaufsformen der MS. Die Diagnose „MS“ aller Patienten wurde klinisch, liquordiagnostisch und kernspintomographisch in der Routinediagnostik gesichert. Anhand der Arztbriefe wurden die Patienten unter Berücksichtigung des in der Anamnese beschriebenen Verlaufs der Symptome sowie dem dokumentierten Verlauf der Erkrankung gemäß der McDonald Kriterien [38] in die oben genannten Subgruppen eingeteilt. Für die einzelnen Definitionen der vier Untergruppen sei auf das Kapitel 1.1 in der Einleitung dieser Arbeit verwiesen. Abbildung 1 demonstriert die Einteilung des Patientenkollektives anhand eines Flussdiagrammes: Abbildung 1 - Einteilung des Patientenkollektives dargestellt als Flussdiagramm 2.1.2 Kontrollkollektive Als Negativkontrolle dienten 45 Seren von gesunden Studenten und Liquor/Serumproben von Patienten mit Normaldruckhydrozephalus (NPH), deren Studiendaten in einer vorausgegangen Arbeit von Barbara Kleer erhoben worden waren [31]. Als Positivkontrolle wurden die Liquor- und Serumproben von 23 Patienten verwendet, die klinisch und serologisch ein gesichertes PNS gemäß der 15 Patienten, Material, Methoden Konsensuskriterien von 2004 [21] mit hohen Titern der antineuronalen Antikörper anti-HuD, Yo, Ri, Ma2, CV2 und Amphiphysin aufwiesen. 21 dieser Patienten wurden bereits in der vorausgegangenen Arbeit von Barbara Kleer untersucht [31]. 2.2 Versuchsmaterialien 2.2.1 Antigene Die Untersuchung der Patientenproben im ELISA basierte auf der Verwendung der sechs gut charakterisierten onkoneuralen Antigene HuD, Ri, Ma2, Yo, Amphiphysin und CV2. Diese wurden mittels des Baclovirus Expressionssystems rekombinant hergestellt, unter Verwendung der Affinitätschromatographie gereinigt und von Ravo Diagnostika in Freiburg zur Verfügung gestellt. 2.2.2 Chemikalien Die verwendeten Chemikalien und weitere Laborreagentien sind im Anhang (s. Kapitel 7.1) aufgelistet. 2.2.3 Geräte Die Serum- und Liquorproben wurden in Mikrotiterplatten mit 96 Vertiefungen, Flachboden und hoher Bindungskapazität der Firma Greiner getestet: Abbildung 2 - ELISA-Platten mit 96 Vertiefungen mit Flachboden 16 Patienten, Material, Methoden Die einzelnen Waschschritte erfolgten mit Hilfe eines Platten-Waschgerätes der Firma Tecan: Abbildung 3 - ELISA-Washer mit Wasser-, Pufferlösung- und Abfallbehälter Zur Inkubation bei 37°C wurden die ELISA-Platten in einem Wärmeschrank der Firma Heraeus Instruments aufbewahrt: Abbildung 4 - Wärmeschrank 17 Patienten, Material, Methoden Für die Messung der Farbreaktion wurden die Platten in einem ELISA-Reader der Firma Biolinx, Dynatec MR 4000, gelesen. Die Auswertung erfolgte an einer angeschlossenen Computerstation: Abbildung 5 - Plattenlesegerät und Computerarbeitsplatz 2.3 Methoden Der Nachweis und die Quantifizierung der antineuronalen Antikörper erfolgte mittels eines Enzym-linked immunosorbent assay (ELISA): 2.3.1 Funktionsprinzip des ELISA 1. Verdünntes Serum wird in die Vertiefungen (Wells) einer Mikrotiterplatte pipettiert. In diesen Wells sind spezifische Antigene gebunden (Festphase). 2. Wenn spezifische Antikörper (Primärantikörper) in den Serumproben vorhanden sind, binden diese an die adsorbierten Antigene. 3. In mehreren Spülschritten erfolgt die Entfernung nicht gebundener, überschüssiger Serumbestandteile. 4. Danach wird ein zweiter Antikörper aufgetragen, der gegen den ersten Antikörper gerichtet ist. An diesen Sekundärantikörper ist ein Enzym (Peroxidase) gekoppelt. 5. Im nächsten Schritt wird ein farbloses Substrat hinzugegeben, welches von dem Enzym in einen Farbstoff umgesetzt wird. 18 Patienten, Material, Methoden 6. Die Färbung lässt sich mit einem Photometer (ELISA-Reader) als optische Dichte (OD) messen: je mehr Primärantikörper im Serum vorhanden sind, desto intensiver ist der Farbumschlag des Substrates und desto größer ist die OD. Substrat Optische Dichte ~ Antikörperkonzentration in Serumprobe Farbreaktion Peroxidase-markierter Sekundärantikörper Probe mit Primärantikörper, der am Antigen bindet adsorbiertes Antigen Plattenboden Abbildung 6 - Funktionsprinzip des ELISA 2.3.2 Durchführung des ELISA Im ersten Schritt erfolgte die Beschichtung der Mikrotiterplatte mit dem Antigen: Dazu wurde die entsprechende Menge Antigen (s. Tabelle 4) in Beschichtungspuffer (pH 9,6) verdünnt und jeweils 100µl in die Vertiefungen pipettiert. Die Mikrotiterplatte wurde dann über Nacht bei 4°C inkubiert, um eine Bi ndung des Antigens an die Platte zu erreichen. Am nächsten Tag wurde nach dreimaligem Waschvorgang mit Waschpuffer je 100µl Verdünnungspuffer in die Wells aufgetragen und die Platten bei Raumtemperatur erneut inkubiert, um unspezifische Bindungen zu blockieren. Im zweiten Schritt wurden die Serumproben mit Verdünnungspuffer je nach zu bestimmenden Antikörper im Verhältnis 1:2000, 1:1000 und 1:500 verdünnt (s. Tabelle 4) und je 100µl der Proben in die Wells pipettiert. Zur Doppeltbestimmung wurden dabei jeweils zwei Vertiefungen mit derselben Probe gefüllt. Zusätzlich zu 19 Patienten, Material, Methoden den Serumproben wurden auf jeder Platte ein Positiv-, eine Negativkontrolle und ein Leerwert (nur Verdünnungspuffer) mitgeführt. Während der 30 minütigen Inkubation bei 37°C konnten eventuell vorhandene Antikörper au s der Serumprobe an das Antigen binden. Die Platten wurden erneut dreimal gewaschen und mit Verdünnungspuffer für eine Stunde geblockt. Nachdem der mit Peroxidase (HRP; horse radish peroxidase) konjugierte Sekundärantikörper zuvor im Verhältnis von 1:5000 in Verdünnungspuffer verdünnt worden war, wurde dieser nun mit jeweils 100µl in die Vertiefungen aufgetragen, die Platten bei 37°C über dreißig Minuten inkubiert und danach erneut dreimal gewaschen. Für die Farbentwicklung wurden vier Orthophenylendiamin- (OPD) Tabletten eine halbe Stunde vor dem Entwicklungsschritt lichtgeschützt in 12ml Aqua dest. aufgelöst und kurz vor Start der Reaktion 10µl H202 dazugegeben. Dann wurden jeweils 100µl dieser Substratlösung in die Wells pipettiert und nach der jeweiligen Entwicklungszeit (s. Tabelle 4) 50µl H2SO4 dazu gegeben, um den Farbumschlag zu stoppen. Tabelle 4 - Konzentrationen für Antigenbeschichtung, Serumverdünnungen, Entwicklungszeiten und Cut off-Werte der jeweiligen Antigene Antigen Konzentration Serumverdünnung Entwicklungszeit Cut off Beschichtung [min] [mg/l] HuD 0,8 1:500 1:15 0,077 Ri 0,2 1:1000 1:30 0,065 Yo 0,4 1:2000 1:15 0,049 Ma2 0,8 1:500 1:30 0,177 CV2 0,2 1:1000 1:30 0,156 Amphiphysin 0,2 1:1000 1:30 0,099 Tabelle 4 - Konzentrationen für Antigenbeschichtung, Serumverdünnungen, Entwicklungszeiten und Cut off-Werte der jeweiligen Antigene Im letzten Schritt erfolgte die Bestimmung der optischen Dichte mittels Photometer (ELISA-Reader) bei einer Wellenlänge von 410 nm. Zur Auswertung wurden die Mittelwerte der jeweiligen Doppeltbestimmungen berechnet und die Mittelwerte der Leerwertbestimmungen abgezogen. 20 Patienten, Material, Methoden In einer vorausgegangenen Arbeit von Barabara Kleer wurden die Cut off-Werte unter Verwendung der 45 Seren von NPH-Patienten und Studenten (Negativkontrollen) bestimmt (s. Tabelle 4) [31]. Lagen die Ergebnisse der ODMessung über diesen Werten, wurde die Serumprobe als positiv gewertet und in einem zweiten Durchlauf sowie in einer seriellen Verdünnung des Serums in direktem Vergleich zu einer seriellen Verdünnung einer Positivkontrolle erneut getestet. 2.3.3 Immunoblot mit rekombinanten Antigenen (Ravoblot) Bei positivem Befund im ELISA diente ein Immunoblot (ravo PNS blot, Ravo Diagnostika GmbH, Freiburg) als Bestätigungstest. Dieses Testverfahren verwendet rekombinante Antigene (HuD, Yo, Ri, Ma2, CV2, Amphiphysin) zum Nachweis antineuronaler Antikörper: Dabei werden verdünnte Serumproben (1:2000) auf Teststreifen mit Antigenen aufgetragen und 60 Minuten bei Raumtemperatur auf einem Schüttler inkubiert. Gebundene Antikörper können nun durch Zugabe eines mit Alkalischer Phosphatase markierten IgG-Konjugats (30 Minuten Inkubation) und eines gebrauchsfertigen Substrates (25 Minuten Inkubation) sichtbar gemacht werden. Die Farbreaktion wird durch Spülen mit Aqua dest. gestoppt und die Teststreifen mit einer Positivkontrolle verglichen. 2.3.4 Immunfluoreszenz Als dritte Methode zum Nachweis antineuronaler Antikörper wurde die indirekte Immunfluoreszenz herangezogen (Neurologie-Mosaik 1, Euroimmun, Lübeck, Germany). Bei diesem Verfahren werden Gewebeschnitte vom Primaten (Cerebellum, Darm und peripherer Nerv) als Antigen-Substrate verwendet. Während einer ersten Inkubationszeit von 30 Minuten binden sich bei positiven Proben die nachzuweisenden Antikörper aus dem verdünnten Patientenserum an die Antigene im Gewebe. Nach einem zweiten Inkubationsschritt (30 Minuten) mit Fluoreszinmarkierten Antikörpern und anschließendem mehrfachen Waschen können die gebundenen Antikörper im Fluoreszenzmikroskop nachgewiesen werden. 21 Patienten, Material, Methoden In den Abbildungen 7 und 8 sind eine Negativkontrolle und eine Positivkontrolle für das Yo-Antigen dargestellt. Abbildung 8 - Positivkontrolle Yo, Cerebellum Abbildung 7 - Negativkontrolle Yo, Cerebellum 2.3.5 Spezifischer Antikörperindex Bei Seren, die einen positiven Antikörperbefund im ELISA aufwiesen, wurde der spezifische Antikörperindex (AI) bestimmt, um damit eine Quantifizierung der intrathekalen Synthese antineuronaler Antikörper zu ermöglichen. Der AI wird aus dem Konzentrationsquotienten der spezifischen Antikörper in Liquor und Serum (Qspez) einerseits und dem Gesamt-IgG-Quotienten in Liquor und Serum (QIgG) andererseits nach folgender Formel berechnet: 1) AI = Qspez/QIgG Die Gesamt-IgG-Konzentration im Liquor kann durch verschiedene Prozesse beeinflusst werden und damit zu einer Verfälschung des AI führen: Entzündliche Prozesse im ZNS, die zu einer polyspezifischen intrathekalen Immunantwort führen, und Funktionsstörung der Blut-Liquor-Schranke können eine erhöhte Konzentration des Gesamt-IgG im Liquor zur Folge haben. Dadurch würde der AI mit falschniedrigen Werten berechnet werden [54]. Aus diesem Grund wird QIgG mit dem Albuminquotienten (QAlb) verglichen. Dieser ist ein Indikator für die Integrität der Blut-Liquor-Schranke, da Albumin ausschließlich 22 Patienten, Material, Methoden peripher, d.h. in der Leber produziert wird. Die nicht-lineare Beziehung zwischen QIgG und QAlb wird nach Reiber und Peter als eine hyperbolische Funktion dargestellt [49]: 2) QLim (QIgG) = 0,93√(QAlb)² + 6 x 10-6 - 1,7 x 10-3 Durch diese Funktion kann im so genannten „Reibergramm“ zwischen einer isoliert intrathekalen und einer peripheren IgG-Synthese mit Übertritt von IgG nach intrathekal unterschieden werden: QIgG -Werte, die oberhalb von QLim liegen, geben Hinweis auf eine polyspezifische intrathekale IgG-Synthese. In diesem Fall wird die Berechnung des AI auf QLim bezogen, damit die spezifische intrathekale Synthese nicht unterschätzt wird. Deshalb gilt: - AI = Qspez/ QIgG für QIgG < QLim - AI = Qspez / QLim für QIgG > QLim Als Referenzbereich gelten Werte für AI = 0,7-1,3. Werte des AI > 1,4 sind als pathologisch anzusehen und sprechen für eine intrathekale Synthese spezifischer Antikörper. 2.3.6 Bestimmung des Antikörperindexes Zur Berechnung von Qspez wurden mittels ELISA die ODs der Liquor-Serum-Paare bei verschiedenen Konzentrationen (20 mg/l, 10 mg/l, 5 mg/l, 2,5 mg/l, 1,25 mg/l, 0,63 mg/l) bestimmt: Dafür wurden die Probenpaare in Liquor und Serum beginnend bei 20 mg/l mit Verdünnungspuffer auf die gleiche IgG-Konzentration angeglichen und seriell verdünnt. Die Gesamt-IgG-Konzentrationen des Liquors (IgGLiquor) und des Serums (IgGSerum) sowie die Albuminkonzentrationen wurden im Routinelabor im Nephelometer bestimmt. Aus den im ELISA ermittelten ODs des Liquors (ODLiquor) und des Serums (ODSerum) und den Gesamt-IgG-Konzentrationen ließ sich nach der oben genannten Formel 1) der AI berechnen: 23 Patienten, Material, Methoden a) Qspez = ODLiquor / ODSerum b) QIgG = IgGLiquor / IgGSerum Und daraus folgend: c) AI = Q(ODLiquor / ODSerum)/ Q(IgGLiquor / IgGSerum) Mit Hilfe der Albuminkonzentrationen wurde nach Formel 2) QLim berechnet und mit QIgG verglichen: Für Patienten mit Hinweis auf eine polyspezifische IgGKonzentration (QIgG > QLim) wurde anstelle von QIgG zur Berechnung des AI QLim herangezogen: d) AI = Q(ODLiquor / ODSerum)/ QLim Auf diese Weise erhielt man entsprechend der Konzentrationsschritte je sechs Einzelwerte des AI. 24 Ergebnisse 3 Ergebnisse 3.1 Demographische Daten Insgesamt ergab sich innerhalb des Gesamtkollektivs eine Geschlechterverteilung von 82 Männern und 165 Frauen. Das durchschnittliche Alter bei Probenentnahme betrug 39,0 Jahre. Die größte Subgruppe stellte die Gruppe der RRMS mit insgesamt 136 Patienten dar, die Gruppen der PPMS, SPMS und wahrscheinliche MS/CIS umfassten jeweils 53, 32 und 26 Patienten. In Tabelle 5 finden sich die demographischen Daten des Probandenkollektivs und der Untergruppen zusammengefasst. Tabelle 5 - Demographische Daten der Patienten und Kontrollgruppen Gruppe/Subgruppe MS-Verlaufsform: PPMS RRMS SPMS wahrscheinliche MS/CIS Total n Altersdurchschnitt und Standardabweichung Geschlecht (M/F) 53 136 32 26 45,1 (10,7) 35,9 (10,3) 42,9 (14,4) 38,6 (10,6) 25/28 35/101 10/22 12/14 247 39,0 (11,5) 82/165 PPMS: primär chronisch progrediente MS; RRMS, schubförmig remittierende MS; SPMS, sekundär chronisch progrediente MS; CIS: klinisch isoliertes Syndrom Tabelle 5 - Demographische Daten der Patienten und Kontrollgruppen 3.2 Patienten mit Krebserkrankungen Bei drei der 247 (1,2%) getesteten MS-Patienten wurde in der Vorgeschichte von einem Tumor bzw. dem Verdacht auf eine Krebserkrankung berichtet: • Ein PPMS-Patient mit Zustand nach transurethaler Prostataresektion bei inzidentiellem Prostatakarzinom (pT1aGI) im Jahr 1996 und einer monoklonalen Gammopathie vom Typ IgG mit Verdacht auf Plasmozytom. Zum Zeitpunkt der Blutentnahme war der Patient 69 Jahre alt, zwischen 25 Ergebnisse Tumordiagnose und dem Auftreten neurologischer Symptome lagen zwei Jahre. • Eine RRMS-Patientin mit unklarer suprasellärer Raumforderung im MRT 2001, DD Zyste der Rathke-Tasche. Das Alter dieser Patientin betrug bei Probenentnahme 35 Jahre, zwischen dem Verdacht auf eine mögliche Tumorerkrankung und den neurologischen Beschwerden lag ein Jahr. • Eine SPMS-Patientin mit Zustand nach Corpus uteri-Karzinom, Erstdiagnose 1998, die Therapie beinhaltete eine Totaloperation und eine perkutane und intravaginale Bestrahlung, in den Nachsorgeuntersuchungen fand sich kein Anhalt für ein Rezidiv. Bei Blutentnahme war die Patientin 64 Jahre alt, das Intervall zwischen Tumordiagnose und der neurologischen Symptomatik betrug drei Jahre. Gesicherte Malignome im untersuchten MS-Kollektiv traten damit nur bei zwei von 247 Patienten (0,8%) auf. 3.3 Sensitivität und Spezifität des ELISA Zur Etablierung des ELISA wurden in einer vorausgehenden Arbeit von Barbara Kleer die Sensitivität und Spezifität der Methode bestimmt [31]: Dafür wurden 21 Seren von Patienten, die eindeutig eine Paraneoplasie aufwiesen, für alle sechs Antigene getestet. Alle zeigten ein eindeutig positives Ergebnis mit OD-Werten zwischen 0,4 und 1,6. Damit konnte für den ELISA eine Sensitivität von 100% demonstriert werden. Die Spezifität wurde anhand einer Gruppe von Negativkontrollen untersucht. Diese beinhaltete Patienten mit nicht-entzündlichen neurologischen Erkrankungen (NPHPatienten) und gesunde Studenten. Jeweils eine Serumprobe zeigt eine geringe Reaktion mit den Antigenen CV2 und Yo. Für diese beiden Antigene konnte somit eine Spezifität von 98,9% ermittelt werden, für die übrigen Antigene wurde eine Spezifität von 100% erreicht. 26 Ergebnisse 3.4 Prävalenz antineuronaler Antikörpern bei Patienten mit Multipler Sklerose Bei keinem der 247 Seren der MS-Patienten konnte im ELISA eine hohe Konzentration der antineuronalen Antikörpern anti-HuD, anti-Ri, anti-Yo, anti-CV, anti-Ma2 oder anti-Amphiphysin nachgewiesen werden. In Tabelle 6 sind die Mittelwerte und Standardabweichungen der optischen Dichte für die jeweiligen MS-Untergruppen und der 45 Negativ- und 21 Positivkontrollen aufgezeigt. Tabelle 6 - Mittelwerte und Standardabweichungen der Optischen Dichte (OD) MS-Verlaufsform: Antigen: HuD PPMS 0,019 (0,017) 0,005 (0,008) 0,010 (0,010) 0,008 (0,016) 0,024 (0,023) Amphiphysin 0,008 (0,014) RRMS 0,020 (0,016) 0,006 (0,009) 0,008 (0,011) 0,009 (0,019) 0,022 (0,022) 0,007 (0,011) SPMS 0,019 (0,025) 0,007 (0,010) 0,004 (0,004) 0,005 (0,007) 0,022 (0,024) 0,003 (0,005) wahrscheinliche MS/CIS 0,019 (0,017) 0,009 (0,016) 0,005 (0,006) 0,007 (0,010) 0,021 (0,025) 0,011 (0,018) MS gesamt 0,019 (0,018) 0,006 (0,010) 0,007 (0,010) 0,008 (0,017) 0,022 (0,023) 0,007 (0,012) 0,024 (0,013) 0,020 (0,011) 0,007 (0,011) 0,031 (0,031) 0,046 (0,033) 0,031 (0,017) 0,724 (0,183) 0,077 0,826 (0,372) 0,065 1,062 (0,393) 0,049 0,776 (0,481) 0,156 0,602 (0,102) 0,177 1,342 (0,000) 0,099 Kontrollen: Negativkontrollen (Studenten und NPH) Positivkontrollen Cut off: Ri Yo CV2 Ma2 Tabelle 6 - Mittelwerte und Standardabweichungen der Optischen Dichte (OD) 27 Ergebnisse Zwei Patienten wiesen eine sehr niedrige Antikörperkonzentration auf, davon zeigte: • ein Patient mit einer SPMS einen mäßig positiven Befund für das HuD-Antigen (OD: 0,138, Cut off: 0,077) • eine Patientin mit einer RRMS einen schwach positiven Befund für das YoAntigen (OD: 0,094, Cut off: 0,049) Diese beide Seren wurden mittels Immunoblot und indirekter Immunfluoreszenz erneut auf antineuronale Antikörper getestet: In keinem der beiden Verfahren konnte ein positives Ergebnis erzielt werden. Auch in einer zusätzlich angefertigten seriellen Verdünnungsreihe (1:500 bis 1:64000) zeigte die HuD-Probe im Gegensatz zur Positivkontrolle (dazu s. Tabelle 7, Kapitel 3.5) bereits im zweiten Verdünnungsschritt OD-Werte unterhalb des Cut offs. Für Yo konnte in der Verdünnungsreihe in keinem Schritt ein positives Ergebnis wiederholt werden. Für die Antigene Ri, CV2, Ma2 und Amphiphysin konnte in keinem der Seren eine positive Antikörperreaktion nachgewiesen werden. Auch die Patienten, bei denen in der Vorgeschichte ein Tumorleiden oder der Verdacht auf eine Krebserkrankung (s. Kapitel 3.2) festgestellt worden war, zeigten keinen Hinweis auf das Vorhandensein antineuronaler Antikörper. Die Ergebnisse des ELISA sind in den nachfolgenden Abbildungen 9 bis 14 dargestellt, wobei jeder Punkt dem Messwert der optischen Dichte eines Patientenserums entspricht. Werte über der Cut-off-Linie gelten als positiv. 28 Ergebnisse Anti-HuD Antikörper 1,200 1,000 0,800 OD 0,600 0,400 0,200 Cut off: 0,077 0,000 gesunde Studenten NPH PPMS RRMS SPMS wahrsch. MS/CIS Positivkontrollen Abbildung 9 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positivund Negativkontrollen für HuD Anti-Ri Antikörper 1,200 1,000 0,800 OD 0,600 0,400 0,200 Cut off: 0,065 0,000 gesunde Studenten NPH PPMS RRMS SPMS wahrsch. MS/CIS Positivkontrollen Abbildung 10 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positivund Negativkontrollen für Ri 29 Ergebnisse Anti-Yo Antikörper 1,600 1,400 1,200 1,000 0,800 OD 0,600 0,400 0,200 Cut off: 0,049 0,000 gesunde Studenten NPH PPMS RRMS SPMS wahrsch. MS/CIS Positivkontrollen Abbildung 11 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positivund Negativkontrollen für Yo Anti-Ma2 Antikörper 0,800 0,700 0,600 0,500 0,400 OD 0,300 0,200 Cut off: 0,177 0,100 0,000 gesunde Studenten NPH PPMS RRMS SPMS wahrsch. MS/CIS Positivkontrollen Abbildung 12 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positivund Negativkontrollen für Ma2 30 Ergebnisse Anti-CV2 Antikörper 0,900 0,800 0,700 0,600 0,500 0,400 OD Cut off: 0,156 0,300 0,200 0,100 0,000 gesunde Studenten NPH PPMS RRMS SPMS wahrsch. MS/CIS Positivkontrollen Abbildung 13 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positivund Negativkontrollen für CV2 Anti-Amphiphysin Antikörper 1,400 1,200 1,000 0,800 OD 0,600 0,400 0,200 Cut off: 0,099 0,000 gesunde Studenten NPH PPMS SPMS RRMS wahrsch. MS/CIS Positivkontrolle Abbildung 14 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positivund Negativkontrollen für Amphiphysin 31 Ergebnisse 3.5 Positivkontrollen Die in der vorliegenden Arbeit mitgetesteten sechs Positivseren zeigten alle hohe Konzentrationen der antineuronalen Antikörper anti-HuD, anti-Ri, anti-Yo, anti-CV, anti-Ma2 oder anti-Amphiphysin im Bereich zwischen 0,2 und 1,1. In Tabelle 7 sind die Mittelwerte der ODs der Positivkontrollen und die Ergebnisse der seriellen Verdünnung dieser Kontrollen aufgelistet: Tabelle 7 - Mittelwert Positivkontrollen und Standardabweichung der Optischen HuD Ri Yo CV2 Ma2 MW (SD) 0,222 (0,071) 0,826 (0,424) 0,876 (0,087) 0,420 (0,123) 0,726 (0,205) Verdünnung Optische Dichte in serieller Verdünnung Dichte der Amphiphysin 1,039 (0,426) 1:500 0,316 ----- 1,196 ----- 0,835 1,047 1:1000 0,117 0,68 1,113 1,224 0,516 1,019 1:2000 0,096 0,510 0,952 1,000 0,294 0,923 1:4000 0,036 0,37 0,832 0,701 0,158 0,777 1:8000 0,057 0,244 0,658 0,471 0,076 0,648 1:16000 0,004 0,169 0,492 0,286 0,036 0,450 1:32000 0,006 0,117 0,307 0,189 0,013 0,323 1:64000 0,001 0,093 0,164 0,120 0,007 0,189 Tabelle 7 - Mittelwert und Standardabweichung der Optischen Dichte der Positivkontrollen 3.6 Antikörperspezifitätsindex Bei den beiden im ELISA schwach positiv getesteten Seren wurde die Antikörperreaktivität im Liquor bestimmt. Dabei fanden sich in beiden Fällen im Vergleich zur Kontrollgruppe (10 NPH Patienten; [31]) keine signifikant erhöhte ODs als Hinweis auf eine intrahekale antigenspezifische Synthese. Aus diesem Grund konnte die Berechnung des spezifischen Antikörperindexes nicht erfolgen. 32 Diskussion 4 Diskussion Sowohl der Multiplen Sklerose (MS) als auch paraneoplastischen neurologischen Syndromen (PNS) liegen wahrscheinlich Autoimmunprozesse zu Grunde, die im Krankheitsverlauf zu einer entzündlich-autoimmunologischen Schädigung des Nervensystems führen. Da PNS auch isoliert das zentrale Nervensystem betreffen können, kann sich in seltenen Fällen die Differenzierung eines PNS von einer MS als schwierig gestalten, weil sich die Klinik bei Erstmanifestation der beiden ätiologisch unterschiedlichen Krankheitsbilder ähneln kann. So finden sich z.B. die klinischen Syndrome einer Optikusneuritis oder einer Encephalomyelitis bei beiden Erkrankungen [6], [10], [12], [22]. Fallbeispiel Im Neurologischen Zentrum der Universitätsklinik Freiburg wurde ein Fall beobachtet, dessen Symptomatik die Kliniker zuerst an eine MS denken ließ, die Bestimmung antineuronaler Antikörper letztendlich aber wegweisend für die Diagnose eines PNS war: Ein 47-jähriger, männlicher Patient stellte sich mit seit über einem Jahr andauernder, an Intensität zunehmender Gangstörungen vor. Zusätzlich berichtete er über eine depressive Verstimmung und das Auftreten transienter Doppelbilder. Die neurologische Untersuchung ergab eine spastische Paraparese und eine Pallhypästhesie der Extremitäten. Aufgrund dieser Befunde und dem Nachweis eines für die MS typisch veränderten Liquorbefundes wurde mit dem Patienten die Verdachtsdiagnose einer chronisch progredienten MS besprochen. Nachdem zwei Jahre nach Diagnosestellung der MS ein kleinzelliges Bronchialkarzinom festgestellt worden war, konnten in einer retrospektiven Serumanalyse die antineuronalen Antikörper anti-HuD und anti-CV2 bereits zum Zeitpunkt der vermeintlichen MSDiagnosestellung nachgewiesen werden. Anhand dieser neuen Befunde wurde die Diagnose eines PNS gestellt. Dieser Fall zeigt, dass PNS eine Differentialdiagnose der MS darstellen können. Mit dem Nachweis der antineuronalen Antikörper ergibt sich ein direkter Hinweis auf ein paraneoplastisches Geschehen und damit auf einen oftmals okkulten Tumor [21]. Vor diesem Hintergrund wurden in der vorliegenden Arbeit die Seren von 247 MSPatienten auf das Vorhandensein der sechs gut charakterisierten antineuronalen 33 Diskussion paraneoplastischen Antikörper anti-HuD, anti-Ri, anti-Yo, anti-CV, anti-Ma2 und antiAmphiphysin getestet. Damit sollte untersucht werden, ob in seltenen Fällen PNS eine MS imitieren können und ob eine kostspielige Testung auf antineuronale Antikörper bei MS-Patienten in der Routinediagnostik sinnvoll wäre. Ausgangspunkt war die These, dass es aufgrund eines möglicherweise noch okkulten Tumorleidens zu einer Immunantwort kommt, bei der sich kreuzreaktive Autoantikörper und TZellen sowohl gegen Tumorgewebe als auch gegen Nervengewebe richten. Die dadurch entstandene Nervenzellschädigung kann zu einem PNS führen, das aufgrund seiner Klinik für eine chronisch entzündliche Erkrankung des ZNS, wie beispielsweise eine MS, gehalten werden könnte. MS und Malignome – epidemiologische Studien Der Zusammenhang zwischen Krebs und MS wird in der Literatur kontrovers diskutiert. Einige epidemiologische Studien beschreiben keine generell erhöhte Inzidenz von Krebserkrankungen bei MS-Patienten im Vergleich zur Allgemeinbevölkerung [63], [66]. Auch weitere Studien belegen, dass MS-Patienten kein allgemein höheres Risiko haben, einen Tumor zu entwickeln als Nicht-MSErkrankte: Midgard et al. beschreibt eine Studie in Norwegen, in der mit Hilfe des norwegischen Krebsregisters retrospektiv ein Kollektiv von 1271 MS-Patienten untersucht worden war, um das relative Risiko einer Krebserkrankung einzuschätzen [40]. Møller et al. untersuchte mit Hilfe des dänischen Krebsregisters das Krebsrisiko einer Kohorte von 5359 MS-Patienten in Dänemark, die zwischen 1977 und 1987 einen Krankenhausaufenthalt hatten [41]. Beide Studien schließen mit dem Ergebnis, dass für MS-Erkrankte verglichen mit der Normalbevölkerung kein generell erhöhtes Krebsrisiko besteht. Das Follow-up bei Møller et al. betrug im Durchschnitt allerdings nur 5,2 Jahre [41], eine längerfristige Beobachtung der Patientengruppe wurde nicht durchgeführt. In beiden Studien wird aber auch aufgezeigt, dass es für einige spezielle Krebserkrankungen dennoch ein erhöhtes Risiko gibt und sie vermehrt bei MSPatienten auftreten: Während bei Møller et al. für viele Tumoren (hämatologische und lymphatische Tumoren, Tumoren des weiblichen Genitaltraktes, RektumKarzinome u.a.) kein signifikanter Unterschied zwischen der Anzahl der erwarteten und beobachteten Krebsfällen auftrat, konnte er für Tumoren des Harntraktes, für maligne Hirntumore und für Brust- und Hautkrebs (ausgenommen waren maligne 34 Diskussion Melanome) ein erhöhtes relatives Risiko feststellen [41]. Frauen mit MS hatten in dieser Studie sogar ein 50-fach erhöhtes Risiko, ein Nasopharyngeal-Karzinom zu entwickeln. Diese Beobachtung beruht allerdings auf der Grundlage von nur drei Patientenfällen, so dass laut Autoren eine weitere Abklärung sinnvoll erscheint. Bei Midgard et al. zeigte sich eine erhöhte Inzidenz von Brustkrebs bei MSPatientinnen [40]: Von 741 Frauen wurden bei 21 Frauen ein Brustkrebs beobachtet, im Vergleich waren das 70% mehr als erwartet. Auch Nielsen et al. veröffentlichte vor wenigen Jahren Daten, aus denen hervorgeht, dass Frauen mit MS ein erhöhtes Risiko haben, an Brustkrebs zu erkranken [42]: In seiner Studie verglich er Patientendaten des dänischen MS-Registers mit denen des dänischen Krebsregisters und setzte die Anzahl der Krebsfälle bei MS-Erkrankten in Bezug zur erwarteten Krebsinzidenz in der Normalbevölkerung. Ebenso wie bei Møller und Midgard konnte in dieser Studie zwar kein generell erhöhtes Risiko für Krebserkrankungen bei MS-Patienten gefunden werden, aber auch hier war sowohl das relative Risiko für nasopharyngeale Tumoren als auch für Brustkrebs signifikant erhöht. Letzteres ist laut Nielsen und Kollegen nicht auf eine niedrige Anzahl ausgetragener Schwangerschaften oder auf ein höheres Lebensalter der Mutter bei der Geburt des ersten Kindes zurückzuführen. Interessanterweise konnte zusätzlich gezeigt werden, dass die Tumoren bei Diagnosestellung bei Frauen mit MS eine größere Ausdehnung hatten als bei anderen Frauen. Dies lässt die Autoren zu dem Schluss kommen, dass es sich bei den beobachteten Ergebnissen bezüglich der erhöhten Inzidenz von Brustkrebs nicht um eine Verzerrungserscheinung in der Erfassung und Bewertung des Krankheitsbildes handelt [42]. Auch in anderen Studien finden sich Hinweise auf einen Zusammenhang zwischen MS und Tumoren. Anderson et al. beschreibt ein erhöhtes Vorkommen von Gliomen in ZNS-Bereichen, in denen eine vermehrte Demyelinisierung nachgewiesen werden konnte [2]. In Finnland wurde von Palo et al. eine erhöhte Prävalenz und Mortalitätsrate an Krebs bei MS-Patienten beobachtet [44]. Und auch Sumelahti et al. konnte ein erhöhtes Risiko für ZNS-Tumoren und hämatologische Tumoren bei MSPatienten in Finnland nachweisen. In letzterem Fall vermuten die Autoren eine mögliche gemeinsame infektiöse Ätiologie, wohingegen sie die Assoziation von MS und ZNS-Tumoren auf eine Missklassifikation zurückführen [58]. Des Weiteren zeigte eine kürzlich veröffentliche Studie von Torkildsen et al., dass Patienten mit MS ein doppelt so hohes Risiko haben, an Krebs zu versterben als die 35 Diskussion Normalbevölkerung [59]. Diese Studie umfasste insgesamt ein Kollektiv von 878 MSPatienten in Norwegen: Frauen verstarben dabei häufiger an Krebs als Männer [59]. Eine Studie von Hjalgrim et al. beschäftigte sich mit der Entstehung des Morbus Hodgkin bei MS-Erkrankten und ihren Verwandten ebenso wie mit der Entwicklung einer MS bei Patienten, die an einem Hodgkin-Lymphom erkrankt waren, und deren Familien. Dabei stellte sich heraus, dass es zwar einerseits nur wenige Fälle von Hodgkin-Lymphomen bei MS-Patienten und MS-Erkrankungen bei Patienten mit M. Hodgkin gab. Dafür konnte allerdings für erstgradig Verwandte von MS-Patienten ein erhöhtes Risiko, im jungen Erwachsenenalter an einem Hodgkin-Lymphom zu erkranken, festgestellt werden. Außerdem war auch das Risiko einer MS-Erkrankung bei erstgradig Verwandten von Hodgkin-Lymphom-Patienten signifikant erhöht. Diese Häufung von MS und Hodgkin-Lymphomen in einer Familie kann nach Ansicht der Autoren gemeinsame umwelt- und/oder anlagebedingte Risikofaktoren widerspiegeln [24]. Patienten mit Malignomen und Raumforderungen in der aktuellen Studie In der vorliegenden Studie sind drei Patienten eingeschlossen, bei denen zum Zeitpunkt der Probenentnahme ein Tumor bekannt war oder eine Krebserkrankung vermutet wurde: Neben einem Patienten mit Prostata-Karzinom und Verdacht auf ein Plasmozytom fanden sich eine Patientin mit operiertem Corpus uteri-Karzinom und eine Patientin mit suprasellärer Raumforderung. Bei der zuletzt genannten Patientin konnte der initiale Verdacht auf eine maligne Neoplasie allerdings nicht bestätigt werden: Anhand der kernspintomographischen Untersuchung wurde schließlich der Verdacht auf eine Zyste im Hypophysenbereich (Rathke´sche Zyste) gestellt. Letztendlich wiesen somit nur zwei der 247 MS-Patienten (0,8%) ein gesichertes Malignom auf. Dies entspricht in etwa der Prävalenz von Karzinomen bei MSPatienten (0,64%) in Finnland in der Studie von Palo et al. [44]. Interessanterweise beschreibt Midgard et al. ein statistisch zwar nicht signifikantes, aber dennoch erhöhtes Risiko für Corpus uteri-Karzinome bei MS-Patientinnen in Norwegen [40]. Auch Møller et al. konnte ein leicht erhöhtes Risiko für Corpus uteri-Karzinome (RR=1,4) bei MS-Patienten in Dänemark aufzeigen [41], auch wenn dies vor allem junge Patientinnen betraf und die in dieser Studie eingeschlossene Patientin mit Corpus uteri-Karzinom bei Probenentnahme bereits 64 Jahre alt war. Des Weiteren 36 Diskussion konnte in dieser Studie auch ein erhöhtes Risiko für Hirntumore (RR=1,7) festgestellt werden, allerdings wies keiner der untersuchten MS-Patienten ein Plasmozytom auf. Für Prostata-Karzinome (RR=0,9) konnte diese epidemiologische Studie kein erhöhtes Risiko zeigen. [41] Bei keinem der beiden Patienten mit Malignom konnte im Serum eine erhöhte Konzentration antineuronaler Antikörper nachgewiesen werden, so dass gemäß den Konsensuskriterien von Graus et al. kein Hinweis auf ein „definitives“ PNS besteht (s. Kapitel I.2.2). Allerdings muss bedacht werden, dass PNS auch ohne oder mit nicht typischen antineuronalen Antikörpern auftreten können. Darüber hinaus lagen zwischen Tumordiagnose und dem Auftreten neurologischer Symptome nur wenige Jahre, so dass anhand der Konsensuskriterien ein „mögliches“ PNS nicht sicher ausgeschlossen werden kann [21]. Paraneoplastische neurologische Syndrome mit Demyelinisierung des ZNS Einige wenige Fallstudien berichten über eine Demyelinisierung des ZNS aufgrund eines möglichen paraneoplastischen Geschehens, welches differentialdiagnostisch an eine MS denken lassen könnte. Kaluza et al. beschreibt den Fall eines 68jährigen Patienten, der an einem Seminom erkrankt war und der neben der Symptomatik einer limbischen und bulbären Enzephalitis auch Zeichen einer zerebellären Degeneration aufwies. Nach seinem Tod wurde bei diesem Patienten ein PNS diagnostiziert, allerdings fanden sich keine spezifischen Antikörper [30]. Jaster et al. vermutet aufgrund einer Fallstudie von zwei Patienten mit solitären, fokalen Demyelinisierungen und Malignomen außerhalb des ZNS (Seminom und Lymphom) eine mögliche paraneoplastische Ursache der neurologischen Symptome [26]. Des Weiteren greift er die epidemiologische Studie von Sumelahti et al. über die erhöhte Inzidenz von hämatologischen Malignomen und ZNS-Tumoren bei MSPatienten in Finnland auf und stellt die Ergebnisse in Zusammenhang mit einer paraneoplastischen Genese [28]. Darüber hinaus fasst er einige Fallserien anderer Autoren zusammen, bei deren Patienten eine ZNS-Demyelinisierung und entweder Seminome oder ZNS-Lymphome nachgewiesen werden konnten. Auch hier zieht er die Möglichkeit einer paraneoplastischen Genese der Demyelinisierung in Betracht und fordert zu einer intensiveren Diskussion auf [27]. 37 Diskussion Eine Studie von Glantz et al. beschreibt vier Patienten mit verschiedenen PNS und pathologischen MRT-Befunden in Regionen des ZNS, die mit der Klinik der Patienten vereinbar waren: Davon zeigte ein Patient mit paraneoplastischer Enzephalomyelitis (PEM) in der T2-gewichteten MRT-Aufnahme einzelne Läsionen im zervikalen Rückenmark und im Hirnstamm. Ein weiterer Patient mit nekrotisierender Myeolopathie wies T2-Läsionen im thorakalen Rückenmark auf, außerdem konnte bei ihm eine uneinheitliche Gadoliniumanreicherung und in der Rückenmarksbiopsie eine Demyelinisierung nachgewiesen werden [17]. Aufgrund dieser Befundkonstellationen könnte sowohl hier als auch im nachfolgend beschriebenen Fall differentialdiagnostisch eine MS in Betracht gezogen werden. Wong et al. berichtet in einem Case-Report von einem 54-jährigen Patienten mit einem Seminom und einer neurologischen Symptomatik, die sich in zunehmenden Konzentrationsund Gedächtnisschwierigkeiten und Verwirrtheit äußert. Die cerebrale Bildgebung (CT und MRT) und eine stereotaktische Biopsie zeigen eine demyelinisierende Läsion mit zusätzlichem Axonenverlust im periventrikulären Bereich. An diesem Beispiel veranschaulicht Wong et al., dass im Fall eines bekannten Tumors, einer neurologischen Symptomatik und einer entsprechenden Bildgebung an eine paraneoplastische Erkrankung gedacht werden sollte [65]. In einigen weiteren Fällen konnten zudem paraneoplastische Syndrome beobachtet werden, die verdeutlichen, dass zentral demyelinisierende Erkrankungen eine MS oder ein Devic Syndrom imitieren können: So gibt Ojeda et al. in seiner Fallserie zwei Fälle wieder, in denen die Patienten an einer Paraplegie litten und mittels Biopsie eine ausgeprägte nekrotisierende Myelopathie nachgewiesen werden konnte. Bei beiden Patienten war in der Vorgeschichte ein Tumorleiden bekannt (Lungentumor und Brustkrebs). Aus diesen Befunden schließen die Autoren auf zwei neue mögliche Beispiele einer nekrotisierenden Myelopathie paraneoplastischen Ursprungs, obwohl diese neurologische Erkrankung ein eher ungewöhnliches Beispiel einer PNS darstellt [43]. Auch Antoine et al. beschreibt einen Fall, in welchem ein Patient an einer Myasthenia gravis und einem Thymom erkrankt war. Zusätzlich entwickelte dieser Patient vier Monate nach der Tumorbehandlung eine Neuromyelitis optica (NMO; Devic Syndrom) und eine nekrotisierende Myositis. Im Serum fanden sich in der Akutphase der NMO-IgG Antikörper, die mit dem Gewebe des ZNS und des Tumors reagierten, so dass Antoine und Kollegen daraus einen denkbaren paraneoplastischen Zusammenhang zwischen Thymomen und dem 38 Diskussion Devic Syndrom herleiteten [3]. Auch eine weitere Fallstudie zeigt nach Ansicht von Ducray et al., dass in seltenen Fällen eine NMO paraneoplastischen Ursprungs sein kann: Die Autoren berichten von einer Patientin, bei der sich phänotypisch ein Devic Syndrom (und eine nekrotisierende Myelopathie) vermuten ließ und bei der neben einem Thymom auch anti-CV2/CRMP5-Antikörper nachgewiesen werden konnten [12]. Bezug nehmend auf eine Studie von Cross et al., in der drei Fälle einer Myelopathie in Assoziation mit anti-CV2/CRMP5-Antikörper und Krebserkrankungen beschrieben wurden [6], schlägt er eine zusätzliche Untersuchung auf antineuronale Antikörper bei Myelopathien unbekannten Ursprungs vor. In der Studie von Cross et al. dient CV2/CRMP5-IgG als serologischer Marker für eine paraneoplastische Optikusneuritis/Retinitis in Zusammenhang mit einem kleinzelligen Bronchialkarzinom. Er beschreibt insgesamt 16 Patienten, von denen sich die meisten mit einem Visusverlust und multikokalen neurolgischen Ausfällen präsentierten. Bei den drei Patienten, bei denen die Myelopathie im Vordergrund stand, wurden initial die Diagnose MS oder Devic Syndrom gestellt [6]. Prävalenz der sog. gut charakterisierten antineuronalen Antikörper bei Patienten mit MS in der aktuellen Studie In der vorliegenden Arbeit konnte bei nur zwei der 247 untersuchten MS-Patienten eine sehr niedrige antineuronale Aktivität (anti-Yo, anti-HuD) im ELISA nachgewiesen werden. Beide Seren wurden parallel zu einer Positivkontrolle in einer seriellen Verdünnungsreihe untersucht. Während für das Yo-Serum in keinem Schritt ein positives Ergebnis wiederholt werden konnte und das HuD-Serum bereits im zweiten Verdünnungsschritt keine Reaktivität mit den rekombinanten Antigenen mehr zeigte, fanden sich bei den Positivkontrollen Titer zwischen 1:16 000 und 1:128 000 [55]. Im Folgenden soll kurz auf beide MS-Patienten mit schwach positiver antineuronaler Aktivität im Serum eingegangen werden: Eine Patientin mit einer schubförmig verlaufenden MS zeigte einen schwach positiven Befund für anti-Yo-Antikörper. Da aber sowohl im Immunoblot als auch in der indirekten Immunfluoreszenz dieses Ergebnis nicht verifiziert werden konnte, ist anzunehmen, dass es sich dabei höchstwahrscheinlich um unspezifische Hintergrundaktivität des ELISAs handelt. Der zweite Patient wies einen sekundär chronisch progredienten MS-Verlauf auf. Bei ihm konnte eine niedrige Konzentration 39 Diskussion von anti-HuD Antikörpern gefunden werden. Allerdings verlief seine Krankheitsgeschichte über einen Zeitraum von über 24 Jahren, was gegen eine paraneoplastische Ätiologie spricht. Darüber hinaus waren auch hier beide Bestätigungstests negativ, so dass auch dieses Ergebnis eher auf unspezifische Bindungen im ELISA zurückzuführen ist als auf ein paraneoplastisches Geschehen, insbesondere da für PNS typischerweise hohe Titer antineuronaler Antikörper zu erwarten sind [8]. Für die Seren der anderen Patienten konnte keiner der sechs gut charakterisierten antineuronalen Antikörper anti-HuD, anti-Ri, anti-Yo, anti-CV, anti-Ma2 oder antiAmphiphysin nachgewiesen werden. Wenngleich das Fehlen dieser antineuronalen Antikörper ein PNS nicht ausschließt, ist unter Berücksichtigung neurologische Syndrome der bei Konsensuskriterien diesen Patienten eine für paraneoplastische Paraneoplasie sehr unwahrscheinlich [20]. Aufgrund dieser Ergebnisse scheint eine kostspielige, routinemäßige Bestimmung von antineuronalen Antikörpern im Rahmen der MSDiagnostik nicht erforderlich zu sein. Allerdings sollte dabei bedacht werden, dass nicht zwangsläufig jedes PNS mit antineuronalen Antikörpern assoziiert ist und es außer den sechs gut charakterisierten antineuronalen Antikörpern, die dieser Arbeit zu Grunde lagen, noch weitere nicht etablierte Antikörper gibt, die mit einem PNS vergesellschaftet sein könnten. Klassische antineuronale Antikörper als Epiphenomen des neuronalen Untergangs bei MS? Eine weitere These dieser Arbeit beschäftigt sich mit der bereits früh in der Krankheitsphase einsetzenden axonalen Schädigung bei der MS, aufgrund derer es zu einem sogenannten „Epitope spreading“ kommen kann [45]: Hierbei wäre im Rahmen der neuronalen Degeneration eine Freilegung von autologen Determinanten denkbar, die im Kontext von MHC-Molekülen von sog. Antigen-präsentierenden Zellen (APC) präsentiert werden. Gegen diese Determinanten könnten sich im Sinne einer sekundären Immunantwort neben Autoantigen-spezifischen T-Zellen auch antineuronale Antikörper richten. Bislang konnte bei Patienten mit demyelinisierenden Autoimmunkrankheiten wie der MS eine Vielzahl von Antikörpern nachgewiesen werden, die sich gegen Bestandteile des ZNS richten. Insbesondere 40 Diskussion bei der PPMS wird einer B-Zell-Autoimmunität eine besondere Rolle zugeschrieben: So konnte Sadatipour et al. bei Patienten mit PPMS im Gegensatz zu Patienten mit RRMS/SPMS eine erhöhte Serumkonzentration von Antikörpern gegen axonale Bestandteile (Antigangliosid-Antikörper) nachweisen, welche laut Autoren den progredienten Verlauf der Erkrankung erklären könnten [52]. Des Weiteren untersuchte Berger et al. in einer Studie 103 CIS-Patienten, bei denen Antikörper gegen Myelinproteine wie dem Myelin-Oligodentrozyten-Antigen (MOG) oder dem basischen Myelinprotein (MBP) zu einer frühen Konversion in eine klinisch definitive MS beitragen könnten [4]. Ferner beschrieben Lennon und Kollegen sog. NMO-IgG Antikörper, die eine hohe Spezifität für eine Neuromyelitis optica (NMO; Devic Syndrom) aufwiesen [33]. Histopathologisch finden sich bei der NMO ähnliche Befunde mit Ablagerung von IgG und Komplement als Hinweis auf eine maßgebliche Beteiligung des humoralen Immunsystems wie bei MS-Patienten des histopathologischen Subtyps II nach Lucchinetti et al. [36]. Die Rolle der IgG-NMOAntikörper in der Ätiopathogenese der NMO ist jedoch noch unklar [25]. Roussel et al. konnte in einer Studie von 89 MS-Patienten eine erhöhte Prävalenz von AntiPhospholipid-Antikörpern nachweisen [51]. Des Weiteren zeigte Mathey et al. einen möglichen Zusammenhang zwischen einem Antikörper gegen Neurofaszin und dem axonalen Verlust bei MS-Erkrankungen auf [37]. Welche Rolle diese Antikörper in der Pathogenese allerdings spielen, ist auch hier noch unklar. Sueoka et al. untersuchte in einer Studie die Seren und den Liquor von 35 MSPatienten auf das Vorhandensein von Antikörpern gegen heterogene nukleäre Ribonukleinproteine (hnRNP A und B) und verglich die Ergebnisse mit 25 Patienten, die an einer anderen neurologischen Erkrankung litten. Dabei konnte er im Liquor von 32 MS-Patienten (91,4%) Antikörper gegen hnRNP B1 nachweisen [57]. Interessanterweise gehört nach Pittock et al. das Ri-Antigen zur Familie der hnRNPs [47]. Dass anti-Ri-Antikörper ausschließlich mit PNS assoziiert sind, die das ZNS (Hirnstamm, Kleinhirn und Rückenmark) betreffen [47], ist gut damit vereinbar, dass bei Sueoka et al. der Nachweis der Anti- hnRNP B1 -Antikörper auf den Liquor der MS-Patienten beschränkt war [57]. In der vorliegenden Studie konnte bei keinem der Patienten mit MS oder CIS eine erhöhte Reaktivität mit dem rekombinanten Ri-Antigen detektiert werden. Ebenso konnte für keinen der beiden Patienten, die im Serum eine niedrige Konzentration paraneoplastischer Antikörper (anti-Yo, anti-HuD) erkennen ließen, einer der 41 Diskussion klassischen antineuronalen Antikörper in der entsprechenden Liquorprobe gezeigt werden. Da die aktuelle Studie zum Nachweis antineuronaler Antikörper im Serum etabliert wurde, kann hinsichtlich einer möglichen geringen Konzentration dieser Antikörper im Liquor - wie sie beispielsweise bei sekundären epiphenomenologischen Reaktionen gegen Autoantigene denkbar wäre - keine Stellung bezogen werden. Quantifizierung einer intrathekalen Antikörpersynthese anhand des spezifischen Antikörperindexes In einigen Studien konnte gezeigt werden, dass bei PNS mit zerebraler Beteiligung ein erhöhter IgG-Index oder oligoklonale Banden im Liquor vorlagen [16], [54]. Dies könnte darauf zurückzuführen sein, dass es im Rahmen der Ätiopathogenese zentraler PNS zu einem intrathekalen Autoimmunprozess kommt. Außer einer intrathekalen IgG-Synthese als Zeichen einer unspezifischen Immunreaktion kann in manchen Fällen auch IgG, welches sich gegen ein spezifisches Antigen richtet, nachgewiesen werden. In der Studie von Furneaux et al. fand sich eine intrathekale spezifische IgG-Synthese mit einer erhöhten relativen Konzentration spezifischer Autoantikörper im Vergleich zum Serum [16]. Die MS ist eine isolierte Erkrankung des ZNS. Somit stellt sich die Frage, ob bei MSPatienten mit geringer antineuronaler Aktivität im Serum eine spezifische intrathekale Synthese der entsprechenden antineuronalen Antikörper vorliegen könnte. Interessanterweise wurde in einer Studie zum Antikörperindex von Stich et al. ein Patient mit einem anti-Ri assoziierten PNS und zentraler Manifestation beschrieben, der im Serum nur eine geringe anti-Ri-Aktivität aufwies, jedoch im Liquor hoch positiv war [54]. Vor diesem Hintergrund erfolgte in der vorliegenden Arbeit die Bestimmung der anti-Yo bzw. anti-HuD spezifischen Synthese der beiden im Serum schwach positiven Patienten. Da sich in beiden Fällen in der Liquoruntersuchung im Vergleich zur Kontrollgruppe keine signifikant erhöhten ODs als Zeichen einer möglicherweise vorliegenden intrathekalen spezifischen Antikörpersynthese nachweisen ließen, konnte die Berechnung des spezifischen Antikörperindexes nicht erfolgen. Somit ergab sich auch kein Anhalt für eine anti-Yo- bzw. anti-HuD-spezifische intrathekale Antikörpersynthese bei beiden Patienten. 42 Diskussion Conclusio Insgesamt kann anhand der Ergebnisse dieser Studie nicht auf einen Zusammenhang zwischen typischen Symptomen einer MS und der Prävalenz gut charakterisierter antineuronaler Antikörpern geschlossen werden, der eine sekundäre Immunantwort aufgrund von Neuronuntergang oder gar eine paraneoplatische Genese vermuten ließe. Der routinemäßige Einsatz der Bestimmung der gut charakterisierten antineuronalen Antikörper (anti-HuD, Yo, Ri, Ma2, CV2 und Amphiphysin) erscheint daher nicht sinnvoll. Dennoch könnte sich die Bestimmung antineuronaler Antikörper bei Abklärung der Verdachtsdiagnose MS in einigen Fällen durchaus als hilfreich erweisen: Bei Patienten, die sich mit einer untypischen klinischen Symptomatik, einer B-Symptomatik, einem Tumor innerhalb von fünf Jahren in der Vorgeschichte oder einem für die MS ungewöhnlichen Alter präsentieren, könnte ein positiver Antikörperbefund wegweisend für die Diagnose und damit auch für die Behandlung einer Paraneoplasie sein. Des Weiteren sollte an eine Antikörperbestimmung gedacht werden, wenn bei einem Patienten nach Immuntherapie keine Besserung der neurologischen Symptomatik auftritt oder er Risikofaktoren für einen Tumor wie z.B. Nikotinabusus aufweist. Da die PNS häufig der Tumordiagnose vorausgehen und das Malignom noch in einem frühen (okkulten) Stadium ist, sind PNS häufig die einzige Symptomatik, die den Patienten beeinträchtigt. Eine frühzeitige Erkennung mittels Antikörpernachweis würde somit sowohl eine Behandlung des Tumors als auch die einzig effektive Therapie (Entfernung ektoper Antigene durch Tumorextirpation) der paraneoplastischen neurologischen Symptomatik ermöglichen [17], [61]. 43 Zusammenfassung 5 Zusammenfassung Die Multiple Sklerose (MS) und paraneoplastische neurologische Syndrome (PNS) sind Erkrankungen, denen ein bislang noch nicht vollständig geklärter Autoimmunprozess zu Grunde liegt. Bei beiden Erkrankungen findet sich eine Vielzahl von Autoantikörpern. Die sog. gut charakterisierten antineuronalen Antikörper anti-HuD, Yo, Ri, Ma2, CV2 und Amphiphysin besitzen einen hohen prädikativen Wert für ein PNS und sind pathognomonisch für einen zu Grunde liegenden, oftmals okkulten Tumor. Epidemiologische Studien berichten über eine erhöhte Inzidenz bestimmter Malignome bei MS-Patienten. Da gerade bei der Erstmanifestation der Symptome (Optikusneuritis, Enzephalomyelitis, cerebelläre Symptomatik) PNS eine MS imitieren können, stellen PNS eine mögliche Differentialdiagnose der MS dar. Ziel der vorliegenden Arbeit war die Bestimmung der Prävalenz der gut charakterisierten antineuronalen Antikörper bei einem großen Kollektiv von MSPatienten. Hierzu wurden die Seren von 247 MS-Patienten mit einem ELISATestsystem unter Verwendung rekombinanter Antigene untersucht. Bei keinem der MS-Patienten konnte eine hohe antineuronale Reaktivität im Serum als Hinweis auf ein PNS gemessen werden. Die knapp überschwelligen Werte von zwei Patienten werten wir als Hintergrundaktivität im ELISA, da weder die Bestätigungstests (Immunfluoreszenz, Westernblot) noch die Bestimmung einer möglichen spezifischen intrathekalen Synthese den Befund verifizieren konnten. Bei zwei Patienten traten in der Vorgeschichte Malignome auf (Prostata-Ca, Corpus uteri-Ca), die Seren beider Patienten zeigten jedoch keine antineuronale Aktivität. Somit erscheint aufgrund dieser Ergebnisse die routinemäßige Bestimmung der klassischen antineuronalen Antikörper bei der MS-Abklärung nicht notwendig. Diese Untersuchung sollte atypischen Verläufen vorbehalten sein. 44 Literaturverzeichnis 6 Literaturverzeichnis [1] Albert ML, Austin LM, Darnell RB. (2000) Detection and treatment of activated T cells in the cerebrospinal fluid of patients with paraneoplastic cerebellar degeneration. Ann Neurol. 47:9-17 [2] Anderson M, Hughes B, Jefferson M, Smith WT, Waterhouse JA. (1980) Gliomatous transformation and demyelinating diseases. Brain 103:603-622 [3] Antoine JC, Camdessanché JP, Absi L, Lassablière F, Féasson L. (2004) Devic Disease and thymoma with anti-central nervous system and antithymus antibodies. Neurology 62:978-980 [4] Berger T, Rubner P, Schautzer F, Egg R, Ulmer H, Mayringer I, Dilitz E, Deisenhammer F, Reindl M. (2003) Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. N Engl J Med. 349:139-45 [5] Brück W, Stadelmann-Nessler C. (2006) Pathologie und Pathophysiologie. In: Schmidt RM, Hoffmann FA. Multiple Sklerose. 4. Aufl. Elsevier GmbH, München, S.33-42 [6] Cross SA, Salomao DR, Parisi JE, Kryzer TJ, Bradley EA, Mines JA, Lam BL,. Lennon VA. (2003) Paraneoplastic autoimmune optic neuritis with retinitis defined by CRMP-5-IgG. Ann Neurol. 54:38-50 [7] Dalmau J, Graus F, Cheung NK, Rosenblum MK, Ho A, Cañete A, Delattre JY, Thompson SJ, Posner JB. (1995) Major histocompatibility proteins, anti-Hu antibodies, and paraneoplastic encephalomyelitis in neuroblastoma and small cell lung cancer. Cancer 75:99-109 [8] Dalmau J, Furneaux HM, Gralla RJ, Kris MG, Posner JB. (1990) Detection of the anti-Hu antibody in the serum of patients with small cell lung cancer -- a quantitative western blot analysis. Ann Neurol. May 27:544-52 [9] Dalmau J, Furneaux HM, Rosenblum MK, Graus F, Posner JB. (1991) Detection of the anti-Hu antibody in specific regions of the nervous system and tumor from patients with paraneoplastic encephalomyelitis/sensory neuronopathy. Neurology 41:1757-64 [10] De la Sayette V, Bertran F, Honnorat J, Schaeffer S, Iglesias S, Defer G. (1998) Paraneoplastic cerebellar syndrome and optic neuritis with anti-CV2 antibodies: clinical response to excision of the primary tumor. Arch Neurol. 55: 405-408 45 Literaturverzeichnis [11] Deutsche Multiple Sklerose Gesellschaft (DMSG), Bundesverband e.V. (2006) Behandlungsleitlinien der Deutschen Gesellschaft für Neurologie (DGN), http://www.dmsg.de/multiple-sklerose-news/ und http://www.amsel.de/multiple-sklerose/ zuletzt besucht am 16.01.2008 [12] Ducray F, Roos-Weil R, Garcia PY, Slesari J, Heinzlef O, Chatelain D, Toussaint P, Roullet E, Honnorat J. (2007) Devic’s syndrome-like phenotype associated with thymoma and anti-CV2/CRMP5 antibodies. J Neurol Neurosurg Psychiatry. 78:325-327 [13] Flachenecker P, Zettl UK. (2006) Epidemiologie. In: Schmidt RM, Hoffmann FA. Multiple Sklerose. 4. Aufl. Elsevier GmbH, München, S.11-17 [14] Flachenecker P, Zettl UK. (2006) Krankheitsverlauf und Prognose. In: Schmidt RM, Hoffmann FA. Multiple Sklerose. 4. Aufl. Elsevier GmbH, München, S.6170 [15] Frohman EM, Filippi M, Stuve O, Waxman SG, Corboy J, Phillips JT, Lucchinetti C, Wilken J, Karandikar N, Hemmer B, Monson N, De Keyser J, Hartung H, Steinman L, Oksenberg JR, Cree BA, Hauser S, Racke MK. (2005) Characterizing the mechanisms of progression in multiple sclerosis: evidence and new hypotheses for future directions. Arch Neurol. 62:1345-1356 [16] Furneaux HF, Reich L, Posner JB. (1990) Autoantibody synthesis in the central Nervous System of patients with paraneoplastic syndromes. Neurology 40:1085-1091 [17] Glantz MJ, Biran H, Myers ME, Gockerman JP, Friedberg MH. (1994) The radiographic diagnosis and treatment of paraneoplastic central nervous system disease. Cancer 73:168-175 [18] Gold R, Linington C, Lassmann H. (2006) Understanding pathogenesis and therapy of multiple sclerosis via animal models: 70 years of merits and culprits in experimental autoimmune encephalomyelitis research. Brain 129:1953-1971 [19] Gold R, Rieckmann P. (2000) Pathogenese und Therapie der Multiplen Sklerose. 2. Aufl. UNI-MED Verlag, Bremen, S.14-19 [20] Graus F, Dalmou J, Reñé R, Tora M, Malats N, Verschuuren JJ, Cardenal F, Viñolas N, Garcia del Muro J, Vadell C, Mason WP, Rosell R, Posner JB, Real FX. (1997) Anti-Hu antibodies in patients with small-cell lung cancer: association with complete response to therapy and improved survival. J Clin Oncol. 15:2866-2872 [21] Graus F, Delattre JY, Antoine JC, Dalmau J, Giometto B, Grisold W, Honnorat J, Smitt PS, Vedeler Ch, Verschuuren JJ, Vincent A, Voltz R. (2004) Recommended diagnostic criteria for paraneoplastic neurological syndromes. J Neurol Neurosurg Psychiatry. 75:1135-1140 46 Literaturverzeichnis [22] Graus F, Keime-Guibert F, Reñe R, Benyahia B, Ribalta T, Ascaso C, Escaramis G, Delattre JY. (2001) Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain. 124:1138-48 [23] Grønbaek K, Straten PT, Ralfkiaer E, Ahrenkiel V, Andersen MK, Hansen NE, Zeuthen J, Hou-Jensen K, Guldberg P. (1998) Somatic Fas mutations in nonHodgkin's lymphoma: association with extranodal disease and autoimmunity. Blood 92:3018-3024 [24] Hjalgrim H, Rasmussen S, Rostgaard K, Nielsen NM, Koch-Henriksen N, Munksgaard L, Storm HH, Melbye M. (2004) Familial clustering of Hodgkin lymphoma and multiple sclerosis. J Natl Cancer Inst. 96:780-784 [25] Jarius S, Paul F, Franciotta D, Waters P, Zipp F, Hohlfeld R, Vincent A, Wildemann B; Vanderbilt. (2008) Mechanisms of Disease: aquaporin-4 antibodies in neuromyelitis optica. Nat Clin Pract Neurol. 4:202-14 [26] Jaster JH, Bertorini TE, Dohan FC Jr, O'Brien TF, Wang H, Becske T, Menke PG, Handorf CR, Horner LH, Mönkemüller KE. (1996) Solitary focal demyelination in the brain as a paraneoplastic disorder. Med Pediatr Oncol. 26:111-115 [27] Jaster JH, Dohan FC Jr, O'Brien TF. (2002) Demyelination in the brain as a paraneoplastic disorder: candidates include some cases of seminoma and central nervous system lymphoma. J Neurol Neurosurg Psychiatry. 73:352 [28] Jaster JH, Zamecnik J, Bartos A, Smith TW. (2005) Demyelination in the brain as a paraneoplastic disorder: candidates include some cases of multiple sclerosis. Neuroepidemiology 25:212 [29] Kaiser R. (1999) Paraneoplastic neurologic syndromes. Diagnosis and pathogenetic significance of autoantibodies. Nervenarzt 70:688-701 [30] Kałuza J, Słowiński J, Bujny T, Grochala M. (1997) Paraneoplastic syndrome simulating encephalitis in the course of testicular seminoma. Folia Neuropathol. 35:24-28 [31] Kleer B. Antineuronale Antikörper bei Motoneuronenerkrankungen [Doktorarbeit]. Freiburg: Neurologischen Universitätsklinik der Albert-LudwigsUniversität Freiburg i. Br.; 2008 [32] Kobelt G, Berg J, Lindgren P, Elias WG, Flachenecker P, Freidel M, Konig N, Limmroth V, Straube E. (2006) Costs and quality of life of multiple sclerosis in Germany. Eur J Health Econ. 7:34-44 [33] Lennon VA, Wingerchuk DM, Kryzer TJ, Pittock SJ, Lucchinetti CF, Fujihara K, Nakashima I, Weinshenker BG. (2004) A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 364:2106-2112 47 Literaturverzeichnis [34] Limmroth V, Sindern E. (2004) Multiple Sklerose. 1.Aufl. Georg Thieme Verlag, Stuttgart, S.20-29 [35] Linker RA, Sendtner M, Gold R. (2005) Mechanisms of axonal degeneration in EAE - lessons from CNTF and MHC I knockout mice. J Neurol Sci. 233:167172 [36] Lucchinetti C, Brück W, Parisi J, Scheithauer B, Rodriguez M, Lassmann H. (2000) Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol. 47:707-17 [37] Mathey EK, Derfuss T, Storch MK, Williams KR, Hales K, Woolley DR, Al-Hayani A, Davies SN, Rasband MN, Olsson T, Moldenhauer A, Velhin S, Hohlfeld R, Meinl E, Linington C. (2007) Neurofascin as a novel target for autoantibodymediated axonal injury. J Exp Med. 204:2363-2372 [38] McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, McFarland HF, Paty DW, Polman CH, Reingold SC, Sandberg-Wollheim M, Sibley W, Thompson A, van den Noort S, Weinshenker BY, Wolinsky JS. (2001) Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol. 50:121-127 [39] Meinl E, Voltz R. (2006) Immunpathogenese. In: Schmidt RM, Hoffmann FA. Multiple Sklerose. 4. Aufl. Elsevier GmbH, München, S.43-51 [40] Midgard R, Glattre E, Grønning M, Riise T, Edland A, Nyland H. (1996) Multiple sclerosis and cancer in Norway. A retrospective cohort study. Acta Neurol Scand. 93:411-415 [41] Møller H, Kneller RW, Boice JD Jr, Olsen JH. (1991) Cancer incidence following hospitalization for multiple sclerosis in Denmark. Acta Neurol Scand. 84:214220 [42] Nielsen NM, Rostgaard K, Rasmussen S, Koch-Henriksen N, Storm HH, Melbye M, Hjalgrim H. (2006) Cancer risk among patients with multiple sclerosis: a population-based register study. Int J Cancer. 118:979-984 [43] Ojeda VJ. (1984) Necrotizing myelopathy associated with malignancy. A clinicopathologic study of two cases and literature review. Cancer 53:11151123 [44] Palo J, Duchesne J, Wikström J. (1977) Malignant diseases among patients with multiple sclerosis. J Neurol. 216:217-222 [45] Peterson LK, Fujinami RS. (2007) Inflammation, demyelination, neurodegeneration and neuroprotection in the pathogenesis of multiple sclerosis. J Neuroimmunol. 184:37-44 48 Literaturverzeichnis [46] Pittock SJ, Lucchinetti CF. (2007) The pathology of MS: new insights and potential clinical applications. Neurologist. 13:45-56 [47] Pittock SJ, Lucchinetti CF, Lennon VA. (2003) Anti-neuronal nuclear autoantibody type 2: paraneoplastic accompaniments. Ann Neurol. 53:580-587 [48] Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L, Lublin FD, Metz M, McFarland HF, O'Connor PW, Sandberg-Wollheim M, Thompson AJ, Weinshenker BG, Wolinsky JS. (2005) Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann Neurol. 58:840-846 [49] Reiber H, Peter JB. (2001) Cerebrospinal fluid analysis: disease-related data patterns and evaluation programs. J Neurol Sci. 184:101-122 [50] Roberts W., Darnell RB. (2004) Neuroimmunology of the paraneoplastic neurological degenerations. Curr Opin Immunol 16:616-622 [51] Roussel V, Yi F, Jauberteau MO, Couderq C, Lacombe C, Michelet V, Gil R, Couratier P, Vallat JM, Preud'homme JL. (2000) Prevalence and clinical significance of anti-phospholipid antibodies in multiple sclerosis: a study of 89 patients. J Autoimmun. 14:259-265 [52] Sadatipour BT, Greer JM, Pender MP. (1998) Increased circulating antiganglioside antibodies in primary and secondary progressive multiple sclerosis. Ann Neurol. 44:980-3 [53] Schmidt RM, Hoffmann FA. (2006) Klinik der Multiplen Sklerose. In: Schmidt RM, Hoffmann FA. Multiple Sklerose. 4. Aufl. Elsevier GmbH, München, S.55-60 [54] Stich O, Jarius S, Kleer B, Rasiah C, Voltz R, Rauer S. (2007) Specific antibody index in cerebrospinal fluid from patients with central and peripheral paraneoplastic neurological syndromes. J Neuroimmunol. 183:220-224 [55] Stich O, Kleer B, Rauer S. (2007) Absence of paraneoplastic antineuronal antibodies in sera of 145 patients with motor neuron disease. J Neurol Neurosurg Psychiatry. 78:883-885 [56] Stüve O, Cepok S, Elias B, Saleh A, Hartung HP, Hemmer B, Kieseier BC. (2005) Clinical stabilization and effective B-lymphocyte depletion in the cerebrospinal fluid and peripheral blood of a patient with fulminant relapsingremitting multiple sclerosis. Arch Neurol. 62:1620-3 [57] Sueoka E, Yukitake M, Iwanaga K, Sueoka N, Aihara T, Kuroda Y. (2004) Autoantibodies against heterogeneous nuclear ribonucleoprotein B1 in CSF of MS patients. Ann Neurol. 56:778-786 [58] Sumelahti ML, Pukkala E, Hakama M. (2004) Cancer incidence in multiple sclerosis: a 35-year follow-up. Neuroepidemiology 23:224-227 49 Literaturverzeichnis [59] Torkildsen NG, Lie SA, Aarseth JH, Nyland H, Myhr KM. (2007) Cancer-related mortality among patients with multiple sclerosis, 1953-2003. Multiple sclerosis. 13:327 [60] Vega F, Graus F, Chen QM, Poisson M, Schuller E, Delattre JY. (1994) Intrathecal synthesis of the anti-Hu antibody in patients with paraneoplastic encephalomyelitis or sensory neuronopathy: clinical-immunologic correlation. Neurology 44:2145-2147 [61] Voltz R. (2004) Paraneoplastic neurological autoimmune diseases. Dtsch Med Wochenschr. 129:1743-1746 [62] Voltz R, Dalmau J, Posner JB, Rosenfeld MR. (1998) T-cell receptor analysis in anti-Hu associated paraneoplastic encephalomyelitis. Neurology 51:1146-1150 [63] Wender M, Lenart-Jankowska D, Kowal P, Pruchnik-Grabowska D. (1987) Incidence of malignant neoplasms in patients with multiple sclerosis. Neurol Neurochir Pol. 21:40-44 [64] Winter SF, Sekido Y, Minna JD, McIntire D, Johnson BE, Gazdar AF, Carbone DP. (1993) Antibodies against autologous tumor cell proteins in patients with small-cell lung cancer: association with improved survival. J Natl Cancer Inst. 85:2012-2018 [65] Wong K, Poon P, Berry K, Coppin C, Kostashuk E. (1998) Paraneoplastic demyelinating disorder in the brain of a patient with seminoma. J Comput Assist Tomogr. 22:136-138 [66] Wynn DR, Rodriguez M, O'Fallon WM, Kurland LT. (1990) A reappraisal of the epidemiology of multiple sclerosis in Olmsted County, Minnesota. Neurology 40:780-786 50 Anhang 7 Anhang 7.1 Materialien für ELISA • Beschichtungs-Puffer: pH 9,6; ad 1000 ml Aqua dest. Na2 CO3 (106): 1,6g Na HCO3 (84,01): 2,93g Na N3 (69,01): 0,2g • PBS-Puffer: ad 5000ml Aqua dest. NaCl: Na2HPO4: NaH2PO4: • 40g 7g 1,2g Verdünnungspuffer (VP): 1% BSA (Rinderserumalbumin), Firma Sigma, Deutschland 2% Tween 20 (Polyoxyethylensorbitanmonolaurat), Firma GERBU Biotechnik GmbH in PBS-Puffer • Waschpuffer: 0,05% Tween 20 in PBS-Puffer • Substratlösung: Pro Platte 4 OPD (Orthophenylendiamin)-Tabletten, Firma Dako in 12ml Aqua dest. 10µl H2O2 kurz vor Start dazugeben • Stopplösung: 2,5 M H2SO4, Firma Merck • Sekundärantikörper: Peroxidase-konjugiertes Anti-human-IgG von der Ziege, Firma Dianova 51 Anhang 7.2 Abbildungsverzeichnis Abbildung 1 - Einteilung des Patientenkollektives dargestellt als Flussdiagramm 15 Abbildung 2 - ELISA-Platten mit 96 Vertiefungen mit Flachboden 16 Abbildung 3 - ELISA-Washer mit Wasser-, Pufferlösung- und Abfallbehälter 17 Abbildung 4 - Wärmeschrank 17 Abbildung 5 - Plattenlesegerät und Computerarbeitsplatz 18 Abbildung 6 - Funktionsprinzip des ELISA 19 Abbildung 7 - Negativkontrolle Yo, Cerebellum 22 Abbildung 8 - Positivkontrolle Yo, Cerebellum 22 Abbildung 9 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positiv- und Negativkontrollen für HuD 29 Abbildung 10 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positiv- und Negativkontrollen für Ri 29 Abbildung 11 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positiv- und Negativkontrollen für Yo 30 Abbildung 12 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positiv- und Negativkontrollen für Ma2 30 Abbildung 13 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positiv- und Negativkontrollen für CV2 31 Abbildung 14 - Optische Dichte-Werte (OD) aller getesteten Probanden einschließlich Positiv- und Negativkontrollen für Amphiphysin 31 7.3 Tabellenverzeichnis Tabelle 1 - McDonald Kriterien zur Diagnosefindung einer MS [48] 6 Tabelle 2 - Klinisch-anatomische Klassifikation paraneoplastischer neurologischer Syndrome 7 Tabelle 3 - Gut charakterisierte antineuronale Antikörper 11 Tabelle 4 - Konzentrationen für Antigenbeschichtung, Serumverdünnungen, Entwicklungszeiten und Cut off-Werte der jeweiligen Antigene 20 Tabelle 5 - Demographische Daten der Patienten und Kontrollgruppen 25 Tabelle 6 - Mittelwerte und Standardabweichungen der Optischen Dichte (OD) 27 Tabelle 7 - Mittelwert und Standardabweichung der Optischen Dichte der Positivkontrollen 32 52 Abkürzungsverzeichnis 8 Abkürzungsverzeichnis AI Spezifischer Antikörperindex Ca Karzinom CIS Clinically isolated syndrome CT Computertomographie ELISA Enzym-linked immunosorbant-assay HnRNP Nukleäre Ribonukleinproteine IgG Immunglobulin G MBP Basisches Myelinprotein MHC Major Histocompatibility Complex MOG Myelin-Olgodenntrozyten-Glykoprotein MRT Magnet-Resonanz-Tomographie MS Multiple Sklerose NMO Neuromyelitis optica NPH Normaldruckhydrozephalus OD Optische Dichte OKB Oligoklonale Banden PEM Paraneoplastische Enzephalomyelitis PNS Paraneoplastisch neurologisches Syndrom PPMS Primary progressive MS, primär chronisch progredient verlaufende MS QAlb Albuminquotient QIgG Gesamt-IgG-Quotient QLim QLim (QIgG) = 0,93√(QAlb)² + 6 x 10-6 - 1,7 x 10-3 RR Relatives Risiko RRMS Relapsing-remitting MS, schubförmige remittierend verlaufende MS SPMS Secondary progressive MS, sekundär chronisch progredient verlaufende MS SSN Subakut sensorischer Neuropathie VEP Visuell evozierbares Potential ZNS Zentrales Nervensystem 53 Lebenslauf 9 Lebenslauf Persönliche Angaben: Name: Adresse: Geburtsdatum: Geburtsort: Staatsbürgerschaft: Familienstand: Eltern: Geschwister: Constanze Murek Littenweilerstr. 40a, 79117 Freiburg 08.11.1982 Müllheim, Deutschland deutsch ledig Wilfried Murek, berentet; Holle Murek, Hebamme Mareike, Philipp, Clemens und Franziska Murek Schulen: 1989-1993: 1993-2000: 2000-2002: Grundschule Horben, Horben Rotteck-Gymnasium, Freiburg St. Ursula-Gymnasium, Freiburg Universität: 2002-2004: Aufnahme des Medizinstudiums an der Albert-LudwigsUniversität in Freiburg Erfolgreich bestandene Ärztliche Vorprüfung Klinischer Studienabschnitt Praktisches Jahr im Kreiskrankenhaus Lörrach 2004: 2004-2008: 2008-heute: Praxiserfahrung: 1 Monat: 1 Monat: 1 Monat: 1 Monat: Famulatur Gynäkologie - Heliosklinik Müllheim Famulatur Strahlenheilkunde - Universitätsklinik Freiburg Famulatur Radiologie - Diakonissenkrankenhaus Karlsruhe Famulatur Kardiologie - Asklepios Klinik Altona, Hamburg Berufliche Erfahrung: 2004-2006: 2007: Medizinische Hilfswissenschaftlerin in der Klinik für Strahlenheilkunde, Universitätsklinikum Freiburg Medizinische Hilfswissenschaftlerin im Zentrum Klinische Studien (ZKS), Universitätsklinikum Freiburg Sprachkenntnisse: Englisch: Latein: Italienisch: 8 Jahre Schulkenntnisse (mit der Note „gut“ abgeschlossen) 7 Jahre Schulkenntnisse (mit der Note „sehr gut“ abgeschlossen) 3 Jahre Schulkenntnisse (mit der Note „gut“ abgeschlossen) Freiburg, den 05.06.2008 Constanze Murek Tel: 0049 761 7669463 • Mobil: 0049 170 4375861 • E-Mail: [email protected] 54 Danksagung 10 Danksagung An dieser Stelle möchte ich mich sehr herzlich bei all denen bedanken, die mich auf dem Weg meiner Doktorarbeit begleitet haben. Mein besonderer Dank gilt meinem Doktorvater Prof. Dr. med. Sebastian Rauer für die Überlassung dieses überaus spannenden Themas und die dadurch gegebene Möglichkeit, wissenschaftliches Arbeiten zu erlernen und sich mit einem sehr interessanten Teilgebiet der Neurologie intensiv auseinander zu setzen. Die Entstehung dieser Doktorarbeit wurde aber auch durch einen Menschen in ganz besonderen Maße geprägt, der mir in den beiden letzten Jahren fortwährend zur Seite stand und dessen geduldigen Erklärungen, wertvollen Anregungen und dessen fundiertes Fachwissen zum Gelingen der Arbeit beigetragen haben: Für die exzellente Betreuung sowohl bei der Durchführung der Studie im Labor als auch der Literaturrecherche und dem Schreiben der Arbeit möchte ich mich ganz herzlich bei Dr. med. Oliver Stich bedanken. Mein weiterer Dank gilt dem Team im Liquorlabor und meinen Laborkollegen, die immer aushalfen, wenn Not am Mann war und deren hilfsbereite und freundliche Art für ein sehr angenehmes Arbeitsklima sorgten. Mein Dank gilt aber auch meiner Familie, vor allem meiner Mutter, die mich während meines Freisemesters sowohl in finanzieller als auch kulinarischer Hinsicht liebevoll unterstützte und meinem Vater, der mir mit einem unerschöpflichen Materialienreichtum zum Thema „Multiple Sklerose“ den Einstieg in die Materie um ein Vielfaches erleichterte. Außerdem möchte im mich bei meinem Bruder Philipp bedanken, der mir in allen Computerfragen eine große Stütze war und der geduldig alle Excelprobleme aus der Welt schaffte. Zuletzt gebührt mein Dank allen Freunden, die mir tatkräftig zur Seite standen, insbesondere meiner lieben Freundin Nora für den „Anstoß“ zur richtigen Zeit und die vielen aufbauenden und anregenden Gespräche rund um das Thema Dissertation, sowie meinen ältesten Freundin Anna und Britta für das Korrekturlesen und ihre Unterstützung zu jeder Zeit. 55