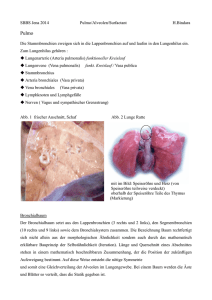
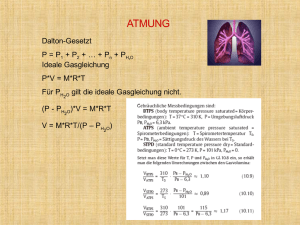
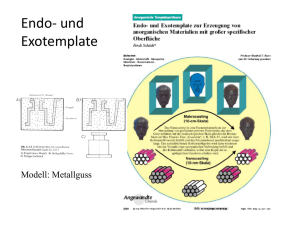
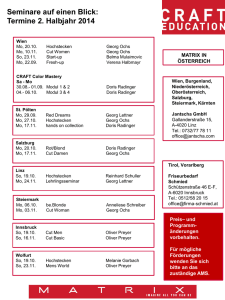
Tierärztliche Hochschule Hannover
Werbung

Tierärztliche Hochschule Hannover Charakterisierung der entzündungsbedingten Surfactant- und Lungenparenchymalterationen beim Schwein nach Infektion mit Actinobacillus pleuropneumoniae INAUGURAL – DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae (Dr. med. vet.) vorgelegt von Diana Johanna Linda Busley Hamm Hannover 2014 Wissenschaftliche Betreuung: Prof. Dr. Isabel Hennig-Pauka Klinik für kleine Klauentiere und Forensische Medizin und Ambulatorische Klinik, Tierärztliche Hochschule Hannover Prof. Dr. Dr. Andreas Schmiedl Institut für Funktionelle und Angewandte Anatomie Medizinische Hochschule Hannover 1. GutachterIn: Prof. Dr. Isabel Hennig-Pauka Prof. Dr. Dr. Andreas Schmiedl 2. Gutachter: PD Dr. Christoph Baums Institut für Mikrobiologie, Zentrum für Infektionsmedizin, Tierärztliche Hochschule Hannover Tag der mündlichen Prüfung: 22.10.2013 In Zusammenarbeit mit dem Institut für Funktionelle und Angewandte Anatomie der Medizinischen Hochschule Hannover. Diese Forschungsarbeit wurde dankenswerterweise von der Friedrich-Ebert-Stiftung unterstützt. Für Jens Für Unsere Stärke Für Johanna F. Funke Für Deinen Glauben an Bildung Inhaltsverzeichnis: ABKÜRZUNGSVERZEICHNIS ABBILDUNGSVERZEICHNIS TABELLENVERZEICHNIS Seite 15 1. Übergeordnete Einleitung 2. Literaturübersicht 2.1 Anatomischer und histologischer Aufbau der Lunge beim Schwein bzw. bei Haussäugetieren 2.2 Surfactant 2.2.1 Aufbau, Funktion und Synthese 2.2.2 Die Rolle des Surfactants im angeborenen Immunsystem 2.2.3 Surfactantdysfunktion 2.2.4 Die Rolle des Surfactants bei spezifischen Erkrankungen des Menschen bzw. in der tierexperimentellen Grundlagenforschung 2.3 Surfactant bei Tieren 2.4 Surfactant beim Schwein 2.5 Erkrankungen des Respirationstrakts beim Schwein 2.5.1 Porcine Respiratory Disease Complex (PRDC) 2.5.2 Porzine Pleuropneumonie 17 Material und Methoden 3.1 Surfactantcharakterisierung beim Schwein 3.1.1 Infektionsversuche mit Scoring im Rahmen des FUGATO-RePoRI- Projektes 3.1.1.1 Versuchstiere 3.1.1.2 Aerosolinfektion 3.1.1.3 Klinische und pathomophologische Erhebungen 3.1.2 Bronchoalveoläre Lavage 3.1.2.1 Spülmethode 3.1.2.2 Zytologische Untersuchung 3.1.2.3 Surfactantgewinnung- und aufbereitung 3.1.2.4 Aufbereitung der Lavageflüssigkeit für die Elektronenmikroskopie 3.1.3 Elektronenmikroskopie 3.1.3.1 Fragestellung 3.1.3.2 Elektronenmikroskopische Auswertung 3.1.3.3 Stereologische Parameter wie Volumendichte, Oberflächendichte und des Volumen-/Oberflächenverhältnis‘ 41 41 3. 17 21 21 23 25 27 31 33 35 35 36 41 41 42 42 45 45 46 47 48 50 50 51 54 3.2 3.3 3.4 3.1.4 Biophysikalische Untersuchung des Surfactants: Pulsating Bubble Surfactometrie Charakterisierung von immersionsfixiertem Lungenparenchym beim Schwein (Lungengesunde- und A.pp.- infizierte Schweine) 3.2.1 Versuchstiere 3.2.2 Aerosolinfektion 3.2.3 Klinische, computertomographische, hämatologische und pathomorphologische Erhebungen im Rahmen der Infektionsstudien von BRAUER (2012) und HENNIG-PAUKA et al. (2012) 3.2.4 Präparationstechnik 3.2.5 Fixierung, Einbettung und Anfertigung von Gewebedünnschnitten 3.2.6 Protokoll der lichtmikroskopischen Auswertung und Berechnung stereologischer Parameter 3.2.7 Auswertung der computertomographischen Transversalschnitte von Schweinelungen 3.2.7.1 Punktzählverfahren im STEPanizer 3.2.7.2 Berechnung des funktionellen Lungenparenchymvolumens der Schweinelungen nach dem Cavalieri Prinzip 3.2.7.3 Funktionelles Volumen der Alveolarsepten 3.2.7.4 Funktionelle Oberfläche der Alveolarsepten 3.2.7.5 Funktionelles Parenchymvolumen von pathologisch veränderter Strukturen Charakterisierung von perfusionsfixiertem Lungenparenchym beim Schwein 3.3.1 Versuchstiere 3.3.2 Versuchsablauf 3.3.3 Samplingverfahren der perfusionsfixierten Lungen 3.3.4 Aufbereitung der Proben für die lichtmikroskopische Untersuchung 3.3.5 Protokoll der lichtmikroskopischen Auswertung 3.3.6 Berechnung der stereologischen Parameter Statistik 3.4.1 Statistische Auswertung von vor und nach der Infektion erhobenen Daten 3.4.2 Statistische Auswertung der Daten, die nach Immersionsoder Perfusionsfixierung lichtmikroskopisch erhoben wurden 56 61 61 61 61 63 63 64 66 66 67 67 68 68 69 69 69 74 76 76 76 76 76 77 4. Manuskript Characterisation of the inflammation-caused alterations of Surfactant in pigs infected by Actinobacillus pleuropneumoniae Abstract Background Porcine respiratory disease Pulmonary surfactant Methods Housing, infection and examination of pigs Bronchoalveolar lavage Fixation and tissue processing Stereology Pulsating bubble surfactometry Statistical analysis Results Clinical and laboratory diagnostic findings Morphology of surfactant subtypes Average minimal surface tension Discussion Conclusions Abbreviations Competing interests Author’s contribution Acknowledgements References Figure legends Tables and figures 5. 78 78 79 80 84 91 93 97 97 97 98 98 98 107 109 Übergreifende Diskussion 5.1 Alterationen im Surfactantsystem (vgl. Manuskript) 5.1.1 Reflexion der Ergebnisse 5.1.2 Reflexion der angewandten Methoden und Ausblick 5.2 Charakterisierung der infektionsbedingten Parenchymalterationen 5.2.1 Reflexion der Ergebnisse 5.2.2 Methodenkritik und Ausblick 5.3 Strukturelle Charakterisierung von porzinem, perfusionsfixiertem Lungenparenchym 5.3.1 Reflexion der Ergebnisse 5.3.2 Methodenkritik und Ausblick 115 115 115 122 124 124 127 6. Literaturverzeichnis 133 7. Anhang 163 Anhang 1. mit Tabelle 7.1.1: „Alterationen im Surfactantsystem: Klinik, Pathomorphologie und kulturelle Untersuchung“ 163 Anhang 2. „Stereologische Charakterisierung von immersionsfixiertem 129 129 132 Anhang 3. Anhang 4. Lungenparenchym beim Schwein (Lungengesunde und A.pp.- infizierte Schweine)“ Vergleich zwischen Immersions- und Perfusionsfixierung von Lungenparenchym beim Schwein Protokoll über die Surfactant-Auswertung 164 177 180 8./9. Zusammenfassung in deutscher und englischer Sprache 181 10. 186 Danksagung ABKÜRZUNGSVERZEICHNIS AE II alveolar epithelial cells type II A.pp. Actinobacillus pleuropneumoniae ARDS Acute Respiratory Distress Syndrome BAL Bronchoalveoläre Lavage BALF Bronchoalveoläre Lavageflüssigkeit BMBF Bundesministerium für Bildung und Forschung bspw. beispielsweise CT Computertomographie DPPC Dipalmitoylphosphatidylcholin Σ Summe ECP eosinophilic cationic protein Fa. Firma hPa Hektopascal KGW Körpergewicht kV Kilovolt kPa Kilopascal LA large aggregates lb lamellar body lbl lamellar body-like forms LLS Lung Lesion Score LSP Linienschnittpunkt mAs Milliampèresekundenprodukt MHz Megaherz mlv multilamellar vesicle ms Millisekunde p p-Wert P Punkt(e) PBS Pulsating Bubble Surfactometer PEEP positive end-exspiratory pressure PINSP pressure inspiratoric PRDC Porcine Respiratory Disease Complex p. inf. post infectionem RHS Respiratory Health Score SA small aggregates SD standard deviation s.o. siehe oben SP bzw. SP- Surfactantprotein SV Oberflächendichte TEM Transmissionselektronenmikroskop tm tubular myelin u.a. unter anderem ulv unilamellar vesicle V/S-Ratio Volumen-/Oberflächenverhältnis VV Volumendichte z.B. zum Beispiel ABBILDUNGSVERZEICHNIS Seite Literaturverzeichnis Abb. 2.1. a: Aufbau der Schweinelunge (aus WAIBL 1999, S. 268) 18 Abb. 2.1. b: Legende zur Abb. 2. 1. a (aus WAIBL 1999, S. 268) 18 Abb. 2.2: Surfactant bei belastungsinduzierten Asthma (modifiziert nach ENHORNING et al. 2000) 28 Material und Methodik Abb. 3.1.1: Versuchsdesign im Rahmen des FUGATO-RePoRI-Projektes, teilweise publiziert in REINER et al. (2014) Abb. 3.1.2: a.) 44 Beispielhaft Ferkel in Neuroleptanalgesie mit ausgebundenem Kiefer während Laryngoskopie, wie beschrieben in KIPPER (1990) b.) 46 Beispielhaft Bronchoskopie, wie beschrieben in KIPPER (1990) 46 Abb. 3.1.3.: Punktzählverfahren im STEPanizer© stereology tool 53 Abb. 3.1.4: PBS 58 Abb. 3.1.5: PBS schematisch (ENHORNING 1977) 58 Abb. 3.1.6: Blick durch das Okular des Pulsating Bubble SurfactometersTM 59 Abb. 3.1.7: PBS Output eines Kontrollschweines: 60 Abb. 3.3.1: Nahezu vollständig kollabierte Lunge ohne definierte Blähung 72 Abb. 3.3.2: Überblähtes Lungenparenchym durch falsche Einstellung des Beatmungsdruckes (>40 mbar), beim späteren Sampling floss viel Flüssigkeit von der Schnittfläche ab Abb. 3.3.3: Entnommene Lungen mit definierter Blähung durch Abklemmung der Trachea am Ende der Inspiration Abb. 3.3.4: 72 73 Schneidapperatur zum exakten Schneiden der Lungen (von der Forschungswerkstatt der Medizinischen Hochschule Hannover konstruiert) 75 Diskussion Abb. 5.1.1: Schematische Darstellung des Surfactantmetabolismus (aus MÜHLFELD u. OCHS 2010, S. 4) 119 Anhang Abb. 7.2.1: Verteilung der stereologisch erarbeiteten Volumendichten bei Kontrolltieren und infizierten Tieren am Tag der Sektion Abb. 7.2.2: 168 Oberflächendichten [1/µm] der Alveolarsepten bei Kontrolltieren und infizierten Tieren 169 Abb.7.2.3: V/S-Ratio [µm] bei Kontrolltieren und infizierten Tieren 169 Abb.7.2.4: Vergleichende Darstellung der zytologischen Untersuchung der BALF der Kontrolltiere und der infizierten Schweine am Tag der Sektion Abb.7.2.5: Vergleichende Darstellung der Blutwerte der Kontrolltiere und infizierten Schweine am Tag 21. p. inf. Abb. 7.2.6: 171 Vergleichende Darstellung der stereologisch ermittelten Daten der Kontrolltiere und infizierten Schweine am Tag 21. p. inf. Abb.7.2.7: 170 172 Via Stereologie ermittelte funktionelle Oberfläche der Alveolarsepten vergleichend für Kontrolltiere und der infizierten Schweine am Tag 21. p. inf. Abb. 7.2.8: 173 Funktionelle Parenchymvolumina pathologisch veränderter vergleichend für die Kontrolltiere und die infizierten Schweine am Tag 21. p. inf. Abb. 7.2.9: 174 Immersionsfixiertes Lungenparenchym eines Kontrolltieres, HE-Färbung 175 Abb. 7.2.10: Immersionsfixiertes Lungenparenchym eines mit A.pp.infizierten Tieres (21 Tag p.inf.), HE-Färbung Abb. 7.3.1: 176 Verteilung der stereologisch berechneten Volumendichten von immersionsfixiertem Lungenparenchym und perfusionsfixiertem Lungenparenchym (schraffiert). Abb. 7.3.2: Vergleich der Oberflächendichte [1/µm] zwischen 177 Immersions- und Perfusionsfixierung (schraffiert) Abb. 7.3.3: Perfusionsfixiertes Lungenparenchym eines Kontrolltieres, HE-Färbung Abb. 7.3.4: 178 179 Nahezu vollständig kollabierte Lunge ohne definierte Blähung am Ende der Inspiration, Lungenparenchym eines Kontrolltieres, HE-Färbung 179 TABELLENVERZEICHNIS Seite Anhang Tabelle 7.1.1: Alterationen im Surfactantsystem: Klinik, Pathomorphologie und kulturelle Untersuchung Tabelle 7.2.1: Stereologische und klinische Charakterisierung der Lungenparenchymalterationen nach Infektion mit A.pp. Tabelle 7.2.2 163 164 Pathomorphologische und histopathologische Charakterisierung der Lungenparenchymalterationen nach Infektion mit A.pp. Tabelle 7.2.3: Ausgewählte Korrelationen (Lichtmikroskopie) in der Kontrollgruppe (n=5) Tabelle 7.2.4: 165 166 Ausgewählte Korrelationen (Lichtmikroskopie) bei den A.pp.- infizierten Schweinen (n=4) 167 Übergeordnete Einleitung 1. Übergeordnete Einleitung Erkrankungen des Respirationstraktes führen in der Schweineproduktion zu großen wirtschaftlichen Verlusten (JACKSON u. COCKCROFT 2007) und sind neben den Durchfallerkrankungen einer spanischen Studie zufolge die bedeutendste Indikation für den Einsatz von Antibiotika beim Schwein (CASAL et al. 2007). Die Weiterentwicklung der Diagnostik und Therapie von porzinen Atemwegserkrankungen ist deshalb nicht nur aus ökonomischen Gesichtspunkten nötig, sondern auch im Sinne des Verbraucherschutzes, des Tierschutzes und der Landwirtschaft entscheidend (modifiziert nach HENNIG-PAUKA 2007). Die Dissertation basiert auf vorausgegangenen Arbeiten, in denen a) die genetische Krankheitsresistenz verschiedener Rassen und die Bedeutung angeborener Immunitätsmechanismen bezüglich der Anfälligkeit gegenüber Actinobacillus pleuropneumoniae untersucht wurde (HÖLTIG 2009), b) bildgebende Verfahren bei dieser Erkrankung evaluiert wurden (BRAUER et al. 2012) und c) zum angeborenen Immunsystem gehörende antibakterielle Peptide im die Lungenoberfläche auskleidenden Flüssigkeitsfilm entdeckt und als Krankheitsmarker genutzt wurden (HENNIG-PAUKA et al. 2006). Studien haben Immunsystems, gezeigt, dass funktionelle als Komponenten Bestandteile des Surfactantsystems, des angeborenen bei der Abwehr bakterieller Erreger eine wichtige Rolle spielen (LEVINE et al. 1998; GIANNONI et al. 2006; WU et al. 2003). Somit lag es nahe, die bronchoalveoläre Lavageflüssigkeit (BALF) grundlagenorientiert zu untersuchen. Hierbei wurde die BALF sowohl auf ihre biophysikalischen Eigenschaften (Oberflächenspannung) als auch ultrastrukturell (Surfactantsubtypen) anhand bestimmter morphometrischer Parameter untersucht (in Anlehnung an SCHMIEDL et al. 2003). Diese Untersuchungen fanden in Zusammenarbeit mit der Medizinischen Hochschule Hannover, Institut für Funktionelle und Angewandte Anatomie und der Klinik für Pädiatrische Pneumologie, Allergologie und Neonatologie statt. Anhand der Infektion mit Actinobacillus pleuropneumoniae (A.pp) sollen mit dieser 15 Übergeordnete Einleitung Studie nun zwei daran anknüpfende grundlagenforschungsorientierte Fragestellungen bearbeitet werden (in Anlehnung an SCHMIEDL et al. 2003; VAN SCHAIK et al. 1997): 1. Wie stellt sich die Morphologie der Surfactantsubtypen und die biophysikalische Funktion vor und nach der Infektion dar? 2. Lassen sich entzündungsbedingte Veränderungen des Surfactants hinsichtlich seiner Morphologie und Gesundheitszustand Funktion (Klinik darstellen, und so dass Pathomorphologie) auf des den Tieres rückgeschlossen werden kann? Die BALF könnte dann einerseits auf Erreger (vgl. GROSSE-BEILAGE et al. 2013, S. 204-206), andererseits auch auf die Qualität des oberflächenaktiven Surfactants (s.o.) untersucht werden. Langfristig wäre dies ein wichtiger Ansatz, um neue Therapieansätze und auch Vakzinierungsstrategien bezüglich ihrer Wirkung auch auf Komponenten des angeborenen Immunsystems evaluieren zu können (modifiziert nach HENNIG-PAUKA et al. 2012). Dabei sollen die durchgeführten Untersuchungen Orientierungswerte für die Surfactantcharakterisierung beim Schwein bieten, und zwar sowohl für gesunde Tiere, als auch für Tiere mit Pneumonie. Da das Schwein häufig als Modelltier genutzt wird (TRACHSEL et al. 2011, HOHLFELD et al. 1999 b, ROGERS et al. 2008), stellen diese Daten auch für die humanmedizinische Forschung eine Grundlage dar, um Tiermodelle für Erkrankungen des Menschen besser charakterisieren zu können. Dieselben Tiere, die zuvor zur Beantwortung anderer Fragestellungen mit A.pp. infiziert worden waren (s.o.), wurden nun auch genutzt, um in dieser Arbeit die pathogenspezifischen Alterationen im porzinen Surfactant und im Lungenparenchym zu charakterisieren. 16 Literaturübersicht 2. Literaturübersicht 2.1 Anatomischer und histologischer Aufbau der Lunge beim Schwein bzw. bei Haussäugetieren Anatomie Grundsätzlich hat die Lunge der Haussäugetiere die Struktur eines tubuloalveolär zusammengesetzten Gangsystems, die Aufzweigung des Bronchialbaumes ist als Grundlage für die Lappengliederung tierartspezifisch gegeben (KÖNIG u. LIEBICH 2012, S. 383). KÖNIG u. LIEBICH (2012, S. 382) beschreiben, dass beim Schwein die Anatomie der rechten Lunge (Pulmo dextra) und der linke Lunge (Pulmo sinistra) in Bezug auf die Lappengliederung verschieden ist. Die Pulmo sinistra gliedert sich in einen Lobus cranialis sinister mit je einer Pars cranialis und Pars caudalis und einen Lobus caudalis sinister. Die rechte Lunge besitzt vier Lappen: Lobus cranialis, Lobus accessorius, Lobus medius und Lobus caudalis (KÖNIG u. LIEBICH 2012, S. 382). Des Weiteren erörtern KÖNIG u. LIEBICH (2012, S. 386) beim Schwein und beim Wiederkäuer das gesonderte Vorhandensein eines rechtsseitigen Bronchus trachealis. Dieser entspringt als selbstständiger Lappenbronchus vor der Bifurcatio tracheae aus der Trachea. Das luftleitende Bronchialsystem lässt sich bei den Haussäugetieren in Hauptbronchien (Bronchi principales) nach Aufzweigung der Trachea, Lappenbronchien (Bronchi lobares) jeweils der linken und rechten Lunge, Segmentbronchien (Bronchi segmentales) für ein umschriebenes kegelförmiges Lungensegment, Subsegmentbronchien (Bronchi subsegmentales), kleinere Bronchien (Bronchioli veri) und Endbronchiolen (Bronchioli terminales) untergliedern. Daran anschließend besteht das respiratorische System aus Bronchioli respiratorii, Alveolargängen (Ductus alveolares), Alveolarsäckchen (Sacculi alveolares) und Lungenbläschen (Alveoli pulmonis) (KÖNIG u. LIEBICH 2012, S. 386). Funktionell ist die Lunge bei den Haussäugetieren über den Truncus pulmonalis an das Gefäßsystem des kleinen Lungenkreislaufs angeschlossen, die nutritive Versorgung übernehmen die Arteria und Vena bronchooesophagea (KÖNIG u. LIEBICH 2012, S. 388). 17 Literaturübersicht Arterielles, sauerstoffangereichertes Blut wird über die Venae pulmonales in die linke Vorkammer des Herzens gebracht (KÖNIG u. LIEBICH 2012, S. 388). a: b: c: d: 1: Lobus cranialis Lobus medius Lobus caudalis Lobus accessorius Incisura cardiaca pulmonis dextri bzw. sinistri 2: Trachea 3: Bronchus principalis 4: Bronchus trachealis 5: Bronchus lobaris cranialis 6: Bronchus lobaris medius 7: Bronchus accessorius 8: Bronchus lobaris caudalis 9: 1. bzw. 3. ventraler Segmentbronchus des Lobus‘ caudalis 10: 2. dorsaler Segmentbronchus des Lobus’ caudalis 11: weitere Segmentbronchen 12: Lymphonodi tracheobrochales craniales 13: Lymphonodi tracheobrochales sinistri 14: Lymphonodi tracheobrochales dextri 15: Lymphonodi tracheobrochales medii (aus WAIBL 1999, S. 268) Abb. 2.1.a (nach WAIBL 1999, S. 268) Abb. 2.1.b (nach WAIBL 1999, S. 268) Abb. 2.1.a: Aufbau der Schweinelunge (nach WAIBL 1999, S. 268) Abb. 2.1.b: Legende zu Abb. 2. 1.a (nach WAIBL 1999, S. 268) Histologie LIEBICH u. ZENGERLING (2010, S. 265-267) berichten, dass die Lunge bei den Haussäugetieren außen von einer Kapsel (Pleura visceralis) umschlossen wird, die ein einschichtiges, flaches bis isoprismatisches Epithel und eine unregelmäßig dicke Lage kollagener und elastischer Fasen enthält. Davon ausgehend laufen Bindegewebssepten zusammen mit Blutgefäßen und Nerven ins Organinnere und gliedern als beim Schwein deutlich ausgebildetes, interstitielles Bindegewebe die Lunge in Lappen und Läppchen (LIEBICH u. ZENGERLING 2010, S. 265-267). 18 Literaturübersicht Den innerhalb der Lunge liegenden, luftleitenden Abschnitten fallen ca. 6 % des Lungenvolumens zu, den respiratorischen Abschnitten hingegen rund 85 % (LIEBICH u. ZENGERLING 2010, S. 265). Luftleitendes System LIEBICH u. ZENGERLING (2010, S. 267) beschreiben, dass die innere Oberfläche der Bronchien bei den Haussäugetieren von einem respiratorischen Flimmerepithel mit Becherzellen ausgekleidet wird, die Epithelhöhe wird dabei nach distal laufend kontinuierlich geringer. Die Lamina propriae mucosae ist mit gemischten Drüsen, Blut- und Lymphgefäßen, Nerven, Solitärlymphknötchen und lockerem Bindewebe (kollagene, aber vor allem elastische Fasern) ausgestattet. Sich daran anlegend folgt eine Schicht glatter Muskulatur und hyalinem Knorpelparenchym (je nach Aufzweigungsgrad Knorpelspangen bis Knorpelfragmente) (LIEBICH u. ZENGERLING 2010, S. 267). Im Weiteren wird von LIEBICH u. ZENGERLING (2010, S. 269) genannt, dass abschließend bei den Haussäugetieren eine bindegewebige Tunica adventitia mit Gefäßen und Nerven folgt. Das Lumen der Bronchioli wird von einem mehrreihigen, hochprismatischen Flimmerepithel ausgekleidet. Dieses wird morphologisch mit zunehmender Aufzweigung mehrreihig, isoprismatisch bis einschichtig, isoprismatisch in den Bronchioli terminales. In bevorzugt kleineren Bronchioli finden sich auch hochprismatische Zellen ohne Zilien (Clara-Zellen). Im Grundaufbau der Bronchioli sind Drüsen und knorpelige Strukturen gänzlich nicht vorhanden, eine kräftige Tunica muscularis aus mehreren Lagen vorrangig zirkulär angeordneter glatter Muskelzellen ist deutlich ausgeprägt (LIEBICH u. ZENGERLING 2010, S. 269). Respiratorisches System LIEBICH u. ZENGERLING (2010, S. 270) stellen dar, dass histologisch die beim Schwein selten vorkommenden Bronchioli respiratorii überwiegend den Bronchioli terminales gleichen. Die Bronchioli respiratorii sind bei den Haussäugetieren mit 19 Literaturübersicht tiefen Ausbuchtungen, ausgekleidet mit einem flachen Alveolarepithel, ausgestattet. Aus den terminalen Bronchioli respiratorii zweigen sich bis zu zehn Alveolargänge ab (LIEBICH u. ZENGERLING 2010, S. 270). LIEBICH u. ZENGERLING (2010, S. 270) weisen darauf hin, dass die Alveolargänge mit ihren Nischen aus einschichtigem Plattenepithel (Alveolarepithel) von außen von einem Netz aus kollagenen und vor allem elastischen Fasern umfasst werden, zusätzlich findet man glatte Muskelzellen. Durch drei- bis fünffache Aufzweigung der Alveolargänge entwickeln sich die Endabschnitte des respiratorischen Systems: die Alveolarsäckchen (Sacculi alveolares). Die Lungenbläschen (Alveoli pulmonis) kleiden die Bronchioli respiratorii, die Ductus und Sacculi alveolares als säckchenförmige Ausstülpungen aus (LIEBICH u. ZENGERLING 2010, S. 270). Die mittels stereologischer Methoden ermittelte Anzahl der Alveolen beträgt beim Menschen ca. 480 Millionen, ein mm³ Lungenparenchym beeinhaltet folglich ca. 170 Alveolen (OCHS et al. 2004). LIEBICH u. ZENGERLING (2010, S. 270) erörtern, dass das die Alveolen auskleidende Alveolarepithel bei den Haussäugetieren aus zwei Zelltypen: Alveolarepithelzellen Typ I (AE I) und AE II besteht. Die AE I sind als dünne, abgeplattete Deckzellen für ca. 95 % der Innenauskleidung der Alveolaroberfläche verantwortlich. Als Bestandteil der Blut-Luftschranke liegen sie der Basalmembran an. AE II sind wesentlich größere Zellen (etwa 10-12 µm) und befinden sich als kleine Gruppen in den Alveolarnischen (LIEBICH u. ZENGERLING 2010, S. 270). Als Charakteristikum der AE II sind die Lamellenkörper zu sehen, die dicht gepacktes phospholipidreiches Material (intrazellulärer Surfactant) enthalten (LIEBICH u. ZENGERLING 2010, S. 271). AE II sind für die Produktion, Sekretion, Wiederaufnahme und Recycling des Surfactants verantwortlich (JOBE u. RIDER 1992). Eine vergleichende Studie von WIRKES et al. (2010) zum intrazellulären Surfactantsystem bei verschiedenen Säugetieren (Etruskische Spitzmaus, Meerschweinchen, Mensch, Rind, Pferd, Kamel, Giraffe, Kaninchen, Hund, Ziege, Ratte und Maus) zeigt, dass das mittlere Volumen der AE II 500-600 µm3 und das 20 Literaturübersicht mittlere Volumen der Lamellenkörper je AE II 80-100 µm3 bei den meisten Spezies beträgt und nur bei der Etruskischen Spitzmaus, Meerschweinchen und beim Menschen etwas höher liegt. Das mittlere Volumen der AE II stellte sich folglich unabhängig vom Körpergewicht dar. Das Gesamtvolumen der Lamellenkörper und die Anzahl der AE II waren mit dem Körpergewicht korreliert, was eine allometrische Relation bedeutet (WIRKES et al. 2010). Eine Zellteilung und Transformation von AE II zu AE I bei Verletzungen des Alveolarepithels ist beim Menschen möglich (WELSCH u. DELLER 2010, S. 281). LIEBICH u. ZENGERLING (2010, S. 271) erklären, dass die benachbarte gemeinsame Wand zweier Alveolen (Septum interalveolare) beidseitig von AE I und II bedeckt wird, die Alveolarepithelzellen liegen ihrerseits einer dünnen Basalmembran auf. Zusätzlich ist subepithelial eine bindegewebige Grundlage, das Lungeninterstitium, mit dichtem Kapillarnetz vorhanden (LIEBICH u. ZENGERLING 2010, S. 271). Zusammenfassend dient folglich als Blutluftschranke: Surfactant auf der Oberfläche der Alveolarepithelzellen, Alveolarepithels, die das Zytoplasma Basalmembran und und die Zytoplasma Basalmembran des des der Endothels Kapillarwand, das Blutplasma und die Plasmalemm der Erythrozyten (LIEBICH u. ZENGERLING 2010, S. 271). 2.2 Surfactant 2.2.1 Aufbau, Funktion und Synthese Das pulmonale Surfactant setzt sich aus ca. 90 % Lipiden, vor allem dem Dipalmitoyl-Phosphatidylcholin (DPPC), und ca. 10% Proteinen zusammen (COCKSHUTT u. POSSMAYER 1992, S. 340). Zu den Proteinen zählen die Surfactantproteine (SP) A, B, C und D (COCKSHUTT u. POSSMAYER 1992, S. 342). Die hydrophoben SP B und C haben biophysikalische Eigenschaften (COCKSHUTT u. POSSMAYER 1992, S. 343-344). Eigenschaften der Erregerabwehr sind vor allem SP A (VAN IWAARDEN et al. 1990; VAN IWAARDEN et al. 1991; VAN IWAARDEN 1992; VAN IWAARDEN et al. 1992 a) und D (VAN 21 Literaturübersicht IWAARDEN et al. 1992 b; HERBEIN u. WRIGHT 2001) zuzusprechen (ausführlich dargestellt in CROUCH und WRIGHT 2001; WRIGHT 2005). Das sezernierte Surfactant kleidet die intraalveoläre Oberfläche komplett aus, setzt als oberflächenaktive Substanz die Oberflächenspannung an der Luft- Flüssigkeitsgrenze im Inneren der Alveolen um das fünf bis zehn-fache herab (LIEBICH u. ZENGERLING 2010, S. 271), verhindert ein Kollabieren der Alveolen (CLEMENTS 1997; ENHORNING u. HOLM 1993) und trägt somit zur alveolären Stabilität bei (CLEMENTS et al. 1961). Dieses hochgradig oberflächenaktive Material ermöglicht zudem eine leichte Erweiterung der Alveolen während der Einatmung (GRIESE 1999). Die Surfactanproteine werden via Transskription, Translation am rauhen endoplasmatischen Retikulum (rER) und posttranslationaler Modifikation vorwiegend am Golgi-Apparat und teilweise auch in den multivesikulären Körperchen in den AE II produziert und modifiziert (MÜHLFELD u. OCHS 2010, S. 4). Vor der Exozytose wird der Großteil aller intrazellulärer Surfactantkomponenten in den Lamellenkörpern der AE II (OCHS 2010), die nahezu zu den Lysosomen identische, hydrolytische Eigenschaften aufweisen (HOOK u. GILMORE 1982), zusammengesetzt und gelagert (OCHS 2010). Als Unterschied zu „echten“ Lysosomen besitzen die Lamellenkörper eher eine Speicherungs- und Sekretionsfunktion als dass sie am Abbau von Strukturen beteiligt sind (WEAVER et al. 2002). WEAVER et al. (2002) erörtern, dass die Lamellenkörper (Größe: 1-2 µm) endozytotisch bei saurem pH-Wert (5,5) aktiv sind. Die Phospholipide in den Lamellenkörpern sind dicht gepackt und in konzentrischen membranartigen Blättern angeordnet. DPPC stellt die Hauptkomponente der zweischichtigen Blätter dar (WEAVER et al. 2002), welches unter allen bekannten Phospholipiden am stärksten oberflächenaktiv ist (VELDHUIZEN et al. 1998). OCHS (2010) beschreibt, dass ausgehend von den AE II die Exkretion mittels Exozytose in die wässrige Hypophase des Alveolarraumes erfolgt. Ein bestimmter Surfactantsubtyp, der als Lamellenkörper-ähnliche Struktur angesprochen werden kann, verbindet sich mit dem Surfactantprotein A unter Bildung eines gitterförmigen 22 Literaturübersicht Komplexes, der als Tubuläres Myelin bezeichnet wird (OCHS 2010). Man nimmt dabei an, dass sich SP-A in die äußeren Ecken des Gitters setzt (VOORHOUT et al. 1991). Dieser Komplex ist vermutlich als Vorläufer des Surfactantfilms zu sehen, von dem ausgehend nun der eigentliche Surfactantfilm aufgebaut werden kann (HAWGOOD u. POULAIN 2001; OCHS 2010). Sezerniertes Surfactant liegt in der Hypophase in Form von oberflächenaktiven Vorstufen und oberflächeninaktiven Abbauprodukten vor (UEDA et al. 1994; GROSS u. NARINE 1989 a). Unilamelläre Vesikel (ulv) sind als als „verbrauchte“ (GROSS u. NARINE 1989 a) bzw. inaktive Surfactantsubtypkomponenten zu sehen, die in AE II recycelt oder abgebaut werden oder von Alveolarmakrophagen aufgenommen und abgebaut werden können (MÜHLFELD u. OCHS 2010, S. 4). Die Surfactantsubtypen tubuläres Myelin (tb) und lamellenkörperartige Vesikel (lbl) stellen sich hingegen als aktive Surfactantkomponenten dar (OCHS 2010). Durch Dichtegradientenzentrifugation von intraalveolärem Surfactant, gewonnen aus BALF, lassen sich small aggregates (SA) und large aggregates (LA) unterscheiden (GROSS et al. 2000). SA enthalten die inaktiven Surfactantsubtypen, wie ulv (GROSS u. NARINE 1989 a; OCHS et al. 2006), und LA die aktiven Surfactantsubtypen wie lbl und tm (SCHMIEDL et al. 2003). Das Verhältnis von SA zu LA (SA/LA ratio) spiegelt die biophysikalische Aktivität des intraalveolären Surfactants wieder (OCHS 2010). So findet sich beim Ischämie/Reperfusioninduzierten Lungenschaden (OCHS 2010), Lungentransplantation (HOHLFELD et al. 1998) bzw. beim Akuten Atemnotsyndrom (VELDHUIZEN et al. 1995) eine verschlechterte biophysikalische Funktion des Surfactants im Sinne einer erhöhten SA/LA ratio. 2.2.2 Die Rolle des Surfactants im angeborenen Immunsystem Die SP A und D gehören zu der Proteinfamilie der Kollektine, die dem angeborenen Immunsystem zugeordnet sind (MÜHLFELD u. OCHS 2010, S. 3). Die erste Etappe der Wirtsabwehr wird durch das angeborene Immunsystem bewerkstelligt, dieses wirkt als Brücke bis die adaptive Immunreaktion greifen kann 23 Literaturübersicht (HAAGSMANN et al. 2008). Es ist ein „phylogenetisch altes System“, das mit Keimbahn-kodierten Proteinen, wie den Lysozymen, Kollektinen und dem Komplementsystem arbeitet (WRIGHT 2004). Zusätzlich sind noch physikalische Komponenten der Wirtsabwehr, wie die Epithelbarrieren im Respirationstrakt und die mukoziliäre Clearance, zu erwähnen (ROHMANN et al. 2011). Als Zellfraktionen des angeborenen Immunsystems gelten Dendritische Zellen, Epithelzellen, Basophile und Eosinophile Granulozyten, Natürliche Killerzellen und Mastzellen sowie die phagozytierenden Zellen wie Neutrophile Granulozyten, Monozyten und Makrophagen (ROHMANN et al. 2011). Da das adaptive Immunsystem bei Neugeborenen noch nicht ausgebildet ist, ist das angeborene Immunsystem besonders wertvoll (HAAGSMANN et al. 2008). WRIGHT (2004) erklärt, dass die Kollektine eine N-terminale, kollagenartige-Region und eine C-terminale Lektin-Domäne besitzen. Die Lektin-Domäne ist für den Bindungsvorgang mit wirtsfremden Oligosacchariden auf der Oberfläche von Krankheitserregern (Bakterien und Viren) verantwortlich (WRIGHT 2004). Dieser Vorgang ist auch als Opsonisierung bekannt, da die Aufnahme durch Phagozyten erleichtert wird (VAN IWAARDEN et al. 1991; WRIGHT 2004). Eine Studie mit SP-A defizienten Mäusen zeigte nach einstündiger, intratrachealer Infektion mit Pseudomonas aeruginosa eine wesentlich geringere bakterielle Elimination (Phagozytose durch Makrophagen) als der Wildtyp (LEVINE et al. 1998). WRIGHT (2004) nennt, dass in in vitro Studien die Aktivität vieler Zellen des Immunsystems durch Kollektine vermittelt wird, obwohl ein genauer Wirkmechanismus häufig nicht klar ist. Phagozytose, Chemotaxis, Zytokinregulation und die Bildung freier Sauerstoffradikale durch verschiedenste Abwehrzellen werden durch SP-A und SP-D beeinflusst (WRIGHT 2004). Des Weiteren konnte bei SP-A und SP-D eine antimikrobielle Wirkung (Hemmung des Wachstums von bestimmten gramnegativen Bakterien) belegt werden (WU et al. 2003). HAAGSMANN et al. (2008) erklären, dass Kollektine grundsätzlich mit zahlreichen Bakterien reagieren, wobei bei gram-negativen Bakterien die Lipopolysaccharide der 24 Literaturübersicht Membranen einen Hauptangriffspunkt darstellen. Bei gram-positiven Bakterien sind als Hauptangriffspunkte die Lipoteichonsäuren und Peptidoglykane zu nennen (HAAGSMANN et al. 2008). GIANNONI et al. (2006) wiesen in einer Studie bei Mäusen darauf hin, dass SP-A und SP-D die Elimination von Pseudomonas aeruginosa aus dem Lungenparenchym verstärken. Dies geschieht durch eine modulierte Entzündungsreaktion und einer stimulierten Aufnahme durch Alveolarmakrophagen (GIANNONI et al. 2006). Auch die adaptive Immunantwort (T-Lymphozyten und Dendritische Zellen) wird durch Kollektine (SP A und D) beeinflusst (WRIGHT 2004). Des Weiteren ist auch den Surfactantlipiden eine immunologische Rolle zuzusprechen: sie verstärken Phagozytose und Erregerelimination, modifizieren die Bildung freier Radikale und Lymphozytenproliferation (WRIGHT 1997). 2.2.3 Surfactantdysfunktion Einer der Gründe für die Entstehung einer Surfactantdysfunktion ist die Ausschwitzung von Plasmaproteinen in den Alveolarraum (SEEGER et al. 1993 a; PARK et al. 1998; KEOUGH et al. 1988; CURRIE et al. 1998 a). Des Weiteren findet man bei pathologischen Prozessen wie Asthma von eosinophilen Granulozyten freigesetzte, zytotoxische Proteine wie das eosinophilic cationic protein (ECP) (BOUSQUET et al. 1990; HOHLFELD et al. 2004), für das auch ein deutlicher Zusammenhang zur Surfactantinaktivierung gezogen werden konnte (HOHLFELD et al. 2004). SCHMIEDL et al. (2004) zeigten in diesem Zusammenhang, dass eine Mischung von Alveofact®, einem exogenen natürlichen bovinen Surfactant, mit ECP eine signifikante Größenreduktion der aktiven Surfactantsubtypen und einen signifikanten Anstieg der Volumenfraktion der inaktiven Surfactantsubtypen bewirkt (SCHMIEDL et al. 2004). Diese Verschiebung von aktiven zu inaktiven Surfactant-Subtypen konnten auch in anderen Studien im Rahmen von akutem Lungenschaden und Lungentransplantation (MAITRA et al. 2002) und Akutem Atemnotsyndrom (VELDHUIZEN et al. 1995) 25 Literaturübersicht gezeigt werden. ENHORNING (2008) erklärt, dass Plasmaproteine nur schwach hydrophob und potenziell überall im Flüssigkeitsfilm der Atemwege vorhanden sind. Sie sind bei der Exspiration nur geringgradig an den Surfactantfilm adhäriert und verhindern dennoch, dass die amphiphilen Phospholipide näher zusammen rücken, wodurch die Oberflächenspannung physiologischer Weise gesenkt werden würde (ENHORNING 2008). In der Studie von CURRIE et al. (1998 b) mit Ozon ausgesetzten Mäusen zeigte sich eine signifikante Verschlechterung der Surfactantfunktion. Nach Entfernung der wasserlöslichen Proteine und anderer Substanzen stellte sich die Funktionalität wieder ein (CURRIE et al. 1998 b). Eine verschlechterte Surfactantfunktion zeigte sich auch in den Versuchen von VAN SCHAIK et al. (1997) mit Mäusen, die mit dem Respiratorischen Synzytial Virus infiziert worden waren, wobei hier die eingedrungenen Proteine nicht als einzige Ursache für eine reduzierte Funktion diskutiert wurden. Es wurde auch die Hydrolyse von Surfactantbestandteilen durch Mediatoren von Entzündungszellen diskutiert (VAN SCHAIK et al. 1997). Bei menschlichen Asthmapatienten zeigte sich ein ähnliches Bild: die BALF wies eine deutlich bessere Funktion nach Entfernung der wasserlöslichen Inhibitoren (Proteine und andere Substanzen) auf (JARJOUR u. ENHORNING 1999). Eine Studie von WRIGHT et al. (2001) ergab nach Infektion von Mäusen mit Pneumocystis carinii erhöhte Oberflächenspannungen und erhöhte Protein- Phospholipid-Verhältnisse in der BALF (WRIGHT et al. 2001). Bei asthmatischen Brown Norway Ratten konnte in der Studie von SCHMIEDL et al. (2003) gezeigt werden, dass sowohl die minimale Oberflächenspannung als auch die Lungenresistance signifikant erhöht war. Des Weiteren waren die inaktiven Surfactantsubtypen stärker vertreten, was eine gesteigerte Konversion von aktiven zu inaktiven Surfactantsubtypen nahelegte. Eine Interaktion zwischen Proteinen und Konvertase oder eine Inaktivierung von SP-A wurden diskutiert. Ursächlich können dafür entzündungsbedingte proteinreiche Exsudate sein (SCHMIEDL et al. 2003). 26 Literaturübersicht 2.2.4 Die Rolle des Surfactants bei spezifischen Erkrankungen des Menschen bzw. in der tierexperimentellen Grundlagenforschung Asthma (vgl. Abb. 2.2) JARJOUR u. ENHORNING (1999) beschreiben, dass bei Patienten mit Asthma die Surfactantdysfunktion wahrscheinlich primär durch die Entzündungsreaktion, verknüpft mit dem Einströmen von Plasmaproteinen in den Alveolarraum, ausgelöst wird. Diese Proteine schädigen massiv die oberflächenaktiven Eigenschaften des Surfactants (JARJOUR u. ENHORNING 1999). Als zukünftiger, therapeutischer Ansatz wäre die Hydrolyse dieser Proteine ohne eine Schädigung der Epithelien der Lunge anzustreben (ENHORNING 2008). In einer Studie von HOHLFELD et al. (1999 a) kam es 24 Stunden nach der Allergenexposition von Asthmapatienten zu einem signifikanten Anstieg der eosinophilen Granulozyten, der Proteine, der SA/LA ratio und der minimalen Oberflächenspannung in der BALF. Hier wird eine stärkere Konversion der LA zu SA vermutet. Bei Asthmapatienten sind die SP-A Level reduziert, so dass eine abgeschwächte Wirkung des SP-A auf die Konversion der aktiven Surfactantsubtypen zu erwarten ist. Auch an dieser Stelle wurden ursächlich Entzündungsproteine und andere inflammatorische Produkte angenommen (HOHLFELD et al.1999 a). Untersuchungen von ENHORNING et al. (2000) erörtern die Effekte einer verringerten Temperatur auf die Surfactantfunktion, die zusätzlich durch entzündliche Prozesse beeinflusst wird. Daraus ließe sich eine mögliche Ursachenerklärung für den erhöhten Widerstand in den Atemwegen bei Hyperventilation Asthmapatienten bei kaltem Wetter ableiten (ENHORNING et al. 2000). 27 von Literaturübersicht Abb. 2.2: Surfactant bei belastungsinduziertem Asthma (Abbildung modifiziert nach ENHORNING et al. 2000), Schwarze Linien: Mechanismen, die die Atemwegsobstruktion verursachen, gestrichelte Linien: Mechanismen, die die Atemwegsobstruktion mildern (ENHORNING et al. 2000) Atemnotsyndrom des Erwachsenen (Adult Respiratory Distress Syndrome, ARDS) bzw. tierexperimentelle Studien in diesem Rahmen HAMM et al. (1996) subsummieren, dass beim Atemnotsyndrom des Erwachsenen verschiedenste Ätiologien beschrieben worden sind: Traumata, Verbrennungen, akute Pankreatitis; Sepsis, Pneumonie, etc. Der Gasaustausch in den Alveolen ist akut, diffus und hochgradig gestört, was sich in einem respiratorischen Versagen manifestiert. Auch bei der Pathogenese dieser Erkrankung spielen Veränderungen im Surfactantsystem eine bedeutende Rolle (HAMM et al. 1996). 28 Literaturübersicht Eine Störung der Surfactantfunktion (Erhöhung der minimalen Oberflächenspannung) und eine veränderte Zusammensetzung der Phospholipide sind in verschiedenen Tiermodellen bspw. beim Hund (LIAU et al. 1987) oder bei Meerschweinchen (TAHVANAINEN und HALLMANN 1987) diskutiert worden (ausführlich dargestellt in HAMM et al. 1996). LEWIS et al. (1994) lösten beim Schaf einen Septikämie-bedingten akuten Lungenschaden aus, der zu einer Erhöhung der SA/LA-Ratio und zu einer Reduktion der SP A, B und C führte (LEWIS et al. 1994). Lungentransplantation/ Ischämie/Reperfusion-induzierter Lungenschaden Der Ischämie/Reperfusion-induzierte Lungenschaden kann in schweren Fällen nach Lungentransplantation zu einem Transplantatversagen führen (DE PERROT et al. 2003), was entsprechende Mortalitäten (CHRISTIE et al. 2005) bedingt. Unter anderen Ursachen führen mechanische Ventilationen, Pneumonien, Hypotensionen und Traumata zum Ischämie/Reperfusion-induzierten Lungenschaden (DE PERROT et al. 2003). Eine Studie von CASALS et al. (1998) belegt in Lungentransplantationsversuchen bei Hunden eine signifikant erniedrigte SP A Konzentration und erhöhte Konzentrationen von C-reaktivem Protein (ein Akute- Phase- Protein) nach Reperfusion (CASALS et al. 1998). HOHLFELD et al. (1998) zeigten, dass die SA/LA ratio bei Patienten mit Transplantat signifikant höher und die Oberflächenaktivität signifikant niedriger war als bei gesunden Probanden. Die biophysikalischen Beeinträchtigungen des Surfactants schienen zu persistieren, was eine funktionelle Beeinträchtigung der AE II als Ursache haben könnte (HOHLFELD et al. 1998). HAMM et al. (1996) subsummierten einen Zusammenhang zwischen der verschlechterten Funktion der AE II nach Lungentransplantationen und der Ischämiezeit. Eine Surfactantsubstitution könnte die Funktion der AE II nach Lungentransplantationen durch eine Feedbackhemmung erhalten (HAMM et al. 1996). 29 Literaturübersicht Eine tierexperimentelle, transplantationsassoziierte Studie von KNUDSEN et al. (2011) zeigte, dass nach Ischämie und Reperfusion die Lamellenkörper in den AE II zwar signifikant reduziert, aber vergrößert waren. Dies könnte auf eine gesteigerte Neusynthese oder ein verstärktes Recycling von inaktiven Surfactantkomponenten hinweisen. Eine vermehrte Exozytose von Lamellenkörpern in die Alveole wurde vermutet, die den Verlust an intraalveolärem Surfactant zu kompensieren vermochte (KNUDSEN et al. 2011). Auch die Studie von MÜHLFELD et al. (2010) zum Ischämie/Reperfusion-induzierten Lungenschaden bei Ratten zeigte einen Anstieg der inaktiven Surfactantsubtypen nach Ischämie/Reperfusion (Ratten ohne exogene Surfactantbehandlung), jedoch nicht bei mit exogenem Surfactant behandelten Ratten. Korreliert war das Auftreten der inaktiven Surfactantsubtypen mit einer herabgesetzten Oxygenierung und einer Bildung von intra-alveolären Ödemen. Hintergrund der Studie war die Frage, in wie weit eine exogene Surfactanapplikation den endogenen Surfactantpool beeinflusst. Die Hypothese war, dass sich eine prä-ischämische exogene Surfactantsubstitution vor allem auf die Stabilisierung und Erhöhung des aktiven, endogenen intraalveolären Surfactantpool auswirkt. Ödembildung und Schäden an der BlutLuftschranke könnten dadurch reduziert werden (MÜHLFELD et al. 2010). In einer vorangegangenen Studie von MÜHLFELD et al. (2009) wurde bereits gezeigt, dass bei Ratten im Falle des durch Ischämie/Reperfusion induzierten Lungenschadens die prä-ischämische, exogene Surfactantgabe die Bildung von intraalveoläre Ödemen und den Schaden an der Blut-Luftschranke mildern könnte (MÜHLFELD et al. 2009). Als weiterer therapeutischer Ansatz wird auch eine Kombinationstherapie aus exogenem Surfactant und Keratinozyten-Wachstumsfaktor (Palmiferin, ΔN23-KGF) im Rattenmodell in Erwägung gezogen (SADOVSKI et al. 2008; MÜHLFELD et al. 2010). Durch Therapie mit Keratinozyten Growth Factor (Palmiferin, ΔN23-KGF) vor der Lungenexplantation kann die intraalveoläre Ödembildung nach einer Transplantation signifikant reduziert werden (SADOVSKI et al. 2008). 30 Literaturübersicht In einer tierexperimentellen Studie mit Schweinen von INCI et al. (2011) diente Surfactant der Beurteilung der Qualität des Lungenparenchyms für eine Transplantation nach Herztod. Mittelfristig kann die Nutzung der Surfactantqualität als Marker möglicherweise den Spenderpool erhöhen. In dieser Studie zu Surfactantalterationen nach Herztod wurde bei Hausschweinen belegt, dass nach zwei Stunden warmer Ischämiezeit die BALF- Proteinkonzentration und die Oberflächenspannung signifikant erhöht waren und die Sauerstoffsättigung signifikant niedriger war (INCI et al. 2011). 2.3 Surfactant bei Tieren In den Ausführungen von BERNHARD et al. (2004) wird erläutert, dass die Strömung der Luft grundsätzlich bei Säugetieren während des Atmungsvorgangs in zwei Richtungen erfolgt, wird allerdings in den peripheren Strukturen, wie bspw. Bronchiolen und Alveolen, herabgesetzt. Kleine Partikel (<1 µm) können dadurch die Bronchiolen passieren und sich in den Alveolen absetzen, so dass eine erste Phase der Wirtsabwehr durch v.a. Alveolarmakrophagen, SP-A und (Phospholipid-) Regulatoren, wichtig ist. Beim Vogel dagegen bleibt die Luftströmung durch Parabronchen, Atria und die gaswechselnden Kapillaren konstant und kontinuierlich während der In- und Exspiration. Gewährleistet wird dies einerseits durch das konstante Öffnen und Schließen des Klappensystems zwischen Mesobronchen/Luftsäcken und Parabrochen und andererseits durch einen während der In- und Exspiration wechselnden cranio-caudalen Druckgradienten (BERNHARD et al. 2004). BERNHARD et al. (2001 a) erklären, dass die Oberflächenspannung von Säugersurfactant sich von Vogelsurfactant beträchtlich unterscheidet. Während beim Schwein minimale Oberflächenspannungen von kleiner 5 mN/m unter dynamischer Kompression erreicht werden, sind diese bei Lungen von Enten und Hühnern aufgrund ihres tubulären Aufbaus wesentlich höher (BERNHARD et al. 2001 a). Die Studie von BERNHARD et al. (2001 a) zeigte auch, dass der Surfactantsubtyp tm im Surfactant von Enten und Hühnern gänzlich fehlte. Des Weiteren konnten SP-A 31 Literaturübersicht und SP-C im Surfactant von Enten und Hühnern nicht nachgewiesen werden, während SP-B in etwa gleichen (Huhn) oder in höheren Konzentrationen (Ente) als beim Schwein vorkamen (BERNHARD et al. 2001 a). BERNHARD et al. (2004) erklären, dass SP-B u.a. für eine schnelle Oberflächenadsorption des Surfactant wichtig ist und daher sowohl in Säuger- als auch in Vogellungen benötigt wird. Für die geringe Oberflächenspannung in den Alveolen und einer Reintegration von Phospholipiden in den Surfactantfilm nach starker Kompression ist SP-C verantwortlich. Solche Vorgänge sind in der rigiden, tubulären Vogellunge von untergeordneter Bedeutung (BERNHARD et al. 2004). Allerdings merkt ZENG et al. (1998) an, dass SP A in den Epithelzellen der Mesobronchien von Hühnerküken (Tag 3 nach Schlupf) nachweisbar war. In den Epithelzellen der peripheren Luftwege (inklusive Parabronchien und Luftkapillaren) konnte SP A jedoch nicht detektiert werden. Die Studie sah darin einen Hinweis, dass SP A für die Lagerung, Verarbeitung und Funktion von Surfactant in Vogellungen nicht wesentlich ist (ZENG et al. 1998). Auf elektronenmikroskopischer Ebene stellt sich lavagierter Surfactant von Enten und Hühnern als oligo- und multilamelläre Struktur dar, während porziner Surfactant Lamellenkörper, amorphes und granuläres Material und tm aufweist (BERNHARD et al. 2001 a). Eine kalifornisch-deutsche Studie von SPRAGG et al. (2004) berichtet, dass die BALF von Flossenfüßern signifikant höhere Phospholipidkonzentrationen und einen höheren Phosphatidylcholinanteil hat, wodurch die Reexpansion der Alveolen nach Tieftauchgängen optimiert wird. Gelelektrophoretische Messungen ergaben bei Elefantenseelöwen im Vergleich zum Menschen signifikant höhere Konzentrationen an SP-B. Zu berücksichtigen ist jedoch, dass bei Meeressäugern nur die cranialen Lungenlappen lavagiert werden konnten. Die LA Surfactantfraktion und die SP-B und -C liegen in höheren Konzentrationen bei Elefantenseelöwen und kalifornischen Seelöwen als beim Menschen vor. Die LA Fraktion trägt mit ihren aktiven Surfactantsubtypen maßgeblich zur Oberflächenspannungsreduktion bei. Die minimale Oberflächenspannung ist allerdings beim Elefantenseelöwen signifikant größer als bei anderen Flossenfüßern und beim Menschen. Erklärend könnte ein 32 Literaturübersicht höherer Anteil an Neutralfetten genannt werden (SPRAGG et al. 2004). Summa summarum lassen sich bei den verschiedenen Vertebratenspezies und während der postnatalen Entwicklung Anpassungsprozesse bezüglich der Zusammensetzung des Surfactants erkennen, die durch die anatomischen und physiologischen Begebenheiten vorgegeben werden (SPRAGG et al. 2004). POSTLE et al. (2001) subsummierten, dass einfach ungesättigte, anionische Phospholipide ein gemeinsames Merkmal von Säugetiersurfactant sind. Untersucht wurde Surfactant vom Menschen und von verschiedenen Tierarten wie Kaninchen, Meerschweinchen und Ratten (POSTLE et al. 2001). 2.4 Surfactant beim Schwein Die Studie von BERNHARD et al. (1997) belegt, dass Surfactant der luftleitenden Atemwege (Trachealaspirate) beim Schwein ähnliche Phospholipid- und Phosphatidylcholinkonzentrationen wie Surfactant aus BALF zeigt, was darauf hinweist, dass auch trachealer Surfactant aus den Alveolen stammt. In den porzinen Trachealaspiraten sind höhere minimale und maximale Oberflächenspannungen als in der BALF zu verzeichnen. Im Gegensatz dazu findet man in Pharyngealaspiraten menschlicher, neugeborener Säuglinge große Mengen an oberflächenaktiven Surfactants. Beim Schwein wurden die SP-B und C nicht und SP-A nur in geringen Konzentrationen im porcinen, trachealen Surfactant nachgewiesen, wobei der Gesamtproteingehalt erhöht war. Surfactant der luftleitenden Wege könnte bei der mukoziliären Clearance eine wichtige Rolle spielen. Es wird vermutet, dass reduzierte oberflächenaktive Eigenschaften bei einer pathologisch-veränderten mukoziliären Clearance mit chronisch-eitrigen Prozessen im Zusammenhang stehen (BERNHARD et al. 1997). SOERENSEN et al. (2005) zeigten, dass bei Schweinen mit akuter und chronischer Bronchopneumonie eine höhere SP-D- Immunreaktivität im Surfactant vorkommt und dass SP-D in bronchusassoziiertem, lymphatischem Gewebe mit Dendritschen Zellen interagierte. SP-D wird daher als Schnittstelle zwischen angeborenem und erworbenem Immunsystem eingestuft (SOERENSEN et al. 2005). 33 Literaturübersicht In einer umfassenden Studie von NIENHOFF (1998) wurde die BALF von Kontrollschweinen und Schweinen mit akuten Pneumoniesymptomen untersucht. Die Alkalische Phosphatase war bei den erkrankten Schweinen signifikant erhöht, die Laktatdehydrogenase und die Proteinkonzentrationen wiesen keine signifikanten Unterschiede auf (NIENHOFF 1998). Eine deutsch-niederländische Studie von RAU et al. (2004) unterstreicht die bessere Oberflächenaktivität des Surfactants neugeborener Saugferkel im Vergleich zu älteren Schweinen.Bei den Saugferkeln konnten erhöhte Konzentrationen an SP-B, C und Phospholipiden (Phosphatidylcholin 16:0/14:0 bzw. 16:0/16:1) nachgewiesen werden. Mit zunehmendem Alter kam es zu einem Rückgang der Phosphatidylcholin16:0/16:0-Konzentationen. Dieses Phospholipid, DPPC, stellte unter den Surfactantphospholipiden die bedeutendste Substanz dar, die die minimale Oberflächenspannung in der Endexspiration minimiert. Eine hohe Konzentration an Arachidonsäurehaltigen-Phospholipiden im Surfactant der Saugferkel stimulierte den alveolären Eicosanoidmetabolismus. Grundsätzlich zeigte die Studie an Schweinen unterschiedlichen Alters eine Anpassung auf molekularer Ebene an die sich ändernden, respiratorischen Begebenheiten während der Lungenentwicklung (RAU et al. 2004). Im Minipig-Modell von HOHLFELD et al. (1999 b) wiesen nach Ischämie und Reperfusion der linken Lunge Schweine ohne exogene Surfactantbehandlung eine deutlich höhere SA/LA ratio und höhere minimale Oberflächenspannungen im Surfactant auf. Reperfusionsbedingt kam es als Folge der Störung der Funktion des Kapillarendothels zu einem Einstrom von Plasmaproteinen in den Alveolarraum. Plasmaproteine wie Albumin, Fibrinogen und Hämoglobin wurden hauptsächlich für die beeinträchtigte Surfactantfunktion verantwortlich gemacht (HOHLFELD et al. 1999 b). Bei an Pneumonie erkrankten Schweinen in der Dissertation von DELBECK (1995) war die Anzahl der neutrophilen Granulozyten mit der Gesamtzellzahl in der BALF korreliert bzw. stieg mit dem Logarithmus der Gesamtzellzahl an. Erklärend wurde hier die stark gehäufte Invasion von neutrophilen Granulozyten aus dem Blut genannt (DELBECK 1995). 34 Literaturübersicht Die Anzahl der polymorphkernigen neutrophilen Granulozyten dient als sensitiver Marker zur Differenzierung von gesunden und lungenkranken Schweinen (GANTER u. HENSEL 1997). 2.5 Erkrankungen des Respirationstrakts beim Schwein Im Jahr 2011 wurden in Deutschland rund 59,7 Millionen Schweine geschlachtet, was einer Schweinefleischerzeugung von etwa 5,6 Millionen Tonnen entspricht (STATISTISCHES BUNDESAMT 2013). Folglich führen Erkrankungen zu massiven wirtschaftlichen Verlusten, die Verbraucherschutz und die wirtschaftliche Existenz gefährden (HENNIG-PAUKA 2007). In einer spanischen Studie von CASAL et al. (2007) setzten rund 58 % der untersuchten Betriebe (n=62) antimikrobielle Substanzen prophylaktisch bei Mastschweinen ein. 26 % der Farmen verwendeten mindestens zwei Wirkstoffe. 92 Farmen gaben unter tierärztlicher Anleitung bei respiratorischen Symptomen Antibiotika ohne zuvor eine gesicherte Krankheitsdiagnose zu stellen (CASAL et al. 2007). 2.5.1 Porcine Respiratory Disease Complex (PRDC) Es handelt sich um einen Erkrankungskomplex mit multiplen Infektionen des pozinen Respirationstraktes, der ca. 6-24 Wochen alte Schweine betrifft (GROSSE-BEILAGE et al. 2013, S. 235). Stallklima (Temperaturschwankungen, hohe Luftfeuchte und Schadgaskonzentration wie bspw. Kohlenstoffdioxid, Ammoniak und Methan), Management (Hygienstatus) (Fütterung, Herdengröße, Haltungsbedingungen), Genetik und bestehende Erkrankungen beeinflussen den Erkrankungsfortschritt (WHITE 2011 a). Genannte nicht-infektiöse Faktoren sind entscheidend für die Initialisierung der Respirationserkrankung, ihnen gegenüber steht eine Vielzahl von viralen und bakteriellen Erregern als infektiöse Agentien (OPRIESSNIG et al. 2011). 35 Literaturübersicht Als virale Erreger sind das Porcine Reproductive and Respiratory Syndrome Virus, das Porzine Influenzavirus (H1N1, HN2, H1N2) und in einigen Ländern auch das Porzine Herpesvirus 1 mit hoher Relevanz und bspw. das Porzine Circovirus Typ 2 mit geringerer Relevanz zu nennen (OPRIESSNIG et al. 2011). Als bakterielle Erreger mit hoher Relevanz gelten Mycoplasma hyopneumoniae, A.pp., Bordetella bronchiseptica, Actinobacillus suis und Salmonella spp. sowie Hämophilus parasuis, Trueperella pyogenes, Mycoplasma hyorhinis, Pasteurella multocida und Streptococcus suis mit eher untergeordneter Bedeutung (OPRIESSNIG et al. 2011). Mycoplasma hyopneumoniae und das Porcine Reproductive and Respiratory Syndrome Virus nehmen aufgrund ihrer Nachweishäufigkeit im Zusammenhang mit dem PRCD eine Sonderstellung ein (THACKER et al. 1999). Das klinische Bild ist dominiert durch Husten, angestrengter Atmung, Fieber, Anorexie, Lethargie, Nasen- und Augenausfluss, Hautverfärbungen im Bereich der Extremitäten, Gewichtsverlust, Todesfälle und letztlich verschlechterter Mastleistung (WHITE 2011 b). 2.5.2 Porzine Pleuropneumonie Verbreitung und Bedeutung Grundsätzlich ist von einer weltweiten Verbreitung der Erkrankung auszugehen, die eine beträchtliche wirtschafliche Relevanz hat (ZIMMERMANN u. PLONAIT 2004, S. 131). In den letzen Jahren nimmt die Infektion mit A.pp. in Betrieben mit intensiver Schweineproduktion eine zunehmende Rolle ein (HEINRITZI 2006, S. 144). Im Jahr 1964 wurde in einer umfassenden Studie von R. Shope über die experimentelle Übertragung, Ätiologie und Pathologie der ansteckenden Lungenbrustfellseuche berichtet (SHOPE 1964). Gemäß einer spanischen Studie lag bei etwa 27 % der Schlachtschweine eine Pleuritis vor, die gemäß Scoring-System zu ca. 50 % auf eine A.pp. Infektion zurückzuführen war (FRAILE et al. 2010). Zunächst wurde das Bakterium als Hämophilus pleupneumoniae bezeichnet. 36 Literaturübersicht Nachdem die DNA-Homologie zu Actinobacillus lignieresii bekannt wurde, wurde das Bakterium in Actinobacillus pleuropneumoniae umbenannt (GOTTSCHALK 2012, S. 653). Die infektionsbedingte Pneumonie bringt massive wirtschaftliche Konsequenzen mit sich: eine schlechte Futterverwertung von chronisch infizierten Tieren und hohe Kosten für Arzneimittel (STRAW et al. 1985), darunter Breitspektrumantibiotika (SANFORD u. JOSEPHSON 1981) und eine erhöhte Mortalität (30- 50%) (QUINN et al. 2002, S. 133). Ätiologie und Pathogenese A.pp., der Erreger der ansteckenden Lungen- und Brustfellentzündung des Schweines (EWERS u. WIELER 2011, S. 229), ist ein gramnegatives, amotiles und stäbchenförmiges Bakterium (EWERS u. WIELER 2011, S. 226). Taxonomisch gehört es in die Familie der Pasteurellaceae (EWERS u. WIELER 2011, S. 221). Die Nikotinamiddinukleotid (NAD) abhängigen Biovar-1 zugeordnete Stämme gelten als virulenter als die NAD unabhängigen Biovar-2 zugeordneten (EWERS u. WIELER 2011, S. 229). Eine Unterteilung erfolgt anhand der Serovare, Biovare und des Vorkommens von ApX-Toxinen, es sind 15 Serovartypen bekannt (EWERS u. WIELER 2011, S. 229), alle Serovare besitzen das Apx IV Toxingen(EWERS u. WIELER 2011, S. 228). Die Serotypen (1, 5, 9, und 11) mit den Apx Toxingenen I und II und Serotyp 10 mit Apx I zeigen eine stärkere Virulenz als andere Serovartypen(EWERS u. WIELER 2011, S. 229). Es sind zahlreiche Virulenzfaktoren, wie Exotoxine, die Ausbildung einer Kapsel, Lipopolysaccharide, Typ-4-Fimbrien und äußere Membranproteine, bekannt (EWERS u. WIELER 2011, S. 228). Als weitere bedeutsame virulenzfördernde Eigenschaft ist die Eisengewinnung aus porzinem Hämin und Hämoglobin (ARCHAMBAULT et al. 2003), aus Hämoglobin (BÉLANGER et al. 1995) und aus Transferrin (GERLACH et al. 1992) zu nennen (ähnlich dargestellt in HENNIG-PAUKA 2007). Für das Weiterleben nach Phagozytose in Makrophagen sind bspw. die Kohlenwasserstoffbestandteile von Kapsel und Lipopolysacchariden, die freie 37 Literaturübersicht Sauerstoffradikale binden, essentiell (EWERS u. WIELER 2011, S. 230). Kapselpolysaccharide und/oder Lipopolysaccharide sind wesentliche Faktoren für die Serumresistenz (EWERS u. WIELER 2011, S. 230). Serotypendifferenzierung erfolgt mittels Bestimmung von Kapsel- und Lipopolysacchariden (GOTTSCHALK 2012, S. 654). Die Oligosaccharidkernregion der Lipopolysaccharide stellt einen wichtigen Adhäsionsfaktor für A.pp. an Wirtszellen dar (GOTTSCHALK 2012, S. 656). EWERS u. WIELER (2011, S. 228) beschreiben, dass die RTX-Toxine (repetitive glyzinreiche Sequenzen) für die massive Entzündungsreaktion und den Gewebsschaden maßgeblich verantwortlich sind. Das Bakterium erzeugt je nach Serotyp bis zu vier verschiedene RTX-Toxine (Apx I-IV), die den Ca2+-abhängigen, porenbildenden, zytolytischen Proteintoxinen gramnegativer Bakterien zugeordnet werden. Apx I hat stark hämolytische und zytotoxische Eigenschaften, Apx II zeichnet sich durch schwächere hämolytische und moderat zytotoxische Eigenschaften aus. Apx III ist nicht an der Hämolyse beteiligt, gilt aber als stark zytotoxisch. Eine schwache Hämolyse löst auch das Apx IV-Toxin aus, Zytotoxizität wurde bisher nicht getestet, was vor allem auf einer fehlenden in-vitro-Produktion zu begründen ist (EWERS u. WIELER 2011, S. 228). EWERS u. WIELER (2011, S. 230) erörtern, dass RTX-Toxine die Funktion von Makrophagen und polymorphkernigen neutrophilen Granulozyten beeinträchtigen. Chemotaktische und phagozytotische Funktionen der Makrophagen werden bereits in sublytischen Dosen beeinflusst. Der oxidative Stoffwechsel in Makrophagen und polymorphkernigen neutrophilen Granulozyten wird angeregt. ApX I und III erweisen sich in hohen Dosen hochgradig toxisch und ApXII moderat toxisch für Alveolarmakrophagen und polymorphkernige neutrophile Granulozyten (EWERS u. WIELER 2011, S. 230). Obwohl es zum Ausbruch der Erkrankung keiner prädisponierenden Faktoren braucht, besteht dennoch eine Verbindung von Stressfaktoren mit erhöhten Erkrankungsinzidenzen (EWERS u. WIELER 2011, S. 229). Der Krankheitsausbruch und die Erregerverbreitung werden durch hohe Tierzahlen, ungünstiges Stallklima mit schwankenden Umgebungstemperaturen und hoher 38 Literaturübersicht relativer Luftfeuchte mit ungenügender Ventilation bevorteilt (GOTTSCHALK 2012, S. 658). Bei der Erregerverbreitung spielen Aerosole und der direkte Tierkontakt die wesentliche Rolle, wobei beim Schwein die Tonsillen den Hauptkolonisationsort darstellen (MACINNES et al. 2008). Als Zielzellen gelten vor allem die Zellen des unteren Respirationstraktes (Zellen der terminalen Bronchioli, Alveolarepithel), die Kolonisierung des Erregers an der Eintrittspforte wird u.a. durch das Fehlschlagen der mukoziliären Clearance begünstigt (EWERS u. WIELER 2011, S. 229). Klinik und Pathologie Der nur für das Schwein pathogene Erreger, A.pp., löst perakute, akute, chronische und subklinische Krankheitsverläufe mit hoher Morbidität und Mortalität aus (HEINRITZI 2006, S. 144). Meist zeigt sich die Infektion beim Schwein zwischen der 6. und 20. Lebenswoche (EWERS u. WIELER 2011, S. 230). Die Erkrankungsschweregrade sind abhängig von der Erregermenge (SEBUNJA et al. 1983). Die klinischen Bilder variieren stark in Abhängigkeit von der Virulenz des Bakterienstammes, der Infektionsdosis und der Abwehrlage des Schweins (EWERS u. WIELER 2011, S. 230). WEISS u. RUDOLPH (2007, S. 66) beschreiben, dass die sich entwickelnde Pleuropneumonie im akuten Zustand durch fibrinöse, hämorrhagisch-nekrotisierende Veränderungen gekennzeichnet ist, während im chronischen Stadium adhäsive Pleuritis, Sequestration und Induration im Vordergrund stehen. Des Weiteren bildet sich eine umfangreiche adhäsive Pleuritis aus (WEISS u. RUDOLPH 2007, S. 66). Die Läsionen sind vor allem in den dorsocaudalen Lungenbereichen lokalisiert (FRANK et al. 1992, LÓPEZ 2009, S. 502) wobei theoretisch alle Lungenlappen betroffen sein können (LÓPEZ 2009, S. 502). Nach einer Infektion werden oft eine hohe Mortalität und Morbidität beobachtet und erkrankte, noch lebende Schweine entwickeln sich zu Kümmerern mit chronischen Lungenläsionen (MACINNES et al. 2008). 39 Literaturübersicht Als Erregerreservoir gelten chronisch infizierte Trägertiere (EWERS u. WIELER 2011, S. 226). Nach der Infektion besteht ein immunologischer Schutz in Bezug auf homologe A.pp. Serotypen, eine Reinfektion mit heterologen Serotypen ist jedoch möglich (CRUIJSEN et al. 1995). 40 Material und Methoden 3. Material und Methoden 3.1 Surfactantcharakterisierung beim Schwein 3.1.1 Infektionsversuche mit Scoring im Rahmen des FUGATO-RePoRI- Projektes 3.1.1.1 Versuchstiere Die stammten Tiere aus einem vorausgegangenen Projekt (Funktionelle GenomAnalyse im Tierischen Organismus (FUGATO) – Resistance to Porcine Respiratory Tract Infections (RePoRI). Das Projekt (FUGATO-RePoRI) wurde vom Bundesministerium für Bildung und Forschung (BMBF) gefördert (Förderkennzeichen: 0315129A-D).1) Wie beschrieben in REINER et al. (2014) wurden hierzu F2 Schweine (Kreuzungstiere der Linien Deutsche Landrasse x Hampshire) verwendet, die in der Klinik für kleine Klauentiere, der Tierärztlichen Hochschule Hannover, geboren und im Alter von vier Wochen abgesetzt worden sind. Die Tierversuchsgenehmigungsnummer lautete 33.9-42502-04-05/919. Die Haltung der Ferkel fand im Rahmen der gesetzlichen Vorschriften mit standardisierter Haltung statt. Alle Ferkel sind negativ auf A.pp. spezifische Antikörper (Apx IIA nach LEINER et al. 1999 und Apx IV A nach DREYFUS et al. 2004) gestestet worden. Zudem fand eine labordiagnostische Untersuchung auf Mycoplasma hyopneumoniae und PRRSV (HerdChek®, IDEXX laboratories, Wetbrook, Maine, USA) mittels Antikörper-ELISA und auf Influenza A Virus durch Hämagglutinationshemmungstest statt, wie beschrieben in REINER et al. (2014). 1) laut persönlicher Mitteilung von Frau Dr. Doris Höltig, 16.11.2013, Hannover 41 Material und Methoden 3.1.1.2 Aerosolinfektion Grundsätzlich kommt die Aerosolinfektion der natürlichen Infektion am nächsten und kann somit bevorzugt für Läuferschweine verwendet werden (HENNIG-PAUKA 2007). Die Ferkel wurden im Alter von sieben Wochen via Aerosolinfektion mit einem A.pp.-Stamm (Serotyp 7) infiziert (REINER et al. 2014). Die Aerosolinfektion erfolgte wie bei HÖLTIG et al. (2009) etabliert (REINER et al. 2014). 3.1.1.3 Klinische und pathomorphologische Erhebungen Für die Erhebung von statistisch-auswertbaren, quantitativen Daten war von HÖLTIG (2009) ein Scoring-System entwickelt worden, das eine objektive Bewertung der Erkrankungsschweregrade ermöglicht. Die Ergebnisse der klinischen, ultrasonographischen und röntgenologischen Scores waren hierbei untereinander als auch mit den Sektionsbefunden (Lung Lesion Score, LLS) positiv korreliert (p<0,0001) (HÖLTIG 2009). Daran knüpfen die folgenden Untersuchungen im vorangegangenen FUGATORePoRI- Projekt an. Vor der Infektion und sieben Tage nach der Infektion [p. Inf.] wurden alle Schweine klinisch untersucht, selbstverständlich gingen nur klinisch gesunde Tiere in den Versuch (REINER et al. 2014). Das in HÖLTIG (2009) beschriebene klinische, ultrasonographische und röntgenologische Scoring und Lung Lesion Scoring (LLS) kamen als Basis für die Untersuchungen in REINER et al. (2014) zum Einsatz. Der Erreger konnte kulturell reisoliert werden (REINER et al. 2014). Die sonographische Untersuchung lieferte v.a. in Betracht auf die Pleura und das oberflächliche Lungenparenchym gut auswertbare Ergebnisse (HÖLTIG 2009). Es kam ein 8 MHz Linearschallkopf (LOGIQ™ Book XP, Fa. GE Medical Systems, Chalfont St.Giles, Großbritannien) zum Einsatz, geschallt wurde bei lateraler Lagerung des Ferkels jeder Interkostalraum von dorsal nach ventral (HÖLTIG 2009). 42 Material und Methoden Die Arbeit von HÖLTIG (2009) etablierte die Untersuchungen wie folgt: bei der sonographischen Untersuchung wurden Parameter wie Kometenschweifartefakte, Konsolidierungen, Pleuraergüsse, ein echogenes Grundmuster, hyperechogene Bereiche, Abszesse/Nekrosen und die diffuse Unterbrechung des pleuralen Reflexbandes evaluiert. Es wurden Punkte für pathologische Veränderungen je nach Parameter von „0“ bis „8“ vergeben und aufaddiert. Hierbei wurde jeweils die rechte und linke Lunge in fünf Bereiche unterteilt. Die röntgenologische Untersuchung stellte auch die tieferen Lungenbereiche zufriedenstellend dar, so dass auch hier ein Scoring-System etabliert werden konnte. Als abweichende Parameter wurden diffuse Verschattungen, Bronchographie oder gut abgegrenzte, total verdichtete Bereiche definiert. Als physiologisch galt die Darstellung des Herz- und Zwerchfellschattens. Die Aufnahmen erfolgten in zwei Ebenen (latero-lateral und dorso-ventral; Convix Generator 360, Fa. Picker Int., München, Deutschland). Auch hierbei fand eine Unterteilung der jeweils rechten und linken Lunge in vier Bereiche statt. Mit steigenden Ausprägungsgrad der pathologischen Veränderungen wurden Punkte von „0“ bis „3“ vergeben, aufaddiert und der Score für den jeweiligen Untersuchungstag berechnet (HÖLTIG 2009). Bei den Auswertungen konnte somit umfassend ein Bild des Lungengesundheitszustandes gewonnen werden. Um diesen weiter zu quantifizieren wurden die drei „klinischen“ Scores (klinisch, sonographisch und röntgenologisch) in einem Respiratory Health Score (RHS) zusammengefasst (REINER et al. 2014), (RHS etabliert in HÖLTIG et al. (2009)). Dier RHS zeigte sowohl in der akuten als auch in der chronischen Krankheitsphase eine exzellente Korrelation zu den Sektionsbefunden (HÖLTIG 2009). HÖLTIG (2009) zeigte durch die Berechnungen des RHS ebenfalls, dass die Schwere des Krankheitsbildes und der Lungenveränderungen in der Lunge vor allem durch den Verlauf der akuten Krankheitsphase bestimmt werden. Bemerkenswert war also, dass Faktoren des unmittelbar wirkenden, angeborenen Immunsystems entscheidend für Krankheitsschweregrad und Krankheitsverlauf waren (HÖLTIG 2009). Des Weiteren konnte eine genetische Krankheitsresistenz in der genannten Arbeit 43 Material und Methoden (HÖLTIG (2009)) gezeigt werden: Schweine der Rasse Hampshire zeigten sich als nur gering unempfänglich für eine A.pp. Infektion, wobei Schweine der Rassen Deutsche Landrasse, Piétrain und Large White nahezu gleiche Empfänglichkeiten aufwiesen (HÖLTIG 2009). REINER et al. (2014) erörtert, dass im Rahmen der Sektionen am siebten Tag p. inf. für jedes Tier ein „Lung Lesion Score“ erhoben wurde. Anatomisch-pathologische Befunde wurden in einem Schema der porzinen Lunge vermerkt. Die einzelnen Lungenlappen wurden in Dreiecke unterteilt. Es konnte ein maximaler Lung Lesion Score von „35“ erreicht werden, also „5“ Punkte maximal für jeden Lappen (REINER et al. 2014; LLS zuerst beschrieben in HANNAN et al. 1982). Abb. 3.1.1: Versuchsdesign im Rahmen des FUGATO-REPORI-Projektes, teilweise bereits publiziert in REINER et al. (2014) 44 Material und Methoden 3.1.2 Bronchoalveoläre Lavage im Rahmen des FUGATO-RePoRIProjektes 3.1.2.1 Spülmethode Die Schweine wurden jeweils sieben Tage vor der Infektion und am Tag 7 nach der Infektion einer bronchoalveolären Lavage (BAL), durchgeführt von Fr. Dr. Doris Höltig, unterzogen.2) Die BAL diente der Gewinnung von „Lungenspülproben“. Unter Anästhesie (Ketamin (20 mg/kg KGW i.m; Ursotamin®, Fa. Serum-Werk-Bernburg AG, Deutschland) und Azaperon (2 mg/kg KGW; Stresnil®, Fa. Janssen-Cilag GmbH, Neuss, Deutschland)) wurde mithilfe eines flexiblen Bronchoskops der Bronchus trachealis mit insgesamt 100 ml einer 154 mmol Kochsalzlösung gespült (modifiziert nach HENNIG-PAUKA et al. 2007). Wie in KIPPER (1990) beschrieben, war das Ferkel in einer hängenden Matte fixiert und der Oberkiefer nach oben ausgebunden [s. Abb. 3.1.2.]. Mit einem Laryngoskop (Heine Optotechnik, Herrsching, Deutschland) wurde das Bronchoskop, geschützt im Maul durch einen zylindrischen Plastikmaulkeil mit zentraler Öffnung, in die Trachea vorgeschoben (KIPPER 1990). Das Bronchoskop wurde dabei in die sogenannte „wedge position“ gebracht, so dass das Lumen des Bronchus‘ abgedichtet war (GANTER 1996). Es wurde nacheinander 5x 20 ml Kochsalzlösung mit einer Einmalspritze in den Arbeitskanal des Bronchoskops eingegeben und mithilfe der Saugpumpe (Endo_aspirator, system endo-parts, Fa. Georg Pauldrach, Hannover, Deutschland) in eine Gaswaschflasche nach Drechsel (Fa. Gebrüder Rettberg GmbH, Göttingen, Deutschland) unter einem Absaugdruck von 0,2-0,5 bar wieder abgesaugt (HENNIGPAUKA et al. 2007). 2) Persönliche Mitteilung von Frau Dr. Doris Höltig, 16.11.2013, Hannover 45 Material und Methoden a.) Abb. 3.1.2: a.) b.) Beispielhaft Ferkel in Anästhesie mit ausgebundenem Kiefer während Laryngoskopie, wie beschrieben in KIPPER (1990) b.) Beispielhaft Bronchoskopie, wie beschrieben in KIPPER (1990) 3.1.2.2 Zytologische Untersuchung Vorab wurde im klinikeigenen Labor nach der Methode modifiziert nach GANTER (1996) (durchgeführt unter Anweisung von Prof. Dr. Martin Ganter von den Labormitarbeiterinnen der Tierärztlichen Hochschule Hannover, Klinik für kleine Klauentiere) das Gesamtvolumen der BALF im Messzylinder bestimmt. Ein Teil der BALF wurde für die zytologische Untersuchung verwendet. Die Gesamtzellzahl wurde mit der Neubauer-Zählkammer ermittelt. Zur prozentualen Bestimmung der Lymphozyten, neutrophilen Granulozyten und Makrophagen wurde die BALF bei 200 x g für 10 Minuten bei 4 °C zentrifugiert (modifiziert nach GANTER 1996). Der physiologischen Kochsalzlösung wurde so viel Sediment hinzugegeben bis eine geringe, optisch sichtbare Trübung entstand (SCHERF 2010). Dieser Ansatz wurde erneut zentrifugiert (200 x g, 10 Minuten, Multifuge® 4 KR Heraeus, Kendro® Laboratory Products GmbH, Langenselbold, Deutschland) (GANTER 1996). 46 Material und Methoden Mithilfe eines Zentrifugeneinsatzes wurden zwei Zytospots auf einem Objektträger erzeugt. Nach schneller Trocknung am Ventilator wurden die Objektträger nach Pappenheim gefärbt (GANTER 1996). Je 400 Zellen wurden bei tausendfacher Vergrößerung auf Integrität untersucht und differenziert (modifiziert nach GANTER 1996). 3.1.2.3 Surfactantgewinnung - und aufbereitung Der zellfreie Überstand der Lavageflüssigkeit wurde bei -80 °C in Kryoröhrchen eingelagert. Im Surfactantlabor der Medizinischen Hochschule Hannover (Klinik für Pädiatrische Pneumologie, Allergologie und Neonatologie) wurden, modifiziert nach MOTTAGHIAN (1999), die bei -80 °C gelagerten Proben zunächst im Kühlschrank bei 4 °C über Nacht aufgetaut und danach je 5-10 ml in Ultrazentrifugengefäße gegeben. Durch die Ultrazentrifugation (26.000 x g, 1 Stunde und 50 Minuten, 4 °C) erhielt man die Surfactantpellets, die in 100 µl 1,5 mmol/l Calciumchloridlösung (Calciumchlorid gelöst in 154 mmol/l NaCl-Lösung) (Calciumchlorid, fein gekörnt, rein, Fa. Merck KGaA, Darmstadt, Deutschland) resuspendiert wurden (modifiziert nach MOTTAGHIAN 1999). Um eine spätere, einheitliche Ermittlung der minimalen Oberflächenspannung zu gewährleisten, wurde der Phospholipidgehalt der Proben nach MOTTAGHIAN (1999) bestimmt: es wurde mit drei angesetzten Volumina gearbeitet: Phosphatstandard (50 µl; Kaliumdihydrogenphosphat zur Analyse, Fa. Merck KGaA, Darmstadt, Deutschland), Leerwert (nur Perchlorsäure und Wasserstoffperoxid) und Probe (5-10 µl vom resuspendierten Surfactantpellet). Alle drei Ansätze wurden mit 500 µl 70 %iger Perchlorsäure (Perchlorsäure, A.C.S. Reagenz, ca. 70 %ige Lösung in Wasser, Fa. Sigma-Aldrich® Laborchemikalien GmbH, Seelze, Deutschland) und 200 µl 30 %iger Wasserstoffperoxidlösung (Suprapur®, Hydrogenperoxide 30 %, Fa. Merck KGaA, Darmstadt, Deutschland) versetzt und bei 190 °C im Wärmeblock für 35 Minuten verascht. Nun wurde in alle drei Ansätze 4 ml Aqua bidestillata, 500 µl Ammoniummolybdat (Ammoniumheptamolybdat zur Analyse, Fa. Merck KGaA, Darmstadt, Deutschland; zur Bildung eines Phosphomolybdatkomplexes) und 200 µl 47 Material und Methoden 10 %ige Ascorbinsäure (L(+)- Ascorbinsäure, Fa. Merck KGaA, Darmstadt, Deutschland; zur Reduktion des Phosphomolybdatkomplexes) hinzupipettiert, gemischt (zur Entstehung einer Blaufärbung, deren Extinktion proportional zum Phosphatgehalt der Probe ist) und bei 95 °C für 10 Minuten im Thermoblock inkubiert. Im Anschluss wurden die Proben im Wasserbad abgekühlt und es erfolgte eine photometrische Bestimmung (Photometer Nanocolor 100 D, Fa. MachereyNagel GmbH und Co. KG, Düren, Deutschland) des Phospholipidgehaltes bei 800 nm gegen den Leerwert (MOTTAGHIAN 1999). Wichtig bei diesem Verfahren ist, dass sich bei der kolorimetrischen, quantitativen Messung nach Farbumschlag keine Veränderung der Extinktion mehr darstellte (OHLER 2010). Der Phospholipidgehalt der Proben wurde nach MOTTAGHIAN (1999) berechnet, indem die Extinktion der Proben mit der Extinktion des Phosphatstandards in Relation gesetzt wurde. Für die funktionelle Analyse des Surfactants sollte der Phospholipidgehalt einheitlich 3 mg/ml betragen. Um dies zu gewährleisten wurde eine zuvor berechnete Menge 1,5 mmol/l Calciumchloridlösung der Suspension hinzugefügt (MOTTAGHIAN 1999). Diese Arbeiten wurden von Frau Christa Acevedo (Mitarbeiterin im Surfactantlabor der Medizinischen Hochschule Hannover (Klinik für Pädiatrische Pneumologie, Allergologie und Neonatologie)) durchgeführt. 3.1.2.4 Für Aufbereitung der Lavageflüssigkeit für die Elektronenmikroskopie die elektronenmikroskopischen Untersuchungen wurden ebenfalls ultrazentrifugierte Proben benötigt, die im Anschluss wieder bei -80 °C tiefgefroren und zur weiteren Aufbereitung in das Institut für Funktionelle und Angewandte Anatomie der Medizinischen Hochschule Hannover gebracht wurden. Für die elektronenmikroskopische Untersuchung wurden die Proben aufgetaut und über Nacht in Fixierungslösung (1,5 % Glutaraldehyd (Glutardialdehyd solution 25 %, Fa. Merck KGaA, Darmstadt, Deutschland) und 1,5 % Paraformaldehyd (Emprove® exp. DAC Paraformaldehyde, Fa. Merck KGaA, Darmstadt, Deutschland) in 0,15 Μ HEPES (N-(2-Hydroxethyl)piperazine-N‘-2-ethane sulfonic acid, Fa. SERVA Electrophoresis GmbH, Heidelberg, Deutschland) Puffer (1:1)) immersionsfixiert 48 Material und Methoden (OCHS et al. 2006). Zwischen den einzelnen Schritten (auch im Folgenden) wurden die Pellets erneut zentrifugiert (10000 x g, 5 Minuten). Im nächsten Schritt wurden die Proben in 0,15 Μ HEPES Puffer (2 x 6 min) und 0,1 Μ Natrium-Cacodylat Puffer (Cacodylic acid Na-salt, Fa. SERVA Electrophoresis GmbH, Heidelberg, Deutschland) (4 x 6 min) gewaschen (modifiziert nach SCHMIEDL et al. 2004). Zur Postfixierung gab man die Proben in 1 % Osmiumtetroxid (Osminumtetroxide, WAK-Chemie Medical GmbH, Bad Homburg, Deutschland) und 0,2 Μ NatriumCacodylat Puffer (1:1) für zwei Stunden (OCHS et al. 2006). Danach wusch man die Pellets in 0,1 Μ Natrium-Cacodylat Puffer (4 x 5 min) und destilliertem Wasser (2 x 5 min) erneut (MÜHLFELD et al. 2013, S. 373-374). Die en bloc Kontrastierung wurde über Nacht mit einer Kontrastierungslösung bestehend aus gleichen Teilen Uranylacetat (Uranyl acetate – 2 H2O, Fa. SERVA Electrophoresis GmbH, Heidelberg, Deutschland) und destilliertem Wasser (halbgesättigt, ca. 4 %ig) bei einer Temperatur von 4 °C vollzogen, dieser Vorgang garantiert die Stabilisierung der gesättigten Phospholipide (wie beschrieben in SCHMIEDL et al. 2004). Am nächsten Tag wurden die Pellets erneut in destilliertem Wasser gewaschen (2 x 5 min) (modifiziert nach MÜHLFELD et al. 2013, S. 374). Für die Dehydratation kamen aufsteigende Acetonkonzentrationen je 70 %, 90 % und 100 % zum Einsatz, schließlich wurden die Pellets mithilfe von Epon (bestehend aus Dodecenyl succinic acid anhydride , Methyl nadic anhydride, 2, 4 ,6 - Tris (dimethylaminomethyl)phenol, Glycid ether 100, Fa. SERVA Electrophoresis GmbH, Heidelberg, Deutschland) und Aceton (Acetone, BAKER analyzed®, Fa. J.T. Baker, AvantorTM Performance Materials, Deventer, Niederlande) eingebettet (modifiziert nach OCHS et al. 2006). Dabei wählte man zunächst ein Gemisch von Epon und Aceton im Verhältnis 1:1 für eine Stunde, im Weiteren gab man auf die Proben frisches Epon über Nacht (modifiziert nach MÜHLFELD et al. 2013, 374). Abschließend wurden die Proben erneut mit frischem Epon begossen, umgebettet in Flachbettförmchen und für 24 Stunden bei 40 °C und anschließend 48 Stunden bei 60 °C im Wärmeschrank gelagert (modifiziert nach MÜHLFELD et al. 2013, 374). Der quaderförmige Harzblock trimmte man unter einer Lupenlampe mit einer Rasierklinge, so dass 49 Material und Methoden gerade eben das Präparat auf der Oberfläche sichtbar wurde (MEIER-STIEGEN 2004). Zunächst fertigte man Semidünnschnitte (Stärke 1 µm) an, die mit Toluidinblau (Certistain®, Toluidinblau O, Fa. Merck KGaA, Darmstadt, Deutschland) gefärbt wurden (modifiziert nach MEIER-STIEGEN 2004). Die anschließende lichtmikroskopische Begutachtung diente der Orientierung, ob sicher im Präparat angeschnitten worden war und gab einen ersten Überblick über die Strukturen (MEIER-STIEGEN 2004). Modifiziert nach SCHMIEDL et al. (2004) wurden im Weiteren ca. 60-70 nm dicke Schnitte mithilfe des Ultramikrotoms Leica EM UC7 (Fa. Leica Mikrosysteme GmbH, Wien, Österreich) durchgeführt. Pro Schnitttiefe fertigte man jeweils bis zu fünf Einzelschnitte, die unmittelbar hintereinander geschnitten worden waren, an. Zudem wurden Schnitte von drei Schnitttiefen, die jeweils einen Abstand von circa 70 nm hatten, angefertigt. Im letzten Schritt gab man die Ultradünnschnitte jeweils auf einen Single Slot Grid. Kontrastierung wurde mittels Uranylacetat für 15 Minuten und Bleicitrat (Blei II -nitrat, tri-Natriumcitrat-Dihydrat, Fa. Merck KGaA, Darmstadt, Deutschland) für 2 Minuten erreicht. Die Single Slot Grids bewahrte man in Gridboxen bei Raumtemperatur auf (modifiziert nach SCHMIEDL et al. 2004). Diese Arbeiten wurden von den technischen Mitarbeiterinnen der Medizinischen Hochschule Hannover, Institut für Funktionelle und Angewandte Anatomie, durchgeführt, dabei dienten die dortigen Laborprotokolle als Basis. 3.1.3 Elektronenmikroskopie 3.1.3.1 Fragestellung HSIA et al. (2010) erläutern, dass um bei der quantitativen Beurteilung von Lungenstrukturen objektive/ unvoreingenommene Daten (unbiased data) zu erhalten, jegliche Form von methodologischem Fehler ausgeschlossen werden muss. Eine effektive Variante um unbiased data zu erhalten, ist der studiendesign-basierte Zugang. Hierbei wird jeder Versuchsschritt (Aufbereitung, Sampling, Analyse) kritisch und wiederholend beurteilt, um somit objektiv-wissenschaftlich und nicht intuitiv zu 50 Material und Methoden arbeiten. Als Stereologie definiert man unter Verwendung mathematischer Formeln die Darstellung physikalischer Eigenschaften von irregulären 3D Strukturen. Dabei werden 2D Schnitte verwendet und physikalische oder optische, bildgebende Verfahren kommen zum Einsatz. Das konkrete Messen der Strukturen wird als Morphometrie bezeichnet (HSIA et al. 2010). Der intraalveoläre und intrazelluläre Surfactantpool kann durch die Kombination von Elektronenmikroskopie und Stereologie qualitativ und quantitativ umfassend analysiert werden (OCHS 2010). Struktursubtypen des intraalveolären Surfactants können stereologisch durch Punkt- oder Schnittpunktzählverfahren analysiert werden (OCHS et al. 1999). Zudem stellt sich dieses Verfahren als wertvolles Instrument dar, um pathologische Alterationen und Behandlungseffekte in experimentellen Studien zu erforschen (OCHS 2010). Das Prinzip des „uniform random sampling“ wird dadurch verwirklicht, dass jede (Ziel-) Struktur die Chance hat, gesampelt zu werden (HOWARD u. REED 2010, S. 3). Das sollte für jede Ebene des Sampling-Verfahrens gelten (HOWARD u. REED 2010, S. 5). Zusammenfassend soll durch die Elektronenmikroskopie mit anschließendem Punktzählverfahren die Verteilung von aktiven und inaktiven Surfactantsubtypen, also der morphologisch-funktionelle Status des Surfactants von gesunden und mit A.pp. infizierten Schweinen, charakterisiert werden (in Anlehnung an WEIBEL et al. 2007; OCHS et al. 1999). Nur auf elektronenmikroskopischer Ebene lässt sich die morphologische Komplexität des Surfactants erfassen (OCHS 2010). 3.1.3.2 Elektronenmikroskopische Auswertung Die elektronenmikroskopischen Auswertungen erfolgten als Blindstudie und im Sinne des „systematic random sampling“ nach HOWARD und REED (2010, S.19-29). Um das Sampling-Verfahren zu verbessern (die totale Variabilität sollte von der biologischen Variabilität und nicht von stereologischen Messungen bestimmt werden) (OCHS et al. 2006), wurden stets mehr als 200 Treffer pro Schnitt erfasst (modifiziert nach OCHS et al. 2006; HOWARD u. REED 2010, S. 7). 51 Material und Methoden Modifiziert nach SCHMIEDL et al. (2003) wurden die Ultradünnschnitte am Transmissionselektronenmikroskop (Morgagni 268, Fa. FEITM, Eindhoven, Niederlande) mithilfe der Software iTEM (Olympus SIS GmbH, Münster, Germany) durchgemustert und auszuwertende Testfelder mit der Digitalkamera (Veleta CCD, Fa. Olympus SIS GmbH, Münster, Germany, Auflösung: 2048 x 2048 pixel) dokumentiert. Das Transmissionselektronenmikroskop wurde dabei auf eine 18.000 fache Vergrößerung eingestellt. Die Zahl der Aufnahmen variierte zwischen 20-60 Aufnahmen pro Single Slot Grid je nach Größe des Schnittes, wobei 3-5 Grids pro Tier ausgewertet wurden (modifiziert nach SCHMIEDL et al. 2003). Der Abstand zwischen den Aufnahmen betrug 200 μm bzw. 150 μm für Abzisse und Ordinate je nach Größe des Schnittes im Grid. Orientiert wurde sich an der Mikroskop-eigenen, räumlichen Messung, so dass man sich in definierten Intervallen nach dem Prinzip des „systematic random sampling“ bewegte (FEHRENBACH u. OCHS 1998, S. 446). Diese Aufnahmen wurden im Anschluss mit der Onlinesoftware STEPanizer© stereology Tool Version1 [URL: http://www.stepanizer.com/] (in Anlehnung an TSCHANZ et al. 2011) ausgewertet [s. Abb. 3.1.3]. Hierfür wurde ein Protokoll ausgearbeitet [siehe Anhang 4]. Zunächst wurde mit einer modellbasierten Befundbeschreibung gearbeitet. Dabei wurde morphologisch zwischen lamellenkörperartigen-Vesikeln (lbl; kompaktes Zentrum, Lamellen nur peripher erkennbar) dicht oder locker gepackt, multilamellären Vesikeln (mlv) dicht oder locker gepackt, unilamellären Vesikeln (ulv), lamellären Vesikeln mit 2-3 Lamellen (lv 2-3), tubulärem Myelin (tm) und Zelldetritus (überwiegend ausgefallenes Protein oder lamelläre Membranen) unterschieden (modifiziert nach FEHRENBACH et al. 1998). 52 Material und Methoden Abb. 3.1.3: Punktzählverfahren im STEPanizer© stereology tool Die Abbildung zeigt das Layout des Zählfensters im STEPanizer©. Nach TSCHANZ et al. (2011) sind die relevanten Areale von dem Zählrahmen begrenzt. Alle Strukturen zwischen durchgezogener und gestrichelter Linie werden gezählt, falls sie durch den grünen Zählpunkt oder von der roten Linie getroffen werden. Strukturen, die auf der durchgezogenen Linie (verbotene Linie) liegen, werden nicht gezählt. Strukturen auf der gestrichelten Linie werden mitgezählt (TSCHANZ et al. 2011). 53 Material und Methoden 3.1.3.3 Stereologische Parameter wie Volumendichte, Oberflächendichte und das Volumen-/Oberflächenverhälnis‘ Zur Quantifizierung der verschiedenen Subtypen des intraalveolären Surfactants wurden folgende stereologische Parameter ermittelt: die Volumendichten und die Volumen-Oberflächen-Verhältnisse (modifiziert nach SCHMIEDL et al. 2004). Folgende Formeln fanden Verwendung: Vv Subtyp [%] Σ PSubtyp = x 100 % Σ Paller Surfactantsubtypen (Formel nach HOWARD u. REED 2010, S. 57; SCHMIEDL et al. 2003) Volumen-/Oberflächenverhältnis V/S-Ratio (ulv bzw. lbl) [µm] Σ P ulv bzw. lbl x Testlinienlänge [µm] /2 Σ=LSP ulv bzw. lbl x 2 = (Formel nach WEIBEL 1979) „Σ P bzw. LSP“ waren die Summe aller Punkte (P) bzw. Linienschnittpunkte (LSP), die über Punktzählverfahren im STEPanizer© ausgezählt werden konnten (in Anlehnung an TSCHANZ et al. 2011). Unter Surfactantsubtyp wurden ulv, lv 2-3, mlv dicht gepackt, mlv locker gepackt, lbl jeweils dicht oder locker gepackt und tm verstanden (modifiziert nach SCHMIEDL et al. 2003). Artefakte, schwarze Areale, Strukturen am Präparatende oder auf der durchgezogenen Linie wurden vom Referenzraum subtrahiert (modifiziert nach TSCHANZ et al. 2011). Die STEPanizer© Software berechnete selbständig die Testlinienlänge, wenn man vorher skaliert hatte. Die Skalierung erfolgte vor der eigentlichen Auszählung. Auf dem ersten Bild musste ein Messbalken sein und dessen Abmessung musste im STEPanizer in µm angegeben werden (TSCHANZ et al. 2011). 54 Material und Methoden Für die Bestimmung der Oberflächendichte wurden jeweils die Linienschnittpunkte mit ulv, repräsentativ für inaktive Surfactantsubtypen (SCHMIEDL et al. 2003), und lbl, repräsentativ für aktive Surfactantsubtypen (FEHRENBACH et al. 1998; GROSS u. NARINE 1989 a), ausgezählt (in Anlehnung an SCHMIEDL et al. 2004). Das Volumen-Oberflächenverhältnis gab demenstprechend Veränderungen der Größe des jeweiligen Subtyps an (SCHMIEDL et al. 2004). In Anlehnung an den in der Literatur beschriebene Surfactantmorphologie (GROSS u. NARINE 1989 a; GROSS u. NARINE 1989 b; SCHMIEDL et al. 2003 und 2004, FEHRENBACH et al. 1998) wurden vier Gruppen von Surfactantsubtypen gebildet: 1. ulv 2. mlv 3. lbl 4. tm. 55 Material und Methoden 3.1.4 Biophysikalische Untersuchung des Surfactants: Pulsating Bubble Surfactometrie GOERKE u. CLEMENTS (1986) erläutern, dass es prinzipiell an einer LuftFlüssigkeitsgrenze eine Oberflächenspannung gibt, da die Moleküle innerhalb der Flüssigkeitsoberfläche ein höheres energetisches Niveau als in der Hauptmasse haben. Das Schrumpfen der Oberfläche der Luft-Flüssigkeitsgrenze kommt dadurch zustande, dass die Moleküle von der Oberfläche in die Hauptmasse übergehen, wie beispielsweise bei Wassertropfen (sphärische Struktur mit einer verringerten Oberfläche und kleinstmöglicher Oberflächenenergie) (GOERKE u. CLEMENTS 1986). Um die Funktion des Surfactants evaluieren zu können, wurde die minimale Oberflächenspannung, in Anlehnung an ENHORNING (1977) und MOTTAGHIAN (1999), gemessen. Die Messungen wurden an der Klinik für pädiatrische Pneumologie, Allergologie und Neonatologie der Medizinischen Hochschule Hannover durch Frau Christa Acevedo durchgeführt. Dazu wurde ein Pulsating Bubble SurfactometerTM (PBS) (Fa. Electronetics Corporation, Amherst, New York, United States of America) verwendet [Abb. 3.1.4 und 3.1.5] (MOTTAGHIAN 1999). In die Messkammer, die durch ein umgebendes Wasserbad (entgastes Aqua bidestillata) auf 37 °C erwärmt wurde, wurden 38 µl des vorbereiteten Surfactants in ein Spezialröhrchen gegeben (modifiziert nach MOTTAGHIAN 1999). MOTTAGHIAN (1999) zufolge wurde durch eine mechanische Kolbenbewegung eine Blase geformt. Eine optische Kontrolle der Lage der Blase war erforderlich, da die Blase an der minimalen Begrenzung auf der optischen Skala liegen sollte [Abbildung 3.1.6]. Nach einer Adsorptionszeit von 10 Sekunden an der Luft-Flüssigkeitsgrenze pulsierte die Blase mit 20 Hysteresen pro Minute mit einer Zyklusdauer von je 3 Sekunden. Während des Vorgangs hatte die Blase einen minimalen Radius von 0,4 mm (= Exspiration) und einen maximalen Radius von 0,55 mm (= Inspiration). Diese zyklischen Variationen der Blasengröße wurden durch den im Gerät integrierten Pulsator sichergestellt. Die Ein- und Ausatmung wird durch den Wechsel zwischen 56 Material und Methoden dem minimalen und maximalen Radius simuliert. Der Indikator für die Surfactantadsorption bei Blasenexpansion ist hierbei die Oberflächenspannung bei maximalem Blasenradius. Die Adsorption bei Filmkompression wird durch die Oberflächenspannung bei minimalem Blasenradius dargestellt. Die Druckmessung über der Blase erfolgte durch einen Differenzdruckaufnehmer. Nachdem ein SteadyState erreicht ist, kann die Oberflächenspannung über das LaPlace’sche Gesetz berechnet werden (MOTTAGHIAN 1999). Dieses Gesetz setzt eine sphärische Oberfläche des Alveolus voraus, so dass gilt: ΔP= 2 x γ / R. Der Differenzdruck (ΔP) ist abhängig von der Oberflächenspannung des Alveolarfilms (γ) und dem Radius des Alveolus (R) (ENHORNING 2008). BERNHARD et al. (2001 b) erklären, dass beim Menschen und beim Schwein Hysteresekurven gemessen worden sind, bei denen sich eine minimale Oberflächenspannung von <5 mN/m nach 10 Zyklen eingestellt hat. Bei Enten und Hühnern stellten sich minimale Oberflächenspannungen von 20 mN/m selbst nach 100 Pulsationen ein (BERNHARD et al. 2001 b). MOTTAGHIAN (1999) erläutert, dass die computerbasierte Auswertung der Daten sich auf eine Programmversion von Frieling von Dettmar und Coldewey gründete, die 1990/1991 für das Fraunhofer Institut für Toxikologie und Aerosolforschung entwickelt worden war. Mithilfe des Programms konnte eine graphische Auswertung durchgeführt werden [s. Abb. 3.1.7]. Bei der dargestellten Hysteresekurve wurde auf der Abszisse die Oberfläche der Blase in mm² und auf der Ordinate die minimale Oberflächenspannung in mN/m angegeben. Auch die Funktion der Zeit in Sekunden gegen die Oberflächenspannung in mN/m wurde ausgewertet. Es konnte der Zeitpunkt der Erreichung des Steady-States abgelesen werden (Kurve verläuft dann nahezu parallel zur Zeitachse) (MOTTAGHIAN 1999). 57 Material und Methoden Abb. 3.1.4: PBS Abb. 3.1.5: PBS schematisch (ENHORNING 1977) ENHORNING (1977) erklärt dazu, dass durch die Kolbenbewegungen in der Messkammer eine Blase erzeugt wird. Der Durck in der Flüssigkeit, die die Blase umgibt, wird mit einem Differenzdruckaufnehmer gemessen. Dieser gibt den Druckgradienten auf der Blasenoberfläche an. Mithilfe des Druckgradienten und des Blasenradius‘ kann die Oberflächenspannung bestimmt werden (ENHORNING 1977). 58 Material und Methoden Abb. 3.1.6: Blick durch das Okular des Pulsating Bubble SurfactometersTM: Es erfolgte eine optische Kontrolle der Blase bezüglich ihrer Begrenzungen, die beiden inneren Eichmarken berühren die Blase tangential (MOTTAGHIAN 1999). Diese Abbildung wurde freundlicherweise von Frau Christa Acevedo zur Verfügung gestellt. 59 Material und Methoden Abb. 3.1.7: PBS Output eines Kontrollschweines: MOTTAGHIAN (1999) erörtert hierzu: Hysteresekurve: Es wurde die Fläche der Blase [mm2] gegen Oberflächenspannung [mN/m] aufgetragen. Das Programm ermittelt nach manueller Eingabe des Steady-States den Mittelwert, die Varianz und die Standardabweichung aller Zyklen nach Erreichen des Steady-States. Zudem wurde die Zeit [sec] gegen Oberflächenspannung [mN/m] aufgetragen Der SteadyState ist durch die nahezu horizontalen Linienverläufe der minimalen und maximalen Oberflächenspannungen zu erkennen, die sich auf bestimmte Werte eingependelt haben. Adsorptionsplot: Hierin wird die Abnahme der Oberflächenspannung nach zehn Sekunden angezeigt und erlaubt vorab eine grobe Aussage über die Funktionstüchtigkeit des Films (MOTTAGHIAN 1999). 60 Material und Methoden 3.2 Charakterisierung von immersionsfixiertem Lungenparenchym beim Schwein (Lungengesunde- und A.pp. infizierte Schweine) 3.2.1 Versuchstiere Für diese Studie wurden neun Ferkel der Deutschen Landrasse aus einer Versuchsreihe von BRAUER (2012) (Infizierte- und Kontrolltiere) und HENNIGPAUKA et al. (2012) (nur drei Kontrolltiere, infizierte Tiere vollständig) mit einem Einstallungsalter von 6,5 Wochen verwendet. Schweine der Deutschen Landrasse hatten sich als empfänglicher bezüglich der Infektion mit A.pp. erwiesen als andere Rassen (HÖLTIG 2009). HENNIG-PAUKA et al. (2012) erörtert, dass die Tiere unter standardisierten Bedingungen im Rahmen der gesetzlichen Vorschriften gehalten wurden. Die Tierversuchsgenehmigungsnummer lautete 33-42502-05/941. Die Schweine kamen aus einem Basiszuchtbetrieb, der durch routinemäßige Untersuchungen als frei von toxinbildenden Pasteurella-multocida-Stämmen, A.pp., dem Virus des Porzinen Reproduktiven und Respiratorischen Syndroms sowie Endo- und Ektoparasiten galt (HENNIG-PAUKA et al. 2012). 3.3.2 Aerosolinfektion im Rahmen der Infektionsstudien von BRAUER (2012) und HENNIG-PAUKA et al. (2012) Die Aerosolinfektion entsprach nahezu dem unter 3.1.2.1 beschriebenen Prozedere. Auf eine Gruppe von vier Schweinen kam 13 ml Kultursuspension (ca. 2x10 5 Koloniebildende Einheiten A.pp.) wurden innerhalb von zwei Minuten unter einem Druck von 2 bar vernebelt (BRAUER et al. 2012). 3.2.3 Klinische, computertomographische, hämatologische und pathomorphologische Erhebungen im Rahmen der Infektionsstudien von BRAUER (2012) und HENNIG-PAUKA et al. (2012) Die klinischen und pathomorphologischen Erhebungen erfolgten nahezu wie unter 3.1.1.3 beschrieben (vgl. BRAUER (2012)). 61 Material und Methoden Am Tag 21 wurden Bilder vom Thorax der Schweine mit dem Single-Slice-SpiralComputertomograph der dritten Generation (Philips Tomoscan M, Fa. Philips Medical Systems, Hamburg, Deutschland) unter Neuroleptanalgesie angefertigt, das Versuchsdesign und die Ergebnisse sind bei BRAUER (2012) beschrieben. In craniocaudaler Richtung wurden Transversalschnitte beginnend bei der Apertura thoracis bis zum Diaphragma aufgenommen. Mit Hilfe der Computersoftware e-Film (Fa. eFilm Medical Inc., Toronto, Ontario, Canada) wurde für die CT-Aufnahmen ein klassisches Lungenfenster von 1500 Houndsfield-Einheiten (HE) Weite und -600 HE Länge konstruiert (BRAUER et al. 2011 und 2012). Die Ferkel lebten bis zum Tag 21 p. inf., wurden dann euthanasiert und seziert wie in 3.1.1.3 beschrieben. Nach Berechnung des Lung Lesion Scores, wie beschrieben in BRAUER et al. (2012), wurde Lungenparenchym zum Erregernachweis auf A.pp. (kulturelle Untersuchung, PCR und biochemische Untersuchung) entnommen (BRAUER et al. 2012 und HENNIG-PAUKA et al. 2012). Modifiziert nach NERBAS (2008) wurde, um einen Status des roten und weißen Blutbildes zu erlangen, den Schweinen an Tag 0 und 21 aus der Vena cava cranialis bzw. Vena jugularis externa Blut (Monovette®, Fa. Sarstedt AG und Co., Nümbrecht, Deutschland) abgenommen. Ein „rotes Blutbild“ und die Gesamtzellzahl wurden mit dem Hämatologiegerät (celltac α Modell MEK-6450K, Fa. Nihon Kohden Corporation, Tokyo, Japan) ermittelt. Zur Differenzierung der Leukozyten und Formveränderungen der Erythrozyten wurden die Blutausstriche nach Pappenheim gefärbt (modifiziert nach NERBAS 2008). Eine BAL wurde am Tag 0 und 21 nach der Infektion durchgeführt und wurde, wie in 3.1.2. beschrieben, zytologisch untersucht. Die für die Lungenparenchymuntersuchungen ausgewählten Kontrolltiere wogen am Tag der Sektion im Median 17,6 kg und die ausgewählten infizierten Tiere 20,4 kg. Die hämatologischen und bronchoskopischen Daten wurden im Rahmen der Infektionsstudien von Carsten Brauer und Isabel Hennig-Pauka erhoben, aus denen auch folgende Veröffentlichungen resultierten: BRAUER (2012) und HENNIG-PAUKA et al. (2012). 62 Material und Methoden 3.2.4 Präparationstechnik Es wurde für die sich anschließenden histologischen Untersuchungen stets der rechte Lobus caudalis verwendet, es wurde ein Stück Lungenparenchym im Bereich des Bronchus lobaris‘ an der Abzweigungsstelle des Bronchus segmentalis‘ entnommen (BRAUER (2012) und gemäß in dieser Arbeit verwendetem Sektionsprotokoll). 3.2.5 Fixierung, Einbettung und Anfertigung von Gewebedünnschnitten Die mit Formol nach LILLIE (BÜCHL- ZIMMERMANN et al. 2010, S. 90) fixierten Lungenparenchymproben wurden zunächst, wie modifiziert beschrieben in HENNIGPAUKA et al. (2012), über eine aufsteigende Alkoholreihe entwässert und zweimal jeweils für eine Stunde in Xylol gegeben und für 12 Stunden in 60 °C heißes Paraffin (Paraplast Plus, Fa. Tyco Healthcare, Neustadt, Deutschland) verbracht. Nach Zugabe einer zweiten Portion frischem Paraffin wurden die Proben in Paraffin ausgegossen, welches bei Raumtemperatur aushärtete. Die Paraffinproben wurden mikrotomisch auf eine Stärke von 5 µm geschnitten und auf Objektträger aufgezogen. Nach der Trocknung im Brutschrank erfolgte die Entparaffinierung durch das Intermedium Xylol und über eine absteigende Alkoholreihe wurden die Proben in Aqua destillata überführt. Die Paraffinschnitte wurden Hämalaun-Eosin (HE) (Standardrezept, modifiziert nach RIEDELSHEIMER u. WELSCH 2010, S. 214) und nach Masson-Goldner (modifiziert nach RIEDELSHEIMER u. WELSCH 2010, S. 217) gefärbt. Diese Arbeiten wurden von Frau Gudrun Wirth, Anatomisches Institut der Tierärztlichen Hochschule Hannover, nach den dortigen Laborprotokollen durchgeführt. Das in diesem Kapitel beschriebene Prozedere fand modifiziert nach HENNIG-PAUKA et al. (2012) statt. Die Proben wurden im Rahmen der Infektionsstudien von Carsten Brauer und Isabel Hennig-Pauka aufgearbeitet, aus denen auch folgende Veröffentlichungen resultierten: BRAUER (2012) und HENNIGPAUKA et al. (2012). 63 Material und Methoden 3.2.6 Protokoll der lichtmikroskopischen Auswertung und die Berechnungen stereologischer Parameter Die mikroskopische Darstellung der immersionssfixierten Lungenparenchymschnitte erfolgte am Lichtmikroskop (Zeiss, Photomikroskop Axiophot, Fa. Carl Zeiss AG, Oberkochen, Deutschland) der Medizinischen Hochschule Hannover, Institut für Funktionelle und Angewandte Anatomie, es wurde mit 5 facher Objektivvergrößerung und 10 facher Okularvergrößerung gearbeitet und die Paraffinschnitte im Sinne des „systematic random sampling“ durchgemustert und fotographiert (Mikroskopische Farbkamera: Olympus XC50, Inventarnummer: 1001041990), wie beschrieben in FEHRENBACH u. OCHS (1998, S. 446). Mithilfe einer Computersoftware (Olympus cell^b Imaging Software for Life Science Microscopy, Fa. Olympus Europa SE und CO. KG, Hamburg, Deutschland) konnten die Aufnahmen entsprechend ihrer Vergrößerung skaliert werden. Das „systematic random sampling“-Verfahren beinhaltete ein mäanderförmiges Abfahren des Präparates in definierten Abständen (gemäß Linealraster auf Objekttisch) (FEHRENBACH u. OCHS 1998, S. 446). Somit konnten pro Lobus caudalis 25-40 Aufnahmen gemacht werden. Diese Aufnahmen wurden im Anschluss mit der Onlinesoftware STEPanizer© stereology Tool Version1 (TSCHANZ et al. 2011) ausgewertet. Hierzu wurde im Parameterfenster eine Monitorauflösung von 1280x1024, eine Auswahl von „Line pairs, Number of titles: 4, Sub Sampling: no, Line width: 2, T-Bar: 0, Show: alle ankreuzen“ gewählt. Modifiziert nach BEHRENS (2011) arbeitete man nach dem Prinzip des Punktzählverfahrens, wobei eine Unterscheidung zwischen Parenchym (untergliedert in Alveolarluftraum und Alveolarsepten) und Non-Parenchym (Bronchien und Gefäße) getroffen wurde. Zudem wurden die Linienschnittpunkte mit den Alveolarsepten ausgezählt. Die Auswertung erfolgte als Blindstudie (modifiziert nach BEHRENS 2011). Zur Quantifizierung von möglichen Veränderungen innerhalb des Lungenparenchyms wurden folgende Parameter modifiziert nach SCHMIEDL et al. (2007) bestimmt: 64 Material und Methoden die Volumendichte des Non-Parenchyms [%], die Volumendichte des Parenchyms [%], die Volumendichte des Alveolarluftraums [%], die Volumendichte der Alveolarsepten [%], die Oberflächendichte (Sv) der Alveolarsepten [1/µm], das Volumen-Oberflächenverhältnis (V/S) [µm] und die Volumendichte von pathologisch verändertem Gewebe [%]. Das Volumen-Oberflächenverhältnis der Alveolarsepten ist ein Maß für die Alveolarseptendicke (BEHRENS 2011). Die folgenden Formeln fanden dabei Verwendung modifiziert nach BEHRENS (2011): Vv Non-Parenchym [%] = Σ PNon-Parenchym x 100% (Σ PParenchym + Σ PNon-Parenchym + Σ Ppathologisch verändertes Gewebe) (Vorangegangene Formel modifiziert nach BEHRENS 2011) Vv Parenchym [%] = Σ PParenchym x 100% (Σ PParenchym + Σ PNon-Parenchym + Σ Ppathologisch verändertes Gewebe) (Vorangegangene Formel modifiziert nach BEHRENS 2011) Vv Alveolarluftraum [%] = Σ PAlveolarluftraum x 100% Σ PParenchym (Vorangegangene Formel nach BEHRENS 2011) Vv Alveolarsepten [%] = Σ PAlveolarsepten Σ PParenchym (Vorangegangene Formel nach BEHRENS 2011) 65 x 100% Material und Methoden Sv Alveolarsepten [1/µm] = Σ LSPSepten x 2 (Σ PParenchym) x Testlinienlängehalbe [µm] (Vorangegangene Formel nach WEIBEL 1979, S. 121) V/S Alveolarsepten [µm] = Vv Septen Sv Septen (Vorangegangene Formel nach BEHRENS 2011) Vv pvG [%] Σ Ppathologisch verändertes Gewebe = x 100% (Σ PParenchym + Σ PNon-Parenchym + Σ Ppathologisch verändertes Gewebe) (Vorangegangene Formel modifiziert nach BEHRENS 2011) 3.2.7 Auswertung der computertomographischen Transversalschnitte von Schweinelungen 3.2.7.1 Punktzählverfahren im STEPanizer Die computertomographischen Transversalschnitte der Schweinelungen wurden in der Studie von BRAUER et al. (2012) erhoben. Diese Aufnahmen (ca. 50-55 pro Tier) wurden in die Onlinesoftware STEPanizer© stereology Tool Version1, wie beschrieben in TSCHANZ et al. (2011), eingelesen. Die Feineinstellung der Software lautete wie folgt: line pairs, Nbr of tiles 196, no subsampling, line with 2, T – bar 0, wobei „frame“, „circle“ und „testsystem“ aktiviert waren und die Farben in ihrer Originaleinstellung beibehalten wurden. Als Resultat erhielt man 392 Testlinien mit je zwei Zählpunkten pro Aufnahme. In Anlehnung an OCHS (2006) kam wiederum das Punktzählverfahren zum Einsatz. Die Differenzierung der Strukturen beinhaltete eine Unterteilung in Lungenparenchym und non-Parenchym. Lungenparenchym war als makroskopisch unverändertes Gewebe definiert und als non-Parenchym stellten sich Strukturen des Bronchialsystems und große Gefäße dar. Testlinienpunkten auf grundsätzlich 66 Material und Methoden anderen Bereichen des Tierkörpers wurden nicht miteingebunden. Zusätzlich konnten pathologische Strukturen ausgezählt werden (in Anlehnung an OCHS 2006). Nach BRAUER et al. (2012) galten nur jene Strukturen als pathologisch, wenn man im CT-Bild innerhalb eines 1,2 cm2 großen, zirculären Bereich einen mittleren Wert für die Dichte von größer als -550 HU hatte. Diese wurde aufgrund der Absorptionsdichte der Pixel innerhalb der bestimmten Fläche berechnet. Diese Auswertung wurde vorab mit der Bildbefundungs- und Bildverarbeitungssoftware für die medizinische Diagnostik, e-Film, vorgenommen (BRAUER et al. 2012). 3.2.7.2 Berechnung des funktionellen Lungenparenchymvolumens der Schweinelungen nach dem Cavalieri Prinzip Die Berechnung des funktionellen Lungenparenchymvolumens der Schweinelungen erfolgte nach folgender Formel (modifiziert nach SCHNEIDER u. OCHS 2013, S. 270-271): Funktionelles Lungenparenchymvolumen [cm3] = Zählpunkte auf Lungenparenchym x t x a(p) Zählpunkte Lungenparenchym = in 3.2.7.1 via STEPanizer ermittelt t= Schichtdicke der CT-Bilder (0,7 cm) a(p) = Fläche pro Punkt (p) in cm2 (Formel modifiziert nach SCHNEIDER u. OCHS 2013, S. 270-271). 3.2.7.3 Funktionelles Volumen der Alveolarsepten Die Berechnung des funktionellen Volumens der Alveolarsepten der Schweinelungen erfolgte nach folgender Formel (modifiziert nach OCHS 2006; HSIA et al. 2010): 3 Funktionelles Volumen der Alveolarsepten [cm ] = Funktionelles Lungenparenchymvolumen x Volumendichte Parenchym x Volumendichte Alveolarsepten Zu 3.2.7.3: Die Volumendichte des Parenchyms wurde wie in 3.2.6. beschrieben ermittelt, allerdings mussten die stereologisch-ermittelten Dichten noch durch „100“ dividiert werden. 67 Material und Methoden 3.2.7.4 Die Funktionelle Oberfläche der Alveolarsepten Berechnung der funktionellen Oberfläche der Alveolarsepten der Schweinelungen erfolgte nach folgender Formel (modifiziert nach SCHNEIDER u. OCHS 2013, S. 282): Funktionelle Oberfläche der Alveolarsepten [cm2] = Funktionelles Lungenparenchymvolumen x Volumendichte Parenchym x Oberflächendichte Alveolarsepten Die Volumendichte des Parenchyms und die Oberflächendichte der Alveolarsepten wurden wie in 3.2.6 beschrieben ermittelt, allerdings mussten die stereologischermittelten Volumendichten noch durch „100“ dividiert werden. 3.2.7.5 Funktionelles Parenchymvolumen pathologisch veränderter Strukturen Die Berechnung des funktionellem Parenchymvolumens von pathologisch veränderten Strukturen der Schweinelungen erfolgte nach folgender Formel (modifiziert nach OCHS 2006; HSIA et al. 2010): 3 Funktionelles Parenchymvolumen von pathologisch veränderten Strukturen [cm ] = Funktionelles Lungenparenchymvolumen x Volumendichte pathologisch verändertes Gewebe Die Volumendichte des pathologisch-veränderten Gewebes wurde wie in 3.2.6 beschrieben ermittelt, allerdings mussten die stereologisch-ermittelten Dichten noch durch „100“ dividiert werden. 68 Material und Methoden 3.3 Charakterisierung von perfusionsfixierten Lungenparenchym beim Schwein 3.3.1 Versuchstiere Die drei untersuchten Ferkel wurden in der Klinik für kleine Klauentiere am 13.07.2012 geboren. Die Tiere waren gegen Mycoplasma hyopneumoniae (1 ml Impflösung/Tier i.m. laut Hersteller, J Stamm, Isolat B-3745, Ingelvac Mycoflex®, Fa. Boehringer Ingelheim Vetmedica GmbH, Ingelheim, Deutschland) und Porzines Circovirus Typ 2 (1 ml Impflösung/Tier i.m. laut Hersteller, ORF2 Protein, Ingelvac Circoflex®, Fa. Boehringer Ingelheim Vetmedica GmbH, Ingelheim, Deutschland) geimpft. Die Haltung der Ferkel fand im Rahmen der gesetzlichen Vorschriften der Tierschutzgesetzgebung statt (Gruppenhaltung, 8 m2/10 Tiere, Standarddiät) (HÖLTIG 2009). Da die Tiere im Rahmen des Versuchs getötet wurden, wurde dies in einer Tötungsanzeige (Tierkategorie: 112, Organentnahme am toten Tier zum Zwecke der Untersuchung isolierter Organe/Gewebe/Zellen) dem Nds. Landesamt für Verbraucherschutz und Lebensmittelsicherheit in Oldenburg angezeigt. Durch eine umfassende, klinische Untersuchung nach HÖLTIG (2009) wurden die Tiere als lungengesund beurteilt. Die Ferkel wogen im Median 14,3 kg. 3.3.2 Versuchsablauf 3) Die drei acht Wochen alten Ferkel (Rasse: Bundeshybridzuchtprogramm) wurden in Anästhesie (20 mg/kg KGW i.m Ketamin, Ursotamin®, Fa. Serum-Werk-Bernburg AG, Deutschland) und 2 mg/kg KGW i.m. Azaperon, Stresnil®, Fa. Janssen-Cilag GmbH, Neuss, Deutschland) versetzt (Anästhesie modifiziert nach HÖLTIG 2009). Über einen Ohrvenenkatheter wurde Natrium-Heparin (400 I.E./kg KGW; Heparin- 69 Material und Methoden Rotexmedica, Fa. Rotexmedica GmbH, Trittau, Deutschland) verabreicht, um eine Koagulation des Blutes in den Lungengefäßen zu verhindern. Im Anschluss daran wurden die Ferkel intubiert und eine Inhalationsanästhesie mit 3-5 Vol. % Isofluran (Isofluran CP®, Fa. cp-pharma Handelsgesellschaft mbH, Burgdorf, Deutschland) in Sauerstoff bzw. Luft, in Rückenlage durchgeführt. Durch den Ohrvenenkatheter wurde Pentobarbital (0,2 ml / kg KGW laut Hersteller; Euthadorm®, 400 mg / ml, Fa. cp-pharma Handelsgesellschaft mbH, Burgdorf, Deutschland) zur Euthanasie verabreicht. Über das Narkosegerät Dräger Cato edition (Fa. Dräger-Medical Deutschland GmbH, Lübeck, Deutschland) konnte weiterhin eine definierte, druckkontrollierte Beatmung stattfinden (Beatmungsdrücke: PINSP 20 hPa, PEEP 5 hPa). Das Isoflurangas wurde post mortem abgestellt, damit das Lungenparenchym geschont wurde. Am Ende der Inspiration wurde mit einer Arterienklemme der Tubus in der Trachea abgeklemmt, so dass bei der nachfolgenden Thoraxeröffnung ein Kollabieren der Lungen verhindert wurde und die Lunge im definierten Inspirationszustand (PINSP 20 hPa) verblieb. Zur Eröffnung des Brustkorbes wurden die Rippen mit einer oszillierenden Säge durchtrennt und somit die Brusthöhle mit Lungen und Trachea freigelegt. Mit Arterienklemmen wurden die Aorta und die Vena cava cranialis und caudalis abgeklemmt. Das Herz-Lungenpaket wurde entnommen und auf ein Tablett gelegt, hierbei war es von zentraler Bedeutung, die Lungen nicht zu verletzen (Abb. 3.3.1-3). Um die Lungen isoliert perfundieren zu können, wurde im Weiteren das Herz abpräpariert. Der Truncus pulmonalis wurde lang am Lungenpräparat belassen. Zudem verblieb das Dach des linken Atriums mit den Lungenvenen am Lungenpräparat. So wurde für die Fixierungslösung ein Abfluss über das linke Atrium geschaffen und die Lösung konnte in einem 10 l Eimer aufgefangen werden. Durch den Truncus pulmonalis Organtransplantationskanüle „XVIVO Lung Cannula Set AB, Göteborg Schweden), gekoppelt an wurde eine TM “ (Fa. XVIVO Perfusion entsprechendes Infusionsbesteck „Transplantationsset 4-fach ohne SG 0, DSO Modell Mitte DSO Mainz“ (Fa. Medos® Medizintechnik AG, Stolberg, Deutschland) in Richtung Lunge geschoben und am Truncus pulmonalis mithilfe eines Kabelbinders festgebunden. Somit wurde ein Arbeitskanal für die Fixierungslösung geschaffen. Dabei wurde der Truncus 70 Material und Methoden pulmonalis möglichst herznah abgesetzt. Die Lunge wurde zusätzlich mit 1 l Kochsalzlösung (Natriumchlorid-Lösung 0,9 % WDT, Fa. Wirtschaftsgenossenschaft deutscher Tierärzte eG, Garbsen, Deutschland) versetzt mit Natrium-Heparin (400 I.E./kg KGW; Heparin-Rotexmedica, Fa. Rotexmedica GmbH, Trittau, Deutschland) gespült. Die Fixantien (4 % Paraformaldehyd und 0,1 % Glutaraldehyd) wurden in einen Infusionsbeutel gegeben und dieser in ca. 30 cm Höhe aufgehangen. Hierdurch konnte die Lunge mit 2 l pro Tier kalter Perfusionslösung luftblasenfrei perfusionsfixiert werden. Die durch das linke Atrium abfließende Perfusionslösung wurde in einem 10 l Eimer aufgefangen, so dass man die perfusionsfixierte Lunge zusätzlich darin fixieren konnte. Es mussten auf die perfusionsfixierten Lungen zusätzlich Kissen (in Plastikfolie eingeschweißter handelsüblicher Aquarienkies, 43x21 cm) zur Beschwerung und dazwischen Gasetücher „Gazin®, 7,5x7,5 cm Mullkompressen“ (Lohmann und Rauscher International GmbH und Co KG, Rengsdorf, Deutschland) gelegt werden. Der gesamte Versuchsablauf wurde auf der Basis der persönlichen Mitteilung von Fr. Dr. Schnapper durchgeführt.3) 3) laut persönlicher Mitteilung von Fr. Dr. Anke Schnapper, Hannover am 17.10.2013, (Dabei diente als Grundlage SCHNAPPER et al. 2012) 71 Material und Methoden Abb. 3.3.1: Nahezu vollständig kollabierte Lunge ohne definierte Blähung Abb. 3.3.2: Überblähtes Lungenparenchym durch falsche Einstellung des Beatmungsdruckes (>40 mbar), beim späteren Sampling floss viel Flüssigkeit von der Schnittfläche ab 72 Material und Methoden Abb. 3.3.3: Entnommene Lungen mit definierter Blähung durch Klemmung der Trachea am Ende der Inspiration 73 Material und Methoden 3.3.3 Samplingverfahren der perfusionsfixierten Lungen 4) Um die Lunge mit möglichst wenigen Schneidkompressionsartefakten schneiden zu können, wurde die Lunge in einen Plexiglaskasten mit Agar versetzt. Dazu wurden 24 g Agar (Agar-Agar, Kobe I Artikel-Nummer 5210.1, Fa. CARL ROTH GMBH + CO. KG, Karlsruhe, Deutschland) benötigt, der mit 800 ml Aqua destillata aufgefüllt wurde. Das Gemisch wurde in der Mikrowelle bei 800 Watt 15 Minuten zum Kochen gebracht und anschließend im Kühlraum bei 6 °C auf ca. 45 °C abgekühlt. Der Plexiglaskasten wurde mit Frischhaltefolie ausgelegt und zusätzlich wurde auf die Unterseite eine Kunststoffplatte gelegt, um ein Stumpfwerden der Klinge zu verhindern. Der Boden der Plexiglasschale wurde mit Agar ausgegossen bis dieser gut bedeckt war. Jetzt wurde zentral die Lunge in den Kasten verbracht, mit dem restlichen Agar (40-45 °C) bis zur vollständigen Bedeckung begossen und auf ca. 35 °C abgekühlt. Im Folgenden konnte die in den Agar verbrachte Lunge aus dem Plexiglaskasten gelöst in die Schneidapperatur der Forschungswerkstatt der Medizinischen Hochschule Hannover (17,5x38,5 cm² Gesamtgröße) verbracht werden. Die Schneidapperatur besaß rechts und links an den langen Seiten Schlitze, durch die die Klinge (FEATHER®, FEATHER TRIMMING BLADE No. 260, Fa. pfm medical org, Köln, Deutschland) geführt werden konnte. Für diese Lungengröße (Gewicht der Tiere von 12 – 16 kg) wurden Schneidabstände von einem bis zwei Schlitzen (je nach Lungengröße) gewählt, welche einer Scheibendicke von ca. 0,55 cm - 1,25 cm (je nach Lungengröße) entsprachen. Von jeder geschnittenen Lungenscheibe mit Agarumhüllung wurden einheitlich entweder die abgewandte oder zugewandte Seite mit einem 25 cm Lineal als Maßstab fotographiert. Die Lungenschnitte mit Agarumhüllung standen nach Randomisierung entweder für die Elektronenmikroskopie (für nachfolgende Arbeiten) oder für lichtmikroskopische Auswertungen zur Verfügung. Auf die Lungenscheiben wurde eine Schablone mit kreisförmigen Aussparungen im selben Abstand (je nach Lungengröße: 2 cm oder 3 cm) aus einer Höhe von ca. 20 cm geworfen. In die kreisförmige Aussparung der Schablone wurde als Markierung eine Nadel gesteckt und ein Stück Lungenparenchym rechts oberhalb für die Elektronenmikroskopie und links unterhalb für die Lichtmikroskopie mit einem Skalpell herausgeschnitten.4) 74 Material und Methoden Die Probengewinnung erfolgte nach dem Prinzip der „systematic uniform Randomisierung“. Jede (Ziel-)Struktur der gesamten Lunge hat hierbei dieselbe Chance gesampelt zu werden (KNUDSEN et al. 2011). Die Probenblöcke wurden in die entsprechenden Fixantien überführt. Für die Einbettung der ca. 0,5 cm² großen Probenblöcke zur lichtmikroskopischen Untersuchung wurden die Proben in 0,1 % Glutaraldehyd und 4 % Paraformaldehyd verbracht. Die Proben wurden zur weiteren Aufbereitung auf 4 °C gekühlt. Das beschriebene Verfahren wurde laut persönlicher Mitteilung von Fr. Dr. Schnapper durchgeführt.4) 4) laut persönlicher Mitteilung von Fr. Dr. Anke Schnapper, Hannover am 17.10.2013 Das Verfahren ist in ähnlicher Weise auch bei KNUDSEN et al. (2011) beschrieben. Abb. 3.3.4: Schneidapperatur zum exakten Schneiden der Lungen (von der Forschungswerkstatt der Medizinischen Hochschule Hannover konstruiert) 75 Material und Methoden 3.3.4 Aufbereitung der Proben für die lichtmikroskopische Untersuchung Einbettung des Lungenparenchyms und Anfertigung der Gewebedünnschnitte Diese Arbeiten wurden von Frau Andrea Herden, Institut für Funktionelle und Angewandte Anatomie der Medizinischen Hochschule Hannover, durchgeführt. Des Prozedere entsprach weitgehend dem unter 3.2.5 beschriebenen. 3.3.5 Protokoll der lichtmikroskopischen Auswertung Verfahren wie in 3.2.6. 3.3.6 Berechnung der stereologischen Parameter Verfahren wie in 3.2.6. 3.4 Statistik 5) Zur statistischen Auswertung der Daten kam, wie häufig üblich, die Statistik-Software SAS® Version 9.1 2006 (Fa. SAS Institute Inc., Cary, NC, USA) zum Einsatz. 3.4.1 Statistische Auswertumg von vor und nach der Infektion erhobenen Daten Gemäß SACHS u. HEDDERICH (2009, 464-468) wurde zum Vergleich der Daten, die vor und nach der Infektion erhoben worden waren, der Vorzeichen Rang-Test von Wilcoxon (Wilcoxon matched pairs signed rank test) durchgeführt Es wurde untersucht, ob sich die Parameter (Vv und Sv der Surfactantsubtypen, V/S ratio von ulv und tm, minimale Oberflächenspannung, klinischer/ultrasonographischer und röntgenologischer Score, Respiratory Health Score, etc.) jeweils vor und nach der Infektion signifikant unterscheiden (SACHS u. HEDDERICH 2009, 464-468). 76 Material und Methoden Die Rangkorrelationskoeffizienten nach SPEARMAN wurden berechnet, um Zusammenhänge zwischen klinischen, funktionellen und stereologischen Parametern vor und nach der Infektion zu analysieren (KREIENBROCK u. SCHACH 2005, S. 8890). 3.4.2 Statistische Auswertung der Daten, die nach Immersions- oder Perfusionsfixierung lichtmikroskopisch erhoben wurden Laut SACHS u. HEDDERICH (2009, 451-458) wurde für den statistischen Vergleich der Daten, die nach „Immersionsfixierung“ und die nach „Perfusionsfixierung“ erhoben worden waren, der Wilcoxon Rangsummentest für zwei unabhängige Stichproben verwendet. Es wurden zwei unabhängige Zufallsstichproben von Messwerten verglichen (SACHS u. HEDDERICH 2009, 451-458). Die Rangkorrelationskoeffizienten nach SPEARMAN wurden berechnet, um Zusammenhänge zwischen klinischen und stereologischen Parametern bei der „Immersionsfixierung“ zu analysieren (KREIENBROCK u. SCHACH 2005, S. 88-90). 5) Ein besonderer Dank geht an dieser Stelle an Herrn Dr. Beyerbach, der bei der statistischen Auswertung der Daten geholfen hat. 77 Manuskript 4. Manuskript: Characterization of the inflammation-caused alterations of surfactant in pigs infected by Actinobacillus pleuropneumoniae Diana Busley1■ Email: [email protected] ■ Corresponding author Matthias Ochs2,3 Email: [email protected] Doris Hoeltig1 Email: [email protected] Martin Ganter1 Email: [email protected] Christa Acevedo4 Email: [email protected] Andreas Schmiedl2,3* Email: [email protected] Isabel Hennig-Pauka5* Email: [email protected] 1 Clinic of Swine and Small Ruminants, Forensic Medicine and Ambulatory Service, University of Veterinary Medicine Hannover, Bischofsholer Damm 15, 30173 Hannover, Germany 2 Institute of Functional and Applied Anatomy, Hannover Medical School, Carl-NeubergStr. 1, 30625 Hannover, Germany 78 Manuskript 3 Biomedical Research in Endstage und Obstructive Lung Disease Hannover (BREATH), Member of the German Center for Lung Research (DZL), Hannover, Germany 4 Department of Pediatric Pulmonology and Neonatology, Hannover Medical School, Carl- Neuberg-Str. 1, 30625 Hannover, Germany 5 Clinic for Swine, Department for Farm Animals and Veterinary Public Health, University of Veterinary Medicine, Vienna, Veterinärplatz 1, A-1210 Vienna, Austria * Equal contributors. Abstract Background Pathogen caused alterations are analyzed during experimental aerosolic infection using Actinobacillus pleuropneumoniae (A.pp.) as the challenge organism. In this study a functional and ultrastructural analysis of porcine surfactant was performed in five pigs seven days prior to and seven days after infection with A.pp. serotype 7. Surfactant was isolated from bronchoalveolar lavage fluid (BALF) and examined for its functional properties in a Pulsating Bubble SurfactometerTM. Surfactant subtypes were characterized using a transmission electron microscope (TEM) and quantified stereologically. Results TEM analysis of surfactant resulted in an unexpected distribution of the surfactant subtypes. Inactive forms, which are usually increased in other species during inflammation, were most abundant in pigs prior to infection. The active surfactant component had a tendency to lower volume densities and the inactive subtype to higher volume densities in infected pigs, although all pigs had severe inflammatory lung alterations. The minimal surfactant surface tension after infection was only slightly increased and did not show any tendencies or significances. Conclusions Summa summarum, infected swine exhibited a tendency to more active surfactant subtypes in the BALF (p=0.0625) than controls and may therefore adapted effectively to inflammatory lung disorders. This might be one possible explanation for the observation, that pigs do not show clinical signs during this stage of infection in spite of severe lung tissue alterations. 79 Manuskript Keywords Actinobacillus pleuropneumoniae, surfactant, brochoalveolar lavage fluid, stereology, minimal surface tension, clinical and lung lesion score Background Porcine respiratory disease The species swine shows several similarities to human anatomy and physiology (Swindle and Smith 2008), so that swine becomes more and more important as an animal model for studying human diseases (Swindle and Smith 2008, Hohlfeld et al. 1999 a, Trachsel et al. 2011, Rogers et al. 2008). Nevertheless, both species -swine and human- have its own functional anatomy (Schwegler 2002 a, König and Liebich 2012 a). For this reason pig disease models should be thoroughly characterized in order to define limitations regarding the comparability with humans. In contrast to the human lung (Schwegler 2002 b, p. 229), the porcine lung is subdivided into seven lung lobes, which are separated from each other by connective tissue (König and Liebich 2012 b, p. 382). For this reason naturally occurring pneumonia is often found in specific localizations in the lung next to nearly unaffected lung tissue (Reinhold 2002). Different substances in the porcine epithelial lining fluid have been described previously, as glycoproteins (Kahlisch et al. 2009), antimicrobial peptides (Hennig-Pauka et al. 2007 a) and acute phase proteins (Hiss et al. 2008). It was found, that swine are well equipped with naturally occurring antimicrobial substances, considered to be the first line of defense after microbial invasion (Hennig-Pauka et al. 2012). The so called porcine respiratory disease complex (PRDC) still cause high economic losses in modern pork production (White 2011). For this reason research in respiratory tract diseases in swine focuses on the development of new vaccine candidates and therapeutics as well as on virulence factors and strategies fighting the respective pathogens (modified according to Hennig-Pauka et al. 2012). 80 Manuskript The fact, that the species swine is an important model for human diseases (Swindle and Smith 2008, Rogers et al. 2008), demanded precise knowledge of the lung milieu in healthy and infected pigs. Knowledge about local inflammatory reactions and innate immune defense mechanisms in the porcine lung might be important for the future development of diagnostic tools as well as for preventive and therapeutic measures (Hennig-Pauka et al. 2012). In addition, this knowledge is indispensable for the assessment if results from swine can be transferred to human (Rogers et al. 2008). The characterization of porcine epithelial lining fluid and surfactant covering the airway surface is a basis for future, practice-oriented as well as basic research (modified according to Hennig-Pauka et al. 2012) The Gram-negative, non-motile und non-spore-forming bacterium Actinobacillus pleuropneumoniae (A.pp.) is not only a primary pathogen of the respiratory tract of swine (Ewers and Wieler 2011, p. 226, 229) causing high economic losses to the pig industry (Penrith and Henton 2004, p. 1661), but also an excellent challenge organism for experimental infection models to study pathogen caused alterations (Hennig-Pauka et al. 2012, Brauer et al. 2012, Höltig et al. 2009, Höltig et al. 2008). Up to date 15 serotypes have been described (Gottschalk 2012, p. 654). In general pigs become infected by aerosols or get direct contact, so that the tonsils are the first colonized tissue (MacInnes et al. 2008). Clinical signs of an acute infection are anorexia, fever, dyspnea, coughing and sometimes mouth breathing. In chronic cases either swine show coughing of varying intensity and intolerance of exercise or they are lacking any clinical signs (Gottschalk 2012, p. 659). Acute lung lesions are characterized by fibrinous to fibrinonecrotic bronchopneumonia. In chronic cases, pulmonary sequestra and reduced weight gain dominate (Penrith and Henton 2004, p. 1661). The advantage of experimental infection models using A.pp. as a challenge pathogen for studying pathogen caused alterations is the reliable reproducibility of this different stages of disease (Höltig et al. 2009). 81 Manuskript Especially subacute to chronic lung alterations were of high scientific interest, because chronic inflammatory can be studied in lung tissue in parallel to persistence mechanisms of pathogens (Baltes et al. 2003, Jacobsen et al. 2005). Pulmonary surfactant Pulmonary surfactant protects the air-liquid interface by surface tension reduction and stabilization of the alveolus during the respiratory cycle (Clements 1997, Enhorning 2001). To study the physical properties of pulmonary surfactant a pulsating bubble surfactometer has been developed which simulates the spherical structure of an alveolus (Enhorning 2008). Alterations of the surfactant surface tension for example caused by extravasating plasma proteins could be measured properly (Enhorning 2008). Surfactant contains approximately 90% lipids, mainly phospholipids, and 10% proteins (Cockshutt and Possmayer 1992, p. 340) ((including surfactant specific so called surfactant proteins (SP) (Cockshutt and Possmayer 1992, p.342)). While the hydrophilic SP-A and SP-D participate in immunoregulating processes (Van Iwaarden et al. 1990; Van Iwaarden et al. 1991; Van Iwaarden 1992; Van Iwaarden et al. 1992 a; Van Iwaarden et al. 1992 b) and belong to the innate immune system (Wright 2004), the hydrophobic SP-B and SP-C are mainly responsible for the biophysical stability of the surfactant layer (Cockshutt and Possmayer 1992, p. 343344). Alveolar epithelial type II cells (AEII) produce, store and secret surfactant by exocytosis (Mühlfeld and Ochs 2010, p. 4). Lamellar bodies (LB), the storage organelles, are secreted by exocytosis, freshly secreted LB occur in the alveolar hypophase as densely packed lamellar body- like forms (lbl) (Ochs 2010). These forms are converted into the lattice like structure defined as tubular myelin (tm), when SP-A is attached to their outer lamellae (Voorhout et al. 1991). Tm is suggested to be the direct precursor of the tension reducing surface layer (Hawgood and Poulain 2001; Ochs 2010). Unilamellar versicles (ulv) as spent (Gross and Narine 1989) and inactive (Ochs et al. 2006) surfactant subtypes are generated from the surfactant layer for reuptake by AEII or macrophages (Veldhuizen and Possmayer 2004, p. 359). 82 Manuskript Intraalveolar surfactant subtype morphology reflects different stages of surfactant metabolism (Mühlfeld and Ochs 2010, p. 4). Intraalveolar surfactant includes small aggregates (SA) containing ulv (Mühlfeld and Ochs 2010, p. 4).) and the large aggregates (LA) containing predominantly lbl and tm (Schmiedl et al. 2003). All surfactant subtypes inclusively multilamellar vesicles (mlv) are also found in the alveolar space of perfusion fixed lungs (Fehrenbach et al. 1998; Ochs et al. 1999, Schmiedl et al. 2003). The SA/LA ratio, obtained from centrifugation, is used for the assessment of surfactant samples collected by BAL from patients (Hohlfeld et al. 1999 b). Bacterial colonization of the lung parenchyma causes a massive inflammation characterized by an infiltration of neutrophils and macrophages, platelet activation, vascular thrombosis, hemorrhage, edema and fibrinous exsudation (Marsteller and Fenwick 1999). The impact of antigen-induced inflammation on the surfactant system reveals in a surfactant dysfunction (Jarjour and Enhorning 1999). The aim of this study was to define surfactant alterations in infected pigs with airway inflammation. We hypothesized that in infected pig lung tissue inflammation causes functional and morphological surfactant alterations comparable to those observed in previous studies. These previous studies, in which inflammation was discussed, show a decrease of biophysical properties (Van Schaik et al. 1997, Hohlfeld et al. 1998, Wright et al. 2001, Meyer and Zimmerman 2002, Hite et al. 2005, Schmiedl et al. 2003) as well as increased protein concentration (Wright et al. 2001, Van Schaik et al. 1997) and inactive surfactant subtypes (Hohlfeld et al. 1998, Hite et al. 2005, Schmiedl et al. 2003). In this study functional as well as morphological surfactant parameters, as volume density and the volume to surface ratio, were quantified in healthy and infected pigs (according to Schmiedl et al. 2003 and 2004). Highlighting differences between swine and human in these parameters might contribute to basic knowledge for future research in swine as a model for human disease (according to Swindle and Smith 2008, Rogers et al. 2008) and for potential intervention strategies. 83 Manuskript Methods Housing, infection and examination of pigs The five pigs examinated during this study were part of an experiment which describes functional genes in pigs infected by A.pp. (Höltig et al. 2013; Reiner et al. 2014; FUGATO-RePoRI-Project). The project was funded by the Federal Ministry of Education and Research, Germany under contract No. 0315129A-D.1) Caring of piglets was performed according to the regulations of the European Convention concerning the protection of Vertebrate animals under standardized containment level 2 conditions (approval number: 33.9-42502-04-05/919) (Reiner et al. 2014). Pigs of both sexes were seven weeks old (Reiner et al. 2014) and tested negative for A. pp. using an Apx-IIA and an ApxIVA ELISA, for Mycoplasma hyopneumoniae and Porcine Reproductive and Respiratory Syndrome Virus (PRRSV) by antibody ELISA (HerdChek, IDEXX Laboratories, Westbrook, Maine, USA), and for Porcine Influenza A Virus by hemagglutination inhibition test using porcine H1N1, H1N2 and H3N2 strains (Höltig et al. 2009; Reiner et al. 2014). In the infection trial of Reiner et al. (2014) pigs were infected after an acclimatization period with A. pp. serotype 7 strain AP 76 aerosol as previously described Höltig et al. (2009). In the infection trial of Reiner et al. (2014) clinical health status of pigs was assessed prior to infection to day 7 after infection. The clinical score was assessed as previously described in Höltig et al. (2009). Bronchoscopy, bronchoalveolar lavage (according to Hennig-Pauka et al. 2007 b), ultrasonographic and radiographic examinations (according to Höltig et al. 2009) were carried out under anaesthesia with 20 mg/kg body weight (bw) ketamine i.m. (Ursotamin®, Serum-Werk-BernburgAG, Bernburg, Germany) and 2 mg/kg bw i.m. azaperone (Stresnil®, Janssen-Cilag GmbH, Baar, Switzerland)1). 1) Dr. Doris Höltig, personal communication, November 11, 2013, Hannover 84 Manuskript A 8 MHz linear scanner (LOGIQ™ Book XP, GE Medical Systems, Chalfont St. Giles, Great Britain) was used for ultrasonography of the lungs in lateral recumbency. Intercostal spaces were scanned from dorsal to ventral on both thorax sides (Höltig et al. 2009; Reiner et al. 2014). Radiography of the thorax was performed in two views (latero-lateral and dorsoventral; Convix Generator 360, Picker Int., Munich, Germany, 400 mAs, 110 kV, 1000 ms) (Höltig et al. 2009; Reiner et al. 2014). All pigs were necropsied on day 7 after experimental infection and lungs were removed from the thorax. Postmortal scoring for lung lesions have been described previously (Reiner et al. 2014; Hannan et al. 1982). Briefly, pathomorphological findings were recorded in a schematic map of the porcine lung, where different lobes were divided into triangles. A maximal lung lesion score of 35 with a maximal score of 5 for each each lobe was possible (Reiner et al. 2014; Hannan et al. 1982). Bacteriological examinations followed to ensure a persistent infection with A.pp (Reiner et al. 2014). The clinical, ultrasonographic and radiographic scores prior to infection and at day 7 after infection were divided by their maximal reachable scores, added and divided by three. This percentage value was the Respiratory Health Score used for the quantification of disease susceptibility in living pigs. Scoring has been described in detail previously (Höltig et al. 2009; Reiner et al. 2014). 85 Manuskript Bronchoalveolar lavage According to Hennig-Pauka et al. (2007 b), Bronchoalveolar lavage was performed seven days prior to infection and on day 7 after infection under deep anesthesia. A flexible bronchoscope tip was positioned into the bronchus trachealis. Throughout the working channel 100 ml of 154 mmol sodium chloride was instilled into the bronchus. Approximately 83 ml in controls and 84 ml in infected pigs (median) bronchoalveolar lavage fluid (BALF) was recovered using a vaccum pump, procedure as previously described in Hennig-Pauka et al. (2007 b). Total cell counts were determined in native, undiluted BALF in a Neubauer-counting chamber (modified according to Ganter and Hensel 1997). Afterwards modified according to Ganter and Hensel (1997), BALF was centrifuged (10 minutes, 200xg, 4 °C) and BALF sediment was used for cytological examination. Cytospots were prepared for differential cell determination in BALF by centrifugation of small amounts of resuspended BALF sediments in a cytocentrifuge (Multifuge® 4 KR Heraeus, Kendro® Laboratory Products GmbH, Langenselbold, Germany) with 200xg for 10 minutes. Cells were stained with a May-Grünwald-Giemsa staining solution and 400 cells were differentiated at 1000x magnification, procedure modified according to Ganter and Hensel (1997). The cell-free supernatant of BALF was stored at -80 °C for the examination of surfactant, later an ultracentrifugation (1 hour und 50 minutes, 60000xg, 4 °C) for the preparation of surfactant pellets followed, modified according to Bernhard et al. (2000). For biophysical examination the surfactant pellets were resuspended in saline 154 mmol/l to which 1.5 mmol/L calcium chloride were given to guarantee standardized phospholipid concentrations, surfactant pellets were stored at -80 °C until the biophysical measurements succeeded (Bernhard et al. 2000). Fixation and tissue processing For electron microscopy fixation solution was added overnight, consisting of 1.5 % glutaraldehyde (Glutardialdehyd solution 25 %, Fa. Merck KGaA, Darmstadt, Germany) and 1.5 % paraformaldehyde (Emprove® exp. DAC Paraformaldehyde, Fa. 86 Manuskript Merck KGaA, Darmstadt, Germany) in 0.15 M HEPES buffer (N-(2- Hydroxethyl)piperazine-N‘-2-ethane sulfonic acid, Fa. SERVA Electrophoresis GmbH, Heidelberg, Germany) (Ochs et al. 2006). During procedures pellets were centrifuged (10000 x g for five minutes) again (also during following steps). Subsequently, pellets were washed two times for 6 minutes with 0.15 M HEPES buffer and four times for 6 minutes with 0.1 M sodium-cacodylate buffer (Cacodylic acid Na-salt, Fa. SERVA Electrophoresis GmbH, Heidelberg, Germany)(modified according to Schmiedl et al. (2004)). For postfixation the samples were placed in 1 % osmium tetroxide (Osminumtetroxide, WAK-Chemie Medical GmbH, Bad Homburg, Germany) in 0.2 M sodium-cacodylate buffer for 2 hours (Ochs et al. 2006). Thereafter, pellets were washed four times for five minutes in 0.1 M sodiumcacodylate buffer and with distilled water for two times for five minutes (Mühlfeld et al. 2013, p. 373-374). Stabilization of phospholipids and contrasting were performed with a half-saturated aqueous uranyl acetate staining solution, containing equal parts of uranyl acetate (Uranyl acetate – 2 H2O, Fa. SERVA Electrophoresis GmbH, Heidelberg, Deutschland) and distilled water at 4 °C overnight (Schmiedl et al. 2004). Subsequently, on the next day pellets were rinsed in distilled water two times for five minutes (modified according to Mühlfeld et al. 2013, p. 374). For dehydration, pellets were rinsed in ascending concentrations of 70 %, 90 % and 100 % acetone and, finally, pellets were immersed in epon (Dodecenyl succinic acid anhydride, Methyl nadic anhydride, 2, 4 ,6 - Tris (dimethylaminomethyl)phenol, Glycid ether 100, Fa. SERVA Electrophoresis GmbH, Heidelberg, Germany) (modified according to Ochs et al. 2006) and acetone in a proportion of 1:1 for 1 hour (modified according to Mühlfeld et al. 2013, p. 374). Samples were left in fresh epon overnight, then samples were immersed in epon again, put into moulds and left at 40 °C for 24 hours and at 60 °C for 48 hours in a heating cabinet (modified according to Mühlfeld et al. 2013, p. 374). Ultrathin sections (Leica EM UC7, Leica Mikrosysteme GmbH, Vienna, Austria) of 60-70 µm thickness were stained with uranyl acetate for 15 minutes and lead citrate (lead II -nitrate, trisodium citrate dihydrate, Fa. Merck KGaA, 87 Manuskript Gemany, trisodium citrate dihydrate) for two minutes, ultrathin sections were stored at room temperature in grid boxes (modified according to Schmiedl et al. 2004). Transmission electron microscopy Quantitative measurements were carried out on ultrathin sections of each pellet, sections were examined in a transmission electron microscope (TEM) (Morgagni 268, FEITM, Eindhoven, Netherlands) equipped with a camera (Veleta CCD, Olympus SIS, Münster, Germany) connected to a computer (software: iTEM (Olympus SIS GmbH, Münster, Germany) (Schmiedl et al. 2003). Between 20 and 60 micrographs per section were examined. Three to five sections in three different depths of cut per pig were used (modified according to Schmiedl et al. 2003). The distance between two micrographs (magnification: 18.000x) was 150-200 µm of the abscissa and 150-200 µm of the ordinate. Abscissa and ordinate were part of a measurement framework of the TEM, the analysis was in accordance with the principle of systematic uniform random sampling and blind study (Fehrenbach and Ochs 1998). More than 200 counts per section were examined to ensure that the total variability depended on the biological variability between individuals and not on the stereological measurements (Howard and Reed 2010, p. 7). Stereology To characterize the ultrastructure of surfactant subtypes quantitatively a stereological approach was chosen (Hsia et al. 2010). Stereology creates statistically valid data in accordance with “good laboratory practice” (Knudsen and Ochs 2011). Different surfactant subtypes were stereologically analysed by point or line intersection counting (Schmiedl et al. 2003). This is a precise instrument to define pathological surfactant alterations and to study treatment effects (Ochs 2010). The volume density and volume to surface ratio of the different surfactant subtypes were performed using the online software (according to Schmiedl et al. 2004) STEPanizer© stereology Tool Version 1 [URL: http://www.stepanizer.com/]. 88 Manuskript Recording of the counts was performed by the keypad, each key was associated with one stereological parameter (Tschanz et al. 2011). The following subtypeas were characterized: tubular myelin (tm) and lamellar body-like forms (lbl) corresponding to active forms of surfactant, unilamellar vesicles (ulv) corresponding to inactive forms (Schmiedl et al. 2003) and structures largely corresponding to multilamellar vesicles (mlv) (Schmiedl et al. 2003). According to Schmiedl et al. (2003) and Howard and Reed (2010, p. 57), the volume density (VV) [%] was calculated by dividing the counted points hitting one of the subtypes by the counted points hitting all subtypes (mlv, ulv, lbl and tm). The resulting fraction was given as percent by multiplying with 100 (Schmiedl et al. 2003; Howard and Reed 2010, p. 57): Vvsubtype [%] = P subtype x 100 P (ulv + mlv + lbl + tm) (Schmiedl et al. 2003 Howard and Reed 2010, p. 57) The volume to surface ratio was determined using the following formula (Weibel 1979): V/S-ratiosubtype [µm] = sum of all subtype counting hits x (test line segment length / 2) sum of all line intersections with subtype x 2 (Weibel 1979) Pulsating bubble surfactometry To characterize the function of surfactant the minimal surface tension was determined using a Pulsating Bubble SurfactometerTM (PBS; Electronetics, Amherst, NY) as described by Enhorning (1977). Briefly, a volume of 38 µl surfactant suspension was placed in the sample chamber of the PBS at 37 ºC (modified according to Bernhard et al. 2000). Movement of pistons inside the sample chamber 89 Manuskript resulted in a bubble within the surfactant suspension, the correct position and integrity of the bubble was controlled by eye during the experiment (Enhorning 1977). According to Bernhard et al. (2000), surfactant was allowed to adsorb to the air-liquid interface for 10 seconds. Thereafter, the bubble was pulsated with 20 oscillations per minute. During these cycles the bubble had a minimal radius of 0.4 mm and a maximal radius of 0.55 mm. Pressure changes during pulsation were measured by a pressure transducer. Procedures were performed according to Bernhard et al. (2000). After reaching the steady state, surface tension was assessed by the law of La Place (ΔP= 2γ/R, ΔP = difference of pressure, which is dependent on the surface tension of the fluid covering the alveolar surface (γ) and the radius of the alveolus (R)) (Enhorning 2008). Statistical analysis Data were analysed using the statistical software SAS ® (SAS Institute Inc., Cary, NC, USA). Significant differences between paired samples prior to and after infection were calculated using the Wilcoxon Signed-Rank test (according to Sachs and Hedderich 2009). The Spearman’s rank correlation coefficients were calculated to determine correlations between the clinical, functional and stereological parameters prior to and after infection (according to Kreienbrock and Schach 2005). 90 Manuskript Results Clinical and laboratory diagnostic findings The clinical respiratory health scores combine the clinical parameters and were calculated according to Hoeltig and coworkers (2009) (Reiner et al. 2014). In euthanized pigs lung lesions were quantified according to Reiner et al. (2014). Data used for the definition of the lung health status are shown in table 1. In this study cell counts in bronchoalveolar lavage fluid were implemented in the evaluation. All pigs were severely ill during the first days after infection. A clinical improvement took place mostly from day three on after infection without any treatment, so that no obvious clinical signs could be recorded any more at day 7 after infection.2) Nevertheless, all subscores as clinical, ultrosonographic and radiographic scores as well as the overall Respiratory Health Score were statistically noticeable increased at this point of time (table 1).2) Total BALF leucocytes as well as differential inflammatory cell counts (lymphocytes, neutrophils and macrophages) were not significantly increased (table 1).2) Morphology of surfactant subtypes (Fig. 2) Different stereological parameters of surfactant morphology were quantified in healthy and infected pigs, as volume density of various manifestations of surfactant and the respective volume to surface ratios. The impact of infection onto changes in the surfactant system was analyzed after infection. Changes comparable to human surfactant were assumed. Surfactant of healthy pigs prior to infection showed a tendency to more inactive surfactant components than after infection (table 1). 2) Dr. Doris Höltig, personal communication, November 11, 2013, Hannover Data were assessed in course of FUGATO-RePoRI 91 Manuskript The Vvtm was statistically noticeable increased after infection (p=0.0625). The Vvlbl showed no noticeable changes prior to or after infection and the volume to surface ratio of lbl was nearly comparable. The Vvmlv did not significantly reveal in differences. Therefore, the relation of ulv to tm and lbl (corresponding to the relation of SA/LA) showed no statistical differences between healthy pigs and A.pp. infected pigs. LLS showed a significant negative correlation with the Vvlbl prior to infection (p=0.0374). The data also demonstrate a significant positive correlation between the Vvulv and the clinical score, radiographic score and RHS after infection (p=0.0374); (clinical and lung lesion scoring published in Reiner et al. 2014). Average minimal surface tension There was a statistically noticeable increase in the mean minimal surface tension after infection, although the median (4.2 mN/m) of infected pigs was not as high as expected deduced from experiences in human medicine and other species. The range of measured minimal surface tension is shown in table 1. The data demonstrate significant positive correlation between macrophages in BALF and the minimal surface tension on day 0 (r=1, p<.0001). 92 Manuskript Discussion Selected five pigs were part of an infection trial (FUGATO-RePoRI-Project). This project, inter alia, included various examination methods as a sophisticated clinical examination, radiographic and ultrasonographic scoring (according to Reiner et al. 2014). Obviously pigs were in the stage of recovery after acute infection, when consolidation of lung tissue alterations took place.3) It is known from clinical infection, that several environmental factors are decisive for the outcome of disease, e.g. stress, crowding and cold stress (Gottschalk 2012, p. 658). All these factors can be excluded in this study, where pigs were kept in a comfortable and calm environment (Reiner et al. 2014). The procedure of bronchoalveolar lavage causes by itself an influx of neutrophils inside the airways, so that subsequent examinations should not be in at least four days intervals (according to Ganter and Hensel 1997). The decision for this point of time for sampling was, that piglet’s condition was adequate to survive the procedure of anaesthesia and bronchoalveolar lavage. 3) In addition, the question should be addressed, if the extent of pathomorphological, consolidated lung alterations is correlated to changes in the surfactant system. Neutrophils, considered to be a sensitive marker for an affection of the respiratory tract (Ganter and Hensel 1997) were not significantly increased in the selected pigs. However, in the BALF harvested from infected lungs the percentage of neutrophils had a tendency to higher values. Furthermore, the percentage of macrophages, which normally appear in higher number in healthy pigs (Ganter and Hensel 1997), had lower values. 3) Dr. Doris Höltig, personal communication, November 11, 2013, Hannover, 93 Manuskript The aerosol infection model was chosen to simulate the natural route of infection with a first contact of the pathogen to the mucosal surfaces of the upper respiratory tract (according to MacInnes et al. 2008). This route of infection was found to be appropriate to achieve an acute/chronic stage of disease without high lethality (according to Höltig et al. 2009), although pigs had suffered from acute respiratory symptoms during the prior acute stage of disease.4) Experimental intratracheal infection usually resulted in severe, mostly fatal disease models (Hennig-Pauka et al 2008). Bronchoalveolar lavage was performed seven days prior to infection and on day 7 after infection. In this stage of infection acute disease passes into the subacute stage of infection (Baumgärtner and Schmidt 2011, p. 185), when most of the pigs do not show clinical symptoms any longer, but have severe pathomorphological lung alterations (table 1).4) A. pp. is able to persist in encapsulated necrotic lung tissue sequesters and in tonsillar crypts under anaerobic conditions, these persistently infected carrier pigs are involved in disease dissemination and are an important target for disease control (Jacobsen et al. 2005). Our results indicate, that surfactant of infected pigs had a tendency to higher values of active surfactant components than in healthy pigs. Surfactant components such as unilamellar vesicles are considered to be ‘spent’ or inactive surfactant forms (Mühlfeld and Ochs 2010, p. 4) with little surface activity (Gross and Narine 1989). Surfactant dysfunction could be explained by an influx of plasma proteins (Seeger et al. 1993 a, b; Park et al. 1998) or serum proteins (Ueda et al. 1994) or “incorporation by fibrin” (Seeger et al. 1993 a, c). 4) Dr. Doris Höltig, personal communication, November 11, 2013, Hannover, 94 Manuskript Another hypothesis is, that plasma proteins and surfactant lipids compete for space at the interface, plasma proteins also might promote the displacement of lipid from the monolayer (Keough et al. 1988). Deduced from previous studies (Hohlfeld et al. 1998, Veldhuizen et al. 1995, Schmiedl et al. 2003) the hypothesis of our study was, that inactive surfactant forms would be increased in infected pigs. This hypothesis could be rejected. One possible explanation for an increase of active componentsin diseased pigs might be, that there was an increased compensatory production of active subtypes due to a higher conversion rate during inflammatory processes (according to Schmiedl et al. 2003). This can be interpreted as a response mechanism in swine, reflecting effective adaptation to inflammatory processes in this species. However, only an adequate amount of functional surfactant within the respiratory tract guarantees the maintenance of gas exchange throughout an intact air-blood barrier (according to Bernhard et al. 2001 a). In contrast to these data according to Hohlfeld et al. (1999 b), in humans with asthma an increase of the relation of SA/LA after allergen challenge was demonstrated. This indicated the higher conversion of active to inactive surfactant components without a sufficient response mechanism leading to a significant increase of surfactant precursors in the alveolar space. Physiologically, the conversion of functionally active surfactant components is mediated by SP-A. It was shown, that BALF-SP-A levels of patients with asthma declined, which is discussed to be one reason for a high concentration of inactive surfactant forms (Hohlfeld et al. 1999 b). The SA/LA ratio and altered SP levels could be considered as benchmarks for the detection of high-risk patients in an early stage of acute lung injury (Lewis et al. 1994). Another study in mice, infected with Respiratory Syncytial Virus, also discussed the malfunction of surfactant explained by plasma protein influx and hydrolysis caused by mediators of inflammatory cells (Van Schaik et al. 1997). It has been described previously that in surfactant of healthy human a minimal surface tension of <5 mN/m by 10 cycles occurred (Bernhard et al. 2001 b). In 95 Manuskript contrast to that, in persons with pneumonia (Sutnick and Soloff 1964) and pneumonia caused by bacteria the surface tension was increased (Hamm et al. 1996). Rose and Lindberg (1968) demonstrated, that after incubation of different gramnegative bacteria species (Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Aerobacter aerogenes, Klebsiella pneumoniae und Escherichia coli) with alveolar lavage of rabbits a significant increase of surface tension appeared (Rose and Lindberg 1968). Rau et al. (2004) showed, that in newborn piglets the minimal surface tension was found to be significantly lower than in adolescent pigs. This reflects a molecular adaptation of surfactant function and biochemistry to respiratory physiology of newborn pigs with breathing at higher rates during pulmonary development (Rau et al. 2004). Similar to human, in surfactant of healthy swine a minimal surface tension of < 5 mN/m by 10 cycles has been described (Bernhard et al. 2001 b). It has been previously shown, that a low surface tension was mainly mediated by dipalmitoylphosphatidylcholin, although in piglets relatively low concentrations were measured (Rau et al. 2004). In our study the increase of the minimal surfactant surface tension after infection was not as high as expected, so that the primary hypothesis could not be confirmed. In connection with the morphology of surfactant subtypes a higher supply of functionally active surfactant subtypes can be assumed. Freshly produced active surfactant subtypes were probably able to reduce the surface tension of pulmonary surfactant after infection. Furthermore a positive correlation between macrophages in BALF and the minimal surface tension prior to infection was demonstrated. Macrophages normally appear in higher number in healthy pigs (Ganter and Hensel 1997). 96 Manuskript Conclusions The changes in the composition of surfactant subtypes during the course of infection might be explained by a higher, compensatory production of tm and lbl, as active surfactant subtypes, in A.pp. infected pigs during inflammatory processes. These subtypes were able to reduce the minimal surface tension properly. The clinical data show that the pigs were already in convalescence 5), reflecting effective and quick adaptation to inflammatory processes in this species. Abbreviations AEII, alveolar epithelial type II cells; A.pp., Actinobacillus pleuropneumoniae; BAL, bronchoalveolar lavage; BALF, bronchoalveolar lavage fluid; bw, body weight; LA, large aggregates; lb, lamellar bodies; lbl, lamellar body- like forms; LLS, Lung Lesion Score; mlv, multilamellar vesicles; RHS, Respiratory Health Score; SA, small aggregates; SP, surfactant protein; TEM, transmission electron microscope; tm, tubular myelin; ulv, unilamellar versicles; Vv, volume density; V/S-ratio, volume to surface ratio; γmin, average minimal surface tension; Competing interests The authors declare that they have no competing interests. Author’s contribution DB established the scientific protocols for the evaluation of BALF surfactant and quantified surfactant subtypes by TEM and STEPanizer as an evaluation software. She also drafted the manuscript. IHP helped to design the study and to draft the manuscript. AS planned the determination of the surfactant subtypes and their 5) Dr. Doris Höltig, personal communication, November 11, 2013, Hannover, 97 Manuskript specific evaluation, and instructed and attended the stereological evaluation and revise it critically. MO designed the stereological examination procedures and revised it critically. DH carried out the clinical and pathological studies. CA measured the surfactant function with the PBS. MG prepared the cell-free bronchoalveolar lavage fluid supernatants and determined the cellular parameters. All authors proofread the manuscript. Acknowledgements Advices given by Martin Beyerbach (Department of Biometry, Epidemiology and Information Processing, University of Veterinary Medicine Hannover, Bünteweg 2, 30559 Hannover, Germany), has been an extraordinary help in performing the statistic evaluations. The authors would like to acknowledge the help provided by Mrs. Ariane Jacobi and Mrs. Anne Menzel. Special thanks are extended to the staff of the Department of Functional and Applied Anatomy Hannover Medical School, especially Mrs. Andrea Herden, Mrs. Susanne Fassbender and Mrs. Sabine Fiedler. MO is supported by the DFG (SFB 587/ TP 18, OC-23/9-3 and 10-1) and the BMBF (German Center for Lung Research DZL). References Baltes N, Hennig-Pauka I, Jacobsen I, Gruber AD, Gerlach GF: Identification of Dimethyl Sulfoxide Reductase in Actinobacillus pleuropneumoniae and Its Role in Infection. Infect Immun 2003, 71: 6784–6792. Baumgärtner W, Schmidt P: Entzündung. In Allgemeine Pathologie für die Tiermedizin. Edited by Baumgaertner W and Gruber A D. Stuttgart: Enke in MVS Medizinverlage; 2011:180-221. Bernhard W, Mottaghian J, Gebert A, Rau GA, von Der HARDT H, Poets CF: Commercial versus native surfactants. Surface activity, molecular components, and the effect of calcium. Am J Respir Crit Care Med 2000, 162: 1524-1533. 98 Manuskript Bernhard W, Hoffmann S, Dombrowsky H, Rau GA, Kamlage A, Kappler M, Haitsma JJ, Freihorst J, von der Hardt H, Poets CF: Phosphatidylcholine molecular species in lung surfactant: composition in relation to respiratory rate and lung development. Am J Respir Cell Mol Biol 2001 a, 25: 725-731. Bernhard W, Postle AD, Rau GA, Freihorst J: Pulmonary and gastric surfactants. A comparison of the effect of surface requirements on function and phospholipid composition. Comp Biochem Physiol A Mol Integr Physiol 2001 b, 129: 173-182. Brauer C, Hennig-Pauka I, Hoeltig D, Buettner FF, Beyerbach M, Gasse H, Gerlach G-F, Waldmann KH: Experimental Actinobacillus pleuropneumoniae challenge in swine: Comparison of computed tomographic and radiographic findings during disease. BMC Vet Res 2012, 8: 47. Clements J A: Lung Surfactant. A Personal Perspective. Annu Rev Physiol 1997, 59:1-21. Cockshutt AM, Possmayer F: Metabolism of Surfactant Lipids and Proteins in the Developing Lung. In Pulmonary Surfactant: From molecular biology to clinical practice. Edited by Robertson B, Van Golde L M G & Batenburg J J. Amsterdam: Elsevier Science Publishers; 1992: 339-377. Enhorning G: Pulsating bubble technique for evaluating pulmonary surfactant. J Appl Physiol Respir Environ Exerc Physiol 1977, 43: 198–203. Enhorning G: Pulmonary surfactant function studied with the pulsating bubble surfactometer (PBS) and the capillary surfactometer (CS). Comp Biochem Physiol A Mol Integr Physiol 2001, 129: 221–226. Enhorning G: Surfactant in Airway Disease. Chest 2008, 133: 975–980. Ewers C, Wieler LH: Pasteurellaceae. In Tiermedizinische Mikrobiologie, Infektions-und Seuchenlehre. 9th edition. Edited by Selbitz H-J, Truyen U, ValentinWeigand P. Stuttgart: Enke Press in MVS Medizinverlage; 2011: 221-246. Fehrenbach H, Ochs M: Studying lung ultrastructure. In Methods in Pulmonary Research. Edited by Uhlig S, Tyller AE. Basel: Birkhäuser; 1998: 429-454. 99 Manuskript Fehrenbach H, Brasch F, Uhlig S, Weisser M, Stamme C, Wendel A, Richter J: Early alterations in intracellular and alveolar surfactant of the rat lung in response to endotoxin. Am J Respir Crit Care Med 1998, 157: 1630-1639. Ganter M, Hensel A: Cellular variables in bronchoalveolar lavage fluids (BALF) in selected healthy pigs. Res Vet Sc 1997, 63: 215-217. Gottschalk M: Actinobacillosis. In Diseases of Swine. 10th edition. Edited by Zimmerman JJ, Karriker LA, Ramirez A, Schwartz KJ, Stevenson GW. Chichester: Wiley-Blackwell; 2012:653-669. Gross NJ, Narine KR: Surfactant subtypes in mice: characterization and quantitation. J Appl Physiol 1989 (1985), 66: 342-349. Hamm H, Kroegel C, Hohlfeld J: Surfactant: a review of its functions and relevance in adult respiratory disorders. Respir Med 1996, 90: 251–270. Hannan PCT, Bhogal BS, Fish JP: Tylosin tartrate and tiamulin effects on experimental piglet pneumonia induced with pneumonic pig lung homogenate containing mycoplasmas, bacteria and viruses. Res Vet Sci 1982, 33: 76-88. Hawgood S, Poulain FR: The pulmonary collectins and surfactant metabolism. Annu Rev Physiol 2001, 63:495-519. Hennig-Pauka I, Bremerich S, Nienhoff H, Schröder C, Verspohl J, StrutzbergMinder K, Ganter M, Waldmann KH, Blecha F, Beyerbach M, Gerlach GF: Respiratory disease markers in porcine bronchoalveolar lavage fluid. J Vet Med A Physiol Pathol Clin Med 2007 a, 54: 434–440. Hennig-Pauka I, Bremerich S, Nienhoff H, Schröder C, Ganter M, Blecha F, Waldmann K-H, Gerlach GF: Comparison of three common methods of lung lavage in healthy pigs. J Vet Med A Physiol Pathol Clin Med 2007 b, 54: 428–433. Hennig-Pauka I, Baltes N, Jacobsen I, Stratmann-Selke J, Gerlach GF, Selbitz H J, Waldmann KH: Study of the virulence of Actinobacillus pleuropneumoniae in finishing pigs as a basis for vaccination development. Berl Munch Tierarztl Wochenschr 2008, 121:189-197. Hennig-Pauka I, Koch R, Hoeltig D, Gerlach GF, Waldmann KH, Blecha, F, Brauer C, Gasse H: PR-39, a porcine host defence peptide, is prominent in mucosa and 100 Manuskript lymphatic tissue of the respiratory tract in healthy pigs and pigs infected with Actinobacillus pleuropneumoniae. BMC Res Notes 2012, 5: 539. Hiss S, Willbrenning GS, Suntz M, Reinacher M, Sauerwein H: Immunohistochemical localization of haptoglobin in porcine lungs. Anat Histol Embryol 2008, 37: 196–199. Hite RD, Seeds MC, Bowton DL, Grier BL, Safta AM, Balkrishnan R, Waite BM, Bass DA: Surfactant phospholipid changes after antigen challenge: a role for phosphatidylglycerol in dysfunction. Am J Physiol Lung Cell Mol Physiol 2005, 288:L610-7. Höltig D, Hennig-Pauka I, Thies K, Rehm T, Gerlach GF, Waldmann KH: Comparison of the diagnostic statement of clinical, radiographic and ultrasonographic results after an experimental Infection with Actinobacillus pleuropneumoniae in pigs. Berl Mun Tierarztl Wochenschr 2008, 12 (11/12): 422431. Höltig D, Hennig-Pauka I, Thies K, Rehm T, Beyerbach M, Strutzberg -Minder K, Gerlach GF, Waldmann KH, FUGATO-consortium IRAS: A novel Respiratory Health Score (RHS) supports a role of acute lung damage and pig breed in the course of an Actinobacillus pleuropneumoniae infection. BMC Vet Res 2009, 5:14. Höltig D, Waldmann KH, Reiner G (2013): Actinobacillus-pleuropneumoniaeInfektion – Untersuchungen zur genetisch bedingten Empfänglichkeit von Schweinen. Tierärztl Umschau 2013, 68: 533-541. Hohlfeld JM, TIryaki E, Hamm H, Hoymann HG, Krug N, Haverich A, Fabel H: Pulmonary Surfactant Activity Is Impaired in Lung Transplant Recipients. Am J Respir Crit Care Med 1998, 158: 706–712. Hohlfeld J M, Strüber M, Ahlf K, Hoeper MM, Fraund S, Krug N, Warnecke G, Harringer W, Haverich A, Fabel H: Exogenous surfactant improves survival and surfactant function in ischaemia ± reperfusion injury in minipigs. Eur Respir J 1999 a, 13: 1037-1043. Hohlfeld JM, Ahlf K, Enhorning G, Balke K, Erpenbeck VJ, Petschallies J, Hoymann HG, Fabel H, Krug N: Dysfunction of pulmonary surfactant in 101 Manuskript asthmatics after segmental allergen challenge. Am J Respir and Crit Care Med 1999 b, 159: 1803–1809. Howard CV, Reed MG: Unbiased Stereology. 2th edition. Coleraine: QTP Publications; 2010: 7, 57. Hsia CCW, Hyde DM, Ochs M, Weibel ER, ATS/ERS Joint Task Force on Quantitative Assessment of Lung Structure: An Official Research Policy Statement of the American Thoracic Society/European Respiratory Society: Standards for Quantitative Assessment of Lung Structure. Am J Respir Crit Care Med 2010, 181: 394–418. Jacobsen I, Hennig-Pauka I, Baltes N, Trost M, Gerlach G: Enzymes Involved in Anaerobic Respiration Appear To Play a Role in Actinobacillus pleuropneumoniae Virulence. Infec Immun 2005, 73: 226–234. Jarjour NN, Enhorning G: Antigen-induced airway inflammation in atopic subjects generates dysfunction of pulmonary surfactant. Am J Respir Crit Care Med 1999, 160: 336-341. Kahlisch D, Buettner FFR, Naim HY, Gerlach GF: Glycoprotein analysis of porcine bronchoalveolar lavage fluid reveals potential biomarkers corresponding to resistance to Actinobacillus pleuropneumoniae infection. Vet Res 2009, 40: 60. Keough KM, Parsons CS, Phang PT, Tweeddale MG: Interactions between plasma proteins and pulmonary surfactant: surface balance studies. Can J Physiol Pharmacol 1988, 66:1166-1173. Knudsen L, Ochs M: Microscopy-based quantitative analysis of lung structure: application in diagnosis. Expert Opin Med Diagn 2011, 5: 319-330. König HE, Liebich HG: Anatomie der Haussäugetiere. 5th edition. Stuttgart: Schattauer GmbH Press; 2012 a. König HE, Liebich HG: Atmungsapparat. In Anatomie der Haussäugetiere. 5th edition. Edited by König HE. Stuttgart: Schattauer Press; 2012 b: 367-388. Kreienbrock L, Schach S: Epidemiologische Methoden. 4th edition. Munich: Elsevier, Spektrum Akademischer Verlag; 2005: 88-90. 102 Manuskript Lewis J F, Veldhuizen R, Possmayer F, Sibbald W, Whitsett J, Qanbar R, McCaig L: Altered alveolar surfactant is an early marker of acute lung injury in septic adult sheep. Am J Respir Crit Care Med 1994, 150: 123-130. MacInnes JI, Gottschalk M, Lone AG, Metcalf D S, Ojha S, Rosendal T, Watson SB, Friendship RM: Prevalence of Actinobacillus pleuropneumoniae, Actinobacillus suis, Haemophilus parasuis, Pasteurella multocida, and Streptococcus suis in representative Ontario swine herds. Can J Vet Res 2008, 72: 242–248. Marsteller TA, Fenwick B: Actinobacillus pleuropneumoniae disease and serology, Swine Health Prod 1999, 7: 161–165. Meyer KC, Zimmerman JJ: Inflammation and surfactant. Paediatr Respir Rev 2002, 3: 308-314. Mühlfeld C, Knudsen L, Ochs M: Stereology and Morphometry of Lung Tissue. Volume 931. Chapter 18. In Cell Imaging Techniques: Methods and Protocolls, Methods in Molecular Biology. 2nd edition. Edited by Taatjes DJ and Roth J. New York: Springer Science+ Business Media Press; 2013: 367-390. Mühlfeld C, Ochs M: Functional Aspects of Lung Structure as Related to Interaction with Particles. In Particle-Lung Interactions. Edited by Gehr P, Mühlfeld C, Rothen-Rutishauser B, Blank F. 2nd edition. New York: Informa Healthcare USA. 2010: 1-16. Ochs M, Nenadic I, Fehrenbach A, Albes JM, Wahlers T, Richter J, Fehrenbach H: Ultrastructural alterations in intraalveolar surfactant subtypes after experimental ischemia and reperfusion. Am J Respir Crit Care Med 1999, 160: 718-724. Ochs M, Schüttler M, Stichtenoth G, Herting E: Morphological alterations of exogenous surfactant inhibited by meconium can be prevented by dextran. Resp Res 2006, 7: 86. Ochs M: The closer we look the more we see? Quantitative microscopic analysis of the pulmonary surfactant system. Cell Physiolol Biochem 2010, 25: 27–40. 103 Manuskript Park J, Bae CW, Choi, YM: In vitro inhibition of biophysical surface properties and change in ultrastructures of exogenous pulmonary surfactant by albumin or fibrinogen. J Korean Med Sci 1998, 13: 123-130. Penrith ML, Henton MM: Porcine Pleuropneumonia, Synonym: Actinobacillus pleuroneumoniae infection. In Infectious Diseases of Livestock. 2nd edition. Volume three. Edited by Coetzer J, Tustin R C. Southern Africa: Oxford University Press; 2004: 1661-1669. Rau GA, Vieten G, Haitsma JJ, Freihorst J, Poets C, Ure BM, Bernhard W: Surfactant in newborn compared with adolescent pigs: adaptation to neonatal respiration. Am J Respir Cell Mol Biol 2004, 30: 694–701. Reiner G, Bertsch N, Hoeltig D, Selke M, Willems H, Gerlach GF, Tuemmler B, Probst I, Herwig R, Drungowski M, Waldmann KH: Identification of QTL affecting resistance/susceptibility to acute Actinbacillus pleuropneumoniae infection in swine. Mamm Genome 2014, 25:180-191. Reinhold P: Methodische Grenzen der bronchoalveolären Lavage bei Rind und Schwein [abstract]. In 43. Kongress der Deutschen Gesellschaft für Pneumologie/ 22. Tagung der Deutschen Gesellschaft für Allergologie und klinische Immunologie/ Workshop des Arbeitskreises “Vergleichende Pathologie und Pathopsychologie des respiratorischen Systems“ der Fachgruppe Pathologie der Deutschen Veterinärmedizinischen Gesellschaft (DVG) in Zusammenarbeit mit der Sektion Pathophysiologie der Atmung der Deutschen Gesellschaft für Pneumologie (DGP): 13-16 March 2002; Bochum. Edited by Costabel U, Kirsten D, Kroegel C, Mueller-Quernheim J, Rabe K, Schaberg T. Stuttgart: Thieme Press; 2002:119 (Pneumologie 56). Rogers CS, Abraham WM, Brogden KA, Engelhardt JF, Fisher JT, McCray PB Jr, McLennan G, Meyerholz DK, Namati E, Ostedgaard LS, Prather RS, Sabater JR, Stoltz DA, Zabner J, Welsh MJ: The porcine lung as a potential model for cystic fibrosis. Am J Physiol Lung Cell Mol Physiol 2008, 295: 240-263. Rose M, Lindberg DA.: Effect of pulmonary pathogens on surfactant. Dis Chest 1968, 53: 541-544. 104 Manuskript Sachs L, Hedderich J: Angewandte Statistik: Methodensammlung mit R. 13th edition. Berlin, Heidelberg: Springer. 2009: 464-468. Schmiedl A, Hoymann HG, Ochs M, Menke A, Fehrenbach A, Krug N, Tschernig T, Hohlfeld JM: Increase of inactive intra-alveolar surfactant subtypes in lungs of asthmatic Brown Norway rats. Virchows Arch 2003, 442: 56–65. Schmiedl A, Krug N, Hohlfeld JM: Influence of plasma and inflammatory proteins on the ultrastructure of exogenous surfactant. J Electron Microsc (Tokyo) 2004, 53: 407–416. Schwegler JS: Der Mensch: Anatomie und Physiologie; Schritt für Schritt Zusammenhänge verstehen. 3rd edition. Stuttgart: Georg Thieme; 2002 a. Schwegler JS: Der Mensch: Anatomie und Physiologie; Schritt für Schritt Zusammenhänge verstehen. 3rd edition. Stuttgart: Georg Thieme Press; 2002 b: 229. Seeger W, Günther A, Walmrath HD, Grimminger F, Lasch HG: Alveolar surfactant and adult respiratory distress syndrome. Pathogenetic role and therapeutic prospects. Clin Investig 1993 a, 71: 177-190. Seeger W, Grube C, Günther A, Schmidt R: Surfactant inhibition by plasma proteins: differential sensitivity of various surfactant preparations. Eur Respir J 1993 b, 6: 971-977. Seeger W, Elssner A, Günther A, Krämer HJ, Kalinowski HO: Lung surfactant phospholipids associate with polymerizing fibrin: loss of surface activity. Am J Respir Cell Mol Biol 1993 c, 9: 213-220. Sutnick A I, Soloff LA: PULMONARY SURFACTANT AND ATELECTASIS. Anesthesiology 1964, 25: 676-681. Swindle MM, Smith AC: Swine in Biomedical Research. In Sourcebook of Model in Biomedical Research. Edited by Conn P M. Totowa, New Jersey: Humana Press; 2008: 233-239. Trachsel S, Purkabiri K, Loup O, Jenni H, Eberle B, Ochs M, Kadner A: High-quality lung fixation by controlled closed loop perfusion for stereological analysis in a large animal model. J Surg Res 2011, 166: 97–102. Tschanz SA, Burri PH, Weibel ER: A simple tool for stereological assessment of digital images: the STEPanizer. J Microsc 2011, 243: 47–59. 105 Manuskript Ueda T, Ikegami M, Jobe A: Surfactant subtypes. In vitro conversion, in vivofunction, and effects of serum proteins. Am J Respir Crit Care Med 1994, 149, 1254-1259. Van Iwaarden F, Welmers B, Verhoef J, Haagsman HP, Van Golde LM: Pulmonary surfactant protein A enhances the host-defense mechanism of rat alveolar macrophages. Am J Respir Cell Mol Biol 1990, 2: 91-98. Van Iwaarden JF, Van Strijp JA, Ebskamp MJ, Welmers AC, Verhoef J, Van golde LM (1991): Surfactant protein A is opsonin in phagocytosis of herpes simplex virus type 1 by rat alveolar macrophages. Am J Physiol 1991, 261: L204-209. Van Iwaarden JF: Surfactant and the Pulmonary Defense System. In Pulmonary Surfactant: From molecular biology to clinical practice. Edited by Robertson B, Van Golde LMG, Batenburg JJ. Amsterdam: Elsevier Science Publishers; 1992: 215-227. Van Iwaarden JF, Van Strijp JA, Visser H, Haagsman HP, VerhOEF J, Van Golde LM: Binding of surfactant protein A (SP-A) to herpes simplex virus type 1infected cells is mediated by the carbohydrate moiety of SP-A. J Biol Chem 1992 a, 267: 25039-43. Van Iwaarden JF, Shimizu H, Van Golde PH, Voelker DR, Van Golde LM: Rat surfactant protein D enhances the production of oxygen radicals by rat alveolar macrophages. Biochem J 1992 b, 286: 5-8. Van Schaik SM, Vargas I, Welliver RC, Enhorning G: Surfactant Dysfunction Develops in BALB/c Mice Infected with Respiratory Syncytial Virus. Pedr Res 1997, 42: 169-173. Veldhuizen RA, McCaig LA, Akino T, Lewis JF: Pulmonary surfactant subfractions in patients with the acute respiratory distress syndrome. Am J Respir Crit Care Med 1995, 152:1867-1871. Veldhuizen R, Possmayer F: Phospholipid metabolism in lung surfactant. In Subcellular Biochemistry: Membrane Dynamics and Domains. Vol 1. Edited by P J Quinn. New York: Kluwer Academic/Plenum Publishers; 2004: 359-388. 106 Manuskript Voorhout WF, Veenendaal T, Haagsman HP, Verkleij AJ, van Golde LM, Geuze HJ: Surfactant protein A is localized at the corners of the pulmonary tubular myelin lattice. J Histochem Cytochem 1991, 39:1331-1336. Weibel ER: Stereological methods (Practical Methods for Biological Morphometry Vol. 1). London: Acedemic Press; 1979: 109-121. White M: Porcine respiratory disease complex (PRDC): Part 2: Non-infectious factors. Livestock 2011, 16:44-46. Wright TW, Notter RH, Wang Z, Harmsen AG, Gigliotti F: Pulmonary inflammation disrupts surfactant function during Pneumocystis carinii pneumonia. Infect Immun 2001, 69:758-764. Wright J: Host defense functions of pulmonary surfactant. Biol Neonate 2004, 85: 326–332. Figure legends Figure 1 Counting of points and intersections using the STEPanizer© Stereology tool. According to Tschanz et al. (2011), the figure shows the layout of the counting window seen in STEPanizer©, the evaluation area is a square bordered by lines. All structures between the continuous und the dashed lines of the square were counted, if hit by a test line segment (red line) or by a test point (green points at the ends of test lines). Eight test line segments with 16 test points at the end were used to define counting hits with the different surfactant structures (Tschanz et al. 2011). In this micrograph tm and mlv could be found. Figure 2 Proportion of volume densities of different surfactant subtypes [%] in healthy and A.pp. infected pigs. Grey columns: surfactant seven days prior to infection, grey dashed columns: surfactant from day 7 after infection 107 Manuskript ■ Statistically noticeable difference between the two examination days prior to infection and 7 days after infection (Wilcoxon Sign-Ranked test, five pigs). Figure 3 Lung lesion scores and minimal surface tension [mN/m]. The minimal surfactant surface tension is shown seven days prior to infection and at day 7 after infection in six pigs. For data prior to infection the ordinate depicts the surfactant surface tension as well as the abscissa. For data after infection the ordinate depicts the lung lesion score. The Spearman’s rank correlation coefficient between the minimal surface tension after infection; [mN/m]) and the lung lesion score was calculated. A correlation could not be shown (correlation coefficient 0.2, p=0.7471). Figure 4 Surfactant of a pig prior to infection. Many ulv (arrow head) are shown. Figure 5 Surfactant of the same pig on day 7 after infection with A.pp. Mlv are characterized (circle) and tm is 108 indicated by a triangle. Manuskript Table 1 Various parameter in healthy and A.pp. infected pigs Parameter Stage of infection with A.pp. serotype 7 strain AP76 Prior infection After infection Minimum Median Maximum Minimum Median Maximum Vv ulv [%] VV mlv [%] Vv lbl [%] Vv tm [%] V/S ulv [µm] V/S lbl [µm] Vv [%] LA SA/LA ratio γmin [mN/m] Clinical Score♦ Ultrasonographic Score♦ Radiographic Score♦ RHS [%]♦ LLS♦ Leucocytes [G/l] in BALF▲ Lymphocytes [%] in BALF▲ Segmented Neutrophils [%] in BALF▲ Macrophages [%] in BALF▲ p-value 23.58 58.74 2.36 0 0.49 1.11 2.79 4.96 0.69 0 0 0 0 0.35 1 35.18 62.01 2.84 0.29 0.61 1.50 2.84 12.48 1.8 0 0 0 0 0.59 2.2 38.43 71.9 5.48 0.43 0.69 1.88 5.77 13.55 2.9 0 2 0 0.33 0.82 3.5 19.23 54.02 3.24 0.48 0.48 1.01 3.72 1.30 1.6 0.93 33 9 14.54 10.08 0.51 0.7 24.4 70.09 8.47 1.89 0.65 1.69 10.67 3.04 4.2 2.2 54 12 19.76 12.89 0.54 1.5 34.61 70.41 12.61 4.8 0.87 2.26 17.41 7.03 6.0 2.9 94 19 30.97 20.87 5 4.2 0.0625■ 0.8125 0.1875 0.0625■ 0.3125 0.3125 0.1250 0.1250 0.1250 0.0625■ 0.0625■ 0.0625■ 0.0625■ 0.3750 0.50 0 0.2 2.7 1.5 3.5 30 0.0625■ 93.7 97.5 99 68.5 92.2 97 0.1250 Vv = Volume densities of surfactant subtypes [%], V/S = Volume to surface ratio [µm], γ min = Average minimal surface tension ■ [mN/m], RHS = Respiratory Health Score [%], LLS = Lung Lesion Score, =statistically noticeable, ♦ = part of an infection trial (FUGATO-RePoRI-Project), personal communication Dr. D. Höltig, 16.11.2013 Hannover (article: Reiner et ▲ al. 2014); = part of an infection trial (FUGATO-RePoRI-Project) 109 Manuskript Figure 1 110 Manuskript Figure 2 111 Manuskript Figure 3 112 Manuskript Figure 4 Figure 5 113 Manuskript 114 Übergreifende Diskussion 5. Übergreifende Diskussion Diese Arbeit umfasst zwei Themenbereiche: Surfactant- und Lungenparenchymcharakterisierung nach Infektion durch jeweils denselben, veterinärmedizinisch relevanten Erreger mit Hilfe stereologischer Methoden. Grundsätzlich können die in dieser Arbeit etablierten Modelle als eine Art Vorstudie oder als Matrizen für weitere Studien zu infektionsbedingten Alterationen gesehen werden. Der Schwerpunkt der Arbeit liegt grundlagenorientiert auf den entzündungsbedingten Veränderungen im Surfactantsystem. 5.1 Alterationen im Surfactantsystem (vgl. Manuskript) 5.1.1 Reflexion der Ergebnisse Im folgenden Ansatz sollte, in Anlehnung an SCHMIEDL et al. (2003); VAN SCHAIK et al. (1997), herausgestellt werden, inwieweit sich die Qualität des Surfactants (stereologische Darstellung der Subtypen und Funktion) in pathologischen und klinischen Parametern wiederspiegelt. Falls ein Zusammenhang besteht, könnte man als weiteren Parameter zur Definition des Lungengesundheitsstatus die Untersuchung des Surfactants (ultrastrukturell, biophysikalisch) heranziehen. Um die entzündungsbedingten Veränderungen zu beschreiben, wurden die Volumendichten der Surfactantsubtypen, die Volumen-/Oberflächenverhältnisse bestimmter Surfactantsubtypen (jeweils repräsentativ für aktive und inaktive Strukturen) und die minimalen Oberflächenspannungen vor und nach der Infektion bestimmt (in Anlehnung an SCHMIEDL et al. 2003). Weitere Bausteine waren die klinischen Parameter, die durch klinische, röntgenologische, ultrasonographische und pathomorphologische Untersuchung im Rahmen des vorangegangenen FUGATO-RePoRI-Projektes (publiziert in REINER et al. 2014) erhoben wurden. Zudem wurde die BALF zytologisch (ebenfalls FUGATORePoRI-Projekt) untersucht. Zur Durchführung der Infektion wurde ein Aerosolverfahren gewählt, in dem die 115 Übergreifende Diskussion Schweine in einer Kammer mittels Vernebelung der Bakteriensuspension aerogen infiziert wurden (REINER et al. 2014). Dieses Verfahren erschien besonders sinnvoll, da es den natürlichen Infektionsweg wiederspiegelt (WEISS u. RUDOLPH 2007, S. 66). Die klinischen und pathomorphologischen Daten sind im Rahmen des FUGATORePoRI- Projektes (publiziert in REINER et al. 2014) erhoben worden. Die klinischen Scores (Klinische Ultrasonographie, Untersuchung Röntgen und mit RHS) Schwerpunkt der fünf Respirationstrakt; ausgewählten Schweine unterschieden sich statistisch auffällig (p=0,0625) vor und nach der Infektion, während sich die zytologischen Befunde in der BALF nicht signifikant unterschieden. Lediglich die Segmentkernigen Granulozyten in der BALF waren nach der Infektion statistisch auffällig höher (p=0,0625)7). Die Schweine waren im Stadion der Rekonvaleszenz und bereits in der subakuten Entzündungsphase (zur Definition für subakut, vgl. BAUMGÄRTNER u. SCHMIDT 2011, S. 185) als sich die Konsolidierungen im Lungenparenchym manifestierten. 6) Genau in diesem konsolidierten Lungenparenchym, den Krypten der Tonsillen und den Epithelzellen des Respirationstraktes kann der Erreger über Wochen und Monate nach der Infektion überleben (JACOBSEN et al. 2005). Die Tiere zeigten in diesem Stadium bereits keine Klinik mehr6) (vgl. Anhang 1., Tab. 7.1.1) und sind stille Erregerträger und tückische Infektionsquellen (PENRITH und HENTON 2004, S. 1661). Die Charakterisierung von Surfactant an Tag 7 der Infektion erschien in dieser Studie besonders sinnvoll. Die Schweine waren an diesem Tag bereits wieder stabil genug6), um eine Neuroleptanalgesie und anschließende BAL durchzustehen. 6) Persönliche Mitteilung von Frau Dr. Doris Höltig, 16.11.2013, Hannover 7) Im Rahmen von FUGATO-RePoRI erhoben 116 Übergreifende Diskussion Bei der Entstehung einer Surfactantdysfunktion kann pathogenetisch die Ausschwitzung von Plasmaproteinen (SEEGER et al. 1993 a und b; PARK et al. 1998) bzw. Serumproteinen (UEDA et al. 1994), und die „Inkorporation“ von Surfactant durch Fibrin (SEEGER et al. 1993 b und c) genannt werden. Des Weiteren kann es zur Verdrängung von Phospholipiden im Monolayer durch Plasmaproteine kommen (KEOUGH et al. 1988). Bei der Beeinträchtigung der Surfactantfunktion wird auch bestimmter oxidativer Stress (SEEGER et al. 1985) und die Phospholipase A2 bzw. C (HOLM et al. 1991) diskutiert. Vielen Studien, in denen u.a. ursächlich eine Entzündung (HOHLFELD et al. 1998) bzw. direkt Entzündung als Ursache (VAN SCHAIK et al. 1997; WRIGHT et al. 2001; SCHMIEDL et al. 2003) diskutiert wurde, zu Veränderungen im Surfactantsystem ist gemein, dass es zu einer Verschiebung von aktiven zu inaktiven Surfactantsubtypen (HOHLFELD et al. 1998; SCHMIEDL et al. 2003) und verschlechterten funktionellen Eigenschaften kommt (VAN SCHAIK et al. 1997; HOHLFELD et al. 1998; WRIGHT et al. 2001; SCHMIEDL et al. 2003). Diese Beobachtungen bestimmten die Hypothese, auf die diese Studie mit der Messung der Funktion und der Morphometrie des Surfactants aufbaute. Die morphometrisch ermittelten Volumendichten [%] der Surfactantsubtypen ergaben eine stark tendenzielle Verschiebung von inaktiven zu aktiven Surfactantsubtypen nach der Infektion. So waren die ulv nach der Infektion mit einem p von 0,0625 erniedrigt und die tms nach der Infektion mit einem p von 0,0625 erhöht. Die lbl waren nach Infektion größer, allerdings nicht statistisch signifikant. Die SA/LA ratio war nach der Infektion im Median (allerdings nicht signifikant) erniedrigt, was auf eine beginnende Verschiebung von aktiven zu inaktiven Subtypen hindeutet. Zudem war der LLS signifikant negativ mit der Volumendichte [%] der lbl vor der Infektion korreliert (p=0,0374). Die Volumendichte der ulv [%] nach der Infektion war signifikant positiv korreliert mit dem klinischen Score nach der Infektion, dem röntgenologischen Score nach der Infektion und dem RHS nach der Infektion (p=0,0374) (LLS und klinische Daten publiziert in REINER et al. 2014). Surfactantsubtypen, wie ulv, werden als verbrauchte Strukturen, lbl und tm hingegen als aktive, frische Surfactantsubtypen angesehen (FEHRENBACH et al. 1998; 117 Übergreifende Diskussion GROSS u. NARINE 1989 a). Des Weiteren waren die stabkernigen Granulozyten im Blut nach der Infektion signifikant negativ korreliert mit der Volumendichte des tms [%] nach der Infektion (p=0,0374), jedoch signifikant positiv korreliert mit dem klinischen Score und dem RHS nach der Infektion. Stabkernige Granulozyten gehören zu den unreifen Granulozyten (MORITZ et al. 2014, S.102). Diese Form gelangt bei einem stark gesteigerten Bedarf an weißen Blutzellen in den peripheren Geweben über die Blutbahn vom Knochenmark zu den Zielgeweben. Dies ist bei akuter Inflammation der Fall (MORITZ et al. 2014, S. 105). 118 Übergreifende Diskussion Abb. 5.1.1 Schematische Darstellung des Surfactantmetabolismus (aus MÜHLFELD u. OCHS 2010, S. 4) MÜHLFELD u. OCHS (2010, S. 4) beschreiben, dass in den AE II die Surfactantproteine via Transskription, Translation (rER = rauhes endoplasmatische Reticulum) und posttranslationaler Weiterverarbeitung am Golgi-Apparat und in den multivesikulären Körperchen (MVB) gebildet werden. Für SP-A ist bekannt, dass es in kleinen Vesikeln und/oder MVB zur Zelloberfläche gelangt und dort sezerniert wird. SP-B und C werden in sogenannten composite bodies (CB) gebildet. Aus den CB gehen die reifen Lk hervor. Diese werden über Exozytose in die wässrige Hypophase (HY) sezerniert. Die LB werden umstrukturiert und bilden tubuläre Myelinfiguren (TM), von denen ausgehend sich der Surfactantfilm (SF) bildet. Zusammenfassend werden die HY und der SF als alveolar lining layer (ALL) bezeichnet. Verbrauchter Surfactant erscheint als unilamelläre Vesikel (UV). Diese können von Alveolarmakrophagen oder von AE II aufgenommen und weiter verarbeitet werden. Letzlich ist auch eine Beseitigung über die Luftwege möglich (MÜHLFELD u. OCHS 2010, S. 4). In einer humanmedizinischen Studie mit Asthmapatienten wurde eine erhöhte SA/LA Ratio nach Allergenexposition nachgewiesen, was eine erhöhte Konversion von 119 Übergreifende Diskussion aktiven zu inaktiven Subtypen bedeutet (HOHLFELD et al. 1999 a). LEWIS et al. (1994) lösten beim Schaf einen Septikämie-bedingten akuten Lungenschaden aus, der zu einer Erhöhung der SA/LA-Ratio und zu einer Reduktion der SP A, B und C führte Die Ergebnisse können in der Humanmedizin als Orientierungspfeiler für die Detektion von Patienten mit hohem Risiko für eine akute Lungenschädigung genutzt werden (LEWIS et al. 1994). OULTON et al. (1999) beschrieben eine 76-kDa Serinprotease, die als Convertase den heavy-aggregate alveolären Surfactant zu light aggregate, nicht oberflächenaktiven Formen katabolisiert. Die Lamellenkörper in den AE II werden als Herkunft der Konvertase vermutet (OULTON et al. 1999). Die Ergebnisse dieser Arbeit könnten dahingehend diskutiert werden, dass es infektionsbedingt zu einer gesteigerten, kompensatorischen Produktion von aktivem Surfactant als Reaktion auf eine gesteigerte Konversion gekommen ist (in Anlehnung an SCHMIEDL et al. 2003). Dieser Vorgang könnte einen generellen Mechanismus beim Schwein darstellen, der in der subakuten Krankheitsphase eine effektive Adaptation auf die Entzündung bei dieser Spezies darstellt. Funktionell aktive Surfactantsubtypen überwogen bei den infizierten Tieren. Die Frage bleibt offen, ob diese auch oberflächenaktiv waren. Um dieser Frage nachzugehen, wurden die minimalen Oberflächenspannungen bestimmt (in Anlehnung an SCHMIEDL et al. 2003). Die zur Bestimmung der Funktion herangezogenen minimalen Oberflächenspannungen erwiesen sich nach der Infektion als erhöht, allerdings lag keine Signifikanz oder ein Trend vor. Zudem muss relativiert werden, dass ein deutlicher Anstieg über 5 mN/m, (physiologischer Bereich: <5 mN/m, wie beschrieben in BERNHARD et al. 1997; BERNHARD et al. 2001 a; BERNHARD et al. 2001 b), ausgeblieben ist. Der Median der minimalen Oberflächenspannung der infizierten Tiere an Tag 7 lag bei 4,2 mN/m, die Range war zwischen 1,6 mN/m und 6 mN/m. Studien aus der Humanmedizin belegen erhöhte Oberflächenspannungen bei 120 Übergreifende Diskussion Pneumonien (SUTNICK u. SOLOFF 1964) bzw. bei bakteriell bedingten Pneumonie (HAMM et al. 1996). ROSE und LINDBERG (1968) zeigten, dass es nach Inkubation von bestimmten gram- negativen Bakterien (Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Aerobacter aerogenes, Klebsiella pneumoniae und Escherichia coli) mit Lavagen des bronchoalveolären Raumes von Kaninchen zu einem signifikanten Anstieg der Oberflächenspannung kam (ROSE u. LINDBERG 1968). In einer Studie mit Saugferkeln von RAU et al. (2004) erwies sich die Funktion des Surfactants der Saugferkel als signifikant besser als die adulter Tiere. Diese wurde als ein Beweis dafür angesehen, dass sich auf molekularer Ebene die Surfactantfunktion- und biochemie an die Physiologie des Atmungsapparates während der Lungenentwicklung anpasst. Saugferkel haben höhere Atemfrequenzen als adulte Tiere (RAU et al. 2004). Der menschlichen Physiologie sehr ähnlich zeigte das Surfactant vom gesunden Schwein eine minimale Oberflächenspannung <5 mN/m auf 10 Zyklen (BERNHARD et al. 2001 b). Ergänzend kann gesagt werden, dass sich in der vorliegenden Studie die Anzahl der Makrophagen in der BALF signifikant positiv mit der minimalen Oberflächenspannung an Tag 0 korrelieren ließ. Makrophagen dominieren normalerweise bei lungengesunden Schweinen in der BALF (GANTER u. HENSEL 1997). Zusammenfassend ist zu sagen, dass ein Anstieg der Oberflächenspannung über den physiologischen Grenzwert (im Median) ausgeblieben ist. Trotzdem passt das Ergebnis der Funktionsanalyse zum morphologischen Bild der Surfactantsubtypenverteilung. Der frisch sezernierte Surfactant war in der Lage die Oberflächenspannung herabzusetzen. Das Surfactantsystem des Schweines scheint effektiv auf entzündliche, A.pp. bedingte Veränderungen in der Lunge zu reagieren. Dies zeigte sich in der Produktion von frischem, oberflächenaktiven Surfactant nach der Infektion. Die Hypothese des Zusammenhangs zwischen morphometrischem Bild und Funktion des Surfactants dieser Spezies konnte somit bestätigt werden. 121 Übergreifende Diskussion Allerdings muss kritisch angemerkt werden, dass sich die Tiere sich im Stadium der Rekonvaleszenz und in der subakuten Entzündungsphase befanden.8) Es lagen zwar noch pathologische Veränderungen und ein kultureller Nachweis von A.pp. im Lungenparenchym vor (REINER et al. 2014), dennoch ist für eine abschließende Beurteilung die Untersuchung des Surfactants zu einem früheren Zeitpunkt sinnvoll. Trotzdem ist es in der vorliegenden Studie erstaunlich, wie schnell sich das Surfactantsystem beim Schwein zu regenerieren vermochte. 5.1.2 Reflexion der angewandten Methoden und Ausblick COSTABEL (2005) erläutert, dass die BAL als ein adäquates Verfahren erscheint, das wenig invasiv ist und selbst bei schwer kranken Patienten durchgeführt werden kann. Durch die Untersuchung der BALF lässt sich einfacher eine Aussage über den Lungengesundheitsstatus treffen als durch die Untersuchung von Bioptaten (COSTABEL 2005). Bei der Durchführung der BAL beim Schwein ist allerdings eine Allgemeinanästhesie unumgänglich (GANTER et al. 1993). In dieser Arbeit wurden ergänzend neue Daten zum auch in der Humanmedizin vermehrt genutzten Modelltier Schwein (TRACHSEL et al. 2011, HOHLFELD et al. 1999 b, ROGERS et al. 2008) gesammelt. OCHS (2010) beschreibt, dass der intraalveoläre und intrazelluläre Surfactantpool durch die Kombination von Elektronenmikroskopie und Stereologie qualitativ und quantitativ umfassend analysiert werden kann. Diese Verfahren stellen sich als wertvolle Instrumente dar, um pathologische Alterationen und Behandlungseffekte in experimentellen Studien zu erforschen (OCHS 2010). 8) Persönliche Mitteilung von Frau Dr. Doris Höltig, 16.11.2013, Hannover 122 Übergreifende Diskussion Das Kernstück dieser Arbeit basiert auf der tierexperimentellen Methode der BAL. SCHMIEDL (2007) erklärt, dass leider bei der konventionell gewonnenen BALF keine Information über Lokalisation und Verteilungsmuster von Surfactant verfügbar ist. Eine Variante intraalveolären und intrazellulären Surfactant zu lokalisieren ist die Perfusionsfixierung von Lungenparenchym (s. beispielhaft unter Kapitel 3.3.), da diese die Mikroorganisation des Surfactants nicht beeinträchtigt (SCHMIEDL 2007). In Lungenparenchymproben kann hingegen ultrastrukturell der intrazelluläre Surfactantpool erfasst werden (OCHS 2010). In folgenden Arbeiten wäre es folglich sinnvoll, sich intrazelluläre Surfactantalterationen anzuschauen. Des Weiteren könnte man die Surfactantproteine (SP-A) mittels Immunelektronenmikroskopie in ihrer Verteilung mithilfe von stereologischen Methoden untersuchen (vgl. beispielhaft in SCHMIEDL et al. 2005). Experimentelle Studien zur therapeutischen Surfactantsubstitution beim Schwein, wie sie beim Menschen bei bspw. ARDS (WALMRATH et al. 2008) oder beim Neonatalem Atemnotsyndrom (PARMIGIANI u. SOLARI 2003) beschrieben wurden, erscheinen nach den Ergebnissen dieser Arbeit nicht sinnvoll zu sein, da diese Tierart vermutlich Surfactantalterationen relativ schnell zu regenerieren vermag. 123 Übergreifende Diskussion 5.2 Charakterisierung der infektionsbedingten Parenchymalterationen 5.2.1 Reflexion der Ergebnisse Im ersten Teil der Arbeit wurde auf die ultrastrukturellen Veränderungen im Surfactant aus der BALF eingegangen. Zudem wurden die entzündungsbedingten Alterationen auch auf Lungenparenchymebene mittels stereologischer Methoden charakterisiert (in Anlehnung an BEHRENS 2011). Es wurde mit einer Kontrollgruppe und einer Gruppe A.pp.- infizierter Schweine gearbeitet (vgl. BRAUER 2012; HENNIG-PAUKA et al. 2012): 1) für die Erhebungen der klinischen, pathomorphologischen Daten ((BRAUER 2012 (beide Gruppen); HENNIG-PAUKA et al. 2012 (nur drei Kontrolltiere, infizierte Tiere vollständig)), 2) für die histologischen Daten (im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, alle infizierten Tiere)), und 3) für die stereologischen und computertomographisch stereologischen Daten (BRAUER et al. 2012). Das Infektionsmodell (A.pp. Serotyp 7, Infektion über Aerosole in einer Kammer) wurde ähnlich wie Surfactantalterationen gewählt (BRAUER 2012). Die klinische Untersuchung orientierte sich nahezu an HÖLTIG (2009) und für die pathomorphologischen Erhebungen wurde der LLS, wie beschrieben in BRAUER et al. (2012), ermittelt. BRAUER (2012) (beide Gruppen) und HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, infizierte Tiere vollständig) zeigten bereits, dass ein signifikanter Unterschied (p=0,02) zwischen dem klinischen Score der Kontroll- und infizierten Tiere an Tag 21 bestand. Der klinische Score lag bei den Kontrolltieren bei 0,3 (Range: 0,1 bis 0,7) und bei den A.pp.- infizierten Tieren bei 0,96 (Range: 0,81 bis 2,06; s. Anhang 2., Tabelle 7.2.1). Die Sektion der chronisch infizierten Tiere fand am Tag 21 nach der Infektion statt. Die infizierten Tiere hatten geringgradige LLS (Range: 4,39 bis 12,33; Median: 6,335; s. Anhang 2., Tabelle 7.2.1 und Tabelle 7.2.2. Es bestand im Wilcoxon Rangsummentest kein signifikanter Unterschied im LLS 124 Übergreifende Diskussion zwischen beiden Gruppen (p=0,1084). Diese Daten stammen aus den Infektionsstudien von BRAUER (2012) (beide Gruppen) und HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, infizierte Tiere vollständig). Der eingesetzte A.pp. Stamm soll laut Literatur vor allem chronische Veränderungen auslösen (HÖLTIG et al. 2008). Großflächige, fibrinöse Pleuropneumonie im Bereich der Hauptlappen sind charakteristisch für eine Infektion mit A.pp. (LÓPEZ 2009, S. 502). Abszessbildung der Nekroseherde durch Sekundärinfektion, Indurationen, adhäsive Pleuritis und Sequestrationen (sind beschrieben WEISS u. RUDOLPH 2007, S. 66). Pathologisch-anatomisch zeigten sich bei den infizierten Tieren verschiedenste Verwachsungen der Lungenlappen mit umliegenden Strukturen, Sequester und Pleuritis (BRAUER 2012 (beide Gruppen); HENNIG-PAUKA et al. 2012 (nur drei Kontrolltiere, infizierte Tiere vollständig)). Zudem konnten Pneumonien mit Abszessoder Sequesterbildung pathohistologisch diagnostiziert werden (HENNIG-PAUKA et al. 2012) (s. Anhang 2., Tabelle 7.2.1 und 7.2.2). Die histologischen Präparate sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (alle infizierten Tiere, nur drei Kontrolltiere) entnommen worden. Bei den histologisch-stereologischen Untersuchungen zeigten sich bei der Volumendichte des Parenchyms [%], des Non-Parenchyms [%], der Alveolarsepten [%] und des Alveolarluftraumes [%] und der Oberflächendichte der Alveolarsepten [1/µm] keine signifikanten Unterschiede zwischen Kontrolltieren und A.pp- infizierten Tieren. Lediglich die Alveolarseptendicke [µm] war statistisch auffällig größer bei den infizierten Tieren (s. Anhang 2., Tabelle 7.2.1 und Abb. 7.2.1-3). Zudem erwiesen sich die mithilfe des CTs bestimmten funktionellen Volumina von Parenchym [cm3], Alveolarsepten [cm3] und pathologisch veränderten Strukturen [cm3] sowie die Oberfläche der Alveolarsepten [cm2] als nicht signifikant unterschiedlich zwischen den Tiergruppen (vgl. Anhang 2., Abb. 7.2.6-8 und Tabelle 7.1.1). Volumen und Oberfläche der Alveolarsepten sind letztendlich als Maß für die Gasaustauschfunktion bzw. Gasaustauschfläche zu sehen (modifiziert nach BEHRENS 2011). Die Ergebnisse deuten darauf hin, dass keine Alveolarsepten 125 Übergreifende Diskussion infektionsbedingt verloren gegangen sind. Aufgrund der tendentiell erhöhten Alveolarseptendicke (interstitieller kann Raum und eine infektionsbedingte /oder Schwellung Alveolarepithel, der Septen Kapillarendothel) nicht ausgeschlossen werden. Erklärend für die histologisch-computertomographischen Ergebnisse könnte es zwei Hypothesen geben: a.) Die strukturellen Veränderungen im Lungenparenchym traten nur innerhalb der nur sporadisch auftretenden fokalen Läsionen auf. Das Lungenparenchym außerhalb der Läsionen zeigte keine strukturellen Veränderungen, so dass sich bei der Auswertung des gesamten Parenchyms nach dem „systematic random sampling“ Verfahren nach FEHRENBACH u. OCHS (1998, S. 446). keine signifkanten Unterschiede ergaben. b.) Und/oder die Genesung der Tiere war bereits weit vorangeschritten. Für b.) spricht, dass die infizierten Tiere im letzten Drittel des Untersuchungszeitraumes nur noch geringgradige, klinische Symptome zeigten (vgl. Infektionsstudie von BRAUER (2012)). Für die Hypothese a.) spricht, dass sich die via CT bestimmten Lungenparenchymvolumina statistisch auffällig (p=0,066) unterschieden haben (s. Anhang 2., Tabelle 7.2.1 und Abb. 7.2.6.). Die infizierten Tiere hatten geringere Lungenparenchymvolumina (Median: 566,96 cm³; Range: 539,71 cm³ bis 643,50 cm³) als die Kontrolltiere (Median: 665,56 cm³; Range: 544,90 cm³ bis 678,53 cm³) am Tag der Sektion. Lungenparenchymvolumina Bei wurde der stereologischen pathologisch Berechnung verändertes der Gewebe herausgerechnet, da eine Zuordnung zu Parenchym bzw. Non-Parenchym aufgrund der pathologischen Veränderung nicht mehr möglich war, so dass nur gesundes Parenchym miteinbezogen wurde. Infektionsbedingt wiesen die infizierten Tiere aber weniger gesundes Parenchym auf, das ausgezählt werden konnte. Dieses Ergebnis zeigt, dass durch die CT-Analysen die funktionellen Lungenparenchymvolumina und die pathologischen Veränderungen umfassender dargestellt werden konnten. Epidemiologisch bedeutsam ist die Persistenz von A.p.p. in sequestriertem Lungenparenchym über Wochen bis Monate, wodurch klinisch gesunde Trägertiere 126 Übergreifende Diskussion entstehen (JACOBSEN et al. 2005). Obwohl die Tiere zunächst stark erkrankten, welches durch den signifikanten Unterschied im klinischen Score zwischen Kontrollen und infizierten Schweinen erkennbar wurde, wiesen die infizierten Tiere gegen Ende des Untersuchungszeitraumes nur noch geringgradige, klinische Symptome auf (vgl. Infektionsstudie von BRAUER 2012). Nur die CT-Analyse der Lungenvolumina und die pathomorphologische Untersuchung stellten die pathologischen Veränderungen wie bereits erwähnt heraus. Die stereologische Bestimmung von Volumina anhand von digitalen CT-Bildern nach Infektion mit einem schweinespezifischen Erreger wurde in der Tiermedizin zum ersten Mal durchgeführt. Zur Abgleich dieser Daten wurden die Lungenvolumina für die Kontrolltiere nach PENZLIN (2005) (Lungenvolumen [l] = 0,046 x Körpergewicht [kg]1,06) berechnet. Die Mediane beider Methoden unterschieden allerdings um 296,06 cm3 (p=0,0625). Bei der Berechnung von PENZLIN (2005) wird wahrscheinlich das Non- Parenchym miteinbezogen, so dass man größere Volumina erhält. Bei den stereologischen Schätzungen dieser Arbeit spielten allerdings für die Ermittlung des funktionellen Lungenparenchymvolumens u.a. nur die Punkte auf Parenchym im CT- Bild mitein (vgl. 3.2.7). Innerhalb der Tiergruppen wurde jeweils der Rangkorrelationskoeffizienten nach SPEARMAN zwischen verschiedenen Parametern berechnet. CT und Lichtmikroskopie ergaben als unterschiedliche Methoden mit einem auf der Stereologie basiertem Quantifizierungsverfahren logische und nachvollziehbare Korrelationen bei den Kontrolltieren und bei den A.pp. infizierten Tieren, was für die Korrektheit beider Methoden in diesem Zusammenhang spricht (s. auch Anhang 2, Tabelle 7.2.2 und 3). 5.2.2 Methodenkritik und Ausblick Die Probenentnahme für die Lichtmikroskopie erfolgte an einer definierten Stelle im cranialen Bereich des rechten Lobus caudalis (s. Material und Methoden 3.2.4.). Denn aus der Literatur ist bekannt, dass am häufigsten die caudodorsalen Bereiche 127 Übergreifende Diskussion der Lungen pathologisch durch A.pp. verändert werden (LÓPEZ 2009, S. 502). Die Methodik beinhaltete folglich, dass nicht alle Lungenlappen in das Ergebnis eingingen. Diese Arbeit zielte auf die Etablierung und beispielhafte Anwendung eines spezifischen Auswertemodells, in Anlehnung an SCHMIEDL et al. (2007) und BEHRENS (2011), vgl. Material und Methoden 3.2, ab und zielte nicht auf vollständige Repräsentativität. Somit sind die Daten nicht repräsentativ für die ganze Lunge. Ausgehend von diesem Modell können aber jegliche Form von infektionsbedingten Lungenveränderungen analysiert werden. Das gewählte, stereologische Verfahren liefert dabei objektive (unbiased) Daten (HSIA et al. 2010). Zudem könnte bei zukünftigen Studien die Qualität der CT- Bilder optimiert werden. Des Weiteren ist anhand dieses Modells auch die stereologische Ermittlung des totalen Lungenvolumens möglich, man muss lediglich in den CT-Bildern aich die Punkte auf Parenchym und Non-Parenchym auszählen. Folgende Formel nach SCHNEIDER u. OCHS (2013, S. 270-271) kann dann Anwendung finden: Totales Lungenvolumen = Zählpunkte auf Lungenparenchym- und Non-Parenchym x t x a(p) (Zählpunkte Lungenparenchym- und non-parenchym, t = Schichtdicke der CT-Bilder, a(p) = Fläche pro Punkt (p)) (Formel nach SCHNEIDER u. OCHS 2013, S. 270-271). Dieses Verfahren wäre noch umfangreicher und in der humanmedizinischen Stereologie üblicher (vgl. OCHS 2006). Außerdem müsste die Berechnung von pathologisch verändertem Gewebe noch optimiert werden. In dieser Arbeit nahm man an, dass die pathologischen Strukturen vom Parenchym ausgingen. Dies konnte man allerdings nicht mehr nachvollziehen. 128 Übergreifende Diskussion 5.3 Strukturelle Charakterisierung von porzinem, perfusionsfixierten Lungenparenchym 5.3.1 Reflexion der Ergebnisse Grundsätzlich soll die Fixierung die Strukturen vor Brüchen oder Rissen beim Einbetten und beim späteren Schneiden schützen und den autolytischen Prozess aufhalten (BOZZOLA u. RUSSELL 1999, S. 19). Bei der chemischen Fixierung gibt es verschiedene Vorgehensweisen (BÜCHLZIMMERMANN et al. 2010, S. 88-89), in dieser Arbeit wurde mit der Immersionsfixierung und Perfusionsfixierung (s. Material und Methoden 3.2 und 3.3) gearbeitet. BÜCHL- ZIMMERMANN et al. (2010, S. 88) beschreiben, dass bei der Immersionsfixierung das Lungenparenchym direkt in die Fixierungslösungen gegeben wurde. Die Fixantien durchwandern das Parenchym unterschiedlich stark. Ein Teil der Fixierungslösung läuft mit der eindringenden Front mit, ein Teil wird vernetzt und ein Teil wird wieder ausgeschwemmt. Folglich kann es hierbei vermehrt zu Artefaktbildungen, wie Schrumpfung, Quellung oder Substanzflucht, kommen. Artefaktbildung kann durch die bedachte Auswahl der Fixierungslösung, der Probe per se und der Fixanzienmenge minimiert werden (BÜCHL- ZIMMERMANN et al. 2010, S. 88). Des Weiteren führen die bei der Präparation entstandenen Veränderungen im Blutdruck zu Volumenveränderungen des Gewebes und Alterationen durch das Fehlen von Sauerstoff und spontane post morten-Veränderungen treten auf (HAYAT 1981, S. 256). Für das gewöhnliche, lichtmikroskopische Arbeiten wird als Einbettmedium glycol methacrylate und nicht Paraffin empfohlen, denn bei der Einbettung mit Paraffin ist das Auftreten von Schrumpfartefakten wahrscheinlicher (FEHRENBACH u. OCHS 1998, S. 442). Ein möglicher Grund für die Wahl der Immersionsfixierung kann sein, dass die Strukturen zu klein für eine Perfusionsfixierung sind (BOZZOLA u. RUSSELL 1999, S. 25). Allerdings können auch besonders große Organe, wie Gehirn oder Niere, bei 129 Übergreifende Diskussion der Perfusionsfixierung ungleiche Fixierungsergebnisse zeigen (HAYAT 1981, S. 211). BOZZOLA u. RUSSELL (1999, S. 25) erörtern, dass für die Immersionsfixierung für Elektronenmikroskopie empfohlen wird, dass Gewebsstücke maximal 1 mm Dicke aufweisen. Ansonsten kann das Fixans Glutaraldehyd das Gewebe nicht rechtzeitig vor Einsetzen der Autolyse durchdringen. Des Weiteren dürfen die Gewebsstücke nicht austrocknen. Die eingesetzte Fixanzienmenge soll das Volumen des Gewebsstückes um das 5 bis 10fache übersteigen (BOZZOLA u. RUSSELL 1999, S. 25). Bei der Charakterisierung der A.pp. bedingten Lungenparenchymalterationen fiel bei der qualitativ-lichtmikroskopischen Untersuchung auf, dass das Lungenparenchym nach Infektion stärker kollabiert war (vgl. Abb. 7.2.9-10). Um der Fragestellung nachzugehen, in wie weit Strukturerhaltung bei porzinem Lungenparenchym fixierungsbedingt ist, wurde Lungenparenchym vom Schwein mit unterschiedlichen, chemischen Fixierungsmethoden (Immersion und Perfusion) untersucht. Bei der Perfusionsfixierung gelangt das Fixans über die Gefäße in das Parenchym. In den meisten Geweben sind die Zellen nur wenige µm von der Blutgefäßversorgung entfernt (BOZZOLA u. RUSSELL 1999, S. 26). Wichtig ist, dass das Blutgefäßsystem vor der Fixierung mit physiologischer Lösung von Blutzellen befreit wird (LANG 2013). Nach BÜCHL- ZIMMERMANN et al. (2010, S. 89) liefert diese Methode exzellente Fixierungsergebnisse. GIL (1971) erörtert, dass die Strukturerhaltung des alveolar lining layers durch Perfusionsfixierung der Lunge über die Arteria pulmonalis am besten geeignet ist. Durch den unmittelbaren Beginn der Fixierung kommt es nur zu geringgradigen Veränderungen in den zellulären Strukturen, da sich das Fixans über das Gefäßsystem und Kapillargebiet schnell im Gewebe ausbreiten kann (HAYAT 1981, S. 209). TRACHSEL et al. (2011) haben in einer humanmedizinischen Studie ein GroßtierModell der Perfusionsfixierung in einem, über Perfusionspumpen druckkonstant 130 Übergreifende Diskussion gehaltenem System („closed loop perfusion fixation“) beim Schwein etabliert. Dieses Verfahren garantiert eine qualitativ hochwertige Strukturerhaltung des Lungenparenchyms in situ (TRACHSEL et al. 2011). Der materielle Aufwand ist bei diesem Verfahren allerdings höher (vgl. TRACHSEL et al. 2011). Diese Arbeit wählte deshalb einen Kompromiss. Die Fixierungslösung wurde nach der ca. 10 minütigen hydrostatisch kontrollierten Perfusion für die spätere Immersionsfixierung der Lunge über Nacht in einem Eimer aufgefangen. Mit diesem modifizierten Verfahren wurde die Strukturerhaltung der Lunge im Vergleich zur Immersionsfixierung untersucht (vgl. 3.3. Material und Methoden). Die immersionsfixierten, lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von C. Brauer und I. Hennig-Pauka entnommen worden, aus denen u.a. die Dissertation von C. Brauer (2012) resultierte. Statistisch auffällig war die Volumendichte des Luftraumes [%] (p=0,0736). Diese lag bei den immersionsfixierten Lungen bei einem Median von 53,54 % (Range: 44,18 % bis 72,84 %) und bei den perfusionsfixierten Lungen bei einem Median von 74,03 % (Range: 63,1 % bis 78,65 %) [s. Anhang 3., Abb. 7.3.1]. Die Volumendichte der Alveolarsepten [%] war ebenfalls statistisch auffällig (p=0,0736) und zeigte bei den immersionsfixierten Lungen einen Median von 46,46 % (Range: 27,16 % bis 55,82 %) und bei den perfusionsfixierten Lungen einen Median von 25,97 % (Range: 21,35 % bis 36,91 %) [s. Anhang 3., Abb. 7.3.1]. Bei den perfusionsfixierten Lungen konnten also im Vergleich zur Immersionsfixierung tendentiell mehr Alveolarlufträume und weniger Alveolarsepten ermittelt werden, was auf eine bessere Strukturerhaltung hindeutet (in Anlehnung an BÜCHL- ZIMMERMANN et al. 2010, S. 89). Diese stereologisch ermittelten Daten bestätigen in dieser Arbeit die These der besseren Strukturerhaltung bei Perfusionsfixierung. Das hierbei gewählte Verfahren der Fixierung erwies sich als qualitativ (vgl. Abb. 7.3.3-4) und quantitativ sinnvolle Alternative zur Immersionsfixierung. Die Immersionsfixierung ist allerdings wesentlich weniger personalintensiv, kostengünstiger und leichter durchzuführen, so dass man abwägen sollte, in wie weit eine optimierte Strukturerhaltung für die entsprechende Fragestellung notwendig ist (modifiziert nach BÜCHL- ZIMMERMANN et al. 2010, S. 87). 131 Übergreifende Diskussion Für elektronenmikroskopische Studien ist eine Perfusionsfixierung jedoch dringend zu empfehlen (HAYAT 1981, S. 209). 5.3.2 Methodenkritik und Ausblick Leider stand nur eine geringe Tierzahl begründet durch das komplexe und relativ teure Verfahren zur Verfügung. Die beschriebene Perfusionsfixierung bei Schweinelungen könnte genutzt werden, um diese Art der chemischen Fixierung beim Schwein in der Tiermedizin weiter zu etablieren, wenn eine optimierte Strukturerhaltung für die Fragestellung erforderlich ist (modifiziert nach BÜCHL- ZIMMERMANN et al. 2010, S. 87). 132 Literaturverzeichnis 6. Literaturverzeichnis (bitte bedenken: das Manuskript in Kapitel 4 hat ein eigenes Literaturverzeichnis) ARCHAMBAULT, M., J. LABRIE, C. R. RIOUX, F. DUMAS, P. THIBAULT, C. ELKINS u. M. JACQUES (2003): Identification and preliminary characterization of a 75-kDa hemin- and hemoglobinbinding outer membrane protein of Actinobacillus pleuropneumoniae serotype 1. Can. J. Vet. Res. 67(4), 271–277 BAUMGÄRTNER, W., u. P. SCHMIDT (2011): Entzündung in: W. BAUMGÄRTNER u. A. D. GRUBER (Hrsg.): Allgemeine Pathologie für die Tiermedizin. Verlag Enke in MVS Medizinverlage Stuttgart, Stuttgart, S. 180-221 BEHRENS, J. (2011): Pränatale LPS-Applikation potenziert die Verzögerung der morphologischen Lungenausreifung und die pulmonale Entzündungsreaktion in transgenen ErbB4heart−/−-Mäusen. Hannover, Med. Hochsch. Hannover, Diss. BÉLANGER, M., C. BÉGIN u. M. JACQUES (1995): Lipopolysaccharides of Actinobacillus pleuropneumoniae Bind Pig Hemoglobin. Infect. Immun. 63(2), 656–662 BERNHARD, W., H. P. HAAGSMAN, T. TSCHERNIG, C. F. POETS, A. D. POSTLE, M. E. VAN EIJK u. H. VON DER HARDT (1997): Conductive Airway Surfactant: Surface-tension Function , Biochemical Composition , and Possible Alveolar Origin Am. J. Respir. Cell Mol. Biol. 17(1), 41-50 BERNHARD, W., A. GEBERT, G. VIETEN, G. A. RAU, J. M. HOHLFELD, A. D. 133 Literaturverzeichnis POSTLE u. J. FREIHORST (2001 a): Pulmonary surfactant in birds: coping with surface tension in a tubular lung Am. J. Physiol. Regul. Integr. Comp. Physiol. 281(1), 327-337 BERNHARD, W., A. D. POSTLE, G. A. RAU u. J. FREIHORST (2001 b): Pulmonary and gastric surfactants. A comparison of the effect of surface requirements on function and phospholipid composition. Comparative Biochemistry and Physiology Part A 129(1),173-182 BERNHARD, W., P. L. HASLAM u. J. FLOROS (2004): Translational Review From Birds to Humans New Concepts on Airways Relative to Alveolar Surfactant. Am. J. Respir. Cell Mol. Biol. 30(1), 6–11 BOUSQUET, J., P. CHANEZ, J. Y. LACOSTE, G. BARNÉON, N. GHAVANIAN, I. ENANDER, P. VENGE, S. AHLSTEDT, J. SIMONY-LAFONTAINE, P. GODARD, u. F. B. MICHEL (1990): Eosinophilic inflammation in asthma. N. Engl. J. Med. 323(15), 1033-1039. BOZZOLA, J. J., u. L.D. RUSSELL (1999): Electron Microscopy: Principles and Techniques for Biologists. 2. Aufl. Verlag Jones and Bartlett Publishers, Sudbury, S. 19, 25, 26 BRAUER, C., D. HOELTIG, I. HENNIG-PAUKA, M. BEYERBACH, H. GASSE, M. HEWICKER-TRAUTWEIN, G.-F. GERLACH u. K.-H. WALDMANN (2011): Computertomographie der Lunge des Schweines Ein innovativer Ansatz zur Definition des Lungengesundheitsstatus. Tierarztl. Prax. Ausg. G Grosstiere Nutztiere 39(4), 205-214. BRAUER, C., I. HENNIG-PAUKA, D. HOELTIG, F.F. BUETTNER, M. BEYERBACH, 134 Literaturverzeichnis H. GASSE, G.-F. GERLACH u. K.-H. WALDMANN (2012): Experimental Actinobacillus pleuropneumoniae challenge in swine: Comparison of computed tomographic and radiographic findings during disease. BMC Vet. R. 8, 47 BRAUER, C. (2012): Klinische Diagnostik von Lungenerkrankungen bei Schweinen anhand computertomographischer und digitaler Röntgenbefunde. Hannover, Tierärztl. Hochsch., Diss. BÜCHL- ZIMMERMANN, S., S. DÄNHARDT- PFEIFFER, M. MULISCH, B. NIXDORF- BERGWEILER, B. RIEDELSHEIMER u. U. WELSCH (2010): Präparationsmethoden in: M. MULISCH u. U. WELSCH (Hrsg.): Romeis Mikroskopische Technik. 18. Aufl. Spektrum Akademischer Verlag, Heidelberg, S. 39-179 CASAL J., E. MATEU, W. MEJÍA u. M. MARTÍN (2007): Factors associated with routine mass antimicrobial usage in fattening pig units in a high pig-density area. Vet. Res. 38(3), 481–492 CASALS, C., A. VARELA, M.L. RUANO, F. VALIÑO, J. PÉREZ-GIL, N. TORRE, E. JORGE, F. TENDILLO u. J. L. CASTILLO-OLIVARES (1998): Increase of C-reactive protein and decrease of surfactant protein A in surfactant after lung transplantation. Am. J. Respir. Crit. Care Med. 157(1), 43-49 CHRISTIE, J.D., R. M. KOTLOFF, V. N. AHYA, G. TINO, A. POCHETTINO, C. GAUGHAN, E. DEMISSIE u. S. E. KIMMEL (2005): The effect of primary graft dysfunction on survival after lung transplantation. 135 Literaturverzeichnis Am. J. Respir. Crit. Care Med. 171(11), 1312-1316 CLEMENTS, J. A. (1997): Lung surfactant: a personal perspective. Annu. Rev. Physiol. 59, 1-21 CLEMENTS, J. A., R. F. HUSTEAD, R. P. JOHNSON u. I. GRIBETZ (1961): Pulmonary surface tension and alveolar stability. J. Appl. Physiol. 16, 444-450 COCKSHUTT, A. M., u. F. POSSMAYER (1992): Metabolism of Surfactant Lipids and Proteins in the Developing Lung in: B. ROBERTSON, L. M. G. VAN GOLDE u. J. J. BATENBURG (Hrsg.): Pulmonary Surfactant: From molecular biology to clinical practice. Verlag Elsevier Science Publishers, Amsterdam, S. 339-377 COSTABEL, U. (2005): BAL beim Menschen in REINHOLD, P., U. COSTABEL, J. HAMACHER, D. THEEGARTEN u. M. ROSENBRUCH: Vergleichende Aspekte der bronchoalveolären Lavage bei Mensch und Tier. In 46. DGP-Kongress Pathophysiologie des des Arbeitskreises respiratorischen „Vergleichende Systems” Pathologie der und Deutschen Veterinärmedizinischen Gesellschaft (DVG) in Zusammenarbeit mit der Sektion „Pathophysiologie und Aerosolmedizin” der Deutschen Gesellschaft für Pneumologie (DGP) mit einem speziellen Workshop zu spezies-übergreifenden Aspekten der broncho-alveolären Lavage (BAL), 18.03.2005, S. 486 Pneumologie 59(7), 486 CROUCH, E., u. J. R. WRIGHT (2001): Surfactant proteins A and D and pulmonary host defense. 136 Literaturverzeichnis Annu. Rev. Physiol. 63, 521-554 CRUIJSEN, T., L. A. VAN LEENGOED, M. HAM-HOFFIES u. J. H. VERHEIJDEN (1995): Convalescent pigs are protected completely against infection with a homologous Actinobacillus pleuropneumoniae strain but incompletely against a heterologousserotype strain. Infect. Immun. 63(6), 2341–2343 CURRIE, W. D., S. M. VAN SCHAIK, I. VARGAS u. G. ENHORNING (1998 a): Ozone affects breathing and pulmonary surfactant function in mice. Toxicology 125(1), 21–30 CURRIE, W. D., S. VAN SCHAIK, I. VARGAS u. G. ENHORNING (1998 b): Breathing and pulmonary surfactant function in mice 24 h after ozone exposure. Eur. Respir. J. 12(2), 288–293 DELBECK, F. (1995): Erfolgskontrolle einer oralen Chlortetrazyklin-Behandlung bei lungenkranken Schweinen mittels der bronchoalveolären Lavage. Hannover, Tierärztl. Hochsch., Diss. DE PERROT, M., M. LIU, T. K. WADDELL u. S. KESHAVJEE (2003): Ischemia-reperfusion-induced lung injury. Am. J. Respir. Crit. Care Med. 167(4), 490-511 DREYFUS, A., A. SCHALLER, S. NIVOLLET, R. P. A. M. SEGERS, M. KOBISCH, L. MIELI, V. SOERENSEN, D. HUSSY, R. MISEREZ, W. ZIMMERMANN, F. INDERBITZIN u. J. FREY (2004): Use of recombinant ApxIV in serodiagnosis of Actinobacillus pleuropneumoniae infections, development and prevalidation of the ApxIV ELISA. 137 Literaturverzeichnis Vet. Microbiol. 99(3-4), 227-238 ENHORNING, G. (1977): Pulsating bubble technique for evaluating pulmonary surfactant. J. Appl. Physiol.: Respir. Environ. Exerc. Physiol. 43(2), 198–203 ENHORNING, G., u. B. A. HOLM (1993): Disruption of pulmonary surfactant's ability to maintain openness of a narrow tube. J. Appl. Physiol. (1985) 74(6), 2922-2927. ENHORNING, G., J. HOHLFELD, N. KRUG, G. LEMA u. R. C. WELLIVER (2000): Surfactant function affected by airway inflammation and cooling: possible impact on exercise-induced asthma. Eur. Respir. J. 15(3), 532–538 ENHORNING, G. (2008): Surfactant in Airway Disease. Chest 133(4), 975–980 EWERS, C., u. L. H. WIELER (2011): Pasteurellaceae in: H.-J. SELBITZ, U. TRUYEN u. P. VALENTIN-WEIGAND (Hrsg.): Tiermedizinische Mikrobiologie, Infektions-und Seuchenlehre. 9. Aufl. Verlag Enke in MVS Medizinverlage Stuttgart, Stuttgart, S. 221-246 FEHRENBACH, H., F. BRASCH, S. UHLIG, M. WEISSER, C. STAMME, A. WENDEL u. J. RICHTER (1998): Early alterations in intracellular and alveolar surfactant of the rat lung in response to endotoxin. Am. J. Respir. Crit. Care Med. 157(5 Pt 1), 1630-1639 FEHRENBACH, H., u. M. OCHS (1998): Studying lung ultrastructure 138 Literaturverzeichnis in: S. UHLIG u. A. E. TAYLOR (Hrsg.): Methods in Pulmonary Research. Verlag Birkhäuser, Basel, S. 429-454 FRAILE, L., A. ALEGRE, R. LÓPEZ-JIMÉNEZ, M. NOFRARÍAS u. J. SEGALÉS (2010): Risk factors associated with pleuritis and cranio-ventral pulmonary consolidation in slaughter-aged pigs. Vet. J. 184(3), 326–333 FRANK, R. K., M. M. CHENGAPPA, R. D. OBERST, K. J. HENNESSY, S.C. HENRY, u. B. FENWICK (1992): Pleuropneumonia Caused by Actinobacillus Pleuropneumoniae Biotype 2 in Growing and Finishing Pigs. J. Vet. Diagn. Invest. 4(3), 270–278 GANTER, M. (1996): Pneumologische Untersuchungen beim Schaf unter besonderer Berücksichtigung der bronchoalveolären Lavage. Hannover, Tierärztl. Hochsch., Habil.-Schr. GANTER, M. u. A. HENSEL (1997): Cellular variables in bronchoalveolar lavage fluids (BALF) in selected healthy pigs. Res. Vet. Sc. 63(3), 215-217 GANTER, M., S. KIPPER, H. SCHÖTTGER-WEGENER, G. BECKMANN u. S. BUNKA (1993): Pneumoniediagnostik am lebenden Schwein mit Hilfe der Lungenspülung. Berl. Münch. Tierärztl. Wochenschr. 106(10), 330-333 GERLACH, G. F., C. ANDERSON, A. A. POTTER, S. KLASHINSKY u. P. J. 139 Literaturverzeichnis WILLSON (1992): Cloning and expression of a transferrin-binding protein from Actinobacillus pleuropneumoniae. Infect. Immun. 60(3), 892–898 GIANNONI, E., T. SAWA, L. ALLEN, J. WIENER-KRONISH u. S. HAWGOOD (2006): Surfactant Proteins A and D Enhance Pulmonary Clearance of Pseudomonas aeruginosa. Am. J. Respir. Cell Mol. Biol. 34(6), 704-710 GIL, J. (1971): Ultrastructure of lung fixed under physiologically defined conditions. Arch. Intern. Med. 127(5), 896-902 GOERKE, J. u. J. A. CLEMENTS (1986): Alveolar surface tension and lung surfactant in: A. P. FISHMAN (Hrsg. Section), P. T. MACKLEM u. J. MEAD (Hrsg. Volume), S. R. GEIGER (Hrsg. Executive): Handbook of Physiology, Section 3: The Respiratory System. Volume III. Mechanics of breathing, Part 1. American Physiological Society, Bethesda, Maryland, S. 247-261 GOTTSCHALK, M. (2012): Actinobacillosis in: J. J. ZIMMERMANN, L. A. KARRIKER, A. RAMIREZ, K. J. SCHWARTZ u. G. W. STEVENSON (Hrsg.): Diseases of Swine. 10. Aufl. Verlag Wiley-Blackwell bzw. John Wiley & Sons Ltd., Chichester, West Sussex, UK, S. 653-669 GRIESE, M. (1999): Pulmonary surfactant in health and human lung disease: state of the art. Eur. Respir. J. 13(6), 1455-1476 140 Literaturverzeichnis GROSS, N. J. u. K. R. NARINE (1989 a): Surfactant subtypes in mice: characterization and quantitation. J. Appl. Physiol. (1985) 66(1), 342-349 GROSS, N. J. u. K. R. NARINE (1989 b): Surfactant subtypes in mice: metabolic relationships and conversion in vitro. J. Appl. Physiol. (1985) 67 (1), 414-421 GROSS, N.J., M. KELLAM, J. YOUNG, S. KRISHNASAMY u. R. DHAND (2000): Separation of alveolar surfactant into subtypes. A comparison of methods. Am. J. Respir. Crit. Care Med. 162(2 Pt 1), 617-622 GROSSE-BEILAGE, E., H. NATHUES, B. GRUMMER, J. HARTUNG, J. KAMPHUES, M. KIETZMANN, J. ROHDE, B. SPINDLER u. H. WEISSENBÖCK (2013): Diagnostik, Prophylaxe und Therapie von Atemwegserkrankungen in Schweinebeständen in: E. GROSSE-BEILAGE u. M. WENDT (Hrsg.): Diagnostik und Gesundheitsmanagement im Schweinebestand. Band 1, Verlag Eugen Ullmer, Stuttgart, S. 200-270 HAAGSMANN, H.P, A. HOGENKAMP, M. VAN EIJK u. E. J. VELDHUIZEN (2008): Surfactant Collectins and Innate Immunity. Neonatology 93(4), 288-294 HAMM, H., C. KROEGEL u. J. HOHLFELD (1996): Surfactant: a review of its functions and relevance in adult respiratory disorders. Respiratory Medicine 90(5), 251–270 HANNAN, P. C. T., B. S. BHOGAL u. J. P. FISH (1982): Tylosin tartrate and tiamulin effects on experimental piglet pneumonia induced with 141 Literaturverzeichnis pneumonic pig lung homogenate containing mycoplasmas, bacteria and viruses, Res. Vet. Sci. 33, 76-88 HAWGOOD, S., u. F. R. POULAIN (2001): The pulmonary collectins and surfactant metabolism. Annu. Rev. Physiol. 63, 495-519 HAYAT, M. A. (1981): Fixation for Electron Microscopy. Verlag Academic Press Inc., New York, London, S. 209, 211, 256 HEINRITZI, K. (2006): Pneumonie in: K. HEINRITZI, H. R. GINDELE, G. REINER u. U. SCHNURRBUSCH: Schweinekrankheiten. Verlag Eugen Ulmer, Stuttgart, S. 137-146 HENNIG-PAUKA, I., I. JACOBSEN, F. BLECHA, K.- H.WALDMANN u. G. F. GERLACH (2006): Differential proteomic analysis reveals increased cathelicidin expression in porcine bronchoalveolar lavage fluid after an Actinobacillus pleuropneumoniae infection. Vet. Res. 37(1), 75–87 HENNIG-PAUKA, I., S. BREMERICH, H. NIENHOFF, C. SCHRÖDER, M. GANTER, F. BLECHA, K.- H. WALDMANN u. G.- F. GERLACH (2007): Comparison of three common methods of lung lavage in healthy pigs. J. Vet. Med. A Physiol. Pathol. Clin. Med. 54(8), 428–433 HENNIG-PAUKA, I. (2007): Respiratory disease markers in porcine bronchoalveolar fluid. Hannover, Tierärztl. Hochsch., Habil.-Schr. 142 Literaturverzeichnis HENNIG-PAUKA, I., R. KOCH, D. HOELTIG, G.-F. GERLACH, K.-H. WALDMANN, F. BLECHA, C. BRAUER u. H. GASSE (2012): PR-39, a porcine host defence peptide, is prominent in mucosa and lymphatic tissue of the respiratory tract in healthy pigs and pigs infected with Actinobacillus pleuropneumoniae. BMC Research Notes 5, 539 HERBEIN, J.F., u. J. R. WRIGHT (2001): Enhanced clearance of surfactant protein D during LPS-induced acute inflammation in rat lung. Am. J. Physiol. Lung Cell. Mol. Physiol. 281(1), L268-277 HOHLFELD, J. M., E. TIRYAKI, H. HAMM, H. G. HOYMANN, N. KRUG, A. HAVERICH u. H. FABEL (1998): Pulmonary Surfactant Activity Is Impaired in Lung Transplant Recipients. Am. J. Respir. Crit. Care Med. 158(3), 706–712 HOHLFELD, J. M., K. AHLF, G. ENHORNING, K. BALKE, V. J. ERPENBECK, J. PETSCHALLIES, H. G. HOYMANN, H. FABEL u. N. KRUG (1999 a): Dysfunction of pulmonary surfactant in asthmatics after segmental allergen challenge. Am.J. Respir. Crit. Care Med. 159(6), 1803–1809 HOHLFELD, J. M., M. STRÜBER, K. AHLF, M. M. HOEPER, S. FRAUND, N. KRUG, G. WARNECKE, W. HARRINGER, A. HAVERICH u. H. FABEL (1999 b): Exogenous surfactant improves survival and surfactant function in ischaemia ± reperfusion injury in minipigs. Eur. Respir. J. 13(5), 1037-1043 HOHLFELD, J. M., A. SCHMIEDL, V. J. ERPENBECK, P. VENGE u. N. KRUG 143 Literaturverzeichnis (2004): Eosinophil cationic protein alters pulmonary surfactant structure and function in asthma. J. Allergy Clin. Immunol. 113(3), 496-502. HÖLTIG, D., I. HENNIG-PAUKA, M. BEYERBACH, K. THIES, T. REHM, G.- F. GERLACH u. K.- H. WALDMANN (2008): Vergleich der diagnostischen Aussagekraft klinischer, röntgenologischer und sonographischer Befunde bei der experimentellen Infektion des Schweines mit Actinobacillus pleuropneumoniae. Berl. Münch. Tierärztl. Wschr. 121(11-12), 422–431 HÖLTIG, D. (2009): Vergleichende klinische Untersuchungen an Ferkeln der deutschen Landrasse, Hampshire, Pietrain und deutsches Edelschwein hinsichtlich unterschiedlicher Erkrankungsgrade nach einer Aerosolinfektion mit Actinobacillus pleuropneumoniae. Hannover, Tierärztl. Hochsch., Diss. HOELTIG, D., I. HENNIG-PAUKA, K. THIES, T. REHM, M. BEYERBACH, K. STRUTZBERG –MINDER, G.- F. GERLACH, K.-H. WALDMANN u. FUGATOCONSORTIUM IRAS (2009): A novel Respiratory Health Score (RHS) supports a role of acute lung damage and pig breed in the course of an Actinobacillus pleuropneumoniae infection. BMC Vet. Res. 5, 14 HOLM, B. A., L. KEICHER, M. Y. LIU, J. SOKOLOWSKI u. G. ENHORNING (1991): Inhibition of pulmonary surfactant function by phospholipases. J. Appl. Physiol. (1985) 71(1), 317-321 HOOK, G.E., u. L. B. GILMORE (1982): 144 Literaturverzeichnis Hydrolases of pulmonary lysosomes and lamellar bodies. J. Biol. Chem. 257(15), 9211-9220. HOWARD, C. V., u. M. G. REED (2010): Unbiased Stereology: Three-dimensional Measurement in Microscopy. 2. Aufl. Verlag QTP Publications, Liverpool, Coleraine, S. 3, 5, 7, 19-29, 57 HSIA, C. C. W., D. M. HYDE, M. OCHS, E. R. WEIBEL u. ATS/ERS Joint Task Force on Quantitative Assessment of Lung Structure (2010): An Official Research Policy Statement of the American Thoracic Society/European Respiratory Society: Standards for Quantitative Assessment of Lung Structure. Am. J. Respir. Crit. Care Med. 181(4), 394–418 INCI, I., S. ARNI, C. ACEVEDO, W. JUNGRAITHMAYR, D. INCI, P. VOGT u. W. WEDER (2011): Surfactant alterations following donation after cardiac death donor lungs. Transplant. Int. 24(1), 78–84 JACKSON, P. G. G., u. P. D. COCKCROFT (2007): Handbook of Pig Medicine. Verlag Saunders Elsevier, Edinburgh, London, New York, Oxford, Philadelphia, St. Louis, Sydney, Toronto, S. 70 JACOBSEN, I., I. HENNIG-PAUKA, N. BALTES, M. TROST u. G.- F. GERLACH (2005): Enzymes involved in anaerobic respiration appear to play a role in Actinobacillus pleuropneumoniae virulence. Infec. Immun. 73(1), 226–234 JARJOUR, N.N., u. G. ENHORNING (1999): Antigen-induced airway inflammation in atopic subjects generates dysfunction of 145 Literaturverzeichnis pulmonary surfactant. Am. J. Respir. Crit. Care Med. 160(1):336-341 JOBE, A. H., u. E. D. RIDER (1992): Catabolism and Recycling of Surfactant in: B. ROBERTSON, L. M. G. VAN GOLDE & J. J. BATENBURG (Hrsg.): Pulmonary Surfactant: From molecular biology to clinical practice. Verlag Elsevier Science Publishers, Amsterdam, S. 313-337 KEOUGH, K. M., C. S. PARSONS, P. T. PHANG u. M. G. TWEEDDALE (1988): Interactions between plasma proteins and pulmonary surfactant: surface balance studies. Can. J. Physiol. Pharmacol. 66(9), 1166-1173 KIPPER, S. (1990): Bronchoskopie bei Schweinen sowie mikrobiologische und zytologische Untersuchungen der bronchoalveolären Spülflüssigkeiten. Hannover, Tierärztl. Hochsch., Diss. KNUDSEN, L., H. WAIZY, H. FEHRENBACH, J. RICHTER, T. WAHLERS, T. WITTWER u. M. OCHS (2011): Ultrastructural changes of the intracellular surfactant pool in a rat model of lung transplantation-related events. Respir. Res. 12, 79 KÖNIG, H.E. u. H.-G. LIEBICH (2012): Atmungsapparat in: H.E. KÖNIG u. H.-G. LIEBICH: Anatomie der Haussäugetiere. 5. Aufl. Verlag Schattauer, Stuttgart, Deutschland, S. 367-388 KREIENBROCK, L., u. S. SCHACH (2005): Epidemiologische Methoden. 4. Aufl. Verlag Elsevier, Spektrum Akademischer Verlag, München, S. 88-90. 146 Literaturverzeichnis LANG, G. (2013): Histotechnik Praxislehrbuch für die Biomedizinische Analytik. 2. Aufl. Springer-Verlag, Wien, S. 49 LEINER, G., B. FRANZ, K. STRUTZBERG u. G.- F. GERLACH (1999): A novel enzymelinked immunosorbent assay using the recombinant Actinobacillus pleuropneumoniae ApxII antigen for diagnosis of pleuropneumonia in pig herds. Clin. Diagn. Lab. Immunol. 6(4), 630-632 LEVINE, A M., K. E. KURAK, M. D. BRUNO, J. M. STARK, J. A. WHITSETT u. T. R. KORFHAGEN (1998): Surfactant protein-A-deficient mice are susceptible to Pseudomonas aeruginosa infection. Am. J. Respir. Cell Mol. Biol. 19(4), 700–708 LEWIS J. F., R. VELDHUIZEN, F. POSSMAYER, W. SIBBALD, J. WHITSETT, R. QANBAR u. L. MCCAIG (1994): Altered alveolar surfactant is an early marker of acute lung injury in septic adult sheep. Am. J. Respir. Crit. Care Med. 150(1), 123-130 LIAU D. F., C. R. BARRETT, A. L. LOOMIS BELL u. S. F. RYAN (1987): Functional abnormalities of lung surfactant in experimental acute alveolar injury in the dog. Am. Rev. Respir. Dis. 136(2), 395-401 LIEBICH, H.-G. u. G. ZENGERLING (2010): Atmungsapparat in: LIEBICH, H.-G.: Funktionelle Histologie der Haussäugetiere und Vögel. Lehrbuch und Farbatlas für Studium und Praxis. 5. Aufl. Verlag Schattauer, Stuttgart, Deutschland, S. 255-274 147 Literaturverzeichnis LÓPEZ, A. (2009): Atmungsorgane in: M. MCGAVIN u. J. ZACHARY, J. P. TEIFKE, C. V. LÖHR, R. KLOPFLEISCH u. R. E. MARSCHANG (Hrsg.): Pathologie der Haustiere. Allgemeine, spezielle und funktionelle Veterinärpathologie. Verlag Elsevier, München, S. 433-521 MACINNES, J. I., M. GOTTSCHALK, A. G. LONE, D. S. METCALF, S. OJHA, T. ROSENDAL, S. B. WATSON u. R. M. FRIENDSHIP (2008): Prevalence of Actinobacillus pleuropneumoniae, Actinobacillus suis, Haemophilus parasuis, Pasteurella multocida, and Streptococcus suis in representative Ontario swine herds. Can. J. Vet. Res. 72(3), 242–248 MAITRA, G., K. INCHLEY, R. J. NOVICK, R. A. W. VELDHUIZEN, J. F. LEWIS u. F. POSSMAYER (2002): Acute lung injury and lung transplantation influence in vitro subtype conversion of pulmonary surfactant. Am. J. Physiol. Lung Cell. Mol. Physiol. 282(1), L67-74 MEIER-STIEGEN, A. S. (2004): Lokalisierung und Charakterisierung von Zellkontaktproteinen im olfaktorischen Epithel. Medizinische Fakultät der Bayerischen Julius-Maximilians-Universität zu Würzburg, Diss. MORITZ, A., I. SCHWENDENWEIN u. W. KRAFT (2014): Hämatologie In: A. MORITZ (Hrsg.): Klinische Labordiagnostik in der Tiermedizin. 7. Aufl. Verlag Schattauer, Stuttgart, S. 79-159 148 Literaturverzeichnis MOTTAGHIAN, J. (1999): Einflussfaktoren auf die Surfactantanalyse im Pulsating Bubble Surfactometer am Beispiel verschiedener kommerzieller und nativer Surfactants. Hannover, Med. Hochsch. Hannover, Diss. MÜHLFELD, C., I.- M. SCHAEFER, L. BECKER, C. BUSSINGER, M. VOLLROTH, A. BOSCH, R. NAGIB, N. MADERSHAHIAN, J. RICHTER, T. WAHLERS, T. WITTWER, u. M. OCHS (2009): Pre-ischaemic exogenous surfactant reduces pulmonary injury in rat ischaemia/reperfusion. Eur. Respir. J. 33(3), 625–633 MÜHLFELD, C., u. M. OCHS (2010): Functional Aspects of Lung Structure as Related to Interaction with Particles in P. GEHR, C. MÜHLFELD, B. ROTHEN-RUTISHAUSER u. F. BLANK (Hrsg.): Particle-Lung Interactions. Lung Biology in Health and Disease, Volume 241, executive editor: CLAUDE LEFANT. 2. Auflage, Informa Healthcare USA, New York, London. S. 1-16 MÜHLFELD, C., L. BECKER, C. BUSSINGER, M. VOLLROTH, R. NAGIB, I.- M. SCHAEFER, L. KNUDSEN, J. RICHTER, N. MADERSHAHIAN, T. WAHLERS, T. WITTWER u. M. OCHS (2010): Exogenous surfactant in ischemia/reperfusion: effects on endogenous surfactant pools. J. Heart Lung Transplant. 29(3), 327–34 MÜHLFELD, C., L. KNUDSEN u. M. OCHS (2013): Stereology and Morphometry of Lung Tissue in: D. J. TAATJES und J. ROTH (Hrsg.): Cell Imaging Techniques: Methods and Protocolls, Methods in Molecular Biology. Vol. 931, Chapter 18, 149 Literaturverzeichnis 2. Aufl., Springer Science+ Business Media Press, New York, S. 367-390 NERBAS, E. (2008): Aktualisierung von Blutparametern beim Schwein. Hannover, Tierärztl. Hochsch., Diss. NIENHOFF, H. (1998): Wirksamkeitsprüfung pneumoniekranken einer Schweinen langwirkenden unter Ceftiofur- Verwendung der Verbindung an Pulsoxymetrie und bronchoalveolärer Lavage. Hannover, Tierärztl. Hochsch., Diss. OCHS, M., I. NENADIC, A. FEHRENBACH, J. M. ALBES, T. WAHLERS, J. RICHTER u. H. FEHRENBACH (1999): Ultrastructural alterations in intraalveolar surfactant subtypes after experimental ischemia and reperfusion. Am. J. Respir. Crit. Care Med. 160(2), 718-724 OCHS, M., J. R. NYENGAARD, A. JUNG, L. KNUDSEN, M. VOIGT, T. WAHLERS, J. RICHTER u. H. J. G. GUNDERSEN (2004): The number of alveoli in the human lung. Am. J. Respir. Crit. Care Med. 169(1), 120-124 OCHS, M. (2006): A brief update on lung stereology. J. Microsc. 222 (Pt 3), 188–200 OCHS, M., M. SCHÜTTLER, G. STICHTENOTH u. E. HERTING (2006): Morphological alterations of exogenous surfactant inhibited by meconium can be prevented by dextran. Respir. Res. 7, 1-8 150 Literaturverzeichnis OCHS, M. (2010): The Closer we Look the more we See? Quantitative Microscopic Analysis of the Pulmonary Surfactant System. Cell. Physiol. Biochem. 25(1), 27–40 OHLER, F. (2010): Rekombinanter Keratinozytenwachstumsfaktor als Alternative zu Glukokortikoiden: Spezifische Effekte auf Surfactantstatus und Leberphospholipide in neugeborenen Ratten. Medizinische Fakultät der Eberhard Karls Universität zu Tübingen, Diss. OPRIESSNIG, T., L. G. GIMÉNEZ-LIROLA u. P. G. HALBUR (2011): Polymicrobial respiratory disease in pigs. Animal Health Research Reviews 12(2), 133–148 OULTON, M., E. EDWARDS u. K. HANDA (1999): Convertase activity in alveolar surfactant and lamellar bodies in fetal, newborn, and adult rabbits. J. Appl. Physiol. (1985) 86 (1), 71-77 PAMIGIANI, S., u. E. SOLARI (2003): The era of pulmonary surfactant from Laplace to nowadays. ACTA BIO MEDICA 74(2), 69-75 PARK, J., C.- W. BAE u. Y.- M. CHOI (1998): In vitro inhibition of biophysical surface properties and change in ultrastructures of exogenous pulmonary surfactant by albumin or fibrinogen. J. Korean Med. Sci. 13(2),123-130 PENRITH, M.- L., u. M. M. HENTON (2004): Porcine Pleuropneumonia, Synonym: 151 Literaturverzeichnis Actinobacillus pleuroneumoniae infection. In: J. COETZER u. R. C. TUSTIN (Hrsg.): Infectious Diseases of Livestock. 2nd edition, Volume three, Oxford University Press, Cape Town, Southern Africa, S. 1661-1669 PENZLIN, H. (2005): Versorgung mit Sauerstoff (Atmung) in: H. PENZLIN, als Coautoren bestimmter Kapitel: G. BEINBRECH, H. BIRKENBEIL, H. BLECKMANN, M: ECKERT, S. FRINGS, M. HENNIG, J-P. HILDBRANDT, C. JESSEN, M. STENGL u. A. STUMPNER: Lehrbuch der Tierphysiologie. 7. Aufl. Spektrum Akademischer Verlag, Elsevier, München, S. 251-311 POSTLE, A. D., E. L. HEELEY u. D. C. WILTON (2001): A comparison of the molecular species compositions of mammalian lung surfactant phospholipids. Comparative Biochemistry and Physiology Part A 129(1), 65-73 QUINN, P. J., B. K. MARKEY, M. E. CARTER, W. J. DONNELLY u. F. C. LEONARD (2002): Veterinary Microbiology and Microbial Disease. Verlag Blackwell Science, Oxford, London, Edinburgh, Malden, Victoria, Paris. S. 133 RAU, G. A, G. VIETEN, J. J. HAITSMA, J. FREIHORST, C. POETS, B. M. URE u. W. BERNHARD, W. (2004): Surfactant in newborn compared with adolescent pigs: adaptation to neonatal respiration. Am. J. Respir. Cell Mol. Biol. 30(5), 694–701 REINER, G., N. BERTSCH, D. HOELTIG, M. SELKE, H. WILLEMS, G.- F. GERLACH, B. TUEMMLER, I. PROBST, R. HERWIG, M. DRUNGOWSKI, K.- H. WALDMANN (2014): 152 Literaturverzeichnis Identification of QTL affecting resistance/susceptibility to acute Actinbacillus pleuropneumoniae infection in swine. Mamm. Genome 25, 180-191 RIEDELSHEIMER, B., u. U. WELSCH (2010): Färbungen in: M. MULISCH u. U. WELSCH (Hrsg.): Romeis Mikroskopische Technik. 18. Aufl. Spektrum Akademischer Verlag, Heidelberg, S. 181-297 ROHMANN, K., T. TSCHERNIG, R. PABST, T. GOLDMANN u. D. DRÖMANN (2011): Innate immunity in the human lung: pathogen recognition and lung disease. Cell Tissue Res. 343(1), 167–174 ROGERS, C.S., W. M. ABRAHAM, K. A. BROGDEN, J. F. ENGELHARDT, J. T. FISHER, P. B. JR. MCCRAY, G. MCLENNAN, D. K. MEYERHOLZ, E. NAMATI, L. S. OSTEDGAARD, R. S. PRATHER, J. R. SABATER, D. A. STOLTZ, J. ZABNER, u. M. J. WELSH (2008): The porcine lung as a potential model for cystic fibrosis. Am. J. Physiol. Lung Cell. Mol. Physiol. 295(2), 240-263 ROSE, M., u. D. A. LINDBERG (1968): Effect of pulmonary pathogens on surfactant. Dis. Chest 53(5), 541-544. SACHS, L., u. J. HEDDERICH (2009): Angewandte Statistik. Methodensammlung mit R. 13. Aufl., Springer-Verlag, Berlin, Heidelberg, S. 451-458, 464-468 SADOVSKI, J., T. KUCHENBUCH, C. RUPPERT, A. HIRSCHBURGER, W. PADBERG, A. GÜNTHER, J. M. FEHRENBACH, M. HOHLFELD, H. FEHRENBACH u. V. GRAU (2008): Keratinocyte growth factor prevents intra-alveolar oedema in experimental lung 153 Literaturverzeichnis isografts. Eur. Respir. J. 31(1), 21–28 SANFORD, S. E., u. G. K. A. JOSEPHSON (1981): Porcine Haemophilus Pleuropneumonia Epizootic in Southwestern Ontario: Clinical, Microbiological, Pathological and Some Epidemiological Findings. Can. J. Comp. Med. 45(1), 2-7 SCHERF, C. (2010): Untersuchungen zum Einfluss einer Maedi-Infektion auf die Funktion und die Morphologie der Lungen verschiedener Schafrassen. Hannover, Tierärztl. Hochsch., Diss. SCHMIEDL, A., H.- G. HOYMANN, M. OCHS, A. MENKE, A. FEHRENBACH, N. KRUG, T. TSCHERNIG u. J. M. HOHLFELD (2003): Increase of inactive intra-alveolar surfactant subtypes in lungs of asthmatic Brown Norway rats. Virchows Arch. 442(1), 56–65 SCHMIEDL, A., N. KRUG u. J. M. HOHLFELD (2004): Influence of plasma and inflammatory proteins on the ultrastructure of exogenous surfactant. Journal of Electron Microscopy 53(4), 407–416 SCHMIEDL, A., M. OCHS, C. MÜHLFELD, G. JOHNEN u. F. BRASCH (2005): Distribution of surfactant proteins in type II pneumocytes of newborn, 14-day old, and adult rats: an immunoelectron microscopic and stereological study. Histochem. Cell. Biol. 124(6), 465-476 SCHMIEDL, A. (2007): Das Surfactantsystem der Lunge in der postnatalen Entwicklung der Ratte. 154 Literaturverzeichnis Hannover, Med. Hochsch. Hannover, Diss. SCHMIEDL, A., G. VIETEN, C. MÜHLFELD u. W. BERNHARD (2007): Distribution of intracellular and secreted surfactant during postnatal rat lung development. Pediatr. Pulmonol. 42(6), 548-562 SCHNAPPER A., S. BECKER, M. AVSAR, G. WARNECKE u. M. OCHS (2012): How to evaluate cellular and subcellular effects of ex vivo lung perfusion quantitatively in a large animal model? Technical procedures to obtain high quality samples for stereological analysis. 29. Arbeitstagung der Anatomischen Gesellschaft, Würzburg, 26.-28.9.2012, S. 69 SCHNEIDER, J. P., u. M. OCHS (2013): Stereology of the lung in: P. M. CONN (Hrsg.): Laboratory Methods in Cell Biology. Imaging. Methods in Cell Biology. Volume 113, Academic Press, London, Amsterdam, Wlatham, San Diego, S. 257-294 SEBUNYA, T. N., J. R. SAUNDERS u. A. D. OSBORNE (1983): Dose response relationship of Haemophilus pleuropneumoniae aerosols in pigs. Can. J. Comp. Med. 47(1), 54–56 SEEGER, W., H. LEPPER, H. R. D. WOLF u. H. NEUHOF (1985): Alteration of alveolar surfactant function after exposure to oxidative stress and to oxygenated and native arachidonic acid in vitro. Biochim. Biophys. Acta. 835(1), 58-67 SEEGER, W., C. GRUBE, A. GÜNTHER u. R. SCHMIDT (1993 a): Surfactant inhibition by plasma proteins: differential sensitivity of various surfactant preparations. 155 Literaturverzeichnis Eur. Respir. J. 6(7), 971-977 SEEGER, W., A. GÜNTHER, H. D. WALMRATH, F. GRIMMINGER u. H. G. LASCH (1993 b): Alveolar surfactant and adult respiratory distress syndrome. Pathogenetic role and therapeutic prospects. Clin. Investig. 71(3), 177-190 SEEGER, W., A. ELSSNER, A. GÜNTHER, H.- J. KRÄMER u. H. O. KALINOWSKI (1993 c): Lung surfactant phospholipids associate with polymerizing fibrin: loss of surface activity. Am. J. Respir. Cell. Mol. Biol. 9(2), 213-220 SHOPE, R.E. (1964): Porcine contagious pleuropneumonia, I., Experimental transmission, etiology, pathology. J. Exp. Med. 119, 357-368 SOERENSEN, C. M., U. HOLMSKOV, B. AALBAEK, M. BOYE, P. M. HEEGAARD u. O. L. NIELSEN (2005): Pulmonary infections in swine induce altered porcine surfactant protein D expression and localization to dendritic cells in bronchial-associated lymphoid tissue. Immunology 115(4), 526–535 SPRAGG, R. G., P. J. PONGANIS, J. J. MARSH, G. A. RAU, R. G. SPRAGG, P. J. PONGANIS, J. J. MARSH u. W. BERNHARD (2004): Surfactant from diving aquatic mammals. J. Appl. Physiol. (1985) 96(5), 1626–1632 STATISTISCHES BUNDESAMT (2013): 156 Literaturverzeichnis Datenangebot- Themen- Land- und Forstwirtschaft Fischerei- Viehbestand und tierische Erzeugung- Schlachtungs-und Schlachtgewichtstatistik Schwein für 2011, gewerbliche Schlachtungen Tiere in- und ausländischer Herkunft und Hausschlachtungen, [Internet: URL: https://www-genesis.destatis.de/genesis/online] GENESIS-Online Datenbank, Ergebnis - 41331-0001, Statistisches Bundesamt, 04.01.2013 STRAW, B. E., N. J. MACLACHLAN, W. T. CORBETT, P. B. CARTER u. H. M. SCHEY (1985): Comparison of tissue reactions produced by Haemophilus pleuropneumoniae vaccines made with six different adjuvants in swine. Can. J. of Comp. Med 49(2), 149–151 SUTNICK, A. I., u. L. A. SOLOFF (1964): PULMONARY SURFACTANT AND ATELECTASIS. Anesthesiology 25, 676-681. TAHVANAINEN J. u. M. HALLMAN (1987): Surfactant abnormality after endotoxin-induced lung injury in guinea-pigs. Eur. J. Respir. Dis. 71(4), 250-258 Zitiert nach H. HAMM (1996) THACKER, E.L., P. G. HALBUR, R. F. ROSS, R. THANAWONGNUWECH u. B. J. THACKER (1999): Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. J. Clin. Microbiol. 37(3), 620-627. TRACHSEL, S., K. PURKABIRI, O. LOUP, H. JENNI, B. EBERLE, M. OCHS u. A. 157 Literaturverzeichnis KADNER (2011): High-quality lung fixation by controlled closed loop perfusion for stereological analysis in a large animal model. J. Surg. Res. 166(2), 97–102 TSCHANZ, S. A., P. H. BURRI u. E. R. WEIBEL (2011): A simple tool for stereological assessment of digital images: the STEPanizer. Journal of Microscopy 243(1), 47–59 UEDA, T., M. IKEGAMI u. A. JOBE (1994): Surfactant subtypes. In vitro conversion, in vivofunction, and effects of serum proteins. Am. J. Respir. Crit. Care Med.149, 1254-1259 VAN IWAARDEN, F., B. WELMERS, J. VERHOEF, H. P. HAAGSMAN, L. M. VAN GOLDE (1990): Pulmonary surfactant protein A enhances the host-defense mechanism of rat alveolar macrophages. Am. J. Respir. Cell. Mol. Biol. 2(1), 91-98 VAN IWAARDEN, J. F., J. A. VAN STRIJP, M. J. EBSKAMP, A. C. WELMERS, J. VERHOEF u. L. M. VAN GOLDE (1991): Surfactant protein A is opsonin in phagocytosis of herpes simplex virus type 1 by rat alveolar macrophages. Am. J. Physiol. 261(2 Pt 1), L204-209 VAN IWAARDEN, J. F. (1992): Surfactant and the Pulmonary Defense System In: B. ROBERTSON, L. M. G. VAN GOLDE u. J. J. BATENBURG (Hrsg.): Pulmonary Surfactant: From molecular biology to clinical practice. Verlag Elsevier Science Publishers, Amsterdam, S. 215-227 158 Literaturverzeichnis VAN IWAARDEN, J. F., J. A. G. VAN STRIJP, H. VISSER, H. P. HAAGSMAN, J. VERHOEF, L. M. G. VAN GOLDE (1992 a): Binding of surfactant protein A (SP-A) to herpes simplex virus type 1-infected cells is mediated by the carbohydrate moiety of SP-A. J. Biol. Chem. 267(35), 25039-25043 VAN IWAARDEN, J.F., H. SHIMIZU, P. H. M. VAN GOLDE, D. R. VOELKER u. L. M. VAN GOLDE (1992 b): Rat surfactant protein D enhances the production of oxygen radicals by rat alveolar macrophages. Biochem. J. 286(Pt 1), 5-8 VAN SCHAIK, S. M., I. VARGAS, R. C. WELLIVER u. G. ENHORNING (1997): Surfactant Dysfunction Develops in BALB/c Mice Infected with Respiratory Syncytial Virus. Pediatric Research 42(2), 169–173 VELDHUIZEN, R. A. W., L. A. MCCAIG, T. AKINO u. J. F. LEWIS (1995): Pulmonary surfactant subfractions in patients with the acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med. 152(6 Pt 1), 1867-1871 VELDHUIZEN, R., K. NAG, S. ORGEIG u. F. POSSMAYER (1998): The role of lipids in pulmonary surfactant. Biochim. Biophys. Acta. 1408(2-3), 90-108 VOORHOUT, W. F., T. VEENENDAAL, H. P. HAAGSMAN, A. J. VERKLEIJ, L. M. G. VAN GOLDE u. H. J. GEUZE (1991): Surfactant protein A is localized at the corners of the pulmonary tubular myelin lattice. J. Histochem. Cytochem. 39(10), 1331-1336 159 Literaturverzeichnis WAIBL, H. (1999): Atmungsapparat in: J. FREWEIN, H. GASSE, R. LEISER, H. ROOS, H. THOMÉ, B. VOLLMERHAUS u. H. WAIBL (Hrsg.): Lehrbuch der Anatomie der Haustiere. 8. Aufl. Band II Eingeweide. Verlag Parey, Berlin, Wien, S. 223-307 WALMRATH, D., K. MAYER u. W. SEEGER (2008): Lungenödem und akutes respiratorisches Distress-Syndrom (ARDS) in: H. MATTHYS und W. SEEGER (Hrsg.): Klinische Pneumologie. 4. überarbeitete und aktualisierte Auflage, Springer Medizin Verlag, Heidelberg, S. 434-461 WEAVER, T. E., C.-L. NA u. M. STAHLMAN (2002): Biogenesis of lamellar bodies, lysosome-related organelles involved in storage and secretion of pulmonary surfactant. Sem. Cell Dev. Biol. 13(4), 263–270 WEIBEL, E. R. (1979): Stereological methods. Vol. 1 Practical Methods for Biological Morphometry. Acedemic Press, London, S. 109-121 WEIBEL, E. R., C. C. W. HSIA u. M. OCHS (2007): How much is there really? Why stereology is essential in lung morphometry. J. Appl. Physiol. 102(1), 459–467 WEISS, E., u. R. RUDOLPH (2007): Atmungsorgane in: E. DAHME u. E. WEISS (Hrsg.): Grundriss der speziellen pathologischen Anatomie der Haussäugetiere. 6. völlig neu bearbeitete Aufl. Verlag Enke in MVS Medizinverlage Stuttgart, Stuttgart, 160 Literaturverzeichnis S. 49-81 WELSCH, U., u. T. DELLER (2010): Lehrbuch Histologie. 3. Aufl. Verlag Elsevier, München, S. 281 WIRKES, A., K. JUNG, M. OCHS u. C. MÜHLFELD (2010): Allometry of the mammalian intracellular pulmonary surfactant system. J. Appl. Physiol. 109(6), 1662–1669 WHITE, M. (2011 a): Porcine respiratory disease complex (PRDC): Part 2: Non-infectious factors. Livestock 16(3), 44-46 WHITE, M. (2011 b): Porcine respiratory disease complex (PRDC). Livestock 16(2), 40-42 WRIGHT, J. R. (1997): Immunomodulatory Functions of Surfactant. Physiol. Rev. 77(4), 931-962 WRIGHT, J. R. (2004): Host defense functions of pulmonary surfactant. Biology of the Neonate 85(4), 326–332 WRIGHT, J. R. (2005): Immunoregulatory functions of surfactant proteins. Nat. Rev. Immunol. 5(1), 58-68 WRIGHT, T.W., R. H. NOTTER, Z. WANG, A. G. HARMSEN u. F. GIGLIOTTI (2001): 161 Literaturverzeichnis Pulmonary inflammation disrupts surfactant function during Pneumocystis carinii pneumonia. Infect. Immun. 69(2), 758-64 WU, H., A. KUZMENKO, S. WAN, L. SCHAFFER, A. WEISS, J. H. FISHER, K. S. KIM u. F. X. MCCORMACK (2003): Surfactant proteins A and D inhibit the growth of Gram-negative bacteria by increasing membrane permeability. J. Clin. Invest. 111(10), 1589-1602. ZENG, X., K. E. YUTZEY u. J. A. WHITSETT (1998): Thyroid transcription factor-1, hepatocyte nuclear factor-3beta and surfactant protein A and B in the developing chick lung J. Anat. 193 (Pt 3), 399-408. ZIMMERMANN, W., u. H. PLONAIT (2004): Erkrankungen des Atmungsapparates in: K.- H. WALDMANN u. M. WENDT (Hrsg.) : Lehrbuch der Schweinekrankheiten. 4. Aufl., Verlag Parey in MVS Medizinverlage Stuttgart, Stuttgart, S. 112-150 162 Anhang 7. Anhang Anhang 1. mit Tabelle 7.1.1: Klinischer Score Tier kummuliert über ▲ sieben Untersuchungstage 1 1,00 „Alterationen im Surfactantsystem: Klinik, Pathomorphologie und kulturelle Untersuchung“ Klinischer Score an ▲ LLS Befunde der Pathomorphologie an Tag 7▲ Tag 7▲ 0 an Tag 7▲ Verklebungen des linken Hauptlappens mit der Pleura costalis, Lungenlymphknoten mgr. vergrößert Kulturelle Untersuchung an Tag 7▲ 20,39 positiv 20,87 positiv 12,89 positiv 10,64 positiv 10,08 positiv Großflächige Verklebungen zwischen den linken Haupt- und Spitzenlappen, sowie 2 2,76 0 der Pleura visceralis mit der Pleura diaphragmatica und costalis verklebt, rechter Hauptlappen nicht von der Pleura costalis zu lösen Mgr. Verklebungen der Pleura visceralis und der Pleura paritalis, 3 2,20 0 hgr. Verklebungen beider Lobi caudales mit der Pleura costalis, Lungenlymphknoten hgr. vergrößert ▲ 4 0,93 0 5 2,9 0 Mgr. Verklebungen zwischen der Pleura parietalis (v.a. costalis) und visceralis, Lungenlymphknoten hgr. vergrößert Rechter Spitzenlappen mgr. mit der Pleura costalis verklebt, linker Hinterlappen mit der Pleura diaphragmatica und costalis veklebt In Infektionsstudie des FUGATO-RePoRI-Projektes und REINER et al. (2014) 163 Anhang Anhang 2. Tabelle 7.2.1: „ Stereologische Charakterisierung von immersionsfixiertem Lungenparenchym beim Schwein (Lungengesunde und A.pp.- infizierte Schweine)“ Stereologische und klinische Charakterisierung der Lungenparenchymalterationen nach Infektion mit A.pp. Parameter Vv Parenchym [%] Vv Luftraum [%] Vv Septen [%] Vv Non-Parenchym [%] Vv pathologisch verändertes Gewebe [%] Sv Alveolarseptum [1/µm] ▲ V/S-Ratio [µm] ♦ BALF Neutrophile Granulozyten [%] ♦ BALF Makrophagen [%] Funktionelles Lungenparenchymvolumen [cm³] Funktionelles Volumen pathologisch veränderter Strukturen [cm³] Funktionelles Lungenparenchymvolumen pro kg KGW [cm³/kg] Funktionelles Volumen der Alveolarsepten [cm³] Funktionelle Oberfläche der Alveolarsepten [cm²] 1 Klinischer Score Tag 21 ● LLS ● Anmerkung zur Sektion Status Kontrollgruppe (n=5) Infizierte Tiere (n=4) Minimum Median Maximum Minimum Median Maximum 73,02 78,16 83,21 12,52 74,60 85,11 44,18 53,54 72,84 41,31 44,92 51,58 27,16 46,46 55,82 48,42 55,08 58,69 16,79 21,84 26,98 8,27 17,58 30,54 0 0 0 0 0 79,21 0,042 0,048 0,06 0,01 0,035 0,062 6,75 7,83 11,5 9,28 13,25 48 5,2 9,95 15,5 7 9,1 25 75,7 78,25 81 67 81 88,5 544,90 665,56 678,53 539,71 566,96 643,50 p-Wert 0,7133 0,1113 0,1113 0,5403 0,3711 0,5403 ■ 0,0662 0,2454 0,5614 ■ 0,0662 0 0 0 0 0 428,53 0,3711 30,56 31,21 41,86 24,99 30,29 31,82 0,1779 131,96 213,39 289,35 32,80 229,44 317,25 0,9025 181364,38 258554,86 327729,86 6773,41 210913,8 273841,63 0,2703 0,1 0 0,3 3,57 0,7 7,04 Keine Veränderungen im Lobus caudalis ● 0,81 0,96 2,06 4,39 6,335 12,33 Darunter Verwachsungen, Pleuritis, sequesterartige Umfangsvermehrungen, schlecht belüftetes Parenchym 0,02* 0,1084 Die Daten stammen aus der Infektionsstudie von BRAUER (2012) (beide Gruppen vollständig) bzw. HENNIG-PAUKA et al. (2012) (alle infizierten Tiere, nur drei Tiere der Kontrollgruppe). * Im Wilcoxon Rangsummentest signifikant. ■ ▲ Im Wilcoxon Rangsummentest statistisch auffällig. Der Parameter entspricht der Alveolarseptendicke (BEHRENS 2011). 1 Die Daten stammen aus der Infektionsstudie von BRAUER (2012). ♦ Im Rahmen der Studie (Tierversuchsgenehmigungsnummer: 33-42502-05/941) erhoben, aus der auch folgende Manuskripte resultierten: BRAUER et al. (2012) und HENNIG-PAUKA et al. (2012), BALF leider nur von vier der fünf Kontrolltiere vollständig auswertbar 164 Anhang Tabelle 7.2.2: Pathomorphologische und histopathologische Charakterisierung der Lungenparenchymalterationen nach Infektion mit A.pp. Tier 1 ● LLS 4,39 Befunde der Pathomorphologie ● Histopathologie Hauptlappen ▲ Lungenlymphknoten umfangsvermehrt, rechterseits: ggr. Verwachsungen von Herzbeutel und Mgr., interstitielle, lympho-histiozytäre Pleura, ggr. Verwachsungen der Mittellappen mit der Pleura parietalis, 3x3 cm große Pneumonie; katarrhalisch-eitrige und Verwachsungen zwischen den Hauptlappen und des Zwerchfells, 3x3 cm große Verwachsungen abszedierende Bronchopneumonie zwischen Hauptlappen und Pleura parietalis (rechter Hauptlappen) Ggr., interstitielle, lympho-histiozytäre 2 12,33 Rechts: Hauptlappen großflächig mit Pleura verwachsen; links: Verwachsungen von Herzbeutel Pneumonie; hgr., katarrhalisch-eitrige und mit Pleura, Mittellappen vollständig mit Pleura verwachsen abszedierende Pneumonie (rechter Hauptlappen) Rechts: Hauptlappen mit hgr. Pleuritis, zusätzlich Verwachsungen mit Mittelllappen und 3 6,32 Zwerchfell, Spitzenlappen ggr. Verwachsen mit der Pleura parietalis, Lobus accessorius mit Herzbeutel verwachsen 4 ● ▲ 6,35 Mgr., interstitielle, lympho-histiozytäre Pneumonie (rechter Hauptlappen); hgr., eitrig-abszedierende Pneumonie mit Sequesterbildung (Lobus accessorius) Verwachsungen aller Hauptlappen zur Pleura parietalis und an mehreren Stellen zum Zwerchfell Hgr., fibrosierende, eitrige Pneumonie großflächige Verwachsungen; rechter Hauptlappen mit umschriebenen Sequester (linker Hauptlappen) Die Daten stammen aus der Infektionsstudie von BRAUER (2012) und HENNIG-PAUKA et al. (2012). Die Daten stammen aus der Infektionsstudie von HENNIG-PAUKA et al. (2012). 165 Anhang Tabelle 7.2.3: Ausgewählte Korrelationen (Lichtmikroskopie) in der Kontrollgruppe (n=5) Parameter Vv Parenchym [%] Vv Alveolarluftraum [%] Vv Alveolarsepten [%] Funktionelles Lungenparenchymvolumen [cm³] Vv Non-Parenchym [%] -1; <.0001 0,6; 0,2848 -0,6; 0,2848 0,3; 0,6238 Vv Alveolarsepten [%] 0,6; 0,2848 -1;<.0001 1 -0,1;0,87 Funktionelles Volumen der Alveolarsepten [cm²] 0,3; 0,6238 -0,9; 0,0374 0,9; 0,0374 0,2; 0,7471 Es erfolgte eine Berechnung des Spearman‘schen Rangkorrelationskoeffizienten, Signifikanzen sind grau unterlegt. Anmerkung: die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Tiere) entnommen worden. 166 Anhang Tabelle 7.2.4: Ausgewählte Korrelationen (Lichtmikroskopie bzw. CT) bei den A.pp.- infizierten Schweinen (n=4) Parameter Vv Parenchym [%] Vv Alveolarluftraum [%] Vv Alveolarsepten [%] Pathologisch verändertes Gewebe [%] V/S Ratio [µm] Vv Alveolarsepten [%] 1; <.0001 -1; <.0001 1 -0,77; 0,2254 -0,8; 0,22 Sv Alveolarsepten [1/µm] 0,8; 0,2 -0,8; 0,2 0,8; 0,2 -0,77; 0,2254 -1; <.0001 1; <.0001 -1; <.0001 1; <.0001 -0,77; 0,22 -0,8; 0,2 -0,77; 0,22 0,77; 0,22 -0,77; 0,22 1; <.0001 0,77; 0,22 Funktionelles Volumen der Alveolarsepten [cm²] Funktionelles Volumen Pathologisch verändertes Gewebe [cm³] Es erfolgte eine Berechnung des Spearman‘schen Rangkorrelationskoeffizient, Signifikanzen sind grau unterlegt. Anmerkung: die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) bzw. HENNIG-PAUKA et al. (2012) entnommen worden. 167 Anhang Abb. 7.2.1: Verteilung der stereologisch erarbeiteten Volumendichten bei Kontrolltieren und infizierten Tieren am Tag der Sektion. Der Wilcoxon Rangsummentest lieferte keine signifikanten Unterschiede zwischen den beiden Gruppen. Anmerkung: die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, alle infizierten Tiere) entnommen worden. 168 Anhang ■ Abb. 7.2.2: Oberflächendichten [1/µm] der Abb.7.2.3: V/S-Ratio [µm] bei Kontrolltieren Alveolarsepten bei Kontrolltieren und und infizierten Tieren. Im Wilcoxon infizierten Tieren. Im Wilcoxon Rangsummentest zeigte sich ein statistisch Rangsummentest zeigten sich keine auffälliger Unterschied bezüglich der Dicke signifikanten Unterschiede. der Alveolarsepten. Anmerkung: die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, alle infizierten Tiere) entnommen worden. 169 Anhang Abb.7.2.4: Vergleichende Darstellung der zytologischen Untersuchung der BALF der Kontrolltiere (vier der fünf Tiere) und infizierten Schweine am Tag der Sektion. Der Wilcoxon Rangsummentest wurde berechnet und ergab keine signifikanten Unterschiede zwischen Kontrollen und Infizierten. Im Rahmen der Studie (Tierversuchsgenehmigungsnummer: 33-42502-05/941) erhoben, aus der auch folgende Manuskripte resultierten: BRAUER et al. (2012) und HENNIG-PAUKA et al. (2012) 170 Anhang Abb.7.2.5: Vergleichende Darstellung der Blutwerte der Kontrolltiere und infizierten Schweine am Tag 21 (Tag der Sektion). Der Wilcoxon Rangsummentest wurde berechnet und ergab keine Signifikanzen. Anmerkung: Im Rahmen der Studie (Tierversuchsgenehmigungsnummer: 33-42502-05/941) erhoben, aus der auch folgende Manuskripte resultierten: BRAUER et al. (2012) und HENNIG-PAUKA et al. (2012) 171 Anhang Abb. 7.2.6: Vergleichende Darstellung der stereologisch ermittelten Daten der Kontrolltiere und infizierten Schweine am Tag 21 (Tag der Sektion). Der Wilcoxon Rangsummentest wurde berechnet und ergab keine Signifikanzen. ■ = Das funktionelle Lungenparenchymvolumen war vor der Infektion statistisch auffällig (p=0,066) größer. Anmerkung: Die verwendeten CT-Bilder stammen aus der Infektionsstudie von BRAUER (2012) und die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, alle infizierten Tiere) entnommen worden. 172 Anhang Abb.7.2.7: Via Stereologie ermittelte funktionelle Oberfläche der Alveolarsepten vergleichend für Kontrolltiere und infizierte Schweine am Tag 21 (Tag der Sektion). Der Wilcoxon Rangsummentest wurde berechnet und ergab keine Signifikanzen. Anmerkung: Die verwendeten CT-Bilder stammen aus der Infektionsstudie von BRAUER (2012) und die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, alle infizierten Tiere) entnommen worden. 173 Anhang Abb. 7.2.8: Funktionelles Parenchymvolumen pathologisch veränderter Strukturen vergleichend für Kontrolltiere und infizierte Schweine am Tag 21. Der Wilcoxon Rangsummentest wurde berechnet und ergab keine Signifikanzen. Anmerkung: Die verwendeten CT-Bilder stammen aus der Infektionsstudie von BRAUER (2012) und die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudien von BRAUER (2012) (alle Tiere) bzw. HENNIG-PAUKA et al. (2012) (nur drei Kontrolltiere, alle infizierten Tiere) entnommen worden. 174 Anhang Abb. 7.2.9: Immersionsfixiertes Lungenparenchym eines Kontrolltieres, HE-Färbung Anmerkung: Die histologische Probe ist im Rahmen der Infektionsstudie von BRAUER (2012) gewonnen worden. 175 Anhang Abb. 7.2.10: Immersionsfixiertes Lungenparenchym eines A.pp. infizierten Tieres (21 Tag p.inf.), HE-Färbung Anmerkung: Die histologische Probe stammt aus der Infektionsstudie von BRAUER (2012). 176 Anhang Anhang 3. Vergleich zwischen Immersions- und Perfusionsfixierung von Lungenparenchym beim Schwein Abb. 7.3.1: Verteilung der stereologisch berechneten Volumendichten von immersionsfixiertem Lungenparenchym und perfusionsfixiertem Lungenparenchym (schraffiert). ■ Der Wilcoxon Rangsummentest zeigte statistisch auffällige Unterschiede bei der Volumendichte des Alveolarluftraums und der Alveolarsepten [%] zwischen Immersions- und Perfusionsfixierung. Anmerkung: Die immersionsfixierten Proben sind im Rahmen der Infektionsstudie von BRAUER (2012) (vollständig) bzw. HENNIG-PAUKA et al. (2012) (nur drei Tiere der Kontrollgruppe) erhoben worden. 177 Anhang Abb. 7.3.2: Vergleich der Oberflächendichte [1/µm] zwischen Immersions- und Perfusionsfixierung (schraffiert). Anmerkung: Die lichtmikroskopischen Proben sind im Rahmen der Infektionsstudie von BRAUER (2012) (vollständig) bzw. HENNIG-PAUKA et al. (2012) (nur drei Tiere der Kontrollgruppe) erhoben worden. 178 Anhang Histologische Darstellung der Strukturerhaltung am Beispiel zweier Kontrolltiere Abb. 7.3.3: Perfusionsfixiertes Lungenparenchym eines Abb. 7.3.4: Nahezu vollständig kollabierte Lunge ohne definierte Blähung am Ende Kontrolltieres, HE-Färbung der Inspiration, Lungenparenchym eines Kontrolltieres, HE-Färbung 179 Anhang Anhang 4. Protokoll über die Surfactant-Auswertung (Einstellungen TEM/ STEPanizer© stereology tool) TEM: Vergrößerung: 18.000 x Variation der Anzahl der Bilder pro Schnitt, meist 20-60 Bilder Abstand von 200 μm /150 μm zwischen Bildaufnahmen STEPanizer© stereology tool: Parameter Fenster: Monitorauflösung 768x1024, Auswahl: Line pairs, Number of titles: 4, Sub sampling: no Line width:2, T-Bar:0, Show: alle ankreuzen Nummern im STEPanizer© stereology tool / Definition der Subtypen: 1. ulv, eine Lamelle bis zwei Lamellen in Auflösung, unterschiedlicher Größe 2. mlv 3. lbl 4. tm 5. LSP mit ulv, Schnittpunkt gezählt jeweils an äußerer Lamelle 6. LSP mit lbl, Schnittpunkt gezählt jeweils an äußerer Lamelle 7. Zelldetritus (Protokoll modifiziert nach SCHMIEDL et al. 2003 und SCHMIEDL et al. 2004) 180 Zusammenfassung 8. Zusammenfassung Diana Busley (2014): Charakterisierung der entzündungsbedingten Surfactant- und Lungenparenchymalterationen beim Schwein nach Infektion mit Actinobacillus pleuropneumoniae In dieser Arbeit wurde mittels Bronchoalveolärer Lavage (BAL) gewonnnener Surfactant vom Schwein vor und sieben Tage nach der Infektion mit Actinobacillus pleuropneumoniae untersucht. Die Schweine wurden hierfür aerogen in einer Aerosolkammer im Rahmen des FUGATO-RePoRI-Projektes infiziert.9) Die Untersuchungen umfassten umfangreiche morphometrische Analysen der ultrastrukturelle, stereologisch- Volumendichten und des Volumen- /Oberflächenverhältnis‘ [µm] der Surfactantsubtypen. Ziel war hierbei die Verteilung von aktiven und inaktiven Surfactantsubtypen vor und nach der Infektion zu charakterisieren. Des Weiteren wurde die minimale Oberflächenspannung [mN/m] des Surfactants mittels Pulsating-Bubble-Surfactometrie jeweils vor und nach der Infektion bestimmt. Zudem wurden Atmungsapparats, klinische Daten röntgenologische durch die klinische Untersuchungen, Untersuchung des ultrasonographische Untersuchungen, Berechnung des RHS und pathomorphologische Untersuchungen (Lung lesion score) und die zytologische Untersuchung der bronchoalveolären Lavageflüssigkeit (BALF) im Rahmen des FUGATO-RePoRI-Projektes erhoben. Die klinischen Daten, die vor der Infektion erhoben wurden, waren statistisch auffällig unterschiedlich zu denen, die nach der Infektion erhoben wurden (FUGATO-RePoRIProjekt).9) 9) Persönliche Mitteilung von Frau Dr. Doris Höltig, 16.11.2013, Hannover, teilpubliziert in REINER et al. (2014) 181 Zusammenfassung Bei der zytologischen Untersuchung der BALF zeigten sich keine signifikanten Unterschiede.10) Die morphometrisch ermittelten Volumendichten der Surfactantsubtypen ergaben nach der Infektion eine tendenzielle Verschiebung von inaktiven zu aktiven Surfactantsubtypen. Es zeigte sich eine höhere, allerdings nicht signifikant höhere, minimale Oberflächenspannung [mN/m] nach der Infektion, somit blieb ein erwarteter hoher Anstieg über den Referenzwert aus. Eine mögliche Erklärung dafür ist, dass es infektionsbedingt zu einer gesteigerten, kompensatorischen Produktion von aktivem Surfactant als Reaktion auf eine entzündungsbedingte, gesteigerte Konversion kam. Um die infektionsbedingten Alterationen auf Lungenparenchymebene zu charakterisieren, wurden weitere stereologisch-morphometrische Untersuchungen auf lichtmikroskopischer und computertomographischer Ebene bei zwei weiteren Tiergruppen durchgeführt. Statistisch wurden die makroskopischen Lungenveränderungen (Lung Lesion Score) von Kontrolltieren und A.pp.- infizierten Schweinen am Tag 21 p. inf. verglichen. Es ergaben sich keine signifikanten Unterschieden (Infektionsstudie von BRAUER (2012) und HENNIG-PAUKA et al. (2012)). Bei den histologisch-stereologischen Untersuchungen zeigten sich bezüglich der Volumendichte des Parenchyms [%], des Non-Parenchyms [%], der Alveolarsepten [%] und des Alveolarluftraumes [%], der Oberflächendichte der Alveolarsepten [1/µm] und der Septendicke [µm] ebenfalls keine signifikanten Unterschiede zwischen Kontrolltieren und A.pp- infizierten Tieren. Auch erwiesen sich die mithilfe des CTs bestimmten funktionellen Volumina von Alveolarsepten [cm3] und pathologisch veränderten Strukturen [cm3] sowie die Oberfläche der Alveolarsepten [cm 2] als nicht signifikant unterschiedlich zwischen den Tiergruppen. Die mittels CT bestimmten Lungenparenchymvolumina [cm³] stellten sich als statistisch auffällig unterschiedlich (p=0,066) zwischen Kontrolltieren und infizierten Tieren heraus. 10) Persönliche Mitteilung von Frau Dr. Doris Höltig, 16.11.2013, Hannover (FUGATO-RePoRIProjekt), teilpubliziert in REINER et al. (2014) 182 Zusammenfassung Die CT-Analyse der Lungenvolumina ergab einen Hinweis auf pathologische Veränderungen bei den infizierten Tieren, die inzwischen keine klinischen Symptome mehr zeigten (Daten im Rahmen der Dissertation von BRAUER (2012) erhoben). CT und Lichtmikroskopie als zwei unterschiedliche Methoden, die mit einem auf Stereologie basiertem Quantifizierungsverfahren kombiniert wurden, ergaben logisch nachvollziehbare Korrelationen zwischen Parametern bei den Kontrolltieren und den A.pp. infizierten Tieren. Bei der Charakterisierung der A.pp. bedingten Lungenparenchymalterationen konnte qualitativ-lichtmikroskopisch festgestellt werden, dass das Lungenparenchym nach Infektion scheinbar über einen geringeren Luftraum verfügte. Um der Fragestellung nachzugehen, in wie weit Strukturerhaltung des porzinen Lungenparenchyms durch die Fixierungsmethode Lungenparenchym vom bestimmt wird, Schwein wurde nach im letzten Teil unterschiedlichen, der Arbeit chemischen Fixierungsmethoden (Immersion und Perfusion) untersucht. Die stereologischmorphometrischen Daten bestätigen in dieser Arbeit die These der besseren Strukturerhaltung bei Perfusionsfixierung. Das hierbei gewählte Verfahren der Fixierung erwies sich für die qualitative und quantitative Auswertung von Gewebsstrukturen als sinnvolle Alternative zur Immersionsfixierung. 183 Summary 9. Summary Diana Busley (2014) Characterisation of the inflammation-caused alterations of surfactant and lung parenchyma in pigs infected by Actinobacillus pleuropneumoniae This study focused on the examination of surfactant in healty and A.pp. infected pigs (seven days after infection). Surfactant was harvested by bronchoalveolar lavage (BAL). Pigs were infected in an aerosol chamber in the course of the FUGATO-RePoRI-project.11) Extensive ultrastructural examinations were performed: the volume densities of the surfactant subtypes [%] and the volume to surface ratio of specific surfactant subtypes [µm]. The aim of this study was to define the proportion of active and inactive surfactant subtypes prior to and after infection. Furthermore, the minimal surface tension [mN/m] was measured prior to and after infection using a Pulsating Bubble Surfactometer. Clinical data were recorded as the clinical examination of the respiratory tract, radiographical examinations, ultrasonography, calculations of the RHS and pathological examination (Lung Lesion Scoring) as well as the cytologic examination of bronchoalveolar lavage fluid (BALF) in the course of the FUGATO-RePoRI-project. Clinical data after infection differed statistically noticeable from data prior to infection. Cytological findings in BALF did not differ significantly.11) The morphometrically determined data of the volume densities of the surfactant subtypes demonstrated a tendency to a shift from inactive to active surfactant subtypes after infection. A not significantly increase of the minimal surface tension [mN/m] occurred after infection, but was not as high as expected, because the reference value was not exceeded in the most pigs. 11) Dr. Doris Höltig, personal communication, November 11, 2013, Hannover, partly published in REINER et al. (2014) 184 Summary An increased, infection-related compensatory production of fresh and active surfactant in A.pp. infected pigs could be assumed by a higher conversion. Inflammatory alterations in lung parenchyma were investigated by light microscopy and computer tomography combined with a stereological-morphometric approach in additional groups of piglets. Lung Lesion Scores of the control group and of the A.pp. infected group on day 21 after infection did not show significant differences (infection trial of BRAUER (2012)). The histological-stereological examination of the volume density of parenchyma [%], non-parenchyma [%], alveolar septa [%] and the alveolar air space [%] and the surface density of the alveolar septa [1/µm] did also not reveal a statistical significance. Furthermore, the functional volumes of lung parenchyma [cm3], alveolar septa [cm3] and pathological altered structures [cm3] as well as the functional surface of alveolar septa [cm2] were not significantly different between both groups. However, functional lung volumes which were calculated based onto CT were statistically noticeable different (p=0.066) between control and infected group. CT analysis of the functional lung volumes revealed inflammatory lung alterations in infected pigs, which did not show clinical signs any longer (data based on doctoral thesis of BRAUER (2012)) Both methods, light microscopy and CT, resulted in valuable data which partly correlate with each other. Qualitative light microscopical analysis revealed a decreased airspace in lung parenchyma in A.pp. infected pigs. To assess the influence of the fixation method onto the conservation of porcine lung parenchyma different chemical fixation were compared. The stereological-morphometric data evaluation resulted in a superior preservation of lung structures by perfusion fixation. For the qualitative and quantitative characterization of lung structures perfusion fixation was found to be an alternative to immersion fixation. 185 Danksagung 10. Danksagung Ich möchte mich herzlich bei Fr. Prof. Dr. Isabel Hennig-Pauka Hrn. Prof. Dr. Dr. Andreas Schmiedl Hrn. Prof. Dr. M. Ochs und Hrn. Prof. Dr. K.- H. Waldmann der Friedrich-Ebert-Stiftung, v.a. Prof. Dr. Hermann Frister, Dr. Ursula Bitzegeio, Katja Reszel und Jana Hartmann Fr. Tierärztin Ariane Jacobi Fr. Tierärztin Anne Menzel Fr. Tierärztin Carina Helmer Fr. PD Dr. Anke Schnapper Fr.Dr. Esther Humann-Ziehank Fr. Dr. Doris Höltig Fr. Christa Acevedo Hernandez Fr. Andrea Herden, Susanne Faßbender und Sabine Fiedler Fr. Elke Siever und Gudrun Wirth Hrn. Jan-Phillip Schneider, Dr. Mark Kühnel und Dr. Roman Grothausmann Fr. Dr. Melanie Gundlach Hrn. Dr. Martin Beyerbach meiner Familie und Jens Eberling (für das geisteswissenschaftliche Denken) bedanken!!! 186