Beiträge zur Koordinationschemie der niedervalenten Aluminium
Werbung

Beiträge zur Koordinationschemie der niedervalenten
Aluminium, Gallium und Indium-Organyle EICp* an
Übergangsmetallen
Dissertation
zur Erlangung der Doktorwürde der Fakultät Chemie
der Ruhr Universität Bochum
vorgelegt von
Tobias Steinke
aus Bochum
Tag der mündlichen Prüfung:
03. Februar 2005
Gutachter:
Prof. Dr. Roland Fischer
Prof. Dr. William S. Sheldrick
Mündliche Prüfung:
03. Februar 2005
Die vorliegende Arbeit entstand in der Zeit von März 2001 bis September 2004
am Lehrstuhl für Anorganische Chemie II, Organometallics & Materials Chemistry
der Ruhr Universität Bochum.
Mein ganz besonderer Dank gilt
Herrn Prof. Dr. Roland Fischer
für sein großes Vertrauen, seine ermutigende Freundlichkeit und seine fabelhafte
Unterstützung, sein aufrichtiges Interesse an meinen Arbeiten und insbesondere die gewährte
wissenschaftliche Freiheit.
Ferner gilt mein Dank:
Herrn Dr. Christian Gemel für die Anregungen und sein ausdauerndes Interesse, die
umfangreichen Hilfestellungen, die Aufgeschlossenheit und seine Freundschaft. Herrn Dipl.
Chem. Mirza Cokoja für sein engagiertes Interesse in chemischen und privaten Fragen sowie
seiner steten Hilfbereitschaft. Frau M.-Sc. Eliza Gemel für ihre Herzlichkeit und Freundschaft
während unserer großartigen gemeinsamen Zeit.
Frau Jun.-Prof. Dr. Anjana Devi, Herrn Dr. Rochus Schmid, Herrn Dipl.-Chem. Andreas
Kempter, Herrn Cand.-Chem. Thomas Cadenbach, Frau Cand.-Chem. Beatrice Buchin, Frau
Ursula Herrmann, Frau Cand.-Chem. Felicitas Schröder, Frau M.-Sc. Urmila Patil, Herrn Dr.
Harish Parala, Herrn Dipl.-Chem. Stephan Hermes, Herrn Dipl.-Chem. Arne Baunemann,
Frau Dipl.-Chem. Eva Maile, Herrn M.-Sc. Raghunandan Bhakta, Herrn M.-Sc. Jayaprakash
Khanderi, Frau Dipl.-Chem. Marie-Katrin Schröter, Herrn Dipl.-Chem. Daniel Rische, Herrn
M.-Sc. Todor Hikov, Herrn Stephan Spöllmann, Frau Heike Kampschulte, Sabine
Masukowitz, Herrn Dr. Ned J. Hardman, Herrn Dr. Fank Hipler, Frau Dr. Ulrike
Weckenmann und Herrn Dr. Ralf Becker für die geleisteten Hilfestellungen und die
Aufgeschlossenheit, die mir während meiner Arbeit entgegengebracht wurden.
Herrn Dr. Christian Gemel, Frau Manuela Winter, Herrn Dr. Klaus Merz, Frau Dr. Iris
Müller, Frau Annegret Knüfer und Herrn Prof. Dr. William S. Sheldrick für ihre
Hilfsbereitschaft und die gewissenhafte und engagierte Analyse der Kristallstrukturen sowie
die Berechnung der entsprechenden Strukturparameter.
Herrn Prof. Gernot Frenking für die Durchführung der quantenchemischen Untersuchungen.
Herrn Prof. Ulrich Zenneck für die großzügige Bereitstellung von Chemikalien.
Herrn Hans-Jochen Hauswaldt, Martin Gartmann und Gregor Barchan für die stete
Hilfbereitschaft und freundliche Beratung in NMR-Fragen.
Frau M.-Sc. Urmila Patil für die Durchführung der thermogravimetrischen Messungen.
Frau Karin Bartholomäus für die Anfertigung der Elementaranalysen.
Frau Jutta Schäfer für die Anfertigung der Massenspektren.
Der Degussa-Hüls AG und der W.C. Hereaus GmbH für die großzügigen Chemikalienspenden.
Frau Dr. Dana Weiß und Herrn Dr. Jurij Weiß für eine engagierte Betreuung während meines
Examens und zu Beginn dieser Arbeit, die mein Interesse für die metallorganische Chemie
geweckt und entscheidend geprägt haben.
Diese Arbeit ist einer Zeit entstanden, in der ich abgesehen von der universitären Forschung,
viele freudige, aber auch sehr leidvolle persönliche Erfahrungen gemacht habe. Die Geburt
meines wundervollen Sohnes Jakob Luca, die Hochzeit mit meiner bezaubernden Frau Peggy
Glaubrecht sowie der traurige Abschied von meinem Vater Heinz Steinke haben mich
emotional sehr bewegt und mir sehr eindringlich die entscheidende Rolle der Familie als
Basis für das menschliche Zusammenleben vor Augen geführt.
Daher gilt abschließend mein ganz besonderer Dank
meiner Frau Peggy, die mich mit ihrer Liebe, Zuversicht und ihrem Engagement jeden Tag
aufs Neue motiviert und unterstützt,
meinen Eltern und meiner Schwiegermutter Gabriele Glaubrecht, deren Fürsorge und
liebevolle Unterstützung zum Gelingen dieser Arbeit beigetragen haben sowie
meinen Freunden Stefan Appelt, Marc Osthoff, Stefan Ricken, Frank Dudda und Peter Wein,
mit denen man nicht nur einen Abend in geselliger Runde begießen kann, sondern die auch
stets ein offenes Ohr für die täglichen Probleme im Leben haben.
Für Peggy
und
Jakob Luca
Inhaltsverzeichnis
___________________________________________________________________________
Inhaltsverzeichnis
I.
Einleitung
1
II.
Bisheriger Kenntnisstand
4
Synthese, Struktur und Bindungsverhältnisse von niedervalenten
Gruppe-13- Metallorganylen EIR und deren Koordinationschemie
an d-Metallkomplex-fragmenten
III.
Ergebnisse und Diskussion
20
1.
Insertionsreaktionen von Gruppe-13-Metallorganylen EIR in
20
Metall-Metall- und Metall-Halogen-Bindungen
1.1.
Insertion
von
GaCp*
in
die
Metall-Metall-Bindung
von
20
Insertion von EIR in die Rhodium-Chlor-Bindung von [{Cp*RhCln}2]
27
[(Cp)(CO)2M≡M(CO)2(Cp)] (M = Mo, W)
1.2.
(n = 1, 2): neuartige RhCp*/GaCp* und RhCp*/InCp*-Verbindungen
1.2.1. Reaktion von [{RhCp*Cl2}2] mit stöchiometrischen Mengen an ECp*
29
1.2.2. Reaktion von [{RhCp*Cl2}2] mit unterstöchiometrischen Mengen an
39
ECp*: mechanistische Überlegungen
1.2.3. Reaktion von GaCp* mit [{RhCp*Cl}2]
2.
45
M-EIR-Komplexe via Substitution labiler Liganden: Auf dem
52
I
Weg zu homoleptischen Clustern [Ma(E R)b]
2.1.
[(CO)3Mo(GaCp*)3] - ein Synthesebaustein zur Darstellung der
52
dinuklearen Clusterverbindung [Mo2(CO)6(µ2-GaCp*)3]
2.2.
Darstellung von [{Cp(C2H4)Rh(µ2-(η1-GaCp*))}2] via Substitutionsreaktion von [{CpRh(C2H4)(NCMe)] mit GaCp*
61
Inhaltsverzeichnis
___________________________________________________________________________
2.3.
Darstellung monomerer homoleptischer Komplexe [M(ER)4] (M =
67
Ni, Pd, Pt; E = Al, Ga, In; R = Cp*, C(SiMe3)3)
2.4.
2.5.
[M(GaCp*)4] (M = Pd, Pt) als Synthesebausteine zur Darstellung
dinuklearer homoleptischer Clusterverbindungen [MPt(GaCp*)5]
75
Direkte Synthesewege zu fluktionalen di- und trinuklearen
82
Clusterverbindungen [Pda(ECp*)b] (E = Al, Ga, In)
3.
Substitutionsreaktionen an homoleptischen Clustern [Ma(EIR)b]
101
(M = Pd, Pt; E = Ga, In) mit AlCp*, CO, PR3 und t-BuNC
3.1.
Substitutionsreaktionen an dinuklearen Komplexen [M2(ECp*)5] (M
101
= Pd, Pt; E = Al, Ga )
3.1.1. Reaktion mit AlCp*
101
3.1.2. Reaktion mit PPh3 und dppe
106
3.1.3. Reaktion mit t-BuNC
112
3.1.4. Reaktion mit CO
115
3.2.
Substitutionsreaktionen
an
dem
trinuklearen
Komplex
117
[Pd3(InCp*)8]
3.2.1. Reaktion mit PPh3 und dppe
117
3.2.2. Reaktion mit ECp* (E = Al, Ga)
121
4.
126
AlCp* als Steuerligand: C-H- und Si-H-Bindungsaktivierungen an
reaktiven Fragmenten [M(AlCp*)n] (M = Fe, Ni, n < 4)
4.1.
Bindungsaktivierung am reaktiven Intermediat [Ni(AlCp*)3]
128
4.1.1. Aromatische C-H-Aktivierung von Benzol und Toluol
128
4.1.2. Si-H-Aktivierung von HSiEt3
132
4.1.3. Reaktivität von [Ni(AlCp*)3(H)(SiEt3]
135
4.2.
Darstellung von homoleptischen d8-M-EIR-Komplexen: Aliphatische
142
C-H-Bindungsaktivierung in [Fe(AlCp*)5]
4.2.1. Darstellung und Charakterisierung von [Fe(AlCp*)5]
142
4.2.2. Quantenchemische Berechnung zu der Verbindung [Fe(AlCp*)5]
150
Inhaltsverzeichnis
___________________________________________________________________________
IV.
Zusammenfassung
157
V.
Ausblick
164
VI.
Experimenteller Teil
170
1.
Allgemeine Arbeitstechniken
170
2.
Routineanalysemethoden
171
3.
Ausgangsverbindungen
173
4.
Arbeitsvorschriften und analytische Daten neuer Verbindungen
174
5.
Ergänzende kristallographische Daten
193
VII.
Literaturverzeichnis
198
VIII.
Anhang:
Publikationen,
Lebenslauf
Posterbeiträge,
Vorträge,
207
Verzeichnis der verwendeten Abkürzungen
Ar
Aryl
Cp
η5-Cyclopentadienyl
Cp*
η5-Pentamethylcyclopentadienyl
cod
1,5-Cyclooctadien
cdt
trans,trans,trans-1,5,9-Cyclododecatrien
coe
Cycloocten
Cy
Cyclohexyl
dcpe
Bis(Dicyclohexylphospino)ethan
DDP
2-Diisopropylphenylamino-4-diisopropylphenylimino-2-penten
dppe
Bis(Diphenylphospino)ethan
dvds
1,3-Divinyl-1,1,3,3-tetramethyldisiloxan
E
Gruppe-13-Metall, Erdmetall
EA
Elementaranalyse
Et
Ethyl
i-Pr
iso-Propyl
i-Bu
iso-Butyl
IR
Infrarotspektroskopie
L
Ligand
M
d-Block-Metall (Übergangsmetall)
Me
Methyl
Mes*
2,6-Bis(2,4,6-triisopropylphenyl)phenyl
nbd
Norbornadien
NHC
N-heterocyclische Carbene
NMR
Kernresonanzspektroskopie
Np
Neopentyl
Ph
Phenyl
R
Alkyl
RT
Raumtemperatur
THF
Tetrahydrofuran
TEM
Transmissionselektronenmikroskopie
t-Bu
tert.-Butyl
Einleitung
________________________________________________________________________
I.
Einleitung
Das zunehmende Interesse an der Koordinationschemie von Aluminium, Gallium und Indium
an Übergangsmetallzentren geht auf Impulse zurück, die sich aus zwei verschiedenen
Beweggründen ableiten lassen. Zum einen stellen die metallorganischen Verbindungen
[(LnM)(EIR)b] (M = Übergangsmetall; E = Gruppe-13-Metall) potentielle Ausgangsverbindungen oder Vorstufen (Precursoren) für ein breites Spektrum von Anwendungen in
der Materialwissenschaft dar. Neben dem Einsatz von Precursoren in der Metallorganisch
Chemischen Dampfabscheidung (MOCVD), finden M-E-Verbindungen Verwendung in der
Herstellung von Nanophasen und heterogenen Katalysatoren.[1-4]
Die zweite Motivation hat sich durch den Aufschwung der Chemie niedrigkoordinierter
Erdmetallverbindungen EIR (E = Al, Ga, In) entwickelt, deren Synthese und Strukturchemie
und insbesondere ihr Potential als Liganden zur Darstellung neuartiger ÜbergangsmetallGruppe-13-Metall-Komplexe [(LnM)(EIR)b] und Cluster innerhalb des letzten Jahrzehnts im
Hinblick auf eher klassisch komplexchemische Fragestellungen großes Interesse auf sich
gezogen haben.[5-8] In diesem Zusammenhang sind vor allem die Fortschritte bei der
Stabilisierung einwertiger metallorganischer Verbindungen EIR durch sterisch sehr
anspruchsvolle Substituenten R zu nennen. Im Unterschied zur Koordinationschemie von
„BIR“ an d-Metallfragmenten,[9, 10] sind die freien Liganden EIR (E = Al, Ga, In) stabil und
isolierbar. Das Tetramer [{Cp*Al}4],[11-13] die Hexameren [{Cp*E}6] (E = Ga, In),[14-18] die
verwandten Alkylverbindungen [{ER}4] (R= C(SiMe3)3, CH(SiMe3)2, Si(SiMe3)3, CMe4; E =
Al, Ga, In),[19-24] sowie die sehr elektronenreichen monomeren Verbindungen EIMes* (E = Al,
Ga, In; Mes* = 2,6-Bis(2,4,6-triisopropylphenyl)phenyl),[25-31] [EI(DDP)] (E = Al, Ga, In;
DDP = 2-Diisopropylphenylamino-4-diisopropylphenylimino-2-penten)[32-39] und [Ga(TptBu2
)] (Tpt-Bu2 = tris(3,5-di-tert-butylpyrazolyl)hydroborat)[40-44] sind nur einige Beispiele, die
die Strukturvielfalt von EIR belegen.
Obwohl zahlreiche präparative[7,
8]
und quantentheoretische Arbeiten[45-52] zum Thema
der Koordinationschemie dieser Liganden aus verschiedenen Arbeitskreisen existieren, ist
eine systematische Untersuchung der Synthese und der Strukturen von M-E-Komplexen
sowohl im Festkörper als auch in Lösung gefordert. Insbesondere die Reaktivität von M-EKomplexen wurde bislang nur unzureichend untersucht. So beschränken sich die bislang
publizierten Arbeiten weitestgehend auf die Koordination der carbenoiden Spezies EIR an
Metallcarbonyle, wie etwa das zu [Fe(CO)5] isolobale Beispiel [(CO)4FeAlCp*]
-1-
Einleitung
________________________________________________________________________
verdeutlicht.[49] Derartige Verbindungen leiten sich auch strukturell unmittelbar von den
Grundtypen der Metallcarbonyle ab. Jedoch ist der Substituierbarkeit von CO durch EIR eine
intrinsische Grenze gesetzt, die besonders der Generierung homoleptischer Cluster vom Typ
[Ma(EIR)b] (a < b) entgegenwirkt. Aus diesem Grund sind nur einige wenige Komplexe
bekannt, die keine starken π-Akzeptor Liganden enthalten. Zu diesen bemerkenswerten
Ausnahmen zählen der von Schnöckel und Mitarbeiter synthetisierte Komplex [(CpNi)2(µ2AlCp*)2][53] oder die mononuklearen homoleptischen Verbindungen [M(ER)4] (M = Pt, Ni, E
= Ga, In) aus den Arbeitsgruppen Jutzi[54] und Uhl[47, 55, 56]. Auch der in unserer Arbeitsgruppe
synthetisierte
dinukleare
Komplex
[Pt2(GaCp*)2(µ2-GaCp*)3]
legte
das
besondere
koordinationschemische Potential der Liganden EIR offen.[51] Diese Verbindung war das erste
Beispiel für einen homoleptischen Vertreter einer neuen Reihe [Ma(EIR)b] (a < b), für die
weder strukturanaloge Carbonyl- noch Phosphan-Komplexe bekannt sind.
Im Rahmen der vorliegenden Arbeit wurde nun die Synthese, Struktur und Reaktivität
neuartiger, vorwiegend π-Akzeptor-Ligand freier, Gruppe-13-Metall-reicher Übergangsmetallkomplexe [LnMa(EIR)b] systematisch untersucht. Zentrale Fragen waren unter anderem
Möglichkeiten des gezielten Aufbaus von multimetallischen Clusterverbindungen, nach der
Reaktivität der Verbindungen im klassischen Sinn der Organometallchemie (z.B.
Substitutionsreaktionen, Bindungsaktivierungen) und nach der grundsätzlichen Zugänglichkeit höher substituierter Homologe [M(ER)n] (n > 4) (siehe Kapitel II).
Neben neuen Synthesewegen zur Generierung von M-EIR-Bindungen, was beispielhaft
anhand der Insertion von EIR in die Metall-Metall-Mehrfachbindung gelang, konnte eine
Reihe nennenswerter struktureller und reaktiver Eigenschaften dieser Verbindungsklasse
aufgezeigt werden. So bieten Insertionsreaktionen von EIR in die Metall-Halogen-Bindung
ein abwechslungsreiches Feld zur Generierung von ungewöhnlichen fluktionalen Käfig- und
Clusterverbindungen. Des Weiteren können die mononuklearen Komplexe [M(EIR)4] als
Synthesebausteine zum Aufbau von dinuklearen homoleptischen Clusterverbindungen
[M2(EIR)5] eingesetzt werden. Darüber hinaus sind di- und trinukleare homoleptische
Clusterkomplexe [Ma(EIR)b] (a < b) bei geeigneter Wahl des Übergangsmetall-Precursors
auch über direkte Synthesewege zugänglich. Im Gegensatz zu den sterisch und elektronisch
gesättigten
monomeren
homoleptischen
Komplexen
Clusterverbindungen
[M(EIR)4],
I
[Ma(E R)b]
zeigen
ein
die
di-
und
reichhaltiges
trinuklearen
Spektrum
an
Substitutionsreaktionen in Gegenwart von Liganden L (L = EICp*, CO, PR3, RNC). Im
letzten Kapitel werden die Möglichkeiten der Liganden EIR im Hinblick auf
-2-
Einleitung
________________________________________________________________________
Aktivierungsreaktionen
untersucht.
Während
CO
und
Phosphane
als
Stütz-
und
Steuerliganden für Reaktivität und Selektivität in der Organometallchemie geradezu
prototypisch sind, ist über ein entsprechendes Potential der Liganden EIR nie berichtet
worden. Das Beispiel von AlCp* als Steuerligand belegt, dass die reaktiven,
unterkoordinierten Fragmente vom Typ [M(AlCp*)n] (M = Ni, Fe), die bisher auf anderem
Wege nicht erhältlich waren, grundsätzlich zur Bindungsaktivierung (C-H und Si-H) geeignet
sind. Diese Ergebnisse lassen eine fruchtbringende zukünftige Entwicklung innerhalb der
Koordinationschemie von EIR an d-Metallfragmenten erwarten.
-3-
Bisheriger Kenntnisstand
_______________________________________________________________________
II.
Bisheriger Kenntnisstand
Auf dem Gebiet von einwertigen Verbindungen der 13. Gruppe EIR (E = Al, Ga, In; R = Cp*,
C(SiMe3)3 u.ä.) sind in den letzten 10 Jahren eine Vielzahl von präparativen und
bindungstheoretischen Arbeiten entstanden.[7, 8, 45-52] Dieser Aufschwung begründet sich vor
allem darin, dass im starken Kontrast zu der leichten Verfügbarkeit von subvalenten IndiumIund ThalliumI-Verbindungen, bedeutende Fortschritte bei der Stabilisierung der bei
Raumtemperatur normalerweise instabilen zur Disproportionierung neigenden AlI- und GaISpezies gemacht worden sind. Diese Pionierleistungen aus den Arbeitsgruppen Schnöckel,
Uhl, Roesky, Power und Jutzi beruhen auf den Einsatz sterisch anspruchsvoller und
elektronisch stabilisierender Gruppen R (Cp*, C(SiMe3)3, t-Bu, 2,6-disubstituierte
Arylgruppen u.ä.). Da die niedervalenten Verbindungen EIR bei Raumtemperatur stabile,
leicht handhabbare Verbindungen darstellen, können sie so auch systematisch als metalloide,
also "exotische" Liganden in der Koordinationschemie untersucht werden.
Darstellung niedervalenter Gruppe-13-Verbindungen EIR
Der Durchbruch auf diesem Gebiet gelang 1991 Schnöckel und Mitarbeiter, die über die erste
stabile Organo-AlI-Verbindung [{AlCp*}4],[11] durch Umsetzung von metastabilen AlCl mit
MgCp*2, berichteten. 6π-Elektronen-Arene wie substituierte Cyclopentadienid-Anionen (Cp,
Cp*, Cp(SiMe3)3, Cp(Benzyl)5) sind als sterisch anspruchsvolle Elektronendonoren sehr gut dazu
geeignet, Metalle in niedrigen Oxidationsstufen zu stabilisieren. Zwei Jahre später wurde,
ebenfalls durch Halogenidaustausch-Metathese, das Gallium-Derivat [{GaCp*}6] isoliert.[14]
Die einfacheren, aber geringere Ausbeute liefernden Synthesen von [{AlCp*}4] nach
Roesky[12] sowie von [{GaCp*}6] nach Jutzi[16] erfolgt via reduktiver Dehalogenierung
ausgehend
von
[Cp*AlCl2]
bzw.
[Cp*GaI2]
in
Gegenwart
von
Kalium.
Diese
Synthesemethode wurde auch eingesetzt um Alkyl-substituierte Verbindungen von
AluminiumI und GalliumI herzustellen. Die Reduktion von [(Me3Si)3CAlI2⋅(THF)] mit einer
Na/K-Legierung liefert die AlI-Alkylverbindung [{AlC(SiMe3)3}4].[19] Die Umsetzung von
„Greens GaI“ mit Cp*K stellt den heute im Labormaßstab am einfachsten durchzuführenden
Syntheseweg zu [{GaCp*}6] dar.[17] Im Gegensatz zu Gallium und Aluminium sind IndiumIOrganyle leicht aus dem stabilen InCl und Lithiumalkylen zugänglich, wie die Synthese von
-4-
Bisheriger Kenntnisstand
_______________________________________________________________________
[{InC(SiMe3)3}4] aus der Arbeitsgruppe Uhl[21] oder die von Beachley beschriebene Synthese
von [{InCp*}6][18] belegt.
N
E
E
N
a)
b)
Abbildung 1. Schematische Darstellung der sterisch anspruchsvollen Verbindungen EIMes* (Mes* =
2,6-Bis(2,4,6-triisopropylphenyl)phenyl) und EI(DDP) (DDP = 2-Diisopropylphenylamino-4-diisopropylphenylimino-2-penten)
Neben den Cycopentadienyl-Derivaten gelang es Power und Roesky unter Verwendung
sterisch sehr anspruchsvoller Liganden wie substituierten β-Diketiminaten EI(DDP) (E = Al,
Ga;
DDP
=
2-Diisopropylphenylamino-4-diisopropylphenylimino-2-penten)[32-39]
oder
[25-31]
substituierten Arenen (E = In, Tl; Mes* = 2,6-Bis(2,4,6-triisopropylphenyl)phenyl)
im
I
Festkörper nicht assoziierte, einwertige E R-Fragmente herzustellen.
Strukturen niedervalenter Gruppe-13-Verbindungen EIR
Eine Vielzahl der niedervalenten Gruppe-13-Verbindungen ist im Feststoff auf interessante
Art aggregiert, während sie in der Gasphase und in Lösung monomer vorliegen. Was hält die
Cluster in diesen Verbindungen im festen Zustand zusammen? [{AlCp*}4] bildet ein
reguläres Tetraeder von Aluminiumatomen, an die jeweils ein η5-koordinierter Cp*-Ring
gebunden ist. Die sterisch anspruchsvollen, ineinander verzahnten Cp*-Liganden, welche den
Aluminiumtetraeder hochgradig von seiner Umgebung abschirmen, verleihen dieser
Verbindung ihre Stabilität, senken aber gleichzeitig die für die Koordinationschemie
erforderliche Monomerbildung in Lösung. So können erst oberhalb von Raumtemperatur
mittels
27
Al-NMR Kernresonanzspektroskopie monomere Einheiten von AlCp* in Lösung
nachgewiesen werden.[6,
57]
Die für [{Cp*Al}4] und die verwandten tetrameren Alkyl-5-
Bisheriger Kenntnisstand
_______________________________________________________________________
verbindungen [{EC(SiMe3)3}4] (E = Al, Ga, In) bestimmten E-E-Abstände ähneln denen in
den elementaren Metallen, was darauf schließen lässt, dass diese recht starken
Wechselwirkungen die Bildung der Cluster bedingt.
Cp*
Cp*
Ga
Ga
*Cp
Ga
Cp*
Ga
Al
407.3 pm
276.9 pm
*Cp
Cp*
Al
Ga
Al
*Cp
Ga
417.2 pm
*Cp
Al
Cp*
Cp*
d (Ga-Ga im Metall) = 245 - 307 pm
d (Al-Al im Metall) = 286 pm
Abbildung 2. Schematische Darstellung der M–M Wechselwirkungen von [{GaCp*}6] und [{Cp*Al}4] im
Kristall
Dagegen liegt [{GaCp*}6] im Festkörper als Hexamer vor, wobei die sehr langen Ga⋅⋅⋅Ga
Abstände auf nur schwache EI-EI-Wechselwirkungen hindeuten und der Zusammenhalt der
GaCp*-Einheiten im Polyeder nicht auf starke Ga-Ga-Wechselwirkungen, sondern
hauptsächlich auf zusätzliche van der Waals-Wechselwirkungen der äußeren organischen
Hülle beruht.[15] Diese schwachen E-E-Wechselwirkungen finden sich auch in hexameren
[{InCp*}6] sowie den polymeren Verbindungen [InCp], [TlCp] und [TlCp*].[18,
58]
Letztere
Verbindungen belegen, dass im Unterschied zu den leichteren Elementen der 13. Gruppe hier
der ionische Anteil der Bindung zwischen Ligand und Metall größer ist und schwächere
Metall-Metall-Wechselwirkungen vorliegen.
Bindungsverhältnisse in M-EIR Komplexen
Warum sind nun diese einwertigen Verbindungen der Gruppe 13 als Liganden in der
Metallorganik von Nutzen? Die Antwort auf diese Frage ergibt sich aus einer Analyse der
Grenzorbitale der Verbindungen EIR und deren Wechselwirkungen mit Übergangsmetallorbitalen entsprechender Symmetrie. Bis vor kurzem beschränkten sich alle theoretischen
-6-
Bisheriger Kenntnisstand
_______________________________________________________________________
Untersuchungen hinsichtlich der Bindungswechselwirkung M-E weitestgehend auf einzelne
Moleküle. Erst im Jahr 2000 publizierten Frenking und Mitarbeiter eine vergleichende Studie
der Bindungsverhältnisse von Komplexen [LnM-ER] und [M(ER)4] mit verschiedenen
organischen Gruppen R (R = Cp, Ph, N(SiH3)2, Me) und d-Metallzentren M (M = Fe, W, Ni,
Pd, Pt) für alle Elemente B bis Tl.
[45, 46]
Das allgemein anerkannte Bindungsmodell für die
I
M-E R-Bindung ist in Abbildung 3 dargestellt.
R
s
E
M
p
a)
R
E
M
p'
R
b)
R
M
E
E
M
R
q(+)
E
q(-)
M
Abbildung 3. a) Schematische Darstellung der M-EIR Orbital-Wechselwirkungen. b) Schematische
Darstellung
der
elektrostatischen
Wechselwirkuingen
zwischen
der
lokalen
elektronischen
Ladungskonzentration am Donor Atom E und des Akzeptor Atoms M. E verfügt über eine positive
Partialladung und M über eine negative Partialladung.
Die monomeren Verbindungen EIR verfügen formal über ein freies Elektronenpaar innerhalb
eines σ-Typ Orbitals (HOMO) und zwei unbesetzte p-Orbitale (LUMO) senkrecht zur E-C
Bindungsachse, so dass der elektronische Grundzustand als Singulett-Grundzustand
klassifiziert werden kann. Damit sind die Grenzorbitale der Verbindungen EIR denen des CO-7-
Bisheriger Kenntnisstand
_______________________________________________________________________
Moleküls ähnlich.[47,
55, 59]
In Anlehnung an die höheren Homologen der 14. Gruppe MR2
(Silylene, Germylene und Stannylene) werden die Liganden EIR häufig als carbenoid
bezeichnet, da die Chemie der Verbindungen EIR im wesentlichen Carben-analog ist (z.B.
Cycloadditionsreaktionen). Jedoch sind die Grenzorbitale von EIR nicht isolobal zu denen der
Singulett-Carbene, sondern entsprechen vielmehr denen des Carbin-Kations [H-C:]+. Insofern
wäre die Bezeichnung carbinoid zutreffender.
Der „lone-pair“ Charakter des höchsten besetzten Molekülorbitals und die damit
verbundene Fähigkeit dieser Verbindung als Lewis-Base fungieren zu können, wurde durch
Cowley und Mitarbeiter sowohl rechnerisch als experimentell anhand der Synthese der
Lewis-Säure-Base Addukte [Cp*Al→EPhF3] (E = B, Al) verdeutlicht.[60] Verwandte Addukte
konnte Jutzi et al. mit GaCp* in Gegenwart der koordinativ und elektronisch ungesättigten
Gruppe-13-Verbindungen B(C6F5)3, Ga(t-Bu)3 und Cp*GaX2 (X = Cl, I) isolieren.[61] Wie zu
erwarten, nimmt infolge des steigenden s-Anteils sowie der ungünstigeren Hybridisierung der
gerichtete Zweielektronendonor-Charakter von Gruppe-13-Metallorganylen EIR und die
Bindungsenergien M-EIR mit steigender Ordnungszahl ab.
Abbildung 4. Molekülstruktur von [Cp*Al-BPhF3] und [Cp*Ga-Cp*GaCl2] im Kristall
Demgegenüber kommt der M→EIR π-Rückbindung in der Regel eine geringere Bedeutung
zu, da das Gruppe-13-Metallatom über eine geringe Elektronegativität verfügt. Die M→EIRπ-Rückbindung folgt dem Trend B > Al > Ga > In > Tl und die Fähigkeit zur π-Rückbindung
ist abhängig vom Substituent R. Im Falle Alkyl-substituierter Gruppe-13-Metallzentren wie in
[EC(SiMe3)3] (E = Al, Ga, In), in welchen der Substituent über keine π-Donor-Eigenschaften
-8-
Bisheriger Kenntnisstand
_______________________________________________________________________
verfügt, sind die p-Orbitale im wesentlichen leer und es liegen starke M-E-Bindungen vor,
während in Liganden des Typs (C5R5)E aufgrund der π-Donor-Eigenschaften des CpSubstituenten beide p-Orbitale aus den C5R5-π-Orbitalen stammende Elektronendichte
enthalten. Dennoch können im Falle Cp-substituierter EIR-Fragmente durch Haptizitätsänderung des C5-Ringes von η5 nach η3 oder η1 freie Koordinationsstellen geschaffen werden,
wodurch gleichzeitig die π-Akzeptorfähigkeit erhöht wird.[16] Allerdings waren d-Metallkomplexe mit η1-koordinierten ECp* zu Beginn dieser Arbeit nicht dokumentiert.
Schließlich müssen in dem Bindungsmodell M-E auch Coulomb-Wechselwirkungen
berücksichtigt werden. Aufgrund der stark unterschiedlichen Elektronegativitäten der
Metallatome M und E lässt sich die M-E-Bindung (Eδ+-Mδ-) vorwiegend als ionisch
charakterisieren. Der kovalente Beitrag ist vergleichsweise gering (kovalente Bindungsordnung < 1), wobei die Gruppe-13-Metall Zentren stets eine positive Partialladung, die
Übergangsmetall-Zentren eine negative Partialladung tragen.
Aufgrund der großen Vielfalt an möglichen Substituenten beider Metallzentren sowie
in Abhängigkeit von der Koordinationszahl am Zentrum E können die elektronischen
Eigenschaften der M-E-Bindungen über einen weiten Bereich variieren. Das hat zur Folge,
dass Beschreibungen für die Metall-Metall-Bindung in derartigen Komplexen deutlich
voneinander abweichen. An den Verbindungen [(CO)4FeAlCp*][49] und [(CO)4Fe-GaMes*]
(Mes* = 2,6-Bis(2,4,6-triisopropylphenyl)phenyl)[26, 29] sei diese kontroverse Ansicht beispielhaft verdeutlicht.
OC
[Cp*AlCl2]2
Toluol
OC
CO
Fe
Al
CO
(Na/K)[Fe(CO)4]
OC
[Mes*GaCl2]
Et2O
OC
CO
Fe
Ga
CO
Schema 1. Darstellung von [(CO)4FeAlCp*] und [(CO)4FeGaMes*] (Mes* = 2,6-Bis(2,4,6-triisopropylphenyl)phenyl)
-9-
Bisheriger Kenntnisstand
_______________________________________________________________________
Fischer und Mitarbeiter haben, gestützt durch bindungstheoretische Analysen aus der
Arbeitsgruppe Frenking, für den Komplex [(CO)4FeAlCp*] eine Beschreibung als stark
polare, aber durchaus kovalente Donor-Akzeptor-Bindung [Cp*Al→Fe(CO)4] den Vorzug
vor einer von Schnöckel et al. favorisierten extremen Formulierung als Kontaktionenpaar
[(CO)4Fe]2-[AlCp*]2+ gegeben. Die Annahme eines AlIII-Zentrums basiert im wesentlichen
auf Modellrechnungen, die gezeigt haben, dass in dem Komplex [(CO)4FeAlCp*] eine höhere
Ladungspolarisierung besteht, als es für die hypothetische Vergleichsverbindung [Cp*Al=O]
gefunden wurde. Ferner würden experimentelle Befunde, wie die deutlich verkürzten Al-CBindungen in [(CO)4FeAlCp*] (2.147 Å) im Vergleich zu monomeren AlCp* (2.390 Å) eine
polare Fe-Al-Bindung nahelegen.[62]
Die unterschiedlichen Auffassungen über die M-E-Bindung kommen insbesondere für
den verstärkt diskutierten Aspekt des Ausmaßes von Rückbindungen des Typs M(dπ)-E(pπ)
zum Ausdruck. Da die EIR-Liganden als isolobal zu CO angesehen werden, wurde in der
Literatur häufig die Vermutung geäußert, dass den M-EIR-Bindungen Mehrfachbindungscharakter zuzuordnen ist. Herausragendes Beispiel hierfür ist die von Robinson et al.
synthetisierte Verbindung [(CO)4Fe-GaMes*], in der nach Aussage der Autoren eine EisenGallium-Dreifachbindung vorliegen soll.[26,
29]
Die Annahme eines Ferrogallins löste eine
scharfe Kontroverse aus, in deren Verlauf diese Hypothese nicht bestätigt werden konnte. [6365]
Zusammenfassend lässt sich sagen, dass die Diskussion pro und contra den
Bindungscharakter einen derzeit mangels adäquater Bindungsmodelle nicht vollständig
auflösbaren Pseudokonflikt darstellt. So unterschieden sich beide Formulierungen der
Bindungssituation in (CO)4Fe-ER schließlich nur im Grad der π-Rückbindung, die von Art
und Niveau der quantenchemischen Analyse abhängt.
Synthesestrategien zur Darstellung von M-EIR Komplexen
Kehren wir zur metallorganischen Synthesechemie zurück. Eine ganze Reihe von Methoden
hat sich zur Synthese von M-E-Komplexen etabliert (für Details ist auf frühere Übersichten
zu verweisen).[7,
66-68]
Im Hinblick auf die Koordinationschemie von EIR an Übergangs-
metallzentren haben sich in den letzten 10 Jahren vor allem zwei Synthesestrategien bewährt.
Die
Ligandensubstitution und die Insertionsreaktion in die Metall-Metall- bzw. Metall-
Halogen-Bindung.
- 10 -
Bisheriger Kenntnisstand
_______________________________________________________________________
1) Ligandensubstitution
Die Ähnlichkeit der Grenzorbitale der Verbindungen EIR mit denen von Kohlenmonoxid
hatte einen immensen Einfluss auf die Synthese von M-E-Verbindungen. Zahlreiche
präparative Arbeiten belegen die Möglichkeit, CO-Gruppen in d-Metallcarbonylen durch EIRFragmente zu substituieren. Jedoch ist dem Austausch der im Vergleich zu EIR stärker πaziden CO-Liganden eine intrinsische Grenze gesetzt. Wird ein CO-Ligand durch den
besseren σ-Donor-Ligand EIR ersetzt, so wird die Rückdonierung des d-Metallzentrums in
Richtung der übrigen Carbonylgruppen erhöht und diese infolgedessen stärker an das
Metallzentrum gebunden. Somit wird die Substitution weiterer CO-Liganden erschwert, wie
die Darstellung der Komplexe [(Co2(CO)6(µ2-ECp*)2] (E = Al[69], Ga[16]) oder
[(Mn2(CO)8(µ2-EC(SiMe3)3)2] (E = Ga[70], In[71]) ausgehend von den homoleptischen
Carbonylkomplexen [Co2(CO)8] bzw. [Mn2(CO)10] in Gegenwart von EIR belegt (Schema 2).
OC
CO
CO
Co
2 ECp*
+
Co2(CO)8
- 2 CO
E
E
Co
E = Al, Ga
OC
CO
CO
Schema 2. Synthese von [Co(CO)3{µ2-ECp*}2Co(CO)3] (E = Al, Ga)
Auch einige Beispiele von Substitutionsreaktionen an Carbonyl-Clustern, in denen das EIRFragment in den Produkten stets eine µ3-verbrückende Position einnimmt, wie etwa [Ni4(µ2–
GaCp*)2(µ3-GaCp*)2(CO)6],[16] oder die Serie [Rh6(µ3-CO)4-x(µ3-GaCp*)x(CO)12] (x = 14),[72] sind bekannt (Abbildung 5). Konstitution und strukturelle Charakteristika dieser
GaCp*-substituierten Ni4- und Rh6-Carbonyl-Cluster von Jutzi et al. leiten sich unmittelbar
von den Grundtypen der Metallcarbonyle ab. Demzufolge stellen d-Metallcarbonyle keine
geeigneten Precursoren zum Aufbau von homoleptischen Komplexen des Typs [Ma(ER)b] (a
< b) dar.
Einen Ausweg aus dieser Sackgasse deutete sich bei der Suche nach M-E-Komplexen
mit endständig koordinierten Liganden EIR an, die für Kohlenmonoxid die am häufigsten
anzutreffende Bindungsart ist. So gab es lange Zeit keine Berichte über die Synthese terminal
- 11 -
Bisheriger Kenntnisstand
_______________________________________________________________________
EIR-substituierter d-Metallkomplexe. Die in unserer Arbeitsgruppe via Salzmetathese
dargestellte Verbindung [(CO)4FeAlCp*][49] war das erste Beispiel für diese Verbindungsklasse (Schema 1). Noch immer sind AlCp*-substituierte d-Metallkomplexe selten. Insgesamt
waren zu Beginn dieser Arbeit vier Beispiele bekannt. Zum Beispiel ist [Cr(CO)5(AlCp*)] aus
der Reaktion von [Cr(CO)5(coe)] (coe = cis-Cycloocten) mit AlCp* zugänglich.[62] Die
Einführung von zwei terminal koordinierten GaCp*-Liganden gelang erstmals 1999 mit den
Verbindungen [cis-(GaCp*)2M(CO)4] (M = Cr, Mo) durch Substitution des chelatisierend
koordinierten, leicht substituierbaren Norbornadienliganden in [(nbd)M(CO)4].[54] M-EKomplexe mit mehr als zwei endständig koordinierten EIR-Liganden an einem oktaedrischen
d-Metallzentrum waren zu Beginn dieser Arbeit unbekannt. Nach Aussage von Jutzi und
Mitarbeiter sollten derartige Komplexe bedingt durch die sterische Repulsion der
anspruchsvollen EIR Liganden nur schwer zugänglich. Der von den Autoren berechnete
Kegelwinkel von η5-GaCp* beträgt 112° und ist in etwa vergleichbar mit den Kegelwinkeln
der sterisch vergleichsweise anspruchslosen Phosphanliganden PH2Et (111°) oder PMe3
(118°).[16] Die Synthese homoleptischer M-E-Komplexe [M(ECp*)n] (n = 4, 5, 6) sollte daher
aus sterischen Gründen möglich sein.
Abbildung 5. Molekülstruktur von [Rh6(µ3-CO)(µ3-GaCp*)3(CO)12] im Kristall
Ausschlaggebend bei der Darstellung der zuletzt genannten Verbindungen ist der gewählte
Zugangsweg. Als d-Metallkomplexe wurden hier nicht carbonylhaltige Systeme gewählt,
sondern es wurde auf die Substitution leicht verdrängbarer, labil gebundener Liganden wie
- 12 -
Bisheriger Kenntnisstand
_______________________________________________________________________
Olefine (cod, nbd, C2H4) zurückgegriffen. Dieser klassische Ansatz hat, neben der
Generierung anderer carbonylhaltiger Systeme wie [(CO)3Fe{µ2-ER}3Fe(CO)3] (E = Ga, R =
Cp*[16]; E = In, R = C(SiMe3)3[73]), maßgeblich zum Aufbau homoleptischer Komplexe
[Ma(ER)b] beigetragen. So waren homoleptische d-Metallkomplexe, in denen das Metallzentrum nur von EIR-Gruppen und nicht von anderen Liganden koordiniert wird, bis 1998
unbekannt. Uhl und Mitarbeiter synthetisierten den ersten homoleptischen NiIn4-Komplex aus
[Ni(cod)2] und [{InC(SiMe3)3}4], der ein Analogon zu dem einkernigen binären
Carbonylkomplex [Ni(CO)4] darstellt.[55]
InC(SiMe3)3
Ni(cod)2
InC(SiMe3)3
Ni
- 2 cod
(Me3Si)3CIn
InC(SiMe3)3
InC(SiMe3)3
Schema 3. Synthese des ersten homoleptischen NiIn4-Komplexes [Ni{InC(SiMe3)3}4]
Wie durch quantenchemische Rechnungen[47] gezeigt wurde, ist bedingt durch die Alkylsubstituierten Indium-Liganden die Bindungssituation in dieser NiIn4-Verbindung ähnlich zu
derjenigen von [Ni(CO)4] mit einer sehr effektiven Rückbindung von Elektronendichte vom
Metallatom zu den koordinativ und elektronisch stark ungesättigten Indiumatomen.
Inzwischen ist diese Reihe durch weitere ausschließlich EIR-substituierter Komplexe ergänzt
worden, welche alle durch Substitution von Bis(cyclooctadien)metall0 mit den entsprechenden
Gruppe-13-Organylen synthetisiert wurden.
Abbildung 6. Molekülstrukturen von [Ni(GaCp*)4] und [Ni{Ga(C(SiMe3)3}4] im Kristall
- 13 -
Bisheriger Kenntnisstand
_______________________________________________________________________
Die zwei Nickel-Komplexe [Ni(GaCp*)4][54], [Ni{Ga(C(SiMe3)3}4][47] sowie der homologe
Platin-Komplex [Pt{InC(SiMe3)3}4][56] besitzen eine nahezu ideal tetraedrische Struktur
bezüglich des d-Metallzentrums und leiten sich unmittelbar von den entsprechenden
Carbonyl- bzw. Phoshanverbindungen ab. Für den Vektor Cp*Zentrum-Ga-Ni in [Ni(GaCp*)4]
wurde eine substantielle Abweichung von der Linearität beobachtet (35°), wofür repulsive
intramolekulare Wechselwirkungen zwischen den Methylgruppen der verschiedenen GaCp*Liganden verantwortlich gemacht werden.[54] Die mononuklearen homoleptischen Komplexe
[M{EC(SiMe3)3}4] (M = Ni, E = Ga; M = Pt, E = In) und [Ni(GaCp*)4] belegen durch
Bindungslängenvergleich auch aus strukturchemischer bzw. koordinationschemischer Sicht
die Isolobalbeziehung zwischen CO und EIR.
Eine heuristisch ebenso wertvolle Analogie der EIR-Liganden zu Phosphanen ergibt
sich anhand der von [Pt(PR3)4] abgeleiteten Serie [(dcpe)Pt(ER)2] (E = Al, Ga, In, R = Cp*; E
= Ga, R = C(SiMe3)3; dcpe = bis(dicyclohexyl)phosphinoethan).[50,
52]
Die Phosphan-
substituierten Komplexe [(dcpe)Pt(ER)2] mit terminal koordinierten Liganden EIR sind
gemäß Schema 4 quantitativ durch thermische Aktivierung des Hydridkomplexes
[(dcpe)Pt(H)(CH2t-Bu)] und Koordination des durch reduktive Eliminierung von Neopentan
gebildeten 14 Valenzelektronen-Komplexfragments [(dcpe)Pt] durch die EIR-Spezies
zugänglich. Auch ein Vergleich der ν(CO)-Streckschwingungen in den Komplexen
[LCr(CO)5] und [LFe(CO)4] (L = PR3, GaCp*) belegt, dass die elektronischen Eigenschaften
von GaCp* vergleichbar sind mit denen der Phosphane, die bekanntermaßen als starke σDonoren und schwache π-Akzeptoren klassifiziert werden können.[16, 62]
Cy2
P
CH2t-Bu
Pt
P
Cy2
H
Cy2
P
60 - 70 °C
- CMe4
Cy2
P
Pt
P
Cy2
2 ER
ER
Pt
P
Cy2
ER
E = Al, R = Cp*
E = Ga, R = Cp*
E = Ga, R = C(SiMe3)3
E = In, R = Cp*
Schema 4. Synthese der EIR-substituierten Phosphinoplatinkomplexe [(dcpe)Pt(ER)2]
Die im Jahre 1999 von Ramaswamy Murugavel und Vadapalli Chandrasekhar geäußerte
Vermutung, dass "Metallorganische Verbindungen von einwertigen Elementen der 13.
- 14 -
Bisheriger Kenntnisstand
_______________________________________________________________________
Gruppe" als Liganden in der Übergangsmetallchemie "wahrscheinlich einen immensen
Einfluß darauf haben, wie man künftig neue Metall-Metall-Bindungen herstellt ... und wir in
der Zukunft zweifellos Zeugen der Herstellung vieler neuer Clustertypen sein werden", wurde
nur ein Jahr später durch unsere Arbeitsgruppe bestätigt.[8] Der aus [Pt(η2-C2H4)3] und
überschüssigem GaCp* selektiv zugängliche Komplex [Pt2(GaCp*)2(µ2-GaCp*)3] weist eine
ungewöhnliche Molekülstruktur im Festkörper auf.[51] Die Diplatin-zentrierte trigonalbipyramidale Struktur wird aus einer Pt2-Einheit mit zwei endständig koordinierten und drei
verbrückenden GaCp*-Liganden gebildet (Abbildung 7). Dieser Cluster ist das erste Beispiel
für einen homoleptischen mehrkernigen Vertreter, für den weder strukturanaloge Carbonylnoch Phosphan-Komplexe bekannt sind. Durch die Fähigkeit von einwertigen Gruppe-13Metallorganylen, je nach organischen Rest R und nach Art des ÜbergangsmetallKomplexfragments sowohl als σ-Donor/π-Akzeptor-Ligand als auch als reiner σ-Donor zu
fungieren, erlaubt der Einsatz dieses modernen Ligandentyps offensichtlich die Synthese
völlig neuartiger Komplexstrukturen, welche für die üblichen Ligandentypen (CO,
Phosphane) bislang unbekannt sind. In diesem Zusammenhang bleibt zu klären, inwiefern
dieser dinukleare Komplex ein struktureller Einzelfall ist, oder hier tatsächlich der Beginn
einer neuen homoleptischen Serie [Ma(ER)b] (a < b) gefunden wurde.
Abbildung 7. Molekülstruktur von [Pt2(GaCp*)2(µ2-GaCp*)3] im Kristall
- 15 -
Bisheriger Kenntnisstand
_______________________________________________________________________
Die Besonderheit der homoleptischen Verbindungen [M(ER)4] und der dinuklearen
Clusterverbindung [Pt2(GaCp*)5] kommt auch in dem Zahlenverhältnis der Metallatome M
und E (M/E < 1) zum Ausdruck. In der Regel ist das Verhältnis M/E ≥ 1. Komplexe, die mehr
als ein Gruppe-13-Metallzentrum pro d-Metallatom enthalten, sind sehr selten, da sich die
meisten Konstitutionen und Strukturen von den zugrundeliegenden Trihalogeniden- oder
Trialkylverbindungen EX3 bzw. ER3 und deren Koordinationschemie ableiten. Bedingt durch
die geringe Strukturvielfalt von M-E-Komplexen mit einem invertierten Zahlenverhältnis,
konnte bislang nicht hinreichend geklärt werden, welche möglichen Verhältnisse M/E in den
Verbindungen eingestellt werden können.
2) Insertionsreaktionen
Neben der Substitution labil gebundener Liganden bieten auch Insertionsreaktionen in die
Metall-Metall-
und
Metall-Halogen-Bindungen
einen
klassischen
Syntheseweg
zur
Generierung von M-E-Komplexen. Für Metallcarbonyl-Komplexe ist die Insertion von
niedervalenten Halogeniden E2X4 und EX (E = Ga, In) verlässlich und gut dokumentiert.
80]
[74-
Typisch ist die Insertion von InX (X = Cl, Br) in die M-M-Bindung von [{Cp(CO)3M}2]
unter Bildung der dimeren Komplexe [{InCl(Cp(CO)3M)2}2].[81] Green et al. beschrieben die
Insertion von „GaI“ in die Metall-Iod-Bindung von [CpFe(CO)2I] und [(C5H4Me)Mo(CO)3I].[74] Über Insertionen mit niedervalenten AlX-Derivaten in M-M- oder M-XBindungen ist nichts bekannt.
Insertionen
an
„CO-freien“ d-Metallkomplexen
sind
dagegen
weniger
gut
dokumentiert. Frühe Arbeiten von Hsieh et al. enthalten Hinweise auf Umsetzungen von
[Ph3PAuCl] oder [(Et2P)2PtCl2] mit InCl, wobei die Bildung der entsprechenden
Insertionsprodukte mit einer Einheit „M-InCl2“ auf der Basis elementaranalytischer und IRspektroskopischer Daten angenommen wurde.[77] Darüber hinaus gehende Analysen der
Molekülstrukturen konnten bedingt durch die Unlöslichkeit der Produkte nicht durchgeführt
werden. Jüngste Untersuchungen dieser Reaktionen ergaben, dass dieses einfache Bild nicht
korrekt ist und vielmehr von Redoxprozessen begleitete, komplexe Vorgänge ablaufen. So
bildet sich im System [Ph3PAuCl]/InCl hauptsächlich das Salz [(Ph3P)2Au][InCl4]. Erst ein
Zusatz von chelatisierenden Phosphanliganden wie 1,2-Bisdiphenylphosphinoethan (dppe)
erlaubt die Isolierung eines Au3In3-Clusters [(dppe)2Au3In3Cl6(thf)6] aus dem Reaktionsgemisch.[82]
- 16 -
Bisheriger Kenntnisstand
_______________________________________________________________________
Die Stabilität, Verfügbarkeit und schließlich auch die Löslichkeit der carbenoiden Gruppe-13Metallorganyle EIR ermöglicht dieses Konzept zur Generierung von M-E-Bindungen
insbesondere für „CO-freie“ Systeme zu überarbeiten und wirft gleichzeitig einige Fragen
hinsichtlich den Molekülstrukturen der Insertionsprodukte auf. Die im Jahr 1994 von
Schnöckel und Mitarbeiter publizierte Umsetzung von [{Cp*Al}4] mit [Cp2Ni] zum ButterflyCluster [(CpNi)2(µ2-AlCp*)2], die formal als Insertion von AlCp* in eine NiCp-Bindung
aufgefasst werden kann, war das erste Beispiel für diese Methode und gleichzeitig der erste
synthetisierte „all hydrocarbon“ M-EIR-Komplex (Abbildung 8).[53]
Abbildung 8. Molekülstruktur von [(CpNi)2(µ2-AlCp*)2] im Kristall
Die Verbindung [(CpNi)2(µ2-AlCp*)2] leitet sich unmittelbar von dem MetallcarbonylKomplex [(CpNi)2(µ2-CO)2] ab, der seinerseits Reaktionen mit der niedervalenten EIRSpezies eingeht. Uhl und Mitarbeiter konnten zeigen, dass in Abhängigkeit von der
Stöchiometrie, InC(SiMe3)3 in die Ni-Ni-Bindung von [(CpNi)2(µ2-CO)2] insertiert und das
Insertionsprodukt [(Me3Si)3CIn(NiCpCO)2] bildet oder es erfolgt eine Substitution der
verbrückenden CO-Liganden unter Ausbildung des Ni2In2-Komplexes [(CpNi)2(µ2InC(SiMe3)3)2].[48] Die unerwartete Insertion von InC(SiMe3)3 in die Metall-Metall-Bindung
belegte zum ersten Mal, dass niedervalente Indiumorganyle sich nicht immer wie eine CO
analoge Verbindung verhalten müssen.
Jutzi et al. haben das Potential von GaCp* im Hinblick auf Insertionsreaktionen
aufgezeigt.[83] Die Reaktion von GaCp* mit FeCl2 führt zu dem Komplex [Cp*(Cp*Ga)2Fe- 17 -
Bisheriger Kenntnisstand
_______________________________________________________________________
GaCl2⋅THF]. Diese Verbindung ist das Resultat drei aufeinander folgender Reaktionsschritte:
Insertion in die Fe-Cl-Bindung, Cp*/Cl-Austausch und schließlich σ/π Umlagerung des Cp*Restes. Die Insertionsreaktion in die Fe-Cl-Bindung des elektronisch gesättigten Komplexes
[Cp*(CO)2FeCl] beinhaltet dagegen keine weitere Umlagerungsreaktion und führt selektiv zu
[Cp*(CO)2FeGa(η2-Cp*)Cl] (Schema 5).
Cl
FeCl2
Fe
THF
Ga
Cl
*CpGa
O
*CpGa
Cp*Ga
Cl
Cp*(CO)2FeCl
Fe
Toluol
Ga
OC
OC
Schema 5. Insertion von Cp*Ga in die Fe-Cl-Bindung von FeCl2 und [Cp*(CO)2FeCl]
Darüber hinaus könnten Insertionsreaktionen auch einen Zugang bieten, um d-Metallzentren
des Typs [LnM(X)2] (X = Halogene, Alkyle) durch Übertragung von Halogenen oder AlkylGuppen auf das niedervalente EI-Zentrum unter Ausbildung der aciden Spezies ER(X)2 zu
reduzieren. Dieser Redoxprozess beruht auf den reduzierenden Eigenschaften von EIR,
welche insbesondere für Aluminium besonders stark ausgeprägt sind (Al+ → Al3+).[12]
- 18 -
Bisheriger Kenntnisstand
_______________________________________________________________________
Zusammenfassung und Zielsetzung
Bedeutende Fortschritte wurden auf dem Gebiet der Stabilisierung niedervalenter EIRFragmente erzielt. Das Potential niedervalenter Gruppe-13-Metallverbindungen EIR in der
Koordinationschemie an d-Metallzentren wurde an zahlreichen Beispielen aufgezeigt. Die ME-Bindungen in den verschiedenen Komplextypen fügen sich gut in das gewohnte DonorAkzeptor-Konzept ein. Mehrfachbindungen spielen eine untergeordnete Rolle.
Trotz der vergleichsweise großen Vielzahl an präparativen Arbeiten sowie
quantenchemischen Beschreibungen der Bindungsverhältnisse in den letzten 10 Jahren, ist
eine Reihe von Fragen ungeklärt. Die Synthese von M-E-Komplexen beschränkte sich
vorwiegend auf Übergangsmetallcarbonyle. Die Isolobalbeziehung zu CO konnte somit an
zahlreichen Beispielen auch strukturell belegt werden. Allerdings stellen Metallcarbonyle
keine geeigneten Precursoren zur Darstellung von homoleptischen Komplexen [Ma(ER)b] (a <
b) dar. Dabei sind gerade diese Vertreter von großem synthetischen Interesse, da den EIRLiganden in der Koordinationschemie an d-Metallzentren offenbar ein größeres Potential
hinsichtlich der Reaktivität und Reichhaltigkeit an Clusterstrukturen zukommt, als der
formale Vergleich mit CO oder Phosphanen vermuten lässt.
Die Zielsetzung dieser Arbeit beruht nun im Wesentlichen auf der Synthese von πAkzeptor-Ligand
freien
(insbesondere
CO-freien)
M-E-Komplexen
via
Liganden-
substitutionen und Insertionsreaktionen und der Analyse der entstandenen Strukturen sowohl
im Festkörper als auch in Lösung. Dabei ist die Wahl geeigneter d-Metallprecursoren ebenso
ungeklärt, wie die Gestalt, Größe und Zusammensetzung der entstehenden Molekülstrukturen.
Auffallend wenig wurde bislang die Reaktivität von M-E-Komplexen zum Gegenstand der
Untersuchung. Neben der Frage, inwieweit sich diese Verbindungen als Bausteine für weitere
Synthesen nutzen lassen, stehen reaktive Vergleiche mit klassischen metallorganischen
Liganden wie CO und Phosphane noch aus. Diese ermöglichen die EIR-Liganden bezüglich
ihrer Bindungseigenschaften auch aus experimenteller Sicht genauer zu charakterisieren und
einzuordnen. Darüber hinaus sollten die unterschiedlichen Bindungseigenschaften (σ-Donor,
π-Akzeptor, Polarität) innerhalb der 13. Gruppe auch in einer vielfältigen Reaktivität zum
Ausdruck kommen. Insbesondere der starke σ-Donor Charakter von AlCp*, verbunden mit
einer hohen Bindungspolariät Mδ--Eδ+, lässt im Hinblick auf Aktivierungsreaktionen am
Übergangsmetallzentrum M neue Möglichkeiten und Perspektiven von EIR erahnen, welche
es im Rahmen dieser Arbeit zu untersuchen gilt.
- 19 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
III. Ergebnisse und Diskussion
1.
Insertionsreaktionen von Gruppe-13-Metallorganylen EIR in
Metall-Metall- und Metall-Halogen-Bindungen
1.1. Insertion
von
GaCp*
in
die
Metall-Metall-Bindung
von
[(Cp)(CO)2M≡M(CO)2(Cp)] (M = Mo, W)
In Kapitel II wurde bereits dargelegt, dass eine Reihe von M-E-Komplexen durch Insertion
der niedervalenten Spezies EIR in die M-X-Bindung zugänglich ist. Infolge der Isolobalbeziehung von EIR zu Kohlenmonoxid und zu dem Carbin Kation [H-C:]+ kann der EIRSpezies ein gewisser carbenoider Charakter zugeschrieben werden. So konnte Schnöckel et al.
zeigen, dass AlI-Halogenide und in situ erzeugte Arduengo-artige AlI-Heterocyclen des Typs
AlI(DDP) (DDP = 2-Diisopropylphenylamino-4-diisopropyl-phenylimino-2-penten) an
Alkine addieren und Cyclopropen-Derivate bilden.[84,
85]
Eine entsprechende Insertion der
I
E R-Spezies in eine koordinativ ungesättigte Metall-Metall-Mehrfachbindung wurde dagegen
bislang nicht beschrieben. Zur Untersuchung der Reaktivität von EIR gegenüber Systemen mit
Metall-Metall-Mehrfachbindungen bieten sich die dimeren Mo2- bzw. W2-Komplexe
[(Cp)(CO)2M≡M(CO)2(Cp)] (M = Mo, W) als prototypische Beispiele an. Die hohe
Reaktivität der π-Komponente der Dreifachbindung in diesen Verbindungen ermöglicht eine
Vielzahl an Insertionssreaktionen in Gegenwart von weichen Nukleophilen (Phosphine,
Phosphite, Alkine, Iod, HCl etc.), wobei die eintretenden Liganden sowohl terminale, als auch
verbrückende Positionen einnehmen.[86]
Darstellung von [{(OC)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b)
Wird gemäß Schema 6 eine Suspension von [{CpMo(CO)2}2] in Hexan mit 2 Äquivalenten
GaCp* bei Raumtemperatur versetzt, so bildet sich das gelbe Insertionsprodukt
[{(OC)2(Cp)Mo(µ2-(η1-GaCp*))}2] (1a). Die analoge W2Ga2-Verbindung 1b wird durch
Refluxieren von [{CpW(CO)2}2] in Gegenwart von 2 Äquivalenten GaCp* in Hexan
erhalten.[87]
- 20 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
OC
OC
OC
M
M
2 GaCp*
CO
CO
1b: M = W
OC
Ga
M
M
Ga
CO
CO
1a: M = Mo
1b: M = W
Schema 6. Synthese von [{(OC)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b)
Die Verbindung 1a ist in unpolaren Lösungsmitteln nur wenig löslich, kann aber durch
langsames Abkühlen einer auf 150°C erwärmten, gesättigten DiethylenglykoldiethlyetherLösung (diglyme) in Form von wohlgeformten, gelben Einkristallen in reproduzierbaren
Ausbeuten um 50 % umkristallisiert werden. Verbindung 1a ist bei Raumtemperatur stabil
und zersetzt sich im Festkörper bei 190°C. Komplex 1b zeigt eine bessere Löslichkeit in
unpolaren Lösungsmitteln und kann in einer Mischung aus Hexan/Toluol in Form von roten
Einkristallen in Ausbeuten um 50 % umkristallisiert werden. Verbindung 1b ist bei RT stabil
und zersetzt sich im Festkörper bei 183°C.
Bemerkenswerterweise insertieren andere niedervalente Gruppe-13-Organyle, wie
AlCp*, InCp* und InC(SiMe3)3 nicht in die Metall-Metall-Dreifachbindung von
[{CpM(CO)2}2] (M = Mo, W), was anhand von in situ NMR-Messungen in geschlossenen
NMR-Röhrchen nachgewiesen wurde.
Spektroskopische Charakterisierung von [{(OC)2(Cp)M(µ2-GaCp*)}2] (M=Mo 1a,W 1b)
Die IR-Spektren von 1a und 1b zeigen jeweils zwei Frequenzen der v(CO)Streckschwingungen bei 1888 und 1832 cm-1 (1a) sowie bei 1874 und 1826 cm-1 (1b). Die
Lage der v(CO)-Banden liegt im Bereich für verbrückende CO-Liganden, was auf ein
verhältnismäßig elektronenreiches d-Metallzentrum hinweist. Die 1H-NMR-Spektren von 1a
und 1b zeigen jeweils zwei Singuletts bei 2.08 und 4.61 ppm (1a) bzw. 2.12 und 4.58 ppm
(1b) für die Methyl-Gruppen des Cp*- und den Protonen des Cp-Ringes im Verhältnis von 30
- 21 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
zu 10. In den
13
C-NMR-Spektren werden jeweils vier Resonanzen beobachtet, die den CO-
Substituenten (219.8 ppm für 1a, 220.9 ppm für 1b), den Ring-C-Atomen der Cp*-Gruppe
(120.6 ppm für 1a, 122.2 ppm für 1b), den Ring-C-Atomen des Cp-Ringes (82.1 ppm für 1a,
82.4 ppm für 1b) und den Methyl-Gruppen der Cp*-Einheiten (12.9 ppm für 1a, 12.3 ppm für
1b) zugeordnet werden können. Interessanterweise ist im 1H- und
13
C-NMR nur jeweils ein
1
Signal bzw. ein Signalsatz für die im Festkörper η -koordinierten Cp*-Einheiten zu erkennen.
Diese Koaleszenz der Signale erklärt sich durch eine schnelle sigmatrope Umlagerung der
Cp*-Gruppen in Lösung auf der NMR-Zeitskala, was bereits für die dinukleare Verbindung
[{(η1-GaCp*)NXyl}2] (Xyl = 2,6-Me2C6H3) beschrieben wurde.[88]
OC
OC
OC
W
W
2 Cp*Ga
OC
CO
Ga
W
W
Ga
CO
CO
CO
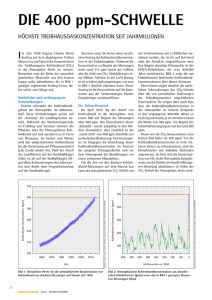
Abbildung 9. Hochtemperatur 1H-NMR-Spektrum von [{(OC)2(Cp)W(µ2-(η1-GaCp*))}2] (1b);
1
Cp* Signale von [{(OC)2(Cp)W(µ2-(η -GaCp*))}2] (1b);
Cp und
Cp und Cp* Signale von [{CpW(CO)2}2] und
GaCp*
Darüber hinaus zeigt das 1H-NMR-Spektrum von 1b oberhalb von 40°C eine interessante
Temperaturabhängigkeit (Abbildung 9). 1b weist bei Raumtemperatur zwei Singuletts bei
4.58 ppm (Cp) und 2.12 (Cp*) auf. Beim Erwärmen auf 40°C erscheinen zwei neue Signale
bei 4.77 und 1.92 ppm, die eindeutig den Ausgangsverbindungen [{CpW(CO)2}2] und GaCp*
- 22 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
zuzuordnen sind. Mit steigender Temperatur nehmen die Intensitäten dieser Signale zu, bis
bei 70°C ein Verhältnis freier Ligand zu koordiniertem GaCp* von 17 % erreicht wird. Nach
Abkühlen auf Raumtemperatur wird das ursprüngliche Spektrum von 1b erhalten. Diese
Beobachtung steht im Einklang mit einem Gleichgewicht zwischen 1b und den Ausgangsverbindungen. Aus entropischen Gründen ist dieses Gleichgewicht bei höheren Temperaturen
auf Seiten der Dissoziationsprodukte verlagert. Darüber hinaus wird das Signal für den freien
Liganden mit steigender Temperatur zunehmend breit und verschiebt sich in Richtung des
koordiniertem GaCp*-Signals. Bei 70°C ist bereits eine leichte Signalüberlagerung mit den
koordinierten Liganden zu beobachten. Diese beginnende Koaleszenz deutet auf einen
Austausch zwischen dem in Komplex 1b koordinierten und freien Liganden. Verbindung 1a
ist dagegen in Lösung stabil und zeigt kein ähnliches Verhalten.
Strukturelle Charakterisierung von [{(OC)2(Cp)M(µ2-GaCp*)}2] (M = Mo 1a, W 1b)
Im Anschluß an die Synthese von [{(OC)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b)
wird durch langsames Abkühlen einer gesättigten Diglyme-Lösung die Verbindung 1a in
Form von gelben Kristallen erhalten. Verbindung 1b wird aus einem Gemisch aus
Hexan/Toluol bei Raumtemperatur umkristallisiert. Die Molekülstrukturen von 1a und 1b
sind in Abbildung 10 dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 1
angeführt.
Die Verbindungen 1a und 1b sind isostrukturell und kristallisieren in der
orthorhombischen Raumgruppe Pbca. Die Molekülstrukturen von 1a und 1b weisen eine
zentrale Einheit von zwei Gallium- und zwei Molybdän- bzw. Wolframzentren auf. Der
Ga2M2-Ring ist planar mit einem Inversionszentrum in der Mitte des Vierringes. Die kleinen
Abweichungen der Winkel Ga-M-Ga (M = Mo 93.6(2)°, W 94.3(2)°) und M-Ga-M (Mo
86.39(2)°; W 85.7(2)°) von dem Idealwert 90° sowie die geringfügig unterschiedlichen MGa-Bindungsabstände von 2.5374(7) Å (W-Ga 2.5356(8) Å) und 2.6063(7) Å (W-Ga
2.6081(8) Å) ergeben eine leicht verzerrte quadratische Geometrie. Die Bindungslängen
zwischen den d-Metallzentren (M = Mo 3.521 Å, W 3.498 Å) sind bemerkenswert lang, so
dass eine direkte Metall-Metall-Wechselwirkung fraglich erscheint. Ein Vergleich der M-MAbstände (M = Mo, W) in 1a und 1b mit den M-M-Einfachbindungen in den Komplexen
[{CpMo(CO)3}2] (3.235(1) Å),[89] [{(CO)2CpM}2As2] (M = Mo 3.038(2) Å, W 3.027(2)
- 23 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
Å),[90] [(Cp)2Mo2(CO)4(µ2-I)(µ2-H)] (3.310(2) Å)[91] und [(Cp*)(S)W-W(CO)2(Cp*)(µ2-S)]
(3.045(2) Å)[92] unterstreicht diese Bedenken. Demgegenüber sind aber auch einige
Verbindungen bekannt, die eine längere M-M-Bindung aufweisen. Der Komplex
[HMo2(CO)9(NO)] verfügt über einen Mo-Mo-Bindungsabstand von 3.540(1) Å, den die
Autoren
auf
[93]
zurückführen.
die
Repulsion
der
ekliptisch
angeordneten
äquatorialen
Liganden
Der W-W-Abstand in dem Komplex [HW2(CO)7(P(p-C6H4F)3)2-(NO)][94] hat
einen Wert von 3.5345(5) Å, wobei eine bindende Metall-Metall-Wechselwirkung, mit
Ausnahme
der
Zweielektronen-Dreizentrenbindung
W-H-W,
nicht
diskutiert
wird.
Gleichwohl verfügt das Fragment [Cp(CO)2M] in 1a und 1b über eine Valenzelektronenzahl
von 15. Bedingt durch das diamagnetische Verhalten der Komplexe 1a und 1b, könnte ein
attraktiver M-M-Wechselwirkungsanteil in Betracht gezogen werden.
Abbildung 10. Molekülstruktur von [{(OC)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b) im Kristall
Die Ga⋅⋅⋅Ga-Bindungsabstände in 1a und 1b betragen 3.750(7) und 3.772(8) Å. Diese Werte
sind etwas kleiner aber dennoch vergleichbar mit der Situation in hexameren [{GaCp*}6] mit
Ga⋅⋅⋅Ga-Abständen von 4.073(2) bis 4.173(3) Å.[15] Wie bereits in Kapitel II diskutiert, ist die
hexamere Struktur von [{GaCp*}6] in erster Linie ein Resultat der van der Waals-Wechselwirkungen der Cp*-Ringe. Direkte Ga-Ga-Wechselwirkungen spielen eine untergeordnete
Rolle. Im Gegensatz dazu ist die Ga-Ga-Bindung in der tetrameren Verbindung
- 24 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
[{GaC(SiMe3)3}4] (2.678(4) und 2.702(3) Å)[20] deutlich verkürzt. Demzufolge können
bindende Ga-Ga-Wechselwirkungen in 1a und 1b ausgeschlossen werden.
Interessanterweise sind die Cp*-Gruppen in 1a und 1b nicht η5, sondern η1 an den
Galliumzentren koordiniert. Daher alternieren die C-C-Bindungen in dem C5-Ring mit
Werten für die C=C-Doppelbindungen von ca. 1.36 Å und C-C-Einfachbindungen von rund
1.45 Å. Die an den Galliumzentren koordinierten C-Atome (C(5) und C(15)) sind sp3hybridisiert, wodurch die Cp*-Ringe nicht planar, sondern gewinkelt vorliegen mit
Torsionswinkeln von 31.8(7)° (1a) und 36.2(9)° (1b). Hingegen sind die Cp-Ringe an den
Molybdän- bzw. Wolframzentren η5-gebunden mit C-C-Bindungslängen zwischen 1.382(10)
und 1.413(9) Å.
Tabelle 1. Vergleich ausgewählter Bindungsabstände (Å) und Winkel (°) für die Komplexe
[{(OC)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b)
1a
1b
M(1)-Ga(1)
2.5374(7)
2.5356(8)
M(1)-Ga(2)
2.6063(7)
2.6081(8)
M(1)-M(2)
3.521
3.498
Ga(1)···Ga(2)
3.750(7)
3.772(8)
M(1)–CpZentrum
1.999
1.996
Ga(1)–C(5)
2.055(4)
2.039(6)
C(5)–C(6)
1.462(6)
1.484(9)
C(6)–C(7)
1.365(7)
1.366(9)
M(1)–Ga(1)–M(2)
86.393(19)
85.7(2)
Ga(1)–M(1)–Ga(2)
93.6(2)
94.3(2)
M(1)–C(1)–O(1)
173.5(4)
171.4(6)
C(1)–M(1)–C(2)
74.52(19)
74.6(3)
M(1)–Ga(1)–C(1)
144.63(14)
144.74(17)
C(10)–C(5)–C(6)–C(11)
31.8(7)
36.2(9)
Die η1-koordinierten Cp*-Ringe in 1a und 1b sind die ersten Beispiele für d-Metallverbindungen mit verbrückenden η1-GaCp*-Liganden. Es ist möglich, dass dieses spezielle
Bindungsverhalten eine Konsequenz der sterischen Repulsion der Cp*- und Cp-Liganden in
Komplex 1a und 1b ist. Dagegen sollte eine η1-Koordination auch die π-Rückbindung von
den d-Metallzentren zu den Galliumatomen erleichtern. Entsprechend der umstrittenen
Bindungssituation in [Fe(CO)4(AlCp*)][49] könnte aber auch eine mehr ionische
- 25 -
Ergebnisse
Insertion von GaCp* in M≡M-Bindungen (M = Mo, W)
________________________________________________________________________
Wechselwirkung der Form M2-/Ga3+ als extreme Formulierung der Bindungsverhältnisse in 1a
und 1b postuliert werden. Die Mo-Ga-Bindungslängen in 1a (2.5374(7) und 2.6063(7) Å)
sind deutlich kürzer, als in dem Komplex [Mo2(CO)6(µ2-(GaCp*))3] (9) (2.666 Å), der in
Kapitel 2.1 näher beschrieben wird. Die Werte von 1a sind vergleichbar mit dem Mo-GaBindungsabstand in dem Komplex [(η5-C5H4Me)(CO)3MoGaI2⋅Et2O] (2.5882(2) Å)[74], aber
kürzer als in [(CpMo(CO)3Ga(t-Bu)2] (2.7376(5) Å).[95] Frenking und Mitarbeiter haben in
ihren quantenchemischen Untersuchungen dargelegt, dass die Bindungssituation von EIR an
d-Metallzentren nicht gänzlich mit einem klassischen σ-Donor-/π-Akzeptor-Modell
beschrieben werden kann.[45,
46, 65]
Zusätzlich müssen bei derartig polaren Metall-Metall-
Bindungen subtilere Faktoren, wie lokale Einflüsse der Elektronenverteilung und
elektrostatische Dipol-Wechselwirkungen berücksichtigt werden (siehe Kapitel II). Daher ist
die Ursache für die η1-Koordination der Cp*-Ringe in 1a und 1b zum jetzigen Zeitpunkt nicht
eindeutig zu klären und bedarf einer eingehenden theoretischen Analyse.
Zusammenfassung
Die für Carbene sowie für EIR wohlbekannte Insertion in C-C-Mehrfachbindungen, lässt sich
auch auf Metall-Metall-Mehrfachbindungen übertragen. Die Insertion von GaCp* in die
koordinativ ungesättigte M-M-Dreifachbindung von [{CpM(CO)2}2] (M =/Mo, W) führt zu
den dinuklearen Komplexen [{(OC)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b). Die
verbrückende Koordination von GaCp* ist in Lösung insbesondere für den W2Ga2-Komplex
überraschend schwach, was durch temperaturabhängige Assoziations- und Dissoziationsgleichgewichte mittels NMR-Spektroskopie belegt werden konnte. Dieser Effekt ist
möglicherweise ein Ergebnis der sterischen Repulsion in 1a und 1b. Ebenso kann die in
diesen Komplexen erstmals beobachtete η1-Koordination von GaCp* an einem d-Metallzentrum ein Resultat sterischer Repulsion sein. Aber auch elektronische Einflüsse in Form
von stark polaren Mδ-/Gaδ+-Bindungen können nicht gänzlich ausgeschlossen werden.
- 26 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
1.2. Insertion von EIR in die Rhodium-Chlor-Bindung von [{Cp*RhCln}2]
(n = 1, 2): neuartige RhCp*/GaCp* und RhCp*/InCp*-Verbindungen
Insertionsreaktionen in die Metall-Halogen-Bindung stellen einen etablierten Zugangsweg zur
Generierung von stabilen Bindungen zwischen d-Metallen und Gruppe-13-Metallen dar und
stehen seit mehr als 50 Jahren im Interesse der Forschung.[66,
74-80]
Im Gegensatz zu den
klassischen niedervalenten Gruppe-13-Metallhalogeniden EIX (E = Ga, In; X = Cl, Br, I)
bieten Gruppe-13-Metallorganyle EIR eine Reihe von Vorteilen. Neben der leichten
Verfügbarkeit und der bemerkenswerten Stabilität der EIR-Spezies ermöglicht die Einführung
eines organischen Restes eine drastische Erhöhung der Löslichkeit sowohl der carbenoiden
Liganden als auch der Insertionsprodukte, so dass strukturelle Aussagen über die gebildeten
Produkte überhaupt erst möglich werden. Darüber hinaus können je nach Interesse und Bedarf
die elektronischen und sterischen Eigenschaften der Liganden EIR durch Wahl des Restes R
eingestellt werden.
Neben diesen allgemeinen Aspekten entwickelten sich im Zuge dieser Arbeit zwei weitere
Beweggründe, die eine eingehende Untersuchung der Insertionsprozesse erforderten:
a) Intermediate auf dem Weg zu homoleptischen M-E Komplexen
Aus der Reaktion von [Pd(tmeda)X2] (X = Cl, CH3) mit ECp* (E = Al, Ga, In)
werden die homoleptischen Komplexe [Pd3(µ2-InCp*)4(InCp*)4] und [Pd(ECp*)4] (E
= Al, Ga) (siehe Kapitel 2.3 und 2.5) gebildet. Die Reduktion von PdII zu Pd0 wird
von einer Methylgruppen- bzw. Chlorübertragung auf das Gruppe-13-Metallzentrum,
also einer Oxidation zu einem EIII-Nebenprodukt, begleitet. Das Pd0-Metallzentrum
in diesen Komplexen ist nicht außerordentlich basisch, so dass die während der
Reaktion gebildeten aciden Fragmente [ECp*(X)2] abgespalten werden. Wählt man
dagegen ein mehr basisches Übergangsmetallzentrum sollten Intermediate der
Insertionsreaktion zugänglich sein, in denen die Fragmente [ECp*X2] mehr oder
weniger starke Wechselwirkungen mit den d-Metallzentren in den gebildeten
Produkten eingehen.
- 27 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
b) Bindungsaktivierung
Auch die Generierung von „all hydrocarbon“ d8-RhI-Fragmenten des Typs
[Cp*Rh(ER)n] (n = 1, 2) ist sehr attraktiv, da durch Koordination der starken σDonatoren EIR die Elektronendichte am d-Metallzentrum M erhöht wird. Dieser
Punkt ist insbesondere aus dem Blickwinkel von Bindungsaktivierungsreaktionen
interessant. Wie in Kapitel 4 noch eingehend aufgezeigt wird, kann AlCp* eine
aromatische C-H-Bindung an einem Ni0-Zentrum via des reaktiven Intermediates
[Ni(AlCp*)3] aktivieren. Geht man nun von d10- zu reaktiveren d8-Metallzentren,
sollten sehr elektronenreiche Metallzentren entstehen, die ebenfalls eine Bindungsaktivierung ermöglichen könnten.
(Cp*Rh)2(GaCp*)3
8
110°C,
Toluol
Zersetzung
(Cp*Rh)2(GaCp*)4(GaCl3)
7
6 GaCp*, Hexan
3 min - 1 h
+
(Cp*Rh)2(GaCp*)2Cl2
6
Rh
Rh
Cl Cl
1 ECp*
Toluol, 80°C
- ECp*Cl2
-
[(Cp*)2Rh]+
InCl2
Cp*In
Cl2In
3 InCp*
Toluol, 75°C
Cl
Cl
Rh
Cl
Rh
Cl
6 ER
Toluol, RT
ER
RE
ERCl2
2a (E = Ga, R = Cp*)
2b (E = In, R = Cp*)
3 (E = In, R = C(SiMe3)3)
5
- GaCp*Cl2 GaCl3
Toluol, RT
3 GaCp*, Toluol, 80°C
in geringen Mengen
GaCp*
*CpGa
4
Schema 7. Insertionsreaktionen von EIR in die Rh-Cl Bindung von [{Cp*RhCln}2] (n = 1,2)
- 28 -
GaCl3
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
RhICp* war für diese Untersuchungen das Fragment der Wahl, da es zum einen ein basisches
Metallzentrum aufweist und zum anderen via Reduktion aus der leicht zugänglichen RhIIIVerbindung [{RhCp*Cl2}2] erhältlich sein sollte. Tatsächlich entsteht in Abhängigkeit von
der Stöchiometrie der Reaktionspartner und den Reaktionsbedingungen in Gegenwart von EIR
eine Vielfalt an Insertionsprodukten (Schema 7).
1.2.1. Reaktion von [{RhCp*Cl2}2] mit stöchiometrischen Mengen an ECp*
Darstellung von [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b) und [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3)
Wird gemäß Schema 8 eine Suspension von [{RhCp*Cl2}2] in Toluol bei Raumtemperatur
mit sechs Äquivalenten ECp* (E = Ga, In) versetzt, so bildet sich eine tiefrote Reaktionslösung, aus der nach langsamen Abkühlen auf -30°C rote Einkristalle von [Cp*Rh(ECp*)3Cl2]
(E = Ga 2a, In 2b) in Ausbeuten von 80 % isoliert werden konnten. Entsprechend führt die
Reaktion von [{RhCp*Cl2}2] mit sechs Äquivalenten InC(SiMe3)3 in Toluol bei Raumtemperatur zu dem Insertionsprodukt [Cp*Rh{InC(SiMe3)3}3Cl2] (3), das nach Abkühlen der
Reaktionslösung in Form von tief roten Einkristallen in Ausbeuten von 74 % erhalten wird.
Cl
Cl
Rh
Cl
Rh
Cl
6 ER
Toluol, RT
2
ER
RE
ERCl2
2a: E = Ga, R = Cp*
2b: E = In, R = Cp*
3: E = In, R = InC(SiMe3)3
Schema 8. Synthese von [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b) und [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3)
Für diese Synthese von 2 und 3 werden insgesamt sechs Äquivalente EIR benötigt. Bezogen
auf die dimere Struktur von [{RhCp*Cl2}2] dienen dabei vier Äquivalente EIR für die
Koordination und zwei Äquivalente für die Reduktion des RhIII-Zentrums durch ChlorÜbertragung auf das Gruppe-13-Metallzentrum E.
- 29 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
2a, 2b und 3 sind unter Schutzgasatmosphäre bei Raumtemperatur stabil, lösen sich gut in
apolaren Lösungsmitteln wie Benzol oder Toluol und zersetzen sich bei Temperaturen
oberhalb von 130°C.
Spektroskopische Charakterisierung von [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b) und
[Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3)
Die 1H-NMR-Spektren von 2a und 2b in C6D6 zeigen jeweils zwei Singuletts im Verhältnis
von 15:45 (2a: 2.04/1.81 pm; 2b: 2.18/1.77 ppm), die den Methyl-Gruppen des Cp*-Ringes
am Rh- und Ga- bzw. In-Zentrum zugeordnet werden können. Im 1H-NMR-Spektrum von 3
wurden ebenfalls zwei Signale bei 1.90 ppm (Cp*) und 0.51 ppm (C(SiMe3)3) im Verhältnis
von rund 15:81 detektiert. Die 13C-NMR-Spektren von 2a und 2b weisen jeweils vier Signale
auf, wobei zwei Resonanzen durch die Cp*-Gruppe am Rhodiumzentrum und zwei Signale
durch die Cp*-Gruppe der Liganden ECp* (E = Ga, In) hervorgerufen werden. Die Lage der
chemischen Verschiebungen sind für 2a (118.1 ppm, 96.7 ppm [d, 1J(Rh,C) = 5.1 Hz], 13.9
ppm, 11.7 ppm) und 2b (119.4 ppm, 98.4 ppm [d, 1J(Rh,C) = 4.2 Hz], 12.7 ppm und 12.3
ppm) sehr ähnlich. Verbindung 3 zeigt vier Signale mit chemischen Verschiebungen von 94.4
ppm (d, 1J(Rh,C) = 4.3 Hz), 39.6 ppm (d, 2J(Rh,C) = 5.5 Hz, In-C), 13.4 ppm (Cp*Rh) und
7.6 ppm (SiMe3). Die beobachteten Dubletts der inneren C-Atome des Cp*Rh-Fragments
werden durch das NMR-aktive Rhodiumzentrum (103Rh) hervorgerufen.
Die NMR-Daten lassen sich nicht mit einem einfachen Bild eines Lewis-Säure-BaseAdduktes aus dem Fragment [RhCp*(ER)2] und der aciden Einheit EIIIRCl2 in Einklang
bringen, da für die Cp*- und C(SiMe3)3-Gruppen der Fragmente EIR und EIIIRCl2 unterschiedliche chemische Verschiebungen zu erwarten wären. Stattdessen sind in allen drei
Verbindungen alle drei Liganden auf der NMR-Zeitskala äquivalent. Offensichtlich erfolgt in
Lösung ein schneller Austausch der Cl-Atome zwischen den Gruppe-13-Metallen, so dass
schließlich drei äquivalente EIR-Liganden vorliegen. Auch bei -80°C in d8-Toluol konnte
weder eine Verbreiterung der Signale noch eine Dekoaleszenz beobachtet werden. Ein ähnlich
fluktionaler Prozess wird für das Säure-Base-Addukt aus GaCp* and GaCp*X2 (X = Cl, Br)
beschrieben, wobei auch hier für die Cp*-Gruppen selbst bei -80°C in d8-Toluol eine
Koaleszenz der Cp*-Signale zu beobachten ist. Die Kristallstruktur von [Cp*Ga→GaCp*X2]
zeigt jedoch eindeutig, dass zwei unterschiedliche Galliumzentren vorliegen, wobei eines die
- 30 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Oxidationstufe +III (η1-Cp*, zwei Chloratome) und das andere die Oxidationsstufe +I (η5Cp*) aufweist (siehe Abbildung 4).[61] Timoshkin und Frenking haben quantenchemische
Studien für den fluktionalen Prozess austauschender Halogene und die damit verbundene
Haptizitätsänderung der Cp*-Gruppen durchgeführt. Die Autoren sind zu dem Ergebnis
gekommen, dass diese Prozesse ziemlich umfangreich und zum gegenwärtigem Zeitpunkt
nicht eindeutig aufgeklärt werden können. DFT-Rechnungen an den Systemen R3E-ER und
den Isomeren R2E-ER2 (E = B – Tl, R = H, Cl) belegen, dass der Energieunterschied
zwischen beiden Formen stark von dem Gruppe-13-Metall und dem organischen Rest R
abhängen. Zum Beispiel weisen die Addukte Cl3B-GaH und Cl3B-InH verbrückende ClAtome als energetisches Minimum auf.[96] Jedoch fehlte bislang ein experimenteller Hinweis
für deratige Intermediate.
Strukturelle Charakterisierung von [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b)
Die Komplexe [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b) können durch langsames Abkühlen
einer gesättigten Toluol-Lösung in Form von tief roten Einkristallen erhalten werden. Die
Molekülstrukturen von 2a und 2b sind in Abbildung 11 dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 2 angeführt.
Abbildung 11. Molekülstruktur von [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b) im Kristall
- 31 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Die Verbindungen 2a und 2b sind isostrukturell und kristallisieren in der orthorhombischen
Raumgruppe Pbca. Die Molekülstruktur besteht aus einer verzerrt tetraedrischen RhE3Geometrie, wobei die E-Rh-E-Winkel Werte im Bereich von 77.46(4)°-91.26(4)° (2a) bzw.
76.65(8)°-88.38(9)° (2b) aufweisen. Die Bindungsabstände Rh-E(1) und Rh-E(2) (E = Ga
2.3888(11) und 2.3583(12) Å, In 2.522(3) und 2.537(3) Å) sind nahezu gleich lang, während
die Rh-E(3)-Bindung (E = Ga 2.4500(11) Å, In 2.572(4) Å) rund 3 % aufgeweitet ist. Dieser
Unterschied beruht auf der Position der beiden Cl-Atome, die an das E(3)-Zentrum
koordiniert sind und damit die Rh-E(3)-Bindung schwächen.
Tabelle 2. Vergleich ausgewählter Bindungsabstände (Å) und Winkel (°) für die Komplexe
[Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, In 2b)
2a
2b
Rh(1)-E(1)
2.3583(12)
2.522(3)
Rh(1)-E(2)
2.3888(11)
2.537(3)
Rh(1)-E(3)
2.4500(11)
2.572(4)
E(1)⋅⋅⋅E(2)
3.355(6)
3.526(7)
E(2)⋅⋅⋅E(3)
3.028(5)
3.168(6)
E(3)-Cl(1)
2.438(2)
2.664(4)
E(3)-Cl(2)
2.3316(18)
2.500(3)
E(2)-Cl(1)
2.970(3)
2.923(4)
E(1)-C(η -Cp*)
2.222(7)-2.413(6)
2.382(9)-2.587(10)
E(2)-C(21)
2.293(6)
2.404(9)
E(2)-C(22)
2.158(6)
2.332(9)
E(2)-C(23)
2.426(7)
2.596(9)
E(2)-C(24)
2.681(6)
2.778(10)
E(2)-C(25)
2.597(7)
2.660(10)
E(3)-C(31)
2.086(6)
2.209(9)
C(31)-C(32)
1.488(9)
1.463(12)
C(32)-C(33)
1.364(9)
1.356(12)
E(3)-E(2)-Cl(1)
47.97(9)
51.67(9)
E(2)-E(3)-Cl(1)
64.78(7)
59.42(7)
E(1)-Rh(1)-E(2)
91.26(4)
88.38(9)
E(1)-Rh(1)-E(3)
88.49(3)
84.83(7)
E(2)-Rh(1)-E(3)
77.46(4)
76.65(8)
C(15)-C(14)-C(13)-C(131)
165.4(6)
167.7(5)
5
- 32 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Bemerkenswerterweise nehmen die Chloratome unterschiedliche Positionen ein. Das Cl(2)Atom wird in einer terminalen Position detektiert, was in einer verkürzten E(3)-Cl(2)Bindung (E = Ga 2.3314(18) Å, In 2.500(3) Å) zum Ausdruck kommt. Demgegenüber nimmt
Cl(1) eine verbrückende Position zwischen E(2) und E(3) ein. Die Bindung E(3)-Cl(1) hat
einen Wert von 2.438(2) Å in 2a bzw. 2.664(4) Å in 2b, während die E(2)-Cl(1)-Bindung (E
= Ga 2.970(3) Å; In 2.923(4) Å) deutlich länger ist. Entsprechend ist der Winkel Cl(1)-E(2)E(3) kleiner als der Winkel Cl(1)-E(3)-E(2). Die Gruppe-13-Metall-Bindungsabstände E-E
liegen in 2a im Bereich 3.028(5)-3.355(6) Å und in 2b zwischen 3.168(6)-3.526(7) Å. Die
durchschnittlich um rund 10 % verkürzte Bindungslänge E(2)-E(3) ist vermutlich ein Resultat
des verbrückenden Cl-Atoms Cl(2). Direkte E-E-Wechselwirkungen können ausgeschlossen
werden. Darüber hinaus führt der hohe sterische Anspruch der ECp*-Einheiten zu einer
Abwinkelung der Methyl-Gruppen des Cp*Rh-Fragmentes in die den Liganden entgegengesetzte Richtung aus der aromatischen Ringebene mit einem durchschnittlichen Torsionswinkel von rund 13°.
Der signifikante Unterschied in den Haptizitäten der Cp*-Ringe ist ein auffallendes
Merkmal von Komplex 2a und 2b. So ist der Cp*-Ring an E(3) unverkennbar
σ−gebunden. Die C-C- Bindungslängen des C5-Ringes alternieren mit C=C-Doppelbindungen
von ca. 1.36 Å und C-C-Einfachbindungen von rund 1.47 Å. Demgegenüber ist die Cp*Gruppe an E(1) η5-gebunden, wobei die E(1)-C-Distanzen im Bereich von 2.222(7)-2.413(6)
Å (2a) bzw. 2.382(9)-2.587(19) Å (2b) liegen. Das verbrückende Cl-Atom Cl(1) übt einen
cis-Effekt auf die Koordination des Cp*-Ringes an dem E(2)-Zentrum aus, dessen nicht
klassische Haptizität sich am besten mit einem Bindungsmodus von η3 bzw. η2 beschreiben
lässt. Die E(2)-C-Bindungslängen in 2a und 2b von 2.332(9) bzw. 2.160(7) Å (E(2)-C(22))
und 2.293(6) bzw. 2.404(9) Å (E(2)-C(21)) liegen in einem Bereich bindender Wechselwirkungen, während die anderen E(2)-C-Distanzen deutlich länger sind. Diese ungewöhnliche
Haptizität wirkt sich dagegen nicht signifikant auf die C-C-Bindungslängen in dem C5-Ring
aus. Die Bindungslängen variieren ohne erkennbare Zuordnung einer Einfach- bzw. Doppelbindung und haben Werte im Bereich 1.395(12)-1.440(13) Å. Eine ähnliche Struktur wird von
Jutzi et al. für den Komplex [Cp*(CO)2Fe(GaCp*Cl)] beschrieben, in dem die Cp*-Gruppe
des Fragmentes GaCp*Cl eine η2-Koordination aufweist (siehe Schema 5).[83] Weitere M-EKomplexe mit vergleichbar ungewöhnlichen Haptizitäten der Cp*-Ringe wurden bislang
nicht dokumentiert.
- 33 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Strukturelle Charakterisierung von [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3)
Die Verbindung [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3) kann durch langsames Abkühlen einer
gesättigten Toluol-Lösung in Form von tief roten Einkristallen erhalten werden. Die
Molekülstruktur von 3 ist in Abbildung 12 dargestellt; ausgesuchte Bindungslängen und
Bindungswinkel sind in Tabelle 3 angeführt.
Abbildung 12. Molekülstruktur von [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3) im Kristall
Komplex 3 kristallisiert in der monoklinen Raumgruppe P21/n. Die Molekülstruktur von 3 im
Festkörper verfügt über eine - analog zu Komplex 2a und 2b - verzerrt tetraedrische RhIn3Geometrie, wobei die In-Rh-In-Bindungswinkel Werte im Bereich von 80.64(4)° bis
88.43(5)° aufweisen. Zwei Rh-In-Bindungslängen sind nahezu gleich lang (Rh(1)-In(2)
2.5617(7) Å; Rh(1)-In(3) 2.5618(6) Å), während die Rh(1)-In(1)-Bindung (2.6244(6) Å) rund
6 pm aufgeweitet ist. Diese Deformation und der verhältnismäßig große In(2)-Rh(1)-In(3)Winkel beruhen vermutlich auf der Koordination der beiden Chloratome Cl(1) und Cl(2), die
im Gegensatz zu 2a und 2b in 3 eine verbrückende Position zwischen den drei Indiumzentren
einnehmen, wobei In(1) von beiden Chloratomen verbrückt ist. Die In(1)-Cl-Abstände des
vierfachkoordinierten In-Zentrums betragen 2.7182(17) Å bzw. 2.7006(16) Å und sind etwas
- 34 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
länger als die In-Cl-Abstände zu den dreifachkoordinierten In-Zentren (In(2)-Cl(2)
2.6215(15) Å, In(3)-Cl(1) 2.6302(16) Å).
Tabelle 3. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3] (3)
Rh(1)-In(1)
2.6244(6)
In(1)–Rh(1)–In(2)
84.72(4)
Rh(1)-In(2)
2.5617(7)
In(1)–Rh(1)–In(3)
80.64(4)
Rh(1)-In(3)
2.5618(6)
In(2)–Rh(2)–In(3)
88.43(5)
In(1)-Cl(1)
2.7182(17)
Cl(1)-In(1)-In(3)
49.97(5)
In(1)-Cl(2)
2.6616(8)
Cl(2)-In(1)-In(2)
48.20(6)
In(2)-Cl(2)
2.7006(16)
Cl(1)-In(3)-In(1)
52.31(6)
In(3)-Cl(1)
2.6215(15)
Cl(2)-In(2)-In(1)
50.18(5)
In(1)-C(11)
2.257(5)
In(2)-C(12)
2.241(5)
Cl(1)-In(1)-In(3)-In(2)
156.9(7)
In(3)-C(13)
2.218(5)
Cl(2)-In(1)-In(2)-In(3)
98.8(5)
C-SiMe3
1.873(6)-1.916(5)
C(1)-C(2)-C(3)-C(8)
13.1(6)
Ferner unterscheiden sich die Positionen von Cl(1) und Cl(2) in Bezug auf die drei InZentren. Während Cl(1) eher parallel zur In3-Ebene angeordnet ist (Cl(1)-In(1)-In(2)-In(3)
156.9(7)°), ist Cl(2) in einer davon vergleichsweise senkrecht angeordneten Position
lokalisiert (Cl(2)-In(1)-In(2)-In(3) 98.8(5)°). Die Sonderstellung von In(1) kommt dagegen
nicht in den In-C-Bindungsabständen zum Ausdruck. Diese liegen zwischen 2.218(5) Å
(In(3)-C(13)) und 2.257(5) Å (In(1)-C(11)) und entsprechen den In-C-Bindungsabständen des
freien tetrameren Liganden mit rund 2.24 Å im Mittel. Ebenso weisen die C(SiMe3)3Fragmente nahezu eine ideale Geometrie auf. Die Si-C-Si-Winkel betragen im Durchschnitt
109.8° und die C-Si-Abstände liegen im Bereich 1.873(6) Å - 1.916(5) Å. Entsprechend den
Komplexen 2a und 2b führt der hohe sterische Anspruch der InC(SiMe3)3-Einheiten zu einer
den Liganden entgegengesetzten Abwinkelung der Methyl-Gruppen des Cp*Rh-Fragmentes
aus der aromatischen Ringebene mit einem durchschnittlichen Torsionswinkel von rund 13°.
- 35 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Darstellung des Lewis-Säure-Base-Adduktes [Cp*Rh(GaCp*)2(GaCl3)] (4)
Die Chloratome im Komplex [Cp*Rh(GaCp*)3(Cl)2] (2a) können weder durch Reduktion
(z.B. Na(Hg), K) zur Darstellung von [Cp*Rh(GaCp*)2], noch durch Abstraktion mittels
Zugabe von TlPF6 zur Generierung eines kationischen RhIII-Komplexes [Cp*Rh(GaCp*)3]2+
entfernt werden. Dagegen reagiert 2a bereitwillig in Gegenwart von Lewis-Säuren.
Cl
Cl
Rh
Cl
Rh
Cl
6 GaCp*
Toluol, RT
2
GaCp*
*CpGa
GaCp*Cl2
2a
GaCl3
Toluol, RT
- GaCp*Cl2
3 GaCp*, Toluol, 80°C
2
in geringen Mengen
in geringen
Mengen
GaCp*
*CpGa
GaCl3
4
Schema 9. Synthese von [RhCp*(GaCp*)3Cl2] (2a) und [RhCp*(GaCp*)2GaCl3] (4)
Wird gemäß Schema 9 Komplex 2a mit einem Äquivalent GaCl3 versetzt, bildet sich
augenblicklich ein gelber Niederschlag. Durch Umkristallisation in siedenden Diethylenglykoldimethylether (diglyme) kann die Verbindung [Cp*Rh(GaCp*)2GaCl3] (4) in Form von
gelben Kristallen in Ausbeuten von 83 % erhalten werden. 4 wird auch als Nebenprodukt bei
der Reaktion von [{RhCp*Cl2}2] mit drei Äquivalenten GaCp* sowie bei der thermischen
Zersetzung von [Cp*Rh(GaCp*)3(Cl)2] (2a) in Toluol gebildet, was die Labilität der Cp*-GaBindung unterstreicht. Weitere Produkte dieser Zersetzung (z.B. Cp*2GaCl) können nicht
charakterisiert werden. Verbindung 4 ist an Luft für kurze Zeit stabil, sollte aber unter
Inertgasatmosphäre gelagert werden. 4 löst sich nur in polaren organischen Lösungsmitteln
und zersetzt sich im Festkörper bei 268°C.
- 36 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Spektroskopische Charakterisierung von [Cp*Rh(GaCp*)2(GaCl3)] (4)
Das 1H-NMR-Spektrum von 4 in CD2Cl2 weist zwei Resonanzen bei 2.10 und 2.06 ppm mit
einem Integralverhältnis von 30:15 auf. Das 13C-NMR-Spektrum zeigt erwartungsgemäß vier
Signale bei 114.8 ppm (Cp*Ga), 100.3 ppm (d, 1J(Rh,C) = 4.7 Hz, Cp*Rh), 12.6 ppm
(Cp*Rh) und 10.2 ppm (Cp*Ga).
Strukturelle Charakterisierung von [Cp*Rh(GaCp*)2(GaCl3)] (4)
Für die Röntgenstrukturanalyse geeignete Einkristalle von 4 können durch langsames
Abkühlen einer siedenden Diglyme-Lösung erhalten werden. Die Molekülstruktur von 4 ist in
Abbildung 13 dargestellt; ausgesuchte Bindungslängen und Bindungswinkel sind in Tabelle 4
angeführt.
Abbildung 13. Molekülstruktur von [RhCp*(GaCp*)2GaCl3] (4) im Kristall
Komplex 4 kristallisiert in der triklinen Raumgruppe P⎯1. Die Molekülstruktur verfügt über
eine zentrale RhGa3-Einheit mit Ga-Rh-Ga-Winkeln im Bereich von 81.68(3)° bis 94.13(3)°.
Die Abstoßung der sterisch anspruchsvollen GaCp*-Liganden mit den Cl-Atomen des GaCl3- 37 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Fragments führt dazu, dass die Liganden am Rh(1)-Zentrum und die Cl-Atome entlang der
Rh(1)-Ga(1)-Bindungsachse eine leicht verzerrte gestaffelte Konformation einnehmen. Die
Rh(1)-Ga(2)- und Rh(1)-Ga(3)-Bindungen haben Werte von 2.3442(9) und 2.3456(9) Å,
während der Bindungsabstand Rh(1)-Ga(1) (2.4177(9) Å) um rund 7 pm aufgeweitet ist. Die
Rh-Ga-Abstände sind vergleichbar mit den Werten, die in den Rh-Ga-Clusterverbindungen
[(Cp’’Rh)3(µ3-GaCl)(µ3-Ga3Cl3)(µ3-OGaCl3)]]
und
[{(Cp’’Rh)2(µ-Ga)}2(µ4,η2–Ga2Cl3)2]
(Cp’’= η5-1,3-t-Bu2C5H3) detektiert werden.[97] Diese Cluster werden ausgehend von
[{Cp’’RhCl2}2] in Gegenwart von elementarem Gallium in THF erhalten. Für letztere
Verbindung haben die Autoren eine Rh-Ga-Mehrfachbindung angenommen (Rh-Ga 2.346(1)
und 2.340(1) Å). Im Gegensatz dazu kann die Rh-Ga-Bindung in 4 als eine einfache σBindung beschrieben werden. Die Ga-Ga-Bindungsabstände in 4 liegen im Bereich 3.115(5)3.434(6) Å und werden als nichtbindend betrachtet. Die Ga(1)-Cl-Distanzen haben einen
durchschnittlichen Wert von 2.242 Å, was im Vergleich zu Verbindung 2a leicht verkürzt ist
(4 %).
Tabelle 4. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [RhCp*(GaCp*)2GaCl3](4)
Rh(1)-Ga(1)
Ga(2)-C(η5-Cp*)
2.4177(9)
5
2.221(6)-2.318(6)
Rh(1)-Ga(2)
2.3442(9)
Ga(3)-C(η -Cp*)
2.218(7)-2.362(6)
Rh(1)-Ga(3)
2.3456(9)
Cp*Zentrum-Ga(2)
1.924
Ga(1)-Cl(1)
2.257(2)
Cp*Zentrum-Ga(3)
1.976/1.945
Ga(1)-Cl(2)
2.241(2)
Ga(1)-Cl(3)
2.228(2)
Ga(1)-Rh(1)-Ga(2)
81.68(3)
Ga(1)-Ga(2)
3.115(5)
Ga(1)-Rh(1)-Ga(3)
83.61(4)
Ga(1)-Ga(3)
3.176(6)
Ga(2)-Rh(1)-Ga(3)
94.13(3)
Ga(2)-Ga(3)
3.434(6)
Cl(1)-Ga(1)-Cl(2)
101.55(8)
Die Cp*-Einheiten an Ga(2) und Ga(3) sind nahezu symmetrisch η5-koordiniert (2.218(7)2.362(2) Å), wobei die Bindungslängen der Cp*Zentrum-Ga-Distanzen mit Werten von 1.924 Å
(Ga(2)) und 1.976/1.945 Å (Ga(3) mit fehlgeordneten Cp*-Gruppen) im Vergleich zum freien
monomeren Ligand in der Gasphase (2.081 Å) verkürzt sind.[115] Diese Abstände sind ein
indirektes Maß für die Polarität der Rh-Ga-Bindung. Die elektrophile GaCl3-Einheit
stabilisiert das basische Rhodiumzentrum der intermediären Spezies [Cp*Rh(GaCp*)2] und
erhöht folglich die Polarität der Rh-GaCp*-Bindung. Aus diesem Grund kann die freie LewisBase [Cp*Rh(GaCp*)2] durch Abstraktion von GaCl3 nicht isoliert werden.
- 38 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
1.2.2. Reaktion von [{RhCp*Cl2}2] mit unterstöchiometrischen Mengen an ECp*:
mechanistische Überlegungen
Darstellung von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}](5)
Die Reaktion von [{RhCp*Cl2}2] mit nur 3 Äquivalenten InCp* in Toluol bei 75°C führt zu
einem orangen mikrokristallinen Rückstand in einer Ausbeute von 70 %. Die Elementaranalyse belegt, dass sich nicht – wie zuerst vermutet – der zu 4 analoge Komplex
[Cp*Rh(InCp*)2InCl3] gebildet hat, sondern eine ionische Verbindung der Zusammensetzung
[Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5).
Der ionische Charakter von 5 kommt neben der relativen Stabilität gegenüber
Luftsauerstoff und –feuchtigkeit auch in einer verhältnismäßig hohen Zersetzungstemperatur
von 220°C zum Ausdruck. 5 löst sich gut in polaren Lösungsmitteln, wie THF und CH2Cl2, ist
dagegen in unpolaren Lösungsmitteln (Hexan, Toluol) unlöslich.
Cl
Cl
Rh
Cl
Rh
Cl
3 InCp*
Toluol, 75°C
[(Cp*)2Rh]
InCl 2
InCl 2
Cp*In
5
Schema 10. Synthese von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5)
Der Mechanismus für die Bildung von 5 ist unklar. Ein Erklärungsansatz beruht auf der
Annahme, dass im ersten Schritt eine Reduktion von [{RhCp*Cl2}2] mit InCp* zu dem RhIIDimer [{RhCp*Cl}2] erfolgt. Wird [{RhCp*Cl2}2] mit einem Äquivalent InCp* in C6D6
versetzt, lässt sich im 1H-NMR-Spektrum nahezu quantitativ ein neues Signal bei 1.59 ppm
beobachten, das dem Komplex [{RhCp*Cl}2] zuzuordnen ist. Jedoch führt die Zugabe von
zwei weiteren Äquivalenten InCp* zu einem Gemisch verschiedener Produkte, wobei 5 nur in
Spuren nachgewiesen wird. Aus diesem Grund kann angenommen werden, dass die
Einelektronen-Reduktion des RhIII-Zentrums eine Konkurrenzreaktion zur Bildung von 5
darstellt, die aber nicht an dem Mechanismus auf dem Weg zu 5 beteiligt ist. Demzufolge
wird ein ähnlicher Reaktionsweg angenommen, wie für die Bildung von [Cp*(Cp*Ga)2FeGaCl2⋅THF][83] ausgehend von FeCl2 und GaCp* in THF beschrieben wird: Im ersten
- 39 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Schritt koordiniert ein Äquivalent InCp* an das RhIII-Zentrum. Im zweiten Schritt erfolgt eine
Insertion der InCp*-Einheit in die Rh-Cl-Bindung, gefolgt von einem Cp*/Cl-[1,2]-Austausch
zwischen dem Rh- und In-Zentrum. Aus der heterolytischen Spaltung der Rh-In-Bindung
bildet sich das Kation [(Cp*)2Rh]+. Das anionische Fragment “InCl2”, das bei dieser Spaltung
entsteht, wird von dem zweiten RhIII-Zentrum abgefangen. Die Koordination und Insertion
zwei weiterer Äquivalente InCp* führt schließlich zu dem Anion von 5.
InCp*
Cl
Cl
Rh
3 InCp*
Rh
Cl
Cl
[(Cp*)2 Rh]
InCl 2
InCl 2
Cp*In
Insertion
fluktionaler
Cp*/Cl Austausch
Cp*
In
Cl
Rh
Cl
Rh
Cl
Cl
InCl 2
Cp*In
InCp*
Cl
Cl
Cp*/Cl-Austausch
η 1-Cp*
Rh
Rh
Cl
Cl
2 InCp*
Cl
In
Cl
heterolytische Spaltung
der Rh-In Bindung
- [(Cp*)2Rh]
Koordination
und Insertion
Rh
Cl
Cl
[InCl 2 ]-
Schema 11. Möglicher Mechanismus zur Darstellung von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5)
Spektroskopische Charakterisierung von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5)
Für das Anion von 5 wird in Lösung ein schneller Austausch der Cp*-Gruppen zwischen den
InCp*-Einheiten beobachtet. Das 1H-NMR-Spektrum von 5 in d8-THF zeigt drei Singuletts
bei 2.10, 2.05 und 1.90 ppm im Verhältnis von 15:30:30, die den Cp*-Ringen des Anions am
Rh- und In-Zentrum und den Cp*-Liganden des Kations [Cp*2Rh]+ zugeordnet werden
können. Das
13
C-NMR-Spektrum bestätigt den fluktionalen Austausch der Cp*-Ringe in
- 40 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Lösung, wobei nur eine Resonanz für die Ring-C-Atome (119.8 ppm) und eine für die
Methyl-Gruppen (12.6 ppm) der im Festkörper unterschiedlichen InCp*-Fragmente
beobachtet wird. Die Resonanzen der Cp*-Ringe am Rhodiumzentrum zeigen jeweils einen
Signalsatz bei 99.7/8.8 ppm ([Cp*2Rh]+) und 95.9/14.2 ppm (Cp*Rh). In Anlehnung an
Komplex 2a und 2b zeigt 5 keine Dekoaleszenz bei -80°C, was den schnellen Austausch der
Cp*-Gruppen mit den Cl-Atomen in Lösung unterstreicht.
Strukturelle Charakterisierung von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5)
Für die Röntgenstrukturanalyse geeignete Einkristalle von 5 können durch Diffusion von
Toluol in eine CH2Cl2-Lösung von 5 erhalten werden. Die Molekülstruktur von 5 ist in
Abbildung 14 dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 5
angeführt.
Abbildung 14. Molekülstruktur von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5) im Kristall
- 41 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Komplex 5 kristallisiert in der triklinen Raumgruppe P⎯1. Die Molekülstruktur von 5 besteht
aus zwei ionischen molekularen Einheiten. Das Kation [(Cp*)2RhIII]+ weist keine ungewöhnlichen Charakteristika auf. Die Cp*-Ringe sind nahezu symmetrisch η5-gebunden mit
Rh-C-Bindungslängen im Bereich 2.167(4)-2.194(4) Å. Die anionische Komponente besitzt
eine verzerrt tetraedrische RhIn3-Einheit. Die Rh-In-Bindungsabstände haben Werte von
2.5351(6) Å und 2.5493(5) Å und sind denen von [Cp*Rh(InCp*)3(Cl)2] (2b) und [Cp*Rh(µ2Cl)2{InC(SiMe3)3}3] (3) sehr ähnlich. Die In-In-Distanzen liegen im Bereich 3.2636(8)3.3584(7) Å und werden als nicht-bindend betrachtet. Typische InII-InII-Abstände in R2InInR2 (R = CH(SiMe3)2, C6H2(i-Pr)3) haben Werte von 2.74–2.82 Å.[98, 99] Ferner weisen die
vier Cl-Atome unterschiedliche Koordinationsformen auf. Cl(2) und Cl(3) werden in einer
terminalen Position an In(2) und In(3) detektiert, wobei die In-Cl-Abstände Werte von
2.4476(11)(3) Å und 2.4673(11) Å aufweisen. Demgegenüber nimmt Cl(1) eine leicht
verbrückende Position zwischen In(1) (2.8396(10) Å) und In(2) (2.5734(11) Å) ein, was sich
auch in den In-In-Cl-Winkeln widerspiegelt. Cl(4) neigt sich leicht in Richtung des In(1)Zentrums (In(1)-Cl(4) 2.9828(11) Å, In(3)-Cl(4) 2.5849(11) Å).
Tabelle 5. Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5)
Rh(1)-In(1)
2.5351(6)
In(2)-C(24)
3.042(4)
Rh(1)-In(2)
2.5493(5)
In(3)-C(24)
3.052(4)
Rh(1)-In(3)
2.5447(5)
C(11)-C(12)
1.380(6)
In(1)-In(2)
3.2782(6)
C(12)-C(13)
1.436(6)
In(1)-In(3)
3.3584(7)
C(21)-C(22)
1.373(6)
In(2)-In(3)
3.2636(8)
C(21)-C(25)
1.461(6)
In(1)-Cl(1)
2.8396(10)
C(24)-C(25)
1.416(6)
In(1)-Cl(4)
2.9828(11)
In(2)-Cl(1)
2.5734(11)
In(1)-Rh(1)-In(2)
80.295(16)
In(2)-Cl(2)
2.4476(11)
In(2)-Rh(1)-In(3)
79.684(19)
In(3)-Cl(3)
2.4673(11)
Cl(1)-In(2)-Cl(2)
98.72(3)
In(3)-Cl(4)
2.5849(11)
In(2)-In(1)-Cl(1)
49.11(2)
Rh(2)-C(η -Cp*)
2.167(4)-2.194(4)
In(1)-In(2)-Cl(1)
56.53(2)
In(1)-C(15)
2.259(4)
In(1)-C(14)
2.705(4)
C(251)-C(24)-C(21)-C(25)
15.1(4)
In(2)-C(25)
2.436(4)
C(211)-C(25)-C(22)-C(21)
0.2(4)
In(3)-C(23)
2.466(4)
C(241)-C(25)-C(23)-C(24)
5.4(4)
5
- 42 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Gemäß der Haptizitätsänderung in [Cp*Rh(ECp*)3(Cl)2] (E = Ga 2a, E = In 2b) üben die
verbrückenden Chloratome Cl(1) und Cl(4) einen cis-Effekt auf die Koordination der Cp*Einheit an In(1) aus. Der C5-Ring ist eindeutig σ-gebunden und weist eine In(1)-C(15)Bindungslänge von 2.259(4) Å auf. Offensichtlich konkurrieren die freien p-Elektronenpaare
der Cl-Atome erfolgreich mit der π-Elektronendichte des Cp*-Ringes um die leeren pOrbitale an dem In-Zentrum. Alternativ kann auch eine starke π-Rückbindung der
Elektronendichte in die p-Orbitale des In-Zentrums, infolge einer Akkumulation von
Elektronendichte im Rh-Zentrum des Anions (negative Ladung und elektropositive IndiumLiganden) in Erwägung gezogen werden. Alle weiteren In(1)-C-Abstände sind deutlich länger
(In(1)-C(14) 2.705(4) Å) und werden als nicht-bindend betrachtet. Die C-C-Bindungslängen
des C5-Ringes alternieren mit Abständen für die C=C-Doppelbindung von ca. 1.38 Å und für
die C-C-Einfachbindung von rund 1.44 Å. Der Cp*-Ring an Rh(1) ist η5-gebunden und die
Rh-C-Distanzen liegen im Bereich von 2.197(4) Å bis 2.217(4) Å.
Das auffälligste Merkmal des Anions von 5 ist der die beiden Indiumzentren (In(2)
und In(3)) verbrückende Cp*-Ring. Der C5-Ring nimmt eine annähernd parallele Anordnung
zur Cl-In-Cl-Ebene mit einer Abweichung kleiner als 10° ein. Die C-Atome C(25) und C(23)
sind an In(2) und In(3) σ-gebunden mit In-C-Bindungsabständen von 2.436(4) Å und
2.466(4) Å. Diese Werte sind ca. 0.2 Å länger als der In-C-Bindungsabstand des η1-InCp*Liganden in [Cp*Rh(InCp*)3Cl2] (2b) (2.209(9) Å) oder in [Cp*Rh(µ2-Cl)2{InC(SiMe3)3}3]
(3) (2.218(5)-2.257(5) Å). Die sp3-Hybridisierung der C-Atome C(23) und C(25) kommt auch
in den Torsionswinkeln der Methylgruppen (C231) und C(251)) zum Ausdruck, welche um
rund 15° aus der aromatischen Ringebene herausgebogen sind, während die anderen
Torsionswinkel signifikant kleiner sind ((C(241) 5.4°, C(221) 1.6° und C(211) 0.2°). Für die
C-C-Abstände des C5-Rings werden Werte von 1.373(6) Å (C(21)-C(22)) für eine C=CDoppelbindung und 1.461(6) Å (C(21)-C(25)) sowie 1.454(6) Å (C(22)-C(23)) für eine C-CEinfachbindung gefunden. Die verbleibenden C-C-Distanzen im Ring betragen 1.420(6) Å
(C(23)-C(24)) und 1.416(6) Å (C(24)-C(25)), so dass das C3-Fragment C(23)-C24)-C(25) als
delokalisierte π-Allyl-Einheit betrachtet werden kann. Folglich kann der verbrückende Cp*Ring am besten als ein µ2-η1-η1-en-allyl koordinierter C5Me5-Ring beschrieben werden. Im
Unterschied zu dimeren Metallkomplexen mit verbrückenden Allyl-Liganden sind die InC(24)-Abstände (3.042(4) und 3.052(4) Å) in 5 zu lang, um eine π-Wechselwirkung zu
postulieren. Typische M-CH(CH2)2-Abstände liegen in Bereichen von 2.41-2.67 Å [(µ2-η3C3H5)2Pd2(PPh3)2],[100] 2.45-2.46 Å [{(µ2-η3-C3H5)PdCl(PPh3)}2],[101] 2.44-2.56 Å [(µ2-η3- 43 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
C3H5)(µ2-SEt)Fe2(CO)6][102,
103]
und 2.51-2.61 Å [{Mo(µ2-η3-C3H5)(η3-C3H5)}2].[104] Des
Weiteren ist in diesen Komplexen das innere C-Atom der Allyl-Gruppe leicht zur MetallMetall-Bindung geneigt, während in 5 C(24) leicht in die andere Richtung geneigt ist (5.4°).
Komplex 5 ist das erste Beispiel einer intramolekular verbrückenden Cp-Einheit. Die einzigen
strukturellen Analoga sind die Festkörperstrukturen von Et2GaCp and EtGaCp2, die aus einem
linearen Polymer mit intramolekular verbrückenden C5H5-Liganden bestehen. In diesen
Verbindungen ist jedes GaIII-Zentrum in Kontakt mit einem C-Atom von jeweils einem der
beiden verbrückenden C5H5-Liganden, so dass eine Zweielektronen-Dreizentren-Bindung
entlang des C(Cp)-GaC(Cp)-Systems vorliegt. Analog zu Komplex 5 wird die kürzeste C-CBindung in dem Cp-Ring dort gefunden, in der keiner der C-Atome an dem GaIII-Zentrum
koordiniert ist.[105]
Darstellung von [{Cp*RhCl}2]
Da die Reaktion von [{RhCp*Cl2}2] mit einem Äquivalent InCp* zur reduzierten RhIISpezies [{Cp*RhCl}2], aber nicht zum Insertionsprodukt 5 führt, wird die Reaktivität von
isolierten und aufgereinigten [{Cp*RhCl}2] mit ECp* genauer untersucht. Die von Sharp et
al. beschriebene Synthese von [{Cp*RhCl}2] ausgehend von [{RhCp*Cl2}2] mit einem
Überschuss an Na(Hg) (0.4 %) in CH2Cl2 kann nicht reproduziert werden.[106, 107] Stattdessen
kann die Reduktion auch mit flüssigem Kalium in siedendem Toluol über einen Zeitraum von
2 Tagen durchgeführt werden.
Cl
Cl
Rh
Rh
Cl
Cl
1 ECp*,Toluol, 80°C
E = Al, Ga, In
- ECp*Cl2
Rh
Rh
Cl Cl
Schema 12. Synthese von [{Cp*RhCl}2]
Alternativ führt auch die Reaktion von [{RhCp*Cl2}2] mit einem Äquivalent ECp* zur
gewünschten RhII-Spezies, wobei im Falle von E = Al und In hohe Ausbeuten, in Gegenwart
von GaCp* moderate Ausbeuten erzielt werden können (Schema 12). Alle analytischen Daten
von [{Cp*RhCl}2] stimmen gut mit den zuvor beschriebenen überein.[106,
107]
Ebenso kann
nach Scheer et al. die Reduktion auch mit elementarem Gallium durchgeführt werden.[97]
- 44 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
1.2.3. Reaktion von GaCp* mit [{RhCp*Cl}2]
Darstellung von [(Cp*Rh)2(GaCp*)2Cl2] (6)
Die Umsetzung von [{Cp*RhCl}2] mit sechs Äquivalenten GaCp* in Hexan bei -30°C und
weiteres Rühren bei RT für 3 Minuten führt zu einem braunen mikrokristallinen Feststoff, der
in einer Ausbeute von 58 % (bezogen auf die aus der Elementaranalyse abgeleiteten Summenformel) isoliert werden kann (Schema 13). Komplex 6 ist im Festkörper, als auch in Lösung
sehr luftempfindlich, kann jedoch bei RT unter Inertgasatmosphäre über Wochen gelagert
werden. 6 löst sich gut in apolaren organischen Lösungsmitteln, wie Benzol oder Toluol. Für
die Röntgenstrukturanalyse geeignete Einkristalle von 6 können nicht erhalten werden. In
allen Fällen werden nur extrem dünne, dunkelbraune Plättchen isoliert.
6 GaCp*
Hexan
Rh
Rh
RT, 3 min.
[(Cp*Rh)2(GaCp*)2Cl2]
6
Cl Cl
RT, 1h
Cl3
Ga
Ga
Rh
Ga
Ga
110°C, Toluol
Rh
Zersetzung
*Cp
Rh
*CpGa
Ga
Cp*
GaCp*
Rh
GaCp*
Cp*
7
8
Schema 13. Insertion von GaCp* in die Rh-Cl Bindung von [{Cp*RhCl}2]
Spektroskopische Charakterisierung von [(Cp*Rh)2(GaCp*)2Cl2] (6)
Aufschluss über die Zusammensetzung von 6 liefert die Elementaranalyse, welche die
Annahme eines Insertionsproduktes mit der Summenformel [(Cp*Rh)2(GaCp*)2Cl2] (6)
bestätigt. Das 1H-NMR-Spektrum von 6 in C6D6 zeigt zwei Singuletts bei 2.21 und 1.54 ppm
im Verhältnis von 1:1, die den Methylgruppen der Cp*-Gruppen des Gallium- und Rhodiumzentrums zuzuordnen sind. Im
13
C-NMR-Spektrum werden vier Signale bei 123.0 ppm
- 45 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
(Cp*Ga), 96.2 ppm (t, 1J(Rh,C) = 3.1 Hz), 13.7 ppm (Cp*Rh) und 10.7 ppm (Cp*Ga)
detektiert. Das Signal der Ring-C-Atome des Cp*Rh-Fragmentes ist besonders interessant, da
der Ursprung der Multiplizität unklar ist. Wird in diesen Überlegungen ein verbrückender
Cp*-Ring entlang der Rh-Rh-Bindung ausgeschlossen, deutet alles darauf hin, dass das Signal
ein Pseudotriplett ist, d.h. zwei unterschiedliche Dubletts mit gleicher
1
J(Rh,C)-
1
Kopplungskonstante und einer Verschiebungsdifferenz von ∆ν = J(Rh-C). Daher wird eine
unsymmetrische dimere Struktur von 6 angenommen. Auch das NMR-Spektrum in d8-Toluol
bei -80°C zeigt keine Veränderung. Da sich 6 in Lösung bei Temperaturen oberhalb von 40°C
zersetzt, können keine Hochtemperatur-NMR-Untersuchungen durchgeführt werden.
Darstellung von [(RhCp*)2(GaCp*)4(GaCl3)] (7)
Wird gemäß Schema 13 das Reaktionsgemisch von [{Cp*RhCl}2] und GaCp* nicht für 3
Minuten, sondern für eine Stunde bei RT gerührt, wird die Bildung eines rötlichen
mikrokristallinen Niederschlages beobachtet, der in einer Ausbeute von 90 % isoliert werden
kann (wiederum bezogen auf die aus der Elementaranalyse abgeleiteten Summenformel).
Verbindung 7 löst sich nur schwer in apolaren Lösungsmitteln wie Benzol oder Toluol und
zersetzt sich im Festkörper oberhalb von 157°C.
Spektroskopische Charakterisierung von [(RhCp*)2(GaCp*)4(GaCl3)] (7)
Das 1H-NMR-Spektrum von 7 in C6D6 zeigt zwei Resonanzen bei 2.13 und 1.93 ppm mit
einem Integralverhältnis von 2:1, die den Cp*-Gruppen des Ga- und Rh-Zentrums zugeordnet
werden können. Dieses Verhältnis wird auch im
13
C-NMR-Spektrum, mit zwei Signalsätzen
bei 121.0/12.6 ppm (Cp*Ga) und 97.3/13.0 ppm (Cp*Rh), detektiert.
Alle Versuche, für die Röntgenstrukturanalyse geeignete Einkristalle von Komplex 7
zu züchten, schlugen fehl. Jedoch deutet die Elementaranalyse auf eine Verbindung der
Zusammensetzung [(RhCp*)2(GaCp*)4(GaCl3)] (7). In Anlehnung an die Molekülstruktur
eines Zersetzungsproduktes von 7, kann eine dinukleare Struktur bestehend aus zwei Cp*RhFragmenten mit zwei verbrückenden GaCp*-Einheiten angenommen werden. Dieser Rh-GaRh-Ga-Vierring wird von einer GaCl3-Einheit überkappt und zusätzlich ist jedes Rh-Atom
durch eine GaCp*-Einheit koordiniert (Schema 13). Demzufolge kann 7 als dimere Struktur
- 46 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
des Fragments [Cp*Rh(GaCp*)2] von Komplex 4 aufgefasst werden. Das basische Rhodiumzentrum der indermediären Spezies [{Cp*Rh(GaCp*)2}n] (n = 1, 2) wird in beiden Strukturen
durch die elektrophile GaCl3-Einheit stabilisiert.
Der “all hydrocarbon” Komplex [(Cp*Rh)2(µ2-(η1-GaCp*))2(µ4-(η1-GaCp*))] (8): ein
thermisches Zersetzungsprodukt von 7
Neben einer Reihe von thermischen Zersetzungsprodukten von 7 in Toluol bei 110°C, können
in Spuren dunkelrote oktaedrische Kristalle einer neuen Verbindung isoliert werden. Die
Einkristallröntgenstrukturanalyse belegt die Bildung des “all hydrocarbon” Komplexes
[(Cp*Rh)2(µ2-(η1-GaCp*))2(µ4-(η1-GaCp*))] (8), der vermutlich durch Abspaltung von
GaCp* und GaCl3, oder des Adduktes [Cp*Ga→GaCl3] entsteht. Die Molekülstruktur von 8
ist in Abbildung 15 dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 6
angeführt.
Strukturelle Charakterisierung von [(Cp*Rh)2(µ2-(η1-GaCp*))2(µ4-(η1-GaCp*))] (8)
Komplex 8 kristallisiert in der triklinen Raumgruppe P⎯1. Die Molekülstruktur von 8 wird
aus einer pyramidalen Rh2Ga3-Einheit gebildet. Der Rh2Ga2-Ring weicht um 16.5° von der
Planarität ab. Die Winkel Ga(1)-Rh-Ga(2) haben Werte von rund 100°, während die Winkel
Rh(1)-Ga-Rh(2) (ca. 78°) signifikant kleiner als 90°C sind. Diese Verzerrung führt zu einem
relativ kurzen Rh(1)-Rh(2)-Abstand von 3.0131(15) Å. Das Ga(3)-Zentrum wird in einer µ4gebundenen Postion detektiert, wobei sowohl die beiden Rhodiumatome als auch die zwei
Galliumzentren verbrückt werden. So betragen die Rh-Ga-Bindungsabstände in dem Rh2Ga2Vierring 2.3873(15) Å und 2.4054(16) Å. Für die Rh-Ga(3)-Bindungslängen werden
vergleichbare Werte (2.4004(15) und 2.3902(18) Å) gefunden. Die Ga(3)-Ga(1,2)-Distanzen
haben Werte von 2.8055(19) und 2.8253(19) Å. Diese Abstände sind deutlich kleiner als die
Ga-Ga-Bindungslängen in [{Cp*Ga}6] (4.073(2)-4.173(3) Å),[15] jedoch im Vergleich zu
[{GaC(SiMe3)3}4] (2.688 Å)[20] sind die Ga-Ga-Abstände in 8 um 0.12 Å aufgeweitet.
Erwartungsgemäß werden in kovalent gebundenen Digallanen wie z.B. [(SiMe3)2CHGaGaCH(SiMe3)2] (2.541(1) Å)[108] die kürzesten Ga-Ga-Abstände detektiert.
- 47 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Abbildung 15. Molekülstruktur von [(Cp*Rh)2(µ2-(η1-GaCp*))2(µ4-(η1-GaCp*))] (8) im Kristall
Die Cp*-Gruppen der Ga-Zentren sind σ-gebunden mit typischen Ga-C-Abständen von 2.03
Å. Die Ring-C-Atome C(31), C(41) und C(51) sind sp3-hybridisiert, woraus ein nicht planarer
Cp*-Ring resultiert. Die Torsionswinkel der Methylgruppen (C(411) und C(311)) an den
Ring-C-Atomen C(31) und C(41) haben Werte von rund 60°, während der Dihedralwinkel der
Methylgruppe C(511) an Ga(3) (44.4(8)°) signifikant kleiner ist. Diese Verzerrung kann
durch die sterische Repulsion der Cp*-Gruppen an den Ga- und Rh-Zentren erklärt werden. Je
größer die Abweichung von C(411) und C(311) bezüglich der C5-Ringebene ist, desto
geringer ist die sterische Behinderung der angrenzenden Cp*Rh-Fragmente. An C(511) tritt
diese sterische Repulsion nicht auf, so dass hier ein kleinerer Torsionswinkel beobachtet wird.
Zusammenfassend kann die Struktur und die Bindungssituation von 8 nach den
Regeln von Wade/Mingos als heterometallischer precloso-Cluster beschrieben werden. Die
GaCp*-Liganden und die Cp*Rh-Fragmente sind isolobal zu einer BH-Einheit, so dass
Komplex 8 formal als ein Analogon zu B5H5 angesehen werden kann.
- 48 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
Tabelle 6.Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [(Cp*Rh)2(GaCp*)3] (8)
Rh(1)-Ga(1)
2.3873(15)
C(54)-C(55)
1.364(12)
Rh(1)-Ga(2)
2.3942(18)
C(33)-C(34)
1.434(13)
Rh(1)-Ga(3)
2.4004(15)
C(41)-C(42)
1.497(12)
Rh(2)-Ga(1)
2.3902(18)
Rh(2)-Ga(2)
2.4054(16)
Ga(1)-Rh(1)-Ga(2)
100.77(5)
Rh(2)-Ga(3)
2.3908(17)
Ga(1)-Rh(2)-Ga(2)
100.36(4)
Ga(1)-Ga(3)
2.8055(19)
Rh(1)-Ga(1)-Rh(2)
78.20(5)
Ga(2)-Ga(3)
2.8253(19)
Rh(1)-Ga(2)-Rh(2)
77.77(5)
Rh(1)-Rh(2)
3.0131(15)
Ga(1)-C(31)
2.029(8)
Ga(2)-Rh(1)-Rh(2)-Ga(1)
16.48(5)
Ga(2)-C(41)
2.049(9)
C(311)-C(31)-C(32)-C(33)
60.9(9)
Ga(3)-C(51)
2.026(8)
C(411)-C(41)-C(42)-C(43)
59.7(1)
C(44)-C(45)
1.313(13)
C(511)-C(51)-C(52)-C(53)
44.4(8)
Zusammenfassung und Diskussion
In Abhängigkeit von der Stöchiometrie und den Reaktionsbedingungen werden in der
Reaktion von [{Cp*RhCl2}2] und EIR (E = Ga, In) eine Vielfalt an Insertionsprodukten
gebildet. Die Reaktion von [{RhCp*Cl2}2] mit einem Überschuss an EIR (E = Ga, In; R =
Cp* und E = In, R = C(SiMe3)3) bietet einen geeigneten und reproduzierbaren Syntheseweg
zur Darstellung von neuartigen Rh-EIR-Komplexen des Typs [Cp*Rh(ER)3Cl2] (2, 3). Im
Gegensatz zu d10-Metallzentren, wird - infolge der hohen Basizität des gesättigten d8Fragmentes [Cp*Rh(ER)2] - eine Dissoziation der aciden Komponente EIIIRCl2 verhindert.
Die thermisch stabilen Insertionsprodukte 2 und 3 verfügen über käfig-artige Strukturen mit
E-Cl-E-Brücken. In Lösung wird für die formal unterschiedlichen Fragmente EIIIRCl2 und
EIR bis -80°C Fluktionalität beobachtet, was darauf hindeutet, dass kein einfaches SäureBase-Addukt der Form [RhCp*(ER)2→ERCl2] vorliegt. Aufgrund eines schnellen ClAustausches sind die drei EIR-Liganden auf der NMR-Zeitskala äquivalent. Dieser fluktionale
Prozess kommt auch in den Molekülstrukturen der Insertionsprodukte zum Ausdruck, die als
“Intermediate” eines Cl-Austausches zwischen EI und EIII betrachtet werden können.
Die Reaktion von [{RhCp*Cl2}2] mit 3 Äquivalenten GaCp* führt in geringen
Ausbeuten zu dem Lewis-Säure-Base-Addukt [Cp*Rh(GaCp*)2(GaCl3)] (4), welches auch
durch Umsetzung von [Cp*Rh(GaCp*)3Cl2] (2a) mit GaCl3 quantitativ zugänglich ist. Das
- 49 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
basische Rhodiumzentrum der indermediären Spezies [Cp*Rh(GaCp*)2] wird durch die
elektrophile GaCl3-Einheit stabilisiert, wodurch sich die Polarität der Rh-GaCp*-Bindung
erhöht. Die freie Lewis-Base [Cp*Rh(GaCp*)2] kann durch Abstraktion von GaCl3 nicht
isoliert werden.
Werden nur drei Äquivalente InCp* in Gegenwart von [{RhCp*Cl2}2] eingesetzt,
bildet sich der ionische Komplex [Cp*2Rh]+[Cp*Rh(InCp*){In2Cl4(µ2-Cp*}]- (5). Das Anion
der Molekülstruktur von 5 weist eine intermetallische RhIn3-Einheit mit einem intramolekular
verbrückenden Cp*-Ring auf. Die Reduktion von [{Cp*RhCl2}2] zu dem dimeren RhIIKomplex [{Cp*RhCl}2] ist zu beobachten, wenn nur ein Äquivalent EICp* eingesetzt wird.
Allerdings ist [{Cp*RhCl}2] kein Intermediat auf dem Weg zu dem Insertionsprodukt 5, da
die Reaktion mit zwei Äquivalenten InCp* in Gegenwart von InCp*Cl2 nicht zu 5 führt.
Hingegen erscheint ein zur Generierung von [Cp*(Cp*Ga)2FeGaCl2⋅THF][83] analoger
Mechanismus überzeugend, der eine mehrmalige Koordination und Insertionen von InCp* in
die Rh-Cl-Bindung sowie einen Cp*/Cl-[1,2]-Austausch beinhaltet.
Bei der Reaktion von isolierten [{Cp*RhCl}2] mit GaCp* werden weitere
Insertionsprodukte isoliert. In Abhängigkeit von der Reaktionszeit und Temperatur führt die
Reaktion von [{Cp*RhCl}2] mit 6 Äquivalenten GaCp* zu dimeren Rh-Ga-Komplexen mit
der Summenformel [(Cp*Rh)2(GaCp*)2Cl2] (6) und [(Cp*Rh)2(GaCp*)4(GaCl3)] (7).
Demzufolge kann [{Cp*RhCl}2] als ein Intermediat auf dem Weg zu [Cp*Rh(GaCp*)3Cl2]
(2a) ausgeschlossen werden. Offensichtlich ist die Insertionsreaktion auf dem Weg zu 2a
günstiger, als eine Abstraktion der Cl-Atome, die schließlich zu den Produkten 6 und 7 führen
würde. Letztere konnten als Nebenprodukte bei der Darstellung von 2a nicht nachgewiesen
werden. Obwohl in allen hier beschriebenen Insertionsreaktionen der Reaktionsverlauf von
den äußeren Randbedingungen (Stöchiometrie, Temperatur, Lösungsmittel etc.) stark
abhängig ist, kann ein derartiger Bezug bei der Synthese von 2a zumindet bei der Wahl des
Lösungsmittels ausgeschlossen werden. So wird in Hexan oder THF ausschließlich 2a
erhalten.
Ferner bleibt anzumerken, dass als ein thermisches Zersetzungsprodukt von 7 der “all
hydrocarbon” Cluster [(RhCp*)2(GaCp*)3] (8) in Spuren isoliert werden kann. Dieser
heterometallische precloso-Cluster offenbart letztendlich die Möglichkeiten und das Potential
dieser Synthesestrategie, zeigt aber auch gleichzeitig die Komplexität und die Grenzen auf.
Interessanterweise wurde eine Bindungsaktivierung an diesem sicherlich elektronenreichen
d8-Rhodiumfragment nicht beobachtet, während C-H-Bindungsspaltungen an den chemisch
verwandten Systemen [Cp*Rh(CO)2],[109,
110]
[CpIr(CO)2]111] und [TpRh(CO)2] (Tp = Tris-
- 50 -
Ergebnisse
Insertion von EIR in Rh-Cl-Bindungen
________________________________________________________________________
(2,4-dimethylpyrazolyl)borat)[112] eingehend untersucht wurden. Entscheidend für die
Bindungsaktivierung bei diesen Reaktionen ist die photochemische Abspaltung von CO unter
Bildung eines ungesättigten Fragmentes der Form [LnM(CO)] (M = Rh, Ir). Möglicherweise
ist die stärkere M-ER- im Vergleich zur M-CO-Bindung eine Erklärung für das Ausbleiben
von Aktivierungsreaktionen. Ferner könnte die Formation eines Clusters verknüpft mit der
Möglichkeit, dass ein η1-koordinierter GaCp*-Ligand als verhältnismäßig starker π-Akzeptor
fungieren kann (siehe Komplex 8), der Generierung reaktiver Fragmente des Typs
[Cp*Rh(ER)n] (n = 1, 2) gegenüber stehen. Dessen ungeachtet kann mit dem System Fe/Al
die prinzipielle Reaktivität von d8-M-E-Verbindungen in Bindungsaktivierungen nachgewiesen werden (siehe Kapitel 4).
- 51 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
2.
M-EIR-Komplexe via Substitution labiler Liganden: Auf dem
Weg zu homoleptischen Clustern [Ma(EIR)b]
2.1. [(CO)3Mo(GaCp*)3] - ein Synthesebaustein zur Darstellung der
dinuklearen Clusterverbindung [Mo2(CO)6(µ2-GaCp*)3]
Die Substitution labil gebundener Liganden (Nitrile, Olefine u.ä.) in Metallcarbonylkomplexen durch stärkere σ-Donoren, wie Phosphane ist eine grundlegende Reaktion in der
Organometallchemie. Wie bereits in Kapitel II eingehend dargelegt, werden nahezu alle
Übergangsmetallkomplexe mit koordinierten GaCp* durch Ligandensubstitution dargestellt.
So werden beispielsweise [Cr(GaCp*)(CO)5][16] und [cis-(GaCp*)2Mo(CO)2][54] durch
Substitution von Cycloocten bzw. Norbornadien erhalten. M-E-Komplexe mit mehr als zwei
endständig koordinierten EIR-Liganden an einem oktaedrischen d-Metallzentrum waren zu
Beginn dieser Arbeit unbekannt. Nach Ansicht von Jutzi und Mitarbeiter sind - bedingt durch
die sterische Repulsion der Cp*-Gruppen - oktaedrische d-Metallkomplexe mit drei terminal
koordinierten GaCp*-Liganden nur schwer zugänglich.[54] Um diese Annahme zu überprüfen
und damit weitere Einblicke in die Ligandeneigenschaften von EIR zu erhalten wird die
Reaktivität von GaCp* gegenüber den Substitutions-labilen Komplexen [fac-(RCN)3M(CO)3]
(M = Mo, R =/Me; M = W, R = Et) untersucht.
Darstellung von [(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b) und [Mo2(CO)6(µ2-GaCp*)3] (9)
Gemäß Schema 14 führt die Umsetzung von [fac-(MeCN)3Mo(CO)3] mit drei Äquivalenten
GaCp* in siedendem Toluol für 3h zu einer vollständigen Substitution der MeCN-Liganden
durch GaCp*. Die Bildung von [fac-(Cp*Ga)3Mo(CO)3] (9a) verläuft quantitativ, was mittels
IR-Spektroskopie nachgewiesen wird. Nach Abkühlen der Reaktionslösung auf RT werden
gelbe prismatische Einkristalle von 9a in einer Ausbeute von 48 % erhalten. 9a löst sich in
unpolaren Lösungsmitteln wie Hexan und Toluol. In polaren organischen Lösungsmitteln wie
Diethylether oder THF ist die Verbindung unlöslich. 9a ist luft- und feuchtigkeitsempfindlich
und zersetzt sich im Festkörper bei 150°C.[87] Der analoge WGa3-Komplex [fac(Cp*Ga)3W(CO)3] (9b) wird durch Umsetzung von [fac-(EtCN)3W(CO)3] in Gegenwart von
drei Äquivalenten GaCp* in Toluol bei 120°C für 3h in Form von gelben prismatischen
- 52 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Einkristallen in einer Ausbeute von 74 % isoliert.[113]
(MeCN)3M(CO)3
3 GaCp*
Toluol, 120°C
- 3 MeCN
M=Mo, W
CO
GaCp*
GaCp*
M
GaCp*
CO
9a: M=Mo, 9b: M=W
9a
(MeCN)3Mo(CO)3
CO
Toluol, 120°C
- 3 MeCN
Cp*
CO
Ga
CO
CO Mo
Mo CO
CO
CO
Ga Ga
Cp* Cp*
10
Schema 14. Synthese von [fac-(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b) und [Mo2(CO)6(µ2-GaCp*)3] (10)
Des Weiteren kann Verbindung 9a als Synthesebaustein zum Aufbau von dinuklearen
Strukturen eingesetzt werden. Die Kombination von 9a mit einem Äquivalent [fac(MeCN)3Mo(CO)3] in siedendem Toluol führt quantitativ zu dem tiefroten dinuklearen
Komplex [Mo2(CO)6(µ2-GaCp*)3] (10) (Schema 14). Komplex 10 ist luftempfindlich und
wird durch Kristallisation in Toluol gereinigt und in einer Ausbeute von 70-80 % isoliert. 10
löst sich gut in unpolaren Lösungsmitteln und zersetzt sich im Festkörper bei Temperaturen
über 224°C.[87]
Interessanterweise reagiert die Startverbindung [fac-(MeCN)3Mo(CO)3] nicht mit
InCp*. Offensichtlich ist der σ-Donor-Charakter von InCp* nicht ausreichend, um die MeCNSubstituenten teilweise oder vollständig zu verdrängen. Dagegen kann mittels in situ 1H- und
13
C-NMR Experimenten nachgewiesen werden, dass die Reaktion von [(MeCN)3Mo(CO)3]
mit AlCp* zu einem Gemisch zweier Produkte führt, welches vermutlich aus dem Monomer
[fac-(Cp*Al)3Mo(CO)3] und dem Dimer [Mo2(CO)6(µ2-AlCp*)3] zusammengesetzt ist.
Jedoch können die Verbindungen nicht in reiner Form isoliert werden, so dass sie im
Folgenden nicht weiter diskutiert werden.
- 53 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Spektroskopische Charakterisierung von [(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b)
Das 1H-NMR-Spektrum von [(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b) in C6D6 weist ein
Singulett bei 1.90 ppm für die Methyl-Gruppen des Cp*-Ringes auf. Das 13C-NMR-Spektrum
zeigt zwei Resonanzen bei 9.7 und 114.2 ppm, die den Methyl-Gruppen und den Ring-CAtomen zugeordnet werden können. Zusätzlich wird ein CO-Signal bei 221.4 ppm detektiert.
Im IR-Spektrum von 9a finden sich zwei starke Absorptionen bei 1927 und 1846 cm-1. Die
Lage der v(CO)-Streckschwingung ist charakteristisch für terminal koordinierte CO-Liganden
und die Anzahl der Banden belegt die faciale Koordination der drei GaCp*-Einheiten
(Punktgruppe C3v). Im Vergleich zu der Lage der v(CO)-Streckschwingung im IR-Spektrum
von [Mo(CO)6] (2004 cm-1) sind die Absorptionen in Verbindung 9a deutlich zu niedrigeren
Wellenzahlen verschoben, was sich durch eine verstärkte Mo-C-Rückbindung (hervorgerufen
durch den stärkeren σ-Donator GaCp*) erklären lässt.[45, 46]
Verbindung 9b besitzt ähnliche spektroskopische Daten wie 9a. Die Protonen der
Methylgruppen des Cp*-Liganden haben im 1H-NMR-Spektrum in C6D6 eine chemische
Verschiebung von 1.87 ppm. Wie zu erwarten, zeigt das
13
C-NMR-Spektrum von 9b drei
Signale, die den CO-Substituenten (221.8 ppm), den inneren C-Atomen (114.4 ppm) und den
Methyl-Gruppen der Cp*-Ringe (10.0 ppm) zugeordnet werden können. Auch die Lage der
IR-Absorptionen der CO-Liganden von 1921 und 1836 cm-1 stimmt gut mit denen von 9a
überein.
Spektroskopische Charakterisierung von [Mo2(CO)6(µ2-GaCp*)3] (10)
Das 1H-NMR-Spektrum von [Mo2(CO)6(µ2-GaCp*)3] (10) in C6D6 zeigt ein Singulett mit
einer chemischen Verschiebung von 2.12 ppm, welches die hohe Symmetrie der η5koordinierten Cp*-Einheiten betont. Die chemische Verschiebung von 10 ist im Vergleich zu
9a 0.22 ppm zu tiefem Feld verschoben, was auf eine erhöhte Bindungspolarität der Mo-GaBindung in 10 infolge der verbrückenden Position der Liganden hinweist. Im
13
C-NMR-
Spektrum wird nur ein Signalsatz der Cp*-Gruppen (10.1 und 116.6 ppm) beobachtet. Die
CO-Substituenten rufen eine Resonanz bei 219.7 ppm hervor. Im v(CO)-Bereich des IRSpektrums von 10 werden zwei Absorptionen bei 1921 und 1857 cm-1 detektiert.
- 54 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Strukturelle Charakterisierung von [(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b)
Verbindungen 9a und 9b können durch langsames Abkühlen einer gesättigten Toluol-Lösung
auf RT umkristallisiert werden. Dabei können für die Kristallstrukturanalyse geeignete
Einkristalle erhalten werden. Die Molekülstrukturen von 9a und 9b sind in Abbildung 16
dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 7 angeführt.
Abbildung 16. Molekülstruktur von [fac-(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b) im Kristall
Komplex 9a und 9b sind isostrukturell und kristallisieren in der triklinen Raumgruppe P 1 .
Die Molekülstrukturen verfügen über ein oktaedrisch koordiniertes Mo- bzw. W-Zentrum mit
einer facialen Anordnung von jeweils drei GaCp*- und drei CO-Liganden. Alle Winkel
zwischen den cis-Substituenten sind annähernd 90° (Ga(1)-Mo(1)-Ga(2) 91.10(3)°, Ga(1)Mo(1)-Ga(2) 91.10(3)°), die Winkel der trans-Liganden nahezu 180° (Ga(1)-Mo(1)-C(2)
89.6(2)° und Ga(3)-Mo(1)-C(3) 178.4(2)°). Die M-Ga-Bindungsabstände sind nahezu
identisch. Die W-Ga-Bindungslängen liegen im Bereich 2.5198(13)-2.5221(12) Å und sind
vergleichbar mit dem W-Ga-Bindungsabstand in [(Cp*Ga)W(CO)5] (2.566(8) Å).[114] Die
Mo-Ga-Abstände haben einen Wert von rund 2.52 Å (2.5228(8) und 2.5188(8) Å) und
- 55 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
entsprechen den Mo-Ga-Distanzen in dem disubstituierten Komplex [cis-Mo(Cp*Ga)2(CO)4]
(Mo-Ga 2.554(1) und 2.537(1) Å).[54] Infolge der monomeren Molekülstruktur von 9a und 9b
können bindende Ga-Ga-Wechselwirkungen ausgeschlossen werden (3.604 Å in 9a und 3.601
Å in 9b). Ferner sind die Cp*-Einheiten nahezu symmetrisch η5-koordiniert und die Winkel
Cp*Zentrum-Ga-M (166.2° in 9a; 166.3° in 9b) weisen eine verhältnismäßig geringfügige
Abweichung von der Linearität auf, die auch für [Cr(GaCp*)(CO)5] (163.45°)[16] und [cisMo(Cp*Ga)2(CO)4] (160.82° und 172.20°)[54] beobachtet wird.
Tabelle 7. Vergleich ausgewählter Bindungsabstände (Å) und Winkel (°) für die Komplexe [fac(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b)
9a
9b
M(1)-Ga(1)
2.5188(8)
2.5198(13)
M(1)-Ga(2)
2.5204(8)
2.5211(11)
M(1)-Ga(3)
2.5228(8)
2.5221(12)
Ga(1)···Ga(2)
3.604
3.601
M(1)-C(1)
1.958(7)
1.946(10)
M(1)-C(2)
1.970(7)
1.981(10)
M(1)-C(3)
1.951(7)
1.980(10)
Ga(1)–Cp*Zentrum
1.948
1.936
Ga(2)–Cp*Zentrum
1.941
1.952
Ga(3)–Cp*Zentrum
1.947
1.944
C(1)-O(1)
1.168(8)
1.170(12)
C(2)-O(2)
1.154(8)
1.159(11)
C(3)-O(3)
1.168(8)
1.162(12)
M(1)–C(1)–O(1)
179.3(7)
178.0(10)
Ga(1)–M(1)–Ga(2)
91.1(3)
91.14(4)
Ga(1)–M(1)–C(2)
89.6(2)
87.5(3)
Ga(3)-M(1)-C(2)
178.4(2)
177.8(3)
M(1)-Ga(1)-Cp*Zentrum
166.2
166.3
Im Vergleich zum freien Liganden GaCp* mit einem Cp*Zentrum-Ga-Abstand von 2.081 Å
(Gasphase, Monomer)[115] sind die Cp*Zentrum-Ga-Abstände in 9a (1.947(3) Å) bzw. 9b (1.944
Å) leicht verkürzt. Dieser Bindungsabstand ist ein etabliertes indirektes Maß für die Polariät
der M-Ga-Bindung und ein Indikator für die σ-Donor-Fähigkeit der GaCp*-Fragmente. In
Übereinstimmung mit den Resultaten von Jutzi et al. ist der Cp*Zentrum-Ga-Abstand in der
Serie [M(Cp*Ga)x(CO)6-x] (x ≤ 3) abhängig von dem Metall M und der Anzahl der GaCp*-
- 56 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Liganden. Dabei verlängert sich der Abstand Cp*Zentrum-Ga mit steigendem x. Der kürzeste
Abstand wird in [Cr(Cp*Ga)(CO)5] (1.910 Å) und [Fe(Cp*Ga)(CO)4] (1.863(4) Å)
beobachtet.[16] Der Vergleich von 9a (1.947(3) Å) mit [cis-Mo(Cp*Ga)2(CO)4] (1.930(6)
Å)[54] zeigt eindeutig den Trend zu weniger polarisierten Moδ--Gaδ+-Bindungen in höher
substituierten Komplexen, da weniger Carbonyl-Gruppen als Akzeptoren um die
Elektronendichte am d-Metallzentrum konkurrieren. Entsprechendes gilt auch für 9b und
[(Cp*Ga)W(CO)5] (Cp*Zentrum-Ga 1.915 Å).[114] Ferner führt der starke σ-Donor-Charakter
von GaCp* in 9a und 9b auch zu einer verkürzten M-CO-Bindung (1.958(7) Å in 9a,
1.980(10) Å in 9b) und leicht verlängerten C-O-Bindungen (1.168(8) Å in 9a, 1.162(12) in
9b) im Vergleich zu [cis-(Cp*Ga)2Mo(CO)4] (Mo-Caxial 2.042(6), Mo-Cäquatorial 1.975(5) Å; CO 1.144(6)-1.158(5) Å)[54] und [(Cp*Ga)W(CO)5] (W-Caxial 2.048(7), W-Cäquatorial 2.088(7) Å;
C-O 1.111(5)-1.143(6) Å).[114]
Strukturelle Charakterisierung von [Mo2(CO)6(µ2-GaCp*)3] (10)
Komplex 10 wird durch langsames Abkühlen einer gesättigten Toluol-Lösung kristallisiert.
Dabei werden für die Kristallstrukturanalyse geeignete Einkristalle erhalten. Die Molekülstruktur von 10 ist in Abbildung 17 dargestellt; ausgesuchte Bindungslängen und –winkel sind
in Tabelle 8 angeführt.
Tabelle 8.Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Mo2(CO)6(µ2-GaCp*)3] (10)
Mo(1)-Mo(2)
2.7661(6)
Ga(1)–Mo(1)–Ga(2)
101.38(2)
Ga(1)···Ga(2)
3.864(3)
Ga(1)–Mo(1)–Ga(3)
92.66(2)
Mo(1)-Ga(1)
2.6796(8)
Ga(1)–Mo(2)–Ga(2)
101.51(2)
Mo(1)-Ga(3)
2.6567(8)
Ga(1)–Mo(2)–Ga(3)
92.60(2)
Mo(2)-Ga(1)
2.6616(8)
Mo(1)–Ga(1)–Mo(2)
62.571(16)
Mo(1)-C(1)
1.948(5)
Mo(1)–Mo(2)–Ga(1)
58.484(18)
Mo(1)-C(2)
1.964(5)
Mo(1)–C(1)–O(1)
179.8(6)
Mo(1)-C(3)
1.968(5)
Ga(1)–Mo(1)–C(1)
89.00(16)
Mo(2)-C(4)
1.945(5)
Mo(2)-C(5)
1.952(5)
Ga(1)–Mo(1)–Mo(2)–Ga(2)
115.4(2)
Mo(2)-C(6)
1.955(5)
Ga(1)–Mo(1)–Mo(2)–Ga(3)
114.9(2)
Ga(1)–Cp*Zentrum
1.911(4)
Ga(2)–Mo(1)–Mo(2)–Ga(3)
129.7(2)
- 57 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Komplex 10 kristallisiert in der monoklinen Raumgruppe P21/c. Die Molekülstruktur besteht
aus einer zentralen Mo2-Einheit (Mo(1) und Mo(2)) mit einer Mo-Mo-Bindungslänge von
2.7661(6) Å. Dieser Mo-Mo-Abstand ist eindeutig kürzer als in [{CpMo(CO)3}2] (3.235(1)
Å)[89] mit einer Mo-Mo-Einfachbindung, aber im Vergleich zu der Mo≡ Mo-Dreifachbindung
in [{CpMo(CO)2}2] (2.448(1) Å)[116] deutlich aufgeweitet. Folglich ist die Mo-Mo-Bindung in
10 vergleichbar mit der Mo=Mo-Doppelbindung in dem Vinyliden-verbrückten Komplex
[(CpMe)2(CO)4Mo2(µ2-CC12H8)] (2.798(1) Å)[117] oder in [(Cp*)2(NCO)(CO)3Mo2(µ2NCMe2)] (2.745(2) Å).[118]
Abbildung 17. Molekülstruktur von [Mo2(CO)6(µ2-GaCp*)3] (10) im Kristall
Komplex 10 ist die erste dimere Mo0-Verbindung mit zwei MoL3-Fragmenten, die durch drei
Liganden verbrückt wird. So ist die Mo2-Einheit von drei verbrückenden GaCp*-Liganden
und sechs terminal koordinierten Carbonyl-Gruppen in einer nahezu ekliptischen Anordnung
(Abweichung kleiner 2°) umgeben. Alle Mo-C- und C-O-Bindungen sind sehr ähnlich, mit
Werten von rund 1.955 Å (Mo-C) und 1.169 Å (C-O). Die zentrale Einheit des Moleküls kann
formal auch als Mo2Ga3-Cluster mit einer trigonal-bipyramidalen Symmetrie angesehen
werden, wobei die Mo-Zentren axiale und die Ga-Atome äquatoriale Positionen besetzen. Die
- 58 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Torsionswinkel Ga-Mo-Mo-Ga weichen weniger als 10° von dem Idealwert 120° ab. Ebenso
verdeutlicht die Äquivalenz aller Mo-Ga-Bindungslängen (2.6567(7) bis 2.6851(7) Å) die
hohe Symmetrie der µ2-koordinierten GaCp*-Einheiten. Die Mo-Ga-Bindungslängen sind im
Vergleich zu 9a nur um 5 % aufgeweitet. Folglich entspricht die Molekülstruktur von 10 einer
leicht verzerrten D3h-Symmetrie für die (CO)6Mo2Ga3-Struktur. Eine analoge Anordnung der
Zentralatome wird in dem Komplex [(OC)3Fe{µ2-(η5-Cp*Ga)2(µ2-(η3-Cp*Ga)}Fe(CO)3] mit
zwei η5- und einem η3-gebundenen Cp*-Liganden gefunden.[16] In 10 sind aber alle Cp*Gruppen nahezu ideal in einer η5-Symmetrie angeordnet, wobei die durchschnittliche
Cp*Zentrum-Ga-Bindung einen Wert von 1.910 Å aufweist. Diese Distanz ist kürzer als die
durchschnittliche Cp*Zentrum-Ga-Bindung in 9a (1.947 Å), was auf die erhöhte Elektronendonierung der verbrückenden im Vergleich zu den terminal koordinierten GaCp*-Liganden
hindeutet (siehe 1H-NMR-Spektren). Für verwandte Komplexe mit verbrückenden Cp*GaGruppen werden Werte im Bereich 1.932-2.008 Å gefunden ([Ni4(GaCp*)4(CO)6)] 1.9502.008 Å; [(OC)3Co(µ2-GaCp*)2Co(CO)3] 1.932 und 1.945Å).[16] Die Ga⋅⋅⋅Ga-Abstände in
Komplex 10 (3.860 und 4.129 Å) sind im Vergleich zu 9a (3.606 Å) rund 0.25-0.5 Å
aufgeweitet. Infolgedessen gibt es keinen Anhaltspunkt für eine bindende Ga-Ga-Wechselwirkung.
Auf den ersten Blick deutet die kurze Mo-Mo-Bindung in Komplex 10 auf eine
verhältnismäßig starke Metall-Metall-Wechselwirkung hin. Jedoch kann das Mo2Ga3-Gerüst
auch als Resultat von Dreizentrum-Zweielektronen-Bindungen angesehen werden, die aus den
Grenzorbitalen der zwei C3v-Mo(CO)3-Fragmente und den freien Elektronenpaaren der
GaCp*-Liganden mit überwiegend σ-Charakter gebildet werden. Demnach kann die Molekülstruktur von 10 auch einfach als Resultat zweier flächenverknüpfter oktaedrischer MoL3Einheiten beschrieben werden, in der die Molybdänzentren jeweils über eine Valenzelektronenzahl von 18 verfügen, ohne dass direkte bindende Mo-Mo-Wechselwirkungen
einbezogen werden müssen. Die kurze Mo-Mo-Distanz ist demzufolge eine Konsequenz der
verhältnismäßig kurzen Mo-Ga-Bindungen und den kleinen Mo-Ga-Mo-Winkeln von
durchschnittlich 60°. In flächenverknüpften oktaedrischen Strukturen müssen sich
erfahrungsgemäß die beiden Metallzentren sehr nahe kommen, ohne dass dabei direkte
Metall-Metall-Wechselwirkungen auftreten.
- 59 -
Ergebnisse
Bausteinsynthese mit (CO)3Mo(GaCp*)3
________________________________________________________________________
Zusammenfassung
Die Synthese der monomeren Komplexe [fac-(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b) erfolgt
durch Substitution schwach gebundener Alkylnitrile ausgehend von [fac-(RCN)3M(CO)3] (M
= Mo, R = Me; M = W, R = Et) durch GaCp*. Die Komplexe 9a und 9b sind die ersten
Beispiele für mononukleare oktaedrische d-Metallkomplexe mit drei facial angeordneten EIRLiganden. Die strukturellen Daten zeigen keine ungewöhnlichen Verzerrungen und geben
auch keinen Hinweis auf sterische Überfüllung dieser Systeme. Darüber hinaus kann
Komplex 9a als Synthesebaustein zur Generierung von dinuklearen d-Metallkomplexen
eingesetzt werden. 9a reagiert mit einem Äquivalent [fac-(MeCN)3Mo(CO)3] zu der dimeren
Verbindung [Mo2(CO)6(µ2-GaCp*)3] (10). Dieses Ergebnis zeigt eindrucksvoll, dass die
verbrückenden Fähigkeiten von GaCp* weit über die des isolobalen CO-Liganden
hinausgehen. Während bereits dokumentierte EIR-verbrückte Komplexe des Typs [M2(µ2ER)n(CO)m] sich direkt aus den isoelektronischen Metallcarbonylen [M2(CO)m+n] (z.B. M =
Fe, Co) ableiten lassen, ist für Verbindung 10 kein analoger Metallcarbonylkomplex der Form
[(CO)3Mo(µ2-CO)3Mo(CO)3] dokumentiert.
- 60 -
Ergebnisse
Rh2Ga2 - ein dinuklearer Komplex via Ligandsubstitution
________________________________________________________________________
2.2. Darstellung von [{Cp(C2H4)Rh(µ2-(η1-GaCp*))}2] via Substitutionsreaktion von [{CpRh(C2H4)(NCMe)] mit GaCp*
Neben der in Kapitel 1.2 beschrieben Insertion von EIR in die Rh-Cl-Bindung von
[{Cp*RhCl2}2], wurde ein alternativer Zugangsweg zu “all hydrocarbon” d8-Rh-EIR
Verbindungen des Typs [Cp*Rh(ER)2] gesucht. Als Ausgangsverbindungen bieten sich unter
anderem die Ethylen-substituierten Komplexe [RRh(C2H4)2] (R = Cp, Cp*) an. Es ist
allgemein bekannt, dass der Komplex [CpRh(C2H4)2] thermisch sehr stabil, aber unter
photolytischen Bedingungen in Anwesenheit von Substraten L (L = CO, PPh3, Me2SO
etc.),[119] die Substitutionsprodukte [CpRh(C2H4)L] und [CpRhL2] bildet. Das Verhältnis
zwischen mono- und disubstituierten Produkten ist dabei abhängig von den Liganden L.[120]
[CpRh(C2H4)2] kann also als eine Quelle für hoch reaktive ungesättigte Fragmente des Typs
[CpRh(C2H4)] und [CpRh] betrachtet werden.
Auf Grundlage dieser Überlegungen wurde die Photolyse einer Lösung von
[CpRh(C2H4)2] in Gegenwart von ECp* (E = Al, Ga, In) durchgeführt. Eine Ligandensubstitution wird jedoch nicht beobachtet. Offensichtlich ist eine Substitution des stärkeren πAkzeptor-Liganden C2H4 durch den stärkeren Zweielektronen-Donor-Liganden ECp* an dem
sehr basischen Rhodiumzentrum aus thermodynamischen Gründen unvorteilhaft. Ebenso
haben Tilset und Mitarbeiter durch Reaktion von [CpRh(C2H4)2] mit dem N-heterocyclischen
Carben-Ligand 1,3-Dimesitylimidazol-2-yliden bei 90°C in Toluol nur einen partiellen
Austausch der Ethylen-Liganden beobachtet. Nach zwei Tagen beträgt das Verhältnis
zwischen Edukt und monosubstituiertem Produkt ca. 1:1.[121]
Um diese thermodynamisch ungünstige Situation zu umgehen, wurde eine alternative
Route zur Substitution von Ethylen gewählt. Hierbei wird zuerst [CpRh(C2H4)2] bei -20°C mit
einem Überschuss CH3CN zu dem Monosubstitutionsprodukt [CpRh(C2H4)(NCMe)]
umgesetzt, welches in Gegenwart von weiteren Liganden L (L = CO, 1-Penten) dann die
Folgeprodukte [CpRh(C2H4)L] liefert.[120] Die Substitution von MeCN durch EIR wurde
erstmals von Jutzi et al. am Cluster [Rh6(CO)15(NCMe)] beschrieben, der mit einem
Äquivalent GaCp* in THF zu den mono- und disubstituierten Komplexen [Rh6(µ3-CO)3(µ3GaCp*)(CO)12] und [Rh6(µ3-CO)2(µ3-GaCp*)2(CO)12] (siehe Abbildung 5) reagiert.[72] Ferner
wurde diese Substitutionsroute an Molybdän- und Wolframzentren erfolgreich eingesetzt
(Kapitel 2.1).
- 61 -
Ergebnisse
Rh2Ga2 - ein dinuklearer Komplex via Ligandsubstitution
________________________________________________________________________
Darstellung von [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11)
Gemäß Schema 15 wird eine rote Lösung von [CpRh(C2H4)(NCMe)] in CH3CN bei -20°C
mit GaCp* versetzt. Nach Erwärmen auf Raumtemperatur fällt ein roter Niederschlag aus.
Durch langsames Abkühlen einer Toluol-Lösung des Rohproduktes auf -30°C wird die
Verbindung [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11) in Form von roten oktaedrischen
Einkristallen in einer Ausbeute von 49 % erhalten.
hν
CH3CN, -20ºC
Rh
Rh
- C2H4
NCCH3
- NCCH3
GaCp*
- 20ºC bis RT
GaCp*
Toluol
Rh
Ga
Ga
Rh
11
Schema 15. Synthese von [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11)
Komplex 11 löst sich gut in unpolaren organischen Lösungsmitteln. In CH2Cl2 wird langsame
Zersetzung beobachtet. 11 ist luft- und feuchtigkeitsempfindlich, kann aber über Monate unter
Inertgasatmosphäre bei Raumtemperatur gelagert werden. Im Festkörper zersetzt sich der
Komplex oberhalb von 210°C.
Spektroskopische Charakterisierung von [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11)
Im 1H- und
13
C-NMR-Spektrum von 11 in C6D6 bei RT werden zwei Signalsätze für jeden
Liganden (Cp, Cp* und C2H4) im Verhältnis von 1:5 detektiert (Abbildung 18). Das 1HNMR-Spektrum zeigt sechs Singuletts bei 4.96 und 4.91 ppm (RhCp), 2.01 und 1.96 ppm
(GaCp*) sowie 1.55 und 1.47 ppm (RhC2H4) mit einem Integralverhältnis von 10:30:8. Eine
- 62 -
Ergebnisse
Rh2Ga2 - ein dinuklearer Komplex via Ligandsubstitution
________________________________________________________________________
schnelle sigmatrope Umlagerung der im Festkörper η1-koordinierten Cp*-Liganden führt zu
koaleszierten NMR-Signalen (1H,
13
C) für die Methyl-Gruppen als auch für die Ring-C-
Atome. Bei -80°C in d8-Toluol bleiben die Spektren unverändert. Hingegen verändert sich das
Verhältnis der beiden Isomere mit steigender Temperatur. Beim Erwärmen auf 70°C erfolgt
eine unmittelbare Änderung der Signalintensitäten von ursprünglich 1:5 auf 4:1. Beim
Abkühlen der Probe auf Raumtemperatur wird ein langsamer Übergang zum ursprünglichen
Verhältnis detektiert. Nach 5 Tagen wird schließlich ein Verhältnis von 1:2.5 erhalten. Ferner
wird über diesen Zeitraum geringfügige Zersetzung (z.B. freies Cp*H) beobachtet. Die
Veränderungen der Signalintensitäten legen ein temperaturabhängiges Gleichgewicht zweier
Isomere von 11 nahe, z.B. die Umwandlung einer trans- in eine cis-Konformation (Abbildung
18).
Ga
Ga
Rh
Rh
Ga
trans
Rh
Rh
Ga
cis
Abbildung 18. Hochtemperatur-1H-NMR-Spektrum von [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11). Mögliche
Umwandlung zwischen trans- und cis -Konformation
- 63 -
Ergebnisse
Rh2Ga2 - ein dinuklearer Komplex via Ligandsubstitution
________________________________________________________________________
Strukturelle Charakterisierung von [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11)
Komplex 11 wird durch langsames Abkühlen einer gesättigten Toluol-Lösung auf -30°C
kristallisiert. Die Molekülstruktur von 11 ist in Abbildung 19 dargestellt; ausgesuchte
Bindungslängen und –winkel sind in Tabelle 9 angeführt.
Abbildung 19. Molekülstruktur von [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11) im Kristall
Komplex 11 kristallisiert in der orthorhombischen Raumgruppe Pbca. Die Molekülstruktur
von 11 im Festkörper verfügt über eine zentrale Einheit von zwei Rh- und Ga-Atomen. Der
Rh2Ga2-Ring ist nahezu planar. Der Winkel Rh(1)-Ga(1)-Rh(2) (109.28(2)°) weicht stark von
einer idealen quadratischen Geometrie ab. Der kleine Winkel Ga(1)-Rh(1)-Ga(2) von
70.72(6)° führt zu einer kurzen Ga-Ga-Distanz von 2.8065(12) Å, die nahezu den Ga-GaAbständen in dem Komplex [(RhCp*)2(GaCp*)3] (8) (2.8056(19)-2.825(2) Å) entspricht.
Daher können auch in 11 schwache Ga-Ga-Wechselwirkungen nicht ausgeschlossen werden.
Jedoch ist diese Frage nach bindenden Ga-Ga-Wechselwirkungen nicht eindeutig zu klären
und bedarf letztlich einer eingehenden quantentheoretischen Analyse.
Die Rh-Ga-Bindungslängen von 2.4085(8) Å (Rh(1)-Ga(1)) und 2.4408(9) Å (Rh(1)Ga(2)) liegen zwischen den Rh-Ga-Abständen in [Cp*Rh(GaCp*)2Cl2] (2a) (2.3584(12)2.4502(11) Å) und [Cp*Rh(GaCp*)2(GaCl3)] (4) (2.3442(9)-2.4177(9) Å). Der Cp*-Ring an
den Ga-Atomen ist σ-gebunden. Daher alternieren die C-C-Bindungslängen des C5-Ringes
- 64 -
Ergebnisse
Rh2Ga2 - ein dinuklearer Komplex via Ligandsubstitution
________________________________________________________________________
mit C=C-Doppelbindungen von ca. 1.36 Å und C-C-Einfachbindungen von ungefähr 1.44 Å.
Der Torsionswinkel von C(211) an dem sp3-hybridisierten C-Atom C(21) beträgt 37.5(7)°.
Demgegenüber sind die Cp-Ringe an den Rhodiumzentren η5-gebunden, wobei die Rh-CBindungslängen Werte im Bereich 2.067(17)-2.290(16) Å aufweisen.
Tabelle 9. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11)
Rh(1)-Ga(1)
2.4085(8)
C(161)-C(162)
1.40(2)
Rh(1)-Ga(1A)
2.4408(9)
Ga(1)-Ga(1A)
2.8065(12)
Rh(1)-Ga(1)-Rh(1A)
109.28(2)
Rh(1)-Rh(1A)
3.955
Ga(1)-Rh(1)-Ga(1A)
70.72(6)
Ga(1)-C(21)
2.094(6)
Rh(1)–Ga(1)–C(21)
120.02(16)
Rh-CEthylen
2.243(12)-2.294(13)
Rh(1A)–Ga(1)–C(21)
130.68(16)
C(21)-C(22)
1.447(9)
C(22)-C(23)
1.354(8)
C(23)-C(22)-C(21)-C(211)
37.5(7)
Wie bereits für die Komplexe [{(CO)2(Cp)M(µ2-(η1-GaCp*))}2] (M = Mo 1a, W 1b)
diskutiert, ist das spezielle Bindungsverhalten des η1-Cp*Ga-Liganden vermutlich eine
direkte Konsequenz der sterischen Repulsion zwischen den Cp*- und Cp-Liganden. Jedoch
sollte eine η1-Koordination auch die π-Rückbindung von den d-Metallzentren zu den
Galliumatomen erleichtern. Der Grad der π-Rückbindung vom Rh- zum Ga-Zentrum, sowie
die Elektronendichte am Übergangsmetallzentrum kann indirekt durch den C-C-Abstand des
Ethylen-Liganden bzw. durch die Rh-CEthylen-Bindung erfasst werden. Ein starker σ-DonorLigand, wie η5–GaCp* sollte die C-C-Bindung des Ethylen-Liganden schwächen. Die
Bindungslänge C(161)-C(162) in 11 hat einen Wert von 1.40(2) Å und ist im Vergleich zum
freien Liganden (1.335(3) Å) ein wenig aufgeweitet. Diese Beobachtung deutet auf einen
vergleichsweise geringen Grad an π-Rückbindung (Rh→C2H4), infolge der möglicherweise
stärkeren π-Akzeptor-Fähigkeiten von η1–GaCp*. Ähnliche Schlussfolgerungen ergeben sich
auch aus einem Vergleich der Rh-CEthylen-Bindungslängen mit C2H4-substituierten CpRhVerbindungen. Die Rh-CEthylen-Abstände in 11 (2.243(2) und 2.294(13) Å) sind deutlich
länger, als die Rh-C-Distanzen in dem Komplex [CpRh(C2H4)2(C2F4)2] (Rh-C(C2H4) 2.164 Å;
Rh-C(C2F4) 2.026 Å).[122] Die Infrarot-Spektroskopie liefert keine weiteren Informationen
über die Bindungssituation, da die Streckschwingungen von C2H4 bedingt durch
Überlagerung mit den Cp*-Substituenten nicht eindeutig zugeordnet werden können.
- 65 -
Ergebnisse
Rh2Ga2 - ein dinuklearer Komplex via Ligandsubstitution
________________________________________________________________________
Zusammenfassung
Entsprechend der in Kapitel 1.2 beschriebenen Insertionsreaktionen von ECp* in die Rh-ClBindungen von [{Cp*RhCln}2] (n = 1, 2) sind d8-Rh-Komplexe des Typs [CpRh(ER)2] auch
nicht aus [CpRh(C2H4)2] in Gegenwart von ECp* (E = Al, Ga, In) zugänglich. So ist die
Substitution des stärkeren π-Akzeptor-Liganden C2H4 durch die ZweielektronendonorLiganden ECp* an dem basischen Rh-Zentrum aus thermodynamischer Sicht ungünstig. Aus
diesem Grund wird der CH3CN-monosubstituierte Komplex [CpRh(C2H4)(NCMe)] mit
GaCp* zur Reaktion gebracht. Die η1–Koordination von GaCp* in dem dinuklearen Rh2Ga2Komplex [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11) kann als Resultat sterischer Repulsion
gewertet werden. Jedoch kann auch eine erhöhte π-Rückbindung von den Rh-Zentren zu den
η1-GaCp*-Einheiten in Erwägung gezogen werden, die offenbar für die Bindungssituation ME in 1a und 1b (polare Mδ-/Gaδ+-Bindungen) von untergeordneter Bedeutung ist (siehe
Kapitel 1.1).
- 66 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
2.3. Darstellung monomerer homoleptischer Komplexe [M(ER)4] (M =
Ni, Pd, Pt; E = Al, Ga, In; R = Cp*, C(SiMe3)3)
Ein bekannter Syntheseweg zur Generierung von [(LnM)a(ER)b] (a < b) besteht in der
Substitution labil gebundener Liganden durch EIR (E = Al, Ga, In; R = Cp*, C(SiMe3)3). So
werden die Cyclooctadien-Liganden in [Pt(cod)2] und [Ni(cod)2] durch EC(SiMe3)3 (E = Ga,
In) vollständig substituiert, so dass monomere homoleptische Komplexe des Typs
[M{EC(SiMe3)3}4] (M = Pt, E = In[56]; M = Ni, E = Ga[47], In[55]) entstehen. Hingegen reagiert
der Pt0-Olefin-Komplex [Pt(C2H4)3] in Gegenwart eines Überschusses an GaCp* nicht zu
[Pt(GaCp*)4], sondern es bildet sich nahezu quantitativ der dinukleare Komplex
[Pt2(GaCp*)2(µ2-GaCp*)3] (siehe Abbildung 7).[51] In diesem Zusammenhang wurde nun die
Reaktivität von EIR gegenüber Nickel0-, Palladium0- und Platin0-Ausgangsverbindungen
systematisch untersucht.
Darstellung der monomeren Komplexe [M(GaCp*)4] (M = Pt 12a, Pd 12c),
[M(AlCp*)4] (M = Ni 12b, Pd 12e) und [Pd{InC(SiMe3)3}4] (12d)
Die Reaktion von [Pt(cod)2], als eine alterantive Pt0-Quelle zu [Pt(C2H4)3], in Gegenwart
eines Überschusses an GaCp* in Hexan bei -80°C führt zu einer vollständigen Substitution
der olefinischen Liganden und der homoleptische Komplex [Pt(GaCp*)4] (12a) wird in Form
von leuchtend orangen Kristallen in nahezu quantitativer Ausbeute von 88 % erhalten
(Schema 16).
ECp*
M(cod)2
4 ECp*, Hexan
- 2 cod
M
*CpE
ECp*
ECp*
12a: M = Pt, E = Ga
12b: M = Ni, E = Al
Schema 16. Synthese von 12a und 12b
- 67 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
Erwartungsgemäß führt auch die Umsetzung von [Ni(cod)2] mit AlCp* in Hexan bei 80°C zur
vollständigen Substitution der cod-Liganden. [Ni(AlCp*)4] (12b) wird nach Abkühlen der
Reaktionslösung auf -30°C in Form von gelben Kristallen in Ausbeuten um 90 % erhalten.
12a und 12b sind in Lösung als auch im Festkörper sehr luftempfindlich, können aber, wie
alle [M(ER)4]-Komplexe, über Monate bei Raumtemperatur unter Inertgasatmosphäre
gelagert werden. Die Verbindungen lösen sich gut in apolaren organischen Lösungsmitteln
wie Hexan oder Benzol.
Als Palladium-Ausgangsverbindung wurde der PdII-Komplex [Pd(tmeda)(CH3)2]
(tmeda = N,N,N’,N’-tetramethylethylendiamin) ausgewählt, da Pd0-Olefin-Komplexe im
Vergleich zu Pt0-Olefin-Komplexen in der Regel deutlich reaktiver und damit schwieriger
handhabbar sind. So zersetzt sich [Pd(cod)2] im Festkörper schnell zu metallischem Palladium
bei Temperaturen oberhalb 0°C. [Pd(GaCp*)4] (12c) bildet sich quantitativ bei der Umsetzung
von [Pd(tmeda)(CH3)2] mit exakt fünf Äquivalenten GaCp* in Hexan bei RT. Die
Kristallisation in Hexan bei -60°C liefert 12c in Form von hellgelben Kristallen in einer
Ausbeute von 80 % (Schema 17).
Me2
N
N
Me2
ER
Pd
CH3
5 ER, Hexan
CH3
- tmeda
- ER(CH3)2
Pd
RE
ER
ER
12c: E = Ga, R = Cp*
12d: E = In, R = C(SiMe3)3
Schema 17. Synthese von 12c und 12d
Die Bildung von [Pd(PR3)n] (n = 2 - 4) aus [Pd(tmeda)(CH3)2] und Phosphanen erfolgt unter
PR3 induzierter reduktiver Eliminierung von Ethan und Substitution von tmeda durch PR3.
Die Menge an PR3 ist dabei ausschlaggebend für die Zusammensetzung der Produkte
[Pd(PR3)n].[123] Insofern war bei der Umsetzung von GaCp* mit [Pd(tmeda)(CH3)2] im
Molverhältnis 4:1 durchaus die Bildung von [Pd(GaCp*)4] (12c) zu erwarten. Auch bei der
verwandten Synthese der PtE2-Komplexe [(dcpe)Pt(ER)2] (E = Al, Ga, In; R = C(SiMe3)3,
Cp*)[50, 52] aus [(dcpe)Pt(H)(CH2t-Bu)] und exakt zwei Moläquivalenten EIR in Methylcyclohexan erfolgt eine auffällig beschleunigte Bildung der Produkte (100 % Umsatz in 20-30 min
bei 70 °C) im Vergleich zur unimolekularen Eliminierung von Neopentan aus [(dcpe)Pt(H)(CH2t-Bu)] im selben Lösungsmittel (t1/2 = ca. 2 h bei 70 °C).[124, 125]
- 68 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
Werden bei der Darstellung von 12c anstelle von fünf nur vier Äquivalente GaCp* verwendet,
ist die Ausbeute an Produkt deutlich geringer (<50 %). Die Untersuchung des Reaktionsverlaufes mittels Kernresonanzspektroskopie zeigt, dass nur Spuren von Ethan entstehen und
stattdessen ein zweiter Reaktionskanal an Bedeutung gewinnt: So erscheint im 1H-NMR in
C6D6 ein neues Singulett bei -0.15 ppm, das von der Intensität im Vergleich zu 12c etwa 6
Protonen entspricht (13C: -7.8 ppm). Die Lage der chemischen Verschiebung ist
charakteristisch für Ga-CH3-Gruppen. Daher ist anzunehmen, dass die Reduktion von PdII zu
Pd0 gemäß Schema 17 von einer Methylgruppenübertragung auf das Ga-Zentrum also einer
Oxidation zu dem GaIII-Nebenprodukt [GaCp*(CH3)2] begleitet wird.
Die Reaktion von [Pd(tmeda)(CH3)2] mit 5 Äquivalenten InC(SiMe3)3 in Hexan bei
60°C führt zur Bildung des homoleptischen Komplexes [Pd{InC(SiMe3)3}4] (12d). 12d wird
in Form von dunkel rot-braunen Mikrokristallen in einer Ausbeute von 65 % aus Cyclopentan
umkristallisiert. 12d löst sich gut in unpolaren organischen Lösungsmitteln und die
Elementaranalyse von 12d steht im Einklang mit der Summenformel [Pd{InC(SiMe3)3}4].
Entsprechend der Synthese von 12c wird eine Methylgruppen-Übertragung beobachtet. Das
InIII-Nebenprodukt [InC(SiMe3)3(Me)2] zeigt im 1H-NMR in C6D6 ein Singulett bei 0.13 ppm
für die Methyl-Gruppen (6H) und ein Singulett für die SiMe3-Gruppen bei 0.24 ppm (27H).
Diese chemischen Verschiebungen stimmen gut mit den Literaturdaten für diese Verbindung
überein.[126]
Versuche mit [Pd(tmeda)Cl2] anstelle von [Pd(tmeda)(CH3)2] zeigen, dass in Gegenwart
von InCp* und GaCp* prinzipiell auch eine Reduktion unter Bildung von Cp*ECl2 erfolgt,
allerdings verlaufen diese Reaktionen weniger selektiv und liefern schlechtere Ausbeuten.
Demgegenüber reagiert [Pd(tmeda)Cl2] mit AlCp* in Hexan bei 80°C selektiv und nahezu
quantitativ zu dem monomeren Komplex [Pd(AlCp*)4] (12e).
Me2
N
Pd
N
Me2
Cl
Cl
5 AlCp*
Hexan, 80°C
- tmeda
- AlCp*Cl2
AlCp*
Pd
*CpAl
AlCp*
AlCp*
12e
Schema 18. Synthese von 12e
Der bei dieser Reaktion gebildete, fleischfarbene Niederschlag kann mittels NMRSpektroskopie als das AlIII-Nebenprodukt [Cp*AlCl2] nachgewiesen werden. [Cp*AlCl2]
- 69 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
zeigt im 1H-NMR-Spektrum ein Singulett bei 1.86 ppm und im
13
C-NMR-Spektrum einen
Signalsatz bei 116.1 und 11.0 ppm. Diese spektroskopischen Daten stimmen gut mit den
Literaturdaten überein.[127]
Spektroskopische Charakterisierung von [M(GaCp*)4] (M = Pt 12a, Pd 12c),
[M(AlCp*)4] (M = Ni 12b, Pd 12e) und [Pd{InC(SiMe3)3}4] (12d)
Gemäß einer hoch symmetrischen homoleptischen Verbindung mit η5-koordinierten Cp*Liganden, zeigen die 1H- und 13C-NMR-Spektren von 12 nur einen einfachen Signalsatz. Im
1
H-NMR-Spektrum von [Pt(GaCp*)4] (12a) in C6D6 wurde ein Singulett bei 1.89 ppm für die
Methyl-Gruppen des Cp*-Liganden detektiert. Dieser verhältnismäßig niedrige Wert im
Vergleich zum freien Liganden GaCp* (1.92 ppm) ist möglicherweise ein Resultat des
anisotropen magnetischen Feldes der aromatischen Cp*-Ringe. Wie der Molekülstruktur von
12a im Festkörper zu entnehmen ist (Abbildung 20), sind die Cp*Zentrum-Ga-Pt-Winkel nicht
linear, so dass die CH3-Gruppen der Cp*-Liganden das anisotrope magnetische Feld einer
benachbarten Cp*-Einheit durch Rotation um die Ga-Cp*Zentrum-Bindungsachse durchlaufen,
wodurch das koaleszierte Signal schließlich ins hohe Feld verlagert wird. Im
13
C-NMR-
Spektrum wurden zwei Resonanzen bei 113.0 und 10.7 ppm für die Ring-C-Atome und die
Methylgruppen der Cp*-Liganden detektiert.
Im 1H-NMR-Spektrum von [Ni(AlCp*)4] (12a) und [Pd(GaCp*)4] (12c) in C6D6 wird
jeweils nur ein Singulett bei 1.92 bzw. 1.95 ppm und im
13
C-NMR-Spektrum jeweils zwei
Resonanzen bei 112.9 bzw. 113.3 ppm (C5Me5) und 10.7 bzw. 10.5 ppm (C5Me5) detektiert.
Während für 12a und 12c sowie für alle weiteren in dieser Arbeit diskutierten M-GaVerbindungen keine
71
Ga-NMR-Signale beobachtet werden, liefert die
27
Al-NMR-
Spektroskopie für die Struktur Al-haltiger Komplexe oft wichtige Hinweise. 12b zeigt in
C6D6 ein stark verbreitertes Signal bei -37.3 ppm. Im Vergleich dazu liegen die Signale der
stärker polarisierten Verbindungen [Cp*Al-Fe(CO)4][49] und [Cp*Al-Cr(CO)5][62] bei 0.4 bzw.
-26.1 ppm. Die Verschiebungen von freiem AlCp* liegen bei -80.7 ppm (tetramere Spezies)
und -149 ppm (monomere Einheit).[128] Hingegen wird für das Signal des Kations [Cp*2Al]+,
welches vermutlich die am ehesten mit AlICp* vergleichbare AlIII-Verbindung darstellt, eine
chemische Verschiebung von -15.2 ppm berichtet.[129] Dieses Beispiel verdeutlicht, dass die
chemische Verschiebung innerhalb der
27
Al-Spektroskopie von einer Vielzahl subtiler
Faktoren abhängt, so dass ein Vergleich von Werten der chemischen Verschiebung für Al-
- 70 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
Verbindungen in verschiedenen Oxidationsstufen und damit auch die Frage nach dem Grad
der Polarität einer M-E-Bindung nicht immer möglich ist.
Im 1H-NMR-Spektrum von 12d in C6D6 lässt sich nur ein Signal bei 0.42 ppm
beobachten. Das Signal des α-Kohlenstoffatoms im
13
C-NMR-Spektrum wird bei 64.7 ppm
detektiert. Dieser Wert ist vergleichbar mit denen von [Ni{(InC(SiMe3)3}4] (61.6 ppm)[55] und
[Pt{(InC(SiMe3)3}4] (60.2 ppm)[56] und liegt zwischen dem des freien Liganden
[{InC(SiMe3)3}4] (δ 73.0)[21] und den chemischen Verschiebungen für InIII-Verbindungen (δ <
30.0).[98,
130, 131]
Anscheinend ist die chemische Verschiebung weniger von dem d-Metall-
zentrum abhängig, sondern eher von dem Koordinationstyp des Liganden. So werden für
verbrückende InC(SiMe3)3-Gruppen in Übergangsmetallkomplexen Verschiebungen im
Bereich von 48-52 ppm gefunden.[71, 132]
Das 1H-NMR-Spektrum von 12e in C6D6 zeigt ein Singulett bei 1.92 ppm und das 13CNMR zwei Resonanzen bei 113.0 (C5Me5) und 10.8 (C5Me5) ppm. Im
27
Al-NMR in C6D6
wird ein stark verbreitertes Signal bei -67.2 ppm detektiert, das im Vergleich zu 12b ins hohe
Feld verschoben ist.
Strukturelle Charakterisierung von [M(GaCp*)4] (M = Pt 12a, Pd 12c) und
[M(AlCp*)4] (M = Ni 12b, Pd 12e)
Für die Röntgenstrukturanalyse geeignete Einkristalle von 12a können durch langsames
Abkühlen einer konzentrierten Lösung in Hexan auf -80°C erhalten werden. Auf analogem
Weg werden auch Einkristalle von 12b, 12c und 12e erhalten. Die Molekülstruktur von 12a-
12c und 12e ist in Abbildung 20 dargestellt; ausgesuchte Bindungslängen und –winkel sind in
Tabelle 10 angeführt.
Die Komplexe 12a – 12c und 12e kristallisieren in der tetragonalen Raumgruppe I⎯4
(Z = 2) und sind isostrukturell zu [Ni(GaCp*)4].[54] Das d-Metallzentrum ist in allen
Molekülstrukturen tetraedrisch von vier Gruppe-13-Metallatomen koordiniert mit einem E-ME-Winkel von rund 109.3°. Die Cp*-Gruppen sind nahezu symmetrisch an die Gruppe-13Metall-Zentren gebunden. Die M-E-Bindungsabstände variieren in Abhängigkeit von M und
E zwischen 2.1727(8) Å für 12b und 2.3668(7) Å für 12c. Erwartungsgemäß wird der
kürzeste M-E-Abstand für M = Ni und E = Al gefunden, während für [Pd(GaCp*)4] die
längste M-E-Bindung ermittelt wird.
- 71 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
Abbildung 20. Molekülstruktur von [M(ECp*)4] (M = Pt, E = Ga 12a; M = Ni, E = Al 12b; M = Pd, E =
Ga 12c; M = Pd, E = Al 12e) im Kristall
Frenking beschreibt, dass infolge starker Coulomb-Wechselwirkungen die M-ECH3-Bindung
in [M(ECH3)4] (40-60 kcal/mol) deutlich höhere Werte im Vergleich zu den M-COBindungen in [M(CO)4] (M = Ni 22.3 kcal/mol, Pd 7.5 kcal/mol, Pt 10.9 kcal/mol) aufweist.
Dagegen ist die berechnete Bindungsordnung in [M(ECH3)4] in allen Fällen < 0.7, d.h. die
Summe der M-E-Donor-Akzeptor-Wechselwirkungen ergibt einen Anteil der kovalenten
Bindung, der kleiner einer Einfachbindung ist.[45] Diese starken elektrostatischen Wechselwirkungen kommen jedoch nicht in den Molekülstrukturen von 12a-12e zum Ausdruck. Ein
Vergleich der Abstände Cp*Zentrum-E in 12a – 12c und 12e zum freien Ligand GaCp* (2.081
Å, Gasphase, Monomer)[115] bzw. AlCp* (2.015 Å, Gasphase, Monomer)[128] zeigt, dass die
M-E-Bindungen in 12a – 12c und 12e lediglich als schwach polar charakterisiert werden
können. Demgegenüber wurden in Metallcarbonylen deutlich verkürzte Cp*Zentrum-EAbstände und damit stark polare Mδ--Eδ+-Bindungen beobachtet (Kapitel 2.1). Möglicherweise erlaubt der sterische Anspruch der Cp*-Gruppen in 12 keine weitere Verkürzung der
Cp*Zentrum-E-Abstände. Dennoch kann von einer starken M-E-Bindung in [M(ER)4] (12a-12e)
ausgegangen werden, da Substitutionsreaktionen in Gegenwart von freien Liganden L (L =
EIR, Phosphane, CO und Isonitrile) die kinetische Inertheit von 12a-12e belegt haben.
- 72 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
Als weiteres strukturelles Merkmal der monomeren Systeme 12a – 12c und 12e weist der
Winkel Cp*Zentrum-E-M eine substanzielle Abweichung von der Linearität auf. Diese
Abweichung wurde zuvor von Jutzi et al. in [Ni(GaCp*)4] beobachtet und beruht nach
Aussage der Autoren auf repulsive intramolekulare Wechselwirkungen zwischen den
Methylgruppen der GaCp*-Liganden.[54] Interessanterweise ist aber die Abweichung des
Winkels Cp*Zentrum-Al-M von der Linearität in [Ni(AlCp*)4] (12b) (173.5°) und [Pd(AlCp*)4]
(12e) (169.2°) signifikant kleiner als in [Pt(GaCp*)4] (12a) (160.7°), [Pd(GaCp*)4] (12c)
(155.5°) und [Ni(GaCp*)4] (164.7°).[54] Die kürzeren Cp*Zentrum-E- und M-E-Bindungsabstände in 12b und 12d würden eigentlich eine erhöhte sterische Repulsion der Cp*-Ringe
und damit eine größere Abwinkelung aus der ideal symmetrischen Kugeloberfläche erwarten
lassen. Dieser Widerspruch ist zum jetzigen Zeitpunkt ungeklärt.
Tabelle 10. Vergleich ausgewählter Bindungsabstände (Å) und Winkel (°) für die Komplexe
[M(ECp*)4] (M = Pt, E = Ga 12a; M = Ni, E = Al 12b; M = Pd, E = Ga 12c; M = Pd, E = Al 12e)
[Pt(GaCp*)4]
(12a)
[Ni(AlCp*)4]
[Pd(GaCp*)4]
[Pd(AlCp*)4]
(12b)
(12c)
(12e)
M(1)-E(1)
2.335(2)
2.1727(8)
2.3668(7)
2.2950(9)
E(1)-C(1)
2.333(10)
2.286(3)
2.343(6)
2.284(3)
E(1)-C(2)
2.355(10)
2.285(3)
2.332(6)
2.284(3)
E(1)-C(3)
2.334(10)
2.273(3)
2.349(6)
2.267(3)
E(1)-C(4)
2.320(10)
2.270(3)
2.372(6)
2.256(3)
E(1)-C(5)
2.331(10)
2.273(3)
2.336(6)
2.265(3)
Cp*Zentrum-E(1)
2.007
1.933
2.019
1.929
E(1)-M-E(2)
109.40(6)
109.43(2)
109.421(19)
109.26(3)
Cp*Zentrum-E-M(1)
160.7
173.5
155.5
169.2
Verbindung 12c kristallisiert in der kubischen Raumgruppe Fd3m. Der hohe Grad an
Rotationsfehlordnung der SiMe3-Gruppen und die hohe Symmetrie des Kristalls führte zu
erheblichen Problemen in der Strukturverfeinerung, so dass die ermittelten Daten nicht
präsentiert werden können. Ähnliche Probleme wurden auch für [Pt{InC(SiMe3)3}4]
beobachtet und eine gute Strukturanalyse war auch hier nicht möglich.[56] Jedoch geht die
Konnektivität einer tetraedrischen PdIn4-Struktur 12c aus den Strukturdaten sowie den
spektroskopischen Daten (1H- und 13C-NMR, Elementaranalyse) eindeutig hervor.
- 73 -
Ergebnisse
Monomere homoleptische Komplexe M(ER)4 (M = Ni, Pd, Pt)
________________________________________________________________________
Untersuchung der Reaktivität von [M(EIR)4]
Zur Untersuchung der Reaktivität von [M(EIR)4] im Hinblick auf Substitutionsreaktionen
wurden eine Vielzahl von in situ NMR-Untersuchungen in Gegenwart von potentiell
attraktiven Liganden (PR3, Isocyanide, CO, Alkene oder ECp*) in C6D6 durchgeführt. Dabei
zeigt sich, dass - im Unterschied zu der hohen Reaktivität der klassischen Analoga [Ni(CO)4]
und [Ni(PR3)4] - alle Komplexe [M(EIR)4] kinetisch inert sind. Weder Substitutionsreaktionen
mit PR3, CO etc. noch eine Koaleszenz von [M(EIR)4] mit freien Liganden EIR sind mittels
Kernresonanzspektroskopie zu beobachten. Auch die Synthese von heteroleptischen
Komplexen des Typs [M(ECp*)n(E’Cp*)m] (n + m = 4) kann durch direkte Ligandensubstitution ausgehend von [M(ECp*)4] in Anwesenheit von E’Cp* nicht erzielt werden. In
Gegenwart von Iod oder CH2Cl2 wird hingegen Zersetzung beobachtet. Offensichtlich ist die
Bindungsenergie M-E in [M(EIR)4] zu hoch (40-60 kcal/mol),[45] um eine vollständige
Dissoziation in ME3 und freiem Ligand E zu gewährleisten. Interessanterweise ist in der Serie
[M(ECp*)4] (M = Ni, Pd, Pt und E = Al, Ga, In) nur [Pt(InCp*)4][133] thermisch instabil und
zersetzt sich oberhalb von -30°C vollständig. Dies deutet auf eine schwächere σ-DonorEigenschaft von InCp* im Vergleich zu InC(SiMe3)3, AlCp* oder GaCp* hin.
Zusammenfassung
Auf dem Gebiet der Generierung homoleptischer M-E-Komplexe wurden weitere monomere
Komplexe des Typs [M(EIR)4] synthetisiert. Die mononuklearen Komplexe [Pt(GaCp*)4]
(12a) und [Ni(AlCp*)4] (12b) werden durch Umsetzung von Bis(cyclooctadien)metall0 mit
ECp* (E = Al, Ga) erhalten. Als geeignete Palladium-Precursoren erweisen sich die
Komplexe [Pd(tmeda)(X)2] (X = CH3, Cl). So ist [Pd(GaCp*)4] (12c) und [Pd{InC(SiMe3)3}4]
(12d) durch Reaktion von [Pd(tmeda)(CH3)2] mit GaCp* bzw. InC(SiMe3)3 zugänglich.
[Pd(AlCp*)4] (12e) wird aus der Reaktion von [Pd(tmeda)Cl2] mit AlCp* gebildet. Die
Reduktion des PdII-Zentrums erfolgt via Methyl-Gruppen bzw- Chlor-Übertragung auf das
Gruppe-13-Metall-Zentrum E, also einer Oxidation zu einem EIII-Nebenprodukt [ER(X)2] (X
= Me, Cl). Die Komplexe 12a und 12c vervollständigen mit den bereits bekannten
isostrukturellen NiGa4-Komplex die Serie [M(GaCp*)4] (M = Ni, Pd, Pt). Verbindung 12e
stellt den ersten röntgenstrukturanalytisch charakterisierten Pd-Al-Komplex dar. Infolge der
hohen Bindungsenergie M-E sind alle Komplexe [M(EIR)4] kinetisch inert.
- 74 -
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
2.4. [M(GaCp*)4] (M = Pd, Pt) als Synthesebausteine zur Darstellung
dinuklearer homoleptischer Clusterverbindungen [MPt(GaCp*)5]
Während eine Reihe von monomeren Komplexen des Typs [M(EIR)4] (M = Pt, Ni; E = Ga,
In; R = Cp*, C(SiMe3)3) durch Ligandensubstitution bereits synthetisiert wurden, war zu
Beginn dieser Arbeit nur ein einziges Beispiel einer homoleptischen Clusterverbindung
bekannt. Der dinukleare Komplex [Pt2(GaCp*)2(µ2-GaCp*)3] ist aus [Pt(C2H4)3] mit einem
Überschuss an Ligand zugänglich (siehe Abbildung 7).[51] Dieses Resultat ist sicherlich
überraschend, da man analog zur Synthese von [Pt{InC(SiMe3)3}4][56] aus [Pt(cod)2] die
Bildung des monomeren Komplexes [Pt(GaCp*)4] erwarten würde (Kapitel 2.3).
Infolgedessen sollte nun überprüft werden, ob noch weitere präparative Zugänge zu
homoleptischen Clusterverbindungen [Ma(EIR)b] bestehen. Besonders attraktiv erscheint der
Einsatz monomerer Systeme [M(EIR)4] als Basis zum Aufbau größerer Clusterstrukturen. In
diesem Zusammenhang hat unsere Arbeitsgruppe in einem Übersichtsartikel der Zeitschrift
„Angewandte Chemie“ aus dem Jahr 1999 bereits die Frage aufgeworfen, „inwieweit sich die
vielen neuen [M-E]-Verbindungen als Bausteine für weitere Synthesen nutzen lassen.“[7] Der
Einsatz von [M(GaCp*)4] (M = Pd, Pt) als Synthesebausteine zur Generierung von
dinuklearen Clusterstrukturen [MPt(GaCp*)5] kann als eine Antwort auf diese Frage
verstanden werden und zeigt zugleich, dass die kinetisch inerten monomeren Systeme
[M(EIR)4] doch von präparativem Interesse sind.
Darstellung von [MPt(GaCp*)2(µ2-GaCp*)3] (M = Pt 13a, Pd 13b)
Die Reaktion [Pt(GaCp*)4] (12a) mit einem Äquivalent [Pt(cod)2] in Toluol bei
Raumtemperatur und anschließender Zugabe von einem Äquivalent GaCp* führt zu dem
bereits bekannten Komplex [Pt2(GaCp*)2(µ2-GaCp*)3] (13a) in einer Ausbeute von 93 %
(Schema 19). Alle analytischen Daten stimmen gut mit den zuvor beschriebenen überein.[51]
Bemerkenswerterweise reagiert 13a in Gegenwart eines Überschusses an GaCp* nicht
quantitativ zu 12a. So kann 12a nur in Spuren nach Tagen in Toluol bei RT nachgewiesen
werden. Des Weiteren wird auf der NMR-Zeitskala kein Austausch zwischen freiem und
koordiniertem GaCp* beobachtet. Dieses Resultat stimmt gut mit der Beobachtung überein,
dass [Pt(C2H4)3] auch mit einem Überschuss an Liganden den dimeren Komplex 13a und
- 75 -
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
nicht das Monomer 12a bildet.[51] Vermutlich wird die ausschließliche Bildung von 13a durch
kinetische Faktoren bestimmt, so dass 13a auch in Gegenwart von freien Liganden stabil ist.
GaCp*
M
*CpGa
GaCp*
GaCp*
1) Pt(cod)2
2) GaCp*
Toluol, RT
- 2 cod
Cp*
Ga
*CpGa
Pt
M
Ga
Cp*
GaCp*
Ga
Cp*
M = Pt (13a)
M = Pd (13b)
M = Pt (12a)
M = Pd (12c)
Schema 19. Synthese von [MPt (GaCp*)2(µ2-GaCp*)3] (M = Pt 13a, Pd 13b)
Analog liefert die Umsetzung von [Pt(cod)2] mit [Pd(GaCp*)4] (12c) und anschließender
Zugabe von GaCp* den trimetallischen Komplex [PdPt(GaCp*)2(µ2-GaCp*)3] (13b) (Schema
19). Komplex 13b kann aus Diethylether in einer Ausbeute von 56 % umkristallisiert werden.
Der Komplex ist bei Raumtemperatur stabil und löst sich gut in unpolaren Lösungsmitteln.
Spektroskopische Charakterisierung von [PdPt(GaCp*)2(µ2-GaCp*)3] (13b)
Das 1H-NMR-Spektrum von [PdPt(GaCp*)2(µ2-GaCp*)3] (13b) in C6D6 zeigt bei RT nur
zwei Resonanzen bei 2.06 und 1.94 ppm mit einem Integralverhältnis von 1:4. Im 13C-NMRSpektrum werden zwei Signalsätze bei 114.1/10.4 ppm und 113.1/11.5 ppm detektiert. Dieses
Ergebnis ist nicht mit einem statischen Spektrum einer unsymmetrischen Struktur mit drei
verbrückenden und zwei nicht äquivalenten terminalen GaCp*-Liganden vereinbar. Aus
diesem Grund wurden Tieftemperatur-NMR-Untersuchungen von 13b durchgeführt. Im 1HNMR (d8-Toluol) bei –30°C beginnt sich das Signal bei 1.94 ppm sichtlich zu verbreitern.
Dies deutet auf einen fluktionalen Prozess von drei verbrückenden und einem terminal
koordinierten GaCp*-Liganden hin. Bei -80°C zeigt das 1H-NMR-Spektrum ein sehr breites
Signal zwischen 2.4 und 1.8 ppm, ohne dass Dekoaleszenz zu beobachten ist. Hingegen
dekoaleszieren im 13C-NMR-Spektrum bei -80°C die größeren Signale (112.9 und 11.3 ppm)
in jeweils zwei Signalsätze bei 12.1/10.8 ppm und 112.6/113.8 ppm mit einem Integralverhältnis von ungefähr 3:1.
- 76 -
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
Abbildung 21. Tieftempertur-NMR-Untersuchung von [PtPd(GaCp*)5] (13b)
Offensichtlich erfolgt an einem der beiden d-Metallzentren ein Austausch zwischen
terminalem GaCp* mit den drei verbrückenden Liganden, während die andere terminale MGaCp*-Bindung unverändert bleibt. Da [Pt2(GaCp*)5] (13a)[51] bei RT ein perfektes statisches
Spektrum und [Pd2(GaCp*)5] (13c) ein fluktionales Spektrum aufweist (Kapitel 2.5), wurde
zuerst angenommen, dass der fluktionale Prozess am Palladiumzentrum erfolgt. So ist die PdGa-Bindung im Vergleich zur Pt-Ga-Bindung anscheinend schwächer.[45] Jedoch sind beide
d-Metallzentren durch ihre tetraedrische Umgebung formal sterisch gesättigt, so dass ein
dissoziativer Reaktionsmechanismus in Bezug auf die Brückenliganden für die Fluktionalität
in [PdPt(GaCp*)5] sehr wahrscheinlich ist (Schema 20). Das Intermediat in diesem
Mechanismus wird durch Bindungsbruch der verbrückenden Pd-Ga-Bindung gebildet,
wodurch ein ungesättigtes Palladiumzentrum und ein symmetrisches, gesättigtes Platinzentrum entstehen. Demnach ist der fluktionale terminale GaCp*-Ligand nicht an das PdZentrum, sondern vielmehr an das Pt-Zentrum gebunden.
- 77 -
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
Ga
*Ga
Pt
Ga
Pd
Ga
Ga
Ga
Ga
*Ga
Pd
Pt
Ga
Ga
Ga
Ga
Pt
Ga
Pd
Ga
Ga
*
Schema 20. Möglicher Mechanismus für den fluktionalen Prozess in [PdPt(GaCp*)5] (13b) (Cp*Liganden sind der Übersicht halber weggelassen)
Zahlreiche Versuche für die Röntgenstrukturanalyse geeignete Einkristalle von 13b zu
züchten, schlugen fehl. Die Kristallisation in verschiedenen Lösungsmitteln ergeben in allen
Fällen nur stark fehlgeordnete Kristalle, die nur schwache Reflexe liefern. Jedoch kann eine
dinukleare Struktur von 13b mit einer zentralen PdPt-Einheit, anhand der bereits bekannten
Struktur von [Pt2(GaCp*)5] (13a)[51] und den Tieftemperatur-Kernresonanzspektren sowie der
Elementaranalyse unzweifelhaft angenommen werden.
Darstellung von [MPt(GaCp*)4(cod)] (M = Pt 14a, Pd 14b)
Die Reihenfolge des Mischens von [Pd(GaCp*)4] (12c), [Pt(cod)2] und GaCp* ist bestimmend
für das Gelingen der Synthese von [PtPd(GaCp*)5] (13b). So müssen [Pt(cod)2] und 12c
vollständig reagieren, bevor GaCp* zu dem Reaktionsgemisch zugesetzt wird. Wird GaCp*
zu früh hinzugesetzt, dann bilden sich - neben weiteren Nebenprodukten - beträchtliche
Mengen an [Pt(GaCp*)4] (12a). Dies gilt auch für die Synthese von [Pt2(GaCp*)5] (13a),
allerdings in etwas geringerem Ausmaß. Es ist anzunehmen, dass die Synthese von 13a und
13b über Intermediate des Typs [MPt(GaCp*)4(cod)] (M = Pt, Pd) verlaufen. Wird der
Reaktionsverlauf in C6D6 mittels 1H-NMR-Spektroskopie verfolgt, so wird allerdings ein
Gemisch verschiedener Komplexe detektiert. Neben freiem Cyclooctadien, werden
verschiedene Signale für koordinierte GaCp*- und cod-Liganden beobachtet. Hingegen sind
die Ausgangsverbindungen nicht mehr nachweisbar.
Dagegen erlaubt die Reaktionsdurchführung in Hexan die Isolierung eines dieser
Intermediate. Die Umsetzung von [Pt(cod)2] mit einem Äquivalent 12a bzw. 12c in Hexan bei
RT führt jeweils zu hell gelben Niederschlägen (14a und 14b), die durch Filitration von der
orangen Lösung getrennt, mit Hexan gewaschen und im Vakuum getrocknet wurden (Schema
21). Beide Verbindungen werden nur in geringen Ausbeuten erhalten und sind thermisch sehr
- 78 -
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
labil. Infolgedessen konnten 14a und 14b nur durch 1H- und
13
C-NMR Spektroskopie
charakterisiert werden, die unmittelbar nach der Synthese durchgeführt wurden.
GaCp*
M
GaCp*
*CpGa
Cp*
Ga
Pt(cod)2
Hexan, RT
- cod
*CpGa
Pt
M
Ga
Cp*
GaCp*
Ga
Cp*
M = Pt (13a)
M = Pd (13b)
M = Pt (12a)
M = Pd (12c)
GaCp*
Toluol, RT
- cod
Cp*
Ga
Überschuss GaCp*
*CpGa
Pt
M
Ga
Cp*
GaCp*
Ga
Cp*
M = Pt (14a)
M = Pd (14b)
Schema 21. Synthese von [MPt(GaCp*)2(µ2-GaCp*)3] (M = Pt 13a, Pd 13b) via [MPt(GaCp*)4(COD)] (M
= Pt 14a, Pd 14b)
Spektroskopische Charakterisierung von [MPt(GaCp*)4(cod)] (M = Pt 14a, Pd 14b)
Das 1H-NMR-Spektrum von 14a in C6D6 zeigt zwei Singuletts bei 2.03 und 1.99 ppm für die
Cp*-Methylprotonen mit einem Integralverhätnis von 1:3. Diese Beobachtung weist auf eine
dimere Struktur mit einem terminalen und drei verbrückenden GaCp*-Liganden hin. Des
Weiteren
werden Resonanzen
detektiert,
die einem η2-gebundenen
cod-Liganden
entsprechen. Zwei breite Multipletts (jeweils 2H) mit einer chemischen Verschiebung von
4.67 und 3.00 ppm sind der unkoordinierten und koordinierten Doppelbindung zuzuordnen.
Die aliphatischen Protonen (8H) des Cyclooctadien-Liganden ergeben ein breites Multiplett
bei 2.15 ppm. Das 13C-NMR-Spektrum in C6D6 stimmt ebenfalls mit einer Struktur der Form
[(GaCp*)Pt(µ2-GaCp*)3Pt(η2-cod)] überein. Für die GaCp*-Liganden werden vier Signale
bei 114.5 ppm (5C, C5Me5), 113.2 ppm (15C, C5Me5), 11.6 ppm (15C, C5Me5) und 10.6 ppm
(5C, C5Me5) detektiert. Die Resonanzen der olefinischen Kohlenstoffatome des cod-Liganden
- 79 -
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
liegen bei 129.5 ppm (unkoordiniert) und 69.9 ppm (koordiniert). Die Signale für die
aliphatischen C-Atome des cod-Liganden können dagegen nicht detektiert werden. Aus
diesem Grund wurden Tieftemperatur-NMR-Untersuchungen in d8-Toluol bei -80°C
durchgeführt. Bei dieser Temperatur wérden zwei neue Signale bei 27.8 und 24.3 ppm
beobachtet, die den gesuchten aliphatischen C-Atomen des cod-Liganden entsprechen. Jedoch
sind die Resonanzen für die olefinischen Kohlenstoffatome nicht mehr zu erkennen. Da alle
Resonanzen des cod-Liganden im
1
H-NMR-Spektrum stark verbreitert sind, können
möglicherweise zwei fluktionale Prozesse parallel stattfinden. Der erste Prozess, mit einer
Dekoaleszenz
oberhalb
RT,
tauscht
die
koordinierten
und
die
unkoordinierten
Doppelbindungen des cod-Liganden aus. Bei -80°C wird ein zweiter fluktionaler Prozess
entscheidend, der zu stark verbreiterten, d.h. letztendlich nicht detektierbaren Signalen für die
olefinischen C-Atome führt. Die Symmetrie der beiden Doppelbindungen wird dabei
aufgehoben. So sind vier anstelle von zwei olefinischen Signalen in einem vollständig
dekoaleszierten Spektrum zu erwarten. Als anschauliche Erklärung für diesen zweiten Prozess
kann die Rotation des olefinischen Liganden um die Pt-Olefin-Bindungsachse dienen.
Das 1H-NMR-Spektrum von [PtPd(GaCp*)4(cod)] (14b) in C6D6 ist dem von 14a sehr
ähnlich. Für die GaCp*-Liganden sind zwei Singuletts bei 2.05 (15H) und 2.02 ppm (45H)
und für den cod-Substituenten drei breite Signale bei 4.83 (2H), 2.97 (2H) und 2.10 ppm (8H)
zu beobachten. Das
13
C-NMR-Spektrum zeigt für die GaCp*-Liganden zwei Signalsätze bei
114.3/10.4 ppm (5C) und 113.4/11.0 ppm (15C). Das einzige Signal des cod-Liganden wird
bei 64.9 ppm gefunden, welches entsprechend der chemischen Verschiebung der
koordinierten Doppelbindung zugeordnet werden kann. Offensichtlich ist das Signal der
unkoordinierten Doppelbindung von den Lösungsmittelsignalen C6D6 oder d8-Toluol
überlagert. Analog zu 14a können bei -80°C die aliphatischen C-Atome von cod detektiert
werden (26.2 und 24.3 ppm), während das Signal bei 64.9 ppm nicht mehr sichtbar ist.
Da im 1H-NMR von 14b zwei Signale für die GaCp*-Gruppen detektiert wurden,
kann diese Beobachtung auch als indirekter Beweis für die zuvor geäußerte Vermutung
herangezogen werden, dass in [PdPt(GaCp*)5] (13b) die Fluktionalität am Pt- und nicht am
Pd-Zentrum erfolgt. Letztere würde im 1H-NMR von 14b ein koalesziertes Signal für die
verbrückenden und terminalen GaCp*-Liganden liefern.
Abschließend sei bemerkt, dass 14a und 14b thermisch instabil sind und sich in
Lösung vollständig bei Raumtemperatur nach einigen Stunden zersetzen. Anhand von NMRspektroskopischen
Untersuchungen
können
als
Hauptprodukte
[Pt2(GaCp*)5] (13a) und [PdPt(GaCp*)5] (13b) nachgewiesen werden.
- 80 -
dieser
Zersetzung
Ergebnisse
Bausteinsynthese mit M(GaCp*)4 (M = Pd, Pt)
________________________________________________________________________
Reaktion von [Ni(AlCp*)4] mit [M(cod)2] (M = Ni, Pt)
Die Umsetzung von [Ni(AlCp*)4] mit [M(cod)2] (M = Ni, Pt) in C6D6 führt nicht zu
dinuklearen Komplexen, sondern es wird eine Isomerisierung des gebundenen 1,5-codLiganden zum thermodynamisch stabileren, nicht koordinierten 1,3-cod beobachtet. Dieser
Prozess wird von der Bildung eines metallischen Niederschlags begleitet (metallisches Ni
bzw. Pt), wobei der monomere Komplex [Ni(AlCp*)4] während der Reaktion unverändert
bleibt. Eine analoge Isomerisierung wird auch in der Reaktion von [Pt(cod)2] mit Ga(DDP)
(DDP
=
2-Diisopropylphenylamino-4-diisopropylphenylimino-2-penten)
beobachtet.[134]
Jedoch wird der 1,3-cod-Substituent nicht abgespalten, sondern es bildet sich der monomere
Komplex [(1,3-cod)Pt{Ga(DDP)}2] in einer Ausbeute von 74 %. Der Mechanismus für diese
Wanderung ist noch ungeklärt. Möglicherweise erfolgt eine aliphatische C-H-Aktivierung des
cod-Liganden an einem reaktiven [Pt{Ga(DDP)}2]-Fragment unter Ausbildung eines „AllylHydrids“. Im zweiten Schritt liefert die reduktive Eliminierung des „Allyl-Hydrids“ einen
koordinierten 1,3-cod-Substituenten. Ein ähnlicher Mechanismus ist auch für die Umsetzung
von [Ni(AlCp*)4] mit [M(cod)2] (M = Ni, Pt) denkbar, wobei spektroskopische Anhaltspunkte
bislang fehlen.
Zusammenfassung
Die monomeren homoleptischen Komplexe [M(GaCp*)4] (M = Pt 12a, Pd 12b) können als
Synthesebausteine
zur
Generierung
der
dinuklearen,
homoleptischen
Komplexe
[MPt(GaCp*)5] (M = Pt 13a, Pd 13b) eingesetzt werden. Während 13a bei RT ein statisches
NMR-Spektrum aufweist, erfolgt in 13b – unter Annahme eines dissoziativen Mechanismus ein fluktionaler Prozess am Platinzentrum. Die Synthese der dinuklearen Systeme resultiert
aus der schrittweisen Kombination von [M(GaCp*)4] mit einer geeigneten M0-Quelle und
anschließender Zugabe von GaCp*. Die Reihenfolge ist dabei entscheidend für den
Reaktionsverlauf. Im ersten Schritt bilden die monomeren Komplexe [M(GaCp*)4] in
Gegenwart von [Pt(cod)2] reaktive, aber dennoch isolierbare dinukleare Intermediate der
Form [MPt(GaCp*)4(cod)] (M = Pt 14a, Pd 14b). Temperaturabhängige 1H- und
13
C-NMR-
Untersuchungen belegen, dass die Intermediate über dimere Strukturen mit einer zentralen
Pt2- bzw. PtPd-Einheit verfügen, an der ein terminaler und drei verbrückende GaCp*Liganden sowie eine η2-cod-Einheit koordiniert sind.
- 81 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
2.5. Direkte Synthesewege zu fluktionalen di- und trinuklearen
Clusterverbindungen des Typs [Pda(ER)b] (E = Al, Ga, In)
Die Darstellung neutraler homoleptischer Clusterverbindungen des Typs [Ma(EICp*)b] (M =
Pd, Pt; b > a > 1) ist ein neues und vielversprechendes Gebiet in der Koordinationschemie
von EIR (E = Al, Ga, In) an d-Metallzentren. Viele vorhergehende Untersuchungen bezüglich
der Synthese von Clusterverbindungen beschränken sich auf die Koordination von EIR an
Metallcarbonylen [(CO)nMa].[8] Konstitution und strukturelle Charakteristika neuartiger
GaCp*-substituierter Carbonylcluster, wie [Ni4(Cp*Ga)4(CO)6],[16] oder die Serie [Rh6(µ3CO)4-x(µ3-GaCp*)x(CO)12] (x = 1-4)[72], stehen in direktem Bezug zu klassischen Metallcarbonylen (siehe Kapitel II).
Im Gegensatz dazu war zu Beginn dieser Arbeit nur der dinukleare homoleptische
Komplex [Pt2(GaCp*)5] (13a) bekannt.[51] 13a und der im Rahmen dieser Arbeit via
Bausteinsynthese synthetisierte Komplex [PtPd(GaCp*)5] (13b) verfügen über keine direkten
strukturellen Analoga in der klassischen Carbonyl- oder Phosphan-Clusterchemie, auch wenn
kürzlich durch Werner et al. die Koordinationschemie von PR3 auf einen verbrückenden
Bindungsmodus ausgeweitet wurde.[135] Ferner gehen die Strukturen und Zusammensetzungen von 13a und 13b auch über die mononuklearen homoleptischen Komplexe
[M(ER)4] (Kapitel 2.3) [47, 54-56] sowie den heteroleptischen Komplexen der Zusammensetzung
[LnMa(ER)b] hinaus.
Die Gründe für die Besonderheit von 13a und 13b sind vielfältig: Zum einen ist die
Bindungsenergie der Donor-Akzeptor-Bindung M-E vergleichsweise hoch (40-60 kcal/mol).
[45, 46]
Zum anderen werden die niedervalenten Liganden EIR leicht zu EIII oxidiert, so dass
Carben-artige Reaktionen wie Insertionen in Metall-Halogen-Bindungen (Kapitel 1.2 und 2.3)
und Cycloadditionsreaktionen an ungesättigten funktionellen Gruppen (Kapitel 1.1) in
Betracht gezogen werden müssen. Schließlich spielen Assoziations- und Dissoziationsgleichgewichte eine wichtige Rolle. Demzufolge unterliegt die Bildung von [Ma(ECp*)b]
einer kinetischen Kontrolle, so dass die Synthese von [Ma(ECp*)b] empfindlich von den
Reaktionsbedingungen und der Kombination der Ausgangsverbindungen MLn und EIR
abhängt.
Im Rahmen der Chemie oligonuklearer Verbindungen [Ma(ECp*)b] sind nun eine
Reihe von Fragen ungeklärt: Was ist der Bereich von M, E, a und b in Verbindungen des
Typs [Ma(ECp*)b], die präparativ zugänglich sind? Ist es möglich, größere Cluster-
- 82 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
verbindungen [Ma(ECp*)b] mit a, b >> 1 zu synthetisieren, deren Clusterzentrum Ma nur von
einer Hülle aus EIR Liganden stabilisiert wird? Derartige Cluster sind aus der klassischen
Carbonylmetallat-Clusterchemie [Ma(CO)b]m- (M = Os, Pd. Pt etc.) wohlbekannt. Als jüngstes
und zugleich faszinierendes Beispiel innerhalb der Koordinationschemie von EICp* zeigt der
von Schnöckel und Mitarbeiter synthetisierte Aluminiumcluster [Al38(AlCp*)12] die
Möglichkeit einer Stabiliserung größerer Clusterzentren Ma durch EIR auf (siehe Abbildung
38).[136]
Die weitere Untersuchung dieser Chemie führt nun zur Suche nach geeigneten
Übergangsmetallprecursoren, die eine direkte Syntheseroute zu homoleptischen Clusterverbindungen [Ma(ECp*)b] erlauben. Als sehr fruchtbare Startverbindung erweist sich der
Pd0-Komplex [Pd2(dvds)3] (dvds = 1,3-Divinyl-1,1,3,3-tetramethyldisiloxan), der eine Vielzahl an neuen Verbindungen zugänglich macht und die bekannten dinuklearen Strukturmotive [M2(ECp*5)] auf trinukleare Systeme ausweitet (Schema 22).
(tmeda)Pd(CH3)2
- Cp*InMe2
*CpIn
Pd
*CpIn
Cp*
Al
*CpAl
4 Cp*In
n-Hexan, 80°C
Cp*
In
Cp*
In
Pd
In
Cp*
InCp*
Pd
InCp*
In
Cp*
15a
AlCp*
Pd
Pd
- 3 dvds
Pd
*CpAl
AlCp*
Al
Cp*
10 Cp*Al
Benzol, 60°C
8 Cp*In
n-Hexan
50°C
8 Cp*Ga
n-Hexan, -30°C
Pd2(dvds)3
- 3 dvds
16
+
8 Cp*Ga
Toluol
RT
AlCp*
*CpAl
Cp*
Ga
*CpGa Pd
Pd GaCp*
Ga
Cp*
- 3 dvds
Ga
Cp*
13c
Me2Si
O
SiMe2
*CpGa
17
Pd
*CpGa
Cp*
Ga
Ga
Cp*
Cp*
Ga
Pd
GaCp*
Pd
Ga
Cp*
GaCp*
15b
Schema 22. Reaktion von [Pd2(dvds)3] (dvds = 1,3-divinyl-1,1,3,3-tetramethyldisiloxan) mit ECp*
- 83 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Darstellung von [Pd3(InCp*)4(µ2-InCp*)4] (15a)
Wird gemäß Schema 23 [(tmeda)Pd(CH3)2] mit reichlich InCp* in Hexan bei 60 °C
umgesetzt, so bildet sich nicht wie zunächst vermutet [Pd(InCp*)4] sondern quantitativ der
trinukleare Komplex [Pd3(InCp*)4(µ2-InCp*)4] (15a), der aus Benzol in Form von großen,
wohlgeformten, tiefroten Einkristallen in sehr guten, reproduzierbaren Ausbeuten um 90 %
analysenrein anfällt. Alternativ ist 15a auch durch Reaktion von [Pd2(dvds)3] (dvds = 1,3
divinyl-1,1,3,3-tetramethyldisiloxan) mit InCp* in Hexan bei 50°C zugänglich.
Pd2(dvds)3
8 Cp*In
n-Hexan, 50°C
- 3 dvds
*CpIn
Pd
(tmeda)Pd(CH3)2
*CpIn
4 Cp*In
n-Hexan, 80°C
- Cp*InMe2
Cp*
In
Cp*
In
Pd
In
Cp*
InCp*
Pd
In
Cp*
InCp*
15a
Schema 23. Synthese von [Pd3(InCp*)4(µ2-InCp*)4]
Wie bereits in Kapitel 2.3 darlegt, erfolgt die Bildung von [Pd(PR3)n] aus [(tmeda)Pd(CH3)2]
und Phosphanen unter PR3 induzierter reduktiver Eliminierung von Ethan und Substitution
von tmeda durch PR3.[123] Insofern ist auch bei der Umsetzung von InCp* mit
[(tmeda)Pd(CH3)2] im Molverhältnis 4:1 durchaus die Bildung von [Pd(InCp*)4] zu erwarten.
Jedoch wird auch in dieser Reaktion die Bildung eines InIII-Nebenproduktes beobachtet,
welches mittels Kernresonanzspektroskopie als InCp*Me2 identifiziert wird. Demnach lässt
sich für die Umsetzung von [(tmeda)Pd(X)2] (X = CH3, Cl) mit ECp* (E = Al, Ga, In) ein
allgemeiner Reaktionsverlauf beschreiben, in dem gemäß Schema 24 die Reduktion von PdII
zu Pd0 von einer Methylgruppen- bzw. Chlorübertragung auf das Gruppe-13-Metallzentrum,
also einer Oxidation zu einem EIII-Nebenprodukt, begleitet wird. Im NMR-Experiment
können in allen Fällen nur noch Spuren von Ethan nachgewiesen werden. Die für COKomplexe bekannten, klassischen Reaktionstypen der "Insertion" in M-CAlkyl-Bindungen
sowie der "Reduktiven Eliminierung" lassen sich also auf EICp* übertragen.
- 84 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
a Pd(tmeda)(X)2 + (a + b) ECp*
Pda(ECp*)b +
a (CH3)2ECp*
12c (E = Ga)
12e (E = Al)
15a (E = In)
X = CH3, Cl
Schema 24. Allgemeines Schema zur Herstellung von homoleptischen Pd0-ECp*- Komplexen. Für E =
Ga, a = 1 und b = 4 (12c), für E = Al, a = 1 und b = 4 (12e), für E = In, a = 3 und b = 8 (15a).
Versuche, mononukleares [Pd(InCp*)4] aus 15a und Überschuss an InCp* herzustellen,
schlugen fehl. Eine Mischung aus 15a und InCp* (1:4) zeigt im 1H-NMR-Spektrum jedoch
eine Koaleszenz der Signale von 15a (2.12 ppm) und InCp* (2.04 ppm) bei 2.07 ppm
(erwartet bei 2.09 ppm). Das aus dieser Lösung auskristallisierte Produkt erwies sich aber als
reines 15a. Offensichtlich existiert ein komplexes Zusammenspiel von kinetischen Faktoren
sowie Assoziations-/Dissoziationsgleichgewichten. Darüber hinaus können auch schwach
unterschiedliche Gitterenergien der Molekülkristalle alternativer Produkte für die gegenüber
[Pd(InCp*)4] so bevorzugte Bildung von 15a auch bei Überschuss an InCp* verantwortlich
sein.
Darstellung von [Pd3(GaCp*)4(µ2-GaCp*)4] (15b) und [Pd2(GaCp*)2(µ2-GaCp*)3] (13c)
Die Reaktion von [Pd2(dvds)3] mit GaCp* ist ein anschauliches Beispiel für die subtile
kinetische Kontrolle der Clusterbildung. Gemäß Schema 25 werden in Abhängigkeit von den
Reaktionsbedingungen zwei unterschiedliche homoleptische Clusterstrukturen gebildet. Die
Reaktion bei -30°C in Hexan führt zu der dinuklearen Verbindung [Pd2(GaCp*)2(µ2-GaCp*)3]
(13c) in nahezu quantitativer Ausbeute (90 %). Als Nebenprodukt wird in sehr geringen
Mengen (< 3 %) der monomere Komplex [Pd(GaCp*)4] (12c) beobachtet. Die Reaktionsdurchführung in Toluol bei Raumtemperatur erlaubt die Isolierung des trinuklearen
Komplexes [Pd3(GaCp*)4(µ2-GaCp*)4] (15b) in einer Ausbeute von 76 %, während sich die
dimere Spezies 13c unter diesen Bedingungen nur zu einem sehr geringen Anteil (< 2 %)
bildet. Die Bildung von monomerem [Pd(GaCp*)4] (12c) kann unter diesen Bedingungen
nicht nachgewiesen werden. Im Einklang mit der Stabilität von [Pd3(InCp*)4(µ2-InCp*)4]
(15a) kann die monomere Verbindung 12c ausgehend von 13c bzw. 15b in Gegenwart eines
Überschusses an Liganden nicht erhalten werden.
- 85 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Cp*
Ga
8 Cp*Ga
n-Hexan, -30°C
*CpGa Pd
- 3 dvds
Pd GaCp*
Ga
Cp*
Ga
Cp*
13c
Pd2(dvds)3
*CpGa
8 Cp*Ga
Toluol, RT
- 3 dvds
Pd
*CpGa
Cp*
Ga
Cp*
Ga
Pd
GaCp*
Pd
Ga
Cp*
GaCp*
Ga
Cp*
15b
Schema 25. Synthese von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c) und [Pd3(GaCp*)4(µ2-GaCp*)4] (15b)
Darstellung von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) und [(dvds)(AlCp*)2] (17)
Wird gemäß Schema 26 [Pd2(dvds)3] mit einem Überschuss an AlCp* in Benzol versetzt und
die Reaktionsmischung auf 60°C erwärmt, bildet sich nach Umkristallisation in Toluol der
trinukleare Komplex [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) in Form von tiefroten
Einkristallen in einer Ausbeute von 76 %. Die Bildung von monomerem [Pd(AlCp*)4] (12e)
oder dimerem [Pd2(AlCp*)5] (13e) wird nicht beobachtet.
Cp*
Al
Pd2(dvds)3
10 Cp*Al
Benzol, 60°C
AlCp*
*CpAl
+
Me2Si
O
*CpAl
SiMe2
17
Pd
Pd
AlCp*
Pd
*CpAl
AlCp*
Al
Cp*
16
Me2
O
2 Cp*Al, Toluol, 70°C
Si
Me2
Schema 26. Synthese von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) und [(dvds)(µ2-Cp*Al)2] (17)
- 86 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Bei der Darstellung von 16 kann in signifikanten Mengen das Nebenprodukt [(dvds)(µ2AlCp*)2] (17) isoliert werden. Dieser Komplex kann als ein zweifaches Addukt von AlCp* an
die C=C-Doppelbindungen von dvds aufgefasst werden. Dabei verbrücken die AlCp*Einheiten jeweils ein C-Atom einer C=C-Doppelbindung. Schnöckel und Roesky haben
gezeigt, dass AlCp*, AlI-Halogenide oder Arduengo-artige AlI-Heterocyclen sich an Alkine
oder 1,3-Butadienderivate unter Bildung von Cyclopropen- bzw. Cyclopentenderivaten
addieren (Kapitel 1.1).[84,
85]
Das farblose Addukt [(dvds)(µ2-AlCp*)2] (17) ist auch durch
Reaktion von unkoordiniertem dvds mit zwei Äquivalenten AlCp* in Toluol bei 70°C nahezu
quantitativ zugänglich. Eine Pd-katalysierte Bildung von [(dvds)(µ2-AlCp*)2] kann
ausgeschlossen werden.
Spektroskopische Charakterisierung von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c)
In den NMR-Spektren von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c) in C6D6 bei RT wird nur ein
einziger Signalsatz für die Methylgruppen der C5-Ringe bei 1.98 ppm (1H-NMR) und
113.3/10.8 ppm (13C-NMR) detektiert. Bei -80°C (Toluol-d8) kann eine Aufspaltung des
Signals in zwei unterscheidbare Resonanzen bei 2.07 und 2.03 ppm im Verhältnis von 2:3
beobachtet werden. Demzufolge liegt ein fluktionaler Prozess vor (siehe Schema 20), welcher
die terminalen und verbrückenden GaCp*-Liganden auf der NMR-Zeitskala austauscht.
Dieses Resultat steht sowohl mit dem statischen Spektrum der dinuklearen Verbindung
[Pt2(GaCp*)5] (13a) im Einklang, als auch mit der Annahme, dass der fluktionale Prozess in
dem trimetallischen Komplex [PtPd(GaCp*)5] (13b) am Pt-Zentrum erfolgt (Kapitel 2.4).
Offenkundig ist innerhalb der dinuklearen Systeme die Pd-Ga- im Vergleich zur Pt-GaBindung schwächer. Darüber hinaus stimmen diese Resultate gut mit den von Frenking und
Mitarbeiter berechneten Bindungsenergien der Modellverbindungen [M{E(CH3}4] (M = Ni,
Pd, Pt; E = B - Tl) überein, die für die d10-Metalle die Reihenfolge Ni ≈ Pt > Pd und für die
Elemente der 13. Gruppe den Trend B > Al > Ga ≈ In > Tl ermittelt haben.[45]
- 87 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Spektroskopische Charakterisierung von [Pd3(ECp*)4(µ2-ECp*)4] (E = In 15a, Ga 15b)
Die 1H- und
13
C-NMR-Spektren von [Pd3(InCp*)4(µ2-InCp*)4] (15a) in C6D6 zeigen bei RT
ein einziges Signal bzw. einen einzigen Signalsatz für die C5Me5-Liganden. Bis -30°C
(Toluol-d8) kann weder eine Dekoaleszenz noch eine Verbreiterung der Signale beobachtet
werden. Offenbar erfolgt ein schneller Austausch der InCp*-Liganden. Erst bei -80°C
(Toluol-d8) wird eine Aufspaltung der Signale im Verhältnis von ungefähr 1:3 erkennbar.
Ebenso erfolgt im 13C-NMR bei dieser Temperatur eine Dekoaleszenz des bei RT einfachen
Signalsatzes (113.7 und 11.2 ppm) in zwei Signalsätze bei 113.7/11.9 ppm und 113.2/11.5
ppm im Verhältnis von rund 3:1. Das 1H-NMR-Spektrum von [Pd3(GaCp*)4(µ2-GaCp*)4]
(15b) in C6D6 bei RT weist zwei Resonanzen bei 2.05 und 1.96 ppm in einem Verhältnis von
1:3 auf. Bei höherer Temperatur (80°C) wird für 15b hingegen nur eine Resonanz beobachtet,
was für 15a schon bei RT der Fall ist. Offensichtlich ist die Pd-In-Bindung im Vergleich zur
Pd-Ga-Bindung schwächer, d.h. die Bindungsenergie M-E nimmt mit steigender
Ordnungszahl der Elemente der 13. Gruppe ab. Dieses Ergebnis steht grundsätzlich auch mit
den von Frenking berechneten Bindungsenergien M-E im Einklang (s. oben), wobei die
Gleichwertigkeit der Elemente Ga ≈ In in dieser Reihenfolge nicht durch die Fluktionalität der
trinuklearen Systeme zum Ausdruck kommt.[45]
Der Grund für die ungewöhnliche Signalaufspaltung in 15a (-80°C) und 15b (RT) ist
ungewiss und stimmt nicht mit den Festkörperstrukturen von 15a und 15b überein. Eine
Dissoziation der trinuklearen Systeme in zwei Pd(ECp*)3-Fragmente und einer Pd(ECp*)2Einheit (E = Ga, In) kann nicht ausgeschlossen werden, jedoch deuten die Substitutionsreaktionen von 15a in Gegenwart von Phosphanen (PPh3 oder dppe) auf einen Erhalt der
Nuklearität in Lösung (Kapitel 3.2).
*CpE
Pd
*CpE
Cp*
E
E
Cp*
Cp*
E
Cp*
E
ECp*
ECp*
*CpE
Pd
Pd
E
Cp*
ECp*
*CpE
Pd
Pd
ECp*
Pd
ECp*
*CpE
E
Cp*
Festkörper
Lösung
Schema 27. Mögliche Umwandlung der Clusterstrukturen [Pd3(ECp*)4(µ2-ECp*)4] (E = Ga 15b, In 15a)
in Lösung und im Festkörper
- 88 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Demnach würden gemäß Schema 27 die Komplexe 15a und 15b in Lösung über einen
klassischen trigonalen Pd3-Grundkörper verfügen, an dem zwei axiale und sechs äquatoriale
Liganden koordiniert sind. Letztere (terminal und verbrückend) sind auf der NMR-Zeitskala
äquivalent, so dass ein koalesziertes NMR-Signal entsteht. Für den trinuklearen Komplex
[Pd3(AlCp*)6] (16) wurde mittels Kernresonanzspektroskopie nachgewiesen, dass im
Temperaturbereich von +80°C bis -80°C nur die vier äquatorialen, aber nicht die zwei axialen
Liganden fluktuieren (siehe unten).
Spektroskopische Charakterisierung von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16)
Das 1H-NMR von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) in C6D6 bei RT weist zwei
Resonanzen mit chemischen Verschiebungen von 2.05 und 1.97 ppm im Verhältnis von 1:2
auf. Entsprechend werden im 13C-NMR zwei Signalsätze bei 113.8/14.3 ppm und 113.0/11.2
ppm detektiert. Anscheinend sind auf der NMR-Zeitskala zwei der drei im Festkörper
unterschiedlichen AlCp*-Liganden äquivalent, da ansonsten drei Resonanzen im Verhältnis
von 1:1:1 beobachtet würden. Unter Annahme, dass µ3-verbrückende Liganden stärker
gebunden sind als µ2-verbrückende bzw. terminale Liganden, fluktuieren nur die terminalen
und verbrückenden AlCp*-Liganden in den äquatorialen Positionen. Auch bei -80°C in d8Toluol wird weder eine Verbreiterung noch eine Dekoaleszenz der Signale für die
äquatorialen Positionen beobachtet. Hingegen beteiligen sich die axialen AlCp*-Liganden
auch bei erhöhter Temperatur (+80°C) nicht an diesem Austauschprozess. Im
Spektrum kann nur eine stark verbreiterte
Das Fehlen eines zweiten
27
27
27
Al-NMR-
Al-Resonanz bei -44.6 ppm detektiert werden.
Al-Signals ist möglicherweise das Resultat einer Überlagerung
mit dem breiten Probenkopfsignal (66.8 ppm).
Spektroskopische Charakterisierung von [(dvds)(µ2-AlCp*)2] (17)
Das 1H-NMR-Spektrum von [(dvds)(µ2-AlCp*)2] (17) in C6D6 zeigt jeweils ein Singulett für
die Methylgruppen der AlCp*-Liganden bei 1.96 und 1.95 ppm. Für die dvds-Gruppe werden
insgesamt vier Signale detektiert, die sich folgendermaßen zuordnen lassen: Die vier Protonen
der CH2-Gruppen liefern durch gegenseitige Kopplung (Protonen sind nicht äquivalent) und
- 89 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
durch Kopplung mit der benachbarten CH-Gruppe ein breites Multiplett zwischen 0.55-0.32
ppm. Die CH-Gruppen rufen ein breites Triplett bei -0.26 ppm hervor. Die Kopplungskonstante J(H,H) berägt 8.7 Hz. Für die SiMe2-Gruppen werden zwei Singuletts bei 0.29 und
0.11 ppm detektiert. Im 13C-NMR-Spektrum lassen sich alle genannten Signale wieder finden.
Für die AlCp*-Einheiten werden jeweils zwei Resonanzen bei 114.3/114.1 ppm und 10.7/10.6
ppm für die Ring-C-Atome und die Methylgruppen der Cp*-Substituenten detektiert. Die CHund CH2-Gruppe der dvds-Einheit liefern zwei breite Signale bei 13.8 und 10.1 ppm. Die
SiMe2-Gruppen rufen zwei Signale bei 3.6 und -0.2 ppm hervor. Im 27Al-NMR-Spektrum von
17 werden keine
27
Al-Resonanzen detektiert. Offenbar werden die
27
Al-Signale von dem
breiten Signal des Al-haltigen Probenkopfes (66.8 ppm) überlagert.
Strukturelle Charakterisierung von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c)
können durch langsames Abkühlen einer gesättigten Hexan-Lösung auf -80°C erhalten
werden. Die Molekülstruktur von 13c ist in Abbildung 22 dargestellt; ausgesuchte
Bindungslängen und –winkel sind in Tabelle 11 angeführt.
Abbildung 22. Molekülstruktur von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c) im Kristall
- 90 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Komplex 13c kristallisiert in der triklinen Raumgruppe P 1 . Die Molekülstruktur besteht aus
einer zentralen Einheit von zwei Pd-Atomen mit einem im Vergleich zu [Pd3(InCp*)4(µ2InCp*)4] (15a) (2.77(1) und 2.78(1) Å) und [Pd3(GaCp*)4(µ2-GaCp*)4] (15b) (2.843(5) Å)
relativ kurzen Pd-Pd-Bindungsabstand von 2.6091(12) Å. Diese kurze Pd-Pd-Distanz schließt
eine bindende Pd0-Pd0-Wechselwirkung nicht aus, wie z.B. ein Vergleich mit dem
tetranuklearen Cluster [Pd4(CO)5(PPh3)4] (bindende Pd-Pd-Abständen 2.75-2.77 Å) zeigt.[137]
Der nichtbindende Pd-Pd-Abstand im selben Molekül beträgt hingegen 3.21 Å. Für
[Pt2(GaCp*)5] (13a) wurde ebenfalls ein kurzer Pt0-Pt0-Abstand von 2.582(1) Å ermittelt.
Dagegen führen quantenchemische Analysen der Bindungssituation zu dem Schluss, dass nur
schwach bindende Pt0-Pt0-Wechselwirkungen bestehen.[51]
Tabelle 11. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Pd2(GaCp*)2(µ2-GaCp*)3] (13c)
Pd(1)-Pd(2)
2.6091(12)
Ga(1)-Pd(1)-Pd(2)
177.44(5)
Pd(1)-Ga(1)
2.3624(14)
Pd(1)-Ga(2)-Pd(2)
63.17(4)
Pd(1)-Ga(2)
2.4945(15)
Pd(1)-Pd(2)-Ga(2)
58.56(3)
Pd(1)-Ga(3)
2.5052(14)
Ga(1)-Pd(1)-Ga(2)
119.51(5)
Cp*Zentrum-Ga(1)
2.004
Ga(2)-Pd(1)-Ga(3)
92.90(5)
Cp*Zentrum-Ga(2)
2.053
Cp*Zentrum-Ga(1)-Pd(1)
178.77
Cp*Zentrum-Ga(3)
2.032
Ga(2)-Pd(1)-Pd(2)-Ga(3)
118.4
Die Pd2-Einheit in 13c ist von zwei terminalen und drei verbrückenden GaCp*-Liganden
umgeben, so dass eine Dipalladium-zentrierte trigonal-bipyramidale Struktur resultiert
(idealisiert D3h Symmetrie), welche einen nahezu linearen Vektor Cp*Ga-Pd-Pd-GaCp*
aufweist. Die Struktur kann als Kombination zweier seitenverknüpfter PdGa4-Tetraeder
beschrieben werden, wobei die Winkel Ga(1)-Pd(1)-Ga(2) (119.51(5)°) und Ga(2)-Pd(1)Ga(3) (92.90(5)°) signifikant von einer idealen tetraedrischen Geometrie abweichen. Die PdGa-Bindungen der terminalen Liganden haben Werte von 2.3583(14) und 2.3624(14) Å und
stimmen nahezu mit dem Pd-Ga-Abstand in [Pd(GaCp*)4] (12c) (2.3668(7) Å) überein.
Demgegenüber sind die Pd-Ga-Bindungen der verbrückenden GaCp*-Einheiten (2.4867(14)2.5052(14) Å) um rund 14 pm aufgeweitet. Alle Cp*-Substituenten sind annähernd
symmetrisch η5-gebunden. Die durchschnittlichen Cp*Zentrum-Ga-Bindungslängen betragen
1.999 Å für die terminalen und 2.048 Å für die verbrückenden GaCp*-Liganden. Beide
Bindungslängen liegen nahe an der des freien, monomeren Liganden in der Gasphase (2.081
Å)[115], so dass die Pd-Ga-Bindungen in 13c als schwach polar charakterisiert werden können.
- 91 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
In [Pt2(GaCp*)5] (13a) wurden vergleichbare Cp*Zentrum-Ga-Abstände von 1.969 Å (terminal)
und 2.013 Å (verbrückend) bestimmt.[51]
Strukturelle Charakterisierung von [Pd3(ECp*)4(µ2-ECp*)4] (E = In 15a, Ga 15b)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pd3(ECp*)4(µ2-ECp*)4] (E = In
15a, E = Ga 15b) können durch langsames Abkühlen einer gesättigten Toluol-Lösung
erhalten werden. Die Molekülstruktur von 15a und 15b ist in Abbildung 23 dargestellt;
ausgesuchte Bindungslängen und –winkel sind in Tabelle 12 angeführt.
Abbildung 23. Molekülstruktur von [Pd3(ECp*)4(µ2-ECp*)4] (E = In 15a, E = Ga 15b) im Kristall
Der Komplex [Pd3(InCp*)4(µ2-InCp*)4] (15a) kristallisiert in der triklinen Raumgruppe P 1 ,
während für Komplex [Pd3(GaCp*)4(µ2-GaCp*)4] (15b) die monokline Raumgruppe C2/c
gefunden wird. Die daraus resultierende höhere Symmetrie von 15b im Vergleich zu 15a
kommt in vielfältiger Weise in den beiden Molekülstrukturen zum Ausdruck (Abbildung 24).
Im Festkörper bestehen beide Molekülstrukturen aus einem nahezu linearen Arrangement von
drei Pd-Atomen mit Pd-Pd-Bindungsabständen von 2.77(1) und 2.78(1) Å in 15a und
- 92 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
2.843(5) Å in 15b. Trotz einer im Vergleich zu [Pd2(GaCp*)2(µ2-GaCp*)3] (13c) (2.6091(12)
Å) merklich aufgeweiteten Pd-Pd-Bindung, kann eine bindende Pd0-Pd0-Wechselwirkung in
15a und 15b nicht ausgeschlossen werden, wie z.B. ein Vergleich mit den Palladiumcarbonyl-
phosphan-Clustern [Pd30(CO)26(PEt)10] und [Pd54(CO)40-(PEt)14] zeigt (2.76-2.84 Å).[138] Der
Pd-Pd-Abstand in elementarem Palladium beträgt 2.75 Å.[139] Der Pd3-Vektor in 15b ist
nahezu linear, während in 15a eine um ca. 10° von der Linearität abweichende Anordnung
gefunden wird. Die Pd3-Einheit ist in beiden Strukturen von vier terminalen und vier
verbrückenden ECp*-Liganden umgeben, so dass eine Molekülstruktur von drei
kantenverknüpften PdE4-Tetraedern resultiert (Abbildung 24).
Abbildung 24. Vergleich der Molekülstrukturen von 15a und 15b im Kristall (die C-Atome sind der
Übersicht halber weggelassen).
Die Verzerrung der drei PdE4-Tetraeder ist für 15a signifikanter. Die In-Pd-In-Winkel in 15a
sind für die terminalen In-Atome etwas kleiner (101.3° und 104.0°) und für die
verbrückenden (114.0° bis 116.6°) etwas größer als 109°. Diese Tendenz zeigt sich auch in
15b, jedoch mit kleineren Abweichungen von dem Idealwert (terminal: 105.09(13)°;
verbrückend: 112.16(13)°). Entsprechend weichen in 15a auch die Diederwinkel In(3)-Pd(1)Pd(2)-In(4) und In(6)-Pd(2)-Pd(3)-In(5) stärker von der Planarität ab (22.34° und 6.67°), als
in 15b (Ga(3)-Pd(1)-Pd(2)-Ga(4) 5.82°). Die beiden verbrückenden In-Atome mit der
stärkeren Abweichung (In(3), In(4)) sind in Form einer Butterfly-ähnlichen Struktur auf die
durch den Pd-Pd-Pd-Winkel leicht geöffneten Seite gebogen.
- 93 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Tabelle 12. Ausgewählte Bindungsabstände (Å) und Winkel (°) für die Komplexe [Pd3(ECp*)4(µ2ECp*)4] (E = In 15a, E = Ga 15b)[141]
15a
15b
Pd(1)-Pd(2)
2.7762(14)
2.843(5)
Pd(2)-Pd(3)
2.7747(14)
2.843(5)
Pd(1)-E(1)
2.5397(15)
2.399(3)
Pd(1)-E(3)
2.5831(14)
2.442(3)
Pd(2)-E(3)
2.6319(14)
2.514(3)
Pd(2)-E(5)
2.6258(14)
2.514(3)
Pd(3)-E(5)
2.5962(14)
2.442(3)
Pd(3)-E(7)
2.5520(15)
2.399(3)
Cp*Zentrum-E(1)
2.247
2.046
Cp*Zentrum-E(2)
2.343
2.069
Cp*Zentrum-E(3)
2.239
2.064
Cp*Zentrum-E(6)
2.246
2.060
Cp*Zentrum-E(7)
2.276
2.046
Cp*Zentrum-E(8)
2.315
2.069
Pd(1)-Pd(2)-Pd(3)
169.52(5)
179.53(4)
E(1)-Pd(1)-E(2)
101.24(5)
105.09(13)
E(3)-Pd(1)-E(4)
113.96(5)
112.16(13)
E(3)-Pd(2)-E(4)
110.70(5)
107.55(13)
E(5)-Pd(2)-E(6)
114.76(5)
107.55(13)
E(5)-Pd(3)-E(6)
116.60(5)
112.16(13)
E(7)-Pd(3)-E(8)
104.00(6)
105.09(13)
Cp*Zentrum-E(1)-Pd(1)
153.8
175.30
Cp*Zentrum-E(2)-Pd(1)
147.3
168.86
Cp*Zentrum-E(7)-Pd(3)
174.3
175.30
Cp*Zentrum-E(8)-Pd(3)
157.0
168.86
E(3)-Pd(1)-Pd(2)-E(4)
157.66(6)
174.18(4)
E(6)-Pd(2)-Pd(3)-E(5)
173.33(5)
174.18(4)
Die terminalen Pd-E-Abstände (2.5397(15)-2.5520(15) Å in 15a; 2.399(3)-2.418(3) Å in 15b)
sind etwas kürzer als die verbrückenden (2.5831(14)-2.5962(14) Å in 15a; 2.442(3)-2.448(3)
Å in 15b), wobei die Pd-E-Abstände um das zentrale Pd(2)-Atom am längsten sind
(2.6258(14)- 2.6319(14) Å in 15a; 2.514(3)-2.517(3) Å in 15b). Ferner sind die Pd-GaBindungsabstände in 15b denen in 13c sehr ähnlich. Direkte Vergleichswerte für Pd-InBindungsabstände in Koordinationsverbindungen sind nicht bekannt. Für die intermetallische
Phase Pd3In7 mit 8-fach koordiniertem Pd wurden Werte von 2.76 bis 2.79 Å gefunden.[140]
- 94 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Die Bindungsabstände E-Cp*Zentrum sind für die terminalen Positionen (2.247-2.343 Å in 15a;
2.046-2.069 Å in 15b) etwas länger als für die verbrückenden (2.239-2.246 Å in 15a; 2.0602.064 Å) und der Situation in den freien Liganden InCp* (Gasphase, 2.29 Å[18]; Festkörper,
2.30 Å[142]) und GaCp* (Gasphase, Monomer, 2.081 Å)[115] sehr ähnlich. Das spricht für kaum
polare Pdδ--Eδ+-Bindungen wie sie auch in den Komplexen [Pd(GaCp*)4] (12c),
[Pd2(GaCp*)5] (13c) oder [(dcpe)Pt(ECp*)2] (E = Ga 2.04 Å[50], E = In 2.28 Å[52]) gefunden
wurden. Im Gegensatz dazu weist der Komplex [(CO)5CrInCp*] (2.17 Å) einen signifikant
verkürzten In-Cp*Zentrum-Abstand auf.[143] Die Winkel Pd-In-Cp*Zentrum in 15a (144.7° bis
174.3°) weichen im Vergleich zu 15b (168.9-175.3°) stärker von der Linearität ab. Diese und
die anderen oben beschriebenen Verzerrungen gehen vermutlich auf sterische Überfüllung
zurück. Ähnliche Abweichungen wurden auch für [Ni(GaCp*)4][54] und die monomeren
Komplexe [M(ECp*)4] (12) gefunden (Kapitel 2.3). Möglicherweise lässt die sterische
Repulsion der anspruchsvollen Cp*-Liganden auch keine über die Dreikernigkeit hinausgehende Oligomerisierung der Pd(ECp*)2-Einheiten zu, was schließlich die selektive Bildung
von 15a und unter bestimmten Reaktionsbedingungen auch die von 15b erklärt.
Strukturelle Charakterisierung von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3AlCp*)2] (16) werden durch langsames Abkühlen einer gesättigten Toluol-Lösung erhalten.
Die Molekülstruktur von 16 ist in Abbildung 25 dargestellt; ausgesuchte Bindungslängen und
–winkel sind in Tabelle 13 angeführt.
Im Unterschied zu den linearen trinuklearen Strukturen von [Pd3(ECp*)4(µ2-ECp*)4]
(E = In 15a, E = Ga 15b) verfügt die Molekülstruktur von 16 über eine gewinkelte Pd3Einheit die von zwei axialen und vier äquatorialen (zwei verbrückende und zwei terminale)
AlCp*-Liganden umgeben ist. Der Winkel zwischen den drei Pd-Zentren beträgt 87.13(6)°.
Die Pd(1)-Pd(3)-Bindung weist einen Wert von 3.619 Å auf und kann demnach als nichtbindend betrachtet werden. Die übrigen Pd-Pd-Bindungsabstände haben Werte von
2.6157(18) und 2.6363(19) Å, die dem Pd-Pd-Abstand in [Pd2(GaCp*)5] (13c) nahezu
entsprechen, aber im Vergleich zu 15a und 15b signifikant verkürzt sind. Das Pd3-Dreieck
wird ober- und unterhalb der Ebene durch jeweils einen AlCp*-Liganden (Al(1) und Al(2))
verbrückt. Die µ3-verbrückenden Atome Al(1) und Al(2) sind nicht ober- bzw. unterhalb des
- 95 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Pd3-Schwerpunktes lokalisiert, sondern vielmehr ober- bzw. unterhalb der Pd(1)-Pd(3)-Achse,
also in Richtung zur offenen Seite des Moleküls. Der Diederwinkel Pd(1)-Al(1)-Al(2)-Pd(3)
weicht nur rund 9.5° von der Planarität ab. Demzufolge könnte die Molekülstruktur von 16
auch als pyramidal aufgefasst werden, dessen viereckige Basisfläche (bestehend aus Pd(1),
Pd(3), Al(1) und Al(2)) von dem Pd-Atom Pd(2) µ4-verbrückt wird.
Abbildung 25. Molekülstruktur von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) im Kristall
Die Bindungslängen Pd(1,3)-Al(1,2) liegen im Bereich 2.561(5)-2.601(5) Å, während die
Abstände Pd(2)-Al(1,2) (2.478(5)-2.498(5) Å) rund 9 pm kürzer sind. Die äquatorialen µ2AlCp*-Liganden sind annähernd parallel zur Pd3-Ebene angeordnet (178.38(15)°), jedoch
leicht in Richtung des Pd(2)-Zentrums verschoben. Die durchschnittlichen Pd(1,3)-Al(3,4)Bindungsabstände von 2.4885 Å sind im Vergleich zu den Distanzen Pd(2)-Al(3,4) (2.410 Å)
rund 7 pm aufgeweitet. Anscheinend weichen die Cp*-Gruppen an Al(3) und Al(4) infolge
sterischer Repulsion den benachbarten terminalen Liganden (Al(5) und Al(6)) aus.
Erwartungsgemäß werden die kürzesten Pd-Al-Bindungen mit einem durchschnittlichen Wert
von 2.373 Å für die terminalen Liganden beobachtet, die nahezu parallel zur Pd3-Ebene
angeordnet sind (173.7(14)-179.4(16)°). Der Vektor Cp*Zentrum-Al(5,6)-Pd(1,2) ist linear
- 96 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
(178.24°). Die Cp*Zentrum-Al-Abstände liegen im Bereich von 1.919-2.003 Å (durchschnittlich
1.953 Å), jedoch ist ein systematischer Unterschied zwischen terminalen und verbrückenden
Liganden nicht erkennbar. Diese Bindungslängen sind im Vergleich zum freien, monomeren
Liganden in der Gasphase (2.015 Å)[15, 128] nur leicht verkürzt und unterscheiden sich deutlich
von den polarisierten Mδ--Alδ+-Bindungen in [(CO)5Cr-AlCp*] (1.819 Å)[62] oder [(CO)4FeAlCp*] (1.776 Å).[49]
Tabelle 13. Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [Pd3(AlCp*)6] (16)
Pd(1)-Pd(2)
2.6157(18)
Pd(1)-Pd(2)-Pd(3)
87.13(6)
Pd(2)-Pd(3)
2.6363(19)
Pd(1)-Al(1)-Pd(3)
89.18(16)
Pd(1)-Pd(3)
3.619(18)
Pd(1)-Al(2)-Pd(2)
61.93(12)
Pd(1)-Al(1)
2.592(5)
Pd(1)-Al(3)-Pd(2)
64.67(12)
Pd(2)-Al(1)
2.498(5)
Pd(2)-Pd(1)-Al(5)
173.15(14)
Pd(3)-Al(1)
2.563(5)
Al(5)-Pd(1)-Al(3)
117.12(18)
Pd(1)-Al(3)
2.488(5)
Al(5)-Pd(1)-Al(2)
127.42(17)
Pd(2)-Al(3)
2.401(5)
Al(3)-Pd(2)-Al(4)
154.76(17)
Pd(1)-Al(5)
2.369(5)
Cp*Zentrum-Al(5)-Pd(1)
178.24
Cp*Zentrum-Al(1)
1.959
Pd(1)-Pd(2)-Pd(3)-Al(1)
56.76(14)
Cp*Zentrum-Al(3)
2.003
Pd(1)-Pd(2)-Pd(3)-Al(3)
178.38(15)
Cp*Zentrum-Al(5)
1.919
Pd(1)-Pd(2)-Pd(3)-Al(5)
173.7(11)
Insgesamt weist die Molekülstruktur von 16 eine sehr symmetrische Anordnung der
Zentralatome und Liganden auf, die sich signifikant von den linearen Molekülstrukturen
[Pd3(ECp*)8] (E = In 15a, Ga 15b) unterscheidet. Infolge eines kleineren M/E-Verhältnisses
(3:6) im Vergleich zu 15a und 15b (3:8), erlaubt die geringere Anzahl an Liganden in 16 eine
gewinkelte, sterisch weniger überladene Pd3-Molekülstruktur. Offenbar ist AlCp* infolge
erhöhter σ-Donor-Eigenschaften[45] besser dazu geeignet unterkoordinierte Metallzentren zu
stabilisieren, so dass auf diesem Weg neuartige, elektronendefizitäre Strukturmotive gebildet
werden, die in der Koordination von GaCp* oder InCp* offenbar nicht stabil sind.
- 97 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Strukturelle Charakterisierung von [(dvds)(µ2-AlCp*)2] (17)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [(dvds)(µ2-AlCp*)2] (17) konnten
durch langsames Abkühlen einer gesättigten Toluol Lösung auf -30°C erhalten werden. Die
Molekülstruktur von 17 ist in Abbildung 26 dargestellt; ausgesuchte Bindungslängen und –
winkel sind in Tabelle 14 angeführt.
Abbildung 26. Molekülstruktur von [(dvds)(µ2-AlCp*)2] (17) im Kristall
Komplex 17 kristallisiert in der orthorhombischen Raumgruppe Pbca. Die Molekülstruktur
wird aus zwei AlCp*-Einheiten und einem dvds-Liganden gebildet und erinnert hinsichtlich
der Anordnung der „Ringatome“ (Al, Si, O und C) an die Geometrie von Adamantan, die sich
aus vier spannungsfreien Cyclohexanringen in der Sesselform zusammensetzt. Jedoch fehlt
hier das Brückenatom zwischen O(1) und Al(2), so dass die Molekülstruktur von 17 besser als
Bicyclo[3.3.1.]nonan (z.B. 9-BBN) beschrieben werden sollte.
Die geringfügige Verzerrung der C-, Si- und Al-Zentren kommt gut durch die
Koordinationssphäre der jeweiligen Atome zum Ausdruck. So weichen die Winkel C-Al-C,
Al-C-C, Al-C-Si und C-Si-C mit Werten zwischen 106.24(17)° (C(22)-Al(1)-C(24)) und
118.0(3)° nur leicht von einer idealen tetraedrischen Geometrie ab. Erwartungsgemäß ist der
Winkel Si(1)-O(1)-Si(2) (134.50(17)°) signifikant aufgeweitet.
- 98 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
Tabelle 14. Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [(dvds)(Cp*Al)2] (17)
Al(1)-C(22)
2.002(4)
Cp*Zentrum-Al(1)
1.947
Al(1)-C(24)
1.991(4)
Cp*Zentrum-Al(2)
1.952
Al(2)-C(21)
1.968(4)
C(22)-Al(1)-C(24)
106.24(17)
Al(2)-C(23)
1.993(4)
C(21)-Al(2)-C(23)
108.64(18)
Si(1)-O(1)
1.656(3)
Al(1)-C(22)-C(21)
109.0(3)
Si(2)-O(1)
1.663(3)
Al(2)-C(21)-C(22)
118.0(3)
Si(1)-C(22)
1.908(4)
Al(1)-C(22)-Si(1)
109.5(2)
Si(2)-C(24)
1.878(4)
C(22)-Si(1)-O(1)
109.26(17)
Si(2)-C(25)
1.868(5)
Si(1)-O(1)-Si(2)
134.50(17)
Si(2)-C(28)
1.880(5)
C(25)-Si(1)-C(26)
108.6(2)
C(21)-C(22)
1.551(6)
Al(1)-C(22)-C(21)-Al(2)
54.6(4)
C(23)-C(24)
1.568(6)
Al(1)-C(22)-Si(1)-O(1)
45.6(2)
Die Al-C-Bindungsabstände liegen im Bereich 1.991(4)-2.002(4) Å und stimmen gut mit den
Al-C-Distanzen in den Cp*AlIII-Komplexen [{Cp*AlRCl}2] (R = Me 1.931 Å[144], R = iPr
1.951 Å[145]) überein. In den Verbindungen wurden für die Cp*Zentrum-Al-Abstände Werte von
1.952 bzw. 1.947 Å detektiert, die nahezu den Cp*Zentrum-Al-Abständen in 17 entsprechen.
Dagegen wurden in [{Cp*AlCl2}2] (1.871 Å) oder den monosubstituierten Metallcarbonylen
[(CO)5Cr-AlCp*] (1.819 Å)[62] und [(CO)4Fe-AlCp*] (1.775 Å)[49] deutlich kürzere
Cp*Zentrum-Al-Abstände gefunden. Infolge der Insertion von AlCp* in die C=C-π-Bindungen
von dvds, weisen die Bindungen C(21)-C(22) (1.551(6) Å) und C(23)-C(24) (1.568(6) Å)
Bindungsabstände auf,
die eindeutig einer C-C-Einfachbindung
zuzuordnen
sind.
Demgegenüber wurden in dem Komplex [(dmi)Pd(dvds)] (dmi = 1,3-Dimesitylimidazolin-2yliden), in dem der dvds Ligand an das Pd-Zentrum π-gebunden ist, C-C-Bindungsabstände
von 1.408(6) Å und 1.388(6) Å detektiert.[146]
Zusammenfassung und Diskussion
Die Vermutung, dass metallorganische Verbindungen von einwertigen Elementen der 13.
Gruppe EIR ein über die Analogie zu Kohlenmonoxid oder Phosphane hinausgehendes
Potential in der Koordinationschemie an d-Metallzentren haben, wird durch die Synthese der
di- und trinuklearen Komplexe [Pd2(GaCp*)2(µ2-GaCp*)3] (13c), [Pd3(ECp*)4(µ2-ECp*)4] (E
= In 15a, E = Ga 15b) und [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) bestätigt. Während bei
trinuklearen Systemen die Gallium- und Indium-Liganden offenbar lineare Strukturen mit
- 99 -
Ergebnisse
Die Cluster Pda(ECp*)b via Direktsynthese
________________________________________________________________________
einem M/E-Verhältnis von 3:8 bevorzugen, werden bei AlCp* als stärkerem σ-Donator
unterkoordinierte Metallzentren, d.h. ein kleineres M/E-Verhältnis (3:6) stabilisiert. Ein
stöchiometrisches Nebenprodukt bei der Darstellung von 16 ist die Verbindung [(dvds)(µ2AlCp*)2] (17), welche den carbenoiden Charakter von AlCp* unterstreicht.
Als sehr effiziente Pd0-Startverbindung zur Darstellung von M-E-Clusterverbindungen
erweist sich der Komplex [Pd2(dvds)3] (dvds = 1,3 Divinyl-1,1,3,3-tetramethyldisiloxan), der
in Abhängikeit von den Reaktionsbedingungen die Synthese di- und trinuklearer Clusterkomplexe erlaubt. Demgegenüber wird aus der Reaktion von [(tmeda)Pd(CH3)2] mit EICp* (E
= Ga, In) nur im Fall von InCp* der Cluster 15a erhalten, während die Umsetzung mit GaCp*
selektiv zu dem monomeren Komplex [Pd(GaCp*)4] (12c) führt (Kapitel 2.3). Offensichtlich
ist die Wahl des Übergangsmetall-Precursors bestimmend für die Bildung von Clusterstrukturen. Hingegen wird die Zusammensetzung der Produkte nicht maßgeblich durch das
Verhältnis der Reaktanden in dem Reaktionsgemisch beeinflusst. Die Bildung mono-, di- oder
trinuklearer Strukturen wird durch die Reaktionsbedingungen wie Reaktionstemperatur, die
Natur des Übergangsmetall-Komplexes oder einfach die Löslichkeit der Edukte und Produkte
bestimmt. Di- und trinukleare Systeme sind nicht ineinander umwandelbar und in
Anwesenheit von freien Liganden bilden sich keine monomeren Komplexe des Typs
[M(ECp*)4].
In Lösung wird für alle Clusterverbindungen Fluktionaliät beobachtet. Während in
[Pd2(GaCp*)5] (13c) bei RT ein schneller Austausch zwischen terminalen und verbrückenden
Positionen erfolgt, zeigt [Pt2(GaCp*)5] (13a) ein statisches Spektrum. In [PdPt(GaCp*)5]
(13b) tauschen nur die GaCp*-Gruppen am Pt-Zentrum. Anscheinend sind fluktionale
Prozesse an Pd-Zentren schneller als an Pt-Zentren, was gut mit den Bindungsenergien für die
Modellverbindungen [M{E(CH3}4] übereinstimmt, die für die d10-Metalle die Reihenfolge Ni
≈ Pt > Pd und für die Elemente der 13. Gruppe den Trend B > Al > Ga ≈ In > Tl aufweisen.[45]
[Pd3(InCp*)8] (15a) zeigt bei RT ein fluktionales Spektrum, welches für [Pd3(GaCp*)8] (15b)
erst bei 80°C detektiert wird. Die im Festkörper linearen trinuklearen Komplexe 15a und 15b
wandeln sich vermutlich zu klassischen Pd3-Dreiecksstrukturen (zwei axiale und sechs
äquatoriale Liganden) in Lösung um. Für [Pd3(AlCp*)6] (16) wurde ein fluktionaler Prozess
der äquatorialen Positionen mittels Kernresonanzspektroskopie nachgewiesen.
- 100 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
3.
Substitutionsreaktionen an homoleptischen Clustern [Ma(EIR)b]
(M = Pd, Pt; E = Ga, In) mit AlCp*, CO, PR3 und t-BuNC
In dem letzten Jahrzehnt hat die Synthese und Strukturchemie von M-E-Komplexen und der
Einsatz dieser Verbindungen als Precursoren für neue Materialien breites Interesse erhalten.
Demgegenüber ist wenig über die chemische Reaktivität dieser Systeme bekannt. Während
CO und Phosphane als Stütz- und Steuerliganden für Reaktivität und Selektivität in der
Organometallchemie geradezu prototypisch sind, ist über ein entsprechendes Potential der
Liganden EIR nie berichtet worden. In Kapitel 2.3 wurde gezeigt, dass die monomeren
Komplexe [M(ECp*)4] kinetisch inert sind. Doch wie verhält es sich mit den Clusterverbindungen [Ma(ER)b], deren elektronisch ungesättigter Charakter eine erhöhte Reaktivität
vermuten lässt? Zur Untersuchung dieses Apektes wurden die Verbindungen [M2(GaCp*)5]
(M = Pt 13a, PdPt 13b, Pd 13c) und [Pd3(InCp*)8] (15a) mit einer Variation an chemisch
attraktiven Liganden wie AlCp*, CO, Phosphane oder Isonitrile zur Reaktion gebracht. Das
Ergebnis dieser Umsetzungen sind zunächst unerwartete und aufschlussreiche Substitutionsreaktionen, die zu neuartigen di- und trinuklearen Strukturen führen (Schema 28 und 29).
3.1. Substitutionsreaktionen an den dinuklearen Komplexen [M2(ECp*)5]
(M = Pd, Pt; E = Al, Ga)
3.1.1. Reaktion mit AlCp*
Darstellung von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) und [Pd2(AlCp*)2(µ2-AlCp*)3] (13e)
Auf Grundlage theoretischer Untersuchungen aus der Arbeitsgruppe von Gernot Frenking ist
die Substitution von GaCp* oder InCp* durch AlCp* in homoleptischen Clusterverbindungen [Ma(ER)b] eine thermodynamisch bevorzugte Reaktion, wurde jedoch bislang
in der Literatur nicht dokumentiert.[45] Wird gemäß Schema 28 [M2(GaCp*)5] (M = Pt 13a, Pd
13c) mit AlCp* in Toluol bei 80°C zur Reaktion gebracht, entsteht nach kurzer Zeit die
„trimetallische“ Verbindung [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) und der vollständig substituierte
dinukleare Komplex [Pd2(AlCp*)2(µ2-AlCp*)3] (13e) in nahezu quantitativer Ausbeute.
Versuche, die vollständig substituierte Verbindung [Pt2(AlCp*)5] durch Reaktion von 13a mit
- 101 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
einem Überschuss an Ligand oder durch Umsetzung von [Pt(cod)2] mit einer unterstöchiometrischen Menge an AlCp* herzustellen, waren nicht erfolgreich. 13d und 13e lösen
sich nur wenig in apolaren Lösungsmitteln wie Benzol oder Toluol, während sich die
Verbindungen in halogenierten Lösungsmitteln wie CH2Cl2 zersetzen. Im Festkörper sind
beide Komplexe bis rund 180°C stabil.
Cp*
Ga
OC
Cp*
Ga
t-BuNC
Pt
Pt
Ga
Cp*
CNt-Bu
CO
Ga
Cp*
Cp*
Al
21a
Ga
Cp*
CNt-Bu
*CpAl
CO
20
Cp*
Ga
M
Pt
Ga
Cp*
Pt
Ga
Cp*
Ph3P
Pt
AlCp*
GaCp*
PPh3
AlCp*
Cp*
Al
Ph2
P
*CpGa
Cp*
Ga
M
P
Ph2
M = Pd, Pt
Al
Cp*
M = Pd, Pt
PPh3
P
Ph2
AlCp*
13e
dppe
Ph2
P
Pd
Al
Cp*
M2(GaCp*)5
Ga
Cp*
M = Pd 18a, Pt 18b
Pd
Ph3P
Pd
Pt
Al
Cp*
Pd
Ga
Cp*
Pt
PPh3
GaCp*
Al
Cp*
13d
Ga
Cp*
19
Schema 28. Reaktivität von [M2(GaCp*)2(µ2-GaCp*)3] (M = Pd, Pt)
Nicht unerwähnt soll auch die Beobachtung bleiben, dass mittels in situ NMRUntersuchungen auch für den Komplex [PtPd(GaCp*)2(µ2-GaCp*)3] (13b) in Anwesenheit
von AlCp* Substitutionsreaktionen zu beobachten sind. Jedoch verlaufen diese Substitutionen
weniger selektiv. Unter Freisetzung von GaCp* bilden sich mindestens zwei Produkte, wobei
die Lage und Anzahl der chemischen Verschiebungen sowie die Signalintensitäten eine
genaue Strukturaufklärung der Produkte nicht erlauben. Aus diesem Reaktionsansatz wurden
durch langsames Abdampfen des Lösungsmittels unter Inertgasatmosphäre für die Röntgen- 102 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
strukturanalyse geeignete Einkristalle erhalten. Das Ergebnis der Strukturaufklärung belegt
den Erhalt einer dinuklearen M2E5-Struktur, jedoch ist die Zusammensetzung des
zweiatomigen Zentrums (Pd2, Pt2 oder PdPt) ebenso ungeklärt, wie die dazugehörigen
Positionen der Liganden GaCp* und AlCp* in der Koordinationssphäre. Eine weitere
Verfeinerung unter Bestimmung der Besetzungsanteile der Ga- und Al-Atome an den
jeweiligen Ligandenpositionen sowie des dinuklearen d-Metallzentrums ließ sich aufgrund
der vergleichsweise schlechten Kristallqualität nicht durchführen.
Spektroskopische
Charakterisierung
von
[Pt2(GaCp*)2(µ2-AlCp*)3]
(13d)
und
[Pd2(AlCp*)2(µ2-AlCp*)3] (13e)
Die NMR-Untersuchungen von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) und [Pd2(AlCp*)2(µ2AlCp*)3] (13e) in C6D6 weisen für beide Komplexe zwei Signalsätze auf. Das 1H-NMRSpektrum zeigt jeweils zwei Signale bei 2.07/1.86 ppm (13d) und 2.00/1.94 ppm (13e) mit
einem Integralverhältnis von 2:3. Entsprechend werden im 13C-NMR jeweils zwei Signalsätze
detektiert, die den Ring-C-Atomen und den Methylgruppen zweier formal unterschiedlicher
ECp*-Liganden zugeordnet werden können (13d: 114.2/10.6 ppm und 112.5/13.4 ppm; 13e:
113.9/10.6 ppm und 112.8/12.5 ppm). Offensichtlich ist der fluktionale Prozess in 13e
langsamer, als in der dinuklearen Verbindung [Pd2(GaCp*)5] (13c). Diese Beobachtung
unterstreicht den schon mehrmals zitierten Trend (B > Al > Ga ≈ In > Tl) der
Bindungsenergien
[M{E(CH3)}4].
in
So
wird
die
erste
Dissoziationsenergie
in
[Pd{Al(CH3)}4] im Vergleich zu [Pd{Ga(CH3)}4] rund 12.2 kcal/mol höher berechnet
(B3LYP/II und BP86/22).[45] Im
eine stark verbreiterte
27
Fehlen eines zweiten
27
27
Al-NMR-Spektrum wird für beide Komplexe jeweils nur
Al-Resonanz bei -91.8 (13d) bzw. -54.4 ppm (13e) beobachtet. Das
Al-Signals in Komplex 13e ist möglicherweise das Resultat einer
Überlagerung zweier Resonanzen, deren chemische Verschiebungen sich nur geringfügig
voneinander unterscheiden. Auch eine Überlagerung mit dem Probenkopf Signal (66.8 ppm)
ist denkbar, jedoch werden für Verbindungen des Typs [LnMa(AlCp*)b] im Allgemeinen
chemische Verschiebungen zwischen -40 und -115 ppm detektiert. Die 27Al-Resonanzen der
stärker polarisierten Verbindungen [Cp*Al-Fe(CO)4][49] und [Cp*Al-Cr(CO)5][62] weisen
Werte von 0.4 bzw. -26.1 ppm auf.
- 103 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Strukturelle
Charakterisierung
von
[Pt2(GaCp*)2(µ2-AlCp*)3]
(13d)
und
[Pd2(AlCp*)2(µ2-AlCp*)3] (13e)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d)
und [Pd2(AlCp*)2(µ2-AlCp*)3] (13e) können durch langsames Abkühlen einer gesättigten
Toluol-Lösung erhalten werden. Die Molekülstruktur von 13d und 13e ist in Abbildung 27
dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 15 angeführt.
Abbildung 27. Molekülstruktur von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) und [Pd2(AlCp*)2(µ2-AlCp*)3] (13e)
im Kristall
Komplex 13d und 13e kristallisieren in der monoklinen Raumgruppe C2/c. Erwartungsgemäß
verfügen beide Molekülstrukturen über eine zentrale Pd2- bzw. Pt2-Einheit, die von drei
verbrückenden und zwei terminalen Liganden umgeben ist. In Übereinstimmung mit der
NMR-spektroskopischen Untersuchung, belegt auch die Röntgenstrukturanalyse von 13d,
dass AlCp*, infolge der stärkeren σ-Donor-Eigenschaften, die verbrückende Position
bevorzugt. Die M-M-Bindungslängen in 13d and 13e haben Werte von 2.5585(3) Å (M = Pt)
und 2.6327(11) Å (M = Pd), welche mit den M-M-Distanzen in [Pt2(GaCp*)5] (13a) und
[Pd2(GaCp*)5] (13c) gut übereinstimmen. Auch die terminalen Pt-Ga-Bindungslängen in 13d
(2.3310(7) und 2.3329(7) Å) harmonieren mit denen von 13a. Eine Abschätzung der Pt-Ga- 104 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Abstände anhand der Summe der Kovalenzradien liefert Werte im Bereich 2.59-2.65 Å.[147]
Für die kürzesten Pt-Ga-Abstände in den intermetallischen Phasen PtGa und Pt2Ga3 wurden
Distanzen von 2.60 und 2.45 Å gefunden.[148] Die terminalen Pd-Al-Abstände in 13e
(2.3230(18) Å) entsprechen denen in [Pd(AlCp*)4] (12e) (2.2950(9) Å). Die durchschnittlichen Pd-Al-Bindungslängen der verbrückenden AlCp*-Einheiten betragen 2.424 Å in
13e und 2.448 Å in 13d. Letztere Distanzen sind rund 11 pm länger, als die terminalen Pt-Al-
Bindungen in [(dcpe)Pt(AlCp*)2] (2.327(2) und 2.335(2) Å),[50] jedoch im Vergleich zu
binären Pt/Al-Legierungen (2.52 Å) deutlich verkürzt.[149] Eine Abschätzung der Pt-AlAbstände anhand der Summe der Kovalenzradien führt zu Distanzen im Bereich von 2.71 bis
2.77 Å.
Tabelle 15. Vergleich ausgewählter Bindungsabstände (Å) und Winkel (°) für die Komplexe
[Pt2(GaCp*)2(µ2-AlCp*)3] (13d) und [Pd2(AlCp*)5] (13e)
[Pt2(GaCp*)2(µ2-AlCp*)3] (13d)
[Pd2(AlCp*)5] (13e)
M(1)-M(2)
2.5585(3)
2.6327(11)
M(1)-E(1)
2.3310(7)
2.3230(18)
M(1)-E(2)
2.4259(16)
2.4559(18)
M(1)-E(3)
2.4237(17)
2.4559(18)
Cp*Zentrum-E(1)
1.988
1.974
Cp*Zentrum-E(2)
1.919
1.936
Cp*Zentrum-E(3)
1.925
1.940
E(1)-M(1)-M(2)
178.12(2)
179.00(5)
M(1)-E(2)-M(2)
63.46(4)
65.01(5)
M(1)-M(2)-E(2)
58.52(4)
57.26(5)
E(1)-M(1)-E(2)
122.03(4)
121.84(7)
E(2)-M(1)-E(3)
95.66(6)
94.83(5)
Cp*Zentrum-E(1)-M(1)
177.38
176.69
Alle Cp*-Gruppen sind nahezu ideal symmetrisch η5-koordiniert. Die durchschnittlichen
Werte für die Cp*Zentrum-E-Abstände betragen 1.988 Å (terminal, GaCp*) und 1.923 Å
(verbrückend, AlCp*) in 13d sowie 1.974 Å (terminal) und 1.936 Å (verbrückend) in 13e.
Diese Werte liegen nahe denen der monomeren, freien Liganden ECp* in der Gasphase
(AlCp* 2.015 Å[128]; GaCp* 2.081 Å[115]), so dass die Polarität der M-E-Bindung – wie auch
in den vorangegangenen im Rahmen dieser Arbeit vorgestellten homoleptischen Komplexen
[Ma(EIR)b] – als gering einzustufen ist.
- 105 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
3.1.2. Reaktion mit PPh3 und dppe
Darstellung von [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd 18b) und
[Pd2(PPh3)2(µ2-GaCp*)3] (19)
Die Reaktion von [M2(GaCp*)5] (M = Pt 13a, PdPt 13b, Pd 13c) mit PPh3 in Toluol führt zu
den monosubstituierten Verbindungen [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd
18b) und dem disubstituierten Komplex [Pd2(PPh3)2(µ2-GaCp*)3] (19) (Schema 28). Die
Komplexe 18 und 19 sind in Hexan unlöslich, lösen sich mäßig in Benzol oder Toluol,
während in CH2Cl2 Zersetzung beobachtet wird. Im Festkörper zersetzen sich die
Verbindungen oberhalb von 110°C.
Die terminal koordinierten GaCp*-Liganden in [Pd2(GaCp*)5] (13c) werden bereits
bei RT leicht durch PPh3 ausgetauscht, wobei 19 in nahezu quantitativer Ausbeute entsteht.
Verfolgt man die Reaktion durch in situ NMR-Untersuchungen, so lässt sich eine
monosubstituierte Spezies mittels 1H-NMR-Spektroskopie nachweisen (zwei Singuletts bei
2.12 und 1.87 ppm mit einem Integralverhältnis von 1:3 für die GaCp*-Liganden), welche
aber auch bei tiefen Temperaturen nicht isoliert werden konnte. Im Gegensatz zu dieser
milden Disubstitution benötigt die Reaktion von [Pt2(GaCp*)5] (13a) mit PPh3 sowohl eine
längere Reaktionszeit (4h), als auch höhere Reaktionstemperaturen (80°C). Wird als
Startverbindung der “trimetallische” Komplex [PtPd(GaCp*)5] (13b) eingesetzt, so erfolgt die
Substitution nur am Pd-Zentrum und die Pt-GaCp*-Bindung bleibt unverändert.
Diese Resultate stehen im Einklang mit der Fluktionalität von [M2(EIR)5] in Lösung
(Kapitel 2.4 und 2.5). Während Liganden an Pd-Zentren einen schnellen Austausch zwischen
verbrückenden und terminalen Positionen zeigen, sind solche Prozesse an Pt-Zentren
bedeutend langsamer. Für die Elemente der 13. Gruppe lässt sich eine ähnliche Abhängigkeit
im Hinblick auf Substitutionsreaktionen nachweisen. So verhalten sich die Komplexe
[Pt2(GaCp*)2(µ2-AlCp*)3] (13d) und [Pd2(AlCp*)2(µ2-AlCp*)3] (13e) in Gegenwart von PPh3
inert, was die höhere Bindungsstärke M-Al im Vergleich zur M-Ga-Bindung belegt.
Interessanterweise wird bei der Generierung von [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M
= Pt 18a, Pd 18b) und [Pd2(PPh3)2(µ2-GaCp*)3] (19) die Bildung monomerer Komplexe des
Typs [M(GaCp*)4-x(PPh3)x] (x = 1-4) nicht beobachtet. Erst durch den Einsatz
chelatisierender Phosphan-Liganden wie dppe (dppe = Bis(diphenylphosphinoethan)) werden
alle GaCp*-Einheiten in [M2(GaCp*)5] substituiert und es bilden sich die monomeren
- 106 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Komplexe [M(dppe)2] (M = Pd, Pt) in nahezu quantitativer Ausbeute (Schema 28). Alle
analytischen Daten von [M(dppe)2] (M = Pd, Pt) stimmen gut mit den bereits publizierten
Daten überein, so dass auf eine spektroskopische und strukturelle Beschreibung von
[M(dppe)2] (M = Pd, Pt) im Rahmen dieser Arbeit verzichtet wird.[150-156] Ferner war es nicht
möglich, Komplexe des Typs [(dppe)M(ER)2] zu erhalten. Komplexe dieser Art sind jedoch
bekannt. Die Reihe [(dcpe)Pt(ECp*)2] (E = Al, Ga, In; dcpe = Bis(dicyclohexylphosphino)ethan) ist prinzipiell durch Koordination der in situ gebildeten Species [(dcpe)Pt] ausgehend
von [(dcpe)Pt(H)(CH2t-Bu)] mit stöchiometrischen Mengen an ECp* zugänglich (siehe
Schema 4).[50, 52]
Spektroskopische Charakterisierung von [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt
18a, Pd 18b)
Das 1H-NMR-Spektrum von [Pt2(GaCp*)(PPh3)(µ2-GaCp*)3] (18a) in C6D6 weist zwei
Singuletts bei 2.12 und 1.84 ppm mit einem Integralverhältnis von 1:3 auf, die den terminalen
und verbrückenden GaCp*-Einheiten zugeordnet werden können. Zusätzlich zeigt sich ein
breites Multiplett zwischen 7.85 und 7.05 ppm (15H), welches gemäß der chemischen
Verschiebung den Phenyl-Gruppen des PPh3-Liganden entspricht. Im
13
C-NMR werden für
die endständig koodinierten und verbrückenden GaCp*-Liganden zwei Signalsätze bei
114.3/10.5 ppm und 112.8/11.2 ppm beobachtet. Die Phenyl-Gruppen der PPh3-Substituenten
liefern vier Resonanzen bei 141.3 ppm (d, J(P,C) = 44.2 Hz), 135.7 ppm (d, J(P,C) = 14.5
Hz), 129.3 ppm (d, J(P,C) = 4.8 Hz) und 125.7 ppm. Das 31P{1H}-NMR-Spektrum zeigt eine
Resonanz bei 66.0 ppm. Infolge der beiden NMR-aktiven Platinzentren in der Nachbarschaft
können Pt-P-Kopplungen beobachtet werden. Die 1J(Pt,P)-Kopplungskonstante beträgt 5685
Hz, während 2J(Pt,P) mit einem Wert von 276 Hz erwartungsgemäß deutlich kleiner ist.
Die NMR-Spektren von [PdPt(GaCp*)(PPh3)(µ2-GaCp*)3] (18b) sind denen von 18a
sehr ähnlich. Im 1H-NMR-Spektrum in C6D6 werden neben den Resonanzen der PPh3-Gruppe
zwei Singuletts bei 2.11 und 1.84 ppm in einem Verhältnis von 1:3 detektiert. Das 13C-NMRSpektrum zeigt entsprechend zwei Signalsätze für die GaCp*-Liganden bei 114.1/10.6 ppm
und 112.9/11.2 ppm. Im
31
P{1H}-NMR-Spektrum wird ein Signal mit einer chemischen
Verschiebung von 53.0 ppm beobachtet. Die verhältnismäßig kleine 2J(Pt,P)-Kopplungskonstante von 494 Hz belegt, dass die Substitutionsreaktion nur am Pd-Zentrum erfolgt.
- 107 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Spektroskopische Charakterisierung von [Pd2(PPh3)2(µ2-GaCp*)3] (19)
Das 1H-NMR-Spektrum von [Pd2(PPh3)2(µ2-GaCp*)3] (19) in C6D6 weist ein Singulett für die
drei verbrückenden GaCp*-Einheiten mit einer chemischen Verschiebung von 1.77 ppm
(45H) auf. Für die Protonen der Phenyl-Gruppen werden Resonanzen im Bereich von 7.857.05 ppm (30H) beobachtet. Im
13
C-NMR-Spektrum wird ein Signalsatz für die GaCp*-
Gruppen bei 113.9 und 10.4 ppm detektiert. Die Phenyl-Gruppen zeigen Resonanzen bei
135.5 ppm (d, J(P,C) = 8.4 Hz), 135.4 ppm (d, J(P,C) = 9.0 Hz), 129.3 ppm (d, J(P,C) = 2.4
Hz) und 127.2 ppm und rufen im 31P{1H}-NMR ein Signal bei 34.8 ppm hervor.
Strukturelle Charakterisierung von [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd
18b)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [MPt(GaCp*)(PPh3)(µ2-GaCp*)3]
(M = Pt 18a, Pd 18b) können durch langsames Abkühlen einer Toluol-Lösung erhalten
werden. Die Molekülstrukturen von 18a und 18b sind in Abbildung 28 dargestellt;
ausgesuchte Bindungslängen und –winkel sind in Tabelle 16 angeführt.
Abbildung 28. Molekülstruktur von [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd 18b) im Kristall
(die C-Atome sind der Übersicht halber als sphärische Kugeln dargestellt)
- 108 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Beide Komplexe kristallisieren in der triklinen Raumgruppe P 1 . Die Molekülstruktur besteht
jeweils aus einer zentralen Pt2- bzw. PdPt-Einheit, die von einer terminalen PPh3, einer
terminalen GaCp* und drei verbrückenden GaCp*-Gruppen umgeben ist. Der Vektor P-M-PtGa ist nahezu linear. Die Phenylringe an P(1) nehmen eine annähernd gestaffelte
Konformation bezüglich der verbrückenden GaCp*-Liganden ein. Die Dihedralwinkel CP(1)-M(1)-Ga liegen im Bereich 48.5(5)-73.0(6)°. Die sterische Repulsion der terminalen
PPh3-Gruppe mit den verbrückenden GaCp*-Liganden ruft vermutlich eine Verzerrung der
Koordinationssphäre
am
P(1)-Zentrum
hervor.
So
sind
die
Winkel
M-P-CPhenyl
(durchschnittlich 116.65° für 18a und 115.31° für 18b) größer als 109°, während die Winkel
CPhenyl-P(1)-CPhenyl (durchschnittlich 101.43° für 18a und 103.00° für 18b) kleinere Werte
aufweisen. Für den Komplex [Pd(PPh3)3] werden ähnliche Verzerrungen beobachtet (Pd-PCPhenyl 114.71-124.92°; CPhenyl-P(1)-CPhenyl 99.83-102.27°).[157] Demzufolge sind die
verbrückenden GaCp*-Gruppen in 18a leicht in Richtung des Pt(2)-Zentrums verschoben,
was anhand der gemittelten Werte für die Pt-Ga-Bindungen zum Ausdruck kommt (Pt(2)-Ga
2.4596 Å und Pt(1)-Ga 2.4846 Å).
Tabelle 16. Vergleich ausgewählter Bindungsabstände (Å) und Winkel (°) für die Komplexe
[MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd 18b)
18a
18b
M(1)-Pt(2)
2.6008(10)
2.5888(10)
M(1)-P(1)
2.242(3)
2.242(3)
Pt(2)-Ga(1)
2.3379(15)
2.3513(17)
M(1)-Ga(2)
2.5226(17)
2.4966(18)
Pt(2)-Ga(2)
2.4459(17)
2.4589(18)
Cp*Zentrum-Ga(1)
1.976
1.974
Cp*Zentrum-Ga(2)
2.019
2.007
P(1)-CPhenyl
1.825(12)-1.844(13)
1.794(16)-1.839(13)
Ga(1)-Pt(2)-M(1)
179.29(5)
179.31(5)
P(1)-M(1)-Pt(2)
177.20(8)
177.58(9)
M(1)-Ga(2)-Pt(2)
63.11(4)
62.98(5)
M(1)-P(1)-CPhenyl
114.8(5)-118.0(4)
113.2(6)-117.5(5)
CPhenyl-P(1)-CPhenyl
100.3(6)-102.2(6)
102.4(6)-103.6(7)
Cp*Zentrum-Pt(2)-M(1)
179.30
178.72
CPhenyl-P(1)-M(1)-Ga
48.5(5)-71.5(5)
48.5(5)-73.0(6)
- 109 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Interessanterweise übt die Einführung einer PPh3-Gruppe keinen signifikanten Einfluss auf
die Bindungsabstände und –winkel in dem Pt2Ga4-Grundgerüst aus. So stimmen die
ermittelten Pt-Ga-Bindungslängen in 18a und 18b gut mit denen von [Pt2(GaCp*)5] (13a)[51]
überein (terminal 2.326(2) und 2.331(1) Å; verbrückend 2.450(1)-2.472(2) Å). Auch die
Cp*Zentrum-Ga-Distanzen der verbrückenden GaCp*-Gruppen (2.021 Å für 18a und 2.006 Å
für 18b) und der terminal koordinierten Liganden (1.976 Å für 18a und 1.974 Å für 18b) sind
nahezu identisch mit denen von [Pt2(GaCp*)5](13a) und [Pd2(GaCp*)5] (13c). Ferner weist
auch die Pt-Pt-Bindungslänge von 2.5888(10) Å in 18a keine substantielle Abweichung von
dem Pt-Pt-Abstand in 13a auf. Die Pd-Pt-Bindungslänge in 18b hat einen Wert von
2.6008(10) Å, der zwischen den Werten für die M-M-Abstände in 13a (2.582(1) Å) und 13c
(2.6091(12) Å) liegt. Eine Recherche in der CCSD-Datenbank zeigte, dass direkte molekulare
Pd0-Pt0-Vergleichswerte nicht bekannt sind. Demzufolge ist 18b die erste, mittels
Einkristallröntgenstrukturanalyse charakterisierte Verbindung mit einer Pd0-Pt0-Bindung. Die
Molekülstruktur von 18b belegt somit eindeutig die für Komplex [PtPd(GaCp*)5] (13b)
postulierte dinukleare Pd-Pt-Struktur.
Strukturelle Charakterisierung von [Pd2(PPh3)2(µ2-GaCp*)3] (19)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pd2(PPh3)2(µ2-GaCp*)3] (19)
können durch langsames Abkühlen einer Toluol-Lösung erhalten werden. Die Molekülstruktur von 19 ist in Abbildung 29 dargestellt; ausgesuchte Bindungslängen und –winkel sind
in Tabelle 17 angeführt.
Tabelle 17. Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [Pd2(PPh3)2(µ2GaCp*)3] (19)
Pd(1)-Pd(2)
2.6183(8)
P(1)-Pd(1)-Pd(2)
180.0
Pd(1)-Ga(1)
2.5006(6)
P(1)-Pd(1)-Ga(1)
121.544(17)
Pd(2)-Ga(1)
2.5016(6)
Ga(1)-Pd(1)-Ga(1A)
95.13(2)
Pd(1)-P(1)
2.266(2)
Ga(1)-Pd(1)-Pd(2)
58.456(17)
Pd(2)-P(2)
2.267(2)
Pd(1)-Ga(1)-Pd(2)
63.12(2)
Cp*Zentrum-Ga(1)
2.037
Pd(1)-P(1)-C(11)
116.59(15)
P(1)-C(11)
1.836(5)
Pd(2)-P(2)-C(17)
116.71(15)
P(2)-C(17)
1.838(5)
C(11)-P(1)-C(11A)
101.51(19)
C(17)-P(2)-C(17A)
101.36(19)
- 110 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Komplex 19 kristallisiert in der trigonalen Raumgruppe P 3 . Bedingt durch die dreizählige
Drehachse entlang des Vektors P(1)-Pd(1)-Pd(2)-P(2) sind alle drei GaCp*-Liganden sowie
die drei Phenylringe des jeweiligen PPh3-Substituenten äquivalent. Die Molekülstruktur wird
aus einer zentralen Pd2-Einheit gebildet, die von drei verbrückenden GaCp* und zwei
endständig koordinierten PPh3-Gruppen umgeben ist. Die Phenyl-Gruppen besetzen
hinsichtlich des Vektors P(1)-Pd(1)-Pd(2)-P(2) eine ideale ekliptische Anordnung. In
Analogie zu [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd 18b) nehmen die PhenylRinge an P(1) und P(2) eine annähernd gestaffelte Konformation bezüglich der verbrückenden GaCp*-Liganden ein.
Abbildung 29. Molekülstruktur von [Pd2(PPh3)2(µ2-GaCp*)3] (19) im Kristall (die C-Atome sind der
Übersicht halber als sphärische Kugeln dargestellt)
Der Abstand Pd(1)-Pd(2) von 2.6183(8) Å stimmt nahezu mit der Pd-Pd-Bindung in
[Pd2(GaCp*)5] (13c) überein. Auch die Pd-Ga-Bindungsabstände (2.5006(6) und 2.5016(6)
Å) sind vergleichbar mit denen der verbrückenden GaCp*-Einheiten in [Pd2(GaCp*)5] (13c).
Die Pd-P-Abstände in 19 (2.266(2) und 2.267(2) Å) entsprechen dem Abstand in
[PdPt(GaCp*)(PPh3)(µ2-GaCp*)3] (18b) (2.242(3) Å). In den monomeren Verbindungen
[Pd(PPh3)n] (n = 3[157], 4[158]) werden Pd-P-Abstände im Bereich von 2.307-2.458 Å
beobachtet. Die Phosphoratome weisen eine leicht verzerrte tetraedrische Geometrie auf, die
- 111 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
vermutlich durch die sterische Repulsion der PPh3-Substituenten mit den GaCp*-Liganden
hevorgerufen wird. So ist im Einklang mit 18a und 18b der Winkel Pd(1)-P(1)-C(11)
(116.59(15)°) größer als 109°, während für den Winkel C(11)-P(1)-C(11A) rund 15° kleinere
Werte gefunden werden (101.51(19)°). Ferner unterscheidet sich der Abstand Cp*ZentrumGa(1) von 2.037 Å nicht signifikant von den monosubstituierten Verbindungen 18a und 18b,
was darauf hinweist, dass die Bindungssituation in dem Fragment [Pd2(µ2-GaCp*)3] nicht
maßgeblich durch die Koordination der Phosphanliganden in terminaler Position beeinflusst
wird.
3.3. Reaktion mit t-BuNC
Darstellung von [Pt2(t-BuNC)2(µ2-GaCp*)3] (20)
Gemäß Schema 28 bleibt auch in Gegenwart des stärkeren π-Akzeptor Liganden t-BuNC die
dinukleare Struktur von [Pt2(GaCp*)5] (13a) erhalten und es bildet sich der disubstituierte
Komplex [Pt2(t-BuNC)2(µ2-GaCp*)3] (20). 20 kann durch langsames Abkühlen einer HexanLösung auf -30°C in einer Ausbeute von 95 % isoliert werden. Der Komplex löst sich gut in
unpolaren Lösungsmitteln, wie Hexan oder Toluol und zersetzt sich im Festkörper bei einer
Temperatur von 192°C.
Wird die Bildung von 20 mittels Kernresonanzspektroskopie untersucht, so kann das
monosubstituierte Produkt [Pt2(t-BuNC)(GaCp*)(µ2-GaCp*)3] beobachtet, aber nicht isoliert
werden. Für dieses Zwischenprodukt werden für die terminalen und verbrückenden GaCp*Einheiten im 1H-NMR in C6D6 zwei Resonanzen bei 2.05 und 1.98 ppm in einem
Integralverhältnis von 1:3 detektiert. Die (t-BuNC)-Gruppe ruft ein Singulett bei 1.17 ppm
(9H) hervor.
Spektroskopische Charakterisierung von [Pt2(t-BuNC)2(µ2-GaCp*)3] (20)
Das 1H-NMR von 20 in C6D6 zeigt ein Singulett bei 2.06 ppm für die drei verbrückenden
GaCp*-Einheiten und eine Resonanz bei 1.13 ppm für die zwei terminalen (t-BuNC)Substituenten in einem Integralverhältnis von 45:18. Im
- 112 -
13
C-NMR-Spektrum wird ein
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Signalsatz (113.1/10.8 ppm) für die GaCp*-Liganden beobachtet. Die (t-BuNC)-Liganden
liefern drei Signale mit einer chemischen Verschiebung von 175.1 (CNCMe3), 54.6
(CNCMe3) und 30.7 ppm (CNCMe3).
Strukturelle Charakterisierung von [Pt2(t-BuNC)2(µ2-GaCp*)3] (20)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pt2(t-BuNC)2(µ2-GaCp*)3] (20)
können durch Abkühlen einer Hexan-Lösung auf -30°C erhalten werden. Die Molekülstruktur von 20 ist in Abbildung 30 dargestellt; ausgesuchte Bindungslängen und –winkel sind
in Tabelle 18 angeführt.
Komplex 20 kristallisiert in der monoklinen Raumgruppe P2(1)/c. Die Molekülstruktur wird aus einer zentralen Pt2-Einheit gebildet, die von drei verbrückenden GaCp* und
zwei terminalen (t-BuNC)-Gruppen umgeben ist. Die Vektoren C-Pt-Pt-C (177°) und N-C-Pt
(177.0(12)°) sind nahezu linear, während die inneren C-Atome der t-Bu-Gruppen leicht aus
der Linearität gebogen sind (Abweichung 14°).
Abbildung 30. Molekülstruktur von [Pt2(t-BuNC)2(µ2-GaCp*)3] (20) im Kristall
- 113 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Im Unterschied zu den PPh3-substituierten Komplexen [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M
= Pt 18a, Pd 18b) und [Pd2(PPh3)2(µ2-GaCp*)3] (19) weichen vermutlich infolge der
geringeren
sterischen
Repulsion
mit
den
verbrückenden
GaCp*-Einheiten
die
Koordinationssphären von C(2) und C(7) nur geringfügig von idealen tetraedrischen
Geometrien ab (C(3)-C(2)-C(4) 112.9(15)°, N(1)-C(2)-C(3) 108.4(12)°). Der Pt-PtBindungsabstand beträgt 2.6163(8) Å und für die Pt-Ga-Distanzen werden Werte im Bereich
von 2.4432(17) bis 2.4845(15) Å gefunden. Diese Abstände der Zentralatome stimmen gut
mit denen der unsubstituierten dinuklearen Verbindung [Pt2(GaCp*)5] (13a) überein (Pt-Pt
2.582(1) Å; Pt-Ga(verbrückend) 2.464 Å).[51] Auch die Pt-C- (1.9117(15)-1.943(15) Å) und
C-N-Bindungsabstände (1.154(16)-1.168(16) Å) der t-BuNC-Gruppen weisen keine
Besonderheiten auf. So werden in der trinuklearen Pt0-Verbindung [Pt3(t-BuNC)3(µ2-CNtBu)3] Pt-C-Abstände von 1.879-1.918 Ǻ und C-N-Distanzen von 1.138-1.161 Å detektiert.[159]
Tabelle 18. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Pt2(t-BuNC)2(µ2-GaCp*)3] (20)
Pt(1)-Pt(2)
2.6163(8)
N(1)-C(2)
1.441(17)
Pt(1)-Ga(1)
2.4716(15)
N(2)-C(7)
1.409(17)
Pt(1)-Ga(2)
2.4845(15)
Cp*Zentrum-Ga(1)
2.003
Pt(2)-Ga(1)
2.4620(15)
Ga(1)-Pt(1)-Ga(2)
93.34(5)
Pt(2)-Ga(2)
2.4432(17)
Pt(1)-Ga(1)-Pt(2)
64.05(4)
Pt(1)-C(1)
1.917(15)
C(1)-Pt(1)-Pt(2)
175.9(4)
Pt(2)-C(6)
1.943(15)
Pt(1)-C(1)-N(1)
177.0(12)
C(1)-N(1)
1.168(16)
C(1)-N(1)-C(2)
166.7(14)
C(6)-N(2)
1.154(16)
C(3)-C(2)-C(4)
112.9(15)
Ferner geben die Cp*Zentrum-Ga-Bindungsabstände in 20 (1.975-2.009 Å) keinen Hinweis auf
verstärkt
polarisierte
Pt-Ga-Bindungen.
Der
mittlere
Cp*Zentrum-Ga-Abstand
der
verbrückenden GaCp*-Liganden in 13a beträgt 1.969 Å. Während stark polarisierte M-EBindungen für Metallcarbonyle charakteristisch sind, ruft der isoelektronische IsocyanidLigand als stärkerer σ-Donor und schwächerer π-Akzeptor im Vergleich zu CO scheinbar
keine bzw. eine signifikant kleinere Bindungspolarisierung hervor.
- 114 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
3.1.4. Reaktion mit CO
Darstellung von [Pt2(CO)2(µ2-ECp*)3] (E=Ga 21a, E=Al 21b) und [Pd2(CO)(AlCp*)(µ2AlCp*)3] (21c)
Die Reaktion von [Pt2(GaCp*)5] (13a) mit einem Überschuss Kohlenmonoxid führt nach
wenigen Minuten zu dem disubstituierten Komplex [Pt2(CO)2(µ2-GaCp*)3] (21a). Die
Verbindung [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) reagiert mit CO erst im Verlauf von 2 Tagen bei
RT vollständig zu [Pt2(CO)2(µ2-AlCp*)3] (21b). Die Bildung von 21a und 21b kann nur in
situ durch Kernresonanz- und IR-Spektroskopie bestätigt werden, da diese Verbindungen
offenbar nur unter CO-Atmosphäre stabil sind. In Abwesenheit von Kohlenmonoxid bildet
sich in geringen Mengen ein dunkler Niederschlag, der auf das Entstehen von metallischem
Platin hindeutet. Der Komplex [Pd2(GaCp*)5] (13c) zersetzt sich unter CO-Einwirkung
vollständig, während die Verbindung [Pd2(AlCp*)5] (13e) nur langsam und unvollständig zu
einer Verbindung reagiert, die NMR-spektroskopisch als [Pd2(CO)(AlCp*)(µ2-AlCp*)3] (21c)
identifiziert werden kann.
Spektroskopische Charakterisierung von [Pt2(CO)2(µ2-ECp*)3] (E=Ga 21a, E=Al 21b)
und [Pd2(CO)(AlCp*)(µ2-AlCp*)3] (21c)
Das 1H-NMR-Spektrum von [Pt2(GaCp*)5] (13a) in einer Atmosphäre von CO in C6D6 zeigt
eine Resonanz bei 1.85 ppm für die koordinierten GaCp*-Liganden und ein Singulett für die
nicht-koordinierten GaCp*-Einheiten (1.92 ppm) im Verhältnis von 3:2. Entsprechend den
zuvor beschriebenen Substitutionsreaktionen von [M2(GaCp*)5] mit Phosphanen bzw.
Isocyaniden, kann eine Substitution der terminalen GaCp*-Liganden angenommen werden.
Auf der NMR-Zeitskala wird kein Austausch zwischen freiem und koordiniertem Ligand
beobachtet. Für die Methylgruppen der Cp*-Ringe wird im 13C-NMR nur ein Signalsatz bei
113.9/10.2 ppm detektiert. Die koodinierten CO-Liganden rufen eine 13C-Resonanz bei 209.6
ppm hervor. Das IR-Spektrum der C6D6-Lösung zeigt eine IR-Absorption der CO-Liganden
bei 1962 cm-1. Die Lage der v(CO)-Streckschwingung ist charakteristisch für terminal
koordinierte CO-Liganden, so liegt für [Pt(PPh3)3(CO)] die CO-Absorption bei 1940 cm-1.[160]
- 115 -
Ergebnisse
Substitutionsreaktionen an M2(GaCp*)5 (M = Pd, Pt)
________________________________________________________________________
Das 1H-NMR (C6D6) von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) in Gegenwart von CO zeigt nach
zwei Tagen ein Singulett bei 1.87 ppm für die koordinierten AlCp*-Liganden und ein Signal
für die nicht-koordinierten GaCp*-Einheiten (1.92 ppm) im Verhältnis von 3:2. Im 13C-NMR
von 21b wird für die Methylgruppen der Cp*-Ringe nur ein Signalsatz bei 114.1/10.8 ppm
detektiert. Die koodinierten CO-Liganden rufen eine 13C-Resonanz bei 210.4 ppm und im IRSpektrum eine IR-Absorption bei 1954 cm-1 hervor. Im
27
Al-NMR wird eine breite
27
Al-
Resonanz mit einer chemischen Verschiebung von -47.1 ppm detektiert, die im Vergleich zu
13d (-91.8 ppm) deutlich zu tiefem Feld verschoben ist.
Auch die Reaktion von [Pd2(AlCp*)5] (13e) mit CO wurde mittels 1H-NMRSpektroskopie in C6D6 verfolgt. Nach einigen Stunden werden zwei neue Signale mit
chemischen Verschiebungen von 1.93 und 1.92 ppm im Verhältnis von 3:1 detektiert.
Zusätzlich ist die Bildung von unkoordiniertem AlCp* zu beobachten (1.89 ppm). Die
Signalintensität der ungebundenen AlCp*-Resonanz zu den Produktsignalen ist etwas kleiner
(rund 0.8), da AlCp* in C6D6 bei RT nur schwer löslich ist. Im Einklang mit den PPh3substituierten Verbindungen [MPt(GaCp*)(PPh3)(µ2-GaCp*)3] (M = Pt 18a, Pd 18b) kann ein
monosubstituiertes Produkt der Form [Pd2(CO)(AlCp*)(µ2-AlCp*)3] angenommen werden.
Darüber hinaus werden Eduktsignale von 13e (2.00 und 1.94 ppm) detektiert. Das Verhältnis
Edukt/Produkt (bezogen auf die verbrückenden Liganden) beträgt etwa 1:3.5. Nach zwei
Tagen wird ein Verhältnis von rund 1:4 erhalten, wobei keine weiteren Veränderungen im
Spektrum erkennbar sind. Diese Beobachtungen deuten auf ein Gleichgewicht zwischen dem
Edukt 13e und dem monosubstituierten Produkt [Pd2(CO)(AlCp*)(µ2-AlCp*)3] (21c).
Offensichtlich konkurrieren die Liganden CO und AlCp* in diesem System, während in
[Pd2(GaCp*)5] (13c) unter Zersetzung alle GaCp*-Liganden durch CO substituiert werden.
- 116 -
Ergebnisse
Substitutionsreaktionen an Pd3(InCp*)8
________________________________________________________________________
3.2. Substitutionsreaktionen an dem trinuklearen Komplex [Pd3(InCp*)8]
3.2.1. Reaktion mit PPh3 und dppe
Darstellung von [Pd3(InCp*)3(PPh3)3] (22) und [Pd3(InCp*)3(dppe)2] (23)
Die Reaktion der trinuklearen Verbindung [Pd3(InCp*)8] (15a) mit PPh3 oder dppe in Toluol
bei RT führt zu Substitutionsprodukten mit einer zentralen Pd3-Einheit. Jedoch bleibt die
lineare Anordnung der d-Metallzentren nicht bestehen, sondern es werden trigonale Pd3Cluster der Form [Pd3(PPh3)3(µ2-InCp*)(µ3-InCp*)2] (22) und [Pd3(dppe)2(µ2-InCp*)(µ3InCp*)2] (23) erhalten (Schema 29). Interessanterweise wird bei der Synthese von 23 die
Bildung von [Pd(dppe)2] nicht beobachtet.
Cp*
In
3 PPh3
Toluol, RT
- 5 InCp*
PPh3
Pd
Ph3P Pd
*CpIn
Pd
PPh3
In
Cp*
22
Pd3(InCp*)8
2 dppe
Toluol, RT
- 5 InCp*
Ph2
P
Cp*
In
Ph2
P
Pd
P Pd
Ph2
*CpIn
Pd
P
Ph2
In
Cp*
23
Schema 29. Synthese von [Pd3(InCp*)3(PPh3)3] (22) und [Pd3(InCp*)3(dppe)2] (23)
Komplex 22 wird durch Umkristallisation in einem Gemisch aus Toluol/Hexan in Form von
orangen Einkristallen in einer Ausbeute von 68 % erhalten. 22 zersetzt sich im Festkörper bei
einer Temperatur von 112°C. Verbindung 23 löst sich dagegen erst bei höheren Temperaturen
oberhalb von 80°C in unpolaren Lösungsmitteln wie Toluol oder Benzol und wird durch
langsames Abkühlen einer warmen Toluol-Lösung in Form von roten Einkristallen in einer
Ausbeute von 70 % erhalten. Der Zersetzungspunkt von 23 (205°C) ist auffällig höher als der
von 22.
- 117 -
Ergebnisse
Substitutionsreaktionen an Pd3(InCp*)8
________________________________________________________________________
Spektroskopische Charakterisierung von [Pd3(InCp*)3(PPh3)3] (22)
Das 1H-NMR-Spektrum von [Pd3(PPh3)3(µ2-InCp*)(µ3-InCp*)2] (22) in C6D6 zeigt zwei
Singuletts bei 2.11 und 1.70 ppm für die Methylgruppen der InCp*-Liganden mit einem
Integralverhältnis von 1:2. Zusätzlich werden Signale für die PPh3-Liganden mit chemischen
Verschiebungen von 7.85-7.35 ppm (45H) detektiert. Die InCp*-Liganden rufen im 13C-NMR
zwei Signalsätze bei 114.1/10.9 und 113.7/11.1 hervor. Für die PPh3-Gruppen werden
insgesamt sieben Signale bei 140.4 (d, J(P,C) = 13.4 Hz), 140.2 (d, J(P,C) = 13.9 Hz), 139.6,
139.2, 135.3 (d, J(P,C) = 7.9 Hz), 135.0 (d, J(P,C) = 8.2 Hz) und 129.1 ppm (d, J(P,C) = 6.4
Hz) gefunden. Das
31
P{1H}-NMR zeigt zwei Resonanzen bei 30.3 und 13.6 ppm mit einem
Intensitätsverhältnis von 2:1.
Spektroskopische Charakterisierung von [Pd3(InCp*)3(dppe)2] (23)
Das 1H-NMR (C6D6) von [Pd3(dppe)2(µ2-InCp*)(µ3-InCp*)2] (23) ist dem von 22 sehr ähnlich
und weist keine ungewöhnlichen Merkmale auf. Die Methylgruppen der InCp*-Liganden
ergeben zwei Singuletts (2.54 und 1.66 ppm) mit einen Integralverhältnis von 1:2. Für die
dppe-Liganden wird ein Multiplett im Bereich von 7.85-7.0 ppm (40H, Phenyl-Gruppen) und
ein breites Signal bei 2.10 ppm (8H) für die Brücken-CH2-Gruppen gefunden. Im 13C-NMR
sind neben den Resonanzen für die dppe-Einheit (129.3, 129.1, 128.5 und 125.7 ppm, PPh2;
21.4 ppm, CH2) zwei Signalsätze bei 114.1/11.8 und 113.6/11.0 für die InCp*-Liganden zu
erkennen. Das
31
P{1H}-NMR zeigt zwei Tripletts mit gleicher Intensität bei 28.4 (3J(P,P) =
24.3 Hz) und 20.9 ppm (3J(P,P) = 24.6 Hz).
Strukturelle Charakterisierung von [Pd3(InCp*)3(PPh3)3] (22)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Pd3(PPh3)3(µ2-InCp*)(µ3-InCp*)2]
(22) können aus einem Hexan/Toluol Gemisch erhalten werden. Die Molekülstruktur von 22
ist in Abbildung 31 dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 19
angeführt.
- 118 -
Ergebnisse
Substitutionsreaktionen an Pd3(InCp*)8
________________________________________________________________________
Der Komplex 22 kristallisiert in der triklinen Raumgruppe P 1 . Die Molekülstruktur besteht
aus einer trigonalen Pd3-Einheit, die durch zwei InCp*-Moleküle ober- und unterhalb der Pd3Ebene verbrückt wird, so dass eine leicht verzerrte trigonal bipyramidale Geometrie resultiert.
Der dritte InCp*-Ligand (In(3)) wird in einem µ2-Koordinationsmodus nahezu parallel zur
Pd3-Ebene gefunden (Abweichung 6.9°). Zusätzlich ist jedes Pd-Zentrum durch eine PPh3Gruppe koordiniert. Die sterische Repulsion der PPh3-Einheiten mit den benachbarten
Substituenten führt zu einer Verzerrung der tetraedrischen Koordinationssphäre an den
Phosphorzentren, wie sie auch schon in den Komplexen 18 und 19 beobachtet wurde. So sind
die Winkel M-P-CPhenyl (114.2(3)-118.4(3)°) größer als 109°, während die Winkel CPhenylP(1)-CPhenyl (100.8(4)-104.2(4)°) kleinere Werte aufweisen.
Abbildung 31. Molekülstruktur von [Pd3(µ2-InCp*)(µ3-InCp*)2(PPh3)3] (22) im Kristall (die C-Atome
sind der Übersicht halber als sphärische Kugeln dargestellt)
Die Pd-Pd-Bindungsabstände haben Werte von 2.6283(11) Å (Pd(1)-Pd(2)), 2.9306(17) Å
(Pd(2)-Pd(3)) und 2.8003(17) Å (Pd(1)-Pd(3)). Der im Vergleich zu [Pd3(ECp*)8] (E = In
15a, Ga 15b) kurze Pd(1)-Pd(2)-Abstand ist vermutlich das Ergebnis des µ2-verbrückenden
In(3)Cp*-Liganden. Die Pd-In-Bindungsabstände der µ3-verbrückenden InCp*-Einheiten
haben durchschnittliche Werte von 2.7068 Å (In(1)) und 2.6830 Å (In(2)) und sind im
Vergleich zu den Pd-In-Distanzen in 15a etwas länger. Ferner sind die Pd(3)-In(1,2)Abstände gegenüber den übrigen µ3-In-Pd-Distanzen rund 8 pm verkürzt, so dass sich die µ3- 119 -
Ergebnisse
Substitutionsreaktionen an Pd3(InCp*)8
________________________________________________________________________
InCp*-Liganden leicht in Richtung des Pd(3)-Zentrums verschieben. Die Pd-P-Bindungsabstände liegen im Bereich von 2.255(3) bis 2.267(2) Å und entsprechen den Pd-PBindungsabständen in [Pd2(PPh3)2(µ2-GaCp*)3] (19). Die C5-Ringe sind symmetrisch η5gebunden. Der Cp*Zentrum-In-Abstand liegt im Bereich 2.235-2.299 Å und ist der Situation des
freien, monomeren Liganden InCp* in der Gasphase (2.29 Å) sehr ähnlich.[18]
Tabelle 19. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Pd3(InCp*)3(PPh3)3] (22)
Pd(1)-Pd(2)
2.6283(11)
Cp*Zentrum-In(1)
2.262
Pd(1)-Pd(3)
2.8003(17)
Cp*Zentrum-In(2)
2.235
Pd(2)-Pd(3)
2.9306(17)
Cp*Zentrum-In(3)
2.299
Pd(1)-In(3)
2.6447(15)
Pd(1)-Pd(2)-Pd(3)
60.20(4)
Pd(2)-In(3)
2.7094(15)
Pd(1)-Pd(3)-Pd(2)
54.54(4)
Pd(1)-In(1)
2.7325(10)
Pd(1)-In(3)-Pd(2)
58.78(4)
Pd(3)-In(1)
2.6597(14)
Pd(1)-In(1)-Pd(2)
57.54(3)
Pd(1)-In(2)
2.7235(12)
P(1)-Pd(1)-Pd(2)
174.89(7)
Pd(3)-In(2)
2.6183(12)
P(1)-Pd(1)-In(3)
116.54(8)
Pd(1)-P(1)
2.267(2)
Pd(1)-P(1)-CPhenyl
114.2(3)-118.4(3)
Pd(2)-P(2)
2.278(2)
CPhenyl-P(1)-CPhenyl
100.8(4)-104.2(4)
Pd(3)-P(3)
2.255(3)
Pd(1)-Pd(2)-Pd(3)-In(3)
173.12(7)
Strukturelle Charakterisierung von [Pd3(InCp*)3(dppe)2] (23)
Einkristalle von [Pd3(dppe)2(µ2-InCp*)(µ3-InCp*)2] (23) können durch langsames Abkühlen
einer warmen Toluol-Lösung (80°C) auf RT erhalten werden. Jedoch führt die schlechte
Kristallqualität zu erhebliche Problemen in der Strukturverfeinerung, so dass die ermittelten
Daten nur eine Darstellung der Molekülstruktur im Hinblick auf die Konnektivität der Atome
erlauben (Abbildung 32). Genauere Aussagen über Bindungsdistanzen und -winkel können
nicht erbracht werden.
Die Molekülstruktur von 23 besteht wiederum aus einer trigonalen Pd3-Einheit, die
durch zwei InCp*-Moleküle ober- und unterhalb der Pd3-Ebene verbrückt wird. Der dritte
InCp*-Ligand (In(3)) wird in einer µ2-Koordination ungefähr parallel zur Pd3-Ebene
gefunden. Die beiden dppe-Liganden verbrücken die übrigen Kanten der Pd3-Dreiecksfläche,
so dass Pd(3) von beiden dppe-Liganden koordiniert wird. Demzufolge kann 22 (42
Elektronencluster) als ungesättigtes Analogon zu 23 betrachtet werden. Im Gegensatz zu dem
homologen Carbonylcluster [Pd3(CO)3(PPh3)3] addiert 22 kein weiteres Äquivalent PPh3 zur
- 120 -
Ergebnisse
Substitutionsreaktionen an Pd3(InCp*)8
________________________________________________________________________
Bildung des 44 Elektronenkomplexes [Pd3(InCp*)3(PPh3)4], was sich vermutlich aus der
sterischen Repulsion der PPh3-Gruppen mit den benachbarten Liganden erklärt.[161]
Abbildung 32. Molekülstruktur von [Pd3(µ2-InCp*)(µ3-InCp*)2(dppe)2] (23) im Kristall (die C-Atome
sind der Übersicht halber als sphärische Kugeln dargestellt)
3.2.2. Reaktion mit ECp* (E = Al, Ga)
Substitutionsreaktionen von InCp* durch GaCp* bzw. AlCp* in homoleptischen Clusterverbindungen [Ma(ER)b] sind nicht nur auf dinukleare Systeme beschränkt (Kapitel 3.1.1).
Jedoch verlaufen Substitutionen an den trinuklearen Verbindungen [Pd3(ECp*)8] (E = In 15a;
Ga 15b) weniger selektiv und es bilden sich schwerlösliche Produktgemische, deren
Zusammensetzung nicht eindeutig geklärt werden konnte. Wird [Pd3(InCp*)8] (15a) in Toluol
bei RT mit 8 Äquivalenten GaCp* versetzt, so bildet sich ein oranger luftempfindlicher
Niederschlag. Der Feststoff ist extrem luft- und feuchtigkeitsempfindlich, kann jedoch bei RT
unter Inertgasatmosphäre über Wochen gelagert werden. Der Feststoff löst sich nur
geringfügig in apolaren organischen Lösungsmitteln, wie Benzol oder Toluol. In
halogenierten Lösungsmitteln wie CH2Cl2 wird hingegen Zersetzung beobachtet.
Infolge der schlechten Löslichkeit konnten zur genaueren spektroskopischen
Charakterisierung nur 1H-NMR-Experimente durchgeführt werden. Das 1H-NMR-Spektrum
- 121 -
Ergebnisse
Substitutionsreaktionen an Pd3(InCp*)8
________________________________________________________________________
des Feststoffs in Toluol-d8 zeigt zwei sehr breite Signale mit chemischen Verschiebungen von
2.19 und 1.96 ppm mit einem Integralverhältnis von rund 2.5:5.5. Ein Vergleich der Signallagen von [Pd3(InCp*)8] (15a) und [Pd3(GaCp*)8] (15b) zeigt, dass die chemische Verschiebung von 15a gegenüber 15b zu tiefem Feld verschoben ist. Demzufolge kann das
kleinere Signal bei 2.19 ppm InCp* zugeordnet werden, während die größere Resonanz bei
1.96 ppm koordinierten GaCp* entspricht. Offensichtlich werden nicht alle InCp*- durch
GaCp*-Einheiten substituiert, sondern der Austausch ist auf ungefähr 5 bis 6 Äquivalente
beschränkt. Möglicherweise wird bei dieser Reaktion keine selektive Verbindung erhalten,
sondern es bilden sich Produktgemische der Form [Pd3(GaCp*)5±x(InCp*)3±x] (x = 1, 2). Die
Unlöslichkeit der Produkte wirkt vermutlich einer vollständigen Substitution entgegen. Ferner
ist die Löslichkeit von [Pd3(GaCp*)8] (15b) in unpolaren Solventien erheblich schlechter als
die von [Pd3(InCp*)8] (15a), was eine erhöhte Substitution von InCp* durch GaCp* und
damit einen höheren Anteil von GaCp* in den Produkten unterstreicht.
Das Produktgemisch wurde durch Abkühlen einer siedenden Benzol-Lösung auf RT
umkristallisiert, wobei für die Röntgenstrukturanalyse geeignete Einkristalle erhalten wurden.
Die Strukturdaten lassen auf einen Erhalt des linearen Arrangements der drei Pd-Zentren
schließen, jedoch zeigen die acht Gruppe-13-Metall-Zentren eine statistische Verteilung
innerhalb der Positionen der Liganden im Molekül. Eine weitere Verfeinerung unter
Bestimmung der Besetzungsanteile der Ga- und In-Atome an den jeweiligen Ligandenpositionen ließ sich aber aufgrund der vergleichsweise schlechten Kristallqualität nicht
durchführen.
Abschließend soll die Beobachtung nicht unerwähnt bleiben, dass InCp* in
[Pd3(InCp*)8] (15a) in Anwesenheit von 8 Äquivalenten AlCp* bei 80°C vollständig
substituiert werden kann. 1H-NMR-Untersuchungen des Reaktionsverlaufes zeigen, dass nach
der Reaktion nur die Signale des unkoordinierten InCp*-Liganden (2.04 ppm) vorliegen.
Zusätzliche Produktsignale, wie die von AlCp*-substituierten Clusterverbindungen des Typs
[Pda(AlCp*)b] oder Zersetzungsprodukte (z. B. Cp*H, (C5Me5)2) sind dagegen nicht zu
erkennen. So ist der bei dieser Reaktion gebildete gräuliche Niederschlag in unpolaren
Lösungsmitteln wie Toluol oder Benzol gänzlich unlöslich. Die Unlöslichkeit der Produkte
schließt das Entstehen von [Pd3(AlCp*)6] (16) aus, da sich diese Verbindung verhältnismäßig
gut in unpolaren Solventien löst. Demzufolge kann die Bildung größerer Clusterstrukturen
[Pda(AlCp*)b] (a > 3) vermutet werden, jedoch verhindert die Unlöslichkeit der Produkte eine
genaue strukturelle Charakterisierung.
- 122 -
Ergebnisse
Substitution und Fluktionalität in Pda(ECp*)b
________________________________________________________________________
Zusammenfassung und Diskussion
Fluktionalität in homoleptischen Clusterverbindungen Ma(EIR)b
Die Verbindungen [Pt2(GaCp*)5] (13a) und [Pd2(AlCp*)5] (13e) zeigen bei RT ein statisches
Spektrum, während für [Pd2(GaCp*)5] (13c) unter diesen Bedingungen ein koalesziertes
Signal gefunden wird. Demnach kann ein qualitativer Trend für die relativen Raten der
Ligandenaustauschprozesse postuliert werden: [Pt2(GaCp*)5] (13a) ≈ [Pd2(AlCp*)5] (13e) <
[Pd2(GaCp*)5] (13c). Dieses Ergebnis steht im Einklang mit den berechneten M-EBindungsenergien in den monomeren Komplexen [M{E(CH3)}4] (M = Ni, Pd, Pt; E = B - Tl),
die für die Übergangsmetalle die Reihenfolge Ni ≈ Pt > Pd und für die Elemente der
13.Gruppe den Trend B > Al > Ga ≈ In > Tl aufzeigen.[45, 46] Des Weiteren stimmen diese
Resultate gut mit den NMR-Spektren der “trimetallischen” Verbindung [PdPt(GaCp*)5] (13b)
überein, die nur den „halben“ fluktionalen Prozess an einem der beiden Clusteratome zeigen
(Kapitel 2.4). Da die Pd-Ga-Bindung schwächer als die Pt-Ga-Bindung ist, erfolgt in 13b ein
schneller Austausch der verbrückenden und terminalen Liganden an dem Pt-Zentrum
(Schema 20). Ein ähnlicher Trend wird auch in der trinuklearen Serie [Pd3(ECp*)8] gefunden.
Während [Pd3(GaCp*)8] (15b) zwei Resonanzen bei RT aufweist, zeigt [Pd3(InCp*)8] (15a)
eine Dekoaleszenz erst bei -80°C (Kapitel 2.5).
Thermodynamische und kinetische Überlegungen
Von einem thermodynamischen Standpunkt aus betrachtet ist die Substitution von
gebundenem GaCp* in [M2(GaCp*)5] durch AlCp*, PPh3, CO oder Isocyaniden eine
bevorzugte Reaktion, da in allen Fällen teilweise oder vollständige Substitution beobachtet
wurde. Die π-Akzeptor-Liganden CO, Isocyanid und PPh3 wurden in einer terminalen
Position gefunden, während die verbleibenden ECp*-Liganden in der Brückenposition
lokalisiert wurden. In direkter Konkurrenz mit GaCp* favorisiert AlCp* die Brückenposition,
und es wird der „trimetallische“ Komplex [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) gebildet.
Offensichtlich zeigt AlCp* die stärkeren σ-Donor-Eigenschaften. Des Weiteren gehen die
AlCp*-substituierten Verbindungen [Pd2(AlCp*)5] (13e) und [Pt2(GaCp*)2(µ2-AlCp*)3] (13d)
in Gegenwart von Phosphanen keine weiteren Substitutionsreaktionen ein, was die höhere
- 123 -
Ergebnisse
Substitution und Fluktionalität in Pda(ECp*)b
________________________________________________________________________
Bindungsenergie der M-Al-Bindung unterstreicht.
In nahezu allen beschriebenen Substitutionsreaktionen von [M2(ECp*)5] bleibt die
Nuklearität des M2-Zentrums erhalten. Da die monomeren Verbindungen [M(ECp*)4]
einerseits kinetisch inert sind und andererseits nicht aus einer dinuklearen Clusterverbindung
in Gegenwart von freien Liganden ECp* gebildet werden, liegt es nahe, dass eine hohe
kinetische Barriere einen Zerfall der dimeren Struktur in zwei monomere Einheiten
verhindert. Allerdings können thermodynamische Gründe nicht gänzlich ausgeschlossen
werden. So zeigen die Beobachtungen in diesem Abschnitt, dass die verbrückenden ECp*Liganden stärker an die Ma-Einheit gebunden sind, als die terminal koordinierten Liganden.
Wenn aber die Anzahl der M-E-Bindungen während der Reaktion [M2(ECp*)5] + 3/n ECp*n
↔ 2 [M(ECp*)4] (n = 4, 6) erhalten bleibt, sollten die acht terminalen Bindungen in
[M(ECp*)4] gegenüber den M-E-Bindungen in [M2(ECp*)5] (sechs verbrückende und zwei
terminale) thermodynamisch bevorzugt sein. Auch die Ausbildung von Gruppe-13-MetallClustern En sollte nicht maßgeblich zu einer thermodynamischen Stabilität von [M2(ECp*)5]
gegenüber [M(ECp*)4] beitragen. So wurde durch ab-initio-Rechnungen (MP2) für die
Modellverbindung [{AlCp}4] eine Tetramerisierungsenergie von ca. -243 kJ/mol erhalten,
während im Vergleich dazu die Tetramerisierungsenergie für das hypothetische [{AlH}4] mit
-569 kJ/mol sehr groß ist.[6] Ferner sind bindende d10-d10-Metall-Wechselwirkungen im
Vergleich zu den starken M-E-Bindungen (rund 60 kcal/mol) als vernachlässigbar klein zu
werten.[46] Quantenchemische Untersuchungen der Pt-Pt-Bindung in [Pt2(GaCp*)5] (13a)
mittels NBO (Natural bond orbital) und AIM (Atoms in molecules) deuten auf eine schwache
Wechselwirkung hin.[51]
Die Frage nach der Herkunft der kinetischen Aktivität der dimeren Cluster bleibt noch
offen. Da beide d10-Metallzentren in [M2(ECp*)5] sterisch gesättigt sind (tetraedrische
Umgebung), ist ein dissoziativer Mechanismus der verbrückenden Liganden in den
Substitutionsreaktionen als auch den fluktionalen Prozessen ersichtlich (Schema 30). Das
Intermediat in beiden Prozessen ist vermutlich identisch, da sowohl für die Substitution als
auch die Fluktionalität nahezu der gleiche qualitative Trend beobachtet wird (siehe NMRStudien). Dieses Intermediat wird vermutlich durch Bindungsbruch der verbrückenden M-EBindung gebildet, wodurch ein ungesättigtes d-Metallzentrum entsteht, welches das reaktive
Zentrum für die eintretenden Liganden in den assoziativen Substitutionsreaktionen ist. Das
gesättigte d-Metallzentrum in diesem Intermediat verfügt nun über zwei äquivalente terminale
Liganden und erklärt so den Austauschprozess zwischen den verbrückenden und terminalen
Liganden.
- 124 -
Ergebnisse
Substitution und Fluktionalität in Pda(ECp*)b
________________________________________________________________________
E
*E
M
M
E
E
E
E
*E
M
E
E
M
E
E
M
E
M
E
Fluktionalität
E
*
E
L
E
*E
M
Substitution
E
E
M
E
E
E
- E*
L
E
M
E
M
E
E
M
M
L
E
L
E
Schema 30. Möglicher Mechanismus für die Substitutionsreaktionen und die fluktionalen Prozesse
von [M2(GaCp*)5] (M = Pd, Pt)
Ferner kann dieser Mechanismus auch zur Erklärung der unterschiedlichen kinetischen
Stabilität von [M(ECp*)4] und [M2(ECp*)5] angeführt werden. So wird für den Bindungsbruch in [M2(ECp*)5] deutlich weniger Aktivierungsenergie pro Molekül benötigt, als eine
vollständige Dissoziation von [M(ECp*)4] in [M(ECp*)3] und freiem E erfordern würde.
Diese Situation ist für klassische Metallcarbonyl-Komplexe eingehend untersucht worden. So
sind die mononuklearen Komplexe im Vergleich zu den polynuklearen Metallcarbonylen
hinsichtlich CO-Substitionen weniger reaktiv.[162, 163]
Schließlich läßt sich auch die Stabilität von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) in
Gegenwart von Phosphanen durch diesen Mechanismus erklären. Der Bindungsbruch einer
M-E-Bindung der verbrückenden AlCp*-Liganden benötigt mehr Energie als die Spaltung
einer M-Ga-Bindung der verbrückenden GaCp*-Liganden in [Pt2(GaCp*)5] (13a). In
Gegenwart von CO verläuft die Substitution der terminalen GaCp*-Liganden in 13d deutlich
langsamer (2 Tage), während 13a mit CO schon nach einigen Minuten zu [Pt2(CO)2(µ2GaCp*)3] (21a) reagiert. Dieser Reaktivitätsunterschied unterstreicht erneut die zunehmende
Bindungsenergie M-E für die leichteren Elemente der 13. Gruppe.
Die Bildung eines ungesättigten d-Metallzentrums im Verlauf dieses Mechanismus ist
insbesondere aus dem Blickwinkel von Bindungsaktivierungsreaktionen interessant.
Allerdings wurden Aktivierungen mit den präsentierten Verbindungen nicht beobachtet.
Offenbar stehen Bindungsaktivierungen, die im folgenden Kapitel an den Systemen Ni/Al und
Fe/Al beschrieben werden, in Konkurrenz zur Bildung von Clusterverbindungen. Ein
Zusammenhang dieser beiden Reaktionswege konnte bislang nicht erbracht werden und ist
ein attraktives Themengebiet für zukünftige Untersuchungen.
- 125 -
Ergebnisse
Bindungsaktivierungen
________________________________________________________________________
4. AlCp* als Steuerligand: C-H- und Si-H-Bindungsaktivierungen an
reaktiven Fragmenten [M(AlCp*)n] (M = Fe, Ni, n < 4)
Die Aktivierung von C-H- und C-C-Bindungen durch Metallkomplexe in homogenen Medien
ist ein aktuelles Forschungsgebiet und eine der großen Herausforderungen in der modernen
Chemie, da es zur Entwicklung von neuen selektiven und effizienten Prozessen für die
Umsetzung von kostengünstigen Kohlenwasserstoffen zu Feinchemikalien führen könnte.[164172]
Beginnend in den frühen sechziger Jahren wurde viel Aufwand auf dem Gebiet der C-H-
Bindungsaktivierung in Lösung betrieben. Herausragende Beispiele der Metallinsertion sind
zahlreiche
Cyclometallisierungsprozesse,[173]
[174, 175]
aromatischen C-H-Bindungen
die
intermolekulare
Aktivierung
von
und die weitaus schwierigere Metallinsertion in C-H-
Bindungen gesättigter Kohlenwasserstoffe, einschließlich Methan.[167, 176-178] Insbesondere die
Überführung von Methan zu der transportablen Flüsigkeit Methanol ist von bedeutsamen
praktischem Interesse.[164] Als eine weitere wichtige Anwendung wäre die Umwandlung von
n-Alkanen zu linearen Alkoholen oder Carbonsäuren zu nennen. Die hierbei erforderliche
Selektivität (CH3-H > prim. CH > sek. CH > tert. CH) schließt klassische radikalische oder
kationische Prozesse aus („Barton challenge“).[179]
Dennoch ist eine gezielte, selektive, katalytische Funktionalisierung von Kohlenwasserstoffen unter milden Reaktionsbedingungen in Lösung bislang nicht erreicht worden.
Die Problematik der C-H-Bindungsaktivierung ist offensichtlich: Alkane sind verhältnismäßig
inert. Die Reaktionsträgheit resultiert in erster Linie aus der starken C-H-Bindung (90 - 110
kcal/mol), so dass die Moleküle - im Unterschied zu den ungesättigten Kohlenwasserstoffen weder über leere Orbitale niedriger Energie (LUMO´s) noch über besetzte Orbitale höherer
Energie (HOMO´s) verfügen, d.h. Alkane sind extrem schwache σ-Basen und extrem
schwache π-Säuren. Des Weiteren ist die C-H-Bindung nahezu unpolar und im Gegesatz zu
dem sphärisch symmetrischen 1s-Orbital des Wasserstoffatoms hat das sp3-hybridisierte
Kohlenstoffatom nur eine Bindungsrichtung, die im Verlauf der oxidativen Addition zu einem
ungünstigen Dreizentren-Übergangszustand führt. Diese Argumentation erklärt die Vielzahl
an Beispielen von H2-Aktivierungen, während hingegen C-H-Bindungsaktivierungen weniger
häufig zu beobachten sind.[180]
Im Allgemeinen erfolgen C-H-Bindungsaktivierungen an Metallzentren via oxidativer
Addition durch elektronenreiche, niedervalente Komplexe später Übergangsmetalle (Fe, Ru,
Ir, Rh, Pt etc.). Die reaktive Spezies [LnMx] ist koordinativ ungesättigt und daher nicht stabil.
- 126 -
Ergebnisse
Bindungsaktivierungen
________________________________________________________________________
Demzufolge wird die Spezies in situ durch thermische oder photochemische Aktivierung
ausgehend von einem geeigneten Precursor erzeugt. Die hohe Elektronendichte am Metallzentrum führt, infolge einer starken π-Rückbindung in die C-H σ*-Orbitale des Alkans, zum
C-H-Bindungsbruch und das Produkt der oxidativen Addition [LnMx+2(H)(R)] wird
gebildet.[172,
181]
Durch Einsatz basischer Liganden in der Koordinationssphäre wird die
Elektronendichte am Metallzentrum zusätzlich erhöht. Zu solchen, wenn auch sicherlich
exotischen Liganden, zählen niedervalente Gruppe-13-Organyle des Typs EICp* (E = Al, Ga,
In).
Die π-Akzeptorfähigkeit in EICp* ist durch eine partielle Besetzung der leeren pOrbitale der Metalle durch die π-Donor-Orbitale des Cp*-Fragmentes vergleichsweise gering.
Theoretische Rechnungen haben ergeben, dass der größte Anteil der Bindungsenergie aus
elektrostatischen
Wechselwirkungen
zwischen
δ-
dem
partiell
negativ
geladenen
d-
δ+
Metallzentrum M und dem partiell positiv geladenen Gruppe-13-Metall E resultiert. Die
Donor-Akzeptor-Bindung [LnM←ECp*] wurde insbesondere im Fall von E = Al und Ga als
polar beschrieben.[45,
46]
Demnach sollte die Elektronendichte am d-Metallzentrum durch
Koordination von EICp* (E = Al, Ga) deutlich erhöht werden, wodurch eine hervorragende
Basis für Bindungsaktivierungen geschaffen würde.
Allerdings wird bei der Synthese dimerer und trimerer Komplexe des Typs [Ma(EIR)b]
(Kapitel 2.5) sowie deren Substitutionsreaktionen (Kapitel 3) die für Bindungsaktivierungen
notwendige Bildung unterkoordinierter Fragmente der Form [MEn] (n = 2, 3) nicht
beobachtet. Auch Folgeprodukte einer inter- oder intramolekularen oxidativen Addition
werden nicht detektiert. Ferner verhalten sich die monomeren Komplexe [M(EIR)4] (Kapitel
2.3), wie beispielsweise der aus [Ni(cod)2] und vier Äquivalenten AlCp* in Hexan bequem
darstellbare Komplex [Ni(AlCp*)4] (12b), im Gegensatz zu seinen klassischen Analoga
[Ni(CO)4] bzw. [Ni(PR3)4], gegenüber naheliegenden Reaktionspartnern entweder enttäuschend inert (z.B. PPh3, CO, Alkene, Alkine) oder es tritt völlig unspezifische Zersetzung
ein (z.B. I2, CH2Cl2). Dessen ungeachtet wurden im Verlauf dieser Arbeit interessante
Beobachtungen an den Systemen Ni/Al und Fe/Al gemacht, die das Potential der Liganden
EIR als Stütz- und Steuerliganden für Reaktivität und Selektivität im Hinblick auf
Aktivierungsreaktionen erstmals aufzeigen.
- 127 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
4.1. Bindungsaktivierungen am reaktiven Intermediat [Ni(AlCp*)3]
4.1.1. Aromatische C-H-Aktivierung von Benzol und Toluol
Darstellung von [Ni(AlCp*)3(HAlCp*Ph)] (24a) und [Ni(AlCp*)3{HAlCp*(C6H5Me)}]
(24b)
Wählt man für die Synthese von [Ni(AlCp*)4] (12b) ausgehend von [Ni(cod)2] nicht Hexan
sondern Benzol als Lösungsmittel, so bildet sich überraschend nicht 12b, sondern man erhält
nach 3h bei 70°C eine neue Verbindung [Ni(AlCp*)3(HAlCp*Ph)] (24a), die nach Aufarbeitung und Umkristallisation aus Hexan in Form von gelben prismatischen Einkristallen in
nahezu quantitativer Ausbeute isolierbar ist (Schema 31). Komplex 24a löst sich gut in
unpolaren Lösungsmitteln wie Hexan oder Benzol und zersetzt sich im Festkörper bei einer
Temperatur von 85°C.
AlCp*
4 AlCp*
Benzol, 70°C
- 2 cod
H
Ni
AlCp*
*CpAl
AlCp*
24a
Ni(cod)2
4 AlCp*
Toluol, 70°C
- 2 cod
AlCp*
H
Ni
*CpAl
AlCp*
H
AlCp*
+
AlCp*
meta
61%
24b
Ni
*CpAl
AlCp*
AlCp*
para
34%
Schema 31. Darstellung von [Ni(AlCp*)3(HAlCp*Ph)] (24a) und [Ni(AlCp*)3{HAlCp*(C6H5CH3)}] (24b)
Wird gemäß Schema 31 [Ni(cod)2] mit 4 Äquivalenten AlCp* in Toluol anstelle von Benzol
bei 70°C zur Reaktion gebracht, bildet sich das Produkt [Ni(AlCp*)3{HAlCp*(C6H5CH3)}]
(24b). Jedoch werden bei dieser Umsetzung Reaktionsgemische erhalten, da die C-H- 128 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Bindungsaktivierung in Toluol bezüglich der Methyl-Gruppe in ortho-, meta- oder paraPosition erfolgt. Die Kernresonanzspektroskopie zeigt, dass im Wesentlichen nur zwei
Isomere gebildet werden. Infolge der sterischen Repulsion mit den benachbarten Liganden ist
möglicherweise der Anteil des ortho-aktivierten Produktes deutlich kleiner (< 5 %). Das
Verhältnis der beiden anderen Produkte beträgt 61:34. Das würde einer statistischen
Verteilung von meta (2H) vs. para (1H) entsprechen. Ferner wird diese Annahme durch die
Röntgenstrukturanalyse von 24b unterstützt: Die Molekülstruktur zeigt, dass 24b als ein
Produktgemisch kristallisiert, wobei die Methyl-Gruppe des aktivierten Toluol-Moleküls auf
die para- und meta-Position verteilt ist, während in der ortho-Position keine Restelektronendichte detektiert wird. Eine genauere Charakterisierung der Besetzungsanteile kann infolge
der verhältnismäßig schlechten Kristallqualität nicht durchgeführt werden. Eine signifikant
bessere Kristallqualität wurde für Komplex 24a erhalten, so dass diese Molekülstruktur im
Folgenden genauer beschrieben wird.
Spektroskopische
Charakterisierung
von
[Ni(AlCp*)3(HAlCp*Ph)]
(24a)
und
[Ni(AlCp*)3{HAlCp*(C6H5Me)}] (24b)
Das 1H-NMR-Spektrum von [Ni(AlCp*)3(HAlCp*Ph)] (24a) in C6D6 bei RT zeigt zwei
Singuletts bei 1.84 (45H) und 2.04 ppm (15H) für die C5Me5 Gruppen neben Signalen eines
Phenylrestes (7.35–7.15 ppm, 5H) und einem hydridischen Signal bei -11.10 ppm (1H). In
Toluol-d8 bei -80°C kann weder eine Aufspaltung noch eine nennenswerte Verbreiterung der
Signale des koordinierten Cp*-Liganden am HAlCp*Ph-Fragment beobachtet werden: Das
weist auf einen schnellen fluktionalen Prozess mit sehr niedriger Aktivierungsenergie hin, bei
dem die gemäß Röntgenstrukturanalyse nicht äquivalenten Methylgruppen des Ringes
äquilibrieren. Das
13
C-NMR-Spektrum zeigt drei Resonanzen für die Aryl-C-Atome der
Phenyl-Gruppe bei 136.4 (o-C6H5), 125.9 (m-C6H5) und 125.4 ppm (p-C6H5). Für die AlCp*Einheiten werden zwei Signalsätze bei 117.6/13.5 ppm und 113.6/10.5 ppm detektiert. Das
27
Al-NMR-Spektrum weist nur ein Signal im Bereich terminal koordinierter AlCp*-Liganden
auf (δ = - 41.2 ppm), möglicherweise ist das Signal des {HAlCp*(Ph)}-Liganden durch das
breite Probenkopfsignal (66.8 ppm) verdeckt. Im NMR-Experiment wurde gefunden, dass
C6H6 nicht gegen C6D6 austauscht (24a in C6D6 bei 80°C mehrere Stunden), was auf
kinetische Inertheit von Komplex 24a hindeutet. Auch Behandlung mit anderen
Reaktionspartnern (PPh3, CO oder Alkine) zeigte keine Veränderung.
- 129 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Das 1H-NMR-Spektrum von [Ni(AlCp*)3{HAlCp*(C6H5CH3)}] (24b) in C6D6 bei RT zeigt
jeweils 2 Signalsätze für die Liganden der meta- und para-Isomere im Verhältnis von rund
2:1. Für den meta-Komplex werden neben Signalen der aromatischen Ring-Protonen (7.35–
7.15 ppm, 4H) drei Singuletts bei 2.41 (3H, C6H5CH3), 2.04 (15H, AlCp*) und 1.84 ppm
(45H, AlCp*) detektiert. Das hydridische Signal ruft eine Resonanz bei -10.90 ppm (1H)
hervor. Der para-Komplex zeigt neben Signalen der C6H4-Gruppe (7.35–7.15 ppm, 4H) drei
Singuletts bei 2.28 (3H, C6H4CH3), 2.06 (15H, AlCp*) und 1.85 ppm (45H, AlCp*). Das
Hydrid-Signal wurde bei -11.30 ppm (1H) beobachtet.
Strukturelle Charaktersierung von [Ni(AlCp*)3(HAlCp*Ph)] (24a)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Ni(AlCp*)3(HAlCp*Ph)] (24a)
können durch langsames Abkühlen einer Hexan-Lösung erhalten werden. Die Molekülstruktur von 24a ist in Abbildung 33 dargestellt; ausgesuchte Bindungslängen und –winkel
sind in Tabelle 20 angeführt.
Abbildung 33. Molekülstruktur von [Ni(AlCp*)3(HAlCp*Ph)] (24a) im Kristall. Die Wasserstoffatome
wurden mit Ausnahme von H(1) aus Gründen der Übersichtlichkeit ausgelassen.
- 130 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Die Einkristallstrukturanalyse belegt die nach NMR und Elementaranalyse vermutete
Molekülstruktur von [Ni(AlCp*)3(HAlCp*Ph)] (24a) (Abbildung 33). Das Nickelzentrum ist
in einer verzerrt trigonal-bipyramidalen Weise koordiniert, in der die beiden axialen
Positionen von einem Hydrid (H(1))- und einem AlCp* (Al(3))-, die drei äquatorialen
Positionen von zwei weiteren AlCp*-Liganden (Al(1) und Al(2)) und der Gruppe AlCp*Ph
(Al(4)) besetzt sind. Die Winkelsumme der äquatorialen Liganden beträgt ca. 356°, wobei
eine Abweichung der jeweiligen Liganden um rund 20° von der Koplanarität beobachtet wird.
Der Hydridligand wird in einer von der ideal axialen, stark abweichenden, verbrückenden
Position zur offenbar sehr elektrophilen AlCp*Ph Einheit lokalisiert. 24a kann auch als ein
tetraedrisch koordiniertes Ni-Zentrum beschrieben werden, wobei das elektrophile Teilchen
H-Al(Ph)(Cp*) side-on an das neutrale d10-Fragment [Ni(AlCp*)3] koordiniert. Der
verhältnismäßig große Kegelwinkel des side-on gebundenen H-Al(Ph)(Cp*)-Fragmentes im
Vergleich zur Cp*-Gruppe bewirkt eine Verkleinerung der Winkel Cp*Al-Ni-AlCp*
(100.27°-106.66°), während die Winkel {(Ph)(Cp*)Al-HZentrum}-Ni-AlCp* größer als 109°
sind. Ferner weichen die Vektoren Cp*Zentrum-Al-Ni rund 15° von der Linearität ab.
Tabelle 20. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Ni(AlCp*)3(HAlCp*Ph)] (24a)
Ni(1)-Al(1)
2.2105(11)
Cp*Zentrum-Al(2)
1.909
Ni(1)-Al(2)
2.2062(10)
Cp*Zentrum-Al(3)
1.914
Ni(1)-Al(3)
2.1688(11)
Al(1)-Ni(1)-Al(2)
106.66(4)
Ni(1)-Al(4)
2.2912(11)
Al(1)-Ni(1)-Al(3)
100.27(5)
Ni(1)-H(1)
1.50(4)
Al(1)-Ni(1)-Al(4)
118.19(4)
Al(4)-H(1)
1.76(3)
Al(2)-Ni(1)-Al(4)
131.57(4)
Al(4)-C(41)
2.131(4)
H(1)-Ni(1)-Al(3)
136.6(13)
Al(4)-C(42)
2.323(4)
Cp*Zentrum-Al(1)- Ni(1)
162.39
Al(4)-C(51)
1.982(12)
Cp*Zentrum-Al(2)- Ni(1)
169.14
CPhenyl-CPhenyl
1.340(9) – 1.405(7)
Cp*Zentrum-Al(3)- Ni(1)
169.06
Cp*Zentrum-Al(1)
1.916
Al(1)-Ni(1)-Al(2)-Al(4)
157.6(5)
Die Ni-Al-Bindungslängen entsprechen der unterschiedlichen Natur der Al-Zentren (AlI vs.
AlIII): Für die die Ni-AlI-Bindungsabstände werden Werte im Bereich von 2.1688(11)2.2105(11) Å gefunden, während der Ni-AlIII-Abstand (2.2912(11) Å) rund 10 pm
aufgeweitet ist. Der Ni-H Abstand in 24a (1.50(4) Å) ist gegenüber [NiH(cdt){Al(CH3)2N(C7H13)}] (cdt = trans, trans, trans-1,5,9-Cyclododecatrien) (Ni-H 1.65(3) Å, AlH 1.57(3) Å), dem einzigen bekannten Ni-H-Al-Vergleichskomplex, leicht verkürzt,
gleichzeitig ist der Al-H Abstand von 1.76(3) Å jedoch etwas länger.[182] Des Weiteren weist
- 131 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Al(4) eine verzerrt tertraedrische Geometrie auf (105–122°). Der Al(4)-C-Bindungsabstand zu
der Phenyl-Gruppe beträgt 1.982(12) Å, während die Distanzen zu der η2-Cp*-Einheit
merklich aufgeweitet sind (2.131(4)-2.323(4) Å). Die verbleibenden Al(4)-C-Abstände haben
Werte im Bereich von 2.645 Å (C(45)) bis 3.021 (C44)) Å und werden als nichtbindend
betrachtet. Für die Al-C-Bindungsabstände der η5-koordinierten Cp*-Gruppen werden Werte
im Bereich von 2.211(5)-2.279(4) Å beobachtet. Die Cp*Zentrum-Al-Distanzen betragen 1.9091.916 Å und sind im Vergleich zum freien, monomeren Liganden in der Gasphase (2.015 Å)
nur geringfügig verkürzt.[15,
128]
In [Ni(AlCp*)4] (12b) wird ein Cp*Zentrum-Al-Abstand von
1.933 Å detektiert. Ferner weist die Phenyl-Gruppe an Al(4) keine ungewöhnlichen
Verzerrungen auf. Die C-C-Bindungsabstände in dem C6-Ring liegen im Bereich von 1.3401.405 Å.
4.1.2. Si-H-Aktivierung von HSiEt3
Darstellung von [Ni(AlCp*)3(H)(SiEt3)] (25)
Wird gemäß Schema 32 [Ni(cod)2] mit drei Äquivalenten AlCp* in H-SiEt3 bei 80°C zur
Reaktion gebracht, so bildet sich nahezu quantitativ der Hydrosilylkomplex [Ni(AlCp*)3(H)(SiEt3)] (25), der in Form von großen, gelben, prismatischen Einkristallen aus Hexan in
80% Ausbeute anfällt. Komplex 25 ist luft- und feuchtigkeitsempfindlich, löst sich gut in
unpolaren Lösungsmitteln wie Hexan oder Benzol und zersetzt sich im Festkörper bei einer
Temperatur von 98°C.
AlCp*
3 AlCp*
Ni(cod)2
HSiEt 3, 70°C
H
- 2 cod
Ni
Et 3Si
AlCp*
25
Schema 32. Darstellung von [Ni(AlCp*)3(H)(SiEt3)] (25)
- 132 -
AlCp*
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Spektroskopische Charakterisierung von [Ni(AlCp*)3(H)(SiEt3)] (25)
Im 1H-NMR-Spektrum von [Ni(AlCp*)3(H)(SiEt3)] (25) wird bei Raumtemperatur für die
drei AlCp*-Gruppen nur ein Singulett bei 1.88 ppm (45H) beobachtet, die SiEt3 Gruppe zeigt
erwartungsgemäß ein Triplett bei 1.25 ppm (9H) und ein Quartett bei 0.84 ppm (6H). Das
hydridische Signal (1H) ist mit –12.80 ppm im Vergleich zu [Ni(AlCp*)3(HAlCp*Ph)] (24a)
geringfügig ins hohe Feld verschoben. Durch die starke Verbreiterung des Signals kann keine
direkte 2J(Si,H) Kopplung detektiert werden. Das
13
C-NMRSpektrum zeigt für die C5Me5-
Einheiten nur einen Signalsatz bei 113.6/10.4 ppm und die SiEt3-Gruppe ruft zwei
Resonanzen bei 20.6 und 11.8 ppm hervor. Im 27Al-NMR wird nur eine Resonanz bei -35.2
ppm detektiert, die im Vergleich zu 24a (δ = -41.2 ppm) nur leicht ins Tieffeld verschoben ist.
Strukturelle Charakterisierung von [Ni(AlCp*)3(H)(SiEt3)] (25)
Für die Röntgenstrukturanalyse geeignete Einkristalle von [Ni(AlCp*)3(H)(SiEt3)] (25)
können durch Abkühlen einer Hexan-Lösung auf -30°C erhalten werden. Die Molekülstruktur von 25 ist in Abbildung 34 dargestellt; ausgesuchte Bindungslängen und –winkel sind
in Tabelle 21 angeführt.
Tabelle 21. Ausgewählte Bindungsabstände (Å) und Winkel (°) für [Ni(AlCp*)3(H)(SiEt3)] (25)
Ni(1)-Al(1)
2.203(8)
Al(1)-Ni(1)-Al(2)
107.47(15)
Ni(1)-Al(2)
2.208(10)
Al(1)-Ni(1)-Al(3)
99.2(4)
Ni(1)-Al(3)
2.180(7)
Al(1)-Ni(1)-Si(1)
112.3(2)
Ni(1)-Si(1)
2.239(8)
Al(3)-Ni(1)-Si(1)
132.45(17)
Ni(1)-H(1)
1.424(5)
H(1)-Ni(1)-Al(2)
140.6(2)
Cp*Zentrum-Al(1)
1.931
C(41)-Si(1)-Ni(1)
116.7(3)
Cp*Zentrum-Al(2)
1.945
Cp*Zentrum-Al(2)- Ni(1)
176.19
Cp*Zentrum-Al(3)
1.917
Cp*Zentrum-Al(3)- Ni(1)
166.38
Die Molekülstruktur von 25 im Festkörper belegt ein trigonal-bipyramidal koordiniertes
Nickel-Zentrum, mit ähnlichen Verzerrungen wie im Falle von [Ni(AlCp*)3(HAlCp*Ph)]
(24a). Die äquatorialen Positionen werden von den Liganden AlCp* (Al(1) und Al(3)) und
SiEt3 besetzt. Die Winkelsumme der äquatorialen Positionen an Ni(1) beträgt rund 344° und
- 133 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
liegt demnach zwischen einer tetraedrischen (328.5°) und einer trigonal-planaren Geometrie
(360°). Die größte Abweichung wird hierbei für den Winkel Al(3)-Ni(1)-Si(1) (132.45°)
beobachtet. Außerdem weichen die äquatorialen Liganden etwa um 46° von der Koplanarität
ab, ebenso wie die axiale Gruppierung H(1)-Ni(1)-Al(2) mit einem Winkel von 140.6(2)° weit
von der Linearität entfernt ist.
Abbildung 34. Molekülstruktur von [Ni(AlCp*)3(H)(SiEt3)] (25) im Kristall. Die Wasserstoffatome
wurden mit Ausnahme von H(1) aus Gründen der Übersichtlichkeit ausgelassen.
Im Unterschied zu 24a aber ist H(1) nicht in einer verbrückenden Position (Ni-H-Al) zu
finden, sondern koordiniert eindeutig terminal an Ni(1) mit einem Bindungsabstand von
1.424(5) Å. Entsprechend ist die Umgebung des Si-Atoms im Unterschied zur weitaus
elektrophileren AlIII-Einheit in 24a als verzerrt tetraedrisch anzusehen, ohne Indikation
hypervalenter Wechselwirkung mit der Ni-H-Einheit. Als eine Folge der sterischen Repulsion
mit den benachbarten Liganden sind die Winkel Ni(1)-Si(1)-C (114.6(3)-116.8(3)°) größer als
109°, während für die Winkel C-Si(1)-C kleinere Werte gefunden wurden (100.7(4)104.5(3)°). Die Cp*Zentrum-Al-Distanzen liegen im Bereich 1.917-1.945 Å und sind nahezu
vergleichbar mit dem Cp*Zentrum-Al-Abstand in [Ni(AlCp*)4] (12b) mit einem Abstand von
- 134 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
1.933 Å.
Die oxidative Addition von Silanen an Ni0-Komplexen ist an sich nicht ungewöhnlich,
so reagiert beispielsweise [Ni(PPh3)4] mit Silanen des Typs HnSiPh3-n unter Abspaltung von
H2 und PPh3 zu paramagnetischen NiII-Disilankomplexen nach einem dissoziativen
Mechanismus.[183] Allerdings wurden dabei bislang keine zu 25 analogen Monomere des Typs
[LnNiH(SiX3)] isoliert und charakterisiert.
4.1.3. Reaktivität von [Ni(AlCp*)3(H)(SiEt3)]
Im Unterschied zu dem kinetisch inerten Komplex [Ni(AlCp*)3(HAlCp*Ph)] (24a), ist die SiH-Bindungsaktivierung
in
[Ni(AlCp*)3(H)(SiEt3)]
(25)
reversibel.
Die
thermische
Aktivierung von Komplex 25 in C6H6 führt schon nach kurzer Zeit zur, bezogen auf AlCp*,
quantitativen Bildung von Komplex 24a unter selektiver Abspaltung von Triethylsilan
(Schema 33). Offenbar führt die reduktive Eliminierung von H-SiEt3 zu dem unterkoordinierten Fragment [Ni(AlCp*)3], welches vermutlich als sehr elektronenreiches
Fragment die C-H-Bindung von Benzol bzw. Toluol aktiviert. Jedoch fehlen bislang
spektroskopische Hinweise auf die Bildung eines solchen reaktiven Intermediates. Weder
Untersuchungen mittels Kernresonanzspektroskopie, noch massenspektroskopische Analysen
von 24a und 25 geben Aufschluss über die Zusammensetzung der intermediär gebildeten
Spezies. Alternativ wären zum Beispiel auch dinukleare Strukturen [Ni2(AlCp*)n] (n ≤ 5)
denkbar. Derartige Komplexe würden eine Brücke zwischen der Clustersynthese und den
Aktivierungsreaktionen erlauben. Jedoch ist die Synthese di- oder trinuklearer Ni/ECp*Verbindungen bislang nicht geglückt.
Ferner wird die Vermutung, dass die Aktivierung der C-H- und Si-H-Bindungen an dem
unterkoordinierten Fragment [Ni(AlCp*)3] stattfindet durch die Beobachtung gestützt, dass
sich beim Erwärmen in reinem THF unter reduktiver Abspaltung von Triethylsilan langsam
aber ebenso quantitativ (wieder bezogen auf AlCp*) der homoleptische monomere Komplex
[Ni(AlCp*)4] (12b) bildet, ohne dass das Lösungsmittel angegriffen wird. Der Verbleib der
Nickelkomponente (25 %) in diesem Fall konnte bisher nicht eindeutig aufgeklärt werden,
jedoch deutet die Bildung von Spuren eines dunklen Niederschlags auf das Entstehen von
metallischem Nickel. In Abwesenheit von Liganden L bildet sich 12b auch bei thermischer
Aktivierung von 25 in Hexan.
- 135 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
AlCp*
H
C6H6, 70°C
- HSiEt3,
teilweise Zersetzung
Ni
*CpAl
AlCp*
AlCp*
24a
THF, 70°C
AlCp*
- HSiEt3,
teilweise Zersetzung
Ni
*CpAl
H
Ni
Et3Si
HSiEt 3
AlCp*
AlCp*
AlCp*, Hexan, 70°C
AlCp*
AlCp*
12b
- HSiEt3,
[Ni(AlCp*)3]
AlCp*
AlCp*
GaCp*, Hexan, 70°C
25
- HSiEt3,
Ni
*CpGa
AlCp*
AlCp*
12f
AlCp*
PPh 3, Hexan, 70°C
- HSiEt3,
Ni
Ph3P
AlCp*
AlCp*
26
Schema 33. Reaktivität von [Ni(AlCp*)3(H)(SiEt3)] (25)
Der Hydrosilylkomplex 25 ist interessanterweise nicht nur gegenüber Benzol, sondern einer
Vielzahl von Substraten reaktiv. So entsteht der homoleptische Komplex [Ni(AlCp*)4] (12b)
quantitativ aus der Umsetzung von 25 mit einem Äquivalent AlCp* in Hexan bei 70°C unter
Freisetzung von HSiEt3. Auch GaCp* oder PPh3 setzen sich mit 25 in Hexan bei 70°C
entsprechend zu den heteroleptischen Komplexen [Ni(AlCp*)3(GaCp*)] (12f) bzw.
[Ni(AlCp*)3(PPh3)] (26) um, die wie in Kapitel 2.3 dargelegt, nicht aus 12b durch direkte
Substitution von AlCp* darstellbar sind. 12f ist der erste monomere heteroleptische Komplex
des Typs [M(ECp*)n(E’Cp*)m] (n + m = 4). Die Komplexe 12f und 26 werden in Form von
gelben Niederschlägen in einer Ausbeute von rund 80 % erhalten. Beide Verbindungen sind
luft- und feuchtigkeitsempfindlich und wurden mittels Kernresonanzspektroskopie und
Elementaranalyse charakterisiert.
- 136 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Spektroskopische Charakterisierung von [Ni(AlCp*)3(GaCp*)] (12f)
Im 1H-NMR (C6D6) von [Ni(AlCp*)3(GaCp*)] (12f) wird bei Raumtemperatur für die drei
AlCp*-Gruppen ein Singulett bei 1.89 ppm (45H) beobachtet, die GaCp*-Gruppe ruft ein
Singulett bei 2.00 ppm (15H) hervor. Das 13C-NMR-Spektrum zeigt für die C5Me5-Einheiten
der GaCp*- und AlCp*-Liganden zwei Signalsätze bei 112.7/10.4 ppm (GaCp*) und
113.0/10.5 ppm (AlCp*). Auch die Bestimmung der C- und H-Anteile mittels
Elementaranalyse belegt die Bildung einer mononuklearen Struktur mit der Zusammensetzung [Ni(AlCp*)3(GaCp*)] (12f).
Spektroskopische Charakterisierung von [Ni(AlCp*)3(PPh3)] (26)
Das 1H-NMR von [Ni(AlCp*)3(PPh3)] (26) in C6D6 bei RT zeigt neben den Signalen für die
Phenyl-Gruppen bei 7.85-7.55 ppm (15H) ein Singulett bei 1.86 ppm (45H) für die drei
AlCp*-Gruppen. Im 13C-NMR werden für die AlCp*-Liganden zwei Signale bei 113.2 ppm
(C5Me5) und 10.3 ppm (C5Me5) detektiert. Die Phenylgruppen rufen drei Resonanzen bei
147.0 ppm (d, J(P,C) = 28.0 Hz), 133.7 ppm (d, J(P,C) = 13.8 Hz) und 127.0 ppm (d, J(P,C) =
8.5 Hz) hervor. Das
31
P{1H}-NMR zeigt eine
31
P-Resonanz bei 69.7 ppm. Die Elementar-
analyse belegt die nach NMR vermutete Zusammensetzung von [Ni(AlCp*)3(PPh3)] (26).
Zusammenfassung und Diskussion
Die Knüpfung neuer M-E-Bindungen via Substitution, Insertion oder Salzmetathese sowie
quantentheoretische Untersuchungen standen bislang im Vordergrund der Untersuchung von
M-EIR-Komplexen. Über die Möglichkeit, die niedervalente Spezies EIR als Stütz- und
Steuerliganden einzusetzen, wurde bislang nicht berichtet, während dies für die Liganden CO
und PR3 geradezu prototypisch ist.[177] Im Zuge dieser Arbeit ist es gelungen, das Potential
dieser ungewöhnlichen Liganden anhand von jeweils einer aromatischen C-H- und einer SiH-Bindungsaktivierung an einem Ni0-Zentrum unter Beweis zu stellen. So exotisch wie die
Liganden EICp* auch sein mögen, so klassisch ist doch das Konzept, das die Richtung zur
Generierung reaktiver, ungesättigter Intermediate [M(ER)n] (n < 4) und damit zur weiteren
Ausfaltung dieser neuen Chemie weist (Schema 34).
- 137 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
AlCp*
AlCp*, n-Hexan
Ni
*CpAl
AlCp*
12b
AlCp*
AlCp*,
n-Hexan
- HSiEt 3
AlCp*
Ni(cod) 2
3 AlCp*
- 2 cod
[Ni(AlCp*) 3 ]
HSiEt3
H Ni
Et3Si
H
*CpAl
25
AlCp*
- HSiEt 3,
teilweis e Zersetzung
C6 H 6
AlCp*, C 6H 6
AlCp*
AlCp*
Ni AlCp*
24a
AlCp*
Schema 34. Synthese von 12b, 24a und 25 aus [Ni(cod)2] und [{AlCp*}4]
Die Addition von Benzol an [Ni(AlCp*)3] ist das erste Beispiel für eine aromatische C-HAktivierung an einem Ni0-Fragment und weist die Richtung für ein allgemeines Konzept zur
gezielten Generierung reaktiver, unterkoordinierter Fragmente vom Typ [M(ER)n], die auf
anderem Wege (z.B. aus den monomeren Komplexen [M(ECp*)4]) bisher nicht erhältlich
sind. Die Bildung eines koordinativ ungesättigten, elektronenreichen Ni0-Fragments der Form
[Ni(AlCp*)3] ist dabei – wie bei allen klassischen oxidativen Additionen – grundlegende
Voraussetzung für die Bindungsaktivierung. Das Fragment [Ni(AlCp*)3] bildet sich jedoch
nicht dissoziativ aus [Ni(AlCp*)4] (12b), sondern ist vielmehr eine Zwischenstufe auf dem
Weg zu kinetisch inertem 12b, die in Anwesenheit geeigneter Reaktionspartner (z.B. H-SiEt3)
abgefangen wird, bevor sich 12b nennenswert bildet.
Trotz der höheren Bindungsenergie aromatischer C-H- im Vergleich zu aliphatischen
C-H-Bindungen, wird ausschließlich die aromatische C-H-Bindungsaktivierung beobachtet.
So führt die Thermolyse von [Ni(AlCp*)3(H)(SiEt3)] (25) in Hexan nur zur Bildung von
monomeren [Ni(AlCp*)4] (12b). Dieser Reaktivitätssunterschied ist nicht ungewöhnlich und
wurde in zahlreichen anderen Beispielen in der Literatur dokumentiert. Als Gründe für die
erhöhte Reaktivität von Aromaten werden sowohl kinetische, als auch thermodynamische
- 138 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Faktoren angeführt. Zum einen sind aromatische C-H-Bindungen sterisch weniger gehindert
und das Metallzentrum kann außerdem vor dem C-H-Bindungsbruch mit den π-Elektronen
des Aromaten interagieren (Koordination in einem η2-Bindungsmodus), zum anderen weisen
M-Caryl-Bindungen eine höhere Bindungsenergie im Vergleich zu M-Calkyl auf.[164] So ist zum
Beispiel die Rh-Phenyl-Bindung in [Cp*Rh(PMe3)(R)(H)] (R = Ph, Me) ca. 12.5±1 kcal/mol
stabiler als die Rh-Me-Bindung.[184]
Der Mechanismus zur Generierung von [Ni(AlCp*)3(HAlCp*Ph)] (24a) ist in Schema
35 dargestellt. Es wir vermutet, dass im ersten Schritt die aromatische C-H-Bindung von C6H6
an dem unterkoordinierten Fragment [Ni(AlCp*)3] oxidativ addiert wird und sich das NiIIIntermediat [(AlCp*)3Ni(H)(C6H5)] bildet. Im zweiten Schritt erfolgt eine Wanderung des
Phenyl- und Hydridliganden auf eine AlCp*-Einheit unter Oxidation des Aluminiumzentrums
und Ausbildung einer Al-C- und Al-H-Bindung. Die Übertragung des Hydrids in diesem
Mechanismus führt zur Molekülstruktur von 24a, die sich am besten als side-on Koordination
der elektrophilen Gruppe H-Al(Ph)(Cp*) an das elektronenreiche Ni(AlCp)3-Fragment
beschreiben lässt. Abschließend wird ein viertes Äquivalent AlCp* an das Ni-Zentrum
koordiniert. Diese Hypothese folgt aus den Beobachtungen in der Pd/E-Chemie (E = Ga, In):
dort wurde die der klassischen "CO-Insertion" in M-C-Bindungen entsprechende Reaktion
von ECp* mit [(tmeda)Pd(CH3)2] unter Abspaltung von (CH3)2ECp* beschrieben (Kapitel 2.3
und 2.5).
AlCp*
Ni(COD)2
+
4 AlCp*
C6H6
- 2 cod
H
Ni
*CpAl
AlCp*
AlCp*
3 AlCp*
*CpAl
H
Ni
AlCp*
*CpAl
Cp*Al
AlCp*
*CpAl
*CpAl
Schema 35. Möglicher Mechanismus zur Bildung von 24a
- 139 -
Ni
H
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Interessanterweise sind weder für [Ni(CO)4] noch für [Ni(PR3)4] oder andere d10-NiKomplexe vergleichbare aromatische C-H-Aktivierungsreaktionen bekannt. So wird
beispielsweise an dem reaktiven, nicht isolierbaren Ni0-Fragment [Ni(dtbpe)] (dtbpe =
t
Bu2PC2H4PtBu2) eine η2-Koordination von Benzol beobachtet. Beim Erwärmen zersetzen
sich diese labilen Verbindungen ohne C-H-Aktivierung. Im Gegensatz dazu bildet sich in
Anwesenheit von C6F6 [Ni(dtbpe)(F)(C6F5)] als Resultat einer C-F-Addition.[185] Auch
[Ni(PEt3)2] aktiviert C-F, aber nicht C-H-Bindungen.[186-188]
Perutz und Mitarbeiter haben mittels DFT-Berechnungen die oxidative Addition von
C-F- und C-H-Bindungen in C6F6 und C6H6 an Ni0- und Pt0-Fragmenten des Typs
[M(H2PCH2CH2PH2)] und [Ni(PH3)2] untersucht.[189] Die C-H- bzw. C-F-Aktivierung erfolgt
dabei via exothermer Bildung eines η2-koordinierten Aren-Komplexes. Während in
Anwesenheit von C6F6 das Produkt der oxidativen Addition [NiL2(R)(X)] (X = H, F)
gegenüber des η2-koordinierten Intermediats 19.7 kcal/mol (L = H2PCH2CH2PH2) bzw. 26.1
kcal/mol (L = PH3) thermodynamisch bevorzugt ist, wurde in Gegenwart von C6H6 genau der
umgekehrte Fall beobachtet. Der C-H-Bindungsbruch ist im Vergleich zu dem η2koordinierten Intermediat stark endotherm (20.4 kcal/mol für L = H2PCH2CH2PH2 und 21.4
kcal/mol für L = PH3). Zu den Edukten [NiL2] und C6H6 ergibt sich eine gesamte
Energiedifferenz von +8.7 kcal/mol (cis, L = PH3) bzw. +9.7 kcal/mol (trans, L = PH3). Die
Abwesenheit einer thermodynamischen Triebkraft für die C-H-Aktivierung steht im Einklang
mit der experimentellen Beobachtung, dass nur ein η2-Aren-Komplex bildet wird.
Tabelle 22. Ausgewählte Bindungsenergien für die Reaktionen Ni(ECp*)3 + X-H → (ECp*)3Ni(X)(H)
und (ECp*)3Ni(X)(H) → (ECp*)3Ni(ECp*XH) (E = Al, Ga; X = C, Si) in kcal/mol
X-H
H-SiMe3
Caryl-H
M-H
90[190]
[190]
110
[174]
Ni-H
∑
M-X
61 ± 2[190]
Ni-H
61 ± 2[190]
[190]
Ni-Si
Ni-Caryl
76 ± 4[190]
+9±2
[191]
- 24 ± 2
40
Caryl-H
110
Al-H
68 ± 2
H5C2-AlEt2
66
Caryl-H
110[174]
Ga-H
< 65[190]
H5C2-GaEt2
63 ± 4
H3C-GaMe2
- 47 ± 6
[189]
[190]
- 18 ± 4
[190]
-5±4
50 ± 4
In Tabelle 22 sind ausgewählte Bindungsenergien für die C-H- und Si-H-Bindungsaktivierungen an Ni0-Komplexen der Form [Ni(ECp*)3] (E = Al, Ga) zusammengefasst.
Bedingt durch die ungenaue Datengrundlage lassen sich nur qualitative Trends beschreiben,
die jedoch mit den experimentellen Befunden im Einklang stehen. Während die oxidative
- 140 -
Ergebnisse
C-H- und Si-H-Bindungsaktivierung an Ni(AlCp*)3
________________________________________________________________________
Addition von H-SiR3 stark exotherm ist (rund -40 kcal/mol) ist auf Grundlage der Ergebnisse
aus der Arbeitsgruppe Perutz die aromatische C-H-Aktivierung an einem PR3-koordiniertem
Ni0-Zentrum endotherm (ca. +9 kcal/mol). Demzufolge trägt im Verlauf der Bildung von 24a
(Schema 35) die Wanderung der Phenylgruppe und des Hydrids auf eine AlCp*-Einheit
maßgeblich zur thermodynamischen Triebkraft der Reaktion bei. Die Ausbildung einer Al-Cund Al-H-Bindung kompensiert eine ursprüngliche endotherme Reaktion, so dass die
Reaktion nun insgesamt exotherm verläuft (ca. -24 kcal/mol). Außerdem wird eine vierte NiAl-Bindung ausgebildet (59 kcal/mol).[45, 46]
Bemerkenswerterweise
zeigt
GaCp*
gegenüber
[Ni(cod)2]
keine
ähnlich
differenzierten Reaktionsmuster. Bei den Reaktionen von [Ni(cod)2] mit GaCp* sowohl in
Benzol als auch in HSiEt3 entsteht ausschließlich der homoleptische Komplex
[Ni(GaCp*)4].[54] Vermutlich wirkt die bessere Löslichkeit und höhere Monomerisierungstendenz von [{GaCp*}6] im Vergleich zu [{AlCp*}4] der Generierung von reaktiven
Intermediaten wie [Ni(GaCp*)3] entgegen, da die Konzentration an Ligand im Fall von
GaCp* deutlich größer ist. Die kinetisch kontrollierten Aktivierungsreaktionen an diesem
Intermediat konkurrieren mit Substitutions- und Assoziationsreaktionen, die zu kinetisch
inertem [Ni(GaCp*)4] führen. Eine bessere Abstimmung der Konzentrationsverhältnisse der
Reaktionspartner könnte somit durchaus zu Aktivierungsreaktionen auch an [Ni(GaCp*)n]Fragmenten führen. Auf der anderen Seite können auch thermodynamische Faktoren nicht
gänzlich ausgeschlossen werden. Tabelle 22 zeigt zumindest die Tendenz, dass der
Energiegewinn aus der Knüpfung einer Ga-C- und Ga-H-Bindung im Vergleich zum
Aluminium kleiner ist. Ferner ist die Energie einer Ni-Ga-Bindung (47 kcal/mol) ca. 12
kcal/mol geringer als die einer Ni-Al-Bindung.[45, 46]
Abschließend sei noch auf einen interessanten Sachverhalt hingewiesen. Eine Vielzahl
von Bindungsaktivierungen wurde vor allem für die späten Übergangsmetalle der zweiten und
dritten Periode beobachtet (Ru, Os, Rh, Ir, Pd, Pt). Theoretische Rechnungen haben bei
Annahme eines unpolaren Dreizentren-Übergangszustands ergeben, dass die Aktivierungsenergien für die oxidative Addition einer C-H-Bindung von Methan für die späten Übergangsmetalle der ersten Periode (3d) 20-25 kcal/mol betragen. Im Fall der späten Übergangsmetalle
der zweiten Periode (4d) sind die Barrieren jedoch niedriger (13-27 kcal/mol).[192,
193]
Dagegen wird sowohl bei der Generierung homoleptischer Pd0-und Pt0-Komplexe vom Typ
[Ma(ECp*)b] (M = Pd, Pt; E = Al, Ga) als auch im Verlauf der Substitutionsreaktionen eine
Bindungsaktivierung nicht beobachtet. Eine Erklärung für dieses gegenläufige Reaktionsmuster steht noch aus.
- 141 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
4.2. Darstellung von homoleptischen d8-M-EIR-Komplexen: Aliphatische
C-H-Bindungsaktivierung in [Fe(AlCp*)5]
Im Rahmen dieser Arbeit wurden monomere tetraedrische Komplexe wie [M(AlCp*)4] (M =
Ni 12b, Pd 12e) und [M(GaCp*4)] (M = Pd 12c, Pt 12a) sowie die Cluster [Ma(ECp*)b] (13
und 15) erhalten, welche ebenfalls vierfach koordinierte Zentren M enthalten. Dagegen sind
homoleptische d8-Komplexe [M(EIR)5] (M = Fe, Ru) bislang unbekannt, wenngleich auch
quantenchemische Rechnungen an den Modellverbindungen [Fe(EMe)5] die Existenz von
trigonal-bipyramidalen d8-Metall-Komplexen der niedervalenten Gruppe-13-Liganden EIR
nahe legen.[45, 46] Zwar wurde über das monosubstituierte [(CO)4Fe(AlCp*)],[49] ein Derivat
des klassischen Pentacarbonyleisens, schon vor einiger Zeit berichtet, die Frage wie hoch die
Koordinationszahl n im allgemeinen, homoleptischen Fall [M(EIR)n] tatsächlich werden kann,
blieb seitdem jedoch offen: ist n = 5 möglich, vielleicht auch n = 6, oder sogar mehr? Steht
nicht der Platzbedarf von ECp* (Tolman-Winkel von 112° für E = Ga)[16] der Stabilität von
Komplexen [M(ECp*)n] mit n > 4 eigentlich entgegen? Das Beispiel [(CO)3M(ECp*)3] (M =
Mo, W; E = Al, Ga) zeigte immerhin, dass drei ungestörte ECp*-Liganden in facialer
Anordnung möglich sind (Kapitel 2.1). Auf der Suche nach einem synthetischen Zugang zu
[Fe(AlCp*)5] wurde in Zusammenarbeit mit der Arbeitsgruppe Zenneck die moderat
substitutionslabile Fe0-Quelle [(η6-C6H5CH3)Fe(η4-C4H8)][194-196] ausgewählt.
4.2.1. Darstellung und Charakterisierung von [Fe(AlCp*)5]
Darstellung der zwei- und dreifach-aktivierten Verbindung [Fe(AlCp*)5] (27, 28)
Wird gemäß Schema 36 eine rote Lösung von [(η6-C6H5CH3)Fe(η4-C4H8)] mit 6 Äquivalenten
AlCp* in Toluol auf 80°C erwärmt, bildet sich schon nach kurzer Zeit eine orange Lösung,
die nach Aufarbeitung einen gelben Feststoff liefert.
Die 1H-NMR spektroskopischen Daten deuten auf ein Gemisch zweier Produkte (27
und 28) im Verhältnis von ca. 4:1 hin, welche aber nicht mit einer Struktur [Fe(AlCp*)5], die
ausschließlich terminal koordinierte ungestörte AlCp*-Liganden enthalten, in Einklang
stehen. Charakteristische Resonanzen bei hohem Feld (δ = -18 bis -20 ppm) und die
komplexe Vielfalt bzw. Aufspaltung der Cp*-Signale im aliphatischen Bereich deuten auf
- 142 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
eine Bindungaktivierung der organische Hülle, d.h. der Methyl-Gruppen.
Al
Fe
6 AlCp*
C6H6, 70°C
- C6H5Me
- Al
in geringen
Mengen
Fe
Al
Al
Al
Al
H
H
Al
Al
+
H2C
H Fe
Al
CH2
C
H2
H
H
Al
Al
CH2
C
H2
27
28
75%
25%
Schema 36. Darstellung der Isomere [Fe(AlCp*)5] (27 und 28)
Blitz-Kristallisation des Rohproduktes in Toluol bei -30°C (wenige Minuten) liefert
Verbindung 27 in Form von gelben prismatischen Einkristallen bereits nahezu analysenrein in
reproduzierbaren Ausbeuten von 35 %. Langsames Umkristallisieren ergibt wohlausgebildete
Einkristalle von 27. Längere Kristallisationszeiten der Mutterlauge erhöhen den Anteil an 28
im Feststoff. Mehrmaliges fraktioniertes Kristallisieren liefert definierte Einkristalle, die 28
zu ca. 70 % neben 30 % 27 enthalten.
Interessanterweise reagiert der Fe0-Precursor nicht mit GaCp* oder InCp*. Die Fe-GaBindungsenergie reicht offenbar nicht aus, um die Olefinliganden zu substituieren.
Entsprechend dieser Reaktivitätsabstufung AlCp* >> GaCp* > InCp* überrascht es nicht,
dass auch InCp* gegenüber der Fe0-Quelle keinerlei Reaktivität zeigt. Ferner sind die
Verbindungen 27 und 28 nicht ineinander umwandelbar. So lässt sich reines 27 durch
mehrstündiges Kochen in Toluol bei 110°C nicht in 28 umwandeln. Auch die Wahl anderer
Lösungsmittel wie Hexan oder HSiEt3 wirkt sich nicht auf die Produktverteilung von 27 und
28 aus.
- 143 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Strukturelle Charakterisierung der zweifach-aktivierten Verbindung [Fe(AlCp*)5]
(27)
Für die Röntgenstrukturanalyse geeignete Einkristalle von 27 können durch Blitzkristallisation einer Toluol-Lösung des Rohproduktes und anschließender Umkristallisation
des gelben Feststoffs in Toluol erhalten werden. Die Molekülstruktur von 27 ist in Abbildung
35 dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 23 angeführt.
Abbildung 35. Molekülstruktur von [FeH2(AlCp*)2{(η1-Cp*Al)-CH2(η2-C5Me4)Al-CH2(η5-C5Me4)Al}] (27)
im Kristall.
Die Einkristallstrukturanalyse von Produkt 27 belegt die nach NMR-Spektroskopie und
Elementaranalyse
vermutete
FeAl5-Stöchiometrie.
Zwei
CH3-Gruppen
von
zwei
verschiedenen Cp*-Ringen sind CH-aktiviert. Die beiden resultierenden Methyleneinheiten
sind an benachbarte Al-Atome zweier AlCp*-Liganden (Al(4) und Al(5)) gebunden. Die
abgespaltenen H-Atome verbrücken diese Al-Atome mit dem zentralen Fe-Atom. Es resultiert
ein ungewöhnlicher, tridentater Chelat-Ring der Form {(η1-Cp*Al)-CH2-(η2-C5Me4Al)-CH2(η5-C5Me4)Al} mit drei verschiedenen Haptizitäten (η1, η2 und η5) für die Cp*-Ringe. Das
- 144 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Eisenzentrum ist dabei verzerrt trigonal-bipyramidal koordiniert, d.h. die erwartete Grundstruktur [Fe(AlCp*)5] bleibt weitgehend erhalten. Die Winkelsumme der äquatorialen
Positionen Al(1), Al(2) und Al(4) um das Fe-Atom von 359.03° entspricht einer trigonal
bipyramidalen Umgebung. Die beiden axialen Positionen sind von den beiden AlCp*Einheiten Al(3) und Al(5) besetzt. Die Hydridliganden H(1) und H(2) wurden in
verbrückenden Positionen zwischen dem Fe-Zentrum und den Al-Atomen (Al(4) und Al(5))
lokalisiert und in der abschließenden Verfeinerung berücksichtigt (Fe(1)-H(1) 1.59(8) Å,
Fe(1)-H(2) 1.46(7) Å, Al(4)-H(1) 1.88(8) Å, Al(5)-H(2) 1.89(7) Å). Der von 180° abweichende Winkel Al(3)axial-Fe-Al(5)axial (160.09(5)°) geht vermutlich auf die Hydrid-Brücke
Al(5)-H(2)-Fe(1) zurück. Vergleichskomplexe mit Fe-H-Al-Strukturelementen sind nicht dokumentiert. Typische Fe-H-Fe-Bindungslängen liegen im Bereich von 1.5-1.8 Å und die AlH-Abstände in 27 sind dem in [Ni(AlCp*)3(HAlCp*Ph)] (24b: Al-H 1.76(3) Å) sehr ähnlich.
Tabelle 23. Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [FeH2(AlCp*)2{(η1Cp*Al)-CH2(η2-C5Me4)Al-CH2(η5-C5Me4)Al}] (27)
Fe(1)-Al(1)
2.2124(15)
Cp*Zentrum-Al(1)
1.914
Fe(1)-Al(2)
2.2419(15)
Cp*Zentrum-Al(3)
1.891
Fe(1)-Al(3)
2.2404(15)
C(42)-C(43)
1.457(6)
Fe(1)-Al(4)
2.3686(15)
C(43)-C(44)
1.378(6)
Fe(1)-Al(5)
2.3272(14)
C(25)-C(30)
1.490(6)
Fe(1)-H(1)
1.59(8)
C(34)-C(39)
1.492(6)
Fe(1)-H(2)
1.46(7)
Al(1)-Fe(1)-Al(2)
90.44(6)
Al(4)-H(1)
1.88(8)
Al(1)-Fe(1)-Al(4)
118.07(6)
Al(5)-H(2)
1.89(7)
Al(2)-Fe(1)-Al(4)
150.52(6)
Al(4)-C(30)
2.030(5)
Al(3)-Fe(1)-Al(5)
160.09(5)
Al(4)-C(34)
2.164(4)
Cp*Zentrum-Al(1)- Fe(1)
161.00
Al(4)-C(35)
2.245(4)
Cp*Zentrum-Al(2)- Fe(1)
172.22
Al(5)-C(39)
1.990(4)
Cp*Zentrum-Al(3)- Fe(1)
149.43
Al(5)-C(42)
2.113(4)
Al(1)-Fe(1)-Al(2)-Al(4)
165.9(5)
Die Fe-Al-Bindungslängen entsprechen den formal unterschiedlichen Oxidationsstufen der
Al-Zentren: AlI für AlCp* und AlIII für die Fragmente [HAl(Cp*)(CH2C5Me4)]. Die Fe-AlIAbstände liegen im Bereich um 2.2124(15)-2.2419(15) Å. Die Fe-AlIII-Abstände sind als
Folge der erhöhten Koordinationszahl und entsprechend veränderten elektronischen Situation
demgegenüber um rund 10 pm aufgeweitet (2.3272(14) und 2.3686(15) Å). Während die
Cp*-Ringe an Al(1), Al(2) und Al(3) eindeutig η5-koordiniert sind, wird für den C5-Ring an
- 145 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Al(4) ein η2- und für Al(5) ein η1-Koordinationsmodus gefunden. Die CH-aktivierten MethylGruppen an Al(3) und Al(4) sind nur leicht aus der Ringebene heraus gebogen (rund 15°) und
zeigen auch ansonsten keine besonderen Deformationen (Caryl-CH2 1.49 Å; Caryl-CH3 1.50 Å).
Die Al-CH2-Distanzen zu den benachbarten AlCp*-Liganden (Al(5)-C(39) 1.990(4) Å, Al(4)C(30) 2.030 Å) sind im Vergleich zu den Al-C-Distanzen der η1- bzw. η2-Cp*-Ringe mit
2.113(4) Å (Al(5)-C(42)) und 2.164(4) Å (Al(4)-C(34)) leicht verkürzt. Die Winkel
Cp*Zentrum-Al-Fe der nicht an der Aktivierung beteiligten AlCp*-Gruppen weichen kaum von
der Linearität ab (161.00° Al(1) und 172.22° Al(2)), wohingegen für die Cp*Al(3)-Einheit
eine merkliche Verzerrung beobachtet wird (149.43°). Die Cp*Zentrum-Al-Abstände (1.8911.914 Å) liegen im Bereich des freien, monomeren Liganden in der Gasphase (2.015 Å)[128]
und lassen demnach auf kaum polare Fe-Al-Bindungen schließen.
Spektroskopische
Charakterisierung
der
zweifach-aktivierten
Verbindung
[Fe(AlCp*)5] (27)
Das 1H-NMR-Spektrum von 27 in C6D6 bei RT zeigt zwei intensive Singuletts bei 2.20 (15H)
und 1.82 ppm (30H) für die C5Me5-Gruppen an Al(5) (η1-Cp*) sowie Al(1) und Al(2) (η5Cp*). Die Methylgruppen der beiden aktivierten Cp*-Ringe rufen vier schwächere Signale
mit gleicher Intensität bei 2.23 (6H), 2.09 (6H), 1.88 (6H) und 1.63 ppm (6H) hervor. Für die
verbrückenden CH2-Gruppen werden zwei Singuletts bei 1.04 (2H, CH2) und 0.76 ppm (2H,
CH2) detektiert. Zusätzlich wird ein hydridisches Signal bei -19.00 ppm (s, 2H) für die beiden
H-Atome H(1) und H(2) beobachtet. Das
13
C-NMR zeigt für die Aryl-C-Atome der
verschiedenen Cp*-Einheiten insgesamt acht Signale bei 126.9, 123.9, 118.9 (η1-Cp*), 118.2,
114.8 (η5-Cp*), 112.7, 112.6 und 110.5 ppm. Die verbrückenden CH2-Gruppen rufen zwei
breite Signale bei 17.3 und 15.1 ppm hervor. Entsprechend dem 1H-NMR werden für die
Methylgruppen der Cp*-Liganden sechs Signale bei 14.3 (η1-Cp*), 12.3, 12.2, 11.2, 11.1,
11.0 (η5-Cp*) detektiert. Das 27Al-NMR-Spektrum weist nur ein sehr breites Signal bei -2.5
ppm auf ([(CO)4Fe(AlCp*)]: δ = 0.4 ppm),[49] möglicherweise sind die übrigen
27
Al-
Resonanzen durch das breite Probenkopfsignal (+66.8 ppm) verdeckt. Im Temperaturbereich
von 25°C bis 80°C in C6D6 konnte keine Veränderung der Signale beobachtet werden. Daher
erscheint eine reversible C-H-Bindungsaktivierung als Ursache für die Fluktionalität der
Hydride in Lösung eher unwahrscheinlich. Offenbar fluktuieren die Hydride zwischen den
- 146 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Zentralatomen, was auch mit den quantenchemischen Rechnungen im Einklang steht.
Tieftemperatur-Experimente konnten im Zuge dieser Arbeit nicht durchgeführt werden. Es ist
jedoch anzunehmen, dass Komplex 27 entsprechend den vergleichbaren Rhodiumclustern (s.
Kapitel 1.2) einen auch bei tiefer Temperatur schnellen Austausch der anionischen Liganden
zeigt, was auch durch die DFT-Analysen bestätigt wird.
Strukturelle Charakterisierung der dreifach-aktivierten Verbindung [Fe(AlCp*)5]
(28)
Der Einkristallstrukturanalyse eines Mischkristalls von 27 und 28 zufolge liegt eine
statistische Verteilung der beiden Komplexe auf den Positionen in der Elementarzelle vor (27
30 %, 28 70 %). Überstrukturreflexe sind nicht erkennbar und die Struktur lässt sich ausreichend gut als Fehlordnung beschreiben. Die Molekülstruktur von 28 ist in Abbildung 36
dargestellt; ausgesuchte Bindungslängen und –winkel sind in Tabelle 24 angeführt.
Abbildung 36. Molekülstruktur von [FeH2(AlCp*){(η1-Cp*Al)-CH2(η2-C5Me4)Al-CH2(η2-C5Me4)Al-CH2(η5C5Me4)}] (28) im Kristall.
- 147 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Die Molekülstruktur von 28 zeigt ein trigonal bipyramidal koordiniertes Eisenzentrum mit
ähnlichen Verzerrungen wie in 27. Allerdings sind nicht zwei, sondern jetzt drei Methyl-CHBindungen von drei verschiedenen Cp*-Ringen aktiviert und die Methylengruppen, wie im
Falle von 27, an benachbarte AlCp*-Liganden (Al(2), Al(3) und Al(4)) über Al-C-Bindungen
koordiniert. Es entsteht ein tetradentater Chelat-Ligand der Form {(η1-Cp*Al)-CH2(η2C5Me4)Al-CH2(η2-C5Me4)Al-CH2(η5-C5Me4)}. Die axialen Positionen der [Fe(AlCp*)5]Grundstruktur werden von den beiden AlCp*-Einheiten Al(2) und Al(4) (153.78(7)°) und die
drei äquatorialen Positionen von den AlCp*-Liganden (Al(1), Al(3) und Al(5)) besetzt. Die
Winkelsumme der äquatorialen Positionen beträgt 359.95° und die Liganden weichen nur
geringfügig (ca. 5°) von der Koplanarität ab.
Tabelle 24. Ausgewählte Bindungsabstände (Å) und Winkel (°) für den Komplex [FeH2(AlCp*){(η1Cp*Al)-CH2(η2-C5Me4)Al-CH2(η2-C5Me4)Al-CH2(η5-C5Me4)}] (28)
Fe(1)-Al(1)
2.210(2)
C(12)-C(13)
1.384(7)
Fe(1)-Al(2)
2.3474(19)
C(13)-C(14)
1.455(7)
Fe(1)-Al(3)
2.3731(15)
C(23)-C(28)
1.520(7)
Fe(1)-Al(4)
2.333(2)
C(34)-C(39)
1.506(3)
Fe(1)-Al(5)
2.215(2)
C(41)-C(46)
1.542(3)
Al(2)-C(14)
2.107(5)
Al(1)-Fe(1)-Al(3)
123.65(7)
Al(2)-C(28)
2.011(5)
Al(1)-Fe(1)-Al(5)
88.52(7)
Al(3)-C(23)
2.144(5)
Al(3)-Fe(1)-Al(5)
147.78(7)
Al(3)-C(24)
2.259(6)
Al(2)-Fe(1)-Al(4)
153.78(7)
Al(3)-C(39)
1.946(8)
Al(2)-Fe(1)-Al(5)
102.30(8)
Al(4)-C(34)
2.089(6)
Al(2)-Fe(1)-Al(3)
82.88(6)
Al(4)-C(35)
2.244(6)
Al(3)-Fe(1)-Al(4)
81.18(7)
Al(4)-C(46)
2.221(9)
Cp*Zentrum-Al(1)- Fe(1)
162.29
Cp*Zentrum-Al(1)
1.889
Cp*Zentrum-Al(5)- Fe(1)
162.24
Cp*Zentrum-Al(5)
1.862
Al(1)-Fe(1)-Al(2)-Al(4)
176.49(5)
Die Hydridliganden konnten infolge der Fehlordnungsproblematik nicht lokalisiert und
verfeinert werden. Die Fe-Al-Abstände (AlI 2.21 Å, AlIII 2.33-2.37 Å) und die
Haptizitätsänderungen der Cp*-Ringe (η1, η2, η2 und η5) sind denen von 27 sehr ähnlich und
daher auch indikativ für Hydridbrücken. Ferner führen die verbrückenden CH2-Gruppen zu
verhältnismäßig kleinen Al-Fe-Al-Winkel (Al(2), Al(3) und Al(4)) von rund 82° und
vergleichsweise kurzen Al-Al-Bindungslängen von 2.96-3.12 Å, während der Winkel Al(5)- 148 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Fe(1)-Al(2) mit 102.30(8)° und die Bindung Al(2)-Al(5) (3.55 Å) deutlich größer ist. Insofern
ist vermutlich ein vierfach-aktiviertes Produkt wegen sterischer Restriktionen instabil und
wird auch bei der Synthese von 27 und 28 nicht beobachtet. Allerdings sollte einer solchen
Situation im Falle von (bislang unbekannten) oktaedrischen Komplexen des Typs
[M(AlCp*)6] wohl nichts Grundsätzliches im Wege stehen. Ferner unterliegt die C-HAktivierung an Al(4) im Vergleich zu den Aktivierungen an Al(2) und Al(3) anscheinend
einer erhöhten sterischen Belastung. Die CH-aktivierten Methyl-Gruppen an Al(3) und Al(4)
sind nur leicht aus der Ringebene heraus gebogen (ca. 15°), während an Al(5) eine
Deformation von 25° detektiert wird. Die Bindungslänge C(41)aryl-CH2 ist im Vergleich zu
den übrigen Caryl-CH2- und Caryl-CH3-Distanzen rund 4 pm aufgeweitet. Der Al(4)-C(46)Abstand (2.221(9) Å) ist merklich länger als die beiden anderen Al-CH2-Distanzen (Al(2)C(28) 2.011(5) Å, Al(3)-C(39) 1.946(8) Å). Diese abweichenden Al-C- und C-C-Distanzen
können aber auch aus der Fehlordnungsproblematik resultieren, die insbesondere für das
Brückenatom C(46) beträchtlich sind. So kommt eine zusätzliche sterische Beanspruchung
nicht in dem Winkel Cp*Zentrum-Al-Fe zum Ausdruck (162.29° Al(1) und 162.24° Al(5)). Die
Cp*Zentrum-Al-Abstände (1.862 und 1.889 Å) entsprechen denen in Komplex 27.
Spektroskopische
Charakterisierung
der
dreifach-aktivierten
Verbindung
[Fe(AlCp*)5] (28)
Die spektroskopische Charakterisierung von 28 mittels 1H-NMR erwies sich als sehr
schwierig, da trotz beträchtlicher Anreicherung von 28 im Produktgemisch eine Vielzahl von
kleinen Signalen der aktivierten Cp*-Ringe (insgesamt 12 unterschiedliche Methylgruppen)
zu erkennen sind, die sich sowohl untereinander als auch mit denen von 27 überlagern.
Charakteristisch sind zwei Singuletts bei 2.02 (15H, η5-Cp*Al(1)) und 1.77 ppm (15H, η1Cp*Al(5)) der nicht aktivierten Cp*-Gruppen, ein breites Multiplett im Bereich von 1.03-0.75
ppm (6H) für die verbrückenden CH2-Einheiten sowie ein hydridisches Signal für die drei HAtome bei -18.17 ppm (3H).
- 149 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
4.2.2. Quantenchemische Berechnung zu der Verbindung [Fe(AlCp*)5] (27)
Zur genaueren Analyse der Struktur und der Bindungsverhältnisse in 27 wurden in der
Arbeitsgruppe Frenking quantenchemische Rechnungen[197] durchgeführt. Diese ergaben eine
sehr gute Übereinstimmung der berechneten mit den experimentellen Strukturparametern von
27 (Tabelle 25). So sind die berechneten Fe-Al-Bindungsabstände im Vergleich zu den
experimentell bestimmten Werten nur geringfügig aufgeweitet (< 4 pm).[198] Auch die Winkel
Al-Fe-Al zeigen eine gute Übereinstimmung.
Tabelle 25. Vergleich der berechneten und experimentell ermittelten Bindungslängen und Winkel in
[Fe(AlCp*)5] (27)
Rechnung (27M)
Experiment (27)
Fe–Al(6)
2.365
2.3272(14)
Fe–Al(13)
2.388
2.3686(15)
Fe–Al(24)
2.248
2.2404(15)
Fe–Al(25)
2.260
2.2419(15)
Fe–Al(46)
2.214
2.2124(15)
Fe–H(57)
1.547
1.59(8)
Fe–H(57)
1.566
1.46(7)
Al(6)–C(7)
2.023
1.990(4)
Al(13)–C(14)
2.066
2.030(5)
Al(6)–H(58)
1.876
1.89(7)
Al(13)–H(58)
2.387
2.34(7)
Al(13)–H(57)
2.156
1.88(8)
Al(46)–H(57)
2.103
2.18(8)
Al(24)–H(57)
2.331
2.55(8)
Al(46)–Fe–Al(25)
91.772
90.44(6)
Al(46)–Fe–Al(13)
113.856
118.07(6)
Al(25)–Fe–Al(13)
153.677
150.52(6)
Al(24)–Fe–Al(6)
154.360
160.09(5)
Al(46)–Fe–Al(25)–Al(13)
167.171
165.9(5)
Übersetzung der Nomenklatur in Fe(AlCp*)5 (27): Al(1) = Al(46), Al(2) = Al(25), Al(3) = Al(24), Al(4) =
Al(13), Al(5) = Al(6), H(1) = H(57), H(2) = H(58)
Allerdings weist die Modellverbindung 27M eine bemerkenswerte Besonderheit auf. Die
Lage eines der beiden überbrückenden H-Atome wird in der Rechnung etwas anders
ausgewiesen als im Experiment. Das Atom H(57) ist nach den Rechnungen eher ein
- 150 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
klassisches Hydrid-Atom, das sogar etwas näher am Al(46) als am Al(13) liegt (Abbildung
37). Dies darf als Hinweis auf eine sehr flache Potentialhyperfläche für die H-Wanderung
gewertet werden, was eine Unterscheidung zwischen terminalem Hydrid (klassisch) und
verbrückender Struktur obsolet macht, zumal es sich um dynamische Gebilde handelt.[199]
Eine bemerkenswerte Aussage der quantenchemischen Berechnungen resultiert aus
einem Vergleich von 27M mit einer ungestörten homoleptischen [Fe(AlCp*)5]-Struktur. Eine
Struktur [Fe(AlCp*)5] mit fünf Fe-Al-Bindungen und intakten Cp*-Liganden ohne
überbrückende H-Atome ist kein Energieminimum und demzufolge instabil. Die Geometrieoptimierung einer Struktur mit lokaler D3h-Symmetrie (Startgeometrie) am Eisenzentrum
ohne Symmetrieeinschränkung führt zu 27M, dessen Frequenzberechnung keine imaginären
Moden ergibt. Eine Berechnung mit erzwungener Cs-Symmetrie führt zu einer Struktur mit
intakten CH3-Gruppen aber abgekippten Cp*-Ringen, die 22.0 kcal/mol höher als das
Energieminimum liegt. Die Triebkraft für die Ausbildung der H-überbrückten Struktur ist also
erheblich.
Abbildung 37. Optimierte Struktur der Modellverbindung [Fe(AlCp*)5] (27M)
- 151 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Tabelle 26. NBO-Analyse von [Fe(AlCp*)5] (27M) für ausgewählte Atome: Partialladungen
Al(6)
1.159
Fe
-0.315
Al(13)
1.241
H(58)
-0.165
Al(24)
0.922
H(57)
-0.162
Al(25)
0.750
C(7)
-1.060
Al(46)
0.939
C(14)
-1.040
Die Analyse der elektronischen Ladungsverteilung mithilfe der NBO-Methode[200] ergibt
deutliche Unterschiede zwischen eher klassischen und überbrückenden Atomen (Tabelle 26).
Die Methylen-Kohlenstoffatome C(7) (-1.06) und C(14) (-1.04) sind stärker negativ geladen
als die C-Atome der Methylgruppen (-0.64 bis -0.67). Die mit C(7) und C(14) verbundenen
Al-Atome Al(6) (+1.16) und Al(13) (+1.24) tragen dementsprechend eine stärker positive
Partialladung als Al(24) (+0.92), Al(25) (+0.75) und Al(46) (+0.94). Die überbrückenden HAtome H(57) (-0.17) und H(58) (-0.16) sind erwartungsgemäß negativ geladen und daher
eindeutig hydridisch, während die anderen H-Atome schwach positiv geladen sind.
Zusammenfassung und Diskussion
In Analogie zur klassischen Darstellung von [M(EIR)4] via Ligandensubstitution ausgehend
von [M(cod)2] (M = Ni, Pt) konnten durch Umsetzung von [(η6-C6H5CH3)Fe(η4-C4H8)] mit
AlCp* homoleptische Fe0-Komplexe mit der Summenformel [Fe(AlCp*)5] (27 und 28)
erhalten werden. Die Einkristallröntgenstrukturanalyse zeigt in beiden Fällen ein verzerrt
trigonal bipyramidales Eisenzentrum, wobei die AlCp*-Liganden nicht ungestört terminal
koordiniert sind, sondern es erfolgt eine zwei- bzw. dreifache intramolekulare aliphatische CH-Aktivierung von zwei bzw. drei verschiedenen Cp*-Gruppen unter Ausbildung eines
ungewöhnlichen tri- bzw. tetradentaten Chelat-Liganden. GaCp* und InCp* reagieren infolge
der geringeren σ-Donorstärke nicht mit dem Fe0-Precursor, wodurch das Potential von AlCp*
als geeigneter Ligand in Aktivierungsreaktionen erneut unterstrichen wird.
Quantenchemische Berechnungen an 27 ergaben eine sehr gute Übereinstimmung der
berechneten (27M) mit den experimentellen Strukturparametern. Überraschenderweise ist
eine Struktur [Fe(AlCp*)5] mit fünf Fe-Al-Bindungen und nicht-aktivierten Cp*-Liganden
kein Energieminimum.
Der Mechanismus zur Generierung von Komplex 27 und 28 ist bislang unklar. Da die
Verbindungen 27 und 28 nicht ineinander umwandelbar sind, kann vermutet werden, dass
- 152 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
reaktive unterkoordinierte Intermediate [Fe(AlCp*)n] (n < 5) auf dem Weg zu 27 bzw. 28 für
die intramolekularen Bindungsaktivierungen verantwortlich sind. Jedoch sind der
Mechanismus bzw. die kooperativen Rollen der beteiligten Metallatome im Detail noch
ungeklärt und verlangen nach eingehenden experimentellen und theoretischen Analysen.
Grundsätzlich stehen zwei Möglichkeiten zur Auswahl:
1) Bindungsaktivierung an einem koordinativ ungesättigten Eisenzentrum
Entsprechend der (aromatischen) C-H- und Si-H-Bindungsaktivierung im System Ni/Al
(Kapitel 4.1) können die C-H-Spaltungen an dem unterkoordinierten Eisenzentrum einer
Spezies [Fe(AlCp*)n] (n < 5) über das Intermediat [Fe(H)(C5Me4CH2)(AlCp*)n-1] verlaufen.
Die anschließende Wanderung der Methylengruppe auf eine AlCp*-Einheit unter Oxidation
des Al-Zentrums und Ausbildung einer Al-C-Bindung sowie Koordination weiterer
Äquivalente AlCp* würde sicherlich zum einen die Ringspannung des Systems
[HFeAl(C5Me4)-CH2] reduzieren und zum anderen zur thermodynamischen Triebkraft der
Reaktion beitragen (Schema 37).
Al
Al
AlCp*
Fe
Al
Fe
H
Al
H
27
Al
CH2
C
H2
n AlCp*
(n < 5)
m AlCp*
(n + m= 5)
(AlCp*)n-1
H2C
Fe
Al
H
(AlCp*)n-3
(AlCp*)n-2
*CpAl
H2C
H
Fe
Al
H
*CpAl
H2C
H
Fe
Al
CH2
Al
Schema 37. Möglicher Mechanismus zur Bildung von 27: C-H-Spaltung am Eisenzentrum
- 153 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Der Vektor Cp*Zentrum-Al-Fe muss während dieses Reaktionsverlaufes stark abgewinkelt
werden (< 150°), um in einen Bereich bindender Wechselwirkungen der Methyl-Cp*Gruppen mit dem Fe-Zentrum zu gelangen. Darüber hinaus sollte eine η5-Koordination der
Cp*-Einheit erhalten bleiben, da sich die Methylgruppen bei einer Haptizitätsänderung
η5→η3→η1 von dem Zentralatom entfernen. Demzufolge ist dieser Weg sehr unwahr-
scheinlich.
Me2P
PMe3
Me3P
Fe
Me3P
PMe3
Fe
CH 2
Me3P
PMe3
H
PMe3
Schema 38. Isomerengleichgewicht zwischen [Fe(PMe3)4] und [(PMe3)3Fe(H){Me2PCH2}]
Dennoch sei erwähnt, dass diese Form von Cyclometallisierungsreaktionen an koordinativ
ungesättigten Eisenkomplexen nicht ungewöhnlich ist. So konnten Rathke und Muetterties
sowie Karsch et al. zeigen, dass Tetrakis(trimethylphosphan)eisen0 im Isomerengleichgewicht mit dem EisenII-Hydridkomplex [(PMe3)3Fe(H){Me2PCH2}] steht. In Lösung liegt
infolge einer intramolekularen C-H-Spaltung weitgehend der FeII-Komplex vor (Schema
38).[201, 202]
2) Bindungsaktivierung am elektrophilen Aluminiumzentrum
Der zweite mögliche Mechanismus auf dem Weg zu 27 und 28 beinhaltet eine C-H-Spaltung
am Al-Zentrum. So dürfte von einem qualitativen Standpunkt aus klar sein, dass durch
Koordination des sehr potenten σ-Donors und vergleichsweise schwachen π-Akzeptors
AlCp* die Nukleophilie am Fe-Zentrum und die Elektrophilie des Al-Zentrums ganz
erheblich steigt. Der M→EIR π-Rückbindung kommt insbesondere für R = Cp* eine eher
geringe Bedeutung zu.[45,
46]
Die Positivierung der Atome E infolge Koordination und
Ausbildung einer polaren Mδ--Eδ+-Bindung ist durch quantenchemische Rechnungen aus der
Arbeitsgruppe Frenking allgemein belegt. Demnach ist die Präkoordination einer C-HBindung am Al-Zentrum unter Ausbildung einer side on gebundenen C-H-Einheit begünstigt.
Das nukleophile Fe0-Zentrum kann dann die für die C-H-Bindungsspaltung erforderliche
Rückdonierung von Elektronendichte in die C-H-σ*-Orbitale beisteuern (Schema 39).
- 154 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Al
Al
AlCp*
Fe
Al
Fe
H
H
27
Al
CH2
Al
C
H2
n AlCp*
(n < 5)
m AlCp*
(n + m= 5)
(AlCp*)n-2
*CpAl
H
C H
H
(AlCp*)n-4
(AlCp*)n-2
Fe
*CpAl
Al
H2C
H
AlCp*
*CpAl
Fe
H2C
Al
H
Fe
H
Al
Al
C
H
H
Schema 39. Möglicher Mechanismus zur Bildung von 27: C-H-Spaltung am Aluminiumzentrum
Bisher ist ein derartiger Reaktionsverlauf in der Literatur nicht dokumentiert. Jedoch deuten
jüngste Ergebnisse aus unserer Arbeitsgruppe auf die Möglichkeit einer Bindungsspaltung am
Gruppe-13-Metallzentrum E hin. So wird bei der Umsetzung von [Cp*Rh(Me)2(L)] (L =
dmso, py) mit ECp* (E = Al, Ga) unter Ausbildung der zwitterionischen Spezies
[Cp*Rh(CpMe4EMe3)] eine Caryl-CH3-Bindungsaktivierung beobachtet (Schema 40).[203]
ECp*
L
CH3
-L
*CpE
CH3
CH3
CH3
L = dmso, Pyridin
Insertion
C-C-Aktivierung
H3C
H3C
E(CH3)3
E
H3C
Schema 40. Möglicher Mechanismus zur Bildung von [Cp*Rh(CpMe4EMe3)]
- 155 -
Ergebnisse
C-H-Bindungsaktivierung in Fe(AlCp*)5
________________________________________________________________________
Dabei konnte der Komplex [Cp*Rh(Me)2(ECp*)] als eine von mehreren Zwischenstufen
isoliert werden. Theoretische Berechnungen und spektroskopische Analysen des Reaktionsverlaufes legen eine CC-Aktivierung am Gruppe-13-Metallzentrum E und nicht am RhZentrum nahe. Ferner zeigt dieses Beispiel, dass Bindungsaktivierungen nicht nur auf
Komplexfragmente des Typs [(LnM)(AlCp*)b] bzw. [M(AlCp*)n] beschränkt sind, sondern
auch GaCp* zur Aktivierung befähigt ist. Man darf wohl gespannt sein, welche
außerordentlichen Reaktionen diese „exotischen“ Liganden noch erlauben werden.
- 156 -
Zusammenfassung
___________________________________________________________________________________________________________
IV. Zusammenfassung
Die vorliegende Arbeit befasst sich mit der Synthese und Charakterisierung von
Übergangsmetall-substituierten Aluminium-, Gallium- und Indiumverbindungen in der
niedervalenten
Oxidationsstufe
+I.
In
der
Vergangenheit
beschränkte
sich
das
Synthesepotential niedervalenter Gruppe-13-Metallverbindungen EIR (E = Al, Ga, In; R =
Cp*, C(SiMe3)3) in der Koordinationschemie an d-Metallzentren M hauptsächlich auf
Übergangsmetallcarbonyle [(CO)nMa], wobei Konstitution und strukturelle Charakteristika
EIR-substituierter Carbonylcluster in direktem Bezug zu klassischen Metallcarbonylen
stehen.[7, 8] Im Rahmen dieser Arbeit wurden hingegen überwiegend neue carbonyl- und damit
π-Akzeptor-Ligand-freie Komplexe der Form [LnMa(EIR)b] und [Ma(EIR)b] erschlossen.
Dabei wurde die eingangs zitierte Vermutung bestätigt, dass den niedervalenten Liganden EIR
im Rahmen der Koordinationschemie an d-Metallzentren ein größeres Potential hinsichtlich
Reaktivität (Substitutionsreaktionen und Bindungsaktivierungen) sowie ein reichhaltiges
Spektrum an Clusterstrukturen zukommt, als der formale Vergleich mit CO oder Phosphanen
auf den ersten Blick vermuten lässt. Als allgemeine synthetische Zugänge zur Knüpfung von
M-E-Bindungen erwiesen sich zum einen Insertionsreaktionen in Metall-Metall- und MetallHalogen-Bindungen und zum anderen die Substitution leicht verdrängbarer Liganden.
1. Insertionsreaktionen von EIR in Metall-Metall- und Metall-Halogenbindungen
Vergleichbar mit der eingehend untersuchten Cycloaddition von Singulett-Carbenen an
ungesättigte C-C-Bindungen erlaubt der carbenoide Charakter von EIR eine Insertion von
GaCp* in die Mo2- bzw. W2-Dreifachbindung von [(Cp)(CO)2M≡M(CO)2(Cp)] unter Bildung
der Insertionsprodukte [{(OC)2(Cp)Mo(µ2-(η1-GaCp*)}2] (M = Mo 1a, W 1b). Erstmalig
wurde ein η1-Koordinationsmodus der verbrückenden GaCp*-Liganden beobachtet, der
vermutlich eine Konsequenz sterischer Überladung in dem Molekül ist.
Dagegen sind Insertionsreaktionen in Metall-Halogen-Bindungen wesentlich subtiler
und schwieriger zu steuern. In Abhängigkeit von der Stöchiometrie und den Reaktionsbedingungen wurde in der Reaktion von [{Cp*RhCln}2] (n = 1, 2) und EIR (E = Ga, In) eine
Vielfalt an Insertionsprodukten erhalten. Die Reaktion von [{RhCp*Cl2}2] mit einem
Überschuss an EIR führt zu monomeren Insertionsprodukten [Cp*Rh(ER)3Cl2] (2, 3), die
- 157 -
Zusammenfassung
___________________________________________________________________________________________________________
nicht als einfaches Säure-Base Addukt der Form [RhCp*(ER)2→ERCl2], sondern vielmehr als
“Intermediate” eines Cl-Austausches zwischen EI und EIII betrachtet werden müssen. Die
Reaktion von [{RhCp*Cl2}2] mit 3 Äquivalenten ECp* (E = Ga, In) führt in geringen
Ausbeuten zu dem Lewis-Säure-Base-Addukt [Cp*Rh(GaCp*)2→(GaCl3)] (4) und dem
ionischem Komplex [Cp*2Rh]+[Cp*Rh-(InCp*){In2Cl4(µ2-Cp*}]-(5). Das Anion von 5 weist
eine intermetallische RhIn3-Einheit mit einem intramolekular verbrückenden Cp*-Ring auf.
Die Reduktion von [{Cp*RhCl2}2] zu dem dimeren RhII-Komplex [{Cp*RhCl}2] ist zu
beobachten, wenn nur ein Äquivalent EICp* eingesetzt wird. In Abhängigkeit von der
Reaktionszeit und Temperatur führt die Reaktion von [{Cp*RhCl}2] mit 6 Äquivalenten
GaCp* vermutlich zu dimeren Rh-Ga-Insertionsprodukten mit der Summenformel
[(Cp*Rh)2(GaCp*)2Cl2] (6) und [(Cp*Rh)2(GaCp*)4(GaCl3)] (7). Als ein thermisches
Zersetzungsprodukt von 7 wurde in Spuren der heterometallische precloso-Cluster
[(RhCp*)2(GaCp*)3] (8) isoliert. Hingegen blieb ein synthetischer Zugang zu RhI-Komplexen
[Cp*Rh(ER)2] bzw. kationischen RhIII-Verbindungen des Typs [Cp*Rh(ER)3]2+ verschlossen.
Auch die Substitution des stärkeren π-Akzeptor-Liganden C2H4 in [CpRh(C2H4)2] in
Gegenwart von ECp* (E = Al, Ga, In) ist aus thermodynamischer Sicht ungünstig. Erst der
CH3CN-monosubstituierte Komplex [CpRh(C2H4)(NCMe)] reagiert mit GaCp* zu der
dinuklearen Verbindung [{CpRh(C2H4)(µ2-(η1-GaCp*))}2] (11).
2.
Substitutionsreaktionen – Auf dem Weg zu M-E-Clusterverbindungen
2.1. Bausteinsynthese mit CO-haltigen M-E-Verbindungen
Die Synthese der monomeren Komplexe [fac-(Cp*Ga)3M(CO)3] (M = Mo 9a, W 9b) erfolgt
durch Substitution schwach gebundener Alkylnitrile ausgehend von [fac-(RCN)3M(CO)3] (M
= Mo, R = Me; M = W, R = Et) durch GaCp*. 9a und 9b sind die ersten Beispiele für
mononukleare oktaedrische d-Metallkomplexe mit drei facial angeordneten EIR-Liganden, die
keinen Hinweis auf sterische Überfüllung geben. Komplex 9a kann als Synthesebaustein zur
Generierung der dinuklearen Clusterverbindung [Mo2(CO)6(µ2-GaCp*)3] (10) eingesetzt
werden. Während bereits dokumentierte EIR-verbrückte Komplexe des Typs [M2(µ2-ER)n(CO)m] sich direkt aus den isoelektronischen Metallcarbonylen [M2(CO)m+n] (e.g. M = Fe,
Co) ableiten lassen, ist für 10 kein analoger Metallcarbonylkomplex dokumentiert.
- 158 -
Zusammenfassung
___________________________________________________________________________________________________________
Tabelle 27. Alle bisher bekannten homoleptischen Komplexe [Ma(EICp*)b]
Verbindung
M/E
Lit.
[Ni{GaC(SiMe3)3}4]
1/4
[47]
[Ni{InC(SiMe3)3}4]
1/4
[55]
[Pd{InC(SiMe3)3}4]
1/4
Diese Arbeit
[Pt{InC(SiMe3)3}4]
1/4
[56]
[Ni(GaCp*)4]
1/4
[54]
[Pd(GaCp*)4]
1/4
Diese Arbeit
[Pt(GaCp*)4]
1/4
Diese Arbeit
[Ni(AlCp*)4]
1/4
Diese Arbeit
[Pd(AlCp*)4]
1/4
Diese Arbeit
[Ni(AlCp*)3(GaCp*)]
1/4
Diese Arbeit
[Fe(AlCp*)5]
1/5
Diese Arbeit
1/5
[228]
[Pt2(GaCp*)2(µ2-GaCp*)3]
2/5
[51]
[PtPd(GaCp*)2(µ2-GaCp*)3]
2/5
Diese Arbeit
[Pd2(GaCp*)2(µ2-GaCp*)3]
2/5
Diese Arbeit
[Pd2(AlCp*)2(µ2-AlCp*)3]
2/5
Diese Arbeit
[Pt2(GaCp*)2(µ2-AlCp*)3]
2/5
Diese Arbeit
[Pd3(InCp*)4(µ2-InCp*)4]
3/8
Diese Arbeit
[Pd3(GaCp*)4(µ2-GaCp*)4]
3/8
Diese Arbeit
[Pd3(AlCp*)2(µ2-AlCp*)2(µ2-AlCp*)2]
3/6
Diese Arbeit
Mononuklear
[Ru(AlCp*)5]
Dinuklear
und diese Arbeit
Trinuklear
2.2. Homoleptische M-E-Verbindungen
Auf dem Gebiet der Darstellung ein- und mehrkerniger homoleptischer Verbindungen des
Typs [M(ECp*)4] und [Ma(ECp*)b] (M = Pd, Pt; b > a > 1) konnte eine Vielzahl von neuen
Komplexen und Strukturtypen erhalten werden. Insbesondere die neuartigen homoleptischen
Clusterverbindungen [Ma(ECp*)b] sind von Interesse, da diese Cluster über keine
strukturellen Analoga in der Carbonyl- oder Phosphanchemie verfügen. Grundsätzlich
bestehen zwei synthetische Zugänge zu Clusterverbindungen [Ma(ECp*)b]: 1) Baustein- 159 -
Zusammenfassung
___________________________________________________________________________________________________________
synthese via [M(EIR)4] und 2) direkte Syntheserouten. In Tabelle 27 sind alle bekannten
homoleptischen Verbindungen [Ma(ECp*)b] angeführt. Mit Ausnahme von [Fe(AlCp*)5] und
[Ru(AlCp*)5] sind alle Komplexe auf die Metalle der 10. Gruppe (Ni, Pd und Pt) beschränkt.
2.2.1. Darstellung von M(EIR)4
Bislang waren nur vier homoleptische mononukleare d10-Komplexe des Typs [M(EIR)4] (M =
Ni, Pt; E = Ga, In, R = Cp*, C(SiMe3)3)[47, 54-56] bekannt, welche als Analoga zu [Ni(CO)4]
bzw. [M(PR3)4] die koordinationschemische Verwandtschaft der Liganden EIR mit CO bzw.
Phosphanen unterstreichen. Im Rahmen dieser Arbeit wurden insgesamt fünf weitere
Komplexe dieses Typs synthetisiert und charakterisiert: Die tetraedrischen Komplexe
[Pt(GaCp*)4] (12a) und [Ni(AlCp*)4] (12b) sind quantitativ durch Umsetzung von [M(cod)2]
(M = Ni, Pt) mit ECp* (E = Al, Ga) zugänglich. [Pd(GaCp*)4] (12c), [Pd{InC(SiMe3)3}4]
(12d) und [Pd(AlCp*)4] (12e) wurden durch Reaktion von [Pd(tmeda)(CH3)2] bzw.
[Pd(tmeda)Cl2] mit EIR erhalten. Die Reduktion des PdII-Zentrums erfolgt via MethylGruppen bzw- Chlor-Übertragung auf das Gruppe-13-Metall-Zentrum E, also einer Oxidation
zu einem EIII-Nebenprodukt [ER(X)2] (X = Me, Cl). Insofern entspricht diese Reaktion einer
Insertion in eine M-X-Bindung, wobei die geringe Basizität des d10-Metallfragmentes (im
Unterschied zu d8-Rh-Fragmenten) eine Abdissoziation der aciden Spezies [ER(X)2] erlaubt.
Die für CO-Komplexe bekannten, klassischen Reaktionstypen der "Insertion" in M-CAlkyl
Bindungen sowie der "Reduktiven Eliminierung" lassen sich also auf EICp* übertragen. Im
Gegensatz zu [Ni(CO)4] bzw. [M(PR3)4] sind infolge der hohen Bindungsenergie M-E alle
Komplexe [M(EIR)4] substitutionsinert.
2.2.2. Darstellung von Ma(EICp*)b
Das Bausteinprinzip ist nicht nur auf GaCp*-substituierte Metallcarbonyle beschränkt,
sondern lässt sich auch auf die monomeren homoleptischen Komplexe [M(GaCp*)4] (M = Pt
12a, Pd 12b) übertragen, die die Darstellung dinuklearer Komplexe der Form
[MPt(GaCp*)2(µ2-GaCp*)3] (M = Pt 13a, Pd 13b) erlauben. Die Synthese von 13a und 13b
erfolgt durch schrittweise Kombination von [M(GaCp*)4] mit [Pt(cod)2] und anschließender
- 160 -
Zusammenfassung
___________________________________________________________________________________________________________
Zugabe von GaCp*. Im ersten Schritt werden reaktive, aber dennoch isolierbare dinukleare
Intermediate der Form [MPt(GaCp*)(µ2-GaCp*)3(η2-cod)] (M = Pt 14a, Pd 14b) gebildet.
Als sehr effiziente Pd0-Startverbindung zur direkten Darstellung von [Pda(EIR)b]Clusterverbindungen erwies sich der Komplex [Pd2(dvds)3] (dvds = Tetramethyldivinyldisiloxan), der in Abhängikeit von den Reaktionsbedingungen die Synthese di- und
trinuklearer Clusterkomplexe wie [Pd2(GaCp*)2(µ2-GaCp*)3] (13c), [Pd3(ECp*)4(µ2-ECp*)4]
(E = In 15a, E = Ga 15b) und [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16) erlaubt. Die
Bildung mono-, di- oder trinuklearer Strukturen wird dabei entscheidend durch kinetische
Faktoren bestimmt. Ferner sind die mono-, di- und trinuklearen Systeme nicht ineinander
umwandelbar. Während innerhalb der trinuklearen Systeme die Elemente Gallium und
Indium lineare Strukturen mit einem M/E-Verhältnis von 3:8 bevorzugen, ist AlCp* als
stärkerer σ-Donator besser dazu geeignet, unterkoordinierte Metallzentren zu stabilisieren,
d.h. ein kleineres M/E-Verhältnis (3:6) zu erzeugen. Ein stöchiometrisches Nebenprodukt bei
der Darstellung von 16 ist die Verbindung [(dvds)(µ2-Cp*Al)2] (17), welche den carbenoiden
Charakter von AlCp* unterstreicht.
3. Fluktionalität und Reaktivität von Ma(EICp*)b
Die Fluktionalität und Reaktivität der Clusterverbindungen [Ma(ECp*)b] im Hinblick auf
Substitutionsreaktionen wurde eingehend untersucht. Dabei konnte eine qualitative Beziehung
zwischen den fluktionalen Prozessen und Ligandsubstitutionen nachgewiesen werden, die zu
einem mechanistischen Vorschlag (dissoziativer Mechanismus) für beide Prozesse führt.
Die Verbindungen [Pt2(GaCp*)5] (13a) und [Pd2(AlCp*)5] (13e) zeigen ein statisches
Spektrum, während für [Pd2(GaCp*)5] (13c) ein koalesziertes Signal bei Raumtemperatur
gefunden wurde. Hingegen tauschen in [PtPd(GaCp*)5] (13b) nur die GaCp*-Gruppen am PtZentrum. Der daraus resultierende qualitative Trend für die relativen Raten der
Austauschprozesse stimmt gut mit den berechneten Bindungsenergien für die Modellverbindungen [M{E(CH3}4] überein, die für die d10-Metalle die Reihenfolge Ni ≈ Pt > Pd und
für die Elemente der 13. Gruppe den Trend B > Al > Ga ≈ In > Tl aufweisen.[45] Ähnliches
wurde auch für die trinuklearen Strukturen [Pd3(ECp*)8] (E = Ga 15b, In 15a) beobachtet.
[Pd3(InCp*)8] (15a) weist bei RT ein fluktionales Spektrum auf, welches für [Pd3(GaCp*)8]
(15b) erst bei 80°C detektiert wurde. Die im Festkörper linearen Komplexe 15a und 15b
- 161 -
Zusammenfassung
___________________________________________________________________________________________________________
wandeln sich vermutlich zu klassischen Pd3-Dreiecksstrukturen (zwei axiale und sechs
äquatoriale Liganden) in Lösung um. Für [Pd3(AlCp*)6] (16) konnte ein ähnlich fluktionaler
Prozess der äquatorialen Positionen mittels Kernresonanzspektroskopie nachgewiesen
werden.
Im Unterschied zu den kinetisch inerten monomeren Komplexen [M(EIR)4] zeigen die
Clusterverbindungen [Ma(ECp*)b] ein reichhaltiges Spektrum an Substitutionsreaktionen,
wobei die Nuklearität des M2-Zentrums in nahezu allen Fällen erhalten blieb. Die π-AkzeptorLiganden CO, t-BuNC und PPh3 wurden in einer terminalen Position detektiert, während die
verbleibenden ECp*-Liganden in der Brückenposition lokalisiert wurden. Im direkten
Vergleich mit GaCp* favorisiert AlCp* die Brückenposition, wobei der „trimetallische“
Komplex [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) gebildet wurde. Die AlCp*-substituierten
Verbindungen [Pd2(AlCp*)5] (13e) und [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) zeigen in Gegenwart
von Phosphanen keine weiteren Substitutionsreaktionen, was die höhere Bindungsenergie der
M-Al-Bindung
unterstreicht.
Darüber
hinaus
reagiert
die
trinukleare
Verbindung
[Pd3(InCp*)8] (15a) mit Phosphanen (PPh3 oder dppe) unter Freisetzung von InCp* zu
klassischen trigonalen Pd3-Strukturen [Pd3(InCp*)3(PPh3)3] (22) und [Pd3(InCp*)3(dppe)2]
(23).
4. Bindungsaktivierungen
Über den Einsatz niedervalenter EIR-Verbindungen als Stütz- und Steuerliganden wurde
bislang nicht berichtet, während dies bekanntermaßen für die isolobalen Liganden
Kohlenmonoxid und Phosphane geradezu prototypisch ist. Im Rahmen dieser Arbeit ist es
gelungen, das Potential der Liganden EIR anhand einer aromatischen C-H- und einer Si-HBindungsaktivierung
an
einem
Ni0-Zentrum
sowie
einer
zwei-
bzw.
dreifachen
intramolekularen aliphatischen C-H-Aktivierung bei der Darstellung von [Fe(AlCp*)5] unter
Beweis zu stellen.
Die Reaktion von [Ni(cod)2] mit AlCp* in Hexan führt zu dem monomeren Komplex
[Ni(AlCp*)4] (12b), während sich in Benzol die Verbindung [Ni(AlCp*)3(HAlPhCp*)] (24a)
bildet. Die Addition von Benzol an dem koordinativ ungesättigten Intermediat [Ni(AlCp*)3]
ist das erste Beispiel für eine aromatische C-H-Aktivierung an einem Ni0-Fragment und weist
die Richtung für ein allgemeines Konzept zur gezielten Generierung reaktiver,
- 162 -
Zusammenfassung
___________________________________________________________________________________________________________
unterkoordinierter Fragmente vom Typ [M(ER)n], die auf anderem Wege bisher nicht
erhältlich waren. Als geeigneter Reaktionspartner zum Abfangen der reaktiven Spezies
[Ni(AlCp*)3] erwies sich Triethylsilan, wobei der Komplex [NiH(AlCp*)3(SiEt3)] (25)
erhalten wurde. Interessanterweise ist die oxidative Addition von H-SiEt3 reversibel. Die
thermische Aktivierung von 25 in Gegenwart geeigneter Liganden L wie ECp* (E = Al, Ga)
oder PPh3 liefert monosubstituierte Komplexe der Form [Ni(AlCp*)3L] (L = AlCp* 12b,
GaCp* 12f, PPh3 26).
Auf der Suche nach einem synthetischen Zugang zu [Fe(EIR)5] wurde in
Zusammenarbeit mit der Arbeitsgruppe Zenneck die moderat substitutionslabile Fe0-Quelle
[(η6-C6H5CH3)Fe(η4-C4H8)] mit AlCp* umgesetzt, wobei zwei verschiedene Produkte mit der
Zusammensetzung [Fe(AlCp*)5] (27 und 28) isoliert wurden. Die Einkristallröntgenstrukturanalyse belegt die CH-Aktivierung von zwei bzw. drei CH3-Gruppen von zwei bzw. drei
verschiedenen Cp*-Ringen, wobei die resultierenden Methyleneinheiten an benachbarte AlAtome der AlCp*-Liganden gebunden sind. Die abgespaltenen H-Atome verbrücken diese
Al-Atome
mit
dem
zentralen
Fe-Atom.
Die
durchgeführten
quantenchemischen
Berechnungen an 27 ergaben eine sehr gute Übereinstimmung der berechneten (27M) mit den
experimentellen Strukturparametern. Überraschenderweise ist eine Struktur [Fe(AlCp*)5] mit
fünf Fe-Al-Bindungen und nicht-aktivierten Cp*-Liganden kein Energieminimum, sondern
liegt 22.0 kcal/mol höher als das Energieminimum von 27 M. Ferner sind vermutlich reaktive
unterkoordinierte Intermediate [Fe(AlCp*)n] (n < 5) auf dem Weg zu 27 bzw. 28 für die
Bindungsaktivierung verantwortlich. Allerdings sind der Mechanismus bzw. die kooperativen
Rollen der beteiligten Metallatome im Detail noch ungeklärt und verlangen nach eingehenden
experimentellen und theoretischen Analysen.
- 163 -
Ausblick
___________________________________________________________________________________________________________
V. Ausblick
Zukünftige Arbeiten werden sich auf die weitere systematische Erforschung der
Koordinationschemie von niedervalenten, carbenoiden Liganden EIR der Gruppe-13Elemente Aluminium, Gallium und Indium an d- und f-Block Metallen konzentrieren. Dabei
stehen vor allem drei Themenkomplexe im Vordergrund, deren Fundament in dieser Arbeit
gelegt worden ist.
1. Homoleptische Cluster des Typs Ma(EIR)b
Ziel ist die selektive molekülchemische Synthese großer mehrkerniger homo- und
heteroleptischer
EIR-substituierter
Komplexe
und
Cluster
vom
allgemeinen
Typ
[MaEb(ER)c]m± (a, b, c, m = 0, 1, 2...), wobei M auch verschiedene Metalle M1 bzw. M2 usw.
und E ebenfalls verschiedene Gruppe-13-Elemente E1 und E2 usw. darstellen können.
Insbesondere der jüngst erschienene Bericht über einen faszinierenden, durch AlCp* als
Ligand geschützten Al38-Cluster [Al38(Al12Cp*12)][136] belegt eindeutig, dass ECp* und
womöglich allgemeine EIR „Liganden“ als Stabilisatoren für nackte Metallcluster, vielleicht
auch Nanopartikel geeignet sind.
Abbildung 38. Molekülstruktur von Al38(AlCp*)12 im Kristall.
- 164 -
Ausblick
___________________________________________________________________________________________________________
Der synthetische Zugang von
Schnöckel beruht dabei auf der Steuerung der
Disproportionierung metastabiler AlI- bzw. GaI-Halogenid-Lösungen. Im Unterschied dazu
zielt unser Arbeitskreis auf eine systematische Clusteraufbaureaktion aus molekular
definierten Bausteinen ab, um langfristig eine gewisse Breite an intermetallischen Phasen,
insbesondere Metallaluminiden zu erschließen, und so in Gebieten jenseits der von H.
Schnöckel untersuchten reinen Hauptgruppenmetallcluster vorzustoßen. Die Tatsache, dass
große Cluster vom homometallischen Typ [Al38(AlCp*)12] stabil sind, aber auch kleine
Cluster vom heterometallischen Typus wie [Pd2(AlCp*)5] existieren und kinetisch nicht inert
sind, lässt hoffen, dass dieses Ziel grundsätzlich erreichbar sein sollte.
Die im Rahmen dieser Arbeit erzielten Ergebnisse zeigen, dass der Syntheseerfolg bei
der Umsetzung von EIR mit Übergangsmetall-Komplexen LnMXm in subtiler Weise von den
Bedingungen, der Kombination der Reaktionspartner, d.h. von den Liganden L bzw. Resten R
sowie von den anionischen Gruppen X abhängt. Auch die Lewis Säure/Base- und die
Redoxeigenschaften der Edukte und Produkte sind von Bedeutung. Gruppenübertragungsreaktionen bzw. Metathesereaktionen unter gleichzeitiger Oxidation von EI nach EIII parallel
zur Reduktion von Mn+2 auf Mn komplizieren die Verhältnisse, bieten aber gerade deshalb
auch Chancen für selektive Synthesen.
Die Frage, welche Größe bzw. Koordinationsmuster ein Cluster vom Typ
[MaEb(ER)c]m± tatsächlich einnehmen kann, ist bislang offen. Wie ein raumerfüllendes Modell
der Komplexe [Pd3(ECp*)8] (E = Ga, In) zeigt, ist eine über die Dreikernigkeit
hinausausgehende Oligo- bzw. Polynuklearität von M(ECp*)2-Einheiten aus sterischen
Gründen erschwert. Offenbar limitiert der Cp*-Ligand das Clusterwachstum auf zwei- und
dreikernige Spezies. Ein möglicher Lösungsansatz ist, für die Synthese von [Ma(ER)b]
sterisch weniger anspruchsvolle Liganden als ECp* zu verwenden. So reagiert InCp zwar mit
[Pd(tmeda)(CH3)2], allerdings war es bislang nicht möglich, das unlösliche Produkt durch
spektroskopische Methoden oder Röntgenkristallographie zu untersuchen. Um die Löslichkeit
der Produktkomplexe bei gleichzeitig geringerem Platzbedarf zu gewährleisten, könnten
deshalb monosubstituierte Liganden des Typs ECpR (R = Methyl, Ethyl,...) hergestellt und
eingesetzt werden. Dadurch könnte es möglich sein, oligo- bzw. polynukleare, dennoch gut
lösliche und charakterisierbare linear polymere Clusterkomplexe vom Typ [{M(ECpR)2}n] zu
generieren.
- 165 -
Ausblick
___________________________________________________________________________________________________________
2. Reaktivitätsuntersuchungen an koordinativ ungesättigten M(EIR)n-Komplexfragmenten
Die Untersuchung der Eigenschaften der Liganden EIR hinsichtlich der Steuerung der
Reaktivität von kleinen elektronenreichen, koordinativ ungesättigten Komplexen bzw.
Komplexfragmenten [M(ER)n] gegenüber typischen Synthesebausteinen in der organischen
Chemie (z.B. Olefinen, H2, Bindungsaktivierung von C-X, Si-X bzw. allgemein Element-X
Bindungen) im Vergleich zu klassischen Stützliganden, wie Phosphane oder Nheterocyclische Carbene NHCs ist ein zweiter Schwerpunkt. Dabei sind neben den bereits
untersuchten d10-Verbindungen Ni0, Pd0 und Pt0 sicherlich d8-Komplexfragmente wie RhI, IrI,
Ru0, PdII oder PtII interessant. Entsprechende Komplexe mit Phosphanen oder NHCs sind in
vielen Fällen ausgesprochen reaktiv für Bindungsaktivierungsreaktionen und deshalb im
Mittelpunkt des aktuellen Forschungsinteresses.[204-208]
Der vergleichsweise geringe Platzbedarf von EICp* und die damit einhergehende
Tendenz koordinativ gesättigte Komplexe wie [Ni(AlCp*)4] oder [Fe(AlCp*)5] zu bilden,
sowie Brückenpositionen zu besetzen, legte es nahe, die koordinativen Eigenschaften von
sterisch anspruchsvolleren EIR Verbindungen als ("metallische") carbenoide Liganden für
reaktive unterkoordinierte Übergangsmetallfragmente zu untersuchen. Dabei ist es von
grundlegender Bedeutung, dass die bei Bindungsaktivierungen mögliche Alkyl- bzw.
Arylgruppenübertragung von (EIR)nM(R’) nach (EIR)n-1M(ERR’) verhindert wird. Um also
die am Übergangsmetallzentrum aktivierte Alkylgruppe R’ nicht in die „thermodynamische
Schlucht“ einer E-R’ Bindung fallen zu lassen (Kapitel 4.1), muss der Ligand EIR so
konstruiert sein, dass die Alkylgruppenübertragung entweder elektronisch ungünstig oder
sterisch nicht möglich ist. Eine ausreichende Blockierung dieser Folgereaktion kann nur in
sp3- oder sp2-hybridisierten EI-Systemen gewährleistet werden, in denen kein energetisch
ausreichend günstiges, freies, elektrophiles Orbital am Gruppe-13-Metall zur Verfügung steht.
Besonders die substituierten β-Diketiminate AlI(DDP) bzw. GaI(DDP) (DDP = 2-Diisopropylphenylamino-4-diisopropylphenylimino-2-penten)[32-39] stellen sterisch ausreichend
blockierte,
elektronenreiche
Verbindungen
dar,
die
deutlich
geringere
reduktive
Eigenschaften aufweisen als die entsprechenden Verbindungen GaCp* bzw. AlCp*.
Im Rahmen seiner Diplomarbeit untersuchte Herr Dipl.-Chem. Andreas Kempter
(Bochum, Mai 2004) die Ligandeigenschaften von Ga(DDP) und erbrachte eine ganze Reihe
bemerkenswerter Resultate.[134] So reagiert beispielsweise Ga(DDP) mit [Pt(1,5-cod)2] nicht
unter vollständiger Substitution des olefinischen Liganden, sondern es bildet sich infolge
- 166 -
Ausblick
___________________________________________________________________________________________________________
einer Hydridverschiebung der Komplex [Pt{Ga(DDP)}2(1,3-cod)]. Auf dem Weg zu
homoleptischen und koordinativ ungesättigten Komplexen des Typs [M{Ga(DDP)}n] wurde
dann ausgehend von [Pt{Ga(DDP)}2-(1,3-cod)] in Gegenwart von H2 die Hydrid-Spezies
[(H)2Pt2{Ga(DDP)}4] und [(H)2Pt2{Ga(DDP)}2] isoliert. Diese Verbindungen bergen ein
besonders Potential für Folgechemie, insbesondere für Bindungsaktivierungen und für den
Aufbau von großen Metallclustern.
Soll darüber hinaus die Aktivierung einer starken Bindung katalytisch laufen, muss
vorerst
gewährleistet
sein,
dass
sowohl
thermodynamische
als
auch
kinetische
Voraussetzungen erfüllt sind. Werden starke Bindungen katalytisch gebrochen, so müssen im
Gegenzug
starke
Bindungen
neu
geknüpft
werden,
damit
die
Gesamtreaktion
thermodynamisch günstig ist. Aus kinetischer Sicht müssen die im Katalysezyklus beteiligten
Intermediate reaktiv genug zur Aktivierung starker Bindungen sein. Als exemplarisches
Beispiel einer katalytischen Bindungsaktivierungsreaktion sei die Borylierung von Alkylen
oder Arylen angeführt. Eine vergleichsweise schwache Bor-Bor-Bindung in Diboranen steht
den stärkeren B-H- und vor allem den sehr starken B-C-Bindungen der Produkte gegenüber.
Boralkylverbindungen sind von hohem Interesse als Synthesebausteine in der organischen
Chemie, die Möglichkeiten ihrer weiteren Funktionalisierung sind fast unbegrenzt.
REI
I
ER
Pd
I
ER
R2B-BR2
R-BR2
H-BR2
R
RE
REI
I
Pd
RE
BR2
RE
H
I
I
Pd
BR2
BR2
BR2
R-H
Schema 41. Möglicher Katalysezyklus zur Borylierung von Alkanen oder Arylen durch Pd(EIR)3
- 167 -
Ausblick
___________________________________________________________________________________________________________
Es soll angemerkt werden, dass J. F. Hartwig die stöchiometrische Borylierung von Alkanen
mit Catecholdiboran an für Bindungsaktivierungen prinzipiell weniger reaktiven Cp*M(CO)n
Fragmenten (M = W, Fe, Ru) in mäßigen bis guten Ausbeuten beobachtet hat.[177] Ferner
haben neue Untersuchungen aus dieser Arbeitsgruppe gezeigt, dass IridiumI/2,2´-BipyridinKomplexe eine stöchiometrische aromatische C-H-Borylierung bereits bei Raumtemperatur
erlauben.[209] Die Verwendung von elektronenreichen Metallzentren, die zusätzlich durch EIRLiganden aktiviert werden, könnte einen geeigneten Weg darstellen, derartige Reaktionen
katalytisch zu führen.
3. Nicht-wässrige Synthese von bimetallischen Nanopartikeln MxEy
Auf der Basis der Erkenntnisse aus diesen beiden Projektbereichen können dann Konzepte,
Modellsysteme bzw. molekulare Bausteine identifiziert werden, welche für die selektive,
rationale Synthese und das anschließende Processing von in nichtwäßrigen Medien (z.B.
kolloidal) stabilisierten Metallaluminid-Nanopartiklen MxAly (ebenso Gallide und Indide mit
geringerer Priorität) geeignet sind. Binäre und ternäre (multinäre) Aluminide von d,f-BlockMetallen sind ein klassisches Gebiet der Metallurgie und der anorganischen Festkörper- und
Strukturchemie mit umfangreichen Anwendungsbezügen, z.B. für Werkstoffe (Hochleistungslegierungen). Aber auch grundlegende Fragen, z. B. im Bereich magnetischer Materialien
oder besonderer strukturchemischer Situationen (Quasikristalle) sind eng mit Metallaluminiden verbunden.[210-212] Dabei ist die Chemie gemischtmetallischer, kolloidal
stabilisierter Metallpartikel bis auf einige wenige Ausnahmen auf Edelmetall-Kolloide (z.B.
Ag, Au, Pd, Pt) bzw. edelmetallhaltige, gemischtmetallische Kolloide (z. B. Pt/Ru, Co/Au
usw.) beschränkt geblieben. Dies hängt mit dem synthetischen Zugang zusammen, der
typischerweise nasschemische (wässrige) reduktive Methoden beinhaltet und daher für
intrinsisch schwer reduzierbare, elektropositive Metalle (z.B. Zn, Al) nicht ohne weiteres
gangbar ist.
In ersten Versuchen wurde nun gezeigt, dass [Pd3(InCp*)8] und [Pt2(GaCp*)5] einen
Zugang zur Chemie metallischer Nanopartikel und Kolloide ermöglicht. Die Photolyse einer
C6D6-Lösung von [Pd3(InCp*)8] bei Raumtemperatur führt zur selektiven Abspaltung der
Cp*-Verpackung der Pd3In8-Einheit in Form von Decamethylfulvalen. Erste TEM
Untersuchungen einer in Gegenwart der stabilisierenden Liganden NOct4Br und
Hexadecylamin mit UV-Licht bestrahlten Lösung von [Pd3(InCp*)8] zeigen, dass sich
- 168 -
Ausblick
___________________________________________________________________________________________________________
metallische Nanopartikel bilden, deren genaue Zusammensetzung derzeit untersucht wird.
Abbildung 39. XRD-Spektrum und TEM-Bild von Aluminiumpartikeln durch Zersetzung von AlCp*
Ferner konnte Herr Dipl.-Chem. Mirza Cokoja im Rahmen seiner Doktorarbeit (Bochum,
Beginn Januar 2004) zeigen, dass sich AlCp* unter H2-Atmosphäre quantitativ zu
elementarem Aluminium und 1,2,3,4,5-Pentamethylcyclopentadien zersetzt. Die Partikel
weisen eine sehr enge Größenverteilung von rund 20 nm auf. Diese Beobachtung erlaubt nun
den Einsatz von AlCp* als eine sehr saubere Aluminium0-Quelle, um auf diesem Weg
nanopartikuläre Metallaluminide zu erzeugen. So führt die Zersetzung von [CpCu(PMe3)] und
AlCp* zu gemischt-metallischen CuAl2- und Cu9Al4-Nanopartikeln.[213] Es liegt wohl auf der
Hand, dass die Komplexe [Ni(AlCp*)4] und [Fe(AlCp*)5] und ihre höhernuklearen
Verwandten [Ma(AlCp*)b] als Metallatompakete innerhalb einer abspaltbaren Kohlenwasserstoff-Schutzhülle einiges für die Zukunft versprechen.
- 169 -
Experimenteller Teil
___________________________________________________________________________________________________________
VI. Experimenteller Teil
1. Allgemeine Arbeitstechniken
Alle Umsetzungen mit metallorganischen Verbindungen wurden unter rigorosem Ausschluss
von Luft- und Feuchtigkeit in ausgeheizten Glasapparaturen (Schlenk-, Vakuum-Linie- und
Glove-Box-Techniken) durchgeführt, falls nicht anders vermerkt. Als Inertgas wurde Argon
(nachgereinigt über Cu-Katalysator und über Molekularsieb 4 Å getrocknet; O2- bzw. H2OGehalt < 1ppm) verwendet. Tieftemperaturreaktionen wurden im Isopropanol/Trockeneis bei
der angegebenen Temperatur durchgeführt.
Die Trocknung und Destillation aller Verbindungen erfolgte im Hochvakuum
(Drehschieberpumpe der Fa. Edwards (p < 2⋅10-2 mbar).
Die Kristallisation der Organometallverbindungen erfolgte bei tiefen Temperaturen
aus gesättigten Lösungsmitteln bzw. durch langsames Abdampfen des Lösungsmittels unter
Inertgasatmosphäre in der Glove-Box. Alle Ausbeuten beziehen sich auf die gereinigten
Kristallfraktionen.
Lösungsmittel
Alle
verwendeten
Lösungsmittel
wurden
durch
mehrtägiges
Refluxieren
in
Umlaufapparaturen unter Verwendung der üblichen Trocknungsmittel (Diethylether, Hexan,
Pentan, THF, Toluol: Na/Paraffin; Chloroform, Methylenchlorid: Phosphorpentoxid)
absolutiert, mit Argon gesättigt und über Molekularsieb 4 Å aufbewahrt. Den Lösungsmitteln
Diethylether, THF und Toluol wurde Benzophenon als H2O/O2-Indikator zugesetzt. Ab dem
Jahr 2004 wurden die Lösungsmittel Hexan, Toluol, THF und Et2O mittels eines
Lösungsmittelreinigungssystems
(mBraun)
getrocknet.
Der
Trocknungsgrad
aller
Lösungsmittel wurde durch Titration nach Karl-Fischer überprüft. Nur Lösungsmittel mit
einem Wassergehalt von < 5 ppm kamen zum Einsatz.
- 170 -
Experimenteller Teil
___________________________________________________________________________________________________________
2. Routineanalysemethoden
Elementaranalytik
Die Analyse der Elementenzusammensetzungen der Verbindungen wurden in der
Arbeitsgruppe Mikroanalytik der Chemischen Abteilung der Ruhr-Universität-Bochum
durchgeführt (Leitung: K. Bartholomäus), wobei ein C, H, N-Analyseautomat vom Typ
„CHNSO Vario EL 1998“ der Firma „Elementar“ (Hanau) eingesetzt wurde.
Infrarotspektroskopie
Die IR-Spektren wurden entweder in Lösung, als KBr-Preßling oder in Nujol gemessen. Alle
Proben wurden unter Inertgasatmosphäre hergestellt und an einem FT-IR-Spektrometer vom
Typ „1720 X“ der Firma Perkin Elmer (Rodgau-Jügesheim) aufgenommen. Das verwendete
KBr wurde mehrere Tage bei 140°C getrocknet und unter Argon aufbewahrt. Das Nujol
wurde vor der Verwendung im Vakuum von Luft befreit, mit Argon gesättigt und in der
Glove-Box gelagert. Für die Angabe der Signalintensitäten wurden folgende Abkürzungen
verwendet: vs = sehr stark, s = stark, m = mittel, w = schwach, vw = sehr schwach, sh =
Schulter und b = breit.
Kernresonanzspektroskopie
Die Proben zur Aufnahme von Kernresonanzspektren wurden in hochreinen, deuterierten
Lösungsmitteln der Firma Merck (Uvasol®) und der Firma Deutero gelöst. Die Lösungsmittel
wurden zuvor mit Molekularsieb 4 Å getrocknet und mit Argon gesättigt. Zur Aufnahme der
Spektren wurde ein Bruker Advance 250 NMR-Spektrometer („Bruker Analytik“,
Rheinstetten) verwendet.
Die Angabe der chemischen Verschiebung δ erfolgt in ppm relativ zur eingestrahlten
Frequenz, wobei bei
1
H- und
13
C-NMR Spektren die Restsignale der deuterierten
Lösungsmittel als interne Standards verwendet wurden (1H, 250.1 MHz; 13C, 62.9 MHz; C6D6
bei 7.15 ppm und 128.02 ppm). Alle 13C-NMR-Spektren sind, sofern nicht anders angegeben,
protonenbreitbandentkoppelt. Die chemische Verschiebung δ der 31P-NMR Spektren beziehen
- 171 -
Experimenteller Teil
___________________________________________________________________________________________________________
sich auf einen externen Standard
(85 % Orthophosphorsäure). Die chemischen
Verschiebungen der 27Al-NMR-Messungen beziehen sich auf [Al(H2O)6]3+ mit δ = 0 ppm.
Für die Angabe der Signalmultiplizitäten werden folgende Abkürzungen verwendet: s =
Singulett, d = Dublett, t = Triplett, q = Quartett, m = Multiplett und br = breites Signal. Die
Werte der Kopplungskonstanten werden in Hz angegeben und sind als Beträge zu verstehen.
Die Vorzeichen der Kopplungskonstanten wurden nicht bestimmt.
Massenspektroskopie
EI-Massenspektren wurden von Frau Dr. D. Müller, Arbeitsgruppe Massenspektrometrie der
SC-Abteilung der Ruhr-Universität Bochum mit einem „CH5 Massenspektrometer“ der Firma
„Varian MAT“ (Bremen) aufgenommen. Die Probenvorbereitung wurde in der Glove-Box
vorgenommen. Alle angegebenen Ionenpaks sind positive Ionen. Signalintensitäten werden in
% relativ zum größten Peak angegeben. Zur Berechnung der Molekülionen [M+] wurden
folgende Massenzahlen verwendet: 1H, 13C, 27Al, 69Ga, 115In, 31P, 28Si.
Thermogravimetrie
Die thermogravimetrische Analyse sowie die Bestimmung der Zersetzungspunkte wurden von
Frau U. Patil an einem „TG/DTA EXSTAR 6200“ der Firma „Seiko Instruments“ (NeuIsenburg) in einem Aluminium-Tiegel unter Schutzgas bestimmt. Die Heizrate betrug
10°C/min mit einem Meßbereich von 30°C bis 600°C.
Einkristall-Röntgenstrukturanalysen
Die Einkristall-Röntgenstrukturanalysen wurden von Herrn Dr. C. Gemel und Frau M. Winter
unter Verwendung von Mo-Kα-Strahlung (λ = 71.07 pm, Graphit Monochromator)
durchgeführt. Die Kristallstrukturen der Verbindungen 1-4, 8-13c, 13e, 15a, 15b, 18b, 19,
24a und 25 wurden an einem „Bruker-AXS-SMART 1000“-Diffraktometer gemessen. Die
Daten für die Verbindungen 13d, 16-18a, 20, 22, 27 und 28 wurden an einem „Oxford
Xcalibur 2“-Diffraktometer erhoben. Die Molekülstruktur von Verbindung 5 wurde an einem
- 172 -
Experimenteller Teil
___________________________________________________________________________________________________________
„X8Apex“-Vierkreis-Goniometer gemessen. Messparameter, kristallographische Daten und
weitere Einzelheiten zur Lösung und Verfeinerung des Datensatzes sind in Kapitel 4.5.
zusammengestellt. Die Verfeinerung der Strukturen erfolgte mit den Programmen SHELXS86 und SHELXL-97 gegen F2.
R1 = Σ( Fo − Fc ) / Σ Fo
1/ 2
[214]
[215]
Dabei ergibt sich der R1-Wert aus
, der wR2-Wert errechnet sich über den Zusammenhang
wR2 = [Σ w ( Fo2 − Fc2 ) 2 / Σ w ( Fo2 ) 2 ]1 / 2 .
3. Ausgangsverbindungen
Zur
Darstellung
der
metallorganischen
Ausgangsprodukte
wurden
handelsübliche
Basischemikalien verwendet, die, wenn nicht anders angegeben, ohne weitere Reinigung
eingesetzt wurden. Kommerziell nicht erhältliche Laborpräparate sind nachfolgend aufgelistet
und wurden gemäß der Literatur synthetisiert.
[{AlCp*}4][12, 13]
[{GaCp*}6][16, 17]
[{InCp*}6][18]
Cp*H [216, 217]
[{InC(SiMe3)3}4][21]
[Pt(cod)2][218, 219]
[Ni(cod)2][220]
[fac-(MeCN)3Mo(CO)3][221]
[fac-(EtCN)3Mo(CO)3][222]
[CpRh(C2H4)2][223]
[{CpMo(CO)2}2][224]
[{CpW(CO)2}2][225]
[Pd(tmeda)Cl2][123]
[Pd(tmeda)Me2][123]
[Pd2(dvds)3][226]
[{RhCp*Cl2}2][227]
- 173 -
Experimenteller Teil
___________________________________________________________________________________________________________
4. Arbeitsvorschriften und analytische Daten neuer Verbindungen
Synthese von [{(OC)2(Cp)Mo(µ2-(η1-GaCp*))}2] (1a)
Eine Suspension von [{CpMo(CO)2}2] (250 mg, 0.58 mmol) in Hexan (5 mL) wurde mit 3
Äquivalenten GaCp* (354 mg, 1.73 mmol) versetzt und für 1 h bei RT gerührt. Alle
flüchtigen Bestandteile wurden im Vakuum entfernt. Der gelbe Rückstand wurde mit Hexan
gewaschen und im Vakuum getrocknet. Das Produkt wurde durch langsames Abkühlen einer
gesättigten Diglyme-Lösung von 170°C auf RT kristallisiert. Ausbeute: 245 mg (50%).
Zerspkt. 196 °C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 4.61 (s, 10H, C5H5), 2.08 ppm (s,
30H, C5Me5). 13C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 219.8 (CO), 120.6 (C5Me5), 82.1
(C5H5), 12.9 ppm (C5Me5). IR (Nujol, cm-1): ν =/1888 (vs, CO), 1832 (vs, CO).
Elementaranalyse: ber. für C34H40O4Mo2Ga2 (M = 844.01 g mol-1): C 48.38, H 4.78; gef.: C
48.62, H 4.80.
Synthese von [{(OC)2(Cp)W(µ2-(η1-GaCp*))}2] (1b)
Eine Lösung von [{CpW(CO)2}2] (90 mg, 0.15 mmol) in Hexan (5 mL) wurde mit 3
Äquivalenten GaCp* (90 mg, 0.44 mmol) versetzt und für 1 h refluxiert. Die zuvor dunkel
rote Reaktionslösung verfärbte sich hell rot. Nach Abkühlen auf RT wurde das Lösungsmittel
im Vakuum entfernt. Der orange Rückstand wurde mit Hexan gewaschen und im Vakuum
getrocknet. Das Produkt wurde aus einer Toluol/Hexan-Mischung umkristallisiert. Ausbeute:
62 mg (41%). Zerspkt. 183 °C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 2.12 (s, 30H,
C5Me5), 4.58 ppm (s, 10H, C5H5). 13C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 220.9 (CO),
122.2 (C5Me5), 82.4 (C5H5), 12.3 ppm (C5Me5). IR (Nujol, cm-1): ν =/1874 (vs, CO), 1826
(vs, CO). Elementaranalyse: ber. für C34H40O4W2Ga2 (M =/1019.81 g mol-1): C 40.04, H 3.95;
gef.: C 39.73, H 4.09.
- 174 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [RhCp*(GaCp*)3Cl2] (2a)
Eine Suspension von [{RhCp*Cl2}2] (0.100 g, 0.162 mmol) in Toluol (6 mL) wurde mit 6
Äquivalenten GaCp* (0.200 g, 0.972 mmol) versetzt und für 30 min bei RT gerührt. Nach
Abkühlen der roten Reaktionslösung auf -30°C wurden rote Kristalle erhalten. Die Kristalle
wurden mit Hexan gewaschen und im Vakuum getrocknet. Ausbeute: 0.239 g (80%). 1HNMR (C6D6, 250.1 MHz, 300 K): δ = 2.04 (s, 45H, C5Me5), 1.81 ppm (s, 15H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 119.4 (C5Me5, Cp*Ga), 98.4 (d, 1J(Rh-C) = 4.2
Hz, C5Me5, Cp*Rh), 12.7 (C5Me5, Cp*Rh), 12.3 ppm (C5Me5, Cp*Ga). Elementaranalyse:
ber. für C40H60RhGa3Cl2 (M = 923.85 g mol-1): C 52.00, H 6.54; gef.: C 51.64, H 6.18.
Synthese von [RhCp*(InCp*)3Cl2] (2b)
Eine Suspension von [{RhCp*Cl2}2] (0.100 g, 0.162 mmol) in Toluol (6 mL) wurde mit 6
Äquivalenten InCp* (0.243 g, 0.972 mmol) in Toluol (2 mL) versetzt und für 30 min bei RT
gerührt. Durch langsames Abkühlen der roten Reaktionslösung auf -30°C wurden rote
Kristalle erhalten. Die Kristalle wurden mit Hexan gewaschen und im Vakuum getrocknet.
Ausbeute: 0.286 g (83%). 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 2.18 (s, 45H, C5Me5),
1.77 ppm (d, (3J(Rh-H) = 0.57 Hz), 15H, C5Me5). 13C{1H}-NMR (C6D6, 62.9 MHz, 300 K):
δ = 118.1 (C5Me5, Cp*In), 96.7 (d, (1J(Rh-C) = 5.1 Hz), C5Me5, Cp*Rh], 13.9 (C5Me5,
Cp*Rh), 11.7 ppm (C5Me5, Cp*In). Elementaranalyse: ber. für C40H60Cl2In3Rh (M = 1059.15
g mol-1): C 45.36, H 5.71; gef.: C 45.56, H 5.46.
Synthese von [RhCp*{InC(SiMe3)3}3Cl2] (3)
Eine Suspension von [{RhCp*Cl2}2] (0.100 g, 0.162 mmol) in Toluol (6 mL) wurde mit 6
Äquivalenten InC(SiMe3)3 (0.336 g, 0.972 mmol) in Toluol (2 mL) versetzt und für 1 h
Stunde bei RT gerührt. Die dunkelrote Lösung wurde langsam auf -30°C abgkühlt, wobei sich
tiefrote Einkristalle bildeten. Die Kristalle wurden mit Hexan gewaschen und im Vakuum
getrocknet. Ausbeute: 0.323 g (74%). 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 1.90 (s, 15H,
C5Me5), 0.51 ppm (s, 81H, SiMe3). 13C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 94.4 (d, (1J
- 175 -
Experimenteller Teil
___________________________________________________________________________________________________________
(Rh-C) = 4.3 Hz), C5Me5, Cp*Rh], 39.6 (d, (2J (Rh-C) = 5.5 Hz, In-C), 13.4 (C5Me5, Cp*Rh),
7.6 ppm (SiMe3). Elementaranalyse: ber. für C40H96Cl2In3RhSi9 (M = 1348.25 g mol-1): C
35.63, H 7.18; gef.: C 36.25, H 7.44.
Synthese von [Cp*Rh(GaCp*)2(GaCl3)] (4)
1) Eine Suspension von [{RhCp*Cl2}2] (0.100 g, 0.162 mmol) in Toluol (6 mL) wurde mit 6
Äquivalenten GaCp* (0.200 g, 0.972 mmol) versetzt und für 30 min. bei RT gerührt. Zu
der orange roten Lösung wurde GaCl3 (0.057 g, 0.324 mmol) in Toluol (3 mL)
zugegeben, wobei sich sogleich ein gelber Niederschlag bildete. Die Kristallisation des
Produktes erfolgte in siedenden Diglyme und langsamen Abkühlen der gesättigten
Lösung auf Raumtemperatur. Die orangen Kristalle wurden mit Hexan gewaschen und im
Vakuum getrocknet. Ausbeute: 0.220 g (83%).
2) Eine Suspension von [{RhCp*Cl2}2] (0.100 g, 0.162 mmol) in Toluol (6 mL) wurde mit 6
Äquivalenten GaCp* (0.200 g, 0.972 mmol) versetzt und für 30 min. bei 100°C gerührt,
wobei sich in geringem Mengen ein hellroter Niederschlag bildete. Die überstehende
Lösung wurde abkanuliert und der mikrokristalline Rückstand wurde mit Hexan
gewaschen und im Vakuum getrocknet. Ausbeute: 0.018 g (7%).
3) Eine Lösung von [RhCp*(GaCp*)3Cl2] (2a) (0.050 g, 0.050 mmol) in Toluol (5 mL)
wurde für 30 min bei 100°C gerührt, wobei sich in geringem Mengen ein hellroter
Niederschlag
bildete.
Die
überstehende
Lösung
wurde
abkanuliert
und
der
mikrokristalline Rückstand wurde mit Hexan gewaschen und im Vakuum getrocknet.
Ausbeute: 0.003 g (7%).
Zerspkt. 268°C. 1H-NMR (CD2Cl2, 250.1 MHz, 300 K): δ = 2.10 (s, 30H, C5Me5), 2.06 ppm
(s, 15H, C5Me5).
13
C{1H}-NMR (CD2Cl2, 62.9 MHz, 300 K): δ = 114.8 (C5Me5, Cp*Ga),
100.3 (d, 1J(Rh-C) = 4.7 Hz, C5Me5, Cp*Rh), 12.6 (C5Me5, Cp*Rh), 10.2 ppm (C5Me5,
Cp*Ga). Elementaranalyse: ber. für C30H45RhGa3Cl3 (M = 824.1 mol-1): C 43.73, H 5.50;
gef.: C 43.45, H 5.44.
- 176 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Cp*2Rh][Cp*Rh(InCp*){In2Cl4(µ2-Cp*}] (5)
Eine Suspension von [{Cp*RhCl2}2] (0.100 g, 0.162 mmol) und InCp* (0.121, 0.485 mmol)
in Toluol (10 mL) wurde bei 75°C für 1h gerührt. Der orange mikrokristalline Niederschlag
wurde mit Toluol gewaschen und im Vakuum getrocknet. Das Produkt wurde durch Diffusion
von Toluol in eine CH2Cl2-Lösung des Produktes in Form von roten Einkristallen erhalten.
Ausbeute: 0.165 g (70%). Zerspkt. 221°C. 1H-NMR (THF-d8, 250.1 MHz, 300 K): δ =
2.10 (d, 3J(Rh-H) = 0.50 Hz, 15Η, C5Me5), 2.05 (s, 30H, C5Me5), 1.90 ppm (s, 30H, C5Me5).
13
C{1H}-NMR (THF-d8, 62.9 MHz, 300 K): δ = 119.8 (C5Me5, Cp*In), 99.7 (d, 1J(Rh-C) =
7.5 Hz, C5Me5, [(Cp*)2Rh]), 95.9 (d, 1J(Rh-C) = 5.2 Hz, C5Me5, Cp*Rh), 14.2 (C5Me5,
Cp*Rh), 12.63 (C5Me5, Cp*In), 8.8 ppm (C5Me5, [(Cp*)2Rh]). Elementaranalyse: ber. für
C50H75Rh2In3Cl4⋅C6H5(CH3) (M = 1404.2 mol-1): C 46.88, H 5.72; gef.: C 46.73, H 5.64.
Synthese von [(Cp*Rh)2(GaCp*)2Cl2] (6)
Eine Suspension von [{Cp*RhCl}2] (0.100 g, 0.183 mmol) in Hexan (4 mL) wurde mit 6
Äquivalenten GaCp* (0.224 g, 1.096 mmol) bei -30°C versetzt. Das Reaktionsgemisch wurde
für 3 Minuten auf RT erwärmt, wobei sich ein dunkel brauner mikrokristalliner Niederschlag
bildete. Das Produkt wurde mit Hexan gewaschen und im Vakuum getrocknet. Ausbeute:
0.101 g (58%). 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 2.21 (s, 30H, C5Me5), 1.54 ppm (s,
30H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 123.0 (C5Me5, Cp*Ga), 96.2
(1J(Rh-C) = 3.1 Hz, C5Me5, Cp*Rh), 96.3 (d, 1J(Rh-C) = 3.1 Hz, C5Me5, Cp*Rh), 13.7
(C5Me5, Cp*Rh) 10.7 ppm (C5Me5, Cp*Ga). Elementaranalyse: ber. für C40H60Cl2Rh2Ga2 (M
=/1008.5 g mol-1): C 50.23, H 6.32; gef.: C 50.05, H 6.44.
Synthese von [(Cp*Rh)2(GaCp*)4(GaCl3)] (7)
Eine Suspension von [{Cp*RhCl}2] (0.100 g, 0.183 mmol) in Hexan (4 mL) wurde mit 6
Äquivalenten GaCp* (0.224 g, 1.096 mmol) bei -30°C versetzt. Das Reaktionsgemisch wurde
auf Raumtemperatur erwärmt und für eine 1h gerührt, wobei sich ein roter mikrokristalliner
Niederschlag bildete, der mit Hexan gewaschen und im Vakuum getrocknet wurde. Ausbeute:
- 177 -
Experimenteller Teil
___________________________________________________________________________________________________________
0.162 g (90 %). Zerspkt. 157°C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 2.13 (s, 60 H,
C5Me5), 1.93 ppm (s, 30 H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 121.0
(C5Me5, Cp*Ga), 97.3 (d, 1J(Rh-C) = 3.6 Hz, C5Me5, Cp*Rh), 13.0 (C5Me5, Cp*Ga), 12.6
ppm (C5Me5, Cp*Rh). Elementaranalyse: ber. für C40H60Cl2Rh2Ga2 (M =/1523.0 g mol-1): C
49.00, H 6.17, Cl 7.24; gef.: C 49.32, H 6.31, Cl 7.10.
Synthese von [fac-(GaCp*)3Mo(CO)3] (9a)
Eine grüngelbe Suspension von [fac-(MeCN)3Mo(CO)3] (200 mg, 0.66 mmol) in Toluol (10
mL) wurde mit 3 Äquivalenten GaCp* (470 mg, 2.30 mmol) versetzt und für 1 h refluxiert.
Nach langsamem Abkühlen der roten Lösung auf RT wurden gelbe Kristalle erhalten. Die
Kristalle wurden mit Hexan gewaschen und im Vakuum getrocknet. Ausbeute: 250 mg
(48%). Zerspkt. 150 °C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 1.90 ppm (s, 45 H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 221.4 (CO), 114.2 (C5Me5), 9.7 ppm (C5Me5).
IR (Nujol, cm-1): ν =/1927 (vs, CO), 1846 (vs, CO). Elementaranalyse: ber. für
C33H45O3MoGa3 (M =/794.82 g mol-1): C 49.87, H 5.71; gef.: C 49.38, H 5.66.
Synthese von [fac-(GaCp*)3W(CO)3] (9b)
Eine Suspension von [fac-(EtCN)3W(CO)3] (165 mg, 0.38 mmol) in Toluol (5 mL) wurde mit
3 Äquivalenten GaCp* (270 mg, 1.32 mmol) versetzt und für 3 h refluxiert. Nach langsamem
Abkühlen der roten Lösung auf RT wurden gelbe Kristalle erhalten. Die Kristalle wurden mit
Hexan gewaschen und im Vakuum getrocknet. Ausbeute: 455 mg (74%). 1H-NMR (C6D6,
250.1 MHz, 300 K): δ = 1.87 ppm (s, 45H, C5Me5). 13C{1H}-NMR (C6D6, 62.9 MHz, 300 K):
δ = 221.8 (CO), 114.4 (C5Me5), 10.0 ppm (C5Me5). IR (Nujol, cm-1): ν =/ 1921 (vs, CO),
1836 (vs, CO). Elementaranalyse: ber. für C33H45O3WGa3 (M = 882.70 g mol-1): C 44.90, H
5.14; gef.: C 44.69, H 4.68.
- 178 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Mo2(CO)6(µ2-(GaCp*))3] (10)
[fac-(MeCN)3Mo(CO)3] (191 mg, 0.63 mmol) und 1 Äquivalent [fac-(GaCp*)3Mo(CO)3] (9a)
(500 mg, 0.63 mmol) wurden in Toluol (20 mL) gelöst und für 2 h refluxiert. Die zuvor gelbe
Lösung verfärbt sich dunkel rot. Nach Abkühlen auf RT wurden alle flüchtigen Bestandteile
im Vakuum entfernt. Der Feststoff wurde mit Hexan gewaschen und im Vakuum getrocknet.
Das Produkt wurde durch Umkristallisation aus Toluol gereinigt. Ausbeute: 455 mg (74%).
Zerspkt. 224 °C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 2.12 ppm (s, 45H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 219.7 (CO), 116.6 (C5Me5), 10.1 ppm (C5Me5).
IR (Nujol, cm-1): ν =/1921 (vs, CO), 1857 (vs, CO). Elementaranalyse: ber. für
C36H45O6Mo2Ga3 (M = 974.79 g mol-1): C 44.36, H 4.65; gef.: C 44.34, H 4.67.
Synthese von [{Rh(Cp)(C2H4)}2(µ2-GaCp*)2] (11)
In einem abgeschnolzenem 5 mm NMR-Röhrchen (Pyrex, λ > 285nm) wurde [CpRh(C2H4)2]
(0.090 g, 0.402 mmol) in CH3CN (1 mL) bei -20° im Vakuum für 20 h photolysiert (Hereaus
150 W Hg-Dampflampe). Die tief rote Lösung wurde in ein auf -20°C gekühltes SchlenkRohr transferiert und mit GaCp* (0.100 g, 0.488 mmol) versetzt. Beim Aufwärmen der
Reaktionslösung auf RT bildete sich ein roter Niederschlag. Die überstehende Lösung wurde
abkanuliert und der Rückstand mit Hexan gewaschen und im Vakuum getrocknet. Durch
langsames Abkühlen einer gesättigten Toluol-Lösung auf -30°C kann das Produkt
umkristallisiert werden. Ausbeute: 159 mg (49%). Zerspkt. 221 °C. 1H-NMR (C6D6, 250.1
MHz, 300 K): δ = 4.96 (s, 10H, C5H5), 4.91 (s, 10H, C5H5), 2.01 (s, 30H, C5Me5), 1.96 (s,
30H, C5Me5), 1.55 (s, 8H, C2H4), 1.47 ppm (s, 8H, C2H4). 13C{1H}-NMR (C6D6, 62.9 MHz,
300 K): δ = 121.0 (C5Me5, Cp*Ga), 120.7 (C5Me5, Cp*Ga), 85.9 (C5H5, CpRh), 84.7 (C5H5,
CpRh), 20.1 (CH2, C2H4), 19.9 (CH2, C2H4), 13.4 (C5Me5, Cp*Ga), 13.3 ppm (C5Me5,
Cp*Ga). Elementaranalyse: ber. für C34H48Rh2Ga2 (M = 801.98 g mol-1): C 50.91, H 6.02;
gef.: C 50.44, H 6.08.
- 179 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Pt(GaCp*)4] (12a)
Eine Suspension von [Pt(cod)2] (0.412 g, 1.000 mmol) in Hexan (7 mL) bei –80°C wurde mit
GaCp* (0.922 g, 4.500 mmol) versetzt. Die gelbe Lösung wurde langsam auf Raumtemperatur erwärmt, wobei sich ein gelber Niederschlag bildete. Der Rückstand wurde durch
Erwärmen auf 60°C gelöst und durch langsames Abkühen auf -80°C kristallisiert. Das
kristalline Produkt wurde abfiltriert, mit Hexan gewaschen und im Vakuum getrocknet.
Ausbeute: 0.891 g (88%). 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 1.89 ppm (s, 60H,
C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 113.0 (t, JPtC = 7.2 Hz, C5Me5), 10.7
ppm (C5Me5). Elementaranalyse: ber. für C40H60Ga4Pt (M = 1013.75 g mol-1): C 47.34, H
5.96; gef.: C 46.97, H 6.07.
Synthese von [Ni(AlCp*)4] (12b)
[Ni(cod)2] (0.100 g, 0.364 mmol) und [{AlCp*}4] (0.234 g, 0.364 mmol) wurden in Hexan (8
mL) suspendiert und für 3h auf 80°C erwärmt. Nach dem Filtrieren der gelben Reaktionslösung wurde auf -30°C abgekühlt, wobei das Produkt in Form von gelben Kristallen anfällt.
(Ausbeute: 0.230 g, 90%). Zerspkt. 94°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 1.92 ppm (s,
60H).
13
C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 112.9 (C5Me5), 10.7 ppm (C5Me5).
Elementaranalyse: ber. für C40H60Al4Ni (M =707.5 g mol-1): C 67.92, H 8.49; gef.: C 67.67, H
8.54.
Synthese von [Pd(GaCp*)4] (12c)
Eine Suspension von [Pd(tmeda)(CH3)2] (0.183 g, 0.7226 mmol) in Hexan (7 mL) bei –80°C
wurde mit GaCp* (0.740 g, 3.613 mmol) versetzt. Die gelbe Lösung wurde langsam auf RT
erwärmt und für 10 min. gerührt, woraufhin sich ein hellgelber Niederschlag bildet. Die
vollständige Kristallisation des Produktes erfolgte bei -60°C. Die überstehende Lösung wurde
abkanuliert. Die hellgelben Kristalle wurden filtriert, mit Hexan gewaschen und im Vakuum
getrocknet. Ausbeute: 0.536 g (80%). Zerspkt. 85 °C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ
= 1.95 ppm (s, 60H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 113.3 (C5Me5),
- 180 -
Experimenteller Teil
___________________________________________________________________________________________________________
10.5 ppm (C5Me5). Elementaranalyse: ber. für C40H60Ga4Pd (M = 925.03 g mol-1): C 51.87, H
6.53; gef.: C 51.73, H 6.65.
Synthese von [Pd{InC(SiMe3)3}4] (12d)
Eine Lösung von [Pd(tmeda)(CH3)2] (0.100 g, 0.396 mmol) in Hexan (3 mL) wurde mit einer
Suspension von InC(SiMe3)3 (0.686 g, 1.980 mmol) in Hexan (10 mL) versetzt und für 1 h bei
60°C erwärmt. Nach Abfiltrieren der dunkelroten Lösung wurden alle flüchtigen Bestandteile
im Vakuum entfernt. Der dunkelrote Rückstand wurde in Cyclopentan gelöst und das Produkt
durch Abkühlen auf -30°C in Cyclopentan kristallisiert. Ausbeute: 0.384 g rotbraune Kristalle
(65%). Zerspkt. 152 °C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 0.42 ppm (s, 108H, SiMe3).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 64.7 (InC), 6.6. ppm (SiMe3).
Elementaranalyse: ber. für C40H108Si12In4Pd (M = 1522.1 g mol-1): C 32.20, H 7.30; gef.: C
31.44, H 7.35.
Synthese von [Pd(AlCp*)4] (12e)
Eine Suspension von [(tmeda)PdCl2] (0.150 g, 0.511 mmol) und [{AlCp*}4] (0.412 g, 0.639
mmol) in Hexan (10 mL) wurde für 5h refluxiert, wobei sich eine orange Lösung und ein
beiger Niederschlag (AlCp*Cl2) bildeten. Die Lösung wurde abfiltriert und alle flüchtigen
Bestandteile im Vakuum entfernt. Der orange Rückstand wurde in Hexan gelöst und durch
langsames Abkühlen auf -30°C in Form von gelben Kristallen kristallisiert. Ausbeute: 0.312 g
(81%). Zerspkt. 123°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 1.92 ppm (s, 60H). 13C{1H}NMR (C6D6, 62.9 MHz, 25 °C): δ = 113.0 (C5Me5), 10.8 ppm (C5Me5).
27
Al-NMR (C6D6,
65.2 MHz, 25 °C): δ = -67.2 ppm. Elementaranalyse: ber. für C40H60AlPd (M = 755.2 g mol1
): C 63.62, H 8.01; gef.: C 64.01, H 8.32.
- 181 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Ni(AlCp*)3(GaCp*)] (12f)
[Ni(AlCp*)3(H)(SiEt3] (25) (0.050 g, 0.075 mmol) und GaCp* (0.015 g, 0.075 mmol) wurden
in Hexan (3 mL) suspendiert und für 2h refluxiert. Die gelbe Lösung wurde auf -30°C
abgekühlt, wobei sich ein oranger Niederschlag bildet. Die überstehende Lösung wurde
abkanuliert, der Rückstand mit kaltem Hexan gewaschen und im Vakuum getrocknet.
Ausbeute: 0.046 g (81%). 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 2.00 (s, 15H), 1.89 ppm (s,
45H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 113.0 (C5Me5, 15C), 112.7 (C5Me5, 5C),
10.5 (C5Me5, 15C), 10.4 ppm (C5Me5, 5C). Elementaranalyse: ber. für C40H60Al3GaNi (M =
751.0 g mol-1): C 63.97; H 8.05, gef.: C 64.19, H 8.21.
Synthese von [Pt2(GaCp*)2(µ2-GaCp*)3] (13a)
[Pt(cod)2] (0.090 g, 0.217 mmol) und [Pt(GaCp*)4] (12a) (0.220 g, 0.217 mmol) wurden in
Toluol gelöst (5 mL) und für 5 min. bei RT gerührt. Nach Zugabe von GaCp* (0.044 g, 0.217
mmol) verfärbte sich die Lösung dunkelrot. Nachdem alle flüchtigen Bestandteile im Vakuum
entfernt wurden, wurde der orange Feststoff mit kaltem Hexan gewaschen und im Vakuum
getrocknet. Ausbeute: 0.284 g (93%). Alle analytischen Daten stimmen mit den bereits
veröffentlichten Daten überein.[51]
Synthese von [PtPd(GaCp*)2(µ2-GaCp*)3] (13b)
[Pt(cod)2] (0.064 g, 0.156 mmol) und [Pd(GaCp*)4] (12b) (0.144 g, 0.156 mmol) wurden in
Toluol gelöst (5 mL) und für 5 min. bei RT gerührt. Nach Zugabe von GaCp* (0.032 g, 0.156
mmol) verfärbte sich die Lösung dunkelrot. Nachdem alle flüchtigen Bestandteile im Vakuum
entfernt wurden, wurde der Feststoff im Vakuum getrocknet. Das Produkt wurde in
Diethylether (3 mL) gelöst und durch langsames Abkühlen auf -80°C kristallisiert. Ausbeute:
0.115 g (56%). Zerspkt. 90°C. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 2.06 (s, 15H,
C5Me5), 1.94 ppm (s, 60H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 114.1
(C5Me5), 113.1 (C5Me5), 11.5 (C5Me5), 10.4 ppm (C5Me5). Elementaranalyse: ber. für
C50H75Ga5PdPt (M = 1326.2 g mol-1): C 45.28, H 5.70; gef.: C 45.15, H 5.82.
- 182 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Pd2(GaCp*)2(µ2-GaCp*)3] (13c)
Eine Lösung von [Pd2(dvds)3] (0.800 g, 1.036 mmol) in Hexan (5 mL) wurde auf -30°C
gekühlt und tropfenweise mit GaCp* (1.272 g, 6.218 mmol) versetzt. Die orange Lösung
wurde langsam auf RT erwärmt, wobei sich ein oranger Niederschlag bildete. Die
überstehende Lösung wurde abkanuliert und der Rückstand mit Hexan gewaschen und im
Vakuum getrocknet. Das Produkt wurde durch langsames Abkühlen einer gesättigten ToluolLösung auf -30°C kristallisiert. Ausbeute: 1.211 g (94%). Zerspkt. 118°C. 1H-NMR (C6D6,
250 MHz, 25 °C): δ = 1.98 ppm (s, 75H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 113.3
(C5Me5), 10.8 ppm (C5Me5). Elementaranalyse: ber. für C50H75Ga5Pd2 (M = 1237.2 g mol-1):
C 48.53, H 6.11; gef.: C 48.26, H 6.32.
Synthese von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d)
Eine Suspension von [Pt2(GaCp*)5] (13a) (0.250 g, 0.177 mmol) und [{AlCp*}4] (0.085 g,
0.133 mmol) in Toluol (5 mL) wurde für 1h auf 80°C erwärmt. Die rote Lösung wurde auf
RT abgekühlt und das Produkt durch langsames Abkühlen auf -30°C kristallisiert. Ausbeute:
0.186 g (83 %). Zerspkt. 176°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 2.07 (s, 30H), 1.86
ppm (s, 45H).
13
C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 114.2 (C5Me5), 112.5 (C5Me5),
13.4 (C5Me5), 10.6 ppm (C5Me5).
27
Al-NMR (C6D6, 65.2 MHz, 25 °C): δ = -91.8 ppm.
Elementaranalyse: ber. für C50H75Al3 Ga2Pt2 (M = 1286.7 g mol-1): C 46.68, H 5.88; gef.: C
46.22, H 5.52.
Synthese von [Pd2(AlCp*)2(µ2-AlCp*)3] (13e)
Eine Suspension von [Pd2(GaCp*)5] (13c) (0.250 g, 0.202 mmol) und [{AlCp*}4] (0.090 g,
0.253 mmol) wurde in Toluol (5 mL) für 3h auf 85°C erwärmt. Die orange Reaktionslösung
verfärbte sich rot und ein rot brauner Niederschlag wurde gebildet. Alle flüchtigen
Bestandteile wurden im Vakuum entfernt. Das Produkt wurde mit kaltem Hexan gewaschen,
in Toluol suspendiert, auf 90°C erwärmt und durch langsames Abkühlen auf -30°C
kristallisiert. Ausbeute: 0.162 g (78%). Zerspkt. 204°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ
- 183 -
Experimenteller Teil
___________________________________________________________________________________________________________
= 2.00 (s, 30H), 1.94 ppm (s, 45H).
13
C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 113.9
(C5Me5), 112.8 (C5Me5), 12.5 (C5Me5), 10.6 ppm (C5Me5).
27
Al-NMR (C6D6, 65.2 MHz, 25
°C): δ = -54.4 ppm. Elementaranalyse: ber. für C50H75Al5Pd2 (M = 1023.8 g mol-1): C 58.94,
H 7.42; gef.: C 58.92, H 7.66.
Synthese von [Pt2(GaCp*)(µ2-GaCp*)3(η2-cod)] (14a)
[Pt(cod)2] (0.041 g, 0.098 mmol) und [Pt(GaCp*)4] (12a) (0.100 g, 0.098 mmol) wurden im
Verhältnis 1:1 in Hexan (5 mL) gelöst und für 5 min. bei RT gerührt, woraufhin sich ein
gelber Niederschlag bildete. Der Rückstand wurde abfiltriert, mit wenig kaltem Hexan
gewaschen und bei RT im Vakuum getrocknet. Das Produkt wurde in C6D6 gelöst und mittels
Kernresonanzspektroskopie charakterisiert. 1H-NMR (C6D6, 250.1 MHz, 300 K): δ = 4.67 (m,
2H, cod), 3.00 (m, 2H, cod), 2.20 (m, 8H, cod), 2.04 (s, 15H, C5Me5), 1.99 ppm (s, 45H,
C5Me5). 13C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 129.5 (CH, cod), 114.5 (C5Me5), 113.2
(C5Me5), 69.9 (Pt-CH, cod), 11.6 (C5Me5), 10.6 ppm (C5Me5).
Synthese von [PtPd(GaCp*)(µ2-GaCp*)3(η2-cod)] (14b)
[Pt(cod)2] (0.044g, 0.108 mmol) und [Pd(GaCp*)4] (12b) (0.100 g, 0.108 mmol) wurden im
Verhältnis 1:1 in Hexan (5 mL) gelöst und für 5 min. bei Raumtemperatur gerührt, woraufhin
sich ein gelber Niederschlag bildete. Der Rückstand wurde abfiltriert, mit wenig kaltem
Hexan gewaschen und bei Raumtemperatur im Vakuum getrocknet. Das Produkt wurde in
C6D6 gelöst und mittels Kernresonanzspektroskopie charakterisiert. 1H-NMR (C6D6, 250.1
MHz, 300 K): δ = 4.83 (m, 2H, cod), 2.97 (m, 2H, cod), 2.10 (m, 8H, cod), 2.05 (s, 15H,
C5Me5), 2.02 ppm (s, 45H, C5Me5).
13
C{1H}-NMR (C6D6, 62.9 MHz, 300 K): δ = 114.3
(C5Me5), 113.4 (C5Me5), 64.9 (Pt-CH, cod), 11.05 (C5Me5), 10.4 ppm (C5Me5).
- 184 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Pd3(InCp*)4(µ2-InCp*)4] (15a)
1) Eine Lösung von [(tmeda)Pd(CH3)2] (0.100 g, 0.396 mmol) in Hexan (4 mL) wurde mit 4
Äquivalenten InCp* (0.396 g, 1.584 mmol) in Hexan (10 mL) versetzt. Das
Reaktionsgemisch wurde für 1h auf 60°C erwärmt, wobei ein roter kristalliner Feststoff
ausfiel. Nach Umkristallisation aus Benzol wurden die Kristalle durch Abkanulieren der
Mutterlauge isoliert, mehrmals mit Hexan gewaschen und im Argon-Strom getrocknet.
Ausbeute: 0.275 g (90%).
2) [Pd2(dvds)3] (0.500 g, 0.648 mmol) und InCp* (1.133 g, 4.534 mmol) wurden in Hexan
(8 mL) gelöst und für 1h auf 50°C erwärmt. Die Reaktionslösung verfärbt sich dunkel rot
und es bildet sich ein roter Niederschlag. Nachdem alle flüchtigen Bestandteile im
Vakuum entfernt wurden, wurde der Feststoff mit kaltem Hexan gewaschen und im
Vakuum getrocknet. Ausbeute: 0.874 (88%).
Zerspkt. 81°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 2.12 (s, 120H). 13C{1H}-NMR (C6D6,
250 MHz, 25 °C): δ = 113.7 (C5Me5), 11.2 ppm (C5Me5). Elementaranalyse: ber. für
C80H120In8Pd3·C6H6 (M = 2397.6 g mol-1): C 42.97, H 5.53; gef.: C 42.79, H 5.64.
Synthese von [Pd3(GaCp*)4(µ2-GaCp*)4] (15b)
Eine Lösung von [Pd2(dvds)3] (0.500 g, 0.648 mmol) in Toluol (5 mL) wurde bei RT
tropfenweise mit GaCp* (0.927 g, 4.534 mmol) versetzt, wobei sich ein roter Niederschlag
bildete. Die überstehende Lösung wurde abkanuliert und der Rückstand mit Hexan gewaschen
und im Vakuum getrocknet. Das Produkt wurde in Toluol suspendiert und auf 90°C erwärmt.
Durch langsames Abkühlen der gesättigten Toluol-Lösung auf -30°C wurden rote Kristalle
erhalten. Ausbeute: 0.651 g (76%). Zerspkt. 178°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ =
2.05 (s, 15H), 1.96 ppm (s, 45H).
13
C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 113.6
(C5Me5), 10.4 ppm (C5Me5). Elementaranalyse: ber. für C80H120Ga8Pd3 (M = 1958.7 g mol-1):
C 49.05, H 6.17; gef.: C 48.84, H 6.18.
- 185 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Pd3(AlCp*)2(µ2-AlCp*)2(µ3-AlCp*)2] (16)
Eine Suspension von [Pd2(dvds)3] (0.250 g, 0.324 mmol) und [{AlCp*}4] (0.522 g, 0.809
mmol) wurde in Benzol (5 mL) für 1h auf 60°C erwärmt, wobei sich ein dunkel rotbrauner
Niederschlag bildete. Die überstehende Lösung wurde abkanuliert (Komplex 17), der
Rückstand wurde mit Hexan gewaschen und im Vakuum getrocknet. Das Produkt wurde in
Toluol suspendiert und auf 90°C erwärmt. Durch langsames Abkühlen der gesättigten ToluolLösung auf RT wurde das Produkt kristallisiert. Ausbeute: 0.178 g (64%). Zerspkt. 196°C.
1
H-NMR (C6D6, 250 MHz, 25 °C): δ = 2.12 (s, 30H), 1.97 ppm (s, 60H).
13
C{1H}-NMR
(C6D6, 62.9 MHz, 25 °C): δ = 113.8 (C5Me5), 113.0 (C5Me5), 14.3 (C5Me5), 11.2 (C5Me5)
ppm.
27
Al-NMR (C6D6, 65.2 MHz, 25 °C): δ = -44.6 ppm. Elementaranalyse: ber. für
C60H90Al6Pd3⋅C6H5(CH3) (M = 1384.4 g mol-1): C 58.10, H 7.13; gef.: C 57.87, H 7.19.
Synthese von [(dvds)(µ2-AlCp*)2] (17)
Eine Suspension von dvds (0.144 g, 0.774 mmol) und [{AlCp*}4] (0.250 g, 0.387 mmol) in
Toluol (5 mL) wurde auf 60°C für 1h erwärmt. Die farblose Lösung wurde langsam auf -30°C
gekühlt, wobei sich farblose Kristalle bildeten. Die überstehende Lösung wurde abkanuliert
und die Kristalle mit Hexan gewaschen und im Vakuum getrocknet. Ausbeute: 0.326 g (83%).
Zerspkt. 103°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 1.96 (s, 15H), 1.95 (s, 15H), 0.550.32 (m, 4H), 0.29 (s, 6H), 0.11 (s, 6H), -0.26 ppm (t, J(H-H) = 8.7 Hz, 2H). 13C{1H}-NMR
(C6D6, 62.9 MHz, 25 °C): δ = 114.3 (C5Me5), 114.1 (C5Me5), 13.8 (CH), 10.7 (C5Me5), 10.6
(C5Me5), 10.1 (CH2), 3.6 (SiMe2), -0.2 ppm (SiMe2). Elementaranalyse: ber. für
C28H48Al2Si2O (M = 510.8 g mol-1): C 65.84, H 9.47; gef.: C 65.57, H 9.32.
Synthese von [Pt2(PPh3)(GaCp*)(µ2-GaCp*)3] (18a)
Eine Lösung von [Pt2(GaCp*)5] (13a) (0.200 g, 0.141 mmol) und PPh3 (0.074 g, 0.282 mmol)
in Toluol (6 mL) wurde für 4h auf 80°C erwärmt. Nachdem alle flüchtigen Bestandteile im
Vakuum entfernt wurden, wurde der gelbe Feststoff mit Hexan gewaschen und im Vakuum
getrocknet. Das Produkt wurde in Toluol gelöst und durch langsames Abkühlen auf -30°C
- 186 -
Experimenteller Teil
___________________________________________________________________________________________________________
kristallisiert. Ausbeute: 0.156 g (75%). Zerspkt. 121°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ
= 7.75-7.10 (m, 15H), 2.12 (s, 15H), 1.84 ppm (s, 45H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25
°C): δ = 141.3 (d, J(P,C) = 44.2 Hz), 135.7 (d, J(P,C) = 14.5 Hz), 129.3 (d, J(P,C) = 4.8 Hz),
125.7, 114.3 (C5Me5), 112.8 (C5Me5), 11.2 (C5Me5), 10.5 ppm (C5Me5). 31P{1H}-NMR (C6D6,
101.3 MHz, 25°C): δ = 66.0 ppm (1J(Pt,P) = 5685 Hz; 2J(Pt,P) = 276 Hz). Elementaranalyse:
ber. für C58H75Ga4PPt2 (M = 1472.2 g mol-1): C 47.32, H 5.13; gef.: C 47.67, H 4.95.
Synthese von [PtPd(PPh3)(GaCp*)(µ2-GaCp*)3] (18b)
Eine Lösung von [PtPd(GaCp*)5] (13b) (0.100 g, 0.075 mmol) und PPh3 (0.020 g, 0.075
mmol) in Toluol (3 mL) wurde für 1h bei RT gerührt. Nachdem alle flüchtigen Bestandteile
im Vakuum entfernt wurden, wurde der gelbe Feststoff mit Hexan gewaschen und im
Vakuum getrocknet. Das Produkt wurde in Toluol gelöst und durch langsames Abkühlen auf 30°C kristallisiert. Ausbeute: 0.078 g (75%). Zerspkt. 114°C. 1H-NMR (C6D6, 250 MHz, 25
°C): δ = 7.85-7.25 (m, 15H), 2.11 (s, 15H), 1.84 ppm (s, 45H).
13
C{1H}-NMR (C6D6, 62.9
MHz, 25 °C): δ = 139.1 (d, J(P,C) = 28.4 Hz), 135.3 (d, J(P,C) = 17.7 Hz), 129.3 (d, J(P,C) =
2.4 Hz), 128.1, 114.1 (C5Me5), 112.9 (C5Me5), 11.2 (C5Me5), 10.6 ppm (C5Me5).
31
P{1H}-
NMR (C6D6, 101.3 MHz, 25°C): δ = 53.0 ppm (t, 2JPt-P = 494 Hz). Elementaranalyse: ber. für
C58H75Ga4PPdPt (M = 1383.5 g mol-1): C 50.35, H 5.46; gef.: C 50.02, H 5.24.
Synthese von [Pd2(PPh3)2(µ2-GaCp*)3] (19)
Eine Lösung von [Pd2(GaCp*)5] (13c) (0.100 g, 0.081 mmol) und PPh3 (0.042 g, 0.161 mmol)
in Toluol (3 mL) wurde auf 40°C für 1h erwärmt. Nachdem alle flüchtigen Bestandteile im
Vakuum entfernt wurden, wurde der gelbe Feststoff mit Hexan gewaschen und im Vakuum
getrocknet. Das Produkt wurde in Toluol bei 80°C gelöst und durch langsames Abkühlen auf
-30°C kristallisiert. Ausbeute: 0.089 g (82%). Zerspkt. 119°C. 1H-NMR (C6D6, 250 MHz, 25
°C): δ = 7.85-7.05 (m, 30H), 1.77 ppm (s, 45H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ =
135.5 (d, J(P,C) = 8.4 Hz), 135.4 (d, J(P,C) = 9.0 Hz), 129.3 (d, J(P,C) = 2.4 Hz), 127.2,
113.9 (C5Me5), 10.4 ppm (C5Me5). 31P{1H}-NMR (C6D6, 101.3 MHz, 25°C): δ = 34.8 ppm.
Elementaranalyse: ber. für C66H75Ga4P2Pd2 (M = 1352.2 g mol-1): C 58.62, H 5.59; gef.: C
58.71, H 5.69.
- 187 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Pt2(CNtBu)2(µ2-GaCp*)3] (20)
Eine Lösung von [Pt2(GaCp*)5] (13a) (0.200 g, 0.141 mmol) und t-BuNC (0.047 g, 0.565
mmol) wurde in Toluol (3 mL) auf 60°C für 1h erwärmt. Nachdem alle flüchtigen
Bestandteile im Vakuum entfernt wurden, wurde der gelbe Feststoff in Hexan gelöst und
durch langsames Abkühlen auf -30°C kristallisiert. Ausbeute: 0.158 g (95 %). Zerspkt. 192°C.
1
H-NMR (C6D6, 250 MHz, 25 °C): δ = 2.05 (s, 45H), 1.14 ppm (s, 18H).
13
C{1H}-NMR
(C6D6, 62.9 MHz, 25 °C): δ = 175.1 (CNCMe3), 113.1 (C5Me5), 54.6 (CNCMe3), 30.7
(CNCMe3), 10.8 ppm (C5Me5). Elementaranalyse: ber. für C40H63Ga3N2Pt2 (M = 1171.3 g
mol-1): C 41.02, H 5.42, N 2.39; gef.: C 40.92, H 5.77, N 2.39.
Synthese von [Pt2(CO)2(µ2-GaCp*)3] (21a)
In einem J-Young-NMR-Röhrchen der Firma Wilmad (PTFE Kappe für Gasreaktionen)
wurde eine Lösung von [Pt2(GaCp*)5] (13a) (0.020 g, 0.014 mmol) in C6D6 (0.6 mL) mit 875
mbar CO (2 mL, 0.070 mmol) für 10 min zur Reaktion gebracht. Der Reaktionsverlauf wurde
mittels NMR-Spektroskopie verfolgt (Freisetzung von 2 Äquivalenten GaCp*). Die Isolierung
des Produktes durch langsames Eindampfen unter Vakuum oder Normadruck führte zur
Zersetzung des Reaktionsgemisches unter Bildung eines metallischen Niederschlages. 1HNMR (C6D6, 250 MHz, 25 °C): δ = 1.85 ppm (s, 45H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25
°C): δ = 209.6 (CO), 113.9 (C5Me5), 10.2 ppm (C5Me5). IR (C6D6, cm-1): ν = 1962 (vs, CO).
Synthese von [Pt2(CO)2(µ2-AlCp*)3] (21b)
In einem J-Young-NMR-Röhrchen der Firma Wilmad (PTFE Kappe für Gasreaktionen)
wurde eine Lösung von [Pt2(GaCp*)2(µ2-AlCp*)3] (13d) (0.020 g, 0.016 mmol) in C6D6 (0.6
mL) mit 950 mbar CO (2 mL, 0.080 mmol) zur Reaktion gebracht. Der Reaktionsverlauf
wurde mittels NMR-Spektroskopie verfolgt, wobei nach zwei Tagen die Reaktion
abgeschlossen war (Freisetzung von 2 Äquivalenten GaCp*). Die Isolierung des Produktes
durch langsames Eindampfen unter Vakuum oder unter Normadruck führte zur Zersetzung
des Reaktionsgemisches unter Bildung eines metallischen Niederschlages. 1H-NMR (C6D6,
- 188 -
Experimenteller Teil
___________________________________________________________________________________________________________
250 MHz, 25 °C): δ = 1.87 ppm (s, 45H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 210.4
(CO), 114.1 (C5Me5), 10.8 ppm (C5Me5).
Al-NMR (C6D6, 65.2 MHz, 25 °C): δ = - 47.1
27
-1
ppm. IR (C6D6, cm ): ν = 1954 (vs, CO).
Synthese von [Pd2(CO)(AlCp*)(µ2-AlCp*)3] (21c)
In einem J-Young-NMR-Röhrchen der Firma Wilmad (PTFE Kappe für Gasreaktionen)
wurde eine Lösung von [Pd2(AlCp*)5] (13e) (0.010 g, 0.010 mmol) in C6D6 (0.6 mL) mit 600
mbar CO (2 mL, 0.050 mmol) zur Reaktion gebracht. Der Reaktionsverlauf wurde mittels
NMR-Spektroskopie verfolgt, wobei nach zwei Tagen ein Verhältnis Edukt/Produkt von 1:4
detektiert wurde. Die Isolierung des Produktes durch langsames Eindampfen unter Vakuum
oder unter Normadruck führte zur Zersetzung des Reaktionsgemisches unter Bildung unter
Bildung eines metallischen Niederschlages. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 1.93 ppm
(s, 45H), 1.92 ppm (s, 15H).
Synthese von [Pd3(PPh3)3(µ2-InCp*)(µ3-InCp*)2] (22)
Ein Gemisch von [Pd3(InCp*)8] (15a) (0.200 g, 0.086 mmol) und PPh3 (0.090 g, 0.344 mmol)
wurde für 20 min in Toluol (3 mL) gerührt. Das Lösungsmittel wurde im Vakuum entfernt,
der ölige Rückstand mit Hexan gewaschen und im Vakuum getrocknet. Das orange Produkt
wurde aus einem Gemisch Toluol/Hexan kristallisiert. Ausbeute: 0.109 (68%). Zerspkt.
112°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 7.85-7.35 (m, 45H), 2.11 (s, 15H), 1.70 ppm
(s, 30H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 140.4 (d, J(P-C) = 13.4 Hz), 140.2 (d,
J(P-C) = 13.9 Hz), 139.6, 139.2, 135.3 (d, J(P,C) = 7.9 Hz), 135.0 (d, J(P,C) = 8.2 Hz), 129.1
(d, J(P,C) = 6.4 Hz), 114.1 (C5Me5), 113.7 (C5Me5), 11.1 (C5Me5), 10.9 ppm (C5Me5).
31
P{1H}-NMR (C6D6, 101.3 MHz, 25°C): δ = 30.3, 13.6 ppm. Elementaranalyse: ber. für
C84H90In3P3Pd3 (M = 1856.1 g mol-1): C 54.36, H 4.89; gef.: C 54.46, H 4.96.
- 189 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Pd3(dppe)2(µ2-InCp*)(µ3-InCp*)2] (23)
Ein Reaktionsgemisch von [Pd3(InCp*)8] (15a) (0.200 g, 0.086 mmol) und dppe (0.085 g,
0.215 mmol) wurde für 1h in Toluol (3 mL) gerührt, wobei sich ein oranger Niederschlag
bildete. Das Lösungsmittel wurde im Vakuum entfernt, der Rückstand mit Hexan gewaschen
und im Vakuum getrocknet. Das Produkt wurde durch langsames Abkühlen einer warmen
Toluol-Lösung (90°C) auf RT kristallisiert. Ausbeute: 0.113 (70%). Zerspkt. 205°C. 1H-NMR
(C6D6, 250 MHz, 25 °C): δ = 7.85-7.00 (m, 40H), 2.54 (s, 15H), 2.10 (s, 8H), 1.67 ppm (s,
30H).
13
C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 129.3, 129.1, 128.5, 125.7, 114.1
(C5Me5), 113.6 (C5Me5), 21.4 (CH2), 11.8 (C5Me5), 11.0 ppm (C5Me5). 31P{1H}-NMR (C6D6,
101.3 MHz, 25°C): δ = 28.4 (3J(P,P) = 24.3 Hz), 20.9 ppm (3J(P,P) = 24.6 Hz).
Elementaranalyse: ber. für C78H85In3P4Pd3 (M = 1856.1 g mol-1): C 51.76, H 4.73; gef.: C
51.94, H 4.87.
Synthese von [Ni(AlCp*)3(HAlCp*Ph)] (24a)
[Ni(cod)2] (0.100 g, 0.364 mmol) und [{AlCp*}4] (0.234 g, 0.364 mmol) wurden in Benzol (8
mL) suspendiert und für 3h auf 70°C erwärmt. Nach dem Entfernen des Lösungsmittels im
Vakuum wurde der gelbe Rückstand in Hexan (8 mL) aufgenommen und das Produkt durch
langsames Abkühlen auf -30°C kristallisiert. Ausbeute: 0.232 g (81%). Zerspkt. 85°C. 1HNMR (C6D6, 250 MHz, 25 °C): δ = 7.35-7.15 (m, 5H), 2.04 (s, 15 H), 1.84 (s, 45 H), -11.10
ppm (s, 1 H) . 13C{1H}-NMR (C6D6, 62.9 MHz, 25 °C): δ = 136.4 (o-C6H5), 125.9 (m-C6H5),
125.4 (p-C6H5), 117.6 (C5Me5, 5 C), 113.6 (C5Me5, 15 C), 13.5 (C5Me5, 5 C), 10.5 ppm
(C5Me5, 15 C). 27Al-NMR (C6D6, 65.2 MHz, 25 °C): δ = -41.2 ppm. MS (70 EV): m/z (%):
328 (5) [(C10H15)2Ni+], 136 (60) [Cp*H+], 121 (100) [Cp*H+-CH3], 105 (45) [Cp*H+-C2H5],
41 (85) [C3H5+], 27 (50) [Al+]. Elementaranalyse: ber. für C46H66Al4Ni (M = 785.6 g mol-1): C
70.33; H 8.47, gef.: C 69.83, H 8.12.
- 190 -
Experimenteller Teil
___________________________________________________________________________________________________________
Synthese von [Ni(AlCp*)3(HAlC6H5CH3Tol)] (24b)
[Ni(cod)2] (0.100 g, 0.364 mmol) und [{AlCp*}4] (0.234 g, 0.364 mmol) wurden in Benzol (8
mL) suspendiert und für 3h auf 70°C erwärmt. Nach dem Entfernen des Lösungsmittels im
Vakuum wurde der gelbe Rückstand in Hexan (8 mL) aufgenommen und das Produkt durch
langsames Abkühlen auf -30°C kristallisiert. Ausbeute (bezogen auf alle Isomere): 0.224 g
(77%).
meta-Komplex: 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 7.35 – 7.15 (m, 4H), 2.41 (s, 3H,
C6H5CH3), 2.04 (s, 15H), 1.84 ppm (s, 45H), -10.90 ppm (1H).
para-Komplex: 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 7.35 – 7.15 ppm (m, 4H), 2.28 (s, 3H,
C6H4CH3), 2.06 (s, 15H), 1.85 (s, 45H), -11.30 ppm (1H)
Synthese von [NiH(SiEt3)(AlCp*)3] (25)
[Ni(cod)2] (0.050 g, 0.182 mmol) und [{AlCp*}4] (0.088 g, 0.136 mmol) wurden in
Triethylsilan (1 mL) suspendiert und für 3h auf 75 °C erwärmt. Alle flüchtigen Bestandteile
wurden im Vakuum entfernt und das Produkt durch langsames Abkühlen einer Hexan-Lösung
auf -30°C in Form von gelben Kristallen isoliert. Ausbeute: 0.101 g (84%). Zerspkt. 98°C.
1
H-NMR (C6D6, 250 MHz, 25 °C): δ = 1.88 (s, 45H), 1.25 (t, 3J(H,H) = 7.8 Hz, 9H, CH3),
0.84 (q, 3J(H,H) = 7.6 Hz, 6H, CH2), -12.80 ppm (s, 1H). 13C{1H}-NMR (C6D6, 62.9 MHz, 25
°C): δ = 113.6 (C5Me5), 20.6, 11.8, 10.4 ppm (C5Me5). 27Al-NMR (C6D6, 65.2 MHz, 25 °C): δ
= - 35.2 ppm. MS (70 EV): m/z (%): 328 (1) [(C10H15)2Ni+], 162 (5) [(C10H15)2Al+], 136 (20)
[Cp*H+], 121 (45) [Cp*H+-CH3], 105 (25) [Cp*H+-C2H5], 87 (80) [HSi(C2H5)+], 59 (100)
[H2Si(C2H5)+], 27 (25) [Al+]. Elementaranalyse: ber. für C36H61Al4SiNi (M = 661.6 g mol-1):
C 65.36; H 9.29; gef.: C 65.19, H 9.42.
Synthese von [Ni(AlCp*)3(PPh3)] (26)
24 (0.050 g, 0.075 mmol) und PPh3 (0.015 g, 0.075 mmol) wurden in Hexan (3 mL)
suspendiert und für 2h refluxiert. Die gelbe Lösung wurde auf -30°C abgekühlt, wobei sich
ein oranger Niederschlag bildete. Die überstehende Lösung wurde abkanuliert, der Rückstand
- 191 -
Experimenteller Teil
___________________________________________________________________________________________________________
mit kaltem Hexan gewaschen und im Vakuum getrocknet. Ausbeute: 0.046 g (75%). 1H-NMR
(C6D6, 250 MHz, 25 °C): δ = 7.85-7.55 (m, 15H), 1.86 ppm (s, 45H). 13C{1H}-NMR (C6D6,
62.9 MHz, 25 °C): δ = 147.0, (d, J(P,C) = 28.0 Hz), 133.7 (d, J(P,C) = 13.8 Hz), 127.0 (d,
J(P,C) = 8.5 Hz), 113.2 (C5Me5), 10.3 ppm (C5Me5).
31
P{1H}-NMR (C6D6, 101.3 MHz,
25°C): δ = 69.74. Elementaranalyse: ber. für C48H60Al3PNi (M = 808.6 g mol-1): C 71.30, H
7.48; gef.: C 71.42, H 7.61.
Synthese von [Fe(AlCp*)5] (27 und 28)
[Fe(η6-C6H5CH3)(η4-C4H8)] (0.100 g, 0.495 mmol) und [{AlCp*}4] (0.478 g, 0.742 mmol)
wurden in Toluol suspendiert und für 2 h auf 80°C erwärmt. Die orange Lösung wurde von
überschüssigem AlCp* filtriert. Nach dem Entfernen des Lösungsmittels im Vakuum wurde
der gelbe Rückstand in warmen Toluol (6 mL) aufgenommen und das zweifach aktivierte
Produkt [Fe(AlCp*)5] (27) durch schnelles Abkühlen auf -30°C kristallisiert. Ausbeute (27):
0.137 g (32%). Längere Kristallisationszeiten der Mutterlauge erhöhen den Anteil an dem
dreifach aktivierten Komplex [Fe(AlCp*)5] (28) im Feststoff. Mehrmaliges fraktioniertes
Kristallisieren liefert definierte Einkristalle, die Komplex 28 zu ca. 70% neben 30% 27
enthalten.
Verbindung 27: Zerspkt. 265°C. 1H-NMR (C6D6, 250 MHz, 25 °C): δ = 2.23 (s, 6H, CH3),
2.20 (s, 15 H, CH3), 2.09 (s, 6H, CH3), 1.88 (s, 6H, CH3), 1.82 (s, 30H, CH3), 1.63 (s, 6H,
CH3), 1.04 (s, 2H, CH2), 0.76 (s, 2H, CH2), -19.00 ppm (s, 2H).
13
C{1H}-NMR (C6D6, 62.9
MHz, 25 °C): δ = 126.9 (C5Me5), 123.9 (C5Me5), 118.9 (C5Me5), 118.2 (C5Me5), 114.8
(C5Me5), 112.7 (C5Me5), 112.6 (C5Me5), 110.5 (C5Me5), 17.3 (CH2), 15.1 (CH2), 14.3
(C5Me5), 12.3 (C5Me5), 12.2 (C5Me5), 11.2 (C5Me5), 11.1 (C5Me5), 11.0 ppm (C5Me5, 10C).
27
Al-NMR (C6D6, 65.2 MHz, 25 °C): δ = - 2.5 ppm. Elementaranalyse: ber. für C50H75Al5Fe
(M = 866.7 g mol-1): C 69.28; H 8.72, gef.: C 69.43, H 8.84.
Verbindung 28: 1H-NMR (C6D6, 250 MHz, 25 °C): 2.02 (s, 15H, CH3), 1.77 (s, 15H, CH3),
1.03-0.75 (m, 6H, CH2), -18.17 ppm (s, 3H).
- 192 -
5. Ergänzende kristallographische Daten
Summenformel
Molgewicht [g mol-1]
Temperatur [K]
Kristallgröße [mm3]
Wellenlänge [Å]
Kristallsystem
Raumgruppe
a (Å)
b (Å)
c (Å)
α (°)
β (°)
γ (°)
Zellvolumen [Å3]
Z
δber. [g cm-3]
µ [mm-1]
F (000)
Messbereich 2θ [°]
Index-Bereich
Anzahl der Reflexe
Unabhängige Reflexe
Goodness-of-fit on F2
Finaler RF
[I>2σ(I)]
R (alle Daten)
1a
C34H40O4Mo2Ga2
844.01
213(2)
0.32 × 0.25 × 0.20
0.71073
Orthorhombisch
Pbca
14.528(3)
12.080(2)
18.694(4)
90
90
90
3280.9(11)
4
1.709
2.407
1688
2.45 – 27.50
1b
C34H40O4Wo2Ga2
1019.81
213(2)
0.24 × 0.20 × 0.16
0.71073
Orthorhombisch
Pbca
14.444(3)
12.094(3)
18.669(4)
90
90
90
3261.2(12)
4
2.077
8.702
1944
2.45 – 27.50
2a
C40H60Cl2Ga3Rh
923.85
213(2)
0.45 × 0.25 × 0.15
0.71073
Orthorhombisch
Pbca
10.707(4)
21.664(9)
34.608(14)
90
90
90
8028(6)
8
1.529
2.555
3776
2.22 – 25.09
2b
C40H60Cl2In3Rh
1059.2
213(2)
0.35 × 0.20 × 0.20
0.71073
Orthorhombisch
Pbca
10.732(19)
21.72(4)
35.49(5)
90
90
90
8272(24)
8
1.701
2.199
4208
2.19 – 25.49
3
C40H96Cl2In3Si9Rh
1348.25
213(2)
0.30 × 0.15 × 0.15
0.71073
Monoklin
P2(1)/n
14.509(3)
18.830(4)
22.633(5)
90
92.88(3)
90
6176(2)
4
1.655
1.655
2752
1.41 – 25.05
4
C30H45Cl3Ga3Rh
824.08
213(2)
0.22 × 0.13 × 0.06
0.71073
Monoklin
P2(1)/n
11.652(2)
18.467(4)
15.991(3)
90
94.40(3)
90
3430.8(12)
4
1.595
3.054
1656
3.15 – 25.06
5
C50H79Rh2In3Cl4O2
1404.21
100(2)
0.40 × 0.30 × 0.03
0.71073
Triklin
P⎯1
10.004(2)
15.458(3)
19.400(4)
101.842(5)
98.540(5)
95.925(5)
2876.0(11)
2
1.622
1.966
1400
2.32 – 25.12
–18≤h≤6, –10≤k≤10,
–22≤l≤24
8672
2995 [Rint = 0.0272]
1.034
R1 = 0.0379,
wR2 = 0.0964
R1 = 0.0502,
wR2 = 0.1035
–18≤h≤18, –3≤k≤15,
–18≤l≤17
8742
3225 [Rint = 0.0296]
1.120
R1 = 0.0305,
wR2 = 0.0602
R1 = 0.0460,
wR2 = 0.0658
–12≤h≤12,–17≤k≤25,
–41≤l≤35
39346
7123 [Rint = 0.1259]
1.078
R1 = 0.0559,
wR2 = 0.1059
R1 = 0.0901,
wR2 = 0.1182
–12≤h≤11, –26≤k≤11,
–38≤l≤39
21255
7199 [Rint = 0.0764]
1.037
R1 = 0.0558,
wR2 = 0.1241
R1 = 0.0906,
wR2 = 0.1392
–8≤h≤17, –22≤k≤22,
–26≤l≤26
34115
10693 [Rint = 0.0438]
1.050
R1 = 0.0435,
wR2 = 0.1141
R1 = 0.0639,
wR2 = 0.1316
–13≤h≤13,–21≤k≤22,
–14≤l≤19
23283
6060 [Rint = 0.0863]
0.851
R1 = 0.0431,
wR2 = 0.0835
R1 = 0.0827,
wR2 = 0.0922
–11≤h≤11, –18≤k0≤17,
–21≤l≤23
20950
9907 [Rint = 0.0248]
1.085
R1 = 0.0281,
wR2 = 0.0781
R1 = 0.0322,
wR2 = 0.0810
- 193 -
Summenformel
Molgewicht [g mol-1]
Temperatur [K]
Kristallgröße [mm3]
Wellenlänge [Å]
Kristallsystem
Raumgruppe
a (Å)
b (Å)
c (Å)
α (°)
β (°)
γ (°)
Zellvolumen [Å3]
Z
δcalc. [g cm-3]
µ [mm-1]
F (000)
Messbereich 2θ [°]
Index-Bereich
Anzahl der Reflexe
Unabhängige Reflexe
Goodness-of-fit on F2
Finaler RF
[I>2σ(I)]
R (alle Daten)
8
C54H79Ga3Rh2
1143.15
203(2)
0.30 × 0.25 × 0.20
0.71073
Triklin
P⎯1
11.819(7)
13.990(9)
17.931(10)
74.978(16)
71.020(14)
67.023(14)
2551(3)
2
1.488
2.230
1172
2.15 – 25.41
9a
C33H45O3MoGa3
794.82
213(2)
0.44 × 0.30 × 0.28
0.71073
Triklin
P⎯1
8.5243(15)
11.569(2)
18.712(3)
89.21(2)
89.82(2)
79.09(2)
1811.8(5)
2
1.457
2573
804
1.79 – 25.00
9b
C33H45O3WGa3
882.70
213(2)
0.30 × 0.20 × 0.20
0.71073
Triklin
P⎯1
8.4993(3)
11.553(2)
18.713(8)
89.215(7)
89.850(7)
79.041(7)
1803(13)
2
1.625
5.423
868
2.44 – 25.18
10
C36H45O6Mo2Ga3
974.79
213(2)
0.12 × 0.18 × 0.25
0.71073
Monoklin
P2(1)/n
22.227(5)
12.603(3)
17.519(4)
90
111.735(4)
90
4558.8(17)
4
1.420
2.320
1944
2.06 – 25.10
11
C34H18Ga2Rh2
801.98
213(2)
0.28 × 0.25 × 0.20
0.71073
Orthorhombisch
Pbca
15.283(3)
11.742(2)
17.902(4)
90
90
90
3212.8(12)
4
1.658
2.689
1616
2.47 – 25.05
12a
C40H60Ga4Pt
1014.85
213(2)
0.35× 0.35 × 0.25
0.71073
Tetragonal
I⎯4
12.1466(12)
12.1466(12)
15.095(3)
90
90
90
2227.2(6)
2
1.513
5.540
1004
2.70 – 25.04
12b
C40H60Al4Ni
707.51
213(2)
0.40× 0.30 × 0.30
0.71073
Tetragonal
I⎯4
12.1322(19)
12.1322(19)
14.867(5)
90
90
90
2188.2(9)
2
1.074
0.547
760
2.74 – 24.99
–14≤h≤14, –13≤k≤16,
–15≤l≤21
15132
9154 [Rint = 0.0802]
0.906
R1 = 0.0593,
wR2 = 0.1170
R1 = 0.1197,
wR2 = 0.1388
–9≤h≤10, –10≤k≤13,
–22≤l≤20
10230
6227 [Rint = 0.0413]
1.097
R1 = 0.0439,
wR2 = 0.1100
R1 = 0.0656,
wR2 = 0.1351
–9≤h≤10,–9≤k≤13,
–22≤l≤22
10112
6273 [Rint = 0.0565]
0.984
R1 = 0.0522,
wR2 = 0.1240
R1 = 0.0675,
wR2 = 0.1332
–24≤h≤26, –15≤k≤12,
–20≤l≤20
22905
8018 [Rint = 0.0478]
0.953
R1 = 0.0384,
wR2 = 0.0824
R1 = 0.0609,
wR2 = 0.0882
–18≤h≤17, –13≤k≤13,
–21≤l≤18
17290
2832 [Rint = 0.0787]
1.025
R1 = 0.0371,
wR2 = 0.0906
R1 = 0.0561,
wR2 = 0.1002
–14≤h≤13,–14≤k≤7,
–11≤l≤17
2841
1872 [Rint = 0.0323]
0.856
R1 = 0.0286,
wR2 = 0.0628
R1 = 0.0320,
wR2 = 0.0675
–14≤h≤10, –14≤k≤6,
–17≤l≤17
2809
1809 [Rint = 0.0250]
1.088
R1 = 0.0334,
wR2 = 0.0806
R1 = 0.0360,
wR2 = 0.0837
- 194 -
Summenformel
Molgewicht [g mol-1]
Temperatur [K]
Kristallgröße [mm3]
Wellenlänge [Å]
Kristallsystem
Raumgruppe
a (Å)
b (Å)
c (Å)
α (°)
β (°)
γ (°)
Zellvolumen [Å3]
Z
δcalc. [g cm-3]
µ [mm-1]
F (000)
Messbereich 2θ [°]
Index-Bereich
Anzahl der Reflexe
Unabhängige Reflexe
Goodness-of-fit on F2
Finaler RF
[I>2σ(I)]
R (alle Daten)
12c
C40H60Ga4Pd
926.16
213(2)
0.44 × 0.32 × 0.20
0.71073
Tetragonal
I⎯4
12.1107(16)
12.1107(16)
15.192(4)
90
90
90
2228.2(7)
2
1.380
2.806
940
2.15 – 29.99
12e
C50H75Al5Pd
755.20
213(2)
0.40 × 0.40 × 0.30
0.71073
Tetragonal
I⎯4
12.178(2)
12.178(2)
15.015(5)
90
90
90
2226.6(9)
2
1.126
0.519
796
2.15 – 25.00
13c
C51.75H77Ga5Pd
1260.53
203(2)
0.45 × 0.40 × 0.35
0.71073
Triklin
P⎯1
15.205(4)
20.824(6)
20.879(6)
60.279(7)
87.525(7)
85.723(7)
8867(28)
4
1.462
2.960
2583
1.13 – 25.31
13d
C50H75Al3Ga2Pd
1286.66
103(2)
0.20 × 0.15 × 0.10
0.71073
Monoklin
C2/c
45.097(2)
11.6375(8)
22.473(2)
90
98.326(6)
90
11669(15)
8
1.465
5.766
5056
3.12 – 25.07
13e
C50H75Al5Pd
1023.80
208(2)
0.40 × 0.35 × 0.30
0.71073
Monoklin
C2/c
14.984(5)
20.096(6)
19.032(8)
90
101.947(13)
90
5607(3)
4
1.213
0.748
2128
2.19 – 26.15
15a
C80H120In8Pd
2319.52
213(3)
0.35 × 0.28 × 0.20
0.71073
Triklin
P⎯1
12.826(3)
16.146(4)
25.215(6)
97.595(4)
101.31(2)
111.31(2)
4650.0(18)
2
1.657
2.543
2260
1.39 – 25.08
15b
C80H120Ga8Pd3
1958.72
213(2)
0.50 × 0.35 × 0.10
0.71073
Monoklin
C2/c
31.92(5)
12.69(3)
24.88(4)
90
118.41(5)
90
8867(28)
4
1.467
3.017
3944
2.15 – 25.06
–17≤h≤11, –17≤k≤13,
–21≤l≤18
2137
1911[Rint = 0.0333]
1.024
R1 = 0.0388,
wR2 = 0.0824
R1 = 0.0541,
wR2 = 0.0899
–14≤h≤14, –7≤k≤14,
–17≤l≤11
3002
1921 [Rint = 0.0183]
1.057
R1 = 0.0266,
wR2 = 0.0645
R1 = 0.0279,
wR2 = 0.0651
–18≤h≤16,–24≤k≤24,
–25≤l≤16
33260
20381 [Rint = 0.0463]
1.051
R1 = 0.0698,
wR2 = 0.1738
R1 = 0.1261,
wR2 = 0.2021
–41≤h≤53, –13≤k≤13,
–26≤l≤20
44079
10322 [Rint = 0.0549]
0.929
R1 = 0.0359,
wR2 = 0.0747
R1 = 0.0549,
wR2 = 0.0795
–18≤h≤17, –23≤k≤23,
–18≤l≤23
16002
5311 [Rint = 0.0458]
1.059
R1 = 0.0540,
wR2 = 0.1615
R1 = 0.0784,
wR2 = 0.1839
–15≤h≤14,–19≤k≤17,
–22≤l≤30
23924
16005 [Rint = 0.0322]
1.055
R1 = 0.0705,
wR2 = 0.2253
R1 = 0.1126,
wR2 = 0.2949
–37≤h≤36,–15≤k≤6,
–29≤l≤27
11752
7567 [Rint = 0.0498]
0.962
R1 = 0.0521,
wR2 = 0.1144
R1 = 0.1103,
wR2 = 0.1354
- 195 -
Summenformel
Molgewicht [g mol-1]
Temperatur [K]
Kristallgröße [mm3]
Wellenlänge [Å]
Kristallsystem
Raumgruppe
a (Å)
b (Å)
c (Å)
α (°)
β (°)
γ (°)
Zellvolumen [Å3]
Z
δcalc. [g cm-3]
µ [mm-1]
F (000)
Messbereich 2θ [°]
Index-Bereich
Anzahl der Reflexe
Unabhängige Reflexe
Goodness-of-fit on F2
Finaler RF
[I>2σ(I)]
R (alle Daten)
16
C60H90Al6Pd3
1292.40
103(2)
0.15 × 0.10 × 0.10
0.71073
Monoklin
C2
18.817(5)
22.799(4)
48.790(5)
90
90.050(14)
90
20932(7)
12
1.230
0.871
7992
2.74 – 25.07
17
C28H48Al2OSi2
510.80
103(2)
0.15 × 0.10 × 0.10
0.71073
Orthorhombisch
Pbca
17.196(10)
15.346(8)
22.706(9)
90
90
90
5992(5)
8
1.133
0.195
2224
3.20 – 25.10
18a
C58H75Ga4PPt2
1472.21
100(1)
0.15 × 0.20 × 0.20
0.71073
Triklin
P⎯1
11.579(3)
11.648(4)
21.529(6)
101.19(3)
96.27(2)
97.47(3)
2797.4(14)
2
1.748
6.944
1436
2.58 – 30.07
18b
C58H75Ga4PPdPt
1383.52
203(2)
0.45 × 0.35 × 0.30
0.71073
Triklin
P⎯1
11.577(4)
11.834(3)
21.723(6)
100.549(7)
96.808(7)
97.273(7)
2871(15)
2
1.600
4.644
1372
2.15 – 25.06
19
C70H79Ga3P2Pd
1404.23
213(2)
0.40 × 0.35 × 0.25
0.71073
Trigonal
P⎯3
11.9551(13)
11.9551(13)
29.123(7)
90
90
120
3604.7(10)
2
1.294
1.675
1428
0.70 – 25.03
20
C40H63Ga2N2Pt2
1171.26
103(2)
0.20 × 0.15 × 0.15
0.71073
Monoklin
P2(1)/c
18.959(4)
21.513(3)
22.477(5)
90
101.072(19)
90
8997(3)
8
1.729
7.997
4528
2.71 – 25.10
22
C84H90In3P3Pd3
1856.13
100(1)
0.10 × 0.15 × 0.15
0.71073
Triklin
P⎯1
14.369(6)
14.679(5)
21.995(4)
77.735(19)
86.52(2)
63.18(3)
4042(2)
2
1.525
1.594
1848
2.72 – 25.05
–22≤h≤22, –27≤k≤27,
–58≤l≤57
125967
35748 [Rint = 0.1945]
0.851
R1 = 0.0836,
wR2 = 0.1320
R1 = 0.1575,
wR2 = 0.1560
–19≤h≤20, –18≤k≤13,
–27≤l≤25
27732
5315 [Rint = 0.0989]
0.958
R1 = 0.0603,
wR2 = 0.1245
R1 = 0.1260,
wR2 = 0.1493
–16≤h≤14,–13≤k≤16,
–28≤l≤30
25538
14256 [Rint = 0.0745]
1.071
R1 = 0.0905,
wR2 = 0.2089
R1 = 0.1229,
wR2 = 0.2227
–9≤h≤13,–13≤k≤14,
–25≤l≤25
15636
9815 [Rint = 0.0645]
0.954
R1 = 0.0713,
wR2 = 0.1784
R1 = 0.1115,
wR2 = 0.1991
–11≤h≤14, –14≤k≤13,
–19≤l≤34
9758
4249 [Rint = 0.0301]
1.025
R1 = 0.0469,
wR2 = 0.1156
R1 = 0.0672,
wR2 = 0.1260
–22≤h≤22,–25≤k≤25,
–26≤l≤26
95920
15946 [Rint = 0.1137]
0.964
R1 = 0.0641,
wR2 = 0.1427
R1 = 0.1134,
wR2 = 0.1679
–17≤h≤17, –17≤k≤17,
–26≤l≤26
54424
14271 [Rint = 0.1021]
1.006
R1 = 0.0546,
wR2 = 0.1159
R1 = 0.1102,
wR2 = 0.1329
- 196 -
Summenformel
Molgewicht [g mol-1]
Temperatur [K]
Kristallgröße [mm3]
Wellenlänge [Å]
Kristallsystem
Raumgruppe
a (Å)
b (Å)
c (Å)
α (°)
β (°)
γ (°)
Zellvolumen [Å3]
Z
δcalc. [g cm-3]
µ [mm-1]
F (000)
Messbereich 2θ [°]
Index-Bereich
Anzahl der Reflexe
Unabhängige Reflexe
Goodness-of-fit on F2
Finaler RF
[I>2σ(I)]
R (alle Daten)
24a
C46H66Al4Ni
785.62
213(2)
0.48 × 0.44× 0.36
0.71073
Monoklin
P2(1)/c
18.223(3)
12.351(2)
21.333(4)
90
104.516(4)
90
4648.3(14)
4
1.123
0.521
1688
2.01 – 25.14
25
C36H61Al3NiSi
661.59
213(2)
0.45 × 0.35 × 0.30
0.71073
Monoklin
P2(1)/n
11.89(5)
19.14(9)
17.91(9)
90
95.11(16)
90
4060(34)
4
1.082
0.593
1432
2.15 – 24.98
27
C50H75Al5Fe
866.85
103(2)
0.30 × 0.25 × 0.15
0.71073
Monoklin
P2(1)/n
10.930(3)
20.473(5)
21.400(6)
90
94.71(2)
90
4773(2)
4
1.206
0.441
1864
3.03 – 25.06
28
C50H75Al5Fe
866.85
105(2)
0.20 × 0.15 × 0.10
0.71073
Monoklin
C2/c
17.539(6)
16.314(5)
33.601(6)
90
98.61(4)
90
9506(7)
8
1.211
0.422
3728
2.64 – 25.06
–13≤h≤21, –14≤k≤14,
–25≤l≤24
25865
8155 [Rint = 0.0497]
1.060
R1 = 0.0509,
wR2 = 0.1278
R1 = 0.0785,
wR2 = 0.1433
–14≤h≤13, –22≤k≤22,
–21≤l≤20
21699
7040 [Rint = 0.0651]
1.053
R1 = 0.0570,
wR2 = 0.1384
R1 = 0.0974,
wR2 = 0.1562
–13≤h≤7,–24≤k≤24,
–25≤l≤25
34170
8437 [Rint = 0.0846]
1.061
R1 = 0.0698,
wR2 = 0.1600
R1 = 0.0986,
wR2 = 0.1752
–20≤h≤20,–19≤k≤19,
–40≤l≤25
29009
8391 [Rint = 0.0859]
0.989
R1 = 0.0717,
wR2 = 0.1534
R1 = 0.1396,
wR2 = 0.1798
- 197 -
Literaturverzeichnis
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[13]
[14]
[15]
[16]
[17]
[18]
[19]
[20]
a) E. S. Shpiro, D. P. Shevchenko, O. P. Tkachenko, R. V. Dmitriev, Appl. Catal. A
1994, 107, 147; b) H. D. Kaesz, R. S. Williams, R. F. Hicks, J. I. Zink, Y.-J. Chen, H.J. Müller, Z. Xue, D. Xu, D.K. Shuh, Y. K. Kim, New J. Chem. 1990, 14, 527.
K. J. Chao, A. C. Wei, H. C. Wu, J. F. Lee, Micropor. Mesopor. Mater. 2000, 35-36,
413.
F. B. Passos, D. A. G. Aranda, M. Schmal, J. Catal. 1998, 178, 478.
D. Casanave, K. Fiaty, J. A. Dalmon, M. Forissier, Stud. Surf. Sci. Catal. 1999, 122,
367.
W. Uhl, Angew. Chem. 1993, 1993, 1449; Angew. Chem. Int. Ed. Engl. 1993, 32,
1386.
C. Dohmeier, D. Loos, H. Schnöckel, Angew. Chem. 1996, 108, 141; Angew. Chem
Int. Ed. Engl. 1996, 35,129.
R. A. Fischer, J. Weiss, Angew. Chem. 1999, 111, 3002; Angew. Chem Int. Ed. Engl.
1999, 38, 2830.
R. Murugavel, V. Chandrasekhar, Angew. Chem. 1999, 111, 1289. Angew. Chem Int.
Ed. Engl. 1999, 38, 1211.
H. Braunschweig, M. Colling, Coord. Chem. Rev. 2001, 223, 1.
a) H. Braunschweig, M. Colling, Eur. J. Inorg. Chem. 2003, 393; b) H. Braunschweig,
Angew. Chem. 1998, 110, 1882-1898, Angew. Chem. Int. Ed. Engl. 1998, 37, 1786.
C. Dohmeier, C. Robl, M. Tacke, H. Schnöckel, Angew. Chem. 1991, 103, 594;
Angew. Chem Int. Ed. Engl. 1991, 30, 564.
S. Schulz, H. W. Roesky, H. J. Koch, G. M. Sheldrick, D. Stalke, A. Kuhn, Angew.
Chem. 1993, 105, 1828; Angew. Chem Int. Ed. Engl. 1993, 32, 1729.
M. Schormann, K. S. Klimek, H. Hatop, S. P. Varkey, H. W. Roesky, C. Lehmann, C.
Röpken, R. Herbst-Irmer, M. Noltemeyer, J. Solid State Chem. 2001, 162, 225.
D. Loos, H. Schnöckel, J. Organomet. Chem. 1993, 463, 37.
D. Loos, E. Baum, A. Ecker, H. Schnöckel, Angew. Chem. 1997, 109, 894-896;
Angew. Chem Int. Ed. Engl. 1997, 36, 860.
P. Jutzi, B. Neumann, G. Reumann, H. G. Stammler, Organometallics 1998, 17, 1305.
P. Jutzi, L. O. Schebaum, J. Organomet. Chem. 2002, 654, 176.
O. T. Beachley, R. Blom, M. R. Churchill, K. Faegri, J. C. Fettinger, J. C. Pazik, L.
Victoriano, Organometallics 1989, 8, 346.
C. Schnitter, H. W. Roesky, C. Röpken, R. Herbst-Irmer, H.-G. Schmidt, M.
Noltemeyer, Angew. Chem. 1998, 110, 2059; Angew. Chem Int. Ed. Engl. 1998, 32,
1952.
W. Uhl, W. Hiller, M. Layh, W. Schwarz, Angew. Chem. 1992, 104, 1378; Angew.
- 198 -
[21]
[22]
[23]
[24]
[25]
[26]
[27]
[28]
[29]
[30]
[31]
[32]
[33]
[34]
[35]
[36]
[37]
[38]
[39]
[40]
[41]
[42]
[43]
[44]
[45]
[46]
Chem Int. Ed. Engl. 1992, 31, 1364.
W. Uhl, R. Graupner, M. Layh, U. Schütz, J. Organomet. Chem. 1995, 493, C1.
W. Uhl, A. Jantschak, J. Organomet. Chem. 1998, 555, 263.
G. Linti, J. Organomet. Chem. 1996, 520, 107.
T. Mennekes, P. Paetzold, R. Boese, D. Bläser, Angew. Chem. 1991, 103, 199; Angew.
Chem Int. Ed. Engl. 1991, 30, 173.
X.-W. Li, W. T. Pennington, G. H. Robinson, J. Am. Chem. Soc. 1995, 117, 7578.
J. Su, X.-W. Li, R. C. Crittendon, C. F. Campana, G. H. Robinson, Organometallics
1997, 16, 4511.
S. T. Haubrich, P. P. Power, J. Am. Chem. Soc. 1998, 120, 2202.
M. Niemeyer, P. P. Power, Angew. Chem. 1998, 110, 1291; Angew. Chem Int. Ed.
Engl. 1998, 37, 1277
J. Su, X.-W. Li, C. Crittendon, G. H. Robinson, J. Am. Chem. Soc. 1997, 119, 5471.
B. Twamley, P. P. Power, Angew. Chem. 2000, 112, 3643; Angew. Chem Int. Ed.
Engl. 2000, 39, 3500.
T. Yamaguchi, K. Ueno, H. Ogino, Organometallics 2001, 20, 501.
C. Cui, H. Roesky, H.-G. Schmidt, M. Noltemeyer, H. Hao, F. Cimpoesu, Angew.
Chem. 2000, 112, 4444; Angew. Chem Int. Ed. Engl. 2000, 39, 4274.
N. J. Hardman, B. E. Eichler, P. P. Power, Chem. Commun. 2000, 1991.
N. J. Hardman, P. Power, Inorg. Chem. 2001, 40, 2474.
N. J. Hardman, C. Cui, H. W. Roesky, W. Fink, P. Power, Angew. Chem. 2001, 113,
2230; Angew. Chem. Int. Ed. 2001, 40, 2172.
N. J. Hardman, P. Power, J. Gordon, C. L. B. Macdonald, A. H. Cowley, Chem.
Commun. 2001, 2001, 1866.
N. J. Hardman, P. Power, Chem. Commun. 2001, 1184.
N. J. Hardman, P. J.Ragogna, K. N. Robertson, T. S. Cameron, Chem. Commun. 2002,
124, 382.
M. Stender, B. E. Eichler, N. J. Hardman, P. Power, J. Prust, M. Noltemeyer, H.
Roesky, Inorg. Chem. 2001, 40, 2794.
H. V. R. Dias, L. Huai, W. Jin, S. G. Bott, Inorg. Chem. 1995, 34, 1973.
H. V. R. Dias, W. Jin, Inorg. Chem. 1996, 35, 267.
H. V. R. Dias, W. Jin, Inorg. Chem. 2000, 39, 815.
A. Frazer, B. Piggott, M. B. Hursthouse, M. Mazid, J. Am. Chem. Soc. 1994, 116,
4127.
a) D. L. Rege, D. G. Garza, Organometallics 1998, 17, 3624; b) M. C. Kuchta, J. B.
Bonanno, G. Parkin, J. Am. Chem. Soc. 1996, 118, 10914; c) M. C. Kuchta, H. V. R.
Dias, S. G. Bott, G. Parkin, Inorg. Chem. 1996, 35, 943.
J. Uddin, C. Boehme, G. Frenking, Organometallics 2000, 19, 571.
J. Uddin, G. Frenking, J. Am. Chem. Soc. 2001, 123, 1683.
- 199 -
[47]
[48]
[49]
[50]
[51]
[52]
[53]
[54]
[55]
[56]
[57]
[58]
[59]
[60]
[61]
[62]
[63]
[64]
[65]
[66]
[67]
[68]
[69]
[70]
[71]
[72]
[73]
[74]
W. Uhl, M. Benter, S. Melle, W. Saak, G. Frenking, J. Uddin, Organometallics 1999,
18, 3778.
W. Uhl, S. Melle, G. Frenking, M. Hartmann, Inorg. Chem. 2001, 40, 750.
J. Weiss, D. Stetzkamp, B. Nuber, R. A. Fischer, C. Boehme, G. Frenking, Angew.
Chem. 1997, 109, 95; Angew. Chem. Int. Ed. 1997, 36, 70.
D. Weiss, T. Steinke, M. Winter, R. A. Fischer, N. Fröhlich, J. Uddin, G. Frenking,
Organometallics 2000, 19, 4583.
D. Weiss, M. Winter, R. A. Fischer, C. Yu, K. Wichmann, G. Frenking, Chem.
Commun. 2000, 2495.
D. Weiss, M. Winter, K. Merz, A. Knüfer, R. A. Fischer, N. Fröhlich, G. Frenking,
Polyhedron 2002, 21, 535.
C. Dohmeier, H. Krautscheid, H. Schnöckel, Angew. Chem. 1994, 106, 2570; Angew.
Chem. Int. Ed. 1994, 33, 2482.
P. Jutzi, B. Neumann, L. O. Schebaum, A. Stammler, H.-G. Stammler,
Organometallics 1999, 18, 4462.
W. Uhl, M. Pohlmann, R. Wartchow, Angew. Chem. 1998, 110, 1007-1009; Angew.
Chem. Int. Ed. 1998, 37, 961.
W. Uhl, S. Melle, Z. Allg. Anorg. Chem. 2000, 626, 2043.
J. Gauss, U. Schneider, R. Ahlrichs, C. Dohmeier, H. Schnöckel, J. Am. Chem. Soc
1993, 115, 2402.
H. Werner, H. Otto, H. J. Krauss, J. Organomet. Chem. 1986, 315, C57.
C. L. B. Macdonald, A. H. Cowley, J. Am. Chem. Soc 1999, 121, 12113.
J. D. Gorden, C. L. B. Macdonald, A. H. Cowley, Chem. Comm. 2001, 75.
P. Jutzi, B. Neumann, G. Reumann, L. O. Schebaum, H.-G. Stammler,
Organometallics 2001, 20, 2854.
Q. Yu, A. Purath, A. Donchev, H. Schnöckel, J. Organomet. Chem. 1999, 584, 94.
F. Cotton, X. Feng, Organometallics 1998, 17, 128.
F. A. Cotton, A. H. Cowley, X. Feng, J. Am. Chem. Soc 1998, 120, 1795.
C. Boehme, G. Frenking, Chem. Eur. J. 1999, 5, 2184.
A. T. T. Hsieh, Inorg. Chim. Acta 1975, 14, 87.
N. A. Compton, R. J. Errington, N. C. Norman, Adv. Organomet. Chem. 1990, 31, 91.
P. J. Brothers, P. P. Power, Adv. Organomet. Chem. 1996, 39, 1.
C. Üffing, A. Ecker, R. Köppe, H. Schnöckel, Organometallics 1998, 17, 2373..
W. Uhl, M. Benter, M. Prött, Dalton Trans. 2000, 643.
W. Uhl, S. U. Keimling, W. Hiller, M. Neumayer, Chem. Ber. 1995, 128, 1137.
E. V. Grachova, P. Jutzi, B. Neumann, L. O. Schebaum, H.-G. Stammler, S. P. Tunik,
Dalton Trans. 2002, 302.
W. Uhl, M. Pohlmann, Organometallics 1997, 16, 2478.
M. L. H. Green, P. Mountford, G. J. Smout, S. R. Speel, Polyhedron 1990, 9, 2763.
- 200 -
[75]
[76]
[77]
[78]
[79]
[80]
[81]
[82]
[83]
[84]
[85]
[86]
[87]
[88]
[89]
[90]
[91]
[92]
[93]
[94]
[95]
[96]
[97]
[98]
[99]
[100]
[101]
[102]
J. J. Schneider, U. Denninger, J. Hagen, K. Krüger, D. Bläser, R. Boese, Chem. Ber.
1997, 130, 1433.
A. T. T. Hsieh, M. J. Mays, J. Organomet. Chem. 1972, 37, 9.
A. T. T. Hsieh, M. J. Mays, Inorg. Chem. Nucl. Lett. 1971, 7, 223.
D. J. Patmore, W. A. G. Graham, Chem. Comm. 1965, 591.
D. J. Patmore, W. A. G. Graham, Inorg. Chem. 1966, 5, 1586.
J. Hoyano, D. J. Patmore, W. A. G. Graham, Inorg. Chem. Nucl. Lett. 1968, 4, 201.
L. M. Clarkson, W. Clegg, D. C. R. Hockless, N. C. Norman, L. J. Farrugia, S. G.
Bott, J. L. Atwood, Dalton Trans. 1991, 2241.
F. P. Gabbai, A. Schier, J. Riede, H. Schmidbaur, Inorg. Chem. 1995, 34, 3855.
P. Jutzi, B. Neumann, L. O. Schebaum, A. Stammler, H.-G. Stammler,
Organometallics 2000, 19, 1445.
H. Schnöckel, M. Leimkühler, R. Lotz, R. Mattes, Angew. Chem. 1986, 98, 929-930;
Angew. Chem. Int. Ed.1986, 25, 921.
C. Cui, S. Köpke, R. Herbst-Irmer, H. W. Roesky, M. Noltemeyer, H.-G. Schmidt, B.
Wrackmeyer, J. Am. Chem. Soc. 2001, 123, 9091.
M. Curtis, R. Klingler, J. Organomet. Chem. 1978, 161, 23.
M. Cokoja, Vertiefungsarbeit II, Ruhr-Universität Bochum 2002.
P. Jutzi, B. Neumann, G. Reumann, H.-G. Stammler, Organometallics 1999, 18, 2037.
R. D. Adams, M. D. Collins, F. A. Cotton, Inorg. Chem. 1974, 13, 1086.
P. J. Sullivan, A. L. Rheingold, Organometallics 1982, 1, 1547.
M. D. Curtis, N. A. Fotinos, K. R. Han, W. M. Butler, J. Am. Chem. Soc 1983, 105,
2686.
H. Brunner, W. Maier, J. Wachter, E. Guggolz, T. Zahn, M. L. Ziegler,
Organometallics 1982, 1, 1107.
J. T. Lin, A. C. Yeh, T. Y. R. Tsai, Y. S. Wen, J. Organomet. Chem. 1993, 453, 221.
J. T. Lin, A. C. Yeh, T. Y. R. Tsai, C. Liao, L.-H. Tseng, Y. S. Wen, F.-K. Shi, Inorg.
Chem. 1992, 31, 4444.
A. S. Borovik, S. G. Bott, A. R. Barron, Organometallics 1999, 18, 2668.
A. Y. Timoshkin, G. Frenking, J. Am. Chem. Soc. 2002, 124, 7240.
M. Scheer, M. Kaupp, A. V. Virovets, S. N. Konchenko, Angew. Chem. 2003, 115,
5237-5240. Angew. Chem. Int. Ed. 2003, 42, 5083-5086.
W. Uhl, M. Layh, W. Hiller, J. Organomet. Chem. 1989, 368, 139.
P. J. Brothers, K. Hüber, U. Hübler, B. C. Noll, M. M. Olmstead, P. P. Power, Angew.
Chem. 1996, 108, 2528. Angew. Chem. Int. Ed. 1996, 35, 2355-2357.
P. W. Jolly, C. Kruger, K.-P. Schick, G. Wilke, Z. Naturforsch. Teil B 1980, 35, 926.
J. Sieler, M. Helms, W. Glaube, A. Svensson, O. Lindquist, J. Organomet. Chem.
1987, 320, 129.
D. Seyferth, G. B. Womack, J. C. Dewan, Organometallics 1985, 4, 398.
- 201 -
[103]
[104]
[105]
[106]
[107]
[108]
[109]
[110]
[111]
[112]
[113]
[114]
[115]
[116]
[117]
[118]
[119]
[120]
[121]
[122]
[123]
[124]
[125]
[126]
[127]
[128]
D. Seyferth, G. B. Womack, C. M. Archer, J. C. Dewan, Organometallics 1989, 8,
430.
R. J. Blau, M. S. Goetz, R. R. Howe, C. J. Smith, R.-J. Tsay, U. Siriwardane,
Organometallics 1991, 10, 3259.
O. T. Beachley, D. B. Rosenblum, M. R. Churchill, C. H. Lake, L. M. Krajkowski,
Organometallics 1995, 14, 4402.
D. W. Hoard, P. R. Sharp, Inorg. Chem. 1993, 32, 612.
P. R. Sharp, D. W. Hoard, C. L. Barnes, J. Am. Chem. Soc. 1990, 112, 2024.
W. Uhl, M. Layh, T. Hildenbrand, J. Organomet. Chem. 1989, 364, 289.
B. H. Weiler, E. P. Wassermann, R. G. Bergmann, C. B. Moore, G. C. Pimentel, J.
Am. Chem. Soc. 1989, 111, 8288.
A. A. Bengali, R. H. Schultz, C. B. Moore, R. G. Bergmann, J. Am. Chem. Soc. 1994,
116, 9585.
T. Ziegler, V. Tschinke, L. Fan, A. D. Becke, J. Am. Chem. Soc. 1989, 111, 9177.
S. E. Bromberg, H. Yang, M. C. Asplund, T. Lian, B. K. McNamara, K. T. Kotz, J. S.
Yeston, M. Wilkens, H. Frei, R. G. Bergmann, C. Harris, Science 1997, 278, 260.
T. Welzel, Vertiefungsarbeit I, Ruhr-Universität Bochum 2002.
E. Leiner, M. Scheer, J. Organomet. Chem. 2002, 646, 247.
A. Haaland, K.-G. Martinsen, H. V. Volden, D. Loos, H. Schnöckel, Acta Chem.
Scand. 1994, 48, 172.
R. J. Klingler, W. Butler, M. D. Curtis, J. Am. Chem. Soc. 1975, 97, 3535.
M. D. Curtis, L. Messerle, J. J. D´Errico, H. E. Solis, I. D. Barcelo, W. M. Butler, J.
Am. Chem. Soc 1987, 109, 3603.
W. A. Herrmann, L. K. Bell, M. L. Ziegler, K. Pflisterer, C. Dahl, J. Organom. Chem.
1983, 247, 39.
D. M. Haddleton, R. N. Perutz, Chem. Commun. 1985, 1372.
S. T. Belt, S. B. Ducket, D. M. Haddleton, R. N. Perutz, Organometallics 1989, 8,
748.
E. Fooladi, B. Dahlus, M. Tilset, Dalton Trans. 2004, 3909.
L. J. Guggenberger, R. Cramer, J. Am. Chem. Soc. 1972, 94, 3779.
W. d. Graaf, J. Boersma, W. J. J. Smeets, A. L. Spek, G. v. Koten, Organometallics
1989, 8, 2907.
M. Hackett, G. M. Whitesides, J. Am. Chem. Soc 1988, 110, 1436.
M. Hackett, G. M. Whitesides, J. Am. Chem. Soc 1988, 110, 1449.
F. Schaller, W. Schwarz, H. D. Hausen, K. W. Klinkhammer, J. Weidlein, Z. Anorg.
Allg. Chem. 1997, 623, 1455.
H. J. Koch, S. Schulz, H. W. Roesky, M. Noltemeyer, H.-G. Schmidt, A. Heine, R.
Herbst-Irmer, D. Stalke, G. M. Sheldrick, Chem. Ber. 1992, 125, 1107.
A. Haaland, K.-G. Martinsen, S. A. Shlykov, H. V. Volden, C. Dohmeier, H.
- 202 -
[129]
[130]
[131]
[132]
[133]
[134]
[135]
[136]
[137]
[138]
[139]
[140]
[141]
[142]
[143]
[144]
[145]
Schnöckel, Organometallics 1995, 14.
C. Dohmeier, H. Schnöckel, C. Robl, U. Schneider, R. Ahlrichs, Angew. Chem. 1993,
105, 1714; Angew. Chem. Int. Ed. Engl. 1993, 32, 1655.
W. Uhl, R. Graupner, H. Reuter, J. Organom. Chem. 1996, 523, 227.
A. J. Carty, M. J. S. Gynane, M. F. Lappert, S. J. Miles, A. Singh, N. J. Taylor, Inorg.
Chem. 1980, 19, 397.
W. Uhl, S. U. Keimling, W. Hiller, M. Neumayer, Chem. Ber. 1996, 129, 397.
[Pt(cod)2] und 4 Äquivalente InCp* wurden bei -70°C in Hexan suspendiert, wobei
sich eine tiefrote Lösung bildete. Langsames Aufwärmen auf -30° führt zur
Zersetzung unter Bildung eines metallischen Niederschlags.
A. Kempter, Diplomarbeit, Ruhr Universität Bochum 2004.
T. Pechmann, C. T. Brandt, H. Werner, Angew. Chem. 2000, 112, 4069. Angew.
Chem. Int. Ed. Engl. 2000, 39 3909.
J. Vollet, J. R. Hartig, H. Schnöckel, Angew. Chem. 2004, 116, 3248; Angew. Chem.
Int. Ed. Engl. 2004, 41, 3186.
R. D. Feltham, G. Elbaze, R. Ortega, C. Eck, J. Dubrawski, Inorg. Chem. 1985, 1985,
1503.
E. G. Mednikov, S. A. Ivanov, L. F. Dahl, Angew. Chem. 2003, 115, 337; Angew.
Chem. Int. Ed. Engl. 2003, 42, 323.
J. Donohue, The Sructures of the Elements, Wiley, New York, 1974.
U. Häußermann, M. Elding-Ponten, C. Svensson, S. Lidin, Chem. Eur. J. 1998, 4,
1007.
Anmerkung: Die in dieser Tabelle angeführten Bindungslängen und -winkel von
[Pd3(GaCp*)8] (15b) resultieren aus der höheren Symmetrie der Struktur (monoklinen
C2/c) im Unterschied zur triklinen Raumgruppe P 1 von [Pd3(InCp*)8] (15a).
Demnach sind die Atome Pd(3) und Ga(5)-Ga(8) in 15a aus kristallographischer Sicht
nicht vorhanden, sondern ergeben sich durch entsprechende Symmetrieoperationen
aus den Atomen Pd(1) und Ga(1)-Ga(4). Um dennoch einen Vergleich der Strukturen
von 15a und 15b zu ermöglichen, wurden die Atome in dieser Tabelle und in
Abbildung 22 wie folgt einander zugewiesen: Pd(3) = Pd(1), Ga(5) = Ga(3), Ga(6) =
Ga(4), Ga(7) = Ga(1), Ga(8) = Ga(2). Abbildung 23 stellt dagegen die korrekte
Nomenklatur der Atome dar.
O. T. Beachley, M. R. Churchill, J. C. Fettinger, J. C. Pazik, L. Victoriano, J. Am.
Chem. Soc. 1986, 108, 4666.
P. Jutzi, B. Neumann, G. Reumann, L. O. Schebaum, A. Stammler, Organometallics
1999, 18, 2550.
P. R. Schoneberg, R. T. Paine, C. F. Campana, J. Am. Chem. Soc. 1979, 101, 7726.
P. R. Schoneberg, R. T. Paine, C. F. Campana, E. N. Duesler, Organometallics 1982,
1, 799.
- 203 -
[146]
[147]
[148]
[149]
[150]
[151]
[152]
[153]
[154]
[155]
[156]
[157]
[158]
[159]
[160]
[161]
[162]
[163]
[164]
[165]
[166]
[167]
[168]
[169]
[170]
[171]
[172]
[173]
[174]
[175]
[176]
[177]
[178]
R. Jackstell, M. G. Andreu, A. Frisch, K. Selvakumar, A. Zapf, H. Klein, A.
Spannenberg, D. Röttger, O. Briel, R. Karch, M. Beller, Angew. Chem. 2002, 114,
1028; Angew. Chem. Int. Ed. Engl. 2002, 41, 986.
R. A. Fischer, H. D. Kaesz, S. J. Kahn, H.-J. Müller, Inorg. Chem. 1990, 29, 1601.
P. Guex, P. Feschotte, Journal of the Less-Common Metals 1976, 46, 101.
R. Huch, W. Klemm, Z. Allg. Anorg. Chem. 1964, 329, 123.
J. Chatt, G. A. Rowe, Nature 1961, 191, 1191.
G. Booth, J. Chatt, J. Chem. Soc A. 1969, 14, 2131.
H. C. Clark, P. N. Kapoor, I. J. McMahon, J. Organomet. Chem. 1984, 265, 107.
M. R. Lewtas, C. P. Morley, M. Di Vaira, Polyhedron 2000, 19, 751.
J. Chatt, F. A. Hart, H. R. Watson, J. Chem. Soc. 1962, 2537.
A. Fusi, R. Ugo, F. Fox, A. Pasini, S. Cenini, J. Organomet. Chem. 1971, 26, 417.
M. Aresta, E. Quaranta, J. Organomet. Chem. 2002, 662, 112.
V. S. Sergienko, M. A. Porai-Koshits, Zh. Strukt. Khim. 1987, 28, 103.
V. G. Andrainov, I. S. Akhrem, N. M. Chistovalova, Y. T. Struchkov, Zh. Strukt.
Khim. 1976, 17, 135.
M. Green, J. A. K. Howard, M. Murray, J. L. Spencer, F. G. A. Stone, Dalton Trans.
1977, 1509.
V. G. Albano, G. M. B. Ricci, P. L. Bellon, Inorg. Chem. 1969, 8, 2109.
P. M. Maitlis, P. Espinet, M. J. H. Russell, Comprehensive Organometallic Chemistry
I, 243.
L. J. Farrugia, Dalton Trans. 1997, 1783.
R. D. Adams, B. Captain, W. Fu, P. J. Pellechia, Inorg. Chem. 2003, 42, 3111.
R. H. Crabtree, Dalton Trans. 2001, 2437.
R. H. Crabtree, Chem. Rev. 1985, 85, 245.
R. H. Crabtree, The Chemistry of Alkanes and Cycloalkanes, Wiley, New York, 1992.
R. G. Bergman, Science 1984, 223, 902.
B. A. Arndtsen, R. G. Bergman, T. A. Mobley, T. H. Peterson, Acc. Chem. Res. 1995,
28, 154.
G. Dyker, Angew. Chem. 1999, 111, 1808; Angew. Chem. Int. Ed. 1999, 38, 1698.
A. D. Ryabov, Chem. Rev. 1990, 90, 403.
J. A. Martinho Simoes, J. L. Beauchamp, Chem. Rev. 1990, 90, 629.
J. A. Labinger, J. E. Bercaw, Nature 2002, 417, 507.
B. L. Shaw, J. Organomet. Chem. 1980, 200, 307.
W. D. Jones, F. J. Feher, Acc. Chem. Res. 1989, 22, 91.
M. Lavin, E. M. Holt, R. H. Crabtree, Organometallics 1989, 8, 99.
P. Burger, R. G. Bergamn, J. Am. Chem. Soc 1993, 115, 10462.
K. M. Waltz, J. F. Hartwig, Science 1997, 227, 211.
R. A. Periana, D. J. Taube, S. Gamble, H. Taube, T. Satoh, H. Fujii, Science 1998,
- 204 -
[179]
[180]
[181]
[182]
[183]
[184]
[185]
[186]
[187]
[188]
[189]
[190]
[191]
[192]
[193]
[194]
[195]
[196]
[197]
[198]
280, 560.
E. Wilson, Chem. Eng. News 1999, 77, 24.
B. Rybtchinski, D. Milstein, Angew. Chem. 1999, 111, 918; Angew. Chem. Int. Ed.
Engl. 1999, 38, 870.
R. H. Crabtree, The Organometallic Chemistry of Transition Metals, 3rd, Wiley, New
York, 2001.
K.-R. Pörschke, W. Kleinmann, Y. Tsay, C. Krüger, G. Wilke, Chem. Ber. 1990, 123,
1267.
M. F. Lappert, G. Speier, J. Organomet. Chem. 1974, 80, 329.
W. D. Jones, F. J. Feher, J. Am. Chem. Soc 1984, 106, 1650.
I. Bach, K.-R. Pörschke, R. Goddard, C. Kopiske, C. Krüger, A. Rufinska, K.
Seevogel, Organometallics 1996, 15, 4959.
M. I. Sladek, T. Braun, B. Neumann, H.-G. Stammler, Dalton Trans. 2002, 297.
T. Braun, R. N. Perutz, Chem. Commun. 2002, 2749.
T. Braun, S. P. Foxon, R. N. Perutz, P. H. Walton, Angew. Chem. 1999, 111, 3543;
Angew. Chem. Int. Ed. Engl. 1999, 38, 3326.
M. Reinhold, J. E. McGrady, R. N. Perutz, J. Am. Chem. Soc. 2004, 126, 5268.
D. R. Lide, CRC Handbook of Chemistry and Physics 2004-2005, Vol. 85, Cleaveland,
2004.
H. A. S. G. Pilchner, The Chemistry of Metal-Carbon Bond, New York, 1982.
J. J. Low, W. A. G. III, J. Am. Chem. Soc 1984, 106, 8321.
P. E. M. Siegbahn, M. R. A. Blomberg, J. Am. Chem. Soc 1992, 114, 10548.
U. Zenneck, Angew. Chem. 1990, 102, 171; Angew. Chem. Int. Ed. Engl. 1990, 29,
126.
S. D. Ittel, C. A. Tolman, Organometallics 1982, 1, 1432.
D. L. Williams-Smith, L. R. Wolf, P. S. Skell, J. Am. Chem. Soc 1972, 94, 4042.
Die Berechnungen wurden mit dem Programmpaket TURBOMOLE durchgeführt: a)
R. Ahlrichs, M. Bär, M. Häser, H. Horn, C. Kölmel, Chem. Phys. Lett. 1989, 162, 165169; b) O. Treutler, R. Ahlrichs, J. Chem. Phys. 1995, 102, 346-354. BeckePerdew(BP86)-Austausch-Korrelations-Funktional und Resolution-of-the-Identity Näherung (RI): c) D. Becke, Phys. Rev. A 1988, 38, 3098-3100; d) S. H. Vosko, L.
Wilk, M. Nusair, Can. J. Phys. 1980, 58, 1200-1211; e) J. P. Perdew, Phys. Rev. B
1986, 33, 8822-8824; Erratum: J. P. Perdew, Phys. Rev. B 1986, 34, 7406; f) K.
Eichkorn, O. Treutler, H. Öhm, M. Häser, R. Ahlrichs, Chem. Phys. Lett. 1995, 242,
652-660. Bei den DFT-Rechnungen wurden SVP-Basissätze verwendet: g) A. Schäfer,
H. Horn, R. Ahlrichs, J. Chem. Phys. 1992, 97, 2571-2577; h) A. Schäfer, C. Huber,
R. Ahlrichs, J. Chem. Phys. 1994, 100, 5829-5835; i) K. Eichkorn, F. Weigend, O.
Treutler, R. Ahlrichs, Theor. Chem. Acc. 1997, 97, 119-124.
B. Delley, M. Wrinn, H. P. Lüthi, J. Chem. Phys. 1994, 100, 5785.
- 205 -
[199]
[200]
[201]
[202]
[203]
[204]
[205]
[206]
[207]
[208]
[209]
[210]
[211]
[212]
[213]
[214]
[215]
[216]
[217]
[218]
[219]
[220]
[221]
[222]
[223]
[224]
[225]
[226]
[227]
[228]
K. K. Pandey, M. Lein, G. Frenking, Organometallics 2004, 23, 2944.
A.E. Reed, L.A. Curtiss, F. Weinhold, Chem. Rev. 1988, 88, 899-926.
J. W. Rathke, E. L. Muetterties, Chem. Commun. 1975, 3272.
H. H. Karsch, H.-F. Klein, H. Schmidtbaur, Chem. Ber. 1977, 110, 2200.
T. Cadenbach, C. Gemel, R. Schmid, S. Block, R. A. Fischer, Dalton Trans. 2004,
3171.
T. Weskamp, V. P. W. Bohm, W. A. Herrmann, J. Organomet. Chem. 2000, 600, 12.
A. Fürstner, Angew. Chem. 2000, 112, 3140. Angew. Chem. Int. Ed. Engl. 2000, 39,
3012.
R. H. Grubbs, S. Chang, Tetrahedron 1998, 54, 4413.
A. C. Hillier, G. A. Grasa, M. S. Viciu, H. M. Lee, C. Yang, S. P. Nolan, J.
Organomet. Chem. 2002, 653, 69.
W. A. Herrmann, Angew. Chem. 2002, 114, 1342. Angew. Chem. Int. Ed. Engl. 2002,
41, 1290.
T. Ishiyama, J. Takagi, J. F. Hartwig, N. Miyaura, Angew. Chem. 2002, 114, 3182.
Angew. Chem. Int. Ed. Engl. 2002, 41, 3056.
K. Kirihara, K. Kimura, Materia 2000, 39, 679.
B. Grushko, D. Holland-Mortiz, J. Alloys Compd. 1997, 262-263, 350.
J. L. Joulaud, C. Bergman, J. Bernardini, P. Gas, J. M. Dubois, Y. Calvayrac, J. Phys.
IV 1996, 6, 259.
M. Cokoja, R. A. Fischer, unveröffentlichte Ergebnisse 2004.
G. M. Sheldrick, University of Göttingen, 1986.
G. M. Sheldrick, University of Göttingen, 1997.
F. X. Kohl, P. Jutzi, J. Organomet. Synth. 1986, 3, 489.
F. X. Kohl, P. Jutzi, J. Organomet. Chem. 1983, 243, 119.
M. Green, J. A. Howard, J. L. Spencer, F. G. A. Stone, Chem. Commun. 1975, 3.
J. L. Spencer, Inorg. Synth. 1979, 19, 213.
D. J. Krysan, P. B. Mackenzie, Inorg. Chem. 1990, 55, 4229.
M. D. Curtis, M. S. Hay, Inorg. Synth. 1991, 28, 150.
G. J. Kubas, Inorg. Chem. 1983, 22, 692.
R. Cramer, Inorg. Chem. 1962, 1, 722.
R. Birdwhistell, P. Hackett, A. R. Manning, J. Organomet. Chem. 1978, 157, 239.
D. S. Ginley, C. R. Bock, M. S. Wrighton, Inorg. Chim. Acta 1977, 23, 85.
J. Krause, G. Cestaric, K.-J. Haak, K. Seevogel, W. Storm, K.-R. Pörschke, J. Am.
Chem. Soc 1999, 1999, 9807.
J. W. Wang, K. Moseley, P. M. Maitlis, J. Am. Chem. Soc 1969, 91, 5970.
M. Cokoja, Doktorarbeit, Ruhr-Universität Bochum 2004.
- 206 -
VIII.
Anhang:
Publikationen,
Posterbeiträge,
Vorträge,
Lebenslauf
1. Publikationen
[1]
D. Weiß, T. Steinke, M. Winter, R. A. Fischer*, N. Fröhlich, J. Uddin, G. Frenking*,
„[(dcpe)Pt(ECp*)2] (E = Al, Ga) – Synthesis, Structure and Bonding Situation of the
First Aluminium(I) and Gallium(I) Complexes of Phosphine-Substituted Transition
Metal Centers“, Organometallics 2000, 22, 4583-4588.
[2]
T. Steinke, C. Gemel, M. Winter, R. A. Fischer, „[Pd3(InCp*)4(µ²-InCp*)4]: Three
Linearly Arranged Palladium Atoms Wrapped into a Fluxional Shell of Eight InCp*
Ligands”, Angew. Chem. 2002, 114, 4955-4957; Angew. Chem. Int. Ed. Engl. 2002, 41,
4761-4763.
[3]
C. Gemel, T. Steinke, D. Weiß, M. Cokoja, M. Winter, R. A. Fischer, „[M(GaCp*)4]
(M=Pd, Pt) as Building Blocks for Dimeric Homoleptic Cluster Compounds of the Type
[MPt(GaCp*)5]”, Organometallics 2003, 22, 2705-2710.
[4]
T. Steinke, C. Gemel, M. Cokoja, M. Winter, R. A. Fischer, „Insertion of organoindium
carbenoids into Rhodium halide bonds: Revisiting a classic type of transition metal group 13 metal bond formation”, Chem. Commun. 2003, 1066-1067.
[5]
M. Cokoja, T. Steinke, C. Gemel, M. Winter, R. A. Fischer, „Ligand properties of
GaCp*: new examples of Mo-Ga and W-Ga complexes”, J. Organomet. Chem. 2003,
684, 277-286.
[6]
T. Steinke, C. Gemel, M. Cokoja, M. Winter, R. A. Fischer, „AlCp* as a Directing
Ligand: C-H und Si-H Bond Activation at the Reactive Intermediate [Ni(AlCp*)3]”,
Angew. Chem. 2004, 116, 2349-2352; Angew. Chem. Int. Ed. Engl. 2004, 43, 22992302.
[7]
T. Steinke, C. Gemel, M. Winter, R. A. Fischer, “Insertion of group 13 carbenoids into
transition metal halide bonds. Part 2: Novel RhCp*/GaCp* and RhCp*/InCp* cluster
complexes”, Dalton Trans. 2005, 55-62.
[8]
C. Gemel, T. Steinke, M. Cokoja, A. Kempter, R. A. Fischer, „Transition Metal
Chemistry of Low Valent Group 13 Organyls“, Eur. J. Inorg. Chem. 2004, 4161-4176.
- 207 -
[9]
T. Steinke, C. Gemel, M. Winter, R. A. Fischer, “The Clusters [Ma(ECp*)b] (M = Pd,
Pt; E = Al, Ga, In): Structures, Fluxionality and Ligand Exchange Reactions”, Chem.
Eur. J. 2005, 11, 1636-1646.
[10]
T. Steinke, M. Cokoja, C. Gemel, A. Kempter, A. Krapp, G. Frenking, U. Zenneck, R.
A. Fischer, „CH-activated Isomers of [M(AlCp*)5] (Fe, Ru)“, Angew. Chem. 2005, 117,
Angew. Chem. Int. Ed. Engl. 2005, 44, im Druck.
2. Posterbeiträge und Vorträge
[1]
T. Steinke, D. Weiß, R. A. Fischer, 1st Symposium der Universitäten Dortmund und
Bochum „Zukunftsperspektiven in der Anorganischen Chemie“, 31. Juni - 01. Juli 2001,
„Koordinationschemie von niedervalenten Erdmetall-Liganden an Pt-Zentren“
(Vortrag).
[2]
T. Steinke, C. Gemel, M. Cokoja, M. Winter, D. Weiß, R. A. Fischer, 20th International
Conference on Organometallic Chemistry, 7.-12. Juli 2002, Corfu, Griechenland,
„Ligand properties of Cp*Ga: New Examples of Rh/Ga, Mo/Ga and W/Ga Complexes”
und „Cp*Ga and Cp*In as Ligands for homoleptic Pt(0) and Pd(0) Cluster
Compounds” (Posterbeiträge)
[3]
T. Steinke, C. Gemel, M. Cokoja, M. Winter, R. A. Fischer, Anorganisch/AnalytischChemisches Kolloquium, 15.11.2002, Ruhr-Universität-Bochum, „Koordinationschemie niedervalenter Erdmetallalkyle E(I)R an Übergangsmetallzentren“ (Vortrag).
[4]
T. Steinke, C. Gemel, M. Cokoja, R. A. Fischer, 226th ACS National Meeting, 7.-11.
September 2003, New York, NY, „Coordination Chemistry of low valent group 13
metal species E(I)R to d10 Transition Metal Centers” (Vortrag).
[5]
T. Steinke, C. Gemel, M. Cokoja, A. Kempter, R. A. Fischer, 21th International
Conference on Organometallic Chemistry, 25.-30. Juli 2004, Vancouver, Canada,
„Organometallic Chemistry with exotic Ligands: Coordination Chemistry of AlCp*,
GaCp*, InCp* to d10 Metal Centres” (Vortrag).
[6]
T. Steinke, C. Gemel, M. Cokoja, A. Kempter, R. A. Fischer, Anorganisch Chemisches
Kolloquium, 11. November, Technische Universität Dresden. „Organometallchemie mit
exotischen Liganden: Koordinationschemie von AlCp*, GaCp* und InCp* an
Übergangsmetallen“ (Vortrag).
- 208 -
3.
Lebenslauf
Persönliche Daten:
Name:
Tobias Steinke
Geburtsdatum:
4. Dezember 1974
Geburtsort:
Bochum
Wohnsitz:
An der Landwehr 34 A
44795 Bochum
Tel: 0234/9449352
Familienstand:
verheiratet, ein Sohn, 1½ Jahre
Schulbildung:
1981 - 1985
Grundschule an der Feldsieperstraße,
Bochum
1985 - 1994
Allgemeine Hochschulreife,
Goethe-Gymnasium, Bochum
Zivildienst:
1994 - 1995
Caritas - Altenzentrum St. Franziskus,
Bochum
Studium:
WS 1995 / 96 - WS 2000 / 01
Studium an der Ruhr-Universität Bochum
für Lehramt Sek. II / Sek. I allgemeinb.
Chemie und Geographie
Examensarbeit:
Beiträge zur Koordinationschemie von
Cp*Al als Komplexligand an Platin- und
Chrom-Zentren
- 209 -
Promotion:
03.2001 – 02.2005
Promotionsthema:
Beiträge zur Koordinationschemie niedervalenter Aluminium, Gallium und IndiumOrganyle EICp*an Übergangsmetallen
Arbeitsgruppe:
Lehrstuhl für Anorganische Chemie II
Organometallics & Materials Chemistry
Prof. Dr. Roland A. Fischer
Ruhr-Universität Bochum
Universitätsstraße 150
D-44780 Bochum
- 210 -