zum
Werbung

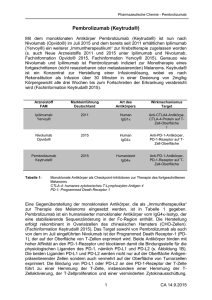
Prüfliste zur Patientenüberwachung bei einer Therapie mit Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab Prüfliste zur Patientenüberwachung bei einer Therapie mit Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab Diese Prüfliste dient dem Pflegepersonal vor der Dosierung eines jeden Patienten sowie bei den Nachsorgeterminen oder Telefonaten mit dem Patienten/der Patientin dazu, einige der Anzeichen und Symptome, die mit unerwünschten Reaktionen in Zusammenhang mit der Nivolumab-, Ipilimumab- oder Nivolumab + Ipilimumab-Behandlung assoziiert werden, festzustellen. Die frühzeitige Erkennung von unerwünschten Reaktionen und die Intervention sind ein wichtiger Bestandteil der richtigen Anwendung von Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab. Bitte beachten: mit dieser Prüfliste wird kein Anspruch auf Vollständigkeit erhoben. Sollte der Patient/die Patientin auf irgendeine der Fragen mit «Ja» antworten, konsultieren Sie den Arzt des Patienten/der Patientin, bevor Sie Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab verabreichen. Hinweise zum Management immunvermittelter Nebenwirkungen unter Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab, allgemeine Vorgehensweisen sowie Empfehlungen bei organspezifischen immunvermittelten Neben­ wirkungen finden Sie in der jeweiligen Fachinformation. Weiterführendes Informationsmaterial erhalten Sie direkt von Bristol-Myers Squibb SA Hinterbergstrasse 16 CH-6330 Cham Telefon: +41 (0)41 767 72 00 E-Mail: [email protected] Medizinische Anfragen an Bristol-Myers Squibb richten Sie bitte an: Telefon: +41 (0)41 767 72 55 E-Mail: [email protected] Fragen zur Therapie und dem Nebenwirkungsspektrum von Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab beim fortgeschrittenen Melanom oder beim nicht-kleinzelligen Lungenkarzinom können Sie in der Schweiz gerne auch direkt an Ihre klinischen Experten richten. Folgende Experten haben sich für eine Beratung bereiterklärt: zu Melanom zu Melanom zu Melanom und NSCLC Prof. Dr. med. Reinhard Dummer Universitätsspital Zürich Klinik für Dermatologie Tel. Sekretariat +41 (0)44 255 25 07 [email protected] Prof. Dr. med. Olivier Michielin, PhD Centre Hospitalier Universitaire Vaudois Département d’oncologie Tél. Réception +41 (0)21 314 0155 [email protected] Prof. Dr. med. Alfred Zippelius Universitätsspital Basel Klinik für Onkologie Tel. Sekretariat +41 (0)61 265 50 74/59 [email protected] Prüfliste zur Patientenüberwachung bei einer Therapie mit Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab Patientendaten Vorname Nachname Geburtsdatum Strasse PLZ / Ort Telefon Allgemein Fragen Antwort Ja Anmerkungen Nein Haben Sie Schwierigkeiten, Ihren normalen Aktivitäten nachzugehen? Hatten Sie in letzter Zeit ständig oder ungewöhnliche Kopfschmerzen? Haben Sie sich in letzter Zeit schläfrig oder ausserordentlich müde gefühlt? War Ihnen in letzter Zeit schwindlig oder sind Sie ohnmächtig geworden? Haben Sie in letzter Zeit Veränderungen Ihrer Stimmung oder Ihres Verhaltens bemerkt wie z. B. verminderter Sexualtrieb, Reizbarkeit oder Vergesslichkeit? War Ihnen in letzter Zeit häufiger kalt? Haben Sie in letzter Zeit an Gewicht zu- oder abgenommen? Hatten Sie in letzter Zeit Haarausfall? Ist Ihre Stimme in letzter Zeit tiefer geworden? Hat sich Ihre Haut oder haben sich Ihre Augen in letzter Zeit gelb verfärbt? Verspüren Sie verstärkten Durst? Müssen Sie häufiger oder seltener Harn lassen als sonst? Ist Ihr Urin blutig, dunkel oder teefarben? Bluten Sie schneller oder bekommen Sie schneller Blutergüsse als normal? Sind Ihre Knöchel angeschwollen? Hatten Sie in letzter Zeit starke oder ständige Muskel- oder G ­ elenkschmerzen? Hatten Sie in letzter Zeit starke Muskelschwäche? Hatten Sie in letzter Zeit Fieber? Hat sich in letzter Zeit Ihr Sehvermögen verändert? Haben Sie in letzter Zeit begonnen, neue Medikamente einzunehmen (verschriebene, frei verkäufliche oder pflanzliche)? Falls ja, welche und wie oft? Lunge Fragen Antwort Ja Leiden Sie seit Kurzem an Husten oder hat sich Ihr Husten verschlechtert? Haben Sie Schmerzen im Brustkorb? Haben Sie Schwierigkeiten beim Atmen oder leiden Sie an Kurzatmigkeit? Nein Anmerkungen Gastrointestinal Fragen Antwort Ja Anmerkungen Nein Leiden Sie an starker Übelkeit und/oder Erbrechen? Hatten Sie in letzter Zeit Appetitverlust oder weniger Hunger als normal? Wie häufig entleeren Sie Ihren Stuhl jeden Tag? • Ist dies anders als sonst? Wenn ja, inwiefern? • Ist Ihr Stuhl flüssig oder wässrig oder riecht er faulig? • Haben Sie Blut oder Schleim in Ihrem Stuhl bemerkt? • Ist Ihr Stuhl dunkel, teerig oder verklebt? Ist Ihr Stuhlgang schmerzhaft? Empfinden Sie Schmerzen in der Bauchgegend oder sind Sie hier besonders empfindlich? Wenn ja, wo? Neurologisch Fragen Antwort Ja Anmerkungen Nein Haben Sie in letzter Zeit Phasen mit Verwirrung erlebt? Haben Sie zu irgendeinem Zeitpunkt das Bewusstsein verloren? Haben Sie in letzter Zeit eine Versteifung des Nackens erlebt? Hatten Sie in letzter Zeit Krampfanfälle irgendeiner Art? Hatten Sie in letzter Zeit plötzliche Veränderungen Ihrer Stimmung, Wahrnehmung, Ihres Urteils- oder Erinnerungsvermögens? Haut Fragen Antwort Ja Anmerkungen Nein Hatten Sie in letzter Zeit Ausschlag oder Hautjucken? Hatten Sie in letzter Zeit Bläschen oder Geschwüre im Mund oder auf den anderen Schleimhäuten? Zusätzliche Fragen für Ihre Patienten auf Nivolumab + Ipilimumab Fragen Antwort Ja Anmerkungen Nein Hatten Sie in letzter Zeit Augenschmerzen oder eine Rötung der Augen? Hat sich Ihre Haut in letzter Zeit abgeschält? Verspüren Sie Taubheit oder Kribbeln in Ihren Händen oder Füssen? Verspüren Sie eine ungewöhnliche Schwäche der Beine, Arme oder im Gesicht? Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab können auch schwere allergische Reaktionen auslösen (bei weniger als 1 % der Patienten). Sollten diese Symptome während oder innerhalb der 24 Stunden nach dem Erhalt von Nivolumab, Ipilimumab oder Nivolumab + Ipilimumab auftreten, suchen Sie unverzüglich einen Arzt auf: • Nesselsucht (rote, juckende Erhebungen), Ausschlag, Jucken • Anschwellen der Lippen, Zunge, des Halses oder Gesichts • Kurzatmigkeit oder Keuchen oder plötzlicher Husten • Schwindelgefühl oder Ohnmachtsgefühl oder Herzklopfen Quellen: Fachinformationen OPDIVO®, YERVOY®, NIVOLUMAB BMS; jeweils aktueller Stand Nivolumab ist als Monotherapie oder in Kombination mit Ipilimumab bei Erwachsenen für die Behandlung des fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanoms indiziert. Nivolumab ist zur Behandlung von lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkarzinom (NSCLC) nach vorangegangener Chemotherapie indiziert. Ipilimumab ist bei Erwachsenen für die Behandlung des fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanoms indiziert. OPDIVO® (Nivolumab). I: Behandlung von lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkarzinom (NSCLC) nach vorangegangener Chemotherapie. D: Die empfohlene Dosierung von OPDIVO® ist 3 mg/kg intravenös verabreicht über 60 Minuten alle 2 Wochen. Die Behandlung sollte so lange fortgesetzt werden, wie ein klinischer Nutzen beobachtet wird oder bis die Behandlung vom Patienten nicht mehr toleriert wird. Eine Dosisreduktion wird nicht empfohlen. Für weitere Informa­tionen zur Dosierung siehe Fachinformation. KI: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. W&V: OPDIVO® wird mit immunvermittelten unerwünschten Wirkungen in Verbindung gebracht, die wahrscheinlich auf den Wirkungsmechanismus des Präparats zurückzuführen sind. Immunvermittelte Nebenwirkungen, die schwerwiegend bis lebensbedrohlich sein können, können Lunge, Verdauungstrakt, Leber, Haut, Niere, endokrines System oder andere Organsysteme betreffen. Eine systemische hochdosierte Therapie mit Kortikosteroiden zusammen mit oder ohne andere Immunsuppressiva kann für die Behandlung schwerer immunvermittelter Nebenwirkungen erforderlich sein. Spezifische Richtlinien für OPDIVO® zur Behandlung von immunvermittelten Nebenwirkungen sind in der Fachinformation beschrieben. Weitere Warnhinweise siehe Fachinformation. UAW: Anaphylaktische Reaktion, infusionsbedingte Reaktion, Hypersensitivität, Hypothyreose, Hyperthyreose, verminderter Appetit, periphere Neuropathie, Kopfschmerzen, Schwindel, verschwommenes Sehen, Hypertonie, Pneumonitis, Atemnot, Husten, Diarrhö, Übelkeit, Stomatitis, Erbrechen, Bauchschmerzen, Verstopfung, Mundtrockenheit, Kolitis, Pankreatitis, Gastritis, Hepatitis, Rash, Pruritus, Vitiligo, trockene Haut, Erythem, Alopezie, toxische epidermale Nekrolyse, Schmerzen im Bewegungsapparat, Arthralgie, tubuläre interstitielle Nephritis, Nierenversagen, Müdigkeit, Pyrexie, Ödeme, erhöhte AST, erhöhte ALT, erhöhte alkalische Phosphatase, erhöhte Lipasewerte, erhöhte Amylase, erhöhtes Kreatinin, Lymphozytopenie, Leukopenie, Thrombozytopenie, Anämie, Hyperkalzämie, Hypokalzämie, Hyperkaliämie, Hypokaliämie, Hypomagnesiämie, ­Hyponatriämie, erhöhtes Gesamt-Bilirubin, Neutropenie, Hypermagnesiämie, Hypernatriämie, Gewichtsverlust. DF: 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung, Durchstech­flaschen zu 100 mg/ 10 ml und 40 mg/4 ml (A). Z: Siehe Fachinformation. ZI: Bristol-Myers Squibb SA, CH-Steinhausen. Stand der Information: November 2015. www.swissmedicinfo.ch NIVOLUMAB BMS (Nivolumab). I: Behandlung des fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanoms bei Erwachsenen als Monotherapie oder in Kombination mit Ipilimumab. D: Die empfohlene Dosierung von NIVOLUMAB BMS als Monotherapie ist 3 mg/kg intravenös verabreicht über 60 Minuten alle 2 Wochen. Während der Kombinationstherapiephase mit 3mg/kg Ipilimumab für die ersten 4 Dosen ist die empfohlene Dosierung von NIVOLUMAB BMS 1 mg/kg intravenös verabreicht über 60 Minuten alle 3 Wochen, gefolgt von einer NIVOLUMAB BMS Monotherapie-Phase. Eine Dosisreduktion wird nicht empfohlen. Die Behandlung sollte so lange fortgesetzt werden, wie ein klinischer Nutzen beobachtet wird oder bis die Behandlung vom Patienten nicht mehr toleriert wird. Für weitere Informationen zur Dosierung siehe Fachinformation. KI: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. W&V: NIVOLUMAB BMS wird mit immunvermittelten unerwünschten Wirkungen in Verbindung gebracht, die wahrscheinlich auf den Wirkungsmechanismus des Präparats zurückzuführen sind und in Kombination mit Ipilimumab häufiger auftreten. Immunvermittelte Nebenwirkungen, die schwerwiegend bis lebensbedrohlich sein können, können Lunge, Verdauungstrakt, Leber, Haut, Niere, endokrines System oder andere Organsysteme betreffen. Eine systemische hochdosierte Therapie mit Kortikosteroiden zusammen mit oder ohne andere Immunsuppressiva kann für die Behandlung schwerer immunvermittelter Nebenwirkungen erforderlich sein. Spezifische Richtlinien für NIVOLUMAB BMS zur Behandlung von immunvermittelten Nebenwirkungen sind in der Fachinformation beschrieben. Weitere Warnhinweise siehe Fachinformation. UAW: Pneumonie, Infekt der oberen Atemwege, Eosinophilie, anaphylaktische Reaktion, infusionsbedingte Reaktion, Hypersensitivität, Hypothyreose, Nebenniereninsuffizienz, Hypopituitarismus, Hypophysitis, Hyperthyreose, Thyreoiditis, Hyperglykämie, Verminderter Appetit, Dehydratation, periphere Neuropathie, Kopfschmerzen, Schwindel, verschwommenes Sehen, Uveitis, Tachykardie, Hypertonie, Pneumonitis, Atemnot, Husten, Diarrhö, Kolitis, Gastritis, Sarkoidose, Duodenititis, intestinale Perforation, Übelkeit, Stomatitis, Erbrechen, Bauchschmerzen, Verstopfung, Mundtrockenheit, Pankreatitis, Hepatitis, Rash, Pruritus, Vitiligo, trockene Haut, Erythem, Alopezie, Urtikaria, toxische epidermale Nekrolyse, Schmerzen im Bewegungsapparat, Arthralgie, tubuläre interstitielle Nephritis, Nierenversagen, Müdigkeit, Pyrexie, Ödeme, Schmerzen am Verabreichungsort, erhöhte AST, erhöhte ALT, erhöhte alkalische Phosphatase, erhöhte Lipasewerte, erhöhte Amylase, erhöhtes Kreatinin, Lymphozytopenie, Leukopenie, Thrombozytopenie, Anämie, Hyperkalzämie, Hypokalzämie, Hyperkaliämie, Hypokaliämie, Hypomagnesiämie, Hyponatriämie, erhöhtes GesamtBilirubin, Neutropenie, Hypermagnesiämie, Hypernatriämie, Gewichtsverlust. DF: 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung, Durchstechflaschen zu 40 mg/4 ml und 100 mg/10 ml (A). Z: siehe Fachinformation. ZI: Bristol-Myers Squibb SA, CH-Steinhausen. Stand der Information: April 2016. www.swissmedicinfo.ch YERVOY® (Ipilimumab). I: Behandlung von fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanomen bei Erwachsenen. D: Das empfohlene Induktionsregime für YERVOY® liegt bei 3 mg/kg, intravenös (i.v.) über einen Zeitraum von jeweils 90 Minuten verabreicht, alle 3 Wochen für insgesamt 4 Dosen. Eine Dosisreduktion wird nicht empfohlen. Für weitere Informationen zur Dosierung siehe Fachinformation. KI: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung. W&V: YERVOY® wird mit entzündlichen Nebenwirkungen aufgrund einer erhöhten oder übermässigen Immunaktivität (immunvermittelte Nebenwirkungen) in Verbindung gebracht, die wahrscheinlich auf den Wirkungsmechanismus des Präparats zurückzuführen sind. Immunvermittelte Nebenwirkungen, die schwerwiegend bis lebensbedrohlich sein können, können Verdauungstrakt, Leber, Haut, Nervensystem, endokrines System oder andere Organsysteme betreffen. Obwohl die meisten immunvermittelten Nebenwirkungen während der Induktionsphase auftraten, wurde auch Monate nach der letzten YERVOY®-Dosis über deren Auftreten berichtet. Eine systemische hochdosierte Therapie mit Kortikosteroiden zusammen mit oder ohne andere Immunsuppressiva kann für die Behandlung schwerer immunvermittelter Nebenwirkungen erforderlich sein. Spezifische Richtlinien für YERVOY® zur Behandlung von immunvermittelten Nebenwirkungen sind in der Fachinformation beschrieben. Weitere Warnhinweise siehe Fachinformation. UAW: Tumorschmerzen, Anämie, Lymphopenie, Hypopituitarismus (einschliesslich Hypophysitis), Hypothyreose, verminderter Appetit, Dehydratation, Hypokaliämie, Verwirrtheit, periphere sensorische Neuropathie, Schwindel, Kopfschmerzen, Lethargie, verschwommenes Sehen, Augenschmerzen, Hypotonie, Hautrötungen, Hitzewallungen, Dyspnoe, Husten, Diarrhö, Erbrechen, Übelkeit, gastrointestinale Hämorrhagie, Kolitis, Verstopfung, gastroösophageale Refluxkrankheit, Bauchschmerzen, gastrointestinale Perforation, Dickdarmperforation, intestinale Perforation, infektiöse Peritonitis, Leberfunktionsstörungen, Ausschlag, Pruritus, Dermatitis, Erythem, Vitiligo, Urtikaria, Alopezie, Nachtschweiss, trockene Haut, Arthralgie, Myalgie, Muskel- und Skelettschmerzen, Muskelspasmus, Müdigkeit, Reaktionen an der Injektionsstelle, Pyrexie, Schüttelfrost, Asthenie, Ödeme, Schmerzen, grippeähnliche Krankheit (Symptome), erhöhte ALT, erhöhte AST, erhöhte Bilirubinwerte, erhöhte Alkalinphosphatasewerte, Gewichtsabnahme. DF: 5 mg/ml Konzentrat zur Herstellung einer Infusionslösung, Durchstechflaschen zu 50 mg/10 ml und 200 mg/40 ml (A). Z: siehe Fachinformation. ZI: Bristol-Myers Squibb SA, CH-Steinhausen. Stand der Information: August 2015. www.swissmedicinfo.ch Quellen: Fachinformationen OPDIVO®, YERVOY®, NIVOLUMAB BMS; jeweils aktueller Stand © 05/2016 Bristol-Myers Squibb. 7356CH16NP02729-01 / 1506CH16PR05736-01 / 1506CH16PR05735-01