mit den Liganden 1.4.7-Triazacyclononan (L)
Werbung

Monomere Komplexe des Vanadium(III) und -(IV) mit den Liganden
1.4.7-Triazacyclononan (L) und l,4,7-Trimethyl-l,4,7-triazacyclononan (L ).
Die Kristallstrukturen von [L'VF3] *4H20 und IL'V(acac)01(C104)
M onomeric Complexes of Vanadium (III) and -(IV) with the Ligands
1.4.7-Triazacyclononane (L) and l,4,7-Trim ethyl-l,4,7-triazacyclononane (L').
The Crystal Structures of [L'VF3] -4 H 20 and [L'V(acac)0](C104)
Petra K nopp und Karl W ieghardt*
Lehrstuhl für Anorganische Chemie I, Ruhr-Universität, D-4630 Bochum
Bernhard N uber und Johannes Weiss
Anorganisch-Chemisches Institut der Universität, D-6900 Heidelberg
Z. Naturforsch. 46b, 1 0 7 7 - 1084 (1991); eingegangen am 18. Januar 1991
M onomerie Vanadium(III) and -(IV) Complexes, Synthesis, Electrochemistry, X-Ray
The syntheses o f m onom eric com plexes o f V(III) and V(IV) containing the ligands 1,4,7triazacyclononane (L) and its N-m ethylated derivative L' are reported: [LVF3] 0 , 5 H 20 ;
[L'VF3] -4 H 20 ; [L'V(acac)Cl]PF6; [L V 0 F 2]- 2 H 20 ; [L'V0(acac)](C104). The crystal structures
o f [L'VF3] -4 H 20 and o f [L'V 0(acac)](C 104) have been determined by X-ray crystallography.
Electronic spectra, magnetic properties and the electrochemistry o f these complexes are re­
ported.
Wir haben in den letzten Jahren intensiv die m ag­
netischen Eigenschaften zweikerniger Komplexe
des Vanadium(III) mit linearen und gewinkelten
[ V - 0 - V ] 4+-Struktureinheiten untersucht [1-4].
Überraschenderweise sind die beiden oktaedrisch
koordinierten V(III)-Zentren mit d 2 -Elektronenkonfiguration stark intram olekular ferrom agne­
tisch gekoppelt [3, 4], Diese Beobachtung steht im
Gegensatz zu den besser untersuchten dinuklearen
Komplexen des C rIÜ(d3) [5], M nII!(d 4 h.s.) [6 ] und
FeIU(d 5 h.s.) [7] mit [ M - 0 - M ] 4 +-Struktureinheit,
in denen die Spins der Elektronen jeweils anti- fer­
romagnetisch über einen Superaustauschmechanismus m iteinander gekoppelt sind. So haben wir
vor allem monomere Komplexe mit dem F rag­
ment LV bzw. L'V, wobei L 1,4,7-Triazacyclono­
nan (C 6 H 1 5 N 3) und L' dessen N-methyliertes Deri­
vat sind, als geeignete Ausgangsverbindungen für
die Synthese derartiger dinuklearer Komplexe herstellen müssen, die über zumindest eine labile K o­
ordinationsstelle zur Bildung der Oxobrücke ver­
fügen sollten. L'VC13 und L 'V (0 3 SCF 3) 3 [2, 3] ha­
ben sich als hierfür geeignet erwiesen. Im Zuge
* Sonderdruckanforderungen an Prof. Dr. K. W ieg­
hardt.
V erlag der Zeitschrift für N a tu rforsch u n g. D -7 4 0 0 T üb in gen
0932 - 0776/91 /0 8 0 0 - 1077/$ 0 1 .0 0 /0
dieser Untersuchungen wurden mehrere einkerni­
ge Komplexe des V(III) und V(IV) erhalten, über
deren Struktur, spektroskopische und magnetische
Eigenschaften sowie über deren Elektrochemie wir
hier berichten.
Ergebnisse und Diskussion
Synthese und spektroskopische Eigenschaften der
Komplexe
Wie bereits an anderer Stelle kurz beschrieben
[3, 4], führt die Umsetzung von VC13 und 1,4,7-Trimethyl-l,4,7-triazacyclononan in Acetonitril unter
einer Ar-Schutzgasatmosphäre zum violetten
[L'VC13], das mit C F 3 S 0 3H unter HCl-Gasentwicklung zum grünen Neutralkom plex
[L'V (0 3 SCF3)3] umgesetzt werden kann. Die koor­
dinierten C F 3 S 0 3-Liganden sind sehr labil; die
Verbindung löst sich in Wasser, M ethanol oder
Acetonitril unter Bildung der entsprechenden Trisolvenskomplexe [L'V(S)3]3+, die bisher noch nicht
in Substanz isoliert werden konnten. Wäßrige Lö­
sungen von L 'V (0 3 SCF 3) 3 reagieren mit dem A n­
ion NCS" unter Bildung des Neutralkomplexes
L'V(NCS ) 3 [3]. Die Umsetzung von L'VC13 in ei­
nem C H 3 0 H /H 2 0-G em isch (4:1) mit Natrium acetylacetonat (acac; 2,4-Pentandionat(l - ) ) führt zu
einer braunen Lösung, aus der nach Zugabe von
Unauthenticated
Download Date | 8/19/17 11:44 PM
1078
P. K n o p p et al. ■ M o n o m e r e K o m p le x e d es V a n a d iu m (II I) u nd -(IV )
N aP F 6 braune Kristalle von [L'V(acac)Cl](PF6)
ausfallen.
V F3, gelöst in etwas wasserhaltigem C H 3 CN,
ergibt nach Zugabe von L' grüne Kristalle
von [L'VF 3 ]-4 H 2 0 ; die gleiche Reaktion mit
1,4,7-Triazacyclononan (L) ergibt hellgrünes
[LVF 3 ]-0 ,5 H 2 0 ,
das
im
Gegensatz
zum
[L'VF 3 ]-4 H 20 in allen gängigen Lösungsmitteln
unlöslich ist.
Alle bisher beschriebenen Komplexe sind m ono­
mere, oktaedrisch koordinierte Verbindungen des
Vanadium(III). Dementsprechend ergaben tempe­
raturabhängige Suszeptibilitätsmessungen an ge­
pulverten Proben im Temperaturbereich 8 9 298 K mittels einer Faraday-W aage tem peratur­
unabhängige magnetische M omente zwischen 2,51
und 2,67 //B. Dies ist typisch für V(III)-Komplexe
mit d 2 -Elektronenkonfiguration, für die ein spinonly-W ert von 2,73 /zBerwartet werden kann [8 ],
Die Elektronenspektren dieser Komplexe sind
in Tab. I zusammengestellt; sie zeigen alle zwei in­
tensitätsschwache (d-d)-Ü bergänge im sichtbaren
Bereich, die den folgenden Übergängen unter der
A nnahm e eines oktaedrischen Ligandenfeldes zu­
geordnet werden können:
V,
v2
’T , ( F ) ^ jT 2 (F)
T, (F) —» 3 T| (P)
3
Der Übergang v3: 3 T, —> 3 A 2 (F) ist durch charge-transfer (CT)-Banden im nahen UV-Bereich
verdeckt. Der Ligandenfeldaufspaltungsparameter 10 Dq läßt sich nach der einfachen Formel (1)
berechnen [9].
v, = 2 Dq - (6600-3 Dq) +
[(6600-3 D q ) 2 + 16 Dq 2 + 6 Dq • 13200]’/2 (1)
Die erhaltenen Zahlenwerte für 10 Dq sind
ebenfalls in Tab. I angegeben. Die G röße von
10 Dq folgt erwartungsgem äß der Stellung der ein­
zähnigen X “-Liganden in der spektrochemischen
Reihe (C F 3 S 0 3 > F “ > CL). Das Elektronenspek­
trum von LV(NCS ) 3 ist bandenreicher und intensi­
tätsstärker. Dies ist wahrscheinlich auf (L —> M)CT-Banden der N C S“-Liganden zurückzuführen.
Im Infrarotspektrum werden zwei v(NCS)-Banden
bei 1980 und 1950 cm “ 1 beobachtet, die eine
V -N C S -K oordination nahelegen.
Die klassische Koordinationschem ie des Vanadium(IV) wird durch die [V = 0 ] 2+-G ruppe dom i­
niert [10]. Ein einfacher Zugang zu diesem K om ­
plextyp ist die Luftoxidation einkerniger Vanadium(III)-Komplexe in etwas H 2 0-haltigen Lö­
sungsmitteln. So kann blaues [L V 0F 2]-2 H 20
aus M ethanol/H 20 durch Luftoxidation von
[LVF3] 0,5H 20 in guten Ausbeuten gewonnen
werden, während Umsetzung von L 'V (0 3 SCF 3 ) 3 in
wäßriger N aO CN - oder N aN 3-Lösung an der Luft
zum tiefblauen [L'VO(NCO)2] bzw. [L'VO(N3)2]
führt [3], Die Oxidation von [L'V(acac)Cl]PF 6 mit
H 2 0 2 in H 20 ergibt nach Zugabe von Perchlorsäu­
re [L'V0(acac)](C104). Im Infrarotspektrum zei­
gen diese Vanadylkomplexe eine intensive
v(V = 0)-Valenzschwingung: [LVO(NCO)2] und
[LVO(N3)2] bei 950 cm "1, [LVO(acac)](ClÖ4) bei
970 cm “ 1 und L'V O F 2 bei 958 cm “1. Sie besitzen
im Bereich 89-298 K ein tem peraturunabhängiges
magnetisches M om ent von 1,7 juB, das dem spinonly-Wert für eine d'-Elektronenkonfiguration
entspricht.
In den Elektronenspektren werden zwei intensi­
tätsschwache Absorptionsm axim a im sichtbaren
Tab. I. Elektronenspektren und M agnetismus der Komplexe.
Kom plex
^ m a x ^ ^ O m o l“1cm “1)
10 Dq [cm ']
L'VCl3a
L 'V (03SC F3)3b
L'V(NCS)3
[L'V(acac)Cl](PF6)a
[L'VF3]-4H-,Oa
[L V F ,]0 ,5 H ,O b
L'VO(NCO)2a
L'VO(N3)2a
[L 'V 0(acac)](C 104)a
[LVOF,] • 2 H-,Oc
750 (30), 507(160), 318(2700)
620,430
434 (7500), 377 ( 3500), 324 (1 2 , 4 x 103), 302 (8,0 x 103)
715 (17), 480 (230)
640 (9), 435 (28)
598,430
770(34), 561 (35), 480 sh
786(58), 594(76)
714(40), 532(10), 391 (41)
806(11), 586(22)
14800
17730
15490
17200
17800
16800
18 800
17100
A'eff’ / V '
2,60
2,62
2,67
2,51
2,60
2,53
1,71
1,72
1,71
1,69
a Lösungsmittel: C H 3CN (20 °C); h Festkörper-Reflexionsspektrum ;c Lösungsmittel: M ethanol (20 C); d im Tem­
peraturbereich 8 9 -2 9 8 K.
Unauthenticated
Download Date | 8/19/17 11:44 PM
1079
P. K n o p p et al. ■ M o n o m e r e K o m p le x e d es V a n a d iu m (I I I ) u n d -(IV )
Bereich beobachtet, die nach Ballhausen und Gray
[ 1 1 ] folgenden (d-d)-Ü bergängen zugeordnet wer­
den können:
V|
v2
dxy —>d x: dyz
d xy -> d x2_y2
b2—»e
b 2 -* b ,
(= 10 Dq)
(Die z-Achse des gewählten Koordinationssystem s
koinzidiert mit dem V =0-B indungsvektor.) Die
Lage von v2 ergibt direkt die G röße von 10 Dq
(Tab. I).
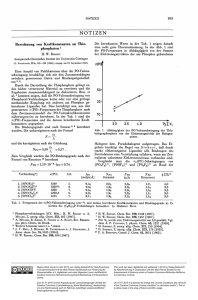
Abb. 1 zeigt das X-Band-ESR-Spektrum von
[L'V0(acac)](C104) in M ethanol bei 10 K. Zwei
Sätze (senkrecht und parallel zur (V = 0)-Achse)
von jeweils acht Linien werden beobachtet, die von
einer Kopplung zwischen dem d_vl,‘-Elektron und
dem 5 1 V-Kern (I = 7/2) herrühren. Die Auswer­
tung des anisotropen Spektrums ergibt die SpinH am ilton-Param eter gx = 2,011, g,| = 1,939 und
A ± = 4 7 x l0 - 4 cm - 1 und A y = 154x 10 - 4 cm -1.
Diese W erte befinden sich im erwarteten Bereich
für axial-symmetrische Vanadylkomplexe.
Elektrochemie
Das Cyclovoltammogramm von [L'VC13] in
trockenem Methylenchlorid (0,10 M [TBA]PF 6 als
Hilfselektrolyt, Pt-Scheibenelektrode, Ag/AgCl
(ges. LiCl/C 2 H 5 OH) Referenzelektrode) zeigt im
Meßbereich + 1,4 bis - 1,8 V vs Ag/AgCl einen re­
versiblen Einelektronenübergang (E l/2 = +1,24 vs
Ag/AgCl (+1,11 V vs NHE)) sowie eine irreversi­
ble R eduktion bei -0 ,86 V vs Ag/AgCl und einen
schwachen, irreversiblen Oxidationspeak bei 0,0 V
vs Ag/AgCl bei einem Spannungsvorschub von
0,2 Vs-1. Der reversible Einelektronenübergang
entspricht einer Oxidation von [L'VinCl3] zu
[L'V ivC 13]+, während die Reduktion zum instabi­
len [L'V"C13]- führt, das sich in Lösung auf der
Zeitskala des CV-Experiments zersetzt.
+ e+ e~
[L'VivC13]+ ^
L'VinCl3 ^
[LVCIJ- ->
-e
-e
Zersetzung
(2)
Interessanterweise ist im CV von [L'VF3] -4H 20
in C H 3CN im Bereich +2,6 bis -2 ,2 V vs Ag/AgCl
unter sonst gleichen Meßbedingungen nur ein re­
versibler Einelektronenübergang bei E, 2 =
+ 0,69 V vs Ag/AgCl (0,56 V vs N H E) zu beobach­
ten, der dem Prozeß Gl. (3) zugeordnet wird.
[LVmF 3] ^
[LV ivF 3]+
+e
Substitution der drei Chloridliganden in L'VC13
gegen drei Fluoridionen erleichtert also die Oxida­
tion zum entsprechenden [LVIVX 3]+-Komplex um
0,55 V.
Die Cyclovoltammogramme der Vanadylkom ­
plexe [L'VO(NCO)2] [3] und [L'V0(acac)](C104)
sind ebenfalls recht interessant. [L'VO(NCO)2]
zeigt im Potentialbereich -2 ,0 bis +2,0 V vs Ag/
AgCl in C H 3CN an einer Au-Scheibenelektrode unter sonst gleichen Arbeitsbedingungen wie oben
geschildert - einen reversiblen Einelektronenüber­
gang bei E 1/2 = +1,13 V vs Ag/AgCl (+1,0 V vs
NHE) und eine irreversible R eduktion Ep, red =
-1 ,9 2 V vs Ag/AgCl, die den Vorgängen in Gl. (4)
zugeordnet werden.
+ e“
[LV vO((N CO )2]+ ^
-e
E ,/2
+e“
[LVivO(NCO)2] -----* Produkte
Ep, red
B[mT]
Abb. 1. X-Band-ESR-Spektrum von [L 'V 0(acac)](C 104)
in M ethanol bei 10 K (Meßbedingungen: 9,4295 GHz;
2 0 ,0 //W /40 dB).
(3)
(4)
Es ist also elektrochemisch möglich, [LVO(NCO)2]
zum strukturgleichen Vanadium(V)-Komplex zu
oxidieren; monomere VHI = 0-Komplexe sind dage­
gen unbekannt. Es kommt in Gegenwart von Proto­
nen (H 2 0 ) zur Bildung des von uns früher beschrie­
benen, dinuklearen Komplexes [L'7 V-,(//-0)(NC0)4]
[3].
Unauthenticated
Download Date | 8/19/17 11:44 PM
1080
P . K n o p p et al. ■ M o n o m e r e K o m p le x e d e s V a n a d iu m (II I) u n d -(IV )
Das Cyclovoltammogramm von
[L'V0(acac)](C104) ist in Abb. 2 dargestellt. Im Po­
tentialbereich + 1,9 bis -2 ,0 V vs Ag/AgCl in
CH 3CN an einer Glaskohlenstoffarbeitselektrode
unter sonst gleichen Meßbedingungen wie oben
wird ein reversibler Einelektronenübergang bei
E { /2 = 1,56 V vs Ag/AgCl (1,43 V vs NHE) und
ein quasireversibler Einelektronenübergang bei
E2/2 = - 1,49 V vs Ag/AgCl (-1,52 V vs NHE) beob­
achtet. Auch hier entspricht der Übergang bei positi­
vem Potential einer reversiblen Oxidation zum Vanadium(V)-Komplex [L'VO(acac)]2+. Die reduzierte
Form [L'VinO(acac)]° ist etwas stabiler als
[L'VinO(NCO)2]_, sie wandelt sich aber auch hier in
Gegenwart von etwas H 20 langsam in die dinukleare
//-oxo-verbrückte Form um: [L2 V2n(//-0)(acac)2]2+
[3], die wir früher beschrieben haben.
Abb. 2. Cyclovoltammogram m von [L 'V 0(acac)](C 104)
in C H 3CN bei 20 °C (0,1 M [TBA]PF6; G laskohlenstoffarbeitselektrode; A g/A gCl (ges. LiCl, C2H 5OH)-Referenzelektrode; 0,2 V s-1 Scan-Geschwindigkeit; [K om ­
plex] ~ 10-3 M; Ferrocen interner Standard).
V l-F l
V 1 -F 2
V 1 -F 3
O l •0 2
1,824(3)
1,797(3)
1,885(3)
2,778(4)
F 1 - V 1 - F 2 100,3(1)
96,0(1)
F 1 -V 1 -F 3
F 2 -V 1 -F 3
95,9(1)
F l - V l - N l 168,4(2)
F 2 - V 1 - N 1 88.9(2)
F 3 - V 1 - N 1 90,1(2)
F 3 - V 1 - N 3 167,5(2)
N 2 - V 1 - N 3 80,0(2)
V l-N l
V 1 -N 2
V 1 -N 3
0 2 -0 4
2,190(4)
2,214(5)
2,167(5)
2,753(3)
F 1 -V 1 -N 2
F 2 -V 1 -N 2
F 3 -V 1 -N 2
N 1 -V 1 -N 2
F 1 -V 1 -N 3
F 2 -V 1 -N 3
N 1 -V 1 -N 3
90,5(2)
166,7(2)
90,7(2)
79,6(2)
92,4(2)
91,7(2)
80,1(2)
D ie K ris ta llstru k tu r e n von [ L' VF3] ■4 H :0 und
[ L ' V O f a c a c ) ] ( C 1 0 4)
Abb. 3 zeigt die Struktur des Neutralmoleküls
in Kristallen von [L'VF 3 ]-4 H 2 0 ; ausgewählte Bin­
dungsabstände und -winkel sind in Tab. II zusam ­
mengefaßt. Jedes Vanadium (III)-Ion ist pseudo­
oktaedrisch vom Aminliganden 1,4,7-Trimethyl1,4,7-triazacyclononan und drei facial koordinier­
ten Fluoridionen umgeben. Die Methylenkohlenstoffatom e zeigen physikalisch bedeutungslose,
große anisotrope Tem peraturfaktoren. Dies ist auf
eine statistische Fehlordnung der chiralen N eu­
tralm oleküle mit (AAÄ)- bzw. (S S ^-konfigurierten
Abb. 3. Struktur des Neutralm oleküls im Kristall von
[L'VF3]- 4 H 20 .
F l - ■Ol
F 2 ••• 0 3
F3 • 0 4
F 3 •• 0 3
03- •0 4
2,702(2)
2,750(2)
2,826(2)
2,813(2)
2,785(3)
Tab. II. Ausgewählte Bindungsab­
stände [Ä] und -winkel [ ] für
[L'VF3] -4 H 20 .
Unauthenticated
Download Date | 8/19/17 11:44 PM
P. K n o p p e t al. ■ M o n o m e r e K o m p le x e d es V a n a d iu m (II I) u n d -(IV )
V -N -C -C -N -C h e la tfü n frin g e n im G itter zu­
rückzuführen.
Interessanterweise sind die drei (V -F )- und
(V -N )-B indungen nicht äquivalent. Der Abstand
V 1 - F 3 ist signifikant länger als die beiden ande­
ren (V -F)-B indungslängen, während die dazu
/ra«s-ständige (V 1- N 3)-Bindung deutlich kürzer
ist als die beiden anderen (V -N )-A bstände. U rsa­
che dieser Verzerrung sind unterschiedliche
(F —H - O)-W asserstoffbrückenbindungen
im
Kristall. W ährend die Fluoridionen F l und F 2
nur eine derartige Bindung zu den W assermolekü­
len mit O 1 bzw. O 3 ausbilden, ist F 3 durch zw ei
kurze (F —H -0 )-K o n ta k te an zwei Wassermole­
küle ( 0 3 ' und 0 4 ) verbunden. Abb. 4 zeigt diese
Verhältnisse. Die H-Atomlagen der Wassermole­
küle konnten der Differenz-Fourier-Synthese ent­
nommen werden und wurden im letzten Verfeine­
rungszyklus berücksichtigt. Auch die Kristallwassermoleküle sind durch ( O - H —0)-W asserstoffbrückenbindungen m iteinander verknüpft
(O 1 - 0 2 ; 0 2 - 0 4 ; 0 3 - 0 4 -2 ,7 7 Ä; Tab. II).
Bedingt durch die sterischen Verhältnisse des
neungliedrigen
1,4,7-T riazacyclononangerüstes
sind die (N —V-N )-Bindungsw inkel mit —80°
deutlich kleiner als der ideale Oktaederwinkel von
90°; dafür sind die (F -V -F )-W in k e l etwas auf­
geweitet (—97°), während die (F -V -N )-W in k e l
nahezu 90° betragen. Die kleine Aufweitung der
(F -V -F )-W in k e l deutet auf einen kleinen 7r-Donorbeitrag der (V—F)-Bindungen hin, wie dies die
(W =0)-B indungen im [L W 03] • 3 H 20 [12] im we­
sentlich stärkeren Ausmaß haben. Die ( O - W 0)-W inkel betragen —107°. Bemerkenswert ist
1081
Abb. 5. Die Struktur des K ations im Kristall von
[L'V 0(acac)](C 104).
auch die Ähnlichkeit des W asserstoffbrückenbindungssystems in L W 0 3 im Vergleich mit dem hier
beschriebenen LVF3.
Die Struktur des komplexen Kations im Kristall
von [L'V0(acac)](C104) ist in Abb. 5 gezeigt. Auch
hier ist das V(III)-Ion pseudooktaedrisch von ei­
nem facial koordinierten Amin, einem zweizähni­
gen Acetylacetonatliganden und einer terminalen
Oxogruppe umgeben. Der (V = 0)-A bstand ist mit
1,588(5) Ä recht kurz und kann als Dreifachbin­
dung aufgefaßt werden [13]; er entspricht dem staTab. III. Ausgewählte Bindungsabstände [Ä] und -win­
ke! [°] für [L'V 0(acac)](C 104).
Abb. 4. Stereobild des W asserstoffbrückenbindungssystems der V F 3-Gruppe im Kristall von [L'VF3] - 4 H ,0
(offene, nicht bezeichnete Kreise sind H-Atome).
V l-O l
V 1- 0 2
V 1 -0 3
0 2 -C 1 3
C 1 2 -C 1 3
C 13 —C 14
1,972(4)
1,975(5)
1,588(5)
1,270(7)
1,384(10)
1,481(10)
V l-N l
V 1 -N 2
V 1 -N 3
O l-C ll
C 1 1 -C 1 2
C 1 0 -C 1 1
2,154(5)
2,168(5)
2,333(6)
1,295(7)
1,383(10)
1,493(9)
0 1 -V 1 -0 2
0 1 -V 1 -0 3
0 2 -V 1 -0 3
O l-V l-N l
0 2 -V 1 -N 1
0 3 -V 1 -N 1
0 1 -V 1 -N 2
0 2 - V 1- N 2
0 3 - V 1 -N 2
N 1 -V 1 -N 2
0 1 -V 1 -N 3
88,9(2)
102,0(2)
102,2(2)
162,6(2)
92,3(2)
94,7(2)
92,2(2)
163,3(2)
93,8(2)
81,8(2)
85,2(2)
0 2 -V 1 -N 3
0 3 -V 1 -N 3
N 1 -V 1 -N 3
N 2 -V 1 -N 3
V l-O l-C ll
V 1 -0 2 -C 1 3
O l-C ll-C lO
0 1 -C 1 1 -C 1 2
C 1 0 -C 1 1 -C 1 2
86,7(2)
168,5(2)
77,5(2)
76,8(2)
125,6(4)
127,4(4)
114,9(6)
124,2(6)
120,8(6)
Unauthenticated
Download Date | 8/19/17 11:44 PM
1082
P. K n o p p et al. • M o n o m e r e K o m p le x e d es V a n a d iu m (II I) u n d -(IV )
tistischen Mittel von 1,598 Ä, der aus 36 Kristall­
strukturen von V(lV)-M onooxokomplexen erm it­
telt wurde [14]. Ein starker /rc/ns-Einfluß au f die
in /ram-Stellung zur (V = 0)-G ruppe stehende
(V -N )-B indung ist ebenfalls charakteristisch für
derartige Komplexe (4 [(V -N ,rflJ - ( V - N dt)] =
0,17 Ä).
Experimenteller Teil
Die Synthese der Liganden L und L' [15] und des
Komplexes L'VC13 [4] erfolgte nach Literaturanga­
ben.
[L V F 3J 0 ,5 H 20
Zu einer Lösung von 1,20 g (9,3 mmol) 1,4,7Triazacyclononan in 20 ml Dimethylformamid
wurde 1,0 g (9,3 mmol) V F 3 gegeben und 1 h unter
einer Argonschutzgasatm osphäre am Rückfluß er­
hitzt. Es bildete sich ein hellgrüner Niederschlag,
der in allen gängigen Lösungsmitteln unlöslich ist.
Nach Filtration und Trocknung wurde 1,94 g
(85%) [LVF3] •0,5 H20 erhalten.
Analyse für C 6 H 1 6 N 3 O 0 5 F 3V (MG: 246,15)
Ber. C 29,3 H 6 , 6 N 17,1 F 2 3 ,l,
Gef. C 29,5 H 6 , 6 N 17,1 F 22,9.
[ L VOF2] ■2 H 20
0,5 g (2 mmol) [LVF3] •0,5 H20 wurden in 10 ml
M ethanol gelöst und mit einigen Tropfen Wasser
versetzt. Nach 1 d Stehen an der Luft in einem of­
fenen Gefäß hatte sich eine blaue Lösung gebildet,
aus der blaue Kristalle ausfielen (Ausbeute: 0,42 g
(78%)).
Analyse für C 6 H 19 N 3 0 3 F,V (MG: 270,17)
Ber. C 26,7 H 7,1 N 15,5,
Gef. C 26,7 H 6 , 8 N 15,5.
[ L 'V ( a c a c ) 0 ] ( C l0 4)
Eine Lösung von 0,2 g (1,8 mmol) Natrium acetylacetonat und 0,3 g (0,9 mmol) L'VC13 in 15 ml
H 20 wurde unter Rühren erhitzt, bis sich eine kla­
re, braune Lösung gebildet hatte. Nach Zugabe
von 1 ml 30-proz. H 2 0 2 ändert sich die Farbe der
Lösung nach blau. Überschüssiges H 2 0 2 wurde
durch vorsichtiges Erhitzen zerstört. Nach Zugabe
von 0,5 ml conc. HC10 4 fielen innerhalb von 2 d
hellblaue Kristalle aus (Ausbeute: 0,30 g (76%)).
Analyse für C 1 4 H 28N 3 0 7 C1V (MG: 436,79)
Ber. C 38~5 H 6,5 N 9,6,
Gef. C 38,4 H 6 , 6 N 9,5.
[ L' VF3] ■4 H 20
Kristallstrukturen
Zu einer Lösung von 1,6 g (9,3 mmol) 1,4,7-Trim ethyl-l,4,7-triazacyclononan in 20 ml Acetoni­
tril wurde 1,0 g (9,3 mmol) V F 3 gegeben und 1 h
unter Argon am Rückfluß erhitzt. Aus der tiefgrü­
nen Lösung fielen in der Kälte grüne Kristalle aus,
die aus einem C H 3 C N /H 2 0-(1:1)-Gem isch um kri­
stallisiert wurden (Ausbeute: 2,45 g (75%)).
Die Abmessungen der Elementarzellen von
[L'VF 3 )-4 H 20 und [L'V(acac)0](C104) sowie
Details der Intensitätsmessungen und S truktur­
verfeinerungen sind in Tab. IV zusammengefaßt.
Die Intensitäten wurden in der üblichen Weise
korrigiert; empirische A bsorptionskorrekturen
(^/-scans von jeweils 7 Reflexen im Bereich
8,5
2# =s 47,0 ) wurden ebenfalls durchgeführt.
Die Strukturen wurden mittels Patterson- und Differenz-Fourier-Synthesen gelöst. Die A tom koor­
dinaten für [L'VF3] -4H 20 sind in Tab. V und für
[L'V(acac)0](C104) in Tab. VI angegeben [16]. Die
Positionen der H-Atome der Methyl- und M ethy­
lengruppen wurden berechnet. In [L'V(acac)0](C104)
sind die Perchloratanionen leicht fehlgeordnet,
wodurch der relativ schlechte R -Wert von 0,93 be­
dingt ist. Alle Nicht-H-Atome wurden mit aniso­
tropen Tem peraturfaktoren verfeinert.
Analyse für C 9 H 29 N ,0 4 F 3V (MG: 351,28)
Ber. C 30,8 H 8,3 N 12,0,
Gef. C 30,9 H 8,4 N I 1,9.
[ L'V ( acac) CI] PF6
Zu einem mit Argon durchspülten M ethanol/
Wasser-Gemisch (4:1) wurde 0,3 g (0,9 mmol)
L'VC13 und 0,2 g (1,8 mmol) Natrium acetylacetonat gegeben und 10 min unter Rückfluß erhitzt.
Aus der dann klaren, braunen Lösung fielen inner­
halb weniger Stunden nach Zugabe von 1,0 g
N aP F 6 braune Kristalle aus (Ausbeute: 0,26 g
(58%)).
Analyse für C l4 FL8N 3 0 ,P F 6V (MG: 501,75)
Ber. C33~5 H 5 ,6 N 8,3,
Gef. C 33,6 H 5,5 N 8,2.
Wir danken Herrn Dr. E. Bill (Medizinische
Universität Lübeck) für die Messung des ESRSpektrums und dem Fonds der Chemischen Indu­
strie für finanzielle Förderung.
Unauthenticated
Download Date | 8/19/17 11:44 PM
P. K n o p p et al. • M o n o m e r e K o m p le x e d es V a n a d iu m (II I) u n d -(IV )
Formel
Molgewicht
Kristallsystem
Raumgruppe
Gitterkonstanten
*[A ]
b[A ]
c [A]
ß []
Z
Zellvolumen [Ä3]
Ber. Dichte [gern-3]
Kristallgröße [mm]
Diffraktometer
Strahlung
Meßtemperatur [ ]
Scan-Typ
Meßbereich [°]
Gem. Reflexe
Unabhängige Reflexe
Absorptionskoeffizient [cm“1]
LS-Parameter
T ransmissionskoeffizienten
R- Werta
/?w-Wertb
Max. Restelektronendichte [e/A 3]
1083
[C9H 21N 3V F3]-4H X>
351.28
orthorhombisch
P bca
[C,4H ,8N 30 3V](C10.
436,79
monoklin
P2 Je
9,008(7)
13,624(9)
27,08(2)
8,433(6)
18,84(1)
12,449(7)
95,24(5)
4
1969,67
1,47
0,4 x 0,5 x 0,6
Syntex R 3
M o - K a (Graphit)
22
8
3323,39
1,40
0 ,4 5 x 0 ,5 7 x 0 ,7 6
A E D II (Siemens)
M o - K a (Graphit)
22
S CD
3 < 2 9 < 57,5
4816
1836(1 =5 2,5<t(I))
6,20
206
0 ,8 3 -1 ,0
0,062
0,047
0 ,3 4 (-0 ,4 0 )
Tab. IV. Kristallographische
Daten.
CO
3 < 2 9 < 6 0 ,0
6314
3902 (I =s 2,5cr(I))
6,6
236
0 ,7 9 4 -0 ,9 2 0
0,093
0,091
0 ,7 0 (-0 ,6 5 )
a /? = E 11F01- IFCI|/Z|F 0
b Rw= {£w(|F0| - IFc|)2/
Zw|F 0 | 2 }'/2;w = IM F ).
Tab. VI. Atomkoordinaten (x lO 4) und äquivalente iso­
trope Temperaturfaktoren (x 103) für [L'V0(acac)](C104).
Tab. V. Atom koordinaten (x 104) und äquivalente iso­
trope Temperaturfaktoren ( x 103) für [L'VF3] -4 H 20 .
Atom
u eq*
Atom
37(1)
45(1)
47(1)
70(3)
44(2)
57(3)
47(2)
58(3)
51(2)
45(2)
46(2)
49(2)
62(3)
68(3)
77(3)
71(3)
75(3)
64(3)
75(3)
74(3)
72(3)
74(1)
341(12)
268(10)
164(5)
254(10)
V (l)
F (l)
F(2)
F(3)
N (l)
N(2)
N(3)
C (l)
C(2)
C(3)
C(4)
C(5)
C(6)
C(7)
C(8)
C(9)
W a(l)
Wa(2)
Wa(3)
Wa(4)
V (l)
0 (1 )
0 (2 )
C(10)
C ( ll)
C(12)
C(13)
C(14)
0 (3 )
N (l)
N (2)
N(3)
C (l)
C(2)
C(3)
C(4)
C(5)
C(6)
C(7)
C(8)
C(9)
C l(l)
0 (11)
0 (1 2 )
0 (1 3 )
0 (14)
x/a
328(1)
854(5)
2460(6)
1869(11)
1931(8)
3108(9)
3375(8)
4821(9)
- 779(6)
9(7)
-1 6 5 4 (7 )
1535(7)
-1585(10)
-2 5 8 3 (9 )
-1179(11)
515(10)
1561(11)
1354(11)
84(11)
-2 6 6 3 (9 )
3169(9)
5214(3)
6602(18)
4140(20)
5242(14)
5107(22)
y/b
1558(1)
567(2)
1844(2)
- 398(4)
368(3)
808(4)
1502(3)
1883(4)
1784(2)
2536(3)
1233(3)
1309(3)
2515(4)
1896(4)
942(5)
786(5)
1975(5)
2608(4)
3154(4)
718(4)
1044(5)
1150(1)
1042(11)
1095(6)
1818(5)
704(7)
z/c
2958(1)
3359(3)
3599(3)
4405(6)
4106(5)
4580(5)
4282(5)
4733(6)
3866(3)
2068(4)
1835(4)
1388(4)
1439(6)
1657(7)
816(7)
830(6)
735(6)
1378(6)
2810(6)
2347(7)
1598(6)
8149(2)
8594(14)
8820(10)
7673(8)
7393(9)
x /a
2282(1)
1876(3)
3593(4)
616(3)
2745(6)
1001(6)
4045(6)
1523(9)
835(8)
1897(9)
3393(10)
4900(8)
4184(8)
2765(7)
- 473(7)
5056(7)
528(7)
2796(11)
6045(6)
3189(7)
y/b
z/c
4263(1)
3368(2)
3581(2)
3969(2)
5554(3)
5395(3)
4928(4)
6252(5)
6270(5)
5618(7)
5507(6)
5542(6)
5972(6)
5302(4)
5036(4)
4176(5)
2213(8)
2295(7)
2124(4)
2778(4)
1441(1)
959(1)
1805(1)
1835(1)
1898(2)
1037(2)
1011(2)
1801(3)
1345(3)
594(3)
613(3)
1361(3)
1743(3)
2428(2)
888(2)
808(2)
5117(2)
4423(3)
7295(2)
3444(3)
u eq*
41(1)
65(1)
70(2)
59(1)
42(2)
50(2)
54(2)
101(4)
106(4)
114(5)
110(4)
108(4)
92(4)
61(2)
73(3)
81(3)
79(3)
115(3)
65(2)
90(3)
* Äquivalente isotrope U sind definiert als ein Drittel
der Spur des orthogonalisierten U —Tensors.
* Äquivalente isotrope U sind definiert als ein Drittel
der Spur des orthogonalisierten U^-Tensors.
Unauthenticated
Download Date | 8/19/17 11:44 PM
1084
P. K n o p p el a i ■ M o n o m e r e K o m p le x e d es V a n a d iu m (II I) u n d -(IV )
[1] K. Wieghardt, M. Koppen, B. Nuber und J. Weiss,
J. Chem. Soc. Chem. Commun. 1986, 1530.
[2] M. Koppen, G. Fresen, K. Wieghardt, R. Llusar, B.
Nuber und J. Weiss, Inorg. Chem. 27, 721 (1988).
[3] P. K nopp, K. Wieghardt, B. Nuber, J. Weiss und W.
S. Sheldrick, Inorg. Chem. 29, 363 (1990).
[4] P. Knopp und K. Wieghardt, Inorg. Chem., zur
Veröffentlichung eingereicht.
[5] a) E. Pedersen. Acta Chem. Scand. 26, 333 (1972);
b) J. Glerup, ibid. 26, 3775 (1972);
c) B. G. Gafford, R. E. Marsh, W. P. Schaefer, J. H.
Zhang, C. J. O ’Connor und R. A. Holwerda, Inorg.
Chem. 2 9 , 4652 (1990) und dort zitierte Literatur.
[6] C. A. Kipke, M. J. Scott, J. W. Gohdes und W. H.
Armstrong, Inorg. Chem. 29, 2193 (1990).
[7] a) K. S. Murray, Coord. Chem. Rev. 12, 1 (1974);
b) D. Kurtz (Jr.), Chem. Rev. 9 0, 585 (1990);
c) S. J. Lippard, Angew. Chem. 100, 353 (1988).
[8] B. N. Figgis und J. Lewis, Progr. Inorg. Chem. 6, 37
(1964).
[9] C. J. Ballhausen, Z. Phys. Chem., Neue Folge 11,
205(1954).
[10] L. V. Boas, J. C. Pessoa, in G. Wilkinson, R. D. Gillard und J. A. M cCleverty (Herausg.): Comprehen­
sive Coordination Chemistry, Vol. 3, S. 487. Perga­
mon Press, Oxford (1987).
[11] C. J. Ballhausen und H. B. Gray, Inorg. Chem. 1,
111 (1962).
[12] P. Schreiber, K. Wieghardt, B. Nuber und J. Weiss,
Z. Anorg. Allg. Chem. 587, 174(1990).
[13] W. A. Nugent und J. M. Mayer. Metal-Ligand M ul­
tiple Bonds. Wiley, New York (1988).
[14] J. M. Mayer, Inorg. Chem. 2 7, 3899 (1988).
[15] a) K. Wieghardt, P. Chaudhuri, B. Nuber und J.
W eiss, Inorg. Chem. 21, 3086 (1982);
b) K. Wieghardt, W. Schmidt, B. Nuber und J.
W eiss, Chem. Ber. 112, 2220(1979).
[16] Weitere Einzelheiten zu den Kristallstrukturuntersuchungen können beim Fachinformationszentrum
Energie, Physik, M athematik GmbH, D-7514 Eggenstein-Leopoldshafen 2, unter Angabe der Hin­
terlegungsnummer CSD 55142, der Autoren und
des Zeitschriftenzitats angefordert werden.
Unauthenticated
Download Date | 8/19/17 11:44 PM