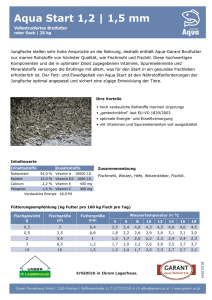
Praxistipp - FORUM VIA SANITAS
Werbung

Praxistipp von Dr. rer. nat. Nicole Wopfner 01.06.2016 Ernährung bei Stress, Burnout und Neuroendokrinen Störungen 1. Allgemeines Burnout ist nicht klar definiert. Manche Fachleute sagen, dass Burnout ein schleichender und „arbeitsassoziierter“ Prozess ist, andere sprechen von einer langanhaltenden Überforderungssituation oder von einem Zustand des „Ausgebranntseins“. Im Allgemeinen bezeichnet Burnout heutzutage einen längerfristigen emotionalen und körperlichen Zustand der Erschöpfung, von dem man sich nicht in wenigen Tagen erholt. Fakt ist, dass Burnout keine Diagnose, sondern ein Syndrom ist, hinter dem sich viele unterschiedliche Aspekte verbergen können. Derzeit gibt es mehr als 150 (!) körperliche und geistige „Symptome“, die mit Burnout in Zusammenhang gebracht werden können. Dabei darf nicht übersehen werden, dass Burnout gemäß der internationalen Nomenklatur von Krankheiten (ICD 10) unter Z 73 eingruppiert wird und somit keine Krankheit im klassischen Sinne darstellt, sondern ein Problem der Lebensbewältigung. Burnout ist keine Errungenschaft von heute. Bereits 1880 beklagte man die „Fernwirkung der elektrischen Revolution“, d.h. wachsende Städte, mehr Straßenverkehr und mehr Technik im Alltag. „Unruhefaktor“ war damals die Taschenuhr. Der Nervenarzt George M. Beard prägte für die damals oft auftretenden Symptome des Hetzens und Jagens den Begriff Neurasthenie (Nervenschwäche). Bereits um 1900 galt Neurasthenie als „Epidemie“ und schon 1914 war es eine der häufigsten Diagnosen überhaupt. 2. Die Zyklen des Burnout Neurasthenie ist ein Begriff von gestern – heutzutage spricht man von Burnout. In einem 12stufigen Zyklus beschrieb erstmals der deutsch-amerikanische Psychologe Herbert Freudenberger (1926-1999) die Entwicklung eines Burnouts, wobei sich die einzelnen Zyklen auch überlagern oder vermischen können: 1 1. Im ersten Stadium hat der Betroffene den Drang, anderen Menschen und sich selber etwas beweisen zu wollen. Hier kommt es zu einer dynamischen Rivalität zwischen übertriebener Erwartung und Verbissenheit, ein Ziel zu erreichen. Diese Phase ist am schwersten zu erkennen, da der Wunsch erfolgreich zu sein, prinzipiell positiv ist. 2. In der Phase des verstärkten Einsatzes dominieren Perfektionismus und Ehrgeiz verbunden mit der mangelnden Bereitschaft, Aufgaben zu delegieren. 3. Die subtile Vernachlässigung eigener Bedürfnisse ist typisch im Burnout-Zyklus. Alltägliche Freuden und Pflichten werden als störend empfunden. Die Arbeit hat den Betroffenen jetzt komplett unter Kontrolle. Körperliche Signale werden ignoriert, Pausen gelten als überflüssig und Zeichen von Schwäche und die Ernährung wird unwichtig. 4. Die Phase der Konfliktverdrängung ist ein Alarmsignal. Der Betroffene realisiert, dass etwas nicht in Ordnung ist, ordnet seine Bedürfnisse aber dem Erreichen des Ziels unter. Die Personen ziehen sich gesellschaftlich zurück und kapseln sich ab. Häufig flüchten sich diese Menschen in „suchtauslösende Kompensationen“, z.B. Alkohol. 5. Umdeutung von Werten bedeutet, dass zeitliche Orientierungen verloren gehen, Vergangenheit und Zukunft werden ignoriert, es zählt nur die Gegenwart. 6. Eine verstärkte Verleugnung auftretender Probleme dient als Schutzmechanismus und kaschiert bereits jetzt den Burnout-Prozess. Die Betroffenen reagieren bei einfachen Fragen bereits aggressiv oder zynisch. 7. Rückzug: Der Betroffene zieht sich „aus der Welt zurück“, er wird desillusioniert sowie orientierungs- und hoffnungslos. 8. Die Verhaltensänderungen werden jetzt für jedermann sichtbar. Die Person fühlt sich von der Umgebung missverstanden und persönlich angegriffen. Dementsprechend wird die Person aggressiv, z.T. bösartig und unsozial. 9. Depersonalisation bedeutet, dass der Betroffene sich selbst verneint. 10. Im Zustand der inneren Leere entstehen oft Panikattacken und undefinierbare Ängste. Ein „Auftanken oder zu Kräften kommen“ ist nur noch mit Aufputschmitteln oder größeren Mengen Alkohol machbar. 11. Im Stadium der Depression gibt es weder Motivation noch Initiative, sondern nur noch Hoffnungslosigkeit und Verzweiflung. Es dominiert ein starkes Bedürfnis nach langem Schlaf, erste Suizidgedanken stellen sich an. 12. Das Stadium der völligen Erschöpfung wird als Burnout bezeichnet. Jetzt brechen sämtliche psychischen und physischen Symptome aus und werden vollends sichtbar. Ohne Hilfe ist der Betroffene verloren, da der Suizid als der einzige Ausweg erscheint. Zusammenfassend kann man sagen, dass die Stadien 1-3 unter dem Zeichen von Idealismus und Enthusiasmus stehen. Diese gehen über in einen Zustand der Stagnation und des 2 Überdruss (Stadien 4-6). In den Stadien 7-9 dominieren Frustration und Verzweiflung, die schließlich in Apathie und totaler Erschöpfung mündet. 3. Belastungen, Stress und Burnout Vor 100 Jahren hatten die Menschen schwerwiegende Bürden: Trotz harter körperlicher Arbeit in 6-Tage-Wochen und 12-Stunden-Schichten war die Armut ein dominierendes Thema. Es gab keine sozialen Sicherungssysteme, die moderne Medizin steckte noch in den Kinderschuhen, es gab weniger Medikamente als heutzutage und viele Menschen starben schon vor dem 60. Lebensjahr. Außerdem war der Krieg ein unberechenbarer Faktor, der jederzeit ausbrechen konnte. Das heißt, dass die meisten Menschen damals zahlreichen existenziellen Bedrohungen ausgesetzt waren. In der heutigen Zeit erleben wir (in den Industrieländern) die meisten Belastungssituationen mit anderen Menschen, z.B. in der Schule, am Arbeitsplatz, in der Familie oder anderen Beziehungen sowie in der Freizeit. Zweifellos handelt es sich nicht um existentielle Bedrohungen, wohl aber um sogenannten Stress. Als Vorreiter der Stressforschung gilt Charles Darwin (1809-1882), der den Begriff Stress jedoch nie selbst benutzt hat. In seinem im Jahr 1859 veröffentlichten Buch „The origin of species“ sagt er, dass Stress wichtig für das Überleben einer Art ist, weil er Selektionsdruck erzeugt, d.h. nur die anpassungsfähigsten Individuen einer Art überleben. Im Jahr 1914 benutzte der amerikanische Psychologe Walter Cannon (1871-1945) den Begriff Stress erstmals in einem medizinischen Zusammenhang. Er wies nach, dass der Körper bei Belastungen die Botenstoffe Adrenalin und Kortisol ausschüttet, die ihn im Sinne einer Notfallreaktion zum Kampf oder zur Flucht befähigen (Fight or Flight). Als unspezifische Reaktion auf anhaltenden Stress beschrieb der kanadische Mediziner Hans Selye 1936 das allgemeine Adaptionssyndrom. Er unterteilte es in eine Alarmphase, eine Widerstandsphase, die die Anpassung des Körpers symbolisiert und eine Erschöpfungsphase, die mit der Zeit zu gesundheitlichen Problemen führt. Revolutioniert wurde die Stressforschung vom amerikanischen Psychologen Richard Lazarus 1974. Er sagt, dass Stressreaktionen weniger durch Belastungen selbst, sondern eher von der persönlichen Seite des Betroffenen verursacht werden. Einfacher gesagt: Stress ist eine Kopfsache. Was für den einen Stress bedeutet, ist für den anderen eine motivierende Herausforderung. Im Normalfall befinden sich die beiden Systeme des vegetativen Nervensystems, der Sympathikus und der Parasympathikus im Gleichgewicht. Der Sympathikus hat eine ergotrope Wirkung, d.h. er erhöht die nach außen gerichtete Handlungsbereitschaft (Fight or Flight). Der Parasympathikus hat eine trophotrope Wirkung, er ist der „Ruhenerv“ und dient der Erholung, der Ruhe und Schonung. Beide Teil-Nervensysteme verhalten sich antagonistisch. Bei Stress sind beide Teilsysteme „hochgefahren“- vergleichbar einem Auto, das gleichzeitig Vollgas fahren will und bremsen muss. Hier sind tabellarisch die Wirkungen von Sympathikus und Parasympathikus am Erfolgsorgan aufgeführt: 3 Erfolgsorgan Pupillen Ösophagus Magen Darm Blase Genitalien Nebennieren Pankreas Leber Bronchien Schilddrüse Koronargefäße Stoffwechsel Sympathikus Erweiterung Erschlaffung Hemmung Hemmung Erregung des Sphinkter, Harnretention Vasokonstriktion Steigerung der Adrenalinsekretion Hemmung Gluconeogenese, Glykogenolyse Dilatation Anregung Dilatation Dissimilation zunehmend Parasympathikus Verengung Kontraktion Anregung Anregung Erschlaffung des Sphinkter, Harnentleerung Erektion und Vasodilatation Hemmung der Adrenalinsekretion Anregung Konstriktion Hemmung Konstriktion Assimilation zunehmend Es ist verständlich, dass sich aus einer Dysbalance von Sympathikus und Parasympathikus eine Reihe von Symptomen ergeben können: Physische Symptome Erhöhter Ruhepuls Hypertonie, ggf. Herzrasen Verspannungen/Rückenschmerzen Vermehrte Schweißneigung Erhöhte Infektanfälligkeit Diarrhoe/Obstipation Magenbeschwerden/Sodbrennen/Übelkeit Tinnitus Allergien/Ausschlag/Herpes/Juckreiz Potenzprobleme Abendliche Heißhungerattacken Gewichtsprobleme Erschöpfung Psychische Symptome Chronische Müdigkeit Nervosität Reizbarkeit/Aggressivität Angstgefühle Apathie/Traurigkeit Konzentrationsstörungen Vergesslichkeit Schuldgefühle Verminderte Entscheidungsfähigkeit Sexuelle Unlust Verlängerte Erholung nach geistiger Beanspruchung 4. Zusammenführung von Stress, Burnout und Depression Im Jahr 2006 gelang Otto Denkert, ehemaliger Leiter der psychiatrischen Universitätsklinik Mainz, eine Zusammenführung der Begriffe Stress, Burnout und Depression. Er veröffentlichte seine Theorie in dem Buch Stress Depression, Verlag C.H. Beck, 1. Auflage, ISBN: 978-3406584489. Alle diese drei Begriffe unterliegen in der Praxis neuronalen, immunologischen und hormonellen Mechanismen wie die nachstehende Grafik verdeutlicht: 4 Quelle: http://www.bildungsstudio.de/inhalt/9.%20arbeiten_von_studierenden/stressmanagement/stressmanagement.htm Hormoneller Weg Zu den Hormonen zählen das Corticotropin Releasing Hormon (CRH) aus dem Hypothalamus, das die Stressreaktionen steuert. Aus dem Hypophysenvorderlappen wird anschließend das Adrenocortikotrope Hormon (ACTH) freigesetzt, welches das Signal zur Cortisolausschüttung an die Nebennierenrinde vermittelt. Cortisol ist für den Menschen essentiell und bindet an den nukleären Glucocorticoidrezeptor. Dieser wird dadurch als Transkriptionsfaktor aktiviert und führt zur Expression bestimmter Gene, z. B. für die Gluconeogenese oder auch von β2Adrenozeptoren. So erklären sich die Wirkungen von Cortisol auf den Stoffwechsel. Daneben kann der cortisolgebundene Glucocorticoidrezeptor auch direkte Wechselwirkungen mit anderen Transkriptionsfaktoren (z. B. NF-κB) eingehen, dieser Mechanismus spielt für die Wirkung auf das Immunsystem eine Rolle. Die Cortisolausschüttung, die Hypophyse und der Hypothalamus sind über einen negativen Regelkreis gekoppelt. So wird sichergestellt, dass nicht endlos Cortisol ausgeschüttet werden kann, da sich der Körper sonst zu Tode stressen würde. Im Stressstoffwechsel ist der Gesamtproteinumsatz erhöht (der Energieaufwand steigt), jedoch ist die Protein-Synthese-Quote kleiner als die Abbaurate. Bevorzugt wird daher Muskelmasse abgebaut, im Gegenzug wird Zucker in der Leber aufgebaut, so dass es bei Dauerstress zur Bildung einer Fettleber und Ausbildung eines metabolischen Syndroms kommen kann. 5 Neuronaler Weg Neurotransmitter sind Botenstoffe, die an den Synapsen die Erregung von einer Nervenzelle auf eine andere Zelle Übertragen. Dazu zählen Adrenalin, Noradrenalin, Dopamin, Serotonin, GABA, Glutaminsäure und Taurin. Zu beachten ist, dass die im Gehirn vorkommenden Katecholamine nicht aus dem Blut aufgenommen werden, sondern im Gehirn direkt hergestellt werden. Katecholamin-Biosynthese: Phenylalanin wird mittels Phenylalaninhydroxylase in Gegenwart von Folsäure und Tetrahydrobiopterin zusammen mit Sauerstoff in Tyrosin und Dihydrobiopterin umgewandelt. Tyrosin reagiert mit Tyrosinhydroxylase und NADH + H+ zu Dihydroxyphenylalanin (Levodopa oder L-Dopa). L-Dopa wird unter Vitamin B6-Beteiligung enzymatisch zu Dopamin decarboxyliert. In Gegenwart von Eisen- und Kupferionen sowie Vitamin C wird Dopamin in einer enzymatischen Reaktion in Noradrenalin überführt. In 6 einem letzten Schritt wird Noradrenalin mittels des Enzyms Phenylethanolamin-NMethyltransferase in Gegenwart von S-Adenosylmethionin (SAMe), den Vitaminen B6, Folsäure und B12 zu Adrenalin umgesetzt. Aus dem SAMe entsteht S-Adenosylhomocystein. Adrenalin: Adrenalin kontrahiert die Gefäße der Baucheingeweide, der Haut und der Schleimhäute. Die Gefäße am Herzen und in der Skelettmuskulatur werden hingegen dilatiert. Der diastolische Blutdruck sinkt, der systolische hingegen steigt aufgrund der Erhöhung des Herzzeitvolumens. Adrenalin wirkt positiv inotrop und chronotrop, d.h. die Kontraktionskraft und die Herzfrequenz werden erhöht. Auf die glatte Muskulatur des Darms und der Bronchien wirkt Adrenalin erschlaffend, so dass sich die Peristaltik vermindert, die Sauerstoffaufnahme jedoch erhöht. Dieses Katecholamin kann nicht die Blut-Hirn-Schranke überwinden, was bedeutet, dass sogenannte zentrale Wirkungen nach Adrenalingaben rein reflektorisch sind, z.B. Angstzustände Noradrenalin: Der Hauptteil an Noradrenalin wird im Locus caeruleus produziert, ein blau schimmerndes und schwarz pigmentiertes Kerngebiet im Bereich der dorsalen Brückenhaube des Metencephalons. Noradrenalin erhöht durch eine allgemeine Vasokonstriktion (mit Ausnahme der Koronararterien) den Blutdruck. Außerdem kommt es zu einer Steigerung der Konzentrationsfähigkeit und Wachheit. Die Motorik und die Motivation werden positiv beeinflusst. Langfristig hemmt Noradrenalin das Immunsystem. Ein Mangel an Noradrenalin führt zu deutlichen Konzentrations- und Gedächtnisstörungen. Die Rolle bei Depressionen ist derzeit noch Gegenstand laufender Forschungen. Dopamin: Dopamin verengt die (nicht lebensnotwendigen) Gefäße in der Muskulatur und der Haut. Gleichzeitig erweitert es die Gefäße in der Niere, so dass deren Durchblutung gesteigert wird. Außerdem wirkt es positiv inotrop und chronotrop. Unter anderem beeinflusst Dopamin die extrapyramidale Motorik - hier besteht ein Zusammenhang mit der Parkinsonschen Erkrankung. Ebenso steht der Dopaminhaushalt im Zusammenhang mit den neurobiologischen Aspekten von Psychosen und verschiedenen Störungen, allerdings auch mit der Stimulation von Glücksgefühlen. Auch in die Regulation des Hormonhaushaltes greifen dopaminerge Systeme ein. So hemmt Dopamin aus Neuronen, die um das 3. Hirnventrikels gruppiert sind, die Ausschüttung des Hormones Prolaktin. Glutamin, Glutaminsäure, Glutamat Glutamin ist die am häufigsten im Organismus vorkommende Aminosäure. Sie stellt das Gamma-Amid der Aminosäure Glutaminsäure dar. Die Salze der Glutaminsäure heißen Glutamate. die als Neurotransmitter im zentralen Nervensystem vorkommen. An den Präsynapsen wird ein Teil des Glutamats nach der Ausschüttung in den synaptischen Spalt in benachbarte Gliazellen aufgenommen. Um das resorbierte Glutamat zurück in die präsynaptischen Neuronen zu transportieren, wird es in den Gliazellen in Glutamin umgewandelt. In den Neuronen wird Glutamin dann wieder in Glutamat umgewandelt. LGlutamat ist der wichtigste Neurotransmitter. Im Zentralnervensystem kann Glutamat durch das Enzym L-Glutaminsäuredecarboxylase zu γ-Aminobuttersäure (GABA) decarboxyliert werden, die als Neurotransmitter an inhibitorischen Synapsen eingesetzt wird. Glutamat ist wichtig für die Bewegungssteuerung, das Gedächtnis und das 7 Wahrnehmungsvermögen. Der Neurotransmitter ist an der Entstehung epileptischer Anfälle beteiligt. Ob eine gestörte Freisetzung und Aufnahme von Glutamat ursächlich oder nur ein „Symptom“ bei Alzheimerpatienten ist, wird derzeit noch erforscht. GABA: Gamma-Aminobuttersäure (GABA) ist der primäre inhibitorische Neurotransmitter im Gehirn. Dockt er an den Rezeptor an, so setzt er die Erregbarkeit der Nervenzellen herab. Somit ist GABA gewissermaßen der Gegenspieler von Glutamat. Serotonin: Serotonin (5-HT) entsteht aus der essentiellen Aminosäure L-Tryptophan durch Hydroxylierung und anschließende Decarboxylierung. Neuronales Serotonin kommt vor allem im Hypothalamus, in den Raphekernen, im Mittelhirn sowie im Gastrointestinaltrakt vor. Die Wirkung ist die eines Neurotransmitters. Extraneuronales Serotonin kommt in 8 Thrombozyten und enterochromaffinen Zellen vor. Unabhängig vom Vorkommen hat Serotonin zahlreiche Wirkungen: System Effekt Anmerkung Herz Positiv inotrop Positiv/Negativ chronotrop Blutdruck Senkung Erhöhung Senkung Sofortwirkung (kurz) Vasokonstriktion (nach 1 min) Vasodilatation (Spätwirkung) Blutgefäße der Skelettmuskulatur Venen Haut Niere Dilatation Konstriktion Dilatation/Konstriktion Konstriktion Magen Motilitätshemmung Dünndarm Motilitätszunahme Spastische Kontraktion Dickdarm Motilitätshemmung Thrombozyten Aggregation Bronchien Konstriktion Psyche Stimmungsaufhellung Niedrige Dosis Hohe Dosis Nur bei Asthmatikern Taurin: Taurin ist eine Aminosulfonsäure, die unter Vitamin B6-Beteiligung aus Cystein bzw. Methionin gebildet wird. Taurin ist wichtig für die Bildung von Gallensäurenkonjungaten, ein einwandfreies Funktionieren des Immunsystems und die Membranbindung von Calcium. Im Zentralen Nervensystem unterstützt Taurin zusammen mit GABA und der Aminosäure Glycin eine dämpfende Wirkung. Taurin gilt daher als angstlösend und beruhigend. Immunologischer Weg Zytokine werden während der natürlichen, spezifischen Immunreaktion freigesetzt. Diese Peptide regulieren vor allem das Wachstum und die Proliferation von Zielzellen. Die Hauptgruppen der Zytokine sind Interferone, Interleukine, Chemokine, Tumornekrose9 Faktoren und Kolonie-stimulierende Faktoren. Zytokine sind an der Schmerzauslösung, Depressionen, Gedächtnisstörungen und Müdigkeit beteiligt. 5. Neuroendokrine Gesundheitsstörungen Eine nicht unerhebliche Anzahl von vollkommen verschiedenen Krankheiten gehen mit einer Störung neuroendokriner Funktionen und deren Abläufe einher. Derartige Störungen können eine Dysbalance der Neurotransmitter, eine beeinträchtigte Synthese einzelner Katecholamine oder eine reduzierte Immunfunktion sein (Häufigkeit in %): ADHS 10-15 % CFS 1-3 % Fatigue 10-20 % FMS/Fibromyalgie 3-5 % Migräne 6-8 % Übergewicht/Adipositas 30-50 % Kohlenhydrate-Heißhunger 5-10 % Appetitstörungen 20-30 % Depressionen 15-20 % Burnout-Syndrom 5-10 % Schlafstörungen > 10 % Angstsyndrome 10-30 % Reizdarm 10-15 % Prämenstruelles Syndrom 10-20 % Multiple Chem. Sensitivität <5% Tinnitus 10-15 % Schizophrenie 1-2 % Morbus Parkinson 5-10 % Restless Leg Syndrom 10-15 % Autismus 1-2 % Nahrungsmittelunverträglichkeit 10-20 % Chronischer Stress Cortisol, das vorwiegend nachts produziert wird, ist am Morgen entsprechend hoch. Sein ausgeprägter Tagesrhythmus mit raschem Abfall der Konzentration bis zum Abend ist zwar noch intakt, jedoch zu einem höheren Konzentrationsniveau verschoben, so dass ein Hypercortisolismus besteht. Chronischer stress kann zu sehr unterschiedlichen Phänomenen führen, wobei genetische Faktoren eine große Rolle spielen. Viele Menschen halten auch anhaltenden stress ohne nennenswerte gesundheitliche Störungen aus, bei ihnen ist die neuroendokrine Regulation intakt. Bei anderen entwickelt sich jedoch eine zunehmende Resistenz gegenüber der „Dauerstimulation“ durch Neurohormone, es kommt zur Blockade der Stressreaktion mit einem Absinken des Cortisolspiegels und Aufhebung des physiologischen Tagesrhythmus. Dies sind quasi die „Rahmenbedingungen“ eines Burnouts. Der andauernde Cortisolüberschuss hat deutliche Folgen für die Gehirnfunktion. Cortisol hemmt die Neurotransmitterfunktion, beschleunigt den Verlust von Gehirnzellen und hemmt die Neurogenese. Andauernder Cortisolüberschuss wirkt neurotoxisch. Die Menge an Noradrenalin steigt zunächst stark an, das in der Nebenniere gebildete 10 Adrenalin fällt stark ab. Bei weiterem Stress wird das sympathische Nervensystem immer mehr eingeschränkt, schließlich kann auch Dopamin defizitär werden. Serotonin sinkt bei Stressbelastung ebenfalls sehr stark ab, so dass sich ein Serotoninmangel entwickeln kann, dessen klinische Auswirkungen mannigfaltig sein können (siehe Liste). Empfohlene Dosierungen: Mikronährstoff Vitamin B Vitamin C Vitamin B12 Pantothensäure Magnesium Zink Coenzym Q10 Griffonia-Extrakt (mit 5-HTP) L-Tyrosin L-Carnitin Traubenkernextrakt Theanin Omega 3-Fettsäuren Phosphatidylserin Kreatin Empfohlene Tagesdosis 20-100 mg 1-3 g 200-1000 µg 500-2000 mg 200-1000 mg 15-30 mg 100-250 mg 25-150 mg 500-2000 mg 1-2 g 50-150 mg 200-400 mg 1-3 g 100-300 mg 1-1,5 g Burnout Das Burn-out-Syndrom stellt die Form der chronischen Stressreaktion dar, bei der es zur weitgehenden Blockade der HPT-HVLNNR-Achse mit Hypocortisolismus kommt. Voraussetzung für diesen fatalen Verlauf der Stressreaktion sind offensichtlich genetisch disponierende Besonderheiten, die den Turnover der neuroendokrinen Signalsysteme betreffen. Zwei Faktoren sind charakteristisch für das Burn-out Syndrom: (1) Der Zusammenbruch der neuroendokrinen Regelkreise und (2) die überdurchschnittlich starken Entzündungsreaktionen. 11 Der normale 24 h-Rhythmus der Stresshormonproduktion versagt. Der nächtliche Anstieg der Cortisolproduktion bleibt aus, da die Hypophyse CRH-refraktär wird und nicht mehr auf zentrale CRH-Signale reagiert. Vor allem morgens besteht ein ausgeprägter Cortisolmangel, es kann allerdings im Lauf des Tages auch zu atypischen Cortisolsteigerungen kommen. Serotonin fällt infolge Synthesehemmung und Verbrauchssteigerung stark ab und damit auch das aus Serotonin gebildete Melatonin, das nicht nur für den Schlaf-Wach-Rhythmus, sondern auch für die Steuerung der hormonellen Zyklen wichtig ist. Auch andere Neurotransmitter wie Noradrenalin, Adrenalin und Dopamin sind mehr oder weniger stark vermindert. Für das Ausmaß der Entzündungsreaktionen sind individuell disponierende Faktoren mitbestimmend. Auch Gesunde reagieren auf Stress mit einer Entzündungsreaktion, die jedoch nur kurz andauert. Die proentzündlichen Zytokine wie Interleukin 6, Interleukin 1s, TNF-alpha steigen an und werden rasch wieder auf Normalniveau gesenkt, ohne dass es zu gesundheitlichen Folgen für die Betroffenen kommt. Genetisch disponierte Personen entwickeln dagegen eine anhaltende, erheblich stärker ausgeprägte Entzündungsreaktion, die die Burn-out-Reaktion ins Krankhafte lenkt. Zusammen können die neuroendokrinen und entzündlichen Veränderungen beim Burn-out ein vielfaltiges Spektrum von Beschwerden bewirken: Schlafstörungen mit Einschlafstörung und verkürzten Schlafphasen, wiederholte depressive Episoden, Motivationsverlust, Antriebsschwache, Ängste, Panikattacken, hochgradige Erschöpfung bzw. Leistungsabfall (Fatigue), Appetitstörungen, Missempfindungen (Fibromyalgie, Migräne), Gedächtnisstörungen, Wortfindungs- und Koordinationsstörungen. Empfohlene Dosierungen: Mikronährstoff S-Adenosylmethionin (SAMe) Vitamin B1 Niacin Empfohlene Tagesdosis 500-1500 mg 50-100 mg 100-500 mg 12 Pantothensäure Vitamin B12 Folsäure Magnesium Zink Selen L-Tyrosin L-Carnitin Traubenkernextrakt Griffonia-Extrakt Theanin Omega 3-Fettsäuren Phosphatidylserin Kreatin L-Arginin L-Glutamin L-Tyrosin 300-2000 mg 1000 µg 400-1500 µg 200-1000 mg 15-30 mg 100-300 µg 500-2000 mg 1-3 g 50-150 mg 25-150 mg 200-400 mg 1-3 g 100-300 mg 1-1,5 g 1000-2000 mg 1000-4000 mg 1000-2000 mg CFS/Chronisches Müdigkeitssyndrom Die idiopathische Form der Fatigue ist das chronische Müdigkeits- bzw. Erschöpfungssyndrom (CFS). Das beim CFS nahezu durchgehend vorhandene Kriterium ist die Störung der neuroendokrinen Funktionsachse mit Hypocortisolismus. Der morgendliche Cortisolspiegel (Speichelcortisol) ist erniedrigt, die Tagesrhythmik der Cortisolsekretion ist mehr oder weniger stark gestört. ACTH ist ebenfalls niedrig, sodass von einer Störung oberhalb der HVL-NNR-Achse auszugehen ist. Die hypothalamische CRH-Sekretion ist infolge anhaltender psychischer, physischer oder toxischer Belastung dauerhaft gesteigert, die CRHabhängigen Organe, Hypophyse und Nebennierenrinde sind möglicherweise durch RezeptorDownregulation und Desensibilisierung refraktär geworden. Individuell disponierende, genetische, Faktoren sind mit ausschlaggebend für die Entwicklung der zentralen Fatigue. Beim CFS wurde in Zwillingsuntersuchungen eine Konkordanz von > 50% gefunden. Auch die Neurotransmitterbalance ist gestört, vor allem Serotonin und Noradrenalin sind erniedrigt. Bei einem Teil der CFS-Falle spielen offensichtlich auch protrahierte, reaktivierte Infektionen, toxisch-inflammatorische Zustände oder schwerwiegende oxidative/nitrosative Schäden mit Hemmung der Mitochondrienfunktion und zentraler Enzymsysteme eine dominante Rolle. Empfohlene Dosierungen: Mikronährstoff S-Adenosylmethionin (SAMe) Griffonia-Extrakt Vitamin B1 Niacin Pantothensäure Vitamin B12 Folsäure Vitamin C Empfohlene Tagesdosis 500-1500 mg 100-400 mg 50-100 mg 50-300 mg 500-1000 mg 1000 µg 400-1500 µg 1-3 g 13 Magnesium Calcium Zink Selen L-Carnitin Traubenkernextrakt Ginkgo-Extrakt Omega 3-Fettsäuren Phosphatidylserin Coenzym Q10 200-1000 mg 500-1500 mg 10-25 mg 100-300 µg 1-3 g 50-150 mg 100-250 mg 1-3 g 100-300 mg 100-300 mg Depression Eine andere, schwerwiegendere Form der Reaktion auf außergewöhnliche Belastungen ist die Depression. Definitionsgemäß ist die Depression eine psychische Störung, die durch gedrückte Stimmung, Ängste, gehemmten Antrieb, Interesselosigkeit und Gefühlsarmut, ein gestörtes Selbstwertgefühl, Hoffnungslosigkeit, Unruhe und Konzentrationsstörungen gekennzeichnet ist. Oft bestehen gleichzeitig körperliche Symptome wie Appetitlosigkeit, Schlafstörungen, Tagesmüdigkeit, Gewichtsab- oder auch -zunahme, diffuse Schmerzen, ev. auch gesteigerte Infektanfälligkeit. Fast alles Symptome, die uns schon beim Burn-out- Syndrom begegneten. Im Unterschied zum Burn-out-Syndrom, bei dem die HVL-NNR-Achse inaktiviert ist, ist dauerhafte Aktivierung der HPT-HVLNNR-Achse das wesentliche biochemische Kriterium der primären Depression. Während beim Burn-out-Syndrom die andauernde hypothalamische CRH-Ausschüttung zur Desensibilisierung und schließlich zur Blockade der HVL-NNR-Achse führt, bleibt bei der primären Depression trotz Dauerstimulation die HVL-NNR-Aktivität hoch, wofür die genetischen Besonderheiten der Depression verantwortlich sind. Die meisten der jährlich ca. 12.000 Selbstmorde in Deutschland werden auf Depressionen zurückgeführt. Frauen erkranken doppelt so häufig wie Männer. Zwillingsuntersuchungen haben gezeigt, dass das genetische Risiko der primären Depression bei 50 % liegt. Auch wenn das familiäre Risiko hoch ist, sprechen doch die anderen 50 % dafür, dass erworbene Risiken der Lebensweise und Umweltfaktoren eine ebenfalls erhebliche Rolle spielen. Früher wurde die familiäre Form der Depression als Melancholie bezeichnet, heute als endogene oder primäre bzw. auch „Major”-Depression. Sie tritt ohne erkennbaren Anlass auf, sie überfallt die Betroffenen aus „heiterem Himmel“ und verläuft typischerweise in Phasen, die Tage oder auch Monate bis Jahre andauern können. Heute unterscheidet man verschiedene Formen der Depression, die bei einmaligem Auftreten als depressive Episode und bei häufigerem Auftreten als wiederkehrende depressive Störung bezeichnet werden: • Leichte, mittelgradige oder schwere depressive Episoden • Schwere depressive Episode mit psychotischen Symptomen • Manische Depression oder bipolare Psychose • Sonstige depressive Episoden, z.B. die prämenstruelle Depression • Wochenbett-Depression • Winter- oder Frühjahrsdepression Pathophysiologie der Depression Bis in die siebziger Jahre wurde der endogenen, primären die reaktive oder sekundäre Depression gegenübergestellt, die sich als Folge einschneidender traumatischer Erlebnisse entwickeln kann. 14 Sekundäre Formen der Depression finden sich z.B. bei Schilddrüsenerkrankungen, bei Sexualhormonmangel oder bei Einnahme bestimmter Medikamente wie Betablocker oder Immuntherapeutika (Interferonbehandlung bei multipler Sklerose, Hepatitis oder Krebs). Auch Umweltgifte stehen im Verdacht, depressive Reaktionen auslösen zu können. Heute findet sich die reaktive Depression am ehesten im neu geprägten Begriff der StressDepression wieder. Die genetischen Risiken der Depression sind Gegenstand intensiver Untersuchungen. Zu den heute bekannten Risiken zahlen genetische Unterschiede in der Cortisol-Produktionsrate, Polymor auf Ebene des Cortisolrezeptors, Defekte von Enzymen der Neurotransmittersynthese (z.B. Tph = Tryptophanhydroxylase), Varianten der synaptischen Reuptake-Proteine (z.B. 5-HTT = Serotonin-Transporter), der NT-abbauenden Enzyme wie der MAO (Monoaminoxidase) bzw. COMT (Catechol-O-Methyltransferase) oder der postsynaptischen Neurotransmitter-Rezeptoren. Als erworbene Risiken werden traumatische Erlebnisse in der Kindheit, psychische „Verletzungen“ wie Verlust der Mutter, sexueller Missbrauch, Schockerlebnisse oder auch übermäßiger Stress gesehen. Sie können zu „Narben“, morphologisch nachweisbaren Veränderungen der neuronalen Schaltung, zum Untergang von Nervenzellen und vor allem auch zur Hemmung der neuronalen Regeneration und Neubildung von Nerven führen. Die Hemmung der Neurogenese, der Neubildung voll funktionsfähiger Nervenzellen und Anpassung der Hirnleistung an aktuelle Anforderungen gilt heutzutage als eines der wesentlichen erworbenen Merkmale der Depression. Man spricht von veränderter „Plastizität“ des Gehirns. Die bleibenden strukturellen Veränderungen des Gehirns nach traumatischen Schockerlebnissen in der Kindheit, wenn die Plastizität und Formbarkeit des Gehirns noch verhältnismäßig groß sind, schaffen die Voraussetzungen für das spätere Auftreten der Depression, wenn erneut traumatische Ereignisse eintreten. Außer der HPT-HVL-NNR-Achse sind bei der primären Depression meist auch die exzitatorischen Neurotransmittersysteme (Noradrenalin, Dopamin, Glutamat) aktiviert. Serotoninmangel ist ein durchgehendes Phänomen der Depression. Auch entzündliche Mechanismen sind involviert: die proentzündlichen Zytokine TNFalpha, IL-1s oder IL-6 sind erhöht. Sie verstärken die Aktivität der HPT-HVL-Achse und potenzieren die Hemmung der Serotoninsynthese durch Entzug von Tryptophan und Hemmung der Serotoninsynthese. Durch diese zentralen Effekte tragen sie zur Manifestation der Depression bei. Charakteristisch sind das gehäufte Vorkommen schwerer Depressionen bei der Zytokintherapie chronischer Erkrankungen (Hepatitis, CMS, Tumoren) und das Auftreten depressiver Episoden bei chronischen Entzündungen. Antidepressiva Als Folge übermäßiger Stressbelastung kommt es bei der primären Depression zur Daueraktivierung des Hypothalamus mit gesteigerter CRH Sekretion und permanentem Hypercortisolismus. Inzwischen gibt es Hinweise, dass möglicherweise CRH selbst im Überschuss Depressionen auslösen kann und eher als Cortisol zum Ziel antidepressiver Therapeutika werden konnte. Viele moderne Antidepressiva sind allerdings nicht gegen die CRH-Cortisol-Achse gerichtet, sondern wirken vorrangig auf die Neurotransmitterregulation. Die meisten sind sog. Serotonin-Wiederaufnahme-Hemmer (SSRI = Spezifische Serotonin Reuptake-Inhibitoren), die die Verfügbarkeit des eminent wichtigen Neurotransmitters Serotonin verbessern. Serotoninmangel ist eine weit verbreitete Ursache von Depressionen, oft allerdings verstärkt durch Noradrenalin- und/oder Dopaminmangel. 15 Die neuesten Antidepressiva sind kombinierte Serotonin-Noradrenalin-Reuptake-Hemmer (SNRI‘s), daneben gibt es auch reine Noradrenalin-Reuptake-Hemmer (NRI‘s) oder DopaminReuptake-Inhibitoren (DRI ‘s). Neurotransmitterfunktion Neurotransmitter (NT) werden in den Nervenzellen gebildet und am Nervenende, den sog. Synapsen, gespeichert. Kommt es zum Nervenimpuls werden die gespeicherten Neurotransmitter ausgeschüttet und übertragen das Nervensignal auf das Erfolgsorgan durch Bindung an dessen postsynaptische Rezeptoren. Überschüssige NT werden umgehend abgebaut, diffundieren in die Blutbahn oder werden über einen Spareffekt für erneute Impulse gespeichert. Die Ruckspeicherung erfolgt über einen spezifischen Transportmechanismus in der synaptischen Membran, ein Transportprotein oder „ReuptakeCarrier“. Antidepressiva vom Reuptake-Inhibitortyp blockieren spezifisch diesen Wiederaufnahmemechanismus und erhöhen auf diesem Wege die Konzentration an Neurotransmittern am Wirkort. Die längere Präsenz des Neurotransmitters im synaptischen Spalt mit gesteigerter Diffusion und erhöhtem NT-Abbau sowie die Unterdrückung des Reuptake- Spareffektes haben allerdings zur Folge, dass der NT-Verbrauch ansteigt und ein schon bestehender Mangel tendenziell verstärkt wird. Empfohlene Dosierungen: Mikronährstoff S-Adenosylmethionin (SAMe) Griffonia-Extrakt Vitamin B1 Niacin Pantothensäure Vitamin B12 Folsäure Vitamin C Vitamin D Magnesium Zink Selen Kupfer Johanniskraut-Extrakt Omega 3-Fettsäuren Phosphatidylserin Empfohlene Tagesdosis 500-1500 mg 100-300 mg 50-100 mg 50-300 mg 500-1000 mg 500-2000 µg 1000-3000 µg 1-3 g 2000-4000 I.E. 200-1000 mg 10-30 mg 100-300 µg 1-3 mg 600-1000 mg 1,5-4 g 100-300 mg Zusammenfassend eine Übersicht der neuroendokrinen und entzündlichen Veränderungen bei Depressionen, Burnout und Chronischem Müdigkeits-Syndrom (CFS): 16 Multiple Chemische Sensitivität (MCS) Auch das MCS ist durch einen allerdings in der Regel latenten Hypocortisolismus gekennzeichnet. Die Ruhekonzentrationen von Cortisol und ACTH sind meist unauffällig, unter Belastung kommt es jedoch statt zum Anstieg zum paradoxen Abfall der Stresshormone, sodass auch hier von einer erheblichen Störung der HPT-HVL-NNR-Achse ausgegangen werden muss. Häufig ist auch beim MCS Serotonin vermindert und der Noradrenalin:Adrenalin-Quotient zu Noradrenalin hin verschoben. Empfohlene Dosierungen: Mikronährstoff Glutathion Griffonia-Extrakt Vitamin B1 Folsäure Vitamin C Chrom Magnesium Zink Selen L-Glutamin L-Glycin Cholin Taurin Theanin Resveratrol Coenzym Q10 Empfohlene Tagesdosis 200-500 mg 100-300 mg 10-30 mg 1000-3000 µg 500-2000 mg 40-120 µg 200-1000 mg 10-30 mg 100-300 µg 150-500 mg 100-500 mg 100-300 mg 100-200 mg 200-400 mg 100-300 mg 50-200 mg Fibromyalgie CFS und MCS werden heute als Varianten einer umfassenderen Gesundheitsstörung, des C M I (Chronic Multisystem Illnesses) gesehen, zu dem auch die Fibromyalgie (FMS) gerechnet wird. Über 40 % der FMS-Patienten sind auch von Fatigue betroffen, viele CFS-Patienten leiden auch unter erhöhter Unverträglichkeit gegenüber Umweltstoffen (MCS) oder anderen Umwelteinflüssen (ESM: Elektrosmog). Allen drei Manifestationsformen sind starke Schlafstörungen gemeinsam. Bei FMS findet sich wie beim CFS und bei MCS häufig eine gestörte Cortisol-Chronizität und inadäquate HPT-NNR-Aktivierung unter Belastung. Bei der Mehrheit der Patienten besteht ein ausgeprägter Serotoninmangel. Die Schmerzsymptomatik ist meist nicht gesteigerter Aktivität proentzündlicher Zytokine zuzuschreiben, sondern weitgehend auf neuroinflammatorische Mediatoren wie Substanz P, Neurokinine und die gestörte Neurotransmitterbalance zurückzuführen. Besonders verbreitet und ausgeprägt ist der Serotonin- bzw. Melatoninmangel, die meist auch Konsequenzen für andere Exponenten der HPT-HVL-Achse wie Prolactin und Wachstumshormon haben. Das posttraumatische Stressyndrom (PTSD: „Post traumatic Stress Disorder“) ist ebenfalls durch gravierende Störungen der HPT-HVL-NNR-Achse gekennzeichnet, die sich allerdings nicht als Hypo- sondern als Daueraktivierung von CRH-ACTH-Cortisol und Steigerung der 17 exzitatorischen Neurotransmission manifestieren. Auch die inflammatorische Aktivität ist erhöht. Damit rückt das PTSD biochemisch nahe an die primäre Depression. Empfohlene Dosierungen: Mikronährstoff Omega 3-Fettsäuren Griffonia-Extrakt Vitamin B1 Folsäure Vitamin B12 Vitamin C Vitamin D Vitamin E Chrom Magnesium Zink Selen Calcium L-Carnitin Cholin SAMe Coenzym Q10 Empfohlene Tagesdosis 1-3 g 100-300 mg 20-100 mg 400-1000 µg 50-500 µg 500-2000 mg 1000-3000 I.E. 12-50 mg 50-200 µg 300-1000 mg 15-30 mg 100-300 µg 600-1200 mg 1-3 g 100-300 mg 400-1000 mg 50-200 mg Fatigue Eines der wichtigsten und am meisten verbreiteten Leitsymptome der ins Pathologische übergehenden Stressreaktion ist die zentrale Erschöpfung (Central Fatigue), die von der peripheren Form (Peripheral Fatigue) mit muskulärer Erschöpfbarkeit zu unterscheiden ist. Erschöpfbarkeit ist am ehesten zu definieren als die erheblich eingeschränkte Fähigkeit, willentliche Aktionen aufzunehmen oder über längere Zeit durchzuhalten. Zentrale Erschöpfbarkeit betrifft sowohl die körperliche als auch die mentale und emotionale Leistungsfähigkeit. Die Erschöpfungsreaktion entsteht auf komplexer Grundlage. Sie ist einerseits mit den Zytokin-basierten Entzündungsreaktionen assoziiert, da proentzündliche Zytokine wie IL-1s, TNF-alpha oder IL-6 unmittelbar entsprechende neurologische Komplikationen auslösen können. Andererseits mit der unter andauernder Belastung entstehenden neuroendokrinen Dysbalance. Die entzündliche Aktivität kann außer durch pathologischen Stress auch durch Infektionen, Autoimmunerkrankungen oder toxische Einflüsse (Medikamente, Fremdstoffe, Strahlung usw.) zustande kommen. Zentrale Erschöpfbarkeit findet sich symptomatisch bei verschiedensten neurologischen Erkrankungen, u.a. bei MS, myotoner Dystrophie, M. Parkinson, Guillan-Barre-Syndrom, nach Enzephalitiden (Neuroborreliose, Q-Fieber, Poliomyelitis), bei zerebralen Vaskulitiden oder Motoneuron-Erkrankungen; als postvirale Müdigkeit (Herpesvirusgruppe), bei reaktivierten Infektionen, bei Lupus, rheumatoider Arthritis oder bei Tumorerkrankungen unter/nach Behandlung sowie bei therapeutischer Anwendung von Zytokinen (MS, Hepatitis, Tumoren). 18 Empfohlene Dosierungen: Mikronährstoff L-Glutamin L-Tyrosin Vitamin B3 Pantothensäure Vitamin B6 Folsäure Vitamin B12 Vitamin C Grüntee Rhodolia rosea Mucuna pruriens Magnesium Zink Selen Coenzym Q10 Empfohlene Tagesdosis 100-300 mg 100-300 mg 10-30 mg 100-200 mg 3-10 mg 400-1000 µg 50-500 µg 300-1000 mg 50-150 mg 15-50 mg 100-300 mg 300-1000 mg 15-30 mg 100-200 µg 50-200 mg Reizdarm Funktionelle Magen-Darm-Erkrankungen wie das Reizdarmsyndrom, die funktionelle Dyspepsie oder funktionelle viszerale Schmerzen haben heute eine Prävalenz von bis zu 20% in den westlichen Ländern. Viszerale Hypersensitivität und abnorme zentrale Perzeption viszeraler Signale gelten als Schlüsselelemente der Pathophysiologie. Eine mitentscheidende Rolle spielt das viszerale neuroendokrine System, zuvorderst Serotonin als Neurotransmitter. Die enterochromaffinen Zellen des Gastro-Intestinal-Traktes enthalten ca. 95% des gesamten Körperserotonins. Nach vagaler Aktivierung sezernieren enterale Neurone Serotonin, das zur Kontraktion der glatten Muskulatur, aber auch zur Relaxation im Zusammenspiel mit NO-Neuronen führt. Die Sekretion wird gesteigert, die Peristaltik vermehrt, wobei verschiedene Serotoninrezeptoren, insbesondere 5HT1 bis 5HT5, involviert sind. Klinisch können neben den häufigen Schmerzen sowohl Diarrhoe als auch Obstipation dominieren. Neben Serotoninrezeptor-Agonisten und -Antagonisten werden vor allem SSRI eingesetzt. Empfohlene Dosierungen: Mikronährstoff N-acetyl-cystein L-Tyrosin L-Theanin L-Glutamin L-Lysin L-Arginin L-Methionin Griffonia-Extrakt Bromelain Empfohlene Tagesdosis 100-300 mg 100-300 mg 100-300mg 300-1000 mg 200-500 mg 150-500 mg 100-200 mg 100-200 mg 200-600 mg 19 Papain Boswelliasäuren Vitamin B6 Folsäure Vitamin B12 Vitamin C Magnesium Zink Selen Coenzym Q10 200-600 mg 300-1500 mg 4-12 mg 400-1000 µg 20-100 µg 500-1500 mg 200-600 mg 10-20 mg 100-200 µg 50-200 mg Prämenstruelles Syndrom Viele Frauen leiden unter zum Teil erheblichen zyklusabhängigen Beschwerden bzw. Beschwerden im Rahmen der Menopause: Hitzewallungen, Schmerzen, Unruhe, Schlafstörungen, Depressionen, Antriebsschwäche, Essstörungen. Neben den hormonellen Ursachen wie Abfall von Östrogenen, Progesteronmangel, Ungleichgewicht androgener und östrogener Hormonmengen sind auch neuroregulatorische Defizite mitverantwortlich. Serotoninmangel, kombiniert mit Noradrenalin- und ev. Dopaminmangel auf der einen Seite, Defizite inhibitorischer Neurotransmitter wie GABA auf der anderen Seite sind in unterschiedlichem Maße beteiligt. Behandlung mit Serotonin- bzw. Noradrenalinagonisten (Clonidin), SSRI, SNRI oder auch GABAergegen Substanzen (Gabapentin) sind u.U. erfolgreicher als der Versuch, hormonelle Defizite auszugleichen. Empfohlene Dosierungen: Mikronährstoff L-Tryptophan Griffonia-Extrakt Vitamin B3 Vitamin B6 Folsäure Vitamin C Vitamin D Vitamin E Omega 3-Fettsäuren Magnesium Calcium Zink Selen Mangan Chrom Coenzym Q10 Gamma-Linolensäure Empfohlene Tagesdosis 1000-3000 mg 100-300 mg 10-30 mg 100-300 mg 400-1000 µg 300-1000 mg 1000-2000 I.E. 12-36 mg 1-3 g 300-800 mg 600-1800 mg 15-30 mg 100-200 µg 4-20 mg 200-500 µg 50-200 mg 50-100 mg 20 Migräne Migräne ist eine Erkrankung mit familiärer Häufung, die bis zu 18 % der Frauen und 6 % der Männer, vorwiegend im Alter zwischen 30 und 50 Jahren, trifft. Störungen des serotoninergen Systems sind ursächlich. Kopfschmerz kommt durch Aktivierung des Trigeminussystems zustande, wobei neuroinflammatorische Peptide wie Substanz P, CGRP (Calcitonin-Gene-Related Peptide) oder Neurokinine freigesetzt werden. Repetitive neurogene Inflammation steigert die Erregbarkeit sensorischer Neurone und die Kopfschmerzbereitschaft. Serotonin hemmt die Schmerzentwicklung über spezifische 5-HT-Rezeptoren auf den Trigeminusfasern. Bei Migräne liegen genetische Veränderungen der 5HT-Rezptoren vor. Außerdem finden sich Hinweise für eine immunallergische Komponente. Im akuten Anfall steigt Interleukin 10 an wahrend IL-4 und IL-5 auch in den Zwischenperioden erhöht sind. Inflammatorische Mediatoren sind nicht beteiligt, sodass immunologisch ein klares TH2Aktivitätsmuster dominiert. Auffallend oft ist Migräne mit Nahrungsmittelallergien bzw. -unverträglichkeiten assoziiert. Die Substitution mit den Aminosäurevorstufen 5-HTP und Tyrosin bzw. mit SNRI ist eine effiziente, spezifische Behandlungsoption. Empfohlene Dosierungen: Mikronährstoff Magnesium Selen Vitamin B2 Niacin Vitamin B6 Vitamin B12 Vitamin C Griffonia-Extrakt Omega 3-Fettsäuren Coenzym Q10 Coenzym 1 Taurin N-acetyl-cystein Oligomere Proanthocyanidine (OPC) Chrom Empfohlene Tagesdosis 300-900 mg 100-300 µg 10-100 mg 50-100 mg 20-60 mg 50-500 µg 2-5 g 50-200 mg 1-3 g 100-300 mg 40-100 mg 40-120 mg 300-900 mg 100-300 mg 100-200 µg Adipositas/Übergewicht Neben den Hormonen Leptin, Insulin, HGH und den Schilddrüsen-sowie Sexualhormonen sind die Glukokortikoide, CRH, Noradrenalin und vor allem Serotonin und in die Appetitkontrolle und den Energiestoffwechsel involviert. Die Cortisolsekretion ist bei Übergewichtigen erhöht, bei zentraler (viszeraler) Adipositas stärker als bei peripherer Adipositas. Serotonin und Noradrenalin sind absolut oder relativ erniedrigt. 1015 % der Adipösen profitieren von alleiniger Behandlung mit Serotoninvorstufen (5Hydroxytryptrophan) bzw. selektiven SSRI, da Serotonin herausragende Bedeutung für die Appetitregulation und begrenzt auch für den Energiestoffwechsel hat. 21 Besonders bei Kohlenhydrathunger („Craving“) sind serotoninerge Strategien sehr wirksam. Reine Sympathikomimetika wie z.B. Recatol (Phenylpropanolamin) sind in ihrer Wirksamkeit begrenzt. Sehr effizient ist die kombinierte Serotonin- und Noradrenalinrestitution mit den betreffenden Aminosäurevorstufen (5-HTP, Tyrosin) bzw. mit SNRI, kombinierten Reuptake-Inhibitoren wie Reductil (Sibutramin). Empfohlene Dosierungen: Mikronährstoff Bromelain Papain Vitamin B6 Vitamin B12 Vitamin C Acetyl-L-carnitin Griffonia-Extrakt Omega 3-Fettsäuren Coenzym Q10 L-Theanin L-Tyrosin N-acetyl-cystein Oligomere Proanthocyanidine (OPC) Chrom Selen Empfohlene Tagesdosis 50-150 mg 50-150 mg 10-20 mg 10-100 µg 50-200 mg 500-1500 mg 50-200 mg 1-3 g 100-300 mg 50-200 mg 600-1800 mg 300-900 mg 100-300 mg 40-120 µg 100-200 µg ADHS Das ADS (Aufmerksamkeits-Defizitsyndrom) ist per Definitionem eine neurobiologische Störung, die durch erhebliche Beeinträchtigung der Konzentration und Daueraufmerksamkeit, mangelhafte Impulskontrolle und eingeschränkte emotionale Regulation gekennzeichnet ist. Bei zusätzlicher motorischer Hyperaktivität bzw. Unruhe spricht man vom ADHS (ADS mit Hyperaktivität, „Struwwelpeter-Syndrom“). Folgen sind bei Kindern und Heranwachsenden Fehlverhalten in der Schule, Leistungsschwäche, Lernstörungen, ev. später auch Suchterkrankungen, Depressionen, Angststörungen. AD(H)S ist eine obligat im Kindesalter beginnende Verhaltens- und Lernstörung, die jedoch in 30 – 50 % der Fälle auch im Erwachsenenalter fortbesteht. Während die hyperkinetische Symptomatik oft verschwindet, halten die Aufmerksamkeitsprobleme, die emotionalen Störungen (Unruhe, Stimmungsschwankungen, Hypersensibilität usw.) und die Impulsivität an. Als Ursache des AD(H)S wird heute eine angeborene neurogene Stoffwechselstörung angesehen, die zur Dysregulation von Neurotransmittersystemen wie Dopamin und Noradrenalin führt und die geordnete Informationsverarbeitung im Gehirn behindert. Vor allem die dopaminerge Signaltransduktion ist betroffen. Psychostimulanzien wie das Dopamin-agonistisch wirkende Ritalin (Methylphenidat), Amphetaminsaft oder Captagon (Fenetyllin) können die neuronale Aktivität normalisieren. Ritalin wirkt in ca. 70 % der Fälle, gelegentliche ernstzunehmende Nebenwirkungen sind jedoch zu berücksichtigen. 22 Bei Erwachsenen werden eher tricyclische Antidepressiva (Nortriptylin, Desipramin, Imipramin), Noradrenalin-Wiederaufnahmehemmer wie Strattera (Atomoxetin) und Edronax (Reboxetin) oder auch das Antidepressivum Venlafaxin eingesetzt. Neben der zweifellos vorhandenen genetischen Disposition wird die Rolle verschiedener Umweltfaktoren kontrovers beurteilt. Reizüberflutung, Rauchen der Mutter in der Schwangerschaft, familiäre Probleme („schlechtes Elternhaus“) sind als gravierende Faktoren anerkannt. Schilddrüsenhormone wirken regulierend auf das Neurotransmitternetzwerk. Subklinische SD-Unterfunktion oder periphere Hormonresistenz werden gehäuft bei AD(H)SKindern gefunden. Unverträglichkeitsreaktionen gegenüber Lebensmitteln und LM-Additiva, Belastung mit Neurotoxinen wie Schwermetallen (Blei, Quecksilber, Aluminium, Cadmium, Arsen) oder chlororganische Verbindungen und Überempfindlichkeit gegenüber Chemikalien (MCS) sind in ihrer Bedeutung umstritten. Gesichert ist das gehäufte Vorkommen von Mikronährstoffdefiziten (Magnesium, Zink, Niacin, Pyridoxin, Thiamin, Folat, Vitamin C, Omega- 3-Fettsäuren, seltener auch die Vitamine B12, A, E, B2 und Pantothenat) bei AD(H)S. Supplementierung mit Vitamin B6, Omega-3-Fettsauren, Flavonoiden und Phosphatidylserin scheinen die Symptomatik wesentlich zu verbessern und in Verbindung mit Detoxifikation, Diät und ggf. Korrektur einer intestinalen Dysbiose äußerst effektiv zu wirken. Nahrungsmittelunverträglichkeiten sollen bei der Mehrheit der betroffenen Kinder vorkommen. Eine entsprechende Eliminationsdiät ist daher häufig erfolgreich. Empfohlene Dosierungen: Mikronährstoff Magnesium Calcium Zink Phosphatidylserin Grüntee-Extrakt Moringa Vitamin B1 Vitamin C Vitamin E Omega 3-Fettsäuren L-Arginin L-Theanin L-Tyrosin Acetyl-L-carnitin Chrom Selen Empfohlene Tagesdosis 200-1000 mg 500-1000 mg 10-25 mg 100-300 mg 50-100 mg 50-200 mg 10-50 mg 200-500 mg 10-15 mg 1-3 g 100-300 mg 50-200 mg 600-1800 mg 500-1500 mg 20-100 µg 30-100 µg 6. Labordiagnostik Folgende labordiagnostische Möglichkeiten zur Objektivierung stressvermittelter Störungen bestehen: 23 NeuroStress Test Speichel: Cortisol Tagesprofil (8, 12, 20 Uhr) DHEA (8, 20 Uhr) Zweiter Morgenurin: Adrenalin, Noradrenalin, Dopamin, Serotonin, GABA, Glutamat 1) Speicheltests- Hormone: Cortisol, das wichtigste Stresshormon, lässt sich optimal in Speichel messen. Speichel hat neben dem Vorteil der unblutigen, stressfreien Materialgewinnung gegenüber Serum den weiteren Vorteil, dass kurzfristige Veränderungen der freien, biologisch relevanten Hormonmenge erheblich besser als in Serum erfasst werden können. Im Speichel findet sich ausschließlich freies, nicht an Eiweiß gebundenes Hormon, das in enger Korrelation mit dem aktuell im Organismus verfügbaren freien und biologisch aktiven Hormon steht. Auch DHEA kann hervorragend im Speichel gemessen werden. Unter Berücksichtigung der ausgeprägten Altersabhängigkeit der DHEA(S)-Produktion liefert die DHEA Bestimmung Informationen über den Funktionszustand der Nebenniere. Unter chronischen Belastungsbedingungen steigt DHEA über das Normale. Nicht selten sind hormonelle Funktionsstörungen beteiligt. Häufig ist die Schilddrüsenfunktion eingeschränkt. Eine subklinische Hypothyreose ist evtl. nicht am TSH-Anstieg ablesbar und muss durch sorgfältige klinische Untersuchung ausgeschlossen werden: Müdigkeit, Verlangsamung, kognitive Einbußen, Hypotonie, niedrige Körpertemperatur, etc. Leider fast alles klinische Symptome, die auch zu den neuroendokrinen Störungen passen, sodass die Entscheidung schwierig ist. Auch der vorzeitige oder altersgemäße Abfall der Androgene (Testosteron > DHEA); der Abfall von Progesteron und Östradiol vor allem bei PMS/Menopausebeschwerden können zu ähnlichen Symptomen führen: Kräfteverfall, Müdigkeit, Antriebsschwäche, Muskelabbau, Gewichtszunahme, Libidoverlust, kognitiven Einbußen, Schlafstörungen und Depressionen. Während DHEA im Speichel routinemäßig mitgemessen wird, sollten im Verdachtsfall, generell im Alter, Testosteron, Östradiol und evtl. Progesteron im Speichel mitgemessen und in die Therapieentscheidung einbezogen werden. 2) Urinmessungen-Neurotransmitter: Für die Bestimmung der Neurotransmitter (NT) hat sich der zweite Morgenurin als besonders geeignet erwiesen. Während die Neurosteroide zyklisch synthetisiert werden und nur morgens zum Zeitpunkt des Aufstehens in maximaler Konzentration vorhanden sind, werden die Neurotransmitter nur bei Bedarf ausgeschüttet, sehr schnell metabolisiert und ausgeschieden. Der erste Morgenurin enthält lediglich die während der Nacht gebildeten NT, erst im zweiten Morgenurin sind die unter Tagesbelastung gebildeten Neurotransmitter und evtl. Metaboliten vorhanden. 3) Blutmessung-Zytokine: Für die Feststellung und Beurteilung der entzündlichen Aktivität stehen zum einen die proinflammatorischen Zytokine im Serum zur Verfügung, TNF-alpha oder IL-6 bzw. das über IL-6 in der Leber induzierte sCRP (C-reaktives Protein), das allerdings meist nicht sensitiv genug ist. Für eine spezifische Entzündungsaktivität kommt außerdem die Messung von IFNgamma in Betracht. Besser geeignet sind allerdings in vitro Funktionstests mit Messung der stressinduzierten Zytokinsekretion. 4) Genetische Prädisposition: Die Depression, heute als Major Depression (MDD; major depressive disorder) oder unipolare Depression in Abgrenzung zur bipolaren Depression (BD; bipolar disorder) bezeichnet, hat eine hohe Vererbungsrate. Nach Zwillingsstudien liegt das genetische Risiko bei 40 – 50 %. Bei frühzeitigem Eintritt im Alter um 30 und bei rekurrenten depressiven Episoden liegt das Vererbungsrisiko noch weit höher, bis zu 70 %. Im Unterschied zur MDD 24 ist das genetische Risiko der leichteren Depressionsformen wie der reaktiven oder melancholischen Depressionen, der Winter/Frühjahrsdepression, der PostpartumDepression oder der Altersdepression ungleich geringer, allerdings wenig untersucht. 7. Neurostress-Therapiekonzept Behandlungsprinzip ist die Regeneration erschöpfter Neurotransmitter-Pools mit ihren physiologischen Aminosäuren-Vorstufen und die Wiederherstellung der Balance aktivierender und dämpfender Nervenimpulse. Durch die Regeneration des zentralen und autonomen Nervensystems wird auch die Funktion der Stresshormonachse wieder normalisiert, der Sexualhormonstatus verbessert und neuroentzündliche Prozesse minimiert. Die Stresssteroide, insbesondere Cortisol, sind erst über einen längeren Behandlungszeitraum nachhaltig beeinflussbar. Infolge der intensiven Wechselbeziehung zwischen Neurotransmitternetzwerk und Neurosteroiden kann jedoch indirekt nach Normalisierung der Neurotransmitterbalance auch die Stresshormonachse harmonisiert werden. Das Behandlungskonzept in drei Stufen: Stufe 1 - Initialbehandlung In dieser Stufe wird zunächst die inhibitorische, dämpfende Achse des NeurotransmitterNetzwerkes gestärkt und in erster Linie der fast immer feststellbare Serotoninmangel angegangen. Bei gravierenden inhibitorischen / exzitatorischen Gleichgewichtsstörungen werden zusätzlich zu Serotonin auch GABA-Vorstufen substituiert. Stufe 2 - Herstellung der Neurotransmitter-Balance Nach der Anhebung von Serotonin und GABA wird auf eine Kombinationsbehandlung umgestellt, die einen höheren Anteil an Vorstufen exzitatorisch wirkender Neurotransmitter aufweist, um das Neurotransmitternetzwerk auf höherem Niveau zu optimieren. Während dieser Phase sollen die Neurotransmitterwerte über den Normalbereich hinaus angehoben werden, bis die neuronalen Neurotransmitterpools im ZNS wieder aufgefüllt sind und die renale Ausscheidungsrate wieder reguliert ist. Die Aminosäurendosis muss ggf. noch mehrmals erhöht werden, um das angestrebte klinische Ansprechen zu erreichen. Veränderungen der Dosis werden in Intervallen von drei bis zehn Tagen vorgenommen. In speziellen Fallen, wenn die Aminosäurensubstitution keinen oder kaum Erfolg hat, ist ggf. auch die Suche nach genetischen Varianten beteiligter Enzymsysteme zu empfehlen, deren Bedeutung für die NT-Synthese, speziell die Serotoninverfügbarkeit, in den letzten Jahren gezeigt wurde: vor allem Genvarianten der Tryptophanhydroxylase, des geschwindigkeitsbestimmenden Enzyms der Serotoninsynthese, des Serotonintransporters (5HTT) oder auch des zentralen Serotoninrezeptors 5HTR2a. Stufe 3 - Dauertherapie In der letzten Stufe ist das vorrangige Ziel, die Dosierung der Aminosäuren langsam zu reduzieren oder auf eine minimale Erhaltungsdosis einzustellen. Die Dauer der Substitutionsbehandlung ist nicht absehbar. Sie kann von wenigen Monaten bis zu mehreren Jahren andauern, abhängig von der Ausgangssituation und der zugrunde liegenden Störungen. Eine Balance zwischen inhibitorischem und exzitatorischem Neurotransmittersystem sowie Neuroendokrinium / Stressachse und Nervensystem ist notwendig für ein optimales körperliches psychisches Wohlbefinden. Bei nachgewiesenem Ungleichgewicht mit 25 entsprechender klinischer Problematik hat sich gezeigt, dass die Korrektur durch Behandlung mit Aminosäure-Vorstufen zu signifikanter Verbesserung der Beschwerden bis zur völligen Gesundung führt. Das Verständnis der inhibitorischen und exzitatorischen Balance der Neurotransmitter ist der Schlüssel zur optimal kalkulierten Anwendung einer zielgerichteten Aminosäure-Therapie. Bei unzureichender Aussagekraft der klinischen Symptomatik wird empfohlen, ein Neurostress Profil anzufordern. Dies beinhaltet die Messung der Stresshormone im Speichel (Cortisol, DHEAS) sowie der Neurotransmitter im zweiten Morgenurin. Stufe 4 - Patientenführung Der in diesem Konzept als Stufe 4 benannter Therapieschritt ist die eigentliche „Basis“ in jeder ganzheitsmedizinischen Betreuung und Behandlung von Patienten. Vor allem bei Patienten mit chronischem Stress, die kaum noch Phasen der Entspannung kennen, kann ein Coaching helfen, Veränderungen im Umgang mit dem Alltag zu etablieren und so ihr Leben wieder in den Griff zu bekommen. Es neu zu strukturieren, positive Gewohnheiten zu starken, Stressauslöser zu entschärfen und eine andere Perspektive einzunehmen. Gutes Coaching ist Hilfe zur Selbsthilfe. Es soll die Fähigkeit erhöhen, das eigene Handeln zu reflektieren und Probleme zu lösen. Basis jeder Regulationstherapie ist die Balance des Saure- Basen-Haushaltes. Eine intakte Hormonproduktion ist nur auf Basis eines intakten Saure-Basen-Haushaltes möglich. • Ernährungsberatung • Körperpflege • Zeitmanagement und Konfliktlosung • Bewusste Entspannung (Yoga, QiGong usw.) Neurotransmitter: inhibitorisch vs. exzitatorisch Die exzitatorischen Neurotransmitter fördern neuronale Signale, andere wirken hemmend (inhibitorisch) und senken die Wahrscheinlichkeit einer Signalübertragung. So wird gewährleistet, dass wichtige, starke Signale erfolgreich sind und andere weniger wichtige, schwächere, ignoriert oder abgefangen werden. Bis zu 70 % der zentralen Synapsen sind GABA-abhängig. Sie erhalten kontinuierlich niedrig dosierten, dämpfenden Input, was man tonische Hemmung nennt. Dem entgegen wirkt das andere, mengenmäßig dominante Glutamat-System, das kurze, starke Signale aussendet, die die GABA-Hemmung überwinden und ein Aktionspotenzial auslösen. Alle anderen Neuronen und ihre Transmitter sind Modulatoren des GABA/Glutamat-Systems. Neuromodulatoren, die synergistisch mit GABAergen Neuronen wirken, nennt man inhibitorisch, die glutaminerge Signale verstärkenden, zählt man zu den exzitatorischen Modulatoren. Exzitatorische Neuromodulatoren sind Adrenalin, Noradrenalin und Phenylethylamin (PEA) sowie Asparaginsäure, während Serotonin und Glycin inhibitorisch wirken. Dopamin hat mehr als andere Modulatoren neben seiner exzitatorischen Aktivität auch inhibitorische Wirkungen. Therapiedauer Die Konzentration einzelner Neurotransmitter kann durch therapeutische Intervention sehr effektiv verändert werden. Der Serotoninspiegel wird durch die Gabe von 5ydroxytryptophan (5-HTP), Dopamin durch L-Dopa und die Katecholamine insgesamt durch L-Tyrosin bzw. L-Phenylalanin in der Regel innerhalb weniger Stunden, Tage bis Wochen messbar gesteigert. Dieser Anstieg läuft allerdings nicht parallel mit der Regeneration der NT-Pools in den präsynaptischen Vesikeln. Hier kann die Normalisierung Monate in Anspruch nehmen. Außerdem muss berücksichtigt werden, dass auch andere Abschnitte des NTTurnovers betroffen sein können und der NT-Bedarf für eine volle Wirkung hoher als im 26 Normalfall ist. Neben den zentralen NT-Pools werden auch periphere Pools mitregeneriert, was insbesondere bei Serotonin erhebliche Bedeutung hat, da > 95 % peripher im Gastrointestinaltrakt gebildet werden. Die Auffüllung der peripheren Serotonin-Pools beansprucht daher den größten Teil des Aminosäureangebotes. Auch die Ruckresorption der NT kann erheblich beeinträchtigt sein, entweder infolge toxischer Schädigung oder aufgrund genetischer Varianten der Reuptake-Proteine. Schließlich kann auch die Rezeptorseite betroffen sein. Infolge toxischer Defekte (Beispiel Parkinson) oder auch aufgrund genetischer Disposition kann die Rezeptordichte bzw. Rezeptorfunktion und Signalübermittlung eingeschränkt sein, so dass höhere Mengen an Neurotransmittern benötigt werden, um eine effektive Signalwirkung zu erreichen. Schließlich kann auch die renale Filtration/ Ruckresorption der NT in der Niere variieren und darüber hinaus die lokale Synthese in der Niere die Kontrollmessungen der NT im Urin überlagern. Aus diesen Gründen müssen die Neurotransmitter-Precursormengen in Phase 2 meistens in einem therapeutischen Bereich (bezogen auf die Urinmessdaten) angehoben werden, der zum Teil erheblich hoher als der normale Referenzbereich liegen kann. In der Phase 3 wird die Dosierung der Aminosäure-Vorstufen gegenüber Phase 2 zunehmend reduziert. Ziel ist hier die Einstellung auf optimale Messbereiche der Neurotransmitter. Follow-up Testungen der Neurotransmitter im zweiten Morgenurin bestätigen den Erfolg der NeurotransmitterTherapie und können für Korrekturen der Substitution genutzt werden. 8. Mikronährstoffkonzept - Aminosäurentherapie Ziel der Aminosäuretherapie ist die Erhöhung der zentralen Konzentration einzelner Neurotransmitter, an erster Stelle von Serotonin, und die Wiederherstellung der Balance aller wichtigen Neurotransmitter, in erster Linie von Serotonin, Noradrenalin, Dopamin und ebenso der zwei mengenmäßig wichtigsten NT GABA und Glutamat. Schließlich ist die Wiederherstellung physiologischer Stresshormonzyklen durch Dämpfung übermäßiger Sekretion (endogene Depression) bzw. Überwindung der sekretorischen Blockade bei Burn-out, reaktiver Depression bzw. Stress Depression nach Rejustierung der neuronalen Balance. Ein einheitliches Substitutionsschema kann nicht verfolgt werden. Schon die Erfahrungen mit den modernen Antidepressiva haben gezeigt, dass die Pathophysiologie der Depressionen vielfaltigen Mechanismen unterliegt. Die Behandlung mit den SSRI, die auf Serotonin fokussiert sind, reicht oft nicht aus und muss durch Kombination mit dem NRI-Effekt ergänzt werden. Daher reicht es auch bei der Aminosäurebehandlung nicht aus, allein die Serotoninvorstufe 5-HTP zu verwenden. Sie muss mit meist Tyrosin (oder auch Acetyltyrosin, Mucuna pruriens) für die Katecholaminrestitution, evtl. auch mit Glutamin für die Verstärkung der GABA-Wirkung kombiniert werden. Serotonin wird vorzugsweise über die unmittelbare AminosäureVorstufe 5-Hydroxytryptophan (5-HTP) substituiert. 5-HTP ist wesentlich effizienter als seine Vorstufe, die Aminosäure L-Tryptophan, da es ungestört die Blut-Hirn-Schranke passiert (Tryptophan konkurriert mit anderen Aminosäuren um aktive Passage der BlutHirn-Schranke) und ausschließlich zu Serotonin umgewandelt wird. Tryptophan steht nur zum kleinen Teil für die Synthese des Neurotransmitters Serotonin zu Verfügung, der weitaus größere Anteil (bis zu 95%) wird in andere Substrate (Kynurenine, Niacin, NADP) umgewandelt bzw. in Eiweiß eingebaut. Der kritische Schritt in der Serotoninsynthese ist die Umwandlung von Tryptophan zu 5-HTP durch das Enzym Tryptophanhydroxylase (TpH), das sehr störungsanfällig ist und von dem genetische 27 Varianten mit zum Teil erheblich eingeschränkter Aktivität vorkommen. Stress (Cortisolüberschuss), oxidativer Stress (vor allem Peroxynitrit: NOO-), Insulinresistenz, Vitamin B6- oder Magnesiummangel, Entzündungen, alle hemmen die Enzymaktivität der TpH, unter Umstanden bis zur irreversiblen vollständigen Inaktivierung (Entzündungsstress: NOO-). Die Katecholamine Dopamin, Noradrenalin und Adrenalin, werden aus der Aminosäure Tyrosin bzw. aus Phenylalanin via Tyrosin aufgebaut. Gelegentlich ist auch Acetyl-Tyrosin vorzuziehen, das erst nach Hydrolyse zum Tyrosin für die Katecholaminsynthese verfügbar ist und damit einen Retardeffekt besitzt. Bei höherem Dopaminbedarf wird der Extrakt der Heilpflanze Mucuna pruriens eingesetzt, der reich an (bis zu 25%) Dopaminvorstufen ist. Für die Enzyme, die die Aminosäuren zu Neurotransmittern aufbauen, werden die Vitamine C, B6, B12 und Folat sowie Magnesium und Calcium eingesetzt. Vor allem Vitamin B6 ist an zahlreichen Enzymschritten der Neurotransmittersynthese beteiligt. Nicht selten kann allein die Gabe von Vitamin B6 und/oder Folat schon große Wirkung erzielen. Die genetischen Variationen der an der NT-Synthese beteiligten Enzyme können im Einzelfall einen weit über das Normalmaß hinausgehenden Vitamin/Cofaktorbedarf bewirken. Schließlich können verschiedene Naturstoffe als sehr wirksame Modulatoren, d.h. Verstärker der Neurotransmitterwirkung bzw. dämpfende Faktoren für die Verbesserung der neuroendokrinen Balance, verwendet werden. Bewährt haben sich vor allem Theanin aus Tee, EGCG (Epigallocatechingallat) aus Grüntee, die Heilpflanze Rhodiola rosea (Rosenwurz) sowie die Aminosäure Taurin. Behandlungsziel ist zunächst der Ausgleich des praktisch immer vorhandenen Serotonindefizits und anschließend die Balance aller Neurotransmitter bis zur Normalisierung der neuroendokrinen Systeme. Empfohlene Dosierungen: Mikronährstoff Taurin Calcium Magnesium L-Tyrosin L-Arginin L-Glutamin Rosenwurz Griffonia-Extrakt (mit 5-HTP) Mucuna pruriens Epigallocatechingallat (EGCG) Theanin Vitamin C Vitamin B6 Folsäure Vitamin B12 Empfohlene Tagesdosis 1-4 g 1-1,5 g 300-1000 mg 500-3000 mg 1000-2000 mg 1000-4000 mg 10-30 mg 25-150 mg 60-120 mg 10-50 mg 200-400 mg 1-5 g 100-300 mg 400-5000 µg 250-1000 µg 28 9. Mikronährstofftherapie Vitamin C fungiert im Körper als Antioxidans. Die Biosynthese, Freisetzung und Wiederaufnahme von Neurotransmittern im Gehirn setzt permanent eine hohe Anzahl sauerstoffhaltiger Radikale frei, so dass es zu einer hohen Belastung mit oxidativem Stress kommt. Insbesondere der Abbau von Katecholaminen durch das Enzym Monoaminoxidase generiert diese Radikale. Vitamin C schützt die Zellen vor Peroxidverbindungen auf doppelte Weise. Zum einen fängt es die entstehenden Radikale ab und neutralisiert sie und zum anderen schützt es die Katecholamine vor oxidativen Prozessen. Zusätzlich vermag Vitamin C die DOPA-Menge aus der Aminosäure L-Tyrosin zu steigern, da es als Kofaktor der TyrosinHydroxylase wirkt. Dies kommt insbesondere Patienten mit Morbus Parkinson zugute. Die B-Vitamine werden auch als Anti-Stress-Vitamine bezeichnet. Insbesondere bei physischer und psychischer Erschöpfung haben sich Vitamin B-Mischungen in hochdosierter Form empfohlen. Ähnliches gilt für praktisch alle neuroendokrinen Gesundheitsstörungen, z.B. Migräne, aber auch Schizophrenie. Vitamin D ist wichtig für ein einwandfreies Funktionieren des Immunsystems und leistet einen Beitrag zu einer normalen Denkleistung. Studien haben gezeigt, dass insbesondere das Kleinhirn und der Hippocampus (das ist der Bereich, der für das Gedächtnis zuständig ist) auf Vitamin D angewiesen sind, um korrekt arbeiten zu können. Auffallend ist, dass Menschen mit einem hohen Vitamin D-Spiegel in der Regel bessere memoriale Fähigkeiten aufweisen als Patienten mit einem niedrigen Vitamin D-Gehalt. Coenzym Q10 spielt im zellulären Stoffwechsel eine entscheidende Rolle. Das Molekül fungiert als Elektronen- und Protonenüberträger in der Atmungskette und bewirkt die Synthese von Adenosintriphosphat (ATP) als Energiespeicher. Demzufolge besitzen alle Organe mit hohem Energiebedarf auch hohe Coenzym Q10-Mengen, z.B. Herz, Leber, Nierem. Bei Stress, Burnout, CFS, Fibromyalgie, Alzheimer, Migräne, Krebs, Schilddrüsenüberfunktion, Krebs, Infektionen oder auch Muskelarbeiten ist der Q10-Bedarf erhöht. Normalerweise liegt der Coenzym Q10-Spiegel im Blut zwischen 0,8 und 1,2 µg/ml. Bei Krankheit empfiehlt sich eine Steigerung auf 3-4 µg/ml. L-Carnitin reguliert nicht nur die Verfügbarkeit von Acetyl-CoA, es steigert auch die Glucoseverstoffwechselung durch Anregung der Glucoseverwendung. Zusätzlich hat LCarnitin eine neuroprotektive Wirkung und vermag sogar die Nervenzellregeneration zu beschleunigen, indem es den NGF (Nerve Grow Factor) stimuliert. L-Carnitin aktiviert die Cholin-Acetyl-Transferase, die Acetylcholin (ACh) aus Acetyl-CoA und Cholin synthetisiert. Acetylcholin ist zuständig für die Erregungsübertragung zwischen Nerv und Muskel an der neuromuskulären Endplatte. Weiterhin fungiert es als Transmitter, der die Übertragung von der ersten auf die zweite der beiden hintereinandergeschalteten Nervenzellen im vegetativen Nervensystem, sowohl im Sympathikus als auch im Parasympathikus, vermittelt. Im parasympathischen Teil des vegetativen Nervensystems ist es zudem der Transmitter der zweiten Nervenzelle am Zielorgan. Daneben stellt ACh einen wichtigen Transmitter im zentralen Nervensystem dar. Viele kognitive Prozesse sind an Acetylcholin gekoppelt. So besteht bei der Alzheimerschen Krankheit durch Absterben von primär Acetylcholin produzierenden Nervenzellen ein Mangel an ACh. Diesen Mangel kann man medikamentös auszugleichen, indem man mit Acetylcholinesterasehemmern (ACE-Hemmer) dieses 29 Acetylcholin abbauende Enzym hemmt, um dadurch die ACh-Konzentration an den Synapsen zu erhöhen. Einen anderen Weg geht man über die Verabreichung von Precursor-Proteinen wie z. B. Deanol und Meclophenoxat, um so den Aufmerksamkeitsgrad zu erhöhen. Acetylcholin gehört nach γ-Aminobuttersäure (GABA) und Glycin zu den Neurotransmittern, die im Gehirn am häufigsten vorkommen. S-Adenosyl-Methionin (SAMe) reguliert elektrische Vorgänge in den Zellmembranen. Es vermag Schwermetallausleitungen zu beschleunigen und spielt eine Rolle bei der Entgiftung bestimmter Toxine und Xenobiotika, z.B. Methadon oder Paracetamol. SAMe vermag die Genexpression zu kontrollieren. Im Synthesezyklus der Katecholamine wandelt SAMe Noradrenalin in Adrenalin und Serotonin in Melatonin um. Außerdem steigert es die Biosynthese von Serotonin und Noradrenalin im Hippocampus und Cortex. Omega 3-Fettsäuren sind Bestandteil von Zellmembranen. Sie steigern die NO-vermittelte Gefäßdilatation und verringert die Synthese proinflammatorischer Zytokine, so dass die Entzündungsreaktionen an einem bereits geschädigten Endothel reduziert werden. Durch eine kompetitive Verdrängung von Arachidonsäure kommt es zu einer deutlichen Verringerung vasodilatatorischer, antithrombogener und antiinflammatorischer Leukotriene und Prostanoide, also Gewebshormone, die sich von der Arachidonsäure ableiten lassen. Selen ist Bestandteil von GSH-Peroxidasen, die zelltoxisches Wasserstoffperoxid neutralisieren können. Sie wirken als Antioxidans für Zellmembranen und Erythrozyten und stimulieren die Lymphozytenproliferation sowie die Zytokinproduktion. Außerdem wird die Interferon-γ-Synthese gesteigert. Im Bereich des Entzündungsstoffwechsels reduziert Selen die Menge an proinflammatorischen Leukotrienen und Prostanoiden und inhibiert redoxabhängige Transkriptionsfaktoren (u.a. NF-κB). Kupfer hat eine antioxidative Schutzfunktion (Superoxid-Dismutase). Es ist an der Biosynthese von Myelin und an der Herstellung des Katecholamins Noradrenalin aus Dopamin beteiligt. Dieser Schritt verläuft in Gegenwart von Kupfer, Eisen und Vitamin C. Der Abbau von Neurotransmittern verläuft unter Oxidation der Aminfunktion zur Aldehydgruppe, dieser Schritt ist kupferkatalysiert. Zink ist wichtig für die Kollagensynthese und die Wundheilung sowie für eine Entgiftung des Körpers von Cadmium und Blei. Zink spielt eine entscheidende Rolle bei der Synthese von Neurotransmittern, außerdem im Stoffwechsel der Schilddrüsen, Sexual- und Wachstumshormone. Außerdem werden Zellmembranen durch Zink stabilisiert. Resveratrol stimuliert das Immunsystem, inhibiert jedoch den redoxabhängigen Transkriptionsfaktor NF-κB. Zusätzlich werden die Cyclooxygenase (COX) und die Lipoxygenase gehemmt. Bekanntermaßen steigert Resveratrol die antioxidative Kapazität und vermag sauerstoff- und Stickstoffradikale zu neutralisieren. Zusätzlich wird die NOBioverfügbarkeit erhöht. Cordyceps. Dieser Heilpilz stimuliert das Immunsystem gegen Bakterien, Viren und Pilze. Er beseitigt psychische und physische Erschöpfungszustände und wirkt (insbesondere in Kombination mit Maca) potenz- und libidosteigernd. 30 Phosphatidylserin gehört zur Gruppe der Phospholipide. Es ist zuständig für die Freisetzung der Neurotransmitter, insbesondere Dopamin, Serotonin und Acetylcholin. Phosphatidylserin ist empfehlenswert bei Depressionen, Lern-, Gedächtnis- und Konzentrationsstörungen sowie bei einer gestörten Glucoseverwertung im Gehirn. Ein erhöhter Bedarf besteht bei Alzheimer, Stress, ADHS, kognitiven Störungen usw. Empfohlene Dosierungen: Mikronährstoff Vitamin B1 Niacin Pantothensäure Vitamin D Coenzym Q10 L-Carnitin S-Adenosyl-Methionin (SAMe) Omega 3-Fettsäuren Selen Kupfer Zink Phospatidylserin Cordyceps Resveratrol Empfohlene Tagesdosis 50-100 mg 100-500 mg 100-1000 mg 1000-2000 I.E. 50-400 mg 1-3 g 600-1500 mg 1-3 g 100-200 µg 1-3 mg 10-30 mg 200-400 mg 700-1400 mg 50-200 mg 10. Für weitergehende Informationen sind folgende Literaturstellen zu empfehlen: Agelaki S, Tsatsanis C, Gravanis A, Margioris AN: Corticotropin-releasing hormone augments proinflammatory cytokine production from macrophages in vitro and in LPS induced endotoxin shock in mice. Infect Immun 2002; 70: 6068-6074 Anisman H. Cascading effects of stressors and inflammato ry immune system activation: implications for major depressive disorder. J Psychiatry Neurosci 2009;34(1):4-20 Arterburn LM, Hall EB, Oken H. Distribution, interconversion, and dose response of n-3 fatty acids in humans. Am J. Clin Nutr 2006; 83(suppl): 1467S – 1476S Beaulieu JM, Zhang X, Rodriguiz RM, Sotnikova TD, Cools MJ, Wetsel WC, Gainetdinov RR, Caron MG. Role of GSK3 beta in behavioral abnormalities induced by serotonin deficiency. Proc Natl Acad Sci U S A. 2008;105(4):1333-8 Berk M, Sanders KM, Pasco JA, Jacka FN, Williams LJ, Hayles AL, Dodd S. Vitamin D deficiency may play a role in depression. Med Hypotheses 2007; 69(6):1316-9. Boyer EW, Shannon M: The serotonin syndrome. New Engl J Med 2005; 352: 1112–1120 Brody S, Preut R, Schommer K, Schürmeyer TH. A randomized controlled trial of high dose ascorbic acid for reduction of blood pressure, cortisol, and subjective responses to 31 psychological stress. Psychopharmacology 2002;159:319–24 Brotman D, Golden SH, Wittstein IS: The cardiovascular toll of stress. Lancet 2007; 370: 1089-1098 Bryan J. Psychological effects of dietary components of tea: caffeine and L-theanine. Nutr Rev 2008; 66(2):82-90 Calder PC. Glutamine and the immune system. Clin Nutr 1994; 13: 2-8 Calder PC: n-3 Polyunsaturated fatty acids, inflammation, and inflamatory diseases. Am J Clin Nutr 2006; 83(suppl): 1505S-19S Camacho-Arroyo I, López-Griego L, Morales-Montor J. The role of cytokines in the regulation of neurotransmission. Neuroimmunomodulation 2009; 16(1):1-12 Christiansen L, Tan Q, Iachina M, Bathum L, Kruse TA, McGue M, Christensen K: Candidate Gene Polymorphisms in the Serotonergic Pathway: Influence on Depression Symptomatology in an Elderly Population. Biol Psychiatry 2007;61:223–230 Chrousos GP: Stress, chronic inflammation, and emotional and physical well-being: concurrent effects and chronic sequelae. J Allergy Clin Immunol 2000, 106 (suppl 5): S275S291 Dagai L, Peri-Naor R, Birk RZ. Docosahexaenoic acid significantly stimulates immediate early response genes and neurite outgrowth. Neurochem Res 2009;34(5):867-75 Dantzer R, O’Connor JC, Freund GG, Johnson RW, Kelley KW. From inflamma tion to sickness and depression: when the immune system subjugates the brain Nature Rev Neurosci 2008; 9: 46-57 Eisenhofer G, Kopin IJ, Goldstein DS: Catecholamine metabolism: a contemporary view with implications for physiology and medicine. Pharmacol Rev 2004; 56: 331-349 Elenkov IJ, Chrousos GP: Stress System – organization physiology and immuneoregulation. Neuroimmunomodulation 2006; 13: 257-267 Gerretsen P, Pollock BG. Pharmacogenetics and the serotonin transporter in late-life depression. Expert Opin Drug Metab Toxicol 2008;4(12):1465-78 Golden RN, Heine AD, Ekstrom RD, Bebchuk JM, Leatherman ME, Garbutt JC: A longitudinal study of serotonergic function in depression. Neuropsychopharmacology 2002; 26: 653-659 Grossi G, Perski A, Ekstedt M, Johansson T, Lindström M, Holm K. The morning salivary cortisol response in burnout. J Psychosom Res. 2005 Aug;59(2):103-11 Haskell CF, Kennedy DO, Milne AL, Wesnes KA, Scholey AB. The effects of L-theanine, caffeine and their combination on cognition and mood. Biol Psychol 2008;77(2):113-22 32 Imeri L, Opp MR. How (and why) the immune system makes us sleep. Nat Rev Neurosci 2009;10(3):199-210 Jorde R, Waterloo K, Saleh F, Haug E, Svartberg J. Neuropsychological function in relation to serum parathyroid hormone and serum 25-hydroxyvitamin D levels. The Tromsoe study. J Neurol 2006; 253: 464-470 Jorgensen HS. Studies on the neuroendocrine role of serotonin. Dan Med Bull 2007; 54: 266288 Kimura K, Ozeki M, Juneja LR, Ohira H. L-Theanine reduces psychological and physiological stress responses. Biol Psychol. 2007; 74(1):39-45. Kraft JB, Peters EJ, Slager SL, Jenkins GD, Reinalda MS, McGrath PJ, Hamilton SP. Analysis of association between serotonin transporter and antidepressant response in a large clinical sample. Biol Psychiatry 2007; 61: 734-742 Lukiw WJ, Bazan NG. Docosahexaenoic acid and the aging brain. J Nutr 2008: 138: 2510-14 Lupien SJ, McEwen BS, Gunnar MR, Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nat Rev Neurosci. 2009 Jun;10(6):434-45 Marc DT, Ailts JW, Ailts Campeau DC, Bull MJ, Olson KL. Neurotransmitters excreted in the urine as biomarkers of nervous system activity: Validity and clinical applicability. Neurosci Biobehav Rev 2011; 35: 635-644 Miller AH. Therapeutic considerations of L-glutamine: a review of the literature. Altern Med Rev 1999; 4 Miller AH, Maletic V, Raison CL. Inflammation and its discontents: the role of cytokines in the pathophysiology of major depression. Biol Psychiatry. 2009 May 1;65(9):732-41 Müller N, Riedel M, Schwarz MJ, Engel RR: Clinical effects of COX2 inhibitors on cognition in schizophrenia. Eur Arch Psychiatry clin Neurosci 2005; 255: 149-151 Müller N, Schwarz MJ: The immune-mediated alteration of serotonin and glutamate: towards an integrated view of depression. Mol Psychiatry 2007 12, 988–1000 Myint AM, Kim YK. Cytokine-serotonin interaction through IDO: a neurodegeneration hypothesis of depression. Med Hypotheses 2003; 61: 519–525 Myint AM, Schwarz MJ, Steinbusch HW, Leonard BE. Neuropsychiatric disorders related to interferon and interleukins treatment. Metab Brain Dis. 2009; 24(1):55-68. Nautiyal KM, Ribeiro AC, Pfaff DW, Silver R: Brain mast cells link the immune system to anxiety-like behavior. PNAS 2008: 105: 18053-57 33 Newsholme EA, Blomstrand E. Branched-chain amino acids and central fatigue. J Nutr 2006; 136 (suppl 1): 274S-76S Osterberg K, Karlson B, Hansen AM. Cognitive performance in patients with burnout, in relation to diurnal salivary cortisol. Stress 2009; 12(1): 70-81 Pecchi E, Dallaporta M, Jean A, Thirion S, Troadec JD. Prostaglandins and sickness behavior: old story, new insights. Physiol Behav 2009; 97: 279-92 Perianayagam MC, Oxenkrug GF, Jaber BL: Immune-modulating effects of melatonin, Nacetylserotonin, and N-acetyldopamine. Ann NY Acad Sci 2005; 1053: 386–393 Raison CL, Borisov AS, Majer M, Drake DF, Pagnoni G, Woolwine BJ, Vogt GJ, Massung B, Miller AH. Activation of central nervous system inflammatory pathways by interferon-alpha: relationship to monoamines and depression. Biol Psychiatry. 2009 Feb 15;65(4):296-303 Rogers PJ, Smith JE, Heatherley SV, Pleydell-Pearce CW. Time for tea: mood, blood pressure and cognitive performance effects of caffeine and theanine administered alone and together. Psychopharmacology 2008; 195(4):569-77 Rupp H, Wagner D, Rupp T, Schulte LM, Maisch B. Risk stratification by the "EPA+DHA level" and the "EPA/AA ratio" focus on anti-inflammatory and antiarrhythmogenic effects of longchain omega-3 fatty acids. Herz 2004;29(7):673-85. Sanacora G, Rothman DL, Mason G, Krystal JH: Clinical studies implementing glutamate neurotransmission in mood disorders. Ann NY Acad Sci 2003; 1003: 292–308 Schiepers OJ, Wichers MC, Maes M: Cytokines and major depression. Prog Neuropsychopharmacol Biol Psychiatry 2005; 29: 201-217 Szelenyi J, Vizi ES: The catecholamine cytokine balance: interaction between the brain and the immune system. Ann . Aca. Sc.2007; 1113: 311–324 Tracey KJ: Physiology and immunology of the cholinergic antiinflammatory pathway. J Clin Invest 2007; 117: 289-296 Vaccarino V, Brennan ML, Miller AH, Bremner D, Ritchie JC, Lindau F, Veledar E, Su S, Murrah NV, Jones L, Jawed F, Dai J, Goldberg J, Hazen SL: Association of major depressive disorder with serum myeloperoxidase and other markers of inflammation: a twin study. Biol Psychiatry 2008; 64: 476-483 Weaver KL, Ivester P, Seeds M, Case LD, Arm JP, Chilton FH. Effect of dietary fatty acids on inflammatory gene expression in healthy humans. J Biol Chem 2009; 284: 15400-407 Wilkins CH, Sheline YI, Roe CM, Birge SJ, Morris JC. Vitamin D deficiency is associated with low mood and worse cognitive performance in older adults. Am J Geriatr Psychiatry. 2006; 14(12):1032-40 34 Wurtman RJ: Genes, stress, and depression. 2005;54(5 Suppl 1):16-9 Zeisel SH, Blusztajn JK: Choline and human nurition. Annu Rev Nutr 1994; 14: 269-296 Zlokovic BV: The Blood-Brain Barrier in Health and Chronic Neurodegenerative Disorders. Neuron 2008: 57: 178-201 Stichworte: Neurostress, Chronischer Stress, Depression, Burnout, Fatigue, Chronisches Müdigkeitssyndrom, CFS, MCS, ADS, ADHS, Kopfschmerz, Migräne, PMS, Prämenstruelles Syndrom, Fibromyalgie, Cortisol, Adrenalin, Noradrenalin, Dopamin, Serotonin, GABA, Aminosäurentherapie. Herausgeberin Mag. Dr. rer. nat. Nicole Wopfner Biologin, Ernährungswissenschafterin, Mitglied des Fachsenats des FORUM VIA SANITAS Römerweg 22, 5061 Elsbethen, Österreich E-Mail: Website: [email protected] www.forumviasanitas.org Hinweis: Dieser Praxistipp repräsentiert die Meinung und Praxiserfahrung des Autors und ersetzt keinesfalls eine ordnungsgemäße Diagnose bzw. Behandlung unter Berücksichtigung der Besonderheiten des Einzelfalls. 35