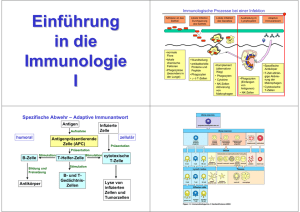
Das Immunsystem
Werbung
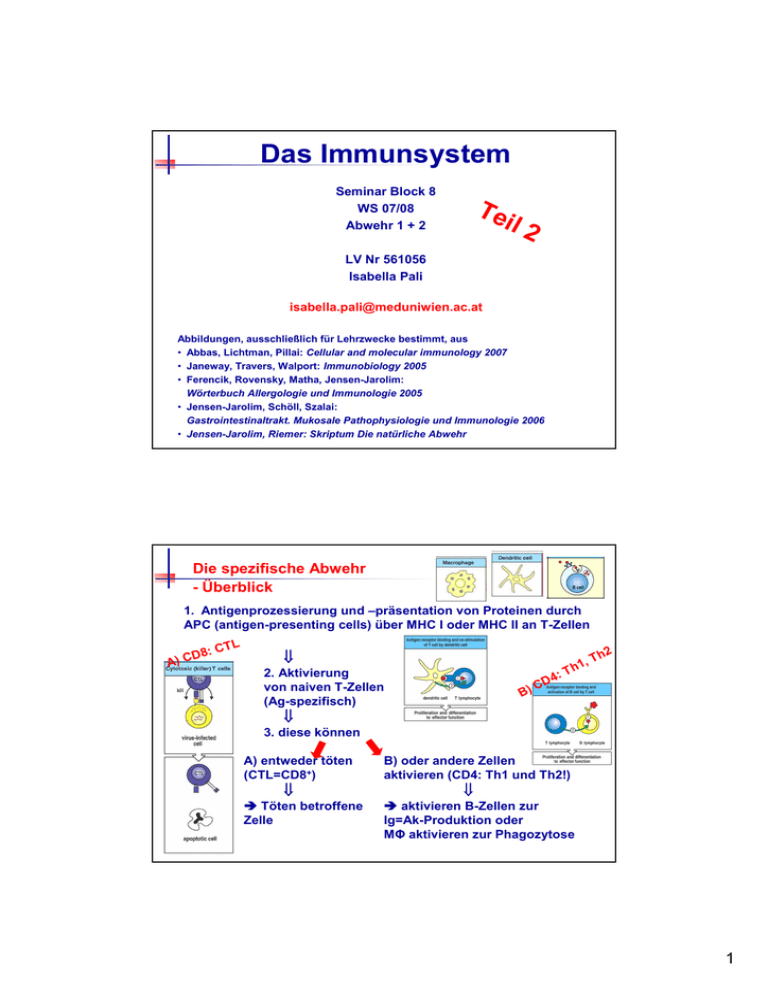
Das Immunsystem Seminar Block 8 WS 07/08 Abwehr 1 + 2 Te il 2 LV Nr 561056 Isabella Pali [email protected] Abbildungen, ausschließlich für Lehrzwecke bestimmt, aus • Abbas, Lichtman, Pillai: Cellular and molecular immunology 2007 • Janeway, Travers, Walport: Immunobiology 2005 • Ferencik, Rovensky, Matha, Jensen-Jarolim: Wörterbuch Allergologie und Immunologie 2005 • Jensen-Jarolim, Schöll, Szalai: Gastrointestinaltrakt. Mukosale Pathophysiologie und Immunologie 2006 • Jensen-Jarolim, Riemer: Skriptum Die natürliche Abwehr Die spezifische Abwehr - Überblick 1. Antigenprozessierung und –präsentation von Proteinen durch APC (antigen-presenting cells) über MHC I oder MHC II an T-Zellen CTL D8: C ) A ⇓ 2. Aktivierung von naiven T-Zellen (Ag-spezifisch) C B) D4 :T , h1 Th 2 ⇓ 3. diese können A) entweder töten (CTL=CD8+) ⇓ Töten betroffene Zelle B) oder andere Zellen aktivieren (CD4: Th1 und Th2!) ⇓ aktivieren B-Zellen zur Ig=Ak-Produktion oder MΦ aktivieren zur Phagozytose 1 Dendritische Zellen - Der Weg zu aktiven T- und B-Zellen ig A. Ant senta en-Prä tion üb e r DC ... oder. n e l n l ö te -Ze e T und t v i TL t na triff rden C C P e B. A iese w d C. hier ellen ( Z e r e n and tiviere D. ...ak Dendritische Zellen - Die professionellen APC B-Zell ktion) Produ k A r en zu A Formen Follikuläre dendritische Zellen: Keimzentren von Lymphfollikeln Interdigitierende dendritische Zellen: T-Zell-Regionen der Lymphknoten potenteste Stimulatoren der naiven T-Zellen Langerhans-Zellen: in der Epidermis der Haut 2 Dendritische Zellen - Die Antigen-Prozessierung und -Präsentation A 1. MHC I: körpereigene und fremde zytosolische Antigene, z.B. virale Proteine Proteasom: kleine Peptidfragmente von Transporter namens TAP (transporter associated with antigen processing) ad Endoplasmatisches Retikulum (ER) mittels Adapter-Protein Tapasin ein MHC I-Komplex in Nähe des TAP gebracht importiertes Protein präferenziell an diesen MHC I-Komplex gebunden MHC I+Peptid an Zelloberfläche MHC I präsentiert das Antigenpeptid an CD8+ T-Lymphozyten Aktivierung der CD8+ T-Zelle zum Zytotoxischen T-Lymphozyten (CTL) Dendritische Zellen - Die Antigen-Prozessierung und -Präsentation A 1. MHC I: körpereigene und fremde zytosolische Antigene, z.B. virale Proteine 3 Dendritische Zellen - Die Antigen-Prozessierung und -Präsentation A 2. MHC II: extrazelluläre und vesikuläre Antigene Peptid-Bindungsspalt durch Invariant chain blockiert Verschmelzung des MHC tragenden Vesikels mit Phagolysosom + HLA-DM + saures pH-Milieu verdrängen Invariant chain Bindung eines Peptid-Fragments (Ursprung extrazellulär – Organismus, z. B. ein Bakterium, wurde durch Phagozytose im Phagolysosom zerlegt) Dendritische Zellen präsentieren über MHC II Peptifragmente den CD4+ T-Lymphozyten kann nun ihrerseits B-Zellen zur Antikörperproduktion aktivieren oder Makrophagen dazu veranlassen, die phagozytierten Erreger im Phagolysosom zu vernichten Dendritische Zellen - Die Antigen-Prozessierung und -Präsentation A 2. MHC II: extrazelluläre und vesikuläre Antigene 4 Dendritische Zellen - Die Antigen-Präsentation an T-Zellen B Die Lymphozyten - Vielfalt ihrer Rezeptoren Vielfalt durch 1. Rekombination der Gensegmente für Rezeptoren 2. Kombination der Ketten (alpha, beta bzw. schwere und leichte) 3. Verknüpfung an Verbindungsstellen B D Transmembrane Signaltransduktionsmodule 5 Dendritische Zellen - Die Antigen-Präsentation an T-Zellen B Die T-Zellaktivierung B - Braucht Signal 1 (MHC+Ag/TCR) + 2 (Co-Stimulation) 6 Die Antigen-Präsentation an T-Zellen - Naive T-Zellen erhalten Effektorfunktion B C Die Effektor-T-Lymphozyten - Töten oder aktivieren C D (Th1) (Th1+Th2!) 7 Die Effektor-T-Lymphozyten - Töten ... C einmalig aktivierter CTL kann nun seinerseits MHC I auf Oberfläche kernhaltiger Körperzellen erkennen, sobald diese das Peptidfragment (z. B. von einem Virus-Protein) exprimieren, mit dem der CTL aktiviert wurde die virusbefallene Zelle wird von CTL getötet = zellvermittelte Zytotoxizität (CMC) Die Effektor-T-Lymphozyten - ... oder aktivieren zelleigene Programme angeregt zerstören vesikuläre Pathogene D AntikörperProduktion 8 Differenzierung der T-Zellen in Th1/Th2 - Zytokinmilieu und Antigen sind bestimmend B Differenzierung der T-Zellen in Th1/Th2 - Zytokinmilieu und Antigen sind bestimmend B 9 Aktivierung der T-Zellen - Zytokinmilieu und Antigen sind bestimmend B Das Schicksal der naiven T-Zellen im Lymphknoten wird durch 3 Signale (von DC) bestimmt: 1. MHC I-, MHC II-Peptid Liganden Erkennung durch TCR (Signal 1): a. Geringe Interaktion, Selbstpeptide Anergie oder Apoptose oder Treg b. Mittlere Stärke oder Dauer der Interaktion Effektorzellen + central memory T-Zellen c. Starke, lange Interaktion Effektor-Zellen, die besten werden dann zu memory Effektorzellen 2. Co-stimulatorische Moleküle (Signal 2): * Aktivierung der T-Zellen(!), Polarisierung, Beeinflussung und Timing der Zytokinbildung * In Abwesenheit dieser Signale wird die T-Zelle anerg, was zur Toleranz führen kann (wichtig bei Selbstpeptiden). 3. Zytokine und Treg (Signal 3): * Polarisierung der TH-Antwort. Die Art der gebildeten Zytokine kann vom Subtyp der DCs, von der Art des Ag, der Entzündungsreaktion und dem Mikromilieu abhängen. Aktivierung der T-Zellen - DC/T-Zell-Interaktion B Entwicklung einer adaptiven Immunantwort (T-Zell Aktivierung, Polarisierung der TH-Antwort TH1, TH2, Toleranz, Memory) abhängig von: 1. Subtyp, Funktion und Lokalisation der DC 2. AG-Konzentration, Art der AG, Art der AG-Aufnahme (welche TLR benutzt werden) 3. Stärke einer Entzündungsreaktion Information mit DC in Lymphknoten 10 Aktivierung der T-Zellen - DC/T-Zell-Interaktion B Die B-Lymphozyten D - Treffen in Lymphorganen auf spezifische T-Zellen Nächste Folie 11 Die B-Lymphozyten D - Aktivierung führt zur Produktion von Antikörpern Die B-Lymphozyten D - Aktivierung führt zur Produktion von Antikörpern 1 3 2 12 Die B-Lymphozyten D - Aktivierung führt zur Produktion von Antikörpern 4 Die Immunglobuline - Humoraler Teil der spezifischen extrazellulären Abwehr D Antikörper gegen Antigene Glykoproteine, bestehend aus Polypeptidketten mit unterschiedlichen Zuckeranteil B-Zellen exprimieren Ig an ihrer Oberfläche = BCR! Antikörper-produzierende Zellen, die Ig an Umgebung abgeben = Plasmazellen 13 Die Funktionen der Immunglobuline Funktionen Antikörper neutralisieren binden an andere Zelltypen aktivieren das Kompliment Antigene binden (jedes Immunglobulin kann dabei nur an ein bestimmtes Antigen binden an die spezifische antigene Determinante = Epitop) Valenz: mindestens 2, IgA = 4, IgM = 10 Die Funktionen der Immunglobuline Bindung eines Antikörpers an ein Antigen: oft keine unmittelbaren Auswirkungen auf das Antigen erst, wenn weitere Effektor-Funktionen ins Spiel kommen (abhängig von der Bindung des Antikörpers an sein Antigen und Art der Antikörper-Moleküle) Neutralisation: Pathogen und/oder seine Produkte binden und sie damit zu neutralisieren (bakterielle Toxine, Oberfläche von Viren oder Bakterien) Bindung an verschiedene Zellarten: Phagozyten, Lymphozyten, Dendritische Zellen, Thrombozyten, Mastzellen und Basophile tragen an ihrer Oberfläche Rezeptoren (Fc Rezeptoren) Phagozytose wesentlich besser 14 Die Funktionen der Immunglobuline binden auch an derartige Rezeptoren auf den Throphoblastzellen der Plazenta mütterlichen Ig durch die Plazenta in den fetalen Kreislauf schützen das Ungeborene vor Infektionen Komplementbindung und – aktivierung: Antikörper können durch Bindung an bestimmte Komplementkomponenten zur Aktivierung des Komplementsystems führen Lyse der beladenen Mikroorganismen, dabei Freisetzung von biologisch aktiven Mediatorsubstanzen und zur Beladung der Erreger mit bestimmten Komplementkomponenten noch bessere Opsonisierung Die unterschiedlichen Immunglobuline unterschiedliche Funktionen brauchen unterschiedliche Antikörper: erreicht durch Klassenswitch über Zytokine diese beeinflussen das von den T-Zellen geschaffene Zytokinmilieu spezifische DNA-Sequenzen (switch-region) regulieren die Rekombination Isotyp-switch wird durch Transkriptionsfaktoren (Switchfactors) induziert Isotyp-switch findet im Lymphknoten (Keimzentrum) statt erfordert ein spezifisches Milieu aus Zytokinen, die ihrerseits die Switchfaktoren aktivieren 15 Die unterschiedlichen Immunglobuline unterschiedliche Funktionen brauchen unterschiedliche Antikörper: erreicht durch Klassenswitch über Zytokine diese beeinflussen das von den T-Zellen geschaffene Zytokinmilieu spezifische DNA-Sequenzen (switch-region) regulieren die Rekombination Isotyp-switch wird durch Transkriptionsfaktoren (Switchfactors) induziert Isotyp-switch findet im Lymphknoten (Keimzentrum) statt erfordert ein spezifisches Milieu aus Zytokinen, die ihrerseits die Switchfaktoren aktivieren Die unterschiedlichen Immunglobuline ...Klassenswitch über Looping-out 16 IgG: Der universale Antikörper Monomere universiellste Immungloblinklasse (kann die meisten Funktionen der Immunglobuline ausüben) häufigstes Immunglobulin im Serum: bis 75% der Antikörper häufigstes und wichtigstes Immunglobulin im Extravaskulärraum (Gewebe) einzige Ig Klasse, die Plazentaschranke überqueren kann (Subklassen können unterschiedlich gut übertreten, IgG2 am schlechtesten) Komplementbindung ist unterschiedlich ausgeprägt, je nach Subklasse (IgG4 bindet das Komplement nicht) Makrophagen, Monozyten, PMN und manche Lymphozyten haben Rezeptoren für Fc-Region von IgG (Subklassen binden unterschiedlich gut: IgG2 und IgG4 z.B. gar nicht) IgG ist somit ein gutes Opsonin IgM: Der erste Antikörper Pentamere jeweils alle schweren und leichten Ketten ident, die Valenz beträgt maximal 10, Aufbau des Pentamers mit J-Kette, die durch Disulfidbrücken an 2 schwere Ketten gebunden ist Größe verhindert Diffusion ins Gewebe IgM wird als erstes vom Fetus produziert auch das erste Immunglobulin, das von einer naiven B-Zelle produziert wird, wenn sie durch ein Antigen aktiviert wird Aufgrund seiner pentameren Struktur kann IgM das Komplement besonders gut binden IgM kann gut agglutinieren: Mikroorganismen und Antikörper verklumpen miteinander, die Keime werden eliminiert 17 IgA: Der sezernierte Antikörper im Serum als Monomer, in Sekreten als Dimer auch hier ist eine J-Kette mit den beiden schweren (alpha) Ketten verbunden In Sekreten ist IgA mit einem weiteren Protein zusammen, dem sekretorischen Stück (ist der verbleibende Rest des poly-Ig Rezeptors für den Transport durch die Epithelzellen notwendig (wird von den Epithelzellen produziert und an ihrer basalen Seite exprimiert) sekretorisches Stück beschützt das sezernierte IgA davor, in den Sekreten verdaut zu werden IgA ist der wichtigste Antikörper in Sekreten wie Tränen, Speichel, Kolostrum, Schleim besonders wichtig zur Ausbildung der lokalen (mukosalen) Immunantwort (Neutralisation) IgD: Der unbekannte Antikörper nur als Monomere IgD: IgD nur in sehr geringen Mengen im Serum Mission unknown Bedeutung ist unklar IgD wird auf der Oberfläche von reifen naiven B-Zellen gefunden und fungiert dort als Antigenrezeptor 18 IgE: Der allergische Antikörper nur Monomere IgE ist das seltenste Immunglobulin im Serum auch ohne Antigen bindet es an Oberfläche von Basophilen und Mastzellen an Fc Rezeptoren für IgE (FcεRI+II) an allergischen Reaktionen beteiligt: bindet ein Antigen an z wei oberflächengebundene IgE-Moleküle gleichzeitig Quervernetzung der Fc Rezeptoren der Mastzelle Freisetzung von pharmakologisch aktiven Substanzen, die die klinische Symptomatik der Allergie hervorrufen wichtige Rolle bei der Abwehr von parasitären Wurmerkrankungen gute Opsonine: IgE-Moleküle binden an Antigene auf den Parasiten docken sie an Fc Rezeptoren von Eosinophilen an Abtöten der Parasiten Die Funktionen der Immunglobuline +++ ++ + * dominierend weniger wichtig sehr selten Opsonin bei bestimmten Fc-Rezeptor-Allotyp (50% der weißen Bevölkerung) 19 Die Verteilung der Immunglobuline Die Produktion der Immunglobuline Spezifische Immunfaktoren • Sekretorisches Immunglobulin A (sIgA) • IgA: der (mg/Tag) prominenteste Isotyp Produktion IgA in der Mukosa IgG • Meist produzierte Ig-Klasse, 2/3 davon ist sIgA Zirkulation 2100 2100 • Hauptquelle: Knochenmark Saliva 200 2 Tränen 5 ? Galle 400 160 Kleines Intestinum 5200 600 Grosses Intestinum 1200 140 Nasopharynx 45 15 Urin 3 3 Total 9200 3000 sc J Mestecky 1986; Clin Immunol Immunopathol. 20 Immunologisches Gedächtnis 1. humoral: 1. Prä-existierende Antikörper 2. Gedächtnis-B-Zellen in sek. Lymphorganen exprimieren hoch-affine BZR (IgM-IgD-CD27+) rasche Sekundär-AK-Antwort 3. Langlebige Plasmazellen in KM kaum BZR (ausdifferenziert, können nur mehr AK in bestimmter Menge und Art produzieren ohne Ag-Stimulation, lebenslang?) 2. zellulär: 1. CD8 T-Gedächtniszellen unterschiedliche Subsets effektor memory T (Tem) und central memory (Tcm): a. TCM in sek. Lymph., wenig Effektorfunktion b. TEM in peripherem Gewebe rasche zytotoxische Antwort Kalia et al., Differentiation of memory B and T cells, Curr Opin Immunol 2006 Überempfindlichkeits-Reaktionen 21 Autoimmunreaktionen Typ II Autoimmunreaktionen Typ II - Beispiel Effekte von Typ II: Komplementaktivierung (klassisch) und dadurch Zelllyse ADCC (NK, MΦ Φ, Neutros, Eos, Monos) Opsonisierung und weiters Phagozytose betrifft nur Gewebe/Zellen/Organe, welche das Antigen tragen 22 Autoimmunreaktionen Typ III Autoimmunreaktionen Typ IV 23 Toleranzmechanismen Antikörper-Moleküle und T-Zellen-Rezeptoren können jedes andere Molekül erkennen, ob fremd oder körpereigen, sogar künstlich synthetisierte das Immunsystem ist bezüglich seiner Eigenschaft Antigene zu erkennen vollständig Toleranzmechanismen gegenüber „selbst“ sowie „fremd-ungefährlich“ von entscheidender Bedeutung T-Zellen B-Zellen Zentrale Toleranz (rezessiv) Im Thymus: mTEC-Ag erkannt Apoptose = klonale Deletion, Elimination Im KM: Stromazelle klonale Deletion= Elimination oder neuer Rezeptor Periphere Toleranz (dominant) • klonale Anergie • mangelnde Kommunikation = Ignoranz • klonale Anergie • klonale Ignoranz Toleranzmechanismen - Zentrale Toleranz der T-Zellen 24 Toleranzmechanismen - Periphere Toleranz der T-Zellen 1. 2. 3. 4. Apoptose = klonale Elimination, Deletion Anergy = funktionelle Nicht-Reaktivität Aktive Suppression durch regulatorische T-Zellen Mangelnde Kommunikation = klonale Ignoranz: isolierte Moleküle in ZNS und Augen; fehlende MHC IIMoleküle; Antigen unterhalb Schwellenwert exprimiert spezifische T-Zellen weder aktiviert noch deletiert Toleranzmechanismen - Periphere Toleranz der T-Zellen 1. Apoptose Induktion von Activation-induced cell death (AICD) von T-Zellen: nach Restimulierung von kürzlich aktivierten CD4+ T-Zellen kommt es zur Induktion von Fas-Ligand (FasL) und Fas bei Bindung dieser beiden (auf Zelle selbst) oder durch nahe T-Zellen Apoptose Verstärkt durch IL-2, also wenn viele T-Zellen aktiviert werden Deletion-induzierte Toleranz (FasL auch von HIV induziert, FasL auch auf Tumorzellen exprimiert) 25 Toleranzmechanismen - Periphere Toleranz der T-Zellen Toleranzmechanismen - Periphere Toleranz der T-Zellen 2. Anergy * Geringe Interaktion von DC und T-Zellen * Geringe Menge an co-stimulatorischen Molekülen und MHC Molekülen * Geringe Affinität des TCR zum MHC/Peptid Komplex * Antigen-Erkennung parallel mit CTLA-4 statt CD28 (auf T-Zellen) und B7 (auf DC) 26 Toleranzmechanismen - Periphere Toleranz der T-Zellen Toleranzmechanismen - Periphere Toleranz der T-Zellen 3. Regulatorische T-Zellen * Charakterisiert durch die Produktion von immunsuppressiven Faktoren: IL-10, TGF-β * T-reg entstehen im Thymus (erkennen Selbst-Antigen) * T-reg unterdrücken TH1 und TH2-Antworten 27 Toleranzmechanismen - Periphere Toleranz der T-Zellen Toleranzmechanismen - Periphere Toleranz der T-Zellen 28 Toleranzmechanismen - Periphere Toleranz der T-Zellen ! Lucy S.K. Walker & Abul K. Abbas: THE ENEMY WITHIN: KEEPING SELF-REACTIVE T CELLS AT BAY IN THE PERIPHERY Nature Reviews Immunology 2, 11-19 (2002); doi:10.1038/nri701 Toleranzmechanismen - Zentrale Toleranz der B-Zellen Bindung von multivalenten, membranständigen Liganden (Zellmembran-Moleküle, dsDNA...) Elimination im KM oder Veränderung des Rezeptors (2. Chance) 29 Toleranzmechanismen - Periphere Toleranz der B-Zellen B-Zelle erkennt lösliches Antigen und/oder Antigen ohne T-Zell-Hilfe 1. Anergie und 2. Ausschluss aus Lymphfollikel (durch Verlust der Chemokin-Rezeptoren) daher keine Aktivierung zur Ak-Produktion möglich (wichtig für Toleranz von NM und Kommensalen) Selbst-Toleranzmechanismen - Zusammenfassung Feature T lymphocytes B lymphocytes Principal sites of tolerance induction Thymus (cortex); periphery Bone marrow; periphery Tolerance-sensitive stage of maturation CD4+CD8+ (double positive) thymocyte Immature (IgM+IgD-) B lymphocyte Stimuli for tolerance induction Central: high-avidity recognition of antigen in thymus Central: recognition of multivalent antigen in bone marrow Peripheral: antigen presentation by APCs lacking costimulators; repeated stimulation by self antigen Peripheral: antigen recognition without T cell help or second signals Principal mechanisms of tolerance Central tolerance: deletion (apoptosis); development of regulatory T cells Peripheral tolerance: anergy, apoptosis, suppression Peripheral tolerance: block in signal transduction (anergy); failure to enter lymphoid follicles; apoptosis Central tolerance: deletion (apoptosis); receptor editing 30 Ergänzung Spezifische Abwehr [email protected] 1. Warum E. coli im Darm harmlos aber im Urogenitaltrakt problematisch? Das Keimspektrum der Harnwegsinfektionen setzt sich aus fakultativ anaeroben Bakterien der Darmflora zusammen, wobei E. coli als Leitkeim zu nennen ist. 80 Prozent der unkomplizierten HWI und etwa 40 Prozent der komplizierten HWI werden durch E. coli vom uropathogenen Typ (UPEC) verursacht. Im Unterschied zu anderen fäkalenE. coli-Stämmen exprimieren sie typische Pathogenitäts- und Vitalitätsfaktoren: 1. fimbrielle Adhäsine (P-, S-, F1C-Fimbrien) (Kolonisation von Harnwegsepithel), 2. Polysaccharidkapseln (Resistenz gegen Serumkomplement und Phagocytose), 3. porenbildende Cytotoxine (Hämolysine), 4. spezifische Eisenkomplexone, zum Beispiel das Siderophor Aerobaktin. Darüber hinaus findet man die O-Serotypen O4, O6, O18 und O75 gehäuft bei UPEC. Bei anderen HWIErregern wie Proteus mirabilis und Staphylococcus saprophyticus scheint auch die Ureasebildung, die durch Harnstoffhydrolyse den Harn alkalisiert und die Phosphatsteinbildung begünstigt, zur Uropathogenität beizutragen. Für die Kolonisierung ist die Interaktion von bakteriellen Adhäsinen mit Wirtszellrezeptoren von Bedeutung. Wirtsfaktoren, die insbesondere Reinfektionen begünstigen, sind die Blutgruppenzugehörigkeit, der Sekretorstatus und die Fähigkeit, bestimmte Glykoproteine (zum Beispiel Tamm-Horsfall-Protein, THP) auszuscheiden. Da das P-Blutgruppenantigen auf den Uroepithelzellen den Rezeptor für P-Fimbrien darstellt, zeigen Personen, die für diese Blutgruppe negativ sind (p-Status), ein vermindertes Risiko für Harnwegsinfektionen. Das THP wiederum bindet S-Fimbrien und dient somit als "Falle" für potentiell uropathogene Bakterien; erhöhte THPSekretion senkt also das Risiko für eine Harnwegsinfektion. Siehe auch: http://www.mpiib-berlin.mpg.de/research/neisseria_VL2.pdf 2. Gibt es Anergie im Thymus? Ja. Auch die natürlich vorkommenden T-regulatorischen (CD4+CD25+) Zellen sind anergische T- Zellen aus dem Thymus. Papers: * Roberts JL et al: Clonal deletion and clonal anergy in the thymus induced by cellular elements with different radiation sensitivities. J Exp Med. 1990 Mar 1;171(3):935-40. Abstract: The present study demonstrates that immune tolerance can be achieved in the thymus both by clonal deletion and by clonal inactivation, but that the two tolerant states are induced by cellular elements with different radiation sensitivities. TCR engagement of self antigens on bone marrow-derived, radiation-sensitive (presumably dendritic) cells induces clonal deletion of developing thymocytes, whereas TCR engagement of self antigens on radiation-resistant cellular elements, such as thymic epithelium, induces clonal anergy. The nondeleted, anergic thymocytes can express IL-2-Rs but are unable to proliferate in response to either specific antigen or anti-TCR antibodies, and do develop into phenotypically mature cells that emigrate out of the thymus and into the periphery. * Misako Itoh et al.: Thymus and Autoimmunity: Production of CD251CD41 Naturally Anergic and Suppressive T Cells as a Key Function of the Thymus in Maintaining Immunologic Self-Tolerance1. J Immunol 1999 * Ramsdell, F., and B. J. Fowlkes. 1990. Clonal deletion versus clonal anergy: the role of the thymus in inducing self tolerance. Science 248:1342. 3. Anergische T-Zellen führen auch andere T-Zellen in die Anergie? Ja (siehe Skriptum Prof. Stockinger Block 8, Seite 19) 4. Müssen Protein, welche über MHC I präsentiert werden und daher zur Beladung ins ER gelangen, vorher ubiquitiniert werden? Nicht unbedingt. Mechanismus noch nicht genau geklärt. Dissertation: Antje Voigt: Prozessierung des pp89 MCMV MHC Klasse I Epitops durch das Proteasom. 2004. Humboldt-Universität zu Berlin, Medizinische Fakultät - Universitätsklinikum Charité. “….Demzufolge ist für die Generierung von viralen Epitopen ein Proteasom-abhängiger, aber Ubiquitinunabhängiger Abbauweg denkbar.“