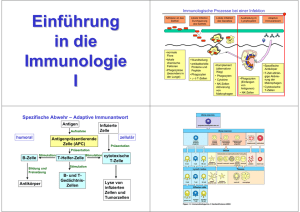
Das Adapterprotein Grb2 in B- und T-Lymphozyten der Maus
Werbung

Das Adapterprotein Grb2 in B- und TLymphozyten der Maus Der Naturwissenschaftlichen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades Dr. rer. nat. Vorgelegt von Daniel Radtke aus Berlin Als Dissertation genehmigt von der Naturwissenschaftlichen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 29.01.2015 Vorsitzender des Prüfungsorgans: Prof. Dr. Jörn Wilms Gutachter: Prof. Dr. Lars Nitschke Prof. Dr. David Vöhringer 1 Inhalt 2 Zusammenfassung .................................................................................................................... 1 3 SUMMARY ............................................................................................................................. 3 4 Einleitung ................................................................................................................................. 4 4.1 B-Zell Entwicklung .......................................................................................................... 4 4.2 Transitionale B-Zellen ...................................................................................................... 6 4.3 Keimzentrumsreaktion und Gedächtnis B-Zellen ............................................................ 7 4.4 Der B-Zell Rezeptor in der Aktivierung von B-Zellen des IgM und des IgG Isotypes .... 8 4.5 B-Zell Rezeptor Signalleitung ........................................................................................ 10 4.6 T-Zell Entwicklung ........................................................................................................ 11 4.7 T-Helferzellen................................................................................................................. 14 4.8 Die Experimentelle autoimmune Enzephalomyelitis (EAE) ein Mausmodell für Multiple Sklerose im Menschen ................................................................................................. 17 4.9 Das Adapterprotein „growth factor receptor bound protein 2” ...................................... 19 4.10 Die Rolle von Grb2 in B-Zellen ..................................................................................... 20 4.11 Die Rolle von Grb2 in T-Zellen ..................................................................................... 24 5 Zielsetzung der Arbeit ............................................................................................................ 27 6 Ergebnisse .............................................................................................................................. 29 6.1 B-Zell spezifische Grb2 Knockoutmaus......................................................................... 29 6.1.1 Kein Einfluss von Grb2 auf die in vitro Überlebensrate von B-Zellen .................. 29 6.1.2 Grb2 spielt eine wichtige Rolle in der Entwicklung von unreifen zu reifen B-Zellen 33 6.1.3 Die Rolle von Grb2 in der B-Zell Signalleitung transitionaler und reifer B-Zellen 46 6.1.4 Einfluss von Grb2 auf die FcγR2b Expression ....................................................... 50 6.1.5 Einfluss von Grb2 auf die B-Zell Immunantwort ................................................... 54 6.1.6 Keine erhöhte Autoimmunität in alternden Grb2fl/fl mb1cre/+ Mäusen .................... 75 6.2 6.2.1 T-Zell spezifische Grb2 Knockoutmaus ......................................................................... 78 Erfolgreiche gewebespezifische Depletion von Grb2 in T-Zellen ......................... 78 6.2.2 Die T-Zell spezifische Grb2 Defizienz beeinträchtigt die frühe T-Zell Entwicklung 80 6.2.3 T-Zell spezifische Grb2 defiziente Mäuse zeigen eine reduzierte Zahl an CD4+ und CD8+ T-Zellen im Thymus und in der Peripherie, zudem ist der Anteil der aktivierten CD4 und CD8 T-Zellen in der Milz erhöht. ................................................................................... 82 6.2.4 Die T-Zell spezifsiche Grb2 Defizienz beeinflusst die Zahl von naiven und Gedächtnis T-Zellen in der Peripherie ................................................................................... 86 6.2.5 Kein großer Einfluss von Grb2 auf die Ca2+ Signalleitung im Thymus nach TZR- Stimulation ............................................................................................................................. 90 6.2.6 Erhöhte Zahl von γδ T-Zellen in Teilen der Peripherie und Tendenz zu einer Erhöhung im Thymus von T-Zell spezifischen Grb2 defizienten Mäusen ............................ 92 6.2.7 Inhibitorischer Einfluss von Grb2 auf die TH17 Differenzierung in vitro, so wie veränderte Treg und unveränderte TH1 und TH2 Differenzierung ............................................. 94 6.2.8 Ex vivo Analysen von CD4-Effektorzellen zeigen einen Einfluss von Grb2 abhängig vom Deletionszeitpunkt durch die Cre Rekombinase ............................................ 96 6.2.9 T-Zell spezifische Grb2 defiziente Mäuse entwickeln eine schwächere experimentelle autoimmune Enzephalomyelitis, die ein Mausmodell für multiple Sklerose im Menschen ist .......................................................................................................................... 98 6.2.10 Verringerte Aktivierbarkeit von Grb2 defizienten CD4+ T-Zellen durch dendritische Zellen im gemischten Lymphozyten Versuch ................................................. 108 7 8 Diskussion ............................................................................................................................ 110 7.1 Einfluss von Grb2 auf die B-Zell Entwicklung und das Überleben von B-Zellen ...... 110 7.2 Bedeutung von Grb2 für die FcγR2b Expression und Signalleitung ........................... 114 7.3 Die Rolle von Grb2 in der Keimzentrumsreaktion ...................................................... 115 7.4 Einfluss von Grb2 auf die sekundäre Immunantwort und Gedächtnis B-Zellen ......... 116 7.5 Grb2 – Mögliche Autoimmunität in alternden Mäusen ............................................... 120 7.6 Einfluss von Grb2 auf B1 B-Zellen ............................................................................. 121 7.7 Die Rolle von Grb2 in der T-Zell Entwicklung ........................................................... 122 7.8 Grb2 und T-Effektorzellen der CD4+ Population ........................................................ 126 7.9 Die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell ............................... 129 Material ................................................................................................................................ 133 8.1 9 Antikörper .................................................................................................................... 133 8.1.1 Antikörper Durchflusszytometrie und Streptavidinkonjugate .............................. 133 8.1.2 Antikörper ELISA ................................................................................................ 134 8.1.3 Antikörper für magnetische Zellseperation / komplement vermittelte Lyse ........ 134 8.1.4 Antikörper Western-Blot ...................................................................................... 134 8.2 Chemikalien und Labormaterial ................................................................................... 134 8.3 Computerprogramme .................................................................................................... 136 8.4 Geräte ........................................................................................................................... 136 8.5 Kommerzielle Kits........................................................................................................ 137 8.6 Lösungen, Medien und Puffer ...................................................................................... 137 8.7 Stimulanzien / Antigene / Immunisierungszusätze ...................................................... 141 8.8 Zytokine........................................................................................................................ 142 Methoden .............................................................................................................................. 143 9.1 Aufarbeitung muriner Zellen und durchflusszytometrische Analyse ........................... 143 9.1.1 Zentrifugation ....................................................................................................... 143 9.1.2 Organentname und Aufbereitung von murinen Zellen ......................................... 143 9.1.3 Bestimmung der Gesamtzellzahl mit einer Neubauer Zählkammer ..................... 143 9.1.4 Durchflusszytometrische Messungen ................................................................... 144 9.1.5 Durchflusszytometrische Bestimmung der Lebend/Gesamtzellzahl mit Partikeln und Propidiumiodid .............................................................................................................. 144 9.1.6 9.2 Messung der Calciummobilisierung nach Rezeptorstimulation in Lymphozyten 145 Aufreinigung von B- und T-Zellen............................................................................... 145 9.2.1 Zellsortierung über magnetische Partikel (MACS) .............................................. 145 9.2.2 Komplement-vermittelte T-Zelllyse zur B-Zell Anreicherung............................. 147 9.3 Untersuchungen zur Apoptose, Proliferation und Differenzierung von B-Zellen ........ 148 9.3.1 In vitro B-Zell Reifung ......................................................................................... 148 9.3.2 Messung der spontanen Apoptoserate in vitro mittels DAPI-Färbung ................. 148 9.3.3 Toll Like Rezeptor (TLR) Stimulation und 3H-Tritiumthymidin Proliferationsassay 148 9.4 Untersuchungen zur Apoptose, Proliferation und Differenzierung von T-Zellen ........ 149 9.4.1 T-Zell Proliferationsassay .................................................................................... 149 9.4.2 Allogener gemischter Lymphozytenversuch........................................................ 149 9.5 Genexpressionsanalysen und Polymerase Kettenreaktion ........................................... 150 9.5.1 Realtime PCR – B-Zell Subpopulationen ............................................................ 150 9.5.2 RNA Isolierung mit Trizol und Chloroform ........................................................ 152 9.5.3 RNA Isolierung über Säulen ................................................................................ 152 9.5.4 cDNA Synthese .................................................................................................... 152 9.5.5 Detektion eines spezifischen RNA Abschnittes als Zeichen für einen Klassenwechsel zu IgG1 ...................................................................................................... 153 9.5.6 DNA-Aufreinigung aus Ohr- und Schwanzbiopsien ........................................... 153 9.5.7 Polymerase Kettenreaktion (PCR) ....................................................................... 155 9.5.8 Agarose Gelelektrophorese .................................................................................. 159 9.6 Untersuchungen zu Autoimmunität ............................................................................. 159 9.6.1 Detektion von Autoantikörpern gegen Zellkomponenten von Hep-2 Zellen ....... 159 9.6.2 BUN - Harnstoff-Stickstoffgehalt im Blut ........................................................... 159 9.7 ELISA - Enzyme Linked Immunosorbent Assay......................................................... 160 9.7.1 ELISA - Glykoprotein B / virusartige Partikel von humanem hCMV ................. 160 9.7.2 ELISA auf 4-Hydroxy-3-nitrophenyl (NP) und CGG.......................................... 161 9.7.3 ELISA auf dsDNA ............................................................................................... 161 9.7.4 ELISA auf Antikörper Subklassen ....................................................................... 162 9.8 ELISPOT...................................................................................................................... 162 9.9 Immun-Histologie ........................................................................................................ 163 9.9.1 Einbetten von Organen......................................................................................... 163 9.9.2 Erstellen von Kryoschnitten ................................................................................. 163 9.9.3 Immunhistologische Färbung ............................................................................... 164 9.10 Proteinbiochemische Methoden ................................................................................... 165 9.10.1 SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE) ........................................ 165 9.10.2 Western Blot und Signaldetektion über Röntgenfilm .......................................... 165 9.11 Untersuchung von T-Helferzellen ................................................................................ 166 9.11.1 In vitro T-Zell Differenzierung............................................................................. 166 9.11.2 Intrazelluläre Färbung von Zytokinen .................................................................. 167 9.11.3 Intrazelluläre FoxP3-Färbung ............................................................................... 168 9.11.4 Ex vivo T-Zell Analyse ......................................................................................... 169 9.11.5 Cytometric Bead Array (CBA) zur Bestimmung von sekretierten Zytokinen ..... 169 9.12 Immunisierungen und Mausversuche ........................................................................... 170 9.12.1 Intravenöse (i.v.) Injektion ................................................................................... 170 9.12.2 NP-CGG / NP-KLG / CGG Immunisierung......................................................... 170 9.12.3 Immunisierung mit Glykoprotein B und virusartigen Partikeln (VLPs) des humanen Zytomegalieviruses ............................................................................................... 170 9.12.4 Immunisierung mit Schafserythrozyten zur Keimzentrumsanalyse ..................... 170 9.12.5 NK-Zell Depletion ................................................................................................ 171 9.12.6 Adoptiver Zelltransfer .......................................................................................... 171 9.12.7 Serumgewinnung .................................................................................................. 172 9.12.8 Experimentelle autoimmune Enzephalomyelitis (EAE) ....................................... 172 9.12.9 Arbeit mit Versuchstieren und verwendete Mausstämme .................................... 173 10 Literaturverzeichnis .......................................................................................................... 174 11 Anhang ..................................................................................................................................I 11.1 Abbildungsverzeichnis ......................................................................................................I 11.2 Tabellenverzeichnis ........................................................................................................ IV 11.3 Abkürzungsverzeichnis ................................................................................................... V 12 Danksagung ..................................................................................................................... VIII 13 Publikationsliste .................................................................................................................. X Zusammenfassung 2 Zusammenfassung Das Adapterprotein growth factor receptor bound protein 2 (Grb2) ist ein kleines, hoch konserviertes Protein von 25-30 kDa und verfügt über eine zentrale Src homology 2 (SH2) und zwei flankierende Src homology 3 (SH3) Domänen. Grb2 besitzt keine katalytische Funktion, sondern trägt dazu bei proximale, rezeptorvermittelte Signale weiterzuleiten und zu modulieren. B-Zell spezifische Grb2-/- Mäuse zeigen eine verringerte B-Zellzahl in der Peripherie. Grb2 hat keinen Einfluss auf die Apoptose von peripheren B-Zellen, sondern ist entscheidend in der B-Zell Entwicklung, was die reduzierten B-Zell Zahlen erklärt. B-Zell spezifische Grb2-/- Mäuse haben einen Block in der B-Zell Entwicklung, der in den unreifen B-Zellen im Knochenmark beginnt, aber in den transitionalen B-Zellen der Milz am deutlichsten wird. Grb2 wirkt fördernd auf Gene, die in transitionalen B-Zellen hoch reguliert werden und mit der PI3K Signalleitung in Verbindung stehen. Dies lässt vermuten, dass die PI3K Signalleitung am B-Zell Block beteiligt ist. Grb2 bindet in vitro direkt an die immunoglobulin tail tyrosine (ITT) Bindestelle im IgG- und IgE- B-Zell Rezeptor (BZR) und verstärkt so das BZR Signal. Durch den Transfer einer definierten Zahl an IgG Gedächtniszellen und einer erneuten Immunisierung der Empfängertiere zur Reaktivierung der Gedächtnis B-Zellen wurde gezeigt, dass Grb2 die Gedächtnisantwort auch in vivo zellintrinsisch fördert. Dieser Effekt ist unabhängig von T-Zell Hilfe. Der positive B-Zell intrinsiche Effekt von Grb2 auf die Gedächtnisantwort hängt vermutlich mit einer Bindung an die immunoglobulin tail tyrosine (ITT) Bindestelle im IgG BZR zusammen. Vorausgegangene Studien haben gezeigt, dass Grb2 in T-Zellen eine wichtige Rolle in der positiven und negativen Selektion von T-Zellen spielt. Grb2fl/fl Lckcretg Mäuse, die Grb2 früh in der T-Zell Entwicklung deletieren, haben eine drastisch reduzierte Zahl an T-Zellen in der Peripherie. Eine spätere Deletion von Grb2 in CD4+CD8+ T-Zellen des Thymus (Grb2fl/fl CD4cretg Mäuse) führt zu einer milderen Reduktion der T-Zellen in der Peripherie. T-Zell spezifische Grb2-/- Mäuse weisen einen milderen Krankheitsverlauf im autoimmunen Enzephalomyelitis Modell (EAE) auf als wildtyp Mäuse. Durch das fehlende Grb2 entwickeln sich weniger TH1 und TH17 Zellen, welche die EAE fördern, während mehr regulatorische TZellen gebildet werden, die inhibierend auf die Krankheit wirken. Dies hängt wahrscheinlich mit einer reduzierten Aktivierbarkeit der Grb2-/- T-Zellen durch antigenproduzierende Zellen zusammen. Damit ist Grb2 ein positiver Faktor für die Entwicklung von T H1 und TH17 Zellen und ein negativer Faktor für die Entwicklung von T-reg Zellen in der EAE. Mechanistisch fördert 1 B-Zell Entwicklung Zusammenfassung Grb2 die Produktion von IL-6 und könnte so das Verhältnis von TH17 zu regulatorischen T-Zellen zu Gunsten der proinflammatorischen TH17 T-Zellen verschieben. Zusammengefasst hat Grb2 wichtige, nicht redundante Funktionen bei der Entwicklung von Lymphozyten und der Funktion von Effektorlymphozyten. 2 B-Zell Entwicklung SUMMARY 3 SUMMARY Growth factor receptor bound protein 2 (Grb2) is a small, ubiquitously expressed and strongly conserved adapterprotein of 25-30 kDa. It contains one central Src homology 2 (SH2) and two neighboring Src homology 3 (SH3) domains and has no catalytic activity. Adapter proteins transmit and modulate proximal signals from receptors to distal functions. B-cell specific Grb2-/- mice show reduced B cell numbers in the periphery. Grb2 does not influence apoptosis of peripheral B cells but it is crucial for B cell development which explains the reduced B cell numbers. B-cell specific Grb2-/- mice show a block in B cell development which starts in immature B cells of the bone marrow but is most distinct in transitional B cells of the spleen. Grb2 forces the expression of genes that are upregulated in transitional B cells and are related to PI3K signaling. This implies that impaired PI3K signaling is a reason for the block in B cell development. Grb2 binds directly to the immunoglobulin tail tyrosine binding site of the IgG and IgE B-cell receptor in vitro which enhances B-cell receptor signaling. The transfer of defined numbers of IgG memory B-cells in recipient mice that are immunized afterwards to reactivate the IgG memory cells shows that Grb2 enhances the memory response of B cells in vivo and in a B-cell intrinsic fashion. This effect is independent of T-cell help. Grb2 enhances the memory response B cell intrinsically which is probably related to its binding to the immunoglobulin tail tyrosine binding site of the IgG B-cell receptor. It has previously been shown that Grb2 has crucial functions in positive and negative selection of T cells. Grb2fl/fl Lckcretg mice where Grb2 is deleted early in development show a drastically reduced number of T cells in the periphery. If Grb2 is deleted at a later point in development at the CD4+CD8+ stage (Grb2fl/fl CD4cretg mice) the reduction of T cells in the periphery is much weaker. T cell specific Grb2-/- mice show a less severe course of disease in an autoimmune encephalomyelitis model (EAE). Without Grb2 less TH1 and TH17 cells develop that elevate EAE severity whereas more regulatory T-cells develop that inhibit EAE. This seems to be related to a reduced activation potential of Grb2-/- T cells through antigen presenting cells. Therefore Grb2 is a positive factor for the development of TH1 and TH17 cells but a negative factor for the development of regulatory T cells in EAE. Mechanistically Grb2 also elevates the production of IL-6 which influences the ratio of TH17 and regulatory T cells and more proinflammatory TH17 T cells develop. In summary Grb2 has crucial and non redundant functions in lymphocyte development and in the effector functions of lymphocytes. 3 B-Zell Entwicklung Einleitung 4 Einleitung 4.1 B-Zell Entwicklung B-Lymphozyten bilden einen wichtigen Teil des humoralen Immunsystems. Sie sind in der Lage spezifische B-Zell Rezeptoren (BZR) zu bilden, deren lösliche Form sie auch als Antikörper sekretieren können. B-Zellen sind über die Rekombination von Gensegmenten (V, D, J) fähig, ein breites Spektrum an BZRs mit verschiedenen Spezifitäten zu generieren, wobei jede B-Zelle nur BZRs und Antikörper einer Spezifität exprimiert. Der BZR besteht aus zwei schweren und zwei leichten Ketten und hat eine variable und eine konstante Region. Die variable Region vermittelt die spezifische Bindung an ein Antigen, während die konstante Region bei Antikörpern für Effektorfunktionen zuständig ist. Die Generierung des Antikörperrepertoires erfordet strenge Selektionsprozesse, um zu verhindern, dass Antikörper gegen körpereigene Antigene gebildet werden (Miosge & Goodnow 2005; Goodnow et al. 2010). B-Zellen, die über ihren BZR spezifisch ein fremdes Antigen erkennen, können hingegen expandieren, zu antikörperproduzierenden Plasmazellen differenzieren, ihre Avidität und Affinität zum Antigen in Keimzentrumsreaktionen verbessern, zu B-Gedächtniszellen werden und einen Klassenwechsel zu einer anderen Immunglobulinklasse durchlaufen (Stavnezer et al. 2008; Oracki et al. 2010; Takemori et al. 2014; Shlomchik & Weisel 2012). 4 B-Zell Entwicklung Einleitung Knochenmark Langlebige Plasmazelle Multipotente Stammzelle Frühe lymphoide Vorl. Zelle Gedächtnis B-Zellen Keimzentrums B-Zellen cγ1-cre mb1-cre Pro-B Zelle VDJH Rekombination Naive follikuläre B-Zelle Kurzlebige Plasmazelle Pre-BZR T2 B-Zelle Pre-B Zelle MZ B-Zelle VJL Rekombination BZR Milz/Lymphknoten unreife-B Zelle T1 B-Zelle Blut Abb. 1: Schema B-Zell Entwicklung und Differenzierung zu Effektorzellen. Multipotente Vorläuferzellen entwickeln sich über ein frühes lymphoides Vorläuferstadium, aus dem sich auch T-Zellen entwickeln können zu proB-Zellen, die sich weiter über pre-B-Zellen zu unreifen B-Zellen differenzieren. Diese verlassen das Knochenmark als unreife B-Zellen und werden zu transitionalen B-Zellen (T1/T2), die in die Milz wandern. Dort differenzieren sie zu reifen, naiven B-Zellen oder Marginalzonen B-Zellen (MZ). Während der Entwicklung von pro- zu unreifen B-Zellen rearangieren die Zellen ihre VH,DH und JH Gene für die schwere Kette des B-Zell Rezeptors (BZR) und ihre VL, JL Gene für die leichte Kette des BZR, der dann auf der Oberfläche von unreifen B-Zellen zum ersten Mal exprimiert wird. Die naiven B-Zellen können nach einer Aktivierung zu kurzlebigen Plasmazellen, Gedächtniszellen oder Keimzentrumszellen werden. Keimzentrums B-Zellen können zu Gedächtnis B-Zellen oder langlebigen Plasmazellen differenzieren. Dunkelblau: Vorläuferzellen, die sich noch zu anderen Zelltypen außer B-Zellen differenzieren können; Hellblau: B-Zell Stadien; Orange: B-Effektorzellen; rote Schrift: Erste Expression von cre unter verschiedenen Promotoren, wobei Cγ1-cre auch beim Klassenwechsel zu IgG1 B-Zellen aktiviert wird. Quellen: Matthias et al. Nat. Rev. Immunol. 2005, Kurosaki et al. Annu. Rev. Immunol. 2010, Pieper et al. J. Allergy Clin. Immunol. 2013, Shlomchik and Weisel Immunol. Rev. 2012. Sowohl in Mäusen als auch im Menschen werden B-Zellen im Knochenmark schrittweise aus multipotenten Stammzellen generiert. Diese differenzieren zu frühen lymphoiden Vorläuferzellen 5 B-Zell Entwicklung Einleitung und weiter zu pre-pro-B-Zellen (Hardy Fraktionen A), die als erste Population den B-Zell Marker B220 exprimieren und sich weiter zu pro-B-Zellen entwickeln (Hardy Fraktionen B und C). In pro-B-Zellen wird dann auch CD19 exprimiert, das ebenfalls als B-Zell Marker dient. Außerdem werden in diesen frühen B-Zell Stadien RAG-Gene aktiviert, die an der Umlagerung der Gene für den BZR beteiligt sind (Igarashi et al. 2002) und die V-, D- und J- Gene für die schwere Kette des BZRs werden rekombiniert. Im späten pro-B-Zell Stadium wird die VDJ-Rekombination für die schwere Kette des BZR abgeschlossen (Hardy Fraktionen C). Zellen, die es schaffen, eine funktionelle schwere Kette zu generieren, exprimieren einen pre-BZR mit einer vorläufigen leichten Kette (surrogate light chain) und werden unterstützt durch die Signalleitung über den pre-BZR zu pre-B-Zellen (Hardy Fraktionen D). In diesen werden V- und J- Segmente für die leichten Ketten des BZR kombiniert. Nach einer erfolgreichen Kombination wird die vorläufige leichte Kette durch die rekombinierten leichten Ketten ersetzt. Die Zellen werden zu unreifen BZellen (Hardy Fraktionen E), die einen Rezeptor des IgM-Typs exprimieren (Hardy & Hayakawa 2001; Busslinger 2004). Die unreifen B-Zellen wandern als transitionale Typ 1 B-Zellen (T1) in die Milz, wo sie zu transitionalen Typ 2 B-Zellen (T2) und anschließend zu naiven B-Zellen reifen. Während der Reifung von unreifen zu reifen B-Zellen regulieren die Zellen als wichtigen Kontrollpunkt den BAFF-Rezeptor (BAFF-R) hoch. Überlebenssignale, die über den BAFFRezeptor vermittelt werden, sind für das Überleben von transitionalen B-Zellen und naiven reifen B-Zellen entscheidend (Hsu et al. 2002; Yan et al. 2001; Sasaki et al. 2004; Schiemann et al. 2001; Otipoby et al. 2008; Batten et al. 2000). Kürzlich wurde beschrieben, dass der BAFFRezeptor den B-Zell Rezeptor für die Übertragung von Überlebenssignalen benötigt, was diese beiden wichtigen Kontrollpunkte in der B-Zell Entwicklung verbindet (Schweighoffer et al. 2013; Stadanlick et al. 2008). 4.2 Transitionale B-Zellen Transitionale B-Zellen sind eine heterogene Population für die es keine einheitliche Einteilung gibt. Sie wurden zuerst in transitionale Typ 1 (T1) (CD21loIgMhiIgDloCD24hi) und transitionale Typ 2 (T2) B-Zellen (CD21hi/intIgMhiIgDhi CD24hi) unterteilt (Loder et al. 1999). Nach BZR Stimulation proliferieren T2 Zellen, während T1 Zellen in Apoptose gehen (Su & Rawlings 2002; Petro et al. 2002). Später wurde eine alternative Nomenklatur vorgeschlagen, die auf der Expression von AA4.1 (CD93) basiert und bei der T2 B-Zellen als eine Population definiert werden, die nach BZR Stimulation nicht proliferiert (Allman et al. 2001). Es wurde beschrieben, dass die ursprünglich beschriebene T2 B-Zell Population (Loder et al. 1999) mitunter Vorläuferpopulationen für Marginalzonen B-Zellen (Saito et al. 2003; Srivastava et al. 2005; Pillai et al. 2005) und follikuläre B-Zellen enthält (CD21intIgMhiIgDhiCD24hiCD23+) (MeyerBahlburg et al. 2008). 6 Transitionale B-Zellen Einleitung Das Calciumsignal spielt eine wichtige Rolle in der B-Zell Entwicklung und wird abhängig vom Differenzierungsstadium in T1, T2 und reifen B-Zellen unterschiedlich reguliert. In T1 B-Zellen trägt es wahrscheinlich zur Apoptose bei, während es in T2 B-Zellen die B-Zell Reifung fördert (Hoek et al. 2006; Gross et al. 2009). Nach einer Stimulation über den BZR treten T2 B-Zellen schnell in den Zellzyklus ein, aktivieren Akt, welches das Überleben von B-Zellen positiv beeinflusst und regulieren anti-apoptotische Gene hoch, während T1 B-Zellen nach der BZR Stimulation nicht proliferieren, sondern in Apoptose gehen (Carman et al. 1996; Su & Rawlings 2002; Andrews & Rawlings 2009; Petro et al. 2002). Sortierte T2 B-Zellen (Loder et al. 1999) reifen in vitro nach BZR Stimulation zu Zellen aus, lo hi die lo follikulären B-Zellen ähneln, während transitionale Typ 1 (T1) hi (CD21 IgM IgD CD24 ) B-Zellen in Apoptose gehen (Su & Rawlings 2002; Petro et al. 2002). Die Aktivierung von Akt über den PI3K Signalweg ist entscheidend für die Reifung von transitionalen zu reifen oder Marginalzonen B-Zellen und deren Überleben (Calamito et al. 2010). 4.3 Keimzentrumsreaktion und Gedächtnis B-Zellen Keimzentren werden in T-Zell abhängigen Immunantworten in sekundären lymphatischen Organen gebildet. Dazu müssen B-Zellen an der T-B-Zell-Grenze der Milz oder in interfollikulären Regionen der Lymphknoten mit T-Zell- Hilfe aktiviert werden. Hierfür nehmen B-Zellen das beim ersten Kontakt gebundene Antigen auf, prozessieren es so, dass es auf MHCIIMoleküle geladen werden kann und präsentieren es T-Helferzellen. Erkennt eine T-Helferzelle ein präsentiertes Peptid kann sie zur endgültigen Aktivierung der B-Zelle beitragen. Ein Teil der aktivierten B-Zellen differenziert zu kurzlebigen Plasmazellen. Ein anderer Teil der T- und BZellen beginnt nach der Aktivierung B-cell lymphoma-6 (Bcl6) (Kerfoot et al. 2011; Kitano et al. 2011) zu exprimieren. Einige dieser B-Zellen wandern in den Follikel ein und es bilden sich oligoklonale Keimzentren mit stark proliferierenden Blasten. Sie durchlaufen somatische Hypermutation (Apel & Berek 1990; Jacob et al. 1991), die auf den Genbereich beschränkt ist, der für den variablen Bereich des BZR kodiert. Reife Keimzentren können in eine helle und eine dunkle Zone unterteilt werden. Die proliferierenden Blasten bzw. Zentroblasten befinden sich in der dunklen Region. Sie entwickeln sich weiter zu Zentrozyten, die sich dann in der hellen Region befinden und nicht proliferieren. In der hellen Zone befindet sich auch ein Netzwerk von follikulären dendritischen Zellen, die in der Lage sind, Antigene zu präsentieren. Die vorherschende Meinung ist, dass B-Zellen, die durch die somatische Hypermutation affiner für ein Antigen sind, besser an das auf follikulären dendritischen Zellen gebundene Antigen binden und Überlebenssignale von den follikulären dendritischen Zellen bekommen, während weniger affine B-Zellen in Apoptose gehen (Honjo et al. 2002; Liu et al. 1989; MacLennan 1994). Außerdem bekommen die B-Zellen positive Signale durch den Kontakt mit follikulären T- 7 Keimzentrumsreaktion und Gedächtnis B-Zellen Einleitung Helferzellen, welche die humorale Immunität unterstützen, indem sie die Keimzentrumsreaktion, den Klassenwechsel von B-Zellen, die Affinitätsreifung von antikörper produzierenden B-Zellen und lang anhaltende Antikörperantworten fördern. Ihr Einfluss auf Gedächtnis B-Zellen ist weitgehend unklar (Crotty 2011; Yamane & Paul 2013; Shlomchik & Weisel 2012). Die selektionierten B-Zellen können zu langlebigen Plasmazellen oder Gedächtnis-B-Zellen werden. Viele der Keimzentrumszellen vollziehen zusätzlich einen Klassenwechsel (Stavnezer et al. 2008). Gedächtnis-B-Zellen können verschiedene Immunglobulin-Isotypen haben und müssen keinen Klassenwechsel vollzogen haben, wie Berichte über IgM Gedächtniszellen zeigen (Dell et al. 1989; Pape et al. 2011; White & Gray 2000; Dogan et al. 2009; Shlomchik & Weisel 2012; Tomayko et al. 2010; Anderson et al. 2007). Neben der Möglichkeit, dass sich Gedächtnis-BZellen in der Keimzentrumsreaktion bilden gibt es auch Hinweise, dass sich Gedächtnis-B-Zellen auch außerhalb von Keimzentrumsreaktion bilden können. Der Schwellenwert von IgGGedächtniszellen, um über den BZR aktiviert zu werden ist niedriger als bei naiven B-Zellen und sie können nach Aktivierung schneller in den Zellzyklus eintreten (Gagro et al. 2003; Good et al. 2009; Yefenof et al. 1986). Außerdem können Antigene wie virusähnliche Partikel des humanen Zytomegalievirus und Haptene mit verschiedenen Trägerproteinen spezifische Gedächtnis-BZellen auch ohne T-Zell Hilfe reaktivieren (Klinman & Doughty 1973; Hebeis et al. 2004; Weisel et al. 2010). 4.4 Der B-Zell Rezeptor in der Aktivierung von B-Zellen des IgM und des IgG Isotypes IgG- Gedächtnis-B-Zellen können stärker über den BZR aktiviert werden als IgM-B-Zellen. Welche Mechanismen für diesen Unterschied verantwortlich sind, ist bislang nur unvollständig verstanden, doch konnte gezeigt werden, dass Gedächtnis- B-Zellen ein anderes Genexpressionsprofil als naive B-Zellen aufweisen (Bhattacharya et al. 2007; Tomayko et al. 2008). So werden in humanen IgM- und IgG-Gedächtnis B-Zellen KLF4, KLF9 und promyelocytic leukemia zinc finger Transkriptionsfaktoren herunterreguliert, die für die Aufrechterhaltung des ruhenden Zustandes der Zelle wichtig sind (Good & Tangye 2007). Dagegen werden z.B. TNF Rezeptoren und Proteine der Bcl2 Familie hoch reguliert (Good et al. 2009). Für Mäuse wurde beschrieben, dass der Transkriptionsfaktor Bach2 in IgG1-GedächtnisB-Zellen herrunterreguliert ist, wodurch IgG1-Gedächtnis-B-Zellen prädispositioniert sind schnell zu Plasmazellen zu differenzieren (Kometani et al. 2013). Ein Unterschied zwischen naiven BZellen und Gedächtniszellen ist auch die unterschiedliche Expression der Immunglobulin Isotypen. Während naive B-Zellen sowohl einen IgM- als auch einen IgD- BZRs tragen, exprimieren viele Gedächtniszellen einen IgG-BZR. IgM- und IgD-BZRs ragen beide nur mit drei Aminosäuren in den intrazellulären Bereich, weshalb sie ihre Signale vorwiegend über die Igαund Igβ- Untereinheiten des BZR-Komplexes weitergeben. IgG-BZRs verschiedener Subklassen 8 Der B-Zell Rezeptor in der Aktivierung von B-Zellen des IgM und des IgG Isotypes Einleitung haben neben den Igα- und Igβ-Untereinheiten hingegen noch 28 Aminosäuren der schweren Ketten, die in den intrazellulären Bereich reichen (Reth 1992). Diese vermitteln den IgG-BZRs die intrinsische Kapazität zur Signalleitung über den IgG-Rezeptor, welche die Signalleitung gegenüber der des IgM-Rezeptors erhöht (Martin & Goodnow 2002; Liu et al. 2010; Engels et al. 2009). So wurde gezeigt, dass transgene Mäuse mit einem spezifischen anti-HEL-BZR, bei denen der zytoplasmatische-IgM Bereich durch den zytoplasmatischen-IgG1 Bereich ersetzt wurde, nach BZR Stimulation zehn Mal mehr Plasmazellen bilden (Martin & Goodnow 2002). Allerdings waren die untersuchten Zellen keine Gedächtnis B-Zellen. Kürzlich wurde beschrieben, dass IgG-Gedächtniszellen hauptsächlich für einen schnellen Anstieg des Antikörperspiegels nach einer erneuten Stimulation verantwortlich sind, während IgM-Gedächtniszellen nach einer Restimulation eher zu Keimzentrumszellen werden. Für die entsprechenden Versuche wurden Cγ1cre-Mäuse verwendet, in denen Cre ein Toxin aktivierte, dass IgG1-Zellen spezifisch töteten sollte (Kometani et al. 2013). Cγ1cre ist aber nicht nur in IgG1-B-Zellen, sondern auch in der frühen Keimzentrumsreaktion aktiv (Casola et al. 2006), weshalb das Toxin unter Cre Kontrolle auch die Bildung von Keimzentren und somit die Entwicklung von Gedächtnis B-Zellen beeinträchtigen könnte. In Zellkultur wurde beschrieben, dass sowohl SAP97 (Liu et al. 2010) als auch das Adapterprotein Growth factor receptor-bound protein 2 (Grb2) (Engels et al. 2009) über verschiedene Bindemotive an die intrazelluläre Domäne von IgG binden und die Signalleitung über den IgG-BZR verstärken können. Adoptive Transferexperimente mit Gedächtniszellen aus B-Zell spezifischen Grb2-/- Mäusen, die in Rag1-/- Mäusen übertragen wurden, weisen darauf hin, dass die Bindung von Grb2 an die immunoglobulin tail tyrosine (ITT) Bindestelle auch in vivo eine Rolle spielt (Ackermann et al. 2011). Auch die Umgebung, in der sich die B-Zellen befinden, könnte einen Einfluss auf die Aktivierbarkeit der Gedächtnis-B-Zellen haben. So können adoptive transferierte Gedächtnis-B-Zellen gegen virusartige Partikel des humanen Zytomegalivirus (VLPs) direkt nach dem Transfer schlechter reaktiviert werden, als wenn ihnen Zeit gegeben wurde, ihre Nischen zu finden (Weisel et al. 2010). Es erscheint wahrscheinlich, dass eine Kombination von IgG-BZR extrinsischen und intrinsischen Signalen die stärkere Signalleitung und schnellere Aktivierbarkeit der IgG Gedächtniszellen gegenüber naiven IgM-Zellen fördert. 9 Der B-Zell Rezeptor in der Aktivierung von B-Zellen des IgM und des IgG Isotypes Einleitung 4.5 B-Zell Rezeptor Signalleitung Nach einer Kreuzvernetzung des BZRs werden immunoreceptor tyrosine-based activation motifs (ITAMs) der Igα- und Igβ- Untereinheit des BZRs durch Phosphotyrosinkinasen phosphoryliert. Die Kinase Syk kann über seine SH2-Domäne an die ITAMs binden und wird so aktiviert. Syk kann dann SLP65 (BLNK) phosphorylieren, das dann PLCγ2 und Btk über ihre SH2 Domänen rekrutieren kann. Dieser Komplex gelangt an die innere Plasmamembran. PLCγ2 wird während dieses Prozesses aktiviert und spaltet das Membranlipid Phosphatidyl-4,5-biphosphat in die sekundären Botenstoffe 1,4,5-triphosphate (IP3) and Diacylglycerol (DAG). 1,4,5-triphosphate (IP3) kann dann an den IP3-Rezeptor binden, der einen Ausstrom von Calcium aus dem Endoplasmatischen Retikulum bewirkt. Durch das Calcium im Cytosol werden CRAC (calcium release activated calcium)-Kanäle aktiviert, die einen Calcium-Einstrom durch die Plasmamembran ermöglichen. DAG wiederum aktiviert die Proteinkinase C (PKC) und RasGRP und startet so den NF-kB und den MAPK-Signalweg (Niiro & Clark 2002; Kurosaki et al. 2010). Die Signalleitung über den BZR kann durch negative Corezeptoren, wie CD22, CD72 oder den FcγR2b, negativ oder durch positive Corezeptoren, wie CD19 oder CD21 (Nitschke 2005; Kurosaki 2002), positiv beeinflusst werden. Die inhibitorischen Rezeptoren wirken oft über Immunoreceptor tyrosine-based inhibitory motifs (ITIM), welche die Phasphatasen SH2 domaincontaining phosphatase-1 (SHP-1) und SH2 domain-containing inositol phosphatase (SHIP) aktivieren können, die das BZR-Signal inhibieren (Tsubata 1999; Daëron et al. 2008), während aktivierende Corezeptoren meist über ihre ITAMs Kinasen aktivieren (Kurosaki 2002). 10 B-Zell Rezeptor Signalleitung Einleitung 4.6 T-Zell Entwicklung Einige thymusbesiedelnde Vorläuferzellen, die ihre Fähigkeit zur Selbsterneuerung verloren, aber weiterhin die Fähigkeit haben, sich in verschiedene Entwicklungslinien zu differenzieren, wandern aus dem Knochenmark in den Thymus. (Adolfsson et al. 2001; Christensen & Weissman 2001). Die Differenzierung zu T-Zellen verläuft als gradueller Prozess in vielen Entwicklungsschritten (Koch & Radtke 2011). Wenige Vorläuferzellen wandern in den Thymus ein und entwickeln sich zu frühen Thymus-Vorläuferzellen, die in vier Hauptfraktionen unterteilt werden können. Die DN1 CD44+CD25− Zellen, zu denen die gerade eingewanderten Zellen gehören, proliferieren im adulten Thymus für etwa 10 Tage im Bereich des perimedullären Cortex (Porritt et al. 2003; Koch & Radtke 2011). Ein wichtiger Kontrollpunkt in den frühen DN1-Zellen für die weitere T-Zell-Reifung ist die Aktivierung der Notch1 Signalleitung, die das Potential der Zellen sich zu vielen anderen Zelltypen, wie B-Zellen, zu entwickeln, inhibiert (Wada et al. 2008; Feyerabend et al. 2009; Bell & Bhandoola 2008). Der entscheidende Ligand für die Notch1 Signalleitung ist dabei DLL4 auf Epithelzellen des Thymus (Hozumi et al. 2008; Koch et al. 2008). DN1 Zellen wandern tiefer in den Cortex, genauer in den sub-kapsulären Bereich, wo sie stimulatorische Signale von cortikalen Epithelzellen des Thymus und Fibroblasten bekommen und sich zu DN2 (CD44+CD25+) Zellen entwickeln (Petrie & Zúñiga-Pflücker 2007; Takahama 2006). In diesem Stadium beginnen die Zellen, TCRγ, TCRδ und TCRβ Gene zu rearangieren (Capone et al. 1998; Livák et al. 1999), ein Vorgang, der in den DN3-Zellen abgeschlossen wird (Livák et al. 1999). Im DN2 Stadium spielt die IL-7 eine wichtige Rolle. Signale über den IL-7Rezeptor machen den TCRγδ Genlokus zugänglicher und Zellen mit einer höheren Expression des IL-7-Rezeptor werden bevorzugt zu TCRγδ Zellen (Kang et al. 2001; Ye et al. 2001; Huang et al. 2001). Im späten DN2 Stadium und im Übergang zum DN3 Stadium werden entscheidende Gene für die β-Selektion der T-Zellen, wie Ptrca (pre-TCR α Kette) and Rag1, hochreguliert (Balciunaite et al. 2005; Gounari et al. 2002; Taghon et al. 2006). Die Zellen entwickeln sich in der subkapsulären Zone des Thymus weiter zum DN3 (CD44-CD25+) Stadium. Im weiteren Verlauf der Rekombination der TZRγ, TZRδ und TZRβ Gene wird auch endgültig festgelegt, ob sich die Zelle in eine γδ- oder αβ- T-Zelle differenziert. Die erfolgreiche Rekombination der TZRγ und TZRδ Ketten legt das Schicksal zur γδ T-Zelle fest, das Notch unabhängig zu sein scheint (Lauritsen et al. 2009; Wolfer et al. 2002; Ciofani et al. 2006). DN3 αβ-T-Zellen entwickeln sich weiter und durchlaufen eine β-Selektion, nach der sie CD27 hoch regulieren. Dazu benötigen sie Signale über einen funktionellen pre-TZR Komplex. Der Komplex besteht aus einer funktionellen TCRβ-Kette, die mit einer vorläufigen invarianten pTα Kette kombiniert wird und Komponenten von CD3 Ketten beinhalten (von Boehmer 2005). Zudem tragen CXCR4, der Rezeptor für das Chemokin CXCL12 (Janas et al. 2010; Trampont et al. 2010) und der Notch1Rezeptor (Maillard et al. 2006; Ciofani et al. 2006; Ciofani & Zúñiga-Pflücker 2007) zur β- 11 T-Zell Entwicklung Einleitung Selektion bei. Notch1 vermittelt Überlebenssignale wahrscheinlich über den PI3K und AKT Signalweg (Ciofani & Zúñiga-Pflücker 2005). Signale, die über CXCR4 vermittelt werden, regulieren Bcl2-2A1, ein wichtiges Gen für das Überleben, hoch. Außerdem führt die Expression des pre-TZR Komplexes im DN3 Stadium zu einer starken Proliferation der Zellen, bis sie das doppelt positive CD4+CD8+ Stadium erreichen, in dem die Rag-Gene erneut exprimiert werden, was die Rekombination der TZRα-Kette initiiert. So kann eine funktionelle TZR β-Kette in den Nachkommen einer Zelle mit vielen TCR α-Ketten kombiniert werden. Bevor die DN3 Zellen zu doppelt positiven CD4+CD8+ Zellen werden reifen sie zu DN4 (CD44-CD25−) Zellen und fangen an, aus der subkapsulären Zone in Richtung Medulla auszuwandern. Währenddessen regulieren die DN4 T-Zellen im Cortex CD4 und CD8 hoch und werden so zu doppelt positiven T-Zellen. Zellen, die im doppelt positiven Stadium einen funktionellen αβ-TZR exprimieren, werden auf dessen Bindung an selbst-Peptid-major histocompatibility complexes (MHC) auf cortikalen Epithelzellen des Thymus, dendritischen Zellen oder Fibroblasten selektioniert. Zellen, die selbst-Peptid-MHCs mit einer ausreichenden Affinität/Avidität binden, werden positiv selektioniert, während Zellen, die zu schwach an selbstPeptid-MHCs binden keine Überlebenssignale bekommen und in Apoptose gehen (Klein et al. 2009). Die CD4+CD8+ Zellen differenzieren nach der positiven Selektion zu CD4+CD8- oder CD4-CD8+ einzel-positiven Zellen und wandern in die Medulla. Dort werden die Zellen negativ selektioniert. Zellen, die mit einer zu hohen Affinität/Avidität an die selbst-Peptid-MHCs binden, sterben durch Apoptose (Klein et al. 2009). Die einzel-positiven T-Zellen regulieren schließlich den sphingosine-1-phosphate receptor 1 hoch und wandern aus dem Thymus in die Peripherie aus, wo mehr des sphingosine-1-phosphate receptor 1 Liganden vorhanden sind (Matloubian et al. 2004). Die Zellen werden zu reifen, naiven CD4+ T Helferzellen oder CD8+ zytotoxischen TZellen, die in der Peripherie zirkulieren. 12 T-Zell Entwicklung Einleitung Knochenmark Hämatopoetische Stammzelle Thymus besiedelnde Vorl.-Zelle Thymus (Cortex) Peripherie Naive CD4+ einzelpositive Zelle Naive CD8+ einzelpositive Zelle CD4+ einzelpositive Zelle CD8+ einzelpositive Zelle Thymus (Medulla) αβ-TZR DN-1 CD4+CD8+ doppelt pos. Zellen CD4-cre TCRα Rekombination γδ -TZR γδ T-Zellen DN2 Lck-cre TCRγδ / TCRβ Rekombination DN-3 pre-TZR Thymus (Subkapsuläre Zone) DN-4 Abb. 2: Schema T-Zell Entwicklung. Hämatopoetische Vorläuferzellen entwickeln sich zu thymus besiedelnden Vorläuferzellen, die aus dem Knochenmark in den Thymus einwandern. Dort differenzieren sie vom doppelt negativen (DN) 1 (CD4-CD8-) Stadium über das DN2 Stadium zum DN3 Stadium. Dabei verlieren sie die Zellen schrittweise die Kapazität sich in andere Zelltypen zu differenzieren und rearangieren ihre T-Zell Rezeptor (TZR) γδ und TZR β Ketten. Durch die Expression eines γδ TZR oder eines vorläufigen TZR mit β Kette entscheidet sich, ob die T-Zellen zu γδ TZellen oder αβ T-Zellen werden. In der weiteren αβ T-Zell Eintwicklung reifen die Zellen das DN4 zu doppelt positiven T-Zellen CD4+CD8+, die einen vollständigen αβ TZR exprimieren. Die Zellen durchlaufen eine positive und eine negative Selektion und differenzieren zu CD4+ oder CD8+ einzel positiven naiven T-Zellen, die in die Peripherie auswandern. Dunkelblau/Hellblau: Vorläuferzellen, die sich noch zu anderen Zelltypen außer T-Zellen differenzieren können; Grün: T-Zell Stadien; rote Schrift: Erste Expression von cre unter verschiedenen Promotoren. Quellen: Shah und Zúñiga-Pflücker J. Immunol. 2014, Koch und Radtke Annu. Rev. Cell Dev. Biol. 2011. 13 T-Zell Entwicklung Einleitung 4.7 T-Helferzellen Viele Effektorfunktionen werden mit CD4+ T-Helferzellen (TH) in Verbindung gebracht, wobei die Organisation und Entwicklung dieser Funktionen noch nicht vollständig verstanden ist. Der erste Kontakt mit einer dendritischen Zelle, auf der die CD4+ T-Zelle ihr spezifisches PeptidAntigen auf einem MHCII Molekül entdeckt, hat einen wichtigen Einfluss auf die Entwicklung und Funktion der Zelle, beispielsweise können dendritische Zellen dabei je nach Situation verschiedene Zytokine sekretieren und die Costimulation für die T-Zelle variieren (Walsh & Mills 2013). Aber auch die Stärke der Signale, die über die T-Zell Rezeptoren (TZR) vermittelt werden, spielt eine Rolle (Yamane & Paul 2013). Diese Signale können dann T-Zell- intrinsische Entwicklungsprogramme anstoßen, die die Zelle und ihre Nachkommen in Richtung einer definierten Effektor TH-Population treiben (Abb. 3). TH1-Antworten vermitteln Immunantworten gegen intrazelluläre Pathogene (Paul & Seder 1994). IL-12 und IFNγ induzieren die TH1-Antworten, die durch einen synergistischen Effekt von IL-18 verstärkt werden kann. Nach der TZR Aktivierung regulieren diese Zellen den IL-12Rβ2 hoch (Szabo et al. 1997), was das Stat4-abhängie Reaktionspotential gegenüber IL-12 erhöht (M H Kaplan et al. 1996). IFNγ löst Stat1-abhängig die Expression des TH1 Masterregulators T-bet aus, der die IFNγ-Produktion fördert, aber gleichzeitig auch die IL-4 Expression inhibiert (Szabo et al. 2003). TH2-Antworten vermitteln Immunantworten gegen extrazelluläre Parasiten durch die Produktion von IL-4, IL-5, IL-13 und IL-25. Die T-Zellen regulieren den IL-4 Rezeptor hoch, der über Stat6 die Expression des TH2-Masterregulators GATA-3 fördert (Mark H Kaplan et al. 1996; Zheng & Flavell 1997). GATA-3 wird für die TH2-Differenzierung benötigt, blockiert aber auch die TH1Antwort. IL-2 kann auch Stat5-abhängig die Produktion von TH2 Zytokinen verstärken (Zhu et al. 2003). TH1- und TH2- Antworten führen also zu Reaktionen, die sich gegenseitig ausschließen. Zusätzlich wurde eine TH17 Entwicklungslinie beschrieben (Bettelli et al. 2006; Harrington et al. 2005; Mangan et al. 2006; Park et al. 2005; Veldhoen et al. 2006). TH17-Zellen wurden ursprünglich mit Autoimmunerkrankungen und chronischen Entzündungen in Verbindung gebracht, vermitteln aber auch Antworten gegen Pilze und extrazelluläre Bakterien durch die Produktion von IL-17, IL-17F und IL-22 (Korn et al. 2009; Miossec et al. 2009). Es wurde gezeigt, dass IL-6 und TGFβ die Produktion von IL-17 in naiven TH-Zellen auslösen können (Bettelli et al. 2006; Veldhoen et al. 2006), beteiligt sind aber auch IL-21 und IL-23 (Zhou et al. 2007). TGFβ allein führt zur Bildung von induzierten T-reg Zellen, die inhibierend auf die Immunantwort wirken. Die zusätzliche Gabe von IL-6 wiederum begünstigt die IL-17 Produktion und inhibiert die FoxP3- abhängige Differenzierung zu T-reg Zellen. Außerdem wird nach IL-6Zugabe der orphan nuclear receptor RORγt Stat3-abhängig hoch reguliert. Diese Vorgänge 14 T-Helferzellen Einleitung führen zur Expression des TH17 Masterregulators RORγt (Ivanov et al. 2006), an dessen Regulation der IRF-4 Rezeptor und das IRF4 bindende Protein beteiligt sind (Chen et al. 2008; Brüstle et al. 2007). FoxP3 kann von RORγt und dem verwandten RORα gebunden werden, wodurch FoxP3 inhibiert wird und eine Differenzierung zu T-reg Zellen unterbunden wird (Yang et al. 2008; Zhou et al. 2008). Bei den TH17- und den Treg-Zellen handelt es sich also wie bei den TH1- und die TH2-Zellen um eigene Entwicklungslinien, die sich teilweise gegenseitig inhibieren. Außerdem gibt es follikuläre Helfer T-Zellen (TFH), welche die humorale Immunität unterstützen, indem sie die Keimzentrumsreaktion, den Klassenwechsel von B-Zellen, die Affinitätsreifung von antikörper produzierenden B-Zellen und lang anhaltende Antikörperantworten fördern. Ihr Einfluss auf Gedächtnis B-Zellen ist weitgehend unklar (Crotty 2011; Yamane & Paul 2013). Sie haben Bcl6 als Masterregulator (Nurieva et al. 2009; Johnston et al. 2009; Yu et al. 2009; Crotty 2011), der die Differenzierung zu TH1, TH2 und TH17 Zellen insbesondere durch die Inhibition der Blimp-1 Expression unterdrückt. Außerdem exprimieren TFH Zellen den CXC-Chemokin Rezeptor 5 (CXCR5), der wichtig für die Wanderung der Zellen in den Follikel ist (Breitfeld et al. 2000; Schaerli et al. 2000). Ob es sich bei den TFH Zellen um eine eigene Linie handelt oder, ob sich die Zellen aus TH1, TH2 und TH17 Zellen entwickeln ist umstritten (Crotty 2011; Yamane & Paul 2013). Die Differenzierung zu TFH Zellen wird aber unter anderem durch die Zytokine IL-6 und IL-21 und starke TZR-vermittelte Signale gefördert (Crotty 2011). Neben den bereits aufgezählten Populationen wurden noch TH9 (Kaplan 2013) und TH22 (Eyerich et al. 2009) Zellen beschrieben. Jede T-Helferzellinie ist auf spezifische Aufgaben in der Immunantwort spezialisiert. Gezeigt werden konnte außerdem, dass es bis zu einem gewissen Grad möglich ist, die verschiedenen T-Helferzellen ineinander umzuwandeln, das heißt sie zeigen eine Plastizität (Nakayamada et al. 2012; Zhou et al. 2009; O’Shea & Paul 2010). 15 T-Helferzellen Einleitung IFNγ + IL-12 TH1 STAT4 T-bet TH17 STAT3 RORγT Naive CD4+ einzelpositive Zelle IL-4 + IL-2 IL-17a, IL-17f, TNFα, GM-CSF, IL-22 iT-reg STAT5 FoxP3 IL-10, IL-35, TGFβ TH2 STAT6 GATA3 IL-4, IL-5, IL-13 T-fol. Helfer Zellen Bcl-6 IL-6; kein TGFβ IFNγ, TNFα IL-21, IFNγ oder IL-4 TH9 PU.1? IL-9, IL-10, IL-21 TH22 ? IL-22 Abb. 3: T-Helferzell Differenzierung. Klassisch können sich naive CD4+ T-Zellen nach T-Zell Rezeptor Stimulation abhängig vom Zytokinmilieu zu verschiedenen Helferzelllinien entwickeln. Dabei wirken unterschiedliche Zytokine auf unterschiedliche STAT (signal transducer and activator of transcription) Transkriptionsfaktoren, die die Entwicklung einer entsprechenden T-Helferzelllinie unterstützen (grün). Neben diesen Transkriptionsfaktoren gibt es Transkriptionsfaktoren, die Master Regulatoren (Lila) genannt werden und nach der Induktion ihrer Expression hauptsächlich zur Entwicklung und Aufrechterhaltung der entsprechenden T-Helferzelllinie beitragen. Das Schema ist stark vereinfacht, da viele Faktoren an der Entwicklung der verschiedenen Populationen beteiligt sind und sich die THelferzellpopulationen teilweise ineinander umwandeln können. Gelb: Klassische T-Helferzelllinien; Rot: Es ist umstritten, ob es sich bei diesen Zellen um eigene Linien handelt und ihre Entwicklung und Funktion in vivo ist weitgehend unklar. Quellen: Zhu et al. Annu. Rev. Immunol. 2010, Evans und Jenner Brief. Funct. Genomics 2013, Yamane und Paul Immunol. Rev. 2013, Walsh und Mills Trends Immunol.2013, Kaplan Immunol. Rev. 2013, O’Shea und Paul Science 2010, Zhu und Paul Immunol. Rev. 2010. 16 T-Helferzellen Einleitung 4.8 Die Experimentelle autoimmune Enzephalomyelitis (EAE) ein Mausmodell für Multiple Sklerose im Menschen Multiple Sklerose ist eine auf Entzündungen basierende, demyelierende Krankheit des zentralen Nervensystems (ZNS). Allerdings gibt es verschiedene Formen, die auch verschiedene Ursachen und Verläufe haben können (Lucchinetti et al. 2000; Sospedra & Martin 2005). Die experimentelle autoimmune Enzephalomyelitis (EAE) ist das am weitesten verbreitete Modell für die Multiple Sklerose und wird durch die Stimulation einer Immunantwort gegen ein Antigen des zentralen Nervensystems ausgelöst (Stromnes & Goverman 2006). Die Gabe von Freund’s Adjuvant (Kabat et al. 1947) und Pertussis- Toxin (Levine & Sowinski 1973) verbessern die Effizienz der EAE Induktion, wobei es die Aufgabe des Pertussis- Toxins ist, die Blut-HirnSchranke durchlässiger zu macht. Als Antigene für die EAE kommen verschiedene Antigene in Frage, z.B. Myelin Oligodendrozyten Glykoprotein (MOG), ein kleiner Bestandteil des Myelin, der eine starke Hirnhautentzündung hervorrufen kann (Linnington et al. 1984; Lebar & Vincent 1981). Es wurde gezeigt, dass es ausreicht T-Zellen, die eine spezifische MHCII-Peptid Kombinationen erkennende aus EAE-Mäusen in Rezipienten zu übertagen, um eine EAE auszulösen (Zamvil et al. 1985; McDevitt et al. 1987). Die aktive wie die passive EAE basieren darauf, dass periphere Myelin- spezifische CD4+ T-Zellen, die den Toleranzmechanismen entkommen sind, aktiviert werden (Seamons et al. 2003), weil diese besser in der Lage sind, die Blut-Hirn-Schranke zu überqueren als naive T-Zellen (Wekerle et al. 1986; Brabb et al. 2000; Hickey 1991). Im ZNS präsentieren sowohl lokale als auch eingewanderte antigenpräsentierende Zellen auf ihren MHCII- Molekülen Myelinpeptide im Zusammenspiel mit costimulatorische Molekülen (Tompkins et al. 2002; McMahon et al. 2005). Diese können infiltrierende Myelinspezifische T-Zellen aktivieren (Kawakami et al. 2004), was auch dazu führt, dass Chemokine ausgeschüttet werden, die vorwiegend Makrophagen anlocken. Makrophagen wiederum können proinflammatorische Proteine wie TNFα und IL1 ausschütten, die eine Entzündung verlängern und zur Gewebeschäden führen (Kuchroo et al. 2002). Es bilden sich Infiltrate aus T-Zellen, BZellen und Makrophagen, sowie demyelierte Stellen im ZNS, wie sie auch in der Multiplen Sklerose zu finden sind (Raine et al. 1978; Sospedra & Martin 2005). Die klinischen Symptome haben mit der Position der Infiltrate zu tun (Sobel 2000), während die Schwere der Krankheit auch mit der Zusammensetzung der Infiltrate (Berger et al. 1997) und der Anwesenheit demyelierender Antikörper zusammenhängt (Linington et al. 1988). Die EAE kann akut, chronisch oder wiederkehrend sein. Dies hängt vom Mausstamm, dem Antigen und der Gabe von Pertussis- Toxin ab (Levine et al. 1966; Tsunoda et al. 2000). Außerdem können Geschlecht und Alter der Tiere (Smith et al. 1999; Teuscher et al. 2004), sowie weitere Faktoren Einfluss nehmen (Stromnes & Goverman 2006). In der klassischen Form der EAE reflektieren die klinischen Anzeichen vorwiegend Entzündungen im Rückenmark, obwohl die MOG induzierte EAE auch 17 Die Experimentelle autoimmune Enzephalomyelitis (EAE) ein Mausmodell für Multiple Sklerose im Menschen Einleitung den Sehnerv beeinträchtigt (Sakuma et al. 2004; Storch et al. 1998; Bettelli et al. 2003). Die vorwiegend im Rückenmark vorkommenden Entzündungen und die limitierten Anzeichen für die Krankheit stellen Unterschiede zur Multiplen Sklerose im Menschen dar. Es gibt aber neben dem klassischen EAE Modell, weitere atypische Modelle, die helfen andere Aspekte der Multiplen Sklerose zu untersuchen (Stromnes & Goverman 2006). CD4+ T-Zellen sind die vorwiegenden Effektor- T-Zellen während einer EAE, wohingegen in der Multiplen Sklerose aber wahrscheinlich auch CD8+ T-Zellen beteiligt sind (McDole et al. 2006; Lassmann & Ransohoff 2004; Friese & Fugger 2005; Johnson et al. 2007; Goverman et al. 2005). Durch die Nutzung von Freund’s Adjuvant wird in der EAE vor allem eine TH1- und TH17-Immunantwort ausgelöst (Tigno-Aranjuez et al. 2009; Batoulis et al. 2010). Mit in vitro differenzierten Myelinspezifischen T-Helferzellen wurde gezeigt, dass TH1-, TH17- und TH9- Zellen eine EAE auslösen können (Jäger et al. 2009). IL-6 ist zusammen mit TGFβ an der Differenzierung von naiven CD4+ T-Zellen zu TH17- Zellen beteiligt, während TGFβ allein zur Differenzierung zu Treg Zellen führt. IL-6 defiziente Mäuse entwickeln erwartungsgemäß eine mildere EAE, aber eine in vivo Depletion der T-regs in diesen Tieren führte zur Bildung von TH17 Zellen und einem stärkeren Krankheitsverlauf. IL-6 kontrolliert also die Balance zwischen einer TGFβ- abhängigen T-reg- und TH17- Antwort. Diese Versuche belegen die Bedeutung von TH17- Zellen und T-regZellen in der EAE (Rangachari & Kuchroo 2013). Die EAE ist ein Krankheitsmodell für Multiple Sklerose, das hauptsächlich auf der Wirkung von CD4+ T-Zellen basiert. 18 Die Experimentelle autoimmune Enzephalomyelitis (EAE) ein Mausmodell für Multiple Sklerose im Menschen Einleitung 4.9 Das Adapterprotein „growth factor receptor bound protein 2” Adapterproteine dienen als Gerüst für Signalosomen und sind an der Bildung von Antigenrezeptorkomplexen beteiligt (Lindquist et al. 2003; Samelson 2002; Samelson 1999). Das Adapter Protein growth factor receptor bound protein 2 (Grb2) ist ein kleines, hoch konserviertes Adapterprotein von etwa 25-30 kDa, verfügt über eine zentrale Src homology 2 (SH2) und zwei flankierende Src homology 3 (SH3) Domänen (Abb. 4). Es wurde 1992 unabhängig von zwei Gruppen beschrieben. Eine Gruppe entdeckte es in einem Screening für Proteine, die an die phosphorylierte Form des epidermal growth factor receptor (EGFR) oder des platelet-derived growth factor receptor binden und benannten es entsprechend (Lowenstein et al. 1992). Sie fanden heraus, dass Grb2 die Wachstumsfaktor-Rezeptoren mit der Ras Signalleitung verbindet, indem es an den GDP/GTP Austauschfaktor für Ras namens SOS bindet. Eine andere Gruppe führte unabhängig einen cDNA Screen auf SH2-Domänen in Säugern durch und nannte das Protein abundant Src homology (Ash) (Matuoka et al. 1992). Grb2 besitzt keine katalytische Funktion, sondern kann mit seiner SH2 Domäne kurze Konsensussequenzen mit einem phosphorylierten Tyrosinrest binden (Pawson & Gish 1992; Kessels et al. 2002), während es mit seinen SH3 Domänen prolinreiche Regionen mit einem PXXP Kernstück erkennt und bindet (Ren et al. 1993). Grb2 ist ein Mitglied der Grb2-Adapterfamilie zu der auch das Grb2-related adapter protein (Grap) (Feng et al. 1996) und Grb2-related adapter downstream of Shc (Gads) gehören (Liu & McGlade 1998). Gads wurde auch als Grap-2 (Qiu et al. 1998), Grb2-related protein of the lymphoid system (GrpL) (Law et al. 1999),monocytic adapter (Mona) (Bourette et al. 1998), Grb2-related protein with insert domain (GRID) (Ellis et al. 2000) und Grb2 family member of 40 kDa (Grf40) (Asada et al. 1999) beschrieben. Grap zeigt eine etwa 59%ige Übereinstimmung in der Aminsosäuresequenz mit Grb2 und wird vorwiegend in Milz und Thymus exprimiert (Feng et al. 1996). Gads weist ebenfalls eine hohe Ähnlichkeit zu Grb2 auf und wird vorwiegend im hämatopoetischen System exprimiert (Liu & McGlade 1998). Die Funktionen des breiter exprimierten Grb2 könnten in den lymphatischen Organen mit denen von Grap und Gads überlappen. So binden die SH2 und SH3 Domänen von Grb2 und Grap ähnliche Proteine und Grap- defizienten Mäuse haben keinen auffälligen Phenotyp (Cheng et al. 1998). Gads kann zumindest über seine SH3 Domänen auch an andere Zieldomänen als Grb2 binden (Liu & McGlade 1998; Liu et al. 1999; Liu et al. 2000). Grb2 spielt in der Embryonalentwicklung der Maus eine wichtige Rolle bei der Differenzierung von Endodermzellen und der Bildung des Epiblasten (Cheng et al. 1998; Findlay et al. 2013), weshalb Grb2-defiziente Mäuse embryonal lethal sind (Cheng et al. 1998). In der Folge wurden Mäuse untersucht, die haploid Grb2 defizient waren (Gong et al. 2001). Mit dem Cre/loxP System wurde es schließlich möglich, konditionale knockout Mäuse zu generieren (Rajewsky et al. 1996; Kos 2004). Es wurden in zwei 19 Das Adapterprotein „growth factor receptor bound protein 2” Einleitung Arbeitsgruppen unabhängig voneinander konditionale Grb2 knockout Mäuse generiert (Ackermann et al. 2011; Jang et al. 2010). B-Zell Corezeptoren B-Zell Rezeptor FcyR2b, CD72, CD22, CD19 IgG, IgE Grb2 PI3K Signalweg Ras/MAPK SH2 SHIP1, SHIP2, BCAP, PI3K Cβ, p85 α/β, Vav GAPT Protein Tyrosin Phosphatasen SOS1/2, HPK-1 Adapterproteine LAT, Dok-3, LAX, SLP65, NTAL, GAPT SHP1, SHP2, PTP-PEST PTPRα SH3-C SH3-N T-Zell Corezeptoren Weitere Bindepartner CD28 Btk, Themis Abb. 4: Aufbau von Grb2 und Bindepartner, mit denen Grb2 in Lymphozyten über seine SH2 und SH3 Domänen interagiert.In grün sind positive Regulatoren und in rot sind negative Regulatoren verschiedener Signalwege dargestellt. Verändert nach: Maignan et al. Science 1995, Neumann et al. Immunol. Rev. 2009. Zusätzliche Quellen: Schneider et al. Eur. J. Immunol. 1995, Sommers et al. Bioessays 2004; Paster et al. J. Immunol. 2013, Engels et al. Nat. Commun. 2014. 4.10 Die Rolle von Grb2 in B-Zellen Grb2 hat eine Vielzahl von Interaktionspartnern in B-Zellen, die zumeist an der Signalleitung über den BZR beteiligt sind. Grb2 moduliert die Signalleitung über den BZR unter anderem durch seine Bindung an den aktivierenden BZR- Corezeptor CD19, der an der Bildung der B-Zell Mikrocluster beteiligt ist und die anti- apoptotisch wirkende PI3K rekrutiert und das BZR- Signal amplifiziert (Brooks et al. 2000; Depoil et al. 2008; Tuveson et al. 1993; Fujimoto et al. 2000; Tedder et al. 1997; Neumann et al. 2009). Zusätzlich bindet Grb2 auch direkt an weitere Moleküle des PI3K Signalweges (Neumann et al. 2009) und fördert die Aktivierung des anti-apoptotischen Faktors Akt (Ackermann et al. 2011). Damit verstärkt Grb2 insgesamt die Signalleitung über CD19 und den PI3K Signalweg. 20 Die Rolle von Grb2 in B-Zellen Einleitung Außerdem interagiert Grb2 mit negativen BZR- Corezeptoren, wie CD72, CD22 und FcγR2b, sowie Phosphatasen, die von diesen Rezeptoren aktiviert werden (Poe et al. 2000; Nitschke 2005; Neumann et al. 2009; Neumann et al. 2011). Funktionell wurde beschrieben, dass eine Kreuzvernetzung des BZRs mit dem FcγR2b in einer reifen B-Zelllinie zu einer verstärkten Bildung eines Dok-3/Grb2/SHIP Komplexes und einer reduzierten Bindung von Grb2 an CD19 führt. Dadurch wird das Verhältnis der inhibierenden und aktivierenden Funktionen von Grb2 in Richtung der inhibierenden Funktionen verschoben (Neumann et al. 2011). Grb2 moduliert die B-Zell Signalleitung auch durch die Bindung an andere Adapterproteine. So wird das Adapterprotein Dok-3, welches an der Innenseite der Membran lokalisiert ist, nach BZRStimulation von Lyn phosphoryliert und bindet Grb2 aus dem Zytosol. Dieser Komplex wird dann durch Grb2 in BZR- Mikrocluster rekrutiert, in denen auch die potentiellen Grb2 Bindepartner SLP65 und Vav3 zu finden sind. Grb2 inhibiert dort die Syk- Phosphorylierung durch Lyn und verstärkt die Phosphorylierung von SHIP und wirkt somit inhibierend. Auch die Btk-Aktivität wird durch den Dok-3/Grb2 Komplex reduziert, was wiederum die PLCγ2 Aktivität, die IP3 Bildung und die Calcium Mobilisierung verringert (Lösing et al. 2012; Stork et al. 2007; Schnyder et al. 2011). Während die Bindung von Grb2 an Dok-3 inhibierend wirkt, verstärkt die Bindung von Grb2 an das Adapterprotein Non-T Cell Activation Linker (NTAL) die Calcium Mobilisierung. NTAL rekrutiert Grb2 in lipid rafts und verhindert so seine Beteiligung an inhibitorischen Prozessen (Stork et al. 2004). Die subzelluläre Position von Grb2 beeinflusst also die biologische Funktion von Grb2 durch die Beteiligung an verschiedenen Signalkomplexen, die aktivierend oder inhibierend wirken können. Somit ist Grb2 ein Adapter, der das Verhältnis von inhibitorischen und aktivierenden Funktionen modulieren kann. Die biologische Funktion von Grb2 in vivo konnte lange nicht untersucht werden, da ein vollständiger Grb2 Knockout in der Maus embryonal lethal ist (Cheng et al. 1998). Dies wurde erst durch konditional deletierbare Knockout Mäuse möglich (Ackermann et al. 2011; Jang et al. 2010). Um Grb2 in B-Zellen zu deletieren, wurde zum einen cre unter der Kontrolle des mb1Promotors verwendet (Ackermann et al. 2011), zum anderen cre unter der Kontrolle des CD19Promotors (Jang et al. 2011). In beiden Mäusen sind die Zellzahlen im Knochenmark normal, aber die Zahl der Transitionalen Typ 1 (T1), Transitionalen Typ 2 (T2) und reifen B-Zellen in der Peripherie ist reduziert (Ackermann et al. 2011; Jang et al. 2011). In Grb2fl/fl mb1cre/+ Mäusen war die spontane in vitro Apoptoserate reifer B-Zellen leicht erhöht, die BAFF-Rezeptor Expression war auf diesen moderat niedriger und die Aktivierung des anti-apoptotisch wirkenden AKT war nach BZR-Stimulation reduziert, was auf einen Einfluss von Grb2 auf Apoptosemechanismen nahelegt. Zudem war der BrdU Einbau in T1-Zell Vorläufern in vivo reduziert, was zu einer niedrigeren Zahl an BrdU+ T1-Zellen in der Milz führte und auf eine reduzierte Proliferation in der Entwicklung hindeutet (Ackermann et al. 2011). 21 Die Rolle von Grb2 in B-Zellen Einleitung B-Zellen von Grb2fl/fl mb1cre/+ und Grb2fl/fl CD19cre/+ Mäusen zeigen eine reduzierte CD22 Phosphorylierung nach BZR Stimulation und dazu passend eine höhere PLCγ2 Phosphorylierung und Calcium Mobilisierung (Ackermann et al. 2011; Jang et al. 2011). Ein Grund dafür könnte die leicht niedrigere Lyn- Aktivierung nach BZR- Stimulation sein, da Lyn CD22 phosphoryliert (Jang et al. 2011). Grb2 interagiert auch mit SOS und HPK1 aus dem MAPK Signalweg (Neumann et al. 2009). Die Bindung von Grb2 an SOS führt in vielen Zelltypen über die Aktivierung von Ras zur Aktivierung von MAP-Kinasen. In B-Zellen gibt es aber Hinweise, dass der Signalweg über RasGRP3 eine wichtigere Rolle bei der Ras Aktivierung spielt (Ehrhardt et al. 2004; Oh-hora et al. 2003; Teixeira et al. 2003). In Grb2fl/fl CD19cre/+ Mäusen war die Phosphorylierung von der MAP-Kinasen ERK, JNK und P38 nach BZR Stimulation erhöht (Jang et al. 2011). Grb2fl/fl mb1cre/+ Mäuse zeigten dagegen eine unveränderte ERK und P38 Phosphorylierung nach BZR- Stimulation, während die Phosphorylierung von JNK reduziert war. Warum die Signalleitung in Grb2fl/fl mb1cre/+ und Grb2fl/fl CD19cre/+ Mäusen unterschiedlich beeinträchtigt ist, ist unklar. Trotz der unveränderten ERK Aktivierung in Grb2fl/fl mb1cre/+ Mäusen war die Aktivierung von Ras reduziert (Ackermann et al. 2011). Ras ist ein wichtiges Protein für die ERK Aktivierung. Eine normale ERK- und beeinträchtigte Ras- Aktivierung wurde aber auch für haploid Grb2 defiziente T-Zellen beschrieben (Gong et al. 2001). Es ist unklar, welche alternativen Signale ERK in der Grb2fl/fl mb1cre/+ Maus aktivieren bzw., ob die niedrigere Ras Aktivität ausreicht, um ERK und P38 aber nicht JNK auf ein mit dem Wildtyp vergleichbares Niveau zu phosphorylieren. B-Zell spezifische Grb2 defiziente Mäuse haben mehr IgM Plasmazellen, einen höheren IgM Antikörperlevel und mehr IgM Autoantikörper. Außerdem proliferieren ihre B-Zellen in vitro stärker nach anti-IgM Stimulation (Ackermann et al. 2011; Jang et al. 2011) und weisen somit einen hyperreaktiven Phänotyp auf. Grb2 wirkt also auch inhibierend auf die Zahl und die Aktivität von IgM B-Zellen. Die sekundäre Immunantwort gegen virusartige Partikel des humanen Zytomegalovirus (VLPs) war in Grb2fl/fl mb1cre/+ Mäusen reduziert (Ackermann et al. 2011). Dazu passend wurde beschrieben, dass Grb2 auch an den IgG- und den IgE-Rezeptor binden kann und die Signalleitung in vitro im Vergleich zum IgM-Rezeptor verstärkt (Engels et al. 2009). Außerdem war die IgG3 Immunatwort von Grb2fl/fl mb1cre/+ Mäusen gegen das Thymus- unabhängige Typ 2 Antigen TNP-Ficoll beeinträchtigt. Die primäre und sekundäre Antwort von Grb2fl/fl CD19cre/+ Mäusen gegen NP30KLH war dagegen unverändert (Jang et al. 2011). Der unterschiedliche Einfluss von Grb2 auf die sekundäre Immunantwort zwischen der Grb2fl/fl mb1cre/+ Maus und der Grb2fl/fl CD19cre/+ Maus kann an den unterschiedlichen Antigenen liegen, die verwendet wurden. Während die von Viren abgeleiteten VLPs partikulär sind, ist NP30KLH ein lösliches 22 Die Rolle von Grb2 in B-Zellen Einleitung Proteinantigen. Grb2 fördert also sowohl Thymus- abhängige Immunreaktionen als auch Antworten gegen Thymus- unabhängige Typ 2 Antigene. Grb2fl/fl mb1cre/+ und Grb2fl/fl CD19cre/+ Mäuse weisen eine beeinträchtigte Keimzentrumsreaktion nach einer Immunisierung mit Schafserythrozyten auf (Ackermann et al. 2011; Jang et al. 2011). Für Grb2fl/fl CD19cre/+ Mäuse wurde gezeigt, dass sie nach der Stimulation mit CXCL13 über CXCR5 einen Defekt in der Produktion von Lymphotoxin-β aufweisen. Der Phänotyp von Grb2fl/fl CD19cre/+ Mäusen in der Milz gleicht darum dem von Lymphotoxin-β defizienten Tieren (Junt et al. 2006; Endres et al. 1999; Tumanov et al. 2002), die eine beeinträchtigte Keimzentrumsreaktion aufweisen , eine fehlerhafte Ausbildung des Netzwerks der follikulären dendritischen Zellen in der Milz und eine Störung der Marginalzonenbildung (Junt et al. 2006; Endres et al. 1999; Tumanov et al. 2002; Jang et al. 2011). Wurden Knochenmarkszellen aus der Grb2fl/fl CD19cre/+ Maus mit einem retroviralen Vektor zur Überexpression von Lymphotoxin-β transduziert und in Rag1-/- Mäuse übertragen, so zeigten diese normale Keimzentrumsreaktionen. Auch Knochenmarkschimären, bei denen Wildtyp- und Grb2- defiziente B-Zellen über CD45.1 und CD45.2 unterschieden werden konnten , zeigten normale Keimzentrumsreaktionen, an denen Grb2 defiziente B-Zellen beteiligt waren. Grb2 hat also keinen intrinsischen Effekt auf die Differenzierung naiver B-Zellen zu Keimzentrumszellen (Jang et al. 2011). Neben den Keimzentrumzellen ist in den Grb2fl/fl CD19cre/+ Mäusen auch die Zahl der Gedächtnis B-Zellen reduziert (Jang et al. 2011). 23 Die Rolle von Grb2 in B-Zellen Einleitung 4.11 Die Rolle von Grb2 in T-Zellen Die Rolle von Grb2 in vivo wurde zuerst in T-Zellen von Mäusen untersucht, die haploid Grb2defizient waren. Die Grb2+/- T-Zellen zeigten nach TZR-Stimulation eine schwächere JNK und P38 Phosphorylierung, aber eine normale Phosphorylierung von ERK (Gong et al. 2001). Die MAP-Kinasen ERK, JNK und P38 wirken unterschiedlich auf die Selektion im Thymus. ERK ist wichtig für die positive Selektion (Pagès et al. 1999; O’Shea et al. 1996; Swan et al. 1995; Alberola-Ila et al. 1995; Alberola-Ila et al. 1996), während JNK und P38 wichtig für die negative Selektion sind (Rincón et al. 1998; Sabapathy et al. 1999; Sugawara et al. 1998; Dong et al. 1998; Dong et al. 2000). Anhand von transgenen Mausmodellen wurde gezeigt, dass die negative Selektion in den haploid Grb2 defizienten Mäusen passend zur niedrigeren JNK und P38 Aktivierung beeinträchtigt war, während die positive Selektion nicht betroffen war. Die unterschiedliche Regulation der MAP-Kinasen könnte damit erklärt werden, dass der Schwellenwert der Signalleitung für eine Aktivierung von ERK niedriger ist, als der für eine Aktivierung von JNK oder P38. Eine Reduktion von Grb2 um etwa 60 % in Grb2+/- T-Zellen könnte demnach noch ausreichen, um ERK zu aktivieren (Gong et al. 2001). Später wurde eine konditionale T-Zell spezifische Grb2 Knockout Maus generiert, bei der Cre unter der Kontrolle des Lck-Promotors steht und in der Grb2 ab dem Übergang vom DN2- zum DN3-Stadium deletiert wird (Jang et al. 2010). Die Grb2fl/fl Lckcretg Mäuse zeigten eine Reduktion der doppeltpositiven T-Zellen um etwa 30 %. Um die positive Selektion der CD4+ T-Zellen zu überprüfen, wurden DO11.10 TZR trangene Mäuse verwendet. Diese exprimieren einen TZR, der das Antigen OVA (chicken ovalbumin) in Verbindung mit einem I-Ad MHCII-Molekül erkennt (Murphy et al. 1990). DO11.10 TZR trangene Mäuse wurden mit Grb2fl/fl Lckcretg Mäusen gekreuzt. Die Zahl der positiv selektionierten CD4+ Zellen in diesen Mäusen war stark reduziert (Jang et al. 2010). Um die positive Selektion der CD8+ T-Zellen zu untersuchen, wurden T-Zell spezifische Grb2 defiziente Mäuse mit H-Y transgenen Mäusen gekreuzt, die einen TZR exprimieren, der das männliche Antigen H-Y in Verbindung mit einem H-2B MHCI-Molekül erkennt. Weibliche Mäuse dieser Linie exprimieren kein H-Y Antigen, weshalb ihre T-Zellen positiv, aber nicht negativ selektioniert werden (Kisielow et al. 1988). In den weiblichen Grb2fl/fl Lckcretg Mäusen, die einen H-Y spezifischen TZR exprimierten, war die positive Selektion der CD8+ T-Zellen stark beeinträchtigt (Jang et al. 2010). Zusätzlich sollte auch die negative Selektion untersucht werden. In männlichen Mäusen, die einen transgenen TZR exprimiern, der das männliche Antigen H-Y in Verbindung mit einem H-2B MHCI-Molekül erkennt, werden die CD8+ Zellen negativ selektioniert. In den männlichen Grb2fl/fl Lckcretg Mäusen, die einen H-Y spezifischen TZR exprimierten, war die negative Selektion der CD4+CD8+ und der CD8+ T-Zellen stark beeinträchtigt (Jang et al. 2010). Auch durch die Gabe des Superantigens SEB (staphylococcal enterotoxin B) wurde die negative Selektion untersucht. Auf MHCII- Komplexen präsentiert führt 24 Die Rolle von Grb2 in T-Zellen Einleitung es zur Deletion von TCRVβ8+ T-Zellen, während TCRVβ6+ T-Zellen unbeeinflusst bleiben (White et al. 1989; Jenkinson et al. 1990). In Grb2fl/fl Lckcretg Mäusen, die mit SEB behandelt wurden, war die negative Selektion der CD4+ Zellen gegenüber Kontrolltieren stark beeinträchtigt (Jang et al. 2010). Mit Hilfe dieser transgenen Modellen und dem Superantigen SEB wurde gezeigt, dass sowohl die positive als auch die negative Selektion der T-Zellen in Grb2fl/fl Lckcretg Mäusen gestört ist (Jang et al. 2010). Darüber hinaus wurde entdeckt, dass auch die Signalleitung in den Grb2fl/fl Lckcretg Mäusen beeinträchtigt ist (Jang et al. 2010). Nach TZR Stimulation werden die ITAMs der CD3ζ Kette von der Tyrosinkinase Lck phosphoryliert (Weiss & Littman 1994; Samelson et al. 1995). Die ITAMS rekrutieren dann die Tyrosinkinase ZAP70, die durch Autophosphorylierung aktiviert werden kann. ZAP 70 phosphoryliert den protein linker for activation of T cells (LAT), der Signalkomplexe rekrutiert, die Grb2, SLP-76, Vav, Gads, PLCγ-1, und Itk enthalten. Dies führt zu Veränderungen des Zytoskeletts, der Aktivierung von Transkriptionsfaktoren im Kern und zur Calcium- Mobilisierung (Weiss & Littman 1994; Samelson 1999; Schaeffer & Schwartzberg 2000; Myung et al. 2000). Die Phosphorylierung der TCRζ Kette, Lck, ZAP70 und LAT waren in den Grb2fl/fl Lckcretg Mäusen nach TZR Stimulation reduziert. Grb2 ist also ein positiver Faktor für die Aktivierung von Proteinen, die an der Initiierung des TZR- Signales beteiligt sind. Außerdem war in der TZR- Signalleitung die Aktivierung von P38 und JNK beeinträchtigt, während die Aktivierung von ERK und Ras unverändert war. Dies zeigt, dass ERK und Ras in TZellen auch unabhängig von Grb2 aktiviert werden können. Wahrscheinlich erfolgt die Aktivierung über RasGRP (Dower et al. 2000). Auch die Aktivierung von PLCγ und die damit verbundene Calcium- Mobilisierung nach TZR- Stimulation waren in Grb2fl/fl Lckcretg Mäusen reduziert (Jang et al. 2010). Damit ist Grb2 in naiven T-Zellen anders als in naiven B-Zellen (Ackermann et al. 2011; Jang et al. 2011) ein positiver Regulator der Calcium- Mobilisierung. Über retrovirale Transduktion wurden Grb2 Mutationen in Knochenmarkszellen von T-Zell spezifischen Grb2-/- Mäusen eingebracht, die zur Generierung von Knochenmarkschimären verwendet wurden. So wurde gezeigt, dass die Entwicklung von CD4+ T-Zellen von der SH2- und der C-terminalen SH3-, nicht aber von der N-terminalen SH3- Domäne von Grb2 abhängt (Jang et al. 2010). Kürzlich wurde beschrieben, dass Grb2 über seine SH3- Domäne konstitutiv an Thymocyte-expressed molecule involved in selection (THEMIS) binden kann (Paster et al. 2013). THEMIS reguliert den Schwellenwert des TZR-Signales, das zur positiven und negativen Selektion von T-Zellen nötig ist (Fu et al. 2013). Grb2 ist wichtig, um THEMIS über LAT zur immunologischen Synapse zu rekrutieren, wo Themis dann durch Lck and ZAP-70 phosphoryliert werden kann. Ohne diese Verbindung ist die Entwicklung der Thymozyten beeinträchtigt (Paster et al. 2013). Die Rekrutierung von CD3ζ, ZAP70 und Grb2 in lipid rafts ist beispielsweise in Patienten mit einer chronischen Hepatitis- Infektion gestört und trägt wahrscheinlich zu deren 25 Die Rolle von Grb2 in T-Zellen Einleitung defekten adaptiven Immunantwort bei. Dies unterstreicht die Wichtigkeit von Grb2 in der TZR Signalleitung (Barboza et al. 2013). Grb2 ist also ein positiver Faktor für die Signalleitung über den TZR und ist an der Organisation von lipid rafts/immunologischen Synapsen beteiligt. 26 Die Rolle von Grb2 in T-Zellen Zielsetzung der Arbeit 5 Zielsetzung der Arbeit B-Zell spezifische Grb2-/- Tiere haben eine reduzierte Zahl an B-Zellen in der Peripherie (Ackermann et al. 2011). Es ist allerdings weitgehend unklar, über welchen Mechanismus Grb2 die peripheren B-Zellen beeinflusst. Durch die Untersuchung der Überlebensfähigkeit von BZellen durch in vitro Versuche und die Überexpression des Überlebensfaktors Bcl2 in vivo sollte die Rolle von Grb2 beim Überleben von B-Zellen in der Peripherie untersucht werden. Als zweite Möglichkeit wurde untersucht, ob ein Differenzierungsblock für die reduzierten B-Zellzahlen verantwortlich ist. Dazu wurden in vitro Differenzierungansätze mit transitionalen Grb2-/- BZellen durchgeführt. Außerdem wurde die Aktivierbarkeit von Grb2-/- transitionalen Typ 1, transitionalen Typ 2 und reifen B-Zellen anhand der Calciummobilisierung untersucht, um herauszufinden, ob Grb2 die Differenzierung über die BZR Signalleitung beeinflusst. Zudem wurde der Einfluss von Grb2 auf die Expression von Genen untersucht, die in der Entwicklung von transitionalen Zellen zu reifen B-Zellen wichtig sind. Neben der B-Zell Entwicklung spielt Grb2 auch in der sekundären Immunantwort und der Keimzentrumsreaktion eine wichtige Rolle (Ackermann et al. 2011; Jang et al. 2011). Es wurde beschrieben, dass Grb2 in vitro direkt an eine immunoglobulin tail tyrosine (ITT) genannte Bindestelle im IgG- und IgE-BZR binden kann und so das BZR Signal verstärkt (Engels et al. 2009). Um den intrinsischen Effekt von Grb2 auf die Gedächtnis B-Zellen zu untersuchen, wurden Transferexperiemente mit angeglichenen Zahlen von antigen-spezifischen Grb2-/Gedächtnis B-Zellen und Kontroll-Gedächtniszellen durchgeführt. Zudem wurden Grb2fl/fl (Ackermann et al. 2011) mit cγ1cre Mäusen (Casola et al. 2006) verpaart, um Tieren zu generieren, in denen Grb2 erst in der Keimzentrumsreaktion deletiert wird. Diese Tiere ermöglichten es, die Rolle von Grb2 in Gedächtnis B-Zellen unabhängig von seiner Funktion in der B-Zell Entwicklung zu untersuchen. Die Restimulation spezifischer Grb2-/- Gedächtnis BZellen in vivo erfolgte zum einen mit einem Antigen, das die spezifisch übertragenen Gedächtniszellen B-Zell-unabhängig reaktivieren kann, um den intrinsischen Effekt von Grb2 in Gedächtnis-B-Zellen zu untersuchen (Hebeis et al. 2004). Zum anderen wurden NP-spezifische Grb2-/- Gedächtnis B-Zellen mit NP-CGG und der Unterstützung von T-Helferzellen restimuliert, um zu analysieren, wie Grb2-/- Gedächtnis B-Zellen auf T-Zell Hilfe reagieren. T-Zell spezifische Grb2-/- Mäuse (Grb2fl/fl Lckcretg Mäuse) weisen eine beeinträchtigte positive und negative Selektion auf, wenn Grb2 früh in der Entwicklung deletiert wird (Jang et al. 2010). Durch die Kreuzung von Grb2fl/fl (Ackermann et al. 2011) mit CD4cretg Mäusen wurden Tiere generiert, in denen Grb2 erst später in CD4+CD8+ Zellen deletiert wird. Der Effekt einer frühen oder einer späteren Deletion von Grb2 während der T-Zell Entwicklung sollte anhand der Grb2fl/fl Lckcretg und der Grb2fl/fl CD4cretg Mäuse vergleichend untersucht werden. 27 Die Rolle von Grb2 in T-Zellen Zielsetzung der Arbeit Aufgrund der Beteiligung von Grb2 an einer Vielzahl von Signalwegen (Jang et al. 2010; Gong et al. 2001) ist es wahrscheinlich, dass Grb2 auch die Entwicklung von T-Effektorzellen in der Peripherie beeinflusst. Daher wurde der Einfluss von Grb2 auf die T-Helferzell Differenzierung und Funktion in vitro und in vivo untersucht. Außerdem wurde der Effekt von Grb2 auf die THelferzellen im experimentellen autoimmunen Enzephalomyelitis (EAE) Modell, das stark von THelferzellen abhängig ist analysiert (Rangachari & Kuchroo 2013). 28 Die Rolle von Grb2 in T-Zellen Ergebnisse 6 Ergebnisse 6.1 B-Zell spezifische Grb2 Knockoutmaus 6.1.1 Kein Einfluss von Grb2 auf die in vitro Überlebensrate von B-Zellen 6.1.1.1 Die Überlebensrate von B-Zellen in vitro mit oder ohne BAFF Zugabe wird nicht durch Grb2 beeinflusst Grb2 fl/fl mb1cre/+ Mäuse weisen eine um die Hälfte reduzierte B-Zellanzahl in der Peripherie auf. Diese Reduktion beginnt bei den transitionalen B-Zell Entwicklungsstadien (Ackermann et al. 2011; Jang et al. 2011). Außerdem ist die spontane Apoptose von reifen Grb2 defizienten BZellen in vitro leicht erhöht und könnte für die geringere B-Zell Zahl in den Grb2fl/fl mb1cre/+ Mäusen verantwortlich sein. Zusätzlich die BAFF-Rezeptor (BAFFR) Expression reifer Grb2 defizienter B-Zellen verringert, die für ihr Überleben wichtig ist (Ackermann et al. 2011). Um zu überprüfen, ob Grb2 einen Einfluss auf das BAFF-abhängige Überleben hat, wurden unreife und reife Grb2-/- B-Zellen und Zellen von Kontrolltieren in vitro mit verschiedenen Konzentrationen des Zytokins BAFF (Blys) behandelt und die Zahl an vitalen Zellen (Propidiumiodid-negativ) zu verschiedenen Zeitpunkten bestimmt (Abb. 5). Höhere BAFF-Konzentrationen führten generell zum besseren Überleben der B-Zellen aus der Milz. Unabhängig von der Behandlung mit BAFF war das Überleben von unreifen und reifen Grb2-/- B-Zellen vergleichbar mit dem der Kontrollen. Die reduzierte BAFFR Expression von reifen Grb2-/- B-Zellen hatte dagegen unabhängig von der BAFF Konzentration keinen Effekt auf die Apoptose der Zellen (Abb. 5). Zudem reicht die vorher beschriebene leicht erhöhte spontane Apoptoserate in Grb2-/- B-Zellen nicht aus, um die Zahl der lebenden Zellen im Versuch substantiell zu beeinflussen. 29 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A d0 B d4 FL-3 Side scatter Beads 5 ng/ml BAFF 1.50 1.25 1.00 0.75 0.50 0.25 0.00 0 1 2 + 3high immature (B220 HSA time(d) 1.75 ) 4 50 ng/ml BAFF 1.50 fl/fl Grb2 +/+ mb1 1.25 Grb2fl/flmb1cre/+ 1.00 Grb2fl/flmb1+/+ + BAFF fl/fl Grb2 0.75 mb1cre/+ + BAFF 0.50 0.25 0.00 0 1 2 3 immature time(d) (B220+ HSAhigh ) 1.75 4 440 ng/ml BAFF 1.50 Grb2fl/fl mb1+/+ 1.25 Grb2fl/fl mb1cre/+ fl/fl Grb2 1.00 fl/fl Grb2 0.75 mb1+/+ BAFF mb1cre/+ BAFF 0.50 0.25 0.00 0 1 2 3 time(d) d3 1.75 5 ng/ml BAFF 1.50 1.25 1.00 0.75 0.50 0.25 0.00 0 1 2 + 3 mature (B220 HSAlow ) 1.75 50 ng/ml BAFF 1.50 Grb2fl/flmb1+/+ Grb2 mb1cre/+ 1.00 fl/fl Grb2 mb1+/+ + BAFF 0.75 Grb2fl/fl mb1cre/+ + BAFF 1.25 fl/fl 0.50 0.25 0.00 0 1.75 1 2 3 4 + low mature (B220 time(d)HSA ) 440 ng/ml BAFF 1.50 Grb2fl/flmb1+/+ 1.25 Grb2fl/flmb1cre/+ 1.00 Grb2fl/flmb1+/+ + BAFF Grb2fl/fl mb1cre/+ + BAFF 0.75 0.50 0.25 0.00 0 1 2 3 4 time(d) n=6 d2 d4 * 4 time(d) fl/fl * Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ BAFF Grb2fl/fl mb1cre/+ BAFF 4 mature (B220high HSAlow) Grb2 mb1 Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ BAFF Grb2fl/fl mb1cre/+ BAFF 30 B-Zell spezifische Grb2 Knockoutmaus d3 d4 +/+ * ** ** *** *** ** *** ) * HSA B220 D relative number of viable cells relative number of viable cells 1.75 high relative number of living cells relative number of viable cells relative number of viable cells relative number of viable cells immature (B220 low ** Propidium iodide C n=6 Ergebnisse Abb. 5: Grb2 defiziente primäre B-Zellen reagieren weiter auf eine Zytokinbehandlung mit BAFF. Ihre Überlebensrate ist vergleichbar mit der von primären B-Zellen aus Kontrollmäusen. Unreife (B220+ HSAhigh) und reife B-Zellen (B220+ HSAlow) wurden aus Gesamtmilzzellen durchflusszytometrisch sortiert. Danach erfolgte eine Inkubation zu den angegeben Zeitpunkte mit 5 ng/ml, 50 ng/ml oder 440 ng/ml BAFF oder ohne einen zusätzlichen Stimulus. Anschließend wurde die Zahl der lebenden Zellen durchflusszytometrisch bestimmt. A) Propidiumiodid negative Zellen wurden als lebend definiert und B) TrueCount-Beads (BD) wurden verwendet, um die Zellzahlen zu berechnen. C) Relative Zahl unreifer B-Zellen. D) Relative Zahl reifer B-Zellen. Für 5 ng/ml und 50 ng/ml BAFF Grb2fl/fl mb1+/+ n=3; Grb2fl/fl mb1cre/+ n=3; Grb2fl/fl mb1+/+ + BAFF n=3; Grb2fl/fl mb1+/+ + BAFF n=3. Für 440 ng/ml BAFF Grb2fl/fl mb1+/+ n=6; Grb2fl/fl mb1cre/+ n=6; Grb2fl/fl mb1+/+ + BAFF n=6; Grb2fl/fl mb1+/+ + BAFF n=6. Für die Statistik wurde der T-Test verwendet. 6.1.1.2 Die Überlebensrate von B-Zellen mit oder ohne Bcl2 Überexpression wird nicht signifikant durch Grb2 beeinflusst Neben dem BAFF Signalweg könnten für das Überleben der B-Zellen andere Mechanismen wichtig sein. Deswegen wurde mit dem anti-apoptotischen humanen Bcl2-Protein (B-cell lymphoma 2), welches in Grb2-/- B-Zellen überexprimiert wurde, überprüft, ob eine längere Überlebensrate der B-Zellen die reduzierten B-Zellzahlen ausgleichen kann. Die Überexpression von Bcl2 führte generell zu verlängertem Überleben von Grb2-/- und wildtyp B Zellen (Abb. 6). Die spontane in vitro Apoptoserate reifer Grb2-/- B-Zellen ohne Bcl2 Überexpression war gegenüber reifen wildtyp B-Zellen nach einem Tag um etwa 5 % erhöht. In reifen Bcl2 überexprimierenden Grb2-/- B-Zellen war die spontane Apoptoserate ebenfalls um 7-10 % erhöht allerdings erst nach 3 bzw. 4 Tagen. Unreife Grb2-/- B-Zellen, die Bcl2 überexprimieren zeigten ebenfalls eine um etwa 3 % erhöhte Apoptoserate an denselben Tagen (Abb. 6C und D). Diese zeitlich begrenzten, limitierten Veränderungen haben aber keinen Einfluss auf die Zahl der lebenden Grb2-/- B-Zellen mit oder ohne Bcl2 Überexpression (Abb. 5; Abb. 6E). Daher folgern wir, dass die Überlebensrate der B-Zellen durch Grb2 nicht stark beeinflusst wird. 31 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse CD24 (HSA) FSC area A Single cells immature B cells mature B cells FSC-weight B B220 d0 d8 d3 count G1 SubG1 S/G2/M DAPI-area 2 75 50 25 * * 3 4 1 0 0 0 0 1 2 5 6 7 8 100 75 50 25 1 0 2 3 4 5 n6 2 1 2 3 2 3 4 4 5 6 7 5 6 n=3 7 8 n6 * 1 8 Grb2fl/fl mb1+/+ fl/fl +/+ Grb2 fl/fl cre/+ mb1 Grb2 mb1 fl/fl cre/+ Grb2 mb1 fl/fl +/+ tg Grb2 mb1 fl/fl Bcl2 Grb2 mb1+/+ hBcl2tg Grb2 fl/fl mb1 cre/+ Bcl2tg Grb2 fl/fl mb1 cre/+ hBcl2tg statistics: two way ANOVA 0 7 time(d) 0 Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ hBcl2tg Grb2 fl/fl mb1 cre/+ hBcl2tg statistics: two way ANOVA 0 6 time(d) Zälkammer 1 * ** * * time(d) E Trypan blue negative Cell Count (x105) mature (B220high HSAlow) % cells in sub-G1 phase immature (B220low HSAhigh ) 100 Zälkammer D Trypan blue negative Cell Count (x105) % cells in sub-G1 phase C 8 time(d) n=3 32 +/+ spezifische Grb2 Knockoutmaus Grb2fl/fl mb1B-Zell fl/fl cre/+ Grb2 mb1 Grb2fl/fl mb1+/+ hBcl2tg Ergebnisse Abb. 6: Vergleichbare spontane Apoptose- und Überlebensrate nach Überexpression von humanem Bcl2 in Grb2fl/fl mb1cre/+ B-Zellen und Kontrollzellen in vitro. Durch eine komplementvermittelte T-Zelllyse wurden BZellen aus der Milz angereichert und anschließend für die angegebenen Zeiten inkubiert (37 °C, 5 % CO 2). A) Die Zellen wurden extrazellulär auf B220 und HSA (CD24) gefärbt und mit 2% Paraformaldehyd in PBS fixiert. Am letzten Tag wurden die Zellen permeabilisiert und mit DAPI intrazellulär gefärbt, um den DNA-Gehalt der Zellen zu bestimmen. B) Der Prozentsatz an Zellen im sub-G1 Gate wurde durchflusszytometrisch bestimmt. C) Prozentsatz der unreifen B-Zellen (B220low HSAhigh) im sub-G1 Gate. D) Prozentsatz der reifen B-Zellen (B220high HSAlow) im sub-G1 Gate. E) Die Zahl der Trypanblau-negativen Zellen wurden nach verschiedenen Inkubationszeiten mit einer Neubauer Zählkammer bestimmt. Für C) und D): Grb2fl/fl mb1+/+ n=6; Grb2fl/fl mb1cre/+ n=7; Grb2fl/fl mb1+/+ Bcl2tg n=8; Grb2fl/fl mb1cre/+ Bcl2tg n=7. Für E) Zellen von 3 Mäusen pro Gruppe. Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01. 6.1.2 6.1.2.1 Grb2 spielt eine wichtige Rolle in der Entwicklung von unreifen zu reifen B-Zellen Die Überexpression von humanem Bcl2 kann den Block in der B-Zell Entwicklung von B-Zell spezifischen Grb2-/- Mäusen nicht ausgleichen Zusätzlich zu den in vitro Apoptoseversuchen wurde der Einfluss von überexprimiertem humanem Bcl2 auf B-Zell Populationen mit und ohne Grb2 in vivo untersucht. Die Anzahl der gesamten B-Zellen war in Mäusen, die Bcl2 überexprimierten stark erhöht. Allerdings zeigten die reifen, T1- und T2- B-Zell Populationen in Bcl2 überexprimierenden B-Zell spezifischen Grb2-/Mäusen gegenüber Bcl2 überexprimierenden Kontrolltieren im Verhältnis die gleiche Reduktion, wie ohne Bcl2 Überexpression (Abb. 8; Tab. 1). Abgesehen von den höheren Gesamtzellzahlen war die Zahl an Bcl2 überexprimierenden pro/pre Grb2-/- B-Zellen im Knochenmark unverändert (Abb. 7; Tab. 1), während die Zahl der unreifen und reifen B-Zellen in Grb2fl/fl mb1cre/+ Mäusen mit und ohne Bcl2 Überexpression reduziert war (Abb. 7; Tab. 1). Auch in der Milz waren die unreifen und reifen B-Zellen von Grb2fl/fl mb1cre/+ Bcl2tg Mäusen gegenüber Bcl2 überexprimierenden Kontrolltieren etwa im selben Verhältnis reduziert, wie in Tieren ohne Bcl2 Überexpression (Abb. 8; Tab. 1). Die Überexpression von humanem Bcl2 hatte keinen Einfluss auf die Zahl der B1-Zellen im Peritoneum und konnte somit auch die signifikant reduzierte B1Zellzahl im Peritoneum von B-Zell spezifischen Grb2-/- Mäusen im Vergleich zu Kontrolltieren nicht kompensieren (Abb. 9). Die humane Bcl2 Überexpression in vivo zeigte in Kombination mit den in vitro Überlebensassays, dass eine erhöhte Apoptoserate keinen Einfluss auf die reduzierte Zahl der B-Zellen in B-Zell spezifischen Grb2-/- Mäusen hatte, stattdessen weisen die Ergebnisse auf eine Blockade in der Entwicklung hin. 33 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A Bone Marrow B fl/fl cre/+ Grb2fl/fl mb1+/+ immature 2.7% ±0.9 Grb2 mb1 mature 2.5% ±0.6 2.1% ±0.5 1.7% ±0.5 F5 BM IgM IgD B220 FcyR2b ohne Trans u MR 7 pro/pre 6.4% ±0.8 Grb2fl/fl mb1+/+ hBcl2tg 6.4% ±1.7 Grb2fl/fl mb1cre/+ hBcl2tg 5.2% ±1.3 5.8% ±1.2 * * 6 Total cells (x106) IgM 5.5% ±1.1 5 4 3 * 2 ** 1 3.1% ±0.7 lls ce B ce e B m at ur e at ur m 7.4% ±1.1 im 6.8% ±1.1 pr o/p re -B ce lls lls 0 B220 Abb. 7: Eine Überexpression des anti-apoptotisch wirkenden humanen Bcl2 Genes in der B-Zell Entwicklung kann den Verlust von Grb2 in Grb2fl/fl mb1cre/+ Mäusen nicht kompensieren. Das humane Bcl2 befindet sich im Lokus für die µ-schwere Kette und wird so in B-Zellen überexprimiert. A) Für Knochenmarkszellen wurde der Anteil pro/pre B-Zellen (B220+ IgM-), unreifen B-Zellen (B220low IgM+) und reifen B-Zellen (B220high IgM+) durchflusszytometrisch bestimmt. B) Gesamtzellzahl für Populationen aus A). Grb2fl/fl mb1+/+ n=7 Mäuse; Grb2fl/fl mb1cre/+ n=9 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=8 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=5 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01. 34 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Spleen B A Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ 23.5%±4.8 31.7%±4.1 T cells F1 SP B220 CD5 B1 3.6%±1.5 8.5%±1.6 300 Grb2fl/fl mb1cre/+ hBcl2tg 14.2%±1.2 12.4%±3.2 ** 3.6%±0.7 * 0 ** 45.5% ±4.9 ce 2 B 51.5% ±6.8 B 1 ce lls 1.4%±0.3 100 ce lls CD5 Grb2fl/fl mb1+/+ hBcl2tg 200 T 20.8% ±3.7 lls B2 40.6% ±6.8 Total cells (x106) * B220 D C B220+ Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ T2/MZ 3.7%±1.4 4.2%±1.5 F4 SP CD21 IgM B220 FcyR2b Mature 13.4%±2.7 1.5%±1.2 Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ hBcl2tg hBcl2tg 1.4%±0.5 50 ** ** 26%±2.7 5%±2.8 12.8%±3.2 IgM * 0 Grb2fl/fl Grb2fl/fl Grb2fl/fl Grb2fl/fl at ur e 31.1%±3.1 *** M 1.1%±0.4 100 T1 CD21 T1 T2 -M Z 5.1%±1.2 * 150 Total cells (x106) 27.2%±4.4 mb1+/+ mb1cre/+ mb1+/+ hBcl2tg mb1cre/+ hBcl2tg 35 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 8: Eine Überexpression des anti-apoptotisch wirkenden humanen Bcl2 Genes in der Peripherie kann den Verlust von Grb2 in Grb2fl/fl mb1cre/+ Mäusen nicht kompensieren. Das humane Bcl2 befindet sich im Lokus für die µ-schwere Kette und wird so in B-Zellen überexprimiert. A) Der Anteil von B1 B-Zellen (B220+ CD5+), B2 B-Zellen (B220+ CD5-) und T-Zellen (B220- CD5+) in der Milz wurde durchflusszytometrisch bestimmt. B) Gesamtzellzahl für Populationen aus A). C) Anteil von reifen B-Zellen (B220+ CD21med IgMmed), Transitionalen Typ 1 B-Zellen (B220+ CD21low IgMhigh) und Transitionalen Typ2 B-Zellen/Marginalzonen B-Zellen (B220+ CD21low IgMhigh) in der Milz. D) Gesamtzellzahl für Populationen aus C). Grb2fl/fl mb1+/+ n=7 Mäuse; Grb2fl/fl mb1cre/+ n=9 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=10 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=6 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. 36 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Peritoneal Cavity B A Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ 4%±1.9 3.9%±2 B1 20.7%±6.4 F7 PC CD5 B220 FcyR2b 11.8%±4 T cells 2.5 CD5 16% ±6.6 Grb2fl/fl mb1+/+ hBcl2tg Grb2fl/fl mb1cre/+ hBcl2tg 2.2%±0.8 2.9%±0.9 14.8%±4 7%±1.5 Total cells (x106) B2 9.6% ±5.5 2.0 1.5 * * 1.0 0.5 ce lls lls T ce 2 B 1 28.4% ±5.8 B 25.6% ±8.1 ce lls 0.0 B220 C CD19+ D Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ B1a 12.6%±2.2 10.1%±2.8 F8 PC CD43 CD19 CD5 FcyR2b 7.5% ±4.1 0.9% ±0.4 7.8% ±2.8 4.1% ±4 Grb2fl/fl mb1+/+ hBcl2tg Grb2fl/fl mb1cre/+ hBcl2tg 9.1%±2.1 4.9%±0.8 Total cells (x106) B1b 1.5 1.0 * * 0.5 p=0.05 * B 2 ce lls ce lls 3.3% ±1.2 1b 18.1% ±5 B 1.3% ±0.6 1a 20.7% ±6.1 ce lls 0.0 B CD5 2.0 B2 CD43 37 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 9: Geringere Zahl an B1a B-Zellen im Peritoneum von Grb2fl/fl mb1cre/+ Mäusen. Eine Überexpression des anti-apoptotisch wirkenden humanen Bcl2 Genes in Zellen des Peritoneums hat keinen Einfluss auf die Zahl der B1 B-Zellen. Das humane Bcl2 befindet sich im Lokus für die µ-schwere Kette und wird so in B-Zellen überexprimiert. A) Der Anteil von B1 B-Zellen (B220+ CD5+), B2 B-Zellen (B220+ CD5-) und T-Zellen (B220- CD5+) im Peritoneum wurde durchflusszytometrisch bestimmt. B) Gesamtzellzahl für Populationen aus A). C) Anteil von B1a B-Zellen (CD19+ CD5+ CD43+), B1b B-Zellen (CD19+ CD5- CD43+) und B2 B-Zellen (CD19+ CD5- CD43-). D) Gesamtzellzahl für Populationen aus C). Grb2fl/fl mb1+/+ n=5 Mäuse; Grb2fl/fl mb1cre/+ n=8 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=10 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=6 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05. 38 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Bone Marrow (x106) proB/preB (B220+ IgM-) Immature B (B220med IgM+) Mature B (B220high IgM+) Mature recirculating (B220+ IgDhigh) Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ Grb2fl/flmb1+/+ Bcl2tg Grb2fl/flmb1cre/+ Bcl2tg 2.2 ± 1.2 1.1 ± 0.6* 0.9 ± 0.5** 0.5 ± 0.2** 1.7 ± 0.6 0.6 ± 0.2 0.5 ± 0.2 0.2 ± 0.1 4.6 ± 2.2 4.3 ± 2.1* 3.8 ± 1.9* 4.0 ± 1.8* 4.0 ± 1.4 3.0 ± 1.4 1.7 ± 0.8 2.0 ± 0.6 3.3 ± 1.7* 37.4 ± 13.3** 21.2 ± 5.5 6.3 ± 1.8 1.2 ± 0.6* 4.2 ± 3.1** 4.6 ± 1.7** 3.6 ± 0.8* 25.6 ± 10.9** 5.8 ± 2.3 14.2 ± 5.2 21.4 ± 7.3 4.4 ± 2.5 0.5 ± 0.3 1.9 ± 0.8 0.9 ± 0.7 2.4 ± 1.2 8.9 ± 2.8 4.6 ± 1.8** 178.3 ± 82.3* 42.1 ± 16.4 20.0 ± 12.0 10.8 ± 6.4** 26.7 ± 9.8*** 43.6 ± 19.3*** 3.6 ± 1.4 106.0 ± 42.2* 7.9 ± 2.5 99.4 ± 25.4 31.0 ± 6.7 11.3 ± 6.6 2.8 ± 2.0 10.1 ± 2.9 10.1 ± 5.3 2.9 ± 1.1 56.5 ± 12.1 0.8 ± 0.6* 0.3 ± 0.2 0.2 ± 0.1 0.4 ± 0.2* 0.03 ± 0.01* 0.2 ± 0.1 0.2 ± 0.2 0.2 ± 0.1 0.1 ± 0.0 0.2 ± 0.1 0.05 ± 0.03 0.1 ± 0.1 0.7 ± 0.4* 1.3 ± 0.9 0.1 ± 0.1 0.4 ± 0.2* 0.05 ± 0.02 1.0 ± 0.7 0.3 ± 0.2 1.3 ± 1.0 0.1 ± 0.1 0.2 ± 0.1 0.14 ± 0.12 0.8 ± 0.7 Spleen (x106) B1 (B220+ CD5+) B2 (B220+ CD5-) T cells (B220- CD5+) T1-MZ (B220+ IgM+ IgDlow) T2 (B220+ IgMhigh IgDhigh) Mature B (B220+ IgMlow IgDhigh) T1 (B220+ CD21low IgMhigh) T2-MZ (B220+ CD21high IgMhigh) Mature B (B220+ CD21med IgMmed) Peritoneal Cavity (x106) B1 (B220+ CD5+) B2 (B220+ CD5-) T cells (B220- CD5+) B1a (CD19+ CD5+ CD43+) B1b (CD19+ CD5- CD43+) B2 (CD19+ CD5- CD43-) Tab. 1: Absolute Zellzahlen für verschiedene Lymphozytenpopulationen von Grb2 fl/fl mb1+/+, Grb2fl/fl mb1cre/+, Grb2fl/fl mb1+/+ Bcl2tg und Grb2fl/fl mb1cre/+ Bcl2tg Mäusen. Verglichen wurden Grb2fl/flmb1cre/+ gegen Grb2fl/flmb1+/+ Mäuse und Grb2fl/flmb1cre/+ Bcl2tg gegen Grb2fl/flmb1+/+ Bcl2tg Mäuse. Grb2fl/flmb1+/+ n=5-7 Mäuse; Grb2fl/flmb1cre/+ n=8-9 Mäuse; Grb2fl/flmb1+/+ Bcl2tg n=8-10 Mäuse; Grb2fl/flmb1cre/+ Bcl2tg n=5-6 Mäuse; Für die Statistik wurde der TTest verwendet; *p<0,05; **p<0,01; ***p<0,001. 39 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse 6.1.2.2 Reduzierte Zahl transitionaler und reifer B-Zellen im Blut Zu der reduzierten Zahl an transitionalen B-Zellen in der Milz von B-Zell spezifischen Grb2-/Mäusen könnte auch ein beeinträchtigter Übergang der B-Zellen vom Knochenmark in die Milz beitragen. Bei einem Defekt der Zellen in die Milz einzuwandern würden sich die transitionalen B-Zellen im Blut ansammeln. Da die Zahl von T1 B-Zellen von spezifischen Grb2-/- Mäusen im Blut analog zur Zahl in der Milz um etwa die Hälfte reduziert und die Zahl reifer B-Zellen ebenfalls reduziert war, weist dieser Versuch nicht auf eine veränderte Wanderung von transitionalen B-Zellen in die Milz hin. (Abb. 10). A B B220+ Grb2fl/fl mb1+/+ relativ IgM IgD Transitional blood Mature *** IgD T1 Grb2fl/fl mb1cre/+ relative number of Lymphocytes 0.8 Grb2fl/fl m Grb2fl/fl m 0.7 0.6 0.5 0.4 0.3 *** 0.2 0.1 T1 M at ur e 0.0 IgM Abb. 10: Grb2fl/fl mb1cre/+ Mäuse weisen im Blut eine reduzierte Zahl an Transitionalen und reifen B-Zellen auf. Die Erythrozyten wurden durch eine tonische Lyse aus den Blutproben depletiert. Die aufgereinigten Zellen wurden auf die Marker B220, IGM und IgD angefärbt und durchflusszytometrisch analysiert. B) Der relative Anteil an reifen BZellen (B220+,IgDhigh, IgMmed) und transitionalen Typ 1 B-Zellen (B220+,IgDlow, IgMhigh) wurde bestimmt, wobei die Zahl der B220- Lymphozyten als Referenzwert diente. Grb2fl/fl mb1+/+ n=9 Mäuse; Grb2fl/fl mb1cre/+ n=8 Mäuse. Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. 40 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse 6.1.2.3 Während der B-Zell Entwicklung wird der BAFF-R in Grb2fl/fl mb1cre/+ Mäusen nicht hoch reguliert. Dieser Defekt kann nicht durch die Überexpression von humanem Bcl2 ausgeglichen werden. Die BAFF-R Expression wird während der Reifung von unreifen zu reifen B-Zellen hochreguliert. In Grb2-/- B-Zellen ist dieser Prozess beeinträchtigt und die BAFF-R Expression bleibt niedrig (Ackermann et al. 2011), was aber in vitro keinen negativen Effekt auf das Überleben hatte. Um zu untersuchen, ob man einen Effekt der niedrigeren BAFF-R Expression in B-Zell spezifischen Grb2-/- Mäusen in vivo ausschließen kann wurde analysiert, ob die Überexpression des Überlebensfaktors Bcl2 auch die Expression des BAFF-R in B-Zell spezifischen Grb2-/- Mäusen erhöht und somit den fehlenden Einfluss von Grb2 auf den BAFF-R ausgleicht. Es wurden aber keine deutlichen Veränderungen in der BAFF-R Expression durch die Überexpression von humanem Bcl2 festgestellt (Abb. 11), weshalb es anhand der Bcl2 überexprimierenden Mäuse nicht möglich war Rückschlüsse auf mögliche Funktionen der niedrigeren BAFF-R Expression in vivo zu ziehen. 41 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A immature mature % of max pro/pre BAFF receptor expression Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ hBcl2tg cre/+ hBcl2tg mb1B220 F6 BMGrb2 IgMfl/flIgD BAFFR ohne Trans u MR B *** BAFF-R expression (geometric Mean) 12.5 * 10.0 7.5 ** * 5.0 * 2.5 lls ce B ce m at ur e B at ur e m im pr o/p re -B ce lls lls 0.0 Abb. 11: Die Expression des BAFF-Rezeptors ist in den unreifen und reifen Grb2-/- B-Zellen reduziert und kann nicht durch die Überexpression von humanem Bcl2 kompensiert werden. A) Die pro/pre B-Zellen (B220+ IgM-), die unreifen B-Zellen (B220low IgMmed) und die reifen B-Zellen (B220high IgMmed) aus dem Knochenmark wurden durchflusszytometrisch auf ihre BAFF-Rezeptor Expression untersucht. Grb2fl/fl mb1+/+ n=7 Mäuse; Grb2fl/fl mb1cre/+ n=9 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=8 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=5 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. 6.1.2.4 Bei der Entwicklung von Transitionalen Typ 2 zu reifen B-Zellen in vitro spielt Grb2 eine wichtige Rolle Die reduzierten B-Zellzahlen in Grb2fl/fl mb1cre/+ Mäusen wurden nicht durch eine erhöhte Apoptoserate der B-Zellen ausgelöst. Darum wurde analysiert, ob die Reduktion durch einen Block in der Differenzierung hervorgerufen wird. In einer Veröffentlichung wurde beschrieben, dass isolierte T2 B-Zellen, die mit anti-IgM stimuliert werden in vitro zu reifen B-Zellen 42 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse differenzieren können, während T1 B-Zellen nicht zu reifen B-Zellen werden, sondern in Apoptose gehen (Su & Rawlings 2002). Darum haben wir das Reifungspotential von sortierten T1 Grb2-/- B-Zellen (B220+ HSAhigh CD21low) und sortierten T2 Grb2-/- B-Zellen (B220+HSAhighCD21highCD23+) (Wie in Abb. 12 gezeigt) mit dem beschriebenen Protokoll analysiert (Su & Rawlings 2002). Nach 48 h Inkubation war unabhängig von der Stimulation keine Reifung von T1 Grb2-/- B-Zellen oder den entsprechenden Kontroll-T1 B-Zellen messbar (Abb. 12A,C). Ein Teil der T2 Zellen war hingegen gereift und erschien im Gate für reife BZellen (Abb. 12B,C). Das Potential von T2 Grb2-/- B-Zellen sich spontan, nach BZR-Stimulation oder nach BZR-Stimulation und BAFF Zugabe zu reiferen B-Zellen zu entwickeln war drastisch reduziert (Abb. 13). Nach Stimulation mit dem Mitogen LPS war keine deutliche Reifung zu erkennen und es war auch kein Unterschied zwischen den Grb2-/- und den Kontrollzellen detektierbar (Abb. 13). Grb2 fördert also die Differenzierung von transitionalen Typ 2 zu charakteristisch reiferen B-Zellen durch einen intrinsischen Effekt, da die Reifung in vitro unabhängig von der Umgebung der Zellen in vivo gemessen wurde. 43 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Mature CD21 CD21high (T2/MZ) Cells CD21 B220+HSAhighCD21hi B220+HSAhighCD21hi B220+ B220+ Mature sorted cells CD21low (T1) CD24 (HSA) CD21high (T2) 97% Cells pre-Sort 99.2% CD21low (T1) T2 T2 CD24 (HSA) CD23 CD23 B220+ CD21high (T2) 95.2% Mature CD21high (T2) 91.6% CD21low (T1) CD21 CD21 Mature B220+ CD21low (T1) CD24 (HSA) CD24 (HSA) B B220+ Abb. 12: Strategie zum sortieren staining von T1, T2after und reifen B-Zellen. T-Zellen wurden mit anti-CD90.2 (Thy1) restained cells remaining 48h of culture magnetischen Beads depletiert, um B-Zellen aus der Milz anzureichern. Die Zellen wurden dann weiter durchflusszytometrisch wurden auf B220, HSA (CD24), CD21, CD23 gefärbt. Transitionale Mature T1 aufgereinigt. A) Die ZellenT2 Mature CD21 high BTyp 1 B-Zellen (B220+ HSAhigh CD21low), Transitionale Typ 2 B-Zellen (B220+ HSAhigh CD21high CD23+) CD21 oder reife + low int (T2) Zellen (B220 HSA CD21 ) wurden sortiert. Mature CD21low (T1) CD24 (HSA) Suppl. Fig. X: Sorting strategy for T1, T2 and mature B cells. Splenic B cells magnetically 44 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A T1 B cell maturation B220+ unstim. Grb2fl/fl mb1+/+ anti-IgM (Fab2) anti-IgM (Fab2) + BAFF LPS. CD21high (T2/MZ) Mature 1.41% 0.93% 1.72% 1.55% 1.91% 4.62% 5.17% CD21 CD21low (T1) Grb2fl/fl mb1cre/+ 1.3% CD24 (HSA) anti-IgM (Fab2) + BAFF anti-IgM (Fab2) B T2 B cell maturation B220+ unstim. LPS. Grb2fl/fl mb1+/+ CD21high (T2/MZ) Mature 9.82% 17.8% 21.2% 11.3% 5.13% 6.82% 19.4% CD21 CD21low (T1) Grb2fl/fl mb1cre/+ 2.82% Test1Mittelwerte alle Exp T1 to T1 CD24 (HSA) 2.5 mature from T2 mature from T1 ** 2.0 * Grb2fl/fl mb1cre+/+ Grb2fl/fl mb1crecre/+ 1.5 1.0 0.5 0.0 an ti- ant u i Ig M -IgM ns t + (1 im. B 0µ A FF g (0 /ml ) .2 LP µg / m S l) (1 µg /m an l) ti- ant u i Ig M -IgM ns t + (1 im. B 0µ A FF g (0 /ml ) .2 LP µg /m S l) (1 µg /m l) mature B cells developed from T1 or T2 B cells C 45 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 13: Transitionale Typ 2 B-Zellen von Grb2fl/fl mb1cre/+ Mäusen weisen in vitro einen Differenzierungsblock zu reifen naiven B-Zellen auf. A), B) und C) T-Zellen wurden mit anti-CD90.2 (Thy1) magnetischen Beads depletiert, um B-Zellen aus der Milz anzureichern. Daraus wurden über durchflusszytometrische Zellsortierung die transitionalen Typ 1 (T1) B-Zellen (B220+ HSAhigh CD21low) und die transitionalen Typ 2 (T2) B-Zellen (B220+ HSAhigh CD21high CD23+) aufgereinigt. Die Zellen wurden für 48h mit anti-IgM (Fab2) (10 µg/ml), anti-IgM (Fab2) (10 µg/ml) und BAFF (0.2 µg/ml), LPS (1 µg/ml) oder ohne zusätzliche Stimuli kultiviert (37 °C, 5 % CO2). A) Der Prozentsatz an reifen B-Zellen, die sich aus sortierten transitionalen Typ1 B-Zellen (A) oder transitionalen Typ 2 B-Zellen (B) differenzierten wurde durchflusszytometrisch bestimmt (B220+ HSAlow CD21int). C) Quantifizierung von vier unabhängigen Experimenten. Als Referenz dienten die aus Grb2fl/fl mb1+/+ transitionalen Typ 2 Zellen ohne Stimulation gereiften B-Zellen. Grb2fl/fl mb1+/+ n=4 Pools von Zellen. Jeder Pool bestand aus Zellen von 3-4 Mäusen; Grb2fl/fl mb1cre/+ n=4 Pools von Zellen. Jeder Pool bestand aus Zellen von 3-4 Mäusen. Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01. 6.1.3 6.1.3.1 Die Rolle von Grb2 in der B-Zell Signalleitung transitionaler und reifer B-Zellen Beeinträchtigung der Genexpression von Genen in Grb2-/- B-Zellen, die entscheidend für die Differenzierung von unreifen zu reifen B-Zellen sind Die Differenzierung von transitionalen zu reifen B-Zellen ist von der der Transkription von Genen abhängig, die nach der Stimulation über den BZR zum Überleben und zur Proliferation beitragen (Carman et al. 1996; Andrews & Rawlings 2009; Andrews et al. 2012). Typischerweise werden in reifen B-Zellen nach BZR Stimulation anti-apoptotische Gene, wie Gene der Bcl2Familie oder Gene, die für den Eintritt in den Zellzyklus wichtig sind, hoch reguliert. Um zu überprüfen, ob die Expression solcher kritischer Gene in B-Zell spezifischen Grb2-/- Mäusen betroffen ist, wurden sortierte T1, T2 oder reife B-Zellen mit einer quantitativen Realtime PCR untersucht. Grb2-/- T1 B-Zellen weisen eine reduzierte Expression der Gene für Bcl-xl und A1 (Bcl2a1), zwei Mitglieder der Bcl2-Familie auf (Abb. 14A,B). Die Menge an Bcl-xl war in T1, T2 und reifen B-Zellen auch noch nach BZR Stimulation niedrig. Die Expression des Gens für Bcl2 war hingegen in reiferen Grb2-/- B-Zellen und nach BZR Stimulation kaum mehr verändert. Die Realtime PCR Analyse ergab außerdem, dass die Expression von Genen, die wichtig für den Eintritt in den Zellzyklus sind, unterschiedlich von Grb2 beeinflusst werden. Während das Gen für c-Myc in T2 und reifen B-Zellen nach Stimulation nur schwach exprimiert wurde, wurde das Gen für Cyclin D2 höher in T2 B-Zellen exprimiert (Abb. 14C,D). Die Expression des Transkriptionsfaktors Mef2c, der für das Überleben und die Proliferation von transitionalen BZellen wichtig ist, war in T1 und reifen B-Zellen ohne BZR Stimulation niedriger exprimiert (Abb. 14E). Demnach reguliert Grb2 in B-Zellen mehrere Gene, die für das Überleben und die Proliferation von transitionalen B-Zellen wichtig sind. 46 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse qRT PCR B A Bcl2l1 (Bcl-xl) Bcl2a1 (A1) 3 Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ ** relative expression 2 1 0 * 1 p=0.07 5.0 2.5 0.0 M at ur e T2 Ccnd2 2.0 * Grb2fl/fl mb1+/+ cre/+ Grb2fl/fl 1.5mb1 relative expression * 10.0 anti-IgM Fab(2) unstim. D Myc 7.5 T1 M anti-IgM Fab(2) C at ur e T2 M T1 at ur e T2 T1 M at ur e T2 T1 0 unstim. Grb Grb 1.0 0.5 unstim. at ur e M T2 T1 at ur e M M anti-IgM Fab(2) unstim. E at ur e T2 T1 M at ur e T2 T1 0.0 T1 relative expression 2 Grb Grb T2 relative expression 3 anti-IgM Fab(2) Mef2c * 2.0 Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ * 1.5 1.0 0.5 unstim. at ur e M T2 T1 at ur e M T2 0.0 T1 relative expression 2.5 anti-IgM Fab(2) 47 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 14: Grb2fl/fl mb1cre/+ B-Zellen zeigen eine verringerte Expression von Genen, die wichtig für das Überleben und den Zellzyklus sind. T-Zellen wurden mit anti-CD90.2 (Thy1) magnetischen Beads depletiert, um B-Zellen aus der Milz anzureichern. Daraus wurden über durchflusszytometrische Zellsortierung Transitionale Typ 2 B-Zellen (B220+ HSAhigh CD21high CD23+), Transitionale Typ 1 B-Zellen (B220+ HSAhigh CD21low) oder reife B-Zellen (B220+ HSAlow CD21int) isoliert. Die isolierten Zellpopulationen wurden für 3h mit anti-IgM (Fab2) (10 µg/ml) oder ohne zusätzliche Stimuli kultiviert (37 °C, 5 % CO2). Anschließend wurden die Expressionslevel von Genen mittels quantitativer PCR bestimmt. Dargestellt sind Expressionslevel von Genen mit Aktin als Kalibrator und stimulierten T1 B-Zellen als Referenz. A) Bcl2l1 (Bcl-xl), B) Bcl2a1, C) Myc, D) Cyclin D2 (Ccnd2), E) Mef2c. Grb2fl/fl mb1+/+ n=3 Pools von Zellen. Jeder Pool bestand aus Zellen von 4-5 Mäusen. Grb2fl/fl mb1cre/+ n=3 Pools von Zellen. Jeder Pool bestand aus Zellen von 5-7 Mäusen; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01. 6.1.3.2 Grb2 ist ein negativer Regulator des Calciumsignalweges in T2 und reifen B-Zellen aber die Veränderungen haben keinen Einfluss auf die B-Zell Differenzierung Das BZR vermittelte Ca2+ Signal löst unterschiedliche Reaktionen in T1 und T2 B-Zellen aus und ist entscheidend für die Reifung von T2 zu reifen B-Zellen (Hoek et al. 2006; Gross et al. 2009). B-Zellen der Milz aus B-Zell spezifischen Grb2-/- Mäusen zeigen nach BZR Stimulation eine erhöhte Calciummobilisierung (Ackermann et al. 2011; Jang et al. 2011). Um zu testen, ob eine beeinträchtigte Calciummobilisierung für den Differenzierungsdefekt von Grb2-/- B-Zellen verantwortlich ist wurde die Calciummobilisierung für die T1, T2 und reifen B-Zellen einzeln bestimmt. Nach der BZR-Stimulation von Grb2-/- B-Zellen war die Stärke des Calciumsignals in T1 B-Zellen unverändert aber es war in T2 und reifen Grb2-/- B-Zellen erhöht (Abb. 15). In der Abbildung ist auch die inhibitorische Rolle des FcγR2b in Grb2-/- B-Zellen dargestellt, die separat beschrieben ist (6.1.4.1). Dies weist darauf hin, dass Grb2 in verschiedenen Entwicklungsstadien unterschiedliche Funktionen in der Regulation des Calciumsignales hat. Dieses Ergebnis zeigt, dass es keinen Defekt in der Calciummobilisierung von Grb2-/- T2 B-Zellen gibt, der die beeinträchtigte Differenzierung zu reifen B-Zellen erklären kann. 48 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A Loading control Intensity of stimulation Goat IgG-F(ab)2 α-mouse-IgM: 3 µg 6 µg 10 µg Goat IgG α-mouse-IgM: 4.5 µg 9 µg 15 µg 0.05 µg Ionomycin 70000 60000 50000 40000 30000 0 50 100 150 200 90000 Ca 80000 70000 60000 50000 40000 30000 0 50 100 50000 40000 30000 0 50 100 150 200 Ca Grb2fl/fl Grb2fl/fl 130000 Grb2fl/fl Grb2fl/fl mb1+/+ -IgM Fab2 mb1+/+ -IgM mb cre/+ -IgM Fab2 mb cre/+ -IgM 80000 30000 0 50 100 150 200 time(s) time(s) 40000 30000 150 200 50000 40000 30000 0 50 100 time(s) 90000 80000 70000 60000 50000 40000 30000 0 50 100 150 200 70000 60000 50000 40000 30000 100 100000 Ca Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 -IgM Fab2 mb 70000 Legend 60000 50000 40000 30000 0 50 100 150 200 80000 70000 60000 50000 40000 30000 100 time(s) 200 100000 150 150 100000 Ca -IgM Fab2 60000 50000 40000 30000 50 100 200 100000 Ca 150 200 Grb2fl/fl mb1+/+ -IgM Fab2 -IgM Fab2 70000 Legend 60000 50000 40000 30000 0 50 100 60000 30000 0 50 100 150 150 Ca Ca2+ Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 mb1+/+ -IgM 80000fl/fl Grb2 mb cre/+ -IgM Fab2 70000 Legend 60000 50000 40000 30000 0 50 100 100000 150 200 stimulation 2+ 210000 Ca Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 mb1+/+ -IgM 150000 Grb2fl/fl mb cre/+ -IgM Fab2 Legend 180000 fl/fl 120000 90000 60000 30000 0 50 100 2 mb1+/+ -IgM mb cre/+ -IgM Fab2 mb cre/+ -IgM 60000 50000 40000 30000 50 100 200 100000 Ca 150 200 210000 stimulation 2+ Ca mb1+/+ -IgM Fab Grb2fl/fl Grb2 150000 Grb2fl/fl Grb2fl/fl 120000 180000 fl/fl 2 mb1+/+ -IgM mb cre/+ -IgM Fab2 mb cre/+ -IgM 90000 60000 30000 0 50 100 Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 mb1+/+ -IgM 80000fl/fl Grb2 mb cre/+ -IgM Fab2 70000 Legend 60000 50000 40000 30000 50 100 time(s) 150 200 stimulation 2+ 210000 Ca Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 mb1+/+ -IgM 150000 Grb2fl/fl mb cre/+ -IgM Fab2 Legend 180000 fl/fl 120000 90000 60000 30000 0 50 100 150 time(s) 49 B-Zell spezifische Grb2 Knockoutmaus 200 Ca2+ 90000fl/fl 0 150 time(s) stimulation 2+ time(s) 200 Ca2+ stimulation 2+ 0 150 time(s) Ca mb1+/+ -IgM Fab Grb2fl/fl Grb2 80000fl/fl Grb2 70000 Grb2fl/fl 90000fl/fl 200 time(s) Ca2+ stimulation 2+ mb 90000 time(s) 90000 fl/fl Grb2 mb1+/+ -IgM 80000 fl/fl cre/+ Grb2 120000 Ca2+ Grb2fl/fl mb1+/+ -IgM Fab2 0 Ca Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 mb1+/+ -IgM 150000 Grb2fl/fl mb cre/+ -IgM Fab2 Legend 180000 fl/fl time(s) 90000 fl/fl Grb2 mb1+/+ -IgM 80000 fl/fl cre/+ Grb2 mb 70000 Legend 200 90000fl/fl Ca2+ Ca2+ (bound/ unbound Indo-1) stimulation 2+ 50 100 stimulation 2+ time(s) 90000 0 150 stimulation 2+ Marginal zone B cells 2+ Cahigh (B220+ HSAhigh CD21 CD23-) Ca 50 210000 Ca2+ 90000 fl/fl Grb2 mb1+/+ -IgM 80000 fl/fl cre/+ time(s) 100000 0 Ca2+ Ca2+ (bound/ unbound Indo-1) 80000 50 30000 Ca2+ stimulation 2+ 90000 0 40000 time(s) Mature B cells 2+ (B220+ HSAlow CD21Caint) Ca 50000 stimulation 2+ time(s) stimulation 2+ time(s) 100000 200 Ca2+ (bound/ unbound Indo-1) Ca stimulation 2+ Ca2+ (bound/ unbound Indo-1) Transitional Type 2 B cells 2+ (B220+ HSAhigh CD21Cahigh CD23+) 100000 150 60000 time(s) Ca2+ (bound/ unbound Indo-1) 100 -IgM Fab2 mb 60000 Ca Grb2fl/fl mb1+/+ -IgM Fab2 Grb2 mb1+/+ -IgM 80000fl/fl Grb2 mb cre/+ -IgM Fab2 70000 Legend 90000fl/fl Ca2+ (bound/ unbound Indo-1) 50000 Grb2 70000 Legend 100000 Ca2+ (bound/ unbound Indo-1) 60000 Ca Grb2fl/fl mb1+/+ -IgM Fab2 90000 fl/fl Grb2 mb1+/+ -IgM 80000 fl/fl cre/+ Ca2+ stimulation 2+ Ca2+ (bound/ unbound Indo-1) 70000 100000 Ca2+ stimulation 2+ Ca2+ (bound/ unbound Indo-1) 80000 50 18 µg Ca2+ (bound/ unbound Indo-1) 90000 0 13.5 µg Ca2+ stimulation 2+ Ca2+ (bound/ unbound Indo-1) Ca 12 µg 0.1 µg Ionomycin 9 µg Transitional Type 1 B cells 2+ (B220+ HSAhigh CD21Calow) 100000 9 µg Ca2+ (bound/ unbound Indo-1) Rabbit IgG α-mouse-IgM: Ca2+ (bound/ unbound Indo-1) mb1 -IgM mb cre/+ -IgM Fab2 mb cre/+ -IgM 180000 Grb2fl/fl mb cre/+ -IgM Fab2 Legend Rabbit IgG-F(ab)2 6 µg α-mouse-IgM: Ca2+ (bound/ unbound Indo-1) 2 +/+ stimulation 2+ Grb2fl/fl mb1+/+ -IgM Fab2 Grb2fl/fl mb1+/+ -IgM B Ca2+ (bound/ unbound Indo-1) 200 Camb1+/+ -IgM Fab Grb2fl/fl Grb2 70000 Grb2fl/fl Grb2fl/fl 60000 80000 fl/fl time(s) time(s) Ca2+ (bound/ unbound Indo-1) 150 90000 stimulation 2+ Ca2+ (bound/ unbound Indo-1) Ca 80000 stimulation 2+ Ca2+ (bound/ unbound Indo-1) 90000 Ca2+ Ca2+ Ca2+ stimulation 2+ Ca2+ (bound/ unbound Indo-1) Ca2+ (bound/ unbound Indo-1) mostly unstained B cells Ca2+ CD5- MAC1- 200 Ergebnisse Abb. 15: Höheres Ca2+ Signal nach B-Zell Rezeptor Stimulation ab den transitionalen B-Zell Entwicklungsstadien und funktionelle Ca2+ Inhibition über den FcγR2b in Grb2fl/fl mb1cre/+ Mäusen. 107 mit Indo-1 beladene Milzzellen, die extrazellulär auf A) Mac1 und CD5 oder B) B220 (RA3-6B2), HSA (M1/69), CD21 (E79) und CD23 (B3B4) gefärbt waren wurden auf die Ca2+ Mobilisierung nach Stimulation untersucht. Stimuliert wurde mit equimolaren Konzentrationen von anti-IgM oder anti-IgM (Fab2). Der inhibitorische Effekt des FcγR2b auf das Ca2+ Signal kann gemessen werden, in dem er über den IgG Fc-Teil des anti-IgM Antikörpers an den B-Zell Rezeptor rekrutiert wird. Dies geschieht nicht, wenn mit anti-IgM (Fab2) stimuliert wird. Für A): Grb2 fl/fl mb1+/+ n=4 Mäuse; Grb2fl/fl mb1cre/+ n=4 Mäuse; Für B): Grb2fl/fl mb1+/+ n=3 Mäuse; Grb2fl/fl mb1cre/+ n=3 Mäuse. 6.1.4 6.1.4.1 Einfluss von Grb2 auf die FcγR2b Expression Grb2 hat keinen Einfluss auf die inhibitorische Funktion des FcγR2b in primären B-Zellen Grb2 ist ein negativer Regulator des Calciumsignalweges in Zelllinien und primären B-Zellen nach BZR-Stimulation (Stork et al. 2004; Stork et al. 2007; Ackermann et al. 2011; Jang et al. 2011; Neumann et al. 2011). Zusätzlich verstärkt Grb2 die inhibitorische Wirkung des FcγR2b in der reifen B-Zelllinie Bal17.TR (Neumann et al. 2011). Es sollte untersucht werden, ob Grb2 die inhibitorische Wirkung des FcγR2b auch in primären B-Zellen erhöht. Dazu wurden primäre BZellen entweder mit anti-IgM (Fab2) oder mit einem kompletten IgG anti-IgM Antikörper in equimolaren Konzentrationen stimuliert. Der IgG Fc-Teil des anti-IgM Antikörpers ist in der Lage den FcγR2b zum BZR zu rekrutieren, wo er inhibitorisch auf die BZR Signalleitung wirken kann. Um auszuschließen, dass Fc-Teile von Färbeantikörpern mit FcγR2b interagieren und so den Versuch beeinflussen wurden Milzzellen auf die Expression von CD5 und Mac1 gefärbt und das Calciumsignal für die CD5-Mac1- ungefärbten Milzzellen wurde bestimmt. Der verwendete Ziege IgG anti-IgM Antikörper rekrutiert den FcγR2b zum BZR und die inhibitorische Wirkung des FcγR2b auf die CD5-Mac1- Milzzellen in Grb2-/- B-Zellen und Kontrollzellen war deutlich messbar (Abb. 15A). Die Stärke der Inhibition war aber schwer zu vergleichen, da die Grb2-/- BZellen ein höheres Calciumsignal aufwiesen (Abb. 15A). Anschließend wurde die inhibitorische Wirkung des FcγR2b auf B-Zell Subpopulationen untersucht. Dazu wurden die Zellen direkt gefärbt. Für die Stimulation wurde statt des Ziege IgG anti-IgM Antikörpers ein Kaninchen IgG anti-IgM Antikörper verwendet, mit dem eine stärkere Inhibition über den FcγR2b erzielt wurde. Auch in den direkt gefärbten Zellen war eine Inhibition über den FcγR2b messbar, die sowohl in T1, T2 als auch in reifen B-Zellen mit und ohne Grb2 deutlich detektierbar war (Abb. 15B). Allerdings ist die Stärke der Reduktion durch den FcγR2b in T2 und reifen B-Zellen mit und ohne Grb2 aufgrund des grundsätzlich unterschiedlich hohen Calciumsignals kaum vergleichbar. In T1 B-Zellen, die ein etwa gleich hohes Calciumsignal aufweisen, war die Reduktion des Calciumsignales durch den FcγR2b nach BZR-Stimulation mit und ohne Grb2 unverändert (Abb. 15B). Zusätzlich wurde der Calcium Level auch in primären B-Zellen aus dem Knochenmark 50 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse gemessen. Dort war die inhibitorische Wirkung des FcγR2b nach BZR-Stimulation ebenfalls detektierbar (Daten von Christina Forsch und Daniel Radtke nicht gezeigt). Die inhibitorische Wirkung des FcγR2b auf das Calciumsignal ist in primären T1, T2 und reifen Grb2-/- B-Zellen deutlich messbar und auch die Stärke der Inhibition ist in Grb2-/- B-Zellen gegenüber Kontrollzellen nicht sichtlich beeinträchtigt. Grb2 spielt in primären B-Zellen keine Rolle bei der Inhibition über den FcγR2b. 6.1.4.2 Grb2 beeinflusst die FcγR2b Expression von B-Zell Subpopulationen im Knochenmark und der Peripherie. Das Fehlen von Grb2 kann dabei nicht durch die Überexpression von Bcl2 ausgeglichen werden Die inhibitorische Wirkung des FcγR2b auf das Calciumsignal ist in primären Grb2-/- B-Zellen funktionell. Allerdings verstärkt Grb2 die inhibitorische Wirkung des FcγR2b in Grb2 transfizierten Bal17.TR Zellen gegenüber Bal17.TR Zellen ohne Grb2 (Neumann et al. 2011). Darum sollte überprüft werden, ob eine veränderte Expression des FcγR2b in primären Grb2-/- BZellen als Grund für die intakte inhibitorische Wirkung des FcγR2b in Frage kommt. Zudem wurde untersucht, ob die Überexpression von humanem Bcl2 Auswirkungen auf die Expression des FcγR2b hat. In primären Zellen aus dem Knochenmark von Grb2fl/fl mb1cre/+ Mäusen war die Expression des FcγR2b im Knochenmark im Vergleich zu Kontrollzellen nicht verändert. In Zellen aus Grb2fl/fl mb1cre/+ Bcl2tg Mäusen war die Expression in den unreifen und reifen B-Zellen im Vergleich zu Zellen aus Grb2fl/fl mb1+/+ Bcl2tg Mäusen leicht erhöht (Abb. 16A). In der Milz war die Expression des FcγR2b in den unreifen, T1 und T2-MZ B-Zellen ohne Grb2 um etwa ein Viertel bis ein Drittel erhöht, während die Expression in den reifen B-Zellen unverändert war. Interessanterweise war die Expression des FcγR2b auf Grb2-/- B1-Zellen der Milz etwa um den Faktor zwei erhöht (Abb. 16B, C und D). Darum wurde die FcγR2b auch im Peritoneum untersucht, in dem die B1-Zellen die größte B-Zell Population stellen. Dort war die FcγR2b Expression in Grb2-/- B1a Zellen allerdings unverändert und auf Grb2-/- B1B-Zellen war sie tendenziell erhöht. Die Expression des FcγR2b war hier, anders als in der Milz, bei den B2-Zellen um den Faktor zwei erhöht (Abb. 16E). Die Expression des FcγR2b in den B-Zellen der Peripherie wurde weder in Zellen mit Grb2, noch in Zellen ohne Grb2 deutlich durch die Überexpression von humanem Bcl2 beeinflusst. Die höhere Expression des FcγR2b auf unreifen Grb2-/- B-Zellen kann potentiell die Calcium Inhibition über den FcγR2b verstärken. Die unveränderte Expression auf Grb2-/- B-Zellen im Knochenmark und den reifen Grb2-/- B-Zellen der Milz zeigte allerdings, dass die höhere Expression des FcγR2b nicht für die funktionelle Inhibition des Calciumsignals durch den FcγR2b in Grb2-/- B-Zellen verantwortlich ist. Demnach gibt es Unterschiede in der FcγR2b Signalleitung von primären Grb2-/- B-Zellen und Bal17.TR Zellen. 51 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse 3.0 * 2.5 2.0 1.5 1.0 0.5 B e B ur e at ur m at M at ur e ce B e B T2 -M Z ce lls * 1.0 0.5 0.0 52 B-Zell spezifische Grb2 Knockoutmaus B 2 ce lls ce lls ce lls T lls ce B 2 ce lls 0.00 * 1b 0.25 1.5 B 0.50 * ce lls 0.75 2.0 1a 1.00 F B 1.25 F8 PC CD43 CD19 CD5 FcyR2b relative FcyR2b expression (based on geo Mean) ** 1.50 1 at m im ** * B ur e ur at 2 B B T1 ** Peritoneal Cavity F7 PC CD5 B220 FcyR2b E 1.75 relative FcyR2b expression (based on geo Mean) lls ls ce l *** B 2.25 2.00 1.75 1.50 1.25 1.00 0.75 0.50 0.25 0.00 T F4 SP CD21 IgM B220 FcyR2b *** 1.2 1.1 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 ce lls ce 1 ce lls p=0.05 m 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 C F2 SP HSA B220 FcyR2b * *** 1.3 relative FcyR2b expression (based on geo Mean) im m F1 SP B220 CD5 FcyR2b *** *** lls relative FcyR2b expression (based on geo Mean) relative FcyR2b expression (based on geo Mean) ce lls ce ce pr o/p re -B Spleen 1.2 B 1.1 D lls 0.0 lls relative FcyR2b expression (based on geo Mean) F5Bone BM IgMMarrow IgD B220 FcyR2b ohne Trans u MR * A 3.5 * Ergebnisse Abb. 16: Höhere Fcγ-RezeptorIIb Expression auf unreifen- und B1 B-Zellen der Milz, sowie auf B2 B-Zellen im Peritoneum. Die Expression des Fcγ-RezeptorsIIb wurde durchflusszytometrisch bestimmt. Die Auswahl der einzelnen Zellpopulationen ist teilweise exemplarisch in Abb. 7, Abb. 8 und Abb. 9 dargestellt. Es wurde jeweils eine Population von Grb2fl/fl mb1cre/+ Zellen als Referenzwert gesetzt, um Schwankungen zwischen Experimenten zu relativieren. A) Knochenmark: pro/pre B-Zellen (B220+ IgM-), unreife B-Zellen (B220low IgMmed), reife B-Zellen (B220high IgMmed); B) Milz: B1 B-Zellen (B220+ CD5+), B2 B-Zellen (B220+ CD5-) und T-Zellen (B220- CD5+); C) Milz: Unreife B-Zellen (B220low HSAhigh) reife B-Zellen (B220high HSAlow); D) Milz: Reifen B-Zellen (B220+ CD21med IgMmed), Transitionalen Typ 1 B-Zellen (B220+ CD21low IgMhigh) und Transitionalen Typ2 B-Zellen/Marginalzonen B-Zellen (B220+ CD21low IgMhigh); E) Peritoneum: B1 B-Zellen (B220+ CD5+), B2 B-Zellen (B220+ CD5-) und T-Zellen (B220- CD5+); F) Peritoneum: B1a B-Zellen (CD19+ CD5+ CD43+), B1b B-Zellen (CD19+ CD5- CD43+) und B2 B-Zellen (CD19+ CD5CD43-). Knochenmark: Grb2fl/fl mb1+/+ n=7 Mäuse; Grb2fl/fl mb1cre/+ n=9 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=8 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=5 Mäuse; Milz: Grb2fl/fl mb1+/+ n=7 Mäuse; Grb2fl/fl mb1cre/+ n=9 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=10 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=6 Mäuse; Peritoneum: Grb2fl/fl mb1+/+ n=5 Mäuse; Grb2fl/fl mb1cre/+ n=8 Mäuse; Grb2fl/fl mb1+/+ Bcl2tg n=10 Mäuse; Grb2fl/fl mb1cre/+ Bcl2tg n=6 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. 6.1.4.3 Grb2 hat keinen Einfluss auf die Expression des FcγR2b im Keimzentrum nach Immunisierung mit Schaferythrozyten. Die Expression des FcγR2b wird in Keimzentrumzellen hochreguliert und eine niedrigere Expression des FcγR2b kann zu Autoimmunität führen (Xiu et al. 2002; Jiang et al. 2000; Espéli et al. 2012). Aufgrund der veränderten FcγR2b Expression in Grb2fl/fl mb1cre/+ Mäusen (Abb. 16) und der beeinträchtigten Keimzentrumsbildung (Ackermann et al. 2011) sollte untersucht werden, ob die Expression auch in Keimzentrumzellen verändert ist. Dazu wurden Keimzentrumzellen zehn Tage nach einer Immunisierung mit Schafserythrozyten auf ihre FcγR2b Expression hin untersucht. Die Hochregulation des FcγR2b in Keimzentrumzellen von Grb2fl/fl mb1cre/+ Mäusen war vergleichbar mit der von Kontrollzellen (Abb. 17). Grb2 beeinflusst demnach die Keimzentrumsreaktion nicht durch die Veränderungen der FcγR2b Expression. 53 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A B220+ Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ Grb2fl/fl mb1cre/+ non GC B cells (Fas- GL7-) GL7 B % of max Fas GC B cells (Fas+ GL7+) - non Germinal Center B cells - non Germinal Center B cells - Germinal Center B cells - Germinal Center B cells Fcγr2b expression F1 SP B220 Fas GL7 FcyR2b FcyR2b expression (geo Mean) 700 600 500 400 300 200 100 + 22 0 B B 22 0 + G L7 G L7 + - Fa s Fa s - + 0 Abb. 17: Kein Einfluss von Grb2 auf die Hochregulation des FcγR2b in Keimzentrums B-Zellen. Grb2fl/fl mb1+/+ und Grb2fl/fl mb1cre/+ Mäuse wurden mit 1x107 Schafserythrozyten pro Maus immunisiert. Nach 10 Tagen wurden die Milzzellen durchflusszytometrisch analysiert. Die Zellen wurden auf A) B220, Fas, GL7 und FcγR2b (2.4G2) gefärbt. B) Relative FcγR2b Expression. Für A) und B) Grb2 fl/fl mb1+/+ n=7 Mäuse; Grb2fl/fl mb1cre/+ n=12 Mäuse. Für die Statistik wurde der T-Test verwendet; *p<0,05. Das Experiment wurde zusammen mit Christina Forsch durchgeführt. 6.1.5 6.1.5.1 Einfluss von Grb2 auf die B-Zell Immunantwort Grb2 ist wichtig für die Gedächtnisantwort gegen virusartige Partikel des humanen Cytomegalovirus und das darin enthaltene Glycoprotein B Grb2 kann an eine konservierte Bindestelle im intrazellulären Teil des IgG und IgE Rezeptors binden und so die Signalleitung über den BZR in vitro verstärken (Engels et al. 2009). Um diesen Effekt zu untersuchen wurden Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Kontrolltiere zwei Mal i.p. mit virusartigen Partikeln des humanen Zytomegalovirus (VLPs) immunisiert (Hebeis et al. 2004). Die primäre und sekundäre IgM und IgG Immunantwort gegen VLPs wurde mittels ELISA untersucht. Die IgM-Antwort der Grb2fl/fl mb1cre/+ Mäuse war sowohl bei der primären als auch bei der sekundären Antwort auf VLPs erhöht, während die IgG-Antwort bei der sekundären 54 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Antwort schwächer ausfiel (Abb. 18B). Nach 58 Tagen Wartezeit wurden CD19+ Milzzellen mit jeweils der gleichen Zahl an IgG1/IgG2a/IgG2b+ Zellen, unter denen auch VLP spezifische Gedächtniszellen sind, aus Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Mäusen in Rag1-/- Mäuse übertragen. Die Gesamtzellzahl der IgG+ Zellen in Grb2fl/fl mb1cre/+ Mäusen gegenüber den Grb2fl/fl mb1+/+ Kontrollen war drastisch reduziert (Abb. 18C). Nach sieben Tagen, in denen die übertragenen B-Zellen Zeit hatten ihre Nischen in den Rag1-/- Mäusen zu finden wurden sie durch eine i.v. Immunisierung mit VLPs reaktiviert, die Gedächtnis B-Zellen ohne T-Zell Hilfe reaktivieren können (Hebeis et al. 2004). Während es keinen signifikanten Unterschied in der IgM-Antwort der Grb2fl/fl mb1cre/+ und der Grb2fl/fl mb1+/+ Zellen in den Rag1-/- Mäusen gab war die IgG-Antwort der Rag1-/- Tiere mit den Grb2fl/fl mb1cre/+ Zellen stark reduziert (Abb. 18D). Auch die Zahl der VLP spezifischen Antikörper sekretierenden Zellen war stark vermindert (Abb. 18E). Dieses Ergebnis weist darauf hin, dass Grb2 wichtig für die IgG Gedächtnisantwort ist. Das Experiment hat aber den Nachteil, dass nicht gezeigt wurde, ob die gleiche Zahl an antigenspezifischen B-Zellen übertragen wurde, da nur die gleiche Zahl an IgG1/IgG2a/IgG2b+ Zellen übertragen wurde. Außerdem kann nicht ausgeschlossen werden, dass IgM-Memoryzellen, die nach Reaktivierung schnell zu IgG1 wechseln können den Versuch beeinflussen. Darum wurde ein weiteres Experiment durchgeführt, bei dem Glykoprotein B (gB), ein Bestandteil des humanen Zytomegalovirus als Antigen genutzt wurde. Grb2fl/fl mb1cre/+ Mäuse und Grb2fl/fl mb1+/+ Kontrolltiere wurden drei Mal mit gB immunisiert. Nach einer Wartezeit von 83 Tagen wurde die Zahl der B220+IgG1/IgG2a/IgG2b+gB-bindenden Zellen bestimmt. Sie war in Grb2fl/fl mb1cre/+ Mäusen gegenüber Grb2fl/fl mb1+/+ Tieren tendenziell reduziert (Abb. 19B). Es wurden B220+IgG1/IgG2a/IgG2b+gB-bindende Gedächtniszellen in Rag1-/- Füllerzellen sortiert und 1x104 Gedächtniszellen pro Maus in Rag1-/- Mäuse übertragen. Nach sechs Tagen wurden die Empfängermäuse i.v. mit VLPs immunisiert, da lösliches gB allein nicht in der Lage ist die gB spezifischen Gedächtniszellen zu reaktivieren (Hebeis et al. 2004). Sowohl der gB-spezifische Serumtiter, als auch die Zahl der gB-spezifischen Antikörper sekretierenden Zellen in der Milz und tendenziell im Knochenmark waren in Rag1-/- Mäusen mit Grb2fl/fl mb1cre/+ Gedächtniszellen gegenüber Tieren mit Kontrollzellen deutlich reduziert (Abb. 19D und E). Somit konnte das Ergebnis der VLP Immunisierung antigenspezifisch bestätigt werden. Grb2 ist essentiell für die Gedächtnisantwort von IgG-Zellen. 55 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A VLPs of hCMV in Alum i.p. d0 d32 d90 2µg 2µg donor Adoptive transfer of 2x106 IgG+CD19+ splenic cells i.v. ELISA recipient (NK-cell depl. Rag1-/- mice) 10 1 VLP (Boost) 10 Joche 1 VLP (Boost) 0.1 0.1 21 28 35 42 0 7 14 21 time(d) 0.1 7 Total cells (x106) 0.01 se d e/ + + +/ un i cr b b1 m fl m m fl fl/ ** *** 10 im no n *** Spleen Grb2fl/fl mb1+/+ Grb2fl/fl mb cre/+ non immunised 1 14 21 0 7 14 time(d) VLP-specific IgG - Spleen * Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells 500 250 ls on or ce l -d do no rc el im m fl fl/ b2 B-Zell spezifische Grb2 Knockoutmaus un is ed m m b b1 cr e/ + do no rc el + +/ ls 0 ls Antibody-secreting cells per 106 cells 750 fl fl/ 0.02 *** 100 time(d) IgG VLP ELISPOT Spleen rb 2 0.03 0.1 0 56 0.04 immunisation with VLPs of hCMV IgG G 1000 1 0.05 0.00 FL-2 (notofstained) immunisation with VLPs hCMV postTransfer IgM VLP-specific IgG (AU) VLP-specific IgM (AU) Grb2fl/fl mb1+/+ 0.06 Grb2fl/fl mb cre/+ 0.11%±0.03 0.21%±0.12 10 E 42 IgG+ before transfer spleen IgG+ *** 0.07 Grb2fl/fl mb1+/+ non immunised rb 2 IgG1/IgG2a/IgG2b Grb2fl/fl mb1cre/+ Grb2+ fl/fl mb1+/+ IgG fl/fl Grb2 mb cre/+ 0.19%±0.06 100 35 time(d) d90 Grb2fl/fl mb1+/+ D 28 fl/ 14 rb 2 7 G 0 C ELISPOT ELISA immunisation with VLPs of hCMV immunisation with VLPs of hCMV ante Transfer IgG IgM * 1000 * ** ** * * ** *** 100 100 VLP-specific IgM (AU) d-7 VLP-specific IgG (AU) B d0 reactivation VLPs in PBS i.v. d21 2µg Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells 21 Ergebnisse Abb. 18: Schwächere sekundäre Immunantwort von Grb2fl/fl mb1cre/+ Mäusen gegen virusartige Partikel (VLP) des humanen Cytomegalovirus und reduzierte Gedächtnisantwort von IgG+ Grb2fl/fl mb1cre/+ B-Zellen gegenüber Kontrollzellen. Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Mäuse wurden zwei Mal mit 2 µg VLPs in Alum intraperitoneal immunisiert. IgM und IgG Serumtiter wurden über die Zeit mittels ELISA bestimmt (B). Nach 90 Tagen wurde die Zahl an IgG1/IgG2a/IgG2b+ Zellen in der Milz analysiert (C). Es wurden 2x106 CD19+ Milzzellen und damit eine gleiche Anzahl an IgG+ Zellen aus Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Mäusen i.v. in Rag1-/- Rezipienten übertragen. Die CD19+ Zellen wurden negativ über eine komplementvermittelte T-Zelllyse (anti-Thy1, anti-CD4, anti-CD8) und danach positiv mit anti-CD19 Beads magnetisch angereichert. Die Rag1-/- Mäuse wurden zwei Tage vor dem Transfer mit 1 mg/Maus anti-NK1.1 behandelt, um NK-Zellen zu depletieren. Dies geschah, weil die Donorzellen aus einem gemischten BALB/c / C57BL/6 Hintergrund kommen, während die Rezipienten C57BL/6 Tiere sind. Die Gedächtniszellen wurden 7 Tage nach dem Transfer über die Injektion von 2 µg/ Maus VLPs reaktiviert und der VLP spezifische IgG Serumtiter wurde über die Zeit per ELISA bestimmt (D). Die Rezipienten wurden 28 Tage nach dem Transfer geopfert und es wurde eine VLP spezifischer ELISPOT durchgeführt (E). Für B) und C) Grb2fl/fl mb1+/+ n=5 Mäuse; Grb2fl/fl mb1cre/+ n=5 Mäuse; For C) nicht immunisiert =2 Mäuse; Für D) und E) Grb2 fl/fl mb1+/+ Donorzellen n=5 Mäuse; Grb2fl/fl mb1cre/+ Donorzellen n=4 Mäuse; naive Donorzellen =2 Mäuse. Für die Statistik wurde der T-Test verwendet; *p<0,05; *p<0,01; *p<0,001. Jochen Ackermann hat die Donortiere immunisiert und ihre Seren gesammelt. 57 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse recipient (NK-cell depl. Rag1-/- mice) Grb2fl/fl mb1+/+ non immunised Grb2fl/fl mb1cre/+ 0.12%±0.03 IgG+ before transfer spleen 0.05%±0.01 IgG+gB+ 0.01%±0.01 0.00%±0.00 40 30 20 10 0 ** 50 * ** 5 gB-specific IgG1 (AU) p=0.05 14 21 28 time(d) gB-specific IgG2b (AU) 7 50 *** 5 0.5 immunisation with VLPs of hCMV 7 14 21 28 se d m IgG2a 50 5 0 7 14 21 28 time(d) Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells 50 im immunisation with VLPs of hCMV time(d) IgG2b un i m fl fl/ rb 2 ** ** 0 0 Grb2fl/fl mb cre/+ non immunised 500 IgG1 500 0.05 Grb2fl/fl mb1+/+ immunisation with VLPs of hCMV 0.05 0.5 Spleen NKp46+ NKp46+ immunisation withNKp46 VLPs of(CD335) hCMV 500 IgG D 500 Bone Marrow d35 after NK1.1 i.p. gB-specific IgG2a (AU) % of Max NKp46+ cr +/ b1 Spleen d35 after NK1.1 i.p. Blood d13 after NK1.1 i.p. G Grb2fl/fl mb1cre/+ Grb2fl/fl mb1+/+ gB-specific IgG (AU) Grb2fl/fl mb1+/+ non immunised G Post transfer C e/ + + gB-Cy5 b 0.03%±0.03 B220+IgG+gB+ 50 no n IgG+ 0.13%±0.02 ELISPOT m Grb2fl/fl mb1+/+ d27 ELISA fl d187 IgG1/IgG2a/IgG2b d-6 Ante transfer B220+ d0 reactivation VLPs in PBS i.v. 2µg VLPs Total cells (x103) B Transfer of 1x104 IgG+CD19+gB+ cells mixed with Rag1-/filler cells i.v. fl/ gB of hCMV in Alum i.p. d0 d28 d104 d187 10µg 5µg 5µg donor rb 2 A 5 0 300 Antibody-secreting cells per 106 cells Antibody-secreting cells per 106 cells E IgG VLP ELISPOT Spleen gB-specific - +/+ Spleen Grb2fl/flIgG mb1 donor cells * fl/fl cre/+ Grb2 mb donor cells 30 7 100 0 21 28 Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells non immunised - donor cells 200 14 time(d) IgG VLP ELISPOT Bone Marrow gB-specific IgG - Bone Marrow 20 10 0 on or ce lls on or ce l -d un is ed cr e/ + m im m fl fl/ b2 rb 2 fl/ fl m b b1 se d +/ + -d B-Zell spezifische Grb2 Knockoutmaus un i m im do no rc el ls do no rc el ls ls ls do no rc el fl fl/ b2 rb 2 fl/ fl m b m b1 cr +/ + 58 e/ + do no rc el ls Suppl. Fig. X: Reduced memory immune response of Grb2fl/fl mb1cre/+ cells to glycoprotein B Ergebnisse Abb. 19: Schwächere Gedächtnisantwort von Grb2fl/fl mb1cre/+ B-Zellen gegen glykoprtein B (gB) des humanen Zytomegalovirus gegenüber Kontrollzellen. Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Mäuse wurden ein Mal mit 10 µg und zwei Mal mit 5 µg gB in Alum i.p. immunisiert. Nach 187 Tagen wurde die Zahl an B220 +, IgG+, gB-bindenden Zellen in der Milz bestimmt (B) und 1x104 B220+, IgG1/IgG2a/IgG2b+,gB-bindende sortierte Zellen wurden zusammen mit Rag1-/- Milzzellen als Füllerzellen i.v. in Rag1-/- Rezipienten übertragen. In die Rag1-/- Mäuse wurde zwei Tage vor dem Transfer 1 mg/Maus anti-NK1.1 Antikörper i.p. injiziert, um NK-Zellen zu depletieren. Dies geschah, weil die Donorzellen aus einem gemischten BALB/c / C57BL/6 Hintergrund kamen, während die Rezipienten C57BL/6 Tiere waren. Die Depletion der NK-Zellen wurde durchflusszytometrisch überprüft (C). Die transferierten gB spezifischen Gedächtnis B-Zellen wurden sechs Tage nach dem Transfer durch die Gabe von 2 µg virusartigen Partikeln in PBS i.v. (enthalten gB) reaktiviert. gB spezifische Immunglobulinlevel wurden mittels ELISA über die Zeit bestimmt (D). Die Rezipiententiere wurden 33 Tage nach dem Transfer der Gedächtniszellen geopfert und ein gB spezifischer ELISPOT wurde durchgeführt (E). Für B) Grb2fl/fl mb1+/+ n=4 Mäuse; Grb2fl/fl mb1cre/+ n=3 Mäuse; nicht immunisiert =2 Mäuse; Für C), D) und E) Grb2fl/fl mb1+/+ Donorzellen n=3 Mäuse; Grb2fl/fl mb1cre/+ Donorzellen n=4 Mäuse; naive Donorzellen =2 mice. Für die Statistik wurde der T-Test verwendet; *p<0,05; *p<0,01; *p<0,001. Die i.v. Injektion wurde von Prof. Dr. Thomas Winkler durchgeführt. 6.1.5.2 Für den Immunglobulin Klassenwechsel in B-Zellen ist Grb2 nicht essentiell Es wurde gezeigt, dass die sekundäre Immunantwort von Grb2fl/fl mb1cre/+ Mäusen gegen virusartige Partikel des humanen Zytomegalievirus reduziert ist (Abb. 19B). Neben einer abgeschwächten Aktivierung über den IgG-BZR könnte auch ein Defekt beim Klassenwechsel zu dieser Reduktion beitragen. Darum wurde die Fähigkeit zum Klassenwechsel in Grb2fl/fl mb1cre/+ B-Zellen untersucht. Dazu wurden die Zellen in vitro kultiviert und entweder unbehandelt belassen oder mit dem Mitogen LPS allein oder LPS und IL-4 stimuliert. Die Stimulation von naiven B-Zellen mit LPS führt bevorzugt zu einem Wechsel zu IgG3, während eine Stimulation mit LPS und IL-4 bevorzugt zu einem Wechsel zu IgG1 führt (Burstein et al. 1991). Der Überstand der Zellen wurde mittels ELISA auf die Sekretion von IgM, IgG1 und IgG3 untersucht. Stimulierte Grb2fl/fl mb1cre/+ B-Zellen sekretierten sowohl nach LPS als auch nach LPS und IL-4 Stimulation jeweils mehr IgM, IgG1 und IgG3. Außerdem war die Sekretion von IgM, IgG1 und IgG3 tendenziell auch in den unstimulierten Zellen höher, was auf eine höhere Voraktivierung der Zellen hindeutet (Abb. 20A). Die höhere Sekretion von Antikörpern nach Stimulation mit LPS (Abb. 20A) könnte darauf hindeuten, dass die Grb2fl/fl mb1cre/+ B-Zellen stärker als die Kontrollen über Toll-Like-Rezeptoren stimulierbar sind. Ein Stimulationsversuch mit Liganden für die TollLike-Rezeptoren 7 und 9, bei dem die Proliferation von unreifen und reifen B-Zellen gemessen wurde bestätigte dies (Abb. 21). Trotz der stärkeren Stimulierbarkeit über Toll-Like-Rezeptoren weist dieser Antikörperlevel im Überstand auf einen funktionellen Klassenwechsel von Grb2fl/fl mb1cre/+ B-Zellen zu IgG1 und IgG3 hin. Es ist beschrieben, dass während des Klassenwechsels DNA Stücke in zirkulärer Form aus dem Immunglobulin Lokus für die schwere Kette geschnitten werden. Diese werden weiter in RNA umgeschrieben. Die RNA kann als Marker für einen 59 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse aktiven Klassenwechsel in einer reversen Transkriptase-PCR spezifisch nachgewiesen werden (Kinoshita et al. 2001). Das spezifische zirkuläre Transkript für den Klassenwechsel zu IgG1 konnte nach LPS und IL-4 Stimulation sowohl in Grb2fl/fl mb1cre/+ als auch in Grb2fl/fl mb1+/+ Zellen nachgewiesen werden (Abb. 20A). Grb2 ist also nicht essentiell für die Fähigkeit von BZellen ihre Immunglobulinklasse zu wechseln. Es gibt keinen Hinweis, dass ein Defekt beim Klassenwechsel zu einer niedrigeren sekundären IgG Antwort von Grb2fl/fl mb1cre/+ Mäusen gegen virusartige Partikel beiträgt. 60 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse IgM IgG1 IgG3 A 10000 IgG1 IgG3 100 Grb2fl/fl mb1cre/+ LP S . IL -4 + LP S . Grb2fl/fl mb1+/+ LP S + LP S Grb2fl/fl mb1+/+ * 100 10 un st im IL -4 LP S un st im B 1000 10 . 10 ** 1000 im 100 * un st 1000 10000 IgG3 (ng/ml) 10000 IgG1 (ng/ml) IgM (ng/ml) ** IL -4 100000 ** + ** IgM LP S 100000 Grb2fl/fl mb1cre/+ Abb. 20: Primäre Grb2fl/fl mb1cre/+ B-Zellen können einen effizienten Klassenwechsel zu IgG1 und IgG3 vollziehen. A) Milzzellen von Grb2fl/fl mb1+/+ and Grb2fl/fl mb1cre/+ Mäusen wurden für 6 Tage mit LPS (10 µg/ml), LPS (10 µg/ml) und IL-4 (10 ng/ml) oder ohne weitere Stimulation in 5 ml Medium inkubiert (37 °C, 5 % CO2). Sekretiertes IgM, IgG1 oder IgG3 im Überstand wurde mittels ELISA gemessen. B) Milzzellen wurden wie in A beschrieben stimuliert und für 48 h inkubiert. Dann wurde die RNA der Zellen aufgereinigt und in cDNA umgeschrieben. Diese wurde verwendet, um ein spezifisches RNA Stück nachzuweisen, das beim Klassenwechsel zu IgG1 synthetisiert wird. Es wird von einem zirkulären DNA Stück trankribiert, welches beim Klassenwechsel zu IgG1 aus dem Bereich, der für die Immunglobulin schwere Kette kodiert geschnitten wird. Für A): Grb2fl/fl mb1+/+ n=6 Mäuse; Grb2fl/fl mb1cre/+ n=6 Mäuse; Für B): Grb2fl/fl mb1+/+ n=2 Mäuse; Grb2fl/fl mb1cre/+ n=2 Mäuse. Für die Statistik wurde der T-Test verwendet; *p<0,05; *p<0,01. 61 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A 100000 *** ** ** 10000 1000 100 0 0.2 1 5 10 counts per minute (cpm) counts per minute (cpm) R848 (TLR7 ligand) stimulated immature B cells (B220low HSAhigh) R848 (TLR7 ligand) stimulated mature B cells (B220high HSAlow) 100000 *** ** 10000 1000 100 15 0.0 0.2 0.5 R848 (µg/ml) 10 15 *** 10000 * * 100 0,1 0.5 CPG (TLR9 ligand) stimulated mature B cells (B220high HSAlow) counts per minute (cpm) counts per minute (cpm) 100000 0.0 0,02 5 Grb2fl/fl mb1+/+ Grb2fl/fl mb cre/+ CPG (TLR9 ligand) stimulated immature B cells (B220 low HSAhigh) 1000 1 R848 (µg/ml) Grb2fl/fl mb1+/+ Grb2fl/fl mb cre/+ B * 2.0 3.5 5.0 100000 *** 10000 ** * * 1000 100 0.0 0,02 CPG (µg/ml) Grb2fl/fl mb1+/+ Grb2fl/fl mb cre/+ 0,1 0.5 2.0 3.5 CPG (µg/ml) Grb2fl/fl mb1+/+ Grb2fl/fl mb cre/+ Abb. 21: Stärkere Antwort von primären Grb2fl/fl mb1cre/+ B-Zellen auf TLR7 und TLR9 Stimulation. A) Unreife (B220low HSAhigh) und reife B-Zellen (B220high HSAlow) wurden durchflusszytometrisch aus Gesamtmilzzellen heraus sortiert. Sie wurden jeweils für 48 h mit den angegebenen Mengen R848 (TLR7 Ligand) oder CPG-ODN 1826 (TLR9 Ligand) in 0,2 ml Medium stimuliert. Für die letzten 12 h wurde 1µCi/Well 3H Tritiumthymidin zu den Zellen gegeben. Nach der Inkubation wurde der 3H-Tritiumthymidineinbau detektiert (Berthold-Inotech Trace-96 - Berthold, Wildbad, Germany), um die Proliferation der Zellen zu bestimmen. Für A) und B): Grb2fl/fl mb1+/+ n=3; Grb2fl/fl mb1cre/+ n=3. Für die Statistik wurde der T-Test verwendet; *p<0,05; *p<0,01; *p<0,001. 62 B-Zell spezifische Grb2 Knockoutmaus 5.0 Ergebnisse 6.1.5.3 Grb2 in Keimzentrumszellen hat keinen Einfluss auf die Keimzentrumsbildung nach einer Immunisierung mit Schafserythrozyten Es wurde gezeigt, dass gB-spezifische Gedächtniszellen aus Grb2fl/fl mb1cre/+ Mäusen nach Restimulation eine schwächere Immunantwort hervorrufen als Memoryzellen aus Grb2fl/fl mb1+/+ Mäusen. Allerdings sind die B-Zell Entwicklung und die Keimzentrumsreaktion in Grb2fl/fl mb1cre/+ Mäusen ebenfalls beeinträchtigt (Ackermann et al. 2011; Jang et al. 2011) und es ist unklar in wie weit diese Faktoren die Bildung der Gedächtniszellen beeinflussen. Um eine Beteiligung dieser Faktoren bei der Untersuchung von Gedächtniszellen weitestgehend auszuschließen zu können, wurden Grb2fl/fl Mäuse mit Cγ1cre/+ Mäusen verpaart, die Cre in Keimzentrumzellen exprimieren (Casola et al. 2006). Die erfolgreiche Deletion von Grb2 in Keimzentrumszellen von Grb2fl/fl Cγ1cre/+ Mäusen wurde mittels Western Blot bestätigt (Abb. 22). Grb2fl/fl Cγ1cre/+ Mäuse wurden zur Untersuchung der Keimzentrumsreaktion mit Schafserythrozyten immunisiert. Als Kontrolle dienten Grb2wt/wt Cγ1cre/+ Mäuse, da die Antikörperproduktion in Cγ1cre/+ Mäusen gegenüber wt Tieren reduziert ist (Casola et al. 2006). Zehn Tage nach der Immunisierung mit Schafserythrozyten wurde die Keimzentrumsreaktion in der Milz untersucht. Es waren keine Veränderungen in der Struktur, Zahl oder Größe der Keimzentren in Grb2fl/fl Cγ1cre/+ Mäusen gegenüber Grb2wt/wt Cγ1cre/+ Tieren festzustellen (Abb. 23A und B; Abb. 24A und B). Auch das Verhältnis von B-Zellen aus der dunklen Zone zu BZellen aus der hellen Zone der Keimzentren war unverändert (Abb. 24C und D). Außerdem wurden keine Unterschiede bei der Zahl der IgM-Plasmazellen und der IgG+ Zellen in der Milz zwischen Grb2fl/fl Cγ1cre/+ Mäusen und Kontrolltieren festgestellt (Abb. 23A und C). Die Zahl der follikulären T-Helferzellen in der Milz von Grb2fl/fl Cγ1cre/+ Mäusen war vergleichbar mit der Anzahl in den Kontrolltieren (Abb. 24E und F). Das bedeutet, die Deletion von Grb2 in B-Zellen des Keimzentrums beeinflusst die Struktur, Anzahl oder Größe von Keimzentren der Milz nicht. 63 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A Grb2wt/wt Cγ1cre/+ Grb2fl/fl Cγ1cre/+ α -Grb2 α -β-Aktin Abb. 22: Deletion von Grb2 in Keimzentrums B-Zellen von Grb2fl/fl Cγ1cre/+ Mäusen. Die Mäuse wurden zuvor für NP-KLH Experimente verwendet, wobei die letzte Immunisierung mit NP-KLH mindestens 7 Wochen zurück lag. Grb2fl/fl Cγ1+/+ und Grb2fl/fl Cγ1cre/+ Mäuse wurden mit 1x107 Schafserythrozyten immunisiert. Nach 10 Tagen wurden T-Zellen mit anti-CD90.2 (Thy1) magnetischen Beads depletiert, um B-Zellen aus der Milz anzureichern. Danach wurden die Zellen auf B220 (RA3-6B2), Gl7 (GL-7) und Fas-Rezeptor (Jo2) gefärbt. B220+ GL7+ Fas-Rezeptor+ (Keimzentrums B-Zellen) und B220+ GL7- Fas-Rezeptor- B-Zellen wurden über durchflusszytometrische Zellsortierung weiter aufgereinigt. Lysate der Zellen wurden für einen Western-Blot verwendet, um Grb2 und Aktin über anti-Grb2 (3F2) oder anti-Aktin (Caderlane) Antikörper in den Proben nachzuweisen. Deletion 64 of Grb2 in Grb2 Cγ1 germinal center B cells. The mice were part of NP-KLH immunisation B-Zell spezifische Grb2 Knockoutmaus Ergebnisse 65 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 23: Vergleichbare Struktur und Anzahl von Keimzentren, so wie IgG+ Zellen in Grb2fl/fl Cγ1cre/+ Mäusen und Kontrolltieren nach Immunisierung mit Schafserythrozyten. Grb2fl/fl Cγ1+/+ und Grb2fl/fl Cγ1cre/+ Mäuse wurden mit 1x107 Schafserythrozyten pro Maus immunisiert. Nach 10 Tagen wurden die Milzen in TissueTec eingefroren. Es wurden 8 µm dicke Schnitte angefertigt. Dargestellt ist je ein Milzschnitt von drei Grb2fl/fl Cγ1cre/+ Mäusen und je ein Milzschnitt von drei Grb2wt/wt Cγ1cre/+ Mäusen, so wie ein Milzschnitt einer nicht immunisierten Kontrolle. Die Schnitte wurden auf A) IgM (B7-6) und IgD (11-26c), B) PNA (FL-1071, Vector Laboratories) und IgD oder C) IgG (A11001, Invitrogen) und IgD gefärbt wurden. Es wurden fluoreszenzmikroskopische Aufnahmen gemacht. B) Die relative Zahl und Fläche der Keimzentren wurde bestimmt. C) Die relative Zahl an IgG+ Zellen wurde bestimmt. Grb2fl/fl Cγ1cre/+ n=6 Mäuse; Grb2wt/wt Cγ1cre/+ n=6 Mäuse; Grb2fl/fl nicht immunisiert n=1 Maus. Für die Statistik wurde der T-Test verwendet; *p<0,05. 66 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A B B220+ Grb2wt/wt Cγ1cre/+ Grb2fl/fl Cγ1cre/+ Grb2fl/fl non immunised GC B cells 2.7%±1.1 1% Fas 3.3%±1.1 GL7 C D B220+ Fas+ Grb2wt/wt Cγ1cre/+ Grb2fl/fl Cγ1cre/+ Grb2fl/fl non immunised Dark zone 37.5%±9 CXCR4 37.8%±3.2 25.6% Light zone 41.8%±5.2 40.5%±9 40.7% CD86 E F CD4+ Grb2wt/wt Cγ1cre/+ Grb2fl/fl Cγ1cre/+ Grb2fl/fl non immunised PD-1 Follicular TH cells 9.8% ±2.1 8.6% ±2.2 13.2% CXCR5 (CD185) 67 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 24: Vergleichbare Zahl von Keimzentrums B-Zellen und follikulären T-Helferzellen in Grb2fl/fl Cγ1cre/+ und Kontrollmäusen nach Immunisierung mit Schafserythrozyten. Grb2fl/fl Cγ1+/+ und Grb2fl/fl Cγ1cre/+ Mäuse wurden mit 1x107 Schafserythrozyten pro Maus immunisiert. Nach 10 Tagen wurden die Milzzellen durchflusszytometrisch analysiert. Die Zellen wurden auf A) B220, Fas und GL7; C) B220, Fas, CXCR4, CD86 und E) CD4, PD-1 und CXCR5 (CD185) gefärbt. Berechnung der Gesamtzellzahlen für A), C) und E) in B), D) und F). Grb2fl/fl Cγ1cre/+ n=5 Mäuse; Grb2wt/wt Cγ1cre/+ n=6 Mäuse; Grb2fl/fl nicht immunisiert n=1 Maus. Für die Statistik wurde der T-Test verwendet; *p<0,05. 6.1.5.4 Die Deletion von Grb2 in Keimzentrums-B-Zellen oder in allen B-Zellen ab der frühen Entwicklung hat keinen Einfluss auf die Affinitätsreifung von B-Zellen Die primäre und sekundäre IgG1 Immunreaktion gegen NP-KLH ist in Grb2fl/fl mb1cre/+ Mäusen, die Grb2 in der frühen B-Zell Entwicklung deletieren unverändert (Doktorarbeit Jochen Ackermann). Allerdings könnte die Affinitätsreifung in Grb2fl/fl mb1cre/+ Mäusen durch die veränderte Keimzentrumsreaktion (Ackermann et al. 2011; Jang et al. 2011) gestört sein. Die relative Affinität von Antikörpern lässt sich untersuchen, indem man die Bindefähigkeit der Antikörper an ein Trägerprotein mit mehr gekoppelten Epitopen in ein Verhältnis zur Bindefähigkeit an ein Trägerprotein mit weniger gekoppelten Affinitätsreifung war in der sekundären Immunantwort von Grb2 fl/fl Epitopen cre/+ mb1 setzt. Die Mäusen im Vergleich zu den Kontrolltieren unverändert (Abb. 25A). Zusätzlich wurde die IgG1 Immunantwort und die Affinitätsreifung nach NP-KLH Immunisierung in Grb2fl/fl Cγ1cre/+ Mäusen untersucht, die Grb2 erst in der Keimzentrumsreaktion deletieren (Casola et al. 2006). Die primäre IgG1 Immunantwort von Grb2fl/fl Cγ1cre/+ Mäusen nach einer Immunisierung mit NP33-KLH war erhöht, während die sekundäre Antwort unverändert war (Abb. 25B). Grb2 hat also einen inhibitorischen Effekt auf die primäre IgG1-Antwort gegen NP-KLH in Grb2fl/fl Cγ1cre/+ Mäusen. Die Affinitätsreifung von B-Zellen in Grb2fl/fl Cγ1cre/+ Mäusen war aber nicht verändert (Abb. 25B). Die Deletion von Grb2 im Keimzentrum oder in B-Zellen ab der frühen B-Zell Entwicklung beeinträchtigt die Affinitätsreifung von B-Zellen nicht. 68 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A 10 1 0.1 0.01 0.001 Grbfl/flmb1+/+ NP33 -KLH (Boost) Grb2fl/fl mb1cre/+ 100 10 1 0.1 0.01 0.001 0 7 14 21 28 35 0 B 14 33 IgG1 100 * * 10 1 0.1 NP33 -KLH (Boost) 0.01 NP4-specific IgG1 (AU) * 21 28 0.001 7 14 21 Grbfl/flmb1+/+ Grb2fl/fl mb1cre/+ 1.0 NP33 -KLH (Boost) 0.0 0 7 14 * 28 35 NP33 -KLH (Boost) 0.01 0 7 time(d) 14 21 28 35 2.0 IgG1 1.5 NP33 -KLH (Boost) 1.0 0.5 0.0 0 7 14 21 28 time(d) time(d) wt/wt fl/fl cre/+ wt/wt C1cre/+ Grb2wt/wt C1cre/+ Grb2 C1cre/+ Abb. 25: Keine Veränderung in der Affinitätsreifung von Grb2 Cγ1cre/+ und Grb2fl/fl mb1Grb2 Mäusen im fl/fl cre/+ fl/fl cre/+ fl/fl cre/+ Grb2 C Grb2 35 33 1 0.1 28 Affinity maturation NP -KLH immunisation p=0.08 * 21 time(d) NP33-KLH immunisation IgG1 10 G G 0.5 35 0.001 0 1.5 IgG1 time(d) Primary immunisation: NP -KLH NP -KLH immunisation 33 NP17-specific IgG1 (AU) 7 time(d) 100 NP4/NP17-specific IgG1 (AU) 1000 NP33 -KLH (Boost) 100 Affinity NP33-KLHmaturation immunisation NP33-KLH immunisation IgG1 NP4/NP17-specific IgG1 (AU) 1000 IgG1 NP4-specific IgG1 (AU) NP17-specific IgG1 (AU) Primary NP33immunisation: -KLH immunisationNP33-KLH C Grb2 C Vergleich zu Kontrolltieren. A) Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Mäuse wurden an Tag 0 und 14 mit je 100 µg NP33-KLH immunisiert. Der IgG1 Serumtiter gegen NP4 und NP17 wurde mittels NP-BSA ELISA von Tag 14 bis Tag 35 bestimmt. Das Verhältnis der NP4 zur NP17 Antwort wurde gebildet, um die Affinitätsreifung zu untersuchen. Jochen Ackermann die Mäuse für A immunisiert und Serum gewonnen. B) und C) Grb2fl/fl Cγ1cre/+ und Grb2wt/wt Cγ1cre/+ Mäuse wurden an Tag 0 und 21 mit je 50 µg NP 9- oder NP33-KLH immunisiert. Der IgG1 Serumtiter gegen NP4 und NP17 wurde mittels NP-BSA ELISA bestimmt. Das Verhältnis der NP4 zur NP17 Antwort wurde gebildet, um die Affinitätsreifung zu untersuchen. C) Wurde zusammen mit Felix Hartmann durchgeführt. Für A): Grb2fl/fl mb1+/+ n=4 Mäuse; Grb2fl/fl mb1cre/+ n=4 Mäuse; Für B) Grb2wt/wt Cγ1cre/+ n=4 Mäuse; Grb2fl/fl Cγ1cre/+ n=5 Mäuse; Für C) Tage 0, 7 und 14: Grb2wt/wt Cγ1cre/+ n=11 Mäuse; Grb2fl/fl Cγ1cre/+ n=5 Mäuse; C) Tage 21, 28 und 35: Grb2wt/wt Cγ1cre/+ n=6 Mäuse; Grb2fl/fl Cγ1cre/+ n=3 Mäuse. Für die Statistik wurde der T-Test verwendet; *p<0,05. Suppl. Fig. X: Elevated IgG1 responses of Grb2fl/fl Cγ1cre/+ mice after NP -KLH immunisation 69 B-Zell spezifische Grb2 Knockoutmaus 35 Ergebnisse 6.1.5.5 Grb2 verstärkt die Gedächtnisantwort gegen Glycoprotein B des humanen Cytomegalovirus auch nach einer intakten B-Zell Entwicklung Neben der beeinträchtigten Gedächtnisantwort von Grb2-/- B-Zellen aus Grb2fl/fl mb1cre/+ Mäusen haben diese auch einen Defekt in der B-Zell Entwicklung und eine verminderte Keimzentrumreaktion, die Auswirkungen auf die Generierung von Gedächtnis B-Zellen haben könnte. Die Grb2fl/fl Cγ1cre/+ Maus bietet mit der normalen Entwicklung von naiven B-Zellen, der weitgehend unbeeinflussten Keimzentrumsreaktion (Abb. 23 und Abb. 24), sowie der intakten Affinitätsreifung (Abb. 25) und der späten Deletion von Grb2 (Casola et al. 2006) die Möglichkeit, Grb2-/- Gedächtnis B-Zellen zu untersuchen, die eine weitgehend normale Entwicklung durchlaufen haben. Grb2fl/fl Cγ1cre/+ Mäuse und Grb2wt/wt Cγ1cre/+ Kontrolltiere wurden drei Mal mit gB immunisiert. Die Bildung von gB-spezifischen IgG1 Antikörpern war in Grb2fl/fl Cγ1cre/+ und Kontrolltieren vergleichbar (Abb. 26A). 71 Tage nach der letzten Immunisierung war die Zahl der B220+IgG1+, und der B220+IgG1+gB-bindenden Zellen in der Milz tendenziell reduziert, während die Zahl der B220+IgG2b+ Zellen unverändert war (Abb. 26C und D). Es wurden Gesamt-CD19+-Milzzellen, die jeweils 8x103 CD19+B220+IgG1+gB-bindende Zellen enthielten aus Grb2fl/fl Cγ1cre/+ und Kontrolltieren i.v. in Rag1-/- Rezipienten übertragen und nach sechs Tagen mit VLPs reaktiviert. Die gB spezifische IgG1-Gedächtnisantwort war in Grb2fl/fl Cγ1cre/+ Mäusen im Vergleich zu den Grb2wt/wt Cγ1cre/+ Kontrolltieren reduziert (Abb. 26E). Die gB spezifischen IgG1-Serumtiter glichen sich aber etwa ab Tag 15 wieder aneinander an, während die Zahl der IgG1+ gB-spezifischen antikörper-sekretierenden Plasmazellen in Rag1-/Mäusen, die Grb2fl/fl Cγ1cre/+ Gedächtniszellen erhalten hatten, auch an Tag 42 noch stark verringert war (Abb. 26E und F). Durch die Untersuchung von Gedächtnis-B-Zellen aus Grb2fl/fl Cγ1cre/+ Mäusen, die eine weitgehend normale B-Zell-Entwicklung und Keimzentrumsreaktion aufweisen konnte gezeigt werden, dass Grb2 unabhängig von der B-Zell Entwicklung und der Keimzentrumsreaktion einen positiven Einfluss auf die Gedächtnisantwort von B-Zellen hat (Abb. 18 und Abb. 19). 70 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse A gB of hCMV in Alum i.p. d0 reactivation Transfer of + + VLPs in PBS i.v. d43 d-6 d0 d28 d63 d134 IgG CD19 spleen 4µg 2µg 2µg 2µg VLPs cells containing recipient donor 8x103 (Rag1-/- mice) IgG+CD19+gB+ cells i.v. ELISA ELISPOT ELISA immunisation with gB of hCMV C Ante transfer + IgG2b+ before transfer IgG1+ spleen before transfer spleen IgG+ gB before transfer spleen wt/wt cre/+ Grb2 c1 + + B220+ IgG2b B220+ IgG1 B220+IgG1+gB+ 2.0 Total cells (x104) 1 0.1 gB (2nd Boost) gB (1st Boost) 0.01 0 d134 Grb2wt/wt cγ1cre/+ IgG1+ G B220+ 0.5 0.8 6 0.7 5 4 3 2 1 0.5 0.4 0.3 0.2 0.0 Grb2fl/fl cγ1cre/+ non immunised Grb2fl/fl cγ1cre/+ Bone Marrow Bone Marrow 0.04%±0.02 Grb2wt/wt cg1cre/+ fl/fl cre/+ Grb2 cg non immunised IgG1+gB+ 0.003%±0.001 immunisation with gB of hCMVgB-Cy5 500 0.6 0.1 0 0.06%±0.02 0.11%±0.06 IgG1 gB-specific IgG1 (AU) 1.0 7 7 14 21 28 35 42 49 56 63 70 77 0.011%±0.009 E 1.5 0.0 time(d) D Total cells (x104) Grb2fl/fl cg1cre/+ 10 Total cells (x104) IgG1 rb 2w t/ G wt rb c 2f g1 cr l/f no l cg e/+ 1 n im cre / m un + is ed G rb 2 wt /w t G rb c 2 fl/ 1 cre fl /+ no c n im 1 cre /+ m un is ed G rb 2 wt /w t G rb c 2 fl/ 1 cre fl /+ no c n im 1 cre /+ m un is ed gB-specific IgG1 (AU) B 100 Spleen Grb2wt/wt c1cre/+ fl/fl cre/+ Grb2 c1 non immunised Grb2wt/wt c1cre/+ Grb2fl/fl c1cre/+ non immunised 0.000%±0.000 Post transfer IgG1 * 50 ** 5 ** * 0.5 0.05 0 7 14 21 28 35 42 time(d) p=0.09 Antibody-secreting cells per 106 cells 70 IgG gB ELISPOT Spleen gB-specific IgG - Spleen IgG1 gB ELISPOT Spleen gB-specific IgG1 - Spleen 35 * 40 Grb2wt/wt c1cre/+ donor cells30 Grb2fl/fl cg1cre/+ donor cells 25 non immunised - donor cells20 30 15 50 20 10 0 10 5 0 rb do 2f l/f no lc rc g1 el cr ls e/ on + d im on m or un ce is lls ed -d on or ce lls 60 rb do 2f l/f no lc rc g1 el cr ls e/ on + d im on m or un ce is lls ed -d on or ce lls Antibody-secreting cells per 106 cells F t/w tc g1 cr e/ + B-Zell spezifische Grb2 Knockoutmaus 2w 2w t/w tc g1 cr e/ + Suppl. Fig. X: Reduced memory immune response of Grb2fl/fl Cγ1cre/+ cells to glycoprotein B 71 Ergebnisse Abb. 26: Schwächere Gedächtnisantwort von Grb2fl/fl cγ1cre/+ B-Zellen gegen Glykoprotein B (gB) des humanen Zytomegalovirus verglichen mit Kontrollzellen. A) Grb2fl/fl cγ1cre/+ und Grb2wt/wt cγ1cre/+ Mäuse (10 Generationen auf C57BL/6 zurückgekreuzt) wurden ein Mal mit 4 µg und zwei Mal mit 2 µg gB in Alum i.p. immunisiert. Die gB spezifischen IgM und IgG Serumtiter wurden mittels ELISA über die Zeit bestimmt (B). 134 Tage nach der ersten Immunisierung wurde der Anteil an B220+, IgG+, gB-bindenden Zellen in der Milz bestimmt (C und D). Es wurden 8x103 CD19+B220+IgG1+gB-bindende Milzzellen i.v. in Rag1-/- Rezipienten übertragen. Die CD19+ Zellen wurden negativ über eine komplementvermittelte T-Zelllyse (anti-Thy1, anti-CD4, anti-CD8) und danach positiv mit anti-CD19 Beads magnetisch angereichert. Die transferierten gB spezifischen Gedächtnis B-Zellen wurden sechs Tage nach dem Transfer durch die Gabe von 2 µg virusartigen Partikeln in PBS i.v. (enthalten gB) reaktiviert. gB spezifische Immunglobulinlevel wurden mittels ELISA über die Zeit bestimmt (E). Die Rezipiententiere wurden 33 Tage nach dem Transfer der Gedächtniszellen geopfert und ein gB spezifischer ELISPOT wurde durchgeführt (F). Für B), C) und D): Grb2wt/wt Cγ1cre/+ n=6 mäuse; Grb2fl/fl Cγ1cre/+ n=6 Mäuse; Für C) und D) nicht immunisiert =2 Mäuse; Für E) und F) Grb2wt/wt Cγ1cre/+ Donorzellen n=3 Mäuse; Grb2fl/fl Cγ1cre/+ Donorzellen n=5 Mäuse; naive Donorzellen =1 Maus. Für die Statistik wurde der T-Test verwendet; *p<0,05; *p<0,01. 6.1.5.6 Untersuchung zur Rolle von Grb2 in der Gedächtnisantwort gegen NP-CGG Grb2 verstärkt die Gedächtnisantwort von B-Zellen (Abb. 18, Abb. 19 und Abb. 26). Die bisherigen in vivo Experimente basieren auf einem Transfersystem, in dem die Gedächtnis BZellen ohne T-Zell Hilfe in Mäusen mit einem leeren B-Zell Kompartment reaktiviert wurden. Hier soll untersucht werden, ob T-Zell Hilfe die reduzierte Gedächtnisantwort der Grb2-/Gedächtnis B-Zellen ausgleichen kann. Dazu wurden Grb2fl/fl mb1cre/+ Mäuse und Grb2fl/fl mb1+/+ Kontrolltiere zunächst zwei Mal mit NP-CGG immunisiert, welches eine thymus-abhängige Immunantwort auslöst (Abb. 27A). Die Primär- und Sekundärantwort für IgG1 und IgG2c waren unverändert, während die primäre IgM-Antwort gegen NP erhöht war (Abb. 27B). Die Zahl der B220+IgG1/IgG2a/IgG2b+NP-bindenende Zellen war 106 Tage nach der letzten Immunisierung in Grb2fl/fl mb1cre/+ Mäusen leicht aber nicht signifikant erniedrigt (Abb. 27C). Es wurden je 3x102 sortierte CD19+B220+IgG+NP-bindende Milzzellen zusammen mit naiven Milzzellen als Füllerzellen i.v. in immunkompatible wt Rezipienten übertragen (Abb. 27D). Es gab zwei Gruppen von Rezipienten. Eine Gruppe naiver wt Mäuse und eine weitere Gruppe, die vor dem Transfer der Gedächtniszellen mit CGG immunisiert wurde. Fünf Tage nach dem Transfer wurden die Gedächtniszellen durch die Gabe von 50 µg/Maus NP-CGG reaktiviert. Die T-Zellen aus den Rezipienten, die mit CGG vorimmunisiert waren sollten in der Lage sein den übertragenen NP-spezifischen Gedächtnis B-Zellen spezifische Hilfe zur Verfügung zu stellen, im Gegensatz zu T-Zellen aus den naiven Rezipienten (Abb. 27E). Die IgM-Antwort gegen NP war in allen vier Gruppen gleich. Die NP-spezifische IgG-Antwort dagegen war in den vorgeprimten Tieren tendenziell stärker als in den naiven Rezipienten. Die Immunantwort der Mäuse, die Grb2fl/fl mb1cre/+ Gedächtniszellen bekommen hatten war tendenziell niedriger als in denen die 72 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse Grb2fl/fl mb1+/+ Gedächtniszellen bekommen hatten. Dies war auch in bei den Rezipienten zu beobachten, die mit CGG vorimmunisiert wurden (Abb. 27F). Der Unterschied ist aber jeweils nicht signifikant, was an der geringen Zahl der übertragenen Gedächtniszellen liegen könnte. Auch die Affinitätsreifung der NP-spezifischen Antikörper war in Mäusen, die Grb2fl/fl mb1cre/+ Gedächtniszellen bekommen hatten gegenüber Tieren, die Grb2fl/fl mb1+/+ Gedächtniszellen bekommen hatten, unabhängig von der Rezipientengruppe tendenziell niedriger (Abb. 27G). 73 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse 56 0.05 63 0 7 14 21 28 56 0.05 0 63 7 21 28 0.00%±0.00 mb 5 4 3 2 1 e/ + + H-2Kb cr +/ immunisation with CGG IgG *** 70 40 10 1 IgM 70 200 150 100 50 IgG Spleen Grb2fl/fl mb1+/+ 60 50 40 30 20 10 0 0 0 2 4 6 time(d) 8 10 0 2 Grb2fl/fl mb cre/+ non immunised no tp rim ed 4 6 8 10 C immunisation with NP-PE postTransfer G NP4/NP17-specific IgG (AU) NP17-specific IgM (AU) 250 H-2Kd NP4-specific IgG (AU) F im 100 no n G rb 2 E 0 IgDb immunisation with NP-PE immunisation with NP-PE 1.5 Affinity IgG not primed 1.0 CGG primed 0.5 0.0 7 10 time(d) Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells time(d) Grb2fl/fl mb1+/+ donor cells Grb2fl/fl mb cre/+ donor cells non immunised - donor cells Suppl. Fig. X: T cell help does not seem to compensate for the reduced memory immune fl/fl +/+ 74 63 0 like C57BL/6 like BALB/c mixed allo-/haplotype Blood 56 + fl/fl +/+ B220 IgG+NP+ Grb2 NP-APC recipient mice MHC I haplotypes Blood 49 6Grb2fl/fl mb1cre/+ mb 2.83%±2.48 B220+ IgD allotypes 42 IgG+ before transfer spleen Grb2fl/fl mb1+/+ non immunised NP-PE+ D 35 time(d) m b Grb2 3.31%±1.95 IgDa 14 fl cre/+ fl/fl mb1+/+ Grb2fl/fl mb1Grb2 fl/fl cre/+ mb NP-PE 49 b1 B220+IgG1/IgG2a/IgG2b+ +/+ +/+ Grb2fl/flfl/fl mb1 Grb2 mb1 d134 fl/fl cre/+ Grb2 42 time(d) time(d) C 35 se d 49 fl/ 42 m 35 rb 2 28 G 21 NP-CGG (Boost) Total cells (x103) 14 0.5 fl 7 5 fl/ 0 0.5 50 CGG-specific IgG (AU) 1.5 NP-CGG (Boost) IgG2c un i NP-CGG (Boost) 5 500 m 15 IgG1 ed * ante Transfer 50 pr im NP17-specific IgG1 (AU) NP17-specific IgM (AU) IgM* G ELISA immunisation with NP-PE B150 d0 reactivation Adoptive transfer 2 d-5 NP27-CGG in PBS i.v. d10 of 3x10 + + 50µg IgG CD19 NPrecipient binding splenic (immunogenic cells with matched matched mice; filler cells i.v. ELISPOT ELISA CGG primed or not) immunisation with NP-PE immunisation with NP-PE G NP27-CGG in Alum i.p. d0 d28 d134 50µg 50µg donor NP17-specific IgG2c (AU) A Grb2 mb1 donor cells in CGG primed mice fl/fl Knockoutmaus B-Zell spezifische Grb2 Grb2 mb cre/+ donor cells in CGG primed mice Grb2fl/fl mb cre/+ donor cells in CGG primed m Grb2fl/fl mb cre/+ donor cells in CGG primed mice non immunised - donor cells in CGG primed mice Legend Legend Ergebnisse Abb. 27: Untersuchung zur Rolle von Grb2 in der Gedächtnisantwort gegen NP-CGG. A) Grb2fl/fl mb1cre/+ und Grb2fl/fl mb1+/+ Mäuse wurden zwei Mal mit i.p. mit 50 µg NP27-CGG in Alum immunisiert. Die NP-spezifischen IgM, IgG1 und IgG2c Immunglobulin Serumtiter wurden mittels ELISA über die Zeit bestimmt (B). 134 Tage nach der ersten Immunisierung wurde der Anteil an B220 +, IgG+, NP-bindenden Zellen in der Milz bestimmt (C). Es wurden 3x102 sortierte B220+, IgG+, NPbindende Milzzellen zusammen mit Milzzellen von naiven immunologisch kompatiblen wt Mäusen als Füllerzellen i.v. in immunologisch kompatible Rezipienten übertragen. Donortiere und Rezipienten haben einen gemischten BALB/c / C57BL/6 Hintergrund, weshalb es nötig ist Abstoßungsreaktionen zwischen Donor und Rezipient zu minimieren. Die immunologische Kompatibilität wurde über den MHCI Haplotyp und den Immunglobulin Allotyp bestimmt (D). Die Sortierung der Gedächtniszellen erfolgte in drei Schritten. Als erstes wurden die CD19 + Zellen über magnetische Beads angereichert. Die weiteren Schritte nutzen durchflusszytometrische Methoden. Im zweiten Schritt wurden die B220+, IgG+ Zellen mit einer hohen durchflussrate angereichert und im dritten Schritt wurden daraus die B220+, IgG+, NPbindenden Zellen sortiert. Die Rezipienten wurden 22 vor dem Transfer der Gedächtniszellen entweder mit 50 µg CGG oder nicht immunisiert und 27 Tage nach der CGG-Immunisierung wurde der CGG spezifische Immunglobulintiter mittels ELISA bestimmt (E). Die transferierten NP spezifischen Gedächtnis B-Zellen wurden fünf Tage nach dem Transfer durch die Gabe von 50µg NP27-CGG in PBS i.v. reaktiviert. NP spezifische Immunglobulinlevel (F), sowie die Affinität (G) wurden mittels ELISA über die Zeit bestimmt (F). Für B) und C) Grb2fl/fl mb1+/+ n=5 Mäuse; Grb2fl/fl mb1cre/+ n=5 Mäuse; For C) nicht immunisiert =2 Mäuse; Für F) Grb2fl/fl mb1+/+ Donorzellen n=6 Mäuse; Grb2fl/fl mb1cre/+ Donorzellen n=3 Mäuse; naive Donorzellen =2 Mäuse; Grb2fl/fl mb1+/+ Donorzellen n=5 CGG vorbehandelte Mäuse; Grb2fl/fl mb1cre/+ Donorzellen n=3 CGG vorbehandelte Mäuse; naive Donorzellen =2 CGG vorbehandelte Mäuse. Für die Statistik wurde der T-Test verwendet; *p<0,05. 6.1.6 Keine erhöhte Autoimmunität in alternden Grb2fl/fl mb1cre/+ Mäusen B-Zell spezifische Grb2-/- Mäuse bilden mehr IgM Autoantikörper und weisen mehr Antikörperablagerungen in der Niere auf, was allerdings zu keinen Autoimmunerkrankungen führt (Jang et al. 2011). Um dies zu belegen, sollte untersucht werden, wie sich das Fehlen von Grb2 in alternden Mäusen auswirkt. Es wurden Schnitte von Hep-2 Zellen verwendet, um zu untersuchen, ob es im Serum von B-Zell spezifischen Grb2-/- Mäusen mehr IgG Antikörper gegen körpereigene Antigen im Zellkern (ANA), wie z.B. gegen DNA gibt. Dazu wurden die Hep-2 Zellen mit Serum aus den B-Zell spezifischen Grb2-/- Mäusen inkubiert und IgG Antikörper aus 75 B-Zell spezifische Grb2 Knockoutmaus Ergebnisse dem Serum, die an Antigene der Hep-2 Zellen gebunden hatten wurden über fluoreszenzgekoppelte anti-IgG Antikörper nachgewiesen. Das Serum von 50 Wochen alten BZell spezifischen Grb2-/- Mäusen enthielt gegenüber 50 Wochen alten Kontrollmäusen keine erhöhten IgG Autoantikörperlevel. Auch das Muster der Antikörperbindung, das Rückschlüsse auf die Spezifität von Autoantikörpern zulässt (Mahler & Fritzler 2012) war nicht deutlich verändert (Abb. 28A, B). Zusätzlich zeigt ein dsDNA ELISA über die Zeit, dass der Spiegel autoreaktiver anti-dsDNA-IgG Antikörper in B-Zell spezifischen Grb2-/- Mäusen bis zu einem Alter von 42 Wochen unauffällig war (Abb. 28C). B-Zell spezifische Grb2-/- Mäuse weisen bis zu einem Alter von 50 Wochen noch keine erhöhten IgG ANA-Autoantikörpertiter auf. Ergänzend wurde ein Blut-Harnstoff-Stickstoff (BUN) Test durchgeführt. Harnstoff fällt als Endprodukt des Eiweißstoffwechsels an und wird in der Niere aus dem Blut gefiltert und über den Urin abgegeben. Bei einer gestörten Nierenfunktion sammelt sich Harnstoff im Blut an und kann im Serum nachgewiesen werden. Im Serum von 64 Wochen alten B-Zell spezifischen Grb2-/- Mäusen war kein erhöhter Harnstofflevel festzustellen (Abb. 28D). Damit gab es keine Hinweise auf eine beeinträchtigte Nierenfunktion in B-Zell spezifischen Grb2-/- Mäusen. Zusammenfassend zeigen Grb2fl/fl mb1cre/+ Mäuse im Alter keine Anzeichen für erhöhte IgG Autoantikörperlevel oder eine beeinträchtigte Nierenfunktionen. 76 B-Zell spezifische Grb2 Knockoutmaus Tota Tota 50 45 40 35 30 25 20 15 10 5 0 20 * 10 Ergebnisse 0 A control (20 weeks) Grb2fl/fl mb1+/+ 100 µm 50 weeks pos. control (old MLR-lpr) Grb2fl/fl mb1cre/+ ANA Anti Nuclear Antibodies (Mean fluorescence intensity) B C 200 grb2fl/flmb1+/+ 50 weeks grb2fl/flmb1cre/+ 50 weeks old MLR-lpr 150 grb2fl/flmb1+/+ 20 weeks 100 50 0 D Anti-dsDNA (AU) BUN IgG anti-dsDNA 30 Blood urea nitrogen grb2fl/flmb1wt/wt grb2fl/flmb1cre/wt 20 100 mg/dl IgG anti-dsDNA (AU) 1000 10 10 18 0 24 30 weeks 36 42 Grb2fl/flmb1+/+ Grb2fl/flmb1cre/+ Survival of Grb2 fl/fl mb1cre cre/wt mice weeks:Survival proportions 100 B-Zell spezifische Grb2 Knockoutmaus ival p=0.19 75 Grb2fl/fl mb1wt/wt Grb2fl/fl mb1cre/wt 77 Ergebnisse Abb. 28: Keine erhöhte Autoimmunität in Grb2fl/fl mb1cre/+ Mäusen. A) Objektträger mit Schnitten von Hep-2 Zellen wurden mit 1:50 vorverdünntem Serum aus 50 Wochen alten Grb2fl/fl mb1+/+ oder Grb2fl/fl mb1cre/+ Mäusen inkubiert. Als Kontrollen dienten ein Gemisch aus Seren von alten MLR-lpr Mäusen und das Serum einer 20 Wochen alten Grb2fl/fl mb1+/+ Maus. IgG-Antikörper, die gegen Bestandteile von Hep-2 Zellen gerichtet waren wurden über einen Alexa Fluor 488 gekoppelten Ziege anti-Maus IgG (H+L) Antikörper detektiert. Gezeigt ist beispielhaft ein Präparat pro Maus, wobei je zwei Beispiele für Grb2fl/fl mb1+/+ bzw. Grb2fl/fl mb1cre/+ Mäuse ausgewählt wurden. B) Zeigt die Quantifizierung von A anhand der durchschnittlichen Fluoreszenzstärke der Hep-2 Zellkerne. Pro Maus wurde die durchschnittliche Fluoreszenzstärke von fünf Hep-2 Zellkernen mit ImageJ bestimmt und der Mittelwert gebildet. Die Mittelwerte für die Fluoreszenz der Proben der einzelnen Mäuse sind grafisch dargestellt. C) Maxisorp-Platten wurden erst mit Poly-L-Lysin und dann mit doppelstrang-DNA inkubiert. Es wurde 1:50 vorverdünntes Serum, das zu unterschiedlichen Zeitpunkten gewonnen wurde, auf die Platten gegeben. Dann wurden an doppelstrang-DNA gebundene IgG Antikörper über einen anti-IgG alkaline Phosphatase gekoppelten Antikörper und die Umsetzung von Para-Nitrophenylphosphat detektiert. D) Blut-Harnstoff-Stickstoff (BUN) von 64 Wochen alten Grb2fl/fl mb1+/+and Grb2fl/fl mb1cre/+ Mäusen wurde mit einem kommerziell erhältlichen Kit bestimmt (Stanbio). Für A) und D) Grb2fl/fl mb1+/+ n=3 Mäuse; Grb2fl/fl mb1cre/+ n=5 Mäuse; Für C) Grb2fl/fl mb1+/+ n=3 Mäuse; Grb2fl/fl mb1cre/+ n=6 Mäuse; Für die Statistik wurde der T-Test verwendet. 6.2 T-Zell spezifische Grb2 Knockoutmaus Grb2 hat in heterozygoten Grb2 Knockout Mäusen, sowie in T-Zell spezifischen Grb2 Knockout Mäusen einen Einfluss auf die T-Zell Entwicklung und Aktivierung (Gong et al. 2001; Jang et al. 2010). Nachfolgend wurden diese Aspekte, sowie die Rolle von Grb2 in T-Helferzellpopulationen weiter untersucht. Dafür wurden Grb2fl/fl Mäuse mit Lckcretg Mäusen verpaart, die Cre unter der Kontrolle des proximalen Lck Promotors ab dem Übergang vom DN2 zum DN3 Entwicklungsstadium exprimieren (Shimizu et al. 2001). Außerdem wurden Mäuse in die Cre unter der Kontrolle des CD4 Promotors eingebracht wurde und die Cre in der Entwicklung ab dem CD4+CD8+ doppelt positiven T-Zell Stadium exprimieren mit Grb2fl/fl Mäusen verpaart. Durch die Deletion von Grb2 in unterschiedlichen Stadien der T-Zell Entwicklung ist es möglich Rückschlüsse auf die Wirkung von Grb2 im Verlauf der T-Zell Entwicklung zu ziehen. 6.2.1 Erfolgreiche gewebespezifische Depletion von Grb2 in T-Zellen Die Deletion von Grb2 in CD4-CD8- T-Zellen, CD4+CD8+ T-Zellen und in CD4+ bzw. CD8+ einzel positiven T-Zellen im Thymus von Grb2fl/fl Lckcretg Mäusen wurde mittels Western-Blot untersucht. In CD4-CD8- Grb2fl/fl Lckcretg T-Zellen war die Grb2 expression tendenziell reduziert und ab den CD4+CD8+ T-Zellen war kein Grb2 mehr nachweisbar (Abb. 29A). Auch in T-Zellen aus der Peripherie von Grb2fl/fl Lckcretg Mäusen konnte kein Grb2 mehr nachgewiesen werden (Abb. 29B), weswegen Grb2 in Grb2fl/fl Lckcretg Mäusen erfolgreich ausgeknockt wurde. 78 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A Thymus Grb2fl/fl double positive CD4+ CD4 Lckcre double negative - + - + - + - + CD8+ α -Grb2 CD8 α -β-Aktin B Spleen Grb2fl/fl Lckcre CD3 T cells - - + + B cells α -Grb2 B220 α -β-Aktin Abb. 29: T-Zell spezifische, genetische Depletion von Grb2 im Thymus und in der Peripherie von Grb2fl/fl Lckcretg Mäusen. A) Thymocyten wurden auf CD4 und CD8 angefärbt. B) Milzzellen wurden auf B220 und CD3 angefärbt. A) Es wurden doppelt negative T-Zellen (CD4-CD8-), doppelt positive T-Zellen (CD4+CD8+), CD4 einzelpositive T-Zellen (CD4+CD8-), CD8 einzelpositive T-Zellen (CD4-CD8+) aus dem Thymus und B) T-Zellen (CD3+B220-), sowie B-Zellen (CD3-B220+) aus der Milz über durchflusszytometrische Sortierung aufgereinigt. Gezeigt sind Überlagerungsbilder der sortierten reanalysierten Zellpopulationen. Das Verhältnis der Populationen zueinander spiegelt dabei nicht die Situation in der Ausgangssituation vor der Sortierung da. Lysate der sortierten Zellen wurden für einen Immunoblot verwendet und mit anti-Grb2 (3F2) oder anti-Aktin (Cedarlane) Antikörpern auf den Grb2- bzw. Aktingehalt untersucht. cell specific deletion of Grb2 in the thymus and periphery of Grb2 T-Zell spezifische Grb2 Knockoutmaus Lckcre mice. A) Splenic cells were 79 Ergebnisse 6.2.2 Die T-Zell spezifische Grb2 Defizienz beeinträchtigt die frühe T-Zell Entwicklung Die frühe T-Zell Entwicklung in Grb2fl/fl Lckcretg Mäusen und Grb2fl/fl CD4cretg Mäusen wurde durchflusszytometrisch analysiert. Cre unter der Kontrolle des proximalen Lck Promotors wird ab dem Übergang vom DN2 zum DN3 Entwicklungsstadium exprimiert (Shimizu et al. 2001), während Cre unter der Kontrolle des CD4 Promotors später in der Entwicklung ab dem CD4+CD8+ doppelt positiven T-Zell Stadium exprimiert wird. In der Grb2fl/fl CD4cretg Maus waren in den doppelt negativen Stadien, in denen CD4cre noch nicht exprimiert wird, keine Veränderungen in den Populationen vorhanden. In der Grb2fl/fl Lckcretg Maus waren die doppelt negativen Stadien ab der Expression von Lckcre verändert. Es waren mehr DN3 T-Zellen und weniger DN4 T-Zellen vorhanden (Abb. 30A). In CD4+CD8+ doppelt positiven T-Zellen wurde die Hochregulation von CD5 und CD69 untersucht, die abhängig von der TZR-Expression und Signalleitung sind und mit positiver Selektion in Verbindung gebracht werden (Azzam et al. 1998; Dutz et al. 1995; Swat et al. 1993; Bendelac et al. 1992; Testi et al. 1988). Der Anteil der CD5+CD69+ Zellen an den CD4+CD8+ T-Zellen war in der Grb2fl/fl CD4cretg Maus und in der Grb2fl/fl Lckcretg Maus gegenüber den Kontrollmäusen unverändert (Abb. 30B). Die Reifung der B-Zellen wurde auch anhand des Reifungsmarkers HSA (CD24) untersucht. Die Zahl der TCRβ+HSAhigh Zellen war in der Grb2fl/fl CD4cretg Maus unverändert, während sie in der Grb2fl/fl Lckcretg Maus reduziert war. Dies kann mit der früheren Deletion von Grb2 in der Grb2fl/fl Lckcretg Maus erklärt werden. Die Zahl der reiferen TCRβ+HSAlow Zellen war sowohl in der Grb2fl/fl CD4cretg Maus als auch in der Grb2fl/fl Lckcretg Maus reduziert (Abb. 30C). Grb2 ist wichtig für die T-Zell Entwicklung und spielt sowohl in den frühen doppelt negativen Stadien, als auch in der späteren Entwicklung im Thymus eine Rolle. 80 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse -C D 25 - + + -C D 25 C D 25 + D 44 C C N 2 N 3 C N 4 D 44 TH DN % of DN N 1 D Grb2fl/fl Lckcretg D CD44 Grb2fl/fl D DN3 Grb2fl/fl Grb2fl/fl CD4cretg D 44 DN4 % of parent DN2 90 80 70 60 50 40 30 20 10 0 D Grb2 DN1 TH F3 percent of parent B D 44 Grb2fl/fl CD4cretg C Thymus C D 25 + - CD4- CD8A Gr1- CD11b- B220 fl/fl *** 80 Grb2fl/fl Grb2fl/fl Lckcretg 70 % of parent 60 50 * 40 30 20 10 -C D 25 - D 25 + D 44 C N 4 D N 3 D N 2 D D D 44 C D 44 C C N 1 D Grb2fl/fl CD4cretg -C +C D +C D D 44 CD25 C CD4+CD8+ Grb2fl/fl 25 + 25 - 0 TH F5 DP pos percent of parent fuer Abb CD5+CD69+ 17.5 % of parent 15.0 12.5 10.0 7.5 5.0 TH CD5 CD69 fuer Abb + 0.0 D 69 + C D 5 Grb2fl/fl Lckcretg Grb2fl/fl 17.5 Grb2fl/fl Grb2fl/fl Lckcretg C CD69 2.5 % of CD4+ CD8+ 15.0 12.5 10.0 7.5 5.0 2.5 C D 69 + 0.0 C TH F2 percent of parent H H ** 13 12 11 10 9 8 7 6 5 4 3 2 1 0 Grb2fl/fl Grb2fl/fl Lckcretg SA H hi gh SA hi gh lo w * H hi gh lo w TH HSA TCRb SA hi gh * hi gh Grb2fl/fl Lckcretg % of parent Grb2fl/fl TC R HSA (CD24) TCRhigh HSAlow 12 11 10 9 8 7 6 5 4 3 2 1 0 SA F % of parent TCRhighHSAhigh Grb2fl/fl CD4cretg hi gh Grb2fl/fl TC R E D 5+ CD5 TC R TC R TCRβ Fig. X: Grb2 influences early T cell development positively. Deletion of Grb2 at the double 81 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 30: Grb2 ist wichtigfür die frühe T-Zell Entwicklung. Dabei führt die Deletion von Grb2 im doppelt negativen 3 (DN3) Stadium (Lckcre) zu einer stärker beeinträchtigten Entwicklung, als die Deletion im CD4+CD8+ Stadium. Thymuszellen von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen wurden mit fluochrom gekoppelten Antikörpern gefärbt und durchflusszytometrisch untersucht. A) und B) Grb2-CD11b-B220-CD4-CD8- TZellen wurden über die CD25 und CD44 Expression in die doppelt negativen Zellstadien 1,2,3 und 4 unterteilt. C) und D) Die positive Selektion wurde über den Anteil von CD5+CD69+ Zellen an den CD4+CD8+ T-Zellen untersucht. E) und F) Die Reifung der T-Zellen im Thymus wurde über den Anteil der TCRβ+HSAhigh(CD24) funktionell unreiferen und den TCRβ+HSAlow(CD24) funktionell reiferen T-Zellen an den Thymozyten untersucht. Für A) und B) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Grb2fl/fl Lckcrewt n=16 Mäuse; Grb2fl/fl CD4Lckcretg n=16 Mäuse; Für C), D), E) and F) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Grb2fl/fl Lckcrewt n=5 Mäuse; Grb2fl/fl Lckcretg n=5 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Die Grb2fl/fl Lckcretg Maus hat einen gemischten BALB/c / C57BL/6 Hintergrund, während die Grb2 fl/fl CD4cretg Maus 10 Generationen auf den C57BL/6 Hintergrund zurückgekreuzt wurde. Der Großteil der Daten für die Grb2fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. T-Zell spezifische Grb2 defiziente Mäuse zeigen eine reduzierte Zahl an CD4+ und CD8+ T-Zellen im Thymus und in der Peripherie, zudem ist der Anteil der aktivierten CD4 und CD8 T-Zellen in der Milz erhöht. Die Gesamtzellzahlen an CD4+CD8+, CD4+ und CD8+ T-Zellen im Thymus bzw. CD4+ und CD8+ 6.2.3 T-Zellen in der Peripherie von Grb2fl/fl Lckcretg Mäusen und Grb2fl/fl CD4cretg Mäusen wurden untersucht. Es gab keine signifikanten Unterschiede für die Zahl an CD4+CD8+, CD4+ und CD8+ T-Zellen im Thymus von Grb2fl/fl CD4cretg Mäusen. In Grb2fl/fl Lckcretg Mäusen war die Zahl der CD4+CD8+ T-Zellen tendenziell reduziert, während die CD4+ und CD8+ T-Zellen signifikant reduziert waren (Abb. 31A). Im Lymphknoten und in der Milz von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen war die Zahl an CD4+ und CD8+ T-Zellen signifikant reduziert, wobei die Reduktion in Grb2fl/fl Lckcretg Mäusen deutlich stärker ausfiel (Abb. 31B und C). In der Milz war der Anteil der aktivierten (CD69+) CD4+ und CD8+ T-Zellen an der jeweiligen Population sowohl in Grb2fl/fl Lckcretg als auch in Grb2fl/fl CD4cretg Mäusen leicht erhöht. Der Anteil der aktivierten Zellen in den Lymphknoten war in beiden Mäusen gleich (Abb. 32). T-Zell spezifische Grb2 defiziente Mäuse weisen abhängigkeit vom Zeitpunkt der Grb2 Deletion in der T-Zell Entwicklung reduzierte Zahlen an CD4+ und CD8+ T-Zellen im Thymus und in der Peripherie auf. 82 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse D 8 D 4 D 4 + C D 8 + TH CD4+ CD8+ GZZ C Grb2fl/fl Lckcretg C Grb2fl/fl + TH F1 total cells 120 110 100 90 80 70 60 50 40 30 20 10 0 C CD4 CD8+ B + Grb2fl/fl CD4cretg CD8+ CD4 Thymus CD4+ Grb2fl/fl + Total cells (x106) A CD3+ 100 Grb2fl/fl Grb2fl/fl Lckcretg Total cells (x106) p=0.08 75 50 25 *** *** + C D 8 + D 4 C D 4 + C CD8 C D 8 + 0 CD8+ SP F1 total cells 20 * 15 * 10 5 SP CD4 CD8 GZZ C C D 4 + CD4 0 Grb2fl/fl Lckcretg Grb2fl/fl + D D 8 Grb2fl/fl CD4cretg Grb2fl/fl Total cells (x106) CD4+ Spleen C *** Total cells (x106) 14 Grb2fl/fl Grb2fl/fl Lckcretg 12 10 ** 8 6 4 2 F CD8+ 1.5 1.0 0.5 C D 4 LN CD4 CD8 GZZ C Grb2fl/fl Lckcretg Total cells (x106) CD4 + * 2.0 0.0 Grb2fl/fl D 8 LN F1 total cells * 2.5 + Grb2fl/fl CD4cretg D 8 Grb2fl/fl + CD4+ Total cells (x106) Lymph Node E C CD8 C D 4 + 0 * 18 14 10 6 2 1.0 * Grb2fl/fl Grb2fl/fl Lckcretg 0.5 + D 8 C C CD8 D 4 + 0.0 Fig. X: Grb2 influences T cell numbers in the thymus and in the periphery. Deletion of Grb2 83 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 31: T-Zell spezifische Grb2 defiziente Mäusen zeigen verringerte T-Zellzahlen im Thymus und in der Peripherie. Die Deletion von Grb2 ab dem doppelt negativen 3 Stadium (Lckcre) führt zu einer früheren und ausgeprägteren Reduktion der T-Zellen als eine Deletion ab dem dem CD4+CD8+ Stadium (CD4cre). T-Zellen des Thymus (A), der Milz (C) oder der Lymphknoten (E) wurden durchflusszytometrisch auf die CD4 und CD8 Expression untersucht. Die Gesamtzellzahl für A), C) und E) wurden berechnet und in B), D) und F) dargestellt. Bei den Grb2fl/fl CD4cretg Mäusen wurden nur die inguinalen (Leisten) Lymphknoten untersucht, bei den Grb2fl/fl Lckcretg Mäusen wurden alle auffindbaren Lymphknoten verwendet. Für B) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Grb2fl/fl Lckcrewt n=15 Mäuse; Grb2fl/fl Lckcretg n=15 Mäuse; Für D) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Grb2fl/fl Lckcrewt n=10 Mäuse; Grb2fl/fl Lcktg n=10 Mäuse; Für E) Grb2fl/fl CD4crewt n=8 Mäuse; Grb2fl/fl CD4cretg n=6 Mäuse; Grb2fl/fl Lckcrewt n=9 Mäuse; Grb2fl/fl Lcktg n=10 Mäuse; Für die Statistik wurde der TTest verwendet; *p<0,05; **p<0,01; ***p<0,001. Der Großteil der Daten für die Grb2 fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. 84 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Grb2fl/fl Spleen CD69+ CD69+ SP F4 percent of parent ** 17.5 15.0 12.5 10.0 *** 7.5 5.0 2.5 0.0 D C C 12.5 10.0 7.5 5.0 2.5 D D 4- C D 8+ 0.0 C CD69+ 15.0 D 4+ CD69+ 4..75% 5.6% C 12.5% 12.7% 17.5 8- CD69+ LN F4 percent of parent CD8 % of CD69+ in population 8.32% 10.1% C Lymph node+ CD4+ CD4- CD8- %of max D 4- CD69+ D 8+ 3.64% 4.35% 8- %of max CD69+ CD8+ 13% 18.7% C CD4+ 8.07% 7.68% D 4+ Grb2fl/fl CD4cretg CD4- CD8- % of CD69+ in population A C CD69+ B Grb2fl/fl Grb2fl/fl Lckcretg Spleen 10 * 5 0 D C C D D 8+ Grb2fl/fl Grb2fl/fl Lck C CD69+ 12 11 10 9 8 7 6 5 4 3 2 1 0 8- CD69+ 3,53.% 3.09% % of CD69+ in population 6.93% 8.18% D 4C CD69+ LN CD4 CD8 CD69+ CD8 C 4,25% 7.42% %of max Lymph node+ CD4+ CD4- CD8- D 4C CD69+ D 8+ CD69+ Grb2fl/fl Grb2fl/fl Lck 15 8- CD69+ *** 20 C CD69+ 25 D 4+ 3.4% 4.39% D 4+ 11.4% 19.3% C %of max 2.44% 3.87% SP CD4 CD8 CD69+ CD8+ % of CD69+ in population CD4+ CD4- CD8- 85 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 32: Grb2 Defizienz führt zu mehr aktivierten (CD69+) T-Zellen in der Milz naiver Mäuse. A) Der Anteil der aktivierten T-Zellen wurde für CD4+ und CD8+ Zellen basierend auf der CD69 Expression mittels Durchflusszytometrie bestimmt. A) Milz und Lymphknotenzellen von Grb2fl/fl CD4crewt and Grb2fl/fl CD4cretg Mäusen. B) Milz und Lymphknotenzellen von Grb2fl/fl Lckcrewt und Grb2fl/fl Lcktg Mäusen. Für A) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Für B) Grb2fl/fl Lckcrewt n=8 Mäuse; Grb2fl/fl Lcktg n=7 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Der Großteil der Daten für die Grb2fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. 6.2.4 Die T-Zell spezifsiche Grb2 Defizienz beeinflusst die Zahl von naiven und Gedächtnis T-Zellen in der Peripherie Der Einfluss von Grb2 auf die naiven und die gedächtnis T-Zellen wurde in der Grb2fl/fl Lckcretg Maus und der Grb2fl/fl CD4cretg Maus vergleichend untersucht. Das Verhältnis von naiven zu Gedächtnis T-Zellen war in Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen im Vergleich zu Kontrolltieren verschoben. In der Milz von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen und im Knochenmark von Grb2fl/fl Lckcretg Mäusen waren im Verhältnis weniger naive CD4+ T-Zellen und mehr CD4+ effektor Gedächtnis T-Zellen (TEM) in der CD4+ Population vorhanden als in Kontrolltieren (Abb. 33A,B,C,D). Im Knochenmark von Grb2fl/fl Lckcretg Mäusen gab es keine signifikanten Verschiebungen zwischen den CD4+ Populationen (Abb. 33C,D). In der Milz von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen waren im Verhältnis weniger naive CD8+ T-Zellen und mehr CD8+ TEM und zentrale Gedächtnis T-Zellen (TCM) in der CD8+ Population vorhanden als in Kontrolltieren (Abb. 34A,B). Dies gilt auch für die CD8+ T-Zellen im Knochenmark von Grb2fl/fl Lckcretg Mäusen, wobei die Grb2 defizienten TEM Zellen nur tendenziell erhöht waren (Abb. 34C,D). Die CD8+ T-Zellen im Knochenmark von Grb2fl/fl CD4cretg Mäusen weisen einen signifikant erhöhten Anteil an TEM Zellen auf, während die anderen Populationen nicht signifikant verändert sind (Abb. 34C,D). Neben relativen Veränderungen von T-Zell Populationen wurden auch deren Gesamtzellzahlen untersucht. Die Zahl der naiven CD4+ und CD8+ T-Zellen war in der Milz und in den Lymphknoten der Grb2fl/fl Lckcretg Maus stark reduziert, während die Reduktion in der Grb2fl/fl CD4cretg Maus moderater ausfiel (Abb. 33; Abb. 34). Die zentralen CD4+ und CD8+ Gedächtnis T-Zellen waren in Milz und Lymphknoten der Grb2fl/fl Lckcretg Maus reduziert (Abb. 33; Abb. 34). Die CD4+ effektor Gedächtnis T-Zellen (TEM) der Grb2fl/fl Lckcretg Maus waren in der Milz signifikant und in den Lymphknoten tendenziell reduziert (Abb. 33). Die CD8+ effektor Gedächtnis T-Zellen (TEM) der Grb2fl/fl Lckcretg Maus waren in der Milz unverändert und in den Lymphknoten reduziert (Abb. 34). Im Gegensatz zu den reduzierten Gedächtnis T-Zellzahlen in Grb2fl/fl Lckcretg Mäusen waren die Gedächtnis T-Zellzahlen in Grb2fl/fl CD4cretg Mäusen nicht signifikant verändert (Abb. 33; Abb. 34). Zusammengefasst weisen T-Zell spezifische Grb2-/Mäuse einen niedrigeren Anteil naiver T-Zellen an den CD4+ und CD8+ T-Zellpopulationen auf 86 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse und haben dafür einen höheren Anteil an Gedächtnis T-Zellen. Die Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäuse haben insgesamt weniger naive B-Zellen und die Grb2fl/fl Lckcretg Mäuse weisen zusätzlich reduzierte Gedächtnis T-Zellzahlen auf. 87 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse T(CM) 37.8%±10.6 7.2% ±2.7 SP F3 CD4 percent of parent *** 70 B 50 30 20 7.5 5.0 2.5 0 Total cells (x106) D 44 C - L D 62 C C p=0.14 Total cells x10 6 25 0.6 0.5 0.4 p=0.25 0.3 0.2 0.1 0.0 EM ) - D 44 C - L D 62 C D 62 Grb2fl/fl mb1cre+/+ Grb2fl/fl mb1crecre/+ Total cells (x106) * 1 0.5 *** D 44 C M) C D 62 L C - C D 62 D 44 L - + C (T + + C C D 62 L + L C D 62 C D 44 - D 44 C C D 44 + C C (n ai ve ) EM ) (T - D 62 - D 44 L D 62 D 44 + C L C + (T C D 62 L M) ai ve ) + L EM ) - 0.0 D 62 - C D 44 C + C L D 62 C + L + C L D 62 C *** 9 Grb2fl/fl mb1cre+/+ 5 fl/fl mb1crecre/+* Grb2 * (n CD44 (T D 44 C M) (T C LN CD4 CD44 CD62L GZZ C C D 44 - D 44 C - D 62 L C + L D 62 C D 62 23.5% ±8.9 * 90 80 70 60 50 40 30 20 10 0 + + D 44 L D 62 C (n ai ve ) EM ) (T D 44 - + D 44 - LN CD4 CD44 CD62L % of CD4 L + C C (T (n ai ve ) C M) - - 0 - 7.8% ±4.3 (T + D 44 C - L D 62 D 62 C D 62 C 50 C 22.4% ±14.2 EM ) - L D 62 C + C L + C + D 44 - D 44 C L D 44 M) (T C (n ai ve ) EM ) (T - L D 62 C + D 44 C LN F3 CD4 total cells ** 0.7 p=0.13 30.7% ±18.7 46.4%±14.2 EM ) - L D 62 C ** 1 - L D 62 C - D 44 C D 62 + C D 44 C p=0.23 % of CD4+ + C + Grb2fl/fl mb1cre+/+ Grb2fl/fl mb1crecre/+ 2 0.8 75 23.3% ±13.7 (T D 44 C M) - C C D 62 D 62 L L + C + C C - L D 62 C D 44 - D 44 + D 44 (T (n ai ve ) EM ) (T D 44 C - L D 62 M) C (T + L + L LN F3 CD4 percent of parent D % of CD4+ 12% ±6.9 *** 0 D 44 5% ±4.8 C 20 10 8% ±5.5 Grb2fl/fl Lckcretg 13.6% ±11.1 + 30 D 62 6.7% ±4.1 Grb2fl/fl 69.5%±14.9 C M) - % of CD4 40 - 38.1%±20.7 12.9% ±6.7 25.8% ±19.1 4 0 Grb2fl/fl CD4cretg T(CM) SP CD4 CD44 CD62L GZZ Grb2fl/fl mb1cre+/+ fl/fl Grb2 mb1crecre/+ 3 *** 50 C 54.6%±19.5 D 44 C L D 62 60 D 44 naive Grb2fl/fl *** 70 46% ±9.5 10.52% ±4.6 + C + L D 62 C 18.5% ±10.4 (n ai ve ) 25.4% ±10 (T (n ai ve ) - D 44 25.1%±9 C 15.5% ±13.3 C C CD4+ 0.0 SP CD4 CD44 CD62L % of CD4 Grb2fl/fl Lckcretg Grb2fl/fl 52.3%±14.3 34.8% ±6.6 15.2% ±6.9 T(EM) (T 19% ±5.4 13.6% ±7.1 CD44 Lymph Node *** 40 10 6.8% ±4.7 CD62L SP F3 CD4 total cells *** 10.0 60 12.3% ±8..8 + CD62L Spleen 60.4%±9.4 Grb2fl/fl CD4cretg Total cells x106 naive Grb2fl/fl % of CD4+ ACD4+ p=0.26 p=0.3 Abb. 33: Der Verlust von Grb2 verschiebt das Verhältnis von naiven zu aktivierten CD4+ T-Zellen in Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen. Insgesamt weisen beide T-Zell spezifischen Grb2 defizienten Mäuse eine Reduktion der naiven CD4+ T-Zellen auf. Die Deletion von Grb2 ab dem doppelt negativen 3 Stadium (Lckcre) führt zu reduzierten Zahl an CD4+ Gedächtnis T-Zellen, wohingegen eine Deletion ab dem CD4+CD8+ Stadium (CD4cre) die Gedächtnis T-Zellzahlen in naiven Mäusen nicht beeinflusst. CD4+ periphere T-Zellen wurden durchflusszytometrisch auf die Expression von CD62L und CD44 untersucht. CD4+ Milzzellen (A), CD4+ Knochenmarkszellen (B) wurden in CD62L+CD44- (naive Zellen), CD62L+CD44+ zentrale Memoryzellen (TCM), CD62L-CD44+ T-Effektor-Memoryzellen (TEM) und CD62L-CD44- Zellen aufgeteilt. Bei den Grb2fl/fl CD4cretg Mäusen wurden nur die inguinalen (Leisten) Lymphknoten untersucht, bei den Grb2 fl/fl Lckcretg Mäusen wurden alle auffindbaren Lymphknoten verwendet. Gesamtzellzahlen und Anteil an den CD4+ T-Zellen für A und C. Für B) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Grb2fl/fl Lckcrewt n=10 Mäuse; Grb2fl/fl CD4Lcktg n=10 Mäuse; Für D) Grb2fl/fl CD4crewt n=10 Mäuse; Grb2fl/fl CD4cretg n=5 Mäuse; Grb2fl/fl Lckcrewt n=10 Mäuse; Grb2fl/fl Lcktg n=10 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Der Großteil der Daten für die Grb2fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. 88 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Total cells x106 * * 2 20 - D 44 - C L D 62 C * + - D 44 L - C D 62 D 62 L C C 0.2 EM ) - + C D 44 L D 62 - C C C D 62 D 62 L C L + L D 62 C 1.3 * * Grb2fl/fl*** mb1cre+/+ 1.0 fl/fl mb1crecre/+ Grb2 0.7 0.50 Grb2fl/fl mb1cre+/+ Grb2fl/fl mb1crecre/+ * 0.25 ** ** 0.00 EM ) - C D 62 D 44 L - + C (T D 44 C M) + D 62 L C C D 62 C L D 62 C L + C + C D 44 C D 44 - L D 62 - + D 44 C p=0.54 (T (n ai ve ) EM ) - (T D 62 C D 44 C L D 62 + C D 44 C L M) + (T C (n ai ve ) + L D 62 - C D 44 C (T D 44 C M) + + C LN CD8 CD44 CD62L GZZ C - C L D 62 D 44 D 44 - + D 44 D 62 C + C L D 62 90 80 70 60 50 40 30 20 10 0 (T (n ai ve ) EM ) (T D 44 - L + D 44 D 44 C (T (n ai ve ) C M) - - 0.0 + CD44 (T D 44 C (T + + C D 62 0.3 0.1 Total cells (x106) 4.7% ±5.4 0.4 0 LN CD8 CD44 CD62L % of CD8 7.7% ±4.7 * 0.5 - 5.3% ±9.2 3.5% ±1.7 0.6 10 C 39,5% ±15.71 C * - 48.1%±15.3 EM ) - 30 C 21.95% ±12.04 Total cells x10 40 % of CD8+ 69.2%±14 C Grb2fl/fl Lckcretg Grb2fl/fl L + L D 62 C 6 50 L T(EM) 11.9% ±6.7 31.7% ±28 D 44 - D 44 C C D 44 C 0.7 p=0.7 60 D 62 27.7% ±25.9 (n ai ve ) EM ) (T - L D 62 - + C 70 20 5.3% ±3.1 LN F3 CD8 total cells 0.8 80 12.5% ±8.5 C M) - D 62 C D 44 L D 62 + C D 44 C D % of CD8+ 43.9%±23.1 L C M) + (T (n ai ve ) + L D 62 - C D 44 T(CM) 10.2% ±5.7 p=0.33 p=0.06 0.25 0.00 LN F3 CD8 percent of parent C 56.9%±22.8 Grb2fl/fl CD4cretg + C L D 62 1 0.50 0 C CD62L Lymph Node naive Grb2fl/fl (T D 44 C M) (T Grb2fl/fl mb1cre+/+ Grb2fl/fl mb1crecre/+ 10 CD44 C CD8+ EM ) - ** C 3 C 30 + C D 62 D 62 L L + C + C D 44 SP CD8 CD44 CD62L GZZ Grb2fl/fl**mb1cre+/+ 2 fl/fl mb1crecre/+ Grb2 Total cells (x106) 40 D 44 - + D 44 - ** 50 17.7% ±5.9 4.7% ±4.5 L D 62 70 % of CD8+ 4.6% ±5.1 C D 62 C 80 60 8.4% ±4.9 3 (n ai ve ) EM ) - L C (T D 44 C M) (T C D 62 L L + C + C D 44 *** C 38.1% ±4.6 D 62 39.6%±12.3 20.7% ±9.2 C 66.4%±12.68 4 0 SP CD8 CD44 CD62L % of CD8 Grb2fl/fl Lckcretg Grb2fl/fl 5 1 + T(EM) *** 6 - 15.4% ±8.7 10.7% ±7.8 7 *** D 44 5.5% ±3.5 7% ±6.8 23.6% ±7.9 90 80 70 60 50 40 30 20 10 0 % of CD8+ 50.4%±15.1 15.3% ±7.9 Spleen CD62L T(CM) SP F3 CD8 total cells SP F3 CD8 percent of parent B iv e) 71.7%±9 Grb2fl/fl CD4cretg - naive Grb2fl/fl (n a ACD8+ p=0.06 Abb. 34: Der Verlust von Grb2 verschiebt das Verhältnis von naiven zu aktivierten CD8+ T-Zellen in Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen. Insgesamt weisen beide T-Zell spezifischen Grb2 defizienten Mäuse eine Reduktion der naiven CD8+ T-Zellen auf. Die Deletion von Grb2 ab dem doppelt negativen 3 Stadium (Lckcre) führt zu Beeinträchtigungen bei den CD8+ Gedächtnis T-Zellen, wohingegen eine Deletion ab dem CD4+CD8+ Stadium (CD4cre) die CD8+ Gedächtnis T-Zellzahlen in naiven Mäusen nicht beeinflusst. CD8+ periphere TZellen wurden durchflusszytometrisch auf die Expression von CD62L und CD44 untersucht. CD8+ Milzzellen (A), CD8+ Knochenmarkszellen (B) wurden in CD62L+CD44- (naive Zellen), CD62L+CD44+ zentrale Memoryzellen (TCM), CD62L-CD44+ T-Effektor-Memoryzellen (TEM) und CD62L-CD44- Zellen aufgeteilt. Bei den Grb2fl/fl CD4cretg Mäusen wurden nur die inguinalen (Leisten) Lymphknoten untersucht, bei den Grb2 fl/fl Lckcretg Mäusen wurden alle auffindbaren Lymphknoten verwendet. B) und D) Gesamtzellzahlen und Anteil an den CD8+ T-Zellen für A und C. Für B) Grb2fl/fl CD4crewt n=13 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Grb2fl/fl Lckcrewt n=10 Mäuse; Grb2fl/fl CD4Lcktg n=10 Mäuse; Für D) Grb2fl/fl CD4crewt n=10 Mäuse; Grb2fl/fl CD4cretg n=5 Mäuse; Grb2fl/fl Lckcrewt n=10 Mäuse; Grb2fl/fl Lcktg n=10 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Der Großteil der Daten für die Grb2fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. 89 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Kein großer Einfluss von Grb2 auf die Ca2+ Signalleitung im Thymus nach TZRStimulation Grb2 ist ein wichtiger positiver Faktor für die Signalleitung über den TZR (Jang et al. 2010). Dies 6.2.5 sollte im Bezug auf das Calciumsignal für Thymozyten aus Grb2fl/fl Lckcretg Mäusen mittels Durchflusszytometrie überprüft werden. Während Grb2 in CD4+, CD8+ und den CD4-CD8Kontroll-T-Zellen unabhängig von der Stimulationsstärke über den TZR keine Auswirkung auf das Calciumsignal hatte (Abb. 35) war das Signal in CD4+CD8+ T-Zellen von Grb2fl/fl Lckcretg Mäusen leicht erhöht. Insgesamt hat Grb2 keinen größeren Einfluss auf das Calciumsignal in TZellen. 90 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A Thymus 60000 50000 40000 30000 Ca2+ 20000 200 300 400 500 50000 40000 30000 Ca2+ 20000 0 100 200 time(s) 100000 Ca2+ stimulation stimulation 90000 80000 70000 60000 50000 40000 30000 Ca2+ 20000 0 100 200 300 400 500 70000 60000 50000 40000 30000 Ca2+ 20000 300 Ca stimulation 100000 400 500 70000 60000 50000 40000 30000 Ca2+ 20000 0 100 80000 70000 60000 50000 40000 30000 Ca2+ 20000 200 300 time(s) 30000 Ca2+ 20000 0 100 200 300 400 500 fl/fl Grb2 90000 fl/fl tg Grb2 80000 Lckcre 70000 60000 50000 40000 30000 Ca2+ 20000 100 200 300 400 500 Ca stimulation 100000 400 500 70000 60000 50000 40000 30000 Ca2+ 20000 0 100 Grb2 90000 fl/fl tg Grb2 80000 Lckcre 70000 60000 50000 40000 30000 Ca2+ 20000 200 300 time(s) 300 400 500 Ca2+ stimulation fl/fl Grb2 90000 fl/fl tg Grb2 80000 Lckcre 70000 60000 50000 40000 30000 Ca2+ 20000 0 100 200 300 400 500 Ca stimulation 100000 400 500 stimulation stimulation stimulation 200000 fl/fl Grb2 180000 fl/fl tg 160000 Lckcre Grb2 140000 120000 100000 80000 60000 40000 20000 0 100 200 stimulation Grb2 90000 fl/fl tg Grb2 80000 Lckcre 70000 60000 50000 40000 30000 Ca2+ 20000 100 200 300 400 500 stimulation stimulation 200000 fl/fl Grb2 180000 fl/fl tg 160000 Lckcre Grb2 140000 120000 100000 80000 60000 40000 20000 0 100 200 time(s) Ca2+ Grb2fl/fl Grb2fl/fl Lck Ca2+ 300 400 500 Ca2+ Grb2fl/fl Grb2fl/fl Lck Ca2+ 300 400 500 Ca 2+ Grb2fl/fl Grb2fl/fl Lck Ca2+ 300 400 time(s) Abb. 35: Das Calciumsignal in CD4+CD8+ T-Zellen wird durch Grb2 inhibiert, während es in CD4+ bzw. CD8+ einzel positiven Zellen nicht beeinflusst ist. Es wurden 2x107 mit Indo-1 beladene Thymuszellen, die extrazellulär auf CD4 und CD8 gefärbt waren auf die Ca2+ Mobilisierung nach T-Zell Rezeptor Stimulation untersucht. Im extrazellulären Färbeschritt wurden die Zellen gleichzeitig mit einem anti-TCRβ Antikörper (H57) auf Eis inkubiert, der später mit verschiedenen Mengen anti-Hamster IgG (H-1643) in vorgewärmten Zellen (1 min in 37 °C Wasserbad) kreuzvernetzt wurde, um die Zellen zu stimulieren. Grb2fl/fl Lckcrewt n=4 Mäuse; Grb2fl/fl Lckcretg n=4 Mäuse. 91 T-Zell spezifische Grb2 Knockoutmaus 500 time(s) 2+ fl/fl 0 400 time(s) stimulation 100000 Ca2+ 300 stimulation 200000 fl/fl Grb2 180000 fl/fl tg 160000 Lckcre Grb2 140000 120000 100000 80000 60000 40000 20000 0 100 200 time(s) stimulation 100 200 Grb2fl/fl Grb2fl/fl Lck time(s) fl/fl Grb2 90000 fl/fl tg Grb2 80000 Lckcre 2+ fl/fl 0 500 Ca2+ stimulation time(s) stimulation 0 400 Ca2+ stimulation Ca2+ stimulation 100000 300 stimulation 100000 time(s) 90000 100 200 2+ stimulation 0 40000 stimulation 200000 fl/fl Grb2 180000 fl/fl tg 160000 Lckcre Grb2 140000 120000 100000 80000 60000 40000 20000 0 100 200 time(s) fl/fl Grb2 90000 fl/fl tg Grb2 80000 Lckcre time(s) CD4-CD8Ca2+ (bound/ unbound Indo-1) 200 Ca2+ (bound/ unbound Indo-1) 80000 Ca2+ (bound/ unbound Indo-1) Ca2+ (bound/ unbound Indo-1) 90000 100 50000 time(s) stimulation 0 60000 Ca2+ stimulation Ca2+ stimulation 100000 500 stimulation 100000 time(s) CD4+CD8+ 400 70000 time(s) Ca2+ (bound/ unbound Indo-1) Ca2+ (bound/ unbound Indo-1) CD8+ 300 Ca2+ (bound/ unbound Indo-1) 100 60000 Ca2+ (bound/ unbound Indo-1) 0 70000 fl/fl Grb2 90000 fl/fl tg Grb2 80000 Lckcre Ca2+ (bound/ unbound Indo-1) 70000 fl/fl Grb2 90000 fl/fl tg Grb2 80000 Lckcre stimulation Ca2+ (bound/ unbound Indo-1) 80000 Ca2+ stimulation 100000 0.1 µg Ionomycin Ca2+ (bound/ unbound Indo-1) 90000 Ca2+ stimulation stimulation 100000 Ca2+ (bound/ unbound Indo-1) Ca2+ stimulation stimulation 20 µl Ca2+ (bound/ unbound Indo-1) 10 µl Ca2+ (bound/ unbound Indo-1) Ca2+ (bound/ unbound Indo-1) 100000 4 µl Ca2+ (bound/ unbound Indo-1) Amount of ab to crosslink TCR-β CD4+ Loading control Intensity of stimulation 500 Ergebnisse Erhöhte Zahl von γδ T-Zellen in Teilen der Peripherie und Tendenz zu einer Erhöhung im Thymus von T-Zell spezifischen Grb2 defizienten Mäusen Neben den αβ T-Zellen, die CD4+CD8+ doppelt positiv oder CD4+ bzw. CD8+ einzel positiv sind 6.2.6 gibt es auch γδ T-Zellen, die CD3+ aber CD4-CD8- doppelt negativ sind und ein verändertes TZell Rezeptor Repertoir aufweisen (Vantourout & Hayday 2013). Diese Population ist entgegen den αβ T-Zellen, die im Thymus und in der Peripherie von Grb2fl/fl Lckcretg Mäusen reduziert sind in der Milz erhöht. Im Thymus und in anderen peripheren Organen sind die γδ T-Zellen auch tendenziell erhöht (Abb. 36). Damit beeinflusst Grb2 entweder die Linienentscheidung zwischen γδ T-Zellen und αβ T-Zellen oder es beeinflusst die Homöostase der γδ T-Zellen evtl. bedingt durch das weniger gefüllte αβ T-Zell Kompartment. 92 T-Zell spezifische Grb2 Knockoutmaus Thymus TCR β TCR TCR γδ+ 2 1.0 0.5 p=0.06 0.0 Spleen 30 12 3 2 * 1 LN gamma delta T cells total cells (x106) TCR β Lymph node 4.2 Grb2fl/fl Lckcretg Grb2fl/fl TCR β+ TCR γδ+ TC R CD3+ T TCR γδ C Lymph node ce lls 0 T TCR γδ+ * 2.2 0.2 0.15 Lung lung gamma delta T cells ce lls TCR γδ+ TC R T Lung TCR β TCR 2.15 Grb2fl/fl Lckcretg Grb2fl/fl β+ total cells (x106) CD3+ Grb2fl/fl Grb2fl/flL 0.00 TCR γδ D Grb2fl/fl Grb2fl/flL ce lls Spleen TCR β TCR β+ * 21 ce lls Grb2fl/fl Lckcretg Grb2fl/fl T CD3+ TC R T spleen gamma delta T cells total cells (x106) B Grb2fl/fl Grb2fl/flL 7 ce lls TCR γδ * 12 Grb2fl/fl Lckcretg Grb2fl/fl β+ T CD3+ total cells (x106) A Thymus thymus gamma delta T cells ce lls Ergebnisse * Grb2fl/fl Grb2fl/flL 1.15 0.15 0.10 0.05 TC R T ce lls T ce lls 0.00 TCR γδ Abb. 36: Die Zahl der γδ T-Zellen in der Peripherie und tendenziell im Thymus ist in T-Zell spezifischen Grb2 defizienten Tieren erhöht. Die Zellen wurden auf die Expression von CD3, TCR β und TCR γδ gefärbt und durchflusszytometrisch analysiert. Die Gesamtzellzahlen der CD3+TCR β+ und der CD3+TCRγδ+ Zellen wurden berechnet. Grb2fl/fl Lckcrewt n=3 Mäuse; Grb2fl/fl Lckcretg n=3 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05. 93 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse 6.2.7 Inhibitorischer Einfluss von Grb2 auf die TH17 Differenzierung in vitro, so wie veränderte Treg und unveränderte TH1 und TH2 Differenzierung Sowohl Grb2fl/fl Lckcretg Mäuse als auch Grb2fl/fl CD4cretg Mäuse weisen eine reduzierte Zahl an naiven CD4+ und CD8+ T-Zellen in der Peripherie auf (Abb. 33; Abb. 34). Außerdem sind von den vorhandenen CD4+ und CD8+ T-Zellen prozentual mehr Zellen aktiviert (CD69+) als in Kontrolltieren (Abb. 32). Diese beiden Punkte könnten auf eine veränderte Aktivierbarkeit bzw. ein verändertes Differenzierungspotential von Grb2-/- T-Zellen hindeuten. Darum wurde das Differenzierungspotential von naiven CD4+ Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Zellen in vitro untersucht. Das Potential von CD4+ Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Zellen zu TH1-Zellen zu differenzieren ist nicht verändert (Abb. 37A), während die naiven CD4+ Grb2fl/fl Lckcretg Zellen vermehrt zu TH2 und TH17 Zellen differenzieren. Die Differenzierung zu T-reg Zellen war hingegen stark beeinträchtigt (Abb. 37B, C, D). Naive CD4+ Grb2fl/fl CD4cretg Zellen zeigen ein erhöhtes Potential sich in TH17 Zellen zu differenzieren, während die Differenzierung zu T H2 und T-reg Zellen dem der Kontrollzellen entsprach (Abb. 37B, C, D). Grb2 inhibiert das Differenzierungspotential von naiven CD4+ Zellen sich in TH17 Zellen zu differenzieren. Die Differenzierung zu TH1-Zellen wird nicht von Grb2 beeinflusst. Die Differenzierung zu TH2 und T-reg Zellen scheint schon früh in der T-Zell Entwicklung beeinflusst zu werden. Grb2 beeinflusst dabei die Differenzierung zu TH2 Zellen negativ und die zu T-reg Zellen positiv oder die Unterschiede im genetischen Hintergrund der Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäuse haben einen Einfluss auf das Differenzierungspotential der naiven CD4+ Zellen (9.12.9). 94 T-Zell spezifische Grb2 Knockoutmaus control stainings 90 60 30 0 T H1 T H17 T H2 T-reg control stainings 20 10 0 T H2 T H17 T H1 T-reg 0 T H1 T H17 T H2 T-reg Grb2fl/fl Grb2fl/fl Lck TH2 FSC-2 CD4+ 30 20 control stainings * 10 0 T H2 T H17 T H1 T-reg IFNγ % of living cells IL17 CD4+ 20 control stainings * 10 * 0 T H17 T H1 T H2 T-reg Grb2fl/fl Grb2fl/fl Lck TH17 CD4+ 20 IL17 control stainings * 10 0 T H17 T H1 T H2 T-reg FoxP3 FoxP3 20 CD4+ Grb2fl/fl Grb2fl/fl CD4cretg T-reg % of living cells T-reg 40 Grb2fl/fl Grb2fl/fl CD4cretg TH17 D control stainings CD4+ CD4+ CD4+ IL17 60 Grb2fl/fl Grb2fl/fl CD4cre/+ % of living cells % of living cells CD4+ FSC-2 IFNγ TH17 CD4+ 80 CD4+ TH2 Alternativauswertung C % of living cells IL17 CD4+ Grb2fl/fl Grb2fl/fl Lck TH1 IL4 TH2 IL4 % of living cells B Grb2fl/fl Lckcretg Grb2fl/fl Grb2fl/fl CD4cretg TH1 CD4+ CD4+ Grb2fl/fl % of living cells TH1 Grb2fl/fl CD4cretg Grb2fl/fl CD4+ CD25 FSC-2 control stainings 70 35 0 T-reg T H17 Grb2fl/fl Grb2fl/fl Lck T-reg T H1 T H2 % of living cells CD4+ IFNγ A IFNγ Ergebnisse 80 CD4+ *** control stainings 40 * 0 T-reg TH17 TH1 TH2 95 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 37: Naive CD4+ Zellen von T-Zell spezifischen Grb2 defizienten Mäusen zeigen in vitro ein verringertes Potential sich zu TH17 und TH2 Zellen zu differenzieren aber das Potential sich zu T-reg-Zellen zu differenzieren ist erhöht. Aus Milzzellen von Grb2fl/fl CD4cretg bzw. Milz und Lymphknotenzellen von Grb2fl/fl Lcktg Mäusen und den entsprechenden Kontrollen wurden CD4+ Zellen durch negative Selektion anderer Populationen aufgereinigt, die CD4+ Zellen wurden dann positiv für CD62L+ Zellen selektiert. Für die Aufreinigung wurden magnetisierbare Partikel gekoppelt an Antikörper verwendet, die gebundene Zellen in einem Magnetfeld zurückhalten können. Die CD4+CD62L+ Zellen wurden mit unterschiedlichen Zytokinen behandelt, um das Differenzierungspotential zu TH1, TH2, TH17 und T-reg Zellen zu untersuchen (Tab. 14). Die Differenzierung zu TH1, TH17 und T-reg Zellen wurde nach 72 h untersucht, während die TH2-Zellen vor der Analyse für weitere 48 h mit 50 U/ml IL-2 inkubiert wurden. Für die letzten 4-6 h wurden die Zellen mit 1µg/ml Ionomycin, 20 ng/ml PMA und 1µg/ml Brefeldin A (Golgiplug BD) behandelt. Anschließend folgten intra- und extrazelluläre Färbungen für A) und C) CD4, IFNγ, IL17, B) CD4 und IL4, D) CD4 und FoxP3. Grb2fl/fl CD4crewt n=6 Mäuse; Grb2fl/fl CD4cretg n=5 Mäuse; Grb2fl/fl Lckcrewt n=5 Mäuse; Grb2fl/fl Lcktg n=5 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Der Großteil der Daten für die Grb2fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. 6.2.8 Ex vivo Analysen von CD4-Effektorzellen zeigen einen Einfluss von Grb2 abhängig vom Deletionszeitpunkt durch die Cre Rekombinase Nachdem ein verändertes Differenzierungspotential naiver CD4+ T-Zellen in vitro gemessen wurde (Abb. 37) wurden die T-Helfer Populationen von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen ex vivo untersucht. In den Grb2fl/fl Lckcretg Mäusen war die Zahl der TH1, TH2 und TH17 Zellen tendenziell erhöht (Abb. 38A-D). In den Grb2fl/fl CD4cretg Mäusen war nur die Zahl der TH1 Zellen erhöht, während die Zahlen der TH2, TH17 und T-reg Zellen unverändert waren (Abb. 38A-D). Die Zahl der aktivierten CD4+ (CD25+) und der T-reg Zellen war in Grb2fl/fl Lckcretg Mäusen signifikant erhöht, während diese Populationen in Grb2fl/fl CD4cretg Mäusen unverändert waren (Abb. 38E). In T-Zell spezifischen Grb2 defizienten Mäusen ist die Zahl der TH1 Zellen ex vivo erhöht. Aufgrund der geringen Mauszahlen für die TH2 und TH17-Zellen aus Grb2fl/fl Lckcretg Mäusen lassen sich keine konkreten Aussagen über die Auswirkung einer frühen Deletion von Grb2 auf diese Zellen treffen. In Grb2fl/fl CD4cretg Mäusen, die Grb2 in den CD4+CD8+ T-Zellen deletieren war der Anteil der TH2, TH17 und T-reg Zellen ex vivo nicht verändert. 96 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A CD4+ Grb2fl/fl CD4cretg Grb2fl/fl IFNγ TH1 / TH17 Grb2fl/fl Lckcretg IFNγ TH1 CD4+ Grb2fl/fl TH17 IL17 B IL17 CD4+ CD4+ IL4 CD4+ T-reg CD4+ % of CD4+ ex vivo CD4+ 8 % of parent Grb2fl/fl 7 Grb2fl/fl CD4cre/+ 6 0.5 re g H2 7 p=0.09 Fo xP 3 D 25 D 25 + C C D 25 + 0 + 5 + 10 0 C T- T T 15 10 D 25 Grb2fl/fl Grb2fl/fl CD4cre/+ Grb2fl/fl Grb2fl/fl CD4cre/+ 3 97 2 T-Zell spezifische Grb2 Knockoutmaus 1 + Fo xP 3 + D 25 C D 25 + C + H1 H1 T * Lymph node Grb2fl/fl CD4cre/+ 20 + % of parent Grb2fl/fl Grb2fl/fl CD4cre/+ 4 + Fo xP 3 D 25 C CD4+ *** Grb2fl/fl CD4+ 0 + 0.0 25 20 D 25 C total cells (x106) 1.0 Spleen ** 30 + + C D 25 Fo xP 3 + + + D 25 C 1.5 D 25 CD4+ + T- T 5 5 C 50 Grb2fl/fl 40 cre/+ Grb2fl/fl CD4 10 Fo xP 3 D 25 C CD4+ 2.0 2 Lck Sonja SP % CD4 CD25 FoxP3 cells Lck Sonja LN % CD4 CD25 FoxP3 cells Lymph node Grb2fl/fl Grb2fl/fl CD4cre/+ LN total CD4 CD25 FoxP3 cells 2.5 3 C % of parent CD4+ SP total CD4 CD25 FoxP3 cells 3.0 4 Fo xP 3 re g H2 7 H1 T T 15 0 3.5 5 0 LN % CD4 CD25 FoxP3 cells Spleen + % of parent CD4+ 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 Grb2fl/fl Grb2fl/fl CD 1 H1 % of parent 9 8 7 6 5 4 3 2 1 0 FoxP3 CD4+ ** SP % CD4 CD25 FoxP3 cells total cells (x106) Lck Sonja % of CD4+ ex vivo FoxP3 D E Side-Scatter FL-4 C CD25 Side-Scatter % of parent TH2 IL4 TH2 Ergebnisse Abb. 38: In naiven T-Zell spezifisch Grb2 defizienten Mäusen (Grb2fl/fl Lcktg und Grb2fl/fl CD4cretg) ist der Anteil der TH1-Zellen an den CD4+ T-Zellen erhöht. Wird Grb2 ab dem Übergang vom doppelt negativen 2 zum doppelt negativen 3 Stadium deletiert (Lckcre) ist auch der Anteil der TH2, TH17 und T-reg Zellen an den CD4+ T-Zellen tendenziell erhöht. Aus Milz und Lymphknotenzellen von Grb2 fl/fl Lcktg Mäusen und den entsprechenden Kontrollen wurden CD4+ Zellen durch negative Selektion anderer Populationen aufgereinigt. Für die Aufreinigung wurden magnetisierbare Partikel gekoppelt an Antikörper verwendet, die gebundene Zellen in einem Magnetfeld zurückhalten können. Milzzellen von Grb2fl/fl CD4cretg Mäusen und entsprechende Kontrollen wurden ex vivo ohne weitere Aufreinigung in Einzelzellsuspension gebracht. Die Zellen wurden für 4-6 h mit 1µg/ml Ionomycin, 20 ng/ml PMA und 1µg/ml Brefeldin A (Golgiplug BD) behandelt. Anschließend folgten intra- und extrazelluläre Färbungen für A) CD4, IFNγ, IL17, B) CD4 und IL4, C) CD4 und FoxP3. D) Quantifizierung des Anteils der TH1, TH17, TH2 und Treg Zellen an den CD4+ Zellen. E) Quantifizierung des Anteils der CD25+ aktivierten CD4+ Zellen und der CD25+FoxP3+ regulatorischen T-Zellen an den CD4+ Zellen. Für A) bis D) Grb2fl/fl CD4crewt n=10 Mäuse; Grb2fl/fl CD4cretg n=5 Mäuse; Grb2fl/fl Lckcrewt n=2 Mäuse; Grb2fl/fl Lcktg n=3 Mäuse; Für E) Grb2fl/fl CD4crewt n=3 Mäuse; Grb2fl/fl CD4cretg n=3 Mäuse; Grb2fl/fl Lckcrewt n=8 Mäuse; Grb2fl/fl Lcktg n=8 Mäuse; Für die Statistik wurde der TTest verwendet; *p<0,05; **p<0,01; ***p<0,001. Der Großteil der Daten für die Grb2 fl/fl Lckcretg Maus stammt aus Experimenten von Sonja Lacher. 6.2.9 T-Zell spezifische Grb2 defiziente Mäuse entwickeln eine schwächere experimentelle autoimmune Enzephalomyelitis, die ein Mausmodell für multiple Sklerose im Menschen ist Aufgrund der veränderten Zusammensetzung von T-Helferzellen und des veränderten Differenzierungspotentiales naiver CD4+ T-Zellen wurde die Rolle von Grb2 in einem experimentellen autoimmunen Enzephalomyelitis (EAE) Modell mit Grb2fl/fl CD4cretg Mäusen untersucht. EAE ist ein Modell für Multiple Sklerose im Menschen. Die Grb2fl/fl CD4cretg Mäuse wurden aufgrund ihres reinen C57BL/6 Hintergrundes ausgewählt. Die Grb2fl/fl Lckcretg Mäuse haben einen gemischten Hintergrund, der für die klassische EAE nicht geeignet ist. Die Grb2fl/fl CD4cretg Mäuse waren ab Tag 8 nach der Induktion der Krankheit tendentiell weniger krank. Zum Höhepunkt der Krankheit (Tag 14-18) waren die Grb2fl/fl CD4cretg Mäuse jedoch signifikant gesünder. An den späteren Tagen glich sich der Krankheitsverlauf wieder an. Die Grb2fl/fl CD4cretg blieben aber tendeziell gesünder (Abb. 39). Grb2 ist ein Faktor, der zu einem stärkeren EAE Krankheitsverlauf beiträgt. 98 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A B EAE mean clinical Score Experimental autoimmune encephalomyelitis (EAE) EAE Score 5 ** 4 EAE clicical score *** † † * 3 ** 2 0 = No clinical Signs 1 = Paralysed tail 2 = Loss in coordinated movement; hind limb paresis 3 = Both hind limbs paralysed 4 = Hind limbs and forelimbs paralysed 5 = Death 1 0 0 7 14 21 28 time(d) fl/fl Abb. 39: T-Zell spezifische Grb2 defiziente Mäuse entwickeln eine schwächere experimentelle autoimmune Grb2 Enzephalomyelitis Grb2fl/flCD4cretg Grb2fl/fl CD4cretg Mäuse wurden subkutan am Rücken mit 50 µg Myelin Oligodendrozyten Glykoprotein (MOG) 35-55 immunisiert und an Tag 0 und 2 wurden 200 µl Pertussistoxin i.p. verabreicht, um die experimentellen autoimmunen Enzephalomyelitis (EAE) zu induzieren. Der Krankheitsverlauf wurde über ein klinisches Bewertungssystem bewertet: 0 = keine klinischen Zeichen, 1 = paralysierter Schwanz, 2 = Defizite in der koordinierten Fortbewegung, Paraparese, 3 = Beide Hinterbeine paralysiert, Paraplegie, 4 = Paraplegie mit Beeinträchtigung der Vorderbeine, 5 = sterbende / tote Tiere. Grb2fl/fl CD4crewt Tag 1-14 n=11 Mäuse; Tag 15-28 n=4 Mäuse; Grb2fl/fl CD4cretg Tag 1-14 n=12 Mäuse; Tag 15-28 n=4 Mäuse; Tiere, die aus dem Versuch genommen werden mussten sind mit einem Kreuz markiert; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Die EAE Versuche wurden in Kooperation mit Elisabeth Zinser (AG Steinkasserer) durchgeführt. 6.2.9.1 Die niedrigeren T-Zellzahlen in naiven T-Zell spezifischen Grb2 defizienten Mäusen gleichen sich im experimentellen autoimmunen Enzephalomyelitis Modell den T-Zellzahlen der Kontrolltiere an. An Tag 30 ist ein negativer Einfluss von Grb2 auf die T-effektor-Gedächtniszellen messbar. Um den Höhepunkt der EAE an Tag 17 und an Tag 30, wenn die Krankheit abklingt (Abb. 39) wurden die T-Zell Populationen der Milz von Grb2fl/fl CD4cretg Mäusen durchflusszytometrisch untersucht. Die Gesamtzellzahl der CD3+, CD3+CD4+, bzw. CD3+CD8+ T-Zellen und der Anteil der aktivierten (CD69+) Zellen dieser Populationen war in Grb2fl/fl CD4cretg Mäusen gegenüber den Kontrollen unverändert (Abb.40A). Die Zahl der naiven CD4+ und CD8+ T-Zellen war an Tag 17 der EAE wie in naiven Mäusen (Abb. 34) reduziert. An Tag 30 hatte sich die Zahl der naiven CD4+ T-Zellen der Zahl in den Kontrolltieren angeglichen (Abb.40B,C). In Grb2fl/fl CD4cretg Mäusen war der Anteil der naiven T-Zellen an den CD4+ und CD8+ T-Zellen an Tag 17 der EAE niedriger und der Anteil der effektor Gedächtniszellen war gegenüber den Kontrolltieren erhöht (Abb.40B,C). Dies spiegelt die Situation in naiven Grb2fl/fl CD4cretg Mäusen wieder (siehe 6.2.4). 99 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse An Tag 30 der EAE war das Verhältnis der naiven CD4+ und CD8+ T-Zellen in Grb2fl/fl CD4cretg Mäusen dagegen wie in den Kontrolltieren (Abb.40B,C). Die Zahl der Gedächtnis T-Zellen war an Tag 17 unverändert. An Tag 30 war die Zahl der CD4+ zentralen und der effektor Gedächtniszellen, sowie die Zahl der CD8+ zentralen Gedächtniszellen unverändert. Die Zahl der CD8+ effektor Gedächtniszellen war allerdings verringert (Abb.40B,C). Die reduzierte Zahl an CD3+, CD3+CD4+, CD3+CD8+ und naiven T-Zellen, die naive Grb2fl/fl CD4cretg Mäuse aufweisen wurde im Verlauf der EAE ausgeglichen. Dies kann mit der Krankheit oder mit dem Alter der Mäuse zusammenhängen, da die T-Zell Populationen in älteren naiven Grb2fl/fl CD4cretg Mäusen noch nicht untersucht wurden. Auch der reduzierte Anteil naiver T-Zellen und der erhöhte Anteil von T-effektor Gedächtniszellen an den CD4+ und CD8+ T-Zellen in naiven Grb2fl/fl CD4cretg Mäusen gleichen sich bis an Tag 30 der EAE an die Situation in den Kontrolltieren an. 100 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A CD3+ EAE d17 Grb2fl/fl CD4cretg 7.5 5.0 D 8+ CD62L CD8+ % of CD4+ Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ 40 30 20 0 EM ) - L D 44 - + C (T D 44 C M) D 62 L C - C D 62 D 44 + C L C C C C D 62 D 62 L D 62 L + C - C D 44 D 44 - + (n a C - L (T iv e) D 44 C M) D 62 C + C L C C D 62 D 62 L D 62 L + C - C D 44 D 44 - + (n a (T iv e) EM ) (T D 44 - + C L D 62 C CD8+ Grb2fl/fl Grb2fl/fl CD4cretg Grb2fl/fl CD4cretg 20 D 62 EM ) L D 44 - + C (T D 44 C M) (T + C + C D 62 C L D 62 C L + C - D 44 - D 44 D 44 - + (n a (T iv e) EM ) - - C L D 62 C D 44 C + L D 62 C D 44 C M) + (n a - D 44 + C C D 62 L L D 62 C (T iv e) EM ) - C D 62 L D 44 - + C (T D 44 C M) C + C L D 62 C L D 62 C D 44 - + (n a D 44 + C - C L D 62 C (T iv e) EM ) (T + D 44 - L D 62 C L D 62 30 0 - - C + + C D 44 - C D 44 C M) (T iv e) (n a D 44 + C 40 10 0.0 0 C 0 Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ - 1 0.5 Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ C 25 1.0 % of CD8 *** + 50 50 L * Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ F3 CD8 % of parent 60 L Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ CD44 * D 62 2 1.5 D 62 *** 4 3 F3 CD8 + total cells CD8 F3 CD8 % of parent 75 C CD44 ** Total cells (x106) F3 +CD8 total cells CD8 % of CD8+ 6 Total cells (x10 ) 5 C CD62L CD62L Grb2fl/fl 50 Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ 10 - D 44 C M) C + C C D 62 D 62 L L L + C - C D 44 D 44 - + (n a + D 44 - D 62 C C (T iv e) EM ) (T D 44 C L D 62 C C C C D 62 D 62 L L + C + C D 44 D 44 - + (n a (T iv e) C M) - 0 60 EM ) 2 70 (T 3 F3 CD4 % of parent CD44 + 4 CD4+ 4.5 fl/fl +/+ Grb2 4.0 CD4 fl/fl cre/+ Grb2 3.5 CD4 3.0 2.5 2.0 1.5 1.0 0.5 0.0 *** - % of CD4+ 6 Total cells (x10 ) 5 55 *** 50Grb2fl/fl CD4+/+ 45Grb2fl/fl CD4cre/+ 40 35 30 25 20 15 10 5 0 Total cells (x106) * 6 1 L Grb2fl/fl CD4cretg F3 CD4 total cells F3 CD4 % of parent CD44 * 7 D 62 0 C D 8+ C C D 3+ C CD62L F3 CD4 total cells CD4+ 8 C 5 CD4+ Grb2fl/fl Grb2fl/fl CD4cretg Grb2fl/fl 10 C 0.0 15 D 4+ 2.5 0 D 3+ 1 D 8+ C D 4+ C D 3+ C 10.0 D 3+ 2 % CD69+ in population 3 12.5 C 4 % CD69+ 20 D 8+ 5 15.0 C 6 0 CD4+ Total cells (x106) 7 D 4+ 10 CD3+ 25 17.5 D 4+ % CD69+ in population Total cells (x106) 20 CD8F1 CD3 gated CD69 % of parent F1 CD3 gated total cells CD3+ % CD69+ C + CD3 8 C CD4 CD8F1 CD3 gated CD69 % of parent F1 CD3 gated total cells CD3+ 30 B EAE d30 Grb2fl/fl CD4cretg CD3+ Grb2fl/fl CD4 Grb2fl/fl 101 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb.40: Grb2fl/fl CD4cretg Mäuse weisen an Tag 17 und Tag 30 nach Induktion einer experimentellen autoimmunen Enzephalomyelitis anders als naive Grb2fl/fl CD4cretg Mäuse keine reduzierten T-Zellzahlen mehr auf. Auch die Zahl naiver T-Zellen, die in naive Grb2fl/fl CD4cretg Mäuse reduziert ist wurde im Verlauf der EAE ausgeglichen. Zudem normalisierte sich das Verhältnis von naiven T-Zellen T-Effektorzellen, das in naiven Grb2fl/fl CD4cretg Mäusen verändert ist.T-Zellen der Milz wurden zu verschiedenen Zeitpunkten der experimentellen autoimmunen Enzephalomyelitis durchflusszytometrisch auf ihre CD4 und CD8 Expression untersucht (A). CD4+ (B) und CD8+ (C) T-Zellen der Milz wurden durchflusszytometrisch auf die Expression von CD62L und CD44 untersucht. Sie wurden in CD62L+CD44- (naive Zellen), CD62L+CD44+ zentrale Memoryzellen (TCM), CD62L-CD44+ T-EffektorMemoryzellen (TEM) und CD62L-CD44- Zellen unterteilt. Für die Quantifizierung sind Gesamtzellzahlen angegeben. Für die CD3+ Zellen ist der Anteil der CD69+ (aktivierten) Zellen angegeben (A). Für die CD62L und CD44 Färbung sind die Anteile der unterschiedenen Populationen an den CD4+ (B) und CD8+ (C) T-Zellen der Milz angegeben. Für Tag 17: Grb2fl/fl CD4crewt n=6 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Für Tag 30: Grb2fl/fl CD4crewt n=9 Mäuse; Grb2fl/fl CD4cretg n=11 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01. 6.2.9.2 Erhöhte Plasmablastenzahl in T-Zell spezifischen Grb2 defizienten Mäusen im experimentellen autoimmunen Enzephalomyelitis Modell T-Helferzellen können über costimulatorische Signale B-Zellen aktivieren, weswegen im Verlauf der EAE auch B-Zellen untersucht wurden. Die Gesamtzahl der B-Zellen und der Plasmazellen war sowohl an Tag 17 als auch an Tag 30 in Grb2fl/fl CD4cretg Mäusen gegenüber den Kontrollen unverändert (Abb. 41A und B). Allerdings war die Zahl der Plasmablasten an Tag 17 der EAE erhöht (Abb. 41A). Die Plasmablasten waren aber weniger aktiviert (Abb. 41A). An Tag 30 war die Zahl der Plasmablasten in den Grb2fl/fl CD4cretg Mäusen und den Kontrolltieren gleich (Abb. 41B). Grb2 in T-Zellen hat einen inhibierenden Einfluss auf die Zahl der Plasmablasten um den Höhepunkt der EAE aber es führt zu einer stärkeren Aktivierung der vorhandenen Plasmablasten. 102 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A EAE d17 Grb2fl/fl CD4cretg B B220 EAE d30 Grb2fl/fl CD4cretg + 8 D 13 + C D 13 - 22 0 B 25 20 15 10 5 + 8 22 0 B B 22 0 - + C D 13 8 + 0 D 13 + B 22 0 - 22 0 B Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ 30 C + 8 D 13 8 22 0 + 8 B 22 0 - 22 0 B Iab expression 35 + C D 13 C D 13 8 + 0 Iab expression (geo mean) F2 Iab geo mean 2 Grb2fl/fl 0CD4+/+ Grb2fl/fl CD4cre/+ 10 22 0 C 22 0 B 4 20 B 8 + 22 0 p=0.09 B 30 10 B 10 6 + 40 + Iab expression (geo mean) + B B 22 0 22 0 - + C D 13 8 + C B D 13 22 0 8 + 0 Iab expression 50 20 Grb2fl/fl CD4+/+ 0 fl/fl CD4cre/+ Grb2 30 C F2 Iab geo mean 5 Total cells 50 + + 8 B B 22 0 22 0 - + C D 13 C D 13 8 + 22 0 B *** total cells (x106) 70 Grb2fl/fl CD4+/+ 0 Grb2fl/fl CD4cre/+ Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ 30 + F2 total cells 10 Total cells % of parent 20 + 75 60 45 30 15 10 30 D 13 F2 total cells % CD69+ 40 Grb2fl/fl CD4+/+ Grb2fl/fl CD4cre/+ C % of parent 40 CD138 F2 CD69 % of parent * + F2 CD69 % of parent % CD69+ 22 0 50 B C138 total cells (x106) Grb2fl/fl B220 Grb2fl/fl Abb. 41: Erhöhte Zahl an Plasmablasten zum Höhepunkt der experimentellen autoimmunen Enzephalomyelitis in T-Zell spezifischen Grb2 defizienten Mäusen. B-Zellen der Milz wurden zu verschiedenen Zeitpunkten der experimentellen autoimmunen Enzephalomyelitis durchflusszytometrisch auf ihre B220 und CD138 Expression untersucht. Sie wurden in B220+ Gesamt-B-Zellen, B220-CD138+ Plasmazellen und B220+CD138+ Plasmablasten unterteilt. Für diese Populationen wurde die Gesamtzellzahl, der Anteil der CD69 + Zellen und die Expression von Iab (MHCII) bestimmt. Für Tag 17: Grb2fl/fl CD4crewt n=6 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Für Tag 30: Grb2fl/fl CD4crewt n=9 Mäuse; Grb2fl/fl CD4cretg n=11 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. 6.2.9.3 Anteilig mehr regulatorische T-Zellen an den CD4+ Grb2-/- T-Zellen und erhöhte Aktivierbarkeit der CD4+ Grb2-/- T-Zellen über PMA und Ionomycin zum Höhepunkt der experimentellen autoimmunen Enzephalomyelitis Die verringerte Zahl an T-Zellen in naiven Grb2fl/fl CD4cretg Mäusen (Abb. 31; Abb. 32) könnte den EAE-Krankheitsverlaufes im Vergleich zu den Kontrolltieren beeinflussen. Um die Effektorzellen von Grb2fl/fl CD4cretg Mäusen vergleichbar zu untersuchen wurden CD4+ T-Zellen aus der Milz an Tag 17 nach Induktion der Krankheit aufgereinigt und in vitro restimuliert. Grb2fl/fl CD4cretg Mäuse zeigten im Vergleich zu den Kontrolltieren sowohl in der unstimulierten, als auch in der spezifisch mit MOG-Peptid stimulierten Probe einen höheren Anteil regulatorischer T-Zellen. Nach einer unspezifischen Stimulation mit PMA und Ionomycin war die Zahl der T-reg Zellen in Grb2fl/fl CD4cretg und Kontrolltieren vergleichbar (Abb. 42A). Der Anteil 103 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse der TH17 bzw. TH1 Zellen an den CD4+ Zellen war in den unstimulierten und den spezifisch mit MOG stimulierten Proben gleich. Nach einer Stimulation mit PMA und Ionomycin war der Anteil der TH17 und TH1 Zellen an den CD4+ Zellen erhöht (Abb. 42B und C). Grb2 hat in T-Zellen aus EAE Tieren in der unstimulierten Situation oder nach einer spezifischen TZR Stimulation einen inhibitorischen Effekt auf die T-reg Zellen, während keine Unterschiede für den Anteil der TH17 und TH1 Zellen messbar waren. Bei einer unspezifischeren Stimulation über PMA und Ionomycin war ein inhibitorischer Effekt von Grb2 auf die TH17 und TH1 Zellen messbar. Grb2 hatte in dieser Situation keinen Effekt auf die T-reg Zellen. Der erhöhte Anteil der T-reg Zellen korreliert mit dem schwächeren Krankheitsverlauf der Grb2fl/fl CD4cretg Mäuse. Milzzellen, die an Tag 30 der EAE spezifisch restimuliert wurden zeigten, dass Grb2 einen fördernden Einfluss auf die Zahl der TH17 Zellen hat (Daten von Dr. Elisabeth Zinser; nicht gezeigt). 104 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse EAE d17 A CD4+ unstim. Mog (20 µM) PMA/Iono Alternativgating mit CD4 int - T-regs - abb CD4+ Grb2fl/fl % Treg of parent CD25 6 Grb2fl/fl CD4cretg ** CD4cre+/+ Grb2 CD4cre+/- Grb2f 5 * 4 3 2 1 B unstim. Mog (20 µM) A /Io no PM og M FoxP3 CD4+CD5+ ) (2 0 µM un st im . 0 PMA/Iono IL17+ - abb Grb2fl/fl CD4+CD5+ % IL17+ of parent IL-17 7.5 Grb2fl/fl CD4cretg CD4cre+/+ Grb2 CD4cre+/- Grb2 5.0 * 2.5 CD4+CD5+ unstim. Mog (20 µM) A /Io no PM og M Forward Scatter PMA/Iono IFNgamma - abb Grb2fl/fl CD4+CD5+ *** % IFN + of parent IFNγ 7 Grb2fl/fl CD4cretg CD4cre+/+ Grb CD4cre+/- Grb2 5 3 1 0.50 0.25 A /Io no PM M og (2 0 µM im Forward Scatter ) . 0.00 un st C ) (2 0 µM un st im . 0.0 105 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 42: Anteilig weniger regulatorische T-Zellen an den CD4+ Grb2-/- T-Zellen und erhöhte Aktivierbarkeit der CD4+ Grb2-/- T-Zellen über PMA und Ionomycin zum Höhepunkt der experimentellen autoimmunen Enzephalomyelitis An Tag 17 der experimentellen autoimmunen Enzephalomyelitis wurden Milzen von Grb2fl/fl CD4cretg Mäusen und den entsprechenden Kontrollen entnommen und es wurden CD4+ Zellen durch negative Selektion anderer Populationen aufgereinigt. Für die Aufreinigung wurden magnetisierbare Partikel gekoppelt an Antikörper verwendet, die gebundene Zellen in einem Magnetfeld zurückhalten können. Milzzellen von Grb2 fl/fl CD4cretg Mäusen und entsprechende Kontrollen wurden mit 20 µM MOG-Peptid, 1µg/ml Ionomycin, 20 ng/ml PMA oder unstimuliert für 24 h inkubiert. Dann wurden alle Zellen für 6 h.mit 1µg/ml Ionomycin, 20 ng/ml PMA behandelt, wobei für die letzten 4 h. 1µg/ml Brefeldin A (Golgiplug BD) zugegeben wurde. Anschließend folgten intra- und extrazelluläre Färbungen für A) CD4, CD25 und FoxP3; Für B) CD4, CD5 und IL17, C) CD4, CD5 und IFNγ. Grb2fl/fl CD4crewt n=6 Mäuse; Grb2fl/fl CD4cretg n=8 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. 6.2.9.4 An Tag 30 der experimentellen autoimmunen Enzephalomyelitis in vitro mit MOG-Peptid reaktivierte Milzzellen aus T-Zell spezifischen Grb2 defizienten Mäusen sekretieren weniger entzündungsfördernde Zytokine An Tag 30 nach EAE Induktion wurden Milzzellen von Grb2fl/fl CD4cretg und Kontrollmäusen ausgesät und mit verschiedenen Konzentrationen MOG-Peptid inkubiert, um MOG-spezifische TZellen zu aktivieren. Die Menge der sekretierten Zytokine im Überstand wurde durchflusszytometrisch bestimmt (Abb. 43A). Mit der Menge an Stimulanz stieg auch die Sekretion der Zytokine. Die Milzzellen aus Grb2fl/fl CD4cretg Tieren produzierten weniger IL17A, IL-2 und TNF als die Kontrollzellen. Die Produzierte Menge an IL-4, IL-8, IL-10 und IFNγ war in Grb2fl/fl CD4cretg Tieren nicht signifikant verändert (Abb. 43B). Entsprechend des schwächeren EAE Verlaufes in Grb2fl/fl CD4cretg Mäusen wurden bei gleicher Zellzahl weniger der Zytokine IL-17A, IL-2 und TNF sekretiert, die zur EAE beitragen. DieZahl der T-Zellen in Grb2fl/fl CD4cretg Tieren glich sich im Verlauf der EAE der Zahl in den Kontrolltieren an (Abb.40). Die gleiche Zahl an CD4+ Grb2-/- T-Zellen sekretieren also weniger Zytokine, welche die EAE fördern. Für Tag 17 nach EAE Induktion gibt es ähnliche Ergebnisse (Daten von Dr. Elisabeth Zinser; nicht gezeigt). 106 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A EAE d30 Beads 78 pg/ml Forward Scatter 1000 IL-2 production 30 IL-17A ** 750 IL2 (pg/ml) IL17A (pg/ml) FL-2 (Cytokines) IL17A production B 1250 pg/ml 625 pg/ml IL-2 IL-4 IL-6 IL-IFNγ TNF IL-17A IL-10 FL-3 (Beads) Side Scatter Cytokine Mix: 0 pg/ml 500 * IL-2 * 20 10 250 20 µM 20 µM 20 µM 2µ M 0, M 02 µ 0, Grb2 Grb2fl/flCD4cretg 30 20 120 fl/fl 100 IL6 (pg/ml) Grb2 Grb2fl/flCD4cretg 80 0, 2µ M 02 µ M IL-6 production 0, µM 0, 00 2 0µ M 20 µM 2µ M 0, 2µ M M 0, 02 µ µM 0µ M 0, 00 2 MOG-peptide IFN Mog-peptide IL-6 Grb2fl/fl Grb2fl/flCD4cretg 60 40 Mog-peptide IL-4 0, 2µ M M 0, 02 µ µM 0, 00 2 20 µM 0 2µ M IL-4 production 0, 2µ M M 0, 02 µ 0, 00 2 µM 0µ M 20 MOG-peptide Grb2fl/fl Grb2fl/flCD4cretg Grb2 Grb2fl/flCD4cretg 1 20 µM 2µ M 0, 2µ M M 0, 02 µ 0, 00 2 µM 0 0µ M IFN (pg/ml) fl/fl 0 IFN production fl/fl IL4 (pg/ml) MOG-peptide IL-10 10 0 2 2µ M IL10 (pg/ml) 50 40 IL10 production 2µ M 60 50 100 3 00 2 0, * Grb2fl/fl Grb2fl/flCD4cretg 150 450 400 350 300 250 200 150 100 50 0 µM 0µ M 20 µM 2µ M 0, 2µ M M 0, 02 µ 0, 00 2 MOG-peptide TNF 0µ M TNF (pg/ml) 200 µM 0µ M 250 TNF production 0 2µ M * 0 MOG-peptide Grb2fl/fl Grb2fl/flCD4cretg 107 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse Abb. 43: An Tag 30 der experimentellen autoimmunen Enzephalomyelitis in vitro mit MOG-Peptid reaktivierte Milzzellen aus T-Zell spezifischen Grb2 defizienten Mäusen sekretieren weniger IL-17A, IL-2 und TNF. An Tag 30 der experimentellen autoimmunen Enzephalomyelitis wurden Milzen von Grb2fl/fl CD4cretg Mäusen und den entsprechenden Kontrollen entnommen und die Zellen wurden mit mit 0 µM, 0,002 µM, 0,02 µM, 0,2 µM, 2 µM, bzw. 20 µM MOG-Peptid für 72 h inkubiert. A) Die Menge der abgegebenen Zytokine im Überstand wurde durchflusszytometrisch über Partikel bestimmt, an die Antikörper gegen je ein spezifisches Zytokin gekoppelt waren. Ein gebundenes Zytokin kann über einen weiteren Antikörper gegen dasselbe Zytokin nachgewiesen werden, der an ein Fluochrom gekoppelt ist. Partikel verschiedener Größen können unterschieden und gleichzeitig gemessen werden (Cytometric Bead Array BD). B) Quantifizierung von IL-17A, IL-2, TNF, IL10, IFNγ, IL-6, IL-4 im Überstand mit Hilfe eines bekannten Zytokinstandards. Grb2fl/fl CD4crewt n=6 Mäuse; Grb2fl/fl CD4cretg n=7 Mäuse; Für die Statistik wurde der T-Test verwendet; *p<0,05; **p<0,01; ***p<0,001. Das Experiment wurde zusammen mit Lena Sandrock (AG Steinkasserer) durchgeführt. 6.2.10 Verringerte Aktivierbarkeit von Grb2 defizienten CD4+ T-Zellen durch dendritische Zellen im gemischten Lymphozyten Versuch Grb2fl/fl CD4cretg Mäuse stimulierten nach einer spezifischen Stimulation über den TZR mit MOG-Peptid weniger Zytokine, die die EAE fördern (Abb. 43). Zudem gibt es Daten, dass die TZR-Signalleitung in Grb2fl/fl Lckcretg Mäusen beeinträchtigt ist (Jang et al. 2010). Darum haben wir die Aktivierbarkeit von Grb2fl/fl CD4cretg T-Zellen durch dendritische Zellen in einem alloreaktiven Ansatz untersucht. Mit einer steigenden Zahl an alloreaktiven dendritische Zellen steigt die Proliferation der Grb2fl/fl CD4cretg und Kontroll-T-Zellen an. Die Grb2fl/fl CD4cretg TZellen proliferieren aber deutlich schwächer als die Kontroll-T-Zellen (Abb. 44). Zusätzlich kann es sein, dass die dendritischen Zellen in Grb2fl/fl CD4cretg Mäusen ein verringertes Potential haben T-Zellen zu aktivieren, da Subpopulationen von dendritischen Zellen CD4-positiv sind und Grb2 in Grb2fl/fl CD4cretg Mäusen verloren haben sollten. Darum wurde erneut ein alloreaktiver gemischter Lymphozytenversuch mit wildtyp T-Zellen und aus Grb2fl/fl CD4cretg Tieren generierten dendritischen Zellen durchgeführt. Die aus dem Knochenmark von Grb2fl/fl CD4cretg Tieren generierten dendritischen Zellen hatten dasselbe Potential T-Zellen zu aktivieren, wie dendritische Zellen aus Kontrolltieren (Abb. 44). Diese in vitro Versuche zeigen, dass Grb2 in CD4+ T-Zellen wichtig für die Aktivierbarkeit von T-Zellen durch dendritische Zellen ist. 108 T-Zell spezifische Grb2 Knockoutmaus Ergebnisse A unstimulated TNF 250000 250000 200000 200000 LPS 250000 *** 100000 200000 *** 150000 *** cpm ** 150000 cpm cpm ** *** * 100000 ** *** *** 150000 *** 100000 ** 75000 75000 75000 Grb2fl/fl CD4cretg DCs fl/fl Grb2 DCs Grb2fl/flCD4cretg DCs 0 30 0 Grb2fl/fl CD4cretg DCs fl/fl Grb2 DCs Grb2fl/flCD4cretg DCs Abb. 44:Grb2 defiziente CD4+ T-Zellen können im gemischten Lymphozytenversuch weniger effizient durch alloreaktive dendritische Zellen aktiviert werden als CD4+ T-Zellen aus Kontrolltieren. Umgekehrt können dendritische Zellen aus Grb2fl/fl CD4cretg Mäusen alloreaktive T-Zellen genauso gut stimulieren, wie alloreaktive T-Zellen aus Kontrolltieren. A) dendritische Zellen wurden aus Knochenmarkszellen von BALB/c Mäusen durch GM-CSF Zugabe generiert. Je 3x105 mit anti CD90.2 Beads magnetisch aufgreinigte T-Zellen aus 10 Generationen auf den C57BL/6 Hintergrund zurückgekrezten Grb2fl/fl CD4cretg Mäusen wurden mit verschiedenen Zahlen von dendritischen Zellen in 200 µl Medium gemischt und für 72 h inkubiert. Die dendritischen Zellen wurden aus Knochenmarkszellen generiert und mit 100 ng/ml LPS oder 500 U/ml TNFα vorbehandelt bzw. unbehandelt eingesetzt. Dann wurden die Zellen für 16 h mit 1µCi/Well 3H Tritiumthymidin inkubiert. Das in die Zellen eingebaute 3H Tritiumthymidin wurde gemessen, um die Proliferation der Zellen zu bestimmen. B) dendritische Zellen wurden aus Knochenmarkszellen von Grb2fl/fl CD4cretg Mäusen und C57BL/6 Kontrolltieren generiert. Je 3x105 Milzzellen aus BALB/c Mäusen wurden mit verschiedenen Zahlen von dendritischen Zellen gemischt und für 72 h inkubiert. Sonst war das Vorgehen wie in A. Grb2fl/fl CD4crewt n=5 Mäuse; Grb2fl/fl CD4cretg n=5 Mäuse; Für die Statistik wurde der TTest verwendet; *p<0,05; **p<0,01; ***p<0,001. Diese Versuche wurden in Kooperation mit Elisabeth Zinser (AG Steinkasserer) durchgeführt. 109 T-Zell spezifische Grb2 Knockoutmaus 0 0 30 00 0 30 0 10 00 30 00 0 10 00 30 00 10 00 30 00 0 0 0 0 30 0 0 10 00 25000 30 00 25000 0 25000 Grb2 DCs Grb2fl/flCD4cretg DCs 10 00 50000 30 0 50000 10 00 cpm 100000 cpm 100000 Grb2fl/fl CD4cretg DCs 30 00 Grb2 Grb2fl/flCD4cretg LPS 100000 fl/fl 0 0 Grb2 Grb2fl/flCD4cretg TNF 50000 10 00 30 00 30 0 10 00 0 Number of BALB/c DCs fl/fl 30 00 Grb2 tg unstimulated Grb2fl/flCD4cre 0 cpm 30 00 Number of BALB/c DCs fl/fl 0 Number of BALB/c DCs 0 0 0 0 fl/fl B 50000 10 00 * 30 00 30 0 10 00 30 00 0 10 00 0 0 0 ** 30 00 * 50000 * 10 00 50000 Diskussion 7 Diskussion 7.1 Einfluss von Grb2 auf die B-Zell Entwicklung und das Überleben von BZellen Sowohl Grb2fl/fl mb1cre/+ als auch Grb2fl/fl CD19cre/+ Mäuse weisen reduzierte B-Zell Zahlen auf, die in der Entwicklung ab dem transitionalen B-Zell Stadium auftreten (Ackermann et al. 2011; Jang et al. 2011). Dies scheint an einem späten Block in der B-Zell Entwicklung zu liegen, da die Entwicklung von pre B-Zellen bis zum Stadium der unreifen B-Zellen nicht betroffen ist. In dieser Arbeit sollte untersucht werden, welcher Mechanismus zu der reduzierten Zahl reifer BZellen in Grb2fl/fl mb1cre/+ Mäusen führt. Dazu wurde das Überleben von Grb2-/- B-Zellen nach Stimulation mit BAFF in vitro untersucht. Grb2fl/fl mb1cre/+ B-Zellen sind nicht in der Lage den BAFF-Rezeptor in der Entwicklung von transitionalen zu reifen Zellen hochzuregulieren, weshalb reife B-Zellen in B-Zell spezifischen Grb2-/- Mäusen weniger BAFF-Rezeptor auf der Oberfläche exprimieren (Ackermann et al. 2011). Sowohl unreife als auch reife Grb2-/- B-Zellen wiesen nach Zugabe von BAFF keine Unterschiede in ihrer Überlebensfähigkeit auf. Auch bei einer Titration der BAFF-Konzentration waren keine Überlebensunterschiede in wt und Grb2-/- B-Zellen festzustellen. Darum kann ein verringertes Überleben durch eine beeinträchtigte BAFF Antwort als Ursache für die reduzierten B-Zell Zahlen in Grb2-/- Mäusen ausgeschlossen werden. Zudem weist eine normale Zahl an Marginalzonen B-Zellen in B-Zell spezifischen Grb2-/- Mäusen auf eine weitgehend normale Signalleitung über den BAFF-Rezeptor hin, da Marginalzonen B-Zellen stark von der Signalleitung über den BAFF-Rezeptor abhängig sind (Sasaki et al. 2004). Die Grb2fl/fl mb1cre/+ Mäuse wurden mit Bcl2 trangenen Mäusen verpaart um zu überprüfen, ob verminderte Apoptose bzw. verlängertes Überleben den Differenzierungsblock in vivo aufheben können. Es wurde beschrieben, dass eine Bcl2 Überexpression die gestörte Entwicklung von transitionalen B-Zellen z.B. in Lyn- (Meade et al. 2002) und BOB.1/OBF.1-defizienten Mäusen (Brunner et al. 2003) wieder herstellen kann. B-Zellen von B-Zell spezifischen Grb2-/- Mäusen, die Bcl2 überexprimieren, haben zwar ähnliche Überlebensraten wie Kontrollzellen, die Bcl2 überexprimieren aber die Überexpression von Bcl2 konnte den Differenzierungsblock in B-Zell spezifischen Grb2-/- Mäusen nicht aufheben. Knochenmarks B-Zellen, T1, T2 und reife B-Zellen waren in B-Zell spezifischen Grb2-/- Mäusen mit transgenem Bcl2 gegenüber den Kontrolltieren mit transgenem Bcl2 in ähnlicher Weise reduziert, wie in B-Zell spezifischen Grb2-/- Mäusen gegenüber Kontrollen ohne Bcl2 Überexpression. Dies deutet auf einen Differenzierungsblock und weniger auf ein verringertes Überleben als Ursache für die reduzierte B-Zell Zahl in B-Zell spezifischen Grb2-/- Mäusen hin. 110 Einfluss von Grb2 auf die B-Zell Entwicklung und das Überleben von B-Zellen Diskussion In vitro Differenzierungsversuche mit sortierten T2 B-Zellen bestätigten die Erkenntinisse aus den Bcl2 transgenen Tieren. Die T2-Zellen reiften nach anti-IgM Stimulation zu reifen B-Zellen. Allerdings war der Anteil der gereiften Zellen kleiner als in der Literatur beschrieben (Su & Rawlings 2002). Die in vitro Differenzierung von Grb2-/- T2-Zellen war stark beeinträchtigt und konnte auch nicht durch BAFF-Zugabe verbessert werden. Diese Daten deuten darauf hin, dass die verringerte B-Zellzahl in Grb2fl/fl mb1cre/+ Mäusen eher auf einen Differenzierungsdefekt zurückzuführen ist. Calciumsignale, die über den BZR vermittelt werden sind entscheidend für die Entwicklung von transitionalen zu reifen B-Zellen. Dies konnte mit Hilfe verschiedenster Mauslinien gezeigt werden, in denen Signalmoleküle aus der BZR Signalleitung fehlten (Niiro & Clark 2002; Pappu et al. 1999; Minegishi et al. 1999; Hayashi et al. 2000; Cheng et al. 1995; Turner et al. 1995; Xu et al. 2000; Jumaa et al. 1999; Khan et al. 1995; Kerner et al. 1995). Grb2 ist ein negativer Regulator des Calciumsignals, nicht nur in reifen B-Zellen (Ackermann et al. 2011), sondern auch in T2 B-Zellen, wie das höhere Calciumsignal in Grb2fl/fl mb1cre/+ Mäusen zeigte. Das Calciumsignal in T1 B-Zellen war aber nicht verändert. Es wurde beschrieben, dass wichtige Elemente für den Schwellenwert der Calcium Mobilisierung in reifen B-Zellen während der Reifung der transitionalen B-Zellen moduliert werden. So wird der inhibitorische BZR Corezeptor CD22, der eine Grb2 Bindestelle besitzt, vom T1 B-Zell Stadium bis zu den reifen B-Zellen um den Faktor 2,5 hochreguliert. Zudem hat die Src Kinase Lyn in reifen B-Zellen einen stärkeren inhibitorischen Einfluss auf die Calciumsignalleitung als in unreifen B-Zellen (Gross et al. 2009). Sowohl CD22 als auch Lyn werden in Grb2-/- B-Zellen nach BZR Stimulation weniger stark phosphoryliert. Dieser beeinträchtigte inhibitorische Signalweg könnte zu dem höheren Calciumsignal in Grb2-/- B-Zellen nach BZR Stimulation beitragen (Ackermann et al. 2011; Jang et al. 2011). Mausstämme, die defizient für inhibitorische Proteine sind, weisen eine effizientere Reifung von transitionalen zu reifen B-Zellen auf, wie beispielsweise für CD22 defiziente Mäuse gezeigt wurde (Gerlach et al. 2003). Viele knockout Mäuse, denen positive Signalmoleküle fehlen, weisen allerdings eine beeinträchtigte Reifung auf (Niiro & Clark 2002; Pappu et al. 1999; Minegishi et al. 1999; Hayashi et al. 2000; Cheng et al. 1995; Turner et al. 1995; Xu et al. 2000; Jumaa et al. 1999; Khan et al. 1995; Kerner et al. 1995; Wang et al. 2000; Hashimoto et al. 2000). Darum ist es unwahrscheinlich, dass Calciumsignale in B-Zell spezifischen Grb2-/- Mäusen für den beobachteten B-Zell Defekt verantwortlich sind. Nachdem Calciumsignale als Ursache für den Differenzierungsdefekt ausgeschlossen werden konnten wurde untersucht, ob andere Signalwege in Grb2-/- B-Zellen betroffen sind. Reife BZellen regulieren nach Stimulation beispielsweise c-Myc und Cyclin D2 hoch, die den Eintritt der Zellen in den Zellzyklus fördern. Außerdem werden anti-apoptotische Gene der Bcl2 Familie hochreguliert. Diese Gene werden in T1 B-Zellen nach BZR Stimulation nicht hochreguliert (Su 111 Einfluss von Grb2 auf die B-Zell Entwicklung und das Überleben von B-Zellen Diskussion & Rawlings 2002; Andrews & Rawlings 2009; Carman et al. 1996). T1 Grb2-/- B-Zellen zeigten einen Defekt in der Bcl2a1 (A1) und Bcl-xl Expression gegenüber Kontrollzellen. Zudem war die Expression des Transkriptionsfaktors Mef2c verringert, der entscheidend für die Reifung von T1 B-Zellen zu reifen B-Zellen ist (Andrews et al. 2012). Für Bcl2a1 (A1), Bcl-xl und Mef2c konnten wir die beschriebene Hochregulation nach BZR Stimulation in T2 und reifen B-Zellen nicht nachweisen. Dies könnte am Zeitpunkt der Analyse nach der Stimulation liegen. A1 (Bcl2a1) und Bcl-xl sind anti-apoptotische Proteine, die durch Akt und NFκB induziert werden können (Su & Rawlings 2002; Su et al. 2002; Grumont et al. 1998; Grumont et al. 1999; Anderson et al. 1996; Chen et al. 2000; Enzler et al. 2006). Allerdings scheint die NFκB Signalleitung in T1 und reifen B-Zellen gleich reguliert zu werden (Andrews & Rawlings 2009). Weil die Grb2-/- B-Zellen starke Beeinträchtigungen in der Akt Aktivierung nach BZR Stimulation aufweisen (Ackermann et al. 2011) könnte die verringerte Bcl2a1 (A1) und Bcl-xl Expression mit diesem Signalweg zusammenhängen. Der Transkriptionsfaktor Mef2c ist in der Lage Bcl-xl, c-Myc und Cyclin mRNAs zu induzieren. Dieser Effekt ist allerdings nicht direkt, weil es keine Bindestellen in diesen Zielgenen gibt (Andrews et al. 2012). Mef2c kann calciumabhängig und calciumunabhängig induziert werden. Weil die B-Zell spezifischen Grb2-/- Mäuse nach BZR Stimulation eine stärkere Calcium Mobilisierung zeigen ist es unwahrscheinlich, dass die schwächere Mef2c Expression durch das Calciumsignal beeinflusst wird. Für die Gene, die für c-Myc und Cyclin D2 kodieren, die den Zellzyklus initiieren, wurden unterschiedliche Ergebnisse gemessen. Die c-Myc Expression ist in Grb2-/- B-Zellen nach BZR Stimulation reduziert. Die Expression von c-Myc hängt vom PI3K Signalweg und Phosphatidylinositol 3,4,5-trisphosphate Generierung ab (Gray et al. 1999; Astoul et al. 1999). Die Defekte Akt Signalleitung in Grb2-/- B-Zellen nach BZR Stimulation, die ein Teil der PI3K Signalkaskade ist, könnte die niedrigere c-Myc Expression erklären. Zuätzlich wurde beschrieben, dass Cyclin D2 als wichtiger Faktor im Zellzyklus in T1 B-Zellen nach BZR Stimulation schwächer induziert wird als in T2 B-Zellen (Su & Rawlings 2002). Cyclin D2 wird in der frühen G1-Phase des Zellzyklus exprimiert und kodiert für eine cdk4 Untereinheit. Frühere Studien haben gezeigt, dass sich Cyclin D2 nach BZR Stimulation in unreifen und reifen B-Zellen ansammelt. Allerdings bleiben die unreifen im Gegensatz zu den reifen B-Zellen in der G1 Phase und schaffen es nicht zu proliferieren. Sie sind nicht in der Lage wichtige Gene für den weiteren Fortschritt des Zellzyklus zu exprimieren (Carman et al. 1996). Die Cyclin D2 Expression ist in Grb2-/- B-Zellen generell erhöht. Dies könnte zumindest zum Teil mit einem höheren Calciumsignal in T2 und reifen B-Zellen zusammenhängen, da ein höheres Calcium mit einer stärkeren Cyclin D2 Expression in Verbindung gebracht wird (Chiles 2004). Sortierte unreife Grb2-/- B-Zellen haben keinen Differenzierungsdefekt, sondern proliferieren eher stärker als 112 Einfluss von Grb2 auf die B-Zell Entwicklung und das Überleben von B-Zellen Diskussion unreife B-Zellen aus Kontrolltieren (Ackermann et al. 2011). Dies spricht gegen einen Defekt in der Induktion des Zellzyklus in Grb2-/- B-Zellen. Zusammengefasst weisen die B-Zell spezifischen Grb2-/- Mäuse einen Block in der B-Zell Entwicklung auf. Dieser Block wird nicht durch eine beeinträchtigte BAFF Signallleitung verursacht und kann auch nicht durch ein verlängertes Überleben der Zellen durch eine Überexpression von Bcl2 aufgehoben werden. Die Expression verschiedener Gene in der Signalleitung von Grb2-/- B-Zellen ist beeinträchtigt, die alle durch die PI3K/Akt Signalleitung aktiviert werden können. Dieser Signalweg ist in BZR stimulierten Grb2-/- B-Zellen beeinträchtigt. Die PI3K/Akt Signalleitung ist sowohl für das Überleben als auch für die Differenzierung von peripheren B-Zellen wichtig (Fruman et al. 1999; Srinivasan et al. 2009). Darum ist es wahrscheinlich, dass dieser Signalweg zum Phenotyp der B-Zell spezifischen Grb2-/Mäuse beiträgt. Aufgrund der Vielzahl an Signalwegen an denen Grb2 beteiligt ist, ist es in Zukunft wichtig transkriptom- und proteomweite Analysen durchzuführen, die helfen einen Überblick über alle veränderten Signalwege in B-Zell spezifischen Grb2-/- Mäusen zu gewinnen. Auf dieser Grundlage könnten gezielt die Signalwege analysiert werden, die in B-Zell spezifischen Grb2-/- Mäusen verändert und wichtig für die B-Zell Entwicklung sind. Aufgrund der reduzierten Zahl unreifer B-Zellen im Knochenmark und der reduzierten Zahl von T1 B-Zellen im Blut ist es wahrscheinlich, dass der Block bei den unreifen B-Zellen im Knochenmark beginnt. Dabei könnte auch die Auswanderung der B-Zellen aus dem Knochenmark betroffen sein. BrdU Experimente zeigen einen geringeren BrdU Einbau in T1 Zellen von B-Zell spezifischen Grb2-/- Mäusen. Dies deutet auf eine reduzierte Zahl von B-Zellen hin, die aus dem Knochenmark auswandern. Außerdem zeigten Versuche mit gemischten Knochenmarkschimären einen kompetetiven Vorteil von unreifen Kontroll B-Zellen gegenüber unreifen Grb2-/- B-Zellen im Knochenmark (Ackermann et al. 2011). Der Differenzierungsblock ist in den T1, T2 und reifen B-Zellen der Milz am deutlichsten erkennbar. Allerdings könnte der Block schon in unreifen B-Zellen stattfinden, die das Knochenmark verlassen. Dennoch haben Grb2-/- T2 B-Zellen einen Differenzierungsdefekt weiter zu reifen B-Zellen, wie in den in vitro Differenzierungsversuchen gezeigt werden konnte. Aufgrund der komplexen Signalstrukturen und der Vielzahl an Signalwegen an denen Grb2 beteiligt ist, kann nicht ausgeschlossen werden, dass verschiedene Funktionen von Grb2 die B-Zell Differenzierung in unterschiedlichen Stadien beeinflussen. 113 Einfluss von Grb2 auf die B-Zell Entwicklung und das Überleben von B-Zellen Diskussion 7.2 Bedeutung von Grb2 für die FcγR2b Expression und Signalleitung Grb2 ist ein negativer Regulator der Calcium Mobilisierung über den BZR in Zelllinien und primären B-Zellen (Stork et al. 2004; Stork et al. 2007; Ackermann et al. 2011; Jang et al. 2011; Neumann et al. 2011). In einer reifen, murinen B-Zelllinie, die spontan Grb2 verloren hat (Harmer & DeFranco 1999), wurde gezeigt, dass Grb2 die inhibitorische Wirkung des FcγR2b verstärkt. Dabei verstärkt die Costimulation des BZR mit dem FcγR2b die Bildung von inhibitorischen Komplexen, wie einem Dok-3/Grb2/SHIP Komplex an denen Grb2 beteiligt ist, während positive Funktionen von Grb2 wie die Bindung an CD19 geschwächt werden (Neumann et al. 2011). Es sollte untersucht werden, ob Grb2 auch in primären B-Zellen zur FcγR2b Signalleitung beiträgt. Um die Funktionalität des FcγR2b in primären B-Zellen zu untersuchen, wurden Calciumexperimente mit Grb2-/- B-Zellen durchgeführt. Dabei wurde die Wirkung des FcγR2b in verschiedenen peripheren B-Zell Entwicklungsstadien untersucht, da viele Regulatoren des Calciumsignalweges erst während der Entwicklung von unreifen zu reifen B-Zellen reguliert werden (Gross et al. 2009), während der FcγR2b schon früh in der B-Zell Entwicklung exprimiert wird (Foy et al. 1992). Sowohl in Grb2-/- T1, T2 als auch in reifen B-Zellen führte eine Kreuzvernetzung des FcγR2b mit dem BZR über komplette anti-IgM Antikörper zu einer Inhibition des Calciumsignales. In Grb2-/- T1 B-Zellen, bei denen das Calciumsignal gegenüber Kontoll B-Zellen unverändert ist, war die Inhibition über den FcγR2b vergleichbar mit der in Kontroll T1 B-Zellen. Auch im Knochenmark war die Inhibition über den FcγR2b in Grb2-/- pre B-Zellen intakt (Daten von Christina Forsch und Daniel Radtke nicht gezeigt). Diese Experimente deuten darauf hin, dass der Verlusst von Grb2 in primären B-Zellen die inhibitorische Funktion des FcγR2b nicht beeinflusst. Um zu überprüfen, ob die funktionelle Inhibition über den FcγR2b in primären B-Zellen gegenüber der beeinträchtigten Inhibition in murinen Bal17.TR Zellen durch eine veränderte Expression des FcγR2b auf primären Grb2-/- B-Zellen hervorgerufen wird, wurde die FcγR2b Expression gemessen. Niedrigere Level des FcγR2b werden mit einer stärkeren Aktivierbarkeit von B-Zellen und Autoimmunität in Verbindung gebracht (Xiu et al. 2002; Jiang et al. 2000; Espéli et al. 2012; Su et al. 2007), während die Auswirkungen einer stärkeren Expression des FcγR2b weitgehend unbekannt sind. In der Milz war die Expression des FcγR2b auf unreifen Grb2-/- B-Zellen moderat erhöht. Die Expression des FcγR2b auf reifen Grb2-/- B-Zellen, in denen die Inhibition über den FcγR2b intakt ist, war allerdings eher unverändert. Außerdem wurde die FcγR2b Expression von Grb2-/- B-Zellen aus dem Knochenmark bestimmt. Grb2 hat keinen Einfluss auf die FcγR2b Expression auf pro B-, pre B- oder reifen B-Zellen im Knochenmark. Diese Ergebnisse legen nahe, dass die moderaten Unterschiede in der Expression des FcγR2b keinen entscheidenden Einfluss auf die inhibitorische Wirkung des FcγR2b haben. Damit kann 114 Bedeutung von Grb2 für die FcγR2b Expression und Signalleitung Diskussion die Expression des FcγR2b nicht für die Unterschiede in der inhibitorischen Funktion des FcγR2b zwischen der Bal17.TR Zelllinie und primären B-Zellen verantwortlich sein. Aufgrund der veränderten FcγR2b Expression in Grb2-/- B-Zellen und der beeinträchtigten Keimzentrumsbildung in Grb2fl/fl mb1cre/+ Mäusen (Ackermann et al. 2011) sollte untersucht werden, ob die Expression des FcγR2b auch auf Keimzentrums B-Zellen verändert ist. Der FcγR2b wird in Keimzentrumzellen hochreguliert. Eine niedrige Expression des FcγR2b in Keimzentrumszellen führt zu Autoimmunität (Xiu et al. 2002; Jiang et al. 2000; Espéli et al. 2012). Die Hochregulation der FcγR2b Expression auf Keimzentrumszellen in Grb2fl/fl mb1cre/+ Mäusen war intakt. Grb2 hat also keinen Einfluss auf die Expression des FcγR2b in Keimzentrums B-Zellen. Zusammengefasst hat Grb2 keinen entscheidenden Einfluss auf die Inhibition des BZR Signals durch den FcγR2b. Die Expression des FcγR2b ist weitgehend unverändert. Somit ist die defekte Inhibition über den FcγR2b in Grb2-defizienten Bal17.TR Zellen (Neumann et al. 2011) nicht auf primäre B-Zellen übertragbar. Damit ist weitgehend ausgeschlossen, dass der FcγR2b die Aktivierarkeit von Grb2-/- B-Zellen verändert, einen Block in der frühen B-Zell Entwicklung auslöst oder an einer beeinträchtigten Keimzentrumsentwicklung beteiligt ist. 7.3 Die Rolle von Grb2 in der Keimzentrumsreaktion Die Keimzentrumsreaktion ist in B-Zell spezifischen Grb2-/- Mäusen beeinträchtigt (Ackermann et al. 2011; Jang et al. 2011). Diese Beeinträchtigung hängt mit einem Defekt der Grb2-/- B-Zellen zusammen, Lymphotoxin-β zu sezernieren, was unter Anderem zu einer beeinträchtigten Bildung von Netzwerken aus follikulären dendritischen Zellen und der Marginalzone führt (Jang et al. 2011). Es wurde gezeigt, dass Grb2-/- B-Zellen in gemischten Knochenmarkschimären mit wt BZellen in der Lage sind normale Keimzentren zu bilden. Außerdem weisen Grb2 -/- B-Zellen, die Lymphotoxin-β überexprimieren eine normale Keimzentrumsreaktion auf (Jang et al. 2011). Somit ist Grb2 über seinen Einfluss auf die Lymphotoxin-β Sezernierung wichtig für die Keimzentrumsreaktion. Es sollte untersucht werden, ob normale Keimzentren gebildet werden, wenn Grb2 erst während der Keimzentrumsreaktion in Keimzentrums B-Zellen ausgeschaltet wird. Dazu wurden Grb2fl/flCγ1cre/+ Mäuse, die Grb2 erst in Keimzentrumszellen deletieren, mit Schafserythrozyten immunisiert und die Keimzentrumsreaktion wurde 10 Tage nach der Immunisierung analysiert. Sowohl die Zahl, die Größe und das Verhältnis von B-Zellen der dunklen zu B-Zellen der hellen Zone der Keimzentren waren in Grb2fl/flCγ1cre/+ Mäusen unverändert. Auch die Zahl der follikulären T Helferzellen war unverändert. Diese Daten zeigen, dass Grb2 in etablierten 115 Die Rolle von Grb2 in der Keimzentrumsreaktion Diskussion Keimzentrums B-Zellen keine essentielle Rolle spielt. Diese Ergebnisse sind kompatibel mit veröffentlichten Daten die nahe legen, dass Grb2 wichtig für die Lymphotoxin-β Sezernierung naiver B-Zellen ist. Lymphotoxin-β ist wiederum wichtig für die Architektur der Milz und somit für die Induktion einer normalen Keimzentrumsreaktion (Jang et al. 2011). Interessanterweise ist auch die Zahl der IgG+ B-Zellen in der Milz an Tag 10 nach der Immunisierung mit Schafserythrozyten in Grb2fl/flCγ1cre/+ Mäusen unverändert, während Grb2fl/fl mb1cre/+ Mäuse, die einen Block in der B-Zell Entwicklung und eine defekte Keimzentrumsreaktion aufweisen, weniger IgG B-Zellen haben (Ackermann et al. 2011). Grb2 hat also keinen intrinsischen Einfluss auf die Entwicklung von IgG B-Zellen im Keimzentrum. Dafür sprechen auch in vitro Versuche zum Klassenwechsel von Grb2-/- B-Zellen, die gezeigt haben, dass Grb2 für den Klassenwechsel nicht gebraucht wird. 7.4 Einfluss von Grb2 auf die sekundäre Immunantwort und Gedächtnis BZellen IgG Gedächtniszellen können stärker über ihren BZR stimuliert werden als IgM B-Zellen. Für Zelllinien wurde beschrieben, dass sowohl SAP97 (Liu et al. 2010) als auch das Adapterprotein Grb2 (Engels et al. 2009) über verschiedene Bindemotive an die intrazelluläre Domäne des IgGRezeptors binden können und die Signalleitung über den IgG-BZR verstärken. Allerdings ist die Rolle von Grb2 bei der Signallleitung über den BZR umstritten (Liu et al. 2010). Es wurde beschrieben, dass sowohl Grb2fl/fl CD19cre/+ Mäuse als auch Grb2fl/fl mb1cre/+ Mäuse eine stärkere IgM Antwort, aber eine unveränderte IgG Immunantwort gegen das lösliche Protein-Antigen NPKLH bilden (Ackermann et al. 2011; Jang et al. 2011). Sonst ist der Einfluss von Grb2 auf die Immunantwort in vivo weitgehend unbekannt. Zunächst wurde getestet, ob Grb2 bei der sekundären IgG Immunantwort gegen ein partikuläres Antigen eine Rolle spielt. Dazu wurden B-Zell spezifische Grb2-/- Mäuse mit virusartigen Partikeln des humanen Zytomegalovirus (VLPs) immunisiert, die eine starke sekundäre IgG Antwort auslösen (Hebeis et al. 2004). Dadurch sollte überprüft werden, ob Grb2 in vivo einen Einfluss auf die sekundäre Immunantwort / Reaktivierung von IgG-Zellen hat. Die sekundäre Immunantwort gegen VLPs war in B-Zell spezifischen Grb2-/- Mäusen verringert. Dieser Effekt war nicht auf einen generellen Defekt zum Klassenwechsel in Grb2-/- B-Zellen zurückzuführen, da Grb2-/- B-Zellen in vitro fähig waren einen normalen Klassenwechsel zu vollziehen. Der Verlust von Grb2 schwächt also die sekundäre Immunantwort von B-Zell spezifischen Grb2-/- Mäusen gegenüber Kontrolltieren. Die Zahl der B-Zellen ist in B-Zell spezifischen Grb2-/- Mäusen generell reduziert und könnte die geringere sekundäre Antwort erklären (Ackermann et al. 2011; Jang et al. 2011). Um zu überprüfen, ob auch die Zahl der IgG Gedächtniszellen in B-Zell spezifischen Grb2-/- Mäusen reduziert ist und für die geringere sekundäre Antwort verantwortlich 116 Einfluss von Grb2 auf die sekundäre Immunantwort und Gedächtnis B-Zellen Diskussion sein könnte, wurde die Zahl der IgG1/IgG2a/IgG2b+ B-Zellen zwei Monate nach der letzten Immunisierung mittels Durchflusszytometrie bestimmt. In B-Zell spezifischen Grb2-/- Mäusen waren geringere IgG1/IgG2a/IgG2b+ B-Zellzahlen vorhanden. Daraus ergeben sich zwei Hypothesen. Grb2 wirkt verstärkend auf die sekundäre Immunantwort, weil es einen positiven Einfluss auf die Zahl der IgG positiven B-Zellen hat oder Grb2 verstärkt die Antwort von IgG positiven Zellen über intrinsische Mechanismen. Es sollte überprüft werden, ob Grb2 auch einen intrinsischen Effekt bei der Reaktivierung von IgG Zellen hat. Darum wurden Gesamtmilzzellen mit gleich vielen IgG1/IgG2a/IgG2b+ Gedächtnis B-Zellen aus B-Zell spezifischen Grb2-/- Mäusen bzw. Kontrolltieren in Mäuse ohne B- und T-Zellen (Rag1-/-) übertragen und reaktiviert. Der IgG Antikörpertiter gegen VLPs und die Zahl der IgG produzierenden Zellen war in Empfängermäusen mit Grb2-/- Gedächtnis B-Zellen deutlich geringer als in Empfängermäusen mit Kontroll-Gedächtnis B-Zellen. Dabei kann ausgeschlossen werden, dass mögliche DNA Rückstände in den VLPs über die Bindung an Toll Like Rezptoren für die reduzierte Immunantwort der Grb2-/- Gedächtnis B-Zellen verantwortlich sind, da Grb2-/- B-Zellen stärker über TLRs aktiviert werden können. Die defekte Gedächtnisantwort ist auch unabhängig von der Antigenpräsentation der B-Zellen, da die Reaktivierung der B-Zellen unabhängig von T-Zellhilfe funktioniert (Hebeis et al. 2004). Der Transfer von IgG Gedächtnis B-Zellen reicht aber nicht aus um sicherzustellen, dass in dem Pool der Gedächtniszellen auch dieselbe Zahl antigenspezifischer Gedächtniszellen vorhanden war. Außerdem werden beim Übertrag von Gesamtmilzzellen auch IgM Gedächtniszellen mit übertragen (Dell et al. 1989; Dogan et al. 2009; Pape et al. 2011; White & Gray 2000; Wolniak et al. 2006). In B-Zell spezifischen Grb2-/- Mäusen ist sowohl die Zahl der naiven als auch der IgM Plasmazellen erhöht (Ackermann et al. 2011), was es wahrscheinlich macht, dass Grb2 auch einen Einfluss auf IgM Gedächtniszellen hat. Auch wenn die meisten IgM Gedächtniszellen nach der Reaktivierung zu Keimzentrumszellen werden, kann ein kleiner Teil auch zu IgG sekretierenden Plasmazellen werden (Dogan et al. 2009; Kometani et al. 2013; Pape et al. 2011). Diese können nicht mehr von Plasmazellen, die sich aus IgG Gedächtniszellen entwickelten, unterschieden werden. Darum wurde als nächstes eine definierte Zahl sortierter, antigenspezifischer IgG+ Gedächtniszellen übertragen. Als Antigen wurde das aufgereinigte Glykoprotein B (gB) des humanen Zytomegalovirus verwendet. Die gB-spezifischen Gedächtnis B-Zellen werden dabei durch die Bindung von fluoreszenz-Farbstoff markiertem gB an den BZR identifiziert. Das monomere gB allein ohne T-Zell Hilfe reicht allerdings nicht aus um die Gedächtniszellen zu reaktivieren, wodurch eine Voraktivierung der Gedächtniszellen weitgehend vermieden wird (Hebeis et al. 2004). In partikulärer Form, wie z.B. in VLPs ist gB aber in der Lage Gedächtnis BZellen ohne T-Zell Hilfe zu aktivieren (Weisel et al. 2010). Die Reaktivierung der gB spezifischen Gedächtnis B-Zellen in den Empfängertieren erfolgte erneut T-Zell unabhängig mit 117 Einfluss von Grb2 auf die sekundäre Immunantwort und Gedächtnis B-Zellen Diskussion VLPs, die gB enthalten. Der gB-spezifische IgG Antikörpertiter und die Zahl der Zellen, die in der Milz IgGs gegen gB produzierten, waren in Rag1-/- Mäusen mit Grb2-/- Gedächtnis B-Zellen deutlich geringer als in Rag1-/- Mäusen mit Kontroll-Gedächtnis B-Zellen. Grb2 verstärkt also intrinsisch die Gedächtnisantwort von IgG+ antigenspezifischen B-Zellen. Die verringerte Gedächtnisantwort der Grb2-/- B-Zellen aus Grb2fl/fl mb1cre/+ Mäusen kann mehrere Gründe haben. Zum einen kann die beeinträchtigte B-Zell Entwicklung dazu führen, dass sich die Gedächtnis B-Zellen nicht richtig entwickeln. Gedächtnis B-Zellen bilden z.B. ein anderes Genexpressionsprofil aus als naive B-Zellen (Bhattacharya et al. 2007; Tomayko et al. 2008). Dabei werden auch TNF Rezeptoren und Proteine der Bcl2 Familie hoch reguliert (Good et al. 2009), die in Grb2fl/fl mb1cre/+ Mäusen schon in naiven B-Zellen schwächer exprimiert werden (Ackermann et al. 2011). Auch das in naiven Grb2-/- B-Zellen nach BZR Stimulation schwächer aktivierte Ras (Ackermann et al. 2011) könnte die Entwicklung der Gedächtnis BZellen negativ beeinflussen (Takahashi et al. 2005). Zum Anderen können intrinsische Funktionen von Grb2 in den Gedächtnis B-Zellen wichtig für die Gedächtnisantwort sein. Für Zelllinien wurde beschrieben, dass Grb2 an die immunoglobulin tail tyrosine (ITT) genannte Bindestelle (Engels et al. 2009) des IgG-Rezeptors binden kann und so die Signalleitung über den BZR verstärkt. Allerdings ist die Rolle von Grb2 bei der Signallleitung über den BZR umstritten (Liu et al. 2010). Darum wurden gB spezifische Gedächtnis B-Zellen in Grb2fl/flCγ1cre/+ Mäusen generiert, die Grb2 erst in Keimzentrumzellen deletieren und eine normale Keimzentrumsreaktion aufweisen. Die Grb2fl/flCγ1cre/+ Mäuse wiesen sowohl nach der primären als auch nach der sekundären Immunantwort normale Antikörpertiter gegen das lösliche Proteinantigen gB auf, was auf eine intakte Immunantwort hindeutet. Die generierten Gedächtnis B-Zellen wurden in Rag1-/Mäuse übertragen und T-Zell unabhängig mit VLPs reaktiviert. Der gB spezifische IgG Antikörpertiter und die Zahl der Zellen, die in der Milz IgGs gegen gB produzierten waren in Rag1-/- Mäusen mit Grb2-/- Gedächtnis B-Zellen deutlich reduziert. Grb2 verstärkt also unabhängig von seinen Funktionen bei der Entwicklung naiver B-Zellen die Gedächtnisantwort von IgG1 B-Zellen. Es sollte weiterhin untersucht werden, ob T-Zell Hilfe die defekte Gedächtnisantwort von Grb2-/B-Zellen kompensieren kann. Grb2fl/fl mb1cre/+ Mäuse wurden mit dem löslichen Protein/Haptenantigen NP-CGG immunisiert um Gedächtnis B-Zellen zu generieren. Diese wurden in genetisch kompatible wt Rezipienten übertragen. Ein Teil der Rezipienten wurde ca. zwei Wochen vor dem Übertrag mit CGG immunisiert. Dadurch gab es in den mit CGG vorimmunisierten Mäusen aktivierte T-Zellen, die NP-spezifische Gedächtnis B-Zellen aus mit NP-CGG immunisierten Donortieren effektiv bei der Aktivierung helfen konnten. Eine gesteigerte T-Zell Hilfe verstärkte die humorale Immunantwort sowohl in Rezipienten mit Grb2 -/Gedächtnis B-Zellen als auch in Rezipienten mit Kontroll Gedächtnis B-Zellen tendenziell. Der 118 Einfluss von Grb2 auf die sekundäre Immunantwort und Gedächtnis B-Zellen Diskussion gB spezifische IgG Antikörpertiter war in Rezipienten mit Grb2-/- Gedächtnis B-Zellen mit und ohne eine gesteigerte T-Zell Hilfe tendenziell geringer als in Rezipienten mit Kontroll Gedächtnis B-Zellen. Dieser Ansatz weist darauf hin, dass die mit gB erzielten Ergebnisse auf ein anderes Antigen übertragbar sein könnten. Zudem wurden die Gedächtniszellen anders als in den Versuchen mit VLPs oder gB in Mäuse mit einem intakten Immunsystem übertragen, was die Ergebnisse physiologisch relevanter macht. Der intrinsische Einfluss von Grb2 auf Gedächtnis BZellen scheint auch bei einer stärkeren T-Zell Hilfe eine wichtige Rolle für die humorale Immunantwort zu spielen. Es sind aber weitere Versuche nötig, um diese Hypothese weiter zu belegen. Mögliche Mechanismen für die stärkere Gedächtnisantwort sind eine stärkere Aktivierung und Signallleitung oder ein verlängertes Überleben der aktivierten B-Zellen. Diese Mechanismen werden wahrscheinlich durch die Bindung von Grb2 an die immunoglobulin tail tyrosine (ITT) genannte Bindestelle des IgG-Rezeptors gesteuert, die die Signalleitung über den BZR verstärkt (Engels et al. 2009). Die Gruppe von Jürgen Wienands hat kürzlich gezeigt, dass Syk das ITT Motiv im intrazellulären Teil von IgG phosphorylieren kann. In der Folge kann Grb2 über seine SH2-Domäne an das ITT Motiv binden und rekrutiert über seine N-terminale SH3-Domäne wiederum die Kinase Btk zum intrazellulären Bereich IgG-Rezeptors. Das durch Grb2 rekrutierte Btk verstärkt die Calciummobilisierung in IgG+ B-Zellen gegenüber IgM+ B-Zellen. Außerdem erhöht das ITT Motiv die Aktivierbarkeit von IgG+ B-Zellen gegenüber IgM+ B-Zellen. Versuche mit Grb2 defizienten B-Zellen haben gezeigt, dass die Signalleitung über das ITT Motiv Grb2 spezifisch ist. Grap, das eine hohe Ähnlichkeit zu Grb2 aufweist bindet auch an das ITT Motiv aber verstärkt die Signalleitung über den IgG BZR gegenüber dem IgM BZR nicht und rekrutiert kein Btk zum IgG-Rezeptor (Engels et al. 2014). Aufgrund der Vielzahl an Signalwegen an denen Grb2 beteiligt ist (Neumann et al. 2009) kann aber nicht ausgeschlossen werden, dass neben der Bindung von Grb2 an das ITT Motiv im zytoplasmatischen Teil des IgG und IgE BZRs auch andere Funktionen von Grb2 die Gedächtnisantwort positiv beeinflussen. 119 Einfluss von Grb2 auf die sekundäre Immunantwort und Gedächtnis B-Zellen Diskussion 7.5 Grb2 – Mögliche Autoimmunität in alternden Mäusen Das Adapterprotein Grb2 ist an vielen inhibierenden und aktivierenden Signalwegen beteiligt. Dabei können je nach Entwicklungsstadium und Situation die positiven oder die negativen Funktionen von Grb2 überwiegen. So wirkt Grb2 auf die Aktivierung von IgM B-Zellen potentiell inhibierend (Ackermann et al. 2011; Jang et al. 2011), während es in Gedächtnis B-Zellen eher aktivierend wirkt (Engels et al. 2009). Grb2 bindet an inhibitorische BZR Corezeptoren, wie CD22, CD72 und den FcγR2b, so wie Phosphatasen der PEST Familie, SHP1 und SHP2, die alle direkt oder indirekt mit Autoimmunität in Verbindung gebracht werden (Tsubata 1999; Jellusova & Nitschke 2012; Bolland & Ravetch 2000; Chan et al. 1997; Ono et al. 1996; Ono et al. 1997; Veillette et al. 2009). B-Zell spezifische Grb2-/- Mäuse zeigen zudem eine schwächere Phosphorylierung von CD22 und der Kinase Lyn und eine dazu passende stärkere Calcium Mobilisierung, so wie hochregulierte Aktivierungsmarker, was darauf hindeutet, dass die Grb2-/IgM B-Zellen voraktiviert sind (Ackermann et al. 2011; Jang et al. 2011). Durch die Interaktion und Modulation von Faktoren, die mit Autoimmunität in Verbindung gebracht werden und die Rolle von Grb2 bei der Generierung von IgM Plasmazellen, ist es möglich, dass Grb2 die Entwicklung von Autoimmunerkrankungen beeinflussen kann. Es wurde bereits beschrieben, dass 5-6 Monate alte B-Zell spezifischen Grb2-/- Mäuse höhere IgM Antikörpertiter gegen dsDNA, ssDNA und Kernantigene bilden (Jang et al. 2011). Um die Rolle von Grb2 in der Autoimmunität weiter zu untersuchen, wurden 10-12 Monate alte B-Zell spezifische Grb2-/- Mäuse auf anti-dsDNA IgG Antikörper, anti-nukleäre IgG Antikörper und den Harnstoffanteil im Blut untersucht, der Rückschlüsse auf die Nierenfunktion zulässt (Black 1973). Es wurden keine erhöhten Werte autoreaktiver Antikörper und auch kein erhöhter Stickstoffanteil im Blut von B-Zell spezifischen Grb2-/- Mäusen gemessen. Dies spiegelt auch die Literatur wieder, in der keine autoreaktiven IgG Antikörper in 5-6 Monate alten B-Zell spezifischen Grb2-/- Mäusen gefunden wurden und die Tiere bis zu einem Alter von einem Jahr keine Autoimmunkrankheiten entwickelten (Jang et al. 2011). Grb2 allein ist also kein entscheidender Faktor, der Autoimmunität verhindert. Aufgrund seiner Beteiligungen an inhibitorischen Signalwegen ist es aber möglich, dass der Verlust von Grb2 in Kombination mit dem Verlust anderer Faktoren zur Entwicklung von Autoimmunität beitragen kann. 120 Grb2 – Mögliche Autoimmunität in alternden Mäusen Diskussion 7.6 Einfluss von Grb2 auf B1 B-Zellen B1 B-Zellen sind für Thymus-unabhängige Typ II (TI-2) Immunantworten wichtig (Martin & Kearney 2001; Fagarasan & Honjo 2000). Die Thymus-unabhängige Typ II Immunantwort des IgG3 Isotyps gegen das TI-2 Antigen TNP-Ficoll ist in B-Zell spezifischen Grb2-/- Mäusen reduziert (Ackermann et al. 2011). Es sollte untersucht werden, ob die Zahl der B1-Zellen verändert ist und diesen Effekt erklären kann. Die B1a und B1b B-Zellen im Peritoneum von B-Zell spezifischen Grb2-/- Mäusen sind reduziert, während die Zahl der B1 B-Zellen in der Milz erhöht ist. Im Peritoneum sind die B1 Zellen die größte B-Zell Population (Berland & Wortis 2002; Baumgarth 2011) und kommen als erstes mit dem i.p. verabreichten TNP-Ficoll Antigen in Kontakt. Der Verlust von Grb2 beeinflusst die Zahl an B1 Zellen im Peritoneum und reduziert somit wahrscheinlich die Thymusunabhängige Typ II Immunantwort (Ackermann et al. 2011). Die Veränderungen der B1 Zellpopulationen im Peritoneum wurden bereits beschrieben, waren aber aufgrund von geringen Mauszahlen teilweise nicht signifikant (Ackermann et al. 2011; Jang et al. 2011). 121 Einfluss von Grb2 auf B1 B-Zellen Diskussion 7.7 Die Rolle von Grb2 in der T-Zell Entwicklung Wird Grb2 früh in der T-Zell Entwicklung durch cre unter der Kontrolle des proximalen Lck Promotors deletiert, der ab dem Übergang vom DN2 zum DN3 Stadium aktiv ist, kommt es zu einer Reduktion der CD4+CD8+ T-Zellen um etwa 30 %. Anschließend ist die positive Selektion beeinträchtigt, was zu einer starken Reduktion der CD4+ und CD8+ T-Zellen führt, die sich auch in der Peripherie fortsetzt. Desweiteren wird die negative Selektion gestört. Dadurch gelangen TZellen in die Peripherie, die normal durch eine zu starke Bindung an MHC-Peptid Komplexe negativ selektioniert worden wären und dadurch potentiell autoreaktiv sind (Jang et al. 2010). Es sollte untersucht werden, wie sich die Deletion von Grb2 in unterschiedlichen Entwicklungsstadien auf die T-Zell Entwicklung auswirkt. Dazu wurde die Deletion von Grb2 durch cre unter der Kontrolle des proximalen Lck Promotors (Orban et al. 1992) mit der Deletion durch CD4cre verglichen. Der proximale Lck Promotor ist ab dem Übergang vom DN2 zum DN3 Stadium aktiv (Shimizu et al. 2001), während der CD4cre ab dem doppeltpositiven T-Zell Stadium aktiv ist (Lee et al. 2001). In der frühen T-Zell Entwicklung von Grb2fl/fl Lckcretg Mäusen waren mehr DN3 T-Zellen und weniger DN4 T-Zellen vorhanden, was auf einen leichten Entwicklungsblock vom DN3 zum DN4 Stadium hindeutet, der zu der Reduktion der doppeltpositiven T-Zellen um 30% (Jang et al. 2010) beitragen könnte. Die DN3 und DN4 Populationen sind in der Grb2fl/fl CD4cretg Maus unverändert, weil Grb2 in diesem Stadium noch nicht deletiert wird. Dazu passt, dass die Zahl der TCRβ+HSA+ unreifen T-Zellen in Grb2fl/fl Lckcretg Mäusen leicht reduziert und in Grb2fl/fl CD4cretg Mäusen unverändert ist. Die TCRβKette wird ab dem DN3 Stadium exprimiert (von Boehmer 2005), nach dem die T-Zellzahlen in Grb2fl/fl Lckcretg Mäusen schon leicht reduziert sind, während die T-Zellen in der Grb2fl/fl CD4cretg Maus noch unverändert sind. Grb2 hat also einen moderaten Effekt auf die Entwicklung der doppeltnegativen T-Zellen. Die doppelt negativen T-Zellen entwickeln sich weiter zu CD4+CD8+ doppelt positiven T-Zellen (Koch & Radtke 2011). In Grb2fl/fl Lckcretg Mäusen waren tendenziell weniger doppelt positive TZellen vorhanden. Die Daten bestätigen die Ergebnisse aus der Literatur, dass die doppelt positiven T-Zellen in Grb2fl/fl Lckcretg Mäusen um 30% reduziert sind (Jang et al. 2010). Dies kann mit der beeinträchtigten Entwicklung der doppelt negativen T-Zellen in Grb2fl/fl Lckcretg Mäusen zusammen hängen. Die Zahl der doppelt positiven T-Zellen in der Grb2fl/fl CD4cretg Maus war hingegen unverändert. Zusätzlich wurde auch beschrieben, dass die positive Selektion von Grb2-/- T-Zellen in TCR-transgenen Mausmodellen stark beeinträchtigt ist. Dabei ist Grb2 sowohl 122 Die Rolle von Grb2 in der T-Zell Entwicklung Diskussion in CD4+ als auch CD8+ T-Zellen wichtig (Jang et al. 2010). Die positive Selektion findet im doppelt positiven T-Zell Stadium statt (Klein et al. 2009) und könnte somit zu der geringeren Zahl an doppelt positiven T-Zellen in Grb2fl/fl Lckcretg Mäusen beitragen. Nach der Selektion entwickeln sich die doppelt positiven T-Zellen zu CD4+ oder CD8+ einzel positiven Zellen (Klein et al. 2009). In Folge der defekten positivien Selektion in Grb2fl/fl Lckcretg Mäusen ist die Zahl der CD4+ bzw. CD8+ einzelpositiven T-Zellen wie in der Literatur beschrieben stark reduziert (Jang et al. 2010). Erwähnenswert ist, dass die Expression von CD5 und CD69 auf doppelt positiven T-Zellen von Grb2fl/fl Lckcretg Mäusen und Grb2fl/fl CD4cretg Mäusen unverändert war. Die Expression von CD5 und CD69 ist abhängig von der TZR-Expression/Signalleitung und wird mit positiver Selektion in Verbindung gebracht (Azzam et al. 1998; Dutz et al. 1995; Swat et al. 1993; Bendelac et al. 1992; Testi et al. 1988), die in Grb2fl/fl Lckcretg Mäusen stark beeinträchtigt ist. Die positive Selektion ist ein Prozess, der in mehreren Schritten stattfindet. Zur Initiierung ist die Bindung des T-Zell Rezptors an MHC Moleküle notwendig, die dazu führt, dass doppelt positive T-Zellen zu einem CD4+CD8+CD69+ Stadium differenzieren (Hare et al. 1999), in dem auch CD5 hochreguliert wird (Merkenschlager et al. 1997). Dieser Schritt allein reicht aber nicht für eine positive Selektion aus (Bendelac et al. 1992; Kishimoto & Sprent 1997). Für die positive Selektion sind weitere MHCunabhängige Schritte notwendig an denen Epithelzellen des Thymus beteiligt sind (Hare et al. 1999; Anderson et al. 1999). Die unveränderte Expression von CD69 und CD5 in doppeltpositiven Grb2-/- B-Zellen legt nahe, dass eine Interaktion von doppeltpositiven Grb2-/- BZellen mit MHC-Molekülen stattfindet und die über den T-Zell Rezeptor vermittelten Signale ausreichen, um CD69 und CD5 zu induzieren. Dafür, dass die Stärke des TZR Signales nicht stark beeinträchtigt ist, sprechen auch Calcium Mobilisierungsexperimente, in denen doppeltpositive Grb2-/- B-Zellen nach TZR Stimulation ein leicht stärkeres Calciumsignal zeigten. Der Defekt in der positiven Selektion von Grb2fl/fl Lckcretg Mäusen kann also mit qualitativen Unterschieden in der TZR Signalleitung oder TZR unabhängigen Signalwegen im weiteren Verlauf der weiteren positiven Selektion zusammenhängen, an denen Grb2 beteiligt ist. Grb2 spielt eine wichtige Rolle in der positiven Selektion von T-Zellen in der Entwicklung, die unabhängig von den Signalwegen ist, welche die CD69 und CD5 Expression steuern. Die Zahl der CD4+CD8+, CD4+ oder CD8+ T-Zellen im Thymus von Grb2fl/fl CD4cretg Mäusen ist nicht verändert. In Grb2fl/fl CD4cretg Mäusen beginnt cre das Gen für Grb2 ab dem doppelt positiven T-Zellstadium zu deletieren (Lee et al. 2001), in dem auch die positive Selektion stattfindet, die in Grb2fl/fl Lckcretg Mäusen stark beeinträchtigt ist (Jang et al. 2010). Das die positive Selektion in Grb2fl/fl CD4cretg Mäusen weniger stark betroffen ist, kann mit der 123 Die Rolle von Grb2 in der T-Zell Entwicklung Diskussion Deletionseffizienz und der Halbwertszeit von Grb2 zusammenhängen. Die Menge an Grb2, die für eine gewisse Zeit in den T-Zellen verbleibt, könnte für viele Zellen ausreichen, um die positive Selektion erfolgreich zu durchlaufen. So zeigten Mäuse mit einem haploid deletierten Grb2-Gen, deren T-Zellen etwa 40 % der normalen Menge an Grb2 aufwiesen, keinen Defekt in der positiven Selektion (Gong et al. 2001). Eine reduzierte Menge an Grb2 ist also ausreichend für die positive Selektion. Alternativ könnte die Funktion von Grb2 in der frühen T-Zell Entwicklung wichtig für die positive Selektion sein. Grb2fl/fl Lckcretg Mäuse deletieren Grb2 früh in der Entwicklung und weisen einen schweren Defekt der positiven Selektion auf, während die positive Selektion in Grb2fl/fl CD4cretg Mäusen, die Grb2 später deletieren, kaum gestört zu sein scheint. Allerdings ist neben der positiven Selektion auch die negative Selektion in Grb2fl/fl Lckcretg Mäusen beeinträchtigt (Jang et al. 2010). Da schon eine Reduktion von Grb2 um ca. 60 % in haploid Grb2 defizienten Mäusen ausreicht, um die negative Selektion deutlich zu beeinträchtigen (Gong et al. 2001) ist es wahrscheinlich, dass die negative Selektion auch in Grb2fl/fl CD4cretg Mäusen gestört ist. Die geringere positive Selektion in T-Zell spezifischen Grb2-/- Mäusen reduziert also die Zahl der T-Zellen und die beeinträchtigte negative Selektion in T-Zell spezifischen Grb2-/- Mäusen erhöht die Zahl der T-Zellen. Darum spiegeln die Zellzahlen der TZell spezifischen Grb2-/- Mäuse nur zum Teil Defekte in der positiven Selektion wider. Für die Grb2fl/fl Lckcretg Maus wurde beschrieben, dass die CD4+ T-Zellen im Thymus den Reifungsmarker HSA nicht herunteregulieren (Jang et al. 2010). Darum wurde die Reifung der TZellen im Thymus von Grb2fl/fl CD4cretg und Grb2fl/fl Lckcretg Mäusen untersucht. Dabei wurde festgestellt, dass die Zahl der reifen TCRβ+HSAlow Zellen in beiden Mäusen reduziert war, was auf einen Reifungsdefekt hindeutet. Die unveränderten Gesamtzahlen an CD4 und CD8 einzel positiven T-Zellen im Thymus von Grb2fl/fl CD4cretg Mäusen legen nahe, dass ein größerer Teil dieser Zellen HSAhigh ist. HSAhigh T-Zellen sind in einer normalen T-Zell Entwicklung keine funktionell kompetenten, reifen T-Zellen (Ramsdell et al. 1991; Nikolić-Zugić & Bevan 1990). Sie sind eher anfällig für die Induktion von Apoptose und spielen eine Rolle bei der negativen Selektion (Kishimoto & Sprent 1997; Hough et al. 1994). Die höhere Expression von HSA in den einzel positiven Zellen von Grb2fl/fl CD4cretg Mäusen deutet, wie auch in Grb2fl/fl Lckcretg Mäusen (Jang et al. 2010), auf einen Reifungsdefekt beim Übergang von den doppelt positiven zu den einzel positiven T-Zellstadien hin. Grb2 fördert also die Reifung von einzel positiven T-Zellen im Thymus. Es könnte sein, dass Grb2 die positive Selektion und die Reifung der T-Zellen im selben Selektionsschritt beeinflusst, da die positive Selektion im späten doppelt positiven Stadium 124 Die Rolle von Grb2 in der T-Zell Entwicklung Diskussion stattfindet und der Block in T-Zell spezifischen Grb2-/- Mäusen beim Übergang vom doppelt positiven zum einzel positiven Stadium vermutet wird. Um den Einfluss von Grb2 auf die T-Zellen der Peripherie zu untersuchen wurden T-Zellzahlen der Lymphknoten und der Milz bestimmt. Die Zahl der peripheren T-Zellen in Grb2fl/fl Lckcretg Mäusen war drastisch reduziert, während die Zahl in den Grb2fl/fl CD4cretg Mäusen nur etwa um 1/3 reduziert war. Aufgrund der reduzierten Zahl an T-Zellen in der Entwicklung der Grb2fl/fl Lckcretg Maus und der beeinträchtigten Reifung zu einzel positiven T-Zellen ist es wahrscheinlich, dass die reduzierten T-Zellzahlen in der Peripherie auf Entwicklungsdefekte in der T-Zell Entwicklung im Thymus zurückzuführen sind. Es ist aber nicht auszuschließen, dass Grb2 auch die Homeostase der T-Zellen in der Peripherie beeinflusst. Interessanterweise sind in der Milz und in den Lymphknoten von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen weniger naive T-Zellen vorhanden, während die Zahl an Gedächtnis T-Zellen in Grb2fl/fl Lckcretg Mäusen erhöht und in Grb2fl/fl CD4cretg Mäusen unverändert ist. Zudem ist der Anteil an aktivierten Zellen an den CD4+ und CD8+ T-Zellen der Milz in Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen erhöht. Dies deutet darauf hin, dass Grb2 neben der T-Zell Entwicklung im Thymus auch Effekte auf die T-Zellen in der Peripherie hat. Neben der reduzierten Zahl an αβ T-Zellen in Grb2fl/fl Lckcretg Mäusen haben die Tiere tendenziell mehr γδ T-Zellen im Thymus und mehr γδ T-Zellen in der Peripherie. γδ T-Zellen haben ein limitierteres TZR Repertoir als αβ T-Zellen, erkennen teilweise andere Antigene, sind anders im Körper verteilt und können schnell aktiviert werden (Born et al. 2011; Vantourout & Hayday 2013). In wie weit die Grb2 Defizienz zu der höheren Zahl an γδ T-Zellen durch eine erhöhte Rekrutierung von doppelt negativen T-Zellen zur γδ Linie in der frühen Entwicklung beiträgt und ob spätere Homeostasemechanismen beeinflusst sind, ist unklar und wird weiter untersucht. 125 Die Rolle von Grb2 in der T-Zell Entwicklung Diskussion 7.8 Grb2 und T-Effektorzellen der CD4+ Population Nach der Analyse der T-Zell Entwicklung in T-Zell spezifischen Grb2-/- Mäusen wurde die Aktivierung und Differenzierung zu CD4+ T-Helferzellen/Effektorzellen untersucht. Naive CD4+ T-Zellen können sich in verschiedene Effektorzellpopulationen entwickeln, die jeweils spezifische Aufgaben in der Immunantwort übernehmen. Dieser Prozess ist sehr sensitiv für Veränderungen in der Signalleitung (Zhu et al. 2010; Rincón, Conze, et al. 2000). Aufgrund der vielfältigen Interaktionen von Grb2 mit verschiedenen Signalwegen und den schon beschriebenen Einflüssen von Grb2 auf die Signalleitung in T-Zellen (Jang et al. 2010) ist es wahrscheinlich, dass Grb2 die T-Helferzelldifferenzierung beeinflusst. Die am besten untersuchten THelferzellpopulationen sind die TH1, TH2, TH17 und iT-reg Zellen. TH1-Zellen vermitteln Immunantworten gegen intrazelluläre Pathogene (Paul & Seder 1994). TH2-Zellen vermitteln Immunantworten gegen extrazelluläre Parasiten (Zhu et al. 2010). TH17-Zellen wurden ursprünglich mit Autoimmunerkrankungen und chronischen Entzündungen in Verbindung gebracht aber vermitteln auch Antworten gegen Pilze und extrazelluläre Bakterien (Korn et al. 2009; Miossec et al. 2009). iT-regs wirken inhibierend auf die Immunantwort (DiPaolo et al. 2007). Die Differenzierung zu einer der T-Helferpopulationen kann durch viele Faktoren beeinflusst werden. Dazu gehören costimulatorische Signale, wie Zytokine, und die Stärke und Qualität des TZR Signales (Zhu et al. 2010). Um den Einfluss von Grb2 auf die Differenzierung zu verschiedenen T-Helferpopulationen zu untersuchen, wurden naive Grb2-/- CD4+ T-Zellen von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen in vitro über die Stimulation des TZRs in Kombination mit CD28 und verschiedenen Zytokinen bzw. Zytokin neutralisierenden Antikörpern zu TH1, TH2, TH17 bzw. iT-reg Zellen differenziert. Naive Grb2-/- T-Zellen aus Grb2fl/fl Lckcretg Mäusen differenzierten vermehrt zu TH2 und TH17 Zellen, während die Differenzierung zu T-reg Zellen gestört war. In naiven Grb2-/- TZellen aus Grb2fl/fl CD4cretg Mäusen war nur die Differenzierung zu TH17 Zellen leicht erhöht. In doppelt positiven T-Zellen des Thymus verstärkt Grb2 die Signalleitung über den TZR, in dem es die Aktivierung von Tyrosinkinasen fördert (Jang et al. 2010). Die Calciumsignalleitung in Grb2fl/fl Lckcretg T-Zellen war allerdings eher unverändert. Wenn Grb2 fehlt ist also die Signalleitung über den TZR beeinträchtigt und eine schwächere Signalleitung über den TZR führt eher zu einer TH2 Antwort als zu einer TH1 Antwort (Zhu et al. 2010). Die in der Literatur beschriebene schwächere Signalleitung über den TZR passt also zu einem erhöhten Differenzierungspotential naiver Grb2fl/fl Lckcretg T-Zellen. Das Differenzierungspotential von naiven Grb2fl/fl CD4cretg T-Zellen ist allerdings unverändert. Dies kann mit dem genetischen Hintergrund der Mäuse zusammenhängen, da BALB/c Mäuse stärker zu einer TH2 Antwort neigen als C57BL/6 Tiere (Launois et al. 1997; Güler et al. 1996; Guéry et al. 1997) und die Grb2fl/fl Lckcretg Mäuse einen gemischten BALB/c / C57BL/6 haben, während die Grb2fl/fl 126 Grb2 und T-Effektorzellen der CD4+ Population Diskussion CD4cretg Mäuse 10 Generationen auf den C57BL/6 zurückgekreuzt wurden. Alternativ können auch die Unterschiede in der T-Zell Entwicklung der Grb2 in der Grb2fl/fl Lckcretg Maus und der Grb2fl/fl CD4cretg Maus für die unterschiedliche Kapazität von naiven Grb2fl/fl Lckcretg T-Zellen und naiven Grb2fl/fl CD4cretg T-Zellen verantwortlich sein, zu T-Effektorzellen zu differenzieren. Damit führt die Grb2 Defizienz in vitro unter bestimmten Bedingungen zu einer erhöhten Differenzierung naiver T-Zellen zu TH2 Zellen. Die stärkere in vitro Differenzierung zu TH17 Zellen und die schwächere Differenzierung zu iT-regs von naiven Grb2fl/fl Lckcretg T-Zellen legen eine erhöhte IL-6 Signalleitung nahe, da IL-6 in Kombination mit TGFβ die Entwicklung naiver T-Zellen zu TH17 Zelle einleiten kann, während die Stimulation mit TGFβ allein zur Differenzierung in iT-regs führt (Bettelli et al. 2006; Veldhoen et al. 2006; Zhou et al. 2007). Naive Grb2fl/fl CD4cretg T-Zellen differenzieren wie naiven Grb2fl/fl Lckcretg T-Zellen besser zu TH17 Zellen aber ihr Differenzierungspotential zu iT-regs ist nicht verändert. Dies legt nahe, dass Veränderungen in der IL-6 Signalleitung nicht allein für das veränderte Differenzierungspotential verantwortlich sind. Die Grb2 Defizient verstärkt also die Differenzierung zu TH17 Zellen in vitro und inhibiert unter bestimmten Bedingungen die Differenzierung zu iT-reg Zellen. Das Fehlen von Grb2 in vitro erhöht das Differenzierungspotential zu TH2, TH17 T-Helferzellen, die Immunantworten fördern, während es die Generierung von iT-reg Zellen hemmt, die Immunantworten inhibieren. Der Effekt von Grb2 auf die Differenzierung zu T H2-Zellen könnte mit der positiven Rolle von Grb2 in der Signalleitung über den TZR zusammenhängen (Jang et al. 2010), da eine stärkere Signalleitung eher zu einer TH1 Antwort als zu einer TH2 Antwort führt (Zhu et al. 2010). Die beeinträchtigte Signalleitung in T-Zell spezifischen Grb2 defizienten TZellen führt zu einer geringeren Aktivierung von P38 und JNK. Aktiviertes von P38 und aktiviertes JNK2 fördern TH1 Antworten, während aktiviertes JNK1 die TH2 Antwort hemmt (Rincón, Conze, et al. 2000; Rincón, Flavell, et al. 2000), was zu einer erhöhten Differenzierung naiver Grb2-/- T-Zellen zu TH2-Zellen passen würde. Allerdings hat Grb2 in vitro keinen Einfluss auf die TH1-Zell Differenzierung. Insgesamt war nur die Differenzierung zu TH17-Zellen durch Grb2 unabhängig vom genetischen Hintergund bzw. der frühen T-Zell Entwicklung moderat inhibiert. Da in vitro Differenzierungsversuche aufgrund der vielen Faktoren, die die T-Zelldifferenzierung beeinflussen physiologisch nur begrenzt aussagekräftig sind wurden die T-Helferzellpopulationen der naiven Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäuse ex vivo durchflusszytometrisch analysiert. Während in der Grb2fl/fl Lckcretg Maus tendenziell mehr TH1, TH2, TH17 und iT-reg Zellen vorhanden waren, waren in der Grb2fl/fl CD4cretg Maus nur die TH1 Zellen erhöht. Die gesteigerte Zahl an T-Effektorzellen passt zu einem höheren Anteil aktivierter CD4+ T-Zellen und einer verringerten Zahl naiver CD4+ T-Zellen in den Milzen von Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen. Die genauen Mechanismen, die dazu führen, dass in den T-Zell spezifischen 127 Grb2 und T-Effektorzellen der CD4+ Population Diskussion Grb2-/- Mäusen mehr TH1-Zellen vorhanden sind, obwohl die Differenzierung aus naiven T-Zellen zu TH1-Zellen in vitro unverändert ist sind unklar. Die Unterschiede zwischen den Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen können an dem unterschiedlichen Deletionszeitpunkt von Grb2 in der T-Zell Entwicklung, dem genetischen Hintergrund der Mäuse (BALB/c / C57BL/6 bzw. C57BL/6) oder dem weitgehend leeren T-Zell Kompartiment in Grb2fl/fl Lckcretg Mäusen gegenüber dem nur geringfügig beeinträchtigten T-Zell Kompartiment in Grb2fl/fl CD4cretg Mäusen liegen. Allerdings müssen die Ergebnisse mit der Grb2fl/fl Lckcretg Maus noch durch weitere Versuche bestätigt werden. Zusammenfassend haben naive Grb2fl/fl CD4cretg Mäuse mehr TH1 Zellen. Insgesamt differenzieren naive Grb2-/- T-Zellen in vitro verstärkt zu T-Effektorzellen. Passend dazu haben naive T-Zell spezifische Grb2-/- Mäuse mehr T-Effektorzellen. 128 Grb2 und T-Effektorzellen der CD4+ Population Diskussion 7.9 Die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell Die Untersuchung von T-Helferzellen in naiven Mäusen spiegelt nicht wieder, wie Grb2 die THelferzellen in einer Immunreaktion beeinflusst. Aufgrund der erhöhten Differenzierung zu TH17 Zellen aus naiven Grb2-/- T-Zellen in vitro und der erhöhten Zahl an TH1 Zellen in naiven T-Zell spezifischen Grb2-/- Mäusen wurde die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell (EAE) untersucht, in dem TH17 und die TH1 Zellen je nach Art der Krankheitsinduktion entscheidend für die Entwicklung der Krankheit sind (Tigno-Aranjuez et al. 2009; Batoulis et al. 2010). Es wurde ein sowohl TH17- als auch TH1-Zell abhängiges Modell gewählt. Für das Modell wurden Grb2fl/fl CD4cretg Mäuse verwendet, weil sie einen C57BL/6 Hintergrund haben, der für die Induktion der EAE wichtig ist (Rangachari & Kuchroo 2013) und die Zahl der T-Zellen zusätzlich nicht so stark reduziert ist wie in Grb2fl/fl Lckcretg Mäusen, was die Immunantworten vergleichbarer mit den Kontrolltieren macht. Die EAE wurde induziert und der Krankheitsverlauf bis Tag 28 nach der Induktion der EAE anhand eines klinischen Bewertungssystems untersucht. Die Grb2fl/fl CD4cretg Mäuse wiesen einen schwächeren Krankheitsverlauf auf. Die EAE war ab Tag 9, einem der ersten Tage an dem Krankheitssymptome auftraten, tendenziell schwächer. Von Tag 13 bis Tag 19 um den Höhepunkt der Krankheit war dieser Unterschied signifikant. Anschließend wurden die Symptome in den Kontrolltieren schwächer und die Symptome zwischen Grb2fl/fl CD4cretg Mäusen und Kontrolltieren waren ähnlich. An Tag 27 und 28 schwächte sich die Krankheit in Grb2fl/fl CD4cretg Mäusen gegenüber den Kontrolltieren erneut leicht ab. Aufgrund der erhöhten in vitro T-Zell Differenzierung naiver Grb2-/- T-Zellen zu TH17 Zellen und der höheren Zahl an TH1 Zellen in naiven Mäusen war dieser Verlauf unerwartet. Allerdings sind die T-Zellzahlen in der Peripherie von Grb2fl/fl CD4cretg Mäusen um etwa ein Drittel reduziert und die naiven T-Zellen aus denen sich die T-Helferzellen differenzieren sind besonders betroffen. Die T-Zellen der Milz von Grb2fl/fl CD4cretg Mäusen wurden an Tag 17 und Tag 30 der EAE durchflusszytometrisch untersucht, um herauszufinden, ob es während des Krankheitsverlaufes Unterschiede in der Größe der Zellpopulationen ergaben. Interessanterweise waren die Gesamtzellzahlen der CD4+ und der CD8+ T-Zellen, so wie ihre Aktivierung (CD69+) sowohl an Tag 17 als auch an Tag 30 unverändert, während sie in naiven Grb2fl/fl CD4cretg Mäusen um etwa ein Drittel reduziert waren. Dies kann zwei Gründe haben. Entweder gleichen sich die TZellzahlen bedingt durch die EAE während der Krankheit an oder die T-Zellzahlen naiver Grb2fl/fl CD4cretg Mäuse gleichen sich im Alter unabhängig von der EAE an. Für die Bestimmung der TZellpopulationen naiver Grb2fl/fl CD4cretg Mäuse wurden Tiere im Alter von 8 Wochen verwendet, während die Tiere für das EAE Modell bei der Induktion der Krankheit etwa 12 129 Die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell Diskussion Wochen alt waren. An Tag 17 nach der Induktion war die Zahl der naiven T-Zellen in den Grb2fl/fl CD4cretg Mäusen reduziert, glich sich aber bis an Tag 30 nach der Induktion an die Zahl in den Kontrolltieren an. Die reduzierte Zahl naiver T-Zellen kann zu einem milderen EAE-Verlauf in CD4cretg Mäusen beitragen, da sich die TH17 und die TH1 Zellen, die die Krankheit auslösen (Tigno-Aranjuez et al. 2009; Batoulis et al. 2010) aus den naiven T-Zellen entwickeln (Zhu et al. 2010). Die Zahlen der zentralen CD4+ und der CD8+ T-Gedächtniszellen und der Effektor CD4+ T-Gedächtniszellen waren nicht verändert, während die Zahl der CD8+ Effektor TGedächtniszellen leicht erhöht war. Ob dies physiologisch relevant ist, ist unklar und könnte durch ein EAE Modell mit wiederkehrenden EAE Schüben untersucht werden (Stromnes & Goverman 2006). Die ausgeglichenen Gesamtzellzahlen der T-Zellen in der EAE machen es unwahrscheinlich, dass die reduzierte Zahl an T-Zellen in T-Zell spezifischen Grb2-/- Mäusen einen großen Einfluss auf die EAE hat. Allerdings kann die reduzierte Zahl naiver T-Zellen in TZell spezifischen Grb2-/- Mäusen zu einer schwächeren EAE führen. Zudem ist die TZR Signalleitung in Grb2-/- T Zellen beeinträchtigt (Jang et al. 2010) und die Stärke und Qualität des TZR Signales sind entscheidend für die T-Zell Differenzierung (Zhu et al. 2010). Interessanterweise war die Zahl der B220+ CD138+ B-Zellen in den Grb2fl/fl CD4cretg Mäusen in der EAE erhöht. Diese Zellen exprimierten weniger CD69 und waren somit weniger stark aktiviert. Kürzlich wurde beschrieben, dass CD138+ B-Zellen durch die Produktion von IL-35 inhibierend auf die EAE wirken können (Shen et al. 2014). Ob die höhere Zahl an B220+ CD138+ B-Zellen in T-Zell spezifischen Grb2-/- Mäusen während der Krankheit inhibierend auf die EAE wirkt muss noch untersucht werden. Weil sowohl die proinflammatorischen TH17 und TH1 Zellen als auch die inhibierenden T-reg Zellen die EAE beeinflussen, wurden diese im Verlauf der Krankheit untersucht. CD4+ T-Zellen der Milz wurden an Tag 17 der EAE aufgereinigt und in vitro mit MOG-Peptid oder PMA und Ionomycin stimuliert bzw. unstimuliert inkubiert. Der Anteil der TH17, TH1 und T-reg Zellen an den ausgesäten Zellen wurde bestimmt. Es waren keine Unterschiede bei den unstimulierten oder den MOG-Peptid stimulierten TH17 und TH1 Grb2fl/fl CD4cretg T-Zellen gegenüber den Kontrollen feststellbar. Nach der unspezifischen Stimulation mit PMA und Ionomycin waren mehr TH17, TH1 Grb2fl/fl CD4cretg T-Zellen vorhanden. Damit ist der schwächere Verlauf der EAE in Grb2fl/fl CD4cretg Mäusen zum Höhepunkt der Krankheit nicht mit einer niedrigeren Zahl an TH17 und TH1 Grb2fl/fl CD4cretg T-Zellen in der Milz verbunden. Allerdings wird die klassische EAE vor allem durch eine Demeyelierung von Nervenzellen im Rückenmark und im Gehirn ausgelöst (Stromnes & Goverman 2006) und die erwartete Zahl an Effektorzellen in der Milz ist an Tag 17 der EAE noch gering. An Tag 30 der EAE wurde aber festgestellt, dass T-Zell spezifische Grb2-/Mäuse weniger TH17 und TH1 Zellen in der Milz aufweisen (Daten Elisabeth Zinser AG Steinkasserer nicht gezeigt). Die Zahl der Grb2fl/fl CD4cretg T-reg Zellen war an Tag 17 der EAE 130 Die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell Diskussion bei den unstimulierten oder den MOG-Peptid stimulierten T-Zellen erhöht, während es keinen Unterschied bei den mit PMA und Ionomycin stimulierten Zellen gab. T-Zell spezifische Grb2-/Mäuse haben also in der Milz während der EAE weniger TH17 und TH1 Zellen, während mehr Treg Zellen gebildet werden, was zu einem milderen EAE-Verlauf passt. Dazu passend zeigen TZell spezifische Grb2-/- Mäuse an Tag 17 der EAE im Rückenmark und im Gehirn weniger CD45+ Infiltrate (Daten Elisabeth Zinser AG Steinkasserer nicht gezeigt), die an der Demyelierung der Nervenzellen beteiligt sind (Sobel & Kuchroo 1992; McCombe et al. 1992; Schiffenbauer et al. 1998). An Tag 30 der EAE wurden analog zu Tag 17 Gesamtmilzzellen ausgesät, stimuliert und die Menge der sekretierten Zytokine bestimmt. Die Grb2fl/fl CD4cretg T-Zellen produzierten generell weniger Zytokine als die Kontrollzellen. Die Menge des von T H17 Zellen produzierten proinflammatorischen IL-17A war im Überstand von Grb2fl/fl CD4cretg T-Zellen reduziert. Außerdem waren IL-2 und TNFα erhöht. Diese werden besonders von TH1-Zellen produziert und tragen zur TH1-Zell Differenzierung bei (Zhu et al. 2010; O’Garra & Arai 2000). IFNγ, das ein wichtiger Faktor für TH1-Zellen ist, war signifikant verändert. Das inhibitorisch wirkende IL-10, das von T-reg Zellen produziert wird und IL-4, das zur TH2-Antwort beiträgt, sowie IL-6, das an der Differenzierung zu TH17-Zellen beteiligt ist, waren nicht signifikant verändert (Zhu et al. 2010; O’Garra & Arai 2000; Rangachari & Kuchroo 2013). Grb2 fördert also in der EAE die Produktion von prolinflammatorischen Zytokinen, die die TH17 und TH1 Antwort verstärken. Interessanterweise ist die Menge an RNA, die für IL-6 kodiert im Gehirn von T-Zell spezifischen Grb2-/- Mäusen niedriger (Daten Elisabeth Zinser AG Steinkasserer nicht gezeigt). IL-6 wird mit der Balance zwischen TH17 und T-reg Zellen in Verbindung gebracht. Weniger IL-6 führt zur Differenzierung von weniger TH17 Zellen aber mehr T-reg Zellen und schwächt so die EAE ab (Rangachari & Kuchroo 2013). Durch geringere IL-6 Produktion in T-Zell spezifischen Grb2-/Mäusen könnte also das Verhältnis der Differenzierung von TH17 und T-reg Zellen zu Gunsten der T-reg Zellen verschoben werden, was zu einer milderen EAE beitragen würde. Proliferationsversuche mit Gesamtmilzzellen aus T-Zell spezifischen Grb2-/- Mäusen mit EAE, in denen die Proliferation nach IL-2 oder MOG Restimulation gegenüber Kontrollzellen verringert ist, deuten darauf hin, dass Grb2 zur Aktivierung der T-Helferzellen über den TZR und spezifische costimulatorische Wege beiträgt (Daten Elisabeth Zinser AG Steinkasserer nicht gezeigt). Dazu würde auch passen, dass die Signalleitung in Grb2-/- T-Zellen des Thymus beeinträchtigt ist (Jang et al. 2010). Um zu überprüfen, ob der Einfluss von Grb2 auf die Stimulation über den TZR in Kombination mit costimulatorischen Signalen einen Effekt auf die Aktivierbarkeit von T-Zellen hat wurden CD4+ Grb2fl/fl CD4cretg T-Zellen aus dem C57BL/6 Hintergrund in vitro in einem allogenen gemischten Lymphozytenversuch mit dendritischen 131 Die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell Diskussion Zellen aus BALB/c Mäusen gemischt. Dabei binden T-Zellen mit ihrem TZR an allogene MHCIIKomplexe der dendritischen Zellen und werden von diesen ähnlich wie in einer normalen Immunreaktion aktiviert (Sherman & Chattopadhyay 1993; Archbold et al. 2008; D’Orsogna et al. 2012; D’Orsogna et al. 2013). CD4+ Grb2fl/fl CD4cretg T-Zellen proliferieren weniger als Kontrollzellen im gemischten Lymphozytenversuch und sind somit schlechter durch dendritische Zellen aktivierbar. Grb2 in T-Zellen ist also wichtig für die Aktivierung von T-Zellen durch dendritische Zellen. Die beeinträchtigte Aktivierung der Grb2-/- T-Zellen könnte auch die Induktion der EAE hemmen, da die EAE in Grb2fl/fl CD4cretg Mäusen von Beginn an schwächer ausfällt. Allerdings wird Grb2 in Grb2fl/fl CD4cretg Mäusen auch in CD4+ dendritischen Zellen deletiert. Darum wurde die Fähigkeit von dendritischen Zellen, die aus Grb2fl/fl CD4cretg Knochenmarkszellen generiert wurden getestet allogene T-Zellen zu aktivieren. Die Fähigkeit von Grb2fl/fl CD4cretg Knochenmarkszellen allogene T-Zellen zu aktivieren war nicht verändert. Damit hängt die schwächere Induktion der EAE in Grb2fl/fl CD4cretg Mäusen nicht von einer beeinträchtigten Fähigkeit der dendritischen Zellen ab T-Zellen zu aktivieren. Ein Problem bei der Untersuchung von EAE in Grb2fl/fl CD4cretg Mäusen ist die reduzierte Zahl der T-Zellen in naiven Grb2fl/fl CD4cretg Tieren. Eine reduzierte Zahl an T-Zellen kann unabhängig von der Funktion von Grb2 in der T-Zelle zu einer schwächeren EAE führen. Da für die in vitro Versuche gleiche Zellzahlen an Grb2fl/fl CD4cretg und Kontrollzellen eingesetzt wurden und sich die Zahl der T-Zellen zwischen den Grb2fl/fl CD4cretg Mäusen und den Kontrollen an den untersuchten Zeitpunkten der EAE nicht unterschied, sollte das Problem in den in vitro Versuchen nicht auftreten. Allerdings könnte eine reduzierte Zahl an T-Zellen bei der Induktion der Krankheit die Entwicklung der Krankheit und die T-Helferzellpopulationen beeinflussen. Darum sollen passive EAE Transferversuche (Stromnes & Goverman 2006) mit gleichen Zellzahlen von MOG spezifischen Grb2fl/fl CD4cretg T-Zellen und entsprechenden Kontrollzellen helfen den intrinsischen Effekt von Grb2 auf die Entwicklung der EAE besser zu verstehen. Zusammengefasst entwickeln sich in der EAE von T-Zell spezifischen Grb2-/- Mäusen weniger TH1 und TH17 Zellen aber mehr T-reg Zellen. Mechanistisch könnte eine schwächere IL-6 Produktion in T-Zell spezifischen Grb2-/- Mäusen das Verhältnis der Differenzierung von TH17 und T-reg Zellen zu Gunsten der antiinflammatorischen T-reg Zellen beeinflussen, was zu einem schwächeren EAE-Verlauf in T-Zell spezifischen Grb2-/- Mäusen führen würde. Außerdem ist Grb2 in T-Zellen bei der Induktion der EAE wichtig, da es bei der Aktivierung der T-Zellen durch antigenpräsentierende Zellen eine entscheidende Rolle spielt. 132 Die Rolle von Grb2 im autoimmunen Enzephalomyelitis Modell Material 8 Material 8.1 Antikörper Abkürzungen für die Tiere aus denen die Antikörper stammen: H = armenischer Hamster; HS = syrischer Hamster; R = Kaninchen; M = Maus; Ra = Ratte. 8.1.1 Antikörper Durchflusszytometrie und Streptavidinkonjugate Bezeichnung Spezies, Isotyp, Klon Verdünnung anti-BAFFR-FITC R, IgG1 κ, eBio7H22-E16 1:200 anti-CD11b-FITC R, IgG2b κ, M1/70 1:200 anti-CD138-PE R, IgG2a κ, 281-2 1:200 anti-CD16/CD32 (Fc-Block) IgG, 2.4G2 1:100 anti-CD16/CD32-bio R, IgG2b κ, 2.4G2 1:100 anti-CD19-PE Ra, IgG2a κ, 1D3 1:400 anti-CD21-bio R, IgG2a κ, 7E9 1:1000 anti-CD23-PE R, IgG2a κ, B3B4 1:200 anti-CD24-FITC (HSA) R, IgG2c κ, 30-F1 1:600 anti-CD25-bio R IgG1λ, PC61.5 1:500 anti-CD25-PE R IgG1λ, PC61.5 1:100 anti-CD335 (NKp46)-FITC Ra, IgG2a κ, 29A1.4 1:400 anti-CD44-APC R, IgG2b κ, IM7 1:100 anti-CD45R/B220-APC R, IgG2a κ, RA3-6B2 1:200 anti-CD45R/B220-FITC R, IgG2a κ, RA3-6B2 1:100 anti-CD45R/B220-PE-cy5.5 R, IgG2a κ, RA3-6B2 1:200 anti-CD4-PE R, IgG2a κ, GK1.5 1:50 anti-CD5-APC R, IgG2a κ, 53-7.3 1:200 anti-CD62L-bio R, IgG2a κ, MEL-14 1:100 anti-CD69-bio H, IgG, H1.2F3 1:200 anti-CD8a -FITC R, IgG2a κ, 53-6.7 1:50 anti-CD95/Fas-PE H, IgG2, λ2, Jo2 1:200 anti-GL7-Alexa647 R, IgM,GL7 1:100 anti-Gr-1-FITC R, IgG2b κ, RB6-8C5 1:200 anti-IgDa-bio M, IgG2a, AMS15.1.5 1:100 anti-IgDb-FITC M, IgG1, AF6 122.2.5 1:25 anti-IgD-bio anti-IgG1- FITC anti-IgG2a- FITC anti-IgG2b- FITC anti-IgM-PE Anti-MHC Class I (H-2Kb)-APC Anti-MHC Class I (H-2Kd)-bio anti-NK1.1-PE anti-TCRβ-bio anti-TCRγδ-FITC R, IgG2a κ, 11.26C-1 Ra, IgG1 κ, A85-1 Ra, IgG1 κ, R19-15 Ra, IgG2a κ, R12-3 R, IgG2a κ, II/41 M, IgG2a, AF6-88.5.5.3 M, IgG2a κ, SF1-1.1 M, IgG2a, PK-136 H, IgG, H57-597 M, IgG1 κ, B1 1:200 1:250 1:250 1:250 1:100 1:200 1:800 1:100 1:100 1:100 Hersteller eBioscience eBioscience BD Biosciences Eigenes Hybridom Becton Dickinson eBioscience Eigenes Hybridom Becton Dickinson eBioscience eBioscience eBioscience eBioscience eBioscience eBioscience eBioscience eBioscience Becton Dickinson eBioscience eBioscience eBioscience eBioscience Becton Dickinson eBioscience Becton Dickinson von AG Winkler erhalten von AG Winkler erhalten Eigenes Hybridom Becton Dickinson Becton Dickinson Becton Dickinson eBioscience eBioscience Becton Dickinson eBioscience eBioscience Becton Dickinson 133 Antikörper Material gB-Cy5 NIP-APC 1:100 bis 1:400 1:600 NIP-PE 1:800 Streptavidin -PE-cy5.5 Streptavidin-PerCP-cy5.5 1:200 1:200 AG Winkler Geschenk Mark Shlomchik Geschenk Mark Shlomchik eBioscience eBioscience Tab. 2: Antikörper Durchflusszytometrie und Streptavidinkonjugate 8.1.2 Antikörper ELISA Bezeichnung Anti- IgG AP/UNLB Anti- IgG1 AP/UNLB Anti- IgG2a AP/UNLB Anti- IgG2b AP/UNLB Anti- IgG2c AP/UNLB Anti- IgM AP/UNLB Spezies, Isotyp, Klon G, polyclonal, x G, polyclonal, x G, polyclonal, x G, polyclonal, x G, polyclonal, x G, polyclonal, x Verdünnung/Konzentration 1:1000 1:1000 1:1000 1:1000 1:1000 1:1000 Hersteller Southern Biotech Southern Biotech Southern Biotech Southern Biotech Southern Biotech Southern Biotech Tab. 3: Antikörper ELISA 8.1.3 Antikörper für magnetische Zellseperation / komplement vermittelte Lyse Bezeichnung Spezies, Isotyp, Hersteller Klon Für Magnetische Zell-Sortierung anti-CD90.2 Micro Beads rat, IgG2b, x Miltenyi anti-CD19 Micro Beads rat, IgG2a, x Miltenyi Tab. 4: Antikörper für magnetische Zellseperation Bezeichnung Anti-CD4 Anti-CD8 Anti-CD90 (Thy1) Spezies, Isotyp, Klon IgM, RL174.2 IgM, 3168.1 IgM, AT83 Verdünnung/Konzentration Hersteller 500 μl/Milz 500 μl/Milz 500 μl/Milz Eigenes Hybridom Eigenes Hybridom Eigenes Hybridom Tab. 5: Antikörper für komplement vermittelte Depletion 8.1.4 Antikörper Western-Blot Bezeichnung Spezies, Isotyp, Klon anti-Grb2 M, IgG1 kappa, 3F2 HRP linked Ziege-anti-Maus G, Polyklonal, x IgG (H+L) Verdünnung/Konzentration Hersteller 1:500 Upstate Biotechnology 1:5000 Bio-Rad Tab. 6: Antikörper Western-Blot 8.2 Chemikalien und Labormaterial Substanzen/Produkte 1 x DPBS steril 2-Mercaptoethanol Hersteller Gibco Gibco 134 Chemikalien und Labormaterial Material Acrylamid-Bisacrylamid (29:1) (RotiphoreseR Gel 40) Roth Alum AMP (2-Amino-2-methyl-1-propanol) APS (Amoniumperoxodisulfat) BCIP (5-Brom-4-chlor-3-Indoxylphosphat) BD TruCOUNT Tubes BSA (bovine serum albumin) DAPI Diethanolamin DMSO dNTP Mix 1mM dsDNA (D 4522) ECL Westernblotting Detektionsreagenz 1 u. 2 EDTA Dinatrium Salz FCS Formaldehyd 4 % w/v Gelatin GeneRuler 100 bp DNA Ladder Glycerol Horse Serum ImmuGloTM ANA HEp-2 Cells IFA Objektträger Serva Roth Sigma Roth Becton Dickinson Roth Sigma Roth Roth Fermentas Sigma Amersham Applichem PAN Medite Sigma Thermo Scientific Roth Sigma Euroimmun Indo-1 Ionomycin LD Säulen L-Glutamin 200 mM Low Tox rabbit complement LS Säulen Magermilchpulver MaxiSorp 96-Well ELISA Platten Invitrogen Sigma Miltenyi Biotec Gibco Cedarlane Miltenyi Biotec Roth NUNC, ThermoScientific Becton Dickinson Sigma-Genosys Calbiochem Gibco Gibco Pall Corporation / Hartenstein Biosearch Technologies Microtainer® Röhrchen mit FloTop Collector MOG 35-55 Mowiol Natriumpyruvat Nicht essenzielle Aminosäuren (100 x NEAA) Nitrocellulose Membran NP-PE4,15 bzw. 17 PageRulerTM Prestained Protein Ladder Plus Pluronic® F-127 PMA (Phorbol Myristate Acetate) p-Nitrophenylphosphat-disodium hexahydrat Poly-L-Lysine Propidiumiodid (PI) 50ug/ml Proteinase K Fermentas, ThermoScientific Invitrogen Sigma Sigma Sigma Sigma Roche 135 Chemikalien und Labormaterial Material QiaShredder Röntgenfilm RX Roti®-Load 1 RPMI 1640- Medium Schafs Erythrocyten in Alseverlösung steril (31100100) SDS Supertaq-polymerase Supertaq-polymerase buffer TEMED Thymidin [3H] TissueTek® O.C.T. TritonX-100 Trypanblau Tween® 20 Tab. 7: Chemikalien und Labormaterialien 8.3 Computerprogramme Computerprogramm AxioVision CellQuest DACSDiva FlowJo GraphPad Prism v4.03 ImageJ SoftMax Pro v3.0 Stratagene MxPro QPCR Hersteller Zeiss Becton Dickinson Becton Dickinson Treestar GraphPad Software Rasband, W.S., U. S. National Institutes of Health Molecular Device Stratagene Tab. 8: Computerprogramme 8.4 Geräte Bezeichnung 5415C Zentrifuge 5415R Zentrifuge Cryostat CM 1900 Durchflusszytometer FACSCalibur Durchflusszytometer LSR II ELISA-reader VersaMaxPlus Fluoreszenz-Mikroskop Axioscope A1 Megafuge1.0R Mx3000P QPCR System Nanodrop PCR Maschine Primus 96 Plus PCR-Maschine Professional Trio Hersteller Eppendorf Eppendorf Leica Becton Dickinson Becton Dickinson Molecular Devices Zeiss Heraeus Stratagene Thermo Scientific MWG Biotech Biometra 136 Computerprogramme Qiagen Fuji Roth Gibco Fiebig-Nährstofftechnik Sigma HAT Biotechnology HAT Biotechnology Serva Biomedicals Hartenstein Sigma Gibco Roth Material TE Mighty SmallTM Tank Transfer Unit Zellsortiergerät FACSAria II Zellsortiergerät MoFlo Hoefer Becton Dickinson Beckman Coulter Tab. 9: Geräte 8.5 Kommerzielle Kits Name Amersham ECL Western Blotting Detection Reagents BD Cytofix/Cytoperm Fixation/ Permeabilization Solution Kit with BD GolgiPlug BRILLIANT II SYBR® GREEN QRT-PCR MASTER MIX WITH ROX, 1-STEP CD4+ CD62L+ T cell isolation Kit II Hersteller GE Healthcare Becton Dickinson Stratagene Miltenyi CD4+ T cell isolation Kit II Miltenyi Rneasy mini kit SuperScriptTM III RNase H-Reverse Transcriptase α-Maus/Ratte Foxp3 staining set APC Qiagen Invitrogen eBioscience Tab. 10: Kommerzielle Kits 8.6 Lösungen, Medien und Puffer Bezeichnung Stammlösung Menge Anmerkung AMP Substratpuffer 9,58 (v/v) % AMP 0,74 mM MgCl2 x 6H2O 0,01 % (v/v) TritonX-100 pH 10,25 mit Hcl einstellen H2O (entionisiert) 9,58 ml 0,015 g 10 µl ad 100 ml Brij-Lysepuffer 100 mM Tris (pH 7,5) 70 mM NaCl 5 mM EDTA 1 % (v/v) Brij 1M Tris, pH7,5 5M NaCl 0,5M EDTA H2O (entionisiert) 10 ml 1,4 ml 1 ml 1 ml wird ab 56 °C flüssig ad 100 ml DAPI-Lösung für intrazelluläre Färbung 10 µg/ml 4,6-Diamino-2-Phenylindol 100 μg 0,1 % (v/v) TritonX 1 x PBS 10 µl ad 10 ml in H2O lösen DAPI-Lösung für Untersch. vital/apoptotisch 137 Kommerzielle Kits Material 0,05 µg/ml 4,6-Diamino-2-Phenylindol 10 µg/ml DAPI 1 x PBS 50 µl in H2O lösen ad 10 ml Diethanolaminpuffer 0,5 mM MgCl2 x 6H2O 0,02 % (w/v) Natriumazid 10 % NaN3 0,1 g 2 ml 9,7 % (v/v) Diethanolamin pH 9,8 mit HCl einstellen 97 ml H2O (entionisiert) ad 1 l ca. 10-15 ml 38 % HCLSäure 10 x Elektrophoresepuffer 250 mM Tris 1.92 M Glycin 1 % (w/v) SDS H2O (entionisiert) 30,3 g 144,13 g 10 g ad 1 l ELISA Blockierlösung 1% (w/v) BSA 1 x PBS 1g ad 100 ml ELISA Kopplungspuffer gB und VLP 15 mM Na2Co3 1,59 g/l 35 mM NaHCO3 2,94 g/l pH 9,6 einstellen H2O (entionisiert) ad 1 l ELISA Substratpuffer 1 mg/ml pNitrophenylphosphat 1 M Diethanolaminpuffer 20 mg ad 20 ml 1 Tablette ELISA Verdünnungspuffer 0,1 % (w/v) BSA 0,05 % w/v Natriumazid (optional) 10 % NaN3 1 x PBS 0,1 g 0,5 ml ad 100 ml ELISPOT Substratpuffer (AMP-Puffer mit BCIP) frisch ansetzen 1mg/ml BCIP AMP Substratpuffer 100 mg 100 ml FACS Puffer 138 Lösungen, Medien und Puffer Material 1 x PBS 0,1 % w/v BSA 0,01 % w/v Natriumazid 10 % NaN3 500 ml 0,5 g 0,5 ml Gey's Lösung - für tonische Erythrozytenlyse Stammlösung A 654 mM NH4Cl 35 g 25 mM KCl 8,4 mM Na2HPO4 1,85 g 1,5 g 0,88 mM KH2PO4 0,12 g 28 mM Glucose H2O (entionisiert) 5g ad 1 l sterilfiltrieren Stammlösung B 20,7 mM MgCl2 x 6 H2O 1,05 g 5,7 mM MgSO4 x 7 H2O 0,35 g 30,8 mM CaCl2 0,85 g H2O (entionisiert) ad 250 ml autoklavieren Stammlösung C 267,8 mM NaHCO3 H2O (entionisiert) 5,625 g ad 250 ml sterilfiltrieren Gey's Lösung - aus Stammlösungen Lösung A Lösung B Lösung C H2O (entionisiert) 200 ml 50 ml 50 ml ad 1 l Krebs-Ringer Lösung 10mM HEPES (pH 7) 140mM NaCl 4mM KCl 1mM 1mM MgCl2 1mM 1mM CaCl2 10mM Glucose in H2O (entionisiert) 6x DNA-Ladepuffer 30 % (v/v) Glycin 0,25 % Xylencyanol 0,25 % Bromphenolblau in H2O (entionisiert) Lysepuffer 139 Lösungen, Medien und Puffer Material 10 mmol/l TRIS pH 7,8 5 mM EDTA 0,2 % SDS 20 mM NaCl MACS-Puffer 0,5 % (v/v) PAN FCS (hitzeinktiviert) 2 mM EDTA (0,5M, steril) 1 x PBS 2,5 ml 2 ml 500 ml Mowiol Glycerol (w/v) Mowiol H2O (entionisiert) 6g 2,4 g 6 ml 2 h bei Raumtemperatur rühren lassen 200 mM Tris, pH 8,5 10 min 55 °C inkubieren 15 min bei 5000 g zentrifugieren Überstand aliquotieren und wegfrieren 12 ml 1x PBS 137 mM NaCl 2,7 mM KCl 8 mM Na2HPO4 1,76 mM KH2PO4 pH 7,4 mit HCl einstellen H2O (entionisiert) 8 g NaCl 0,2 g KCl 1,15 g 0,24 g ad 1 l 10 x Transferpuffer 250 mM Tris 1,92 M Glycin H2O (entionisiert) 30,3 g 144,13 g ad 1 l 1 x Transferpuffer 10 x Transferpuffer Methanol H2O (entionisiert) 100 ml 200 ml ad 1 l RPMI+ RPMI 1640-Medium (Gibco) 5 % (v/v) PAN FCS (hitzeinktiviert) 1,2 mM L-Glutamin 1 mM Natriumpyruvat 1 x NEAA (nicht essentielle Aminosäuren) 10.000 U/ml Penicillin/Streptomycin 140 Lösungen, Medien und Puffer 500 ml 25 ml 3 ml 5 ml 5 ml 5 ml Material 50 µM 2-Mercaptoethanol 0,5 ml RPMI10+ RPMI 1640-Medium (Gibco) 10 % (v/v) PAN FCS (hitzeinktiviert) 1,2 mM L-Glutamin 1 mM Natriumpyruvat 1 x NEAA (nicht essentielle Aminosäuren) 10.000 U/ml Penicillin/Streptomycin 50 µM 2-Mercaptoethanol 500 ml 50 ml 3 ml 5 ml 5 ml 5 ml 0,5 ml Western-Blot Blockierlösung 5% (w/v) Magermilchpulver 0,05 % (v/v) Tween 20 1 x PBS 5g 50 μl ad 100 ml Zellpuffer / Sortierpuffer 2 % (v/v) PAN FCS (hitzeinktiviert) 2 mM EDTA (0,5M) 1 x PBS 10 ml 2 ml 500 ml Tab. 11: Lösungen, Medien und Puffer 8.7 Stimulanzien / Antigene / Immunisierungszusätze Stimulanzien/Antigene /Immunisierungszusät ze anti-CD28 anti-CD3ε anti-Hamster-IgG Spezies, Isotyp, Klon HS, IgG2 λ, 37.51 H, IgG1 κ, 145-2C11 x,x,H-1643 anti-IgM Ra, IgG1 κ, XMG1.2 G,x,x anti-IgM (Fab2) G,x,x anti-Mouse IgM R,x,x anti-NK1.1 AK M, IgG2a, PK136 H, IgG, H57597 mouse recombinant, x, x anti-IFNγ anti-TCR beta BAFF CGG CpG (ODN 1826) Verdünnung/ Konzentratio n 1,3 µg/ml Reaktivität Hersteller CD28 eBioscience 1 µg/ml CD3 eBioscience variiert armenischer Hamster IgG IFNγ Sigma 5 µg/ml variiert eBioscience IgM B-Zell Rezeptor variiert IgM B-Zell Rezeptor variiert IgM B-Zell Rezeptor 0,8-1 mg/Maus NK1.1 Jackson Dianova 1:50 eBioscience variiert variiert variiert T-Zell Rezeptor β BAFFRezeptor, TACI, APRIL TLR9 Jackson Dianova Jackson Dianova BioXcell ENZO Life Sciences Jackson Dianova InvivoGen 141 Stimulanzien / Antigene / Immunisierungszusätze Material gB Ionomycin LPS Streptomyces conglobatus, x, x E. coli O55, x, x variiert variiert AG Winkler Sigma 10 µg/ml TLR4 Mycobacterium Tubercolosis (H37Ra) NP-CGG 10 µg/ml NP-KLH variiert Pertussis Toxin R848 VLPs (hCMV Densebodies) 200 µl/Maus variiert variiert variiert TLR7 Tab. 12: Stimulanzien / Antigene / Immunisierungszusätze 8.8 Zytokine Zytokin Rekombinante murine IL-12 Rekombinante murine IL-6 Rekombinante humane IL-2 Rekombinante humane TGFβ1 Rekombinante murine IL-4 Stammlösung 2 µg/ml 10 µg/ml 10000 U/ml 2 µg/ml Hersteller Peprotech Peprotech Peprotech Peprotech 10µg/ml Becton Dickinson Tab. 13: Zytokine 142 Zytokine Calbiochem Difco/BD Bioscience Biosearch Technologies Biosearch Technologies List/Quadratech InvivoGen AG Winkler Methoden 9 Methoden 9.1 Aufarbeitung muriner Zellen und durchflusszytometrische Analyse 9.1.1 Zentrifugation Sofern nicht anders angegeben wurden die Zellen bei Zentrifugationsschritten mit 1300 Umdrehungen pro Minute für 5 min bei 4°C zentrifugiert (Megafuge1.0R) und der Überstand anschließend verworfen. 9.1.2 Organentname und Aufbereitung von murinen Zellen Die Mäuse wurden durch Inhalation von CO2 getötet und zeitnah untersucht. Zellen aus dem Peritoneum wurden durch Ausspülen gewonnen. Dazu wurden mit einer Spritze 5 ml PBS mit 2 % FCS und 2 mM EDTA in den peritonealen Raum gespritzt. Die Zellen wurden durch Drücken auf das Peritoneum gelöst und dann mit einer Spritze abgesaugt. Blut wurde gewonnen, indem der Brustraum eröffnet und das Herz angeschnitten wurde. Dann wurde das Blut mit einer 1ml Spritze ohne Nadel aus dem Brustraum gesaugt. Knochenmarkszellen wurden gewonnen, indem Femur und gegebenenfalls Tibia entnommen, äußerlich von Geweberückständen gereinigt, an beiden Seiten an der Gelenkkapsel eröffnet und anschließend mit einer Spritze (0,45 mm Kanüle) und 5 ml PBS mit 2 % FCS und 2 mM EDTA aus dem Knochen gespült wurden. Thymus, Milz, Lymphknoten und Lunge wurden entnommen und mit dem Stempel einer Spritze durch ein 70 µM Nylonsieb gedrückt, um eine Einzelzellsuspension zu erhalten. Wenn nicht anders angegeben wurden die Zellen nach der Entnahme möglichst auf Eis gehalten. Zellen aus Milz, Lymphknoten, Knochenmark, Lunge, Blut wurden einer tonischen Lyse (Geys Lösung) unterzogen. Dazu wurden die Zellen abzentrifugiert, in 5 ml Geys Lösung aufgenommen und 5 min auf Eis inkubiert, abzentrifugiert und in 5 ml PBS mit 2 % FCS und 2 mM EDTA aufgenommen. 9.1.3 Bestimmung der Gesamtzellzahl mit einer Neubauer Zählkammer Zellen wurden entsprechend ihrer Zahl mit Trypanblau verdünnt (Standard 1:10) und 10 µl der Verdünnung wurden in eine Neubauer Zählkammer pipettiert und unter dem Mikroskop ausgezählt. Trypanblau kann in Zellen mit beschädigter Membran eindringen und färbt diese blau. So können lebende und apoptotische/tote Zellen unterschieden werden. Kennt man den Anteil einer bestimmten Subpopulation in der Zellsuspension z.B. durch durchflusszytometrische Analysen kann deren Gesamtzellzahl ebenfalls berechnet werden. Berechnung der Gesamtzellzahl: 143 Aufarbeitung muriner Zellen und durchflusszytometrische Analyse Methoden Ø Zellen aus 4 Großquadraten x Verdünnungsfaktor x 104 (Kammerfaktor) = Zellzahl/ml Zellzahl/ml x Gesamtvolumen der Zellsuspension in ml = Gesamtzellzahl Gesamtzellzahl x (Anteil einer Subpopulation in % / 100) = Gesamtzellzahl der Subpopulation 9.1.4 Durchflusszytometrische Messungen 1x106 bis 5x106 Zellen einer Zellsuspension wurden in ein 5 ml Röhrchen überführt und abzentrifugiert. Die Zellen wurden in 20 µl Färbelösung aufgenommen und für 20 min bei 4°C inkubiert, abzentrifugiert und bis zur Messung in FACS-Puffer aufgenommen und dunkel gelagert. Die Färbelösung enthielt fluochromgekoppelte Antikörper (FITC, PE, APC, PE-Cy5.5, PE-Cy5.5, Cy5) oder andere fluochromgekoppelte Konjugate. Es wurden auch Biotin-gekoppelte Antikörper verwendet. Biotin wurde nach dem ersten Inkubationsschritt in einem zweiten Färbeschritt an Streptavidin an das ein Fluochrom gekoppelt war gebunden (20 µl Färbelösung aufgenommen und für 15 min bei 4°C). In FACS Puffer aufgenommene Proben wurden durchflusszytometrisch analysiert und mit FlowJo (Treestar) oder CellQuest (BD) analysiert. Zum verhindern von unspezifischen Färbungen enthielten die Färbelösungen 2.4G2 Antikörper (1:100), der an FC-Rezeptoren bindet. Ausgenommen sind Versuche, bei denen die Wirkung des FcγR2b untersucht werden sollte. Für T-Zell-Färbungen wurde vor dem ersten Färbeschritt ein zusätzlicher Blockierschritt durchgeführt (10% Ziegenserum in Zellpuffer, 10-20 min, 4 °C). Berechnungen der Gesamtzellzahl von Subpopulationen beziehen sich auf den Anteil der Population in einem „Forward/Sideward Scatter“ basierten Lebendgate. 9.1.5 Durchflusszytometrische Bestimmung der Lebend/Gesamtzellzahl mit Partikeln und Propidiumiodid Zellen in Einzelsuspension können mit einer definierten Zahl an Partikeln (BD TrueCount Beads) gemischt werden, die im Durchflusszytometer von Zellen und anderen Messpunkten unterscheidbar sind. Weil die Zahl an Partikeln pro Volumen bekannt ist, kann berechnet werden, wie viele Zellen sich pro gemessenem Partikel in der Probe befinden. Bezieht man diesen Wert auf das Gesamtvolumen der Zellsuspension hat man die Gesamtzellzahl. BD TrueCount Beads sind sehr klein, darum kann es nötig sein den Schwellenwert für Events, die das Durchflusszytometer aufnehmen soll zu verändern (Forward Scatter). Am ersten Tag der Messung wurde eine Beadlösung für alle Messzeitpunkte in einem 50 ml Falcon angesetzt. Dazu wurden ca. 15 Beads/µl in Zellpuffer aufgenommen. Zum messen wurden die ausgesäten Zellen geerntet und ohne Zentrifugationsschritt in ein 5 ml Röhrchen übertagen. Dann wurde dasselbe Volumen an Beadsuspension in das 5 ml Röhrchen übertragen. 5 min vor der Messung kann Propidiumiodidlösung 50 µg/ml im Verhältnis 1:20 zu den Zellen gegeben werden. Propidiumiodid kann für die Unterscheidung von vitalen und apoptotischen Zellen im Durchflusszytometer genutzt werden. Alternativ kann auch DAPI verwendet werden, das auch 144 Aufarbeitung muriner Zellen und durchflusszytometrische Analyse Methoden apoptotische Zellen färbt. Es dringt in Zellen mit beschädigter Membran ein, interkaliert mit der DNA und färbt so beschädigte Zellen. 9.1.6 Messung der Calciummobilisierung nach Rezeptorstimulation in Lymphozyten Für 1x107 Zellen wurden 700 µl RPMI mit 5 % FCS zugegeben und resuspendiert. Bei mehr Zellen wurden die Mengen entsprechend angepasst. Es wurden 7 µl Indo1-Mix zugegeben und bei 30°C für 25 min inkubiert. Indo1 Mix besteht aus 7,4% Pluronic F127 (Molecular Probes) und 0,1 µg/µl Indo-1 in DMSO. Dann wurden 700 µl RPMI mit 10 % FCS zupipettiert und die Zellen wurden weitere 10 min bei 37 °C inkubiert. Nach der Beladung wurden die Zellen abzentrifugiert und exrtazellulär gefärbt. Anschließend wurden die Zellen zwei Mal mit KrebsRinger-Lösung gewaschen und auf Eis gelagert. Für die Messung wurden die Zellen 1:10 mit vorgewärmter Krebs-Ringer-Lösung versetzt (37 °C) und für 1 min bei 37 °C im Wasserbad inkubiert, bevor sie am LSR II gemessen und das Calcium-Signal mit FlowJo ausgewertet wurde. Bei der Messung wurde zuerst der Calcium-Grundlevel bestimmt, bevor die Zellen stimuliert wurden. Die Stärke des Calciumsignales wird über das Verhältnis von Calcium gebundenen Indo1 zu Indo1 bestimmt. Die Bindung von Calcium verändert das Emissionsmaximum von Indo1 von 475 nm zu 400 nm. Die Verschiebung des Emissionsmaximums kann am LSRII über einen UV-Laser gemessen werden. B-Zellen wurden direkt mit unterschiedlichen Konzentrationen Ziege oder Kaninchen IgG anti-IgM oder IgG anti-IgM (Fab2) stimuliert. Der inhibitorische Effekt des FcγR2b auf das Calciumsignal kann gemessen werden, in dem er über den IgG Fc-Teil des anti-IgM Antikörpers an den B-Zell Rezeptor rekrutiert wird. Dies geschieht nicht, wenn mit anti-IgM (Fab2) stimuliert wird. Der Fc-Teil des Kaninchen-Antikörpers ist in der Lage den FcγR2b stärker zu aktivieren als der Ziegen-Antikörper. T-Zellen wurden in zwei Schritten stimuliert. Zu dem extrazellulären Färbeschritt wurde ein armenischer Hamster antiMaus-TCRβ 1:50 Antikörper zugegeben (H57-597), der an den T-Zell Rezeptor β bindet. Der Calciumflux wurde während der Messung durch die Kreuzvernetzung des anti-TCRβ Antikörpers durch einen anti-Hamster-IgG Antikörper (H-1643) ausgelöst. Ionomycin wurde verwendet, um die Indo1-Beladung der Lymphozyten zu überprüfen. 9.2 Aufreinigung von B- und T-Zellen 9.2.1 Zellsortierung über magnetische Partikel (MACS) Bei diesem Verfahren werden Antikörper eingesetzt, an die magnetisierbare Partikel gebunden sind. Binden diese Antikörper an Zellen können die Zellen in einem magnetischen Feld zurückgehalten werden. Zellen an die keine Antikörper mit magnetisierbaren Partikeln gebunden können das magnetische Feld passieren. 9.2.1.1 Aufreinigung naiver CD62L+CD4+ T-Zellen 145 Aufreinigung von B- und T-Zellen Methoden Die Aufreinigung erfolgte mit dem kommerziellen CD4+ CD62L+ T cell isolation Kit II (Miltenyi). Negativer Selektionsschritt: Weil die Erythrozyten über Antikörper gegen Ter-119 depletiert werden ist keine Erythrozytenlyse notwendig. Die Milz- Lymphknotenzellen wurden für 10 min bei 1400 rpm abzentrifugiert und der Überstand verworfen. Pro 1x108 bis 1,5x108 Zellen wurden 400 µl MACS-Puffer mit 100 µl CD4+ T-Zell Biotin-Antikörpermix gemischt. Die Milzzellen wurden in der Antikörperlösung resuspendiert und 10 min im Kühlschrank inkubiert. Nach der Inkubationszeit wurden pro Milz 300 µl MACS-Puffer versetzt mit 200 µl anti-Biotin „MicroBeads“ zugegeben. Die Zellen wurden weitere 15 min im Kühlschrank inkubiert. Es folgte ein Waschschritt mit 10 ml MACS Puffer. Die Zellen wurden für 10 min bei 1400 rpm abzentrifugiert und der Überstand verworfen. Dann wurde das Pellet in 3ml MACS Puffer gelöst und auf eine mit 3 ml MACS Puffer äquilibrierte LS-Säule gegeben, die sich in einem magnetischen Feld befand. Die Säule wurde zwei Mal mit je 3ml MACS Puffer gewaschen. Der Durchfluss wurde optional auf eine zweite mit 3ml MACS Puffer äquilibrierte LS-Säule gegeben, die mit 3 ml MACS Puffer gewaschen wurde, um die Reinheit zu erhöhen. Durch diesen Schritt wurden CD8a+, CD25+, CD45R+, CD49b+, TCRγδ + und Ter-119+ Zellen depletiert. Es wird mit den Zellen aus dem Durchfluss weiter gearbeitet. Anstelle von MACS-Puffer kann Zellpuffer verwendet werden. Positiver Selektionsschritt: Die Zellen im Durchfluss wurden für 10min bei 1400 rpm abzentrifugiert und der Überstand verworfen. Es wurden pro Probe 800 µl MACS-Puffer mit 200 µl anti-CD62L „MicroBeads“ gemischt. Die Milzzellen wurden in der Antikörperlösung resuspendiert und 15min im Kühlschrank inkubiert. Es folgte ein Waschschritt mit 10 ml MACS Puffer. Die Zellen wurden für 10 min bei 1400 rpm abzentrifugiert und der Überstand verworfen. Dann wurde das Pellet in 3 ml MACS Puffer gelöst und auf eine mit 3 ml MACS Puffer äquilibrierte LS-Säule gegeben, die sich in einem magnetischen Feld befand. Die Säule wurde zwei Mal mit je 6 ml MACS Puffer gewaschen. Die Säule wurde aus dem magnetischen Feld entfernt und in ein frisches 15 ml Röhrchen überführt. Es wurden 5 ml MACS Puffer mit dem beiliegenden Spritzenstempel durch die Säule gedrückt. Dadurch werden die vormals durch das Magnetfeld an die Säule gebundenen CD62L+ Zellen von der Säule gewaschen. Die aufgereinigten Zellen wurden durchflusszytometrisch auf ihre Reinheit überprüft. Dazu wurde die Expression von CD5 und CD4 untersucht. Anstelle von MACS-Puffer kann Zellpuffer verwendet werden. 9.2.1.2 Aufreinigung von CD4+ T-Zellen Die Aufreinigung erfolgte mit dem kommerziellen CD4+ T cell isolation Kit II (Miltenyi). 146 Aufreinigung von B- und T-Zellen Methoden Bei der Aufreinigung handelt es sich um einen negativen Selektionsschritt wie in 9.2.1.1 beschrieben. Allerdings wurde der CD4+ T-Zell Biotin-Antikörpermix aus dem CD4+ T cell isolation Kit II verwendet, der sich leicht von dem genauso benannten Mix aus dem CD4+ CD62L+ T cell isolation Kit II unterscheidet. Es werden CD8a+, CD11b+, CD11c+, CD19+, CD45R (B220)+, CD49b (DX5)+, CD105+, Anti-MHC class II+, und Ter-119+ Zellen depletiert. 9.2.1.3 T-Zell Depletion zur B-Zell Anreicherung Milzzellen wurden mit 10ml MACS-Puffer gewaschen. Die Bindung der Partikel-gebundenen Antikörper wurde in einem Volumen von 200µl MACS-Puffer mit 20µl anti-CD90.2 (Thy1) Partikel-gebundenen Antikörpern (Miltenyi) pro 50 mio Zellen durchgeführt (LD-Säulen Miltenyi benutzt). Die Lösung enthielt zusätzlich 2.4G2 Fc-Block (1:100). Die Inkubationszeit betrug 10min bei 4 °C (nicht auf Eis, sondern im Kühlschrank). Die Zellen wurden mit 5ml MACSPuffer gewaschen. Parallel wurde pro Probe eine LD-Säule mit 2ml MACS-Puffer equilibriert.Die Zellen wurden in 1000µl MACS-Puffer aufgenommen und in einem Magnetfeld auf die LD-Säule geben. Die Säule 3x mit MACS-Puffer nachspülen. Die mit Partikel-gebundenen Antikörpern gelabelten Zellen verbleiben in der Säule. Im Durchfluss befinden sich die angereicherten BZellen. 9.2.1.4 Positive B-Zell Aufreinigung Bei der Aufreinigung handelt es sich um einen positiven Selektionsschritt wie in 9.2.1.1 beschrieben. Allerdings wurden statt der anti-CD62L Beads pro Milz 60 µl anti-CD19 Beads in MACS-Puffer für die Färbung verwendet. 9.2.2 Komplement-vermittelte T-Zelllyse zur B-Zell Anreicherung Aufgereinigte Zellen einer Milz wurden in 1 ml RPMI5+ resuspendiert. Dazu wurden je 500 µl Hybridomüberstände mit IgM-anti-CD4 (Klon: RL 174,2), IgM-anti-CD8 (3168.1) und IgM-antiThy1 (CD90) (Klon: AT83A) pipettiert. Die Zellen wurden für 30 min bei 4 °C inkubiert und anschließend mit 5 ml RPMI5+ gewaschen. Die Zellen wurden in 3 ml Mausmedium aufgenommen zu dem 0,33 ml Kaninchen-Komplement in H2O pipettiert wurde. Das Komplement muss mit 1 ml kaltem Wasser frisch angesetzt werden. Es folgt eine Inkubation für 45 min bei 37 °C unter leichtem Schwenken. In dieser Zeit tötet das Komplementsystem die mit IgM-Antikörpern markierten Zellen. Anschließend wurden die Zellen mit 5 ml Mausmedium gewaschen. 147 Aufreinigung von B- und T-Zellen Methoden 9.3 Untersuchungen zur Apoptose, Proliferation und Differenzierung von BZellen 9.3.1 In vitro B-Zell Reifung B-Zellen der Milz wurden über anti-CD90.2 (Thy1) Partikel-gebundenen Antikörper (Miltenyi) wie in 9.2.1.3 beschrieben angereichert. Die Zellen wurden auf B220 (RA3-6B2), HSA (M1/69), CD21 (E79) und CD23 (B3B4) gefärbt. Es wurden durchflusszytometrisch (BD FACSAria II) T2 B-Zellen (B220+HSAhighCD21highCD23+) und reife B-Zellen (B220+HSAlowCD21int) separiert (Abb. 12). Um die Zellen zu schonen wurden sie in Röhrchen mit 1 ml PBS mit 2 % FCS und 2 mM EDTA sortiert, das einen Tag vorher vorgelegt wurde. Unspezifische Bindestellen werden so abgesättigt und die Zellen haften weniger am Plastik. Es kann nötig sein die Zellen zwei Mal zu sortieren, um die Reinheit zu erhöhen. Für die Sortierung wurden nur DAPI-negative Zellen berücksichtigt. Bis zu 2x105 Zellen wurden für 48 h mit oder ohne Stimulantien bei 37 °C and 5 % CO2 im Brutschrank inkubiert. Die Zellen wurden entweder mit anti-IgM (Fab2) (10 µg/ml), anti-IgM (Fab2) (10 µg/ml) und BAFF (Blys) (0.2 µg/ml) oder LPS (1 µg/ml) stimuliert oder nicht stimuliert. Der Anteil der T1, T2 und reifen B-Zellen nach der Stimulation wurde durchflusszytometrisch bestimmt. Ausgesäte reife B-Zellen dienten als Referenz für die Gates. 9.3.2 Messung der spontanen Apoptoserate in vitro mittels DAPI-Färbung Milzzellen wurden durch eine komplement-vermittelte T-Zelllyse, wie in 9.2.2 beschrieben angereichert. 1x105 bis 2x105 Zellen pro Well (96 Well Flachbodenplatte) wurden für verschiedene Zeiträume in RPMI5+ bei 37 °C und 5 % CO2 kultiviert. Dann wurden die Zellen extrazellulär auf B220 (RA3-6B2) und HSA (M1/69) angefärbt und anschließend für 10 min mit 1ml 2% Paraformaldehyd in PBS für 10 min fixiert. Die Zellen können in FACS-Puffer gelagert werden. Nach Abschluss der Stimulation wurden die Zellen aller Zeitpunkte gleichzeitig über Nacht in 1ml 70 % Methanol in PBS permeabilisiert. Es folgte ein 30 min Färbeschritt in 500 µl DAPI-Lösung bei RT. Dabei dringt DAPI in die permeabilisierten Zellen ein und interkaliert mit der DNA. Dann wurden die Zellen zwei Mal mit je 1 ml FACS-Puffer gewaschen und wurden zum messen (LSRII) in FACS-Puffer aufgenommen. Apoptotische Zellen verlieren nach der Permeabilisierung einen fragmentierten Teil ihrer DNA, weshalb sie einen geringeren DNAGehalt aufweisen als vitale Zellen in der G1-Phase und im subG1 Bereich als definierte Fraktion gemessen werden können. Zur Auswertung wurde das Programm FlowJo (Treestar) verwendet. 9.3.3 Toll Like Rezeptor (TLR) Stimulation und 3H-Tritiumthymidin Proliferationsassay Durchflusszytometrisch sortierte unreife (B220low HSAhigh) und reife B-Zellen (B220high HSAlow) wurden jeweils für 48 h bei 37 °C und 5 % CO2 mit R848 (TLR7 Ligand) oder CPG-ODN 1826 (TLR9 Ligand) in 0,2 ml RPMI5+ stimuliert. Für die letzten 12 h wurde 1µCi/Well 3HTritiumthymidin zu den Zellen gegeben. Nach der Inkubation wurde 148 Untersuchungen zur Apoptose, Proliferation und Differenzierung von B-Zellen der 3 H- Methoden Tritiumthymidineinbau am Szintillationszähler detektiert (Berthold-Inotech Trace-96 - Berthold, Wildbad, Germany). Die Zahl der gemessenen Ereignisse pro Minute (cpm) ist direkt proportional zum 3H-Tritiumthymidineinbau in die Zellen. Dieser ist ein Maß für die Proliferation. 9.4 Untersuchungen zur Apoptose, Proliferation und Differenzierung von TZellen 9.4.1 T-Zell Proliferationsassay Milzzellen aus Mäusen mit experimenteller autoimmuner Enzephalomyelitis wurden in RPMI10+ mit 0 µM, 0,002 µM, 0,02 µM, 0,2 µM, 2 µM, bzw. 20 µM MOG-Peptid für 72 h bei 37 °C und 5 % CO2 restimuliert. Für die letzten 16 h wurde 1µCi/Well 3H-Tritiumthymidin zu den Zellen gegeben. Nach der Inkubation wurden die Zellen mit einem IH-110 Zellernter (Innotech) geerntet und der 3H-Tritiumthymidineinbau am Szintillationszähler (1450 Microplate Counter von Wallac) detektiert. Die Zahl der gemessenen Ereignisse pro Minute (cpm) ist direkt proportional zum 3HTritiumthymidineinbau in die Zellen. Dieser ist ein Maß für die Proliferation. 9.4.2 Allogener gemischter Lymphozytenversuch Die Aktivierbarkeit von T-Zellen durch dendritische Zellen oder die Aktivierungskapazität von dendritischen Zellen gegenüber T-Zellen kann im allogenen gemischten Lymphozytenversuch untersucht werden. CD4+ T-Zellen wurden aus Milzen wie in 9.2.1.2 beschrieben über magnetische Seperation aufgereinigt. dendritische Zellen wurden aus Knochenmarkszellen von BALB/c Mäusen durch GM-CSF Zugabe generiert (von AG Steinkasserer). Dazu wurden Knochenmarkszellen in einer Dichte von 2x106/10 ml in RPMI10+ ausgesät und mit dem 1:10 verdünnten GM-CSF haltigen Überstand von einer Zelllinie, die mit dem murinem GM-CSF Gen transfiziert war behandelt. Nach 10 Tagen Reifung in denen die dendritischen Zellen reifen wurden sie mit T-Zellen gemischt und ausplattiert. Je 4x106 CD4+ T-Zellen aus 10 Generationen auf den C57BL/6 Hintergrund zurückgekreuzten Grb2fl/fl CD4cretg Mäusen wurden mit verschiedenen Zahlen von dendritischen Zellen in RPMI10+ gemischt und für 72 h in einer 96 Well Rundbodenplatte inkubiert. Für die letzten 16 h wurde 1µCi/Well 3H Tritiumthymidin zugegeben. Das in die Zellen eingebaute Proliferation der Zellen zu Knochenmarkszellen von Grb2 fl/fl messen. 3 H Tritiumthymidin wurde gemessen, um die Alternativ wurden dendritische Zellen tg aus 6 CD4cre Mäusen und Kontrolltieren generiert. Je 4x10 T- Zellen aus BALB/c Mäusen wurden mit verschiedenen Zahlen von dendritischen Zellen gemischt und für 72 h inkubiert und dann wie oben beschrieben mit 3H Tritiumthymidin behandelt. 149 Untersuchungen zur Apoptose, Proliferation und Differenzierung von T-Zellen Methoden 9.5 Genexpressionsanalysen und Polymerase Kettenreaktion 9.5.1 Realtime PCR – B-Zell Subpopulationen B-Zellen der Milz wurden über anti-CD90.2 (Thy1) Partikel-gebundenen Antikörper (Miltenyi) wie in 9.2.1.3 beschrieben angereichert. Die Zellen wurden auf B220 (RA3-6B2), HSA (M1/69), CD21 (E79) und CD23 (B3B4) gefärbt. Es wurden durchflusszytometrisch (BD FACSAria II) T1 B-Zellen (B220+HSAhighCD21low), T2 B-Zellen (B220+HSAhighCD21highCD23+) und reife B-Zellen (B220+HSAlowCD21int) separiert (Abb. 12). Es kann nötig sein die Zellen zwei Mal zu sortieren, um die Reinheit zu erhöhen. Für die Sortierung wurden nur DAPI-negative Zellen berücksichtigt. Bis zu 1x106 sortierte Zellen pro Well wurden in einer Konzentration von 1x106 Zellen/ml in RPMI5+ ausgesät und für 3 h mit 10 µg/ml anti-IgM (Fab2) oder ohne Stimulation stimuliert (37°C, 5% CO2). Für die Inkubation wurden je nach Zellzahl unterschiedlich große Zellkulturplatten mit flachem Boden verwendet. Nach der Inkubation wurde die RNA aus den Zellen isoliert, wie in 9.5.3 beschrieben und in cDNA umgeschrieben, wie in 9.5.4 beschrieben. Für die Realtime PCR wurde ein kommerzielles Kit verwendet (BRILLIANT II SYBR® GREEN QRT-PCR MASTER MIX WITH ROX, 1-STEP Stratagene). 150 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden Ansatz (1x 25 µl) - 12,5 µl Mastermix (als erstes rein) - 5 µl - 0,375 ref Dye (vorher 1:500 in H2O vorverdünnt) - 5,13µl Nuklease freies H2O - 2µl Primer (beide Primer im Stock je 1pmol/µl) cDNA-Template Die PCR wurde in einer Stratagene MX3000P PCR-Maschine (AG Slany) mit folgendem Programm durchgeführt: 1 Zyklus 95 °C 10 min Denaturierung 95 °C 15 s Denaturierung 60 °C 30 s Anlagerung 72 °C 30 s Verlängerung 95 °C 30 s Denaturierung 67 °C 30 s Anlagerung 95 °C 30 s Denaturierung 45 Zyklen 1 Zyklus SYBR® Green I interkaliert mit doppelsträngiger DNA und bildet einen fluoreszierenden Komplex mit ihr. Ist es nicht an doppelsträngige DNA gebunden fluoresziert es kaum. Auf diese Weise kann über die Fluoreszenz die Menge an doppelsträngiger DNA in verschiedenen Zeiten einer PCR in Echtzeit bestimmt werden. Der Schwellenwert ab dem die Fluoreszenz einer Probe signifikant über der Hintergrundfluoreszenz liegt wird CT-Wert genannt. Der CT-Wert wird in der exponentiellen Phase der PCR gemessen. Um die Messgenauigkeit zu steigern wurden pro Probe Duplikate gemessen. Von dem CT-Wert der zu untersuchenden Probe wurde der CT-Wert eines Referenzgenes abgezogen, um den ΔCT-Wert zu erhalten. Aktin wurde als Referenzgen gewählt. Geht man davon aus, dass sich die DNA Menge pro Zyklus in der exponentiellen Phase verdoppelt, kann man die relative Expression eines Genes durch 2-ΔCT berechnen. Eine Probe wurde als Kalibrator bestimmt zu dem Änderungen relativ angegeben werden. Für die Messung und Auswertung wurden die MxPro QPCR Software und Excel benutzt. 151 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden 9.5.2 RNA Isolierung mit Trizol und Chloroform Trizol enthält Phenol. Darum wurde mit Handschuhen unter dem Abzug gearbeitet. Bis zu 5x10 6 Zellen wurden in 0,5 ml Trizol resuspendiert. Es wurden 100 µl Chlorophorm dazu pipettiert. Die Proben wurden 2-3 min bei RT inkubiert. Dann wurden die Proben mit 13000 rpm für 10 min bei 4 °C abzentrifugiert. Die obere Phase wurde vorsichtig abgenommen und in ein 1,5 ml Reaktionsgefäß überführt. Dazu wurden 250 µl Isopropanol gegeben und gut vermischt. Es folgte eine weitere Inkubation für 10 min bei RT. Dann wurden die Proben mit 13000 rpm für 10 min bei 4 °C abzentrifugiert. Die Zellen wurden mit 75 % Ethanol in entionisiertem H2O gewaschen. Es folgte ein Zentrifugationsschritt mit 13000 rpm für 10 min bei 4 °C. Der Überstand wurde verworfen und das Pellet wurde luftgetrocknet, bevor es in 25 µl DEPC-H2O aufgenommen wurde. Die RNA-Menge wurde mit einer Nanodrop-Messung bestimmt. Die RNA kann bei -80°C gelagert werden. 9.5.3 RNA Isolierung über Säulen Zur RNA-Isolierung wurde ein kommerzielles Kit verwendet (“Rneasy mini kit” Qiagen). Für die Isolierung von RNA wurde möglichst steril und mit Handschuhen gearbeitet. Die Zellen wurden in 1,5 ml Reaktionsgefäße überführt und 5 min bei 4000 rpm abzentrifugiert. Das Medium wurde komplett abgenommen. Bei weniger als 5 mio Zellen wurden diese in 350µl RLTPuffer aufgenommen. Bis zu 10mio Zellen wurden in 600µl RLT Puffer resuspendiert. Der RLTPuffer enthielt 10 µl 2-Mercaptoethanol pro ml. Die Proben wurden gevortext. Die Lysate wurden in QiaShredder-Säulchen überführt und 2 min bei 13000 rpm abzentrifugiert. An dieser Stelle besteht die Möglichkeit die Lysate bei -80°C einzufrieren. Es wurde ein Mal das Volumen des Lysates in Form von 70% Alkohol zugeben. Davon wurden bis zu 700µl in eine RNeasy MiniSpin-Säule gegeben, die sich in einem 1,5 ml Reaktionsgefäß befindet und 15 s bei 10.000 rpm abzentrifugiert. Die Flüssigkeit aus dem 1,5 ml Reaktionsgefäß wurde verworfen. Bei einem zu großen Volumen kann der Schritt mit derselben Säule wiederholt werden. Es wurden 700µl RW Waschpuffer auf die Säule pipettiert und 15 s bei 10.000 rpm abzentrifugiert. Die Flüssigkeit aus dem 1,5 ml Reaktionsgefäß wurde verworfen. Dann wurden 500µl RPE-Lösung auf die Säule gegeben und 2 min bei 10.000 rpm zentrifugiert. Die Säule wurde in ein frisches 2ml Reaktionsgefäß überführt und 2 min bei 10.000 rpm trocken zentrifugiert. Die Säule wurde in ein frisches 1,5 ml Reaktionsgefäß überführt. Es wurden mit 30 µl entionisiertes H2O auf die Säule gegeben, gefolgt von einer 1 min Zentrifugation bei 10.000 rpm, um die DNA von der Säule zu eluieren. Dieser Schritt kann wiederholt werden, um die RNA Ausbeute zu erhöhen. Die RNAMenge wurde mit einer Nanodrop-Messung bestimmt. Die RNA kann bei -80°C gelagert werden. 9.5.4 cDNA Synthese Für die cDNA Synthese aus RNA wurde eine kommerzielles Kit verwendet (SuperScriptTM III RNase H-Reverse Transcriptase Invitrogen). Es wurden wenn möglich 1-5 µg RNA eingesetzt. 152 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden Wenn nicht genug RNA vorhanden war, wurde die maximal vorhandene Menge an RNA eingesetzt. Zu der RNA wurden 1µl 500 ng oligo(dT)18 und 1µl (10 nM) DNTPs ad 13 µl RNAse freies H2O gegeben. Der Mix mit der RNA wurde für 10 min auf 65 °C erhitzt, um die Sekundärstruktur zu lösen und verbleibende Proteine zu denaturieren. Dann wurden die Proben 1 min auf Eis gekühlt. In dieser Zeit wurde pro Probe ein Mix aus 4 µl 5x „first strand buffer“, 1 µl DTT (0,1 M) und 1 µl \SuperScriptIII (200 U) möglichst ohne Blasenbildung zugegeben. Die Proben wurden für den Umschreibevorgang für 60 min bei 50 °C und anschließend 15 min bei 70 °C inkubiert (Trio Professional PCR Maschine). Die cDNA-Menge kann optional mit einer Nanodrop-Messung bestimmt werden. Die cDNA kann bei -80°C gelagert werden. 9.5.5 Detektion eines spezifischen RNA Abschnittes als Zeichen für einen Klassenwechsel zu IgG1 Mit dieser Methode wird ein spezifisches RNA Stück nachgewiesen, das beim Klassenwechsel zu IgG1 synthetisiert wird. Es wird von einem zirkulären DNA Stück trankribiert, welches beim Klassenwechsel zu IgG1 aus dem Bereich, der für die Immunglobulin schwere Kette kodiert geschnitten wird (Kinoshita et al. 2001). Milzzellen von Grb2fl/fl mb1+/+ and Grb2fl/fl mb1cre/+ Mäusen wurden für 48 h mit LPS (10 µg/ml), LPS (10 µg/ml) und IL-4 (10 ng/ml) oder ohne weitere Stimulation in 5 ml RPMI5+ inkubiert (37 °C, 5 % CO2). Die RNA der Zellen wurde aufgereinigt und in cDNA umgeschrieben (9.5.2 und 9.5.4). Dann wurde eine PCR nach dem unten angegebenen Programm durchgeführt. Cγ1 zirkuläres Transkript 1 Ansatz 50 µl Programm H2O 39,9 µl 94 °C 10x Puffer 5 µl --Block 35x wiederholen-- I-Gamma-1F 1,5 µl 94 °C 45 sek CµR 1,5 µl 50 °C 60 sek dNTPs 1 µl 72 °C 90 sek Taq-Polymerase 0,1 µl -------------------------------- Template 1µl 72 °C 5 min 15 °C unendlich Banden: zirkuläres Transkript für IgG1 408 bp Primer: I-Gamma-1F CµR 9.5.6 5' GGC CCT TCC AGA TCT TTG AG 3' (20 bp) 5' AAT GGT GCT GGG CAG GAA GT 3' (20 bp) 2 min DNA-Aufreinigung aus Ohr- und Schwanzbiopsien 153 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden Ohr- oder Schwanzbiopsien wurden in 30 µl Lysepuffer mit 1 µl Proteinase K aufgenommen und über Nacht bei 56 °C inkubiert. Die Lysate können optional bei 1 h auf 84 °C erhitzt werden, um Enzyme zu inaktivieren. Die Proben wurden 5 min bei 13000 rpm abzentrifugiert. Die DNA ist im Überstand vorhanden und kann zur Genotypisierung genutzt werden. 154 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden 9.5.7 Polymerase Kettenreaktion (PCR) Die Polymerase Kettenreaktion (PCR) ist ein Verfahren mit dem spezifische DNA-Abschnitte vervielfältigt werden können. Diese können dann wie in 9.5.8 beschrieben nach ihrer Größe aufgetrennt und detektiert werden. Unterschiedliche Fragmentgrößen oder das Fehlen bzw. Vorhandensein einer DNA-Bande können Rückschlüsse auf den Genotyp einer Maus zulassen. Für die PCR werden bis auf Ausnahmefälle mindestens zwei spezifische Primer verwendet, die jeweils den Anfang der komplementären DNA-Stränge des gewünschten PCR Produktes bilden und in umgekehrter Orientierung an komplementäre Template DNA-Einzelstränge binden können. Ausgehend von den gebundenen Primern kann eine DNA-Polymerase aus freien Nukleotiden einen Komplementärstrang zum DNA-Templatestrang synthetisieren. Das Verfahren ist Temperaturabhängig. Doppelsträngige DNA wird bei 96 °C denaturiert. Dann wird die Temperatur abhängig von der Schmelztemperatur der eingesetzten Primer gesenkt, damit sich die Primer an die nun Einzelsträngige Template DNA anlagern können. Dann wird die Temperatur so eingestellt, dass die DNA-Polymerase optimal arbeiten kann und den Templatestrang ausgehend vom Primer komplementär synthetisiert. Das doppelsträngige Produkt kann wieder denaturiert und als Template verwendet werden. Diese Schritte werden mehrmals wiederholt, um das gewünschte Produkt zu vervielfältigen. Als Template kann auch cDNA genutzt werden, um RNA Sequenzen nachzuweisen. Grb2 - LoxP überspannt eine LoxP Sequenz 1 Ansatz 50 µl Programm H2O 39,8 µl 94 °C 10x Puffer 5 µl --Block 35x wiederholen-- LoxP check in - 2S 1,5 µl 94 °C 20 sek LoxP check in - 2AS 1,5 µl 55 °C 20 sek dNTPs 1 µl 72 °C 30 sek DMSO 0,5 µl -------------------------------- Taq-Polymerase 0,2 µl 72 °C 10 min Template 0,5 µl 15 °C unendlich Primer: LoxP check in - 2S LoxP check in - 2AS 4 min Produkte: 5' CCA GCA CAC ATG TCC TGC CTT C 3' (22 bp) 5' GGT GGC TCA CAA CCA CCT ATA AC 3' (23 bp) wt 241 bp gefloxt 209 bp Aggregat wt u ko Produkt > wt 155 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden Grb2 - LoxP2 überspannt beide LoxP Sequenzen 1 Ansatz 30 µl Programm H2O 25,1 µl 94 °C 10x Puffer 3 µl --Block 35x wiederholen-- Grb2-in1S_check 0,6 µl 94 °C 30 sek LoxP check in - 2AS 0,6 µl 63 °C 30 sek dNTPs 0,6 µl 68 °C 90 sek Taq-Polymerase 0,1 µl -------------------------------- Template 0,5 µl 68 °C 5 min 15 °C unendlich Primer: 4 min Produkte: 5' TTA CAG CCT TCC TTC TGC CCT CC 3' (23 bp) 5' GGT GGC TCA CAA CCA CCT ATA AC 3' (23 bp) Grb2-in1S_check LoxP check in - 2AS wt 884 bp gefloxt 973 bp ko 298 bp Anmerkung: mb1cre ist teilweise in der Keimbahn aktiv, darum kann es sinnvoll sein zu überprüfen, ob die Deletion auf einem Allel in allen Zellen stattgefunden hat. Eine komplette Deletion auf beiden Allelen würde dazu führen, dass die Mäuse embryonal letal wären. mb1cre 1 Ansatz 50 µl Programm H2O 36,3 µl 94 °C 10x Puffer 5 µl --Block 35x wiederholen-- mb1-in1 jo 2 µl 94 °C 45 sek mb1-cre-rev 1 µl 63 °C 60 sek mb1-ex2-rev jo 1 µl 68 °C 60 sek dNTPs 1 µl -------------------------------- DMSO 2,5 µl 68 °C 10 min Taq-Polymerase 0,2 µl 15 °C unendlich Template 0,5 µl Primer: mb1-in1 jo mb1-cre-rev mb1-ex2-rev jo 10 min Produkte: 5' GTC TGG GCT AGA GCA ATC ATC TCC 3' (24 bp) 5' TCC TCA TCA CCA GGG ACA CAG C 3' (22 bp) 5' ACG CGG AGG TAA GTA CCA CAG G 3' (22 bp) wt 357 bp mb1cre-Bande 469 bp 156 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden Bcl2Transgen 1 Ansatz 30 µl Programm H2O 23,1 µl 94 °C 10x Puffer 3 µl --Block 35x wiederholen-- IMR550 1 µl 94 °C 30 sek IMR551 0,6 µl 55 °C 30 sek mBcl2-in1AS 0,6 µl 72 °C 30 sek dNTPs Super TaqPolymerase 0,6 µl -------------------------------- 0,1 µl 72 °C 1 min Template 1 µl 15 °C unendlich Primer: IMR550 IMR551 mBcl2-in1AS 4 min Produkte: 5' TGG ATC CAG GAT AAC GGA GG 3' (20 bp) 5' TGT TGA CTT CAC TTG TGG CC 3' (20 bp) 5' TGA GAG TTA CTG GAG GGA TGC 3' (21 bp) wt 304 bp Bcl2 177 bp Cγ1cre 1 Ansatz 30 µl Programm H2O 24,4 µl 94 °C 10x Puffer 3 µl --Block 33x wiederholen-- IgG1 KPN1_Fw 0,5 µl 94 °C 30 sek Cg1-cre_Fw 0,7 µl 57 °C 30 sek IgG1_Rev 0,7 µl 72 °C 60 sek dNTPs 0,6 µl -------------------------------- Taq-Polymerase 0,1 µl 72 °C 1 min Template 0,5 µl 15 °C unendlich Primer: IgG1 KPN1_Fw Cg1-cre_Fw IgG1_Rev 90 sek Produkte: 5' TGT TGG GAC AAA CGA GCA ATC 3' (21 bp) 5' GGT GGC TGG ACC AAT GTA AAT A 3' (22 bp) 5' GTC ATG GCA ATG CCA AGG TCG CTA G 3' (25 bp) wt 240 bp Cγ1cre 455 bp 157 Genexpressionsanalysen und Polymerase Kettenreaktion Methoden LckcreTran sgen 1 Ansatz 50 µl Programm H2O 38,8 µl 94 °C 10x Puffer 5 µl --Block 35x wiederholen-- oIMR 7338 1 µl 94 °C 30 sek oIMR 7339 1 µl 51,7 °C 30 sek oIMR 7394 1 µl 72 °C 60 sek oIMR 7393 1 µl -------------------------------- dNTPs 1 µl 72 °C 2 min Taq-Polymerase 0,2 µl 15 °C unendlich Template 0,5 µl Primer: oIMR 7338 (int. Pos. Kontr.) oIMR 7339 (int. Pos. Kontr.) oIMR 7393 fwd oIMR 7394 rev 3 min Produkte: 5' CTA GGC CAC AGA ATT GAA AGA TCT 3' (24 bp) 5' GTA GGT GGA AAT TCT AGC ATC ATC C3' (25 bp) 5' CCT CCT GTG AAC TTG GTG CTT GAG 3' (24 bp) 5' TGC ATC GAC CGG TAA TGC AG 3' (20 bp) wt (Kontr. in IL-2 Gen Chr. 3) 324 bp Lckcre-Transgen ca. 200 bp CD4creTransgen 1 Ansatz 50 µl Programm H2O 39,8 µl 94 °C 10x Puffer 5 µl --Block 38x wiederholen-- oIMR 7338 1 µl 94 °C 30 sek oIMR 7339 1 µl 56 °C 30 sek CD4cre fwd 1 µl 72 °C 60 sek CD4cre rev 1 µl -------------------------------- dNTPs 1 µl 72 °C 10 min Taq-Polymerase 0,2 µl 15 °C unendlich Template 1µl Produkte: wt (Kontr. In IL-2 Gen Chr. 3) 324 bp CD4cre-Transgen 288 bp Primer: oIMR 7338 (int. Pos. Kontr.) oIMR 7339 (int. Pos. Kontr.) CD4cre fwd CD4cre rev 5' CTA GGC CAC AGA ATT GAA AGA TCT 3' (24 bp) 5' GTA GGT GGA AAT TCT AGC ATC ATC C 3' (25 bp) 5' CGA TGC AAC GAG TGA TGA GG 3' (20 bp) 5' GCA TTG CTG TCA CTT GGT CGT 3' (21 bp) 158 Genexpressionsanalysen und Polymerase Kettenreaktion 3 min Methoden 9.5.8 Agarose Gelelektrophorese Agarosegele mit verschiedenen Konzentrationen wurden verwendet, um verschieden große DNAFragmente zu detektieren (Standardkonzentration: 1,5 %). Die Agarose wurde in 0,5x TNE-Puffer aufgekocht, bis die Flüssigkeit klar war. Wenn das Gel etwa handwarm war wurden 3 µl Ethidiumbromid bzw. verschiedene Ersatzstoffe zu dem Gel pipettiert. Die Gele wurden in eine Form gegossen, wo sie auspolymerisierten. Es wurden fünf Teile PCR-Produkt mit einem Teil 6x Ladepuffer gemischt und in die Geltaschen aufgetragen. Als Standard dienten DNA-Fragmente bekannter Größe. Es folgte eine Elektrophorese mit 80 V bis 130 V. Ethidiumbromid, das mit UV-Licht detektiert werden kann, interkaliert mit den DNA-Fragmenten im Gel. So kann die DNA im Gel analysiert werden. 9.6 Untersuchungen zu Autoimmunität 9.6.1 Detektion von Autoantikörpern gegen Zellkomponenten von Hep-2 Zellen Objektträger mit Schnitten von Hep-2 Zellen (Humane Epitheliomzellen Typ 2 eines Larynxkarzinoms) wurden 15 min bei RT erwärmt und dann mit 50 µl von 1:50 vorverdünntem Serum aus 50 Wochen alten Mäusen für 30 min in einer feuchten Kammer inkubiert. Als Positivkontrolle dienten Seren aus alten MLR-lpr Mäusen Mäusen, die hohe Level an antinukleären Antikörpern (ANAs) im Serum haben. Die Objektträger wurden mit 1x mit PBS gewaschen und dann für 10 min bei RT in PBS inkubiert. IgG-Antikörper, die gegen Bestandteile von Hep-2 Zellen gerichtet waren wurden über einen Alexa Fluor 488 gekoppelten Ziege antiMaus IgG (H+L) Antikörper detektiert, der 1:500 in PBS verdünnt war. Die Platten wurden 3x mit PBS gewaschen. Dann wurde ein Deckgläschen mit 100 µl Mowiol aufgebracht, das über Nacht im Dunkeln bei RT aushärtete. Die Proben wurden mit einem Fluoreszenzmikroskop untersucht. Die Intensität und Verteilung der Fluoreszenz lässt Rückschlüsse auf die Menge und die Spezifität von Autoantikörpern zu. Die Bilder wurden mit derselben Belichtungszeit und Belichtungsstärke aufgenommen, damit sie vergleichbar sind. Helligkeit und Kontrast wurden bei Bedarf für alle Bilder gleich abgeändert. 9.6.2 BUN - Harnstoff-Stickstoffgehalt im Blut Der Harnstoff-Stickstoffgehalt ist ein Maß für die Nierenkapazität. Harnstoff wird im Eiweißstoffwechsel gebildet, über die Niere gefiltert und über den Urin ausgeschieden. Bei Funktionsstörungen der Niere steigt der Harnstoffgehalt im Blut. Ein Wert von bis zu 30 mg/dl Harnstoff gilt als unauffällig. Alle Reagenzien wurden vor dem Versuch auf RT gebracht. Für den Versuch wurden 96 Well Zellkulturplatten mit flachem Boden verwendet. Es wurde 1 µl Serum zu 100 µl BUN-Enzymreagenz gegeben und für 10 min bei RT inkubiert. Als Kontrolle wurde 1 µl PBS verwendet. Als Standard diente eine Probe mit einer bekannten Konzentration von 30 mg/dl Harnstoff. Nach der Inkubation wurden 100 µl Farbreagenz zugegeben. Es folgte ein weiterer Inkubationsschritt von 10 min bei RT. Die Proben wurden im ELISA-Messgerät 159 Untersuchungen zu Autoimmunität Methoden (VersaMaxPlus) für eine Absorption von 600 nm gemessen. Der Messwert für die Negativkontrolle wurde von Standard und unbekannten Proben abgezogen. Die Konzentration für unbekannte Proben kann anhand des Standards berechnet werden: Harnstoff-Stickstoffgehalt im Blut (mg/dl) = (OD Probe / OD Standard) x 30 9.7 ELISA - Enzyme Linked Immunosorbent Assay Der ELISA (Enzym-vermittelte immunosorbent-Analyse oder Enzyme Linked Immunosorbent Assay) ist ein Verfahren mit dem man Stoffe, die an eine Platte gekoppelt sind oder Stoffe, die wiederum daran gebunden sind durch ein Farbreaktion nachweisen kann. Der Nachweis erfolgt meist über einen enzymgekoppelten Antikörper, der ein Substrat umsetzt und einen Farbumschlag herbei führt. Dieser Farbumschlag kann über die Absorption von Licht einer bestimmten Wellenlänge gemessen werden. Als Enzym wurde alkalische Phosphatase verwendet, die in Diethanolamin-Puffer gelöstes Nitrophenylphosphat zu einem gelben Farbstoff umsetzt. Dieser Farbumschlag kann über die OD bei einer Wellenlänge von 405 nm im ELISA-Reader (ELISAreader VersaMaxPlus) bestimmt werden. Es wurden Verdünnungsreihen von Proben und Standards erstellt und es wurde anhand von einer vier Parameter Gleichung eine Kurve basierend auf OD und Verdünnungsgrad für jede Probe erstellt. Über einen relativen Standard oder einen Standard mit definierten Konzentrationen lassen sich die Proben vergleichen und gegebenenfalls quantifizieren. Für die Auswertung wurde das Programm SoftMax Pro verwendet. Formel für eine logistische Kurve mit 4 Parametern: F(x) = ((A-D)/(1+((x/C)B))) + D Diese kann nach x aufgelöst werden: x = C(((A-D)/(F(x)-D))-1)(1/B) x = Konzentration, A = Untere Asymptote, B = Steigung der Kurve, C = Wendepunkt, D = Obere Asymptote 9.7.1 ELISA - Glykoprotein B / virusartige Partikel von humanem hCMV Antikörperlevel gegen Glycoprotein B (gB) aus humanem hCMV und gegen virusartige Partikel aus humanem hCMV können mittels ELISA subklassenspezifisch bestimmt werden. 96 Well Maxisorp-Platten wurden pro Well mit 50 µl ELISA Kopplungspuffer und 1 µg/ml VLPs bzw. 0,5 µg/ml gB aus humanem hCMV über Nacht bei 4 °C in einer feuchten Kammer beschichtet. Die Platten wurden 3x mit PBS gewaschen und mit 180 µl/well 5 % FCS, 0,05 % Tween20 in PBS über Nacht bei 4 °C blockiert. Die Platten wurden 3 x mit PBS gewaschen und pro Well mit 50 µl Serumverdünnungen befüllt. Seren von unterschiedlichen Zeitpunkten nach gB oder VLP 160 ELISA - Enzyme Linked Immunosorbent Assay Methoden Immunisierung wurden 1:20 in ELISA Verdünnungspuffer vorverdünnt. Ausgehend von der Vorverdünnung wurde eine 1:3 Verdünnungsreihe mit 7 Verdünnungsschritten angefertigt. Es wurde ein relativer Standard aus gepoolten Seren verwendet und wie die Proben verdünnt. Wenn nötig kann die Standardreihe auch weiter verdünnt werden, um einen größeren Bereich abzudecken. Für den Standard wurden Seren von Tagen verwendet, an denen der zu messende Antikörpertiter voraussichtlich hoch war. Die Platten wurden über Nacht bei 4 °C inkubiert und am nächsten Tag 3x mit PBS gewaschen. Anschließend wurden sie für 2 h mit alkalischer Phosphatase gekoppelten sekundären Antikörpern gegen Maus-IgM, IgG, IgG1, IgG2a oder IgG2b inkubiert (1 µg/ml in ELISA Verdünnungspuffer). Die Platten wurden 3x mit PBS gewaschen. Es wurde eine Tablette Nitrophenylphosphat pro 20 ml Diethanolamin-Puffer gelöst (1 mg/ml Nitrophenylphosphat). Davon wurden 100 µl pro Well als Substrat für die alkalischer Phosphatase auf die Platte pipettiert. Die Messung erfolgte mit einem ELISA-Reader (ELISAreader VersaMaxPlus). 9.7.2 ELISA auf 4-Hydroxy-3-nitrophenyl (NP) und CGG Antikörperlevel gegen das Hapten 4-Hydroxy-3-nitrophenyl (NP), das oft in Immunisirungen verwendet wird, können per ELISA bestimmt werden. 96 Well Maxisorp-Platten wurden pro Well mit 50 µl 10 µg/ml NP4-BSA bzw. NP17-BSA (Stock 10mg/ml) oder Huhn gamma Globulin (CGG) über Nacht bei 4 °C in einer feuchten Kammer beschichtet. Zu jedem Well wurden 180 µl Blockierlösung pipettiert und die Platten wurden über Nacht bei 4 °C inkubiert. Wenn es Probleme mit dem Hintergrundsignal gab wurden dem Blockierpuffer 2 % FCS zugefügt. Das weitere Vorgehen war prinzipiell wie in 9.7.1 beschrieben. Als Sekundärer Antikörper wurden ein anti-IgG und ein anti-IgG2c Antikörper verwendet. Über das Verhältnis der NP4- zur NP17spezifischen Immunantwort gegen NP lassen sich Rückschlüsse auf die Affinitätsreifung der BZellen ziehen. 9.7.3 ELISA auf dsDNA Autoantikörper gegen Doppelstrang DNA können mit einem ELISA gemessen werden. 96 Well Maxisorp-Platten wurden pro Well mit 50 µl 0,01 % w/v poly-L-Lysin in H2O 2 h bei Raumtemperatur vorbeschichtet. Die Platten wurden 3x mit H2O gewaschen und die Flüssigkeit wurde durch Klopfen möglichst komplett entfernt. Die Platten wurden pro Well mit 100 µl 20ug/ml dsDNA (aus Kalbsthymus) in H2O oder TE-Puffer über Nacht bei 4 °C beschichtet. Die Platten wurden 3x mit PBS gewaschen. Blockiert wurde für 1 h bei 37 °C oder über Nacht bei 4 °C mit 2 % BSA in PBS. Die Platten wurden 3x mit 100µl PBS 0,05% Tween gewaschen und mit 50 µl Serumverdünnung inkubiert. Die Seren wurden 1:25 in Verdünnungspuffer vorverdünnt und dann 7x seriell 1:3 verdünnt. Als relativer Standard dienten Seren aus alten MLR-lpr Mäusen, die 1:150 vorverdünnt und dann ebenfalls seriell verdünnt wurden. Die Platten wurden über Nacht bei 161 ELISA - Enzyme Linked Immunosorbent Assay Methoden 4°C inkubiert. Die weiteren Schritte erfolgten wie in 9.7.1 beschrieben. Als Sekundärer Antikörper wurde ein Ziege-anti-Maus IgG Antikörper verwendet. 9.7.4 ELISA auf Antikörper Subklassen Um die Menge an Antikörpern unterschiedlicher Subklassen zu bestimmen, die verschieden stimulierte B-Zellen in vitro sekretieren wurden die Antikörperlevel im Überstand mit einem ELISA bestimmt. 96 Well Maxisorp-Platten wurden pro Well mit 50 µl PBS und 1 µg/ml eines anti-IgM, IgG1 und IgG3 über Nacht bei 4 °C in einer feuchten Kammer beschichtet. Die weiteren Schritte erfolgten wie in 9.7.1 beschrieben. Als Sekundärer Antikörper wurde jeweils ein Antikörper gegen dieselbe Subklasse verwendet, gegen die der Antikörper zum beschichten gerichtet war. 9.8 ELISPOT Ein ELISPOT wird genutzt, um die Zahl der Antikörper-produzierenden Zellen in einer Population zu bestimmen. Protokoll 1: Für diesen Versuch muss steril gearbeitet werden. 96 Well Maxisorp-Platten wurden pro Well mit 50 µl ELISA Kopplungspuffer und 0,5 µg/ml gB aus humanem hCMV über Nacht bei 4 °C in einer feuchten Kammer beschichtet. Die Platten wurden 3x mit PBS gewaschen und mit 180 µl/well 5 % FCS, 0,05 % Tween20 in PBS über Nacht bei 4 °C blockiert. Die Platten wurden 1x mit PBS, 1x mit PBS 0,05 % Tween20 und dann erneut 2x mit PBS gewaschen. 20 mio/ml Milzzellen oder 10 mio/ml Knochenmarkszellen in RPMI5+ wurden seriell 1:3 verdünnt. Es wurde eine Verdünnungsreihe mit 7 Verdünnungsschritten angefertigt. 150 µl Zellsuspension wurden pro Well in die Platten übertragen, die dann möglichst erschütterungsfrei in den Brutschrank (37 °C 5 % CO2) gestellt wurden. Es folgte ein Inkubationsschritt bei 37 °C über Nacht. Ab diesem Schritt muss nicht mehr steril gearbeitet werden. Die Platten wurden 3x mit PBS und 1x mit PBS 0,05 % Tween20 gewaschen. PBS mit 1% Gelatine und 1% Tween wurde aufgekocht. Dabei wird die Lösung durch das Tween20 trüb. Als die Lösung handwarm und wieder klar war, wurde 1µg/ml an alkalische Phosphatase gekoppelter anti-IgG oder anti-IgG1 Antikörper zugegeben. Davon wurden 50 µl in jedes Well pipettieren und möglichst erschütterungsfrei 1 h bei 37 °C inkubiert. Die Platten wurden 3x mit PBS gewaschen. Dann wurden die Wells für 30 min mit PBS 0,05 % Tween20 inkubiert. Der Überstand wurde verworfen und es wurden 50 µl/Well ELISPOT Substratpuffer zugegeben (2 h bei 37 °C). Die Platten wurden 3x mit H2O gewaschen. Bei hohem Hintergrund kann man öfter waschen. Ein blauer Punkt steht für eine gB-spezifische Antikörper-sekretierende Zelle. Die Punkte wurden mit dem Auge ohne weitere Vergrößerung oder unter dem Durchlichtmikroskop ausgezählt. 162 ELISPOT Methoden Protokoll 2: Rechteckige 25 Well Zellkulturplatten wurden mit 1 ml/Well 1 µg/ml gB bzw. 1 µg/ml virusartigen Partikeln des humanen Cytomegalovirus (VLPs) in Kopplungspuffer 2-4 h bei 37 °C oder über Nacht bei 4°C beschichtet. Die Platten wurden mit 5 % FCS in PBS für 2 h bei 37 °C oder über Nacht bei 4 °C inkubiert. Die Platten wurden 3x mit 1ml/Well PBS gewaschen. Es wurden pro Maus ein Mal 1x106 und ein Mal 2 x105 Milz- oder Knochenmarkszellen pro Well pipettiert und möglichst erschütterungsfrei in den Brutschrank (37 °C 5 % CO2) gestellt. Es folgte ein Inkubationsschritt bei 37 °C über Nacht. Ab diesem Schritt muss nicht mehr steril gearbeitet werden. Die Platten wurden 3x mit mit PBS 0,05 % Tween20 und 1x mit PBS gewaschen und möglichst trocken geklopft. Anschließend wurden die Platten für 3 h mit alkalischer Phosphatase gekoppelten sekundären Antikörpern gegen Maus-IgM, IgG bei 37 °C inkubiert (1 µg/ml in PBS). Die Platten wurden 3x mit mit PBS 0,05 % Tween20 und 1x mit PBS gewaschen und möglichst trocken geklopft. Es wurden 5 Teile vorgewärmter ELISPOT Substratpuffer mit einem Teil frisch aufgekochter Agarose mit einem niedrigen Schmelzpunkt (Low melting agarose) gemischt. Davon wurden 1 ml/Well pipettiert. Dies geschah möglichst Erschütterungsfrei und wenn möglich bei einer Umgebungstemperatur von 4 °C, damit die Agarose schnell abkühlt und man distinkte Punkte bekommt. Dieses Protokoll hat gegenüber Protokoll 1 den Nachteil, dass die Zeit in der die Agarose abkühlt reicht, damit sich das umgesetzte Substrat verteilt und einen hohen Hintergrund erzeugt, den man nicht weg waschen kann. 9.9 Immun-Histologie 9.9.1 Einbetten von Organen Organe wurden entnommen, von Fettresten befreit und gegebenenfalls mit einem Skalpell zerschnitten und aufgeteilt. Dabei sollen die Organe möglichst wenig beschädigt werden, um ihre Struktur zu erhalten. Dann wurden die Organe in ein zur Hälfte mit TissueTek® gefülltes Organschälchen (Cryomold Intermediate 15mm x 15mm x 5mm; Bestellnummer 4566) gelegt, das darauf komplett mit TissueTek® aufgefüllt wurde. Das von TissueTek® umgebene Organ wurde auf Trockeneis gelegt, bis es komplett durchgefroren war (10-15 min). Dabei verfärbt sich das durchsichtige TissueTek® weißlich. Die Organe können bei -80 °C gelagert werden. 9.9.2 Erstellen von Kryoschnitten Aus in TissueTek® eingefrorenen Organen wurden mit einem Kryotom (Cryostat AG Brandtstätter, Tierphysiologie) 8 µm dicke Organschnitte der Milz hergestellt. Dazu wurde die Temperatur der Objektkammer auf -21 °C gestellt und die des Objekttisches auf -17 °C. Die Schnitte wurden auf Objektträger überführt und bei RT ca. 15 min getrocknet, bevor sie unter dem Abzug mit Aceton überschichtet wurden. Nachdem das Aceton verdampft war wurden die 163 Immun-Histologie Methoden Schnitte für die spätere Färbung mit einem Roti®-Liquid Barrier Marker umrandet. Die Schnitte können bis zur Färbung bei -20 °C gelagert oder direkt gefärbt werden. 9.9.3 Immunhistologische Färbung Gefrierschnitte der Milz wurden 15 min bei RT an die Temperatur angeglichen. Dann wurden sie für 5 min mit PBS rehydriert. Dazu pipettiert man vorsichtig so viel Flüssigkeit auf den Schnitt, dass er bedeckt ist, die Roti®-Liquid Barrier aber nicht durchbrochen wird Man lässt das PBS ablaufen. Anschließend wurden die Proben für 30 min bei RT mit 20 % Pferdeserum, 20 % FCS und 1:100 2.4G2 Antikörper in PBS blockiert. Man lässt die Blockierlösung ablaufen. Ab diesem Schritt wurden die Proben möglichst wenig Licht ausgesetzt. Es folgte ein 30 min Färbeschritt bei RT in PBS mit 2 % FCS, 0,05 % Tween20 und je nach Färbung verschiedenen Antikörperkombinationen. Man lässt die Färbelösung ablaufen und taucht den Objektträger 1x in eine Wanne mit PBS. Optional erfolgte eine sekundäre Färbung analog zum ersten Färbeschritt. Anschließend wurden die Proben 2x für 5 min mit 0,05 % Tween20 in PBS inkubiert und anschließend für 5 min mit PBS. Man lässt die Flüssigkeit ablaufen und entfernt die Restflüssigkeit mit einem Tuch. Es wurden75 µl Mowiol auf ein Deckglas mit der Größe des Objektträgers geben und der Objektträger damit eingedeckelt. Das Mowiol härtete über Nacht bei RT aus. Am nächsten Tag konnten Aufnahmen der Proben unter dem Fluoreszenzmikroskop gemacht werden, die mit ImageJ weiter ausgewertet wurden. Die einzeln aufgenommenen Kanäle wurden zusammengefügt und die Farbbalance angepasst. Dabei wurden alle Bilder gleich behandelt, um die Vergleichbarkeit zu gewährleisten. Färbungen: Keimzentren: - anti-IgD- bio 1:400 - PNA- FITC 1:400 - sekundär gefärbt mit: Streptavidin-Cy3 1:100 B-Zell Subpopulationen / IgM Plasmazellen: - anti-IgD- bio 1:400 - anti-IgM- FITC 1:50 - sekundär gefärbt mit: Streptavidin-Cy3 1:100 IgG Plasmazellen - anti-IgD- bio 1:400 - anti-IgG- Alexa488 1:200 - sekundär gefärbt mit: Streptavidin-Cy3 1:100 164 Immun-Histologie Methoden 9.10 Proteinbiochemische Methoden 9.10.1 SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE) Bei der eindimensionalen diskontinuierlichen SDS-Gelelektrophorese erfolgt die Auftrennung von Proteinen nach ihrer molekularen Masse in einem elektrischen Feld. Ein Polyacrylamid-Gel besteht meist aus einem Sammel- und einem Trenngel. In einer Gießvorrichtung wurde zuerst das Trenngel gegossen und mit Isopropanol überschichtet. War das Trenngel polymerisiert wurde das Isopropanol entfernt und das Sammelgel als zweite Schicht auf das Trenngel geschichtet. In das Trenngel wurde ein Kamm für die Taschen eingebracht. Ist das Gel polymerisiert kann es in einem feuchten Tuch bei 4 °C gelagert werden. Das Gel wird für die Elektrophorese in eine Kammer mit Elektrophoresepuffer überführt und der Kamm entfernt. Jetzt kann es mit Proben beladen und an die Stromversorgung angeschlossen werden. Eine definierte Zahl B- oder TLymphozyten wurden in Brij-Lysepuffer aufgenommen und für 30 min auf Eis lysiert (Richtwert: 25000/µl Lysepuffer). Dann wurden die Proben bei 13000 rpm für 5 min und 4 °C abzentrifugiert, um Zelltrümmer zu pelletieren. Der Überstand wurde in ein frisches 1,5 ml Reaktionsgefäß überführt. An dieser Stelle können die Proben optional bei -80 °C weggefroren werden. Es wurden drei Teile Lysat mit einem Teil denaturierendem 4x Roti®-Load gemischt und für 5 min auf 96 °C erhitzt. Dann wurden die Proben kurz anzentrifugiert und auf ein Polyacrylamid-Gel aufgetragen. Als Referenz diente ein definierter Proteinstandard (PageRulerTM Prestained Protein Ladder Plus). Solange die Proben das Sammelgel durchliefen wurde eine Spannung von 80 V angelegt, im Trenngel waren es 130 V. Je nach gewünschtem Auftrennungsgrad kann man die Porengröße des Gels durch seine Prozentigkeit variieren. Trenngel (10 %): Bisacrylamid Lösung Sammelgel (3 %): 33,3 % (v/v) 13 % (v/v) 375 mM Tris pH 8,8 125mM Tris pH 0,1 % (v/v) 0,1 % (v/v) Tetramethylethylendiamin (TEMED) 0,001 % (v/v) 0, 002% (v/v) Ammoniumpersulfat (APS) Lösung 0,5 % 0, 5% (v/v) (Mischung Acrylamid - Bisacrylamid 29:1) Tris 6,8 SDS in entionisiertem Wasser 9.10.2 Western Blot und Signaldetektion über Röntgenfilm 165 Proteinbiochemische Methoden Methoden Nach erfolgreicher SDS-Polyacrylamid-Gelelektrophorese wurden die Proteine aus dem Gel auf eine Nitrozellulosemembran übertragen. Dazu wurde Mighty SmallTE Tank Transfer System benutzt. Hierbei handelt es sich um ein Wet-Blot-Verfahren. Der Transfer der Proteine erfolgte in 1x Transferpuffer bei 80 V für 1 h oder bei 40 V über Nacht bei 4 °C. Unspezifische Bindestellen der Membran wurden mit 0,05 % Tween und 5 % Milchpulver in PBS entweder 1 h bei RT oder über Nacht bei 4 °C unter Bewegung blockiert. Es folgten drei Waschschritte mit 0,1 % Tween in PBS für je 7 min. Die Membran wurde in PBS mit 10 ml 5 % BSA, 0,1% (v/v) Tween20 und Primärantikörper für 2 h bei RT oder über Nacht bei 4 °C inkubiert. Es wurde drei Mal mit 0,1 % Tween in PBS für je 7 min gewaschen. Die Membran wurde für 1 h bei RT mit 20 ml Sekundärantikörper in PBS mit 0,1% (v/v) Tween20 inkubiert, der spezifisch den Fc-Teil Primärantikörpers erkennt und Meerrettichperoxidase (HRP) konjugiert ist. Es wurde drei Mal mit 0,1 % Tween in PBS für je 7 min gewaschen. Zum Entwickeln wurden ECL Westernblotting Detektionsreagenz 1 u. 2 (Amersham benutzt). Diese enthalten Luminol, das von HRP zu einem 3-Aminophthalat-Anion umgewandelt werden kann und Licht emittiert, wenn es in seinen Grundzustand zurückkehrt. Detektionsreagenz 1 u. 2 wurden 1:1 gemischt und die Membran wurde komplett benetzt. Und für 1 min inkubiert. Die Membran wurde blasenfrei zwischen zwei Klarsichtfolien gelegt und in eine Filmkassette gelegt. In einer Dunkelkammer wurde ein Röntgenfilm auf die Klarsichtfolie gelegt (Fuji RX) und durch die Chemilumineszenz belichtet. Der Film wurde entwickelt, fixiert und fotografiert. Es können zwei Filme übereinander gelegt werden, um eine höhere Chance zu haben einen der Filme mit der richtigen Lichtmenge zu inkubieren. Alternativ für ECL Westernblotting Detektionsreagenz 1 kann 0,33 % H2O2 in Wasser verwendet werden. 9.11 Untersuchung von T-Helferzellen 9.11.1 In vitro T-Zell Differenzierung Durch die Stimulation naiver CD4+ T-Zellen mit verschiedenen Zytokinen in vitro kann das Differenzierungspotential der Zellen in verschiedene induzierte T-Helferzellpopulationen untersucht werden. Die Wells einer 96-Well Rundbodenplatte wurden mit je 50 µl Tris-Puffer pH 9,5 mit 1 µg/ml anti-CD3 Antikörper für 3 h bei 37 °C im Brutschrank gecoatet. Nach der Inkubation wurden die gecoateten Wells 2x mit 100µl Zellpuffer gewaschen. Naive CD4+ TZellen wurden parallel zum caoten der Platten aufgereinigt (siehe 9.2.1.1). Es wurden 2 mio Zellen/ml in RPMI10+ aufgenommen. Davon wurden je 50µl Zellsuspension in die gecoateten und 2x gewaschenen Wells der 96 Well Platten pipettiert. Es wurde vermieden Wells am Rand zu befüllen, um Randeffekt zu umgehen. Die Wells am Rand wurden mit je 100 µl RPMI10+ gefüllt. Zu den Zellen wurden 50µl eines 2x konzentrierten Zytokinmixes gegeben, der ebenfalls in RPMI10+ angesetzt wurde (siehe Tab. 14). Die Zellen wurden für 72h bei 37°C und 5% CO2 inkubiert. Anschließend wurden die ausgesäten Zellen 2x mit 80 µl/Well Zellpuffer in der Platte 166 Untersuchung von T-Helferzellen Methoden gewaschen. Die TH2-Zellen wurden in 50µl RPMI10+ mit 50 Units IL-2/Well resuspendiert, auf eine neue nicht gecoatetet Platte übertragen und erneut für 48h bei 37°C und 5% CO2 im Brutschrank inkubiert. Die übrigen Zellen wurden auf der alten Platte in 50µl RPMI10 + mit 1µg/ml Ionomycin und 20ng/ml PMA, sowie 1µg/ml Golgiplug (BD) resuspendiert und für 6h bei 37°C und 5% CO2 im Brutschrank inkubiert. Die Differenzierung wurde durchflusszytometrisch überprüft. Die TH2-Zellen wurden nach der erneuten Inkubation 2x mit 80 µl/Well Zellpuffer in der Platte gewaschen, in 50µl RPMI10+ mit 1µg/ml Ionomycin und 20ng/ml PMA, sowie 1µg/ml Golgiplug (BD) resuspendiert und für 6h bei 37°C und 5% CO2 im Brutschrank inkubiert. Die Differenzierung wurde ebenfalls durchflusszytometrisch überprüft. Tab. 14: Stimulationsansätze für die Differenzierung von TH1, TH2, T-reg und TH17 Zellen aus naiven CD4+CD62L+ T-Zellen. anti-CD3 (coated) anti-CD28 anti-IFNγ IL-12 IL-2 IL-4 IL-6 TGFβ TH1 TH2 T-reg TH17 1 µg/ml 1 µg/ml 1 µg/ml 1 µg/ml 1,3 µg/ml 1,3 µg/ml 1,3 µg/ml 1,3 µg/ml 5 µg/ml 5 µg/ml 5 µg/ml 4 ng/ml 50 U/ml 50 U/ml 50 U/ml 10 ng/ml 30 ng/ml 3 ng/ml 2 ng/ml 9.11.2 Intrazelluläre Färbung von Zytokinen Alle intrazellulären Färbungen außer die Färbungen auf FoxP3 wurden mit dem BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit mit BD GolgiPlug von BD durchgeführt. Damit sich die produzierten Proteine/Zytokine im Endoplasmatischen Retikulum ansammeln wurden bis zu 2x106 Zellen in 1 μl/ml BD GolgiPlug in RPMI10+ resuspendiert und für 6 h bis 12 h bei 37 °C und 5 % CO2 inkubiert. Dieser Schritt muss nur durchgeführt werden, wenn vorher noch kein BD GolgiPlug zu den Zellen gegeben wurde. Die Zellen wurden in 5 ml Röhrchen überführt und optional extrazellulär gefärbt wie in 9.1.4 beschrieben. An dieser Stelle können die Proben mit 500µl 4% Paraformaldehyd in PBS für 15 min im Dunkeln bei RT fixiert werden. Es folgt ein Waschschritt mit FACS-Puffer und die Zellen können in 1 ml FACS-Puffer über Nacht gelagert werden. Alternativ werden die Zellen in 250μl Fixation/Permeabilization Lösung resuspendieren und für 20 min. bei 4°C inkubiert. Als nächstes wurde 2x mit 0,5 ml BD Perm/Wash Puffer (1x Verdünnung aus 10x Stock) gewaschen, bevor die Zellen in 50 μl/Well BD Perm/Wash Puffer mit Färbeantikörpern resuspendieren und 30 min bei 4 °C inkubiert wurden. Optional kann 2.4G2 Fc-Block zur Färbelösung gegeben werden, wenn er noch nicht bei der extrazellulären Färbung verwendet wurde. Die Zellen wurden 2x mit 0,5 ml BD Perm/Wash 167 Untersuchung von T-Helferzellen Methoden buffer (1x Verdünnung aus 10x Stock) gewaschen und für die Durchflusszytometrie in 150 µl FACS-Puffer aufgenommen. Färbungen: TH1- und TH17-Zellen: extrazellulär: o anti-CD4- FITC (GK1.5) 1:200 o anti-CD16/CD32 (2.4G2) Fc-Block 1:100 intrazellulär: o anti-IL17-PE (eBio17B7) 1:100 o anti-IFNγ-APC (XMG1.2) 1:200 TH2-Zellen: extrazellulär: o anti-CD4- FITC (GK1.5) 1:200 o anti-CD16/CD32 (2.4G2) Fc-Block 1:100 intrazellulär: o IL-4-APC 1:100 9.11.3 Intrazelluläre FoxP3-Färbung Für die Färbung auf FoxP3+ regulatorische T-Zellen wurde das α-Maus/Ratte Foxp3 staining set APC von eBioscience verwendet. Alle Schritte sollen auf 4 °C durchgeführt werden. Damit sich das produzierte FoxP3 im Endoplasmatischen Retikulum ansammelt wurden bis zu 2x106 Zellen in 1 μl/ml BD GolgiPlug in RPMI10+ resuspendiert und für 6 h bis 12 h bei 37 °C und 5 % CO2 inkubiert. Dieser Schritt muss nur durchgeführt werden, wenn vorher noch kein BD GolgiPlug zu den Zellen gegeben wurde. Die Zellen wurden in 5 ml Röhrchen überführt und optional extrazellulär gefärbt wie in 9.1.4 beschrieben. Dann wurden die Zellen in 200 µL kaltem eBioscience Fix/Perm Puffer aufgenommen und für 30 min bis 18 h inkubiert. Hier besteht die Möglichkeit die Proben über Nacht zu lagern. Die Zellen wurden abzentrifugiert und der Überstand verworfen, bevor sie 2x mit 200µL 1x Permeabilization Puffer gewaschen wurden. Die Zellen wurden in 50 μl/Well BD Perm/Wash Puffer mit Färbeantikörpern resuspendieren und 30 min bei 4 °C inkubiert. Optional kann 2.4G2 Fc-Block zur Färbelösung gegeben werden, wenn er noch nicht bei der extrazellulären Färbung verwendet wurde. Zu den Proben wurden 150ul 1x Permeabilization Puffer pipettiert. Dann wurden die Proben abzentrifugiert und der Überstand 168 Untersuchung von T-Helferzellen Methoden verworfen, bevor sie 2x mit 200µL 1x Permeabilization Puffer gewaschen wurden. Die Zellen wurden für die Durchflusszytometrie in 150 µl FACS-Puffer aufgenommen. Färbungen: T-reg Zellen: extrazellulär: o anti-CD4- FITC (GK1.5) 1:200 o anti-CD25-PE (optional) 1:100 o anti-CD16/CD32 (2.4G2) Fc-Block 1:100 intrazellulär: o anti-FoxP3-APC 1:200 9.11.4 Ex vivo T-Zell Analyse Diese Analyse kann genutzt werden, um den Anteil der T-Helferzellpopulationen möglichst nahe an der in vivo Situation zu untersuchen. CD4-Zellen aus der Milz wurden optional wie in 9.2.1.2 beschrieben aufgereinigt. Alternativ wurden Gesamtmilzzellen verwendet. Es wurden 2x106 Zellen/ml in 1 ml RPMI+ mit 1µg/ml Ionomycin, 20ng/ml PMA, sowie 1µg/ml Golgiplug (BD) resuspendiert und für 6 h bei 37 °C und 5 % CO2 im Brutschrank inkubiert. Dann wurden intrazelluläre Färbungen durchgeführt, wie in 9.11.2 und 9.11.3 beschrieben. 9.11.5 Cytometric Bead Array (CBA) zur Bestimmung von sekretierten Zytokinen Die Menge an Zytokinen in Überstanden kann mit einem „Cytometric Bead Array“ (CBA) bestimmt werden. Es wurden Überstände von Milzzellen aus Mäusen mit experimenteller autoimmuner Enzephalomyelitis verwendet, die mit verschiedenen Konzentrationen MOG für 72 h bei 37 °C und 5 % CO2 restimuliert wurden. Der Überstand kann bis zur Verwendung bei -20 °C gelagert werden. Für den CBA wurde das kommerzielle “BD Cytometric Bead Array (CBA) Mouse Th1/Th2/Th17 Cytokine Kit“ verwendet. Die untersuchten Überstände wurden wie in 9.4 beschrieben gewonnen. Die Menge der abgegebenen Zytokine im Überstand wurde durchflusszytometrisch über Partikel bestimmt, an die Antikörper gegen je ein spezifisches Zytokin gekoppelt waren. Ein gebundenes Zytokin kann über einen weiteren Antikörper gegen dasselbe Zytokin nachgewiesen werden, der an ein Fluochrom gekoppelt ist. Partikel verschiedener Größen können unterschieden und gleichzeitig gemessen werden (Cytometric Bead Array BD). Mit dem Kit kann die Menge an IL-17A, IL-2, TNF, IL10, IFNγ, IL-6 und IL-4 im Überstand anhand eines bekannten Zytokinstandards bestimmt werden. Für die Erstellung der Standardkurve wurde eine logistische Funktion der dritten Ordnung verwendet, die mit Microsoft Excel berechnet wurde. 169 Untersuchung von T-Helferzellen Methoden 9.12 Immunisierungen und Mausversuche 9.12.1 Intravenöse (i.v.) Injektion Die Mäuse wurden unter einer Rotlichtlampe erwärmt und dann in einem „Restrainer“ (Plastikröhre) fixiert. Vor der Injektion kann der Schwanz mit Alkohol abgesprüht werden. Dadurch sind die Venen oft deutlicher zu erkennen. Außerdem kann das Blut im Schwanz gestaut werden, damit die Venen deutlicher hervortreten. Es können abhängig von der Größe der Maus bis zu 200 µl Flüssigkeit injiziert werden. Für die Injektion wurde eine 1 ml Spritze mit einer dünnen Nadel (STERICAN 0.45X25 braun GR 18) verwendet. 9.12.2 NP-CGG / NP-KLG / CGG Immunisierung Die Thymus abhängige Immunantwort bzw. Gedächtnisantwort sollte anhand einer NP-CGG Immunisierung untersucht werden. Mäuse wurden intraperitoneal (i.p.) mit 50 µg NP27-CGG in Alu-Gel-S immunisiert. Das Alu-Gel-S muss vor dem pipettieren gut gemischt werden. Es wurden 1 µg/µl NP27-CGG in PBS mit Alu-Gel-S in einem 50 ml Reaktionsgefäß 1:1 vermischt und 1 h im Dunkeln bei RT unter Rühren inkubiert. Das Gemisch wurde mit 5 ml PBS gewaschen. Dann wurde das NP27-CGG/ Alu-Gel-S Gemisch so mit PBS versetzt, dass 50 µg NP27-CGG in 200 µl Volumen vorhanden waren. Pro Maus wurden 200 µl i.p. injiziert. Zum spritzen wurde eine 1 ml Spritze mit einer BD MICROLANCE 3 Kanuele (26 G 1/2 0,45x13 mm REF 303800) verwendet. Die Mäuse wurden je nach Versuch zu unterschiedlichen Zeitpunkten erneut nach demselben Protokoll mit 50 µg NP27-CGG geboostet. Memoryzellen, die in Rezipienten-Mäuse übertragen wurden konnten mit 50 µg NP27-CGG in 100 µl PBS intravenös (i.v.) reaktiviert werden. Die Gabe des Antigens intravenös ohne Alum soll eine schwächere primäre Immunantwort in den Rezipienten auslösen, um die Memoryantwort besser untersuchen zu können. Den Mäusen wurde zur Serumgewinnung zu verschiedenen Zeitpunkten Blut aus einer Schwanzvene entnommen. Das Protokoll für die Injektion mit Alum kann auch genauso für NPKLH oder CGG allein angewendet werden. Dabei können 50 µg - 100 µg Antigen eingesetzt werden. 9.12.3 Immunisierung mit Glykoprotein B und virusartigen Partikeln (VLPs) des humanen Zytomegalieviruses Die Immunisierungen wurden prinzipiell wie in 9.12.2 durchgeführt. Alum und PBS mit verschiedenen Konzentrationen an Glykoprotein B oder virusartigen Partikeln wurden 1:1 gemischt, inkubiert und i.p. gespritzt. Die Reaktivierung von Memoryzellen erfolgte i.v. in PBS. 9.12.4 Immunisierung mit Schafserythrozyten zur Keimzentrumsanalyse Eine Immunisierung von Mäusen mit Schafserythrozyten führt zu einer starken Keimzentrumsreaktion. Es wurden Schafserythrozyten in Alseverlösung (steril von FiebigNährstofftechnik) 1:100 mit PBS vorverdünnt und dann zum zählen 1:10 in Trypanblau verdünnt. Pro Maus wurden 1x109 Schafserythrozyten gespritzt. Die 170 Immunisierungen und Mausversuche gewünschte Zahl an Methoden Schafserythrozyten wurde in ein 50 ml Reaktionsgefäß überführt und 20 min bei 2400 rpm zentrifugiert. Der Überstand wurde verworfen. Anschließend wurden pro 1x109 Schafserythrozyten 200 µl PBS zugegeben. Pro Maus wurden 200 µl intraperitoneal gespritzt. Zum spritzen wurde eine 1 ml Spritze mit einer BD MICROLANCE 3 Kanuele (26 G 1/2 0,45x13 mm REF 303800) verwendet. Die Keimzentrumsreaktion wurde an Tag 10 histologisch und durchflusszytometrisch untersucht. 9.12.5 NK-Zell Depletion Um allogene Abstoßungsreaktionen von Zellen aus einem anderen gentischen Hintergrund in Rezipientenmäusen gering zu halten konnten NK-Zellen durch die Injektion von 0,8 bis 1 mg/Maus anti-NK1.1 AK (BioXcell) ca. 48 h vor dem adoptiven Zelltransfer depletiert werden. 9.12.6 Adoptiver Zelltransfer Protokoll 1: Für die Untersuchung von Memory B-Zell Antworten wurden Memoryzellen/B-Zellen in Rezipientenmäuse übertragen. Milzzellen aus immunisierten Mäusen wurden in Einzelzellsuspension gebracht. T-Zellen wurden komplementvermittelt lysiert (siehe 9.2.1.3) und dann positiv über magnetische Seperation für CD19+ Zellen angereichert (siehe 9.2.1.4). Der Anteil der Memoryzellen an den aufgereinigten Zellen wurde durchflusszytometrisch bestimmt (Abb. 18, Abb. 26). Dazu wurde ein Teil der Zellen mit ihrem Antigen, dass an einen Fluoreszenzfarbstoff gekoppelt war in Kombination mit weiteren Markern gefärbt. Die Memoryzellzahl für die übrigen Zellen konnte berechnet werden und es wurden gleich viele Memoryzellen in jedes Tier aus den zu vergleichenden Gruppen übertragen. Nach 5 bis 7 Tagen, wenn die Memoryzellen ihre Nischen gefunden haben wurden sie reaktiviert. Protokoll 2: Alternativ wurden Memoryzellen direkt durchflusszytometrisch mit dem MoFlow Zellsortiergerät sortiert. Dieses Protokoll hat den Nachteil, dass die Memoryzellen durch die direkte Färbung mit dem Antigen aktiviert werden können. Für NP-spezifische Memoryzellen: Milzzellen wurden in Einzelzellsuspension gebracht und mit Färbelösung, die anti-IgG1-, anti-IgG2a-, anti-IgG2b-FITC je 1:100 und B220-PE 1:400 (Klon: RA3-6B2 eBioscience), sowie Fc-Block 1:100 enthielt gefärbt (Abb. 27). In einem ersten Sortierschritt, der auf Geschwindigkeit und weniger auf Reinheit optimiert war wurden B220+IgG1/IgG2a/IgG2b+ Zellen angereichert. Diese wurden in einem weiteren Färbeschritt mit gB-Cy5 inkubiert. Bei der Färbung wurde mit 1500 rpm für 10 min zentrifugiert um möglichst wenige Zellen zu verlieren. Es folgte ein zweiter Sortierschritt, der weniger auf Geschwindigkeit als auf Reinheit ausgelegt war. In diesem wurden die B220+IgG1/IgG2a/IgG2b+gB bindende 171 Immunisierungen und Mausversuche Methoden Zellen in ein Röhrchen mit Rag1-/- Füllerzellen sortiert. Es wurden gleich viele Memoryzellen in jedes Tier aus den zu vergleichenden Gruppen übertragen. Nach 5 bis 7 Tagen, wenn die Memoryzellen ihre Nischen gefunden haben wurden sie reaktiviert. Für Glykoprotein B spezifische Memoryzellen: Milzzellen wurden in Einzelzellsuspension gebracht und positiv über magnetische Seperation für CD19+ Zellen angereichert (siehe 9.2.1.4). Anschließend wurden die Zellen mit anti-IgG1-, anti-IgG2a-, anti-IgG2b-FITC je 1:100, B220PE-Cy5.5 1:400, NIP-PE 1:800 und NIP-APC 1:1600 gefärbt (Abb. 19). In einem ersten Sortierschritt, der auf Geschwindigkeit und weniger auf Reinheit optimiert war wurden B220+IgG1+/IgG2a+/IgG2b+ Zellen angereichert. Es folgte ein zweiter Sortierschritt, der weniger auf Geschwindigkeit als auf Reinheit ausgelegt war. In diesem wurden die B220+IgG1/IgG2a/IgG2b+NIP+ Zellen in ein Röhrchen mit wt-Milz-Füllerzellen sortiert. Es wurden gleich viele Memoryzellen in jedes Tier aus den zu vergleichenden Gruppen übertragen. Nach 5 bis 7 Tagen, wenn die Memoryzellen ihre Nischen gefunden haben wurden sie reaktiviert. 9.12.7 Serumgewinnung Die Mäuse wurden unter einer Rotlichtlampe erwärmt. Dann wurde eine seitliche Schwanzvene leicht mit einem Skalpell angeritzt und austretendes Blut mit einem BD Microtainer® Röhrchen mit FloTop Collector oder einem 1,5 ml Reaktionsgefäß aufgefangen. Das Blut wurde im Fall von 1,5 ml Reaktionsgefäßen 1 h bei 37°C inkubiert und dann 10min bei 13000 rpm abzentrifugiert. Die obere Srum-Phase wurde abgenommen, in ein neues 1,5 ml Reaktionsgefäß überführt und gegebenenfalls bei -20 °C gelagert. Bei Microtainer® Röhrchen wurde das Blut für 30 min bei RT inkubiert und dann 5 min bei 13000 rpm abzentrifugiert. Die Röhrchen können bei -20 °C gelagert werden. 9.12.8 Experimentelle autoimmune Enzephalomyelitis (EAE) Die Experimentelle autoimmune Enzephalomyelitis (EAE) ist ein Mausmodell für die Multiple Sklerose im Menschen. 50 µg Myelin-Oligodendrozyten-Glykoprotein (MOG) 35-55 in 50 µl H2O wurden mit 50 µl komplettem Freunds-Adjuvans (CFA) mit 10 µg/ml Mycobacterium Tubercolosis (H37Ra; Difco/BD Bioscience) gemischt. Die Mäuse wurden subkutan (s.c.) mit 100 µl des Gemisches im Bereich des vorderen Rückens immunisiert. Zusätzlich wurden 200 µl Pertussis Toxin (List/Quadratech) i.p. an Tag 0 und 2 gespritzt, um die Blut-Hirn-Schranke durchlässig zu machen. Dieses EAE-Protokoll löst eine chronische EAE aus (Rangachari & Kuchroo 2013). Der Verlauf der EAE wurde anhand eines klinischen Bewertungssystemes verfolgt. 172 Immunisierungen und Mausversuche Methoden 9.12.9 Arbeit mit Versuchstieren und verwendete Mausstämme Die Mäuse wurden unter pathogenarmen Bedingungen im Biotechnologisches Entwicklungslabor (BTE) gezüchtet und gehalten. Bei den Versuchen wurde das deutsche Tierschutzgesetz eingehalten. Es wurden mindestens 6 Wochen alte Tiere verwendet. Grb2fl/fl mb1cre/+ Mäuse – Die Grb2fl/fl Tiere wurden von Dr. Jochen Ackermann generiert (Ackermann et al. 2011) und mit mb1cre/+ Mäusen (Hobeika et al. 2006) verpaart. Die Tiere wurden im Rahmen dieser Arbeit für 10 Generationen auf C57BL/6 Hintergrund zurückgekreuzt. Die ersten Schritte der Rückkreuzung wurden von Jochen Ackermann überwacht. Die meisten Versuche wurden aber mit Grb2fl/fl mb1cre/+ Mäusen im ursprünglichen, gemischten BALB/c / C57BL/6 Hintergrund durchgeführt, die nicht zu C57BL/6 zurückgekreuzt waren. Grb2fl/fl mb1cre/+ Bcl2tg - Diese Tiere wurden im Rahmen der Arbeit durch die Kreuzung von Bcl2tg Mäusen (Strasser et al. 1991) im C57BL/6 Hintergrund (von Prof. Dr. Andre Gessner zur Verfügung gestellt) und Grb2fl/fl mb1cre/+ Mäusen mit gemischten BALB/c / C57BL/6 Hintergrund generiert. Grb2fl/fl cγ1cre/+ Mäuse - Diese Tiere wurden im Rahmen der Arbeit durch die Kreuzung von cγ1cre/+ Mäusen (wir danken Prof. Dr. Stefano Casola für die Erlaubnis die Mäuse zu nutzen und Prof. Dr. David Vöhringer für die Bereitstellung) im C57BL/6 Hintergrund (Casola et al. 2006) mit Grb2fl/fl Mäusen generiert, die 10 Generationen auf C57BL/6 Hintergrund zurückgekreuzt waren. Grb2fl/fl Lckcretg Mäuse - Diese Tiere wurden im Rahmen meiner Masterarbeit durch die Kreuzung von Lckcretg Mäusen (Takahama et al. 1998) im C57BL/6 Hintergrund (von Dr. Andre Gessner zur Verfügung gestellt) mit Grb2fl/fl Mäusen im gemischten BALB/c / C57BL/6 Hintergrund generiert. Grb2fl/fl CD4cretg Mäuse - Diese Tiere wurden im Rahmen der Arbeit durch die Kreuzung von CD4cretg Mäusen (Sawada et al. 1994) im C57BL/6 Hintergrund (von Prof. Dr. David Vöhringer zur Verfügung gestellt) mit Grb2fl/fl Mäusen generiert, die 10 Generationen auf C57BL/6 Hintergrund zurückgekreuzt waren. 173 Immunisierungen und Mausversuche Literaturverzeichnis 10 Literaturverzeichnis Ackermann, J.A., Radtke, D., Maurberger, A., Winkler, T.H., & Nitschke, L., 2011. Grb2 regulates B-cell maturation, B-cell memory responses and inhibits B-cell Ca2+ signalling. EMBO J., 30, 1621–33. Adolfsson, J., Borge, O.J., Bryder, D., Theilgaard-Mönch, K., Astrand-Grundström, I., Sitnicka, E., Sasaki, Y., & Jacobsen, S.E., 2001. Upregulation of Flt3 expression within the bone marrow Lin(-)Sca1(+)c-kit(+) stem cell compartment is accompanied by loss of self-renewal capacity. Immunity, 15, 659–69. Alberola-Ila, J., Forbush, K.A., Seger, R., Krebs, E.G., & Perlmutter, R.M., 1995. Selective requirement for MAP kinase activation in thymocyte differentiation. Nature, 373, 620–3. Alberola-Ila, J., Hogquist, K.A., Swan, K.A., Bevan, M.J., & Perlmutter, R.M., 1996. Positive and negative selection invoke distinct signaling pathways. J. Exp. Med., 184, 9–18. Allman, D., Lindsley, R.C., DeMuth, W., Rudd, K., Shinton, S. a, & Hardy, R.R., 2001. Resolution of three nonproliferative immature splenic B cell subsets reveals multiple selection points during peripheral B cell maturation. J. Immunol., 167, 6834–40. Anderson, G., Hare, K.J., & Jenkinson, E.J., 1999. Positive selection of thymocytes: the long and winding road. Immunol. Today, 20, 463–8. Anderson, J.S., Teutsch, M., Dong, Z., & Wortis, H.H., 1996. An essential role for Bruton’s [corrected] tyrosine kinase in the regulation of B-cell apoptosis. Proc. Natl. Acad. Sci. U. S. A., 93, 10966–71. Anderson, S.M., Tomayko, M.M., Ahuja, A., Haberman, A.M., & Shlomchik, M.J., 2007. New markers for murine memory B cells that define mutated and unmutated subsets. J. Exp. Med., 204, 2103–14. Andrews, S.F., Dai, X., Ryu, B.Y., Gulick, T., Ramachandran, B., & Rawlings, D.J., 2012. Developmentally regulated expression of MEF2C limits the response to BCR engagement in transitional B cells. Eur. J. Immunol., 42, 1327–36. Andrews, S.F. & Rawlings, D.J., 2009. Transitional B cells exhibit a B cell receptor-specific nuclear defect in gene transcription. J. Immunol., 182, 2868–78. Apel, M. & Berek, C., 1990. Somatic mutations in antibodies expressed by germinal centre B cells early after primary immunization. Int. Immunol., 2, 813–819. Archbold, J.K., Macdonald, W. a, Burrows, S.R., Rossjohn, J., & McCluskey, J., 2008. T-cell allorecognition: a case of mistaken identity or déjà vu? Trends Immunol., 29, 220–6. Asada, H., Ishii, N., Sasaki, Y., Endo, K., Kasai, H., Tanaka, N., Takeshita, T., Tsuchiya, S., Konno, T., & Sugamura, K., 1999. Grf40, A novel Grb2 family member, is involved in T cell signaling through interaction with SLP-76 and LAT. J. Exp. Med., 189, 1383–90. Astoul, E., Watton, S., & Cantrell, D., 1999. The dynamics of protein kinase B regulation during B cell antigen receptor engagement. J. Cell Biol., 145, 1511–1520. 174 Literaturverzeichnis Azzam, H.S., Grinberg, A., Lui, K., Shen, H., Shores, E.W., & Love, P.E., 1998. CD5 expression is developmentally regulated by T cell receptor (TCR) signals and TCR avidity. J. Exp. Med., 188, 2301–11. Balciunaite, G., Ceredig, R., & Rolink, A.G., 2005. The earliest subpopulation of mouse thymocytes contains potent T, significant macrophage, and natural killer cell but no Blymphocyte potential. Blood, 105, 1930–6. Barboza, L., Salmen, S., Teran-Angel, G., Peterson, D.L., & Berrueta, L., 2013. A deficient translocation of CD3ζ, ZAP-70 and Grb2 to lipid raft, as a hallmark of defective adaptive immune response during chronic hepatitis B infection. Cell. Immunol., 284, 9–19. Batoulis, H., Addicks, K., & Kuerten, S., 2010. Emerging concepts in autoimmune encephalomyelitis beyond the CD4/T(H)1 paradigm. Ann. Anat., 192, 179–93. Batten, M., Groom, J., Cachero, T.G., Qian, F., Schneider, P., Tschopp, J., Browning, J.L., & Mackay, F., 2000. BAFF mediates survival of peripheral immature B lymphocytes. J. Exp. Med., 192, 1453–66. Baumgarth, N., 2011. The double life of a B-1 cell: self-reactivity selects for protective effector functions. Nat. Rev. Immunol., 11, 34–46. Bell, J.J. & Bhandoola, A., 2008. The earliest thymic progenitors for T cells possess myeloid lineage potential. Nature, 452, 764–7. Bendelac, A., Matzinger, P., Seder, R.A., Paul, W.E., & Schwartz, R.H., 1992. Activation events during thymic selection. J. Exp. Med., 175, 731–42. Berger, T., Weerth, S., Kojima, K., Linington, C., Wekerle, H., & Lassmann, H., 1997. Experimental autoimmune encephalomyelitis: the antigen specificity of T lymphocytes determines the topography of lesions in the central and peripheral nervous system. Lab. Invest., 76, 355–64. Berland, R. & Wortis, H.H., 2002. Origins and functions of B-1 cells with notes on the role of CD5. Annu. Rev. Immunol., 20, 253–300. Bettelli, E., Carrier, Y., Gao, W., Korn, T., Strom, T.B., Oukka, M., Weiner, H.L., & Kuchroo, V.K., 2006. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature, 441, 235–8. Bettelli, E., Pagany, M., Weiner, H.L., Linington, C., Sobel, R. a, & Kuchroo, V.K., 2003. Myelin oligodendrocyte glycoprotein-specific T cell receptor transgenic mice develop spontaneous autoimmune optic neuritis. J. Exp. Med., 197, 1073–81. Bhattacharya, D., Cheah, M.T., Franco, C.B., Hosen, N., Pin, C.L., Sha, W.C., & Weissman, I.L., 2007. Transcriptional Profiling of Antigen-Dependent Murine B Cell Differentiation and Memory Formation. J. Immunol., 179, 6808–6819. Black, D.A., 1973. The measurement of renal function. Am. Heart J., 85, 147–52. Von Boehmer, H., 2005. Unique features of the pre-T-cell receptor alpha-chain: not just a surrogate. Nat. Rev. Immunol., 5, 571–7. 175 Literaturverzeichnis Bolland, S. & Ravetch, J. V, 2000. Spontaneous autoimmune disease in Fc(gamma)RIIB-deficient mice results from strain-specific epistasis. Immunity, 13, 277–85. Born, W.K., Zhang, L., Nakayama, M., Jin, N., Chain, J.L., Huang, Y., Aydintug, M.K., & O’Brien, R.L., 2011. Peptide antigens for gamma/delta T cells. Cell. Mol. Life Sci., 68, 2335–43. Bourette, R.P., Arnaud, S., Myles, G.M., Blanchet, J.P., Rohrschneider, L.R., & Mouchiroud, G., 1998. Mona, a novel hematopoietic-specific adaptor interacting with the macrophage colony-stimulating factor receptor, is implicated in monocyte/macrophage development. EMBO J., 17, 7273–81. Brabb, T., von Dassow, P., Ordonez, N., Schnabel, B., Duke, B., & Goverman, J., 2000. In situ tolerance within the central nervous system as a mechanism for preventing autoimmunity. J. Exp. Med., 192, 871–80. Breitfeld, D., Ohl, L., Kremmer, E., Ellwart, J., Sallusto, F., Lipp, M., & Förster, R., 2000. Follicular B helper T cells express CXC chemokine receptor 5, localize to B cell follicles, and support immunoglobulin production. J. Exp. Med., 192, 1545–52. Brooks, S.R., Li, X., Volanakis, E.J., & Carter, R.H., 2000. Systematic analysis of the role of CD19 cytoplasmic tyrosines in enhancement of activation in Daudi human B cells: clustering of phospholipase C and Vav and of Grb2 and Sos with different CD19 tyrosines. J. Immunol., 164, 3123–31. Brüstle, A., Heink, S., Huber, M., Rosenplänter, C., Stadelmann, C., Yu, P., Arpaia, E., Mak, T.W., Kamradt, T., & Lohoff, M., 2007. The development of inflammatory T(H)-17 cells requires interferon-regulatory factor 4. Nat. Immunol., 8, 958–66. Brunner, C., Marinkovic, D., Klein, J., Samardzic, T., Nitschke, L., & Wirth, T., 2003. B cellspecific transgenic expression of Bcl2 rescues early B lymphopoiesis but not B cell responses in BOB.1/OBF.1-deficient mice. J. Exp. Med., 197, 1205–11. Burstein, H.J., Tepper, R.I., Leder, P., & Abbas, A.K., 1991. Humoral immune functions in IL-4 transgenic mice. J. Immunol., 147, 2950–6. Busslinger, M., 2004. Transcriptional control of early B cell development. Annu. Rev. Immunol., 22, 55–79. Calamito, M., Juntilla, M.M., Thomas, M., Northrup, D.L., Rathmell, J., Birnbaum, M.J., Koretzky, G., & Allman, D., 2010. Akt1 and Akt2 promote peripheral B-cell maturation and survival. Blood, 115, 4043–50. Capone, M., Hockett, R.D., & Zlotnik, A., 1998. Kinetics of T cell receptor beta, gamma, and delta rearrangements during adult thymic development: T cell receptor rearrangements are present in CD44(+)CD25(+) Pro-T thymocytes. Proc. Natl. Acad. Sci. U. S. A., 95, 12522–7. Carman, J.A., Wechsler-Reya, R.J., & Monroe, J.G., 1996. Immature stage B cells enter but do not progress beyond the early G1 phase of the cell cycle in response to antigen receptor signaling. J. Immunol., 156, 4562–9. Casola, S., Cattoretti, G., Uyttersprot, N., Koralov, S.B., Seagal, J., Segal, J., Hao, Z., Waisman, A., Egert, A., Ghitza, D., & Rajewsky, K., 2006. Tracking germinal center B cells 176 Literaturverzeichnis expressing germ-line immunoglobulin gamma1 transcripts by conditional gene targeting. Proc. Natl. Acad. Sci. U. S. A., 103, 7396–401. Chan, V.W., Meng, F., Soriano, P., DeFranco, a L., & Lowell, C. a, 1997. Characterization of the B lymphocyte populations in Lyn-deficient mice and the role of Lyn in signal initiation and down-regulation. Immunity, 7, 69–81. Chen, C., Edelstein, L.C., & Gélinas, C., 2000. The Rel/NF-kappaB family directly activates expression of the apoptosis inhibitor Bcl-x(L). Mol. Cell. Biol., 20, 2687–95. Chen, Q., Yang, W., Gupta, S., Biswas, P., Smith, P., Bhagat, G., & Pernis, A.B., 2008. IRF-4binding protein inhibits interleukin-17 and interleukin-21 production by controlling the activity of IRF-4 transcription factor. Immunity, 29, 899–911. Cheng, A.M., Rowley, B., Pao, W., Hayday, A., Bolen, J.B., & Pawson, T., 1995. Syk tyrosine kinase required for mouse viability and B-cell development. Nature, 378, 303–6. Cheng, A.M., Saxton, T.M., Sakai, R., Kulkarni, S., Mbamalu, G., Vogel, W., Tortorice, C.G., Cardiff, R.D., Cross, J.C., Muller, W.J., & Pawson, T., 1998. Mammalian Grb2 regulates multiple steps in embryonic development and malignant transformation. Cell, 95, 793–803. Chiles, T.C., 2004. Regulation and function of cyclin D2 in B lymphocyte subsets. J. Immunol., 173, 2901–7. Christensen, J.L. & Weissman, I.L., 2001. Flk-2 is a marker in hematopoietic stem cell differentiation: a simple method to isolate long-term stem cells. Proc. Natl. Acad. Sci. U. S. A., 98, 14541–6. Ciofani, M., Knowles, G.C., Wiest, D.L., von Boehmer, H., & Zúñiga-Pflücker, J.C., 2006. Stagespecific and differential notch dependency at the alphabeta and gammadelta T lineage bifurcation. Immunity, 25, 105–16. Ciofani, M. & Zúñiga-Pflücker, J.C., 2005. Notch promotes survival of pre-T cells at the betaselection checkpoint by regulating cellular metabolism. Nat. Immunol., 6, 881–8. Ciofani, M. & Zúñiga-Pflücker, J.C., 2007. The thymus as an inductive site for T lymphopoiesis. Annu. Rev. Cell Dev. Biol., 23, 463–93. Crotty, S., 2011. Follicular helper CD4 T cells (TFH). Annu. Rev. Immunol., 29, 621–63. D’Orsogna, L.J., Nguyen, T.H.O., Claas, F.H.J., Witt, C., & Mifsud, N. a, 2013. Endogenouspeptide-dependent alloreactivity: new scientific insights and clinical implications. Tissue Antigens, 81, 399–407. D’Orsogna, L.J., Roelen, D.L., Doxiadis, I.I.N., & Claas, F.H.J., 2012. TCR cross-reactivity and allorecognition: new insights into the immunogenetics of allorecognition. Immunogenetics, 64, 77–85. Daëron, M., Jaeger, S., Du Pasquier, L., & Vivier, E., 2008. Immunoreceptor tyrosine-based inhibition motifs: a quest in the past and future. Immunol. Rev., 224, 11–43. Dell, C.L., Lu, Y.X., & Claflin, J.L., 1989. Molecular analysis of clonal stability and longevity in B cell memory. J. Immunol., 143, 3364–70. 177 Literaturverzeichnis Depoil, D., Fleire, S., Treanor, B.L., Weber, M., Harwood, N.E., Marchbank, K.L., Tybulewicz, V.L.J., & Batista, F.D., 2008. CD19 is essential for B cell activation by promoting B cell receptor-antigen microcluster formation in response to membrane-bound ligand. Nat. Immunol., 9, 63–72. DiPaolo, R.J., Brinster, C., Davidson, T.S., Andersson, J., Glass, D., & Shevach, E.M., 2007. Autoantigen-specific TGFbeta-induced Foxp3+ regulatory T cells prevent autoimmunity by inhibiting dendritic cells from activating autoreactive T cells. J. Immunol., 179, 4685–93. Dogan, I., Bertocci, B., Vilmont, V., Delbos, F., Mégret, J., Storck, S., Reynaud, C.-A., & Weill, J.-C., 2009. Multiple layers of B cell memory with different effector functions. Nat. Immunol., 10, 1292–9. Dong, C., Yang, D.D., Tournier, C., Whitmarsh, a J., Xu, J., Davis, R.J., & Flavell, R. a, 2000. JNK is required for effector T-cell function but not for T-cell activation. Nature, 405, 91–4. Dong, C., Yang, D.D., Wysk, M., Whitmarsh, A.J., Davis, R.J., & Flavell, R.A., 1998. Defective T cell differentiation in the absence of Jnk1. Science, 282, 2092–5. Dower, N.A., Stang, S.L., Bottorff, D.A., Ebinu, J.O., Dickie, P., Ostergaard, H.L., & Stone, J.C., 2000. RasGRP is essential for mouse thymocyte differentiation and TCR signaling. Nat. Immunol., 1, 317–21. Dutz, J.P., Ong, C.J., Marth, J., & Teh, H.S., 1995. Distinct differentiative stages of CD4+CD8+ thymocyte development defined by the lack of coreceptor binding in positive selection. J. Immunol., 154, 2588–99. Ehrhardt, A., David, M.D., Ehrhardt, G.R.A., & Schrader, J.W., 2004. Distinct mechanisms determine the patterns of differential activation of H-Ras, N-Ras, K-Ras 4B, and M-Ras by receptors for growth factors or antigen. Mol. Cell. Biol., 24, 6311–23. Ellis, J.H., Ashman, C., Burden, M.N., Kilpatrick, K.E., Morse, M. a., & Hamblin, P. a., 2000. GRID: a novel Grb-2-related adapter protein that interacts with the activated T cell costimulatory receptor CD28. J. Immunol., 164, 5805–14. Endres, R., Alimzhanov, M.B., Plitz, T., Fütterer, A., Kosco-Vilbois, M.H., Nedospasov, S.A., Rajewsky, K., & Pfeffer, K., 1999. Mature follicular dendritic cell networks depend on expression of lymphotoxin beta receptor by radioresistant stromal cells and of lymphotoxin beta and tumor necrosis factor by B cells. J. Exp. Med., 189, 159–68. Engels, N., König, L.M., Heemann, C., Lutz, J., Tsubata, T., Griep, S., Schrader, V., & Wienands, J., 2009. Recruitment of the cytoplasmic adaptor Grb2 to surface IgG and IgE provides antigen receptor-intrinsic costimulation to class-switched B cells. Nat. Immunol., 10, 1018– 25. Engels, N., König, L.M., Schulze, W., Radtke, D., Vanshylla, K., Lutz, J., Winkler, T.H., Nitschke, L., & Wienands, J., 2014. The immunoglobulin tail tyrosine motif upgrades memory-type BCRs by incorporating a Grb2-Btk signaling module. Nat. Commun., in press. Enzler, T., Bonizzi, G., Silverman, G.J., Otero, D.C., Widhopf, G.F., Anzelon-Mills, A., Rickert, R.C., & Karin, M., 2006. Alternative and classical NF-kappa B signaling retain autoreactive B cells in the splenic marginal zone and result in lupus-like disease. Immunity, 25, 403–15. 178 Literaturverzeichnis Espéli, M., Clatworthy, M.R., Bökers, S., Lawlor, K.E., Cutler, A.J., Köntgen, F., Lyons, P. a, & Smith, K.G.C., 2012. Analysis of a wild mouse promoter variant reveals a novel role for FcγRIIb in the control of the germinal center and autoimmunity. J. Exp. Med., 209, 2307– 19. Eyerich, S., Eyerich, K., Pennino, D., Carbone, T., Nasorri, F., Pallotta, S., Cianfarani, F., Odorisio, T., Traidl-Hoffmann, C., Behrendt, H., Durham, S.R., Schmidt-Weber, C.B., & Cavani, A., 2009. Th22 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling. J. Clin. Invest., 119, 3573–85. Fagarasan, S. & Honjo, T., 2000. T-Independent immune response: new aspects of B cell biology. Science, 290, 89–92. Feng, G.S., Ouyang, Y.B., Hu, D.P., Shi, Z.Q., Gentz, R., & Ni, J., 1996. Grap is a novel SH3SH2-SH3 adaptor protein that couples tyrosine kinases to the Ras pathway. J. Biol. Chem., 271, 12129–32. Feyerabend, T.B., Terszowski, G., Tietz, A., Blum, C., Luche, H., Gossler, A., Gale, N.W., Radtke, F., Fehling, H.J., & Rodewald, H.-R., 2009. Deletion of Notch1 converts pro-T cells to dendritic cells and promotes thymic B cells by cell-extrinsic and cell-intrinsic mechanisms. Immunity, 30, 67–79. Findlay, G.M., Smith, M.J., Lanner, F., Hsiung, M.S., Gish, G.D., Petsalaki, E., Cockburn, K., Kaneko, T., Huang, H., Bagshaw, R.D., Ketela, T., Tucholska, M., Taylor, L., Bowtell, D.D., Moffat, J., Ikura, M., Li, S.S.C., Sidhu, S.S., Rossant, J., & Pawson, T., 2013. Interaction Domains of Sos1/Grb2 Are Finely Tuned for Cooperative Control of Embryonic Stem Cell Fate. Cell, 152, 1008–1020. Foy, T.M., Lynch, R.G., & Waldschmidt, T.J., 1992. Ontogeny and distribution of the murine B cell Fc gamma RII. J. Immunol., 149, 1516–23. Friese, M. a & Fugger, L., 2005. Autoreactive CD8+ T cells in multiple sclerosis: a new target for therapy? Brain, 128, 1747–63. Fruman, D. a, Snapper, S.B., Yballe, C.M., Davidson, L., Yu, J.Y., Alt, F.W., & Cantley, L.C., 1999. Impaired B cell development and proliferation in absence of phosphoinositide 3kinase p85alpha. Science, 283, 393–7. Fu, G., Casas, J., Rigaud, S., Rybakin, V., Lambolez, F., Brzostek, J., Hoerter, J. a H., Paster, W., Acuto, O., Cheroutre, H., Sauer, K., & Gascoigne, N.R.J., 2013. Themis sets the signal threshold for positive and negative selection in T-cell development. Nature, 504, 441–5. Fujimoto, M., Poe, J.C., Hasegawa, M., & Tedder, T.F., 2000. CD19 regulates intrinsic B lymphocyte signal transduction and activation through a novel mechanism of processive amplification. Immunol. Res., 22, 281–98. Gagro, A., Toellner, K.-M., Grafton, G., Servis, D., Branica, S., Radojcić, V., Kosor, E., Hrabak, M., & Gordon, J., 2003. Naive and memory B cells respond differentially to T-dependent signaling but display an equal potential for differentiation toward the centroblast-restricted CD77/globotriaosylceramide phenotype. Eur. J. Immunol., 33, 1889–98. 179 Literaturverzeichnis Gerlach, J., Ghosh, S., Jumaa, H., Reth, M., Wienands, J., Chan, A.C., & Nitschke, L., 2003. B cell defects in SLP65/BLNK-deficient mice can be partially corrected by the absence of CD22, an inhibitory coreceptor for BCR signaling. Eur. J. Immunol., 33, 3418–26. Gong, Q., Cheng, A.M., Akk, A.M., Alberola-Ila, J., Gong, G., Pawson, T., & Chan, A.C., 2001. Disruption of T cell signaling networks and development by Grb2 haploid insufficiency. Nat. Immunol., 2, 29–36. Good, K.L., Avery, D.T., & Tangye, S.G., 2009. Resting human memory B cells are intrinsically programmed for enhanced survival and responsiveness to diverse stimuli compared to naive B cells. J. Immunol., 182, 890–901. Good, K.L. & Tangye, S.G., 2007. Decreased expression of Kruppel-like factors in memory B cells induces the rapid response typical of secondary antibody responses. Proc. Natl. Acad. Sci. U. S. A., 104, 13420–5. Goodnow, C.C., Vinuesa, C.G., Randall, K.L., Mackay, F., & Brink, R., 2010. Control systems and decision making for antibody production. Nat. Immunol., 11, 681–8. Gounari, F., Aifantis, I., Martin, C., Fehling, H.-J., Hoeflinger, S., Leder, P., von Boehmer, H., & Reizis, B., 2002. Tracing lymphopoiesis with the aid of a pTalpha-controlled reporter gene. Nat. Immunol., 3, 489–96. Goverman, J., Perchellet, A., & Huseby, E.S., 2005. The role of CD8(+) T cells in multiple sclerosis and its animal models. Curr. Drug Targets. Inflamm. Allergy, 4, 239–45. Gray, A., Van Der Kaay, J., & Downes, C.P., 1999. The pleckstrin homology domains of protein kinase B and GRP1 (general receptor for phosphoinositides-1) are sensitive and selective probes for the cellular detection of phosphatidylinositol 3,4-bisphosphate and/or phosphatidylinositol 3,4,5-trisphosphate. Biochem. J., 344 Pt 3, 929–36. Gross, A.J., Lyandres, J.R., Panigrahi, A.K., Prak, E.T.L., & DeFranco, A.L., 2009. Developmental acquisition of the Lyn-CD22-SHP-1 inhibitory pathway promotes B cell tolerance. J. Immunol., 182, 5382–92. Grumont, R.J., Rourke, I.J., & Gerondakis, S., 1999. Rel-dependent induction of A1 transcription is required to protect B cells from antigen receptor ligation-induced apoptosis. Genes Dev., 13, 400–11. Grumont, R.J., Rourke, I.J., O’Reilly, L.A., Strasser, A., Miyake, K., Sha, W., & Gerondakis, S., 1998. B lymphocytes differentially use the Rel and nuclear factor kappaB1 (NF-kappaB1) transcription factors to regulate cell cycle progression and apoptosis in quiescent and mitogen-activated cells. J. Exp. Med., 187, 663–74. Güler, M.L., Gorham, J.D., Hsieh, C.S., Mackey, A.J., Steen, R.G., Dietrich, W.F., & Murphy, K.M., 1996. Genetic susceptibility to Leishmania: IL-12 responsiveness in TH1 cell development. Science, 271, 984–7. Guéry, J.C., Galbiati, F., Smiroldo, S., & Adorini, L., 1997. Non-MHC-linked Th2 cell development induced by soluble protein administration predicts susceptibility to Leishmania major infection. J. Immunol., 159, 2147–53. 180 Literaturverzeichnis Hardy, R.R. & Hayakawa, K., 2001. B cell development pathways. Annu. Rev. Immunol., 19, 595–621. Hare, K.J., Jenkinson, E.J., & Anderson, G., 1999. CD69 expression discriminates MHCdependent and -independent stages of thymocyte positive selection. J. Immunol., 162, 3978– 83. Harmer, S.L. & DeFranco, a L., 1999. The src homology domain 2-containing inositol phosphatase SHIP forms a ternary complex with Shc and Grb2 in antigen receptorstimulated B lymphocytes. J. Biol. Chem., 274, 12183–91. Harrington, L.E., Hatton, R.D., Mangan, P.R., Turner, H., Murphy, T.L., Murphy, K.M., & Weaver, C.T., 2005. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat. Immunol., 6, 1123–32. Hashimoto, a., Takeda, K., Inaba, M., Sekimata, M., Kaisho, T., Ikehara, S., Homma, Y., Akira, S., & Kurosaki, T., 2000. Cutting Edge: Essential Role of Phospholipase C- 2 in B Cell Development and Function. J. Immunol., 165, 1738–1742. Hayashi, K., Nittono, R., Okamoto, N., Tsuji, S., Hara, Y., Goitsuka, R., & Kitamura, D., 2000. The B cell-restricted adaptor BASH is required for normal development and antigen receptor-mediated activation of B cells. Proc. Natl. Acad. Sci. U. S. A., 97, 2755–60. Hebeis, B.J., Klenovsek, K., Rohwer, P., Ritter, U., Schneider, A., Mach, M., & Winkler, T.H., 2004. Activation of virus-specific memory B cells in the absence of T cell help. J. Exp. Med., 199, 593–602. Hickey, W.F., 1991. Migration of hematogenous cells through the blood-brain barrier and the initiation of CNS inflammation. Brain Pathol., 1, 97–105. Hobeika, E., Thiemann, S., Storch, B., Jumaa, H., Nielsen, P.J., Pelanda, R., & Reth, M., 2006. Testing gene function early in the B cell lineage in mb1-cre mice. Proc. Natl. Acad. Sci. U.S.A., 103, 13789–94. Hoek, K.L., Antony, P., Lowe, J., Shinners, N., Sarmah, B., Wente, S.R., Wang, D., Gerstein, R.M., & Khan, W.N., 2006. Transitional B Cell Fate Is Associated with Developmental Stage-Specific Regulation of Diacylglycerol and Calcium Signaling upon B Cell Receptor Engagement. J. Immunol., 177, 5405–5413. Honjo, T., Kinoshita, K., & Muramatsu, M., 2002. Molecular mechanism of class switch recombination: linkage with somatic hypermutation. Annu. Rev. Immunol., 20, 165–96. Hough, M.R., Takei, F., Humphries, R.K., & Kay, R., 1994. Defective development of thymocytes overexpressing the costimulatory molecule, heat-stable antigen. J. Exp. Med., 179, 177–84. Hozumi, K., Mailhos, C., Negishi, N., Hirano, K., Yahata, T., Ando, K., Zuklys, S., Holländer, G. a, Shima, D.T., & Habu, S., 2008. Delta-like 4 is indispensable in thymic environment specific for T cell development. J. Exp. Med., 205, 2507–13. Hsu, B.L., Harless, S.M., Lindsley, R.C., Hilbert, D.M., & Cancro, M.P., 2002. Cutting edge: BLyS enables survival of transitional and mature B cells through distinct mediators. J. Immunol., 168, 5993–6. 181 Literaturverzeichnis Huang, J., Durum, S.K., & Muegge, K., 2001. Cutting edge: histone acetylation and recombination at the TCR gamma locus follows IL-7 induction. J. Immunol., 167, 6073–7. Igarashi, H., Gregory, S.C., Yokota, T., Sakaguchi, N., & Kincade, P.W., 2002. Transcription from the RAG1 Locus Marks the Earliest Lymphocyte Progenitors in Bone Marrow. Immunity, 17, 117–130. Ivanov, I.I., McKenzie, B.S., Zhou, L., Tadokoro, C.E., Lepelley, A., Lafaille, J.J., Cua, D.J., & Littman, D.R., 2006. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell, 126, 1121–33. Jacob, J., Kelsoe, G., Rajewsky, K., & Weiss, U., 1991. Intraclonal generation of antibody mutants in germinal centres. Nature, 354, 389–92. Jäger, A., Dardalhon, V., Sobel, R. a, Bettelli, E., & Kuchroo, V.K., 2009. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J. Immunol., 183, 7169–77. Janas, M.L., Varano, G., Gudmundsson, K., Noda, M., Nagasawa, T., & Turner, M., 2010. Thymic development beyond beta-selection requires phosphatidylinositol 3-kinase activation by CXCR4. J. Exp. Med., 207, 247–61. Jang, I.K., Cronshaw, D.G., Xie, L.-K., Fang, G., Zhang, J., Oh, H., Fu, Y.-X., Gu, H., & Zou, Y., 2011. Growth-factor receptor-bound protein-2 (Grb2) signaling in B cells controls lymphoid follicle organization and germinal center reaction. Proc. Natl. Acad. Sci. U. S. A., 2, 2–7. Jang, I.K., Zhang, J., Chiang, Y.J., Kole, H.K., Cronshaw, D.G., Zou, Y., & Gu, H., 2010. Grb2 functions at the top of the T-cell antigen receptor-induced tyrosine kinase cascade to control thymic selection. Proc. Natl. Acad. Sci. U. S. A., 107, 10620–5. Jellusova, J. & Nitschke, L., 2012. Regulation of B Cell Functions by the Sialic Acid-Binding Receptors Siglec-G and CD22. Front. Immunol., 2. Jenkinson, E.J., Kingston, R., & Owen, J.J., 1990. Newly generated thymocytes are not refractory to deletion when the alpha/beta component of the T cell receptor is engaged by the superantigen staphylococcal enterotoxin B. Eur. J. Immunol., 20, 2517–20. Jiang, Y., Hirose, S., Abe, M., Sanokawa-Akakura, R., Ohtsuji, M., Mi, X., Li, N., Xiu, Y., Zhang, D., Shirai, J., Hamano, Y., Fujii, H., & Shirai, T., 2000. Polymorphisms in IgG Fc receptor IIB regulatory regions associated with autoimmune susceptibility. Immunogenetics, 51, 429–35. Johnson, A.J., Suidan, G.L., McDole, J., & Pirko, I., 2007. The CD8 T cell in multiple sclerosis: suppressor cell or mediator of neuropathology? Int. Rev. Neurobiol., 79, 73–97. Johnston, R.J., Poholek, A.C., DiToro, D., Yusuf, I., Eto, D., Barnett, B., Dent, A.L., Craft, J., & Crotty, S., 2009. Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science, 325, 1006–10. Jumaa, H., Wollscheid, B., Mitterer, M., Wienands, J., Reth, M., & Nielsen, P.J., 1999. Abnormal development and function of B lymphocytes in mice deficient for the signaling adaptor protein SLP-65. Immunity, 11, 547–54. 182 Literaturverzeichnis Junt, T., Tumanov, A. V, Harris, N., Heikenwalder, M., Zeller, N., Kuprash, D. V, Aguzzi, A., Ludewig, B., Nedospasov, S. a, & Zinkernagel, R.M., 2006. Expression of lymphotoxin beta governs immunity at two distinct levels. Eur. J. Immunol., 36, 2061–75. Kabat, E.A., Wolf, A., & Bezer, A.E., 1947. THE RAPID PRODUCTION OF ACUTE DISSEMINATED ENCEPHALOMYELITIS IN RHESUS MONKEYS BY INJECTION OF HETEROLOGOUS AND HOMOLOGOUS BRAIN TISSUE WITH ADJUVANTS. J. Exp. Med., 85, 117–30. Kang, J., Volkmann, A., & Raulet, D.H., 2001. Evidence that gammadelta versus alphabeta T cell fate determination is initiated independently of T cell receptor signaling. J. Exp. Med., 193, 689–98. Kaplan, M.H., 2013. Th9 cells: differentiation and disease. Immunol. Rev., 252, 104–15. Kaplan, M.H., Schindler, U., Smiley, S.T., & Grusby, M.J., 1996. Stat6 is required for mediating responses to IL-4 and for development of Th2 cells. Immunity, 4, 313–9. Kaplan, M.H., Sun, Y.L., Hoey, T., & Grusby, M.J., 1996. Impaired IL-12 responses and enhanced development of Th2 cells in Stat4-deficient mice. Nature, 382, 174–7. Kawakami, N., Lassmann, S., Li, Z., Odoardi, F., Ritter, T., Ziemssen, T., Klinkert, W.E.F., Ellwart, J.W., Bradl, M., Krivacic, K., Lassmann, H., Ransohoff, R.M., Volk, H.-D., Wekerle, H., Linington, C., & Flügel, A., 2004. The activation status of neuroantigenspecific T cells in the target organ determines the clinical outcome of autoimmune encephalomyelitis. J. Exp. Med., 199, 185–97. Kerfoot, S.M., Yaari, G., Patel, J.R., Johnson, K.L., Gonzalez, D.G., Kleinstein, S.H., & Haberman, A.M., 2011. Germinal center B cell and T follicular helper cell development initiates in the interfollicular zone. Immunity, 34, 947–60. Kerner, J.D., Appleby, M.W., Mohr, R.N., Chien, S., Rawlings, D.J., Maliszewski, C.R., Witte, O.N., & Perlmutter, R.M., 1995. Impaired expansion of mouse B cell progenitors lacking Btk. Immunity, 3, 301–12. Kessels, H.W.H.G., Ward, A.C., & Schumacher, T.N.M., 2002. Specificity and affinity motifs for Grb2 SH2-ligand interactions. Proc. Natl. Acad. Sci. U. S. A., 99, 8524–9. Khan, W.N., Alt, F.W., Gerstein, R.M., Malynn, B. a, Larsson, I., Rathbun, G., Davidson, L., Müller, S., Kantor, a B., & Herzenberg, L. a, 1995. Defective B cell development and function in Btk-deficient mice. Immunity, 3, 283–99. Kinoshita, K., Harigai, M., Fagarasan, S., Muramatsu, M., & Honjo, T., 2001. A hallmark of active class switch recombination: transcripts directed by I promoters on looped-out circular DNAs. Proc. Natl. Acad. Sci. U. S. A., 98, 12620–3. Kishimoto, H. & Sprent, J., 1997. Negative selection in the thymus includes semimature T cells. J. Exp. Med., 185, 263–71. Kisielow, P., Blüthmann, H., Staerz, U.D., Steinmetz, M., & von Boehmer, H., 1988. Tolerance in T-cell-receptor transgenic mice involves deletion of nonmature CD4+8+ thymocytes. Nature, 333, 742–6. 183 Literaturverzeichnis Kitano, M., Moriyama, S., Ando, Y., Hikida, M., Mori, Y., Kurosaki, T., & Okada, T., 2011. Bcl6 protein expression shapes pre-germinal center B cell dynamics and follicular helper T cell heterogeneity. Immunity, 34, 961–72. Klein, L., Hinterberger, M., Wirnsberger, G., & Kyewski, B., 2009. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat. Rev. Immunol., 9, 833–44. Klinman, N.R. & Doughty, R.A., 1973. Hapten-specific stimulation of secondary B cells independent of T cells. J. Exp. Med., 138, 473–8. Koch, U., Fiorini, E., Benedito, R., Besseyrias, V., Schuster-Gossler, K., Pierres, M., Manley, N.R., Duarte, A., Macdonald, H.R., & Radtke, F., 2008. Delta-like 4 is the essential, nonredundant ligand for Notch1 during thymic T cell lineage commitment. J. Exp. Med., 205, 2515–23. Koch, U. & Radtke, F., 2011. Mechanisms of T cell development and transformation. Annu. Rev. Cell Dev. Biol., 27, 539–62. Kometani, K., Nakagawa, R., Shinnakasu, R., Kaji, T., Rybouchkin, A., Moriyama, S., Furukawa, K., Koseki, H., Takemori, T., & Kurosaki, T., 2013. Repression of the transcription factor Bach2 contributes to predisposition of IgG1 memory B cells toward plasma cell differentiation. Immunity, 39, 136–47. Korn, T., Bettelli, E., Oukka, M., & Kuchroo, V.K., 2009. IL-17 and Th17 Cells. Annu. Rev. Immunol., 27, 485–517. Kos, C.H., 2004. Methods in Nutrition Science: Cre/loxP System for Generating Tissue-specific Knockout Mouse Models. Nutr. Rev., 62, 243–246. Kuchroo, V.K., Anderson, A.C., Waldner, H., Munder, M., Bettelli, E., & Nicholson, L.B., 2002. T cell response in experimental autoimmune encephalomyelitis (EAE): role of self and cross-reactive antigens in shaping, tuning, and regulating the autopathogenic T cell repertoire. Annu. Rev. Immunol., 20, 101–23. Kurosaki, T., 2002. Regulation of B-cell signal transduction by adaptor proteins. Nat. Rev. Immunol., 2, 354–63. Kurosaki, T., Shinohara, H., & Baba, Y., 2010. B cell signaling and fate decision. Annu. Rev. Immunol., 28, 21–55. Lassmann, H. & Ransohoff, R.M., 2004. The CD4-Th1 model for multiple sclerosis: a critical [correction of crucial] re-appraisal. Trends Immunol., 25, 132–7. Launois, P., Swihart, K.G., Milon, G., & Louis, J.A., 1997. Early production of IL-4 in susceptible mice infected with Leishmania major rapidly induces IL-12 unresponsiveness. J. Immunol., 158, 3317–24. Lauritsen, J.P.H., Wong, G.W., Lee, S.-Y., Lefebvre, J.M., Ciofani, M., Rhodes, M., Kappes, D.J., Zúñiga-Pflücker, J.C., & Wiest, D.L., 2009. Marked induction of the helix-loop-helix protein Id3 promotes the gammadelta T cell fate and renders their functional maturation Notch independent. Immunity, 31, 565–75. 184 Literaturverzeichnis Law, C.L., Ewings, M.K., Chaudhary, P.M., Solow, S.A., Yun, T.J., Marshall, A.J., Hood, L., & Clark, E.A., 1999. GrpL, a Grb2-related adaptor protein, interacts with SLP-76 to regulate nuclear factor of activated T cell activation. J. Exp. Med., 189, 1243–53. Lebar, R. & Vincent, C., 1981. Tentative identification of a second central nervous system myelin membrane autoantigen (M2) by a biochemical comparison with the basic protein (BP). J. Neuroimmunol., 1, 367–89. Lee, P.P., Fitzpatrick, D.R., Beard, C., Jessup, H.K., Lehar, S., Makar, K.W., Pérez-Melgosa, M., Sweetser, M.T., Schlissel, M.S., Nguyen, S., Cherry, S.R., Tsai, J.H., Tucker, S.M., Weaver, W.M., Kelso, A., Jaenisch, R., & Wilson, C.B., 2001. A critical role for Dnmt1 and DNA methylation in T cell development, function, and survival. Immunity, 15, 763–74. Levine, S. & Sowinski, R., 1973. Experimental allergic encephalomyelitis in inbred and outbred mice. J. Immunol., 110, 139–43. Levine, S., Wenk, E.J., Devlin, H.B., Pieroni, R.E., & Levine, L., 1966. Hyperacute allergic encephalomyelitis: adjuvant effect of pertussis vaccines and extracts. J. Immunol., 97, 363– 8. Lindquist, J. a, Simeoni, L., & Schraven, B., 2003. Transmembrane adapters: attractants for cytoplasmic effectors. Immunol. Rev., 191, 165–82. Linington, C., Bradl, M., Lassmann, H., Brunner, C., & Vass, K., 1988. Augmentation of demyelination in rat acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a myelin/oligodendrocyte glycoprotein. Am. J. Pathol., 130, 443– 54. Linnington, C., Webb, M., & Woodhams, P.L., 1984. A novel myelin-associated glycoprotein defined by a mouse monoclonal antibody. J. Neuroimmunol., 6, 387–96. Liu, S.K., Fang, N., Koretzky, G. a., & McGlade, C.J., 1999. The hematopoietic-specific adaptor protein gads functions in T-cell signaling via interactions with the SLP-76 and LAT adaptors. Curr. Biol., 9, 67–75. Liu, S.K. & McGlade, C.J., 1998. Gads is a novel SH2 and SH3 domain-containing adaptor protein that binds to tyrosine-phosphorylated Shc. Oncogene, 17, 3073–82. Liu, S.K., Smith, C. a., Arnold, R., Kiefer, F., & McGlade, C.J., 2000. The Adaptor Protein Gads (Grb2-Related Adaptor Downstream of Shc) Is Implicated in Coupling Hemopoietic Progenitor Kinase-1 to the Activated TCR. J. Immunol., 165, 1417–1426. Liu, W., Meckel, T., Tolar, P., Won Sohn, H., & Pierce, S.K., 2010. Intrinsic Properties of immunoglobulin IgG1 Isotype-Switched B Cell Receptors Promote Microclustering and the Initiation of Signaling. Immunity, 32, 778–789. Liu, Y.J., Joshua, D.E., Williams, G.T., Smith, C.A., Gordon, J., & MacLennan, I.C., 1989. Mechanism of antigen-driven selection in germinal centres. Nature, 342, 929–31. Livák, F., Tourigny, M., Schatz, D.G., & Petrie, H.T., 1999. Characterization of TCR gene rearrangements during adult murine T cell development. J. Immunol., 162, 2575–80. 185 Literaturverzeichnis Loder, F., Mutschler, B., Ray, R JPaige, C.J., Sideras, P., Torres, R., Lamers, M.C., & Carsetti, R., 1999. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med., 190, 75–89. Lösing, M., Goldbeck, I., Manno, B., Oellerich, T., Schnyder, T., Bohnenberger, H., Stork, B., Urlaub, H., Batista, F.D., Wienands, J., & Engelke, M., 2012. The Dok-3/Grb2 signal module attenuates Lyn-dependent activation of Syk in B cell antigen receptor microclusters. J. Biol. Chem. Lowenstein, E.J., Daly, R.J., Batzer, a G., Li, W., Margolis, B., Lammers, R., Ullrich, A., Skolnik, E.Y., Bar-Sagi, D., & Schlessinger, J., 1992. The SH2 and SH3 domain-containing protein GRB2 links receptor tyrosine kinases to ras signaling. Cell, 70, 431–42. Lucchinetti, C., Brück, W., Parisi, J., Scheithauer, B., Rodriguez, M., & Lassmann, H., 2000. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann. Neurol., 47, 707–17. MacLennan, I.C., 1994. Germinal centers. Annu. Rev. Immunol., 12, 117–39. Mahler, M. & Fritzler, M.J., 2012. The clinical significance of the dense fine speckled immunofluorescence pattern on HEp-2 cells for the diagnosis of systemic autoimmune diseases. Clin. Dev. Immunol., 2012, 494356. Maillard, I., Tu, L., Sambandam, A., Yashiro-Ohtani, Y., Millholland, J., Keeshan, K., Shestova, O., Xu, L., Bhandoola, A., & Pear, W.S., 2006. The requirement for Notch signaling at the beta-selection checkpoint in vivo is absolute and independent of the pre-T cell receptor. J. Exp. Med., 203, 2239–45. Mangan, P.R., Harrington, L.E., O’Quinn, D.B., Helms, W.S., Bullard, D.C., Elson, C.O., Hatton, R.D., Wahl, S.M., Schoeb, T.R., & Weaver, C.T., 2006. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature, 441, 231–4. Martin, F. & Kearney, J.F., 2001. B1 cells: similarities and differences with other B cell subsets. Curr. Opin. Immunol., 13, 195–201. Martin, S.W. & Goodnow, C.C., 2002. Burst-enhancing role of the IgG membrane tail as a molecular determinant of memory. Nat. Immunol., 3, 182–8. Matloubian, M., Lo, C.G., Cinamon, G., Lesneski, M.J., Xu, Y., Brinkmann, V., Allende, M.L., Proia, R.L., & Cyster, J.G., 2004. Lymphocyte egress from thymus and peripheral lymphoid organs is dependent on S1P receptor 1. Nature, 427, 355–60. Matuoka, K., Shibata, M., Yamakawa, A., & Takenawa, T., 1992. Cloning of ASH, a ubiquitous protein composed of one Src homology region (SH) 2 and two SH3 domains, from human and rat cDNA libraries. Proc. Natl. Acad. Sci. U. S. A., 89, 9015–9. McCombe, P.A., Fordyce, B.W., de Jersey, J., Yoong, G., & Pender, M.P., 1992. Expression of CD45RC and Ia antigen in the spinal cord in acute experimental allergic encephalomyelitis: an immunocytochemical and flow cytometric study. J. Neurol. Sci., 113, 177–86. McDevitt, H.O., Perry, R., & Steinman, L.A., 1987. Monoclonal anti-Ia antibody therapy in animal models of autoimmune disease. Ciba Found. Symp., 129, 184–93. 186 Literaturverzeichnis McDole, J., Johnson, A.J., & Pirko, I., 2006. The role of CD8+ T-cells in lesion formation and axonal dysfunction in multiple sclerosis. Neurol. Res., 28, 256–61. McMahon, E.J., Bailey, S.L., Castenada, C.V., Waldner, H., & Miller, S.D., 2005. Epitope spreading initiates in the CNS in two mouse models of multiple sclerosis. Nat. Med., 11, 335–9. Meade, J., Fernandez, C., & Turner, M., 2002. The tyrosine kinase Lyn is required for B cell development beyond the T1 stage in the spleen: rescue by over-expression of Bcl-2. Eur. J. Immunol., 32, 1029–34. Merkenschlager, M., Graf, D., Lovatt, M., Bommhardt, U., Zamoyska, R., & Fisher, a G., 1997. How many thymocytes audition for selection? J. Exp. Med., 186, 1149–58. Meyer-Bahlburg, A., Andrews, S.F., Yu, K.O. a, Porcelli, S. a, & Rawlings, D.J., 2008. Characterization of a late transitional B cell population highly sensitive to BAFF-mediated homeostatic proliferation. J. Exp. Med., 205, 155–68. Minegishi, Y., Rohrer, J., Coustan-Smith, E., Lederman, H.M., Pappu, R., Campana, D., Chan, A.C., & Conley, M.E., 1999. An essential role for BLNK in human B cell development. Science, 286, 1954–7. Miosge, L. a & Goodnow, C.C., 2005. Genes, pathways and checkpoints in lymphocyte development and homeostasis. Immunol. Cell Biol., 83, 318–35. Miossec, P., Korn, T., & Kuchroo, V.K., 2009. Interleukin-17 and type 17 helper T cells. N. Engl. J. Med., 361, 888–98. Murphy, K.M., Heimberger, A.B., & Loh, D.Y., 1990. Induction by antigen of intrathymic apoptosis of CD4+CD8+TCRlo thymocytes in vivo. Science, 250, 1720–3. Myung, P.S., Boerthe, N.J., & Koretzky, G. a, 2000. Adapter proteins in lymphocyte antigenreceptor signaling. Curr. Opin. Immunol., 12, 256–66. Nakayamada, S., Takahashi, H., Kanno, Y., & O’Shea, J.J., 2012. Helper T cell diversity and plasticity. Curr. Opin. Immunol., 24, 297–302. Neumann, K., Oellerich, T., Heine, I., Urlaub, H., & Engelke, M., 2011. Fc gamma receptor IIb modulates the molecular Grb2 interaction network in activated B cells. Cell. Signal., 23, 893–900. Neumann, K., Oellerich, T., Urlaub, H., & Wienands, J., 2009. The B-lymphoid Grb2 interaction code. Immunol. Rev., 232, 135–49. Niiro, H. & Clark, E.A., 2002. Regulation of B-cell fate by antigen-receptor signals. Nat. Rev. Immunol., 2, 945–56. Nikolić-Zugić, J. & Bevan, M.J., 1990. Functional and phenotypic delineation of two subsets of CD4 single positive cells in the thymus. Int. Immunol., 2, 135–41. Nitschke, L., 2005. The role of CD22 and other inhibitory co-receptors in B-cell activation. Curr. Opin. Immunol., 17, 290–7. 187 Literaturverzeichnis Nurieva, R.I., Chung, Y., Martinez, G.J., Yang, X.O., Tanaka, S., Matskevitch, T.D., Wang, Y.H., & Dong, C., 2009. Bcl6 mediates the development of T follicular helper cells. Science, 325, 1001–5. O’Garra, A. & Arai, N., 2000. The molecular basis of T helper 1 and T helper 2 cell differentiation. Trends Cell Biol., 10, 542–50. O’Shea, C.C., Crompton, T., Rosewell, I.R., Hayday, a C., & Owen, M.J., 1996. Raf regulates positive selection. Eur. J. Immunol., 26, 2350–5. O’Shea, J.J. & Paul, W.E., 2010. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science, 327, 1098–102. Oh-hora, M., Johmura, S., Hashimoto, A., Hikida, M., & Kurosaki, T., 2003. Requirement for Ras guanine nucleotide releasing protein 3 in coupling phospholipase C-gamma2 to Ras in B cell receptor signaling. J. Exp. Med., 198, 1841–51. Ono, M., Bolland, S., Tempst, P., & Ravetch, J. V, 1996. Role of the inositol phosphatase SHIP in negative regulation of the immune system by the receptor Fc(gamma)RIIB. Nature, 383, 263–6. Ono, M., Okada, H., Bolland, S., Yanagi, S., Kurosaki, T., & Ravetch, J. V, 1997. Deletion of SHIP or SHP-1 reveals two distinct pathways for inhibitory signaling. Cell, 90, 293–301. Oracki, S. a, Walker, J. a, Hibbs, M.L., Corcoran, L.M., & Tarlinton, D.M., 2010. Plasma cell development and survival. Immunol. Rev., 237, 140–59. Orban, P.C., Chui, D., & Marth, J.D., 1992. Tissue- and site-specific DNA recombination in transgenic mice. Proc. Natl. Acad. Sci. U.S.A., 89, 6861–5. Otipoby, K.L., Sasaki, Y., Schmidt-Supprian, M., Patke, A., Gareus, R., Pasparakis, M., Tarakhovsky, A., & Rajewsky, K., 2008. BAFF activates Akt and Erk through BAFF-R in an IKK1-dependent manner in primary mouse B cells. Proc. Natl. Acad. Sci. U. S. A., 105, 12435–8. Pagès, G., Guérin, S., Grall, D., Bonino, F., Smith, A., Anjuere, F., Auberger, P., & Pouysségur, J., 1999. Defective thymocyte maturation in p44 MAP kinase (Erk 1) knockout mice. Science, 286, 1374–7. Pape, K. a, Taylor, J.J., Maul, R.W., Gearhart, P.J., & Jenkins, M.K., 2011. Different B cell populations mediate early and late memory during an endogenous immune response. Science, 331, 1203–7. Pappu, R., Cheng, A.M., Li, B., Gong, Q., Chiu, C., Griffin, N., White, M., Sleckman, B.P., & Chan, A.C., 1999. Requirement for B cell linker protein (BLNK) in B cell development. Science, 286, 1949–54. Park, H., Li, Z., Yang, X.O., Chang, S.H., Nurieva, R., Wang, Y.-H., Wang, Y., Hood, L., Zhu, Z., Tian, Q., & Dong, C., 2005. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17. Nat. Immunol., 6, 1133–41. 188 Literaturverzeichnis Paster, W., Brockmeyer, C., Fu, G., Simister, P.C., de Wet, B., Martinez-Riano, A., Hoerter, J. a. H., Feller, S.M., Wulfing, C., Gascoigne, N.R.J., & Acuto, O., 2013. GRB2-Mediated Recruitment of THEMIS to LAT Is Essential for Thymocyte Development. J. Immunol. Paul, W.E. & Seder, R.A., 1994. Lymphocyte responses and cytokines. Cell, 76, 241–51. Pawson, T. & Gish, G.D., 1992. SH2 and SH3 domains: from structure to function. Cell, 71, 359– 62. Petrie, H.T. & Zúñiga-Pflücker, J.C., 2007. Zoned out: functional mapping of stromal signaling microenvironments in the thymus. Annu. Rev. Immunol., 25, 649–79. Petro, J.B., Gerstein, R.M., Lowe, J., Carter, R.S., Shinners, N., & Khan, W.N., 2002. Transitional type 1 and 2 B lymphocyte subsets are differentially responsive to antigen receptor signaling. J. Biol. Chem., 277, 48009–19. Pillai, S., Cariappa, A., & Moran, S.T., 2005. Marginal zone B cells. Annu. Rev. Immunol., 23, 161–96. Poe, J.C., Fujimoto, M., Jansen, P.J., Miller, a S., & Tedder, T.F., 2000. CD22 forms a quaternary complex with SHIP, Grb2, and Shc. A pathway for regulation of B lymphocyte antigen receptor-induced calcium flux. J. Biol. Chem., 275, 17420–7. Porritt, H.E., Gordon, K., & Petrie, H.T., 2003. Kinetics of steady-state differentiation and mapping of intrathymic-signaling environments by stem cell transplantation in nonirradiated mice. J. Exp. Med., 198, 957–62. Qiu, M., Hua, S., Agrawal, M., Li, G., Cai, J., Chan, E., Zhou, H., Luo, Y., & Liu, M., 1998. Molecular cloning and expression of human grap-2, a novel leukocyte-specific SH2- and SH3-containing adaptor-like protein that binds to gab-1. Biochem. Biophys. Res. Commun., 253, 443–7. Raine, C.S., Traugott, U., & Stone, S.H., 1978. Chronic relapsing experimental allergic encephalomyelitis: CNS plaque development in unsuppressed and suppressed animals. Acta Neuropathol., 43, 43–53. Rajewsky, K., Gu, H., Kühn, R., Betz, U.A., Müller, W., Roes, J., & Schwenk, F., 1996. Conditional gene targeting. J. Clin. Invest., 98, 600–3. Ramsdell, F., Jenkins, M., Dinh, Q., & Fowlkes, B.J., 1991. The majority of CD4+8- thymocytes are functionally immature. J. Immunol., 147, 1779–85. Rangachari, M. & Kuchroo, V.K., 2013. Using EAE to better understand principles of immune function and autoimmune pathology. J. Autoimmun., 45, 31–9. Ren, R., Mayer, B.J., Cicchetti, P., & Baltimore, D., 1993. Identification of a ten-amino acid proline-rich SH3 binding site. Science, 259, 1157–61. Reth, M., 1992. Antigen receptors on B lymphocytes. Annu. Rev. Immunol., 10, 97–121. Rincón, M., Conze, D., Weiss, L., Diehl, N.L., Fortner, K.A., Yang, D., Flavell, R.A., Enslen, H., Whitmarsh, A., & Davis, R.J., 2000. Conference highlight: do T cells care about the mitogen-activated protein kinase signalling pathways? Immunol. Cell Biol., 78, 166–75. 189 Literaturverzeichnis Rincón, M., Flavell, R.A., & Davis, R.A., 2000. The JNK and P38 MAP kinase signaling pathways in T cell-mediated immune responses. Free Radic. Biol. Med., 28, 1328–37. Rincón, M., Whitmarsh, A., Yang, D.D., Weiss, L., Dérijard, B., Jayaraj, P., Davis, R.J., & Flavell, R.A., 1998. The JNK pathway regulates the In vivo deletion of immature CD4(+)CD8(+) thymocytes. J. Exp. Med., 188, 1817–30. Sabapathy, K., Hu, Y., Kallunki, T., Schreiber, M., David, J.P., Jochum, W., Wagner, E.F., & Karin, M., 1999. JNK2 is required for efficient T-cell activation and apoptosis but not for normal lymphocyte development. Curr. Biol., 9, 116–25. Saito, T., Chiba, S., Ichikawa, M., Kunisato, A., Asai, T., Shimizu, K., Yamaguchi, T., Yamamoto, G., Seo, S., Kumano, K., Nakagami-Yamaguchi, E., Hamada, Y., Aizawa, S., & Hirai, H., 2003. Notch2 is preferentially expressed in mature B cells and indispensable for marginal zone B lineage development. Immunity, 18, 675–85. Sakuma, H., Kohyama, K., Park, I.-K., Miyakoshi, A., Tanuma, N., & Matsumoto, Y., 2004. Clinicopathological study of a myelin oligodendrocyte glycoprotein-induced demyelinating disease in LEW.1AV1 rats. Brain, 127, 2201–13. Samelson, L.E., 1999. Adaptor proteins and T-cell antigen receptor signaling. Prog. Biophys. Mol. Biol., 71, 393–403. Samelson, L.E., 2002. Signal transduction mediated by the T cell antigen receptor: the role of adapter proteins. Annu. Rev. Immunol., 20, 371–94. Samelson, L.E., Donovan, J.A., Isakov, N., Ota, Y., & Wange, R.L., 1995. Signal transduction mediated by the T-cell antigen receptor. Ann. N. Y. Acad. Sci., 766, 157–72. Sasaki, Y., Casola, S., Kutok, J.L., Rajewsky, K., & Schmidt-Supprian, M., 2004. TNF Family Member B Cell-Activating Factor (BAFF) Receptor-Dependent and -Independent Roles for BAFF in B Cell Physiology. J. Immunol., 173, 2245–2252. Sawada, S., Scarborough, J.D., Killeen, N., & Littman, D.R., 1994. A lineage-specific transcriptional silencer regulates CD4 gene expression during T lymphocyte development. Cell, 77, 917–29. Schaeffer, E.M. & Schwartzberg, P.L., 2000. Tec family kinases in lymphocyte signaling and function. Curr. Opin. Immunol., 12, 282–8. Schaerli, P., Willimann, K., Lang, a. B., Lipp, M., Loetscher, P., & Moser, B., 2000. CXC chemokine receptor 5 expression defines follicular homing T cells with B cell helper function. J. Exp. Med., 192, 1553–62. Schiemann, B., Gommerman, J.L., Vora, K., Cachero, T.G., Shulga-Morskaya, S., Dobles, M., Frew, E., & Scott, M.L., 2001. An essential role for BAFF in the normal development of B cells through a BCMA-independent pathway. Science, 293, 2111–4. Schiffenbauer, J., Butfiloski, E., Hanley, G., Sobel, E.S., Streit, W.J., & Lazarovits, A., 1998. Prevention of experimental allergic encephalomyelitis by an antibody to CD45RB. Cell. Immunol., 190, 173–82. 190 Literaturverzeichnis Schnyder, T., Castello, A., Feest, C., Harwood, N.E., Oellerich, T., Urlaub, H., Engelke, M., Wienands, J., Bruckbauer, A., & Batista, F.D., 2011. B cell receptor-mediated antigen gathering requires ubiquitin ligase cbl and adaptors grb2 and dok-3 to recruit Dynein to the signaling microcluster. Immunity, 34, 905–18. Schweighoffer, E., Vanes, L., Nys, J., Cantrell, D., McCleary, S., Smithers, N., & Tybulewicz, V.L.J., 2013. The BAFF receptor transduces survival signals by co-opting the B cell receptor signaling pathway. Immunity, 38, 475–88. Seamons, A., Perchellet, A., & Goverman, J., 2003. Immune tolerance to myelin proteins. Immunol. Res., 28, 201–21. Shen, P., Roch, T., Lampropoulou, V., O’Connor, R. a, Stervbo, U., Hilgenberg, E., Ries, S., Dang, V.D., Jaimes, Y., Daridon, C., Li, R., Jouneau, L., Boudinot, P., Wilantri, S., Sakwa, I., Miyazaki, Y., Leech, M.D., McPherson, R.C., Wirtz, S., Neurath, M., Hoehlig, K., Meinl, E., Grützkau, A., Grün, J.R., Horn, K., Kühl, A. a, Dörner, T., Bar-Or, A., Kaufmann, S.H.E., Anderton, S.M., & Fillatreau, S., 2014. IL-35-producing B cells are critical regulators of immunity during autoimmune and infectious diseases. Nature. Sherman, L.A. & Chattopadhyay, S., 1993. The molecular basis of allorecognition. Annu. Rev. Immunol., 11, 385–402. Shimizu, C., Kawamoto, H., Yamashita, M., Kimura, M., Kondou, E., Kaneko, Y., Okada, S., Tokuhisa, T., Yokoyama, M., Taniguchi, M., Katsura, Y., & Nakayama, T., 2001. Progression of T cell lineage restriction in the earliest subpopulation of murine adult thymus visualized by the expression of lck proximal promoter activity. Int. Immunol., 13, 105–17. Shlomchik, M.J. & Weisel, F., 2012. Germinal center selection and the development of memory B and plasma cells. Immunol. Rev., 247, 52–63. Smith, M.E., Eller, N.L., McFarland, H.F., Racke, M.K., & Raine, C.S., 1999. Age dependence of clinical and pathological manifestations of autoimmune demyelination. Implications for multiple sclerosis. Am. J. Pathol., 155, 1147–61. Sobel, R. a, 2000. Genetic and epigenetic influence on EAE phenotypes induced with different encephalitogenic peptides. J. Neuroimmunol., 108, 45–52. Sobel, R.A. & Kuchroo, V.K., 1992. The immunopathology of acute experimental allergic encephalomyelitis induced with myelin proteolipid protein. T cell receptors in inflammatory lesions. J. Immunol., 149, 1444–51. Sospedra, M. & Martin, R., 2005. Immunology of multiple sclerosis. Annu. Rev. Immunol., 23, 683–747. Srinivasan, L., Sasaki, Y., Calado, D.P., Zhang, B., Paik, J.H., DePinho, R.A., Kutok, J.L., Kearney, J.F., Otipoby, K.L., & Rajewsky, K., 2009. PI3 kinase signals BCR-dependent mature B cell survival. Cell, 139, 573–86. Srivastava, B., Quinn, W.J., Hazard, K., Erikson, J., & Allman, D., 2005. Characterization of marginal zone B cell precursors. J. Exp. Med., 202, 1225–34. Stadanlick, J.E., Kaileh, M., Karnell, F.G., Scholz, J.L., Miller, J.P., Quinn, W.J., Brezski, R.J., Treml, L.S., Jordan, K. a, Monroe, J.G., Sen, R., & Cancro, M.P., 2008. Tonic B cell antigen 191 Literaturverzeichnis receptor signals supply an NF-kappaB substrate for prosurvival BLyS signaling. Nat. Immunol., 9, 1379–87. Stavnezer, J., Guikema, J.E.J., & Schrader, C.E., 2008. Mechanism and regulation of class switch recombination. Annu. Rev. Immunol., 26, 261–92. Storch, M.K., Stefferl, A., Brehm, U., Weissert, R., Wallström, E., Kerschensteiner, M., Olsson, T., Linington, C., & Lassmann, H., 1998. Autoimmunity to myelin oligodendrocyte glycoprotein in rats mimics the spectrum of multiple sclerosis pathology. Brain Pathol., 8, 681–94. Stork, B., Engelke, M., Frey, J., Horejsí, V., Hamm-Baarke, A., Schraven, B., Kurosaki, T., & Wienands, J., 2004. Grb2 and the non-T cell activation linker NTAL constitute a Ca(2+)regulating signal circuit in B lymphocytes. Immunity, 21, 681–91. Stork, B., Neumann, K., Goldbeck, I., Alers, S., Kähne, T., Naumann, M., Engelke, M., & Wienands, J., 2007. Subcellular localization of Grb2 by the adaptor protein Dok-3 restricts the intensity of Ca2+ signaling in B cells. EMBO J., 26, 1140–9. Strasser, a, Whittingham, S., Vaux, D.L., Bath, M.L., Adams, J.M., Cory, S., & Harris, a W., 1991. Enforced BCL2 expression in B-lymphoid cells prolongs antibody responses and elicits autoimmune disease. Proc. Natl. Acad. Sci. U. S. A., 88, 8661–5. Stromnes, I.M. & Goverman, J.M., 2006. Active induction of experimental allergic encephalomyelitis. Nat. Protoc., 1, 1810–9. Su, K., Yang, H., Li, X., Li, X., Gibson, A.W., Cafardi, J.M., Zhou, T., Edberg, J.C., & Kimberly, R.P., 2007. Expression profile of FcgammaRIIb on leukocytes and its dysregulation in systemic lupus erythematosus. J. Immunol., 178, 3272–80. Su, T.T., Guo, B., Kawakami, Y., Sommer, K., Chae, K., Humphries, L. a, Kato, R.M., Kang, S., Patrone, L., Wall, R., Teitell, M., Leitges, M., Kawakami, T., & Rawlings, D.J., 2002. PKCbeta controls I kappa B kinase lipid raft recruitment and activation in response to BCR signaling. Nat. Immunol., 3, 780–6. Su, T.T. & Rawlings, D.J., 2002. Transitional B lymphocyte subsets operate as distinct checkpoints in murine splenic B cell development. J. Immunol., 168, 2101–10. Sugawara, T., Moriguchi, T., Nishida, E., & Takahama, Y., 1998. Differential roles of ERK and p38 MAP kinase pathways in positive and negative selection of T lymphocytes. Immunity, 9, 565–74. Swan, K.A., Alberola-Ila, J., Gross, J.A., Appleby, M.W., Forbush, K.A., Thomas, J.F., & Perlmutter, R.M., 1995. Involvement of p21ras distinguishes positive and negative selection in thymocytes. EMBO J., 14, 276–85. Swat, W., Dessing, M., von Boehmer, H., & Kisielow, P., 1993. CD69 expression during selection and maturation of CD4+8+ thymocytes. Eur. J. Immunol., 23, 739–46. Szabo, S.J., Dighe, A.S., Gubler, U., & Murphy, K.M., 1997. Regulation of the interleukin (IL)12R beta 2 subunit expression in developing T helper 1 (Th1) and Th2 cells. J. Exp. Med., 185, 817–24. 192 Literaturverzeichnis Szabo, S.J., Sullivan, B.M., Peng, S.L., & Glimcher, L.H., 2003. Molecular mechanisms regulating Th1 immune responses. Annu. Rev. Immunol., 21, 713–58. Taghon, T., Yui, M. a, Pant, R., Diamond, R. a, & Rothenberg, E. V, 2006. Developmental and molecular characterization of emerging beta- and gammadelta-selected pre-T cells in the adult mouse thymus. Immunity, 24, 53–64. Takahama, Y., 2006. Journey through the thymus: stromal guides for T-cell development and selection. Nat. Rev. Immunol., 6, 127–35. Takahama, Y., Ohishi, K., Tokoro, Y., Sugawara, T., Yoshimura, Y., Okabe, M., Kinoshita, T., & Takeda, J., 1998. Functional competence of T cells in the absence of glycosylphosphatidylinositol-anchored proteins caused by T cell-specific disruption of thePig-agene. Eur. J. Immunol., 28, 2159–2166. Takahashi, Y., Inamine, A., Hashimoto, S.-I., Haraguchi, S., Yoshioka, E., Kojima, N., Abe, R., & Takemori, T., 2005. Novel role of the Ras cascade in memory B cell response. Immunity, 23, 127–38. Takemori, T., Kaji, T., Takahashi, Y., Shimoda, M., & Rajewsky, K., 2014. Generation of memory B cells inside and outside germinal centers. Eur. J. Immunol., 44, 1258–64. Tedder, T.F., Inaoki, M., & Sato, S., 1997. The CD19-CD21 complex regulates signal transduction thresholds governing humoral immunity and autoimmunity. Immunity, 6, 107– 18. Teixeira, C., Stang, S.L., Zheng, Y., Beswick, N.S., & Stone, J.C., 2003. Integration of DAG signaling systems mediated by PKC-dependent phosphorylation of RasGRP3. Blood, 102, 1414–20. Testi, R., Phillips, J.H., & Lanier, L.L., 1988. Constitutive expression of a phosphorylated activation antigen (Leu 23) by CD3bright human thymocytes. J. Immunol., 141, 2557–63. Teuscher, C., Bunn, J.Y., Fillmore, P.D., Butterfield, R.J., Zachary, J.F., & Blankenhorn, E.P., 2004. Gender, age, and season at immunization uniquely influence the genetic control of susceptibility to histopathological lesions and clinical signs of experimental allergic encephalomyelitis: implications for the genetics of multiple sclerosis. Am. J. Pathol., 165, 1593–602. Tigno-Aranjuez, J.T., Jaini, R., Tuohy, V.K., Lehmann, P. V, & Tary-Lehmann, M., 2009. Encephalitogenicity of complete Freund’s adjuvant relative to CpG is linked to induction of Th17 cells. J. Immunol., 183, 5654–61. Tomayko, M.M., Anderson, S.M., Brayton, C.E., Sadanand, S., Steinel, N.C., Behrens, T.W., & Shlomchik, M.J., 2008. Systematic comparison of gene expression between murine memory and naive B cells demonstrates that memory B cells have unique signaling capabilities. J. Immunol., 181, 27–38. Tomayko, M.M., Steinel, N.C., Anderson, S.M., & Shlomchik, M.J., 2010. Cutting Edge: Hierarchy of Maturity of Murine Memory B Cell Subsets. J. Immunol. 193 Literaturverzeichnis Tompkins, S.M., Padilla, J., Dal Canto, M.C., Ting, J.P.-Y., Van Kaer, L., & Miller, S.D., 2002. De novo central nervous system processing of myelin antigen is required for the initiation of experimental autoimmune encephalomyelitis. J. Immunol., 168, 4173–83. Trampont, P.C., Tosello-Trampont, A.-C., Shen, Y., Duley, A.K., Sutherland, A.E., Bender, T.P., Littman, D.R., & Ravichandran, K.S., 2010. CXCR4 acts as a costimulator during thymic beta-selection. Nat. Immunol., 11, 162–70. Tsubata, T., 1999. Co-receptors on B lymphocytes. Curr. Opin. Immunol., 11, 249–55. Tsunoda, I., Kuang, L.Q., Theil, D.J., & Fujinami, R.S., 2000. Antibody association with a novel model for primary progressive multiple sclerosis: induction of relapsing-remitting and progressive forms of EAE in H2s mouse strains. Brain Pathol., 10, 402–18. Tumanov, A., Kuprash, D., Lagarkova, M., Grivennikov, S., Abe, K., Shakhov, A., Drutskaya, L., Stewart, C., Chervonsky, A., & Nedospasov, S., 2002. Distinct role of surface lymphotoxin expressed by B cells in the organization of secondary lymphoid tissues. Immunity, 17, 239– 50. Turner, M., Mee, P.J., Costello, P.S., Williams, O., Price, A.A., Duddy, L.P., Furlong, M.T., Geahlen, R.L., & Tybulewicz, V.L., 1995. Perinatal lethality and blocked B-cell development in mice lacking the tyrosine kinase Syk. Nature, 378, 298–302. Tuveson, D.A., Carter, R.H., Soltoff, S.P., & Fearon, D.T., 1993. CD19 of B cells as a surrogate kinase insert region to bind phosphatidylinositol 3-kinase. Science (80-. )., 260, 986–9. Vantourout, P. & Hayday, A., 2013. Six-of-the-best: unique contributions of γδ T cells to immunology. Nat. Rev. Immunol., 13, 88–100. Veillette, A., Rhee, I., Souza, C.M., & Davidson, D., 2009. PEST family phosphatases in immunity, autoimmunity, and autoinflammatory disorders. Immunol. Rev., 228, 312–24. Veldhoen, M., Hocking, R.J., Atkins, C.J., Locksley, R.M., & Stockinger, B., 2006. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17producing T cells. Immunity, 24, 179–89. Wada, H., Masuda, K., Satoh, R., Kakugawa, K., Ikawa, T., Katsura, Y., & Kawamoto, H., 2008. Adult T-cell progenitors retain myeloid potential. Nature, 452, 768–72. Walsh, K.P. & Mills, K.H.G., 2013. Dendritic cells and other innate determinants of T helper cell polarisation. Trends Immunol., 34, 521–30. Wang, D., Feng, J., Wen, R., Marine, J.C., Sangster, M.Y., Parganas, E., Hoffmeyer, A., Jackson, C.W., Cleveland, J.L., Murray, P.J., & Ihle, J.N., 2000. Phospholipase Cgamma2 is essential in the functions of B cell and several Fc receptors. Immunity, 13, 25–35. Weisel, F.J., Appelt, U.K., Schneider, A.M., Horlitz, J.U., van Rooijen, N., Korner, H., Mach, M., & Winkler, T.H., 2010. Unique requirements for reactivation of virus-specific memory B lymphocytes. J. Immunol., 185, 4011–21. Weiss, a & Littman, D.R., 1994. Signal transduction by lymphocyte antigen receptors. Cell, 76, 263–74. 194 Literaturverzeichnis Wekerle, H., Linnington, H., Lassmann, H., & Meyermann, R., 1986. Cellular immune reactivity within the CNS. Trends Neurosci., 9, 271–277. White, H. & Gray, D., 2000. Analysis of Immunoglobulin (Ig) Isotype Diversity and Igm/D Memory in the Response to Phenyl-Oxazolone. J. Exp. Med., 191, 2209–2220. White, J., Herman, A., Pullen, A.M., Kubo, R., Kappler, J.W., & Marrack, P., 1989. The V betaspecific superantigen staphylococcal enterotoxin B: stimulation of mature T cells and clonal deletion in neonatal mice. Cell, 56, 27–35. Wolfer, A., Wilson, A., Nemir, M., MacDonald, H.R., & Radtke, F., 2002. Inactivation of Notch1 impairs VDJbeta rearrangement and allows pre-TCR-independent survival of early alpha beta Lineage Thymocytes. Immunity, 16, 869–79. Wolniak, K.L., Noelle, R.J., & Waldschmidt, T.J., 2006. Characterization of (4-hydroxy-3nitrophenyl)acetyl (NP)-specific germinal center B cells and antigen-binding B220- cells after primary NP challenge in mice. J. Immunol., 177, 2072–9. Xiu, Y., Nakamura, K., Abe, M., Li, N., Wen, X.S., Jiang, Y., Zhang, D., Tsurui, H., Matsuoka, S., Hamano, Y., Fujii, H., Ono, M., Takai, T., Shimokawa, T., Ra, C., Shirai, T., & Hirose, S., 2002. Transcriptional Regulation of Fcgr2b Gene by Polymorphic Promoter Region and Its Contribution to Humoral Immune Responses. J. Immunol., 169, 4340–4346. Xu, S., Tan, J.E., Wong, E.P., Manickam, A., Ponniah, S., & Lam, K.P., 2000. B cell development and activation defects resulting in xid-like immunodeficiency in BLNK/SLP65-deficient mice. Int. Immunol., 12, 397–404. Yamane, H. & Paul, W.E., 2013. Early signaling events that underlie fate decisions of naive CD4(+) T cells toward distinct T-helper cell subsets. Immunol. Rev., 252, 12–23. Yan, M., Brady, J.R., Chan, B., Lee, W.P., Hsu, B., Harless, S., Cancro, M., Grewal, I.S., & Dixit, V.M., 2001. Identification of a novel receptor for B lymphocyte stimulator that is mutated in a mouse strain with severe B cell deficiency. Curr. Biol., 11, 1547–52. Yang, X.O., Pappu, B.P., Nurieva, R., Akimzhanov, A., Kang, H.S., Chung, Y., Ma, L., Shah, B., Panopoulos, A.D., Schluns, K.S., Watowich, S.S., Tian, Q., Jetten, A.M., & Dong, C., 2008. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity, 28, 29–39. Ye, S.K., Agata, Y., Lee, H.C., Kurooka, H., Kitamura, T., Shimizu, A., Honjo, T., & Ikuta, K., 2001. The IL-7 receptor controls the accessibility of the TCRgamma locus by Stat5 and histone acetylation. Immunity, 15, 813–23. Yefenof, E., Sanders, V.M., Uhr, J.W., & Vitetta, E.S., 1986. In vitro activation of murine antigen-specific memory B cells by a T-dependent antigen. J. Immunol., 137, 85–90. Yu, D., Rao, S., Tsai, L.M., Lee, S.K., He, Y., Sutcliffe, E.L., Srivastava, M., Linterman, M., Zheng, L., Simpson, N., Ellyard, J.I., Parish, I. a, Ma, C.S., Li, Q.-J., Parish, C.R., Mackay, C.R., & Vinuesa, C.G., 2009. The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment. Immunity, 31, 457–68. 195 Literaturverzeichnis Zamvil, S., Nelson, P., Trotter, J., Mitchell, D., Knobler, R., Fritz, R., & Steinman, L., 1985. Tcell clones specific for myelin basic protein induce chronic relapsing paralysis and demyelination. Nature, 317, 355–8. Zheng, W. & Flavell, R.A., 1997. The transcription factor GATA-3 is necessary and sufficient for Th2 cytokine gene expression in CD4 T cells. Cell, 89, 587–96. Zhou, L., Chong, M.M.W., & Littman, D.R., 2009. Plasticity of CD4+ T cell lineage differentiation. Immunity, 30, 646–55. Zhou, L., Ivanov, I.I., Spolski, R., Min, R., Shenderov, K., Egawa, T., Levy, D.E., Leonard, W.J., & Littman, D.R., 2007. IL-6 programs T(H)-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways. Nat. Immunol., 8, 967–74. Zhou, L., Lopes, J.E., Chong, M.M.W., Ivanov, I.I., Min, R., Victora, G.D., Shen, Y., Du, J., Rubtsov, Y.P., Rudensky, A.Y., Ziegler, S.F., & Littman, D.R., 2008. TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing RORgammat function. Nature, 453, 236–40. Zhu, J., Cote-Sierra, J., Guo, L., & Paul, W.E., 2003. Stat5 activation plays a critical role in Th2 differentiation. Immunity, 19, 739–48. Zhu, J., Yamane, H., & Paul, W.E., 2010. Differentiation of effector CD4 T cell populations (*). Annu. Rev. Immunol., 28, 445–89. 196 Anhang 11 Anhang 11.1 Abbildungsverzeichnis Abb. 1: Schema B-Zell Entwicklung und Differenzierung zu Effektorzellen......................................... 5 Abb. 2: Schema T-Zell Entwicklung. .................................................................................................... 13 Abb. 3: T-Helferzell Differenzierung. ................................................................................................... 16 Abb. 4: Aufbau von Grb2 und Bindepartner, mit denen Grb2 in Lymphozyten über seine SH2 und SH3 Domänen interagiert. ..................................................................................................................... 20 Abb. 5: Grb2 defiziente primäre B-Zellen reagieren weiter auf eine Zytokinbehandlung mit BAFF. Ihre Überlebensrate ist vergleichbar mit der von primären B-Zellen aus Kontrollmäusen. .................. 31 Abb. 6: Vergleichbare spontane Apoptose- und Überlebensrate nach Überexpression von humanem Bcl2 in Grb2fl/fl mb1cre/+ B-Zellen und Kontrollzellen in vitro. ............................................................. 33 Abb. 7: Eine Überexpression des anti-apoptotisch wirkenden humanen Bcl2 Genes in der B-Zell Entwicklung kann den Verlust von Grb2 in Grb2fl/fl mb1cre/+ Mäusen nicht kompensieren. ................. 34 Abb. 8: Eine Überexpression des anti-apoptotisch wirkenden humanen Bcl2 Genes in der Peripherie kann den Verlust von Grb2 in Grb2fl/fl mb1cre/+ Mäusen nicht kompensieren. ...................................... 36 Abb. 9: Geringere Zahl an B1a B-Zellen im Peritoneum von Grb2fl/fl mb1cre/+ Mäusen. Eine Überexpression des anti-apoptotisch wirkenden humanen Bcl2 Genes in Zellen des Peritoneums hat keinen Einfluss auf die Zahl der B1 B-Zellen. ...................................................................................... 38 Abb. 10: Grb2fl/fl mb1cre/+ Mäuse weisen im Blut eine reduzierte Zahl an Transitionalen und reifen BZellen auf............................................................................................................................................... 40 Abb. 11: Die Expression des BAFF-Rezeptors ist in den unreifen und reifen Grb2-/- B-Zellen reduziert und kann nicht durch die Überexpression von humanem Bcl2 kompensiert werden............................ 42 Abb. 12: Strategie zum sortieren von T1, T2 und reifen B-Zellen........................................................ 44 Abb. 13: Transitionale Typ 2 B-Zellen von Grb2fl/fl mb1cre/+ Mäusen weisen in vitro einen Differenzierungsblock zu reifen naiven B-Zellen auf. .......................................................................... 46 Abb. 14: Grb2fl/fl mb1cre/+ B-Zellen zeigen eine verringerte Expression von Genen, die wichtig für das Überleben und den Zellzyklus sind. ...................................................................................................... 48 Abb. 15: Höheres Ca2+ Signal nach B-Zell Rezeptor Stimulation ab den transitionalen B-Zell Entwicklungsstadien und funktionelle Ca2+ Inhibition über den FcγR2b in Grb2fl/fl mb1cre/+ Mäusen. 50 Abb. 16: Höhere Fcγ-RezeptorIIb Expression auf unreifen- und B1 B-Zellen der Milz, sowie auf B2 B-Zellen im Peritoneum. ....................................................................................................................... 53 Abb. 17: Kein Einfluss von Grb2 auf die Hochregulation des FcγR2b in Keimzentrums B-Zellen. .... 54 Abb. 18: Schwächere sekundäre Immunantwort von Grb2fl/fl mb1cre/+ Mäusen gegen virusartige Partikel (VLP) des humanen Cytomegalovirus und reduzierte Gedächtnisantwort von IgG + Grb2fl/fl mb1cre/+ BZellen gegenüber Kontrollzellen. .......................................................................................................... 57 I Anhang Abb. 19: Schwächere Gedächtnisantwort von Grb2fl/fl mb1cre/+ B-Zellen gegen glykoprtein B (gB) des humanen Zytomegalovirus gegenüber Kontrollzellen. ......................................................................... 59 Abb. 20: Primäre Grb2fl/fl mb1cre/+ B-Zellen können einen effizienten Klassenwechsel zu IgG1 und IgG3 vollziehen. .................................................................................................................................... 61 Abb. 21: Stärkere Antwort von primären Grb2fl/fl mb1cre/+ B-Zellen auf TLR7 und TLR Stimulation. 62 Abb. 22: Deletion von Grb2 in Keimzentrums B-Zellen von Grb2fl/fl Cγ1cre/+ Mäusen......................... 64 Abb. 23: Vergleichbare Struktur und Anzahl von Keimzentren, so wie IgG+ Zellen in Grb2fl/fl Cγ1cre/+ Mäusen und Kontrolltieren nach Immunisierung mit Schafserythrozyten. ........................................... 66 Abb. 24: Vergleichbare Zahl von Keimzentrums B-Zellen und follikulären T-Helferzellen in Grb2fl/fl Cγ1cre/+ und Kontrollmäusen nach Immunisierung mit Schafserythrozyten.......................................... 68 Abb. 25: Keine Veränderung in der Affinitätsreifung von Grb2fl/fl Cγ1cre/+ und Grb2fl/fl mb1cre/+ Mäusen im Vergleich zu Kontrolltieren.............................................................................................................. 69 Abb. 26: Schwächere Gedächtnisantwort von Grb2fl/fl cγ1cre/+ B-Zellen gegen Glykoprotein B (gB) des humanen Zytomegalovirus verglichen mit Kontrollzellen. ................................................................... 72 Abb. 27: Untersuchung zur Rolle von Grb2 in der Gedächtnisantwort gegen NP-CGG. ..................... 75 Abb. 28: Keine erhöhte Autoimmunität in Grb2fl/fl mb1cre/+ Mäusen. .................................................... 78 Abb. 29: T-Zell spezifische, genetische Depletion von Grb2 im Thymus und in der Peripherie von Grb2fl/fl Lckcretg Mäusen........................................................................................................................ 79 Abb. 30: Grb2 ist wichtigfür die frühe T-Zell Entwicklung. Dabei führt die Deletion von Grb2 im doppelt negativen 3 (DN3) Stadium (Lckcre) zu einer stärker beeinträchtigten Entwicklung, als die Deletion im CD4+CD8+ Stadium. .......................................................................................................... 82 Abb. 31: T-Zell spezifische Grb2 defiziente Mäusen zeigen verringerte T-Zellzahlen im Thymus und in der Peripherie. Die Deletion von Grb2 ab dem doppelt negativen 3 Stadium (Lckcre) führt zu einer früheren und ausgeprägteren Reduktion der T-Zellen als eine Deletion ab dem dem CD4+CD8+ Stadium (CD4cre). ................................................................................................................................ 84 Abb. 32: Grb2 Defizienz führt zu mehr aktivierten (CD69+) T-Zellen in der Milz naiver Mäuse. ....... 86 Abb. 33: Der Verlust von Grb2 verschiebt das Verhältnis von naiven zu aktivierten CD4+ T-Zellen in Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen. Insgesamt weisen beide T-Zell spezifischen Grb2 defizienten Mäuse eine Reduktion der naiven CD4+ T-Zellen auf. Die Deletion von Grb2 ab dem doppelt negativen 3 Stadium (Lckcre) führt zu reduzierten Zahl an CD4+ Gedächtnis T-Zellen, wohingegen eine Deletion ab dem CD4+CD8+ Stadium (CD4cre) die Gedächtnis T-Zellzahlen in naiven Mäusen nicht beeinflusst. .......................................................................................................... 88 Abb. 34: Der Verlust von Grb2 verschiebt das Verhältnis von naiven zu aktivierten CD8 + T-Zellen in Grb2fl/fl Lckcretg und Grb2fl/fl CD4cretg Mäusen. Insgesamt weisen beide T-Zell spezifischen Grb2 defizienten Mäuse eine Reduktion der naiven CD8+ T-Zellen auf. Die Deletion von Grb2 ab dem doppelt negativen 3 Stadium (Lckcre) führt zu Beeinträchtigungen bei den CD8+ Gedächtnis T-Zellen, II Anhang wohingegen eine Deletion ab dem CD4+CD8+ Stadium (CD4cre) die CD8+ Gedächtnis T-Zellzahlen in naiven Mäusen nicht beeinflusst. .......................................................................................................... 89 Abb. 35: Das Calciumsignal in CD4+CD8+ T-Zellen wird durch Grb2 inhibiert, während es in CD4+ bzw. CD8+ einzel positiven Zellen nicht beeinflusst ist. ...................................................................... 91 Abb. 36: Die Zahl der γδ T-Zellen in der Peripherie und tendenziell im Thymus ist in T-Zell spezifischen Grb2 defizienten Tieren erhöht. ........................................................................................ 93 Abb. 37: Naive CD4+ Zellen von T-Zell spezifischen Grb2 defizienten Mäusen zeigen in vitro ein verringertes Potential sich zu TH17 und TH2 Zellen zu differenzieren aber das Potential sich zu T-regZellen zu differenzieren ist erhöht......................................................................................................... 96 Abb. 38: In naiven T-Zell spezifisch Grb2 defizienten Mäusen (Grb2fl/fl Lcktg und Grb2fl/fl CD4cretg) ist der Anteil der TH1-Zellen an den CD4+ T-Zellen erhöht. Wird Grb2 ab dem Übergang vom doppelt negativen 2 zum doppelt negativen 3 Stadium deletiert (Lckcre) ist auch der Anteil der T H2, TH17 und T-reg Zellen an den CD4+ T-Zellen tendenziell erhöht. ........................................................................ 98 Abb. 39: T-Zell spezifische Grb2 defiziente Mäuse entwickeln eine schwächere experimentelle autoimmune Enzephalomyelitis ............................................................................................................ 99 Abb.40: Grb2fl/fl CD4cretg Mäuse weisen an Tag 17 und Tag 30 nach Induktion einer experimentellen autoimmunen Enzephalomyelitis anders als naive Grb2fl/fl CD4cretg Mäuse keine reduzierten TZellzahlen mehr auf. Auch die Zahl naiver T-Zellen, die in naive Grb2fl/fl CD4cretg Mäuse reduziert ist wurde im Verlauf der EAE ausgeglichen. Zudem normalisierte sich das Verhältnis von naiven TZellen T-Effektorzellen, das in naiven Grb2fl/fl CD4cretg Mäusen verändert ist.................................. 102 Abb. 41: Erhöhte Zahl an Plasmablasten zum Höhepunkt der experimentellen autoimmunen Enzephalomyelitis in T-Zell spezifischen Grb2 defizienten Mäusen. ................................................. 103 Abb. 42: Anteilig weniger regulatorische T-Zellen an den CD4+ Grb2-/- T-Zellen und erhöhte Aktivierbarkeit der CD4+ Grb2-/- T-Zellen über PMA und Ionomycin zum Höhepunkt der experimentellen autoimmunen Enzephalomyelitis.............................................................................. 106 Abb. 43: An Tag 30 der experimentellen autoimmunen Enzephalomyelitis in vitro mit MOG-Peptid reaktivierte Milzzellen aus T-Zell spezifischen Grb2 defizienten Mäusen sekretieren weniger IL-17A, IL-2 und TNF. ..................................................................................................................................... 108 Abb. 44:Grb2 defiziente CD4+ T-Zellen können im gemischten Lymphozytenversuch weniger effizient durch alloreaktive dendritische Zellen aktiviert werden als CD4+ T-Zellen aus Kontrolltieren. Umgekehrt können dendritische Zellen aus Grb2fl/fl CD4cretg Mäusen alloreaktive T-Zellen genauso gut stimulieren, wie alloreaktive T-Zellen aus Kontrolltieren. ........................................................... 109 III Anhang 11.2 Tabellenverzeichnis Tab. 1: Absolute Zellzahlen für verschiedene Lymphozytenpopulationen von Grb2fl/fl mb1+/+, Grb2fl/fl mb1cre/+, Grb2fl/fl mb1+/+ Bcl2tg und Grb2fl/fl mb1cre/+ Bcl2tg Mäusen. ..................................................... 39 Tab. 2: Antikörper Durchflusszytometrie und Streptavidinkonjugate ................................................ 134 Tab. 3: Antikörper ELISA ................................................................................................................... 134 Tab. 4: Antikörper für magnetische Zellseperation ............................................................................. 134 Tab. 5: Antikörper für komplement vermittelte Depletion ................................................................. 134 Tab. 6: Antikörper Western-Blot......................................................................................................... 134 Tab. 7: Chemikalien und Labormaterialien ......................................................................................... 136 Tab. 8: Computerprogramme .............................................................................................................. 136 Tab. 9: Geräte ...................................................................................................................................... 137 Tab. 10: Kommerzielle Kits ................................................................................................................ 137 Tab. 11: Lösungen, Medien und Puffer ............................................................................................... 141 Tab. 12: Stimulanzien / Antigene / Immunisierungszusätze ............................................................... 142 Tab. 13: Zytokine ................................................................................................................................ 142 Tab. 14: Stimulationsansätze für die Differenzierung von TH1, TH2, T-reg und TH17 Zellen aus naiven CD4+CD62L+ T-Zellen........................................................................................................................ 167 IV Anhang 11.3 Abkürzungsverzeichnis Abkürzung °C A Abb. AG ANA AP APS BAFF (BLyS) BAFFR BCIP Bcl2 Bcl6 bio bp BSA BTE Btk BZR bzw. C Ca. ca. CBA CD cDNA CFA CGG cpm CRAC cy DAG DAPI DAPI DNA dNTP dsDNA DTT EAE ECL EDTA ELISA ELISPOT Bedeutung Grad Celsius Adenin Abbildung Arbeitsgruppe anti-nukleäre Antikörper Alkalische Phosphatase Ammoniumperoxodisulfat B cell activating factor of the TNF family B cell activating factor of the TNF family receptor 5-Brom-4-chlor-3-Indoxylphosphat B-cell lymphoma 2 B-cell lymphoma-6 Biotin Basenpaar bovine serum albumin Biotechnologisches Entwicklungslabor Bruton´s Tyrosin-Kinase B-Zell-Rezeptor Beziehungsweise Cytosin circa circa Cytometric Bead Array Cluster of differentiaton Copy desoxyribonucleic acid komplettes Freund-Adjuvans Chicken Gamma Globulin Ereignisse pro Minute calcium release activated calcium Cychrome Diacylglycerol 4´,6-Diamin-2-phenylindol 4´,6-Diamin-2-phenylindol deoxyribonucleic acid (Desoxyribonukleinsäure) Desoxyribonukleotid-triphosphat double stranded deoxyribonucleic acid Dithiotreitol Experimentelle autoimmune Enzephalomyelitis enhanced chemiluminescens Ethylendiamintetraacetat enzyme-linked immunosorbent assay enzyme-linked immuno-spot V Anhang ER ERK et al. Fc FCS FITC FSC G G gB GRB2 h H H+L HRP HSA (CD24) i. p. i.p. i.v Ig IL IP3 ITT JNK ko l Lck LPS M M MACS MAPK Mef2c mg MHC min ml MOG MZ NEAA NF-κB NP NP PBS PCR PCR PE VI Endoplasmatisches Riticulum extracellular signal regulated kinase et alii/alia fragment crystallisable fötales Kälberserum Fluorescein isothiocyanate Forward Scatter Ziege(goat) Guanin Glykoprotein B des humanen Zytomegalievirus Growth factor receptor-bound protein 2 Stunde (hour) armenischer Hamster heavy and light chain horse raddish peroxidase heat stable antigen intra peritoneal intraperitoneal intravenös Immunglobulin Interleukin inositol 1, 4, 5 triphosphate immunoglobulin tail tyrosine Jun N-terminal kinase knockout Liter lymphocyte-specific protein tyrosine kinase Lipopolysaccharid Maus Molar Magnetische Zellseperation mitogen activated protein kinase myocyte enhancer factor-2C Milligramm major histocompatibility complex Minute Milliliter Myelin-Oligodendrozyten-Glykoprotein Marginalzone non essential amino acids nuclear factor κB 4-Hydroxy-3-nitrophenyl 4-Hydroxy-3-nitrophenylacetyl Hapten phosphate buffered saline Polymerase Kettenreaktion Polymerase-Kettenreaktion (polymererase chain reaction) Phycoerythrin Anhang Pen pH PIP3 PLC PNA qRT-PCR R Ra RNA rpm RPMI RT RT s.c. SDS sek. sek. SH3 SH3 SLP-65 ssDNA Strep Syk T T1 T2 Tab. Tab. Taq TEMED TLR TNF Tris UNLB V v/v VLP w/v wt z. B. μg μl Penicillin pondus hidrogenii phosphatidylinositol-(3,4,5)-triphosphate Phospholipase C Peanut Agglutinin Realtime-quantitative Polymerase-Kettenreaktion Kaninchen (rabbit) Ratte ribonucleic acid Umdrehungen pro Minute (rounds per minute) Roswell Park Memorial Institute (Medium) Raumtemperatur Raumtemperatur subkutan Natriumdodecylsulfat (sodium dodecyl sulfate) Sekunde Sekunde Src homology 2 Src homology 3 SH2 domain–containing leukocyte protein of 65 kD single stranded deoxyribonucleic acid Streptavidin spleen tyrosine kinase Thymin Transitionale Typ 1 Transitionale Typ 2 Tabelle Tabelle Thermus aquaticus Tetramethylethylendiamin toll like receptor Tumor-Nekrose-Faktor (tumor necrosis factor) Trishydromethylaminomethan unmarkiert (unlabeled) Volt Volumen/Volumen (volume / volume) Virusartige Partikel (virus like particle) Gewicht / Volumen (weight/volume) wildtyp zum Beispiel Mikrogramm Mikroliter VII Danksagung 12 Danksagung Besonders möchte ich mich bei meinem Doktorvater Prof. Dr. Lars Nitschke für die Bereitstellung des vielseitigen und interessanten Themas bedanken. Außerdem danke ich ihm dafür, dass er mir die Teilnahme am Graduiertenkolleg des TRR-130 und an zahlreichen nationalen, sowie internationalen Kongressen ermöglicht hat. Weiter möchte ich Prof. David Vöhringer für die Erstellung des Zweitgutachtens und für nützliche Vorschläge und Diskussionen, so wie die Bereistellung von Mäusen danken. Prof. Dr. Thomas Winkler und Prof. Dr. Alexander Steinkasserer danke ich für die Bereitschaft, mich bei der Verteidigung meiner Dissertation zu prüfen und für hilfreiche Diskussionen und Gespräche. Bei Dr. Jochen Ackermann bedanke ich mich herzlich für die Einarbeitung, die Übergabe des Grb2 Projektes und seine lockere offene Art. Ich möchte mich bei meinen Kooperationspartnern Prof. Dr. Thomas Winkler, Dr. Elisabeth Zinser, Prof. Dr. Jürgen Wienands, Dr. Niklas Engels, Dr. Lars König, Prof. Dr. Becker, Dr. Moritz Leppkes und Prof. Dr. Alexander Steinkasserer für spannende Projekte und die problemlose Zusammenarbeit bedanken. Bei Prof. Dr. Robert Slany, Lisa Füller, Prof. Dr. Falk Nimmerjahn, Heike Danzer, Katharina Gerlach, Martina Seefried, Dr. Adriana Neves, Prof. Dr. Dr. Andre Gessner, Dr. Selina Sitte und Prof. Dr. Brandstätter möchte ich mich für die Bereitstellung von Geräten, Labormaterial, Antikörpern, Zellen, durchgeführte Versuche und das Beibringen neuer Methoden herzlich bedanken. Danken möchte ich auch den Tierpflegern für ihre zuverlässige Arbeit mit den Mäusen. Weiter möchte ich mich bei allen Mitgliedern des Lehrstuhls für Genetik für das gute Arbeitsklima und die interessanten Seminare bedanken. VIII Danksagung Ein ganz besonderer Dank gilt allen ehemaligen und aktuellen Mitgliedern der AG Nitschke. Sieglinde Angermüller und Anne Urbat danke ich für die optimale technische Unterstützung. Den ehemaligen Bachelor- und Masterstudenten Anna Maurberger, Sonja Lacher, Christina Forsch, Alisa und Felix Hartmann möchte ich für die tatkräftige Unterstützung bei meinen Versuchen danken. Sieglinde Angermüller, Dr. Stefan Hutzler und Dr. Jochen Ackermann danke ich für die gute Atmosphäre in unserem kleinen Labor. Dr. Jenniffer Müller, Dr. Julia Jellusova, Nina Weidner, Dr. Susanne Bökers, Lamia Özgör, Heike Schmitt, Dr. Miriam Wöhner, Dr. Astrid Elter und Ingrid Obermeier danke ich für ihre Hilfsbereitschaft und die nicht immer wissenschaftlichen Gespräche. Nicht zu vergessen Julia Koch, Dr. Carolin Brandl, Hannah Seifried und Sarah Mrotzek, die auch für eine lebendige AG sorgen. Insgesamt war es eine schöne Zeit zu der besonders die zahlreichen Aktivitäten wie Ski- und Wanderausflüge beitrugen. Ich danke meiner Freundin und meiner Familie, die mich immer unterstützen. IX Publikationsliste 13 Publikationsliste Ackermann, J.A., Radtke, D., Maurberger, A., Winkler, T.H., & Nitschke, L., 2011. Grb2 regulates B-cell maturation, B-cell memory responses and inhibits B-cell Ca2+ signalling. EMBO J., 30, 1621–33. Dütting, S., Vögtle, T., Morowski, M., Schiessl, S., Schäfer, C.M., Watson, S.K., Hughes, C.E., Ackermann, J.A, Radtke, D., Hermanns, H.M., Watson, S.P., Nitschke, L., & Nieswandt, B., 2014. Growth factor receptor-bound protein 2 contributes to (hem)immunoreceptor tyrosine-based activation motif-mediated signaling in platelets. Circ. Res., 114, 444–53. Engels, N., König, L.M., Schulze, W., Radtke, D., Vanshylla, K., Lutz, J., Winkler, T.H., Nitschke, L., & Wienands, J., 2014. The immunoglobulin tail tyrosine motif upgrades memory-type BCRs by incorporating a Grb2-Btk signaling module. Nat. Commun., in press. Radtke, D., Ackermann, J.A., & Nitschke, L., Grb2 regulates the development of immature transitional to mature B cells. J. Immunol. , submitted. X