Kap4
Werbung

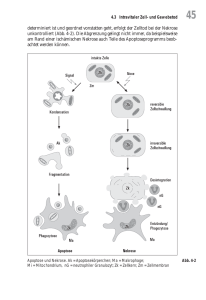
4.3 Intravitaler Zell- und Gewebetod 45 determiniert ist und geordnet vonstatten geht, erfolgt der Zelltod bei der Nekrose unkontrolliert (Abb. 4-2). Die Abgrenzung gelingt nicht immer, da beispielsweise am Rand einer ischämischen Nekrose auch Teile des Apoptoseprogramms beobachtet werden können. Apoptose und Nekrose. Ak = Apoptosekörperchen; Ma = Makrophage; Mi = Mitochondrium, nG = neutrophiler Granulozyt; Zk = Zellkern; Zm = Zellmembran Abb. 4-2 46 4 Allgemeine Stoffwechselstörungen 4.3.1 Apoptose Unter Apoptose versteht man den programmierten Zelltod, wie er beispielsweise während der normalen Embryonal- und Fetalentwicklung (selektive Eliminierung überflüssiger Organanlagen) oder im Rahmen des physiologischen Zellumsatzes vorkommt. Aber auch im Immunsystem übernimmt die Apoptose vielfältige Aufgaben: Bei der T- und B-Zelldifferenzierung dürfen nur solche Zellen überleben, die körpereigenes Antigen tolerieren (negative Selektion, s. S. 140). Zytotoxische T-Zellen, NK-Zellen und Makrophagen können unerwünschte Zielzellen zur Apoptose veranlassen. Nach einer erfolgreichen Immunreaktion wird die Zahl der Immunzellen durch Apoptose wieder reduziert (Activation induced cell death, AICD). Auch nichtaktivierte Immunzellen können apoptotisch untergehen, wenn sie keine Überlebensstimulierung (z.B. präsentierte Antigene) erhalten oder wenn sie überaltern. Fehlerhaft aktivierte T- und B-Zellen werden gleichfalls durch Apoptose eliminiert. Daraus wird ersichtlich, dass eine unzureichende Apoptose zu Autoimmunerkrankungen und Tumoren führen kann, während ein übersteigerter Zelltod eine Immundefizienz bewirkt. ■ Morphologische Zeichen: Die Apoptose unterscheidet sich morphologisch (wie auch biochemisch) grundlegend von der Nekrose (Tab. 4-1). Sie ist durch Zellschrumpfung und Bildung von Zytoplasmaausstülpungen gekennzeichnet. Gleichzeitig kondensiert das Chromatin des Zellkerns (Karyopyknose) und formiert sich an der Kernhülle. Später fragmentiert der Zellkern (Karyorrhexis). Durch die Positionsänderung eines bestimmten Phospholipids von der Membraninnenseite zur Membranaußenseite (Translokation des Phosphatidylserins) können apoptotische Zellen von Makrophagen erkannt, phagozytiert und abgebaut werden. Beim Zell- und Kernzerfall entstehen membranumhüllte Bruchstücke, so genannte Apoptosekörperchen. Anders als bei der Nekrose wird keine Entzündungsreaktion hervorgerufen, da die Phagozytose vor dem Zerfall der Zellmembran stattfindet. Der Ablauf der Apoptose ist im Gegensatz zur Nekrose ein aktiver Prozess, bei dem Energie verbraucht wird. Auslösemechanismen Die verschiedenen Apoptosewege münden alle in einer kaskadenförmigen Aktivierung von Caspasen (das sind Zysteinproteasen). Man unterscheidet zwei Hauptgruppen: Initiierende Caspasen stehen am Anfang der Reaktionskaskade (Caspasen 8, 9, 10 und zum Teil Caspase 2) und aktivieren die ausführenden Caspasen. 4.3 Intravitaler Zell- und Gewebetod Morphologische und biochemische Unterscheidungsmerkmale von Apoptose und Nekrose (modifiziert nach Möwes 2003) Apoptose Nekrose Morphologische Merkmale einzelne Zellen Zellgruppen Blasenbildung bei erhaltener Membranintegrität Verlust der Membranintegrität Zellschrumpfung Bildung von Apoptosekörperchen Zellschwellung Zelllyse Phagozytose der Apoptosekörperchen Phagozytose der Zelltrümmer keine Entzündungszeichen Entzündungszeichen Biochemische Merkmale physiologisches Signal unphysiologische Einwirkung geordneter Ablauf Verlust der Regulation de novo Gentranskription keine de novo Gentranskription neue Proteinbiosynthese erforderlich keine Proteinbiosynthese erforderlich definierte DNA-Fragmentierung zufällige DNA-Verdauung energieaufwändig nicht energieaufwändig Ausführende Caspasen (insbesondere Caspasen 3, 6 und 7) spalten Proteine von Zytoskelett oder Kernstruktur, Enzyme mit Zellreparaturaufgaben, Moleküle der Zellzyklusregulation sowie Moleküle oder Enzyme, die am Ablauf der Apoptose und ihrer Regulation beteiligt sind. Aus den angestoßenen Reaktionen resultieren schließlich die morphologischen Veränderungen der Zelle. ■ Ligand-Rezeptor-Interaktion: Die Apoptose kann durch rezeptorvermittelte Signale gesteuert werden. Man unterscheidet anti- und proapoptotische LigandRezeptor-Wirkungen. So hat zum Beispiel Thyreotropin (TSH) einen antiapoptotischen Effekt auf Thyreozyten. Kommt es nun zur Verringerung der TSHWirkung an den Thyreozyten, dann wirkt dieser Zustand proapoptotisch, und der apoptotische Zelluntergang erfolgt. Der Vorgang mündet mittelfristig in einer numerischen Atrophie des Zielorgans (hier: der Schilddrüse). Eine proapoptotische Interaktion stellt beispielsweise die Ligandenbindung an den CD95-Rezeptor (Fas-Rezeptor) oder den Tumor-Nekrose-Faktor-Rezeptor (TNFR-1) dar. 47 Tab. 4-1