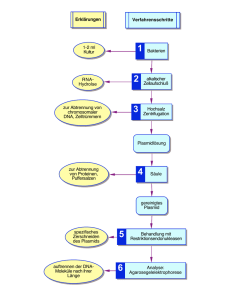
(Microsoft PowerPoint - PROTEINANALYTIK
Werbung

PROTEINANALYTIK Proteinanalytik • • • • • Proteineigenschaften Proteinquellen Proteinisolierung Proteinnachweis Proteincharakterisierung Aminosäuren Proteine Molekulare Eigenschaften • • • • • Chemische Grundstruktur Größe Säure/Base-Eigenschaften Hydrophilie - Hydrophobizität Biologische Aktivität Strukturmerkmale • • • • Primär Sekundär Tertiär Quartär Struktur Strukturmerkmale Nativer Proteinzustand Protein-Denaturierung Proteinquellen (1) Natürliche Proteinquellen •Gewebe vonTieren und Pflanzen •Extrazelluläre Flüssigkeiten •Mikroorganismen (E. coli, Hefe) Individuelle Proteinkonzentration oft gering Proteinquellen (2) Gentechnisch hergestellte Proteine • Mikrobielle Systeme (E. coli, Hefe) • Klonierung in höheren Systemen (Zell-Linien aus Säugetieren, transgene Tiere, Insektenzellen, Pflanzenzellen) Hohe Proteinkonzentration (Überproduktion) Modifizierung des Proteins ? Proteinisolierung (1) Intrazelluläre Proteine: • Zelldisruption • Abtrennung von unlöslichem Material Extrazelluläre Proteine • Zellabtrennung • Abtrennung von unlöslichem Material Proteinisolierung (2) Homogenisierung (Gewebe ⇒ Zellen) Zellaufschluß (Zelle ⇒ Zellbestandteile) Proteinisolierung und -trennung Fällung, Zentrifugation, Chromatographie Abtrennung von Salzen Dialyse, Ultrafiltration, Gelchromatographie Homogenisierung von Geweben Voraussetzungen für Homogenisierungsmedien: Schutz der Zellen vor osmotischer Lyse Schutz vor Proteasen Erhalt der biologischen Funktion Verhinderung von Aggregation Geringe Zerstörung von Organellen Keine Interferenz mit biologischen Analysen und funktionellen Tests Zellaufschluss • Schwache Scherkräfte (bei sehr empfindlichen Zellen, z.B. Leukocyten) • Osmolytisches Aufbrechen (z.B. Isolierte Blutzellen) • Einfrieren/Auftauen (bei Bakterien) • Trocknen (bei Hefen) • Entwässerung durch organische Lösungsmittel • Mechanische Zerkleinerung (Vibrationszellmühle, Messerhomogenisator, Ultraschall, French- Presse, ...) Proteinisolierung (Summary) Proteinlöslichkeit (1) Proteinlöslichkeit (2) Effekt geringer Ionenkonzentration Je geringer die Ionenkonzentration im Lösungsmittel ist, umso eher neigen die Proteine dazu ihre Oberflächenladung gegenseitig durchAggregatbildung zu kompensieren. Große Aggregate fallen aus. Praxis: Verdünnen oder Dialyse gegen Wasser. Bei physiologischer Ionenstärke werden die Ladungen der Proteine durch Salzionen kompensiert Proteinlöslichkeit (3) Proteinlöslichkeit (4) Proteinfällung (1) • Salze • Organische Lösungsmittel • Trichloressigsäure Isolierung des Proteinpräzipitats durch Zentrifugation Abtrennung von Salzen (und hydrophilen Molekülen) • • • • Dialyse Ultrafiltration Gelchromatographie Reversed phase-Chromatographie Dialyse Entfernung oder Austausch von kleinen Molekülen aus einer Lösung über eine semipermeable Membran • Standardverfahren zum Entfernen von (NH4)2SO4 aus Ammoniumsulfatfällungen oder zur „Umpufferung“ von Proteinlösungen für die Säulenchromatographie. • Prinzip: Semipermeable Membran, die von Proteinen nicht durchquert werden kann. Anorganische Salze und niedermolekulare Verbindungen können passieren Cut-Off der Membranen (PVDF, Cellulose) von 1-50 kDa. Dialyseschlauch muß durch Kochen in 0.1 M NaHCO3/10 mM EDTA und sorgfältiges Spülen rehydratisiert werden (Aufbewahrung in 70% EtOH) Konzentrierung • Fällung • Ultrafiltration und Diafiltration Proteinstabilisierung (1) Schutz vor Proteasen (biochemischer Abbau) Protease-Inhibitoren (oft als „Cocktail") • • • • • • • Phenylmethylsulfonylfluorid (PMSF) Aprotinin e-Amino-n-capronsäure Pepstatin Leupeptin Antipain Ethylendiamintetraessigsäure (EDTA) Serinproteasen Aspartatproteasen Cysteinproteasen Metalloproteasen Proteinstabilisierung (2) Schutz vor Denaturierung (physikalischer oder chemischer Effekt) Erhaltung des nativen Zustands und der biologischen Aktivität pH-Wert (Säure-Basen-Gruppen) Salzkonzentration (physiologisch) Proteinkonzentration (Aggregationen) Detergenzien (hydrophobe Proteine) Reduzierende Agenzien (Mercaptoethanol, Dithiothreitol-DTT) Proteinstabilisierung (3) Hydrophobe Proteine Proteinnachweis (1) Proteinbestimmungsmethoden • • • • • Biuret-Test Lowry-Test BC-Assay Bradford-Assay UV-Methoden Aktivitätstests • einfacher enzymatischer Assay • gekoppelter enzymatischer Assay • Bindungstests Immunchemische Verfahren • ELISA • Western-Blot Proteinnachweis (2) Biuret-Reaktion Bicinchoninsäure-Assay Coomassie-Blau/ Bradford-Assay Zentrifugation (1) Physikalisches Prinzip: Trennung nach Größe und Dichte Beschleunigung: B = ω2 . r ω…Winkelgeschwindigkeit r….Radius Relative Zentrifugalbeschleunigung (RZB): bezogen auf die Erdbeschleunigung RZB = B/ 981 Sedimentationsgeschwindigkeit v (Svedberg-Gleichung) v = D2.(ρ ρp-ρ ρm).RZB / 18η η D ρ η Teilchendurchmesser Dichte (Probe/Medium) Viskosität Zentrifugation (2) Sedimentationskoeffizient s: s = v / rω2 s ist die Sedimentationsgeschwindigkeit unter geometrisch vorgegebenen Bedingungen des Zentrifugalfeldes. s wird in Svedberg-Einheiten (S)angegeben: 1 S = 10-13 s Zentrifugationstechniken • Differentielle Zentrifugation Ausnützen unterschiedlicher Sedimentationsgeschwindigkeiten im Festwinkelrotor • Zonenzentrifugation Selektion durch Einbringen eines “flachen” Gradienten • Isopyknische Zentrifugation Trennung von Teilchen gleicher Größe, aber unterschiedlicher Dichte Dichtegradienten Kontinuierlicher oder diskontinuierlicher Gradient (CsCl, Sucrose, Polysaccharide, jodierte Aromaten) Zonenzentrifugation Rotoren für die Zentrifugation Dichte und Sedimentationskonstanten von Zellbestandteilen