STOFFWECHSEL
Werbung
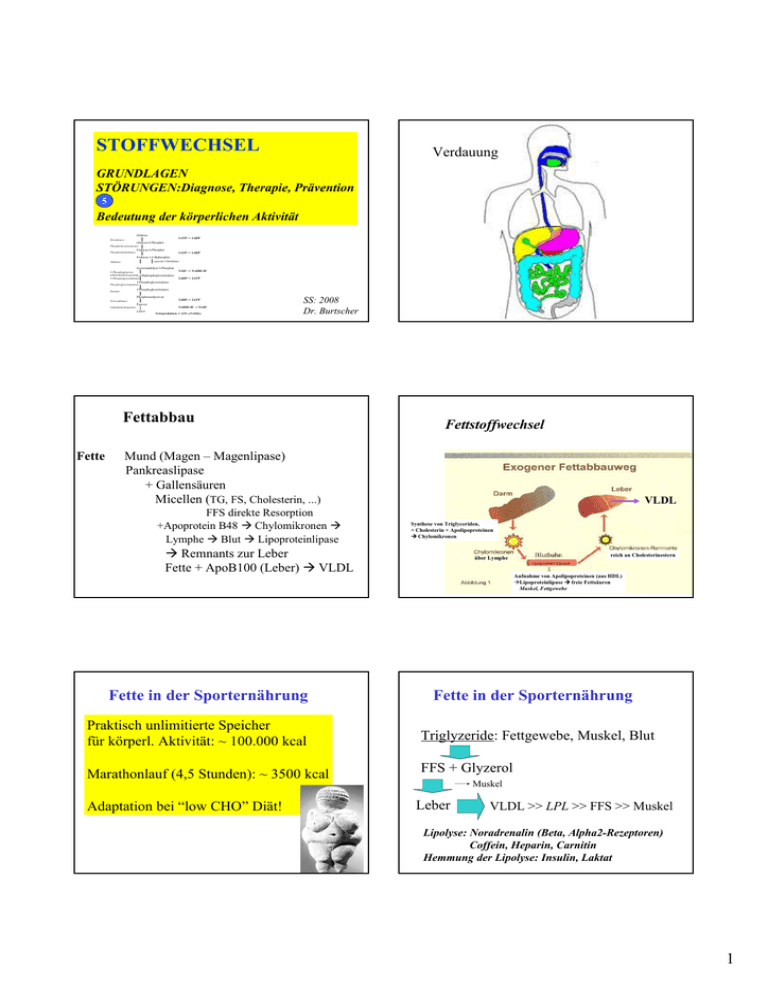
STOFFWECHSEL Verdauung GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 5 Bedeutung der körperlichen Aktivität Glukose 1ATP -> 1ADP Hexokinase Glukose-6-Phosphat Phosphohexoisomerase Fruktose-6-Phosphat Phosphofruktokinase 1ATP -> 1ADP Fruktose-1,6-Biphosphat (jeweils 2 Moleküle) Aldolase Gyzerinaldehyd-3-Phosphat 3-Phosphoglyzerinaldehyddehydrogenase1,3-Biphosphoglyzerinsäure 3-Phosphogyzeratkinase NAD+ -> NADH+H+ 2ADP -> 2ATP 3-Phosphoglyzerinsäure Phosphoglyzeratmutase 2-Phosphoglyzerinsäure Enolase Phosphoenolpyruvat 2ADP -> 2ATP Pyruvatkinase Pyruvat NADH+H+ -> NAD+ Laktatdehydrogenase Laktat Nettoproduktion: 2 ATP, (2NADH2) SS: 2008 Dr. Burtscher Fettabbau Fette Fettstoffwechsel Mund (Magen – Magenlipase) Pankreaslipase + Gallensäuren Micellen (TG, FS, Cholesterin, ...) FFS direkte Resorption +Apoprotein B48 Chylomikronen Lymphe Blut Lipoproteinlipase VLDL Synthese von Triglyceriden, + Cholesterin + Apolipoproteinen Chylomikronen Remnants zur Leber Fette + ApoB100 (Leber) VLDL Fette in der Sporternährung über Lymphe reich an Cholesterinestern Aufnahme von Apolipoproteinen (aus HDL) Lipoproteinlipase freie Fettsäuren Muskel, Fettgewebe Fette in der Sporternährung Praktisch unlimitierte Speicher für körperl. Aktivität: ~ 100.000 kcal Triglyzeride: Fettgewebe, Muskel, Blut Marathonlauf (4,5 Stunden): ~ 3500 kcal FFS + Glyzerol Adaptation bei “low CHO” Diät! Muskel Leber VLDL >> LPL >> FFS >> Muskel Lipolyse: Noradrenalin (Beta, Alpha2-Rezeptoren) Coffein, Heparin, Carnitin Hemmung der Lipolyse: Insulin, Laktat 1 Fette in der Sporternährung STOFFWECHSEL Trainingseffekte: Aminosäuren und Proteine Steigerung der Maximalleistung + %VO2max (Fettoxidation bis ~ 65 % VO2max Verbesserte Kapillarisierung bzw. Perfusion, Steigerung der LPL-Aktivität, TG-Speicher in der Muskulatur Aminosäuren und Proteine COOH 20 AS proteinogene AS H2N – C – H R (20) Andere: Ornithin, Citrullin, GABA Homocystein, ...) COOH AS: 2 funktionelle Gruppen: NH2 Bedeutung, Struktur Proteinbiosynthese, Stoffwechsel Proteine und körperliche Aktivität Neutrale, saure, basische, S-haltige, aromatische, heterozyklische AS Essentielle AS: Threonin, Valin, Leucin, Isoleucin, Lysin, Methionin, Phenylalanin, Tryptophan Trennung und Nachweis von AS: Chromatographie Elektrophorese Löslichkeitsverhalten Kolorimetrische Bestimmung Enzymatische Bestimmung Phenylalanin 2 Peptide bestehen aus verknüpften AS: Dipeptid, Tripeptid, Oligopeptid, Polypeptid z.B.: Insulin (51 AS) Glukagon (29 AS) Proteine > 100 AS Ampholytstruktur (Zwitterion) Puffereigenschaft Hydrophobe + hydrophile Gruppen: Lösungsverm., Lipoproteine Proteine Proteinbiosynthese proteuo: „ich nehme den ersten Platz ein“ Proteine als Träger der Lebensfunktionen: Struktur, Stoffwechsel u. Funktion der Zellen „Transcription“ „Translation“ DNA mRNA „Faltung“ Protein Funktion „Replikation“ RT Informationstransfer Von der DNA Sequenz zur Funktion 4 verschiedene Nukleotide 20 verschiedene Aminosäuren DNA - 4 Grundbausteine - dNukleotide (A, G, T, C) mRNA - 4 Grundbausteine - Nukleotide (A, G, U, C) Genetischer Code Adenin Guanin Thymin Cytosin A G T C Protein - 20 Grundbausteine - Aminosäuren Genetischer Code Alanin Arginin Asparagin Asparaginsäure Cystein Glutamin Glutaminsäure Glycin Histidin Isoleucin Leucin Lysin Methionin Phenylalanin Prolin Serin Threonin Tryptophan Tyrosin Valin Ala Arg Asn Asp Cys Gln Glu Gly His Ile Leu Lys Met Phe Pro Ser Thr Trp Tyr Val A R N D C Q E G H I L K M F P S T W Y V 3 Transkription Genetischer Code Codon - Triplett; 3 NT codieren für 1 AS -> 43 = 64 Kombinationen 1 bis 6 verschiedene Codons können für verschiedene Aminosäuren verwendet werden 3 STOP Codons: UAG, UGA, UAA DNA -> Proteinsequenz; Proteinsequenz -//>DNA Translation PROTEINE – Einteilung: nach Vorkommen: in Organismen (Pflanze, Tier , Bakterium, Virus) in Organen oder Zellorganellen nach physikalischen und chemischen Eigenschaften: Skleroproteine (fibrilläre Proteine, Faserprotein, wasserunlösliche Stütz u. Gerüstbildner); z.Bsp.: α-Keratin, Kollagen Globuläre Proteine (Sphäroproteine, sphärische Gestalt, wasserlöslich) z.B.: Albumine, Globuline, Histone Einfache (nur aus AS bestehende) Proteine und zusammengesetzte Proteine (konjugierte Proteine, Proteide) Glycoproteine (Proteine mit 1-80% Kohlenhydratanteil, kovalent verbunden) Lipoproteine (Proteine mit angelagerten Lipiden) Phosphoproteine (Serin u. Threonin-Reste sind mit Phosphorsäure verestert) Metalloproteine (Metallatome in ionischer u.a. kovalenter Bindung) Nach biologischen Funktionen: Enzyme, Strukturproteine, kontraktile Proteine, Transportproteine, Speicherproteine, Rezeptorproteine, Hormone Chromoproteine (enthalten farbige niedermolekulare Verbindungen, z.Bsp. Häm oder Cytochrome) 4 - Bausteine von Proteinen - Neurotransmitter-Synthese (Glutamat, GABA, Glycin) - Porphyrin-Synthese (Glycin) - Purin- und Pyrimidin-Synthese (Glutamin, Aspartat, Glycin) - NO-Bildung aus Arginin - Niacin-Synthese (Tryptophan) - C1-Stoffwechsel - Polyamin-Synthese - Synthese biogener Amine (z. B. Serotonin) - Kreatin-Synthese - Melanin-Synthese - Synthese von Aminozucker - Hormonsynthese (Catecholamine, Schilddrüsenhormone) - Energiegewinnung - Gluconeogenese - Ketogenese - ... Primärstruktur: bezeichnet die Aminosäuresequenz. Sekundärstruktur: bezeichnet die räumliche Anordnung der Polypeptidkette bedingt durch Wasserstoffbrückenbindungen zwischen den Peptidbindungen ohne Berücksichtigung der Wechselwirkungsmöglichkeiten der Seitenketten der Aminosäuren. (Rückgrat des Proteins, die räumliche Lage der Peptidbindungen) Funktionen der Aminosäuren Tertiärstruktur: bezeichnet die vollständige räumliche Struktur eines Protein unter Berücksichtigung auch der intramolekularen Wechselwirkungen der Seitenketten. Quartärstruktur: bezeichnet die räumliche Struktur von Assoziaten mehrerer Proteinmoleküle. (Molekülkomplexe, die durch intermolekulare Wechselwirkungen zusammengehalten werden) Proteinumsatz Proteinstoffwechsel Hydrolytische Zerlegung Proteinasen, Peptidasen AS Darm Blut Leber Abbau Aufbau Transaminierung oxid. Desaminierung Ammoniak Harnstoffzyklus (Entgiftung) 5 Umbau und Abbau der Aminosäuren Prinzip der Transaminierung Proteine in der Sporternährung Ca. 15 % des KG sind Proteine >> hauptsächlich Muskulatur 8 (9-Histidin) essentielle AS: Valin, Methionin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Threonin, Lysin Komplette Proteinnahrungsmittel Harnstoffzyklus Proteine in der Sporternährung Kontrolle: N-Bilanz Ungenügende Energieaufnahme >> negative N-Bilanz trotz ausreichender Proteinzufuhr! Normal: 0,8 - 2,0 g/kg/d Milchprodukte Eier Fleisch, Fisch, Huhn Mais/Reis + Bohnen Mais + Erbsen Linsen + Brot Proteine in der Sporternährung Verzweigtkettige AS (Valin, Leucin, Isoleucin) werden von der Muskulatur oxidiert >> bes. bei wenig CHO >> nach ca. 1 h Belastung and. AS werden abgegeben BCOAD aktiviert durch zunehmende Bel.intensität Geschletsspezifische Effekte Altersabhängigkeit Zyklusabhängigkeit Temperatureffekte 6 Proteine in der Sporternährung Empfehlungen: für Ausdauersportler: 1,2 - 1,4 g/kg/d für Kraftsportler: 1,2 - 1,7 g/kg/d durch normale Ernährung gegeben! 7











