Proteine III
Werbung

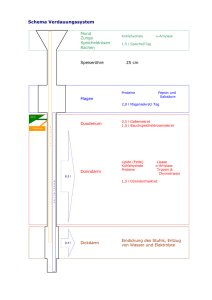
Proteine III SDS-PolyacrylamidGelelektrophorese Dr. Sandra Scheiblhofer Analyse und Reinigung von Proteinen Chromatographie Ultrazentrifugation Elektrophorese Röntgenkristallographie Serumproteine ca. 100 verschiedenen Proteine im Blutplasma; stammen aus Leber und Lymphknoten; Gesunder Organismus: dynamisches Gleichgewicht zwischen Biosynthese und Abbau von Plasmaproteinen Hypoproteinämie – zu niedriger Plasmaproteinspiegel Ursachen: - verringerte Biosynthese (vermindertes Aminosäureangebot oder Leberparenchymschäden) - vermehrte Ausscheidung - Nierenschädigung Hyperproteinämie – zu hoher Plasmaproteinspiegel durch vermehrte Biosynthese; meist klonale Expansion von γ− Globulin produzierenden Plasmazellen Fraktionen der Serumproteine I Bestimmung der gesamten Proteinkonzentration besitzt nur beschränkte Aussagekraft – Auftrennen der Plasmaproteine in Einzelfraktionen Æ diagnostische Hinweise Grundsätzlich kann man Plasmaproteine in 5 Fraktionen trennen: 1) Albumine 2) α1-Globuline 3) α2-Globuline 4) β-Globuline 5) γ-Globuline Analyse der Serumproteinfraktionen I Die Trägerelektrophorese wird meist routinemäßig (,screening method‘) bei Verdacht auf bestimmte Krebstypen durchgeführt. Nach der elektrophoretischen Auftrennung kann man 5 gefärbte Banden (Albumin und Globuline) erkennen. Analyse der Serumproteinfraktionen II Abb.1 Zur genaueren Analyse können die Banden eingescannt und mittels Bildanalyseprogrammen berechnet werden (Abb.1). Am wichtigsten ist die Erkennung abnormer Eiweißstoffe, sog. Paraproteine (Abb.2). Paraproteine können Indikatoren für Blutkrebs sein. Abb.2 Albumin hohe Fähigkeit zur Wasserbindung Æ wichtiger Regulator des kolloidosmotischen Drucks Transportvehikel für Pharmaka, Vitamine, Magnesium, Calcium, nichtveresterte Fettsäuren, Spurenelemente, Abbau- und toxische Produkte im Blut in der Leber synthetisiert und anschließend in den Extrazellulärraum sezerniert; 40% befinden sich im Plasma, 60% im Extrazellulärraum des Hautgewebes Stark erniedrigte Albuminwerte deuten auf schwere Leberleiden, Leberzirrhose oder Nephrose hin. α1-Globuline Saures α1-Glycoprotein: kohlenhydratreichstes Serumprotein; als Akute-Phase-Protein an der Immunmodulation beteiligt; liegt besonders bei akuten und chronischen Entzündungen, bei Carcinomen und während der Schwangerschaft in hohen Konzentrationen vor. α1-Fetoprotein: im fetalen Plasma, beim gesunden Erwachsenen nur in Spuren vorhanden; bindet Östrogen, könnte den Fetus vor einem Überschuss an mütterlichem Östrogen zu schützen. Bei Patienten mit Leberzellkarzinomen oder Hodentumoren findet die Biosynthese von α1-Fetoprotein in den Tumorzellen statt und wird von denen ins Plasma abgegeben. Weiters gehören zur α1 Fraktion: Proteaseinhibitoren, Hormon-bindende Proteine, α1 Lipoprotein (HDL), und Prothrombin. α2-Globuline / β-Globuline α2- Gobuline sind ,Carrier-Moleküle‘ - binden und transportieren bestimmte Stoffe (Haptoglobin bindet Hämoglobin, Coeruloplasmin ist das Transportmolekül für Kupfer). Weiters findet man unter den α2- Gobulinen Thrombin-Inhibitoren, Plasmin-Inhibitoren und das Proenzym Plasminogen. Zu den β-Globulinen zählt man Transferin (bindet und transportiert Eisenmoleküle) Fibrinogen (Fibrinvorstufe – dient der Blutgerinnung) CRP (C-reaktives Protein): fördert die Phagozytose, indem es Makrophagen und das Komplementsystem aktiviert. CRP steigt bei Entzündungen 10-1000fach an und wird zu den Akute-PhaseProteinen gezählt. β-Lipoprotein (low densitiy lipoprotein-LDL), für den Lipidtransport Faktoren des Komplementsystems γ-Globuline Bei den γ-Globulinen (Immunglobulinen) handelt es sich um Antikörper; man unterscheidet fünf Immunglobulinklassen: IgG, IgA, IgM, IgD und IgE γ-Globuline werden von zu Plasmazellen ausgereiften B-Zellen produziert. Sie zirkulieren im Blut, befinden sich aber auch an der Oberfläche von allen BLymphozyten, wo sie als Membranrezeptoren für Antigene wirken. γ-Globulin-Erhöhung bei: Längerdauernden entzündlichen Prozessen (Infektionen; Autoimmunerkrankungen: z.B. Rheuma; maligne Tumoren) Lebererkrankungen, besonders Leberzirrhose Erhöhte Produktion von γ-Globulinen durch Blutkrebserkrankungen Akute-Phase-Reaktion Gewebsverletzung Unspezifische Entzündungsreaktion Erhöhte Plasmakonzentration von Akute-Phase-Proteinen (meist in Hepatocyten gebildet) Regulation der Synthese durch Cytokine, die von Entzündungszellen gebildet werden Bei Stress: Corticosteroide; wirken als Cofaktoren Elektrophorese Elektrophorese ist die Wanderung geladener Teilchen in einem elektrischen Feld. Zur Erzeugung des elektrischen Feldes wird das ganze Elektrophorese-System in einen Puffer getaucht und Spannung angelegt. Über die im Puffer enthaltenen Ionen fließt Strom. Dabei wandern positiv geladene Teilchen (Kationen) zur Kathode (-) und negativ geladene Teilchen (Anionen) zur Anode (+). Die Mobilität dieser Teilchen wird von mehreren Faktoren beeinflußt: - Form und Größe - Nettoladung - Porengröße des Trägers - Stärke des elektrischen Feldes Wanderungsgeschwindigkeit I Die Wanderungsgeschwindigkeit nimmt für größere Moleküle ab, da Reibungskräfte und elektrostatische Hemmungen zunehmen. Moleküle ähnlicher Größe, aber unterschiedlicher Form, können unterschiedliche Wanderungseigenschaften aufweisen, da Reibungskräfte und elektrostatische Kräfte unterschiedlich angreifen. Wanderungsgeschwindigkeit II Ohmsches Gesetz: U I= R I = Stromstärke (in Ampere A) U = Spannung (in Volt V) R = Widerstand (in Ohm Ω) Wanderungsgeschwindigkeit III E z v = f v = Wanderungsgeschwindigkeit des Teilchens E= elektrische Feldstärke z = Nettoladung des Teilchens f = Reibungskoeffizient SDS-PAGE Sodiumdodecylsulfat Polyacrylamidgel- E lektrophorese häufige Methode um Proteingemische zu trennen und die Größe von Proteinen abzuschätzen Detergens (SDS) bindet im Überschuss an die Proteine im Proteingemisch (etwa 1,4g SDS / 1g Protein). Alle Proteine tragen daher eine beständig negative Ladung und wandern zum positiven Pol, der Anode. Infolge der Molekularsiebeigenschaften des Polyacrylamidgels bewegen sich die Proteine unterschiedlich schnell. Je grösser ein Protein, desto langsamer wird es durch die Maschen des Polyacrylamidgels gezogen. Läßt man Eichproteine mit bekanntem Molekulargewicht mitlaufen, so kann man das Molekulargewicht der unbekannten Proteine bestimmen. -200kD -116kD -97kD -66kD -45kD -31kD -21.5kD -14.4kD Polyacrylamidgele als Trägermedien Die Wanderung von Proteinen aufgrund des elektrischen Feldes wird durch das Gel größenabhängig abgebremst. Moleküle, die im Verhältnis zu den Gelporen klein sind, wandern schnell, Moleküle, die größer sind als die Poren, sind nahezu unbeweglich. Polyacrylamid wird in der Elektrophorese gerne als Trägersubstanz verwendet, da : - es chemisch inert ist - es sich leicht herstellen läßt - die Porengröße leicht zu variieren ist Polyacrylamidgele Polyacrylamidgele sollten kurz vor Gebrauch hergestellt werden. Das Monomer Acrylamid wird mit einem quervernetzenden Agens -meist N,N`Methylenbisacrylamid (Kurzform: ,Bis‘) mit Hilfe eines Radikalbildners (Ammoniumpersulfat) und eines Katalysators (TEMED) polymerisiert. Die Porengröße wird durch das Verhältnis der Konzentration des Acrylamid-Monomers zu der des Quervernetzungsagens Bis bestimmt. SDS Dient dazu, die Proteine zu denaturieren, da es fast alle nicht-kovalenten Wechselwirkungen in nativen Proteinen zerstört. Erhitzen auf 95°C löst alle Tertiär – und Sekundärstrukturen auf. Die SDS-Anionen binden sich an die Hauptketten der denaturierten Proteine, sodaß Komplexe mit einer stark negativen Ladung entstehen. Um noch vorhandene Disulfidbrücken zu reduzieren, gibt man 2-Mercaptoethanol oder Dithiothreitol (DTT) zu. Probenvorbereitung Die Proben enthalten neben SDS und 2-Mercaptoethanol noch Glycerin oder Saccharose, um die Dichte zu erhöhen, und Bromphenolblau als Markierungsfarbstoff. Vor dem Laden der Gele werden die Proben für 10 min. aufgekocht, damit alle Proteine vollständig denaturiert werden und auch hydrophobe Proteine in Lösung gehen. Diskontinuierliches Puffersystem I Die Diskontinuierliche (Disk -) Elektrophorese wurde von U.K.Laemmli eingeführt Bei der Disk -Elektrophorese wird die Gelmatrix in 2 Bereiche geteilt: 1) weitporiges Sammelgel 2) engmaschiges Trenngel Die Disk - Elektrophorese hat 2 Vorteile: 1) Aggregation von Proteinen bei Eintritt in das Gel wird verhindert 2) Schärfung der Banden Diskontinuierliches Puffersystem II Andere Proteingel-Typen Gradienten – Gele: Eignen sich, wenn man auf einem Gel Proteine mit sehr unterschiedlichen Grössen auftrennen will Porenweite verringert sich mit der Gellänge Trennschärfe in jedem Bereich sehr gut Native Proteingele SDS-frei Sekundär- und Tertiärstruktur bleibt erhalten Wanderung der Proteine durch ihre Eigenladung Nicht reduzierende Proteingele Ohne DTT oder 2-Mercaptoethanol Disulfidbrücken und somit Quartärstruktur bleiben erhalten Nachteile von nativen und nicht reduzierenden Gelen Neigung zur Aggregatbildung Schlechte Auflösung Schlechte Reproduziebarkeit Nachweismethoden Elektrophoretisch aufgetrennte Proteine können mithilfe von Färbemethoden sichtbar gemacht werden. Coomassie-Brilliant-Blue Das Gel wird dabei in eine Lösung aus Coomassie-BrilliantBlue und 10% Essigsäure eingelegt. Die Proteine werden gefärbt und gleichzeitig durch die Essigsäure fixiert. Nachweisgrenze: 0,5-1µg stöchiometrische Färbung Silverstain Ag+Ionen werden durch schwefelhältige und basische Aminosäuren zu metallischem Silber reduziert. Die Färbung ergibt rotbraune bis schwarze Spots. Empfindlichere Methode mit einer Nachweisgrenze von ca.10ng nicht-stöchiometrische Färbung