Antigen-präsentierende Zellen
Werbung

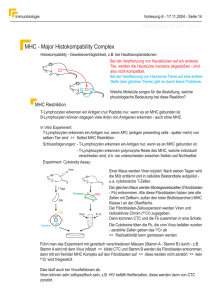
Antigen-präsentierende Zellen Bakk-Modul Immunologie Prof. Dr. Albert Duschl T-Aktivierung 1 Antigenpräsentierende Zellen (APC) sind vor allem Dendritische Zellen, und daneben Makrophagen und B-Zellen. Sie sind in der Lage, T-Zellen zu aktivieren. T-Zellen können Antigene nicht direkt erkennen. Sie können über ihren T-ZellRezeptor (TCR) aber Antigenfragmente erkennen, die in einen MHC Komplex eingebettet sind. Das Antigenfragment ist in der Regel ein Peptid. Der TCR erkennt also einen MHC/Peptid-Komplex. Die TCR-MHC-Bindung reicht alleine nicht aus um die T-Zelle zu aktivieren. Es wird ein zweites Signal benötigt das über die Bindung von Zelladhäsionsmolekulen auf beiden Zelltypen aneinander hergestellt wird. © Burmeister/Pezzutto: Taschenatlas der Immunologie T-Aktivierung 2 Ein wichtiges Cosignal ist etwa Bindung von CD28/CTLA4 an CD80/CD86. Weitere Signale werden über Cytokine vermittelt die von APC produziert werden. Sowohl bei Adhäsionsmolekülen als auch bei Cytokinen gibt es welche die T-Zellen ganz allgemein aktivieren (Bsp. CD80/86 und IL-2). Daneben gibt es für beide Signaltypen spezielle Signale die Differenzierung von bestimmten T-Zell-Subtypen fördern. Die APC lösen damit nicht nur die Immunantwort aus sondern beinflussen auch die Art der Immunreaktion. Ohne zweites Signal kommen Superantigene aus die MHC und TCR gleichzeitig binden. Beispiel: Staphylococcus Enterotoxin B (SEB). © Burmeister/Pezzutto: Taschenatlas der Immunologie MHC I, MHC II MHC (Major Histocompatibility Complex) liegt als Dimer vor. Strukturell gehören MHC zur Immunglobulin-Superfamilie, genauso wie der TCR. Es gibt 2 MHC Typen, MHC I und MHC I, wobei für beide eine grosse Zahl von unterschiedlichen Allelen im Genom vorliegen. Welche von diesen Allelen Sie besitzen macht einen Teil Ihrer immunologischen Identität aus. Die betreffenden Gene heißen HLA. Die Liste rechts deckt nur MHC I ab. MHC I besteht aus einem Transmembranprotein und einem Serumprotein (ß2-Mikroglobulin), MHC II besteht aus zwei Transmembranproteinen. Die 3D-Struktur des Komplexes ist aber jeweils ganz ähnlich. © Burmeister/Pezzutto: Taschenatlas der Immunologie Struktur Der extrazelluläre Anteil der MHCStruktur besteht aus 4 Domänen, hier gezeigt für MHC I. Die N-terminalen Domänen formen zusammen eine „Canyon“-artige Struktur, bei der ein ß-Faltblatt den Boden bildet und zwei a-Helices die Wände darstellen. Das Ergebnis ist eine breite Lücke (cleft) in die ein Peptid eingelagert werden kann. Aminosäurereste aus dem MHC ragen in diese peptide binding cleft hinein und können dort ein Peptid binden. MHC II ist weiter offen und bindet meist Peptide mit 12-19 AS (10-30). MHC I ist geschlossen und bindet kürzere Peptide. © Paul: Fundamental Immunology Cleft In die Cleft passen Peptide wenn sie dort a) stukturell unterkommen (WYWY dürfte anderen Raumbedarf haben als AGAG oder PXXP) und b) Wechselwirkungen mit Ankerresten des MHCKomplex ausbilden können. Das Beispiel rechts ist wieder MHC I, und zwar das gleiche MHC I Allel mit zwei unterschiedlichen Peptiden. Sie sehen daß es sich um Peptide aus dem gleichen Protein handeln dürfte. Da sich die Komplexe aber unterscheiden, könnten jeweils unterschiedliche TCR daran binden. Damit können verschiedene T-Zell Klone aktiviert werden, obwohl in beiden Fällen sogar das gleiche T-Zell Epitop verwendet wird. T-Zell Epitope sind immer linear, was für B-Zell Epitope nicht stimmen muß. Manche T-Zell Epitope sind immundominant, reagieren also sehr gut. Sie haben die Auswahl aus mindestens 107 unterschiedlichen T-Zell-Klonen. © Kropshofer/Vogt: Antigen Presenting Cells I vs. II MHC I präsentiert Self Peptide. Der Komplex bindet TCR und das T-Zell Antigen CD8. Da CD8 für cytotoxische Killerzellen (CTL) charakteristisch ist, wird die Zelle u.U. getötet. Dies passiert wenn das selbst hergestellte Peptid nicht zum Self des Körpers passt, wie z.B. Virusproteine oder Fusionsproteine in Krebszellen. Alle kernhaltigen Zellen tragen MHC I. MHC II präsentiert Non-Self Peptide die von aussen aufgenommen wurden. Der Komplex bindet TCR plus CD4, das typische Antigen der T-Helferzellen (TH). Aufgabe der TH ist die Einleitung einer adaptiven Immunantwort. Nur antigenpräsentierende Zellen haben MHC II und sie werden bei Kontakt mit T-Zellen via MHC II auch nicht zerstört. Sowohl für MHCI als auch für MHC II gilt daß die TZell Aktivierung nur erfolgt wenn die Bindungsaffinität stark genug ist. Je stärker, um so intensiver die Stimulierung. © Schütt/Bröker: Grundwissen Immunologie Peptidprozessierung Hochaffine Erkennung von MHC I und MHC II hat ganz unterschiedliche Konsequenzen, daher muß die Beladung der MHC I und MHC II völlig getrennte Wege gehen. MHC II wird beladen nachdem Antigen über coated pits endozytiert wurde und im Endosom daraus Peptide hergestellt wurden. Endosomen verschmelzen dann mit Transportvesikeln die MHC II enthalten. MHC I verwendet endogen erzeugte Proteine (incl. Virusproteine!) die im Proteasom abgebaut werden. Über TAP (Transport proteins associated with antigen processing) gelangen diese Peptide dann ins Endoplasmatische Retikulum, wo sie auf MHC I treffen. Auch APC haben MHC I, können also durchaus bei Virusbefall zerstört werden. © Burmeister/Pezzutto: Taschenatlas der Immunologie Dendritische Zellen 1 DC wurden zuerst als „akzessorische Zellen“ beschrieben, die notwendig waren um T-Zellen Immunantworten zu erlauben. Die Zellen bildeten lange, verzweigte Fortsätze aus: Dendriten. Dendritische Zellen (DC) sind die wichtigste Klasse von APC. Es gibt unterschiedliche Subsets von DCs, die sich nach Oberflächenmarkern und Lokalisierung unterscheiden lassen. Dendriten können auch durch Epithelien hindurchtreten und auf diese Weise die Mikroorganismen der Umgebung wahrnehmen. Überwiegend sitzen DC aber nahe an Körperoberflächen, wo das Eindringen von Pathogenen am wahrscheinlichsten ist. © Wikimedia Commons Dendritische Zellen 2 Ein Beispiel für DC sind Langerhans-Zellen (LC) in der Epidermis. Bei Aktivierung etwa über PRR verlassen LC die Epidermis und wandern in den zugehörigen lokalen Lymphknoten, wo sie auf T-Zellen treffen. Hier findet im Parakortex der DC:T-Kontakt statt. © Drößler/Gemsa: Wörterbuch der Immunologie Lymphknoten DCs gelangen über Lymphgefäße in den Lymphknoten, die T- und BZellen über High Endothelial Venules (HEV) aus dem Blut. B-Zellen liegen unstimuliert in Primärfollikeln, stimuliert in Keimzentren (Sekundärfollikeln) vor. In Keimzentren erfolgt der T:B Kontakt, die Antikörpersynthese wird induziert. Follikel werden von den follikulären dendritischen Zellen mit organisiert und das sind keine DC (!). Sie kommen nicht aus der Hämatopoiese, fangen aber Antigene als Immunkomplexe ein (AG/AB/Complement), sorgen also für AG-Spezifität der B-Zellen. © Science 336:1676 (2012) T-Aktivierung 3 B-Zellen und Antikörper kriegen wir später, aber lassen Sie uns auf die entscheidende Wechselwirkung zurückkommen: Dem ZellZell Kontakt zwischen DC und T-Zellen. Hier entscheidet sich ob eine adaptive Immunreaktion ausgelöst wird und wenn ja, welcher Typ von Immunreaktion gewählt wird. Die häufigste Reaktion ist die Entscheidung für Toleranz. Die meisten non-self Entitäten sind für den Körper nicht bedrohlich und werden toleriert. © Burmeister/Pezzutto: Taschenatlas der Immunologie In der T-Zelle Nach Aktivierung des TCR und der Wahrnehmung der notwenigen Co-Signale findet in der T-Zelle eine komplexe Signalverrechnung statt. Das Bild rechts ist korrekt, aber vereinfacht. Doch. Wirklich. Wenn keine Toleranz induziert wird ist mit die erste Aufgabe der T-Zelle die Proliferation einzuleiten: Der Klon vermehrt sich um ausreichend T-Zellen für die Immunreaktion verfügbar zu haben. Wichtig ist dabei die Induktion der Expression von IL-2, einem starken Proliferationsstimulus für T-Zellen. Je stärker die Stimulierung um so stärker die Reaktion: Super-Responder dominieren die Immunreaktion und werden später zu Memory-Zellen. © Cell Signaling Technologies Interleukin-2 Wenn IL-2 für die Auslösung der Immunantwort so wichtig ist, dann bietet es sich als Target für die Medizin an. IL-2 selber wird bei manchen Krebsarten als Immuntherapeutikum eingesetzt. Es wirkt am besten bei Nierenkrebs. Ziel der Behandlung ist die Förderung von anti-Tumor Immunität. Hauptproblem dabei: Capillary leak syndrome. Die Hemmung der IL-2 Expression ist die wesentliche Wirkung von Immunsuppressiva wie Cyclosporin A und FK506. Sie werden etwa bei Transplantationen und bei chronisch entzündlichen Erkrankungen verwendet. © Cell Signaling Technologies Immunmodulation Da Immunantworten bei vielen Erkrankungen eine Rolle spielen (teils sogar kausal) ist die Manipulation des Immunsystems eine ständige Aufgabe. Wir werden noch eine Reihe von Möglichkeiten dafür kennen lernen. Es handelt sich um einen aktiven Bereich gegenwärtiger Forschung so dass Sie hier vielleicht einmal Ihren Arbeitsplatz finden. Weiß man‘s? © Gahan Wilson