pdf 1
Werbung

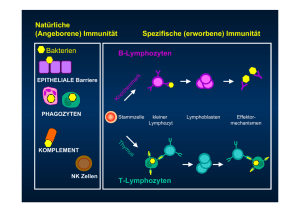
Inhalte unseres Vortrages Vorstellung der beiden paper: Germ – line transmission of a disrupted ß2 – mirkroglobulin gene produced by homologous recombination in embryonic stem cells ß2 – Mikroglobulin deficient mice lack CD4- 8+ cytolytic T cells Theoretischer Hintergrund zum besseren Verständnis der beiden Paper Gliederung: 1. Was ist eine Knockout – Maus ? 2. Herstellung einer Knockout – Maus 3. T – Zell - Rezeptor 9. MHC Klasse I Komplex und ß2 - Mikroglobulin 5. MHC Klasse II Komplex 1. Was ist eine Knockout – Maus ? Tiere bei denen ein ganz bestimmtes Gen gezielt ausgeschaltet wurde benötigt Tiere, die den gleichen genetischen Hintergrund haben → Verwendung von Inzuchttieren Vergleich über Auswirkungen des Genverlustes Herstellung von Krankheitsmodellen für bestimmte Krankheiten Modellsystem Maus: kurze Generationszeit (10 Wochen) Hohe Nachkommenzahl (5 – 10 Neugeborende / Wurf) geringe Lebenserwartung 90 % der Gene von Mensch und Maus haben ähnliche Strukturen und Funktionen 2. Herstellung einer Knockout Maus Gezieltes Ausschalten von Genen und Untersuchung der Auswirkungen Methode ist sehr langwierig und aufwendig (dauert mehrere Monate) Grundlage ist homologe Rekombination → Verknüpfung von DNA Segmenten mit ähnlichen Nukleotidsequenzen Gen liegt in klonierter Form vor Gen wird verändert durch Einbau eines Neomycin Resistenzgen (Neo+) und HSV – tk Gen (Thymidinkinase – Gen aus Herpes – simplex – Virus) Selektionsmarker → Kontrolle des Rekombinationsprozesses Targeting Vektor wird kloniert und über Elektroporation in ES – Zellen eingebracht Nur ein Teil des Transgens wird aufgenommen . Wie funktioniert ein Replacement Vektor enthält Neomycin Resistenzgen und HSV – tk Gen → Selektionsmarker endogenes Gen wird durch homologe Rekombination inaktiviert 2 Crossover – Ereignissen f´ühren zu Verlust des HSV – tk Gens (Negativselektion) und Integration des Neomycin Resistenzgen (positive Selektion) Geninaktivierung und Expression des Neo+ nur ein Teil des Transgens wird aufgenommen durch homologe Rekombination (keine Insertion des HSV – tk Gens!!) andere Möglichkeiten sind random Insertion ( Insertion des HSV – tk Gens!!!!) keine Insertion ( besitzen kein Neomycin Resistenzgen) Zugabe von Neomycin Antibiotika G418 und Ganciclovir (Basenanalog) Bei homologen Einbau des Transgens sollte HSV – tk Gen verlorengegangen sein Zellen mit HSV – tk Gen (random Insertion) überführen Basenanalog in Nucleotide → Hemmung der DNA Replikation → Zelltod Zellen mit keiner Insertion des Transgens können kein Neomycin Resistengen exprimieren → Zelltod Zellen mit target insertion überleben Überprüfung der Ergebnisse durch PCR und Southern Plot Zellen sind heterozygot in Bezug auf das Transgen Übertragung der transgenen ES Zellen (einer Maus mit brauner Fellfarbe) im Blastocyste einer Maus mit schwarzer Fellfarbe Übertragung der Blastocyste in surrogate Maus → Entstehung einer chimären Maus (Gewebe besteht aus 2 Zelltypen unterschiedlicher Herkunft) Chimäre besitzen fleckig – schwarze Fellfarbe Kreuzung einer Chimären Maus mit Maus schwarzer Fellfarbe Phänotyp nicht erkennbar, da das unveränderte allele Gen Wiltyp – Gen Produkte produziert Kreuzung heterozygoter Mäuse → man erhält homozygote Mäuse → Ergebnis im Phänotyp: gerollter Schwanz Vorteil dieser Methode Durchführung und Überprüfung genetischer Veränderung zuerst in Zellkultur und erst danach Herstellung von genetisch veränderten Mäusen 3. T - Zell Rezeptor (TCR) sind mit B – Zell Rezeptoren verwandt 2 bekannte TCR Formen: a.) Heterodimer aus einer α- und einer β – Kette (α β TCR) b.) Heterodimer aus einer γ - und einer δ Kette (γ δ TCR) Bestehen aus variablen (grau) und konstanten Domäne (blau) TCR erkennen intrazelluläre Antigene (Viren, intrazell. Bakterien) Oberflächenkontakt zwischen einer CD4+ T – Zelle und antigenpräsentierenden Zelle TCR Komplex besteht aus spezif. α β TCR und assoziierten Molekülen CD3 Proteine dienen der Expression des TCR an Zelloberfläche u. Signaltransfer von TCR ins Zellinnere → Aktivierung der T – Zelle CD4 bzw. CD8 binden als Corezeptor an MHC Klasse I od. II (APC) → präsentiert ein Peptid ;Antigen → vom α β TCR spezif. erkannt → löst Immunantwort aus Einteilung nach Funktion Zytotoxische T – Zellen (CTL): - Oberflächenmarker: CD8 - Töten infizierte Zellen unseres Körpers und Tumorzellen - Erkennen Peptide auf MHC Klasse I T – Helferzellen: Oberflächenmarker: CD4 Aktivieren CTL und Makrophagen und fördern B – Zell Differenzierung - Erkennen Peptide auf MHC Klasse II 4. MHC Klasse I Komplex und ß2 Mikroglobulin Besitzen eine schwere α – Kette und eine leichte β – Kette Außerhalb des MHC codiert ß2 Mikroglubin (ß2m) ß2m ist hochkonserviert α – Kette ist hoch polymorph MHC I Komplex ist Trimer aus schwerer Kette, ß2 Mikroglubin und dem Peptid TCR von CTL und CD8 binden MHC I TCR bindet Peptid und Oberfläche von MHC I CD8 bindet α – Domäne von MHC I 5. MHC Klasse II Komplex nur auf B – Zell, Makrophagen und dentritischen Zellen hat α – Kette und β – Kette, beide transmembrane Glykoproteine mit je zwei lg- ähnlichen Funktionen MHC II präsentiert für Antigene , die durch endozytose aufgenommen werden TCR von T – Helferzelle und CD4 binden MHC II CD4 bindet an ß2 Domäne von MHC II Prozessieren von Antigenen durch MHC Molekülen Aufnahme eines exogenen Antigen → wird prozessiert - Peptid wird auf der Zelloberfläche MHC Kl. II Molekülen präsentiert Aufnahme einer endogenen viralen DNA → codiert Virus Antigen → wird prozessiert → werden MHC Kl. I Molekülen präsentiert Peptidfragmente entstehen in verschiedenen Kompartimenten der Zelle Funktion von MHC Molekülen ist die Antigenpräsentation Zytotoxische T – Zellen erkennen ein fremdes Antigen (z.B. Virus) und tötet Zielzelle Helfer T – Zellen erkennen fremdes Antigen in Verbindung mit Genprodukten auf antigenpräsentierenden Zellen (APC) Helfer T – Zellen können mit B – Zellen bei der Induktion von Antikörper zusammenarbeiten u. Lymphokine freisetzen, welche Makrophagen beim Abtöten intrazellulärer Mikroorganismen unterstützen. Quellennachweis Kurzes Lehrbuch der Immunologie; 2. neubearbeitete Auflage von Ihor Harabacz Molekulare Genetik von Rolf Knippers; 8. Auflage Lehrbuch der Genetik von Seyffert; 2. Auflage An introduction to Genetic Analysis von Griffiths; 7. Auflage