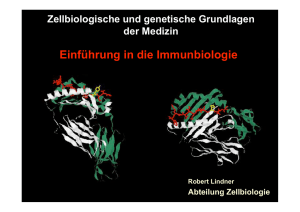
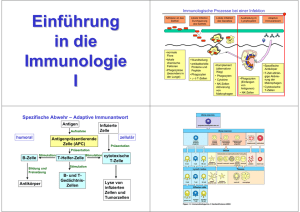
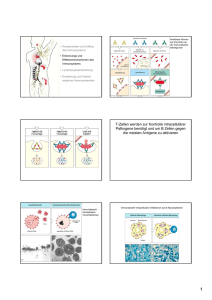
Immunologie Teil A
Werbung

Immunologie Teil A Thomas Decker WS 2010/2011 Dies ist meine Mitschrift von Immunologie Teil A aus dem Wintersemester 2010. Ich übernehme keine Garantie für Vollständigkeit/Richtigkeit oder gute Noten auf die Prüfung. Viel Erfolg beim Lernen! Immunologie, 13. Oktober 2010 General properties of Immune Responses allgemeine Eigenschaften einer Immunantwort: Edward Jenner: Beobachtung, dass Milchmägde, die mit den Kuhpocken infiziert waren, eine Resistenz gegen die menschl. Pocken entwickelten Mit harmlosen Pocken gegen die schlimmen impfen. erstmalige Systematische Impfung der Bevölkerung, Schutz gegen tödl. Krankheit, mit geringer Wahrscheinlichkeit, die tödliche Krankheit zu bekommen. Pasteur und Koch haben viele MOs entdeckt & isoliert und festgestellt, dass diese für die Krankheit verantwortlich sein können; Koch’schen Postulate, danach konnte man beginnen, richtige Impfstoffe herzustellen. Neugier: Wie funktioniert das eigentlich? Was schützt uns eigentlich vor MOs? Behring & Kitasato: durch Übertragen von Serum von einem immunen Organismus auf einen nicht immunen Organismus konnte in vielen Fällen der Immunschutz übertragen werden. Wusste aber noch nichts von Antikörpern, hat dennoch quasi ihre Funktion beschrieben. Paul Ehrlich: Seitenkettentheorie: Zelle hat auf ihrer Oberfläche versch. Strukturen (=Seitenketten), welche mit Krankheitserreger interagieren kann, woraufhin Zelle die Seitenkette freisetzt; dies sei die Funktion, die die Immunität erzeugt. Elie Metchnikoff: Beobachtung, dass es Zellen gibt, die in der Lage sind, MOs aufzufressen und abzutöten Micro-/Macrophagen (Microphagen mittlerweile Granulozyten genannt). Zellvermittelte Immunität (also Immunschutz durch Zellen) und schützende Substanzen im Serum (humorale Immunität). Impfungen haben viele früher tödl. Krankheiten reduzieren können; meist um 99-100%. Immunsystem beseitigt Antigene Immunsystem wird dann aktiviert, wenn fremde Substanz (jede chemische Verbindung) in den Körper eindringt; Organismus muss die Verbindung als fremd erkennen. Immunsystem muss diese Substanzen & vor allem schädliche Mikroorganismen beseitigen. - alle Substanzen, die im Organismus nicht natürlicherweise vorkommen sind Fremdantigene - körpereigene Substanzen, gegen die das Immunsystem fälschlicherweise reagiert sind Selbst(auto- )Antigene ( Autoimmunreaktion); IS ist nicht perfekt Diese Art von IS beginnt schon bei mögl. Einzellern bis zu den ersten Vielzellern. Permanenter Kampf zwischen Organismen in der Natur Immunsystem und Immunantwort Immunsystem kann ohne entsprechende Zellen nicht funktionieren: Generative Phase Immunzellen entstehen dann: Selektive Phase: Immunologische Toleranz wird etabliert (adaptives Immunsystem) die ersten Phasen laufen ab, egal ob ein Antigen vorhanden ist. Wenn Antigen eindringt: Proliferative Phase Anwesenheit von Antigen bewirkt Vermehrung von Immunzellen Differenzierung Effektorzellen (sorgen dafür, dass Antigen beseitigt wird) und Effektormechanismen entstehen bzw. werden aktiviert Effektorphase der Immunantwort Zellen und Molekulare Systeme sorgen für die Beseitigung des Antigens; danach muss IS in Homöostase eintreten: alles zurück gesetzt und für „neuen Einsatz“ wieder bereit. Immunsystem: - angeborenes (innate) Immunsystem Mechanismen, Zellen, sind permanent in uns - adaptives Immunsystem hat man nicht von Anfang an; muss sich erst entwickeln, dies geschieht als Teil der Onkogenese (=Entwicklung), abhängig und unabhängig von Antigen; es ist erst voll funktionsfähig nachdem Antigen eingedrungen ist (Antikörper, T- und B-Lymphozyten, und bei höher entwickelten Lebewesen: Lymphknoten) Höchste Stufe des entwickelten IS bei manchen Vögeln und bei Säugetieren, da dazu extra Organe gebildet werden müssen, um das ganze zu organisieren. Warum ist das „alte“ Immunsystem beibehalten worden, als sich das adaptive entwickelt hat? angeborenes Immunsystem schützt (fast) von Anfang an, das adaptive Immunsystem braucht einige Tage, bis es aktiv wird; wir wären schutzlos ohne dem angeborenen Immunsystem! – da vor allem Viren, aber auch MOs sich sehr schnell vermehren; angeborenes Immunsystem daher essentiell. Zweite wichtige Funktion des angeborenen Immunsystems: Es muss das adaptive Immunsystem erst in Gang setzen Ohne angeborene Immunantwort keine Reaktion vom adaptiven Immunsystem; angeborenes Immunsystem muss den MO aufbereiten und dem adaptiven präsentieren; erst dann kann adaptives Immunsystem reagieren. Angeborenes IS: - Epithelien (Haut, Schleimhaut) jede Wunde ist eine Zerstörung der Epithelien; viele MOs können Epithelien durchdringen - Phagozyten Fresszellen, fressen und töten Fremdkörper - Komplementsystem - Natürliche Killerzellen Adaptives IS: - B- und T-Lymphozyten B-Lymphozyten produzieren Antikörper, diese können an Antigene binden; T-Helfer-Zellen helfen den B-Lymphozyten bei Produktion von Antikörpern; cytotoxische TZellen erkennen sich intrazellulär vermehrende Organismen wie zB Viren. - Antikörper (produziert von Plasmazellen; das sind differenzierte B-Lymphozyten) - Effektor-T-Zellen Immunologisches Gedächtnis Ich werde einmal krank, beim 2. Mal bin ich geschützt Immunsystem verändert sich also zwischen der 1. und der 2. Infektion; Das IS lernt bei der 1. Infektion das Pathogen kennen und reagiert darauf mit Bildung eines immunologischen Gedächtnisses; das heißt beim nächsten Mal ist die Immunität schon vorher da Krankheit kann gar nicht erst ausbrechen. Eigenschaft des adaptiven Immunsystems! Angeborenes Immunsystem erkennt Pathogen und reagiert immer auf die gleiche Art und Weise, egal wie oft der MO eindringt. kein Gedächtnis. Angeborenes Immunsystem hat einen humoralen Komponenten: Körperflüssigkeiten Komplementsystem; bereitet außerdem Antigen auf und präsentiert es dem adaptiven Immunsystem Antigenpräsentation. Angeborenes Immunsystem erzeugt kein immunologisches Gedächtnis. Adaptives Immunsystem benötigt zwar einige Tage, bildet aber nach einer ersten Infektion ein immunologisches Gedächtnis aus. Wie erkennt das Immunsystem eigentlich Antigene? Woher weiß das Immunsystem, was fremd und was körpereigen ist? Welche Strukturen sind zur Erkennung verantwortlich? T- und B- Lymphozyten Antikörper können Antigen erkennen. Antikörper von B-Lymphozyten erzeugt, diese haben ebenfalls Rezeptoren, um Antigen zu erkennen. T-Lymphozyten haben T-Zell-Rezeptor; 2 Arten von T-Lymphozyten: - T-Helferzellen: T-Helferzellen helfen den B-Lymphozyten Antikörper zu machen. B-Lymphozyten brauchen Hilfe von den T-Helferzellen. - Cytotoxische T-Zellen: sind in der Lage, Zellen zu erkennen, die unfreiwillig zur Wirtszelle geworden sind mit MO infizierte Zellen werden erkannt; die infizierte Zelle wird zerstört und mit ihm der fremde Organismus (oder Organismus wird durch Zerstörung der Zelle freigesetzt und ist dann wieder angreifbar durch das Immunsystem). Wie wird Antigen erkannt? Wie wird Unterschied geschaffen zwischen fremd und selbst? 2 unterschiedliche Wege: angeborenes IS benutzt Patternrecognition (=Mustererkennung) Man muss Gemeinsamkeiten bei allen fremden MOs finden; da man sonst nicht genug Gene zum codieren von Antikörpern gegen ALLE MOs hat; was haben MOs also gemeinsam? Muster auf der Zelloberfläche; zB Lipopolysaccharid bei gramnegativen Bakterien; alle gramnegative Bakterien haben unterschiedliches LPS, haben aber ähnliche Struktur ignorieren der Details. Muster können auch aus dem Zellinneren stammen Mit einer begrenzten Anzahl an Rezeptoren kann man alle MOs abdecken. Mustererkennungsrezeptoren sind im Laufe der Evolution entstanden; Selektion sorgt dafür, dass keine Rezeptoren entstehen, die den Wirt angreifen daher Toleranz. Rezeptoren sind in allen Individuen einer Population gleich. adaptives Immunsystem sucht nach Details (Gegenteil vom Angeborenen!) Adaptives Immunsystem kann also unterschiedliche gramnegative Bakterien unterscheiden; macht für jeden MO eigene Antikörper Epitope (=antigene Determinante, ein kleiner Bereich auf einem Antigen, gegen den das Immunsystem Antikörper bildet, da keine Zelle ein ganzes Antigen binden kann. Ein einzelnes Antigen, wie z. B. ein Oberflächenprotein einer Zelle oder eines Bakteriums, trägt verschiedene räumliche Epitope. Gegen jedes dieser Epitope kann ein spezifischer Antikörper gebildet werden.) Besonderheit im adaptiven Immunsystem: Somatische Rekombination DNA kann so verändert werden, dass eine große Anzahl unterschiedlicher Antikörper hergestellt werden kann! Antigen-Rezeptoren müssen erst hergestellt werden; dies ist zufallsgesteuert. Wie wird also beim adaptiven Immunsystem die Toleranz hergestellt? Über Sortiermechanismen Antikörper, die sich gegen körpereigene Substanzen richten, werden aussortiert. Antigenpräsentierende Zellen (APC) nehmen Antigen auf und verarbeiten es; es erscheint dann auf der Oberfläche dieser APC als Komplex mit MHC-Proteinen. Der Antigen-Rezeptor der T-Lymphozyten erkennt diesen Komplex aus prozessierten Antigen und MHC-Proteinen. dies ist der Startschuss für adaptive Immunreaktion Die B-Lymphozyten brauchen Antigen nicht in prozessierter Form, brauchen aber die Hilfe durch die T-Helferzelle; wenn sie die Hilfe bekommen, vermehren sie sich und differenzieren anschließend Plasmazelle; dies ist das Stadium der Zelle, in dem sie Antikörper produziert. Nach einer Immunantwort bleiben die Gedächtnislymphozyten übrig. Das heißt, wenn man erneut infiziert wird, braucht das Immunsystem nicht mehr so lange, um wieder Antikörper zu produzieren, weil das Antigen schon bekannt ist; es geht also schneller und es werden auch mehr Antikörper produziert. Diese Gedächtniszellen sind also sehr wichtig, haben andere Eigenschaften als die anfänglichen „naiven“ Lymphozyten. Außerdem: Spezifität des Immunsystems; Antigenrezeptoren sind sehr spezifisch; dies führt dazu, dass das immunologische Gedächtnis sich nur auf einen MO bezieht; dh man bekommt nur eine schnellere und bessere Immunantwort bei schon bekannte Antigenen. Adaptive Immunantwort benötigt viele Zellen, das heißt man braucht sehr viele Exemplare von jeder spezifischen Zelle. Man käme somit auf eine gigantische Zellzahl, die für das IS notwendig wäre nicht möglich in Organismen. Wie löst man das Problem? Klonale Selektion: das Antigen selbst sorgt für die Vermehrung der Lymphozyten, die für seine Beseitigung notwendig sind. Zunächst nur wenige Antikörper vorhanden, wenn entsprechendes Antigen erkannt wird, werden mehr Antikörper produziert. Adaptives Immunsystem muss sich erst an jedes spezielle Antigen adaptieren. Nach jeder Immunreaktion, nach Beseitigung des Antigens wird das Immunsystem auf den „SollZustand“ zurück gebracht Contraction; das heißt, dass die vielen (überflüssigen) Antikörper verschwinden, nur Gedächtniszellen bleiben zurück. Aktive und passive Immunität - aktive Immunität: vorher erklärter Vorgang: Infektion Antwort Gedächtniszellen - passive Immunität: man entnimmt das, was den immunologischen Schutz ausmacht, und überträgt es auf einen anderen Organismus; man überträgt also Antikörper (=Immunserum); Schutz vor Infizierung des entsprechenden Antigens; da Immunschutz schon vorhanden durch passiven Transfer. Über solche Transferversuche konnte erst herausgefunden werden, wo der Immunschutz zu finden ist. Man hat auch durch passive Immunisierung Leute heilen können (zB Diphterie); man kann so etwas aber nicht zu oft machen, da das Serum ebenfalls körperfremd ist. Spielt heutzutage kaum noch eine Rolle, da Impfungen vorhanden sind. Spielt nur noch eine Rolle bei Fällen, wo Impfung nicht möglich (kein Impfstoff) oder schon zu spät z.B. Schlangengift Schlangenbiss wird mit passiver Immunisierung „geheilt“. Immunologie, 14. Oktober 2010 Innate Immunity (= angeborene Immunität) Barrieren: Intraepitheliale Lymphozyten: funktionieren eher wie Zellen des angeborenen Immunsystems, sie können konservierte Strukturen auf Mikroben erkennen und diese abtöten. Epithelien sind also nicht nur Barrieren sondern tragen auch aktiv zur Zerstörung von Mikroben bei. Epithelien sind wichtig, weil sie für Abwehr auf vor allem Schleimhäuten sorgen; sie können eine bestimmte Klasse von Antikörpern vom Inneren an die Oberfläche der Schleimhaut transportieren; zB Immunglobulin A; auf der dem Inneren des Organismus zugewandten Seite liegt ein Rezeptor, nimmt IgA auf, IgA wird durchtransportiert und auf der anderen Seite wieder freigesetzt. Circulating effector cells: Neutrophile, Macrophagen, Natural Killer Cells Zirkulierende Effektorproteine: Sind in Körperflüssigkeiten gelöst Komplementsystem Mannose-binding lectin (collectin), C-reactive Protein (Pentraxin) – sie binden an die Oberfläche von MOs und markieren sie, dies zeigt den Phagozyten, dass die Zelle gefressen werden sollte ( Opsonine, machen die MOs für die Phagozyten „schmackhaft“) Coagulation factors: (Blutgerinnung) schließen Wunden, dies ist auch Teil der Immunantwort Cytokine: schwer, genau zu definieren was ein Cytokin ist; haben viele Wirkungen, viele Zielzellen und werden von vielen verschiedenen Zellen hergestellt; sie regulieren in irgendeiner Form die Immunantwort; lösliche, freigesetzte Regulatoren der Immunantwort – Aktivierung, Regulierung, Deaktivierung etc. Erzeugung von Zellen des Immunsystems und des Bluts im Vorgang der Hämatopoese (Hämatopoese, ist sehr dynamisch und komplex, führt zur Bildung vieler neuer Blutzellen); Jede Gewebebildung fängt mit einer Stammzelle an. Pluripotente hämatopoetische Zelle: kann alle Zellen des Blutes hervorbringen Multipotente Stammzellen: können immer noch mehrere Zelltypen herstellen (aber nicht mehr alle). Stammzelle kann differenzieren in ein weiterführendes Stadium, oder sie kann sich selbst erneuern kann sich differenzieren und sich gleichzeitig selbst erhalten. Stammzelle differenziert sich: - Common myeloid progenitor: bringt Erythroid, Megakaryozyten, etc. hervor - Commom lymphoid progenitor: bringt B- und T-Lymphozyten hervor und Natural Killer Cells Monocyte = Blutform der Macrophagen Zelltypen bei Abwehr von Wurminfektionen oder Regulation allergischer Reaktionen: Eosinophile und Basophile Neutrophile: sind der dominierende Zelltyp; jeden Tag 7x10^10 produziert; sie sind sehr kurzlebig; ihre Bewegung, ihr Aufenthaltsort und ihr Aktivierungsstatus wird durch Chemokine reguliert; sie stehen an vorderster Front bei einer Immunantwort, sie sind das erste, was bei einer antimikrobiellen Abwehr aktiv wird. Entzündungen sind lokal, wie bekommt man die Zellen, die die Abwehr leisten sollen, zur Wunde/Infektion? Für die Steuerung der Bewegung von Zellen des Immunsystems sind die Chemokine (Unterklasse der Cytokine, der Name rührt von Chemotaxis her = Bewegung in Richtung einer höheren Konzentration einer bestimmten Substanz) verantwortlich. Granulozyten (=bestimmte weiße Blutkörperchen, 45% - 75% aller Leukozyten; sie können in Gewebe einwandern und dort Bakterien, Pilze und Parasiten abtöten, sie werden zu den Fresszellen gezählt) haben einen segmentierten, gelappten Zellkern; hat ein stark granuliertes Cytoplasma. Phagozyten: Monozyten und Makrophagen Monozyten sind im Blut, kann in Gewebe „einwandern“ und dort in Makrophagen umgewandelt werden. Sie sind komplexer als neutrophile Granulozyten (da diese zu kurzlebig sind; sie müssen erkennen wo Infektion ist und MOs abtöten können). Makrophagen können mehr: Sie greifen regulatorisch in die Immunantwort ein, indem sie jede Menge Botenstoffe (Cytokine) freisetzen. Jeder Makrophage hat 2 Zustände: Im immunologisch ruhenden Organismus: ruhende Makrophagen, er übernimmt physiologische Aufgaben; wird er mit mikroorganismischen Bestandteilen konfrontiert (zB LPS) Aktivierung; Aktivierung ebenfalls durch Botenstoffe: vor allem IFN-γ. Wir finden Makrophagen in jedem Organ, sie sind aber nicht funktionell gleich. Sie nehmen Aufgaben wahr, die im Sinne des Organs sind. In Mikroglia (Zellen des Zentralen Nervensystems); Kupffer Zellen (Lunge)... etc. Typisches Erscheinungsbild: großer, hufeisenförmiger Kern. Bei ausdifferenzierten Makrophagen ist der Kern kleiner im Verhältnis zum Cytoplasma. Je aktiver eine Zelle im Herstellen oder Abbauen ist, umso strukturierter ist sie. Dendritische Zellen: nicht ganz klar, wie sie in die Hämatopoiese einzuordnen sind und von welchen Zellen sie abstammen. Haben sehr viele Fortsätze an der Oberfläche, daher der Name. Sie vergrößern dadurch ihre Oberfläche, sie haben die Aufgabe ihre Umwelt nach potentiellen Antigenen abzusuchen (daher die große Oberfläche!). Sie sind die vermutlich wichtigsten antigenpräsentierenden Zellen. Antigenpräsentation Vorgang, durch den das angeborene Immunsystem das adaptive Immunsystem aktiviert. Man findet sie in den Schleimhäuten und vor allem in den Lymphknoten und allen lymphogenen Geweben (Milz z.B.). Natural Killer Cells: sind Zellen des angeborenen Immunsystems und gehören zu den Lymphozyten. Sie lysieren Zellen, die kein MHC1 exprimieren oder Antikörper an ihre Oberfläche gebunden haben. Sie spielen eine wichtige Rolle in der antiviralen und anti-Tumor Immunität (viele Tumoren verlieren die Fähigkeit zur Exprimierung von MHC keine T-Zellen greifen an, dafür die NKC). NKC sind permanent im Organismus, müssen nicht erst entstehen (im Vergleich zu toxischen TZellen). Cytotoxische T-Lymphozyten brauchen bestimmte Antigenpräsentation (MHC1-Protein). Wenn MO unterdrückt, dass MHC produziert wird, fallen die zytotoxischen T-Zellen aus, und man könnte die MOs nicht aufhalten. Hier kommen die NKC ins Spiel; sie sind invers zu den zytotoxischen T-Zellen, sie lysieren nur infizierte Zellen die kein MHC1 exprimieren. Wie kann man eine Zelle erkennen, die etwas nicht hat? 2 Arten von Rezeptoren: NKZell-Rezeptor; kann jede Körperzelle erkennen. NKZelle hat einen Rezeptor, mit dessen Hilfe sie MHC Klasse 1 erkennt. Im Normalfall: normale Körperzelle wird durch 2 Rezeptoren erkannt. Beide Rezeptoren sind antagonistisch; NKZell-Rezeptor ist ein aktivierender Rezeptor ( Tötung). Bei einer normalen Körperzelle ist auch MHC1 vorhanden reprimmiert die Tötungsfunktion der NKC. Viral infizierte Zelle sorgt dafür, dass die Zelle kein MHC1 produzieren kann. Der aktivierende Rezeptor der NKZelle findet die Zelle, kein MHC keine Unterdrückung infizierte Zelle wird getötet. Viele Tumorzellen verlieren unter dem Druck des IS die MHC-Produktion. NKC können Interferon-γ produzieren überführt Makrophagen in aktive Form. Entzündung (Inflammation) Wie starte ich eigentlich eine angeborene Immunreaktion? Jede Immunreaktion beginnt mit dem Eindringen von Antigenen. Zunächst muss das Antigen erkannt werden ( Patternrecognition des angeborenen IS). Dann muss das Antigen beseitigt werden, vor allem wenn viele Mikroben auf einmal eindringen ist das nicht so simpel. Einleiten einer Entzündungsreaktion, dies sorgt dafür, dass das Immunsystem (hauptsächlich das angeborene IS) zum Ort der Infektion „gerufen“ wird. 1) Entzündung ist schmerzhaft (Schwellung – Blutgefäße müssen durchlässig werden; Rötung – wegen stärkerer Durchblutung, bzw. wird das Blut an dieser Zelle gestaut, da Gefäße an der Stelle der Entzündung weit gestellt werden; Wärme und Schmerz) Rekrutierung von Leukozyten zum Ort einer Infektion - Auslösen einer Entzündungsreaktion Fressen eines MOs sorgt dafür, dass ein Makrophage Botenstoffe (proinflammatorische Faktoren, fördern die Entzündung) freisetzt er will weitere Zellen herbeirufen, um Infektion schnell zu beseitigen. Zelladhäsionsmoleküle werden am Endothelium exprimiert, Blutleukozyten haften daran an. Außerdem werden Chemokine und Integrin Liganden hergestellt; Granulozyt bringt Selectin Ligand hervor, hat Integrin und kann mit Blutgefäßoberfläche interagieren. Interaktion zwischen aktiviertem Endothel und Neutrophilen. Der Neutrophile verändert sein Cytoskelett wird lang und dünn; dadurch ist er in der Lage, sich durch 2 Endothelzellen durchzuquetschen, er kann also ins infizierte Gewebe eindringen. 1) Adhäsionsmoleküle müssen für eine stabile Interaktion sorgen 2) Chemokine müssen für Änderung des Cytoskeletts sorgen 3) durch weitere Botenstoffe können an den Endothelzellen Spalten entstehen Auswandern ins Gewebe = Transmigration dieses Prinzip nicht nur bei Neutrophilen, auch bei Monozyten, T-Zellen... Entzündung = Normaler Teil der Immunreaktion Problem von schlecht regulierten Entzündungen: Arthritis (Entzündung der Gelenke), chronische Darmentzünding etwas, das irgendwann durch eine Mikrobe gestartet wurde, ist nicht mehr so zu regulieren, wie die Entzündung normalerweise gesteuert wird. Wie wird das Antigen erkannt? PAMPs und Pattern Recognition Receptors - Zellen des angeborenen Immunsystems exprimieren auf ihrer Oberfläche, in der Membran der Endosomen, oder im Cytoplasma eine Reihe von pattern recognition receptors mit Hilfe derer sie pathogen-associated molecular patterns (PAMPs) erkennen. PAMPs sind sehr oft Zellwandstrukturen, die Gruppen von Mikroorganismen charakterisieren (LPS, Peptidoglykan). Die erkannten Strukturen können aber auch vom Inneren der Zelle sein, zB eine RNA, DNA... Jeder Zelltyp der angeborenen Immunsystems hat ein identisches Set von Pattern Recognition Rezeptoren. Jedes Set kann unterschiedliche Antigene erkennen (Verteilung nicht klonal). Im Gegensatz: Jeder Lymphozytenklon kann nur ein einziges Epitop erkennen. Nur Zellen, die dem gleichen Zellklon zugehören, haben den gleichen Antigenrezeptor. Alle Rezeptoren müssen zwischen selbst und nicht selbst unterscheiden können! Bakterien hängen einen N-Formyl-Rest an das erste Methionin diese Struktur daher typisch für Bakterien. Warum läuft Mustererkennung nicht nur an der Oberfläche ab? Oberfläche der Eukaryotenzelle erkennt die Oberfläche der Bakterienzelle. Es gibt Toll-like Rezeptoren, die gar nicht an der Oberfläche erscheinen, sondern in der Membran von Organellen sitzen, die zu einem Endosom/Phagosom werden. Etwas wird aufgenommen und ins Endosom/Phagosom transportiert, pH-Wert wird gesenkt, Enzyme werden aktiv, Mikrobe soll im Endosom abgetötet werden, ohne Zelle zu beeinträchtigen. Moleküle aus dem Inneren der Mikrobe werden frei gesetzt. Erkennungsstrukturen eines Rezeptors ragen ins Endosom, sie erkennen RNA und DNA. DNA und RNA hat der Wirt auch, aber: Lokalisation macht den Unterschied. Wenn RNA und DNA in einem Phagosom auftauchen, müssen sie zwangsläufig von einer Mikrobe stammen, da körpereigene Zellen nicht ins Phagosom gelangen. Daher machen Nukleinsäure Rezeptoren im Phagosom Sinn. Nur an der Oberfläche oder im Endosom zu erkennen reicht oft nicht aus; viele Viren vermehren sich zB im Cytoplasma dort aber ebenfalls Mustererkennung durch RIG – sie können RNA erkennen, haben Helicaseaktivität, lösen Signaltransduktion aus, die der Zelle sagt, dass hier eine virale Infektion vorliegt. NLR: sind in der Lage bakterielle Strukturen im Cytoplasma zu erkennen, wie zB Peptidoglykan. IM Cytoplasma taucht aber auch körpereigene RNA auf: Problem mit RNA-Viren. Rezeptoren für RNA müssen virale RNA und körpereigene RNA unterscheiden können! RNAs von Wirtszellen sind „gecapped“ am 5’-Ende. Bevor Transkription richtig angelaufen ist, haben die RNAs schon eine CAP-Struktur. Die meisten RNA-Viren haben das nicht. RNA-Viren haben an ihrem 5’-Ende oft ein Triphosphat RNA ist nicht gleich RNA! Mustererkennung an der Oberfläche, im Endosom und im Cytoplasma. TLR = Signal transduzierende Rezeptoren Immunantwort gestartet Botenstoffe werden freigesetzt, Chemokine werden freigesetzt ( Entzündungsreaktion), Adhesionsmoleküle exprimiert, costimulatory molecules, antiviral cytokines. Phagozytose und intrazelluläre Zerstörung von Mikroben: Makrophagen (=gehören ebenfalls zu den weißen Blutkörperchen, Fresszellen, angeborenes Immunsystem) sollen Mikroben phagozytieren, d.h. „auffressen“. Bildung von anorganischen/organischen Radikalen (=chemisch sehr reaktiv) tragen auch zur Zerstörung der Mikrobe bei; zusammen mit Phagosom und Lysosom. Die Reaktion mit Radikalen sorgt für Veränderung der Aminosäuren. O2- Radikal von Phagozytenoxidase gebildet. Oxidase setzt NADPH um, und oxidiert es zu NADP+, das Elektron, das die Oxidase gewinnt, überträgt sie auf molekularen Sauerstoff und stellt so ein O2- Radikal her. Dieses reagiert weiter und kann verschiedene Substanzen (teilweise toxisch) bilden ROI: reactive organ intermediate. iNO-Synthase setzt Aminosäure Arginin um und verändert es in eine Aminosäure namens Citrallin, nimmt ihm eine Aminogruppe weg und macht daraus ein NO-Radikal. Effektorfunktionen von Macrophagen: Man braucht dafür zunächst einen aktivierten Macrophagen. Immunologie, 20. Oktober 2010 Komplementsystem = ein System zirkulierender Effektorproteine, es ist also nicht zellgebunden. Immunologische arbeit ist zellunabhängig; Zusammenspiel von Proteinen, die sich gegenseitig aktivieren, sie bilden einen Membrane Attack Complex, das osmotische Gleichgewicht des MOs wird zerstört. Wie wird Komplementsystem aktiviert? 3 Möglichkeiten, 2 davon sind unabhängig von einer adaptiven Immunantwort, die 3. kann erst agieren, wenn eine vorhergegangene adaptive Immunantwort passiert ist. 1) Alternative Pathway: Eine Komponente des Komplementsystems (C3), diese kann über den Einfluss von wässrigen Lösungen mit einer geringen Wahrscheinlichkeit spontan zerfallen und kann mit bakteriellen Zellwänden reagieren. Opsonisierung = Bindung von etwas an die Oberfläche einer Mikrobe; über Rezeptoren werden diese Mikroben von Phagozyten aufgenommen. Weitere Komponente werden gebildet: C5, C5b und C3 können dafür sorgen, dass MAC gebildet wird. C3a sind Selbstregulatoren der Entzündungsreaktion; 3 Aufgaben des Komplementsystem: - Lysierung von Mikroben - Opsonisierung - Regulation der Entzündungsantwort 2) Lectin Pathway: mit Hilfe von Mannose binding Lectin, diese kann Mannose an der Oberfläche von Mikroben erkennen Spaltung des Komplementsystems C3b gebildet, Rest weiter wie bei Weg 1. 3) Klassischer Weg: Beruht darauf, dass es Antikörper gibt, die an die Oberfläche von Mikroben binden können. Diese Antikörper können Komplementfixieren = eines der Komplementproteine binden; diese Bindung kann erst erfolgen, wenn Antikörper fix an Mikrobenoberfläche gebunden ist C3b wird abgespalten, C5b etc Weg wieder genau weiter. Unterschied der Wege ist nur, wie das C3b erzeugt wird. Dass C3b erzeugt wird, passiert auf jedem Weg und auch die weiteren Schritte sind gleich. Cells and Tissues of the (adaptive) Immune System Immunsystem ist in Säugetieren sehr gut organisiert. Wenn Immunsystem sofort dort reagieren kann, wo Probleme entstehen, ist das natürlich ein Vorteil. Man braucht also gute Organisation, um jedes Antigen sofort und effizient zu bekämpfen. Wie ist das Immunsystem organisiert und strukturiert? Warum ist es kein Zufall, dass das Immunsystem sofort gut reagieren kann? Hämatopoese läuft hauptsächlich in den Knochen ab (primäres generatives (lymphoides) Organ); man braucht auch noch ein 2. generatives Organ: im Thymus zB werden Zellen aus dem Knochenmark zu T-Zellen „erzogen“, Thymus unterstützt also das Knochenmark. Wichtig für Organisation sind die sekundären lymphoiden Organe: Lymphknoten und Milz; sie sind Aufenthaltsorte für Lymphozyten. Sie sind eine Konzentration des Immunsystems, mit allen für das Einleiten der Immunantwort wichtigen Komponenten. Das Immunsystem muss dort konzentriert werden, wo Eintrittspforten für Mikroben sind Häute, Schleimhäute. Wie ist der Ablauf einer Immunreaktion? Verletzung der Epithelien, Mikrobe die Epithelien durchdringen kann Mikrobe landet in einer Antigenpräsentierenden Zelle, die sich in (Schleim-)Häuten befindet, Mikrobe wird in sekundäres lymphoides Organ gebracht, dort wird Antigen präsentiert. Durch den Vorgang der Antigenpräsentation werden naive B- und T-Lymphozyten aktiviert und können wirksam werden. Reifung der B-Lymphozyten findet im Knochenmark statt, sie werden dann ins Blut entlassen, im Blut in alle wichtigen Orte (Milz, Lymphknoten...) transportiert. T-Lymphozyten müssen zur Reifung in den Thymus gebracht werden (entstehen im Knochenmark ( Hämatopoese)), Thymus nur bei jungen Leuten, Problem bei älteren Leuten. Thymus ist ans Lymphsystem angeschlossen. Es gibt eine Rezirkulation von Lymphozyten Sie können Lymphknoten verlassen und in einen anderen Knoten transportiert werden. Im Lymphknoten findet man alle Zellen (Helfer-, Cytotoxische-, Regulatorische-Lymphozyten, Natural Killer Cells... etc.) Antigenpräsentierende Zellen: Antigen wird aufgenommen, die Zelle gelangt in einen Lymphknoten, ein Lymphozyt wird stimuliert durch das Antigen Start der Immunantwort. Wichtig: Die Zellen dort hin zu bringen, wo die Infektion auch stattfindet. Im Zuge der Aktivierung von Lymphozyten finden Veränderungen in den Lymphozyten statt, die den Lymphozyten erlauben, die Lymphknoten zu verlassen und am Ort der Verwundung wirksam zu werden. Wanderungsverhalten der Lymphozyten geändert. Wie? an der Oberfläche der Zelle gibt es Strukturen, mit deren Hilfe die Zellen des IS in der Lage sind, ein Gewebe zu erkennen bzw. ein Gewebe von einem anderen zu unterscheiden. Jedes Gewebe exprimiert spezifische Zelloberflächenmoleküle. Zellen, die dieses Gewebe erkennen wollen exprimieren Oberflächenstrukturen, die diese Moleküle am Gewebe erkennen homing Rezeptoren. Gereifte und bereite Zellen müssen „umziehen“, nämlich an den Ort, wo die Infektion ist Die Oberflächenstrukturen (homing Rezeptoren) müssen verändert werden, da diese die Zellen am alten Gewebe halten! Altes Gewebe weg, neues Gewebe her. Verändertes Blutendothel sorgt dafür, dass infiziertes Gewebe erkannt wird. Chemokine sind dafür verantwortlich, dass Zellen des Immunsystems eine gerichtete Bewegung durchführen (zB an den Ort der Infektion oder zurück in den Lymphknoten). Interleukin2-Rezeptor ist der Wachstumsfaktor für Lymphozyten ( Vermehrung). Naive Lymphozyten haben viele Proteine, die erlauben, die Lymphknoten zu finden. Die Zelle ändert sich natürlich, wenn eine Infektion vorliegt ( siehe Tabelle!); Zellen, die gebraucht werden, müssen sich vermehren können, müssen aus den Lymphknoten gelangen können, können zirkulieren... etc. Wechsel von Chemokinen, Interleukinrezeptoren... Sorgen für die Veränderung des Aufenthaltsortes von Lymphozyten. Ruhende Zellen haben einen großen Kern und wenig Cytoplasma. Beim aktivierten Lymphozyten nimmt das Cytoplasma zu Umschaltung auf Effektorzelle, die viel Arbeit machen muss, daher braucht sie viel Proteinsynthese, ATP-Gewinnung etc. daher viel Cytoplasma. Architektur des Thymus Thymus ist stark strukturiert. Dunkel (Cortex = Rinde) und Hellfärbung (Medulla = Mark) unterscheidbar. Hassall’s corpuscle = dicht gepacktes Thymusepithel. Dieses ist essentiell, da es eine wichtige Rolle spielt bei der Differenzierung von T-Lymphozyten. Wanderungsverhalten von T-Lymphozyten Wandern in den Cortex ein, vollziehen Reifung, über den Cortex wieder aus dem Thymus hinaus. Lymphatisches System - Lymphgefäße, verbinden die einzelnen Lymphknoten - Lymphknoten, sind nicht wahllos über den Körper verteilt Thoraxgang: wichtig, weil er eine Verbindung zum Blutgefäßsystem schafft (können kommunizieren, dies ist wichtig für das Rezirkulieren der Lymphozyten) Gewebsdrainage (draining Lymph node): bezieht sich auf Antigene jede dieser Lymphknotenkonzentration ist verantwortlich für die Gewebsdrainage des Körperareals. Jedes Körperareal hat eine Konzentration an Lymphknoten, dies sorgt dafür, dass Antigen, das beim entsprechenden Areal eindringt auch in den nächsten Lymphknoten gelangt (Vgl.: Erkältung Lymphknoten im Hals sind geschwollen, da dort die Infektion statt findet.) Jedes Körperareal hat seine dafür verantwortlichen Lymphknoten. Daher kann sich das Immunsystem organisierten, das Zusammentreffen mit Antigen ist nicht zufällig. Lymphknoten sind klar strukturiert, wieder in Rinde (Cortex) und Mark (Medulla) eingeteilt. In Follikelbereichen findet man ausschließlich B-Lymphozyten; in den paracortikalen Bereichen: TLymphozyten. Eferente (wegbringen) und aferente (hinbringen) Gefäße. Lymphozyten betreten Lymphknoten über Blutgefäßsysteme. High endothelal venule: Endothel wird von den Eintretenden T-Lymphozyten erkannt, Lymphozyten können sich zwischen den Endothelzellen in die Zelle durch bewegen. (müssen die Endothelzellen mittels Homingrezeptoren erkennen können.) B-Zelle weiß, wo sie hingehört, wenn spezielle Chemokine, für die sie einen Rezeptor hat, ausgeschüttet werden. Immunfluoreszenz: Antikörper, die mit Oberfläche von B- oder T-Lymphozyten interagieren können, auf diesen Antikörpern sind Farbstoffe, welche man anregen kann fluoreszieren in unterschiedlichen Farben. Milz ebenfalls strukturell untergliedert, ähnlich den Lymphknoten. Milz ist aber nicht ausschließlich sekundäres lymphoides Organ, sondern auch ein Speicherorgan; sie speichert und baut Erythrozyten (rote Blutkörperchen) um. Wichtig ist die weiße Pulpa (hier die weißen Blutkörperchen). In der Randzone sind hauptsächlich Makrophagen, wichtig für das Eindringen von Antigenen. Das Immunsystem der Haut Vorbereitung des Immunsystems - obere Struktur = Epidermis, besteht aus Epithelzellen Keratinozyten, in die Schicht der Keratinozyten gibt es bereit antigenpräsentierende Zellen (=dendritische Zellen; Langerhanszellen), sie bilden ein Netzwerk in der Epidermis. Außerdem gibt es in der Haut intraepidermale Lymphozyten: diese haben zwar Antigenrezeptoren und sind Komponenten des adaptiven Immunsystems, aber die Auswahl der Zellen mit bestimmten Antigenrezeptoren in der Haut sind vorsortiert auf Reaktivität mit häufig auftretenden mikrobiellen Komponenten. Außerdem stark ausgeprägte Komponenten in der Dermis: Makrophagen. Falls ein MO schafft, in die Dermis einzudringen, werden sie gleich erkannt ( Einleitung der Entzündungsreaktion) und gefressen. Außerdem wichtig, antigenpräsentierende Zellen zu haben, die das Antigen über lymphatische Gefäße zum regionalen Lymphknoten transportieren. Außerdem dermale dendritische Zellen. Auch in der Haut direkte mikrobielle Abwehr durch Defensine. Genau so gut Ausgeprägt ist das Immunsystem in den Schleimhäuten (zB Darmwand). Darmmucosa mit abschließendem Epithel, besteht aus einer Schicht, macht Oberflächenvergrößerung ( Mikrovilli, Vertiefungen und Ausstülpungen der Wand). Zusätzlich zu den gleichen Zellen, wie wir sie auch in der Haut finden gibt es eine Art sekundäres lymphoides Organ: Peyer’s Patch (klar strukturiert, mit Follikel etc.) Im Darm außerdem weitere spezialisierte Zelltypen: Defensine, Schleimproduktion (wichtige Funktion des Schleims, Bakterien oder Mikroben, die sich im Darm befinden nicht an die Zellen gelangen zu lassen). Viele Bakterien im Darm mit denen wir in Symbiose leben; Immunsystem muss zwischen „körpereigenen“ Bakterien und fremden Bakterien unterscheiden können (zB mit Hilfe des Schleimschutzes). Wenn Mikroben im Darm dem Wirtsorganismus schaden wollen muss eine Immunreaktion ausgelöst werden, wie ist hier die Unterscheidung zwischen den bösartigen und den harmlosen? Im Idealfall hat man jedes wichtige Repertoire in jedem Lymphknoten Problem, dass man nicht so viele IS-Zellen haben kann. Lösung: man lässt das Repertoire patrouillieren. Wahrscheinlich, dass jeder Lymphozyt an jeder Stelle des Körpers mal vorhanden ist. Zirkulation also sehr wichtig! Damit das gesamte Repertoire im ganzen Körper zur Verfügung stehen kann. Wenn Lymphozyt aktiviert wird, verlässt er den Lymphknoten über das Blutgefäßsystem, erkennt infiziertes Gewebe und betritt es, wird dort als Effektorzelle aktiv. Immunologie, 21. Oktober 2010 Antibodies and Antigens Adaptives Immunsystem; Antikörper: Antigen erkennen können: Immunoglobulin (=Antikörper, kann jedes Antigen binden, egal wie die chem. Struktur ist), T-Cell Receptor, MHC Molecules (werden gebraucht beim Vorgang der Antigenpräsentation). Art und Weise wie das Antigen erkannt wird, ist unterschiedlich. Antigenrezeptor der B-Zellen kann das Antigen in der ursprünglichen Form erkennen, Antigen muss nicht verändert werden. T-Zell-Molekül kann kein Makromolekül sondern nur verarbeitete Proteine als Fragmente binden. TCR erkennt nicht Peptid alleine, sondern das Peptid, das von den MHCMolekülen gebunden ist; er erkennt das Peptid in Kombination mit dem MHC-Molekül. T-Zell-Rezeptor reagiert mit Proteinantigenen. Reifung von B-Lymphozyten: Löslicher, gebundener Antikörper (auf naiven, noch nicht aktivierten Lymphozyten; damit erkennt Lymphozyt das Antigen. Wenn Antikörper nicht mehr als Rezeptor gebraucht wird, wird er „abgespalten“ und zum freien Antikörper. Antikörper erkennen Antigene: Die Immunogenizität eines Antigens wird durch folgende Eigenschaften bestimmt: - Fremdheit Fremdantigen muss erkannt werden, Autoantigen sollte vermieden werden; dies sollte nicht erkannt werden Immunologische Toleranz. Je „fremder“ eine Substanz ist, desto einfacher ist sie durch das Immunsystem erkennbar. Je unterschiedlicher die Struktur zu den organismuseigenen Strukturen ist, umso leichter ist Antigen erkennbar (zB bakterielle Zellwände). - Komplexität Je komplexer eine Struktur ist, umso mehr unterschiedliche Antikörper können an die Struktur binden. Wenn sie gleich geformt ist, dann kann ein Antigen an verschiedene Stellen binden. - Stabilität Wie thermodynamisch sind Strukturen? Verändern sie sich? Wenn Antikörper nur gegen eine Struktur geht, ist er bald unbrauchbar, weil sich das Molekül (thermodynam.) ändern kann. Je stabiler ein Molekül ist, umso besser für die Antikörper. Antikörper ist ein perfekt symmetrisches Molekül. Symmetrie ergibt sich daraus, dass das Molekül ein Heterotetramer ist aus 4 Untereinheiten, 2 sind unterschiedlich; 2x die selbe Untereinheit: Die schwere Kette und die leichte Kette. Eine schwere Kette verbindet sich mit einer leichten Kette, Verbindung kovalent durch Disulfidbrücken, die schweren Ketten sind ebenfalls verbunden über Disulfidbrücken. Immunoglobuline Fold Typische Domäne für IG. Diese Domänen werden in 3 konstante und eine variable Domäne unterteilt 10 Antikörpermoleküle des selben Isotyps, die an 10 unterschiedliche Antigene binden können, vergleichen die konstanten Domänen (3 der schweren, 1 der leichten Kette) haben die selbe AS-Sequenz. Die Sequenz hängt nicht von der Spezifität des Antikörpers ab. Variable Domänen am Ende des Moleküls (eines in schwerer, eines in leichter Kette) haben unterschiedliche Aminosäuresequenzen, je nachdem welches Antigen erkannt werden soll. Variable Domäne und die unterschiedlichen AS-Sequenzen erklären, warum jeder Antikörper unterschiedliche Antigene erkennen kann. Die 2 Arme des Antikörpers sind 2 Antigenbindungsstellen (mit derselben Spezifität; jeweils eine schwere und eine leichte Kette) bivalent, kann 2 Antigene binden. Wenn ein Antikörper an ein Antigen bindet, reicht es nicht aus, das Antigen verschwinden zu lassen. Antigen muss eliminiert werden. Antigen muss aufgenommen und abgebaut werden können (hauptsächlich durch Phagozyten). Der nicht variable Teil der Antikörper hat FC-Regionen, Phagozyten haben FC-Rezeptoren, können dadurch ans Antikörpermolekül binden, Antikörper wird mitsamt Antigen abgebaut. Aktivierung des Komplementsystems durch den klassischen Weg. Weg beginnt dadurch, dass ein Antigen-Antikörper-Komplex eine Komponente des Komplementsystems binden kann. D.h. das Antigen muss eine Angriffsstelle für Komplementsystem haben, wenn Antikörper bereits gebunden hat. Antikörper hat Komplementbindingsites in der FC-Region. Es gibt unterschiedliche Isotypen von Immunglobulin (IgG, IgM...), es gibt membranständige und lösliche Antikörper. IgM hat 3 konstante Domänen in der FC-Region, IgG nur 2. Effektorfunktion des Antikörpers variieren mit der Beschaffenheit des FC-Teils. Papain und Pepsin sind Proteasen, sie spalten den oberen Teil des Antikörpers so ab, dass die beiden Ketten verbunden bleiben. Die Arme und der untere Teil (mit den konstanten Domänen) werden also getrennt. Fab (ab für Antigen-Binding) Fragment kann also noch Antigen binden. Fc Fragment ließ sich gut kristallisieren (daher das c). Pepsin trennt den oberen Teil als ganzes ab, es enthält noch Bindungsstellen. Das Fragment kann zwar Antigen noch binden, kann aber nicht an Phagozyten binden. Röntgenstrukturanalyse: Zwischen β-Faltblatt Strukturen hat man Loops, diese sind in der rechten Domäne ( Folie) ausgeprägter, die ausgeprägtere Schlaufenbildung sorgt für die Antigenbindung. Was variiert sind die Schlaufen zwischen der β-Faltblatt Grundstruktur. y-Achse enthält Variabilität der einzelnen Positionen, x-Achse die einzelnen Positionen. An 3 Regionen tritt hohe Variabilität auf sind exakt die Loops (CDR1, CDR2, CDR3); Sequenz der Schlaufen also sehr variabel; CDR1-3 sind also Antigenbindungsstellen. Wie viele CDRs und welche CDRs Antigen binden ist sehr variabel. CDR = complementary dedeterminate regions Die Gelenkregion (hinge) der Immunglobuline erlaubt Adaption an die Distanz zwischen Epitopen. Beide Antigenrezeptoren sollten auch an Antigen binden können, Abstand zwischen den Epitopen kann aber variieren, Bindungsstellen des Antikörpermoleküls muss sich aber anpassen können. Daher hat Antikörper ein Strukturmotiv: das Gelenk (flexible Aminosäureschlaufe, sind flexibel weil die AS keine feste sekundär/tertiär Struktur bilden muss). 5 unterschiedliche Untertypen: IgA (kann Dimer bilden), IgD, IgE, IgG, IgM (kann penta-/hexamer bilden); J-Kette sorgt für multimerisierung. Die häufigsten sind die IgG Isotypen (Serumkonzentration von 13,5 mg/ml) in 6 L Blut also 7g IgG. Die schweren Ketten sind je nach Isotyp unterschiedlich; Isotyp wird also durch die Struktur der konstanten Domänen der schweren Kette bestimmt. 1) IgE ist derjenige Isotyp, der in allergischen Reaktionen eine Rolle spielt. Wenn man viel IgE im Serum hat, ist die Wahrscheinlichkeit einer Allergie hoch. Außerdem dient es (sehr wahrscheinlich) zur Abwehr von helminthic Infections (= Wurmbefall). IgE löst Reaktion aus, dass Zellen aktiv werden, die Substanzen gegen den Helminthen (im Darm) frei setzen, außerdem sollen die Substanzen versuchen, den Helminthen durch entsprechende Mobilität des Darms los zu werden Antiparasiten-Abwehr. 2) IgA = der Isotyp, der durch Epithelien transportiert werden kann und zur Immunabwehr auf Schleimhäuten verwendet werden kann; Konzentration ist daher im Serum nicht sehr hoch, ist aber an der Körperoberfläche bzw. an der Oberfläche von Schleimhäuten aktiv. Immunglobuline sind sehr stabile Moleküle, IgG hat Halbwertszeit von 23 Tagen im Serum (sehr lang). Außerdem wichtig bei neonathaler Immunität (nach der Geburt) 3) IgD = Antigenrezeptor auf B-Zellen, aber keine Zeichen von löslicher Antikörperfunktion bekannt. Nur sehr wenig gelöst im Serum zu finden. 4) IgG hat die meisten Effektorfunktionen der Antikörper, kann auch in den fötalen Kreislauf gelangen und dort Immunabwehr betreiben. Im c-Terminus des Moleküls liegt der Grund, warum es löslich oder membranständig ist. Verschmelzung durch Golgi-Vesikel mit Membran kann Antikörper in Membran integriert werden (oder auch nicht). Kleiner Bereich des Makromoleküls, dass der Antikörper erkennt ist das Epitop (7-9 AS großes Strukturelement). Wie werden diese Strukturelemente gebildet? - Durch lineare abfolge von Aminosäuren, die auch in der Primärsequenz direkt hintereinander zu liegen kommen. Wenn das Protein denaturiert wird, bleibt das Epitop erkennbar. - Konformationsepitope: abfolge der AS nicht durch lineare Sequenz des Proteins bestimmt, sondern durch räumliche Auffaltung. Die AS liegen in der Primärsequenz also nicht nebeneinander, sondern kommen nur wegen der Auffaltung hintereinander zu liegen. Bei Denaturierung wird auch das Epitop zerstört kann nicht mehr mit Antigen reagieren. Westernblotting: Proteine werden durch Elektrophorese denaturiert, wenn man also Antikörper hat, die denaturierte Form eines Proteins nicht erkennen kann, sind sie nicht nützlich. Haptene sind kleine Moleküle, niedermolekulare Substanzen. Wenn Hapten in Versuchstier injiziert wird, entwickelt es keine Antikörper gegen das Hapten. Keine Immunreaktion kann ausgelöst werden. Warum? IS sollte doch alle körperfremden Strukturen erkennen können. Niedermolekulare Substanzen sollten eigentlich erkannt und gebunden werden. Warum nicht beim Hapten? damit BZellen Antikörper machen können, brauchen sie die Hilfe von T-Helferzellen. Diese müssen durch den Vorgang der Antigenpräsentation aktiviert werden. Die Präsentation geschieht in Verbindung mit MHC Diese binden aber ausschließlich Proteinstückchen. Daher sollte kleines Molekül nicht erkennbar sein, außer es ist ein Peptid. Manche sind aber dennoch erkennbar: Wenn man Hapten mit einem Makromolekül verbindet, kriegt man Antikörper gegen Makromolekül und Hapten. Nur Proteine von T-Zellen erkannt, daher muss kleines Molekül gegen das ich Antikörper will, an ein Trägerprotein gebunden werden. Immunsystem kann ganz feine chemische Unterschiede (zB zwischen meta-, ortho-, und paraStellung desselben Moleküls) erkennen. Warum bilden manche Immunglobuline Multimere und andere nicht? IgM ist ein einer Immunreaktion der erste entstehende Isotyp. Wenn ein Antigen zum ersten Mal in einen Organismus eintritt, werden nicht gleich alle Isotypen gemacht. Zunächst entsteht immer IgM, dann IgG und IgE oder IgA. IgM = miltimerisiert; im Laufe einer Immunreaktion ändert sich die Affinität für ein Antigen. Es entstehen in der frühen Immunantwort Antikörper mit niedriger Affinität, später nimmt die Affinität zu. - Affinität beschreibt die Interaktion 2er Moleküle miteinander, je größer die Neigung der beiden Moleküle ist, verbunden miteinander vorzuliegen, umso größer ist die Affinität; beschreibt aber immer nur Interaktion von einem Molekül mit einem anderen; dh je besser Affinität des Antikörpers, umso besser kann dieses eine Antigen gebunden werden. Niedrige Affinität wird ausgeglichen durch eine hohe Anzahl an Bindungsstellen. - Avidität bezeichnet, wie viele Bindungsstellen es gibt. Hohe Avidität: bei niederer Affinität Ausgleich durch hohe Anzahl von Bindungsstellen. Was heißt das für die Immunreaktion? Zuerst werden niederaffine Antikörper gemacht, daher müssen diese eine hohe Avidität haben. (Erhöhung der Bindungsstellen pro Molekül). Unterschiedliche Isotypen – Unterschiedliche Effektorfunktionen Immunglobuline gegen dasselbe Antigen verändern sich im Laufe einer Immunantwort: - Membranständiger Antikörper wird zum gelösten Antikörper - Affinität gegen das Antigen wird gesteigert ( Affinity maturation) - Isotype-Switching, im Laufe einer Immunantwort kann auch der Antikörper seinen Isotyp ändern Änderung der Effektorfunktion Antiserum: wie gewinnt man es? Antikörper sind im Blutplasma (= flüssiger Bestandteil des Blutes). Wie wird aus Plasma ein Serum? Blutzellen und Gerinnungssystem müssen „abgeschaltet“ werden. Der lösliche Bestandteil, den man vom Coagulum trennen kann Serum Im Plasma sind Immunglobuline drinnen, täglich 3g Ig abgebaut und neu aufgebaut, ohne dass Immunreaktion vorliegt. Monoklonare Antikörper: Bei einer Immunreaktion richtet sich diese Immunreaktion gegen einen Mikroorganismus. Dieser bringt nicht ein Epitop mit, sondern viele. Jeder Mikroorganismus bringt also nicht nur eine B-Zelle zur Aktivierung, sondern mehrere Immunreaktionen sind polyklonal; viele B-Zell-Klone werden angeregt, Antikörper zu produzieren. Wenn Serum entnommen wird polyklonales Serum Jeder Antikörper hat schwache, unbedeutende Reaktionen mit anderen Molekülen. Wenn man also einen Antikörper für ein bestimmtes Protein verwenden will, soll der Antikörper nicht mit anderen Proteinen reagieren stört den zuverlässigen Nachweis. Biotechnologisch ist es daher von Vorteil, wenn man eine Antikörperlösung hat, in dem die Antikörper nur ein einziges Antigen erkennt, da damit störende „Nebenreaktionen“ verhindert sind. Nur ein BZell-Klon, daher monoklonal. Problem: eine spezifische B-Zelle zu finden; selbst wenn man die gewünschte B-Zelle findet, teilt sie sich nicht unendlich lang. Wenn man monoklonale Antikörper will, braucht man also einen Weg, diese Klone zu isolieren und die Klone müssen quasi unsterblich werden. Unsterblichkeit dadurch, dass man sich die Milzzellen aus einem immunisierten Tier hernimmt. Man macht ein Zellgemisch und mischt die Milzzellen mit Myelomzellen (=Tumore einer Plasmazelle). Die Myelomzellen die man verwendet haben die Fähigkeit, eigene Antikörper herzustellen verloren. Sie können sich aber noch unendlich teilen. Man hat also eine Immortale B-Zelle, diese kann man Fusionieren mit dem Milzgemisch – mit Polyethylenglycol, diese Substanz sorgt dafür, dass die Zellen an der Oberfläche verkleben und die Membranen anschließend fusionieren. B-Zelle fusioniert mit Myelomzelle, man hat ein Fusionsprodukt (=Hybridomzelle), dieses ist unsterblich. Nur ein Teil der Hybridomzellen wird mit B-Zellen fusionieren, die nicht fusionierten muss man loswerden In vitro selection in HAT-Medium, HAT Medium inhibiert de-novo Pathway; nur über anderen Weg Nukleotidbausteine herstellbar. Die nicht fusionierten Myelomzellen sterben ab, weil sie den de novo Pathway verwenden; die fusionierten Zellen können überleben, da diese den anderen Pathway benutzen können. Verfahren zur Zellknlonierung: Zellgemisch wird verdünnt, dass man pro Gefäß nur eine Zelle hat. Wenn in einem Kulturgefäß Zellen wachsen, dann müssen sie von einem Fusionsprodukt abstammen monoklonal Macht nur den Antikörper, der von dem B-Zell-Anteil der Fusion mitgebracht wurde. Hybridomzellen sind unsterblich und machen eine beliebige Menge von den gewünschten Antikörpern. Immunologie, 27. Oktober 2010 The Major Histocompatibility Complex, Antigenprocessing and Presentation to T-Lymphocytes Die meisten MHC-Moleküle können auschließlich Proteinstückchen binden. Die meisten T-Zellen erkennen Proteine. T-Zell-Rezeptor kann gleichzeitig mit MHC-Molekül und darin gebundenen Proteinstücken interagieren kann MHCProtein ist selbst Teil der Erkennungsstruktur Wie kam es dazu, dass der Ort für MHC-Proteine entdeckt wurde? Durch Transplantationsversuche: Mäuse, durch Inzucht „reine Linien“ (=weitgehend genetisch identisch) gewonnen; mit ihnen wurden Transplantationsversuche gemacht, zB Haut transplantiert auf ein anderes Individuum der selben Inzuchtlinie. Seltsames Produkt: Transplantat wurde akzeptiert (normalerweise: Organe werden nur akzeptiert, wenn bestimmte Voraussetzung erfüllt sind; normalerweise wird Transplantat derselben Spezies abgestoßen). Haut A (einer anderen Linie) auf Maus B transplantiert: Transplantat wird abgestoßen. Unterschied zwischen Individuen muss also verloren gegangen sein. Man kann die Mäuse so lange kreuzen, bis man den Ort gefunden hat, der für die Transplantatabstoßung verantwortlich war. Kompatibilität (Verträglichkeit) von Geweben Haupt-Histo-Compatibilitäts-Ort Unterschiedliche Inzuchtslinien mit gleichem Antigen immunisiert: die eine Linie viele Antikörper produziert, die andere nur wenig genet. Komponente, die dafür sorgt, dass manche Individuen Antigen besser erkennen können als andere. Ort eingrenzen, der für unterschiedliche Qualität der Immunantwort verantwortlich war, dies ist ebenfalls der Histo-Compatibilitäts-Locus. MHC-Loci 2 wichtige Funktionen: Antigenerkennung und Transplantatserkennung MHC-Loci in Mensch und Maus: Auf Leukozyten gibt es Oberflächenproteine, die sich je nach Individuum unterscheiden (starke individuelle Unterschiede). Genort der bei dem Menschen für diese Unterschiede verantwortlich ist: die Proteine werden hier codiert, die beim Menschen so unterschiedlich sind. Klasse 1 und Klasse 2 Proteine: strukturelle Unterschiede, haben aber auch korrelat in funktionellen Unterschieden. Beim Menschen: MHC Klasse 1 = HalA A, B, C Klasse 2 = DP, DQ, DR Bei Maus: MHC Klasse 1 = K, D, L; Klasse 2 = I-A, I-E, H-2M (I von Immuneresponse) Eigenschaften des MHC-Locus Entdeckung damit zu tun, dass Unterschiede beobachtet wurden (zw. Immunreaktionen und Immunzellen) zwischen Individuen. Genort muss also besondes sein und ihn erkennbar machen. MHC hochgradig genetischer Polymorphismus = „Vielgestaltig“; innerhalb einer Art nimmt man ein MHC Klasse 1 Gen, vergleich der DNA Sequenz zwischen vielen Individuen nie eine vollkommen identische Sequenz auffindbar. Es gibt eine vielzal von MHC Allelen. 3 MHC Klasse 1 Gene. Jedes dieser Gene durch den Polymorphismus betroffen, von jedem dieser Gene gibt es eine Vielzahl von Allelen. Säuger sind diploid, jeder trägt ein väterliches und ein mütterliches Set dieser Allele. Dh jeder hat 6 unterschiedl. Allele bzgl der MHC Klasse 1 Proteinen. fast ausgeschlossen, dass 2 Individuen der selben Population in jedem dieser 6 Allele identisch sind (erst bei langen Inzuchtlinien sind die Allele möglw. identisch zB Mäuse, Haplotyp definiert die bestimmte Allelkombination) Gibt es auch bei Eineiigen Geschwistern (diese haben identlische Allele). Transplantationen können nur unter bestimmten Voraussetzungen durchführbar: MHC-Allele sollten so gut wie möglich kompatibel sein. Wenn Spender und Empfänger komplett unterschiedliche Allele haen schlechte Kombination; Wenn Allele zumindest tw ähnlich , ist es eine bessere Kombination daher oft Familienmitglieder Transplantatspender weil Ähnlichkeit wahrscheinlicher. Warum ist MHC verantwortlich für Qualität der Immunantowort? MHC bindet Proteinstückchen, wird T-Zellen präsentiert T-Zelle = Effektorzelle, außerdem Hilfe für B-Zelle (Antikörperproduktion). Struktur MHC Moleküle: Klasse 1: bestehen aus einer schweren α-Kette (hellblau), und einer leichten Kette: β2-microglobulin Auffaltungsmotiv wie bei Antkörpern; 2 Helices α1 und α2, dazwischen eine Furche und einen Boden aus beta-Faltblattstrukturen; da hinein bindet klar definiertes (8-11 Residues) Antigenfragment. Klasse 2: beide Ketten des Moleküls sind gleich schwer, Antigenbindungsstelle durch beide Ketten ausgebildet. 2 α-Helices mit Furche in dem das Peptid eingelagert ist, am Boden wieder β-FaltblattStruktur. Peptid das eingelagert wird ist weniger eingeschränkt (kann größer sein, 10-30 Residues) Stringenz was gebunden werden kann ist wesentlich kleiner. Individuen einer Art im Vergleich: große Wahrscheinlichkeit, dass sie sich in mind. einer, ws in mehreren AS unterscheiden, dort wo Antigen bindet. Wenn Antigenbindungsstelle durch polymorphische AS gebildet wird: T-Zellrezeptor muss bestimmte Seitenketten des Peptids erkennen können. MHC-Molekül bindet nicht einfach jedes Peptidstückchen; abgesehen davon, dass die Länge stimmen muss, andere Kriterien müssen erfüllt sein: Ankerkriterien: Bindungsstellen sind so ausgelegt, dass an den meisten Positionen egal ist, welche AS vorhanden, an bestimmten Stellen müssen ganz bestimmte AS sein invariante Teile: Ankersequenzen. Ankeraminosäuren können polymorph sein Peptidfragment kann dann von einem MHC Allel gebunden, werden, von einem anderen nicht Bestimmung der Immunantwort durch MHC Moleküle. Von jedem Peptidfragment können nur wenige an MHC binden, nur kleine Fraktion der Peptide hat die richtigen Ankeraminosäuren. wenn wenig Stückchen gebildet werden, die binden können immundominante Peptide; kann dazu führen, dass nur wer das passende MHC Allel hat, eine Immunreaktion machen kann, wer kein passendes hat, kann keine Immunreaktion machen. MHC Allele bestimmen, welche Antigenfragmente gebunden werden können durch die durch die Ankerfragmente komplementären Aminosäuren. 3 Peptide, die nach oben stehen (P2, P5, P8) sind die, die den Kontakt zum T-Zell Rezeptor machen. Bsp für Allele: HLA-A2 (Zahl gibt an, welche Bezeichnung das Allel bekommen hat) Akeraminosäuren sind Positionen 2, 5 und 8/9, die müssen hydrophob, Leucin, Isoleucin, basisch (Arginin, Lysin), Prolin... also sehr unterschiedlich sein ( s. Tabelle) Polymorphismus sorgt also dafür, das sehr verschiedene Peptide gebunden werden können/müssen. Genetische Restriktion der Immunantwort Zellen aus 2 unterschiedl. Mauslinien (A und B), beides sind Inzuchtlinien (Individuen von A und B alle gleich; A aber anders als B). Virus der Meningitis (Gehirnhautentzündung) auslöst, Maus wird infiziert, nach 7 Tagen Milz entnommen und man braucht cytotoxische T-Lamphozyten (sind in der Lage, viral infizierte Zellen zu erkennen + abzutöten). Woran erkennt cytotoxische T-Zelle die infizierte Zelle? Im MHC Molekül steckt ein, dem Virus abstammendes Peptid Zelle wird lysiert. Viral infizierte Zellen in die Kulturschale geben, zytotoxische T-Zellen hinzugeben, aber die Zellen stammen einmal aus Stamm A (von dem auch die cyt.T-Zellen stammen) und einmal von B. cyt. T-Zellen und infizierte Zellen beide aus demselben Stamm, fremdes Peptid wird erkannt Zelle wird abgetötet. Kontrolle: Nicht infizierte Zelle und die cyt. T-Zellen keine Abtötung. Viral infizierte Zelle aus Stamm B und cyt. T-Zellen aus Stamm A keine Abtötung Wenn es genet. Unterschied in den MHC Molekülen gibt, zwischen Organismus aus dem T-Zelle und Organismus aus dem infizierte Zelle stammt, dann findet keine Abtötung statt genetische Inkopabilität Gentische Restriktion der Immunantwort Zielzelle und T-Zelle müssen aus genet. Identischen (oder demselben) Organismus stammen. T-Zell-Rezeptor erkennt fremdes Peptid UND Oberfläche des MHC-Moleküls, wo es polymorphe Aminosäuren, daher kann es passieren, dass der T-Zell Rezeptor wirklich nur die MHC Allele aus dem eigenen Organismus erkennt T-Zell-Rezeptor lernt, die MHC-Moleküle zu unterscheiden, und das an Hand der polymorphen Aminosäuren; daher Immunantwort geprägt MHC-Molekül ist auf antigenpräsentierender Zelle; T-Zellen erkennen nur prozessiertes Antigen; wenn Antigen präsentiert wird von antigenpräsentierender Zelle Immunantwort Es gibt unterschiedliche antigenpräsentierende Zellen: Jede körperzelle könnte viral Infiziert werden, dh jede Zelle muss auch virale Peptide (Antigen)präsentieren können. Antigen wird mit MHC-Molekül präsentiert jede Zelle sollte also MHCProteine codieren/expremmieren können. Aber unterschiedlich, welches MHC produziert wird, wann Antigen präsentiert wird und sie unterschieden sich von einer „professionellen“ antigenpräsentierenden Zelle. Adaptive Immunantwort beginnt nicht mit T-Zelle die bereits Effektorzelle (=sofort aktiv) ist. Naive T-Zelle noch keine klonale Expansion, wartet in sek. Lymphorgan auf Antigen. Antigenpräsentation der infizierten Zelle richtet sich an die Effektorzelle. Dh man braucht abgesehen von Zellen, die in der Lage sein müssen die intrazelluläre Infektion sichtbar zu machen auch Zellen, diesen ganzen Prozess einzuleiten, dh die das an die naiven T-Zellen weiterleiten können naive TZellen müssen zu Effektorzellen werden professionelle Antigenpräsentierende Zellen: - Dendritische Zelle - Makrophage - B-Lymphozyt diese 3 haben Kostimulatoren, diese werden gebraucht, damit dendritische Zelle eine naive T-Zelle aktivieren kann. Sie sorgen für ein 2tes Signal bei der Antigenpräsentation, bei Interaktion von T-Zell Rezeptor und MHC. B-Zellen nehmen sich T-Zellen, die bereits durch Dendritische Zellen aktiviert wurden, Interaktion zwischen B- und T-Zelle führt dazu, dass B-Zelle die benötigte Hilfe erfährt, die sie braucht, um Atikörper zu produzieren aktivierte B-Helferzelle Macrophage aktiviert Effektorzelle; diese tut 2 Dinge: sie setzt Cytokine frei, die Macrophage aktiviert, und sie kann Hilfe leisten an die T-Zellen. Alle Körperzellen können Antigen präsentieren, aber die Antigenpräsentation die dazu führt, dass Effektorzellen ihre Arbeit machen können bzw. Antikörper produziert werden professionelle antigenpräsentierende Zellen Kostimulatormoleküle: Machen den Unterschied zwischen antigenpräsetierenden Zellen aus. Vorallem wichtig bei dendritischen Zellen, da sie die naive T-Zellen aktivieren müssen. Kostimulator sendet 2. Signal an T-Zellen. Kostimulatoren sind auf den professionellen dendritischen Zellen nicht dauernd vorhanden, sie nehmen zu, wenn ein Stimulus kommt. Stimulus kommt meistens durch mikrobielles Signal. Patternrecognitionrezeptoren erkennen mikrobielle konservierte Strukturen (pamps). Bei dendritischen Zellen sorgen pamps dafür, dass Kostimulatoren hochreguliert werden. Dh duch Kontakt mit Mikrobe (Antigen) wird dendr. Zelle erst zur professionellen Zelle. Signal, das dendr. Zelle an T-Zelle gibt hängt also von Fremdantigen ab. Selbstantigen führt nicht dazu, dass dendr. Zellen ihre Kostimulatoren hochregulieren daher die Signale wichtig; Kostimulator gibt Signal, das Antigen tatsächlich von Mikrobe stammt. Wenn Antigen direkt in Blutkreislauf gelangt, wird die Milz es herausfiltern, Antigen gelangt in dendr. Zellen der Milz und wird dort präsentiert. Dendr. Zellen hauptsächlich in Haut und Schleimhäuten. Dendritische Zelle, die Antigen aufnimmt, bezeichnet man als unreife dendritische Zelle; da sie nur wenig MHC Klasse 2 Moleküle hat. Dendr. Zelle im Reifungsvorgang hochreguliert also MHC-Klasse 2 Moleküle. Sie braucht außerdem Kostimulatormoleküle, diese werden während der Reifung hochreguliert, weil die dendr. Zelle durch einen Patterrecognition-Rezeptor Antigen erkannt hat. Gleichzeitig zum Hochregulieren der Moleküle die gebraucht werden, werden die Moleküle die zur Aufnahme der Antigenen benötigt werden, runter reguliert, da nicht noch mehr Antigen aufgenommen werden soll. Warum gibt es eigentlich 2 unterschiedliche Klassen von MHC Molekülen? 2 Gruppen von T-Zellen: Helferzellen und cytotocische T-Zellen, sie unterscheiden sich durch Oberflächenprotein Co-Rezeptor; bei den Helferzellen CD4. Co-Rezeptor hat selbe Funktion: Kontakt zwischen Rezeptor und MHC zu stabilisieren. Unterschiedliche Co-Rezeptoren: CD4 und CD8. extrazelluläres Antigen antigenpräsentierender Zelle verabreicht einmal mit CD4 und einmal mit CD8 T-Zellen gemischt, wenn Antigen von außen aufgenommen werden, dann kann sie Antigen an Helferzelle präsentieren, aber nicht an cytotoxische T-Zelle. Plasmid, das zellinneres Antigen codiert wurde in Zelle eingebracht, dh die antigenpräsentierende Zelle stellt Antigen selbst her Nur cytotoxische T-Zellen-Antwort. Kontrollexperiment: extrazelluläres Antigen genommen, Membran der antigenpräsentiereden Zelle porös gemacht und Antigen eingefügt; jetzt verhält sich das Antigen, als hätte Zelle es selbst gemacht es wird präsentiert an cytotoxische T-Zellen. Mit welchem MHC-Molekül wird das jeweilige Antigen präsentiert? wenn Antigen von außen aufgenommen: mit MHC Klasse 2 wenn Antigen von Innen: mit MHC Klasse 1 präsentiert Peptid, das von der unterschiedl. Klasse präsentiert wird, unterscheidet sich auch. Antigen aus Zellinnerem und von Klasse 1 präsentiert: cytotox. Zellen angesprochen Antigen aus Äußerem und von Klasse 2 präsentiert: Helferzellen angesprochen Unterschied in welchem MHC Molekül das Peptid steckt. Klasse 1 cytotox. T-Zellen; Klasse 2 Helferzellen Klassen sind also dafür gut, die T-Zell-Helferfunktion separat von den cytotoxischen T-Zellen anzusprechen. Immunologie, 28. Oktober 2010 MHC = polymorph, viele verschiedene Allele, haben damit zu tun, wie MHC Antigene bindet und mit den T-Zell Rezeptoren interagieren. Daher kann die Immunantwort auf ein und dasselbe Antigen unterschiedlich sein. Antigen wird durch antigenpräsentierende Zellen dargestellt, es gibt unterschiedl. Arten der Antigenpräsentation. 2 Wege: Zelle signalisiert durch Präsentation, dass sie infiziert ist; durch professionelle antigenpräsentierende Zellen wird Immunantwort gestartet. Antigen wird je nach Quelle unterschiedl. präsentiert: Klasse 2 von extrazellulären, Klasse 1 von intrazellulären Proteinen. Klasse 2 Antigen wird durch Phagozytose (Endozytose) in die antigenpräsentierenden Zellen aufgenommen; Antigen langet in einem Vesikel (Endosom, Phagosom), das Vesikel verschmilzt mit dem Lysosom; Proteine werden prozessiert zerstückeltes Antigen entsteht. Es werden hier Peptide erzeugt, die durch MHC Klasse 2 präsentiert werden. Wie kommt das MHC Klasse 2 Molekül mit dem Antigenfragment im Lysosom zusammen? Normalerweise kein Recycling von Inhalten des Phagolysosoms. Vom e.R. (wo die MHC Klasse 2 Molekuüle erzeugt werden) werden die MHC Klasse 2 Proteine ins Golginetzwerk transportiert, sie verschmelzen zunächst mit dem Endolysosom. Darin sind die Proteinfragmente des Antigens, MHC wird beladen ( mit Proteinen von außen). Im e.R. gibt es ebenfalls Peptidfragmente, diese beladen aber MHC Klasse 1 Moleküle. Problem: Die Proteinfragmente für MHC 1 darf nicht die Bindungsstelle von den MHC 2 Molekülen belegen invariante Kette verstopft Antigenbindungsstellen. MHC 2 kann also nicht mit Peptiden aus dem e.R. beladen werden. Mechanismus um die invariante Kette wieder zu entfernen: Im Endolysosom (M2C) gibt es Proteasen, diese machen einen Schnitt: CLIP-Fragment; weiteres Protein, welches mit MHC Molekülen verwandt ist, es hat die Funktion, den Austausch von CLIP zu verursachen Bindungsstelle wird zugänglich gemacht, MHC 2 kann beladen werden, MHC 2 Kompartment kann Vesikel abschnüren die an die Zelloberfläche gelangen. Colocalization indem man unterschiedl. große Goldpartikel inseriert, MHC und Antigenfragment gemeinsam lokalisiert. in der Zelle gibt es postuliertes MHC-Partiment. Ist eine besonderheit der professionellen antigenpresentierenden Zellen, dass sie Vesikel vom e.R. mit einem Lysosom verschmelzen lassen können. Nicht jedes theoretisch mögliche Peptid wird aus einem Protein erzeugt. - Spezifität der Proteasen, die am Abbau beteiligt sind, spielen eine wichtige Rolle dabei, welche Peptidfragmente überhaupt präsentiert werden. nicht jedes beliebige Peptid wird gebunden sondern nur eine bestimmte Auswahl kann gebunden werden auf Grund der Ankeraminosäuren. - Spezifität der MHC-Moleküle für bestimmte Peptide Immundominanz bestimmter Epitope von alle möglichen Epitopen findet man eigentlich nur wenige. Bei Mutantenzellen nur wenige MHC-Moleküle an der Oberfläche. Defekt der Zelllinie ist keine Mutation in den MHC-Genen selbst, sondern Defekt in Transportern in der Membran im e.R. Daher Name des Transporters: Transporter Associated with Antigenpresentation (=TAP) TAP kann Proteinstückchen aus dem Cytoplasma ins e.R. zu transportieren. Dort können MHC Klasse 1 Moleküle durch solche Peptidstückchen beladen werden und an die Oberfläche gelangen. Transporter schleust Peptidstückchen aus dem Cytoplasma ins e.R.; wenn MHC Klasse 1 Proteine nicht mit Peptiden beladen werden, können sie zwar an die Zelloberfläche gelagen, sie sind aber instabil und werden schnell wieder abgebaut. TAP Mutanten wurden daher auffällig, weil sie sehr wenig MHC 1 expression an ihrer Oberfläche haben. Das was T-Zellen erkennen sollen, ist ein fremdes Peptid, dass mit den MHC – Klasse 1 Molekülen expremmiert wird. MHC 1 erscheinen also nur in einer stabilen Form, wenn die Zelle mit einem fremden Organismus infiziert ist ( für fremdes Peptid). MHC 1 Moleküle können aber nicht a priori fremd von eigen unterscheiden, sie binden alles, was die richtigen AnkerAS hat. in einer nicht infizierten Zelle stammt das Antigen von einem eigenen Zellbestandteil. Wenn die Zelle infiziert ist, wird in einem Teil der MHC Moleküle ein fremdes Peptid sein T-Zellen können das dann erkennen. MHC Moleküle präsentieren nicht nur Fremdpeptide, sie präsentieren alles, was sie binden können. Unterschied macht die T-Zelle: sie erkennt, ob etwas aus der Zelle selbst stammt, oder ob es fremd ist! Wenn man Mikrobe im Cytoplasma hat, funktioniert MHC 2 Präsentation nicht. Mikrobe macht sich breit, expremmiert eigene Gene es entstehen mikrobielle Proteine (zB Virusinfektion). Um Proteine abzubauen gibt es Ubiquitin, dies markiert die Proteine, die abgebaut werden sollen durch proteolyt. Maschine = Proteasom. Cytoplasmatische Proteine werden ubiquitiniert und dem Proteasom zugeführt. Dort werden sie zerschnitten und durch TAP können sie ins e.R. gelangen, dort verschmelzen sie mit MHC 1 und gelangen letztendlich an die Oberfläche, wo T-Zelle sie erkennen kann. Aber auch zelluläre Proteine können durch Ubiquitin und Proteasom abgebaut werden und so durch MHC 1 Präsentiert werden; T-Zelle erkennt aber den Unterschied. Proteasom und Immunproteasom - normales Proteasom, ist in Zellen permanent aktiv, zerteilt ubiquitinierte Proteine. Sie können Proteine erzeugen, die zur Beladung von MHC 1 dienen. Sie schneiden aber Proteine nicht immer in richtige Länge; man braucht daher weitere Untereinheiten zB LMP2 und LMP7. Es kann zu einem mehr als doppelt so großen Komplex umgebaut werden, durch hinzufügen weiterer Untereinheiten. - Immunproteasom: Proteine werden MHC Klasse 1 typisch geschnitten (bzgl. der Länge). Die Effizienz der Beladung von MHC 1 wird erhöht. Wann findet die Umwandlung des Proteasoms in Immunproteasom statt? Wenn Immunmodulationen einwirken zB Interferon γ. Koppelung von Prozessierung der Proteine und einer Immunantwort, die Koppler sind zB die Interferone. Ist u.a. wichtig, weil die Interferone auch gleichzeitig die Menge an MHC Klasse 1 erhöhen Sie stimulieren die Gene, die f. MHC 1 gebraucht werden Zelle ist wesentlich besser durch Einfluss der Immunmodulatoren. Extrazelluläres Antigen Beladung MHC 2, Stimulierung T-Helferzellen Cytoplasmatisches Antgen Beladung MHC 1, Stimulierung von cytotoxischen T-Zellen. Ist die Trennung der Klassen wirklich sinnvoll? MHC 1 beladen mit Fremdantigen = „Kill me!“ Signal. Daher ist es sinnvoll, dass man MHC 1 an die cytotoxischen T-Zellen koppelt. Kopplung der Helferzellen an das „kill me!“ Signal ist also nicht sehr sinnvoll. Problem: Eine T-Zelle muss zunächst zu einer Effektorzelle werden, bevor sie eine fremdantigenpräsentierende Zelle abtöten können. Wie werden sie zur Effektorzelle? Ihnen muss das Antigen von einer professionellen antigenpräsentierenden Zelle (mit Kofaktoren) präsentert werden man braucht dendritische Zellen. Die dendritische Zelle sitzt in Häuten, nimmt Pathogen von außen auf. Eig sollten sie daher nur MHC 2 Weg zur Präsentation nutzen können. Es wäre aber sinnvoll, den MHC Klasse 1 Weg zu benutzen, da das Antigen nicht cytoplasmatisch werden sollte (hierfür müsste sich dendr. Zelle infizieren lassen) Phänomen bei manchen dendr. Zellen: Kreuzpräsentation Präsentationswege kreuzen sich tatsächlich, Antigen von außen (MHC 2 Weg) werden statt über MHC 2 Kompartment an die Oberfläche zu gelangen, ins Cytoplasma gelangen Substrat für TAP, TAP bringt’s ins e.R. MHC 1 präsentiert das Antigen. MHC 1 Protein grundsätzlich ist mit Peptid beladen (außer Zelle ist mutiert); wenn man infizierte Zelle hat, bekommt man Peptide von eigenen und welche von fremden Proteinen, beides hat man an der Oberfläche durch MHC. T-Zelle muss die Oberfläche absuchen, wonach sie mit großer Affinität binden kann (meist die fremden Peptide). Wenn Selbstprotein im MHC ist, nur kurze Interaktion und T-Zelle „sucht weiter“. Folge der Differenzierung in Effektorzellen: CD4-Zelle kann 2 Effektorzellen bilden: Hilfe an B-Zelle (B-Zelle erkennt Antigen mit Antigenrezeptor, nimmt Antigen auf, prozessiert und präsentiert es. Antigen wird erkannt von aktivierter (nicht naiver!) T-Helfer-Zelle; sie schüttet Substanzen aus BZelle differenziert zur Plasmazelle/Memoryzelle... B-Zelle braucht also dringend die Hilfe der T-Zellen) oder sie aktiviert Macrophagen. Aktivierung von T-Zellen führt dazu, dass Lymphknoten verlassen werden kann. Effektorzellen finden das infizierte Gewebe. Immunantworten auf Lipid- und Glycolipidantigene Bestimmte T-Zellen sind in der Lage, auch Nicht-Protein Antigene zu erkennen: NKT Zellen erkennen Glycolipidantigene, wenn sie präsentiert werden (MHC können aber nur Proteine präsentieren). MHC ähnliches CD1-Protein. Dieses wird beladen mit extrazellulären Lipiden/Glycolipide durch endosomales Recycling. B-Zelle kann an und für sich alles erkennen, muss aber nicht auch gleichzeitig Antikörper geben. Das Präsentierte muss an ein Protein so gekoppelt sein, dass T-Zelle aktiviert werden kann. In jedem Antigen gibt es B- und T-Zell Epitope, diese beiden müssen nicht korrellieren. Wenn man etwas dran hängt, das nicht Protein ist, kann das B-Zelle auch erkennen. Polymorphismus bestimmt welche Peptide und wie fest diese gebunden werden. Interaktion von TZelle mit antigenpräsentierender Zelle – da T-Zelle nicht nur Peptid sondern auch MHC Protein erkennt; daher kann Antigen in einem Organismus nicht erkannt werden, das in einem andern Organismus schon erkannt wird. Erklärung Transplantatabstoßung: direkte und indirekte Transplantatabstoßung. - indirekte Transplantatabstoßung: Transplantat hat MHC-Allele, die für den Empfängerorganismus fremd sind (=allogeneitsche MHC, genetisch gleich aber unterschiedl. Art, MHC Molekül von einem Individuum der gleichen Art, aber Allel, das es im Empfänger nicht gibt). Wenn Zellen mit fremder MHC sterben, können sie abgebaut werden, von dendr. Zellen aufgenommen werden kann mit MHC präsentiert werden, T-Zellen erkennen es als fremd alloreaktive T-Zelle; sie reagiert auf Gewebe eines genetisch unterschiedl. Spenders der gleichen Art. Die antigenpräsentierende Zelle stammt vom Empfänger. - direkte Transplantatabstoßung: direkte allorecognition: Antigenpräsentierende Zelle stammt nicht vom Empfänger sondern vom Spender. Mit Transplantat sind antigenpräsentierende Zellen vom Spender in den Empfänger gelangt. In jedem Empfänger gibt es viele T-Zellen die den fremden MHC erkennen in Verbindung mit Peptid aus der Zelle, das als fremd erkannt wird, aber nicht unbedingt fremd sein muss Fremd MHC und selbst Peptid. Normalerweise: Im MHC aus dem eigenen Organismus steckt fremdes Peptid diese Kombination gibt eine ausreichend gute Interaktion um die T-Zelle zu aktivieren Allorecognition: Polymorphismus des fremden MHC mit eigenem Peptid, das drinnen steckt sieht aus wie eigener MHC mit fremdem Peptid für die T-Zelle daher Transplantat abgestoßen. Wenn im fremden MHC ein polymorphes Peptid steckt, dann kann die Kombination aus dem fremden MHC und dem Peptid für die T-Zelle aussehen, als ob es sich um selbst MHC und fremdes Peptid handelt. Vehemente Abstoßung eines Transplantats. Daher muss man Immunsuppression anwenden, damit keine Immunantwort auf Transplantat reagiert. T-Zell-Rezeptor Interaktion zwischen MHC-Peptid und T-Zell-Rezeptor löst wichtige Ereignisse in der T-Zelle aus. Rezeptor selbst ist nicht in der Lage, Signale transduzieren, er braucht Hilfsmittel. Hilfsproteine: CD3Komplex und Zetha-Kette. TCR + MHC Erkennung; CD3 + Zetha-Kompl. Weiterleitung des Signals CD3 kann aus 3 verschiedenen Ketten aufgebaut sein: epsilon und gamma, oder epsilon und delta Kette. die „braunen Kästchen“ (Folie) = ITAM, Immunoreceptor tyrosine-based activation motif bestehen aus typischen AS: Tyrosin, man kann es phosphorylieren (und tut dies auch im Zuge der TZell-Aktivierung). Phosphorylierte ITAMS dienen als Andockstelle Signalweiterleitung in der T-Zelle. TCR: ist eigentlich ein TCR-Komplex; dieser Proteinkomplex muss in bestimmter Stöchiometrie vorliegen es müssen definierte Stückzahlen jedes Bestandteiles vorliegen. Wie stellt Zelle das sicher? Stöchiometrie absichtlich zu stören lässt auf die Regulation schließen: Gen zur Herstellung der gamma-Kette fehlt Zelle hat nur ganz wenig/keine TCR, weil es einen Mechanismus gibt, der sicherstellt, dass der Komplex auch 100% richtig funktioniert und zusammengebaut ist. Durch Stabilität des Proteins wird die Funktionalität garantiert. Antigenpräsentation ist mehr als Interaktion zwischen MHC und TCR. Es braucht mehrere Kontakte; diese sind zwar notwendig, aber nicht ausreichend. Wenn man TCR wegnimmt, dann reichen die restlichen Kontakte nicht aus, um die Aktivierung zu starten. alle Komponenten notwendig, keine für sich hinreichend. Korezeptor: Sie definieren die Helfer- und cytotoxische T-Zell-Populationen. Warum müssen Korezeptoren unterschiedlich sein: CD4+ Zellen erhalten Antigen präsentiert über MHC Klasse 2 Weg, CD8+ erhalten Antigen präsentiert durch MHC 1. Korezeptor stabilisiert Interaktion mit MHC und er ist wichtig für die Initiation des Signals; dass es zur Phosphorylierung des ITAMs kommt, ist mit der Funktion der Korezeptoren verknüpft. Kostimulatormoleküle: B7-1 oder B7-2 interagieren mit CD28 CD28 gibt Signal an T-Zelle ab, welches zeigt, dass antigenpräsentierende Zelle Kostimulatormoleküle hat ist ok. Manche Interaktionen sind auch für Stabilität wichtig: Integrin LFA-1; Bei antigenpräs. Zelle: ICAM-1. Korezeptor sind wesentlicher Unterschied zwischen T-Zellen. Wenn Antigenpräsentation im infizierten Gewebe stattfindet bzw. wenn Präsentation der T-Zelle sagen soll, dass Zeit ist für Apoptose bestimmte Kostimulatormoleküle. In Immunologischer Synapse gibt es Moleküle, die Signale weiter leiten, welche die der Anhaftung dienen und welche, die Signaltransport in beide Richtungen leiten. Immunologie, 3. November 2010 Lymphocyte development and the rearrangement and expression of antigen receptor genes Zellen des adaptiven IS (Lymphozyten) haben immunologisches Reportiore; es werden viele unterschiedliche Antigene erkannt, die Möglichkeit sehr fein zwischen verwandten biochemischen Strukturen zu unterscheiden ist da. Wie kann man mit begrenzter Anzahl an Genen eine (fast) unbegrenzt große Zahl an unterschiedlichen Antikörpern erstellen? Hämatopoetische Stammzelle common lymphiod progenitor (entwickelt sich in einen gemeinsamen Vorläufer der B- und T-Zellen) Pro-T oder Pro-B Gesteuert wird dies durch Transkriptionsfaktoren (Notch-1 und GATA-3 Pro-T). Die Entwicklung passiert nicht auf einmal, es gibt verschiedene Entwicklungsschritte, diese sind nicht zufällig sondern erfüllen einen bestimmten Zweck. Prinzip der Differenzierungsstadien ist gleich bei den B- und T-Lymphozyten. 1. Stadium: Prolymphozyt, dieser expremmiert weder einen Antigenrezeptor noch Teile davon. Hier beginnen Prozesse, die dazu führen, dass zumindest eine Kette (schwere Kette beim B-Lymphozyten , beta-Kette beim T-Lymphozyten) des Antigenrezeptors gebidet wird Prelymphozytenstadium. Bildung der 2. Kette: wird erst nachher gebildet, nicht beide Ketten auf einmal. Immature Lymphozyte: Der Bildung der Rezeptoren liegen stochastische Gründe zugrunde: Was der Rezeptor bindet ist zufallsgesteuert und nicht von anfang an festgelegt (keine fremd-selbstUnterscheidung). Zwischen dem unreifen und den reifen Lymphozyten liegt ein wichtiger Selektionsprozess zentrale immunologische Toleranz alle Lymphozyten die Fremdkörper binden können dürfen bleiben, die, die Selbstantigen erkennen werden aussortiert. Effektorzelle Was kommt letzlich heraus: 3 B-Zell-Typen - Follikuläre B-Zelle („wohnt“ in den Follikeln, reagiert auf Antigen) - B1-B-Zellen (v.a. in der Bauchhöle, aber auch mit Schleimhäuten assoziiert) - Marginal Zone B-Zelle: randzone der Milz, hier gibt es bestimmten B-Zell-Typ, ist keine follikuläre BZelle, ähnelt in der Funktion eher den B1-B-Zellen. Pro-T-Lymphozyt alphabeta-T-Zelle gammadelta-T-Zelle Was muss gewährleistet sein im Zuge der Entwicklung, damit eine reife Zelle entsteht? Auf dem Weg der Pro- zum Prelymphozyten liegt das wichtige exprimmieren der 1. Kette; hier müssen aber komplexe molekulare Vorgänge ablaufen ohne Garantie auf Erfolg Absterben der Zelle ist möglich. Expression der 2. Kette: auch hier sehr komplexer Vorgang, der gut ablaufen muss, auch hier keine Garantie auf Erfolg, wenn dies schiefgeht, kann man die resultierende Zelle nicht brauchen. 2 Stellen, an denen Lymphozyten die Entwicklung ev. abbrechen müssen. Wie funktioniert das mit der Toleranz? - ich suche mir unter allen entstandenen Lymphozyten jene heraus, die auf fremdantigen reagieren würde voraussetzen, dass man an dieser Stelle schon jedes denkbare Antigen zur Verfügung hat. anstatt die positiv zu selektionieren, die auf Antigen reagieren, muss man die negativ selektionieren, die auf selbst reagieren Man präsentiert also Selbstantigen. ein unreifer Lymphozyt reagiert entweder überhaupt nicht mit dem Selbstantigen; dies ist eigentlich gut, aber: wenn Lymphozyt gar nicht mit irgendeinem Antigen reagiert, dann ist er wohl auch nicht zu gebrauchen wird eliminiert. es findet eine starke Interaktion mit Selbstantigen statt, dies ist die Situation die ich nicht will Abtöten des Lymphozyten durch Apoptose. Ideal: schwache Reaktion mit Selbstantigen; der Rezeptor funktioniert, aber die Reaktion auf Selbstantigen ist so schwach, dass der Lymphozyt nicht später durch Selbstantigen aktiviert werden kann. Zentrale immunologische Toleranz ist ein essentieller Teil der Entwicklung der B-Lymphozyten. Periphäre immunologische Toleranz: tritt erst auf, wenn B-Lymphozyten fertig entwickelt sind, falls die Zentrale immunologische Toleranz selbstantigenbindende B-lymphozyten übersehen hat, werden sie hier abgetötet. Genetische Loci für IG und TCR: 2 Dinge besonders auffällig: Gen für ein fertiges Immunglobulin ist fragmentiert. Jedes dieser Genstücke hat viele Kopien. VH1 kodiert für variablen Teil der schweren (heavy) Kette Was bedeutet diese Aufteilung des Gens? V-, D- und J-Stückchen werden nicht durch mRNA-Splicing aneinandergefügt, sondern durch somatischer Rekombination Zusammenfügen geschieht auf Ebene der DNA! Normalerweise gibt es in DNA keine Rekombination; nur Lymphozyten haben die Fähigkeit, die DNA am Lokus der Antigerezeptoren zu rekombinieren. ~100 V-Gene, ~30 D-Gene, ~5 J-Gene, hiermit kann man 10000 unterschiedliche schwere Ketten machen, allein dadurch, dass jede neue Zusammenstellung einen neuen Antigenrezeptor ergibt. Southern Blot: Man nimmt Lymphozyten her, isoliert dessen genomische DNA, man verdaut dies mit Restriktionsenzym, viele verschiedengroße Fragmente, dies trägt man auf Gel auf, trennt nach Größe auf, saugt die Flüßigkeit aus dem Gel und auf Membran drauf Abdruck der DNA-Fragmente. Wie groß ist zB Fragment, auf dem J-Fragment oben ist? Markierung, Puffer auf Membran, Fragment wird dort ein Hybrid bilden, wo sie ein komplementäres Stück ist, Autoradiogramm. Irgendwelche Körperzellen lassen den Genort in der Keimbahnkonfiguration, Lymphozyten verändern ihn er wird kleiner, es geht aber unterschiedlich viel verloren; das was zwischen den einzelnen Fragmenten liegt geht verloren wenn die gewünschten Bereiche zusammengefügt werden. Es treten außerdem neue Nukleotide auf, die nicht in der Keimbahn vorhanden waren N/PNukleotide. Reihenfolge, in der Rekombinationen statt finden: Zuerst findet Rekombination eines J- an ein DSegment statt DJ-Join, DNA dazwischen geht verloren; als nächster Schritt: VDJ-joining. Dies ist für variable Domäne. Was ist mit dem C-Teil? Der wird nicht durch somatische Rekombination angefügt, sondern tatsächlich durch mRNA-Splicing. VDJ-Segment wird an das gesplicede Segment herangebracht. Was ist der Sinn der N/P-Nukleotide? Antigenrezeptor besteht aus schwerer und leichter Kette; für die leichte Kette hat man nur D- und JSegmente nochmal etwa 1000 unterschiedliche Zusammenstellungen. Wenn man Rezeptor aus schweren und leichten Ketten zusammenstellt, hat man mehr unterschiedl. schwere Ketten 10.000.000 unterschiedl. Antigerezeptoren. Tatsächliche Anzahl der möglichen Antigenrezeptoren viel höher liegt im Milliardenbereich. Die Viefalt kann aber nicht nur aus den 10000 schweren und den 1000 leichten Ketten entstehen. Somatische Rekombination im Detail: Rekombinationssignale sind wichtig, sie bestehen aus 2 Sequenzen, einem Heptamer (7 Nukleotiden) und einem Nonamer (9 Nukleotiden). Diese Signale sind auf beiden Seiten jedes Gensegments (egal ob V, D oder J). Aber ein Unterschied: distanz zwischen Heptamer und Nonamer ist je nach Segment anders. 12-23-Regel: Nur solche können rekombinieren, bei denen der Abstand der Segmente unterschiedlich ist. Dh. J hat 23-basenpaar spacer, D hat 12-basenpaar spacer, nur die beiden können rekombinieren. Erst wenn D und J gebunden hat, kann man es an V binden. Wegen der 12-23-Regel führt immer dazu, dass man im reifen Rekombinationsprodukt D-, J- und VSegment hat. Der bereich der weggeschnitten werden muss kann entweder „ausgeschlauft“ werden, die DNA geht verloren. Dieser Mechanismus bei schwerer und lamda-leichte Kette. (leichte Kette aus lamda und kappa Teil) kappa-Lokus: nicht ausschlaufen sondern Inversion des dazwischen liegenden Bereichs, die DNA wird nicht hinausgeschnitten sondern umgedreht. Wenn Loci paaren unter Ausschlaufen Rekombinasen Rag1 und Rag2, diese findet man nur in den Entwicklungsstadien in denen die somatische Rekombination passiert in den Lymphozyten. Rekombinasen schneiden die DNA so, dass freie Enden vorliegen, das dazwischenliegende wird herausgeschnitten. Um die freien Enden der D- und J-Segmente zu schützen wird ein intramplekularer Hairpin gebildet; dieser wird nachfolgend wieder aufgeschnitten, Enden werden aneinander ligiert. Hierführ braucht man eine Reihe von Enzymen (Exonuklease etc.). Wie wird man den Hairpinn wieder los? In einem Strang wird geschnitten der Schnitt erfolgt nicht im ursprünglichen Hairpin und kann variieren. Dh plötzlich können oben oder unten mehr Nukleotide sein, da der Schnitt nicht exakt ist Nukleotide werden aufgefüllt mit P-Nukleotiden. Nach dem Auffüllen werden die Enden aber nicht gleich verbunden: Terminale Transferase (Enzym, gehört zu den template unabhängigen DNA-Polymerasen, dh sie kann Nukleotide anhängen, ohne ein Template zu haben) sie hängt beliebig viele N-Nukleotide an die Enden an. in dem Prozess der somatischen Rekombination hat man ein weiteres Element der „Zufallserzeugung“ eingebaut zufälliger Schnitt, zufällige Anzahl der P-Nukleotide außerdem zufälliges Anhängen der N-Nukleotide. Es wird beim Einfügen keine Rücksicht auf das Leseraster genommen man muss ein Vielfaches der Zahl 3 einfügen, damit es keinen vorzeitigen Kettenabbruch der Proteinsynthese geben kann. Verschiebung des Leserasters kann zu nicht funktionsfähigen Proteinen führen somatische Rekombination ist daher ein sehr verlustreicher Vorgang, die nicht funktionierenden Zellen müssen daher gleich eliminiert werden, da sie nur unnötiger Ballast sind. In jedem Fall ist die Antigenbindung unmittelbar durch das Produkt der somatischen Rekombination betroffen. Transkription: Enhancer am 3’-Ende des Locus; dieser wird an die Promotoren der V-Gene herangebracht, Enhancerwirkung bezieht sich immer auf den ihm am nächsten gelegenen Promotor. Somatischer Rekombination bringt den Promoter des V-Gens in den Wirkungsbereich des Enhancers. Es entsteht zunächst durch RNA-processing immer IGM-Isotyp, da zunächst der Cmy-Teil herangebracht wird an den Teil der schweren Kette. Naive reife B-Zellen machen 2 unterschiedl. Isotypen der Rezeptoren; durch alternative Polyadenylierungen (Ende des Transkripts in eukaryotischen Zellen durch Polyadenylierung definiert). Differenzierung: Enstehung der schweren und leichten Kette nicht simultan sondern nacheinander. zunächst die schwere Kette machen, die erfolgreichen Zellen mit schwerer Kette vermehrt man, diese können dann die leichten Ketten machen. An der Oberfläche der Pre-B-Zelle ist die schwere Kette mit einem Surrogat einer leichten Kette ausgestattet, dieses kompensiert die Tatsache, dass noch keine leichte Kette vorhanden ist Preantigenrezeptor, dieser dient nicht der Erkennung von Antigen, dient nur dazu, der Zelle zu signalisieren, dass die somatische Rekombination zur Herstellung der schweren Kette erfolgreich war. Signal sagt der Zelle, dass sie sich vermehren soll. B-Lymphozyten sind natürlich diploid, dh man hat nicht einen Locus sondern 2. Wichtig aber, dass jeder Lymphozyt nur eine Sorte Rezeptor an der Oberfläche hat es muss einen Vorgang geben, durch welche die (bei erfolgreich entstandener schwerer Kette), die weitere Rekombination des 2. Genorts abgebrochen wird, mit Hilfe des Prerezeptors. Allelische Exklusion: sie sorgt dafür, dass wir in einer B-Zelle nicht von jedem Allel unterschiedlich rekombinierte schwere und leichte Ketten bekommen. Antwort auf Antigen ändert sich während der Entwicklung: Die unreife B-Zelle, die vollständigen Rezeptor hat, sich aber noch in Entwicklung befindet, sieht das Selbstantigen bei zu starker Reaktion wird sie eliminiert. Etablierung der immunoligischen Toleranz. Erkennung von Fremdantigen führt zur Aktivierung und Vermehrung der B-Zelle und scnhließenden Differenzierung zu Plasmazelle, Antikörperbildung. Immunologische Toleranz bei B-Lymphozyten: Receptor editing: somatische Reproduktion erzeugt viel Ausschuss; die Anzahl der nicht brauchbaren Zellen sollte man aber minimieren; weitere Chancen für die B-Zelle: erst somat. Rekombination von kappa, dann s.R. von lamda-Allel, wenn auch dieses keine funktionsfähige Kette zustande bringt wird Lymphozyt eliminiert. Wenn Lymphozyt Selbstantigen erkennt und zu stark reagiert Eliminierung ABER: Receptor editing: heißt, dass man noch einmal versucht, den Genort für (meist) die kappaleichte Kette neu rekombiniert und noch einmal schaut, ob man etwas gescheites zustande bringt wenn auch das nicht hilft, endgültig Elimination. 3 Arten von B-Zellen: Knochenmark Reifung sekundäre lymphoide Organe Übergangsstadium, diese kann 2 unterschiedl. Typen von B-Zellen hervorbringen: - follikuläre B-Zelle -B-Zelle der Randzone (marginal zone B-Zell) B1-B-Zelle stammt ursprünglich aus fetaler Leber ab (primitive Hämatopoese beginnt schon im Dottersack und geht dann über in die fetale Leber) innate Lymphocates: B1-B-Zellen und marginal zone B-Zellen; vorallem B1-B-Zellen können ohne T-Zellhilfe Antikörper machen, diese nennt man natürliche Antikörper. Pendant zu diesen B1-B-Zellen: NKT-Zellen und gammadelta-T-Zellen; Interaktion mit häufig auftretenden Molekülen. Immunologie, 4. November 2010 Stadien der T-Zell-Reifung Gemeinsamkeiten zu der B-Zell-Reifung: Prinzipieller Ablauf der Reifung; Stammzelle Pro-T-Zelle Pre-T-Zelle Double positive: Besonderheit, doppelt positiv bezieht sich auf den Ko-Rezeptor, beide Ko-Rezeptoren werden gleichzeitig expremmiert single positive, diese muss selektioniert werden, wenn Antigenrezeptor vorhanden ist wird er ausprobiert: Erkennt er etwas, oder erkennt er Selbstantigen mit zu hoher Affinität? Naive, reife T-Zelle (wurde noch nicht durch ein Antigen aktiviert). Somatische Rekombination der TCR-Gensegmente: Ähnliche Gene wie bei den B-Zellen, aber nicht so ordentlich; ändert nichts daran, dass der Ablauf der somatischen Rekombination genau dem der Entwicklung der schweren Kette der B-Zellen entspricht. Doppel-Positiv-Stadium: Einwanderung der T-Zellen in den Thymus, dort vermehren sich die Vorläufer-T-Zellen. Sie expremmieren beta- und alpha- Kette, dann kommt es zu dem doppelt positiven Stadium, hier findet auch die Selektion statt. Warum stellen T-Zellen beide Ko-Rezeptoren her? Aufgabe der Ko-Rezeptoren: Stabilisierung der Interaktion zwischen MHC-Peptid und T-Zell-Rezeptor. Ko-Rezeptor interagiert mit dem MHC. Wenn eine T-Zelle entsteht, ist genau wie bei der B-Zelle, ist der Antigenrezeptor an der Oberfläche noch nicht definiert auf fremd oder selbst. Antigenrezeptoren entstehen nach zufallsprinzip, bei der T-Zelle können die Rezeptoren nicht unterschieden, ob sie MHC Klasse 1 oder Klasse 2 Peptid erkennen werden während Differenzierung noch nicht klar, ob Helfer- oder cytotoxische T-Zelle entstehen soll. Nachdem die MHC Klasse noch nicht festgelegt ist, muss die Zelle in dem Stadium beide KoRezeptoren zur verfügung haben doppel-positiv Stadium, hier erfolgt Selektion. Nachdem Selektion stattgefunden hat, wird der nicht gebrauchte Ko-Rezeptor hinunter reguliert. Wenn interaktion mit Klasse 1 erfolgt, dann wird der Klasse 2 Rezeptor hinunterreguliert. Durchflusscytometrie: Man will Zellen anhand ihrer Oberflächenproteine analysieren. Man kann sie hierfür mit Antigen beladen. Damit ein Antikörper messbar wird, muss er gekoppelt sein an fluoreszierenden Stoff FITC, es absorbiert eine Wellenlänge und gibt eine andere wieder ab dies kann man messen mit Hilfe des Durchflusscytometers. Messzelle durch die ein Flüssigkeitsstrom geleitet wird, durch diese Messzelle können keine 2 Zellen gleichzeitig durchlaufen, jede Zelle kann einzeln gemessen werden. An einer bestimmten Stelle hat man einen Laser, der die Zelle bestrahlt, diese wird wenn markiert abstrahlen. 2 mal markiert mit unterschiedlich fluoreszierenden Markern doppelt negative Zellen sind mit keinem Antikörper beladen, zeigen keine Fluoreszenz; es gibt Zellen die mit einem der beiden Markern beladen sind, und welche die mit beiden beladen sind. 80% Zellen, die sowohl CD4 als auch CD8 positiv sind doppel-positiv Stadium man braucht möglichst viele Zellen mit beiden Rezeptoren, weil auch viele aufgrund von fehlerhafter Funktion aussortiert werden. Antigenpräsentierende Zellen: In der Medulla des Thymus wo die Selektion stattfindet gibt es ein Epithel, diese Epithelzellen sind an der Antigenpräsentation beteiligt. Man erzeugt milliarden unterschiedl. T-Lymphozyten mit Antigenrezeptoren. Man muss herausfinden, welche davon mit zu hoher Affinität mit Selbstantigen reagieren Man muss ihnen also zunächst JEDES mögliche Peptid im Körper vorführen, um es auf Reaktion zu testen. Thymosepithel muss daher das gesamte Proteom aller Zellen umfassen. Das Thymusepithel kann das, weil es einen bestimmten Transktiptionsfaktor exprimmiert AIRE Wenn man AIRE ausknockt: Autoimmunreaktion, da die Selektion gegen Selbstantigene nicht erfolgreich stattfinden kann. Versuch: Fetal thymic organ culture: Thymus von fötalen Mäusen genommen, bringt er reife T-Zellen hervor? Ja. Man nimmt Thymus einer Maus, der TAP (belädt Klasse 1 MHC Moleküle) fehlt es können keine MHC-Peptid-Komplexe expremmiert werden, CD8 kann sich nicht entwickeln. Antigenpräsentation im Thymus funktioniert gleich wie bei zB dendritische Zellen; man braucht den Mechanismus, durch den Peptide ins Cytoplasma entstehen, ins e.R. gelagen und dann an der Oberfläche präsentiert werden. Nachweis der positiven und negativen Selektion von T-Lymphozyten in transgenen Mäusen: Problem: negativ Selektionierte Zellen gibt es nicht mehr, nachdem sie selektioniert wurden man muss also etwas finden, das es gar nicht mehr gibt. Bestimmte positiv selektierte Zellen außerdem schwer zu finden, da es zu viele verschiedene gibt. Lösung: Man braucht T-Zellen die mit bestimmten Antigen reagieren so oft, dass sie leicht zu finden sind in Keimbahn der Maus transgenen T-Zellrezeptor einbringen. Bei diesem T-Zell-Rezeptor weiß man, wogegen er reagiert. Peptid von nur in männlichen Mäusen expremmiertes H-Y-Peptid. Der T-Zell-Rezeptor reagiert also mit einem Peptid, dass es in weiblichen Mäusen nicht gibt und in männlichen Mäusen körpereigen ist. Wenn ein ferties Rezeptor-Transgen eingebracht wird, werden die eigenen Loci gar nicht somatisch Rekombiniert, da schon fertiger Rezeptor die weitere somatische Rekombination abschaltet. Alle CD8+ Zellen in diesen Mäusen haben denselben T-Zell-Rezeptor. Hat eine Maus in einer bestimmten Situation CD8+ Zellen? Antigen-Rezeptor und Antigen sind klar. Was passiert in männl. Mäusen? T-Zell-Rezeptor interagiert ja mit H-Y-Antigen. Sowohl positive als auch negative Selektion keine funkionierenden T-Zellen. In weibl. Mäusen: sie haben das richtige Allel, aber H-Y-Antigen ist kein Selbstantigen. Es wird also nicht während der Antigenpräsentation im Thymus präsentiert positve Selektion und keine negative Selektion. es gibt also funktionierende T-Zellen. In weiblicher Maus mit falschem H2-D-Allel: keine Selektion. Lymphocyte activation Was passiert mit den reifen, naiven T-Lymphozyten? Im Lymphknoten erfolgt Präsentation, Antigen-Rezeptor-MHC Interaktion sowie Ko-Stimulator Interaktion. Erfolgreiche Antigenpräsentation, T-Zelle (CD4+ Zelle) proliferiert und differenziert zur Effektorzelle, sie kann entweder im Lymphknoten bleiben als Helferzelle für die B-Lymphozyten. Effektor-T-Zelle kann aber auch über ein Blutgefäß oder Lymphgefäß den Lymphknoten verlassen und mit einem Makrophagen interagieren, damit die zelluläre Immunität verstärken. Interleukin-2 treibt Proloferation der Z-Zellen an, dh T-Zellen brauchen einen Rezeptor für Interleukin-2, erst dann kann klonale Vermehrung starten. Ko-Stimulatoren machen den Unterschied zw. professioneller und nicht-professioneller antigenpräsentierender Zelle. Wann werden Ko-Stimulatoren auf dendritischen Zellen expremmiert? Wenn die dendr. Zelle nicht nur Antigen aufnimmt, sondern auch noch mittels Pattern recognition erkennt, dass es von einer Mikrobe stammt. Info der Ko-Stimulatoren: Antigen verursacht tatsächlich Infektion. Wenn eine T-Zelle mit einem Antigen mit hoher Affinität interagiert, ohne, dass Ko-Stimulatoren Signal geben, dass es aus einer Mikrobe stammt keine Antwort (anergy) Periphäre Toleranz Lymphozyt der mit Antigen interagieren kann, die nicht aus einer Infektion stammt, darf dieser Lymphozyt keine Reaktion verursachen. Bei CD8+ Zellen: auch sie müssen von einer professionellen antigenpräsentierenden Zelle aktiviert werden, bevor sie auf infizierte Zellen losgehen können. Daher brauchen auch sie Ko-Stimulatoren; auch hier ist gewährleistet, dass es sich um ein Antigen aus einer Infektion handelt. CD8+ Zelle funktioniert manchmal nur dann, wenn auch gleichtzeitig eine CD4+ Zelle gebildet wird. Dh es gibt zwar, dass cytotoxische T-Zellen ohne Helferzellen entstehen können, meist entstehen sie aber nur, wenn auch Helferzellen gebildet werden. Warum? - Es kann sein, dass CD8+ Zelle Botenstoffe von der CD4+ Zelle braucht, um differenzieren zu können. - licensing durch CD4+ Zelle: In einem Lymphknoten 2 Möglichkeiten, wie antigenpräsentierende Zellen hinein gelangen. Antigenpräsentierende Zellen wandern erst ein von einem infizierten Organ Antigenpräsentierende Zellen sind schon im Lymphknoten, diese dendr. Zellen sind aber nicht reif Antigen gelangt unmittelbar in den Lymphknoten oder Licensing von anitgenpräsentierenden Zellen Information erfolgt, dass Antigen Fremdantigen ist, Signal kommt von einer schon aktivierten THelferzelle, diese interagiert mit dendr. Zelle. CD40 Ligand entsteht erst auf durch Fremdantigen aktivierten T-Zellen. Der Informationsgehalt in den Ko-Stimulatoren ist der, dass ein Antigen wirklich fremd ist und eine Reaktion ausgelöst werden soll; diese Information entweder über Pattern Recognition oder über Licensing. Signaltransduktion durch den T-Zell-Rezeptor-CD3-Komplex führt zur Aktivierung von Transkriptionsfaktoren. Streng zeitlich reguliertes Programm: - c-Fos - CD40 Ligand wichtig für Licensing und B-Zellhilfe - Interleukin2 - IL-2 Rezeptor - dann DNA Synthese, Zellen wachsen kontinuierlich - Differenzierung zur Effektorzelle, an der Oberfläche der T-Zelle werden die Proteine expremmiert, die man braucht, um Ort der Infektion aufzufinden. Aktivierung der T-Zellen endet irgenwann; Immunhomöostase wird wieder hergestellt mit Ausnahme der Gedächtnisszellen verschwinden alle Zellen wieder; man hat gleich viel Zellen nach der Reaktion als davor (außer Memoryzellen). Um Aktivierung abzuschalten CD28 in der T-Zelle durch anderes Membranprotein ersetzen: CTLA-4. Dies kann ebenfalls mit B7 interagieren, liefert aber ein inhibierendes und kein aktivierendes Signal. CTLA-4 entsteht also im späten Stadium der T-Zell Entwicklung. Aktivierung und antigenabhängige Differenzierung von B-Lymphozyten B-Lymphozyten erkennen Antigen so wie es ist. Information die in den Ko-Stimulatoren steckt, fehlt der B-Zelle zunächst. Aber diese Information bekommt die B-Zelle durch die T-Zelle, die das Antigen ebenfalls erkannt hat. T-Zelle liefert also die Information, ob ein Antigen unerwünscht ist und eine Reaktion stattfinden sollte Differenzierung der B-Lymphozyten: Mehrere unterschiedliche Dinge können passieren. 1) B-Zelle teilt sich und differenziert zur Plasmazelle, die Immunglobulin M produziert. 2) B-Zelle reift zur Plasmazelle, durchläuft aber vorher isotype switching, die macht nicht IgM, sondern IgG 3) B-Zelle reift zur Plasmazelle, aber sie durchläuft isotype switching und affinity maturation; Antikörper, die spät oder in einer sekundären Reaktion entstehen haben höhere Affinität. 4) aus der B-Zelle wird eine Gedächtnisszelle Gedächtnisszellen werden sowohl IgG produzieren als auch hochaffine Antikörper (isotype switching, affinity maturation absolviert); Gedächtnisszelle ist langlebig, sie wird nicht abgetötet in der Kontraktionsphase; wenn die in einer sekundären Immunantwort stimuliert wird, können alle Vorgänge schneller ablaufen. Immunologisches Gedächtnis. Nach der Immunantwort bleiben außerdem einige langlebige Plasmazellen übrig. Sekundäre Immunantwort efolgt schneller, stärker, es werden nurnoch IgG produziert (stärker affin). Im Lymphknoten, mitten in der Medulla findet Antigenpräsentation an Helferzelle statt. Die Helferzelle wandert richtung Follikel, dort sitzt die B-Zelle. Auch sie erkennt Antigen. B-Zelle wandert ebenfalls, und zwar an den Rand des Follikels bzw. ein bisschen in den T-Zell-Bereich. Hier hat man T-Zellen, die an ganz bestimmtes Antigen reagieren. Diese nehmen im Laufe der Immunantwort zu, außerdem verlagern T-Zellen ihren Schwerpunkt in Richtung Follikel; man hat also auch T-Zellen in den Randbereichen der Follikel. B-Zellen und T-Zellen bewegen sich aufeinander zu. Zur Hilfe an die B-Zelle durch die T-Zelle muss eine direkte physische Interaktion stattfinden. Eine T-Zelle sollte möglichst eine solche B-Zelle aktivieren, die das gleiche Antigen erkennt. Wie kann man sicherstellen, dass B- und T-Zelle das gleiche Antigen (nicht Epitop) erkennen? Eine B-Zelle erkennt mittels Antigenrezeptor ein mikrobielles Protein. Daraufhin wird sie das Antigen endocytieren und anschließend Präsentieren mit MHC Klasse 2. Das MHC Klasse 2 Peptid wird erkannt durch aktivierte T-Helferzelle. B-Zelle präsentiert nur das, was sie mithilfe ihres Antigenrezeptors erkennen kann, dh wenn die T-Zelle dies auch erkennt, kann es nur vom gleichen Antigen stammen! B-Zelle nimmt Antigen nur durch Antigenrezeptor auf; sie kann nur an T-Zelle präsentieren, was ihrem eigenen Antigenrezeptor entspricht. Sie müssen daher dasselbe Antigen erkennen, auch wenn es sich um unterschiedl. Epitope handelt. Haptene: kleine Moleküle, die keine Proteine sind. Wenn sie in Versuchstier injiziert werden, führen sie nicht zu Antikörperproduktion. Wenn man sie aber an Antigen koppelt führen sie sehr wohl zu Antikörperproduktion, Antikörper erkennen Hapten. Interaktion zwischen CD40 und CD40 Ligand ist ein essentieller Bestandteil der Hilfe der T-Zelle an die B-Zelle. CD40 sendet Signale an die B-Zelle; erfolgreiche Hilfe proliferieren und differenzieren. Aktivierte T-Zelle setzt Cytokine frei, die ebenfalls ihren Beitrag zur B-Zell Aktivierung und Differenzierung leisten. Immunologie, 10. November 2010 WH: Differenzierung vom Lymphozyten, wie stellen sie AG-Rezeptoren her, wie werden sie Selektioniert? Was passiert, nachdem sie reif sind? Aktivierung B-Zellen: sind angewiesen auf Hilfe von T-Zellen, was macht B-Zelle danach: Plasmazelle ändert den Isotyp und macht Affinitätsreifung durch Gedächtnis-B-Zelle Class-Switching bei aktivierten B-Zellen, nur wenn sie nicht zu IgM-produzierenden Plasmazellen werden. Findet statt, nachdem Hilfe der T-Zellen an B-Zellen erfolgt ist, sie wechselt den AntikörperIsotyp Antigenbindungsstelle wird beibehalten (nicht Spezifität für Antigen geändert!). Meist hin zu den IgG-Typen hinwechseln, kann aber auch IgA oder IgE werden – wer bestimmt, was passiert? Cytokine, die im Rahmen der T-Zellhilfe freigesetzt werden. CD40/CD40-Ligand sind wichtig, T-Helferzellen können unterschiedliche Cytikin-„Cocktails“ freisetzen, wenn es Interferon-gamma entält: IgE Wenn Interleukin-4 dominiert: IgG (sind neutralisierend), wenn es stark dominiert: IgE Immunität gegenüber Würmern Soforttypreaktion Wenn z.B. TGF-beta o.a. enthalten sind IgA, wird über Schleimhautepithelien transporiert LPS = Antigenersatz in Kulturschale, man gibt CD40-Ligand dazu (T-Zellhilfe simuliert) und ein Cytokin hinzugefügt (im Kontrollversuch kein Cytokin IgM entsteht). Große Mengen von Interleukin4 vorallem die IgG mit neutralisierender Wirkung (steuern Interaktion von Antigen mit Zellrezeptor); außerdem entsteht IgE Bei Interferon-gamma: hauptsächlich opsonisierende Ig Beim Experiment bleiben aber sehr viele nicht geswitchte IgM übrig. Molekularer Mechanismus der class switch reaktion: Alle B-Zellen machen zunächst IgM wegen der Lage von my-schwere Kette näher an VDJ liegen. Die dazwischenliegenden Bereiche werden ja auf Ebene der RNA herausgespliced. Segmente gehen verloren, anderes Gensegment wird VDJ benachbart (je nach Nachbar wird Isotyp diktiert) wie findet das statt? Man braucht einen Promotor (I-Bereich) und Switch-Regions (DNA-Sequenzen, die für das Switching essentiell sind.) Isotypeswitching zu IgG: Transkription des entsprechenden Bereichs aufgrund der Promotoren (I-gamma-Promotoren): Transkript bezeichnet als Germline-gamma Transkript Interaktion der Switchbereiche neben C-my und neben C-gamma, die dazwischenliegende DNA wird ausgestülpt und weggeschnitten (deletiert) übrig bleibt Hälfte von gamma und Hälfte von my, Gamma ist VDJ benachbart Zelle macht IgG Bedeutung der Cytokine beim Switching: sie sorgen für veränderte Transkripte Wichtig ist also die Aktivierung der I-Promotoren, welche ein Germline-Transkript machen, dieses Transkript diktiert, in welche Richtung das Switchen verläuft. Mechanismus des Sqitching sorgt dafür, dass das Class Switching nur in eine Richtung läuft; die bereiche die beim Switching verloren gehen, gehen unwiederbringlich verloren. Dh wenn zu IgG geswitcht ist, kann man nicht mehr zu IgM switchen, da dieser Bereich verloren ist. AID-Enzyme (activation induced cytidine deaminase) deaminieren Cytosin wird zu Uracil. Nach der Aktion von AID hat man einen DNA-Bereich, der Uracil enthält im Bereich des Germline-Transcript. Wozu führt das Vorhandensein von Uracil in der DNA? Missmatch-Repair, diese beginnt damit, dass ein Enzym (Uracil-N-Glycosidase) das Uracil wegschneidet Strangbruch Bereich wird neu anrepliziert Nur Zellen die das Switching machen, machen auch Affinitätsreifung durch. Was ist germinal center? Im Lymphknoten gibt es Follikel, dies ist die Heimat der B-Zellen. Während einer Immunreaktion kann es zu starker Vermehrung von B-Zellen kommen, dann bildet sich im Follikel ein sog. Keimzentrum (sogar lichtmikroskopisch unterscheidbar, da sehr hell; auch innerhalb des Keimzentrums [=germinal center] 2 Bereiche: helle und dunkle Zone entsprechen 2 unterschiedl. Phasen) In der Germinal Center Reaktion findet man B-Zellen die Isotypeswitching vorgenommen haben und nicht zu Plasmazellen differenziert sind. Diese „versuchen“ höheraffine Antikörper zu erzeugen. Damit sie dies können, müssen im Bereich der Antigenbindungsstellen Punktmutationen eingeführt werden, die zu AS-Austausch führen. Verändert aber nicht die Spezifität! Antikörper erkennt gleiches Epitop aber mit höherer Affinität. Teilung der B-Zellen damit verbunden, dass somatische Hypermutation (=in dem Bereich der variablen Regionen des Immunglobulinlocus steigt die Mutationsrate um 10^6; dh alle 1000 Basen wird ein Fehler gemacht dieser Fehler ist aber gewollt) stattfindet. Wozu kann die Mutation der variablen Gensegmente führen? kann zur Aminosäureaustausch führen, das zu höherer Affinität führt. Die Mutationen sind aber relativ zufällig. Der Antikörper weiß also nicht, welche Mutation sinnvoll ist probiert aus Antigen könnte nicht mehr erkannt werden bzw. anderes Antigen wird plötzlich erkannt (Gefährlich weil Selbstantigenerkennung möglich gemacht werden könnte!) Daher muss es auch hier einen Selektionsprozess geben: hierzu dient Zelltyp in den B-Zell-Follikeln: follikuläre dendritische Zellen (werden nach der Hypermutation eingesetzt). Wie? B-Zellen erkennen Antigen nicht prozessiert; dh dendritische Zelle macht keine MHC-vermittelte Antigenpräsentation. Das Antigen muss also im ursprünglichen Zustand präsentiert werden dendritische Zelle hat an ihrer Oberfläche FC-Rezeptoren. Damit kann man Antikörper-AntigenKomplexe bilden. Gebundenes Antigen ist außen. (Kann auch über Komplementrezeptoren vermittelt werden; C3b-Fragment). Dh dendritische Zelle nimmt Antikörper, die schon an Antigen gebunden haben, bindet dies und präsentiert das ganze der B-Zelle. Selektion danach, ob die hypermutierten Antigenrezeptoren eine ausreichend hohe Affinität aufweisen. Wenn B-Zellen gar nicht reagieren, sterben sie. Folie Somatische Hypermutation: Akkumulation... Affinität des Antikörpes (jede Linie ein Antikörper) zu Antigen, nimmt von der primären zur tertiären Immunreaktion um Faktor 100 zu. Mutationsrate ist im V-Bereich sehr hoch, nimmt danach wieder ab. Der Vorgang der Selektion nicht ganz verstanden; gibt verschiedene Modelle: Transkriptionsfaktoren binden nur an bestimmter Stelle, die können mit AID interagieren und können Locus so schlaufen, dass das AID-Enzym unmittelbar mit RNA-Polymerase interagiert und darauf geladen wird; sie nimmt das AID-Enzym mit und sorgt dafür, dass es Co-Transkriptionell im Bereich der V-Gene Mutationen einführt. Bei der Differenzierung von B-Zelle zur Plasmazelle findet ein Übergang statt, von membrangebundenen Antigenrezeptor zum freien Antigenrezeptor freier Antikörper. 6 verschiedene C-my-Exons, die alternativ gespliced werden können. Thymus-abhängige Antigene sind meist Proteine; die Thymus-unabhängige Antigene sind hochpolymere Antigene zB Polysaccharide. Epitop wiederholt sich immer. Selten-nie IsotypeSwitching; keine Affinitätsreifung, meist findet auch keine Bildung von Immunologischem Gedächtnis statt Innate Lymphocytes, sie funktionieren eher wie Zellen des angeborenen Immunsystems; sie sind vorgefertigt auf mikrobielle Strukturen, sie machen keine Reifung und kein Gedächtnis. Immuological Tolerace = unterscheidung zwischen fremd und selbst. Entwicklung der Lymphozyten ist eng damit gekoppelt, dass zentrale immuologische Toleranz etabliert wird. Wenn Lymphozten Antigenrezeptoren haben, werden sie erst einmal geprüft, ob sie auch richtig funktionieren (geringe Affinität zu Selbstantigen). Möglichkeiten, Toleranz zu erzeugen: Negative Selektion, Deletion Anergie, tritt ein, wenn T-Lymophozyten ohne Co-Stimulation aktiviert werden bei B-Zellen eine 2. Chance durch receptor editing durch Einführen von Punktmutationen; ist Teil der Einwicklung, kann nur im Laufe der Entwicklung statt finden T-cell-mediated suppression: eine Möglichkeit, autoreaktive Lymphozyten bei der Entfaltung ihrer Funktionen behindert durch Suppressor-T-Zellen Während der Entwicklung entsteht der T-Zell-Typ, der die B-Zellen unterdrücken kann: Regulatory oder Suppression T-Zellen. Was, wenn doch eine B-Zelle entlassen wird, die Selbstantigen erkennt? Dies ist nicht unwahrscheinlich, dass es passiert, da es nicht möglich ist, jedes Antigen während der Entwicklung zu präsentieren. periphäre Toleranz: findet in der immunologischen Periphärie statt, also nach der eigentlichen Entwicklung. Hierzu gehört die 1) Anergie, 2) klonale Deletion (Apoptose) und 3) aktive Suppression durch Suppressor-T-Lymphozyten, die entweder im Thymus oder in situ entstehen können. Regulatorische T-Zelle wird positiv selektioiert, wenn sie Selbstantigen erkennt. T-Zellen brauchen Wachstumsfaktor: Interleukin2 Wenn Interleukin2 abgeschalten wird, entwickelt sich Autoimmunität. Effektorzellen können also mit anderem Wachstumfaktor auskommen; aber regulatorische T-Zellen können nicht gebildet werden. T-Zell-Anergie: Welche Information steckt in den Co-Stimulatoren; warum sind sie so wichtig? Sie werden dann expremmiert, wenn die antigenpräsentierende Zelle ein Fremdantigen erkannt hat. In den Co-Stimulatoren steckt also die Information, dass es sehr wahrscheinlich mikrobielles Antigen ist. Wenn die Co-Stimulation fehlt, besteht die Gefahr, dass die dendritische Zelle kein mikrobielles Peptid präsentiert, sondern ein Peptid, das von einer körpereigenen Zelle stammt. T-Zelle wird anstatt aktiviert zu werden anergisch. Sie kann nur mit großer Mühe durch eigenes Antigen aktiviert werden. Impfungen: Bei Impfstoff mit attenuierten vollständigen Mikroorganismen gibt es kein Problem bei Impfung, da PAMPs vorhanden sind. Diese sind notwendig bei der Antigenpräsentation. Bei Viren ist dies problematischer, da diese oft keine PAMPs haben Proteinantigene haben den Nachteil, dass sie keine PAMPs beinhalten, man muss dem Impfstoff also Immunadjuvanzen hinzugeben, diese ersetzen den PAMPs. Diese können an Patternrecognition-Rezeptoren, sorgen für Co-Stimulation. Wenn man nur Protein impft werden die T-Zellen anergisch da das Co-Signal fehlt. Dh man muss nicht nur ein Antigen identifizieren um Impfstoff herzustellen, sondern man muss auch „passende“ Adjuvanzen verabreichen, damit man eine effiziente Immunantwort bekommt. Verschiedene Möglichkeiten zur Eliminierung von T-Zellen bei unzureichender Präsentation (ohne KoStimulatoren) Interaktion zwischen Fas und Fas-Ligand löst Apoptose aus Man kann auch B-Zellen anergisch machen, indem man ihnen T-Zellhilfe verwehrt. Dies führt dazu, dass B-Zellen nicht mehr in Follikel gelangen follicular exclusion; ohne T-Zellhilfe wird Antigen zwar erkannt, es tritt dennoch Apoptose ein. Nachweis der negativen Selektion autoreaktiver B-Lymphozyten: Über Mäuse mit Transgenem B-Zell-Rezeptor, der HEL erkennt. Fertiger Rezeptor in der Entwicklung führt dazu, dass die Loci nicht mehr aktiviert werden, Rezeptoren die alle die selben Antigene erkennen. Gekreuzt mit einer Maus, die HEL als Selbstantigen hat. HEL als Selbstantigen sollte also als Selbstantgen präsentiert werden, dies sollte dazu führen, dass B-Zellen mit hoher Affinität elimiert werden. Man erwartet also, keine B-Zellen zu bekommen. man bekommt B-Zellen, diese sind aber nicht mehr HEL-Spezifisch, da B-Zellen receptor editing betreiben können. Die B-Zellen sind anerg (durch periphäre Toleranz) oder sie haben einen editierten Rezeptor und somit die Spezifität verändert haben. Immunhomöostase: Man fängt mit wenigen, antigenerkennenden Zellen an und vermehrt diese dann enorm, sobald das Antigen beseitigt ist, möchte man die Zellen wieder loswerden. In der Phase der Kontraktion der Immunreaktion. Endzustand: Nur wenige verbliebene Gedächtnisszellen. Wie ist Funktion der Kontraktion, wann wird sie ausgelöst? Folie Lymphozyten müssen Antigen erkennen um aktiviert zu werden und sich zu vermehren. Wenn das Antigen fehlt, fehlt die Wachstumsstimulation. death by neglect, Zellen werden gemächlich absterben. aktive Tötung: Aufregulierung von Proteinen wie zB Bim, dies sind proapoptotisch, und sie inhibieren Aktivität von antiapoptotischen Faktoren. T-cell exhaustion: Wenn T-Zelle immer wieder stimuliert wird, verliert sie irgendwann „die Lust“ und stibt ab durch Apoptose (Problem bei persistierenden Infektionen.) Wichtig bei Kontraktion ist das Ausbleiben von Überlebens- und Wachstumssignal. Death by neglect und Hochregulation von proapoptotischen Faktoren. Auch bei B-Zellen gibt es nicht nur die Möglichkeit, sie abzutöten, durch Feedback-Mechanismus kann sie auch abgedreht werden Fc gamma R2B (ist ein niederaffiner FC-Rezeptor, er bindet Immunglubulin erst, wenn sehr viel davon vorhanden ist.) Folge der Bindung von Immunglobulin ist, dass der Rezeptor über das Aktivieren von Phosphatasen die B-Zell-Aktivierung verhindert. Immunologie, 11. November 2010 Wenn Vaccin von sich aus keine PAMPs enthält, braucht man Adjuvanzien. Es gibt auch noch viele andere Faktoren, bei denen man nicht genau versteht, warum sie so wichtig sind, sind aber dennoch wichtig z.B. Antigendosis: Bei hoher Dosis von Antigen bekommt man eine Tolerogene Antwort (=Immunsystem wird gegen das Antigen tolerant); Persistenz: Wenn man Lymphozyten im Zuge einer Immunreaktion zu oft stimuliert, werden sie anfällig für die Mechanismen der Immunkontraktion (=Zurückfahren des Immunsystems); Antigen sollte also nicht zu lange persistieren, da man sonst einen gegenteiligen Effekt bekommt. Wichtig auch, wo Antigen appliziert wird; das Antigen sollte an das adaptive Immunsystem herangeführt werden, dh in der Peripherie von antigenpräsentierenden Zellen aufgenommen werden, diese Zellen müssen reifen. Wenn das Antigen an der falschen Stelle injiziert wird, so dass es z.B. in generative Organe eindringen kann kann dort toleriert werden. Antigen muss also so injiziert werden, wie auch die Mikrobe selbst in den Körper eindringen würde. Oral aufgenommene Antigene bewirken auch eher Immuntoleranz, als dass sie eine Immunität hervorrufen. Bei Schluckimpfungen wird das Antigen nicht wie ein z.B. in der Nahrung aufgenommenes Antigen aufgenommen, sondern das Antigen kann mit dem Immunsystem hinter dem Epithel im Darm interagieren. Cytokine = Botenstoffe des Immunsystems. Wichtig sowohl für Kommunikation zwischen Lymphozyten als auch Kommunikation zwischen Immunsystem und nicht Immunsystem-Zellen und Organen (z.B. Entzündungsreaktion). Zellen des Immunsystems müssen zunächst erzeugt werden. Auch hier spielen Zytokine eine große Rolle. 2 Situationen: Cytokine während der normalen Hämatopoese, dies ist homöostatisch, dies hat nichts damit zu tun, dass das Immunsystem schon aktiv sein müsste. Man braucht dafür Cytokine, und außerdem braucht man sie, wenn verstärkt Zellen des Immunsystems gebildet werden sollen. Während einer Infektion kann der Output von Granulozyten nochmal erhöht werden. Es muss daher Kommunikation zwischen einer angehenden Immunreaktion (z.B. Entzündung) und der Blutbildung. Auch hier findet die Kommunikation über die Zytokine statt. Eigenschaft von Cytokinen: Sie regulieren die Proliferation und Differenzierung von Zellen des Immunsystems. Z.B. M-CSF Cytokin hat die Eigenschaft, dass es ausschließlich Differenzierung von Macrophagen beeinflusst, ist sehr spezifisch. Stammzellen müssen sich sowohl erneuern als auch differenzieren; je weiter man in der Hierarchie der Hämatopoese kommt, umso differenzierter u. spezifischer sind die Zellen. Wachstum und Differenzierung sind gekoppelte Prozesse. Cytokine, die die Differenzierung und Wachstum von hämatopoetischen Zellen steuern haben den Beinamen Hämatokine. Thrombopoietin, IL-11 sind spezifische Cstokine, sie sorgen für Differenzierung der Megakaryozyten, welche zu Blutplättchen werden. Erythopoietin steuert Entwicklung von Vorläuferzellen von Erythrozyten usw. ( Folie) Interleukin7 wichtig für B- und T-Lymphozyten, wie sowohl für Natural Killer Cells. Cytokine, die nicht nur bei der Blutbildung sondern auch an der Immunregulation verantwortlich sind; es gibt kein Cytokin, das nur eine Sache macht; alle Cytokine machen mehrere verschiedene Aufgaben. Dies liegt an 4 Eigenschaften: Pleiotropismus = Cytokine wirken auf viele Zellen und haben an jeder dieser Zelle mehr als nur eine biologische Wirkung. Redundaz = das eine kann für’s andere einspringen. Wenn ein Cytokin entfällt, können andre Cytokine diese Funktion (oder zumindest Teile davon) übernehmen. Gibt aber selten komplette Redundanz; sowohl Interleukin2 und 4 sind für B-Zellen zuständig. Synergie zwischen Zytokinen – einzelne Zytokine haben kleinen Effekt; aber wenn viele zusammenwirken haben sie einen sehr großen Effekt; größer als die Summe der Einzelnen. Antagonismus – Ein Zytokin kann die Wirkung eines anderen inhibieren, z.B. Interleukin10 kann die Aktivierung von Makrophagen inhibieren. Cytokine sind Polypeptide, diese können in der Regel nicht in die Zelle hinein; sie müssten über Oberflächenrezeptoren ihre Wirkung entfalten. Die Rezeptoren kann man in verschiedene Familien einteilen. Verschiedene Zytokinrezeptoren haben dieselbe Grundstruktur. Cytokinrezeptoren können aus mehr als einer Kette bestehen. Sie sind Multimere. Sind diese Multimere aus immer derselben Kette oder aus unterschiedlichen Ketten? Rezeptoren teilen sich Ketten. Gamma-C = Common gamma Chain, wird geteilt; die alpha-Kette macht den unterschied, ob ein Rezeptor lieber IL-15 oder IL-14 bindet Kein Cytokin ist ausschließlich Teil der adaptiven oder der angeborenen Immunantwort Dennoch grobe Einteilung in Zytokine der angeborenen und adaptiven Immunantwort: Angeboren: IL-12, TNF, IL-1 Interferon-gamma verstärkt angeborenes Immunsystem, wird aber produziert von Zellen des adaptiven Immunsystems. Adaptives Immunsystem: IL-2, IL-4 (class switching! wichtig beim Entwickeln von allergischen Reaktionen) Angeborene Zytokine: Sog. Tumor-Necrose-Faktor (TNF): = Cytokin, das Entzündungsreaktion einleitet. Ohne Entzündungsreaktion keine Möglichkeit, um Zellen des Immunsystems an den richtigen Ort zu bringen. Entzündungen können systemisch werden „Sepsis“ = Bakterien od. andere immunstimulatorische Produkte von Bakterien (z.B. Lipopolysaccharid) nicht mehr lokal entfernt werden kann sondern sich über den ganzen Blutkreislauf verteilt Man bekommt eine systemische Produktion von TNF. 1) Es wird eine gemäßigte Menge an TNF produziert, wirkt auf Gehirn, Leber und Knochenmark. Im Gehirn trägt TNF dazu bei, dass man Fieber bekommt. In Leber Akutphasereaktion; Jedes Organ kann sich an Immunantworten beteiligen; Leber kann viele Plasmaproteine produzieren die relevant sind z.B. Komplementproteine, lösliche Patternrecognitionrezeptoren, Preoteine, die der Infektion bzw. der systemischen Entzündung entgegenwirken sollen wie zum Beispiel Proteaseinhibitoren. Effekt auf’s Knochenmark: Mehr Leukozyten müssen produziert werden. Warum TNF? – es ist das erste Zytokin in der Kaskade von systemischen Entzündungsabläufen. TNF erzeugt aber nicht selbst alle Effekter, es steht nur am Anfang der Reaktion. Zu dieser Kaskade gehören auch IL-1 und IL-12; zeitlicher Verlauf der Erscheinung: Das eine geht dem anderen immer genau vorraus. Sepsis – gegen akute Sepsis gibt es nur sehr wenig, was man tun kann. Woran liegt das? Wenn zu viel von diesen proinflammatorischen Zytokinen vorhanden führt dies zum septischen Schock. Dies ist ein Multiorganversagen (u.a. Niere, Leber, Herz). Wesentlicher Grund für das Versagen: Blutgerinnungssystem wird aktiviert, viele Kapillaren werden verschlossen, die die Organe versorgen sollten, dies führt zum septischen Schock. Interleukin12 hat auf mehrere Unterschiedliche Zelltypen einwirken Interferon-gamma Produktion. NK-Zellen machen Interferon-gamma, sie brauchen keine aktivierten Lymphozyten (T-Helferzellen oder cytotoxische T-Zellen), wenn diese Lymhozyten vorhanden sind, kann Interleukin12 afür sorgen, dass auch diese Interferon-gamma herstellen. Viral infizierte Zellen stellen Substanzen her (=Interferone), die auf benachbarte Zellen einwirken können und in diesen Zellen einen antiviralen Zustand hervorrufen. Virus wird zum Beispiel in einem Endosom zerlegt, die RNA gelangt ins Cytoplasma, Patternrecognitionrezeptoren können dies erkennen. Im Endosom gibt es 2 verschiedene Toll-like Receptors, die ss oder dsRNA erkennen können. Im Cytoplasma gibt es Rezeptor, der RNA erkennen kann. IRFs sorgen dafür, dass Interferone produziert werden. Interferone werden freigesetzt und binden an die Interferonrezeptoren von benachbarten Zellen und dies löst Signale aus, sodass Gene exprimmiert werden, die einen antiviralen Zustand erzeugen. Interferone werden also gebildet, wenn wir viral infiziert sind. Die Interferone sind dafür verantwortlich, dass man sich bei einem Schnupfen krank fühlt Die Interferone, die gebildet werden, können systemische Wirkung haben. Typ2-Interferon = Interferon-gamma Epithelien sind die primären Ziele der Viren, daher haben diese zusätzliche Interferone. Wenn Viren den zustand der Latenz in Zellen erzeugt haben, sind auch Interferone wirkungslos. Chemokin kann an unterschiedlichen Rezeptoren binden; jeder Rezeptor kann unterschiedliche Chemokine binden Man kann daher nicht so leicht unterscheiden. Chemokinrezeptoren für HIV, CD4 auf T-Helferzellen als Rezeptor, aber CCR5 und CDCL12 als Korezeptoren. Zielzellen von Chemokinen sind oft Neutrophile. Die meisten Chemokine wirken aber auf viele unterschiedliche Zellen. Chemokine gehören eher zur angeborenen Immunantwort; das Wanderungsverhalten von B- und TZellen wird aber ebenfalls von Chemokinen gesteuert. IL-2 reguliert die Affinität seines eigenen Rezeptors: Ruhende Zelle, nur gamma und beta-Kette auf ruhender T-Zelle; dh zunächst nur niedrige Affinität für Interleukin2; Heraufregulieren der alpha-Kette ist frühe Antwort – viel höhere Affinität – Expansion von T-Zellen. Marker der Suppressor-T-Zelle die als CD25 bezeichnete alpha-Kette des Rezeptors. Dh die Zelle ist immer durch geringe Mengen an IL2 stimulierbar. IL-4: Class Switching, Beeinflussung von T-Zellen zu TH2-Zellen, Inhibierung der Entwicklung von TZellen zu TH1-Zellen. Interferon-gamma: Macrophagenaktivierung; class switching Beeinflusst zu IgG-Subtypen, die opsonisierend bzw komplementfixierend sind. Außerdem Funktion bei Differenzierung von THelferzellen, Antagonistisch zu IL-4; Wirkung auf antigenpräsentierende Zellen: Hochregulation von MHC2-Proteinen, kann also bei der Reifung mithelfen. IL13: IL4 sehr ähnlich, hat viele gleiche Effekte, zB mit allergischer Reaktion verbunden IL17: wichtig für Immunität gegen extrazelluläre Bakterien IL5: Differenzierungs- und Wuchsfaktor für Eosinophile TGF-beta: inhibiert Aktivierung von Makrophagen und T-Zellen Lymphotoxin: ist dem TGF verwandt, hat aber andere Funktion, ohne LT kann man keine sekundären Lymphorgane erzeugen. wichtig im angeborenen Immunsystem: Immunsuppressive Cytokine: * IL-10: inhibiert Aktivierung von Makrophagen * TGF-beta: inhibiert Aktivierung von Makrophagen und T-Zellen * IL-4: inhibiert Aktivierung von Makrophagen auf andere Art und Weise, es erzeugt einen Zustand im Makrophagen – Alternative Makrophagenaktivierung; der Interferon-gamma Aktivierung antagonistisch gesetzte Aktivierung, dieser Makrophage löst den Entzündungszustand *IL-37: systemische Inhibition der angeborenen Immunantwort – schlecht für’s bekämpfen von Infektionen, aber resistent gegen septischen Schock. Immunologie, 17. November 2010 Effector mechanisms of cell-mediated and humoral immunity Wie bekommt man überhaupt eine zellvermittelte Immunreaktion? Adaptive Immunität fängt im Lypmhknoten an, angeborene Immunität führt dazu, dass antigenpräsentierende Zelle hingewandert und gereift ist, ist jetzt in der Lage, T-Helferzelle zu aktivieren. Entzündungsreaktion beginnt dadurch, dass Makrophage Cytokin erkennt und Endothel aktiviert, dieses produiert Adhesionsproteine, diese erlauben das Binden von Leukozyten. Einleiten der Effektorfunktionen im Gewebe. Was sind Effektorfunktionen: - Makrophagenaktivierung - CD8+ - Effektorzellen Ein in Vesikeln eingeschlossenes Antigen (dh nicht im Cytoplasma) kann kreuz-präsentiert werden. Listerien replizieren wie Viren im Cytoplasma von Zellen. Cytotoxische T-Zellen sollen gegen infizierte Zellen aktiv sein; Listerien können aber auch durch Makrophagen aufgenommen werden. Listerien vermehren sich in Zellen, dh Antikörper sind wohl nicht sehr wirksam bei adoptiven Transfer von Immunserum nicht wirksam. Adoptiver Transfer von T-Zellen wirksam. T-Helferzellen (setzen Cytokine frei) wichtig als Effektorzellen. - TH1-Zellen - TH2-Zellen Differenzierung wird dadurch bestimmt, welche Faktoren die dendritische Zelle freisetzt. Was ist der Unterschied zwischen TH1 und TH2? Cytokinfreisetzung ist unterschiedlich bei den Subpopulationen. TH1 macht Interferon-γ, kein IL-4, IL-5, IL-13; TH2 macht es umgekehrt; beide machen ein bisschen IL-10, IL-3, GM-CSF. Interferon-γ ist daher Signaturcytokin der TH1-Zelle; IL-4 ist Signaturcytokin für TH2. Dh die Cytokinproduktion ist das wesentliche (experimentelle) Charakteristikum, um Subpopulationen zu unterscheiden. TH1 haben Rezeptor für IL-12 und IL-18; dies haben die TH2-Zellen nicht. Cytokinproduktion Interleukinrezeptoren Chemokinrezeptoren Hilfe an B-Zellen zu leisten ist Hauptaufgabe der T-Helferzellen, auch hier Unterschied: TH1-Zelle IgG2a Class Switching stimuliert TH2-Zelle IgE, IgG1/IgG4 Class Switching stimuliert TH2-Zelle hat mehr als TH1 die Funktion, das Class Switching im Lymphknoten zu beeinflussen. Durch TH2 alternative Makrophagenaktivierung Immunosuppression Cytokine regulieren Transkriptionsfaktoren Was macht eine antigenpräsentierende Zelle zusätzlich? Wenn sie IL-12 produziert und NK-Zellen aktiviert, entsteht Interferon-gamma, dies aktiviert Transkriptionsfaktor STAT1, dies aktiviert T-Bet TH1 Differenzierung; es wirkt auf Interferon-γGen Freisetzung von Interferon-γ. T-Bet inhibiert außerdem GATA3 (TH2-Zelle) sonst hätte man eine „Zwitter-Helferzelle“. Die Transkription, die eine Entwicklungslinie begünstigt, inhibieren die Expression der 2. Entwicklungslinie. Außerdem Stabilisation. Interferongamma wird produziert und Interferonγ-Rezeptor ausgebildet. Antigenpräsentierende Zellen setzen weitere Cytokine frei, die den Weg stabilisieren. TH17-Zelle (nicht 17 unterschiedliche Subpopulationen! nur so benannt nach Signaturcytokin): wie entstehen sie? Interleukin6 wichtig, regt STAT6 Transduktionsweg an STAT3 lineage determent factor RORγt (TGF-beta hilft ebenfalls); 3 lineage-determent factors: RORγt, T-Bet, GATA3 Kennzeichen der Typ1 Immunität Typ hat Auswirkung darauf, welche Effektorreaktionen in der Immunreaktion entstehen. Man braucht, je nach Pathogen, unterschiedliche Effektorreaktionen. Typ 1: Makrophagenaktivierung, Abtötung von Mikroben, Class Switching zu Antikörpern, die Komplementsystem aktivieren können und sie sind opsonisierend (binden an Mikrobe, mittels Rezeptor auf den Phagozyten kann Aufnahme durch Phagozyten verbessert werden). Effektorzelle sorgt für Zelloberflächeinteraktion durch das CD40-CD40Ligand-System. Signale die hierdurch kommen können Signale durch Patternrecognition ersetzen. Was hat aktivierter Makrophage? Verstärkt Antigenpräsentation, macht Sauerstoff- und Stickoxidradikale zum Abtöten, Reguliert MHC und KoStimulator-Moleküle hoch... Typ1-Immunität spielen auch klinisch eine Rolle: Phänomen: Delayed type hypersensitivity (DTH) – Patient ist erkrankt an Mikroorganismus, der Typ1Immunität auslöst. Patient wird gesund, wenn man ihm aber Antigen des abgetöteten MOs unter die Haut spritzt Schwellung nach 1-2 Tagen. Auf diese Art kann man nachweisen, ob ein Individuum mit einem bestimmten MO konfrontiert war; wird vorallem bei Tuberkulose (intrazelluläres Bakterium) genutzt. Perivascular cell infiltrates – infiltrieren Blutgefäße Granulome sind eine Form chronischer DTH – Infizierter Bereich wird abgekapselt Zellvermittelte Immunreaktion wird verstärkt (CD8, Makrophagen, Interferon-γ usw.) Kennzeichen der Typ2 Immunität - Humorale Immunität wird verstärkt. Dies kann im Extremfall (viel IL-4) auch allergische Reaktion bedeuten. - Es entstehen neutralisierende Antikörper. Bei viel IL4 wird Immunglobulin-E gemacht (über class switching), IgE bindet auf Rezeptoren der Mast-Zelle und führt zu ihrer Degranulation; Mastzelle setzt Stoffe frei, dies ist im wesentlichen für allergische Reaktion verantwortlich. - Eosinophiler kann auch dazu beitragen, dass allergische Reaktionen chronisch werden; zB Asthma. - Alternative Makrophagenaktivierung, klassische Aktivierung wird unterdrückt. Kennzeichen der Typ17 Immunität wenn TH17 Immunität fehlt, sind Infektionen mit extrazellulär wachsenden MOs schwer. Abtöten von Zielzellen durch CTL Zielzelle wird dadurch erkannt, dass sie MHC1 exprimmiert mit Peptid von Mikrobe. Wenn CTL aktiviert ist, kann Erkennen und Abtöten ohne KoStimulation geschehen. Ekennung von Peptid Aktivierung (blaue Pünktchen) cytotoxische Granula freigesetzt, diese sollen Zielzelle abtöten, durch den Kontakt mit Zielzelle weiß CTL, in welche Richtung sie freisetzen muss – exozytotischer Vorgang Abspaltung Zielzelle stirbt ab durch die in den Granula enthaltenen Substanzen CTL lösen in Zielzellen Apoptose aus CTL setzt Komplex aus Perforin, Serglycin und Granzyme frei, wird von der Zielzelle aufgenommen; Perforine wichtig, zusammen mit Serglycin machen ein Loch in das Endosom Granzyme kommen frei, diese lösen Apoptose aus. Was machen Antikörper? indirekte Funktion über das Komplementsystem; hauptsächlich von Typ1; bestimmte Isotypen können Komplementsystem aktivieren, das Komplementsystem kann Mikroben lysieren, es kann opsonisierend wirken und die kleine Fragmente des Komplementsystems können Entzündungsreaktion verstärken. - Antikörperabhängige zelluläre Cytotoxizität Antikörperisotypen existieren, weil unterschiedliche Effektorfunktionen ausgelöst werden können. Immunreaktion muss den „Anforderungen“ der Mikrobe angepasst sein. Toxine haben Rezeptoren durch die sie in Zellen aufgenommen werden, in der Zelle entwickeln sie dann biochemische Funktionen die der Zelle schaden. Die Bindungsstelle des Toxins muss also mit einem Antikörper blockiert werden (neutralisierende Wirkung von Antikörpern). Die meisten Vaccine führen zur Bildung neutralisierender oder opsonisierender Antikörper ADCC-Reaktion: Antikörper bindet an Zelloberfläche – wenn Zelle viral Infiziert ist, dh sie macht an der Oberfläche Virusprotein – Antikörper binden daher an infizierte Zelle. NK-Zellen aben FC-Rezeptor, der nicht dazu da ist, Antigen aufzunehmen, sondern ADCC auszulösen. 3 Wege der Komplementaktivierung - classical Pathway: diese hängt davon ab, dass eine Mikrobe erkannt werden kann; man hat ihn als 1. entdeckt antikörperabhängige Aktivierung. Antikörperunabhängige Aktivierung: - Lectin Pathway - alternative Pathway 1) Klassischer Weg: Antikörper bidet an Oberfläche einer Mikrobe Antikörper-Antigen-Komplex; Komplementsystem-Aktvierung ist daran gekoppelt, dass der Antikörper ein Antigen erkennt. Erst dann aktivierung und fixierung von Komplement 2) Lectinweg: beruht darauf, dass es im Blut ein Protein Mannose-Binding-Lectin (MBL), ist ein nicht zellgebundener Patternrecognition-Rezeptor. 3) alternativer Weg: Komplementsystem aktiviert sich selbst. CD3-Komponente hat eine Sollbruchstelle; mit geringer, signifikant vorhandener Wahrscheinlichkeit zerfällt CD3 spontan in C3a und C3b. C3b kann an Mikrobe binden, Protein „Faktor B“ bindet daran, weiters Faktor D (wichtig, weil er das B-Protein spaltet in Ba und Bb); Bb = alternative C3-Konvertase, alternative C5Konvertase kann entstehen usw. Spontaner Zerfall von C3? Sollbruchstelle = labile Thioesterbindung; kann zerfallen, für kurze Zeit ist Thioester dem umgebenden Millieu ausgesetzt, er ist empfindlich gegenüber Hydrolyse Wenn Wassermolekül vorhanden entsteht Thiolgruppe und Carboxylgruppe C3b ist inaktiviert. wenn Mikrobielle Oberfläche vorhanden: wird gebunden durch reaktive Zelloberfläche C3b kovalent an mikrobielle Oberfläche gebunden. IgM und bestimmte Isotypen von IgG können Komplementsystem aktivieren. Warum können sie erst auslösen, wenn Mikrobe da ist? Strukturänderung bei IgM von planarer zu staple-Form; nur die Staple-Form kann Komplementsystem aktivieren. IgG macht ebenfalls Koformationsänderung, die Komplementbindungsstelle freisetzt. Immunologie, 24. November 2010 Transplantation Immunology Autologes Transplantat (Selbsttransplantat): Ein Stück Gewebe von einem Individuum auf das gleiche Individuum transportiert zB Hauttransplantation bei Verbrennungen. Syngeneic graft: Transplantat von einem Individuum zum andern, beide Individuuen sind genetisch identisch (zB bei Zwillingen oder Inzuchtlinien von Versuchstieren wie Maus). Medizinisch ist die bedeutsamste Situation die allogeneic graft: von einem Individuum einer Art ein Stück Gewebe oder Organ in ein anderes Individuum der selben Art, genetisch nicht identisches Individuum transplantiert. Xenograft: xenos = fremd, Transplantation von einer Spezies zur anderen (noch nicht relevant, betrifft v.a. Schwein, da es dem Menschen am ähnlichsten ist was Metabolismus angeht, zB Lebertransplantate vom Schwein.) folgende Arten beziehen sich auf den Ort der Transplantation (obere Arten beziehen sich auf die Art, von dem Transplantat stammt bzw. welche Art es empfängt): - Ortotope Transplantation - Heterotrope Transplantation Allogene Transplantate erzeugen ein durch T-Zellen vermitteltes immunologisches Gedächtnis: Mit Mausinzestlinien kann man den Mechanismus der Abstossung von Transplantaten erforschen bzw. auch Therapiemöglichkeiten. Transplantat löst adaptive Immunantwort aus (Transplatat = Fremdkörper) Bei primärem Transplantat (first set rejection) – Transplantation wird in einer Ersttransplantationssituation abgestoßen – dauert 10 Tage. daher nicht durch das angeborene IS (da würde die Abstoßung schnell erfolgen). Nochmal grünes Transplantat und gibt es auf orange Maus, die schon ein Transplantat erhalten hatte: Eine Maus, von der wir erwarten, dass sie immunologisches Gedächtnis besitzt die sekundäre Immunantwort erfolgt schneller und vehementer als die 1. Es dauert nur noch 3 Tage, bis Transplantat abgestoßen wird. Daraufhin nimmt man T-Zellen heraus und injiziert sie in eine Maus, welche noch kein Transplantat erhalten hatte (hier sollten Gedächtnisszellen drinnen sein) auch hier nur 3 Tage zur Immunreaktion, die die Gedächtnisszellen übertragen wurden. Man macht F1-Hybride (1. Generation, die aus dem Verpaaren 2er Inzestlinien erfolgt; man paart grüne Maus mit oranger Maus). Stößt die „Tigermaus“ Transplantate von einem Elternteil ab nein. Tigermaus hat von beiden Eltern die MHC-Allele, das heißt für diese Maus ist kein MHC-Allel fremd. Wenn allerdings von der Tigermaus ein Transplantat auf die Eltern übertragen wird Abstoßung; da Elternteil keine durchmischten Allele hat. T-Zell-vermittelte Transplantatsabstoßung: Unterschied zwischen direkter und indirekter Allo-Antigenerkennung (Allo-Antigen = etwas, dass die Transplantatzelle expremmiert, das anders ist, als im Empfängerorganismus = fremd). Indirekte Allo-Antigenerkennung: Antigenpräsentierende Zelle muss vom Empfänger stammen, sie frisst abgestorbene Transplantatzelle und zerlegt sie, präsentiert, was fremd ist. Im MHC sind Peptide, die für T-Zelle fremd ist sie wird zu alloreaktiven T-Zelle, spezifisch gegen die Zellen des Transplantats. Direkte Allo-Antigenerkennung: Antigenpräsentierende Zelle stammt vom Spender; die a.g.p.-Zelle hat einen fremden MHC fremder MHC kann eigentlich nicht funktionieren wegen der genetischen Restriktion der Immunantwort, dh die agp-Zelle hat nicht dieselben MHC-Allele wie Zelle! dies bezieht sich aber auf die Situation wo ein Selbstantigen präsentiert wird. Man hat verschiedene polymorphe AS; wenn MHC fremd ist, kann die Situation eintreten, dass die Kombination auf Selbstpeptid (vom Spender) und den polymorphen AS für eine T-Zelle aussieht, wie eine Kombination aus Selbst-MHC und Selbstpeptid. Wie unterschiedlich sind Spender und Empfänger? Man könnte MHC sequenzieren; AK verwenden, die spezifische Allele erkennen und im Spender und im Empfänger die MHC-Allele zu testen. Einfacher: „mixed leukocyte reaktion“: Man isoliert Blutleukozyten (agp-Zellen, T-Zellen, B-Zellen) – beide Zelltypen reagieren Man sieht nach, wie viele T-Zellen aktiviert werden. one way MLR: man teilt es auf 2 Reaktionen auf; die Leukozyten vom Donor/Empfänger werden inaktiviert (sie leben noch, sie können aber nicht mehr proliferieren); wenn man das jetzt „zusammenschmeißt“ sieht man nur Lymphozytenproliferation vom Spender/Empfänger (je nachdem, welche man bestrahlt!) Transplantationsabstoßungsreaktionen - Hyperakute: Host vs. Graft – IS des Empfängers stößt das Transplantat sehr schnell ab (noch bevor adaptive Immunreaktion erfolgt ist). Das, was Transplantat abstößt, muss schon vorher im Körper gewesen sein Antikörper, die schon vorher im Empfänger waren, richten sich meist gegen Endothelien des Transplantats (Abstoßung sobald das Transplantat in den Blutkreislauf eingebaut ist – AK binden an Fremdzellen, es wird das Blutgerinnungssystem aktiviert Gefäße werden verschlossen durch Blutpfropfen – Organ unterversorgt.) - akute Abstoßungsreaktion: Abwehr des Transplantats (braucht etwa eine Woche; es werden TZellen/AK gegen das Transplantat gebildet/produziert; cytotoxische T-Zellen, Cytokine, Entszündungsreaktion, Gefäße des Transplantats werden ruiniert, Gefäße werden verschlossen) - chronische Abstoßung (chronic DHT; dauert Monate; außerdem anderer Mechanismus: Gefäße des Transplantats werden verschlossen (nicht durch Blutgerinnung sondern) dadurch, dass die glatte Muskulatur des Gefäßes zu wächst Gefäß wird langsam verschlossen (Muskulaturwachstum verursacht durch Cytokine), Blutversorgung kommt zum erliegen. - ) - Transplantat richtet sich gegen den Wirt: v.a. bei Knochenmarktransplantations – Empfänger ist für Transplantat fremd (da ja im Knochenmark IS-Teile sind) Am häufigsten transplantiert: Niere, sie ist aber besonders anfällig für die Schädigungen – Niere ist ein Blutfilterorgan, dh es fließt sehr viel Blut hindurch - Glomeruli. Mit dem Blut kommt auch alles andere in die Niere (auch Schädliches). Tubulus - führt Primärharn ab; Glomerulus – hier wird filtriert; darin Kapillargefäßsystem... Bei hyperakuter Abstoßung der Niere: Neutrophile werden angelockt durch Antikörper, die an die Andothelzellen gebunden und das Komplementsystem aktiviert haben Verstopfung. Akute: Infiltrat ist nicht beschränkt auf die Gefäße, sondern es ist auch im Bindegewebe; Infiltrat besteht im Wesentlichen aus T-Zellen. Infiltrat zerstört arterielles Endothelium. Chronische Abstoßung: glatte Muskulatur wird dicker, blockiert das Gefäß Verstopfung. Wie kann man Transplantate kopatibler machen? – MHC Kompatibilität. Immunsuppressiva agieren auf der Ebene der T-Zell-Aktivierung. Je weniger HLA-Allele übereinstimmen, umso wahrscheinlicher die Abstoßung (trotz Immunsuppressiva, zB Steriode = antiinflammatorisch oder Anti-CD3-monoclonal antibody – T-ZellDepletion). Cyclosporin bei Patienten mit Herztansplantation – innerhalb von 10 Jahren hat sich die Toleranz von Herztransplantaten verdoppelt durch Cyclosporin. Immunsuppression hat auch Nachteile: Man setzt ja das IS außer Kraft, daher wird man anfälliger für Infektionen; außerdem erhöhtes Auftreten von Tumoren, möglicherweise verursacht durch latente Tumorviren (Epstein-Barr, Papilloma; sie können nicht mehr durch IS in Schach gehalten werden.) Bluttransfusion: AB0-Blutgruppenantigene müssen hierbei übereinstimmen. Jeder Mensch trägt Antikörper gegen Blutgruppen, die er nicht besitzt. Bei Blutgruppe 0 kein Antigen gegen A oder B oder AB. Blutgruppe – Zuckermodifikationen eines Erythrozyten; diese ähneln den Strukturen die bei Bakterien häufig vorkommen; daher hat man auch Antigene gegen andere Blutgruppen. Aglutinationsreaktion: Serum vom Empfänger mit Erithrozyten vom Spender gemischt; Aglutination: Antikörper bilden Netzwerke – makroskopisch sichtbar. IgG ist divalent – könnte 2 Blutkörperchen vernetzen, IgG müsste hierzu aber im Überschuss sein; beide Bindungsstellen benötigt, um Antigene in der Membran zu binden. Aber IgG kannn aglutinieren, wenn man einen polyvalenten Antikörper hinzugeben – IgG und daran gebunden IgM – polyvalent. Blutgruppenantigene sind nicht ausschließlich auf Erithrozyten – sondern auch auf Epithelien. Dh wenn Spender die falsche Blutgruppe hat, kann das dazu führen, dass der Empfänger das Blut nicht akzeptiert – selbes Problem wie nicht kompatibler MHC. Ist aber leichter, einen passenden Spender zu finden als bei Transplantat, da nur 3 unterschiedl. Blutgruppen. fötale Erythroblastose: bei unterschiedliche Expression des Rhesusfaktor (BG-Antigen) von Mutter (Rhesusfaktor) und Vater (+Rhesusfaktor) kann es dazu kommen, dass ein Fötus in einer 2. Schwangerschaft abgestoßen wird. Gegen Rhesusfaktor hat man nicht gleich Antikörper; bei der Geburt kann es aber passieren, dass Erithrozyten und +Rhesusfaktor vom Kind auf die Mutter übertragen werden, bei 2. Schwangerschaft hat Mutter Antikörper gegen den positiven Rhesusfaktor Embryo kann absterben. Mutter muss IgG geswitchte Gedächtnisszellen gegen den Rhesusfaktor bilden. Was tut man dagegen? – FaB2 Faktor bindet an Rhesusgen, dh wenn Mutter rechtzeitig mit dem Rhogam (Präparat) behandelt, so wird der Rhesusfaktor blockiert, solang bis die Erythrozyten im mütterl. Kreislauf abgebaut sind und nicht mehr in der Lage sind, Antikörper zu bilden. Alternative zur dauerhaften medikamentösen Immunsuppression: Erzeugen von Toleranz gegen ein Transplantat. tolerogene Immunantwort: Antigen ohne Adjuvanzien in hoher Dosis intravenös injiziert. - Transfusion von allogenem (Spender-) Blut vor Nierentransplantation kann Toleranz erzeugen. Durch injektion von allogenem Spenderblut kann (vor der Nierentransplantation) eine tolerogene Antwort im Empfänger verursacht werden. - gemischter Chimärismus: Verwirrung, was für das IS fremd, was selbst ist (da man bei Knochenmarkspende eig. plötzlich 2 IS hat) – bessere Chancen, dass ein 2tes transplantiertes Organ akzeptiert wird. Man kann Knochenmark vollständig austauschen. Wenn (genet.) Defekte im Knochenmark vorliegen, kann man versuchen, durch Transplantation die Defekte auszugleichen. Wichtiger: Behandlung von Leukämien; dh man versucht, in einem Leukämiepatienten alles loszuwerden das „Blut“ dh leukämisch ist. Patient braucht aber Knochenmark – man versucht, die leukämischen Zellen zu entfernen aus dem Knochenmark, oder er enthält Spenderknochenmark. Nachteil am fremden Knochenmark – es ist fremd, aber für den Empfänger sind die eigentlichen leukämischen Zellen wegen dem neuen Knochenmark fremd Transplantat kann helfen, leukämische Zellen los zu werden. Es kann aber auch Abstoßung stattfinden, wenn MHC-Allele übereinstimmen. Auch wenn die MHC übereinstimmen kann dennoch Abstoßung erfolgen zB über NK-Zellen; das heißt, man muss das Knochenmark des Patienten vollständig loswerden. Aber wenn es klappt Hämatopoäse vollständig erneuert. Graft vs. Host disease (GVHD) resultiert daraus, dass Empfängergewebe für ein Transplantat fremd ist. Nicht nur adaptive Immunantwort hierbei beteiligt, sondern auch NK-Zellen des Transplantats; dies kann sich gegen Epithelien richten. Wenn MHC angeglichen wird, richtet sich T-Zell-Part meist nicht gegen die MHCProteine sondern gegen die minor-HC dh matching führt nicht 100% zum Erfolg eines Transplantats. wird mit Immunosuppressiva behandelt Wenn chronisch: Fobrose (=normales Gewebe stirbt ab und wird durch Bindegewebe ersetzt) und Atrophy (= Verkümmern des Organs, Organ geht zugrunde). Immunologie, 1. Dezember 2010 Hypersensitivity Hypersensitivitätsreaktionen. Was bedeutet der Begriff? Beschreibt, dass eine Reaktion auf ein Antigen stärker erfolgt, als es im Sinne des Patienten ist Ein Patient ist auf irgenein Antigen so sensitiv, dass die Immunreaktion in eine Immunpathologie umschlägt Immunreaktion bringt eine nachfolgende Krankheit mit, weil sie übersteuert ist (zu stark; beseitigt nicht nur Antigen). Wann tritt dies ein? Was sind die Ursachen? Hypersensitivitätsreaktionen („überschießende Immunreaktion“) in 4 Typen einteilbar. Sie lassen sich hinsichtlich des Immunmechanismus einteilen. - Type 1 – Hypersensitivität vom sofort-Typ (auch AK-vermittelt, aber der Antikörper ist ein bestimmter IgE-Isotyp): klassische allergische Reaktion, IgE - Type 2 – Antikörpervermittelte Hypersensititvität beruht auf Vorhanden sein „normaler“ Isotypen – die AK sind aber autoimmun. - Type 3 - Immunkomplexvermittelte Hypersensitivität - Type 4 – delayed Type Hypersensitivität: aktivierte Makrophagen & T-Zellen spielen eine Rolle Typ2: Krankheiten, die durch Antikörper hervorgebracht werden: Sie können sich gegen ein Protein gegen der Zelloberfläche oder der extrazellulären Matrix richten – Antikörper gebunden an Autoantigen, dies aktiviert Komplement, über FC-Rezeptoren kann es die Aufnahme durch Phagozyten vermitteln; kann auch zur Aktivierung von Makrophagen führen Auslösen einer Entzündungsreaktion; diese führt zum Infiltrieren des Gewebes durch Neutrophile; es werden Enzyme, Sauerstoffradikale etc. im Zuge der Entszündung freigesetzt Gewebsschädigung. Immunkomplexe können sich auch in Kapillargefäßen ablagern, wenn sie zu häufig/groß sind und dadurch Krankheit verursachen. In welchen Situationen geschieht das? Oft bei Autoimmunreaktionen. Wenn es zu einer massiven Schädigung von Körpereigenem Gewebe kommt, können gegen die Inhalte des Gewebes Antikörper gebildet werden (zB Anti-RNA Antikörper, Anti-DNA-AK...). Intrazelluläre Proteine, mit denen das IS eigentlich nicht in Berührung kommt. V.a. Nukleinsäuren sind potentielles Immunogen. Komplexe werden dann in den Kapillaren unlöslich und werden dort deprotoniert, können zur Entzündung führen Vaskulitis = Entzündung der Blutgefäße. Effektormechanismen der antikörperabhängigen Hypersensitivität. - Opsonisierung und Phagozytose - Complement- und FC-Rereptor-vermittelte Entzündung - Abnormale physiologische Antwort ohne Zellschädigung - Antikörper stimuliert Rezeptor ohne, dass Ligand vorhanden wäre - Antikörper verhindert, dass Ligand binden kann – zB am Muskel: Acetylcholinrezeptor wird blockiert, kein Acetylcholin kann wirken, der Muskel kann sich nicht zusammenziehen. - Autoimmune thrombocytopenic purpura: Blutplättchen werden phagozytiert. - Pemphigus vulgaris: Proteasen werden durch Antikörper aktiviert - Acute rheumativ fever: Man glaubt, dass die Antikörper, die sich gegen den Auslöser des rh. Fiebers (Streptokokken) kreuzreagieren können und Zellen des Herzmuskels schädigen. - Insulin-reistant Diabetis: die Antikörper verhinden das Binden von Insulin; sie inhibieren den Insulinrezeptor (normalerweise bei Diabetes kann man Insulin nur nicht selbst herstellen, kann es aber verabreicht bekommen und es wirkt.) usw. ( siehe Tabelle in Folien) Diseases caused by immune complexes: - Lupus erythematosus: innere Schädigungen, Gelenks-, Nieren-, und Blutgefäßentzündungen; Antikörper gegen Nukleinsäuren u.ä. Gewebe wird geschädigt, die Bestandteile werden freigesetzt, Antikörper werden gebildet, Immunkomplexe werden abgelagert... - poststreptococcal glomerulonephritis: verursacht Nephritis (=Nierenentzündung) - serum sickness: Grund, warum das Konzept der passiven Immunisierung nur bedingt zu verwenden ist; das Serum ist ja ebenfalls fremd, wenn man 2x Serum gibt, bekommt man Komplexe mit diesem Serum serum sickness; Arthritis, Nephritis, Vasculitis Außerdem wird bei der serum sickness das Komplementsystem aktiviert. Typ 3: Mechanismen der T-Zellabhängigen Hypersensitivität T-Zellen gegen Selbstantigen; effektor-CD4-Zellen sorgen für Aktivierung von Makrophagen, CD8 zerstören Wirtseigenes Gewebe; daraus werden Inhaltsstoffe frei Entzündungsreaktion, Schädigung des Gewebes. Diseases caused by T-cells: - Multiple Sklerose, T-Zellen richten sich gegen Myelinschicht der Nervenzellen - Typ1 Diabetes - Inflammatory bowel disease – chronische Darmentzündungen (man kennt Auslöser nicht), Darmepithel wird geschädigt, wahrscheinlich Zusammenhang zu den Darmbakterien - Peripheral neuritis Lähmungserscheinungen in den Gliedmaßen (Guillain-Barr Syndrom) - Autoimmune myocarditis (Herzmuskelentzündung) Warum kann die Toleranz eigentlich durchbrochen werden? Voraussetzung für das Einleiten einer adaptiven Immunantwort ist die Antigenpräsentation durch APC (dendritische Zellen, müssen MHC2 und Kostimulatoren haben) an naive T-Zellen. Wenn Antigene ohne Kostimulatoren präsentiert werden Anergie; T-Zellen nicht aktivierbar. Wo kommen Ko-Stimulatoren her? Dendritische Zelle exprimiert pattern recognition receptors, diese erkennen mikrobielle Antigene, senden Signale aus, diese regulieren u.a. die Kostimulatoren auf Auftreten von Mikroben ist an die Produktion der Kostimulatoren geknüpft. woher kommen die Kostimulatoren bei der Autoimmunreaktion? 1) Auftreten sog. DAMPs: danger associated molecular pattern – unterscheidet sich vom PAMP dadurch, dass DAMP aus Wirtsorganismus (aus dem Zellinneren) stammt, das Immunsystem darf nur in Gefahrensituationen DAMP zu sehen bekommen. Auftreten von Kostimulatoren wird nicht mehr an das Auftreten der Mikrobe geknüpft, sondern an das Auftreten von Schädigungen im Gewebe. Genetic susceptibility (man kann bestimmte autoimmune T-Zellen nicht aussortieren) diese autoreaktiven Lymphozyten können nicht aktiviert werden, es sei denn, man bekommt APC mit Kostimulatoren – diese erhält man, wenn man im Zuge der Gewebsschädigung DAMPs bekommt. 2) ungewolltes Aktivieren von Autoreaktivität im Zuge einer Infektion: Infektion sorgt dafür, dass dendritische Zellen aktiviert werden; durch die Mikrobe aktivierte dendritische Zelle kann Antigen aus dem Wirtsorganismus aufgenommen haben, gegen das es T-Zellen gibt Autoimmunantwort verursacht. 3) Molecular Mimicry: Antikörper gegen mikrobielles Antigen wird gebildet, das Epitop des Antigens ist aber einem Epitop im Wirtsorganismus gleich/sehr ähnlich T-Zellen richten sich also gegen Zellen, die dieses Autoantigen präsentieren. Oft als Folge von Infektionen auch Autoimmunität. Man versucht, mit Stammbaumanalysen, welche Genorte mit der Autoimmunität verbunden sind. Es gibt Genorte, die sind bei mehreren Autoimmunkrankheiten involviert – zB PTPN22, CTLA4 (reguliert T-Zellaktivierung negativ), HLA (menschl. MHC)... Gene mutations that result in autoimmunity: - AIRE = Transkriptionsfaktor, der dafür sorgt, das der Thymus viele verschiedene Selbstantigene präsentieren kann um die Toleranz herzustellen. - CTLA4: negativer Regulator der T-Zellaktivierung - FAS/FAS-Ligand - FoxP3: braucht man, um regulatorische T-Zellen zu machen - Interleukin 2 - SHP-1 und PTPN22 – 2 Phosphatasen, nicht unterdrückte Lymphozytenaktivität Typ1 – Hypersensitivität sie ist durch den IgE-Isotyp vermittelt. Man braucht zunächst ein Allergen (= verursacht IgE-Class Switching, ursprüngl. Aufgabe von IgE: Immunität gegen Helminthen). Nicht klar, warum bestimmte Proteine ein Antigen, ein anderes ein Allergen ist. Allergen kann aber das Classswitching auslösen – es führt dazu, dass TH2-Zellen aktiviert werden, IgE entsteht. Allergische Reaktion vermittelt durch Rezeptor spezifisch für die IgE – FC-epsilon Rezeptor; vorwiegend Mastzellen, die bindet IgE an Oberfläche, der Rezeptor kann auch IgE dann binden, wenn es nicht als Komplex vorliegt. Allergen kommt ein 2. Mal: Allergen findet an der Oberfläche der Mastzellen IgE, bindet daran und sorgt für eine Vernetzung der FC-epsilon Rezeptoren und aktiviert daher die Mastzellen, diese setzt innerhalb von Sekunden Granulainhalte frei hier Histamin vorhanden, das Histamin verursacht die allergische Reaktion. Der schnelle Ausschlag verschwindet aber nicht schnell wieder: durch verschiedene Botenstoffe ausgelöste Spätphasenreaktion: Allergische Entzündung. Ödem = Schwellung, die mit Rötung verbunden ist; allergische Reaktion sorgt für Weitstellung der Gefäße, daher Ausfluss von Flüssigkeiten Schwellung, Flüssigkeit staut sich: Rötung. Besonderheit der allergischen Entzündung: Infiltrat ist besonders von eosinophilen Granulozyten durchsetzt. Basophile und Eosinophile: spielen bei allergischer Reaktion eine große Rolle. Sie können Histamin freisetzen. Basophile tragen zur sofort-Typ-Reaktion bei. Bei Helmintheninfektion werden eig. die Mastzellen aktiviert, das Histamin würde versuchen, Helminthen hinauszubekommen. Eosinophilen würden ihre Granula freisetzen, dies zerstört Kutikula der Helminthen. Sofort-Typ-Reaktion: Schnelle Freisetzung von Granulozyten der Mastzellen. Späte Reaktion/allergische Entzündungsreaktion: Synthese von Lipidmediatoren Beginnt mit Arachidonsäure (4fach ungesättigte C20-Fettsäure) - Cyclooxigenase Weg und eine Reihe Modifikationen Prostaglandine (sind wichtig bei Entzündungsreaktionen im weiteren Sinne, Acetylsalicylsäure (Aspirin) hemmt Cyclooxigenase, verhindert/lindert Schmerzen, Fieber etc.) - Lipoxigenase Weg Leukotriene oder Lipoxine Bronchoconstriction = Verengung der Bronchien, Teil des allergischen Asthmas, mehr Schleimproduktion... Neutrophilenchemotaxis, Eosinophile werden durch Cytokine angelockt... das alles sorgt für allergische Entzündungsreaktion. Atopie = Genetische Prädisposition für Allergie. Steroide haben entzündungshemmende Wirkung, werden daher bei Asthma inhaliert.