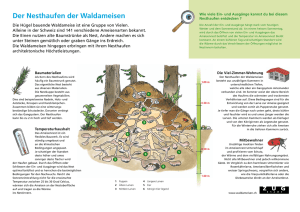
pdf-Dokument - ULB Bonn :: Amtliche Bekanntmachungen und
Werbung

Frühe Immunantworten bei Helminthen-Infektionen: Untersuchungen zur Rolle des Chemokins Thymus and activation-regulated chemokine (TARC/CCL17) am Beispiel des Nagetier-Modells Litomosoides sigmodontis Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-Naturwissenschaftlichen Fakultät der Rheinischen Friedrich-Wilhelms-Universität Bonn vorgelegt von Jutta Kirsten Frank aus Lemgo Bonn, 2011 1 Angefertigt mit Genehmigung der Mathematisch-Naturwissenschaftlichen Fakultät der Rheinischen Friedrich-Wilhelms-Universität Bonn 1. Gutachter: Prof. Dr. Achim Hörauf 2. Gutachter: Prof. Dr. Waldemar Kolanus Tag der Promotion: 22. Juni 2011 Erscheinungsjahr: 2011 2 Inhaltsverzeichnis Inhaltsverzeichnis ......................................................................................................................... 2 Abkürzungsverzeichnis ................................................................................................................. 5 1 1.1 1.1.1 1.1.2 1.2 1.3 1.3.1 1.4 1.4.1 1.4.2 1.5 1.5.1 1.5.2 1.5.3 1.6 1.7 Einleitung ...................................................................................................................... 6 Das angeborene Immunsystem................................................................................................6 Dendritische Zellen...................................................................................................................7 Mastzellen ................................................................................................................................8 Das adaptive Immunsystem .....................................................................................................9 Chemokine ............................................................................................................................ 11 Thymus and activation-regulated chemokine (TARC/CCL17) ............................................... 12 Humane Filariose................................................................................................................... 13 Onchozerkose ........................................................................................................................ 13 Lymphatische Filariose .......................................................................................................... 14 Mausmodell für Filariosen: Litomosoides sigmodontis (Chandler, 1931) ............................. 15 Lebenszyklus von L. sigmodontis........................................................................................... 16 Zelluläre Immunantworten gegen L. sigmodontis ................................................................ 17 Zytokin-Antworten gegen L. sigmodontis ............................................................................. 18 Wolbachia-Endosymbionten ................................................................................................. 19 Fragestellung ......................................................................................................................... 20 2 2.1 2.1.1 2.1.2 2.1.3 2.1.4 2.1.5 2.1.6 2.1.7 2.1.8 2.1.9 2.1.10 2.1.11 2.1.12 2.1.13 2.2 2.2.1 2.2.1.1 Material und Methoden ............................................................................................... 21 Material ................................................................................................................................. 21 Geräte.................................................................................................................................... 21 Verbrauchsmaterial ............................................................................................................... 21 Chemikalien und Reagenzien ................................................................................................ 22 Lösungen und Puffer ............................................................................................................. 23 Enzyme .................................................................................................................................. 24 Wachstumsmedien und Zusätze ........................................................................................... 25 Stimulanzien .......................................................................................................................... 25 Kits ......................................................................................................................................... 25 Inhibitions-Antikörper ........................................................................................................... 25 ELISA-Antikörper ................................................................................................................... 26 FACSTM-Antikörper................................................................................................................. 26 Primer .................................................................................................................................... 26 Tierhaltung ............................................................................................................................ 27 Methoden .............................................................................................................................. 28 Zellkultur ............................................................................................................................... 28 Knochenmarks generierte dendritische Zellen (bone marrow derived dendritic cells, BMDCs) .................................................................................................................................. 28 Knochenmarks generierte Mastzellen (bone marrow derived mast cells, BMMCs)............. 28 Laborzyklus von Litomosoides sigmodontis .......................................................................... 29 Natürliche Infektion mit Litomosoides sigmodontis ............................................................. 29 2.2.1.2 2.2.2 2.2.3 3 2.2.4 2.2.5 2.2.6 2.2.7 2.2.8 2.2.9 2.2.10 2.2.11 2.2.12 2.2.13 2.2.14 2.2.15 2.2.16 2.2.17 2.2.18 2.2.18.1 2.2.18.2 2.2.18.3 2.2.18.4 2.2.19 Isolierung von L3 Larven........................................................................................................ 29 LsAg-Präparation ................................................................................................................... 29 Injektionsexperimente .......................................................................................................... 30 Nachweis eGFP-exprimierender Zellen ................................................................................. 30 Extraktion von Zellen und Würmern aus der Thoraxhöhle ................................................... 30 Zytospin-Analyse ................................................................................................................... 30 Aufreinigung monoklonaler Antikörper ................................................................................ 31 Depletionsexperimente ......................................................................................................... 31 In vivo Messung der vaskulären Permeabilität ..................................................................... 31 Histologie Mastzellen ............................................................................................................ 32 Behandlung mit Histamin-Rezeptor-Antagonisten ............................................................... 32 Mastzellstabilisierung............................................................................................................ 32 Durchflusszytometrie (FACSTM-Analyse)................................................................................ 32 Enzyme Linked Immunosorbent Assay (ELISA) ..................................................................... 33 mRNA-Expression .................................................................................................................. 33 RNA-Extraktion aus Hautproben ........................................................................................... 33 Reverse Transkription zu cDNA ............................................................................................. 33 Real-time PCR ........................................................................................................................ 34 Plasmid-Standards ................................................................................................................. 34 Statistik .................................................................................................................................. 35 3 3.1 3.1.1 Ergebnisse ................................................................................................................... 36 Expression von CCL17 durch Stimulierung mit Filarien-Antigen ........................................... 36 Stimulierung mit Wurmextrakt von L. sigmodontis führt zur Aktivierung dendritischer Zellen ..................................................................................................................................... 36 Expression von CCL17 nach natürlicher Infektion mit L. sigmodontis in Haut, ........................ Lymphknoten und Lunge....................................................................................................... 37 Immunantworten bei CCL17-Defizienz in der Pleura-Kavität ............................................... 39 Erhöhte Wurmlast bei CCL17-Defizienz nach Infektion mit L. sigmodontis ......................... 39 Zelluläre Antworten bei CCL17-Defizienz nach Infektion mit L. sigmodontis ...................... 41 Erhöhte Wurmlast bei CCL17-Defizienz unabhängig von CD25+ Zellen ................................ 43 CCR4-unabhängige Immunabwehr bei Filarien-Infektionen ................................................. 44 Zytokin-Antworten bei CCL17-Defizienz nach Infektion mit L. sigmodontis ........................ 45 Erhöhte Wurmlast bei CCL17-Defizienz unabhängig von IL-10 ............................................. 46 Frühe Immunantworten bei CCL17-Defizienz in der Haut .................................................... 47 Vermehrte Auswanderung von Larven aus der Haut bei CCL17-Defizienz ........................... 47 Zytokin- und Chemokin-Antworten bei CCL17-Defizienz in der Haut ................................... 48 Keine erhöhte Lymphangiogenese in der Haut bei CCL17-Defizienz .................................... 49 Erhöhte vaskuläre Permeabilität bei CCL17-Defizienz nach natürlicher Infektion und Injektion von L3 Larven oder Wurmextrakt von L. sigmodontis ........................................... 52 Rolle von Mastzellen bei CCL17-Defizienz nach Infektion mit L. sigmodontis ..................... 53 Erhöhte Mastzelleinwanderung und -degranulation bei CCL17-Defizienz nach Infektion ........ mit L. sigmodontis ................................................................................................................ 54 Umkehrung von vaskulärer Permeabilität und Wurmlast bei CCL17-Defizienz durch Mastzell-Stabilisierung .......................................................................................................... 56 Keine wichtige Bedeutung von VEGF-A bei der Immunabwehr von L. sigmodontis ............ 57 3.1.2 3.2 3.2.1 3.2.2 3.2.2.1 3.2.2.2 3.2.3 3.2.3.1 3.3 3.3.1 3.3.2 3.3.3 3.3.4 3.3.5 3.3.5.1 3.3.5.2 3.3.5.3 4 3.3.5.4 3.3.6 3.3.7 4 4.1 4.2 4.3 4.4 4.5 4.6 Erhöhte Wurmlast bei CCL17-Defizienz abhängig von Histamin .......................................... 60 Mastzelldegranulation und vaskuläre Permeabilität nach Infektion von L. sigmodontis abhängig von Wolbachia ....................................................................................................... 62 Mastzelldegranulation, vaskuläre Permeabilität und Wurmlast nach Infektion mit L. sigmodontis abhängig von TLR2 ............................................................................................ 63 Diskussion ................................................................................................................... 65 Eine CCL17-Expression durch dendritische Zellen ist für die Immunantwort gegen ................ Filarien wichtig ...................................................................................................................... 65 Der Einfluss von CCL17 auf CCR4+ Zellen in der Thoraxhöhle ist nur von geringer ................... Bedeutung für die Immunabwehr bei Filarieninfektionen ................................................... 67 Frühe, durch L3 Larven induzierte Immunantworten in der Haut sind .................................... Lymphangiogenese-unabhängig ........................................................................................... 71 CCL17 besitzt eine antagonistische Wirkung auf die CCL5-abhängige Mastzell-Migration ...... bei Filarieninfektionen .......................................................................................................... 73 Es besteht ein direkter Zusammenhang zwischen Mastzelldegranulation, vaskulärer Permeabilität, Histamin-Freisetzung und Parasitenlast ........................................................ 76 Mastzelldegranulation, vaskuläre Permeabilität und Wurmlast sind abhängig von Wolbachia-Endosymbionten und einer TLR2-Aktivierung .................................................... 79 5 Zusammenfassung ....................................................................................................... 82 6 Summary ..................................................................................................................... 83 7 Literaturverzeichnis ..................................................................................................... 84 Abbildungsverzeichnis ................................................................................................................ 95 Tabellenverzeichnis .................................................................................................................... 96 Danksagung................................................................................................................................ 97 5 Abkürzungsverzeichnis ADLA AFL APC BMDCs BMMCs bp CCL CCR CD cDCs cDNA CLA d DCs DNA dNTP EDTA eGFP ELISA FACS FCS FITC h HR ICAM-1 IFN Ig IL L1/ L2/ L3/ L4 LF LN LPS LsAg LTA lyDCs akute Dermatolymphangioadenitis acute filarial lymphangitis Allophycocyanin Knochenmarks generierte dendritische Zellen Knochenmarks generierte Mastzellen Basenpaare CC-Chemokin-Ligand CC-Chemokin-Rezeptor cluster of differentiation konventionelle DCs komplementäre DNA cutaneous lymphocyte antigen Tag dendritische Zellen Deoxyribonukleinsäure Deoxyribonuklein Triphosphate Ethylendiamintetraacetat enhanced green fluorescent protein Enzyme Linked Immunosorbent Assay Fluorescence Activated Cell Sorter Fötales Kälber-Serum Fluoresceinisothiocyanat Stunde (hora) Histamin-Rezeptor intracellular adhesion molecule-1 Interferon Immunglobulin Interleukin Larvenstadium 1/ 2/ 3/ 4 Lymphatische Filariose Lymphknoten Lipopolysaccharid Antigenextrakt von Litomosoides sigmodontis Lipoteichonsäure im Lymphgewebe-verweilende DCs MCs mDCs Mf MHC mRNA NK NKT NOD ns OD PAMPs PBS PCR pDCs PE PerCP PFA pi PRRs RNA s.u. SEA ssp TARC TGF-β Th Th1 Th2 TLR TNF Tregs TSLP u.a. VEGF-A WSP z.B. Mastzellen wandernde DCs Mikrofilarien major histocompatibility complex messenger RNA natürliche Killerzellen natürliche Killer-T-Zellen Nucleotide Oligomerization Domain nicht signifikant Optische Dichte Pathogen-assoziierte molekulare Muster Phosphat Buffer Saline Polymerase-Ketten-Reaktion plasmazytoide DCs Phycoerythrin Peridinin-Chlorophyll Protein Paraformaldehyd nach Infektion (post infection) Mustererkennungsrezeptoren Ribonukleinsäure siehe unten Schistosoma mansoni-egg-antigen Unterart Thymus and activation-regulated Chemokine (CCL17) transforming growth factor-beta T-Helferzelle T-Helferzelle Typ 1 T-Helferzelle Typ 2 Toll-like Rezeptor Tumor Nekrose Faktor regulatorische T-Zellen Thymic stromal lymphopoetin unter anderem Vascular endothelial growth factor-A Wolbachia surface protein zum Beispiel Einleitung 6 1 Einleitung Alle Lebewesen sind in ihrer Umwelt einer Vielzahl verschiedener Pathogene ausgesetzt. Sowohl Mikroorganismen wie Bakterien und Viren als auch eukaryotische Parasiten wie Helminthen stellen dabei eine potentielle Bedrohung für die eigene Existenz dar. Evolutionär hat sich als Antwort auf diese Gefahr ein komplexes Immunsystem entwickelt, dessen Aufgabe es ist, die Integrität eines Lebewesens in der Auseinandersetzung mit Bakterien, Parasiten und anderen Noxen zu gewährleisten. Das Immunsystem von Vertebraten kann in zwei Komponenten unterteilt werden, in das angeborene (innate) Immunsystem und das erworbene (adaptive) Immunsystem. Das phylogenetisch ältere angeborene Immunsystem dient als erste Verteidigungslinie gegen eindringende Pathogene, deren klassische Strukturen durch ein geringes Repertoire an ImmunzellRezeptoren erkannt werden können. Darüber hinaus kontrolliert es die Aktivierung des adaptiven Immunsystems und die Determination der Effektorklassen der adaptiven Immunantwort. Zellen des angeborenen Immunsystems sind u.a. dendritische Zellen, Makrophagen, Mastzellen, Granulozyten und natürliche Killerzellen, welche zusammen mit löslichen Faktoren wie denen des Komplementsystems an der Immunantwort des angeborenen Immunsystems beteiligt sind, die rasch (innerhalb weniger Stunden) erfolgt, jedoch nicht sehr spezifisch ist. Im Gegensatz zum angeborenen Immunsystem handelt es sich bei der adaptiven Immunantwort um vergleichsweise langsame Prozesse (von mehreren Tagen), bei denen klonal selektionierte T- und B-Lymphozyten eine Schlüsselrolle spielen. Sie exprimieren hoch-spezifische und vielfältige AntigenRezeptoren, welche durch somatische Rekombination während der Ontogenese entstehen. Nach Antigenkontakt proliferieren die entsprechenden Lymphozyten und differenzieren zu hochspezifischen Effektorzellen zur Eliminierung des Pathogens. Darüber hinaus ist das adaptive Immunsystem durch die Ausbildung eines immunologischen Gedächtnisses charakterisiert, welches dem Organismus langanhaltende Immunität verleihen kann (Janeway 2005). 1.1 Das angeborene Immunsystem Die phylogenetisch älteren Abwehrfunktionen des innaten Immunsystems sind schnell aktivierbar oder konstitutiv vorhanden und in ihren einzelnen Bestandsteilen stark konserviert. Das angeborene Immunsystem ist bei Pflanzen, Invertebraten und Vertebraten vorhanden, während die Ausprägung einer adaptiven Immunantwort nur bei Vertebraten beobachtet werden kann (Medzhitov and Janeway 2000). Es wird auch als unspezifisch bezeichnet, da die eingeleiteten Abwehrmaßnahmen unabhängig vom jeweils eindringenden Erreger aktiv werden. Zu den ersten Abwehrmaßnahmen wird die Barrierefunktion von Epithelien (Haut, Respirationstrakt, Gastrointestinaltrakt, Urogenitaltrakt) gezählt, welche durch mechanische und chemische Prozesse den Eintritt von Bakterien verhindern. Zudem spielen das Flimmerepithel der Lunge, das saure Milieu des Magens und der Vagina und eine Reihe löslicher Faktoren eine tragende Rolle, u.a. anti-mikrobielle Enzyme, die Magensäure und von Schleimhäuten sezernierte antimikrobielle Substanzen, welche eine opsonierende Wirkung haben. Des Weiteren leistet das Komplementsystem einen wichtigen Beitrag als Bestandteil der humoralen Immunantwort (Abbas and Lichtman 2004). Dieses besteht aus einer Kaskade von proteolytischen Enzymen, die nach sequentieller Aktivierung zur Opsonisierung und Lyse von Mikroorganismen führen. Außerdem existiert eine Vielzahl an löslichen Mediatoren. Interferone (IFN) und Interleukine (IL) üben zum einen direkte Effektorfunktionen aus und zum anderen ermöglichen sie neben Chemokinen die Kommunikation zwischen Zellen. Auf zellulärer Ebene vermitteln insbesondere dendritische Zellen sowie Makrophagen, natürliche Killerzellen, Mastzellen und Granulozyten (Eosinophile, Basophile und Neutrophile) die Abwehrmechanismen des angeborenen Immunsystems (Abbas and Lichtman 2004; Janeway 2005). Einleitung 7 Das innate Immunsystem kann zwischen „Selbst“-Antigenen und fremden Pathogenen unterscheiden. Die Erkennung geschieht in hohem Maße über eine limitierte Anzahl Keimbahnkodierter Mustererkennungsrezeptoren (pattern recognition receptors, PRRs). PRRs erkennen sogenannte Pathogen-assoziierte molekulare Muster (pathogen-associated molecular patterns, PAMPs), eine heterogene Gruppe evolutionär konservierter molekularer Strukturen, die für das Überleben von infektiösen Organismen wie Bakterien, Viren, Pilzen und Parasiten essentiell sind, so dass sie kaum einer Variation durch Mutationen unterliegen. Bestimmte dieser invarianten Muster sind spezifische Merkmale von Mikroorganismen und existieren nicht in höheren Eukaryoten, wodurch es dem angeborenen Immunsystem ermöglicht wird zwischen Selbst- und Fremd-Antigenen zu unterscheiden. Klassische PAMPs sind die Strukturen von Lipopolysacchariden (LPS) und Lipoteichonsäuren (LTA), unmethylierte CpG-Dinukleotide, doppelsträngige RNA, Mannane, Flagellin und Peptidoglykan (Janeway 1989; Medzhitov and Janeway 1997). PRRs werden vor allem auf Effektorzellen des angeborenen Immunsystems wie dendritischen Zellen und Makrophagen exprimiert, welche als Erste mit eindringenden Pathogenen in Kontakt kommen. Zu den PPRs werden u.a. Scavenger-Rezeptoren, Mannose-Rezeptoren, Mannosebindendes Lektin, C-reaktives Protein, nucleotide oligomerization domain (NOD)-like Rezeptoren, retinoic acid-inducible gene-like Rezeptoren und Toll-like-Rezeptoren (TLRs) gezählt (Akira and Takeda 2004; Janeway 2005; Meylan, Tschopp et al. 2006). Die Familie der TLRs gehört zu den bestuntersuchtesten PRRs. Die Membran-ständigen Toll-likeRezeptoren lösen nach Erkennung bestimmter PAMPs eine intrazelluläre Signalkaskade aus, die zur Expression verschiedener Gene, z.B. proinflammatorischer Zytokine, Chemokine und kostimulatorischer Moleküle, führt und somit die Induktion von adaptiven Immunantworten einleitet. Die Membran-ständigen TLRs werden bei Säugetieren entweder an der Zelloberfläche oder in endosomalen/ lysosomalen Organellen exprimiert. Letztere detektieren hauptsächlich mikrobielle Nukleinsäuren wie doppelsträngige RNA (TLR3), einzelsträngige RNA (TLR7) und doppelsträngige DNA (TLR9). TLRs auf der Zelloberfläche erkennen dort zugängliche PAMPs meist mikrobieller und parasitärer Bestandteile, beispielsweise LPS (TLR4), LTA (TLR1/TLR2 und TLR2/TLR6) und Flagellin (TLR5) (Akira and Takeda 2004). Die Expression der verschiedenen TLRs ist Zelltyp-spezifisch. 1.1.1 Dendritische Zellen Dendritische Zellen (DCs) sind eine der ersten Zellen des angeborenen Immunsystems, welche auf eindringende Pathogene treffen und die Immunantwort einleiten. Sie sind über die Expression einer Reihe verschiedener Mustererkennungsrezeptoren wie Toll-like-Rezeptoren (Akira, Takeda et al. 2001), Scavenger-Rezeptoren (Aderem and Ulevitch 2000) und Peptidoglykan-Erkennungsproteine (Gottar, Gobert et al. 2002) in der Lage Pathogen-assoziierte molekulare Muster zu erkennen und Abwehrmaßnahmen zur Elimination der Pathogene einzuleiten. Erkennt eine DC durch Bindung an einen (Oberflächen-) Rezeptor PAMPs, wird die Zelle aktiviert. Sie nimmt das Antigen auf, prozessiert es, um es dann als reife Antigen-präsentierende Zelle naiven T-Zellen zu präsentieren und induziert damit adaptive Immunantworten. Die DC erfüllt damit als Antigen-präsentierende Zelle wichtige regulatorische Funktionen zwischen dem innaten und adaptiven Immunsystem. Die Migration der DCs zu naiven T-Zellen in die drainierenden Lymphknoten wird von einer signifikanten Hochregulierung von major histocompatibility complex (MHC)-Molekülen begleitet (Cella, Engering et al. 1997), über welche die Präsentation der Antigene und die Erkennung durch T-Zellrezeptoren erfolgt, während die Fähigkeit zur Aufnahme von Antigen eingestellt wird. Zusätzlich kommt es zu einer erhöhten Expression von z.B. intracellular adhesion molecule-1 (ICAM-1) und von kostimulatorischen Molekülen wie CD80, CD86 und CD40, die das kostimulatorische Sekundärsignal zur vollständigen Aktivierung naiver T-Zellen liefern. Aktivierte DCs erlangen zudem eine erhöhte Bereitschaft zur Sekretion T-Zell stimulierender Zytokine und Chemokine (Janeway 2005). Hat eine naive T-Helfer (Th)- Zelle beide Aktivierungssignale erhalten, kann sie sich zu einer T-Effektorzelle Einleitung 8 differenzieren. Das Milieu von Zytokinen, das von den Antigen-präsentierenden DCs erzeugt wird, beeinflusst, in welche Effektorklasse (Th1 oder Th2) sich die Th-Zellen entwickeln. Dabei ist die Art, in der DCs auf die Differenzierung der Th-Zellen Einfluss nehmen, abhängig von der Aktivierung der DCs selbst. DCs werden durch PAMPs der verschiedenen Pathogene, die sie erkennen, und Gewebefaktoren, die von zahlreichen residenten Gewebezellen und Immunzellen in ihrer Nähe wie Epithelzellen, natürliche Killerzellen, Mastzellen, Makrophagen und Fibroblasten als Antwort auf die Pathogen-Invasion exprimiert werden, unterschiedlich polarisiert (Kapsenberg 2003). Die Expression von Interleukin-12 (IL-12) durch polarisierte, reife DCs z.B. führt eher zu einer Entwicklung von Th1Zellen, die über die Sekretion von z.B. IFN-γ eine zelluläre Immunabwehr gegen intrazelluläre Bakterien und Viren vermitteln. Th2-Zellen hingegen, welche z.B. durch IL-4 induziert werden, regulieren die humorale Immunantwort und Immunmechanismen gegen extrazelluläre Parasiten über die Produktion von z.B. IL-4, IL-5 und IL-13. Dendritische Zellen entwickeln sich wie viele andere Zellpopulationen aus multipotenten hämatopoietischen Stammzellen aus dem Knochenmark. Sie sind sehr heterogen (Shortman and Liu 2002), denn obwohl alle DCs zur Aufnahme, dem Prozessieren und der Präsentation von Antigen fähig sind, unterscheiden sich die verschiedenen DC-Subtypen doch anhand ihre Lokalisation im Organismus, den unterschiedlichen Migrationswegen, den genauen immunologischen Funktionen und in ihrer Abhängigkeit von Infektionen oder inflammatorischen Signalen für ihre Entwicklung (Shortman and Naik 2007). So werden DCs in wenigstens zwei Hauptgruppen eingeteilt, plasmazytoide DCs (plasmacytoid DCs, pDCs) und konventionelle dendritische Zellen (conventional DCs, cDCs). Plasmazytoide DCs werden in ihrem Grundzustand zu Vorläufer-DCs gezählt. Dies sind nichtdendritische, relativ langlebige und zirkulierende Zellen, die sich erst nach Stimulierung durch virale oder bakterielle Antigene zu pDCs mit dendritischer Form und Antigen-prozessierenden und -präsentierenden Eigenschaften entwickeln und große Mengen an Typ I Interferon ausschütten (Grouard, Rissoan et al. 1997; Liu 2005). Konventionelle DCs können weiter unterteilt werden in wandernde DCs (migratory DCs, mDCs) und im Lymphgewebe-verweilende DCs (lymphoid-tissue-resident DCs, lyDCs) (Shortman and Naik 2007). Zu den mDCs werden Langerin+ Langerhanszellen gezählt sowie die meisten DCs in peripheren, nicht-lymphoiden Geweben wie dermale DCs und interstitielle DCs (Romani, Holzmann et al. 2003). mDCs agieren als Wächter im peripheren Gewebe und migrieren nach AntigenAufnahme zu den peripheren Lymphknoten, um dort T-Zellen Antigen zu präsentieren. Wenn sie den Lymphknoten erreichen, haben mDCs in der Regel einen vollentwickelten Phänotyp erreicht und die Möglichkeit zur Antigenaufnahme heruntergefahren (Shortman and Naik 2007). LyDCs umfassen die meisten DCs des Thymus und der Milz (Vremec, Pooley et al. 2000) und können anhand der Expression verschiedener Oberflächenmoleküle in weitere Subtypen unterteilt werden. Anders als mDCs migrieren sie nicht zu Lymphknoten sondern nehmen vor Ort Fremd- und Selbst-Antigene auf und präsentieren diese. Sie haben einen weniger entwickelten Phänotyp, sind aber aktiv in AntigenAufnahme und -Prozessieren (Shortman and Naik 2007). Bei früheren Einteilungen wurden dendritische Zellen anhand spezifischer Oberflächenmarker in plasmazytoide, lymphoide und myeloide DCs sowie Langerhanszellen unterteilt. 1.1.2 Mastzellen Oft finden erste Immunreaktionen gegen eindringende Pathogene in der Haut statt. Neben DCs ist die Mastzelle unter den Zellen des angeborenen Immunsystems eine der Prominentesten dort. Mastzellen befinden sich ebenso in großer Zahl in anderen Bereichen des Körpers, die in direktem Kontakt mit der Umwelt stehen wie den Atmungsorganen, das Lungengewebe und der gastrointestinale Trakt, wo sie im Bereich der Epithelien, insbesondere in direkter Nähe zu Blut- und Lymphgefäßen und Nerven, lokalisiert sind. Einleitung 9 Mastzellen exprimieren, abhängig von ihrer Lokalisation sowie ihres Differenzierungs- und Aktivierungsstatus, eine Reihe verschiedener Rezeptoren, durch welche es auf unterschiedlichen Wegen zur Aktivierung der Zelle und Ausschüttung verschiedener Substanzen kommen kann. Die bekannteste physiologische Aktivierung von Mastzellen erfolgt über die Quervernetzung des hochaffinen IgE-Rezeptors FcεRI (high affinity immunoglobulin E (IgE)-binding receptor). Im Gegensatz zu anderen Fc-Rezeptoren wird der FcεRI ausschließlich von Mastzellen und Basophilen exprimiert. Er bindet reversibel, jedoch mit hoher Affinität die Fc-Region freier, monomerer IgE Moleküle, dabei die Fab-Region zur Antigen-Erkennung präsentierend. FcεRI sind in vivo stets mit IgEAntikörpern beladen. Wird ein Antigen über die IgE-Moleküle von zwei oder mehreren FcεRI gebunden, kommt es zu einer Quervernetzung („crosslinking“) der FcεRI, woraufhin eine intrazelluläre Signaltransduktionskaskade ausgelöst wird, die in der Regel zur Ausschüttung inflammatorischer Mediatoren führt (Kambayashi, Larosa et al. 2009). Mastzellen exprimieren aber auch neben dem FcεRI u.a. IgG-Rezeptoren FcγRIIa (CD32a), FcγRI (CD64), verschiedene G-Protein gekoppelte Rezeptoren wie Prostaglandin E2 Rezeptor, Komplementrezeptoren C3a und C5a, verschiedene Zytokin-Rezeptoren, Chemokin-Rezeptoren und Toll-like Rezeptoren, über die sie aktiviert werden können (Stone, Prussin et al. 2010). Somit gibt es neben der Antikörper-vermittelten Mastzellaktivierung über FcεRI auch eine Reihe IgE-unabhängiger Aktivierungsmechanismen oder Stimuli, die ebenfalls zur Aktivierung der Mastzelle führen können. Die Mastzell-Aktivierung kann durch verschiedene zeitliche Abfolgen in drei Phasen eingeteilt werden, bei denen verschiedene von der Mastzelle produzierte Mediatoren in die Umwelt abgegeben werden. Diese führen u.a. zu einer erhöhten vaskulären Permeabilität der Gefäße und Einwanderung inflammatorischer Zellen in das umliegende Gewebe (Marshall 2004; Kambayashi, Larosa et al. 2009). Innerhalb weniger Sekunden bis Minuten können in der ersten Phase durch den Prozess der Degranulation verschiedene vorgeformte, in Granula gespeicherte Mediatoren in das umliegende Gewebe freigesetzt werden. Dies sind u.a. Proteasen mit Tryptase-, Chymase- oder Carboxypeptidase-Aktivität, die unterschiedliche Rollen in Gewebeumstrukturierung und der Zellrekrutierung spielen (Marshall 2004). Daneben werden vasoaktive Amine wie Histamin freigesetzt, die zu einer erhöhten vaskulären Permeabilität der benachbarten Gefäße führen und zu einer erleichterten Einwanderung inflammatorischer Zellen und Mediatoren in das Gewebe. Mastzell-Granula enthalten außerdem Proteoglykane wie Heparin, welche eine wichtige Rolle als Depot für Chemokine wie Tumor Nekrose Faktor (TNF) und Wachstumsfaktoren wie Vascular endothelial growth factor-A (VEGF-A) spielen, die zur Rekrutierung von Effektor-Zellen bzw. der Steigerung der Angiogenese und erhöhter Permeabilität der Gefäße führen. In einer zweiten, zeitlich leicht verzögerten Phase kommt es zur Bildung von Lipid-Mediatoren und Arachidonsäuremetaboliten, die zusätzlich die Gefäßdurchlässigkeit erhöhen und zur Rekrutierung von Eosinophilen bzw. Neutrophilen beitragen. In der sich über Stunden ausdehnenden dritten Phase werden verschiedene Zytokine, Chemokine und Wachstumsfaktoren neu synthetisiert und sekretiert, die zur fortwährenden Rekrutierung inflammatorischer Zellen führen. 1.2 Das adaptive Immunsystem Die Abwehrmechanismen des adaptiven Immunsystems unterscheiden sich von denen des angeborenen Immunsystems anhand der hochspezifischen Erkennung von Antigenen durch B- und TLymphozyten und der Ausbildung eines immunologischen Gedächtnisses. Durch somatische Rekombination, klonale Selektion und Hypermutation wird die Spezifität für eine große Anzahl verschiedener Antigene gewährleistet. T- und B-Lymphozyten entwickeln sich aus hämatopoietischen Stammzellen im Knochenmark, wobei die Reifung von T-Zellen im Thymus erfolgt während sich B-Zellen mit Ausnahme von B1-Zellen im Knochenmark entwickeln. B-Zellen proliferieren nach Aktivierung durch eine spezifische AntigenErkennung über ihren B-Zell-Rezeptor in Plasmazellen, welche große Mengen von Antikörpern Einleitung 10 (Immunglobulinen) sekretieren, durch welche Pathogene opsoniert und eliminiert werden können (Janeway 2005). T-Zellen differenzieren sich in mehrere Subpopulationen, welche u.a. CD8+ zytotoxische T-Zellen, CD4+ T-Helfer-Zellen und regulatorische T-Zellen (Tregs) umfassen. Durch somatische Rekombination wird ein großes Repertoire von T-Zellen mit unterschiedlichen Antigen-spezifischen T-Zell-Rezeptoren erschaffen. Doch nur Zellen, welche von MHC-Molekülen präsentierte körpereigene Antigene über ihren T-Zellrezeptor erkennen und mit mittlerer Affinität binden und keine Autoantigene erkennen, reifen aus und gelangen als periphere, naive T-Lymphozyten in die Blutzirkulation. Während dieses Selektionsprozesses entscheidet sich auch über die Bindung des T-Zell-Rezeptors und seiner Korezeptoren an MHC Klasse I (MHC-I) oder II (MHC-II) Moleküle, ob sich ein T-Lymphozyt zu einer CD8- oder CD4-positiven T-Zelle entwickelt (Janeway 2005). CD4+ T-Zellen agieren als Regulatoren (sogenannten T-Helferzellen) der zellulären und humoralen (Antikörper-vermittelten) Immunantwort. CD8+ zytotoxische T-Zellen lysieren Tumorzellen und Zellen, welche mit intrazellulären Pathogenen (Viren und Bakterien) infiziert wurden, nach MHC-I vermittelten AntigenKontakt über die Sekretion zytotoxischer Proteine. Von CD8+ T-Zellen sezerniertes IFN-γ spielt zudem eine wichtige Rolle in der Induktion der Expression von MHC-I Molekülen auf Zellen und der Aktivierung von Makrophagen (Glik and Douvdevani 2006). Zur Aktivierung von T-Zellen werden zwei Signale benötigt. Zunächst erhält eine T-Zelle durch die Interaktion ihres spezifischen T-Zell-Rezeptors mit einem Antigen, präsentiert über MHC-I oder IIPeptid-Komplexe auf einer Antigen-präsentierenden Zelle das Primär-Signal. Über MHC Klasse I Moleküle, welche auf der Zelloberfläche von nahezu allen nukleären Zellen exprimiert werden, erfolgt die Präsentation zytosolischer Peptide, die von CD8+ T-Zellen erkannt werden. MHC Klasse II Moleküle werden primär von professionellen Antigen-präsentierenden Zellen wie DCs, Makrophagen und B-Zellen exprimiert. Sie präsentieren Antigene von meist extrazellulären Pathogenen wie Bakterien oder Parasiten, welche endozytotisch von den Zellen aufgenommen und degradiert wurden und werden vom T-Zell-Rezeptor auf CD4+ T-Zellen erkannt. Das Sekundär-Signal erfolgt über die Erkennung kostimulatorischer Moleküle wie z.B. CD80 oder CD86 auf der Oberfläche der Antigenpräsentierenden Zelle durch die Interaktion mit dem T-Zell eigenen CD28-Rezeptor (Janeway 2005). Die spezifische Antigen-Erkennung und kostimulatorischen Signale führen zur Differenzierung naiver CD4+ T-Helferzellen (Th) in zwei unterschiedliche Subpopulationen, den Th1 oder Th2 EffektorZellen. Dabei beeinflusst das Zytokinmilieu, das nach Antigenkontakt durch die Antigenpräsentierenden Zellen erzeugt wird, die Polarisierung zur Th1 oder Th2 Differenzierung. IL-4 z.B. ist für die Induktion von Th2-Zellen nötig (Swain, Weinberg et al. 1990) und wird von CD4+ Gedächtniszellen, Mastzellen etc. produziert, während IL-12 die Differenzierung zu Th1-Zellen induziert (Seder, Gazzinelli et al. 1993) und von dendritischen Zellen und Makrophagen produziert wird. Th1-Zellen sezernieren typischerweise IL-2 und IFN-γ wohingegen Th2-Zellen hauptsächlich IL-4, IL-5, IL-10 oder IL-13 exprimieren. Dabei erleichtern Th1-Zellen generell Zell-abhängige Immunantworten, z.B. durch die Aktivierung von Makrophagen und zytotoxischen T-Zellen zur Abwehr von intrazellulären Erregern. Th2-Zellen beeinflussen über die spezifische Zytokin-Produktion währenddessen die humorale Immunantwort hauptsächlich gegen extrazelluläre Pathogene wie Bakterien und helminthische Parasiten, indem B-Zellen zur Proliferation und Differenzierung zu Antikörper-produzierenden Plasmazellen und Gedächtniszellen angeregt werden (Delves and Roitt 2000; Janeway 2005). Die Polarisierung der Th-Zellen in Th1- oder Th2-Zellen vollzieht sich meist in sekundären lymphoiden Organen, welche dem Infektionsherd nahe liegen und zu denen naive CD4+ T-Zellen vorzugsweise migrieren. Die differenzierten Th-Zellen müssen zur Ausübung ihrer spezifischen Effektorfunktion die lymphoiden Organe wieder verlassen und zur Infektionsstelle geleitet werden. So können über eine unterschiedliche Expression von Adhäsionsmolekülen und ChemokinRezeptoren auf ihrer Zelloberfläche die unterschiedlichen T-Zellen zu spezifischen Stellen im Körper gelenkt werden (Janeway 2005). Durch die unterschiedliche Expression von Chemokin-Rezeptoren Einleitung 11 auf Th1- und Th2-Zellen kann eine spezifische Rekrutierung erzielt werden (Oo, Shetty et al. 2010). Beispielsweise exprimieren Th2-Zellen bevorzugt die Chemokin-Rezeptoren CCR4 und CCR8, welche als Rezeptoren für das Th2-assoziierte Chemokin CCL17 dienen (Bonecchi, Bianchi et al. 1998; Iellem, Mariani et al. 2001). Eine weitere Subpopulation von T-Zellen sind neben anderen die regulatorischen T-Zellen (Tregs). Sie sind in der Lage, die Aktivierung anderer T-Zellen zu unterdrücken. Ihre Hauptfunktion ist damit die Einschränkung der Pathologie von Infektionen durch Dämpfung inflammatorischer Immunreaktionen sowie die Kontrolle von Autoimmunreaktionen (Roncarolo, Gregori et al. 2006; Sakaguchi, Ono et al. 2006). Dies geschieht zum einen über eine Zellkontakt-abhängige Suppression oder über die Inhibition mit immunsuppressiven Zytokinen wie IL-10 und TGF-β. Tregs werden in wenigstens zwei Subpopulationen unterteilt. Tr-1 Zellen produzieren IL-10 und werden als adaptiv bezeichnet, da sie sich aus naiven CD4+CD25- T-Zellen nach Antigen-Stimulierung in der Peripherie entwickeln (Roncarolo, Gregori et al. 2006). CD4+Foxp3+ T-regulatorische Zellen, die mehrheitlich CD25 konstitutiv exprimieren und deren regulatorischer Phänotyp sich durch die Expression des Transkriptionsfaktors Foxp3 auszeichnet, entwickeln sich entweder im Thymus (natürliche CD4+Foxp3+ T-regs) oder aus naiven peripheren CD4+ T-Zellen (induzierte CD4+Foxp3+ Tregs) (Jordan, Boesteanu et al. 2001; Sakaguchi, Ono et al. 2006; Taylor, van der Werf et al. 2009). Man unterscheidet zudem zwischen IL-10-exprimierenden und IL-10-negativen CD4+Foxp3+ Tregulatorische Zellen (Maynard, Harrington et al. 2007). 1.3 Chemokine Für eine effiziente Immunabwehr ist es unabdingbar, dass sich Leukozyten wie T-Zellen am richtigen Ort zur richtigen Zeit befinden. Daher wird ein System wie das Chemokin-System benötigt, um die Migration und Positionierung von Effektor- und regulatorischen Leukozyten-Populationen in lymphoiden und nicht-lymphoiden Geweben zu regulieren (Oo, Shetty et al. 2010). Chemokine sind etwa 8-14kDa große Heparin-bindende Zytokine ähnlicher Struktur, die die Rekrutierung und Aktivierung verschiedener Leukozyten-Subpopulationen induzieren (Zlotnik and Yoshie 2000). Manche Chemokine haben zusätzlich zur chemotaktischen Aktivität eine regulierende Wirkung auf die Hämatopoese und Angiogenese (Cacalano, Lee et al. 1994; Nagasawa, Hirota et al. 1996). Generell werden Chemokine in zwei funktionelle Subklassen unterteilt, in inflammatorische oder homöostatische/ konstitutive Chemokine. Diese funktionelle Einteilung beruht darauf, ob Chemokine durch eine Entzündung induziert werden oder ob sie konstitutiv exprimiert und in die homöostatische Immunregulation involviert sind. Manche Chemokine besitzen beide Funktionalitäten (Oo, Shetty et al. 2010). Inflammatorische Chemokine werden in entzündetem Gewebe von lokalen oder das Gewebe infiltrierenden Zellen nach Stimulation durch pro-inflammatorische Zytokine oder nach Kontakt mit pathogenen Erregern exprimiert. Durch die Erkennung von Pathogenen über PRRs auf Epithel-, Bindegewebs- und Immunzellen werden Chemokine bereits sehr früh nach der Infektion sezerniert. Sie rekrutieren zunächst Zellen des angeborenen Immunsystems ins entzündete Gewebe, darunter DCs, Granulozyten, Makrophagen, Natürliche Killerzellen und Mastzellen, welche alle inflammatorische Chemokin-Rezeptoren auf ihren Oberflächen exprimieren. Nach Antigenspezifischer Aktivierung von Lymphozyten durch aktivierte DCs rekrutieren dann inflammatorische Chemokine Antigen-spezifische T-Effektor-Zellen zum Entzündungsherd. Gleichzeitig werden auch regulatorische T-Zellen angelockt, die die Entzündungsreaktionen wieder supprimieren, was entscheidend für den Ausgang der lokalen Entzündungsreaktion ist (Oo, Shetty et al. 2010). Homöostatische Chemokine hingegen werden in bestimmten Bereichen lymphoider Gewebe (Knochenmark, Thymus, sekundäre lymphoide Organe) sowie in der Haut oder Mucosa exprimiert. Einleitung 12 Diese konstitutiv freigesetzten Chemokine haben Einfluss auf die Migration und Positionierung von Zellen, auf die Antigen-Aufnahme in sekundären lymphoiden Geweben und die Immunüberwachung (Oo, Shetty et al. 2010). Alle Chemokine werden zudem in vier strukturelle Unterfamilien aufgeteilt, wobei die Einteilung auf der Anordnung der zwei N-terminalen Cystein-Reste beruht. Bei der großen Gruppe der CXCChemokine befindet sich zwischen den ersten beiden Cystein-Resten eine Aminosäure, während in der zweiten großen Gruppe der CC-Chemokine beide benachbart sind. In der kleinen Gruppe der CChemokine fehlen Cystein eins und drei der typischen Chemokin-Struktur und CX3C-Chemokine haben 3 Aminosäuren zwischen den ersten zwei Cystein-Resten (Zlotnik and Yoshie 2000). Die verschiedenen Chemokine üben ihre chemotaktische Wirkung über die Interaktion mit spezifischen 7-Transmembran-G-Protein-gekoppelten Rezeptor-Molekülen aus, die auf der Oberfläche der Zielzellen exprimiert werden. Die Chemokin-Rezeptoren werden entsprechend ihrer Liganden ebenfalls in 4 Gruppen eingeteilt, abhängig nach der Anordnung der N-terminalen CysteinReste ihrer Chemokin-Liganden (Zlotnik and Yoshie 2000). Die Bindung eines Chemokins an seinen Rezeptor löst die Abspaltung der Gα1 von den Gβ-γ Untereinheiten des heterotrimeren G-Proteins aus, was zu einem Kalziuminflux in der Zelle und der Aktivierung der Phosphatidylinositol 3-Kinase und Rho-GTPase Signalwege führt. Das humane Chemokin-System umfasst mehr als 50 Chemokine und 20 Chemokin-Rezeptoren (Oo, Shetty et al. 2010). Das murine Chemokin-System ist dem humanen sehr ähnlich. Viele Chemokine der Maus können eindeutig den humanen Homologen zugeordnet werden (z.B. CCL5/RANTES oder CCL17/TARC), während für einige wenige Chemokine noch keine humanen Homologe beschrieben wurden. Für manche humanen Chemokine (z.B. CXCL8/IL-8) konnte bisher kein murines Homolog gefunden werden (Zlotnik and Yoshie 2000). 1.3.1 Thymus and activation-regulated chemokine (TARC/CCL17) Thymus and activation-regulated chemokine (TARC/CCL17) ist ein Mitglied der Gruppe der CCChemokine, das beide funktionellen Eigenschaften der Chemokine in sich vereint, d.h. CCL17 wird konstitutiv im Thymus exprimiert (Imai, Yoshida et al. 1996), kann aber auch von Zellen wie DCs nach Aktivierung über z.B. Toll-like Rezeptoren als inflammatorisches Chemokin induziert werden (Alferink, Lieberam et al. 2003). CCL17 wird insbesondere von DCs (Alferink, Lieberam et al. 2003; Gorski, Shin et al. 2003), darunter Langerhans-Zellen (Xiao, Fujita et al. 2003), exprimiert. Aber auch für andere Zelltypen konnte eine Expression von CCL17 nachgewiesen werden, so für Endothelzellen (Campbell, Haraldsen et al. 1999), Keratinozyten (Vestergaard, Yoneyama et al. 1999), bronchialen Epithelzellen (Sekiya, Miyamasu et al. 2000), Fibroblasten (Yu, Koga et al. 2002), alternativ aktivierte Makrophagen (Katakura, Miyazaki et al. 2004), Mastzellen (Oliveira and Lukacs 2001), B-Lymphozyten (Alferink, Lieberam et al. 2003) und Eosinophilen (Liu, Bates et al. 2007). Durch die Expression von CCL17 werden Leukozyten, die den Chemokin-Rezeptor CCR4 tragen, zum Entzündungsherd rekrutiert. CCR4 gilt als hochaffiner Rezeptor für CCL17 und CCL22 (Imai, Baba et al. 1997; Bonecchi, Bianchi et al. 1998), der speziell von differenzierten Th2-Zellen (Bonecchi, Bianchi et al. 1998), CD25+ regulatorischen T-Zellen (Iellem, Mariani et al. 2001) und cutaneous lymphocyte antigen-positiven (CLA+) skin-homing Lymphozyten (Campbell, Haraldsen et al. 1999) hoch exprimiert wird. Zudem wird CCR4 auf Mastzellen (Juremalm, Olsson et al. 2002), natürlichen Killerzellen (Inngjerdingen, Damaj et al. 2000), Makrophagen (Chvatchko, Hoogewerf et al. 2000), CD8+ T-Zellen (Yung, Mo et al. 2007) und B-Zellen (Johansson, Ahlstedt et al. 2005) exprimiert. CCL17 wird ebenfalls als Ligand für CCR8 gehandelt, wobei in der Literatur gegensätzliche Meinungen dazu herrschen (Bernardini, Hedrick et al. 1998; Garlisi, Xiao et al. 1999). CCR8 wird von Einleitung 13 einer kleinen Untergruppe zirkulierender Lymphozyten (Gombert, Dieu-Nosjean et al. 2005), CD25+ regulatorischen T-Zellen (Iellem, Mariani et al. 2001), natürlichen Killerzellen (Inngjerdingen, Damaj et al. 2000), Langerhans-Zellen und interstitialen DCs (Gombert, Dieu-Nosjean et al. 2005) exprimiert. Nach der Entdeckung des Chemokins CCL17 im Jahre 1996 wurde vermutet, dass es eine wichtige Rolle in der Entwicklung von T-Zellen im Thymus als auch in der Rekrutierung und Aktivierung von Effektor-T-Zellen haben könnte (Imai, Yoshida et al. 1996). Es zeigte sich, dass CCL17, insbesondere durch das spezifische Expressionsprofil seines Rezeptors CCR4 (Bonecchi, Bianchi et al. 1998), wichtig für die Rekrutierung von Th2-Zellen und der Aufrechterhaltung von Th2-Immunantworten ist (Imai, Nagira et al. 1999). Allergie-Studien zeigten, dass das Expressionslevel von CCL17 mit dem Schweregrad der Erkrankungen in einigen chronisch allergischen Pathologien korreliert wie z.B. Asthma (Sekiya, Yamada et al. 2002; Hirata, Arima et al. 2003; Leung, Wong et al. 2003), Atopische Dermatitis (JahnzRozyk, Targowski et al. 2005; Tsunemi, Saeki et al. 2006) und kutanem Lupus Erythematodes (Wenzel, Henze et al. 2005). Auch bei der Allergen-induzierten Rekrutierung von Th2-Zellen ins betroffene Gewebe spielt die Interaktion von CCL17 mit CCR4 eine wichtige Rolle (Romagnani 2002). 1.4 Humane Filariose Es gibt zahlreiche humanpathogene Helminthen, die im Intestinaltrakt oder im Gewebe ihres Wirts leben. Die unter dem Begriff der Filariose zusammengefassten Onchozerkose (Flussblindheit) und lymphatische Filariose sind parasitäre Infektionen hervorgerufen durch gewebsspezifische Helminthen. Von insgesamt 8 humanpathogenen Filarien-Spezies induzieren drei die lymphatische Filariose, Wuchereria bancrofti, Brugia malayi und Brugia timori, während Onchocerca volvulus der Erreger der Onchozerkose ist. Ca. 90% der etwa 120 Millionen geschätzten Fälle von lymphatischer Filariose werden durch W. bancrofti verursacht und kommen weltweit in 83 meist tropischen Ländern vor. Die restlichen 10% werden durch Infektionen mit B. malayi und B. timori herbeigeführt, die im Südosten und Osten Asiens bzw. Südost-Indonesien vorkommen (Taylor, Hoerauf et al. 2010). Die Infektion mit diesen Filarien wird als lymphatische Filariose bezeichnet, da die durch Moskitos übertragenden parasitären Larven sich zu adulten Würmern entwickeln, die sich in Nestern in Lymphgefäßen, meistens in denen der Extremitäten und der männlichen Genitalien, ansiedeln. Dies kann bei einigen Erkrankten zu Lymphödemen in den Extremitäten, Elefantiasis oder Hydrozelen führen (WHO 2000). Die Onchozerkose ist in 34 Ländern endemisch, darunter 27 in West- und Zentralafrika, 6 in Südund Mittelamerika und im Jemen im Süden der Arabischen Halbinsel. Es wird geschätzt, dass ca. 90 Millionen Menschen in Afrika gefährdet sind an der Onchozerkose zu erkranken und fast 37 Millionen bereits mit O. volvulus infiziert sind (Basanez, Pion et al. 2006). Die Onchozerkose wird häufig auch als Flussblindheit bezeichnet, da es bei schweren Fällen zur Erblindung der betroffenen Erkrankten kommen kann und die Infizierten in der Nähe von schnell-fließenden, sauerstoff-reichen Wasserläufen siedeln, wo die als Vektor dienenden Kriebelmücken der Gattung Simulium brüten (Thylefors and Alleman 2006). 1.4.1 Onchozerkose Die Kriebelmücke Simulium ssp. als obligater Zwischenwirt für O. volvulus nimmt während einer Blutmahlzeit an infizierten Individuen Mikrofilarien (Larvenstadium 1, L1) auf. Innerhalb von 10-12 Tagen entwickeln sich die L1 Larven über zwei Häutungen zu infektiösen Larven (Larvenstadium 3, L3) im Vektor. Bei einer erneuten Blutmahlzeit erfolgt durch den Stich des Vektors die Transmission der L3 Larven in die Haut des Wirts. Das adulte Stadium erlangen die Larven über zwei weitere Einleitung 14 Häutungen innerhalb von 6-12 Monaten. Die adulten, geschlechtsreifen Weibchen, welche ein Alter von durchschnittlich 9-10 Jahren erreichen, sammeln sich in subkutanen oder in tiefer gelegenen intramuskulären Knoten (Onchozerkomen) und produzieren nach Paarung mit adulten Männchen Millionen von Mikrofilarien. Es wird vermutet, dass die 3-8 cm langen Männchen dabei von Knoten zu Knoten wandern, um die mit einer Länge von 30-80cm wesentlich größeren Weibchen zu begatten. Die aus den Knoten entlassenen Mikrofilarien, die etwa 6-30 Monate überleben können, migrieren durch subkutanes sowie konjunktivales und intraokulares Gewebe, und können durch den erneuten Stich einer Simulie aufgenommen werden (Hoerauf and Brattig 2002; Guerrant, Walker et al. in Vorbereitung). Die Pathologie der Onchozerkose in Haut und Auge wird durch den Tod von Mikrofilarien ausgelöst, welche Ziel der inflammatorischen Immunreaktionen des Wirts werden. Neben den Onchozerkomen werden Symptome wie Dermatitis in unterschiedlichen Schweregraden und Augenschädigung bis hin zur Erblindung verursacht. Anhand der Immunreaktionen gegen die Infektion mit den Parasiten können innerhalb der Onchozerkose drei klinische Gruppen klassifiziert werden. Die häufigste Manifestation der Krankheit in endemischen Gebieten ist die generalisierte Onchozerkose, welche durch eine massive Anzahl an dermalen Mikrofilarien und Onchozerkomen charakterisiert ist. Aber trotz der hohen Antigendichte werden nur eine schwache Entzündungsreaktion in der Haut und relativ milde Reaktionen wie Atrophie und Pigmentveränderungen ausgelöst, was die Fähigkeit der Filarien widerspiegelt, Immunmechanismen des Wirts zu supprimieren, um das eigene Überleben zu garantieren. Im Gegensatz dazu bleiben einige wenige Individuen, die als putativ immun oder endemisch normal bezeichnet werden, in hyperendemischen Gebieten frei von Infektionen trotz gleich hoher Exposition zum Parasiten. Eine Minderzahl von Patienten, die als Sowda-Patienten bezeichnet werden, entwickelt eine chronisch-hyperreaktive Onchodermatitis. Sowda-Patienten leiden an papulöser Dermatitis, Pruritus, hyperpigmentierten Hautveränderungen mit Läsionen und Lymphadenitis. Charakteristisch sind eine geringe Mikrofilariendichte und wenige adulte Würmer in großen Knoten. Die starke Abwehr der Parasiten in Sowda-Patienten impliziert das Fehlen regulatorischer Immunmechanismen, woraus hyperreaktive Immunantworten resultieren, die zu dem oben beschriebenen schweren Krankheitsbild führen (Hoerauf and Brattig 2002). 1.4.2 Lymphatische Filariose Die lymphatische Filariose (LF) ist die zweithäufigste Ursache für chronische Behinderungen weltweit (WHO 1997). Neben den medizinischen Problemen haben schwächende und entstellende chronische Krankheitsmanifestationen (besonders Lymphödeme, Elephantiasis und Hydrozelen) schwere soziale und psychologische Konsequenzen für die Betroffenen in endemischen Gebieten (Dreyer, Noroes et al. 1997; WHO 1997). Der Lebenszyklus von W. bancrofti bzw. von Brugia ssp ist dem von O. volvulus sehr ähnlich. Anders als bei O. volvulus leben die adulten Würmer in den lymphatischen Gefäßen ihrer humanen Wirte, paaren sich dort und produzieren tausende von Mikrofilarien. Diese werden vom Zwischenwirt mit der Blutmahlzeit aufgenommen, in dem sie sich über zwei Häutungen zu infektiösen Larven entwickeln. Diese können dann mit der nächsten Blutmahlzeit auf einen neuen Wirt übertragen werden und migrieren durch die Haut in die lymphatischen Gefäße, um sich dort über zwei weitere Häutungen zu adulten Würmern zu entwickeln. Die adulte Filarien können für mehr als 20 Jahre überleben und Mikrofilarien bilden, im Durchschnitt ist die Lebensspanne jedoch kürzer. Weibliche W. bancrofti werden durchschnittlich 80-100cm lang, Männchen erreichen eine Länge von etwa 40cm. Die adulten Brugia ssp werden jeweils nur halb so lang. Als Zwischenwirte dienen mehrere Mücken-Spezies (Anopheles, Culex, Aedes, Mansonia ssp) (Cook and Zumla 2009; Pfarr, Debrah et al. 2009). Einleitung 15 In den Endemie-Gebieten für lymphatische Filariose sind drei verschiedene Gruppen von Individuen anzutreffen. Asymptomatische Mikrofilarämie ist die oft am häufigsten vorkommende Manifestation der LF und ähnelt der generalisierten Onchozerkose. Patienten mit Asymptomatischer Mikrofilarämie zeigen trotz hoher Mikrofilariendichte im Blut keine klaren Anzeichen für eine klinische Erkrankung (Melrose 2002). Es wird angenommen, dass eine durch die Filarien induzierte Immunsuppression das Überleben der Parasiten verlängert und die Ausbildung von Pathologien verhindert (Ottesen 1992). Einige Individuen sind in der Lage Mikrofilarien abzuwehren, entwickeln dabei eine klinische Erkrankung und ähneln damit Sowda-Patienten bei der Onchozerkose. Durch Immunreaktionen gegen tote oder sterbende adulte Würmer kommt es zu episodischen Attacken von Lymphangitis (acute filarial lymphangitis, AFL). Hierbei handelt es sich um lokale Entzündungsreaktionen, welche meistens einen milden Verlauf zeigen und selten in Lymphödeme resultieren (Dreyer, Medeiros et al. 1999; Melrose 2002). Sekundäre bakterielle Infektionen, nicht der Tod von adulten Würmern per se, lösen akute Dermatolymphangioadenitis (ADLA) aus. Diese lokalen Entzündungsreaktionen führen oft zu Ödemen in den betroffenen Gliedmaßen, welche sich in manchen Fällen zu chronischen Lymphödemen und Elephantiasis entwickeln können (Dreyer, Medeiros et al. 1999). Endemisch normale Individuen bleiben trotz ständiger Exposition zum Parasiten amikrofilarämisch, zeigen keine klinischen Krankheitssymptome und entsprechen putativ Immunen/ endemisch Normalen in Gebieten mit Onchozerkose. Dennoch scheinen einige dieser Individuen mit Filarien infiziert zu sein, da in ihrem Blut zirkulierendes Filarien-Antigen nachgewiesen werden kann (Weil, Ramzy et al. 1996). 1.5 Mausmodell für Filariosen: Litomosoides sigmodontis (Chandler, 1931) Bei humanen Studien ist es schwierig anhand experimenteller Untersuchungen oder Feldstudien signifikante Wechselwirkungen zwischen parasitologischen, immunologischen und genetischen Faktoren und den verschiedenen klinischen Manifestationen der humanen Filariose nachzuweisen. Daher sind standardisierte Mausmodelle zur Studie der Immunmechanismen von Filarien-Infektionen unerlässlich. Es wurden verschiedene Mausmodelle untersucht, um die komplexen Immunreaktionen gegen Filarien zu charakterisieren. Dabei wurden insbesondere Brugia ssp und Onchocerca ssp Spezies zur experimentellen Infektion von Mäusen genutzt, doch haben diese Filarien den Nachteil, dass sie ihren Lebenszyklus in Labormäusen nicht vollenden können (Lawrence 1996; Horauf and Fleischer 1997; Hoffmann, Petit et al. 2000). Mastomys coucha und Meriones unguiculatus (Jirds) sind gegenüber B. malayi zwar völlig permissiv, doch können viele moderne immunologische Methoden, die für Labormäuse zur Verfügung stehen, in diesen Wirten nicht angewendet werden (Horauf and Fleischer 1997). Petit et al. konnten allerdings mit der Nagetier-Filarie Litomosoides sigmodontis ein adäquates Mausmodell für Filarien-Erkrankungen etablieren, in dem BALB/c Mäuse gänzlich suszeptibel gegenüber der Infektion sind und es dem Wurm erlauben, sich in ihrer Thoraxhöhle zu Adulten zu entwickeln und Mikrofilarien zu bilden (Petit, Diagne et al. 1992; Marechal, Le Goff et al. 1997; Hoffmann, Petit et al. 2000). L. sigmodontis gehört zur Familie der Onchocercidae (Ordnung Spirurida, Stamm Nemotoda), der auch die humanpathogenen O. volvulus, W. bancrofti, B.malayi und B. timori angehören (Xie, Bain et al. 1994). Der natürliche Wirt für L. sigmodontis ist die Baumwollratte Sigmodon hispidus, als Ersatzwirte können Jirds (Meriones unguiculatus) dienen (Hoffmann, Petit et al. 2000). Mäuse auf BALB/c Hintergrund erwiesen sich als einzige immunkompetente Mäuse, in denen sich L. sigmodonitis bis zu einer patenten Infektion mit Blut-Mikrofilarämie in etwa 50% der Fälle entwickeln kann (Petit, Diagne et al. 1992; Al-Qaoud, Taubert et al. 1997). Aber auch andere genetische Hintergründe sind bis zu einem gewissen Grad suszeptibel gegenüber der Infektion – Einleitung 16 während Mäuse auf BALB/c Hintergrund gänzlich suszeptibel sind, sind z.B. Mäuse auf schwarzem Hintergrund (C57BL/6) annähernd resistent, Stämme mit anderem Hintergrund wie C3H hingegen intermediär/ semi-resistent (Petit, Diagne et al. 1992). Bei resistenten C57BL/6 Mäusen entwickeln sich die Larven selten über das L4-Stadium hinaus, die Filarien werden stufenweise von Immunzellen eingekapselt und von etwa Tag 40 nach Infektion an zerstört und es entwickelt sich keine Mikrofilarämie (Le Goff, Lamb et al. 2002). Beim Mausstamm C3H/HeN hat sich hingegen gezeigt, dass, obwohl diese Mäuse keine patente Infektion entwickeln, sich sowohl in männlichen als auch weiblichen Mäusen adulte Würmer entwickeln, wobei in den Eileitern der weiblichen Würmer alle embryonalen Larvenstadien zu finden sind. Männliche Mäuse sind dabei suszeptibler gegenüber der Infektion als Weibliche (Petit, Diagne et al. 1992). 1.5.1 Lebenszyklus von L. sigmodontis Abbildung 1: Lebenszyklus von Litomosoides sigmodontis Der natürliche Wirt für die Filarie L. sigmodontis ist die Baumwollratte Sigmodon hispidus. Während der Blutmahlzeit an der infizierten, mikrofilarämischen Ratte nimmt der Zwischenwirt, die Milbe Ornithonyssus bacoti, mit dem Blut Mirofilarien (erstes Larvenstadium, L1) auf, die sich innerhalb von 10-12 Tagen unter zweimaliger Häutung zu infektiösen Larven (Larvenstadium 3, L3) entwickeln (Abbildung 1). Einleitung 17 Bei der nächsten Blutmahlzeit der Milbe werden infektiöse L. sigmodontis L3-Larven mit der Saliva auf den neuen Wirt übertragen. Sie dringen durch die Bissstelle in die Haut des natürlich infizierten Nagetiers ein und migrieren von der Haut über die lymphatischen Gefäße zum Herzen und gelangen über die Blutzirkulation in die Lunge, von wo aus sie letztendlich in die Thoraxhöhle penetrieren. In den ersten 48 Stunden nach Infektion werden etwa 60-70% der Larven im subkutanen Gewebe durch inflammatorische Reaktionen abgefangen, so dass nur ca. 30-40% aller Larven die Thoraxhöhle erreichen (Marechal, Le Goff et al. 1996). Nach frühestens 4 Tagen nach der Infektion wandern die Larven in die Pleurahöhle ein (Babayan, Ungeheuer et al. 2003). Bis Tag 10 nach Infektion haben fast alle Larven die Thoraxhöhle erreicht, sofern sie nicht den Abwehrmechanismen des WirtsImmunsystems erlegen sind. Über 2 weitere Häutungen entwickeln sich die infektiösen L3-Larven zu adulten Würmern. Zwischen etwa Tag 10 und 28 nach Infektion befinden sich die meisten Larven im L4 Stadium. Ab Tag 25-33 nach Infektion entwickeln sich diese zu adulten Weibchen und Männchen, die mit sexueller Reife kopulieren, woraufhin die Weibchen Mikrofilarien bilden. Ab Tag 55-60 nach Infektion wandern die Mikrofilarien zum Herzen aus, und gelangen dort in die Blutzirkulation. Dort können sie bei einer erneuten Blutmahlzeit vom Zwischenwirt (der Milbe) aufgenommen und weiterverbreitet zu werden. 1.5.2 Zelluläre Immunantworten gegen L. sigmodontis Das Mausmodell mit L. sigmodontis in BALB/c Mäusen ermöglicht die Untersuchung von Immunreaktionen gegen die Stadien des Entwicklungszyklus der Filarie von der L3 Larve bis zur Freisetzung von Mikrofilarien. Bei der Charakterisierung der verschiedenen Immunreaktionen zeigte sich, dass eine Vielzahl verschiedener Zelltypen zur Immunabwehr gegen L. sigmodontis-Infektionen beitragen. Insbesondere CD4+ T-Zellen werden zur Abwehr adulter Würmer benötigt, da nach Infektion mit L. sigmodontis eine Depletion von CD4+ T-Zellen in BALB/c Mäusen zu einer signifikant erhöhten Wurmlast und Mikrofilarämie führt und auch die Mengen an Th2-Zytokinen, Eosinophilen und Parasiten-spezifischem IgE deutlich reduziert werden (Al-Qaoud, Taubert et al. 1997). CD8+ TZellen hingegen scheinen bei der Infektion mit L. sigmodontis keinen Einfluss auf die Abwehr adulter Würmer oder Mikrofilarien zu haben wie Depletionsexperimente gezeigt haben (Korten, Volkmann et al. 2002). Im Vergleich zeigte sich im Mausmodell mit Brugia ssp-infizierten Mäusen bei Defizienz aller T-Zell-Populationen, dass die Mäuse gegenüber der Infektion tolerant werden (Vickery, Vincent et al. 1983), nicht aber, wenn die einzelnen CD4+ (Rajan, Nelson et al. 1994) oder CD8+ (Rajan, Nelson et al. 1992) T-Zell-Subpopulationen fehlen. Regulatorische CD4+CD25+Foxp3+ T-Zellen, die während einer Infektion mit L. sigmodontis zur Infektionsstelle rekrutiert werden und proliferieren, haben eine immunsuppressive Wirkung auf die Immunabwehr adulter Würmer. Die Depletion bereits vorhandener T-regulatorischer Zellen vor der Infektion mit L. sigmodontis beeinflusst zwar nicht die anfängliche Etablierung der Larven in der Pleura-Höhle, führt aber zu einer reduzierten Wurmlast und geringerer Patenz 60 Tage nach Infektion (Taylor, van der Werf et al. 2009). Auch für B1-Zellen, die vor allem in der Peritoneal- und Thoraxhöhle zu finden sind, konnte eine besondere Rolle bei der Immunabwehr von Filarien nachgewiesen werden. B1-Zell-defiziente XidMäuse entwickeln höhere Parasitenlasten als Wildtyp-Mäuse mit höherer Mikrofilarämie, während sich die Parasiten-spezifische Th2-Zytokin-Produktion von Zellen der Pleura-Höhle signifikant erniedrigt (Al-Qaoud, Fleischer et al. 1998). Konventionelle B2-Zellen weisen eine regulierende Rolle in der Immunabwehr in einer Studie mit B-Zell-defizienten µMT-Mäusen auf. Nach einer PrimärInfektion mit L. sigmodontis Larven im Vergleich zu Wildtyp-Mäusen zeigte sich zwar kein Unterschied in der Wurmlast, es konnte jedoch keine patente Infektion in den B-Zell-defizienten Mäusen ausgebildet werden. Die Levels an Th1- und Th2-Zytokinen waren zudem deutlich gesenkt. In µMT-Mäusen, die mit irradizierten L3 Larven vakziniert wurden, war zudem der in vakzinierten Wildtyp-Mäusen gesehene Schutz supprimiert (Martin, Saeftel et al. 2001). NK und NKT-Zellen Einleitung 18 migrieren während einer Infektion mit L. sigmodontis in die Pleura-Höhle und die Depletion dieser Zellen führt ebenfalls zu erhöhten Wurmlasten (Korten, Volkmann et al. 2002). Die Eliminierung adulter Parasiten in der Pleura-Höhle erfolgt durch Einkapselung der Würmer in Knoten durch verschiedene Immunzellen. Neutrophile bilden dabei die innerste Zellschicht um adulte L. sigmodontis Würmer, während Eosinophile eine zweite Schicht bilden (Al-Qaoud, Pearlman et al. 2000). Eine ähnliche Formierung von Neutrophilen in direktem Kontakt zu den Parasiten und Eosinophilen und Mastzellen in äußeren Zellschichten kann auch bei verschiedenen Onchocerca ssp. Spezies beobachtet werden (Wildenburg, Plenge-Bonig et al. 1997; Wildenburg, Korten et al. 1998). Eine erhöhte Anzahl an Mastzellen und Eosinophilen findet sich in Onchozerkomen von Patienten mit generalisierter Onchozerkose, die Mikrofilarien-produzierende Weibchen enthalten, und besonders Onchozerkome mit toten weiblichen Würmern weisen signifikant erhöhte Mengen an Mastzellen im Vergleich zu Knoten mit lebenden Würmern auf (Wildenburg, Korten et al. 1998). U.a. zeigt sich eine Rolle für Eosinophile auf die Immunabwehr von Filarien indirekt in in vivo Studien mit L. sigmodontis durch die IL-5 abhängige Rekrutierung von Eosinophilen zum Infektionsherd (Martin, Le Goff et al. 2000). IL-5 transgene Mäuse, die vermehrt Eosinophile aufweisen, haben eine reduzierte Wurmlast 60dpi, die sich zwischen 10-30dpi entwickelte (Martin, Le Goff et al. 2000). Zudem erwiesen sich als wichtige Moleküle, die in der Abwehr von Filarien involviert sind, das Eosinophilen-spezifische Granula-Protein Eosinophil Peroxidase und das Major Basic Protein, welches ebenfalls von Eosinophilen durch Degranulation ausgeschüttet wird (Specht, Saeftel et al. 2006). 1.5.3 Zytokin-Antworten gegen L. sigmodontis Verschiedene Studien haben gezeigt, dass sowohl Th1- als auch Th2-Zytokinantworten in der Abwehr gegen Filarieninfektionen involviert sind. So liegt z.B. 10-20 Tage nach einer Infektion mit L. sigmodontis sowohl in suszeptiblen als auch resistenten Mausstämmen eine gemischte Th1/ Th2Immunantwort vor, während in der patenten Phase ab Tag 58 Th2-Antworten dominieren (Marechal, Le Goff et al. 1997). Die Depletion des Th1-assoziierten Zytokins IFN-γ resultiert in eine erhöhte Überlebensrate adulter Würmer und in eine erhöhte Mikrofilarämie durch einen Defekt in der Aktivierung neutrophiler Granulozyten und verringerte Knotenbildung um adulte Würmer (Saeftel, Volkmann et al. 2001). Im Gegenzug konnte eine ähnliche verringerte Neutrophilen-vermittelte Knotenbildung und höhere Mikrofilarämie nach der Neutralisierung des Th2-Zytokins IL-5 festgestellt werden (AlQaoud, Pearlman et al. 2000). IL-5 defiziente Mäuse erlauben die vermehrte Entwicklung von Larven zu adulten Würmern und höhere Wurmlasten während chronischer Infektionen (Volkmann, Bain et al. 2003). Auch spielt IL-5 eine essentielle Rolle bei der Vakzine-induzierten Immunität nach Filarienerkrankungen (Le Goff, Loke et al. 2000). Somit können sowohl Th1- als auch Th2-Antworten die Parasitenlast kontrollieren und sogar synergistisch wirken wie für IFN-γ und IL-5 gezeigt wurde (Saeftel, Arndt et al. 2003). Während BALB/c Mäuse gänzlich permissiv gegenüber L. sigmodontis Infektionen sind, können sich in C57/BL6 Mäusen die Würmer nicht weiter als zum L4 Larvenstadium entwickeln (Le Goff, Lamb et al. 2002). In suszeptiblen BALB/c Mäusen führt der Knock-out von IL-4 zu einer erhöhten Mikrofilarämie, beeinflusst aber nicht die Knotenbildung und das Überleben der adulten Würmer (Volkmann, Saeftel et al. 2001; Volkmann, Bain et al. 2003). Die Depletion von IL-4 bricht jedoch die Resistenz der C57/BL6 Mäuse, führt zur vollständigen Entwicklung der Würmer und zur Verlängerung ihres Lebens und demonstriert, dass Th2-abhängige Mechanismen in resistenten, nicht-permissiven Wirten die Abwehr von Parasiten bestimmen (Le Goff, Lamb et al. 2002). Wird jedoch zusätzlich das regulatorische Zytokin IL-10 ausgeknockt, wird die Resistenz gegenüber der Wurminfektion wieder hergestellt, was auf eine antagonistische Aktivität zwischen IL-4 und IL-10 hinweist (Specht, Volkmann et al. 2004). Die Depletion von IL-10 erleichtert die Persistenz von Mikrofilarien Einleitung 19 (Hoffmann, Pfaff et al. 2001), und IL-10 transgene Mäuse haben eine bessere Wurmentwicklung und Fertilität (Hoerauf, Satoguina et al. 2005). 1.6 Wolbachia-Endosymbionten Der Großteil der Filarien, darunter auch die humanpathogenen W. bancrofti, O. volvulus und B. malayi sowie die Nagetier-Filarie L. sigmodontis, führen eine mutualistische Symbiose mit Endobakterien der Gattung Wolbachia, welche eine wichtige Rolle in der Reproduktion, Entwicklung und Pathogenese der Filarien spielen (McLaren, Worms et al. 1975; Taylor, Bandi et al. 2005). Die αProteobakterien Wolbachia, die zur Ordnung Rickettsiales gezählt werden, finden sich in allen Entwicklungsstadien der Filarien, dabei besonders zahlreich in adulten Würmern (Taylor and Hoerauf 1999). In verschiedenen Studien konnte gezeigt werden, dass Wolbachia-assoziierte Antigene bei der Wirts-Immunantwort gegen Filarien eine große Rolle spielen. Die Erkennung dieser Antigene erfolgt über Toll-like Rezeptoren auf Zellen des angeborenen Immunsystems. Für Wolbachien-assoziierte Moleküle wie das Wolbachia surface protein (WSP) konnten LPS-ähnliche Immunantworten bei Zellen beobachtet werden, ausgelöst durch eine Aktivierung TLR2- und TLR4-abhängiger Mechanismen (Brattig, Bazzocchi et al. 2004). Jüngere Studien zweifeln jedoch an, ob Wolbachia tatsächlich über TLR4 erkannt werden. Hise, Daehnel et al. fanden heraus, dass die Immunantworten gegen Wolbachia in B. malayi und O. volvulus von u.a. TLR2 und TLR6 aber nicht von TLR4 abhängig sind (Hise, Daehnel et al. 2007). Zudem entdeckten Turner et al., dass Wolbachia-Lipoproteine als inflammatorische Moleküle agieren, die an TLR2 und TLR6 binden und dadurch angeborene und adaptive Immunantworten induziert werden (Turner, Langley et al. 2009). Neben Anderen gehören Neutrophile zu den Zellen des angeborenen Immunsystems, die über Toll-like Rezeptoren konservierte molekulare Strukturen von z.B. Bakterien erkennen können (KurtJones, Mandell et al. 2002). Wolbachien sind eine direkte bzw. indirekte Quelle für Signale, die zur Akkumulation von Neutrophilen rund um adulte O. volvulus Würmer bei Onchozerkose-Patienten führen. Behandlungen mit Doxyzyklin führen zu einer Depletion der Endobakterien in O. volvulus. Durch die Depletion der Endobakterien konnte gesehen werden, dass die Infiltration der Onchozerkome durch Neutrophile direkt um die Filarien strikt abhängig ist von der Präsenz der Wolbachia (Brattig, Buttner et al. 2001). Einleitung 20 1.7 Fragestellung Die durch Filarien verursachten Erkrankungen Lymphatische Filariose und Onchozerkose stellen weltweit ein ernstes Gesundheitsproblem dar. Während der Blutmahlzeit von Arthropoden werden die parasitischen Helminthen auf den Menschen übertragen und lösen dort chronische, langandauernde Infektionen durch die Suppression von Immunantworten im Wirt aus. Bei Untersuchungen der Immunabwehrreaktionen gegen Filarien konnte anhand von Mausmodellen für Filarien-Infektionen gezeigt werden, dass ein Großteil der in die Haut eindringenden infektiösen Larven innerhalb weniger Tage im subkutanen Gewebe abgewehrt wird und letztendlich nur ein kleiner Teil der initial infizierten Larven sich im Organismus etablieren kann (Marechal, Le Goff et al. 1996). Über diese spezifischen frühen Abwehrmechanismen gegen Filarien ist jedoch bisher wenig bekannt und insbesondere die Rolle von Chemokinen ist dabei noch nicht erforscht worden. In der Haut treffen die eindringenden Filarien auf Zellen des angeborenen Immunsystems, die in der Lage sind, innerhalb kurzer Zeit über die Erkennung von Pathogen-assoziierten molekularen Mustern über spezielle Rezeptoren Abwehrmaßnahmen zur Elimination der Pathogene einzuleiten. Dendritische Zellen können durch die Interaktion mit den infektiösen Larven innate und adaptive Immunantworten initiieren, wobei sie über die Ausschüttung von Zytokinen und Chemokinen andere Immunzellen beeinflussen und zur Infektionsstelle rekrutieren können. Über die Expression des Chemokins Thymus and activation-regulated chemokine (TARC/CCL17) beispielsweise können DCs speziell Th2-Zellen und regulatorische T-Zellen, die für die Abwehr von Filarien von großer Bedeutung sind, an den Infektionsherd rekrutieren (Bonecchi, Bianchi et al. 1998; Campbell, Haraldsen et al. 1999; Iellem, Mariani et al. 2001; Alferink, Lieberam et al. 2003). Auch Mastzellen, die unter den Zellen des angeborenen Immunsystems neben den dendritischen Zellen zu den prominentesten Zellen in der Haut zählen und oftmals an ersten Immunreaktionen gegen eindringende Parasiten beteiligt sind, können sowohl CCL17 als auch CCR4, den Rezeptor für CCL17, exprimieren (Oliveira and Lukacs 2001; Juremalm, Olsson et al. 2002). CCL17 könnte somit eine entscheidende Rolle in der frühen Immunabwehr gegen Filarien spielen. Mit dem Nagetier-Modell Litomosoides sigmodontis sollte daher in dieser Studie die Rolle des Chemokins CCL17 in der frühen Immunantwort gegen Filarien untersucht werden. Dazu sollten CCL17-defiziente Mäuse, die gleichzeitig als eGFP-Reporter-Mäuse dienten, natürlich mit L. sigmodontis infiziert und CCL17-abhängige Immunantworten analysiert werden. Im Detail sollten folgende Fragen bearbeitet werden: 1. Wird CCL17 während der Migration von der Haut zur Thoraxhöhle von L. sigmodontis L3 Larven induziert? 2. Welche Rolle spielt CCL17 bei der Etablierung einer frühen Immunantwort gegen Filarien im Wirt, d.h. welcher Einfluss auf Parasitologie und Immunologie kann zum Zeitpunkt der Etablierung der Filarien in der Thoraxhöhle bzw. kurz nach Infektion in der Haut festgestellt werden? 3. Induzieren Antigene des Endosymbionten Wolbachia oder Antigene der Filarie selbst mögliche CCL17-abhängige Immunmechanismen? 4. Sind TLR-abhängige Mechanismen bei der Induktion CCL17-abhängiger Immunantworten gegen Filarien involviert? Material und Methoden 21 2 Material und Methoden 2.1 Material 2.1.1 Geräte ÄKTAprime TM plus zur Proteinaufreinigung Brutschrank Cryostat Durchflusszytometer Elektrophorese-Netzteil Feinwaage Gel-Dokumentation Gelkammer-System Homogenisator Konfokales Laser Mikroskop Licht-Mikroskop Mikrotom OctoMACS Seperator Paraffin-Streckbad PCR Thermocycler Real-time PCR Thermocycler Spektrophotometer Spektrophotometer Plattenlesegerät Sterilbank Tischzentrifuge Zellzähler Zentrifuge GE Healthcare, München, Deutschland Binder, Tuttlingen, Deutschland Heraeus, Thermo Fisher Scientific, Deutschland CM 3050S, Leica Microsystems GmbH, Wetzlar, Deutschland FACS Canto, BD biosciences, Heidelberg, Deutschland EV243, Consort, Belgien Sartorius AG, Göttingen, Deutschland UV Solo, Biometra GmbH, Göttingen, Deutschland B1, Owi Seperation Systems Inc., USA Precellys 24, Peqlab, Erlangen, Deutschland IX81, Olympus, Hamburg, Deutschland Diaplan, Leitz, Wetzlar, Deutschland 1140 Autocut, Leica Microsystems, Wetzlar, Deutschland Miltenyi Biotech, Bergisch Gladbach, Deutschland TFB45, MEDITE GmbH, Burgdorf, Deutschland Primus, MWG-Biotech, Ebersberg, Deutschland RG-3000, Corbett Research, Sydney, Australien NanoVue, GE Healthcare, München, Deutschland SpectraMAX 340PC, Molecular Devices Inc., USA Hera safe, Heraeus, Thermo Fisher Scientific, Deutschland Universal 32 R, Hettich Zentrifugen, Tuttlingen, Deutschland Micro 20, Hettich Zentrifugen, Tuttlingen, Deutschland Casy, Schärfe System GmbH, Reutlingen, Deutschland Heraeus Varifuge K, Thermo Fisher Scientific, Deutschland Heraeus Multifuge 4KR, Thermo Fisher Scientific, Deutschland 2.1.2 Verbrauchsmaterial Deckgläser ELISA Platte 96, Bindungskapazität hoch FACS-Röhrchen Gazé – Polyamid Siebgewebe, Maschenweite 41µm HiTrap Protein-G Säule Kanüle, 27G, Sterican Gr.20 MACS Säulen Paul Marienfeld GmbH & Co KG, Lauda, Deutschland Greiner bio-one, Frickenhausen, Deutschland Becton Dickinson GmbH, Heidelberg, Deutschland Bückmann, Mönchengladbach, Deutschland GE Healthcare, München, Deutschland Braun, Melsungen, Deutschland Miltenyi Biotech, Bergisch Gladbach, Deutschland Material und Methoden Objektträger Pasteur-Plast Pipette, 3ml, graduiert PCR Tubes 0,2ml Petrischalen, Durchmesser 10cm/ 3,5cm Potter Homogenisatorgefäß, 15ml Reaktionsgefäße (0,5/ 1,5/ 2ml) Röhrchens (15ml/ 50ml) Spritze Omnican F, 1ml Spritze, 1ml Sterilfilter 0,2µm/ 0,45µm Porengröße Strip Tubes 0,1ml (real-time PCR) 22 HistoBond, Paul Marienfeld GmbH & Co KG, Lauda, Deutschland SuperFrost Plus, Menzel-Gläser, Braunschweig, Deutschland COPAN, Brescia, Italien Axygen INC., USA Greiner bio-one, Frickenhausen, Deutschland Braun, Melsungen, Deutschland Eppendorf, Hamburg, Deutschland Greiner bio-one, Frickenhausen, Deutschland Braun, Melsungen, Deutschland Becton Dickinson GmbH, Heidelberg, Deutschland VWR International GmbH, Darmstadt, Deutschland LTF Labortechnik, Wasserburg, Deutschland 2.1.3 Chemikalien und Reagenzien 1-bromo-3-chloropropan (BCP) 2-Mercaptoethanol 2-Propanol 3,3‘,5,5’Tetramethylenbenzidine (TMB) 50bp DNA Leiter Agarose Ampicillin Borsäure Bovines Serum Albumin (BSA) CASYton-Puffer Cimetidine cOmplete Protease-Inhibitor Cocktail Cromolyn DNase Inaktivator Dulbecco’s PBS (1x) ohne Ca oder Mg Entellan Ethanol Evans Blau Formalin Formamid Gel Ladepuffer, 6x Giemsa-Lösung Giemsas Azur Eosin-Methylenblau Glycin IPTG Isofluran Kaliumchlorid KCl Kaliumdihydrogenphosphat KH2PO4 Kaliumpermanganat KMnO4 MACS Puffer SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland Carl Roth GmbH & CO. KG, Karlsruhe, Deutschland New England Biolabs Inc., USA Fermentas GmbH, St. Leon-Rot, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland PAA laboratories, Pasching, Österreich SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Innovatis AG, Reutlingen, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Roche, Mannheim, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Ambion, Hamburg, Deutschland PAA laboratories, Pasching, Österreich MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland New England Biolabs Inc., USA MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Fermentas GmbH, St. Leon-Rot, Deutschland DeltaSelect GmbH, Pfullingen, Deutschland MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland Miltenyi Biotech, Bergisch Gladbach, Deutschland Material und Methoden May-Grünwalds-Lösung Mepyramine Na2 EDTA .2H2O NaCl-Lösung, 0,9% Natriumchlorid NaCl Natriumdihydrogenphosphat NaH2PO4 Natriummetabisulfit Na2S2O5 Oligo-d(T) Primer Paraformaldehyd (PFA) Puffertabletten n. Weise pH7,2 Redsafe RNase Inhibitor Rompun Saccharose Schwefelsäure H2SO4 Streptavidin-POD Succrose SYBR Green I Tetrazyklin Hydrochlorid Tissue Tek O.C.T. Compound Toluidinblau O Tris Base TRIzol Reagenz Tween 20 VECTASHIELD Einbettmedium mit DAPI Wasserstoffperoxid H2O2 X-Gal 23 Carl Roth GmbH & CO. KG, Karlsruhe, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Braun, Melsungen, Deutschland MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Invitrogen, Karlsruhe, Deutschland MERCK, Darmstadt, Deutschland MERCK, Darmstadt, Deutschland iNtRON Biotechnologies, Korea Peqlab, Erlangen, Deutschland Bayer SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland MERCK, Darmstadt, Deutschland Roche, Mannheim, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Roche, Mannheim, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Sakura Finetek, Niederlande MERCK, Darmstadt, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Invitrogen, Karlsruhe, Deutschland MERCK, Darmstadt, Deutschland Vector laboratories, Inc., USA SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Fermentas GmbH, St. Leon-Rot, Deutschland 2.1.4 Lösungen und Puffer Anästhetikum (intramuskuläre Injektion) Bindungspuffer (Protein-Aufreinigung) ELISA Blocking-Puffer ELISA Coating-Puffer ELISA Entwickler-Lösung ELISA Stopp-Lösung ELISA Streptavidin-Lösung ELISA Substrat ELISA Substrat-Puffer ELISA-Waschpuffer Elutionspuffer (Protein-Aufreinigung) FACS-Puffer Dosis für eine intramuskuläre Injektion/ Maus 20µl PBS (1x) 20µl Ketanest (50mg/ml) 10µl Rompun (2%) 0,02M Natriumphosphat in Adest, pH7,0 PBS (1x) 1% BSA 0,1M NaH2PO4 pH 9,0 10ml ELISA Substrat-Puffer 200µl ELISA Substrat 2µl H2O2 2N H2SO4 10ml ELISA Blocking-Puffer 2µl (500U) Streptavidin-POD 6mg/ml TMB 0,1 M NaH2PO4 pH 5,5 PBS (1x) 0,05% Tween 20 0,1M Glycin/HCl, pH2,7 2% BSA in PBS (1x) Material und Methoden Giemsa-Lösung Kollagenase/DNase I-Verdaupuffer LB-Agar LB-Medium Lysepuffer Neutralisationspuffer (ProteinAufreinigung) PBS (Phosphat buffer saline), 20x PFA (Paraformaldehyd)-Lösung, 4% TBE (Tris-Borat-EDTA)-Puffer, 10x Tetrazyklin-Lösung, 0,5% 24 1ml Giemsas Azur Eosin-Methylenblau-Lösung 20ml Giemsa-Pufferlösung pH7,2 (dafür 1 Puffertablette n. Weise, pH7,2 in 1l Aquadest lösen) PBS (1x) 1mg/ml Kollagenase 300µg/ml (180U/ml) DNase I 10g Trypton 5g Hefe-Extrakt 10g NaCl 15g Agar ad 1000µl H2O, pH 7,0, autoklaviert vor dem Ausplattieren Zugabe von 50µg/ml Ampicillin 20µg/ml X-Gal 0,5ml 1M IPTG 10g Trypton 5g Hefe-Extrakt 10g NaCl ad 1000µl H2O, pH 7, autoklaviert vor Gebrauch Zugabe von 50µg/ml Ampicillin 150mM NaCl 50mM Tris, pH 7,5, Komplementierung des Puffers (50ml) kurz vor Gebrauch mit 1 Tablette cOmplete Protease-Inhibitions-Cocktail 1M Tris/HCl, pH 9,0 160g NaCl 23,6g Na2HPO4 (2H2O) 4g KH2PO4 4g KCl ad 1l Adest, einstellen auf pH7,0 4% Paraformaldehyd in PBS (1x), gelöst bei 56°C 108g Tris Base 55g Borsäure 9,3g Na2 EDTA .2H2O ad 1000µl H2O 50ml 10% Saccharose-Lösung 0,25g Tetrazyklin Hydrochlorid vor Lichteinstrahlung schützen 2.1.5 Enzyme DNase I (Verdau) Kollagenase von Clostridium histolyticum Typ VIII rDNase I (PCR) SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Ambion, Hamburg, Deutschland Material und Methoden 25 2.1.6 Wachstumsmedien und Zusätze Fötales Kälber-Serum (FCS) PAN Biotech Hepes SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland IMDM-Medium PAA laboratories, Pasching, Österreich L-Glutamin 200mM (100x) PAA laboratories, Pasching, Österreich nicht-essentielle Aminosäuren (100x) PAA laboratories, Pasching, Österreich Penicillin/ Streptomycin (100x) PAA laboratories, Pasching, Österreich rekombinantes IL-3 Peprotech, London, England RPMI 1640-Medium PAA laboratories, Pasching, Österreich FCS wurde vor Gebrauch hitzeinaktiviert, um die im Serum enthaltenen Komplementproteine zu inaktivieren. Dazu wurde steriles FCS bei 56°C für 30min im Wasserbad inaktiviert, aliquotiert und bei -20°C gelagert. 2.1.7 Stimulanzien Calcium Ionophore A23187 Lipopolysaccharid (LPS) von Serratia marcescens Pam3Cys (Pam3CSK4) SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland InvivoGen, USA 2.1.8 Kits CCL17 ELISA Duoset Histamin HTRF-Assay Hot Star Taq DNA-Polymerase IFN-γ ELISA Duoset Omniscript RT Kit Precellys Stahlkit 2,8mm Qiaprep Spin Miniprep Kit TOPO TA Cloning Kit VEGF-A ELISA Duoset CD11c MicroBeads R&D Systems, Inc., USA CIS bio Bioassays, Frankreich Qiagen, Hilden, Deutschland R&D Systems, Inc., USA Qiagen, Hilden, Deutschland Peqlab, Erlangen, Deutschland Qiagen, Hilden, Deutschland Invitrogen, Karlsruhe, Deutschland R&D Systems, Inc., USA Miltenyi Biotech, Bergisch Gladbach, Deutschland 2.1.9 Inhibitions-Antikörper anti CCL17 (MAB529) anti CD25 (PC61) anti IL-10 (DES5.2) anti-VEGF164 (Ziegen-IgG) Ratten IgG (aus Ratten-Serum) (FcBlock) R&D Systems GmbH, Wiesbaden, Deutschland eigene Gewinnung Überlassung von F. Jüngerkes (IMMEI, Bonn) R&D Systems GmbH, Wiesbaden, Deutschland SIGMA-ALDRICH CHEMIE GmbH, München, Deutschland Material und Methoden 2.1.10 26 ELISA-Antikörper Die folgenden ELISA-Antikörper wurden bei BD Pharmingen (Heidelberg, Deutschland) erworben. Antikörper Konzentration Verdünnung Ratte anti-Maus IL-4 0,5mg/ml 1:250 Biotin Ratte anti- Maus IL-4 0,5mg/ml 1:500 Ratte anti- Maus/ human IL-5 0,5mg/ml 1:250 Biotin Ratte anti- Maus IL-5 0,5mg/ml 1:500 Ratte anti- Maus IL-10 1mg/ml 1:500 Biotin Ratte anti- Maus IL-10 0,5mg/ml 1:500 Ratte anti- Maus IL-12p70 0,5mg/ml 1:250 Biotin Ratte anti- Maus IL-12(p40/p70) 0,5mg/ml 1:250 2.1.11 FACSTM-Antikörper Die folgenden monoklonalen Antikörper wurden für die FACS-Analyse von Zellen genutzt, konjugiert entweder mit Phycoerythrin (PE), Allophycocyanin (APC), Fluoresceinisothiocyanat (FITC) oder den Tandemkonjugaten Peridinin-Chlorophyll Protein (PerCP)-Cy5.5 und PE-Cy7. Die verwendeten Antikörper wurden von BD Pharmingen (Heidelberg, Deutschland) hergestellt, CD19-PE von Caltaq Laboratories/ Invitrogen (Karlsruhe, Deutschland). Antikörper (Klon) CD11b (M1/70) CD11c (HL3) CD19 (1D3) CD25 (PC61) CD4 (L3T4, RM4-5) CD40 (3/23) CD45R/B220 (RA3-6B2) CD80 (16-10A1) CD8a (Ly-2) (53-6,7) MHC Klasse II (I-A/I-E) (M5/114.15.2) 2.1.12 Fluoreszenzfarbstoff PerCP-Cy5.5 PE-Cy7 PE APC FITC PE PE APC PE PE-Cy7 PE Verdünnung 1:300 1:400 1:400 1:400 1:400 1:200 1:400 1:400 1:400 1:400 1:800 Primer Die Primer wurden mithilfe des Primer3 online-Programms entworfen unter folgenden Kriterien: Primer-Länge 20-22bp, Produktlänge 100-200bp, GC-Gehalt der Primer 30-70%, Schmelztemperatur 58°C-60°C. Die Primer wurden bei der Firma Invitrogen (Karlsruhe, Deutschland) oder Operon Biotechnologies (Köln, Deutschland) synthetisiert. cDNA Forward-Primer Reverse-Primer CCL5 5’ TTG CAG TCG TGT TTG TCA CTC 3’ 5’ GGT TGC CAA GCC TTA TCG GA 3’ 5’ AAC CAG CAC ATT GAA GAC CTG 3’ 5’ CAG GGA AGC TAT ACA GGG TCA 3’ 5’ ACC TGC TCC ACT GCC TTG CT 3’ 5’ ACA GGG TCA TCA TCA AAG ACG 3’ IL-10 IL-12p35 Primer-EndMgCl2-EndKonzentration Konzentration 200nM 2,5µM 300nM 4,5µM 300nM 4,5µM Material und Methoden IL-17A 5’ CCG CAA TGA AGA CCC TGA TA 3’ IL-4 5’ TGT ACC AGG AGC CAT ATC CAC 3’ IL-5 5’ AGC ACA GTG GTG AAA GAG ACC TT 3’ JAM-1 5’ GCA CCT ACT CTG GCT TCT CCT 3’ LYVE-1 5’ CTG GCT CTC CTC TTC TTT GGT 3’ Occludin 5’ GCT CTT TGG AGG AAG CCT AAA 3’ Prox1 5’ CAG GAG ATG GCT GAG AAC AAG 3’ TSLP 5’ GAA TCT GGG AGA AAC TGC TGA 3’ VE5’ TGT GGA CAA GAA CAC Cadherin CAA CAA 3’ VEGF-A 5’ AAT GGG ATG AAA GGC TTC AGT 3’ β-Actin 5’ AGA GGG AAA TCG TGC GTG AC 3’ 2.1.13 27 5’ TCC CTC TTC AGG ACC AGG AT 3’ 5’ GTT CTT CGT TGC TGT GAG GAC 3’ 5’ TCC AAT GCA TAG CTG GTG ATT T 3’ 5’ TCA CAG AAC TGA ACG TGA TGC 3’ 5’ TGA CGT CAT CAG CCT TCT CTT 3’ 5‘ TAA GGA AGC GAT GAA GCA GAA 3‘ 5’ AGA GGG TTT GGC TGA GAA GAC 3’ 5’ CTC GTA GAT GTG CAA GGC TCT 3’ 5’ AGA TGC GTT GAA TAC CTG GTG3’ 5’ GTC GTG TTT CTG GAA GTG AGC 3’ 5’ CAA TAG TGA TGA CCT GGC GGT 3’ 300nM 2,5µM 300nM 4,5µM 300nM 4,5µM 300nM 2,5µM 400nM 2,0µM 300nM 3,5µM 500nM 2,0µM 300nM 4,5µM 400nM 2,0µM 300nM 2,5µM 300nM 4,5µM Tierhaltung Für die verschiedenen Versuche wurden 8-12 Wochen alte Mäuse verwendet. Wurden männliche und weibliche Mäuse in einem Experiment verwendet, wurden sie einheitlich auf die verschiedenen Versuchsgruppen aufgeteilt, um geschlechtsspezifische Effekte ausschließen zu können. CCL17defiziente Mäuse auf C3H/HeN, C57BL/6 oder BALB/c-Hintergrund wurden von I. Förster (Molekulare Immunologie, Institut für Umweltmedizinische Forschung, Düsseldorf), C3H/HeN TLR2-/- von C. J. Kirschning (Institut für Medizinische Mikrobiologie, Essen) sowie VEGF-transgene Mäuse auf FvBHintergrund von M. Detmar (Institut für Pharmazeutische Wissenschaften, Zürich) zur Verfügung gestellt. FvB-Wildtyp-Mäuse wurden von Charles River Laboratories International Inc. bezogen. Meriones unguiculatus Wüstenrennmäuse, Ornithonyssus bacoti Milben und Sigmodon hispidus Ratten sowie CCL17-/-, CCL17+/-, TLR2-/- und Wildtyp-Mäuse auf entsprechendem genetischen Hintergrund (ursprünglich bezogen von Janvier, Frankreich) wurden unter Einhaltung der Tierschutzbedingungen in der Tierhaltung des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie, Universitätsklinikum Bonn gehalten und gezüchtet. Material und Methoden 28 2.2 Methoden 2.2.1 Zellkultur 2.2.1.1 Knochenmarks generierte dendritische Zellen (bone marrow derived dendritic cells, BMDCs) Tibia und Femur beider Hinterextremitäten von C3H/HeN CCL17+/- Mäusen wurden unter sterilen Bedingungen frei präpariert, entnommen und jeweils am proximalen und distalen Ende abgetrennt. Zur Gewinnung der Knochenmarkszellen wurden die Knochen mit eiskaltem PBS mithilfe einer Spritze mit 27G-Kanüle durchspült und die Zellen in 15ml-Röhrchens aufgefangen. Nach Zentrifugation der Zellen für 5min bei 300g und 4°C wurden sie gewaschen, durch Gazé gefiltert und gezählt (Casy Zellzähler). Für die Generierung dendritischer Zellen aus Kochenmarkszellen wurden die Zellen einer Maus in 30ml RPMI-Medium, supplementiert mit 20% GM-CSF haltigem Kulturüberstand von X63Ag8-Zellen (s.u.), 1% Penicillin/Streptomycin, 10% FCS und 2mM L-Glutamin, in 3 Petrischalen mit 10cmDurchmesser ausgesät und für insgesamt 8 Tage bei 37°C/ 5% CO2 inkubiert. An Tag 3 der Kultur wurde das Medium gewechselt. Semi-adhärente Zellen wurden an Tag 8 geerntet und dendritische Zellen mit magnetischen CD11c-MicroBeads nach Angaben des Herstellers (MACS, Miltenyi Biotech, Bergisch Gladbach) aufgereinigt. Die Reinheit CD11c+ DCs lag in der Regel bei über 90%. 2,5x105 Zellen/well wurden in 96-well Rundbodenplatten ausgesät und für 24h mit Medium, 100µg/ml LsAg, 100ng/ml LPS oder 100ng/ml Pam3Cys stimuliert. Die Zytokin-Produktion in den Kulturüberständen wurde per ELISA analysiert und Zellen mittels FACS-Analyse untersucht. X63-Zellen sind Plasmacytoma-Zellen der Linie X63-Ag8, die mit dem Gen für murines GM-CSF transfiziert wurden und murines GM-CSF sezernieren (Überlassung von Prof. Dr. Alexander Dalpke, Heidelberg). Sie wurden in RPMI-Medium, supplementiert mit 1% Penicillin/Streptomycin, 10% FCS und 2mM L-Glutamin, für 5-7 Tage kultiviert, bevor der Überstand abgenommen und steril filtriert wurde (0,45µm). Der Kulturüberstand wurde bei –20°C gelagert. Zur Generierung von BMDCs wurde dem Medium Kulturüberstand im Verhältnis von 5–20% (v/v) zugesetzt und die so gewonnenen DCs auf CD11c-Expression untersucht. Die hier verwendeten Chargen ergaben optimale Ergebnisse bei 20% (v/v) Zusatz. 2.2.1.2 Knochenmarks generierte Mastzellen (bone marrow derived mast cells, BMMCs) Knochenmarkszellen von C3H/HeN CCL17+/- und CCL17-/- Mäusen wurden wie in Abschnitt 2.2.1.1 beschrieben gewonnen. Die darin befindlichen Erythrozyten wurden mittels hypotonischen Schocks lysiert, indem die Zellen in 25ml 0,2%igem NaCl resuspendiert und gemischt wurden. Innerhalb einer Minute wurde die Lyse durch Hinzufügen von 25ml 1,6%igem NaCl gestoppt, die Zellen anschließend gewaschen, durch Gazé gefiltert und gezählt. Für die Generierung von Mastzellen aus Knochenmark wurden jeweils 3x105 Zellen/ml in 75cm2-Zellkulturflaschen in 40ml IMDM-Medium, supplementiert mit 3ng/ml rekombinantem IL-3, 10mM Hepes, 1% Penicillin/Streptomycin, 10% Hitze-inaktiviertem FCS und 2mM L-Glutamin, ausgesät und für insgesamt 4-5 Wochen bei 37°C/ 5% CO2 inkubiert. In 7tägigen Intervallen wurde das Medium gewechselt, bis die Reinheit der Mastzellen >95% erreichte. Die Reinheit wurde mittels Toluidinblau-Färbung überprüft. Nicht-adhärente Zellen wurden als nichtaktivierte Mastzellen geerntet, mit Medium gewaschen und zu Stimulationszwecken verwendet. Dazu wurden 1x105 Mastzellen/well in einer 96-well Flachbodenplatte ausgesät und für 1h bei Material und Methoden 29 37°C/5%CO2 mit Medium, 0,5µM A23187 oder 100µg/ml LsAg in 5-fach Bestimmung stimuliert. Histamin-Konzentrationen im Kulturüberstand wurden mittels HTRF-Assay nach Angaben des Herstellers gemessen. 2.2.2 Laborzyklus von Litomosoides sigmodontis Zur Anzucht wurde Ornithonyssus bacoti Milben die Blutmahlzeit an jungen Mäusen erlaubt, die alle 2-3 Tage ersetzt wurden. Die Milben dienen als Zwischenwirt für L. sigmodontis, während der natürliche Hauptwirt die Baumwollratte Sigmodon hispidus ist. Über eine Blutmahlzeit an hochmikrofilarämischen Baumwollratten wurden die Milben mit L. sigmodontis-L1 Larven infiziert und für 12-14 Tage bei 28°C und 80% Luftfeuchtigkeit im Brutschrank gehalten. In dieser Zeit entwickeln sich die Mikrofilarien in den Milben über Häutungen zu infektiösen L3 Larven. An Tag 12 wurde die Infektionsrate an einigen Milben kontrolliert. In der Regel waren 60-90% der Milben mit durchschnittlich 2-5 L3 Larven infiziert. Über eine Blutmahlzeit an mikrofilarämischen Jirds, die 6 Wochen lang mit einer täglich frisch angesetzten 0,5%igen Tetrazyklin-Lösung oral behandelt wurden, wurden Milben mit Wolbachiadepletierten Larven infiziert. 2.2.3 Natürliche Infektion mit Litomosoides sigmodontis 12-14 Tage nach Infektion der Milben mit L. sigmodontis wurden zu infizierende Mäuse anästhesiert (Rompun/Ketanest) und i.d.R. über Nacht infizierten Milben ausgesetzt. Mit einer Blutmahlzeit übertrugen dabei die infizierten Milben infektiöse L3 Larven auf die Mäuse. Diese Art der Infektion mit Milben als Vektor wurde nachfolgend in der Arbeit als „natürliche Infektion“ bezeichnet. 2.2.4 Isolierung von L3 Larven 12-14 Tage nach Infektion mit L. sigmodontis wurden aus infizierten Milben L3 Larven isoliert und diese nach dreimaligem Waschen mit sterilem RPMI-Medium (ohne Zusätze) für Injektionsexperimente verwendet. 2.2.5 LsAg-Präparation Für die Herstellung von Wurmextrakt von L. sigmodontis (LsAg) wurden aus infizierten Baumwollratten adulte L. sigmodontis Männchen und Weibchen isoliert und 3-5-mal in sterilem PBS gewaschen. Für die Herstellung von Wolbachia-depletiertem LsAg wurden adulte Würmer von Tetrazyklin-behandelten Jirds verwendet. Die Würmer wurden bei -80°C bis zur Antigen-Präparation zwischen gelagert. Unter sterilen Bedingungen wurden die L. sigmodontis Würmer auf Eis in einem 15ml-Glaspotter homogenisiert unter Zugabe von RPMI-Medium (ohne Zusätze). Zum Entfernen von unlöslichen Bestandteilen wurde das Homogenisat für 10min bei 300g und 4°C zentrifugiert und im Überstand mittels Advanced Protein Assay (Cytoskeleton, USA) und einer BSA-Standartreihe die Proteinkonzentration bestimmt. Der Wurmextrakt wurde auf 1mg/ml mit RPMI-Medium (ohne Zusätze) eingestellt, aliquotiert und bei -80°C gelagert. Material und Methoden 30 2.2.6 Injektionsexperimente 35 L3 Larven, 10µg LsAg oder 20ng LPS wurden in je 100µl RPMI-Medium (ohne Zusätze) subkutan in den Fuß von CCL17+/- und CCL17-/- Mäusen injiziert. 48h nach der Injektion wurde jeweils der den Fuß drainierende popliteale Lymphknoten entnommen. Als Kontrolle dienten contra-laterale, Medium-behandelte Lymphknoten. Die Lymphknoten wurden einzeln in 200µl Lysepuffer mit Protease-Inhibitoren homogenisiert und für 10min auf Eis inkubiert. Die Homogenisate wurden für 10min bei 13000rpm und 4°C zentrifugiert und die VEGF-A Konzentrationen in den Überständen mittels ELISA analysiert. 2.2.7 Nachweis eGFP-exprimierender Zellen Nach Rasur und Perfusion wurde naiven und mit L. sigmodontis natürlich infizierten CCL17+/- und Wildtyp Mäusen zu unterschiedlichen Zeitpunkten nach Infektion eine Hautprobe aus der Lumbarzone, Lunge, Milz und mediastinale und periphere (axiale, inguinale und popliteale) Lymphknoten entnommen. Die Hälfte der einzelnen Organe wurde Kollagenase/ DNase I verdaut und CD11c+ Zellen mithilfe der MACS-Technologie (Miltenyi, Bergisch Gladbach, Deutschland) magnetisch aufgereinigt und per FACS-Analyse auf die Expression von CD11c, MHC Klasse II und eGFP analysiert. Die andere Hälfte der Organe wurde über Nacht in 4% PFA konserviert, anschließend in 20% Succrose-Lösung für 5h inkubiert und in Tissue Tec Einbettmedium cryokonserviert. CryostatSchnitte, eingebettet mit VECTASHIELD Einbettmedium, wurden mittels konfokaler Lasermikroskopie auf eGFP-Expression der Zellen analysiert (Vergrößerung: Lymphknoten 20x; Lunge, Milz und Haut 40x). 2.2.8 Extraktion von Zellen und Würmern aus der Thoraxhöhle Zur Extraktion von Zellen und Würmern wurde die Pleura-Höhle von Mäusen mit insgesamt 10ml eiskaltem PBS unter Verwendung einer Plastik-Pasteur-Pipette gespült. Zunächst wurde mit 1ml gespült und die Lavage in einem 1,5ml Reaktionsgefäß gesammelt, während die Spülung der PleuraHöhle mit weiteren 9ml PBS in einem 15ml Röhrchen gesammelt wurde. Nach Zentrifugation des ersten Milliliters der Pleura-Lavage wurde der Überstand bei -20°C für spätere Zytokinmessungen mittels ELISA weggefroren. Das Zellpellet wurde in 1ml PBS gelöst und mit den 9ml Pleura-Lavage vereint und für ca. 10min auf Eis inkubiert. Nach Absinken der Würmer wurden diese vorsichtig aus der Pleura-Lavage abgesaugt und in 4% Formalin fixiert und ausgezählt. Die Zellen der Pleura-Höhle wurden indessen gewaschen, durch Gazé gefiltert, in 3ml Medium aufgenommen, gezählt und per FACS-Analyse untersucht. 2.2.9 Zytospin-Analyse Zur Herstellung von Zytospin-Präparaten wurden jeweils 5x104 Zellen in einer Zytospin-Kammer mittels Zentrifugation bei 500g für 3min auf einen Objektträger gebracht. Anschließend wurden die Zellen nach Pappenheim gefärbt. Dazu wurden die Präparate mit May-Grünwalds Lösung überschichtet, für 3min inkubiert, dann mit Aquadest gewaschen und für 20min in Giemsa-Lösung gefärbt. Nach Waschen mit Leitungswasser und Lufttrocknung wurden die Zellen in Entellan eingebettet und 100 Zellen pro Feld bei 100-facher Vergrößerung unter einem Lichtmikroskop analysiert. Die Zellen wurden in Monozyten, Lymphozyten, Neutrophile und Eosinophile unterteilt. Aus den Daten von 3 Auszählungen/Zellprobe wurden Mittelwerte gebildet. Material und Methoden 2.2.10 31 Aufreinigung monoklonaler Antikörper Hybridoma-Zellen wurden unter sterilen Bedingungen in IMDM-Medium, supplementiert mit 1% nicht-essentiellen Aminosäuren, für 8 Wochen bei 37°C/5% CO2 in Rollflaschen kultiviert mit wöchentlichem Medium-Wechsel. Die von den Zellen sezernierten monoklonalen IgG anti-CD25 Antikörper (PC61) wurden aus dem Zellkulturüberstand mittels Affinitätschromatographie in einem ÄKTA Prime plus Gerät nach Angaben des Herstellers (GE Healthcare, München, Deutschland) aufgereinigt. Dabei wurde der Zellkulturüberstand über eine mit Bindungspuffer equilibrierte Protein-G Säule aufgereinigt, wobei die Antikörper an das Protein-G banden. Die Antikörper wurden mit Elutionspuffer in Fraktionierungs-Röhrchen mit Neutralisierungspuffer eluiert. Die AntikörperKonzentrationen wurden mithilfe des Advanced Protein Assays (Cytoskeleton, USA) und einer BSAStandardreihe bestimmt und die Lösung anschließend steril filtriert. Die Antikörper wurden bis zum Gebrauch bei -80°C gelagert. 2.2.11 Depletionsexperimente Für Depletionsexperimente wurden CCL17-defiziente Mäuse vor und nach natürlicher Infektion mit L. sigmodontis mit neutralisierenden Antikörpern behandelt. Die Injektion der Antikörper erfolgte intraperitoneal in 100µl PBS, wobei sich Antikörpermengen und Injektionszeitpunkte für die jeweiligen Depletionen wie nachfolgend beschrieben unterschieden: Zur Depletion von anti-CD25+ Zellen wurden drei Tage vor Infektion 750µg und drei Tage nach Infektion 200µg anti-CD25 Antikörper pro Maus injiziert. Die Depletion von IL-10 erfolgte durch Injektion von 500µg anti-IL-10 Antikörper einen Tag vor und drei Tage nach Infektion. VEGF-A wurde durch Verabreichung von 50µg anti-VEGF Antikörper pro Injektion einen Tag vor sowie einen und drei Tage nach Infektion depletiert. Die Depletion von CCL17 in CCL17-heterozygoten und TLR2-defizienten Mäusen erfolgte durch intraperitoneale Injektion von je 20µg anti-CCL17 Antikörper einen Tag vor sowie Tag 1, 3 und 5 nach Infektion mit L. sigmodontis. Für Untersuchungen der vaskulären Permeabilität oder Mastzellen in der Haut wurden die Mäuse mit 20µg anti-CCL17 einen Tag vor der Injektion von LsAg bzw. vor der natürlichen Infektion behandelt. 2.2.12 In vivo Messung der vaskulären Permeabilität Zur in vivo Untersuchung der vaskulären Permeabilität in der Haut wurden 35 L3 Larven, 10µg LsAg oder Wolbachia-depletiertes LsAg in jeweils 0,1ml RPMI-Medium (ohne Zusätze) subkutan in die Lumbarzone der Mäuse injiziert oder die Mäuse lokal in der Lumbalzone natürlich mit L. sigmodontis infiziert. 6h später erfolgte eine Injektion von Evans Blau (30mg/kg Körpergewicht) in 0,1ml 0,9% NaCl-Lösung in die Schwanzvene der Mäuse. Naive Mäuse mit und ohne Injektion von Evans Blau dienten als Kontrollen. Nach 1h wurden die Mäuse getötet und nach Rasur mit einer Rasierklinge ein ca. 2-3cm2 großes Hautstück an der Injektionsstelle in der Lumbarzone entnommen und gewogen. Die Hautprobe wurde dabei auf Eis gelagert. Anschließend wurde die Haut in 3ml Formamid für 36h in einem 60°C heißem Wasserbad inkubiert. Die Struktur der Haut wurde dabei aufgelöst, so dass sich die in der Haut befindlichen Farbpartikel in Formamid lösen konnten. Als Kontrolle (Leerwert für die anschließende Messung) wurde ein Röhrchen nur mit Formamid verwendet. Anhand der Konzentration von Evans Blau wurde die Extravasation des Farbstoffs ins Gewebe bestimmt durch Messung des gelösten Farbstoffs in Formamid bei 620nm in einem ELISA-Reader. Die gemessene optische Dichte bei 620nm wurde in Relation gesetzt zum Gewicht des entnommenen Hautstücks (OD620nm/ 100mg Haut). Material und Methoden 2.2.13 32 Histologie Mastzellen Naive und natürlich infizierte Mäuse wurden zur Entnahme von ca. 2-3cm2 großen Hautproben aus der Lumbarregion mit Isofluran eingeschläfert und rasiert. Die Hautproben wurden für mind. 48h in PBS/ 4% Formalin konserviert und in Paraffin eingebettet. 5µm dicke Schnitte der Hautproben wurden Toluidinblau gefärbt. Dazu wurden die Paraffin-Schnitte entparaffinisiert und rehydriert. Anschließend erfolgte eine 2-minütige Färbung in 0,5%iger Kaliumpermanganat-Lösung, eine 1minütige Entfärbung in 2%iger Natriummetabisulfit-Lösung mit anschließendem 3-minütigem Bad in Leitungswasser und zuletzt die Färbung in einer Toluidinblau-Lösung (pH3,2) für 5 Minuten. Die gefärbten Schnitte wurden dehydriert und mit Entellan eingebettet. In der Epidermis, Dermis und Hypodermis befindliche Mastzellen in 20 aufeinander folgenden Gesichtsfeldern (Durchmesser eines Gesichtsfelds: 0,18mm) bei 100-facher Vergrößerung an einem Lichtmikroskop wurden ausgezählt. Die Mastzellen wurden dabei in nicht-degranulierend und degranulierend unterschieden. Pro Maus wurden 2-3 Schnitte analysiert und aus den Werten Mittelwerte gebildet. 2.2.14 Behandlung mit Histamin-Rezeptor-Antagonisten Zur Untersuchung des Einflusses von Histamin auf die Etablierung von L. sigmodontis in Mäusen wurden CCL17-defiziente Mäuse mit Histamin-Rezeptor (HR)-Antagonisten behandelt. Pro Injektion wurde den Tieren intraperitoneal 400µg des HR1-Antagonisten Mepyramine (20mg/kg) und 800µg des HR2-Antagonisten Cimetidine (40mg/kg) in 100µl sterilem PBS verabreicht. Die Behandlung erfolgte 1h vor und 2h nach der natürlichen Infektion mit L. sigmodontis, sowie einmal täglich an den darauffolgenden 5 Tagen. 10 Tage nach Infektion wurde die Wurmlast in den behandelten CCL17-/Mäusen sowie unbehandelten CCL17-/- und CCL17+/- Mäusen bestimmt. 2.2.15 Mastzellstabilisierung Zur Stabilisierung von Mastzellen wurden Mäuse täglich, beginnend 6 Tage vor natürlicher Infektion der Mäuse bzw. Injektion von L3 Larven mit Cromolyn behandelt. Die Behandlung erfolgte durch intraperitoneale Injektion von jeweils 600µg Cromolyn in 100µl 0,9% NaCl-Lösung. Cromolynbehandelte Mäuse wurden untersucht auf die Anzahl degranulierender Mastzellen in der Haut und Etablierung der Wurmlast in der Pleura-Höhle nach natürlicher Infektion mit L. sigmodontis sowie auf die vaskuläre Permeabilität der Haut nach Injektion von L3-Larven. 2.2.16 Durchflusszytometrie (FACSTM-Analyse) Anhand der Durchflusszytometrie mit dem „Fluorescence activated cell sorter“ (FACS) wurden Zellen multiparametrisch bezüglich ihrer Größe, Granularität und Fluoreszenzmarkierung analysiert. Jeweils 2x105 Zellen wurden in 96-well U-Form Zellkulturplatten pipettiert und zentrifugiert. Nach dem Verwerfen des Überstands wurden Fc-Rezeptoren der Zellen geblockt durch Inkubation der Zellen mit Ratten-IgG-Antiköpern, 1:100 verdünnt in 50µl FACS-Puffer, für 15min bei 4°C. Nach einmaligem Waschen der Zellen wurden diese mit verschiedenen Fluoreszenz-markierten FACSAntikörpern für 30min bei 4°C mit entsprechender Verdünnung (2.1.11) in insgesamt 50µl FACSPuffer gefärbt. Nicht-bindende FACS-Antikörper wurden durch zweimaliges Waschen mit PBS entfernt. Die Zellen wurden in 200µl FACS-Puffer aufgenommen und nach Filtern durch Gazé in FACSRöhrchen überführt. Die Zellen wurden in einem BD FACS Canto vermessen und die Daten mit FACSDiva oder FlowJo Software ausgewertet. Material und Methoden 2.2.17 33 Enzyme Linked Immunosorbent Assay (ELISA) Als Nachweisverfahren zur Quantifizierung von Zytokinen und Chemokinen wurden SandwichELISA eingesetzt. Erst-Antikörper (Abschnitt 0) wurden in Coating-Puffer entsprechend verdünnt und in 96-well ELISA-Platten (50µl/well) über Nacht bei 4°C inkubiert. Erst-Antikörper aus kommerziell erhältlichen ELISA-Duosets wurden in PBS nach Angaben des Herstellers verdünnt und über Nacht bei Raumtemperatur inkubiert. Nach dreimaligem Waschen mit Waschpuffer wurden die Platten für mindestens 1h bei Raumtemperatur mit 150µl Blocking-Puffer/well behandelt. Nach dreimaligem Waschen wurden Standardreihen und unverdünnte Proben (50µl/well) aufgetragen und für 2h bei Raumtemperatur oder bei 4°C über Nacht inkubiert. Nach 3 Waschschritten wurde der biotinylierte Zweit-Antikörper in Blocking-Puffer mit entsprechender Verdünnung aufgetragen (50µl/well) und für 2h bei Raumtemperatur inkubiert. Nach 3-maligem Waschen wurde mit 100µl StreptavidinLösung/well für 30min inkubiert und nach 5 Waschschritten 100µl Entwickler-Lösung/ well aufgetragen. Die Farbreaktion wurde nach durchschnittlich 10-15min durch Zugabe von 50µl/well Stopp-Lösung beendet, wodurch ein Farbumschlag von blau zu gelb erfolgte. Die Absorption bei 450nm wurde in einem Spektra-Photometer gemessen, wobei eine Wellenlängen-Korrektur bei 540nm durchgeführt wurde. 2.2.18 mRNA-Expression 2.2.18.1 RNA-Extraktion aus Hautproben Hautproben von Mäusen wurden in flüssigem Stickstoff eingefroren und bis zur RNA-Isolierung bei -80°C gelagert. Für die RNA-Extraktion wurde jeweils eine Hautprobe in ein Reaktionsgefäß mit 2,8mm großen Stahl-Beads transferiert und in 1ml TRIzol-Reagenz zweimal für je 30s bei 6800rpm in einem Precellys 24-Homogenisator homogenisiert. Nach einer Zentrifugation für 3min bei 3000g und 4°C wurde das Homogenisat in ein 1,5ml Reaktionsgefäß überführt und mit 100µl 1-bromo-3chloropropan (BCP) supplementiert. Die Proben wurden für 1min energisch von Hand geschüttelt, dann für 10min bei Raumtemperatur inkubiert. Nach einer Zentrifugation für 20min bei 12000g, 4°C wurde die obere Phase in ein frisches Reaktionsgefäß transferiert und 100µl BCP und 500µl TRIzol hinzugefügt, gemischt und für 5min bei Raumtemperatur inkubiert. Nach Zentrifugation für 15min bei 12000g und 4°C wurden für 90min bei -20°C die in der oberen Phase gelösten Nukleinsäuren mit 0,8ml 2-Propanol präzipitiert. Nach Zentrifugation für 15min bei 12000g und 4°C wurde das Pellet zweimal mit je 1ml 75% Ethanol gewaschen und für 10min bei 12000g, 4°C zentrifugiert, anschließend bei Raumtemperatur luftgetrocknet und in Nuklease-freiem H2O gelöst. Genomische DNA wurde durch DNase-Verdau nach Angaben des Herstellers aus den RNA-Proben entfernt. Dazu wurden 10µg Extrakt mit 1µl rDNase I und 10x Puffer für 30min bei 37°C inkubiert. Die DNase wurde danach durch Zugabe eines DNase-Inaktivators deaktiviert. Qualität und Quantität der extrahierten RNA wurde durch spektrophotometrische Messungen bei 260nm bestimmt. 2.2.18.2 Reverse Transkription zu cDNA DNA-freie RNA wurde mit dem Omniscript RT Kit nach Angaben des Herstellers und Oligo-d(t) Primern, die an den Poly-A-Schwanz von mRNA binden, in cDNA revers transkribiert. Dazu wurden jeweils 1µg einer RNA-Probe mit 2µl 10xPuffer, 2µl dNTP Mix, 1µM Oligo-d(t) Primern, 1µl Reverser Transkriptase, 0,33µl RNase Inhibitor und RNase-freiem Wasser in einem Gesamt-Reaktionsvolumen von 20µl gemischt und für 75min bei 37°C inkubiert. Es erfolgte eine 1:3 Verdünnung der cDNA mit H2O. Die cDNA wurde anschließend bis zur weiteren Analyse bei -20°C gelagert. Material und Methoden 2.2.18.3 34 Real-time PCR Die mRNA Expression wurde per real-time PCR in einem Rotor-Gene RG-3000 quantifiziert. Die real-time PCR wurde in einem Gesamt-Reaktionsvolumen von 20µl durchgeführt, bestehend aus 2µl 10x PCR Puffer, 0,2mM dNTPs, 0,2µl SYBR-Green, 0.5U Hotstar Taq Polymerase und 2µl cDNA. Für die Messung der mRNA Expressionslevel von β-Actin, IL-12p35, IL-10, IL-4, IL-5, CCL5, VE-Cadherin, JAM1, VEGF-A, Prox1, TSLP und LYVE-1 wurden Sequenz-spezifische Primer-Paare verwendet (2.1.12). Primer- und Magnesium-Konzentrationen variierten für jede PCR (2.1.12). Die Reaktionsbedingungen waren 15min bei 95°C, gefolgt von 45 Zyklen mit 15s bei 94°C, 20s bei 58°C und 20s bei 72°C. Die Kopienzahlen von IL-12p35, IL-10, IL-4, IL-5, CCL5, VE-Cadherin, JAM-1, VEGF-A, Prox1, TSLP und LYVE-1 wurden mit entsprechenden Plasmid-Standards bestimmt und jeweils anhand der Kopienzahl von β-Actin normalisiert. 2.2.18.4 Plasmid-Standards Zur Herstellung von Plasmid-Standards wurden PCR-Produkte unter Verwendung Sequenzspezifischer Primer (2.1.12) in einem PCR-Thermocycler amplifiziert in einem Reaktionsvolumen von 20µl, bestehend aus 2µl 10x PCR-Puffer, 0,1µl Taq-Polymerase, 0,1µl dNTP-Mix, 1,2µl MgCl2, je 1,2µl Primer, 12,2µl H2O und 2µl cDNA. Die Reaktionsbedingungen waren 15min bei 95°C, gefolgt von 1min bei 94°C, 1min bei 58°C und 2min bei 72°C in 35 Zyklen und 5min bei 72°C. Es wurde cDNA aus verschiedenen Organen der Maus wie Lunge, Lymphknoten, Leber oder Haut verwendet. Das entstandene PCR-Produkt wurde nach Angaben des Herstellers (Invitrogen, Karlsruhe, Deutschland) in einen TOPO-TA Klonierungsvektor ligiert und in chemisch-kompetente Zellen transformiert. Dazu wurden 2µl PCR-Produkt mit 1µl Salzlösung, 2µl H2O und 1µl TOPO Vektor für 5min bei Raumtemperatur inkubiert. 4µl des Ligations-Ansatzes wurden zu einem Röhrchen mit chemischkompetenten Escherichia coli Bakterien hinzugefügt und für 5min auf Eis inkubiert. 10µl bzw. 40µl des Transformationsansatzes wurden über Nacht auf LB-Platten, supplementiert mit Ampicillin, X-Gal und IPTG, kultiviert unter Selektionsdruck durch Ampicillin. Weiße Kolonien wurden gepickt und zur Erhaltung auf frischen LB-Platten ausgestrichen und kultiviert. Zudem erfolgte eine Kolonie-PCR (Reaktionsansatz und -Bedingungen wie oben, cDNA wurde durch H2O ersetzt) mit denselben Klonen als Matrize. Zum Nachweis Plasmid-positiver Zellen wurde das PCR-Produkt auf ein 2%iges AgaroseGel aufgetragen und elekrophoretisch aufgetrennt. Plasmid-positive Bakterienzellen wurden über Nacht bei 37°C in 5ml LB-Medium, supplementiert mit Ampicillin, kloniert. 800µl der Bakteriensuspension wurden mit 200µl Glycerin supplemetiert und zur weiteren Verwendung bei -80°C gelagert. Plasmid-DNA wurde aus der restlichen Zellsuspension mithilfe eines PlasmidMiniprep-Kits nach Angaben des Herstellers (Qiagen, Hilden, Deutschland) isoliert. Die Plasmid-DNA wurde spektrophotometrisch vermessen und zur Verifizierung des Inserts sequenziert. Anhand der Plasmidgröße, des Molekulargewichts und Konzentration der Plasmid-DNA wurde die Kopienzahl/µl berechnet, so dass die Plasmide als Standards mit definierter Kopienzahl/µl für real-time PCR Messungen verwendet werden konnten. Material und Methoden 2.2.19 35 Statistik Für die statistische Analyse der Daten wurde GraphPad Prism 5.0 Software verwendet. Zur Überprüfung der Daten auf Normalverteilung und zur Auswahl des entsprechenden Tests für statistische Analysen wurde der Kolmogorov-Smirnov-Test durchgeführt. Normalverteilte Daten wurden mit dem t-Test für ungepaarte Vergleiche (zwei Gruppen) analysiert oder mit One-way ANOVA und Tukey’s Multiple Comparison Test (mehr als zwei Gruppen), während nicht-parametrisch verteilte Daten mit Mann-Whitney Test (zwei Gruppen) oder mit Kruskal-Wallis-Test mit Dunn`s Multiple Comparison Test (mehr als zwei Gruppen) getestet wurden, um Unterschiede zwischen den einzelnen Gruppen festzustellen. p-Werte ≤0,05 wurden als signifikant erachtet (*, p≤0,05; **, p<0,01; ***, p<0,001). Ergebnisse 36 3 Ergebnisse 3.1 Expression von CCL17 durch Stimulierung mit FilarienAntigen Das Chemokin Thymus and activation-regulated chemokine (TARC/CCL17) spielt eine wichtige Rolle bei der Rekrutierung von Th2-Zellen und der Aufrechterhaltung von Th2-Immunantworten (Imai, Nagira et al. 1999). Dabei korreliert das Expressionslevel von CCL17 mit dem Schweregrad der Erkrankung in einigen chronischen allergischen Pathologien (1.3.1) und es weisen auch verschiedene Studien auf eine Bedeutung von CCL17 bei Infektionen mit helminthischen Parasiten hin: beispielsweise wird CCL17 in den ersten zwei Tagen einer durch Schistosoma mansoni-egg-antigen (SEA)-induzierten Granulombildung in der Lunge stark exprimiert (Chiu, Freeman et al. 2003). Zudem konnten in einem Modell für kutane Leishmaniose erhöhte Mengen von CCL17 in der Haut an der Infektionsstelle festgestellt werden (Espitia, Zhao et al. 2010). Auch ließen sich im Vergleich zu europäischen Infektions-freien Kontrollpatienten im Serum von Onchozerkose-Patienten erhöhte CCL17-Level messen (Fendt, Hamm et al. 2005). Über Bedeutung und Funktion des Chemokins CCL17 bei der frühen Immunantwort während einer Filarien-Infektion ist bisher jedoch kaum etwas bekannt. Alferink et al. entwickelten zur Untersuchung der in vivo Expression von CCL17 ein auf Fluoreszenz basierendes in vivo-Reporter System, bei dem eine grün-fluoreszierende Protein (enhanced green fluorescent Protein, eGFP)-GenKassette in den endogenen murinen CCL17-Lokus eingefügt wurde (Alferink, Lieberam et al. 2003). Es wurde gezeigt, dass aktivierte Langerhans-Zellen und vollentwickelte dendritische Zellen (DCs) in verschiedenen lymphoiden und nicht-lymphoiden Organen in den Reporter-Mäusen CCL17 exprimieren. Die Expression wurde nach Aktivierung von Toll-like Rezeptoren hochreguliert (Alferink, Lieberam et al. 2003). In den folgenden Versuchen wurde dieses in vivo-Reporter System zur Untersuchung der Expression von CCL17 nach Stimulierung mit Filarien-Antigen genutzt. 3.1.1 Stimulierung mit Wurmextrakt von L. sigmodontis führt zur Aktivierung dendritischer Zellen Durch ihre strategisch günstige Lage in der Haut sind dendritische Zellen eine der ersten Immunzellen, die auf eindringende Pathogene treffen und Immunantworten einleiten können. Auch Filarien dringen in die Haut ihres Wirts ein, wenn sie während einer Blutmahlzeit ihres Zwischenwirts auf den neuen Wirt übertragen werden. Daher wurde zunächst untersucht, welches Potential Filarien-Antigene zur Aktivierung von dendritischen Zellen besitzen. Dazu wurden aus Knochenmarkszellen von CCL17-Reporter-Mäusen (CCL17+/-) durch Kultivierung mit GM-CSF-haltigem Medium dendritische Zellen (Bone marrow derived dendritic cells, BMDCs) generiert. Aus Abbildung 2 ist erkennbar, dass die Stimulierung dieser BMDCs für 24h mit Wurmextrakt der Filarie Litomosoides sigmodontis (LsAg) zu einer deutlichen Aktivierung der dendritischen Zellen führte. So exprimierten mit LsAg stimulierte BMDCs signifikant erhöhte Mengen der Aktivierungsmarker CD40 (Abbildung 2A) und CD80 (Abbildung 2B) im Vergleich zu unstimulierten Kontrollen. Im Vergleich war LsAg etwas weniger stimulativ als die TLR2- bzw. TLR4Liganden Pam3Cys und LPS. Interessanterweise erhöhte sich die Anzahl CCL17-exprimierender BMDCs nach Stimulierung mit LsAg (Abbildung 2C). Die Zellen sezernierten nach Stimulierung mit Ergebnisse 37 LsAg eine signifikant erhöhte Menge des Chemokins CCL17 (Abbildung 2E) und des proinflammatorischen Zytokins Interleukin-6 (IL-6) (Abbildung 2D). Die Ergebnisse zeigen, dass LsAg eine Aktivierung dendritischer Zellen und Zytokin- und Chemokin-Antworten, darunter die Produktion von CCL17, induzieren kann. Abbildung 2: BMDCs werden durch Stimulation mit LsAg aktiviert und exprimieren CCL17. BMDCs wurden in vierfach-Bestimmung für 24h mit Medium, 100ng/ml LPS, 100ng/ml Pam3Cys oder 100µg/ml + LsAg stimuliert. Die prozentualen Anteile der CD40- (A), CD80- (B) und CCL17-Expression (C) aller CD11c dendritischer Zellen wurden per FACS-Analyse sowie die Mengen an IL-6- (D) und CCL17-Protein (E) in den Kulturüberständen mittels ELISA bestimmt und als Mittelwerte ± Standardabweichung abgebildet. Dargestellt werden repräsentative Daten von drei unabhängigen Experimenten. Signifikanzen wurden mit One-way ANOVA und Tukey’s Multiple Comparison Test getestet (dargestellt werden Signifikanzen gegenüber der MediumKontrolle). 3.1.2 Expression von CCL17 nach natürlicher Infektion mit L. sigmodontis in Haut, Lymphknoten und Lunge Zusätzlich zum Aktivierungspotential von Filarien-Antigen in vitro wurde die in vivo-Expression von CCL17 in verschiedenen Organen zu unterschiedlichen Zeitpunkten nach Infektion mit Filarien untersucht. Dazu wurden CCL17-Reporter-Mäuse (CCL17+/-) mit der Nagetier-Filarie Litomosoides sigmodontis infiziert, einem etablierten Nagetier-Modell für Filarien-Erkrankungen. Bei der natürlichen Infektion mit Ornithonyssus bacoti Milben werden Larven von L. sigmodontis auf das Nagetier übertragen, die Larven dringen in die Haut ein und migrieren von dort über lymphatische Gefäße und Lymphknoten zum Herzen und gelangen über die Blutzirkulation in die Lunge, um letztendlich in die Pleura-Höhle zu penetrieren. Daher wurde für diese Untersuchung den infizierten Tieren nach unterschiedlichen Zeiträumen Haut, Lunge und periphere Lymphknoten entnommen und die Expression von CCL17 anhand der eGFP-Expression der Zellen mittels konfokaler Laser-Mikroskopie untersucht. Ergebnisse 38 A Abbildung 3:: Natürliche Infektion mit L. sigmodontis führt zur Expression von CCL17 in Haut, Lymphknoten L +/und Lunge in CCL17 Reportermäusen. Konfokale Bilder von Schnitten ten aus Haut, drainierenden Lymphknoten (LN) und Lunge von uninfizierten (uninf) +/CCL17 Mäusen werden gezeigt und zu verschiedenen Zeitpunkten nach Infektion mit L. sigmodontis. (B-D) +/Drainierende Lymphknoten (B), ), Lunge ((C) und Milz (D) infizierter CCL17 (weiße Balken) und C3H/HeN + Wildtyp-Mäuse Mäuse (schwarze Balken) wurden Kollagenase Kollagenase-verdaut, verdaut, die Zellen nach CD11c DCs sortiert und per + + FACS-Analyse Analyse auf den prozentualen Anteil eGFP / MHC Klasse II DCs untersucht. Die Daten aus zwei vergleichbaren Experimenten werden als Mittelwerte ± Standardabweichung dargestellt. Signifikanzen wurden mit One-way ANOVA und Tukey’s Multiple Comparison Test getestet (dargestellt dargestellt werden Signifikanzen gegenüber der uninfizierten Kontrolle). Es zeigte sich, dass CCL17 bereits 6h nach Infektion (post infection,, pi) in der Haut der Mäuse exprimiert wird (Abbildung 33A). A). Naive, uninfizierte Mäuse hingegen zeigten keine Expression von CCL17. Einee zunehmende Expression von CCL17 nach Infektion mit L. sigmodontis konnte zudem in axialen, inguinalen und poplitealen peripheren Lymphknoten (LN) und der Lunge beobachtet werden (Abbildung 3A). A). Alferink et al. zeigten bereits, dass es sich bei diesen CCL17+ Zellen um CD11c+ dendritische Zellen handelt (Alferink, Lieberam et al. 2003).. Mittels quantitativer FACS-Analyse FACS Ergebnisse 39 konnte damit übereinstimmend gezeigt werden, dass die Anzahl CCL17+ MHC Klasse II+ CD11c+ dendritischer Zellen schon 6hpi in den peripheren LN signifikant zunahm, wobei 5 Tage nach Infektion ein Maximum in der Expression erreicht wurde (Abbildung 3B). In den Lungen der eGFPReporter-Mäuse zeigte sich ein ähnlicher Trend, hier erhöhte sich nach einem Tag die Anzahl CCL17+ MHC Klasse II+ DCs leicht, wobei die größte Anzahl der Zellen 10dpi erreicht wurde (Abbildung 3C). Bei dendritischen Zellen in der Milz konnte bei naiven CCL17+/- Mäusen eine marginale eGFPExpression festgestellt werden von weniger als einem halben Prozent, die jedoch nach Infektion mit L. sigmodontis zu keinem der gemessenen Zeitpunkte zunahm (Abbildung 3D). Bei C3H/HeN WildtypMäusen, die als Kontrolle dienten, konnte in keinem der Organe ein eGFP-Signal detektiert werden. Es zeigte sich somit, dass Filarien auch in vivo eine Aktivierung von dendritischen Zellen und damit einhergehend die Expression von CCL17 durch DCs in den untersuchten Geweben Haut, Lymphknoten und Lunge induzieren können, die sich auf dem Migrations-Weg der infektiösen Larven zu ihrem Ziel, der Pleura-Höhle befinden. In der Milz hingegen konnte keine Expression von CCL17 detektiert werden. 3.2 Immunantworten bei CCL17-Defizienz in der PleuraKavität Um weiter die Bedeutung und Funktion des Chemokins CCL17 bei der Immunantwort während einer Filarien-Infektion zu untersuchen, wurden im zweiten Teil dieser Arbeit sowohl parasitologische als auch immunologische Auswirkungen zu verschiedenen Zeitpunkten nach natürlicher Infektion mit L. sigmodontis bei heterozygoten und CCL17-defizienten Mäusen in der Pleura-Höhle analysiert. 3.2.1 Erhöhte Wurmlast bei CCL17-Defizienz nach Infektion mit L. sigmodontis Um den Einfluss von CCL17 auf die Immunabwehr von Filarien zu untersuchen, wurden heterozygote (CCL17+/-) und CCL17-defiziente (CCL17-/-) Mäuse, die alle zum gleichen Zeitpunkt mit derselben Charge Milben natürlich mit L. sigmodontis infiziert wurden, zu unterschiedlichen Zeitpunkten nach der Infektion hinsichtlich der Parasitenlast in der Pleura-Höhle analysiert. Es ist bekannt, dass innerhalb der ersten 10 Tage nach Infektion der Großteil der Larven die Pleura-Höhle erreicht. So zeigte sich in diesem Experiment 10 Tage nach Infektion, dass sich in CCL17-/- Mäusen eine 4-fach erhöhte Wurmlast im Vergleich zur Kontrollgruppe etablieren konnte (Abbildung 4). In früheren Infektionsexperimenten wurde gezeigt, dass sich eine bereits 10 Tage nach Infektion etablierte Wurmanzahl kaum über die nächsten 20 Tage sowohl in suszeptiblen BALB/c als auch in resistenten C57BL/6 bzw. B10D2 Mäusen verändert (Marechal, Le Goff et al. 1996; Babayan, Ungeheuer et al. 2003). So zeigte sich auch hier in zwei unabhängigen Experimenten mit Mäusen auf semi-resistenten C3H/HeN-Hintergrund, dass sowohl 20 als auch 30 Tage nach Infektion weiterhin signifikant höhere Wurmzahlen in CCL17-/- Mäusen zu finden waren (Abbildung 4A). Die Anzahl der Parasiten unterschied sich innerhalb der Gruppen zu den verschiedenen Zeitpunkten nicht bedeutend. Der Einfluss von CCL17 auf die Immunabwehr von Filarien scheint zudem in heterozygoten Mäusen, bei denen eines der CCL17-Allele durch die Insertion von eGFP ausgeschaltet wurde, mit dem in Wildtyp-Mäusen, wo beide Allele von CCL17 noch intakt sind, vergleichbar zu sein. Die Wurmlast in beiden Gruppen war zueinander nicht unterschiedlich, jedoch signifikant niedriger im Vergleich zur Parasitenanzahl in CCL17-defizienten Mäusen (Abbildung 4B). Ergebnisse 40 -/- +/- Abbildung 4: Erhöhte Parasitenlast bei CCL17 Mäusen und anti-CCL17 behandelten CCL17 Mäusen im +/Vergleich zu unbehandelten CCL17 und Wildtyp-Mäusen nach natürlicher Infektion mit L. sigmodontis. +/- -/- (A) C3H/HeN CCL17 und CCL17 Mäuse wurden für 10, 20 oder 30 Tage natürlich mit L. sigmodontis infiziert und die Anzahl der Würmer in der Pleura-Höhle bestimmt. Es werden Daten eines repräsentativen Experiments von zweien dargestellt. Die Daten zu jedem Zeitpunkt wurden mit Mann-Whitney Test analysiert. (B, C) Die Parasitenanzahl in C3H/HeN Wildtyp (+/+), CCL17-heterozygoten (+/-) und CCL17-homozygoten (-/-) Mäusen +/-/(B) sowie in C57BL/6 CCL17 und CCL17 Mäusen (C) wurde 30 Tage nach Infektion mit L. sigmodontis analysiert. Dargestellt werden jeweils repräsentative Daten eines von zwei unabhängigen Experimenten. (D) +/Die Parasitenlast wurde bei CCL17 Mäusen, behandelt mit anti-CCL17 Antikörper, im Vergleich zu +/-/unbehandelten CCL17 und CCL17 Mäusen 10 Tage nach Infektion mit L. sigmodontis bestimmt. Daten eines von zwei unabhängigen Experimenten werden gezeigt. Die Daten wurden mit ungepaartem t-Test (C) oder mit One-way ANOVA und Tukey’s Multiple Comparison Test (B, D) analysiert. Zusätzlich wurden, um Einflüsse durch den genetischen Hintergrund der CCL17-defizienten Mäuse auf die Parasitologie auszuschließen, im Vergleich zu CCL17-/- Mäusen auf C3H/HeN Hintergrund auch Mäuse auf C57BL/6 Hintergrund mit L. sigmodontis infiziert, da bekannt ist, dass verschiedene Mausstämme unterschiedlich suszeptibel gegenüber der Infektion mit L. sigmodontis sind. So entwickeln resistente C57BL/6 Mäuse wie semi-resistente Mäuse auf C3H/HeN Hintergrund keine patente Infektion im Gegensatz zu voll suszeptiblen BALB/c Mäusen (Petit, Diagne et al. 1992; Le Goff, Lamb et al. 2002). Es zeigte sich, dass C57BL/6 CCL17-/-, ähnlich wie CCL17-/- auf C3H/HeN Hintergrund, 30 Tage nach natürlicher Infektion eine signifikante Erhöhung in der Wurmlast im Vergleich zur Kontrollgruppe aufweisen (Abbildung 4C), was darauf hindeutet, dass der genetische Hintergrund bei CCL17-defizienten Mäusen selbst keinen Einfluss auf die Parasitologie hat. Frühere Zeitpunkte wurden nicht getestet, da bekannt ist, dass sich eine um Tag 10 pi etablierte Wurmanzahl bis Tag 30 pi kaum verändert (Marechal, Le Goff et al. 1996; Babayan, Ungeheuer et al. 2003). Ergebnisse 41 Der Knockout eines Gens kann Auswirkungen auf die Entwicklung eines Lebewesens haben, z.B. direkt auf die Ausbildung von Organen, dem lymphatischen System o.ä. Im schlimmsten Fall ist die Defizienz eines Gens letal, wie z.B. für die Defizienz von VEGF-A in der frühen embryonalen Entwicklung gezeigt wurde (Carmeliet, Ferreira et al. 1996; Ferrara, Carver-Moore et al. 1996). Um daher mögliche indirekte Einflüsse ontogenetischer Effekte durch den CCL17-Knock-out auf die Etablierung von Filarien auszuschließen, wurden CCL17+/- Mäuse mit anti-CCL17 Antikörper vor und während der 10-tägigen Infektion mit L. sigmodontis behandelt. Es zeigte sich, dass die Behandlung von CCL17+/- Mäusen mit anti-CCL17 Antikörpern ebenfalls zu einer erhöhten Wurmlast in den Tieren führte, vergleichbar hoch mit unbehandelten CCL17-Knockout Mäusen jedoch signifikant unterschiedlich zu unbehandelten CCL17+/- Mäusen (Abbildung 4D). Mit den Ergebnissen der Experimente konnte gezeigt werden, dass CCL17-abhängige Mechanismen für die Abwehr der eindringenden L. sigmodontis-Larven eine Rolle spielen. Dabei sind die CCL17-abhängigen Immunreaktionen unabhängig vom genetischen Hintergrund der Maus oder ontogenetischen Effekten durch die genetische Manipulation des Genoms. 3.2.2 Zelluläre Antworten bei CCL17-Defizienz nach Infektion mit L. sigmodontis Da viele der Zellen, denen eine besondere Bedeutung bei der Abwehr von Filarien zukommt, CCR4 exprimieren, den Rezeptor für CCL17, sollte der Einfluss der CCL17-Defizienz auf die zellulären Immunantworten bei einer Filarien-Infektion analysiert werden. Dazu wurden CCL17-defiziente Mäuse auf C3H/HeN Hintergrund im Vergleich mit CCL17+/- Mäusen für 10, 20 und 30 Tage mit L. sigmodontis infiziert und die Zellkomposition in der Pleura-Höhle per FACS- oder Cytospin-Analyse untersucht mit speziellem Fokus auf CCR4-exprimierende Zellpopulationen. Tabelle 1: Akkumulation von T- und B-Lymphozyten und Antigen-präsentierenden Zellen in der Pleura-Höhle +/-/von C3H/HeN CCL17 und CCL17 10, 20 und 30 Tage nach natürlicher Infektion mit L. sigmodontis (dargestellt als prozentualer Anteil aller lebenden Zellen). 10dpi +/- -/- 20dpi +/- 30dpi -/- +/- -/- CCL17 CCL17 pWert* + 6,15 ± 4,16 7,93 ± 0,61 0,504 6,68 ± 1,76 7,92 ± 0,76 0,192 2,26 ± 0,92 1,78 ± 0,49 0,334 + 2,88 ± 2,87 1,73 ± 0,92 0,545 4,58 ± 0,50 4,64 ± 0,71 0,882 1,82 ± 0,73 3,74 ± 1,29 0,020 CD4 CD25 TZellen 1,43 ± 0,75 2,88 ± 0,55 0,012 1,54 ± 0,94 3,54 ± 1,33 0,025 0,12 ± 0,04 0,62 ± 0,08 <0,0001 B-Zellen 38,00 ± 11,90 26,70 ± 5,30 0,192 37,48 ± 8,06 36,24 ± 11,70 0,863 24,24 ± 14,48 24,96 ± 6,08 0,921 Makrophagen 37,18 ± 13,56 52,37 ± 7,98 0,149 53,38 ± 7,01 56,82 ± 7,31 0,498 51,54 ± 23,72 39,38 ± 6,09 0,229 DCs 4,15 ± 1,49 4,67 ± 1,10 0,637 4,15 ± 0,87 4,62 ± 0,64 0,380 0,92 ± 0,27 1,32 ± 0,13 0,017 CD4 T-Zellen CD8 T-Zellen + + CCL17 CCL17 pWert* CCL17 CCL17 pWert* Mittelwert ± Standardabweichung n = 5, Daten eines von zwei vergleichbaren Experimenten +/-/* Unterschiede zwischen CCL17 und CCL17 zu den jeweiligen Zeitpunkten wurden mit ungepaartem t-Test getestet. 10, 20 und 30 Tage nach natürlicher Infektion zeigte sich in FACS-Analysen, dass keine signifikanten Unterschiede in der prozentualen Anzahl von CD4+ T-Zellen, B-Zellen und Makrophagen Ergebnisse 42 zwischen CCL17-/- und CCL17+/- Mäusen vorlagen (Tabelle 1). Die Anzahl CD8+ T-Zellen und dendritischer Zellen blieb 10 und 20dpi zwischen den Gruppen gleich, dagegen war 30dpi der Anteil CD8+ T-Zellen und der von DCs in CCL17-defizienten Mäusen im Vergleich zu den Kontroll-Mäusen erhöht. CD4+CD25+ T-Zellen waren sowohl 10dpi als auch 20dpi und 30dpi in CCL17-/- Mäusen signifikant erhöht. Bei Untersuchung der Zellkomposition in der Pleura-Kavität von C57BL/6 Mäusen per FACS-Analyse 30dpi konnte im Vergleich bei keiner der untersuchten Zellpopulationen ein signifikanter Unterschied zwischen CCL17+/- und CCL17-/- Mäusen festgestellt werden (Tabelle 2). + + Tabelle 2: Prozentuale Anteile von CD4 T-Zellen, CD8 T-Zellen, B-Zellen, Makrophagen und DCs in der +/-/Pleura-Kavität von C57BL/6 CCL17 und CCL17 30 Tage nach Infektion mit L. sigmodontis. +/- -/- CCL17 CCL17 p-Wert* + 3,48 ± 1,52 (3,14) 3,72 ± 0,79 (3,65) 0,5350 + CD8 T- Zellen 1,40 ± 0,62 (1,47) 1,09 ± 0,33 (1,10) 0,3829 B-Zellen 7,64 ± 3,75 (6,60) 9,39 ± 1,97 (9,33) 0,0728 Makrophagen 64,11 ± 8,42 (65,47) 61,09 ± 6,45 (59,07) 0,2593 DCs 0,82 ± 0,20 (0,77) 0,81 ± 0,21 (0,77) 0,9078 CD4 T-Zellen Mittelwerte ± Standardabweichung (Median) n=7, repräsentative Daten eines von zwei Experimenten +/-/* Unterschiede zwischen CCL17 und CCL17 Mäusen wurden mit Mann-Whitney Test analysiert. Abbildung 5: Leicht erhöhte Anzahl eosinophiler Granulozyten in CCL17-defizienten Mäusen 10, 20 und 30 Tage nach natürlicher Infektion. +/- -/- 10, 20 und 30 Tage nach natürlicher Infektion von C3H/HeN CCL17 und CCL17 Mäusen wurde der prozentuale Anteil an Eosinophilen (A) und Neutrophilen (B) in der Pleura-Höhle anhand von CytospinPräparationen bewertet. Ergebnisse eines Experiments von Zweien werden als Mittelwerte ± Standardabweichung dargestellt (One-way ANOVA und Tukey’s Multiple ComparisonTest). Bei Infektionsexperimenten mit L. sigmodontis zeigte sich eine stetige Zunahme von Eosinophilen in der Pleura-Kavität bis 30 Tage nach Infektion bei gleich bleibender Wurmlast sowohl in BALB/c als auch C57BL/6 Mäusen (Babayan, Ungeheuer et al. 2003). So zeigte sich auch bei Cytospin-Analysen von C3H/HeN CCL17+/- und CCL17-/- Mäusen, dass bis Tag 30 nach Infektion die Anzahl eosinophiler Granulozyten in der Pleura-Höhle in beiden Mausgruppen stetig zunahm (Abbildung 5A). Dabei war bei CCL17-/- Mäusen, welche signifikant höhere Wurmlasten gegenüber der Kontrollgruppe aufwiesen (Abbildung 4A), die Tendenz zu mehr Eosinophilen in der Pleura-Höhle zu beobachten. Die Anzahl von Neutrophilen blieb zu allen drei untersuchten Zeitpunkten in beiden Mausgruppen sehr gering bei durchschnittlich 1,5% (Abbildung 5B). Ergebnisse 43 Die Ergebnisse lassen vermuten, dass der Einfluss von CCL17 auf die Rekrutierung von CCR4+ Zellen in die Pleura-Höhle 10-30 Tage nach Infektion mit L. sigmodontis insgesamt nur von geringer Bedeutung bei der Immunabwehr von Filarien ist. Eine Rolle von CD4+CD25+ T-Zellen beim Abwehrprozess ließ sich allerdings nicht ausschließen und wurde nachfolgend weiter untersucht. 3.2.2.1 Erhöhte Wurmlast bei CCL17-Defizienz unabhängig von CD25+ Zellen Zu allen drei analysierten Zeitpunkten nach Infektion mit L. sigmodontis konnte eine signifikant erhöhte Anzahl CD4+CD25+ T-Zellen bei CCL17-defizienten Mäusen beobachtet werden. Dies ließ vermuten, dass T-regulatorische Zellen durch ihre supprimierende Wirkung bei der CCL17abhängigen Immunabwehr von Filarien von großer Bedeutung und an der Etablierung größerer Parasitenlasten beteiligt sein könnten. Es ist bekannt, dass Filarien eine schnelle Rekrutierung und Proliferation von CD4+Foxp3+ T-regulatorische Zellen, die mehrheitlich CD25 konstitutiv exprimieren, induzieren und dass diese Einfluss auf die Filarien-Infektion haben. Daher wurden die Auswirkungen einer Depletion CD25+ T-regulatorischer Zellen auf die Etablierung der Wurmlast bei einer CCL17Defizienz untersucht. Abbildung 6: Die Etablierung einer erhöhte Parasitenlast bei CCL17-Defizienz ist unabhängig von CD25 Zellen. + Einen Tag vor Infektion wurden CCL17-defiziente Mäuse mit anti-CD25 Antikörper behandelt und zusammen +/-/mit unbehandelten CCL17 und CCL17 Mäusen mit L. sigmodontis natürlich infiziert. 10dpi wurde die Larvenanzahl in der Pleura-Höhle bestimmt. Die Ergebnisse von einem Experiment werden als Streudiagramm mit Mittelwerten dargestellt, die Daten wurden mit One-way ANOVA und Tukey’s Multiple Comparison Test analysiert. Die Neutralisierung von CD25+ Zellen durch Behandlung von CCL17-/- mit anti-CD25 Antikörper (Klon PC61) einen Tag vor der Infektion mit L. sigmodontis führte jedoch 10dpi nicht zu einer Reduktion der Wurmzahlen im Vergleich zu unbehandelten CCL17-defizienten Mäusen (Abbildung 6). Sowohl anti-CD25 behandelte als auch unbehandelte CCL17-/- Mäuse zeigten eine deutlich erhöhte Wurmlast im Vergleich zu CCL17+/- Mäusen, obwohl eine klare Reduktion von CD4+CD25+ T-Zellen in der Pleura-Höhle um 83% und in mediastinalen, inguinalen und axialen Lymphknoten um 84-86% vorhanden war (Daten nicht gezeigt). Somit ist es wahrscheinlich, dass die erhöhte Anzahl CD4+CD25+ T-Zellen in der Pleura-Kavität nicht ausschlaggebend ist für die erhöhte Wurmlast in CCL17-defizienten Mäusen. Ergebnisse 44 3.2.2.2 CCR4-unabhängige Immunabwehr bei Filarien-Infektionen Trotz einer erhöhten Wurmlast in CCL17-/- Mäusen konnten nur geringe Unterschiede bei der zellulären Komposition in der Pleura-Höhle zwischen CCL17-defizienten und heterozygoten CCL17Mäusen festgestellt werden. CCR4 gilt als hochaffiner Rezeptor für CCL17 und wird von vielen verschiedenen Zelltypen exprimiert, für die auch eine spezifische Rolle in der Immunabwehr von Filarien gezeigt werden konnte, wobei auch spekuliert wird, ob CCL17 ein Ligand von CCR8 ist. Es wäre somit möglich, dass die Etablierung der erhöhten Wurmlast in CCL17-defizienten Mäusen von einer eingeschränkten Rekrutierung CCR4-exprimierender Zellen in die Pleura-Höhle aufgrund einer fehlenden Rezeptor-Liganden-Interaktion zwischen CCR4 und CCL17 abhängig ist. Daher sollte untersucht werden, welchen Einfluss die CCR4-abhängige Rekrutierung von Zellen in die PleuraKavität auf die Immunabwehr von Filarien besitzt. Abbildung 7: CCR4-Defizienz führt in Mäusen zu keiner erhöhten Wurmlast 10dpi. -/- +/+ 10 Tage nach natürlicher Infektion von C57BL/6 CCR4 und Wildtypmäusen (CCR4 ) wurde die Anzahl der Larven in der Pleura-Höhle bestimmt (n=8). Die Ergebnisse eines Experiments werden als Streudiagramm mit Median dargestellt. Die Daten wurden mit dem Mann Whitney Test analysiert. Dazu wurden CCR4-defiziente Mäuse auf C57BL/6 Hintergrund natürlich mit L. sigmodontis infiziert. In CCR4-defizienten Mäuse befand sich die Wurmanzahl auf dem Level von Wildtyp-Mäusen (Abbildung 7) und wiesen somit im Gegensatz zu CCL17-defizienten Mäusen (Abbildung 4C) keine erhöhte Wurmlast 10 Tage nach Infektion auf. Per FACS-Analyse wurde die zelluläre Zusammensetzung in der Pleura-Höhle in infizierten CCR4-/- Mäusen auf Veränderungen hin untersucht, dabei insbesondere auf CCR4-exprimierende Zelltypen fokussierend. Es zeigte sich, dass weder bei CD4+ oder CD8+ T-Zellen noch bei CD4+CD25+ T-Zellen signifikante Unterschiede im prozentualen Anteil der Zellen in der Pleura-Höhle zwischen CCR4-defizienten und CCR4-positiven Mäusen festgestellt werden konnte. Auch für B-Zellen und Makrophagen zeigten sich keine Unterschiede (Tabelle 3). Diese Ergebnisse legen den Schluss nahe, dass die CCR4-abhängige Rekrutierung von Zellen in die Pleura-Höhle durch die Interaktion von CCL17 mit CCR4 keinen Einfluss auf die Immunabwehr von Filarien hat. Ergebnisse 45 + + + + Tabelle 3: Prozentuale Anteile von CD4 T-Zellen, CD8 T-Zellen, CD4 CD25 T-Zellen, B-Zellen und -/Makrophagen in der Pleura-Höhle von C57BL/6 CCR4 und Wildtypmäusen 10 Tage nach Infektion mit L. sigmodontis. +/+ -/- CCR4 CCR4 p-Wert* + 8,61 ± 2,77 12,83 ± 4,90 0,0523 + 11,11 ± 5,47 13,95 ± 5,25 0,3074 CD4 CD25 T-Zellen 2,33 ± 0,96 3,46 ± 1,71 0,1248 B-Zellen 7,51 ± 2,18 7,39 ± 3,68 0,9395 Makrophagen 32,62 ± 13,92 43,56 ± 12,19 0,1169 CD4 T-Zellen CD8 T- Zellen + + Mittelwerte ± Standardabweichung n=8, Daten eines Experiments +/+ -/*Unterschiede zwischen CCR4 und CCR4 Mäusen wurden mit ungepaartem t-Test analysiert. 3.2.3 Zytokin-Antworten bei CCL17-Defizienz nach Infektion mit L. sigmodontis Da sowohl Th1 als auch Th2 Zytokin-Antworten in der Abwehr von Filarien-Infektionen eine Rolle spielen (1.5.3), wurde die Auswirkung einer CCL17-Defizienz auf die Zytokinantworten von Zellen in der Pleura-Höhle hin untersucht, um die erhöhte Wurmlast bei CCL17-defizienten Mäusen zu erklären. Daher wurden neben der zellulären Zusammensetzung verschiedene pro- und antiinflammatorische Zytokine in der pleuralen Coelomflüssigkeit von CCL17-defizienten Mäusen und Kontrollen 10, 20 und 30 Tage nach natürlicher Infektion mit L. sigmodontis mittels ELISA gemessen. Tabelle 4: Zytokin-Level (ng/ml) in der Pleura-Spülung von CCL17 nach natürlicher Infektion mit L. sigmodontis. CCL17 10dpi -/CCL17 IFN-γ 0,13 ± 0,05 IL-5 +/- p-Wert* CCL17 20dpi -/CCL17 0,12 ± 0,04 0,762 0,01 ± 0,01 0,04 ± 0,05 0,09 ± 0,15 0,543 IL-10 0,02 ± 0,04 0,01 ± 0,02 IL-12p70 0,13 ± 0,17 0,11 ± 0,06 +/- -/- und CCL17 Mäusen 10, 20 und 30 Tage p-Wert* CCL17 30dpi -/CCL17 0,05 ± 0,04 0,081 0,11 ± 0,09 0,06 ± 0,06 0,305 0,01 ± 0,02 0,12 ± 0,18 0,190 0,05 ± 0,04 0,09 ± 0,18 0,672 0,556 6,55 ± 0,20 6,98 ± 1,19 0,449 13,83 ± 1,86 15,81 ± 0,07 0,045 0,817 0,85 ± 0,70 0,29 ± 0,21 0,122 8,64 ± 4,67 8,17 ± 3,53 0,122 +/- +/- p-Wert* Mittelwert ± Standardabweichung n = 5, Daten eines Experiments aus zwei vergleichbaren Experimenten +/-/*Unterschiede zwischen CCL17 und CCL17 Mäusen zu allen drei Zeitpunkten wurden mit ungepaartem tTest getestet. Für die Level der Th1-typischen Zytokine IFN-γ und IL-12p70 als auch für den des Th2-typischen Zytokins IL-5 zeigten sich keine signifikanten Unterschiede zwischen CCL17-heterozygoten und CCL17-defizienten Mäusen zu keinem der gemessenen Zeitpunkte (Tabelle 4). Lediglich 30 Tage nach Infektion konnte in CCL17-defizienten Mäusen eine leicht, aber signifikant erhöhte Menge des antiinflammatorischen Zytokins IL-10 gemessen werden (9,99 ng/ml ± 6,1 ng/ml bei CCL17-/- Mäusen zu 8.82 ng/ml ± 5.5 ng/ml bei CCL17+/- Mäusen). Ergebnisse 46 Die Defizienz von CCL17 scheint somit keinen besonderen Einfluss auf die Zytokinausschüttung in der Pleura-Höhle während einer Filarien-Infektion zu haben. Die erhöhten Level an IL-10 30dpi könnten allerdings auf eine IL-10-abhängige Suppression der Immunantwort hinweisen, die möglicherweise zur erhöhten Wurmlast in CCL17-defizienten Mäusen geführt hat. 3.2.3.1 Erhöhte Wurmlast bei CCL17-Defizienz unabhängig von IL-10 Da erhöhte Mengen an IL-10 in der pleuralen Coelomflüssigkeit gemessen werden konnten, wurde die Rolle von IL-10 bei CCL17-Defizienz während einer Filarien-Infektion untersucht. Verschiedene Zellen kämen als Quelle für IL-10 während der Infektion mit L. sigmodontis in Frage, darunter z.B. CD4+ oder CD8+ T-Zellen, T-regulatorische Zellen oder B-Zellen. Viele von ihnen können CCR4 oder CCL17 selbst exprimieren und könnten durch die Defizienz von CCL17 in ihrer Funktion oder Aktivierung so beeinflusst worden sein, dass sie vermehrt IL-10 exprimierten, welches Auswirkungen auf die Immunabwehr der L. sigmodontis-Infektion hätte haben können. Abbildung 8: IL-10-unabhängige Etablierung einer erhöhten Parasitenlast bei CCL17-Defizienz. CCL17-defiziente Mäuse wurden mit anti-IL-10 Antikörper behandelt und zusammen mit unbehandelten +/-/CCL17 und CCL17 Mäusen mit L. sigmodontis natürlich infiziert. 10dpi wurde die Larvenanzahl in der PleuraHöhle bestimmt. Die Ergebnisse von einem Experiment werden als Streudiagramm mit Mittelwerten dargestellt. Die Daten wurden statistisch mit Kruskal-Wallis-Test und Dunn’s Multiple Comparison Test analysiert. CCL17-/- Mäuse wurden mit anti-IL10 behandelt und für 10 Tage natürlich mit L. sigmodontis infiziert. Die Depletion von IL-10 führte jedoch in CCL17-/- Mäusen zu keiner signifikanten Reduktion der Wurmanzahl im Vergleich zu unbehandelten CCL17-/- oder auf Level von unbehandelten CCL17+/Mäusen (Abbildung 8). Allerdings war die als interne Kontrolle dienende Wurmlast zwischen CCL17+/und CCL17-/- Mäusen nicht signifikant unterschiedlich, es war nur ein starker Trend dazu zu erkennen. Die natürliche Infektion mit Milben unterliegt gewissen Variationen, da stets die Möglichkeit besteht, dass bei der natürlichen Infektion im Durchschnitt trotz gleicher Exposition der Mäuse mit derselben Charge Milben unterschiedlich viele Larven auf die Mäuse übertragen werden. So trat bei wenigen Experimenten der Fall ein, dass anstatt einer signifikant erhöhten Wurmlast in CCL17-/- Mäusen nur der Trend dazu zu erkennen war. Die Daten lassen dennoch vermuten, dass IL-10 nicht der Auslöser für die erhöhte Wurmlast bei CCL17-Defizienz ist, da sowohl in IL-10-depletierten als auch unbehandelten CCL17-/- Mäusen ein starker Trend zur erhöhten Wurmlast im Vergleich zu unbehandelten CCL17+/- Mäusen festzustellen war. Zusammengefasst zeigen die Ergebnisse, dass eine CCL17-abhängige Rekrutierung oder eine andere mögliche Beeinflussung der Zellen durch CCL17 zum Zeitpunkt der Etablierung der Würmer in der Pleura-Höhle keine Rolle zu spielen scheinen sondern die entscheidenden CCL17-abhängigen Ergebnisse 47 Immunreaktionen, die zu erhöhten Wurmzahlen in CCL17-defizienten Mäusen führen, zu einem früheren Zeitpunkt als 10 Tage nach Infektion stattfinden müssen. 3.3 Frühe Immunantworten bei CCL17-Defizienz in der Haut Da die entscheidenden CCL17-abhängigen Immunreaktionen, die zu erhöhten Wurmzahlen in CCL17-defizienten Mäusen führen, anscheinend noch vor der Etablierung der Larven in der PleuraHöhle stattfinden, wurde im dritten Teil dieser Arbeit untersucht, ob bei CCL17-Defizienz ihres Wirts es Larven besser bzw. einfacher gelingt den Immunmechanismen in der Haut zu entkommen als unter natürlichen Bedingungen. Es ist bekannt, dass infektiöse L. sigmodontis L3 Larven nach Transmission durch ihren Vektor in die Haut ihres Wirts eindringen und sich ihren Weg durch lymphatische Gefäße zu den drainierenden Lymphknoten suchen und von dort weiter in das Herz und den Blutkreislauf migrieren, um dann über die Lunge in die Pleura-Höhle einzudringen (Wenk 1967). Der erste Kontakt der Larven mit dem Wirts-Immunsystem findet direkt in der Haut statt, so dass nach dem Eindringen in die Haut bis zu 70% der Larven innerhalb der ersten zwei Tage nach Infektion den Immunmechanismen des Wirts erliegen (Marechal, Le Goff et al. 1996). Verschiedene Zelltypen in der Haut sind in der Lage CCL17 zu exprimieren, darunter dendritische Zellen, Langerhanszellen, Endothelzellen, Keratinozyten und Fibroblasten. Zudem können einige von ihnen, wie dendritischen Zellen, Langerhanszellen und Mastzellen CCR4 exprimieren, so dass Filarien kurz nach dem Eindringen in die Haut CCL17-abhängige Immunmechanismen induzieren können. 3.3.1 Vermehrte Auswanderung von Larven aus der Haut bei CCL17Defizienz Zunächst wurde untersucht, ob Larven nach natürlicher Infektion besser aus der Haut von CCL17defizienten Mäusen auswandern und den Immunabwehrmechanismen eher entkommen können als bei CCL17+/- Mäusen. Infektiöse L3 Larven sind in der Lage durch subkutanes Gewebe durch gezielte, sich schlängelnde Bewegungen zu migrieren (Babayan, Attout et al. 2005), um über das Lymphsystem innerhalb von durchschnittlich 24-48h zu den regionalen Lymphknoten zu gelangen. Daher wurden CCL17+/- und CCL17-/- Mäuse natürlich mit L. sigmodontis infiziert und zu unterschiedlichen Zeitpunkten nach der Infektion eingeschläfert und ihnen Bauch-, Rücken- und Nacken-Haut entnommen und diese über Nacht auf Medium schwimmend bei 37°C inkubiert. Es zeigte sich, dass in den ersten Stunden nach Infektion nur sehr wenige Larven aus der Haut ins Medium migrierten (Abbildung 9). 6h nach Infektion erhöhte sich die Anzahl der aus der Haut ins Medium migrierenden Larven ein wenig, nach 12h deutlich von durchschnittlich 1 auf 6 Larven. Zu diesen Zeitpunkten waren keine Unterschiede zwischen CCL17-/- Mäusen und Kontroll-Mäusen festzustellen. 24hpi jedoch zeigte sich tendenziell, dass mehr L3 Larven aus der Haut von CCL17-/Mäusen ins Medium auswanderten (durchschnittlich 17 L3 bei CCL17-/- und 12 L3 bei CCL17+/-), was sich mit einem starken Trend auch 48hpi beobachten ließ. Auch noch 96h nach Infektion migrierten mehr Larven aus der Haut von CCL17-defizienten Mäusen, wobei 72h der Effekt nicht gesehen werden konnte. Die Daten zeigen, dass tendenziell mehr L3 Larven durch die Haut von CCL17-/- Mäusen ins Medium migrierten, so dass die Vermutung nahe liegt, dass Strukturen und Immunreaktionen in der Haut in CCL17-defizienten Mäusen nach der Infektion mit L. sigmodontis so verändert werden, dass in die Haut eindringende Larven davon profitieren und sie den Immunmechanismen effektiver entkommen können als unter natürlichen Bedingungen. Ergebnisse 48 Abbildung 9: Vermehrte Auswanderung von L3 Larven aus der Haut von CCL17-defizienten Mäusen. -/- +/- CCL17 und CCL17 Mäuse wurden natürlich mit L. sigmodontis infiziert und die Haut der Mäuse zu unterschiedlichen Zeitpunkten nach der Infektion entnommen und auf Medium schwimmend inkubiert. Die Anzahl der aus der Haut auswandernden Larven wurde bestimmt. Daten aus 5 Experimenten werden dargestellt als Mittelwerte ± Standardabweichung und zum jeweiligen Zeitpunkt mit dem ungepaartem t-Test analysiert. 3.3.2 Zytokin- und Chemokin-Antworten bei CCL17-Defizienz in der Haut Das Endringen der Larven und Durchwandern der Haut führt zu ersten Immunantworten im Wirt, darunter die Ausschüttung verschiedener Zytokine und Chemokine, die Abwehrreaktionen gegen die eindringenden Larven beeinflussen können. Bereits 6h nach Infektion konnte die Expression von CCL17 in der Haut nachgewiesen werden (Abbildung 3A). Daher wurden 6hpi auch die Expression weiterer Zytokine und Chemokine in der Haut untersucht. Dazu wurden CCL17-/- und CCL17+/- Mäuse sowie mit anti-CCL17 behandelte CCL17+/- Mäuse natürlich mit Milben infiziert, die infektiöse L3 Larven von L. sigmodontis in sich tragen. Als Kontrolle diente der Biss uninfizierter Milben. 6h nach der Infektion wurde die Haut der Lumbalzone entnommen und die mRNA Expression verschiedener Zytokine mittels real-time PCR gemessen. Während der Migration der Larven durch die Haut treffen diese auf eine Reihe verschiedener Zellen, die u.a. durch die Produktion bestimmter Botenstoffe in der Lage sind, erste wichtige Abwehrmaßnahmen gegen die eindringenden Parasiten einzuleiten. So sezernieren beispielsweise dendritische Zellen nach ihrer Aktivierung verschiedene Chemokine und Zytokine, insbesondere IL12, und aktivieren adaptive Immunantworten. Mastzellen sind ebenfalls nach Aktivierung durch Antigen-Kontakt imstande verschiedene Zytokine, darunter die für die Abwehr von Filarien wichtigen IL-4, IL-5 und IL-10 (1.5.3), sowie Chemokine zu sekretieren (Henz, Maurer et al. 2001; Stone, Prussin et al. 2010). Ein weiteres Zytokin, das die Immunantworten gegen Parasiten beeinflussen kann, ist z.B. Thymic stromal lymphopoetin (TSLP), das allgemein mit Th2-Antworten assoziiert und u.a. von Darmepithelien und Epithelzellen der Haut exprimiert wird. Bei Infektionen mit intestinalen Nematoden wie Trichuris muris zeigte sich z.B., dass Darmepithelzellen erhöhte Mengen an TSLP exprimieren, so dass intestinale DCs zur Induktion von Th2-Immunantworten angeregt werden und die Expression von IL-12 inhibiert wird (Artis and Grencis 2008). IL-17A ist ein weiteres wichtiges Zytokin, das an Entzündungsreaktionen in der Haut beteiligt ist. Auch spielen Chemokine bei der Rekrutierung der verschiedenen Immunzellen in die Haut eine spezifische Rolle. CCL5 z.B. als potentes chemotaktisches Chemokin ist in der Lage Monozyten, T-Zellen, Eosinophile und Mastzellen zu rekrutieren, die an entsprechenden Immunreaktionen gegen eindringende Parasiten beteiligt werden (Schall, Bacon et al. 1990; Juremalm, Olsson et al. 2002). Ergebnisse 49 Bei den Messungen zeigte sich sowohl in der Haut von unbehandelten CCL17+/- und CCL17defizienten Mäusen als auch in anti-CCL17 behandelten CCL17+/- Mäusen eine signifikant erhöhte mRNA-Expression von IL-12p35 (Abbildung 10A) und CCL5 (Abbildung 10B) nach Infektion mit L3infizierten Milben im Vergleich zum Biss mit uninfizierten Milben. Zwischen den Gruppen gab es allerdings keine Unterschiede in der Expression. Andere Th2-typische Zytokine wie IL-4, IL-5, IL-10 und TSLP sowie IL-17A konnten nicht detektiert werden. Somit lösen L3 Larven kurz nach Eintritt in die Haut nur eingeschränkt Zytokin- und ChemokinAntworten aus, die eine Rekrutierung und Aktivierung von Zellen in der Haut auslösen können. Gleichwohl wurde durch die Larven allein eine Expression des Th1-Zytokins IL-12 und des Chemokins CCL5 induziert, während die in die Haut abgegebene Milbensaliva keine oder nur sehr geringe Reaktionen bewirkte. Mit der natürlichen Infektion der L3 Larven mit Milben war die Expression von IL-12 und CCL5 bereits 6h nach Infektion detektierbar, wobei allerdings keine Unterschiede in der Expression zwischen CCL17-defizienten und heterozygoten Kontroll-Mäusen festgestellt werden konnten. Abbildung 10: Erhöhte mRNA Expression von IL-12p35 und CCL5 in der Haut 6h nach natürlicher Infektion. Die mRNA Expression von IL-12p35 (A) und CCL5 (B) wurde per real-time PCR 6h nach natürlicher Infektion mit +/-/L. sigmodontis (L3) in der Haut der Lumbalzone von CCL17 , CCL17 und αCCL17 Antikörper-behandelten +/CCL17 Mäusen gemessen. Als Kontrolle diente der Biss uninfizierter Milben. Die mRNA-Kopienzahl von IL12p35 und CCL5 wurden anhand der Kopienzahl von β-Actin normalisiert. Die Daten sind als Mittelwerte ± Standardabweichung dargestellt und wurden mit Kruskal-Wallis Test und Dunn’s Multiple Comparison Test analysiert (Signifikanzen gegenüber den jeweiligen Kontrollen werden angezeigt). 3.3.3 Keine erhöhte Lymphangiogenese in der Haut bei CCL17Defizienz L3 Larven zeigen die Tendenz in der Haut von CCL17-defizienten Mäusen scheinbar einfacher durch die Haut migrieren zu können (Abbildung 9). Zudem seigte sich, dass sich bei CCL17-Defizienz eine höhere Wurmlast etablieren kann (Abbildung 4). Ein möglicher Mechanismus, der den Larven dabei behilflich sein könnte, wäre eine direkte, von den Larven ausgelöste Veränderung des Lymphgefäßsystems in der Haut von CCL17-defizienten Mäusen durch z.B. eine Expansion der Lymphgefäße, die das Migrieren durch die Lymphgefäße erleichtern könnte. Solch eine Expansion könnte durch die Ausbildung größerer Lymphgefäße in der Haut oder durch Bildung neuer oder Ergebnisse 50 weiter verzweigter Lymphgefäße erreicht Lymphangiogenese-fördernder Faktoren. werden, ausgelöst durch die Expression Um Veränderungen im lymphatischen System der Haut von CCL17-/- Mäusen zu untersuchen, wurde die Expression verschiedener Lymphendothel-spezifischer Marker wie Prospero-related homeobox 1 (Prox1) und LYVE-1, Lymphangiogenese-fördernder Faktoren wie Vascular endothelial growth factor A (VEGF-A) und zellulärer Verbindungsproteine wie Occludin, JAM-1 und VE-Cadherin mittels real-time PCR quantifiziert. Um zu überprüfen, dass keine Unterschiede im Lymphsystem der Haut vorliegen, die allein durch den Knock-out von CCL17 ausgelöst werden, wurde 1-2 Tage alten, naiven Mäusen die Haut entnommen und mittels real-time PCR die mRNA-Expression der Lymphendothel-spezifischen Marker LYVE-1 und Prox1 und die des Lymphangiogenese-induzierenden Wachstumsfaktors VEGF-A in der Haut analysiert. Durch die geringe Größe dieser jungen Mäuse war es möglich, fast die gesamte, noch haarlose Körperhaut zu vermessen und es konnte davon ausgegangen werden, dass diese so kurz nach der Geburt kaum durch Umwelteinflüsse, die Veränderungen an dem Lymphsystem hätten induzieren können, belastet wurde. Es konnten jedoch keine signifikanten Unterschiede im Expressionsmuster der Marker zwischen CCL17-defizienten und CCL17+/- Mäusen festgestellt werden (Abbildung 11), wodurch ausgeschlossen werden konnte, dass CCL17-defiziente Mäuse per se nicht mehr lymphatische Endothelzellen in der Haut besitzen als CCL17-positive Mäuse. Abbildung 11: CCL17-Defizienz hat keinen Einfluss auf Lymphangiogenese-Faktoren bei Neugeborenen. -/- +/- In der Haut von 1-2 Tage alten CCL17 (n=17) und CCL17 (n=8) Mäusen wurde mittels real-time PCR die mRNA-Expression der Lymphangiogenesefaktoren LYVE-1 (A), Prox1 (B) und VEGF-A (C) gemessen. Die Kopienanzahl von LYVE-1, Prox1 und VEGF-A wurden anhand der Kopienzahl von β-Actin normalisiert. Die Daten werden als Mittelwerte ± Standardabweichung dargestellt und wurden mit dem Mann Whitney Test analysiert. Um daher zu untersuchen, ob L3 Larven in der Haut von CCL17-defizienten Mäusen eine Veränderung des Lymphsystems hervorrufen, wurden CCL17-/- und CCL17+/- Mäuse natürlich mit L. sigmodontis für 6h infiziert und ihnen und adulten, naiven Mäusen Hautproben aus der LumbalRegion entnommen. Als Kontrolle für den Milbenbiss selbst wurden nicht-infizierte Milben genutzt. Mittels real-time PCR wurde in den Hautproben die mRNA-Expression von LYVE-1, Prox1, VEGF-A, VECadherin, Occludin und JAM-1 gemessen. Bei CCL17-defizienten Mäusen war bereits 6h nach Infektion mit L. sigmodontis eine erhöhte mRNA-Expression des Lymphendothel-spezifischen Markers LYVE-1 in der Haut messbar, allerdings löste allein der Milbenbiss selbst schon eine signifikant erhöhte Expression aus (Abbildung 12A). In CCL17+/- war Ähnliches zu beobachten. Zu diesem frühen Zeitpunkt waren sowohl zwischen CCL17+/und CCL17-/- Mäusen als auch zwischen naiven und infizierten Mäusen der jeweiligen Gruppen keine signifikanten Unterschiede in der LYVE-1 mRNA-Expression in der Haut feststellbar. Es war jedoch ein Trend zur erhöhten Expression von LYVE-1 nach Infektion mit L3 Larven in CCL17-/- Mäusen Ergebnisse 51 erkennbar. Die Kopienzahl nach Infektion war zusätzlich tendenziell erhöht bei CCL17-Defizienz im Vergleich zu CCL17+/- Mäusen. Prox1 als weiterer Lymph-spezifischer Marker konnte nicht in der Haut adulter Mäuse detektiert werden weder im naiven Zustand noch nach Infektion. Abbildung 12: Erhöhte mRNA-Expression von LYVE-1, VE-Cadherin und VEGF-A nach natürlicher Infektion. -/- +/- Adulte CCL17 und CCL17 Mäuse wurden natürlich mit L. sigmodontis-haltigen (+L3) bzw. nicht-infizierten Milben (-L3) infiziert. 6h nach Infektion wurde die Haut der Lumbalzone entnommen und mittels real-time PCR in der Haut infizierter und naiver Mäuse die mRNA-Expression von LYVE-1 (A), VEGF-A (B), VE-Cadherin (C) und JAM-1 (D) analysiert. Die Ergebnisse von 10 bis 16 Hautproben/ Zustand werden als Mittelwerte ± Standardabweichung dargestellt. Die Daten wurden mit Kruskal Wallis und Dunn’s Multiple Comparison Test getestet. Ähnlich wie für LYVE-1 konnte 6h nach natürlicher Infektion mit L3 Larven ein starker Trend zur erhöhten mRNA Expression des Adherens-Junction Proteins VE-Cadherin in der Haut sowohl bei CCL17-defizienten als auch bei heterozygoten Mäusen festgestellt werden (Abbildung 12C). Allerdings löste auch hier der Milbenbiss allein bei beiden Gruppen eine erhöhte Expression von VECadherin aus. In der mRNA-Expression von JAM-1 konnte zwischen den Hautproben naiver und mit L. sigmodonits infizierter Mäuse keine wesentlichen Unterschiede 6h nach Infektion festgestellt werden (Abbildung 12D). Occludin konnte mittels real-time PCR nicht detektiert werden. Die mRNA-Expression von VEGF-A war nach Infektion mit L. sigmodontis L3 Larven signifikant erhöht im Vergleich zu naiven Mäusen, sowohl in CCL17-/- und CCL17+/- Mäusen (Abbildung 12B). Doch auch hier zeigte sich, dass der Milbenbiss allein die erhöhte Expression hervorruft. So gab es keine signifikante Erhöhung der VEGF-A Expression nach Infektion mit L3 Larven im Vergleich zum Ergebnisse 52 Biss des Vektors allein. Auch zwischen CCL17-/- und CCL17+/- Mäusen und der jeweiligen Behandlung waren keine signifikanten Unterschiede vorhanden. Die Ergebnisse weisen darauf hin, dass L3 Larven 6h nach Infektion selbst keine Lymphangiogenese und damit eine Lymphangiogenese-abhängige Expansion der Lymphgefäße in der Haut induzieren können. Jedoch scheint die Saliva der übertragenden Milbe eine solche auslösen zu können, wodurch den in die Haut eindringenden Larven allgemein die Migration erleichtert werden könnte. Da keine signifikanten Unterschiede in der Expression Lymphangiogenese- oder Lymphendothel-spezifischer Marker, die an sich auf größere oder vermehrte Lymphgefäße hinweisen, zwischen CCL17+/- und CCL17-/- Mäusen zu erkennen waren, ist anzunehmen, dass andere, Lymphangiogenese-unabhängige Mechanismen die Larven-Migration durch Haut und Lymphgefäße bei CCL17-Defizienz erleichtern. 3.3.4 Erhöhte vaskuläre Permeabilität bei CCL17-Defizienz nach natürlicher Infektion und Injektion von L3 Larven oder Wurmextrakt von L. sigmodontis Das Eindringen von L3 Larven in die Haut könnte Mechanismen auslösen, die indirekt eine Erweiterung der Lymphgefäße bewirken. Zellen könnten zur Ausschüttung von Substanzen angeregt werden, die durch koordiniertes Öffnen und Schließen von Zellverbindungen die Permeabilität des Blutendothels beeinflussen können. Durch einen Anstieg der vaskulären Permeabilität könnte wiederum eine Erhöhung des interstitiellen Drucks im Gewebe erzielt werden, der durch das Auseinanderziehen der lymphatischen Endothelzellen zu einer Erweiterung des Lumens der Lymphgefäße führt. Solch eine Erweiterung der Lymphgefäße könnten L3 Larven ausnutzen, um unter erleichterten Bedingungen in die Lymphgefäße einzudringen und zu den drainierenden Lymphknoten und weiter zu migrieren. Bei CCL17-defizienten Mäusen, in denen sich eine höhere Wurmlast etablieren kann (Abbildung 4), wäre infolgedessen eine höhere Permeabilität der Gefäße zu erwarten. Zur Untersuchung der vaskulären Permeabilität wurden daher CCL17-defiziente und heterozygote Mäuse lokal mit L3 Larven natürlich infiziert oder es wurde ihnen LsAg bzw. L3 Larven subkutan injiziert. Nach 6h erfolgte eine intravenöse Injektion des Farbstoffs Evans Blau. Wiederum eine Stunde später wurde eine Hautprobe der Inokulationsstelle entnommen und die Extravasation des Farbstoffs ins umliegende Gewebe gemessen. Die Injektion des Farbstoffs allein führte zu einer Erhöhung der optischen Dichte im Vergleich zu naiven Kontroll-Mäusen in beiden Mausgruppen (Abbildung 13A). Jedoch kam es zu einem signifikanten Anstieg in der vaskulären Permeabilität in CCL17-/- Mäusen und anti-CCL17 behandelten CCL17+/- Mäusen durch den Einfluss von LsAg im Vergleich zu CCL17+/- Mäusen und unbehandelten Kontrollen. LsAg in CCL17+/- Mäusen selbst erhöhte kaum die Durchlässigkeit der Blutgefäße (Abbildung 13A). Auch injizierte L3 Larven lösten wie LsAg in CCL17-defizienten Mäusen eine erhöhte vaskuläre Permeabilität aus (Abbildung 13B). Zudem konnten L3 Larven nach einer natürlichen Infektion mit Milben in CCL17-defizienten Mäusen eine erhöhte Permeabilität der Gefäße induzieren, während sie diese kaum in CCL17+/- Mäusen beeinflussen konnten (Abbildung 13C). Die Permeabilität der Hautproben von CCL17+/- Mäusen nach der lokalen Infektion mit L3 Larven blieb auf Level der naiven Hautproben, die etwas entfernt von der Infektionsstelle entnommen wurden (Abbildung 13C). Die Ergebnisse zeigen, dass sowohl natürlich infizierte L3 Larven als auch injizierte L3 Larven und Wurmextrakt von L. sigmodontis eine erhöhte vaskuläre Permeabilität der Blutgefäße in der Haut bei CCL17-Defizienz induzieren, wodurch sehr wahrscheinlich indirekt eine strukturelle Erweiterung der Lymphgefäße in CCL17-defizienten Mäusen ausgelöst wird, die potentiell erleichterte Bedingungen für die Migration der Larven durch die Lymphgefäße schafft. Ergebnisse 53 Abbildung 13: Erhöhte vaskuläre Permeabilität bei CCL17-Defizienz nach natürlicher Infektion von L3 Larven und Injektion von LsAg oder L3 Larven. 6h nach subkutaner Injektion von 10µg LsAg (A, B) oder 35 L3 Larven (B) bzw. nach lokaler natürlicher Infektion von L3 Larven (C) wurde Evans Blau in die Schwanzvene von anti-CCL17 behandelten oder unbehandelten +/-/CCL17 Mäusen und CCL17 Mäusen injiziert. 1h später wurde die vaskuläre Permeabilität anhand der Extravasation des Farbstoffs ins Gewebe an der Injektionsstelle spektrophotometrisch gemessen. Naive Mäuse mit oder ohne Injektion von Evans Blau dienten als Kontrolle (A) bzw. naive, von der Infektionsstelle entfernte Hautproben (C). Repräsentative Daten eines Experiments von zwei (A) bzw. drei (B) unabhängigen Experimenten bzw. Daten eines durchgeführten Experiments (C) werden als Mittelwerte ± Standardabweichung gezeigt. Die Daten wurden statistisch mit One-way ANOVA und Tukey’s Multiple Comparison Test analysiert. 3.3.5 Rolle von Mastzellen bei CCL17-Defizienz nach Infektion mit L. sigmodontis Die bisherigen Ergebnisse weisen darauf hin, dass frühe CCL17-abhängige Prozesse in der Immunabwehr gegen eine Filarien-Infektion in der Haut stattfinden. So konnte bereits 10 Tage nach Infektion mit L. sigmodontis in CCL17-defizienten Mäusen eine signifikant erhöhte Parasitenlast beobachtet werden (Abbildung 4). Da zudem bekannt ist, dass ein Großteil der Larven in den ersten 48h nach Infektion durch inflammatorische Reaktionen abgewehrt wird, ist es wahrscheinlich, dass zu diesen früheren Zeitpunkten CCL17-abhängige Mechanismen über das Schicksal der Larven mit Ergebnisse 54 entscheiden. Eine Expression von CCL17 in der Haut konnte bereits 6h nach Infektion mit L. sigmodontis detektiert werden (Abbildung 3A) und zum selben Zeitpunkt, bei fehlender Expression von CCL17, eine erhöhte vaskuläre Permeabilität der Gefäße (Abbildung 13), welche die Migration der Larven durch das subkutane Gewebe und die Lymphgefäße beeinflussen könnte. Eine Reihe verschiedener Zellen exprimieren CCR4, den Rezeptor für CCL17, oder sind selber in der Lage, CCL17 zu exprimieren. Zu ihnen gehören Mastzellen (MCs), die unter den Zellen des angeborenen Immunsystems neben den dendritischen Zellen zu den prominentesten Zellen in der Haut zählen und oftmals an ersten Immunreaktionen gegen eindringende Pathogene wie Parasiten beteiligt sind. Mastzellen sind im Bereich der Epithelien, insbesondere in direkter Nähe zu Blut- und Lymphgefäßen und Nerven lokalisiert. Sie exprimieren eine Reihe verschiedener Rezeptoren, durch welche es auf unterschiedlichen Wegen zur Aktivierung der Zelle und Ausschüttung verschiedener Substanzen kommen kann. Durch den Prozess der Degranulation können verschiedene vorgeformte, in Granula gespeicherte Mediatoren in das umliegende Gewebe entlassen werden, zu denen unter anderem Histamin und VEGF-A gehören, die die vaskuläre Permeabilität des Endothels erhöhen können. Somit könnten möglicherweise Mastzellen in CCL17-abhängiger Weise in ihrer Aktivierung durch in die Haut eindringenden L3 Larven von L. sigmodontis so beeinflusst werden, dass es bei CCL17-Defizienz zu einer erhöhten vaskulären Permeabilität kommt, welche die Etablierung der Larven in der Maus erleichtert. 3.3.5.1 Erhöhte Mastzelleinwanderung und -degranulation bei CCL17Defizienz nach Infektion mit L. sigmodontis Abbildung 14: Nicht-degranulierende und degranulierende Mastzellen. Mastzellen in Paraffinschnitten verschiedener Hautproben wurden mit Toluidinblau angefärbt und nach ihrem Status in nicht-degranulierende Mastzellen (A) und degranulierende Mastzellen (B) eingeteilt. Es werden jeweils 2 beispielhafte Mastzellen abgebildet. Somit wurde die Frage gestellt, welche Rolle Mastzellen im Zusammenhang mit CCL17 in der frühen Immunantwort bei Filarieninfektionen spielen. Es wurden Mastzellen 6h nach natürlicher Infektion mit L. sigmodontis in CCL17-defizienten und anti-CCL17 behandelten und unbehandelten CCL17+/- Mäusen analysiert, zum selben Zeitpunkt, wo eine Expression von CCL17 in der Haut nach Infektion mit L3 Larven nachgewiesen werden konnte (Abbildung 3A). Neben der Infektion mit Milben, die infektiöse L3-Larven tragen, und naiven Mäusen wurden Mäuse von nicht-infizierten Milben gebissen als Kontrolle für den Biss der Milbe selbst. Toluidinblau-gefärbte Mastzellen in der Haut wurden gezählt, nach ihrem Status unterschieden und als nicht-degranulierend und degranulierend eingestuft (Abbildung 14). Bei nicht-degranulierenden Mastzellen befanden sich die vorgefertigten Granula noch dicht beim Nukleus bzw. leicht distanziert, aber noch innerhalb des Zytoplasmas der Zelle. Degranulierende Mastzellen gaben Granula in den extrazellulären Raum ab und verloren die Integrität ihrer Zellkonturen. Komplett degranulierte Mastzellen konnten hingegen Ergebnisse 55 schwer detektiert werden, da ins umliegende Gewebe abgegebene Granula keiner bestimmten Zelle mehr zugeordnet werden konnten. Abbildung 15: Erhöhte Anzahl nicht-degranulierender und degranulierender Mastzellen bei CCL17-Defizienz nach Infektion mit L. sigmodontis. (A-C) Hautproben der Lumbalzone wurde naiven oder 6h nach natürlicher Infektion mit L. sigmodontis+/-/infizierten (+L3) oder uninfizierten Milben (-L3) von CCL17 und CCL17 Mäusen entnommen und die Gesamtzahl Toluidinblau-gefärbter Mastzellen bestimmt und differenziert in nicht-degranulierende und +/degranulierende Mastzellen. (D-F) Mit anti-CCL17 Antikörper behandelte und unbehandelte CCL17 sowie -/CCL17 Mäuse wurden für 6h natürlich mit L. sigmodontis infiziert und Mastzellen in Hautproben der Lumbalzone analysiert. Mastzellen in der Epidermis, Dermis und Hypodermis in 20 aufeinanderfolgenden Gesichtsfeldern bei 100-facher Vergrößerung im Lichtmikroskop wurden analysiert. Ergebnisse von jeweils 2 unabhängigen Experimenten werden gezeigt als Mittelwerte ± Standardabweichung von je 2-3 Hautschnitten pro Maus, von denen Mittelwerte gebildet wurden. Die Daten wurden mit Kruskal-Wallis und Dunn’s Multiple Comparison Test getestet. Im Vergleich zu naiven Mäusen führte der Milbenbiss selbst nur zu einer geringen, nicht signifikanten Erhöhung der Anzahl von Mastzellen in der Haut bei beiden Mausgruppen, CCL17+/- und CCL17-/- Mäusen (Abbildung 15A-C). Dies galt sowohl für die gesamte Mastzellanzahl als auch für nicht-degranulierende und degranulierende Mastzellen. Hingegen zeigte sich 6h nach dem Biss von Milben mit infektiösen L3-Larven ein signifikanter Anstieg in der Gesamtzahl der Mastzellen in CCL17defizienten Mäusen um das 1,6-fache im Vergleich zu naiven Mäusen, nicht jedoch in CCL17+/Mäusen (Abbildung 15A). Besonders die Anzahl degranulierender MCs erhöhte sich signifikant um das etwa 4,4-fache nach Infektion mit L3-haltigen Milben im Vergleich zu naiven Mäusen in CCL17-/(Abbildung 15C). Nicht-degranulierende MCs erhöhten sich um das 1,5-fache (Abbildung 15B). Indessen konnte bei heterozygoten Tieren nur ein geringer Anstieg um das 1,1-fache bei der Ergebnisse 56 Gesamtzahl und bei nicht-degranulierenden MCs festgestellt werden (Abbildung 15A-B), bei degranulierenden MCs ein signifikanter Anstieg um das 2,9-fache (Abbildung 15C). Auch zeigte sich, dass in anti-CCL17 behandelten CCL17+/- Mäusen erhöhte Anzahlen an Mastzellen wie bei Mäusen mit CCL17-Defizienz zu finden sind. Die Gesamtzahl an Mastzellen und die Zahl degranulierender MCs waren nach Antikörper-Behandlung signifikant erhöht und vergleichbar mit CCL17-/- Mäusen (Abbildung 15D, F). Die Ergebnisse zeigen, dass nach Infektion mit L. sigmodontis mehr Mastzellen in die Haut von CCL17-Knockout Mäusen sowie anti-CCL17 behandelten CCL17+/- Mäusen einwanderten, wobei anzunehmen ist, dass durch die Abwesenheit von CCL17 die Akkumulation der Mastzellen in die Haut nach Infektion mit L3 Larven verstärkt wurde. Insbesondere zeigte sich, dass mehr Mastzellen nach Infektion mit L3 Larven bei einer CCL17-Defizienz degranulierten als bei unbehandelten CCL17+/Mäusen der Fall war, wodurch über die vermehrte Ausschüttung vasodilatorischer Mediatoren die vaskuläre Permeabilität der Gefäße sowie inflammatorische Prozesse in der Haut unterschiedlich beeinflusst werden können. 3.3.5.2 Umkehrung von vaskulärer Permeabilität und Wurmlast bei CCL17Defizienz durch Mastzell-Stabilisierung Da die Degranulation der Mastzellen einen großen Einfluss insbesondere auf die Permeabilität der Gefäße in der Haut zu haben scheint, wurde CCL17-defizienten Mäusen die Chemikalie diNatriumcromoglykat (Cromolyn) verabreicht, die eine Degranulation von Mastzellen verhindert. Zum einen wurden Cromolyn-behandelte und unbehandelte CCL17-/- und CCL17+/- Mäuse natürlich mit L. sigmodontis infiziert und die Anzahl degranulierender Mastzellen in der Haut bestimmt. Es zeigte sich, dass die Anzahl der degranulierenden Mastzellen in Cromolyn-behandelten CCL17-/- Mäusen 6h nach natürlicher Infektion nicht erhöht war im Vergleich zu unbehandelten CCL17-/- Mäusen, sondern auf Level der CCL17+/- Mäuse blieb (Abbildung 16C). Damit erhöhte sich die Gesamtzahl der Mastzellen (Abbildung 16A) sowie die Anzahl nicht-degranulierender Mastzellen (Abbildung 16B) nach Cromolyn-Behandlung leicht in CCL17-/- Mäusen im Vergleich zu unbehandelten CCL17-/- Mäusen. Auch waren die Gesamtzahl und die Zahl nicht-degranulierender Mastzellen wie bei unbehandelten CCL17-/- Mäusen signifikant erhöht gegenüber unbehandelten CCL17+/- Mäusen. Cromolyn führte in CCL17+/- Mäusen zu keiner Veränderung in der Anzahl degranulierender Mastzellen (nicht gezeigt). Außerdem erhöhte sich durch die Behandlung mit Cromolyn die vaskuläre Permeabilität in CCL17defizienten Mäusen nicht nach Injektion lebender L3-Larven (Abbildung 16D). Diese steigerten nur in unbehandelten CCL17-/- Mäusen die Extravasation von Evans Blau ins umliegende Gewebe, was auf einen unmittelbaren Zusammenhang zwischen erhöhter Degranulation von Mastzellen und vaskulärer Permeabilität bei CCL17-Defizienz hinweist. Zum anderen führte die Behandlung mit Cromolyn in CCL17-defizienten Mäusen zu einer signifikant verringerten Parasitenlast 10 Tage nach Infektion mit L. sigmodontis im Vergleich zu unbehandelten CCL17-/- Mäusen (Abbildung 16E). Cromolyn zeigte hingegen keinen Einfluss auf die Wurmlast in CCL17+/- Mäusen. Die Ergebnisse zeigen, dass eine Stabilisierung der Mastzellen und Inhibierung der Degranulation durch die Verabreichung von Cromolyn zu einer Umkehrung des Phänotyps von CCL17-defizienten Mäusen führt. Sie zeigen einen direkten Zusammenhang zwischen der erhöhten Degranulation von Mastzellen und der erhöhten vaskulären Permeabilität bei CCL17-Defizienz nach Infektion mit L. sigmodontis: Die Inhibition der Degranulation der Mastzellen bei CCL17-Defizienz durch die Behandlung mit Cromolyn verhindert, wahrscheinlich durch eine geringere Ausschüttung vasodilatorischer Mediatoren, eine Erhöhung der vaskulären Permeabilität der Blutgefäße, so dass sich weniger Larven in der Pleura-Höhle etablieren können. Ergebnisse 57 Abbildung 16: Mastzell-Stabilisierung durch Cromolyn revertiert vaskuläre Permeabilität und Wurmlast -/- +/- Cromolyn-behandelte und unbehandelte CCL17 Mäuse und CCL17 Mäuse wurden natürlich mit L. sigmodontis infiziert. 6h nach Infektion wurde die Gesamtzahl an Mastzellen (A) in der Haut der Lumbalzone bestimmt und differenziert in nicht-degranulierende (B) und degranulierende Mastzellen (C). Daten eines Experiments werden gezeigt. (E) 10dpi wurde die Anzahl der Parasiten in der Pleura-Höhle bestimmt. Dargestellt werden Daten eines Experiments aus drei Vergleichbaren als Streudiagramm mit Mittelwerten. (D) Nach subkutaner Injektion von 35 Larven in die Lumbalregion wurde mittels des vaskulären PermeabilitätsAssays die Extravasation von Evans Blau ins Gewebe der Injektionsstelle bei Cromolyn-behandelten und -/+/unbehandelten CCL17 Mäuse sowie bei unbehandelten CCL17 Mäusen bestimmt. Dargestellt werden repräsentative Daten eines von zwei Experimenten als Mittelwerte ± Standardabweichung. Die Daten wurden mit One-way ANOVA und Tukey’s Multiple Comparison Test analysiert. 3.3.5.3 Keine wichtige Bedeutung von VEGF-A bei der Immunabwehr von L. sigmodontis Mastzellen sind in der Lage Vascular endothelial growth factor A (VEGF-A) zu produzieren und zu sezernieren. Die Ausschüttung gespeicherten VEGF-A kann schnell nach Aktivierung der Mastzelle erfolgen und die Sekretion durch Synthetisieren neuen VEGF-A Proteins aufrechterhalten werden (Boesiger, Tsai et al. 1998). Da VEGF-A als einer der Haupt-Regulatoren der Angiogenese von Blutund Lymphgefäßen zählt und über die Beeinflussung des vaskulären Endothels die vaskuläre Permeabilität der Gefäße erhöhen kann, wurde die Frage gestellt, ob VEGF-A an der beobachteten erhöhten vaskulären Permeabilität der Gefäße in der Haut nach Stimulierung mit L3 Larven oder LsAg im Zusammenhang mit der erhöhten Degranulation von Mastzellen bei CCL17-Defizienz beteiligt sein könnte. Ergebnisse 58 Auf mRNA-Ebene konnte bereits gezeigt werden, dass die Expression von VEGF-A in der Haut bei CCL17-defizienten Mäusen nach natürlicher Infektion mit Milben induziert wird (Abbildung 12B). Um VEGF-A auch auf Protein-Ebene nach Stimulierung mit Wurm-Antigen nachzuweisen, sollte in der Haut produziertes VEGF-A in drainierenden Lymphknoten nachgewiesen und eventuelle Unterschiede in der Expression zwischen CCL17-defizienten und Kontroll-Mäusen analysiert werden. Halin et al. konnten zeigen, dass in drainierenden Lymphknoten VEGF-A Protein nachgewiesen werden kann, dass im entzündeten Gewebe und nicht im Lymphknoten selbst von Zellen produziert wird (Halin, Tobler et al. 2007). Daher wurden CCL17-defizienten und heterozygoten Mäusen LsAg bzw. L3 Larven subkutan in den Fuß injiziert, welcher nur von einem Lymphknoten (poplitealen LN) drainiert wird. Als Kontrollen dienten Medium- und LPS-behandelte bzw. contra laterale, unbehandelte Lymphknoten. 48h nach Injektion wurde den Mäusen der den Fuß drainierende popliteale Lymphknoten entnommen, homogenisiert und die Konzentration von VEGF-A im Homogenisat per ELISA gemessen. In CCL17-defizienten Mäusen konnte in den LN nach LsAg-Injektion signifikant mehr VEGF-A nachgewiesen werden als in den Medium oder LPS Kontrollen (Abbildung 17A). In CCL17+/- Mäusen führte LsAg hingegen zu keiner erhöhten VEGF-A Expression in den Lymphknoten auf Proteinebene. Zudem zeigte sich im Vergleich zum contra lateralen, unbehandelten Lymphknoten eine signifikante Erhöhung an VEGF-A Protein bei CCL17-/- Mäusen nach Injektion von L3 Larven, nicht aber bei CCL17+/- Mäusen (Abbildung 17B). Abbildung 17: Erhöhte VEGF-A Level in Lymphknoten CCL17-defizienter Mäuse nach Injektion von LsAg und L3-Larven nicht aber nach natürlicher Infektion von L3 Larven. +/- -/- (A) CCL17 und CCL17 Mäusen wurde 10µg LsAg, 20ng LPS oder Medium subkutan in den Fuß injiziert und 48h später im Homogenisat der poplitealen Lymphknoten mittels ELISA die Menge an VEGF-A gemessen. Dargestellt werden repräsentative Daten aus einem von drei unabhängigen Experimenten als Mittelwerte ± Standardabweichung (n=4). (B) VEGF-A wurde 48h nach Injektion von 35 L3 Larven in den drainierenden und +/den unbehandelten, contra lateralen poplitealen Lymphknoten von CCL17 und CCL17-defizienten Mäusen gemessen. Die Daten eines Experiments werden dargestellt als Mittelwerte ± Standardabweichung (n=3). (C) +/-/CCL17 und CCL17 Mäusen wurden natürlich mit L. sigmodontis (+L3) oder mit uninfizierten Milben (-L3) infiziert. 48hpi wurde mittels ELISA im Homogenisat poplitealer und inguinaler Lymphknoten VEGF-A-Mengen bestimmt. Dargestellt werden Daten eines Experiments als Mittelwerte ± Standardabweichung (n=3). Alle Daten wurden mit Kruskal-Wallis und Dunn’s Multiple Comparison Test getestet. Als Vergleich der Ergebnisse nach Injektion von Wurm-Antigen oder L3 Larven wurden CCL17-/und CCL17+/- Mäuse natürlich mit infektiösen L3-Larven tragenden Milben oder mit nicht-infizierten Milben infiziert, die als Kontrolle für den Biss der Milbe selbst dienten. Im Homogenisat der peripheren poplitealen und inguinalen Lymphknoten wurde 48hpi die Menge an VEGF-A per ELISA bestimmt. Es zeigte sich, dass die natürlich infizierten L3 Larven in beiden Mausgruppen kaum eine Ergebnisse 59 Erhöhung von VEGF-A Protein in den peripheren Lymphknoten induzierten im Vergleich zu Mäusen, die von unifizierten Milben gebissen wurden (Abbildung 17C), wobei nicht kontrolliert werden konnte, ob und wieviele Milben in dem Bereich der untersuchten Lymphknoten gebissen hatten. Auch zwischen den Gruppen konnten keine signifikanten Unterschiede festgestellt werden. Die Ergebnisse der Injektionsexperimente zeigen, dass sowohl Wurmextrakt von L. sigmodontis als auch L3 Larven selbst in der Haut von CCL17-defizienten Mäusen erhöhte Mengen an VEGF-A induzierten und lassen eine Rolle für VEGF-A in der Veränderung der Homöostase der Haut bei Infektion mit L. sigmodontis vermuten. Im Vergleich jedoch konnte mit natürlich übertragenen L3 Larven, auch bei CCL17-defizienten Mäusen, keine erhöhten Mengen an VEGF-A in den die Haut drainierenden Lymphknoten gemessen werden. Dies könnte auf Schwächen im natürlichen Infektionsmodell bezüglich gezielter Milbenbisse in Nähe der drainierenden Lymphknoten zurück zu führen sein. Da nach Stimulierung mit Wurm-Antigen in CCL17-defizienten Mäusen, zumindest im Injektionsmodell, ein deutlicher Anstieg von VEGF-A nachgewiesen werden konnte, sollte der Einfluss von VEGF-A auf die Abwehr der Parasiten bei einer Filarien-Infektion untersucht werden. Dazu wurden zum einen VEGF-A transgene Mäuse mit einer Überexpression von VEGF-A in Keratinozyten der Epidermis unter Kontrolle des Keratin-14 Promotors und Wildtypkontrollen auf FvB-Hintergrund natürlich mit L. sigmodontis infiziert. 10 Tage nach Infektion zeigten VEGF-A transgene Mäuse trotz der Überexpression von VEGF-A in der Haut keine erhöhte Wurmlast in der Pleura-Höhle im Vergleich zu Wildtyp-Mäusen (Abbildung 18A). Weitere Untersuchungen ergaben, dass die Anzahl der Zellen in der Pleura-Höhle (Abbildung 18B) und in mediastinalen Lymphknoten (Abbildung 18C) zwischen den beiden Mausgruppen ebenfalls nicht unterschiedlich waren. Die Zellzahlen der die Haut drainierenden peripheren Lymphknoten waren insgesamt jedoch bei VEGF-A transgenen Mäusen deutlich erhöht (Abbildung 18D). 60dpi, wo suszeptible BALB/c Mäuse eine Mikrofilarämie entwickeln können, konnten FvB-Wildtyp- und VEGF-Tg Mäuse die Infektion mit L. sigmodontis fast löschen, nur sehr wenige Würmer waren noch in der Pleura-Höhle zu finden. Dabei bestanden auch hier keine Unterschiede in der Wurmanzahl zwischen den Mausgruppen und keine Mikrofilarämie wurde ausgebildet (Daten nicht gezeigt). Dies lässt vermuten, dass VEGF-A keine gesonderte Rolle bei der Abwehr von Filarien spielt, da eine Überproduktion von VEGF-A nicht dazu führen konnte, den eindringenden L3 Larven die Etablierung im Wirt zu vereinfachen. Desweiteren wurden mit anti-VEGF-A Antikörper behandelte und unbehandelte CCL17-defiziente Mäuse und CCL17+/- Mäuse natürlich mit L. sigmodontis infiziert, um den Einfluss von VEGF-A in vivo bei einer natürlichen Infektion mit L. sigmodontis bei CCL17-Defizienz zu untersuchen. Es zeigte sich keine Reduktion der Wurmanzahl in der Pleura-Kavität bei einer Depletion von VEGF-A in CCL17-/Mäusen 10dpi im Vergleich zu unbehandelten CCL17-/- Mäusen (Abbildung 18E). Die Wurmlast war sogar leicht erhöht in anti-VEGF-A behandelten Mäusen. Beide CCL17-defizienten Mausgruppen waren signifikant erhöht im Vergleich zu CCL17+/- Mäusen. Die Ergebnisse lassen vermuten, dass VEGF-A keine wichtige Rolle bei den Immunabwehrmechanismen gegen Filarien spielt, da eine Überexpression von VEGF-A nicht dazu führen konnte, den eindringenden L3 Larven die Etablierung im Wirt zu vereinfachen. Zudem konnte die Depletion vorhandenen VEGFs vor und freigesetzten VEGFs nach der Infektion nicht verhindern, dass die in die Haut eingedrungenen L3 Larven sich in CCL17-defizienten Mäusen in höherem Maße etablieren konnten. Daher ist eher anzunehmen, dass andere vasodilatorische Substanzen, die Mastzellen nach ihrer Aktivierung ausschütten können, die vaskuläre Permeabilität in CCL17-/Mäusen stärker beeinflussen und eine weit wichtigere Rolle als VEGF-A spielen. Ergebnisse 60 Abbildung 18: Kein Einfluss von VEGF-A auf die Parasitenlast nach Infektion mit L. sigmodontis. (A-D) FvB-Wildtyp (Wt) und VEGF-A transgene (Tg) Mäuse wurden natürlich mit L. sigmodontis infiziert und 10dpi die Anzahl der Parasiten (A) und der Zellen in der Pleura-Höhle (B) sowie die Zellzahl der mediastinalen (C) und peripheren (politealen, inguinalen, axialen) Lymphknoten (D) nach Kollagenase-Verdau bestimmt. Es werden Ergebnisse eines von zwei vergleichbaren Experimenten gezeigt (A, Mann Whitney Test; B-D, ungepaarter t-Test). (E) Mit anti-VEGF-A Antikörper behandelte und unbehandelte CCL17-defiziente Mäuse und +/CCL17 Mäuse wurden natürlich mit L. sigmodontis infiziert und die Parasitenlast in der Pleura-Höhle 10dpi bestimmt. Ergebnisse eines Experiments werden als Streudiagramm mit Mittelwerten dargestellt, die Daten wurden mit Kruskal-Wallis-Test und Dunn’s Multiple Comparison Test getestet. 3.3.5.4 Erhöhte Wurmlast bei CCL17-Defizienz abhängig von Histamin Zu den Mediatoren, die Mastzellen in ihren vorgefertigten Granula speichern und anreichern, gehört insbesondere Histamin. Durch Aktivierung und darauffolgende Degranulation der Mastzellen wird Histamin innerhalb weniger Augenblicke in das umgebende Gewebe freigesetzt, wo es neben anderen Eigenschaften gefäßerweiternd auf Endothelien wirkt und die vaskuläre Permeabilität erhöht. Um eventuelle Unterschiede in der ausgeschütteten Menge an Histamin von Mastzellen von CCL17-/- oder CCL17+/- Mäusen zunächst in vitro zu untersuchen, wurden Knochenmarks-Mastzellen generiert und für 1h mit LsAg stimuliert und die Histamin-Konzentration im Zellkulturüberstand mittels HTRF-Assays gemessen. Die Calciumionophore A23187 diente als Positivkontrolle, Medium allein als Negativkontrolle für eine spontane Abgabe von Histamin in das Kulturmedium. Es zeigte sich, dass die spontane Ausschüttung von Histamin in beiden Gruppen sehr hoch war und die maximale Degranulation, ausgelöst durch A23187, nur zu einer etwa 1,3- bis 1,4-fachen Menge an Histamin im Zellkulturüberstand führte. LsAg führte zu keiner höheren Ausschüttung von Histamin im Ergebnisse 61 Vergleich zur spontanen Abgabe (Abbildung 19A). Zudem konnte zwischen Mastzellen von CCL17defizienten oder heterozygoten Kontrollen keine Unterschiede festgestellt werden. Damit konnte in vitro, wahrscheinlich experimentell bedingt, nicht nachgewiesen werden, dass bei CCL17-Defizienz mehr Histamin von Mastzellen als Antwort auf Wurmantigene ausgeschüttet wird. Desweiteren wurde der Einfluss von Histamin auf die Etablierung der Wurmlast in der PleuraHöhle von CCL17-defizienten Mäusen in vivo untersucht. Dazu wurden CCL17-defiziente Mäuse mit Histamin-Rezeptor (HR)-Antagonisten behandelt und zusammen mit unbehandelten CCL17-/- und CCL17+/- Mäusen mit L. sigmodontis natürlich infiziert und 10dpi die Wurmlast in der Pleura-Kavität bestimmt. Histamin-Rezeptor-Antagonisten haben die Eigenschaft, die Wirkung von Histamin blockieren oder zumindest dämpfen zu können, indem sie die vorhandenen Histamin-Rezeptoren binden ohne selbst Signaltransduktionswege in der Zelle auszulösen. Die Blockade der HistaminRezeptoren 1 und 2 in CCL17-defizienten Mäusen führte zu einer signifikanten Reduktion der Wurmlast 10dpi im Vergleich zu unbehandelten CCL17-/- Mäusen (Abbildung 19B). Die Wurmlast reduzierte sich auf Level von CCL17+/- Mäusen. Die Ergebnisse der Behandlung von CCL17-defizienten Mäusen mit HR1- und HR2-Antagonisten in vivo zeigen somit, dass Histamin einen direkten Einfluss auf die Etablierung von Larven in der PleuraHöhle hat. Daraus kann geschlossen werden, dass bei CCL17-Defizienz durch die erhöhte Degranulation von Mastzellen insgesamt vermehrt Histamin freigesetzt wird, dass durch seine vasodilatorischen Eigenschaften eine erhöhte Permeabilität der Gefäße auslöst, welche Larven, wahrscheinlich durch die Erweiterung der Lymphgefäße, zu einer erleichterten Migration durch subkutanes Gewebe und Lymphgefäße verhilft, wodurch sie Immunreaktionen in der Haut entkommen und sich vermehrt in der Pleura-Höhle etablieren können. Abbildung 19: Behandlung mit Histamin-Rezeptor-Antagonisten in vivo reduziert Etablierung von -/L. sigmodontis in der Pleura-Kavität von CCL17 Mäusen. +/- -/- (A) BMMCs von CCL17 und CCL17 Mäusen wurden in 5-fach Bestimmung für eine Stunde mit Medium, 0,5µM Calciumionophore A23187 (CI) oder 100µg/ml LsAg stimuliert. Im Zellkulturüberstand wurde mittels HTRF-Assays der Gehalt von Histamin bestimmt. Dargestellt sind repräsentative Ergebnisse aus einem von sechs Experimenten als Mittelwerte ± Standardabweichung. (B) Mit HR1- und HR2-Antagonisten behandelte -/CCL17 Mäuse wurden natürlich mit L. sigmodontis infiziert und 10dpi die Wurmlast in der Pleura-Höhle +/-/bestimmt. Als Kontrollen dienten unbehandelte CCL17 und CCl17 Mäuse. Dargestellt werden Daten eines Experiments aus zwei Vergleichbaren als Streudiagramm mit Mittelwerten. Alle Daten wurden mit One-way ANOVA und Tukey’s Multiple Comparison Test analysiert. Ergebnisse 62 3.3.6 Mastzelldegranulation und vaskuläre Permeabilität nach Infektion von L. sigmodontis abhängig von Wolbachia Die bisherigen Ergebnisse zeigen, dass infektiöse L3 Larven von L. sigmodontis bereits 6h nach Infektion in CCL17-defizienten Mäusen eine vermehrte Akkumulation und Degranulation von Mastzellen in der Haut induzieren. Dies führt über eine vermehrte Freisetzung von Histamin zu einer erhöhten vaskulären Permeabilität und erlaubt es den Larven, vermutlich durch eine einfachere Migration durch die Haut in den Lymphgefäßen, den inflammatorischen Immunreaktionen in der Haut eher zu entkommen. Für den Großteil der Filarien, darunter Litomosoides sigmodontis, ist bekannt, dass sie ein symbiotisches Verhältnis mit Endobakterien der Gattung Wolbachia führen, welche eine wichtige Rolle in der Reproduktion, Entwicklung und Pathogenese der Filarien spielen (Taylor, Bandi et al. 2005). Zudem wurde gezeigt, dass Wolbachia-Lipoproteine Immunantworten bei Zellen über Aktivierung des Toll-like Rezeptors 2 (TLR2) auslösen können (Brattig, Bazzocchi et al. 2004; Hise, Daehnel et al. 2007; Turner, Langley et al. 2009). Von Mastzellen ist bekannt, dass sie in der Lage sind über die Expression bestimmter Toll-like Rezeptoren bakterielle Strukturen zu erkennen und auf diese zu reagieren. Wolbachia-Bakterien befinden sich in allen Entwicklungsstadien der Filarien, auch in infektiösen L3 Larven (Taylor and Hoerauf 1999). Wolbachia Antigene könnten somit auch eine Rolle bei der Aktivierung von Mastzellen spielen. Abbildung 20: Mastzelldegranulation und vaskuläre Permeabilität sind Wolbachia-abhängig. +/- -/- (A) CCL17 und CCL17 Mäuse wurden natürlich mit L. sigmodontis Wolbachia-haltigen L3 Larven oder Wolbachia-depletierten L3 Larven infiziert und nach 6h die Anzahl Toluidinblau-gefärbter, degranulierender Mastzellen bestimmt. Daten eines Experiments werden gezeigt. Jeweils 2 Haut-Schnitte von 5 Mäusen pro Gruppe wurden ausgezählt und Mittelwerte gebildet. (B, C) CCL17-defizienten und Kontroll-Mäusen auf C3H/HeN (B) oder BALB/c (C) Hintergrund wurde Wolbachia-haltiges LsAg oder Wolbachia-depletiertes LsAg gespritzt und nach 6h Evans Blau intravenös gespritzt. 1h später wurde der Austritt des Farbstoffs ins Gewebe analysiert. Repräsentative Daten jeweils eines von zwei unabhängigen Experimenten werden gezeigt als Mittelwerte ± Standardabweichung. Alle Daten wurden mit One-way ANOVA und Tukey’s Multiple Comparison Test analysiert. Daher wurde weiterhin untersucht, ob die verstärkte Degranulation von Mastzellen in CCL17defizienten Mäusen nach Infektion mit L. sigmodontis Wolbachia-abhängig ist und ob Wolbachia Einfluss auf die damit in Zusammenhang stehende erhöhte Permeabilität der Gefäße in der Haut haben. Dazu wurden CCL17-/- und CCL17+/- Mäuse natürlich mit L3 Larven von L. sigmodontis infiziert, Ergebnisse 63 deren Wolbachia durch eine Antibiotika-Behandlung depletiert wurden. Im Vergleich mit Wolbachiahaltigen, L3 infizierten CCL17-/- Mäusen waren in CCL17-/-, infiziert mit Wolbachia-depletierten L3 Larven, signifikant weniger Mastzellen degranuliert (Abbildung 20A). Um die Abhängigkeit der vaskulären Permeabilität von Wolbachia zu testen, wurde CCL17defizienten Mäusen Wolbachia-haltiges oder -freies LsAg subkutan gespritzt und 6h später die Extravasation von Evans Blau ins Gewebe der Injektionsstelle analysiert. Nach Injektion von Wolbachia-depletierten LsAg erhöhte sich die Permeabilität in der Haut von CCL17-/- Mäusen nicht wie bei CCL17-/- Mäusen, denen Wolbachia-haltiges LsAg injiziert wurde (Abbildung 20B). Da verschiedene Mausstämme unterschiedlich suszeptibel gegenüber der Infektion mit L. sigmodontis sind (Petit, Diagne et al. 1992), wurde in diesem Fall auch untersucht, ob die Defizienz von CCL17 auch auf BALB/c Hintergrund zu einer erhöhten vaskulären Permeabilität führt und ob diese Wolbachia-abhängig ist. BALB/c Mäuse sind suszeptibler gegenüber einer Infektion mit L. sigmodontis und sind im Gegensatz zu C3H/HeN Mäusen in der Lage eine patente Infektion mit Blutmikrofilarämie zu entwickeln (Petit, Diagne et al. 1992; Al-Qaoud, Taubert et al. 1997). Es zeigte sich, dass wie auf C3H/HeN-Hintergrund 6h nach Injektion von LsAg auch BALB/c CCL17-/- Mäuse eine erhöhte vaskuläre Permeabilität in der Haut im Vergleich zu BALB/c Wildtyp-Mäusen aufweisen (Abbildung 20C). Wurde Wolbachia-depletiertes LsAg den Mäusen injiziert, blieb die Extravasation des Farbstoffs ins umliegende Gewebe auf Level der Wildtyp-Kontrollen. Die Ergebnisse indizieren, dass die Degranulation der Mastzellen und die damit zusammenhängende vaskuläre Permeabilität in der Haut Wolbachia-abhängig sind. Zudem deuten sie darauf hin, dass die genetische Variabilität der verschiedenen Mausstämme auf die vaskuläre Permeabilität und die Wolbachia-Abhängigkeit keinen Einfluss nimmt. Unklar bleibt allerdings noch, ob nach der Übertragung in die Haut lebende L3 Larven Wolbachia-Antigene in die Peripherie freisetzen oder eher L3 Larven, welche direkt nach dem Eintritt in der Haut absterben. Auf welche Weise Wolbachia-Antigene Immunantworten in der Haut auslösen, muss ebenfalls noch untersucht werden. 3.3.7 Mastzelldegranulation, vaskuläre Permeabilität und Wurmlast nach Infektion mit L. sigmodontis abhängig von TLR2 Da die erhöhte Degranulation von Mastzellen und vaskuläre Permeabilität bei CCL17-defizienten Mäusen von Wolbachia-Bakterien abhängig sind (Abbildung 20) und bekannt ist, dass Wolbachiaassoziierte Antigene über TLR2 inflammatorische Reaktionen auslösen können (Brattig, Bazzocchi et al. 2004; Hise, Daehnel et al. 2007; Turner, Langley et al. 2009), wurde zuletzt untersucht, ob Degranulation, Permeabilität und Parasitämie bei Infektion mit L. sigmodontis TLR2 abhängig sind. Um die Abhängigkeit von TLR2 im Zusammenhang einer CCL17-Defizienz zu testen, wurden zur Depletion von CCL17 TLR2-defiziente Mäuse mit anti-CCL17 Antikörpern behandelt und zusammen mit anti-CCL17 behandelten CCL17+/- Mäusen und unbehandelten CCL17-/-, CCL17+/- und TLR2-/Mäusen natürlich mit L. sigmodontis infiziert. 6hpi zeigte die Analyse der Mastzellen in der Haut, dass im Gegensatz zu CCL17-/- und anti-CCL17 behandelten CCL17+/- Mäusen TLR2-defiziente, anti-CCL17 behandelte Mäuse keine erhöhte Anzahl degranulierender Mastzellen in der Haut hatten (Abbildung 21A). Neben der natürlichen Infektion wurde anti-CCL17 Antikörper behandelten und unbehandelten TLR2-/- und CCL17+/- Mäusen sowie CCL17-/- Mäusen LsAg subkutan in die Lumbalzone gespritzt. 6h nach der Injektion wurde die vaskuläre Permeabilität in der Haut an der Injektionsstelle analysiert. So zeigte sich, dass die vaskuläre Permeabilität in anti-CCL17 behandelten TLR2-/- Mäusen ebenfalls erniedrigt war im Vergleich zu CCL17-/- und anti-CCL17 behandelten CCL17+/- Mäusen (Abbildung 21B). Ergebnisse 64 Auch wurden anti-CCL17 TLR2-/- für 10 Tage mit L. sigmodontis infiziert. Die Parasiten-Anzahl lag mit durchschnittlich 59 Würmern/ Maus nur leicht über der Anzahl von unbehandelten TLR2-/- mit etwa 50 Würmern/ Maus. Die Wurmlasten in CCL17-/- (122 Würmer) und anti-CCL17 behandelten CCL17+/- Mäusen (110 Würmer) waren im Vergleich dazu signifikant erhöht (Abbildung 21C). Zusammengefasst zeigen die Ergebnisse, dass die Degranulation der Mastzellen, die Permeabilität der Gefäße und die Parasitämie in CCL17-defizienten Mäusen von TLR2 abhängig sind. Abbildung 21: Mastzelldegranulation, vaskuläre Permeabilität und Wurmlast nach Infektion mit L. sigmodontis sind TLR2-abhängig. +/- -/- -/- Anti-CCL17 Antikörper behandelte und unbehandelte CCL17 und TLR2 Mäuse sowie CCL17 Mäuse wurden natürlich mit L. sigmodontis infiziert und (A) 6h nach Infektion die Anzahl degranulierender Mastzellen in der Haut bestimmt oder (C) 10dpi die Wurmanzahl in der Pleura-Höhle. (B) 6h nach subkutaner Injektion von LsAg +/wurde die vaskuläre Permeabilität in der Haut von anti-CCL17 behandelten und unbehandelten CCL17 und -/-/TLR2 Mäusen sowie CCL17 Mäusen analysiert. Ergebnisse jeweils eines Experiments von zweien werden dargestellt (A, Kruskal-Wallis mit Dunn’s Multiple Comparison Test; B-C, One-way ANOVA und Tukey’s Multiple Comparison Test). Diskussion 65 4 Diskussion Dendritische Zellen und Mastzellen sind ideal in der Haut platziert, um eindringende Pathogene wie Parasiten zu erkennen und abzuwehren. Über die frühen Abwehrmechanismen gegen eindringende Filarien ist erst sehr wenig bekannt und die Rolle von Chemokinen dabei noch nicht erforscht worden. In dieser Studie wurde gezeigt, dass CCL17 anscheinend in der frühen Immunabwehr von Filarien eine besondere Rolle spielt. CCL17 scheint in frühe, innate Immunabwehrmechanismen involviert zu sein und eine Etablierung von Filarien im Wirt zu erschweren. Mit L. sigmodontis als Nagetiermodell für Filarien-Infektionen konnte gezeigt werden, dass eine genetische CCL17-Defizienz bei Mäusen oder die Behandlung mit anti-CCL17 Antikörpern zu einer erhöhten Wurmlast führen. Eine erhöhte Akkumulation und Degranulation von Mastzellen sowie eine damit verbundene erhöhte vaskuläre Permeabilität in der Haut bei CCL17-Defizienz bereits wenige Stunden nach Eindringen der Filarien in die Haut konnte beobachtet werden. Diese scheinen von dem Endosymbionten Wolbachia in der infektiösen L3 Larve abhängig zu sein und über TLR2abhängige Signalwege initiiert zu werden. Die vermehrte Ausschüttung von Histamin durch die Degranulation der Mastzellen induziert anscheinend die erhöhte vaskuläre Permeabilität, die wahrscheinlich wiederum den L3 Larven das Eindringen und die Migration durch die Lymphgefäße, vermutlich durch deren Erweiterung, erleichtert, so dass sich eine größere Anzahl von Filarien in der Thoraxhöhle etablieren kann. 4.1 Eine CCL17-Expression durch dendritische Zellen ist für die Immunantwort gegen Filarien wichtig Dendritische Zellen erfüllen als professionelle Antigen-präsentierende Zellen wichtige regulatorische Funktionen an der Schnittstelle des angeborenen zum adaptiven Immunsystem. Sie sind eine der ersten Immunzellen, die auf parasitäre Würmer wie Filarien treffen, wenn diese in die Haut des Wirtes eindringen. Nach Erkennung von Antigen über PRRs (z.B. TLRs) werden DCs aktiviert, sie exprimieren kostimulatorische Moleküle und präsentieren naiven T-Zellen Antigen, wodurch effektiv adaptive Immunantworten induziert werden. Zudem können DCs über die Ausschüttung von Chemokinen Immunzellen an die Infektionsstelle rekrutieren. So zeigte sich in einem ersten in vitro Experiment, dass eine Stimulierung mit Wurmextrakt von L. sigmodontis zur Aktivierung von BMDCs führt (Abbildung 2). Die Expression der Aktivierungsmarker CD40 und CD80 sowie des proinflammatorischen Zytokins IL-6 wurden hochreguliert, wobei LsAg eine intermediäre Aktivierung der BMDCs hervorrufen konnte im Vergleich zur Aktivierungskapazität der klassischen bakteriellen Stimuli LPS oder Pam3Cys. Mit LsAg-stimulierte Zellen produzierten beispielsweise etwa halb so viel IL-6 als nach Stimulierung mit bakteriellen PAMPs (ca. 500ng/ml versus 1000ng/ml) (Abbildung 2D). Es ist bekannt, dass helminthische Parasiten verschiedene Strategien zur Immunevasion entwickelt haben, die für ihr Überleben und eine wiederholte Übertragung vonnöten sind. Oftmals werden Antigen-präsentierenden Zellen wie DCs durch Immunevasionsmechanismen in ihrer Funktion gestört. Bei der humanpathogenen Filarie B. malayi konnte z.B. beobachtet werden, dass durch L3 Larven und Mikrofilarien Dysfunktionen in humanen dendritischen Zellen und Langerhans-Zellen ausgelöst werden, die zu einer verminderten Kapazität der DCs zur T-Zell-Aktivierung führen (Semnani, Liu et al. 2003; Semnani, Law et al. 2004). Desweiteren werden BMDCs, stimuliert mit soluble Egg antigen (SEA) von Schistosoma mansoni, nicht auf konventionelle Weise aktiviert. Im Kontrast zu klassischen bakteriellen Stimuli induziert SEA nur eine geringe Hoch-Regulierung von Aktivierungsmarkern wie CD40, CD80 oder CD86, auch produzieren SEA-stimulierte BMDCs kein IL-12, TNF oder IL-6. Ähnliche Ergebnisse konnten auch nach Diskussion 66 Stimulation von Zellen mit Antigenen anderer Stadien des Lebenszyklus von S. mansoni beobachtet werden (Perona-Wright, Jenkins et al. 2006). Zudem führt eine Stimulierung mit Leishmania majorLysat nur zu einer geringen Veränderung in der Expression von kostimulatorischen Molekülen oder Zytokinen bei BMDCs (Wiethe, Debus et al. 2008). Antigene von L. sigmodontis hingegen können DCs aktivieren, wenn auch nur eine intermediäre Aktivierung der DCs im Vergleich zu bakteriellen PAMPs erreicht wurde. Zwar könnten diese Ergebnisse z.B. von Konzentrationsunterschieden abhängig sein, doch könnten sie ebenso auf eine mögliche Dysregulation bei DCs hinweisen, die durch L. sigmodontis hervorgerufen werden und der Filarie helfen könnten den Immunreaktionen des Wirts effektiver zu entkommen. Über die frühen Abwehrmechanismen gegen Filarien ist bisher wenig bekannt, speziell die Rolle von Chemokinen wurde dabei noch nicht erforscht. Dies gilt auch für das Chemokin Thymus and activation-regulated chemokine (TARC/CCL17), das insbesondere von dendritischen Zellen und Langerhans-Zellen in der Haut exprimiert wird, um aktivierte T-Zellen zur Infektionsstelle zu rekrutieren. Es ist bekannt, dass eine Aktivierung von Toll-like Rezeptoren zu einer starken Hochregulierung von CCL17 bei DCs führen kann (Alferink, Lieberam et al. 2003; Gorski, Shin et al. 2003; Xiao, Fujita et al. 2003). So zeigte die Untersuchung per FACS-Analyse zwar nur eine intermediäre Erhöhung von CCL17-exprimierenden DCs nach Stimulierung mit LsAg (Abbildung 2C), auf Protein-Ebene konnte LsAg jedoch eine ebenso starke Expression von CCL17 in BMDCs von CCL17-Reporter-Mäusen induzieren wie der TLR2-Ligand Pam3Cys oder der TLR4-Ligand LPS (Abbildung 2E). Nicht alle Funktionen der DCs sind von den oben beschriebenen durch FilarienAntigene hervorgerufenen Dysregulationen betroffen. So reduzieren beispielsweise Mf von B. malayi zwar die Expression von IL-12 und IL-10 bei DCs, profinflammatorische Moleküle wie z.B. IL-8 und TNF werden jedoch normal exprimiert (Semnani, Liu et al. 2003). Inwieweit CCL17 von DCs nach Stimulierung mit Antigenen humaner Filarien oder anderer Helminthen sezerniert wird, ist nicht bekannt. Die Ergebnisse sprechen jedoch dafür, dass die Expression von CCL17 bei DCs ebenfalls nicht von der durch Filarien-Antigen hervorgerufenen möglichen Dysregulation der Zellfunktionen beeinflusst zu werden scheint. Die Expression von CCL17 durch Stimulierung von L. sigmodontis L3 Larven wurde auch in vivo untersucht. Während in naiver Haut von CCL17-Reporter-Mäusen keine Expression von CCL17 beobachtet werden konnte, zeigte sich eine Expression in geringem Maße in naiven peripheren LN und der Lunge von CCL17-Reporter-Mäusen (Abbildung 3). Es ist bekannt, dass Langerhans-Zellen und dermale DCs in gesunder, normaler Haut CCL17-neagtiv sind (Alferink, Lieberam et al. 2003). Jedoch findet eine konstitutive Expression von CCL17 in verschiedenen lymphoiden und nichtlymphoiden Organen statt: Alferink et al. detektierten einen ähnlich hohen prozentualen Anteil eGFP+ DCs für naive CCL17-Reporter-Mäuse in kutanen Lymphknoten und der Lunge wie in Abbildung 3 dargestellt (Alferink, Lieberam et al. 2003). Eine Stimulierung durch Antigen kann die Anzahl CCL17exrimierender DCs allerdings erhöhen, denn während DCs in der Haut CCL17-neagtiv sind, wird nach ihrer Aktivierung eine CCL17-Expression in den Zellen induziert und es findet eine Migration zu drainierenden Lymphknoten statt (Alferink, Lieberam et al. 2003). So konnte bereits 6h nach natürlicher Infektion mit L. sigmodontis L3 Larven eine CCL17Expression von Zellen in der Haut beobachtet werden sowie ein Anstieg CCL17-exprimierender dendritischer Zellen in peripheren Lymphknoten nach einem Tag (Abbildung 3). L. sigmodontis L3 Larven aktivieren somit auch in vivo dendritische Zellen und regen die Migration aus der Haut in drainierende Lymphknoten an. Dies ist vergleichbar mit Experimenten mit S. mansoni Cercarien, die in die Haut injiziert werden und ebenfalls eine Aktivierung und Migration von LCs und dermalen DCs in drainierende Lymphknoten auslösen (Kumkate, Jenkins et al. 2007). Zudem durchqueren die L3 Larven auf ihrem Migrationsweg von der Haut über lymphatische Gefäße die drainierenden Lymphknoten (Marechal, Le Goff et al. 1996), was zusätzlich eine erhöhte Expression von CCL17 bei Lymphknoten-residenten DCs auslösen kann. Eine erhöhte Zahl CCL17+ DCs war von Tag 1 bis Tag 5 nach Infektion in den peripheren Lymphknoten zu beobachten, wohingegen in der Lunge der Trend für eine erhöhte Expression erst 5dpi einsetzte und bis 10dpi festzustellen war (Abbildung 3). Diese Diskussion 67 zeitliche Versetzung der CCL17-Expression in den verschiedenen Organen lässt sich vom Migrationsweg der Larven ableiten, die nach dem Durchwandern der Haut zunächst über die Lymphknoten zum Herzen und in den Blutkreislauf gelangen, um dann nach spätestens 10 Tagen über die Lunge in die Thoraxhöhle zu penetrieren (Marechal, Le Goff et al. 1996). In der Milz hingegen, die nicht auf dem Migrationsweg der Larven liegt, konnte keine Expression von CCL17 festgestellt werden zu keinem der gemessenen Zeitpunkte nach Infektion mit L. sigmodontis (Abbildung 3D). Alferink et al zeigten bereits, dass weder ein eGFP-Signal von Zellen in der Milz naiver CCL17-Reporter-Mäuse mit konfokaler Mikroskopie detektiert werden kann noch innerhalb MACS-angereicherter CD11c+ Zellen der Milz. Eine CCL17 mRNA-Expression war auch nicht in neonatalen CCL17-Reporter-Mäusen festzustellen und eine systemische Stimulierung mit bakteriellen Stimuli (LPS, CpG-ODNs) oder Listeria monocytogenes führten auch bei aktivierten DCs zu keiner Expression von CCL17 in der Milz adulter Tiere (Alferink, Lieberam et al. 2003). Hingegen wurde gezeigt, dass eine Expression von CCL17 bei Milz-DCs nachgewiesen werden kann, wenn diese durch spezifisch aktivierte NKT-Zellen stimuliert werden (Semmling, Lukacs-Kornek et al. 2010). Doch eine ähnliche zellspezifische Aktivierung der DCs, die zu einer Expression von CCL17 in der Milz führen könnte, scheint zumindest bei der frühen Immunantwort gegen Filarien nicht stattzufinden. Dass jedoch CCL17 bei der frühen Immunantwort gegen Filarien in vivo eine bestimmte Funktion besitzt, konnte sowohl durch den genetischen Knockout von CCL17 als auch durch die Depletion mit anti-CCL17 Antikörpern bei Mäusen gezeigt werden. Bei der natürlichen Infektion mit L. sigmodontis konnte bereits 10 Tage nach Infektion in CCL17-defizienten Mäusen eine signifikante Erhöhung der Parasitenlast in der Pleura-Höhle im Vergleich zu Wildtyp- oder heterozygoten CCL17-Mäusen beobachtet werden (Abbildung 4). Dabei spielte der genetische Hintergrund der Mäuse keine Rolle. Auch waren signifikante Unterschiede in der Wurmlast noch 20 und 30 Tage nach der Infektion festzustellen. Es ist bekannt, dass nach einer Filarien-Infektion ein Großteil der Larven innerhalb der ersten 48h in „einer ersten Phase der Zerstörung“ abgewehrt wird, während in einer zweiten Phase erst 30 Tagen nach der Etablierung in der Pleura-Höhle die Wurmanzahl weiter reduziert wird. Für sowohl suszeptible als auch resistente Mäuse wurde gezeigt, dass eine bereits 10 Tage nach der Infektion etablierte Wurmanzahl sich kaum über die nächsten 20 Tage verändert (Marechal, Le Goff et al. 1996; Babayan, Ungeheuer et al. 2003). Somit deuten die Ergebnisse auf sehr früh einsetzende CCL17-abhängige Immunabwehrmechanismen gegen Filarien hin, die wahrscheinlich noch vor der Etablierung der Würmer in der Pleura-Höhle 10dpi aktiv und bei Mäusen mit CCL17-Defizienz gestört sind, wodurch es zu höheren Parasitenlasten kommen kann. 4.2 Der Einfluss von CCL17 auf CCR4+ Zellen in der Thoraxhöhle ist nur von geringer Bedeutung für die Immunabwehr bei Filarieninfektionen Von CCL17 ist bekannt, dass es von dendritischen Zellen exprimiert wird, um CCR4+ Zellen chemotaktisch zur Infektionsstelle zu rekrutieren. Da durch CCL17 insbesondere CD4+ T-Zellen mit einer Präferenz zum Th2-Subtyp rekrutiert werden (Bonecchi, Bianchi et al. 1998), wurden mögliche Einflüsse von CCL17 auf diese Zellen nach Etablierung der Filarien in der Thoraxhöhle untersucht. CCR4 wird aber auch von anderen Zellen wie CD25+ T-regulatorischen Zellen (Iellem, Mariani et al. 2001), CLA+ skin-homing Lymphozyten (Campbell, Haraldsen et al. 1999), DCs, Makrophagen (Chvatchko, Hoogewerf et al. 2000), NK-Zellen (Inngjerdingen, Damaj et al. 2000), CD8+ T-Zellen (Yung, Mo et al. 2007) und B-Zellen (Johansson, Ahlstedt et al. 2005) exprimiert, sodass neben Th2Zellen auch andere CCR4-exprimierende Zellpopulationen von Interesse waren. Messungen der Zellkomposition in der Thoraxhöhle 10, 20 und 30dpi ergaben, dass keine Unterschiede im prozentualen Anteil speziell von CD4+ T-Zellen zwischen CCL17-defizienten und Diskussion 68 CCL17-heterozygoten Mäusen bestanden (Tabelle 1). Dies war erstaunlich, da CCL17 wichtig für die Rekrutierung von Th2-Zellen und die Aufrechterhaltung von Th2-Immunantworten ist (Imai, Nagira et al. 1999) und eine CCL17-Überexpression z.B. mit der Pathogenese Th2-dominierter allergischer Erkrankungen verbunden wird (Romagnani 2002). Da CD4+ T-Zellen bei der Abwehr adulter Würmer eine große Rolle spielen (Al-Qaoud, Taubert et al. 1997), wurde zunächst vermutet, dass eine Defizienz von CCL17 zu einer reduzierten Anzahl CD4+ T-Zellen führt, wodurch die Immunantwort geschwächt und erhöhte Mengen an Filarien sich etablieren können. Dies jedoch scheint anhand der vorliegenden Ergebnisse aber nicht der Fall zu sein. Auch bei anderen CCR4-exprimierenden Zellpopulationen konnte zu den gemessenen Zeitpunkten meistens kein Unterschied in der Anzahl der Zellen zwischen den Gruppen festgestellt werden (Tabelle 1). Es konnte zwar eine signifikante Zunahme an CD8+ Zellen in CCL17-defizienten Mäusen 30dpi beobachtet werden, doch zeigten Korten et al., dass sich eine Depletion von CD8+ Zellen während einer Filarieninfektion nicht auf die Infektionslast auswirkt (Korten, Volkmann et al. 2002). Für B-Zellen hingegen konnte gezeigt werden, dass sie wichtig für die Immunabwehr von Filarien sind (Al-Qaoud, Fleischer et al. 1998; Martin, Saeftel et al. 2001). Dennoch zeigten sich keine signifikanten Unterschiede in der Anzahl an B-Zellen in der Pleura-Höhle 10 bis 30 Tage nach Infektion, die eine erhöhte Wurmlast bei CCL17-defizienten Mäusen erklären würden. Auch war die Anzahl dendritischer Zellen in der Pleura-Höhle zwischen den Gruppen 10 und 20dpi nicht unterschiedlich, so dass CCL17 selbst auch keinen Einfluss auf die Akkumulation von DCs in der Pleura-Höhle zu haben scheint. Zwar sind Makrophagen in der Lage CCR4 zu exprimieren (Chvatchko, Hoogewerf et al. 2000), doch waren die prozentualen Anteile von Makrophagen 10 bis 30dpi in CCL17-defizienten und -heterozygoten Mäusen ähnlich, so dass die CCL17-abhängige Rekrutierung von Makrophagen keine Bedeutung zu haben scheint. Neben der Infektion von Mäusen auf C3H-Hintergrund wurde die zelluläre Zusammensetzung in der Pleura-Kavität 30dpi auch in CCL17-defizienten Mäusen auf C57BL/6-Hintergrund getestet. Es konnten auch hier keine signifikanten Unterschiede bei T- und BZellen, Makrophagen und DCs festgestellt werden (Tabelle 2), so dass zusammengefasst angenommen werden kann, dass eine CCL17-abhängige Rekrutierung der oben beschriebenen CCR4exprimierenden Zellen bei einer Filarien-Infektion in der Thoraxhöhle zu späteren Zeitpunkten ab etwa 10dpi keine bedeutende Rolle zu spielen scheint. Es wurde auch der prozentuale Anteil eosinophiler Granulozyten getestet, wobei humane, nicht aber murine Eosinophile CCR4 exprimieren können (Borchers, Ansay et al. 2002). Die Anzahl Eosinophiler nahm von Tag 10 zu Tag 30 nach Infektion stetig zu (Abbildung 5A), obwohl die Parasitenanzahl sich in dem Zeitraum nicht veränderte (Abbildung 4A). Ähnliches wurde bereits bei anderen Infektionsversuchen beobachtet, wo sich eine stetige Zunahme von Eosinophilen in der Pleura-Kavität bis 30 Tage nach Infektion bei gleich bleibender Wurmlast sowohl in BALB/c als auch C57BL/6 Mäusen zeigte (Babayan, Ungeheuer et al. 2003). Eosinophile akkumulieren schon kurz nach der Migration der L3 Larven in der Brusthöhle und persistieren dort (Al-Qaoud, Taubert et al. 1997; Al-Qaoud, Pearlman et al. 2000). Zu allen drei gemessenen Zeitpunkten war die starke Tendenz zu mehr Eosinophilen in den CCL17-defizienten Mäusen im Vergleich zu den Kontrollmäusen vorhanden, was mit der erhöhten Anzahl an Parasiten bei den Mäusen mit CCL17-Defizienz in Zusammenhang zu stehen scheint. Da der Anteil an Eosinophilen und Makrophagen 30dpi in der Thorahöhle sehr hoch ist, ist dort die prozentuale Abnahme der anderen Zellpopulationen zu diesem Zeitpunkt hin zu erklären (Tabelle 1). Eine sehr geringe Anzahl an Neutrophilen konnte zu allen drei untersuchten Zeitpunkten in beiden Mausgruppen detektiert werden, wobei keine Unterschiede zwischen CCL17-/- und CCL17+/- Mäusen oder zwischen den Zeitpunkten beobachtet wurde (Abbildung 5B). In anderen Infektionsexperimenten mit BALB/c und C57BL/6 Mäusen wurden 10 und 30dpi keine Neutrophilen in der Thoraxhöhle detektiert (Babayan, Ungeheuer et al. 2003). Humane Neutrophile können zwar CCR4 exprimieren (Cheng, Lai et al. 2001; Yousefi, Cooper et al. 2001), doch scheinen Neutrophile durch die Expression von CCL17 im Mausmodell nicht stark beeinflusst zu werden, da es keine Diskussion 69 Unterschiede in der Anzahl zwischen CCL17-defizienten und -heterozygoten Mäusen zu keinem der gemessenen Zeitpunkte gab. Der Anteil von Mastzellen in der Pleura-Höhle erreichte in den Experimenten zu allen gemessenen Zeitpunkten nicht mehr als 0,5% (Daten nicht gezeigt). Auch Babayan et al. konnten maximal 0,5% an Mastzellen in der Thoraxhöhle in Balb/c und C57BL/6 Mäusen 10 und 30 Tage nach Infektion mit L. sigmodontis detektieren (Babayan, Ungeheuer et al. 2003). So besteht also kein Unterschied zwischen C3H/HeN, Balb/c und BL/6 Mäusen und auch eine CCL17-Defizienz hat vermutlich keinen Einfluss auf die Akkumulation von Mastzellen in der Pleura-Höhle 10, 20 oder 30 Tage nach Infektion. Interessanterweise war die Anzahl CD4+CD25+ T-Zellen zu allen drei untersuchten Zeitpunkten nach der Infektion in CCL17-defizienten Mäusen signifikant erhöht (Tabelle 1), obwohl eine reduzierte Anzahl durch die CCL17-abhängige Rekrutierung CCR4-exprimierender CD4+CD25+ Tregulatorische Zellen (Iellem, Mariani et al. 2001) erwartet worden wäre. Da T-regulatorischer Zellen inflammatorische Immunreaktionen supprimieren und autoimmun-Reaktionen kontrollieren können (Roncarolo, Gregori et al. 2006; Sakaguchi, Ono et al. 2006), legte dies die Vermutung nahe, dass Tregulatorische Zellen in CCL17-abhängige Immunmechanismen stark involviert sein könnten und dass durch eine verstärkte Suppression der erhöhten Anzahl CD4+CD25+ T-Zellen in CCL17-defizienten Mäusen die Etablierung von mehr Filarien in der Pleura-Höhle ermöglicht werden könnte. Eine Depletion von CD25+ Zellen in CCL17-defizienten Mäusen führte allerdings zu keiner Reduktion der Wurmlast (Abbildung 6), obwohl eine deutliche Reduktion von CD4+CD25+ T-Zellen in der PleuraHöhle und in mediastinalen, inguinalen und axialen Lymphknoten um 83-86% vorhanden war. Die erzielte Reduktion von CD4+CD25+ T-Zellen ist vergleichbar mit Daten von Taylor et al., wo eine Reduktion um 80% in infizierten Mäusen in der Pleura mit dem gleichen anti-CD25 Antikörper erzielt wurde (Taylor, van der Werf et al. 2009). Taylor et al. zeigten allerdings auch, dass die Depletion von natürlichen CD25+Foxp3+ T-regulatorischen Zellen durch eine anti-CD25 Antikörper-Behandlung vor der Infektion die Etablierung der Larven in den ersten 20 Tagen nach Infektion nicht beeinflusst, sie erst 60dpi in niedrigeren Wurmlasten und erhöhten Wurm-spezifischen Zytokin-Antworten resultiert (Taylor, van der Werf et al. 2009). Somit ist es wahrscheinlich, dass die erhöhte Anzahl CD4+CD25+ TZellen nicht ausschlaggebend war für die Etablierung einer erhöhten Wurmlast in CCL17-/- Mäusen und die CCR4-abhängige Rekrutierung CD25+ T-regulatorischer Zellen durch CCL17 nicht essentiell für die frühe Immunabwehr von Filarien. Bekannt ist, dass innerhalb der ersten 2 Tage nach Infektion der Großteil der eindringenden Larven abgetötet wird (Marechal, Le Goff et al. 1996) und die restlichen Larven sich in der Maus etablieren können. Die Anzahl lebender Larven in CCL17-/- Mäusen war bereits 10 Tage nach Infektion erhöht (Abbildung 4), so dass frühe Immunantworten ausschlaggebend für die Abwehr von Filarien sind. Es ist bekannt, dass Helminthen in der Lage sind Homologe zu Säugetier TGF-β zu produzieren, von denen wenigstens eines imstande ist an den humanen TGF-β-Rezeptor zu binden (Gomez-Escobar, Gregory et al. 2000; Maizels, Gomez-Escobar et al. 2001), um die Wirts-Immunreaktionen in suppressive T-regulatorische Antworten zu lenken. Außerdem zeigten Taylor et al., dass infektiöse L3 Larven in vivo die Proliferation von CD4+CD25+Foxp3+ T-Zellen induzieren, was innerhalb von 7 Tagen nach Infektion zu einem erhöhten prozentualen Anteil Foxp3-produzierender CD4+ T-Zellen führt (Taylor, van der Werf et al. 2009). Daher ist es wahrscheinlich, dass die erhöhte Anzahl von Parasiten in CCL17-/- Mäusen eine erhöhte Anzahl von CD4+CD25+ T-Zellen in der Pleura-Höhle im Vergleich zu CCL17+/- Mäusen mit 4-fach weniger Würmern induzierten, obwohl keine Rekrutierung der Zellen durch CCL17 stattfinden konnte. Die Ergebnisse zeigen, dass die Rekrutierung CCR4+ Zellen durch CCL17 keinen Einfluss auf die Immunabwehr von Filarien 10 Tage nach Infektion oder später hat. Eine Infektion von CCR4defizienten Mäusen mit L. sigmodontis führte ferner zu keiner erhöhten Wurmlast im Vergleich zu Wildtyp-Mäusen (Abbildung 7), auch konnten keine signifikanten Unterschiede zwischen den Gruppen bei der prozentualen Anzahl CCR4-exprimierender Zellen beobachtet werden (Tabelle 3). Trotz einer fehlenden Rekrutierung der Zellen über CCR4 war sogar ein starker Trend zu einem größeren Anteil CD4+ T-Zellen in CCR4-/- Mäusen in der Pleura-Höhle vorhanden. Diskussion 70 Zusammengenommen legt dies den Schluss nahe, dass die Interaktion zwischen CCR4 und CCL17 und die damit zusammenhängende CCR4-abhängige Rekrutierung von Zellen keinen Einfluss auf die Immunabwehr von Filarien hat. Chvatchko et al. konnten zudem zeigen, dass die Depletion von CCR4 keinen Einfluss auf eine Th2-Differenzierung von Zellen in vitro oder in einem Th2-abhängigen Modell von allergischer Entzündung der Atemwege hat (Chvatchko, Hoogewerf et al. 2000). Da CCR4defiziente CD4+ T-Zellen normal ins Peritoneum wandern können (Campbell, O'Connell et al. 2007), wird CCR4 vermutlich nicht zur Rekrutierung von T-Zellen in die Pleura-Kavität benötigt. Somit ist es wahrscheinlich, dass die CCR4-abhängige Rekrutierung von Th2-Zellen und anderen Zellen keine Rolle in der Abwehr von Filarien-Erkrankungen spielt. Andere Rezeptoren als CCR4 wie z.B. CCR8, der ebenfalls als Rezeptor für CCL17 gehandelt (Bernardini, Hedrick et al. 1998) und von vielen verschiedenen Zellen wie T-Zellen exprimiert wird (Iellem, Mariani et al. 2001; Gombert, DieuNosjean et al. 2005), könnten stattdessen involviert sein. Zusammenhänge sind aber bisher noch nicht bekannt. Eine gemischte Th1/Th2-Zytokin-Antwort konnte in sowohl CCL17-exprimierenden als auch CCL17-defizienten Mäusen gemessen werden: Es konnten in der pleuralen Coelomflüssigkeit sowohl die Th1-Zytokine IFN-γ und IL-12 als auch die Th2-Zytokine IL-5 und IL-10 10, 20 und 30dpi detektiert werden, allerdings konnten keine besonderen Unterschiede zwischen CCL17-defizienten Mäusen und der Kontrollgruppe gemessen werden außer für das anti-inflammatorische Zytokin IL-10 30dpi (Tabelle 4). Studien mit BALB/c Mäusen, welche völlig permissiv gegenüber der Infektion mit L. sigmodontis sind, demonstrierten bereits, dass bei Infektionen mit Filarien eher eine gemischte Th1/Th2-Immunantwort vorherrscht und dass verschiedene Th2-Zytokine wie IL-4 und IL-5 sowie das Th-2 Zytokin IFN-γ für die Wurmabwehr benötigt werden. Der Knockout dieser Zytokine führte zu höheren Mikrofilarienlasten oder Überlebensraten adulter Würmer (Al-Qaoud, Pearlman et al. 2000; Volkmann, Saeftel et al. 2001; Le Goff, Lamb et al. 2002; Volkmann, Bain et al. 2003). IL-10 spielt in der murinen Filariose eine regulatorische/ suppressive Rolle und ist direkt an der Kontrolle der Permissivität gegenüber der Wurminfektion beteiligt (Specht, Volkmann et al. 2004). Im Gegensatz zu dieser Arbeit konnten Babayan et al. 10 und 20 Tage nach Infektion in BALB/c und BL/6 Mäusen in der pleuralen Coelomflüssigkeit keine dieser für eine Filarien-Infektion wichtigen Zytokine messen. Erst 30dpi wurden IL-4, IL-5, IL-10 und IFN-γ in beiden Mausgruppen detektiert, wobei die Level der Th2-Zytokine sowie von IFN-γ in BL/6 Mäusen erhöht waren im Vergleich zu denen in BALB/c Mäusen trotz gleich hoher Parasitenlasten (Babayan, Ungeheuer et al. 2003). Die in dieser Arbeit gemessenen Zytokin-Level waren dabei ähnlich hoch wie in der Studie von Babayan et al., wobei sie in etwa so hoch lagen wie die in BALB/c Mäusen gemessen Zytokin-Level. Da jedoch keine signifikanten Unterschiede in der Expression der verschiedenen Zytokine zwischen den Mausgruppen festgestellt werden konnten, kann vermutlich eine Beteiligung der Zytokine in CCL17-abhängigen Immunantworten ausgeschlossen werden, auch wenn die erhöhte Menge an IL-10 in CCL17-/Mäusen einen Beitrag regulatorischer Zellen vermuten ließ. Regulatorische T-Zellen, aber auch CD4+ und CD8+ T-Zellen sowie B-Zellen sind Produzenten von IL-10 (Al-Qaoud, Fleischer et al. 1998; O'Garra, Vieira et al. 2004; Mitre, Chien et al. 2008) und könnten durch die Expression von CCR4 CCL17-abhängig beeinflusst worden sein. Die Depletion von IL-10 in CCL17-defizienten Mäusen führte allerdings zu keiner Reduktion der Parasitenzahl in der Thoraxhöhle 10dpi (Abbildung 8). Mit der Depletion des IL-10-Rezeptors in L. sigmodontis-infizierten Mäusen um 30dpi wurde bereits gezeigt, dass IL-10 zu späten Zeitpunkten keine besondere Rolle im Überleben der Filarien spielt, da bei der Parasitenlast 40 und 60dpi keine Reduktion in den behandelten Mäusen beobachtet werden konnte (Taylor, LeGoff et al. 2005). Über den Einfluss von IL-10 bei früheren Immunreaktionen gegen Filarien etwa 10dpi im Zusammenhang mit IL-10 Depletions-Experimenten ist bisher nichts bekannt. Die frühe Depletion von IL-10 in CCL17-/- Mäusen lässt zumindest vermuten, dass IL-10 keine besondere Rolle bei CCL17-abhängigen Immunmechanismen gegen Filarien spielt und nicht an der vermehrten Etablierung der Würmer in der Pleura-Höhle bei CCL17-Defizienz beteiligt ist. Die Untersuchungen in der Pleura-Höhle zwischen 10 und 30dpi zeigten außer im Falle der Wurmlast grundsätzlich keine Unterschiede zwischen CCL17+/- und CCL17-/- Mäusen weder in der Diskussion 71 Zellkomposition noch in der Produktion von Th1- und Th2-Zytokinen. Zusammengefasst sprechen die Ergebnisse dafür, dass CCL17 keinen Einfluss auf Effektorzellen oder T-regulatorische Zellen während einer Filarieninfektion hat. Wahrscheinlicher ist, dass sehr frühe, nicht-adaptive Immunmechanismen in Abhängigkeit von CCL17 induziert werden, die zu einer erhöhten Wurmlast in CCL17-defizienten Mäusen führen, zumal sich diese bereits 10dpi zeigt. 4.3 Frühe, durch L3 Larven induzierte Immunantworten in der Haut sind Lymphangiogenese-unabhängig Nach der Transmission der Filarien in die Haut findet der erste Kontakt zwischen den infektiösen L3 Larven mit dem Wirtsimmunsystem statt. Es wurde gezeigt, dass in der Haut bis zu 70% der eindringenden Larven innerhalb der ersten 48h nach Infektion Immunabwehrmechanismen erliegen (Marechal, Le Goff et al. 1996). Die restlichen der initial transferierten Larven können diesen durch die Migration über lymphatische Gefäße entkommen und haben die Chance, sich in der Thoraxhöhle anzusiedeln. Es zeigte sich ein starker Trend, dass ein größerer Teil natürlich übertragener L3 Larven von L. sigmodontis nach 24-48h aus der Haut von CCL17-defizienten Mäusen auswandern kann als aus der Haut CCL17-exprimierender Mäuse (Abbildung 9). In die Haut übertragene Larven benötigen durchschnittlich 24-48h, um über die Lymphgefäße zu den regionalen Lymphknoten zu gelangen, von wo aus sie sich weiter auf den Weg zur Thoraxhöhle machen (Wenk 1967). Die Beobachtungen von der Auswanderung der Larven aus der Haut in Medium stimmen zeitlich damit überein. Die größere Anzahl der Larven, die aus der Haut auswandern konnte, ließ vermuten, dass die Defizienz von CCL17 beispielsweise eine erleichterte Migration der Larven durch Haut und Lymphgefäße ermöglicht. Anhand der Expression Lymphendothel-spezifischer Marker sowie des auch Lymphangiogenese fördernden Faktors VEGF-A in naiven, neugeborenen CCL17+/- und CCL17-/- Mäusen konnte angenommen werden, dass die Defizienz von CCL17 nicht per se die Ausbildung eines stärker ausgebildeten lymphatischen Systems induziert, da kein Unterschied in der Expression zwischen den Gruppen festgestellt werden konnte (Abbildung 11). Wie bereits diskutiert, induzieren L3 Larven eine Expression von CCL17 bei DCs in der Haut von CCL17-Reporter-Mäusen (Abbildung 3A). Die Expression konnte bereits 6h nach Infektion detektiert werden, so dass sehr frühe CCL17-abhängige Immunmechanismen in der Haut möglich sind. In unbehandelten und anti-CCL17 behandelten CCL17+/- und CCL17-/- Mäusen konnte zudem 6h nach natürlicher Infektion mit L3 Larven eine erhöhte Expression von CCL5 detektiert werden (Abbildung 10B), ein Chemokin, das verschiedene Immunzellen wie T-Zellen, Monozyten, Eosinophile und Mastzellen zur Infektionsstelle rekrutieren kann und u.a. von DCs und aktivierten Makrophagen in Mäusen exprimiert wird. Unterschiede in der Expression zwischen den Mausgruppen bestanden nicht, zudem induzierten die Larven die Expression und nicht die in die Haut abgegebene Milbensaliva. Es konnte ebenfalls eine starke Expression von IL-12 durch die L3 Larven beobachtet werden (Abbildung 10A), während sie in der Haut 6hpi keine Expression der Th2-Zytokine IL-4, IL-5, IL-10 oder TSLP bzw. von IL-17A induzierten. In vitro konnte gezeigt werden, dass lebende Mikrofilarien von B. malayi in der Lage sind eine Hochregulierung von Chemokinen wie CCL5 in humanen DCs zu induzieren (Semnani, Liu et al. 2003). Hingegen wurde die Expression von Zytokinen und Chemokinen in der Haut in vivo wenige Stunden nach einer Infektion mit Filarien oder anderen Helminthen kaum untersucht. Die Ergebnisse dieser Arbeit zeigen eine Expression weniger Zytokine und Chemokine und dass zu einem so frühen Zeitpunkt nach Infektion mit L. sigmodontis keine für die Wurmabwehr wichtigen Th2-Zytokine in der Haut exprimiert werden. Mit der starken Expression von IL-12 herrscht eher eine frühe Th1-Immunantwort vor, wobei auch Th2-assoziierte Chemokine wie CCL17 exprimiert werden. Diese werden aber nicht typischerweise mit Lymphangiogenese in Verbindung gebracht. Diskussion 72 Es bestand die Vermutung, dass eine Expansion der Lymphgefäße durch Proliferation des Lymphendothels, ausgelöst durch L3 Larven, bei CCL17-Defizienz die Möglichkeit zu einer erleichterten Migration der Larven durch die Haut/ Lymphgefäße bietet. Daher wurde 6h nach Infektion mit L3 Larven die Expression von Lymphendothel-spezifischen Markern, Tight- und Adherens-Junctions sowie Lymphangiogenese-fördernder Faktoren in der Haut gemessen. Im Gegensatz zum Biss der als Vektor dienenden Milbe lösten die natürlich infizierten L3 Larven selbst keine signifikant erhöhte Expression dieser Marker aus (Abbildung 12). Bei der Onchozerkose wurde gezeigt, dass neben Angiogenese innerhalb von Onchozerkomen auch eine Lymphangiogenese von Gefäßen stattfindet (Attout, Hoerauf et al. 2009). Es wurde vermutet, dass die lymphatische als auch die Blut-Gefäßneubildung, die um den weiblichen Wurm erfolgt, entweder von der Filarie selbst durch beispielsweise die Freisetzung angiogener oder lymphangiogener Faktoren induziert wird oder durch fortwährende Wirts-Immunantworten. In vitro konnten Bennuru et al. zeigen, dass sowohl lebende B. malayi als auch Extrakte der Filarien eine Proliferation von Lymphatischen Endothelzellen und die Bildung Gefäß-ähnlicher Strukturen induzieren können (Bennuru and Nutman 2009). Die induzierte Proliferation schien Filarien-spezifisch zu sein, da beispielsweise SEA (Extrakt aus S. mansoni-Eiern) oder Antigen von adulten Schistosomen keine Proliferation bei lymphatischen Endothelzellen induzieren konnten, und die Formierung Gefäß-ähnlicher Strukturen Kontaktunabhängig und durch exkretorisch-sekretorische Proteine der Filarien ausgelöst war. Filarien und andere Parasiten setzen viele unterschiedliche Moleküle frei, darunter exkretorisch-sekretorische Proteine, die die Immunantworten des Wirts auf unterschiedliche Weise beeinflussen können (Harnett and Harnett 2006). Die Freisetzung dieser Moleküle ist oftmals Stadien-spezifisch. ES-62 beispielsweise, das anti-inflammatorische, allerdings keine Lymphangiogenese-fördernden Effekte auf die Wirts-Immunantworten ausübt, wird nur von L4-Larvenstadien und adulten Würmern, nicht aber von L1, L2 oder L3 Larven sekretiert (Stepek, Auchie et al. 2002). Bennuru et al. untersuchten nur für die späteren Entwicklungsstadien der Filarien, adulten Würmern und Mf, das Potential zur Induktion von Lymphangiogenese, nicht aber für infektiöse L3 Larven, so dass direkte Vergleiche mit Ergebnissen aus dieser Arbeit nicht möglich sind. Zudem wurden Lymphangiogenese und lymphatische Neugestaltung frühestens 48h nach Stimulierung mit lebenden Filarien oder FilarienExtrakten beobachtet. Eine Induktion von Lymphangiogenese in der Haut durch L. sigmodontis L3 Larven 6h nach Infektion zu detektieren könnte somit verfrüht oder anhand der verwendeten Marker nicht messbar sein, da die von Bennuru et al. beobachtete Proliferation und Differenzierung der lymphatischen Endothelzellen zudem nicht mit einer erhöhten Expression von LYVE-1, Prox1 und anderen typischen Markern für Lymphangiogenese zusammen zu hängen schien (Bennuru and Nutman 2009). Diese Ergebnisse sprechen dafür, dass L3 Larven 6h nach Infektion auch bei einer CCL17-Defizienz ihres Wirts keine Lymphangiogenese in der Haut induzieren und dass eher Lymphangiogenese-unabhängige Mechanismen die Migration der Larven durch Haut und Lymphgefäße bei einer CCL17-Defizienz der Mäuse erleichtern. So wäre es beispielsweise möglich, dass Filarien-Antigene direkt oder indirekt Zellverbindungen zwischen Lymphendothelzellen aufschließen könnten, die aus Adherens- und Tight-JunctionsProteinen wie VE-Cadherin, Occludin und JAM-1 gebildet werden (Baluk, Fuxe et al. 2007). AdherensJunctions können beispielsweise durch die Phosphorylierung von Tyrosin-Resten in VE-CadherinMolekülen geöffnet werden oder interzelluläre Lücken können durch Permeabilitäts-fördernde Substanzen, inflammatorische Bedingungen oder durch einen enzymatischen Aufschluss entstehen (Dejana, Orsenigo et al. 2008). Solche geöffneten Zellverbindungen und die damit verbundene Destabilisierung der strukturellen Integrität der Lymphendothelien könnten es L3 Larven erleichtern, in das Lumen der Lymphgefäße einzudringen und durch diese zu migrieren. mRNA-ExpressionsAnalysen von Adherens- und Tight-Junctions-Proteinen, wie in dieser Arbeit durchgeführt, können diese möglicherweise stattfindende Öffnung der Zellverbindungen allerdings nicht aufzeigen. Histologische Untersuchungen beispielsweise zur Analyse der Lymphendothelverbindungen auf Protein-Ebene in der Haut von CCL17-defizienten Mäusen nach einer natürlichen Infektion mit L. sigmodontis L3 Larven müssten indessen durchgeführt werden. Diskussion 73 Im Gegensatz zu L. sigmodontis L3 Larven war der Biss der Milbe O. bacoti selbst in der Lage eine Lymphangiogenese in der Haut von CCL17+/- und CCL17-/- Mäusen auszulösen (Abbildung 12A-C). Die Beißwerkzeuge von Milben und anderen Arthropoden durchdringen bei der Blutmahlzeit die Haut ihres Wirts und durchstoßen dabei die erste Abwehrbarriere gegen Pathogene wie Parasiten und geben diesen damit sofortigen Zugang zu den subepithelialen Bereichen des Wirts. Bei der Blutmahlzeit werden aber nicht nur infektiöse Parasiten übertragen sondern auch Saliva-Proteine der Arthropoden. Dementsprechend riefen anscheinend mit dem Biss der Milbe übertragene SalivaProteine Immunreaktionen in der Haut von sowohl CCL17+/- als auch CCL17-/- Mäusen hervor, die die Migration von L3 Larven durch die Haut möglicherweise vereinfachen könnten. Es hat sich in vielen Fällen gezeigt, dass Arthropoden als Vektoren nicht einfach nur Überträger von Parasiten sind, sondern Saliva-Proteine der Arthropoden auch verschiedene Immunreaktionen hervorrufen und umfangreiche Effekte auf die Transmission der Parasiten haben können. Mit Mücken natürlich übertragene Plasmodium berghei Sporozoiten zum Beispiel sind infektiöser als intravenös injizierte Sporozoiten, sodass die Saliva die Transmission der Parasiten zu erleichtern scheint (Vaughan, Scheller et al. 1999). Auch wird die Infektiosität von Leishmania major Parasiten erhöht, wenn sie zusammen mit Extrakten aus der Speicheldrüse der Sandfliegen Phlebotomus papatasi (Belkaid, Kamhawi et al. 1998) oder Lutzomyia longipalpis (Morris, Shoemaker et al. 2001) übertragen werden. Ebenso können Saliva-Proteine der Sandfliege L. longipalpis, welche Überträgerin von Leishmania infantum chagasi-Parasiten in Lateinamerika ist, eine starke Th1-Immunantwort induzieren und eine starke zelluläre Immunität in Hunden hervorrufen (Collin, Gomes et al. 2009). Es wird zudem angenommen, dass mit der Einbeziehung von Saliva-Proteinen bei einer anti-Leishmania-Vakzine Voraussetzungen für eine protektive Immunantwort gegen Leishmanien geschaffen werden könnten, indem anti-Saliva Immunreaktionen mit dem Biss infizierter Fliegen induziert werden (Morris, Shoemaker et al. 2001; Collin, Gomes et al. 2009). Über vergleichbare Eigenschaften von Milbensaliva ist bisher aber nichts bekannt. Die vorliegenden Ergebnisse zeigen jedoch einen deutlichen Einfluss von Saliva-Proteinen der Milbe O. bacoti auf die Expression des Lymphendothel-spezifischen Markers LYVE-1, des Adherens-Junctions VE-Cadherin sowie des Lymphangiogenese-fördernden Faktors VEGF-A in der Haut ihres Wirts. Weitere Untersuchungen zum Einfluss der Milbensaliva auf die Infektiosität von Filarien-Larven wären daher interessant. Prinzipiell wäre es möglich, dass Milbensaliva in CCL17-unabhängiger Weise durch eine Induktion von Lymphangiogenese in der Haut L3 Larven die Infektion des Wirts erleichtert. Allerdings wurden in der vorliegenden Arbeit nur Analysen auf mRNA-Ebene vorgenommen, die keinen Aufschluss über die tatsächliche Proteinexpression der untersuchten Marker geben. Anhand immunhistologischer Analysen wären klarere Aussagen über den Einfluss von Saliva-Proteinen der Milbe auf Anzahl, Größe und Proliferation von Lymphendothelien möglich. 4.4 CCL17 besitzt eine antagonistische Wirkung auf die CCL5-abhängige Mastzell-Migration bei Filarieninfektionen Da gezeigt werden konnte, dass 6h nach einer natürlichen Infektion L3 Larven keine Lymphangiogenese in der Haut ihres Wirtes induzieren können, sind Lymphangiogeneseunabhängige Mechanismen, die eine Migration der Larven durch Haut und Lymphgefäße bei einer CCL17-Defizienz erleichtern, wahrscheinlicher. Ein Mechanismus, durch den beispielsweise eine Erweiterung der lymphatischen Gefäße induziert werden könnte, wäre ein Anstieg der vaskulären Permeabilität, der den interstitielle Druck im Gewebe erhöhen könnte, wodurch lymphatische Endothelzellen auseinandergezogen werden (Hong, Shin et al. 2004). So ergaben Messungen der vaskulären Permeabilität in der Haut von CCL17-heterozygoten und -homozygoten Mäusen, dass im Gegensatz zu CCL17+/- Mäusen in der Haut von CCL17-defizienten Mäusen sowohl natürlich infizierte als auch subkutan-injizierte L3 Larven und LsAg eine erhöhte vaskuläre Permeabilität induzieren Diskussion 74 können (Abbildung 13). Auch bei anti-CCL17 behandelten CCL17+/- Mäusen zeigte sich eine Erhöhung der vaskulären Permeabilität an der Inokulationsstelle durch LsAg (Abbildung 13A). Die gemessene optische Dichte bei 620nm war insgesamt relativ gering und variierte zudem etwas zwischen den Experimenten. Dies war sehr wahrscheinlich abhängig von der Größe, dem Geschlecht und dem entsprechenden Gewicht der Mäuse. Variationen innerhalb der Experimente wurden jedoch vermieden, indem möglichst Mäuse gleichen Alters, Geschlechts und Gewichts für das jeweilige Experiment verwendet wurden. Für Schistosoma mansoni-Zerkarien-Extrakt wurde gezeigt, dass es intradermal verabreicht die Eigenschaft besitzt die vaskuläre Permeabilität und die Bildung von Ödemen in der Haut von Mäusen zu erhöhen. Dies wiederum führt zu einer Erhöhung der Infektiosität nachfolgend applizierter S. mansoni Zerkarien (Fallon, Teixeira et al. 1996). Fallon et al. diskutieren dabei, dass von den Zerkarien sezernierte Serin-Proteasen die Migration der Larven durch eine direkte Lyse des Gewebes erleichtern bzw. dass sie dies indirekt durch das Auslösen von inflammatorischen Immunreaktionen induzieren könnten. Der genaue Mechanismus, der zu einer Erhöhung der Infektiösität der Zerkarien führt, konnte allerdings nicht sicher nachgewiesen werden. L. sigmodontis L3 Larven besitzen hingegen grundsätzlich nicht die Möglichkeit, die vaskuläre Permeabilität in der Haut zu erhöhen, da in CCL17+/- Mäusen keine erhöhte Extravasation von Evans Blau ins Gewebe nach LsAg-Injektion im Vergleich zu unbehandelten Mäusen zu detektieren war (Abbildung 13A). Nur die Defizienz von CCL17 ermöglichte eine Erhöhung der Permeabilität der Gefäße in der Haut durch L3 Larven bzw. LsAg (Abbildung 13A-C). Dies weist auf eine supprimierende Wirkung von CCL17 auf Immunmechanismen hin, die eine Erhöhung der vaskulären Permeabilität in der Haut bewirken. Mastzellen befinden sich sehr zahlreich im Bereich der Epithelien von Haut, gastrointestinalem Trakt und den Atmungsorganen, wo sie besonders in direkter Nähe zu Blut-, Lymphgefäßen und Nerven lokalisiert und in der Haut oft eng mit dermalen DCs verknüpft sind (Sueki, Whitaker et al. 1993). Durch ihre strategisch günstige Lage und schnelle Aktivierungsmechanismen können sie binnen kurzem auf Pathogene, insbesondere Parasiten, reagieren (Marshall 2004). Die Rolle von Mastzellen in der Immunabwehr wurde bereits bei verschiedenen Helminthen-Infektionen untersucht. Bei gastrointestinalen Helminthen-Infektionen werden häufig erhöhte Mengen mukosaler Mastzellen im befallenen Gewebe beobachtet, wobei diese Mastozytosen oft Th2abhängig sind (Behnke, Lowe et al. 2003). Im Fall von Heligmosomoides polygyrus- (Morimoto, Whitmire et al. 2004) oder Nippostrongylus brasiliensis-Infektionen (Knight, Wright et al. 2000) scheinen Mastzellen keine entscheidende Rolle bei der Wurmabwehr zu spielen, jedoch werden z.B. für die Abstoßung von Trichinella spiralis Helminthen Mastzellen benötigt (Grencis, Else et al. 1993; Knight, Wright et al. 2000). Auch zeigte sich beim Eindringen von Schistosoma mansoniZerkarien in die Haut, dass Mastzellen lokale inflammatorische Immunreaktionen auslösen, die zur Abwehr der Parasiten führen (Gerken, Vaz et al. 1990). Bei Filarien-Infektionen mit verschiedenen Onchocerca ssp Spezies konnte eine Präsenz von Mastzellen in den äußeren Zellschichten, die die Würmer umgeben, beobachtet werden (Wildenburg, Plenge-Bonig et al. 1997; Wildenburg, Korten et al. 1998). In Onchozerkomen mit Mikrofilarien-produzierenden Weibchen von Patienten mit generalisierter Onchozerkose findet sich eine erhöhte Anzahl an Mastzellen und Eosinophilen, und besonders Onchozerkome mit toten weiblichen Würmern weisen signifikant erhöhte Mengen an Mastzellen im Vergleich zu Knoten mit lebenden Würmern auf (Wildenburg, Korten et al. 1998). Zudem zeigte sich, dass die Hyperreaktivität gegenüber Mikrofilarien in Onchozerkomen von Sowda-Patienten mit einer starken Mastozytose korreliert (Korten, Wildenburg et al. 1998). Somit können Mastzellen mit späten Immunreaktionen gegen Filarien assoziiert werden, ihre genaue Rolle dabei bleibt aber unklar. Die Bedeutung von Mastzellen bei der frühen Immunabwehr von Filarien in der Haut wurde bisher nicht untersucht. Interessanterweise konnte in CCL17-defizienten Mäusen 6h nach natürlicher Infektion mit L. sigmodontis, dem gleichen Zeitpunkt, zu dem bereits eine Expression von CCL17 in CCL17+/- Mäusen detektiert werden konnte, eine signifikant erhöhte Anzahl von Mastzellen in der Haut beobachtet werden (Abbildung 15A, D). Dabei spielte es keinen Unterschied, ob es sich um CCL17-Knockout- Diskussion 75 Mäuse handelte oder mit anti-CCL17 behandelte CCL17+/- Mäuse (Abbildung 15A, D). Zudem konnten signifikant mehr degranulierende Mastzellen in CCL17-defizienten Mäusen als in CCL17+/- Mäusen gezählt werden (Abbildung 15C, F). Der Biss uninfizierter Milben rief im Vergleich zu naiven Mäusen keine signifikante Erhöhung in der Zahl degranulierender Mastzellen in der Haut 6h nach Infektion hervor (Abbildung 15C, F). Auch konnte nur ein geringfügiger Anstieg in der Gesamtzahl der Mastzellen in der Haut beobachtet werden (Abbildung 15A, D). Bei anderen Arthropoden wie der Anopheles-Mücke zeigte sich, dass die Bisse der Mücke zur Degranulation dermaler Mastzellen führen. Die Aktivierung der Mastzellen resultiert dabei in eine lokale Extravasation von Flüssigkeit ins Gewebe und in eine Rekrutierung von Neutrophilen zur Stelle des Moskitobisses (Demeure, Brahimi et al. 2005). Die Saliva der Milbe hingegen scheint aber weder eine erhöhte Akkumulation von MCs in die Haut zu fördern noch eine erhöhte Degranulation der MCs auszulösen. Eine besondere Rolle der Milbensaliva bei der Aktivierung von MCs kann somit ausgeschlossen werden. Mastzellen sind in der Lage verschiedene Chemokin-Rezeptoren zu exprimieren, darunter CCR4, und selbst Chemokine wie CCL17 nach einer Stimulation zu produzieren (Oliveira and Lukacs 2001; Juremalm, Olsson et al. 2002). CCL5 kann chemotaktisch sowohl auf aktivierte als auch auf nichtaktivierte Mastzellen wirken (Taub, Dastych et al. 1995), wobei CCL5 eine Migration von Mastzellen induzieren kann, indem es an den Chemokin-Rezeptor CCR4 bindet (Juremalm, Olsson et al. 2002). Wie bereits diskutiert, konnte 6h nach Infektion mit L. sigmodontis sowohl in CCL17-defizienten als auch heterozygoten Mäusen eine erhöhte Expression von CCL5 festgestellt werden (Abbildung 10B). Somit besteht die Möglichkeit zu einer CCL5-abhängigen Migration von Mastzellen in die Haut nach Infektion mit L. sigmodontis L3 Larven. Die erhöhte Akkumulation von Mastzellen in der Haut CCL17-defizienter Mäuse lässt eine inhibitorische Eigenschaft von CCL17 auf die Mastzell-Migration vermuten. Es ist bekannt, dass neben ihrer Funktion als natürliche Agonisten manche Chemokine auch die Eigenschaft haben als natürliche Antagonisten zu agieren, wobei sie Rezeptoren binden ohne eine Aktivierung des Rezeptors und damit verbundene Signaltransduktionswege auszulösen. Eine solche antagonistische Eigenschaft für CCL17 konnte in vitro mit humanen Nabelschnur-Mastzellen gezeigt werden: CCL17 wirkte antagonistisch auf den CCR4-Rezeptor und konnte dadurch eine CCL5-induzierte Mastzell-Migration verhindern (Juremalm, Olsson et al. 2005). Gleichzeitig konnten bei einer Überproduktion von CCL17 in der Epidermis CCL17-transgener Mäuse weniger Mastzellen, Neutrophile und Lymphozyten in der Haut bei akuter Kontakthypersensitivität (CHS) nach einer einzelnen Behandlung von Oxazolone beobachtet werden im Vergleich zu Kontrollmäusen (Tsunemi, Saeki et al. 2006). Erst bei chronischer CHS durch mehrfache Behandlung mit Oxazolone akkumulierten vermehrt Mastzellen, Lymphozyten und Neutrophile in der Dermis CCL17-transgener Mäuse. Dies lässt vermuten, dass CCL17 die Eigenschaft besitzt, eine CCL5-induzierte Migration von Mastzellen in die Haut nach Infektion mit L. sigmodontis L3 Larven zu unterbinden. Fehlt hingegen CCL17 im Organismus, kann es zu einer verstärkten Migration und Akkumulation von Mastzellen in der Haut durch eine chemotaktische Rekrutierung von CCL5 kommen, wie wahrscheinlich bei CCL17defizienten Mäusen nach Infektion mit L3 Larven von L. sigmodontis beobachtet werden konnte (Abbildung 15). Durch Transwell-Experimente mit Mastzellen und CCL5 als chemotaktisches Molekül oder durch die Applikation von CCL5 in die Haut von CCL17+/- und CCL17-/- Mäusen und anschließenden histologischen Untersuchungen der Mastzellen in der Haut ließe sich dies beispielsweise überprüfen. Der Befund, dass CCR4-defiziente Mäuse keine erhöhte Wurmlast entwickeln (Abbildung 7), lässt sich, wenn auch mit Mäusen auf einem anderen genetischen Hintergrund durchgeführt, nun zusätzlich damit erklären, dass in diesen Mäusen keine CCL5abhängige Mastzellmigration über die Interaktion mit CCR4 stattfinden kann und damit verbundene Immunmechanismen nicht induziert werden, die eine erhöhte Etablierung von Larven erlauben. Dieser fehlende Mechanismus in CCR4-/- Mäusen wäre somit vergleichbar mit Wildtyp-Mäusen, bei denen CCL17 eine CCL5-abhängige Mastzellmigration über Blockierung von CCR4 auf den MCs supprimieren kann. Diskussion 76 Dass CCL17 durch eine antagonistische Wirkung eine CCL5-induzierte Mastzellmigration supprimieren kann, lässt die Frage aufkommen, welche Beziehung und mögliche Redundanz zwischen CCL17 und CCL22 bestehen, die beide Liganden des Chemokin-Rezeptors CCR4 sind und ihn aktivieren können. Durch Untersuchungen der Expression von CCL22 in BMDC-Kulturen nach Stimulation mit LsAg (1,28ng/ml ±0,18ng/ml in CCL17+/- Mäusen vs. 1,47ng/ml ±0,19ng/ml in CCL17-/Mäusen) anhand von ELISA-Messungen konnte festgestellt werden, dass CCL22 auch in CCL17-/Mäusen induziert und normal exprimiert wird. Damit kann eine Beeinträchtigung des nahe gelegenen ccl22 Gens durch die genetische Manipulation von ccl17 in den Mäusen ausgeschlossen werden. Somit wäre CCL22 generell in der Lage die Defizienz von CCL17 zu kompensieren. Zwar wurde in dieser Arbeit nicht untersucht, ob eine Defizienz von CCL22 ebenfalls zu einer verstärkten Mastzellmigration führt, doch zeigte Juremalm et al. auch für CCL22 in vitro, dass es als Antagonist für CCR4 agieren und eine CCL5-induzierte Mastzell-Migration verhindern kann (Juremalm, Olsson et al. 2005). Diese Möglichkeit spielt aber sehr wahrscheinlich keine Rolle für die Larvenmigration, da CCL22 verglichen mit CCL17 mit höherer Affinität den D6 Decoy-Rezeptor bindet, der von Endothelzellen affarenter lympahtischer Gefäße in der Haut hoch exprimiert wird (Nibbs, Kriehuber et al. 2001), und so CCL22 sehr schnell von D6+ Zellen aufgenommen und degradiert wird (Bonecchi, Locati et al. 2004). Zudem ist CCL22 anfällig für die Spaltung durch die Dipeptidyl-Peptidase IV (CD26). Die Spaltung resultiert in ein inaktiviertes CCL22-Protein, das nicht mehr mit CCR4 interagieren kann (Bonecchi, Locati et al. 2004). Diese Unterschiede könnten erklären, warum CCL22 die Defizienz von CCL17 in vivo nicht völlig kompensieren kann. In den durchgeführten Experimenten konnte eine gewisse Variation in der Mastzellanzahl in sowohl CCL17-heterozygoten als auch CCL17-homozygoten Knockout-Mäusen nach Infektion mit L3 Larven beobachtet werden (Abbildung 15, Abbildung 16, Abbildung 20, Abbildung 21). Das Verhältnis der Gesamtanzahl der MCs blieb dabei aber zwischen den Gruppen gleich mit durchschnittlich 1,4fach mehr Mastzellen in CCL17-/- Mäusen. In den jeweiligen Experimenten war die GesamtMastzellzahl stets signifikant in infizierten CCL17-/- Mäusen im Vergleich zu infizierten CCL17+/erhöht. Der prozentuale Anteil der Mastzellen, die degranuliert waren, war zudem stets höher in CCL17-defizienten Mäusen (durchschnittlich 10% aller MCs in CCL17-/- Mäusen gegenüber durchschnittlich 6% bei CCL17+/- Mäusen). Die Anzahl degranulierender MCs war dabei im jeweiligen Experiment signifikant erhöht in CCL17-/- Mäusen im Vergleich zu CCL17+/- Mäusen 6h nach der Infektion mit L3 Larven. Im Vergleich zu induzierten Mastzellzahlen bei murinen Modellen für Atopische Dermatitis oder Kontakt-Hypersensitivität kann die erhöhte Akkumulation der Mastzellen in der Haut um das 1,4-fache in CCL17-defizienten Mäusen 6h nach Infektion mit L. sigmodontis oder der prozentuale Anteil degranulierender MCs i.d.R. nicht als sehr groß bezeichnet werden (Van Loveren, Kraeuter-Kops et al. 1984; Shimada, Hasegawa et al. 2003; Yamaguchi, Nakamura et al. 2008; Lehto, Savinko et al. 2010). Allerdings werden in diesen Modellen Mäuse meist für mehrere Tage bis Wochen sensibilisiert, bevor die Mastzellen in der Haut analysiert werden, während in dieser Arbeit bereits 6h nach Infektion die Zahl der MCs vermessen wurde. Es ist durchaus möglich, dass zu späteren Zeitpunkten noch mehr MCs in der Haut CCL17-defizienter Mäuse akkumuliert und degranuliert wären. 4.5 Es besteht ein direkter Zusammenhang zwischen Mastzelldegranulation, vaskulärer Permeabilität, Histamin-Freisetzung und Parasitenlast Mastzellen können über verschiedene Rezeptoren aktiviert und zur Degranulation gebracht werden. CCL5 wirkt zwar chemotaktisch auf Mastzellen, indem sie zu CCL5 migrieren, sie degranulieren durch CCL5 aber nicht (Taub, Dastych et al. 1995). Dennoch konnte eine erhöhte Anzahl degranulierender Mastzellen bei CCL17-Defizienz 6h nach Infektion mit L. sigmodontis Diskussion 77 beobachtet werden (Abbildung 15C, F). Bei der Degranulation von Mastzellen können vasodilatorische Substanzen in das umliegende Gewebe entlassen werden, die die vaskuläre Permeabilität des Endothels erhöhen. Tatsächlich konnte, wie bereits diskutiert, in CCL17-defizienten Mäusen 6h nach einer natürlichen Infektion von L3 Larven, aber auch nach einer subkutanen Injektion von L3 Larven oder LsAg, eine erhöhte vaskuläre Permeabilität in der Haut an der Inokulationsstelle detektiert werden (Abbildung 13). Wurden hingegen CCL17-defiziente Mäuse mit der Chemikalie di-Natriumcromoglykat (Cromolyn) behandelt, wurde die vaskuläre Permeabilität der Gefäße nach Injektion von L3 Larven nicht erhöht im Vergleich zu unbehandelten CCL17-/- Mäusen und blieb auf Level von CCL17+/- Mäusen (Abbildung 16D). Cromolyn inhibiert die Degranulation von Mastzellen, indem es wahrscheinlich durch eine Phosphorylierung zu einer Konformationsänderung von Moesin führt, welches in die Regulierung funktionaler Zusammenhänge zwischen Zelloberfläche und Zytoskelett von Mastzellen involviert ist (Theoharides, Wang et al. 2000). Cromolyn gilt gemeinhin als Mastzell-Stabilisator und wurde in dieser Arbeit verwendet, um die Degranulation der Mastzellen zu unterbinden. Die Versuche zeigten, dass durch eine Stabilisierung der Mastzellen sowohl die vaskuläre Permeabilität als auch die Parasitämie revertiert werden konnten (Abbildung 16C-E). Dies zeigt einen direkten Zusammenhang zwischen der Degranulation von Mastzellen, der vaskulären Permeabilität der Gefäße in der Haut und der Etablierung von L. sigmodontis in der Thoraxhöhle auf. Dieser Effekt ist vermutlich durch eine geringere Ausschüttung vasodilatorischer Mediatoren zu erklären, so dass sich weniger Larven in der Pleura-Höhle etablieren können. Histamin ist eines der wichtigsten Moleküle, die in vorgefertigten Granula von Mastzellen in gespeicherter Form vorliegen und auf eine Aktivierung hin ausgeschüttet werden. Histamin ist ein vasoaktives Amin, dass neben anderen Eigenschaften zu einer erhöhten vaskulären Permeabilität der benachbarten Gefäße und zu einer erleichterten Einwanderung inflammatorischer Zellen und Mediatoren in das Gewebe führen kann (Marshall 2004; Kambayashi, Larosa et al. 2009). Zur Bestätigung der Hypothese, dass eines der von Mastzellen gespeicherten Moleküle, in diesem Fall Histamin, hauptverantwortlich für die oben beschriebenen Effekte ist, wurde in folgenden in vivo Experimenten die Wirkung von Histamin durch die Gabe von Histamin-Rezeptor-Antagonisten blockiert. Hierzu wurden Antagonisten gegen die Histamin-Rezeptoren (HR) 1 und 2 verwendet, da diese auf dem größten Teil der für Filarieninfektionen immunologisch relevanten Zellen exprimiert werden. HR3 hingegen findet sich fast ausschließlich auf Zellen des Zentralennervensystems, während der erst kürzlich entdeckte HR4 auf Mastzellen, Eosinophilen, Basophilen, DCs und T-Zellen exprimiert wird. Über die biologische Funktionen dieses Rezeptors ist erst wenig bekannt, wahrscheinlich sind chemotaktische Eigenschaften (Dy and Schneider 2004). Die Blockierung der am häufigsten exprimierten Histamin-Rezeptoren 1 und 2 mit Antagonisten haben sich als wirkungsvolle Werkzeuge für Studien über die Wirkung von Histamin erwiesen. Die Blockade der HistaminRezeptoren bei der natürlichen Infektion von CCL17-defizienten Mäusen zeigt, dass Histamin einen starken Einfluss auf die Etablierung von Larven in der Pleura-Höhle hat (Abbildung 19B). Die Experimente sprechen somit dafür, dass das von Mastzellen produzierte Histamin eine verbesserte Migration der Larven induziert. Wahrscheinlich ist, dass durch die vasodilatorischen Eigenschaften des Histamins eine erhöhte Permeabilität der Blutgefäße hervorgerufen wird. Dies ermöglicht vermutlich die Etablierung einer größeren Menge von L3 Larven in den Mäusen: Der durch die erhöhte vaskuläre Permeabilität erzeugte interstitielle Druck im Gewebe könnte zu einer Erweiterung des Lumens der lymphatischen Gefäße in der Haut führen, wodurch wiederum den Larven das Eindringen in die lymphatischen Gefäße und die Migration durch diese erleichtert wird, so dass mehr Larven den Immunreaktionen in der Haut entkommen können. Beobachtungen bei der Auswanderung der Larven aus der Haut (Abbildung 9) stützen diese These. Es ist bekannt, dass bei der Erhöhung der vaskulären Permeabilität der Blutgefäße durch Histamin durch das Öffnen der Adherens- und Tight-Junctions interzelluläre Lücken zwischen den Blutendothelzellen entstehen, die einen Austritt von Flüssigkeit, Zellen und anderen Stoffen ins umliegende Gewebe erlauben. Dies wiederum führt zu einem Anstieg Diskussion 78 des interstitiellen Drucks in der Haut (Hong, Shin et al. 2004). Lymphatische Endothelzellen besitzen Fibrillin-haltige Ankerfilamente, welche die basolaterale Plasmamembran der Zellen mit der benachbarten extrazellulären Matrix verbinden (Leak and Burke 1968; Pepper 2006). Wenn sich nun der interstitielle Druck im Gewebe durch die erhöhte vaskuläre Permeabilität der Blutgefäße erhöht, werden Kollagenfasern und andere Komponenten der extrazellulären Matrix beiseitegeschoben. Dies zieht wiederum an den Ankerfilamenten der lymphatischen Endothelzellen, so dass Verbindungen zwischen den Zellen geöffnet werden (Pepper 2006) und sich das Lumen der lymphatischen Gefäße erweitert. Lymphatische Flüssigkeit kann dann entlang eines Druckgradienten durch die entstandenen Öffnungen zwischen den einzelnen Endothelzellen ins Lumen fließen (Hong, Shin et al. 2004). Zudem könnte Histamin auch einen direkten Einfluss auf Zellverbindungen zwischen Lymphendothelien haben und zu ihrer Öffnung führen, so dass eine Bildung von interzellulären Lücken im Lymphendothel unterstützt würde. L3 Larven könnten die Erweiterung des Lumens der lymphatischen Gefäße nutzen, um in die Lymphgefäße leichter einzudringen und durch sie hindurch zu migrieren. Lymphgefäße in der Haut von Mäusen sind grundsätzlich breiter als Blutgefäße (Tripp, Haid et al. 2008) und allein deshalb besser zur Migration geeignet. Untersuchungen der Architektur der lymphatischen Gefäße in der Haut am Körper von Mäusen hat zudem gezeigt, dass sich die Lymphgefäße nicht seitlich ausdehnen wie es in der Haut der Ohren der Fall ist, sondern die homogen verteilten Lymphgefäße tauchen vertikal in tiefere Schichten der Dermis ab, wo sie miteinander verbunden sind und ein horizontales Netzwerk bilden (Tripp, Haid et al. 2008). Diese vertikale Ausrichtung der Lymphgefäße aus der Haut kann den in die Haut eindringenden L3 Larven zugutekommen, da sie über die Migration dieser Gefäße zielgerichtet aus der Haut auswandern können, um den örtlichen Immunabwehrmechanismen zu entkommen. Subepidermale Enden von lymphatischen Gefäßen in der Körperhaut bilden offen endende Tunnel (Tripp, Haid et al. 2008), durch die die Larven initial in die Lymphgefäße eindringen könnten, was durch eine Erweiterung des Lumens wesentlich erleichtert werden könnte. Dieses mögliche Szenario könnte bei CCL17defizienten Mäusen zu einer höheren Wurmlast führen, da die L3 Larven durch den Vorteil der erleichterten Auswanderung aus der Haut den frühen Immunreaktionen in der Haut entkommen können. Allerdings liegen dafür keine stichhaltigen Beweise in dieser Studie vor und müsste weiter untersucht werden. Jedoch kann zusammengefasst werden, dass die Expression von CCL17 durch dendritische Zellen durch die Inhibition einer CCL5-abhängigen Mastzellakkumulation und Mastzelldegranulation zu einer Aufrechterhaltung des normalen interstitiellen Drucks durch normale vaskuläre Permeabilität in der Haut zu führen scheint und damit eine erleichtere Migration der Filarien durch die Haut unterbunden wird. Histamin wird aber nicht ausschließlich von Mastzellen produziert, sondern auch von Basophilen und einigen anderen Zelltypen. Doch nur Mastzellen und Basophile sind in der Lage, Histamin in spezifischen Granula zu speichern. In dieser Form gespeichert kann Histamin in großen Mengen durch Degranulation der Zellen freigesetzt werden. Auch für andere Zellen wie Thrombozyten, Makrophagen, DCs und T-Zellen wurde kürzlich gezeigt, dass sie Histamin exprimieren aber nicht speichern können, so dass das neu-synthetisierte Histamin sogleich sekretiert wird. Die Synthese findet aber auf einem 100- bis 1000-fach niedrigeren Level als bei Mastzellen und Basophilen statt (Dy and Schneider 2004). Während Mastzellen in großer Zahl in peripheren Geweben im Bereich der Epithelien vorkommen, finden sich Basophile nur in sehr geringer Zahl im Blutkreislauf (<1% peripherer Blutleukozyten) (Mukai, Obata et al. 2009). Mastzellen und Basophile werden als wichtige Effektorzellen in IgE-assoziierten allergischen Reaktionen angesehen, doch die genaue physiologische Funktion von Basophilen blieb bisher unklar. Sie scheinen eine Rolle bei Filarien-Infektionen als wichtige Quelle für IL-4 zu spielen (Mitre, Taylor et al. 2004). Auch wurde von Mitre et al. gezeigt, dass Basophile aus dem Blut von Filarien-infizierten Patienten nach Stimulierung mit Filarien-Antigen spezifisch Histamin freisetzen können, nicht aber Basophile von uninfizierten Individuen. FilarienAntigen kann damit nur bei Präsenz von Ag-spezifischen IgE über eine Quervernetzung des FcεRI eine Freisetzung von Histamin bei Basophilen induzieren. Auch wenn Basophile eine mögliche Quelle für Histamin darstellen, ist es jedoch unwahrscheinlich, dass sie einen großen Einfluss bei der CCL17abhängigen Immunabwehr von Filarien haben. Denn Basophile befinden sich hauptsächlich im Blut, Diskussion 79 können zwar ins Gewebe einwandern, wie für allergische Reaktionen gezeigt wurde (Mukai, Obata et al. 2009), doch scheinen sie nur durch eine FcεRI-gekoppelte Aktivierung über Filarien-spezifisches IgE auf Filarien-Antigen zu reagieren und Histamin freizusetzen zu können (Mitre, Taylor et al. 2004). Der Mechanismus, über den Mastzellen aktiviert werden und der die Ausschüttung von Histamin induziert, müsste noch geklärt werden, wobei nachfolgende Untersuchungen zur Rolle von Wolbachia und des TLR2 mögliche Hinweise darauf geben. Ein weiterer Faktor, der von Mastzellen produziert werden kann, ist Vascular endothelial growth factor-A (VEGF-A). VEGF-A ist einer der Hauptmediatoren für die Angiogenese von Blutendothel, ist an der Lymphangiogenese beteiligt und kann über die Bindung an entsprechende Rezeptoren die vaskuläre Permeabilität des Blutendothels erhöhen. Während nach Injektion von L3 Larven oder LsAg ein erhöhter Level an VEGF-A in drainierenden Lymphknoten von CCL17-defizienten Mäusen nachgewiesen werden konnte (Abbildung 17A, B), löste die natürliche Infektion mit L3 Larven im Vergleich zur Infektion mit uninfizierten Milben keine Induktion von VEGF-A in der Haut aus (Abbildung 17C). Dabei kann nicht sicher davon ausgegangen werden, dass im Bereich der untersuchten Lymphknoten Milben gebissen haben. So könnte eventuell durch eine lokale natürliche Infektion eine dem Injektionsmodell-ähnelnden Bild gezeigt werden. Bei der lymphatischen Filariose hat sich gezeigt, dass erhöhte Level an VEGF-A mit der Entwicklung von Hydrozelen assoziiert werden können (Debrah, Mand et al. 2007). Entsprechend scheinen auch L3 Larven von L. sigmodontis eine erhöhte Expression von VEGF-A in CCL17-/- Mäusen auszulösen (Abbildung 17A, B), die auch eine erhöhte vaskuläre Permeabilität der Gefäße zeigen (Abbildung 13). Dennoch scheint VEGF-A keine wichtige Rolle bei der frühen Immunabwehr von Filarien zu spielen, da eine Überexpression von VEGF-A allein nicht zu erhöhten Wurmlasten führen konnte (Abbildung 18A). In der Haut von VEGF-A transgenen Mäusen zeigt sich zwar eine erhöhte Dichte von Blutgefäßen, Lymphgefäße jedoch werden von der Überexpression von VEGF-A nicht beeinflusst (Detmar, Brown et al. 1998). Die in CCL17-/- Mäusen erhöhte Permeabilität der Gefäße scheint somit ein sehr wichtiger Faktor für die Etablierung der Filarien zu sein, aber durch die Überexpression von VEGF-A allein nicht ausreichend ausgelöst zu werden. Zudem konnte eine Depletion von VEGF in CCL17-defizienten Mäusen die vermehrte Etablierung der Larven in den Mäusen nicht verhindern (Abbildung 18C). Daher ist anzunehmen, dass hauptsächlich Histamin zu einer erhöhten vaskulären Permeabilität in CCL17-/Mäusen führt und eine weit größere Rolle dabei als VEGF-A spielt. 4.6 Mastzelldegranulation, vaskuläre Permeabilität und Wurmlast sind abhängig von WolbachiaEndosymbionten und einer TLR2-Aktivierung Neben der bekanntesten physiologischen Aktivierung von Mastzellen, die über die Quervernetzung des hochaffinen IgE-Rezeptors FcεRI stattfindet, können Mastzellen über die Expression bestimmter Toll-like Rezeptoren bakterielle und parasitäre Stimuli erkennen und über diese aktiviert werden. Wie der Großteil der Filarien besitzt L. sigmodontis Endosymbionten der Gattung Wolbachia, die für die Filarien eine wichtige Rolle in der Reproduktion, Entwicklung und Pathogenese spielen (Taylor, Bandi et al. 2005). Wolbachia-Bakterien, wenn auch in geringerer Zahl in infektiösen L3 Larven vorhanden als in adulten Würmern, liefern Antigene, die zu Immunantworten über die Aktivierung des TLR2 führen können (Brattig, Bazzocchi et al. 2004; Hise, Daehnel et al. 2007; Turner, Langley et al. 2009). Interessanterweise degranulierten signifikant weniger Mastzellen in der Haut von CCL17-/Mäusen 6h nach der natürlichen Infektion mit Wolbachia-depletierten L3 Larven als bei natürlich infizierten CCL17-defizienten Mäusen, die mit Wolbachia-haltigen L3 Larven infiziert wurden (Abbildung 20A). Ohne die Anwesenheit von Wolbachia wurde zudem die vaskuläre Permeabilität in der Haut von CCL17-defizienten Mäusen nicht erhöht (Abbildung 20B). Dabei machte der genetische Diskussion 80 Hintergrund der Mäuse keinen Unterschied (Abbildung 20C), wenn auch der Unterschied in der vaskulären Permeabilität in CCL17-/- Mäusen auf BALB/c Hintergrund zwischen der Behandlung mit LsAg mit und ohne Wolbachia nicht ganz so stark wie in CCL17-/- auf C3H/HeN-Hintergrund war (Abbildung 20B, C). Zusammengefasst kann damit eine klare Abhängigkeit in der Aktivierung der Mastzellen und in Konsequenz in der vaskulären Permeabilität von Wolbachia-Antigenen aufgezeigt werden. Die CCL17-abhängigen Immunmechanismen werden daher hauptsächlich durch Antigene des Endosymbionten von L. sigmodontis induziert und weniger durch Wurmantigene selbst. Zudem konnte die Degranulation von Mastzellen in der Haut nach natürlicher Infektion mit L3 Larven durch den gleichzeitigen Knockout von TLR2 und CCL17 signifikant erniedrigt werden im Vergleich zu einzel-defizienten CCL17-/- Mäusen (Abbildung 21A). Zur Depletion von CCL17 in TLR2-/Mäusen wurden diese mit anti-CCL17 Antikörper behandelt, da keine TLR2/CCL17-Doppel-KnockoutMäuse zur Verfügung standen. Dies war möglich, da die Behandlung von CCL17+/- Mäusen mit antiCCL17 Antikörper den gleichen Einfluss auf Parasitämie (Abbildung 4D), Zytokin- und ChemokinExpression (Abbildung 10), vaskuläre Permeabilität (Abbildung 13A) und Mastzellen (Abbildung 15DF) in der Haut zeigte wie bei genetisch CCL17-defizienten Mäusen beobachtet. Anti-CCL17 behandelte CCL17+/- Mäuse waren allerdings in diesem Fall nicht wie unbehandelte CCL17-/- Mäuse signifikant unterschiedlich zu anti-CCL17 behandelten TLR2-/- (Abbildung 21A), was möglicherweise auf das natürliche Infektionsmodell zurück geführt werden kann, da man nicht immer sicher sein kann, dass Milben die betroffene Hautregion der Lumbalzone gleichermaßen gebissen und Larven übertragen haben. Möglicherweise ist die CCL17-abhängige Degranulation der Mastzellen auch nicht gänzlich nur von TLR2-abhängig, da sich die Anzahl degranulierender Mastzellen in anti-CCL17 behandelten TLR2-/- Mäusen nicht auf Level von unbehandelten TLR2-/- Mäusen reduzierte (Abbildung 21A). Die Untersuchung der vaskulären Permeabilität und die Auswertung der Wurmlast nach natürlicher Infektion mit L. sigmodontis zeigten jedoch eine klare TLR2-Abhängigkeit: Die vaskuläre Permeabilität in anti-CCL17 behandelten TLR2-defizienten Mäusen war signifikant reduziert im Vergleich zu anti-CCL17 behandelten CCL17+/- und unbehandelten CCL17-/- Mäusen und befand sich auf Level von TLR2-/- Mäusen und CCL17+/- Mäusen (Abbildung 21B). Ebenfalls konnte eine klare Reduktion in der Wurmlast beobachtet werden (Abbildung 21C). Verschiedene Studien mit murinen Knochenmarks-generierten Zellen oder humanen Nabelschnurblut-Mastzellen konnten eine direkte Aktivierung mit klassischen bakteriellen Stimuli über TLR2 zeigen, die zur Degranulation der Mastzellen führt (Supajatura, Ushio et al. 2002; Marshall, McCurdy et al. 2003; McCurdy, Olynych et al. 2003; Varadaradjalou, Feger et al. 2003). Andere Studien zeigten allerdings auch, dass TLR-Liganden zwar synergistisch die inflammatorische ZytokinProduktion von Mastzellen durch IgE Moleküle via TLR2 oder TLR4 erhöhen können, selbst aber keine Degranulation der Mastzellen induzieren (Takenaka, Ushio et al. 2010). Auch Qiao et al. konnten nur feststellen, dass die Aktivierung über TLR2 zwar eine Produktion von Zytokinen induziert, nicht aber zur Degranulation von Mastzellen führt (Qiao, Andrade et al. 2006), so dass der Mechanismus der Aktivierung via TLR unklar bleibt. Es muss somit noch geklärt werden, ob eine Aktivierung über TLRs zu einer Degranulation von Mastzellen führt. Somit bleibt die Frage offen, ob Wolbachia-Antigene direkt über die Aktivierung von TLR2 zu einer Degranulation der Mastzellen führen, oder ob ein indirekter Mechanismus vorliegt, z.B. eine Aktivierung der Mastzellen über eine Interaktion mit TLR-aktivierten dendritischen Zellen. Beispielsweise konnte durch die Verabreichung von TLR-Liganden in Mäusen eine TLR-abhängige Aktivierung von Mastzellen induziert werden, die zu allergischen Atemwegserkrankungen führt, wobei dabei auch TLR-aktivierte dendritische Zellen eine Rolle zu spielen schienen (Schroder and Maurer 2007). Eine Einzelkultivierung von Mastzellen, generiert aus Knochenmarkszellen von CCL17-/bzw. TLR2/ CCL17-defizienten Mäusen, oder in Kokultur mit dendritischen Zellen und die Stimulierung mit Wolbachia-Antigenen bzw. TLR2-Liganden als Kontrollen könnten darüber Aufschluss geben. Diskussion 81 Es muss zudem geklärt werden, inwieweit Wolbachia-Antigene nach der Übertragung in die Haut freigesetzt und durch welchen Mechanismus Immunantworten in der Haut ausgelöst werden, ob von direkt nach dem Eintritt in die Haut sterbenden L3 Larven oder noch lebenden. Dies könnte teilweise z.B. anhand von Injektionsexperimenten mit lebenden und toten L3 Larven oder WolbachiaAntigenen analysiert werden. Bisher ist die Rolle von Wolbachia in der Immunabwehr kurz nach Eindringen in die Haut kaum untersucht worden. Es ist bekannt, dass erste Immunreaktionen in der Haut 60-70% der eindringenden Larven innerhalb der ersten 2 Tage nach Infektion abgetötet werden (Marechal, Le Goff et al. 1996). Somit werden erste Larven sehr schnell abgetötet, so dass Wolbachia-Antigene ins Gewebe freigesetzt werden, die zu einer Aktivierung von DCs und Mastzellen führen können. Es ist wahrscheinlich, dass diese Freisetzung unabhängig von CCL17 geschieht, dennoch ist der prozentuale Anteil der degranulierenden Mastzellen im Vergleich zur Gesamtzahl in der Haut bei einer CCL17-Depletion um fast das Doppelte größer als in CCL17+/- Mäusen (siehe Diskussion 4.4). Dies lässt vermuten, dass CCL17 selbst einen inhibitorischen Einfluss auf die Aktivierungsmechanismen von MCs besitzt, die zur Degranulation der Zelle führen oder auf Zellen, die indirekt die Degranulation der Mastzellen unterstützen. Zusammenfassung 82 5 Zusammenfassung Die durch Filarien verursachten Erkrankungen Lymphatische Filariose und Onchozerkose stellen weltweit ein ernstes Gesundheitsproblem dar. Die durch Arthropoden übertragenen Parasiten gelangen während der Blutmahlzeit in die Haut ihres Wirts, wo ein Großteil der infektiösen Larven innerhalb von 48h ersten Immunabwehrmechanismen erliegt. Bisher ist nur wenig über die frühen Immunabwehrreaktionen gegen Filarien in der Haut bekannt und insbesondere die Bedeutung von Chemokinen dabei noch nicht erforscht worden. Daher wurde in dieser Arbeit die Rolle des Chemokins Thymus and activation-regulated chemokine (TARC/CCL17) in der frühen Immunabwehr bei Filarien-Infektionen am Beispiel des Nagetiermodells Litomosoides sigmodontis untersucht. Es konnte gezeigt werden, dass Wurmextrakt der Filarie L. sigmodontis in vitro in der Lage war dendritische Zellen zu aktivieren und eine Expression von kostimulatorischen Molekülen sowie proinflammatorischen Zytokinen und Chemokinen wie CCL17 zu induzieren. Natürlich infizierte L3 Larven von L. sigmodontis riefen in vivo bereits 6h nach Infektion eine Expression des Chemokins CCL17 in dendritischen Zellen in der Haut hervor und zeitverzögert auch in den auf ihrem weiteren Migrationsweg zur Thoraxhöhle liegenden peripheren Lymphknoten und der Lunge. In Abwesenheit von CCL17 konnte sich nach einer natürlichen Infektion mit L. sigmodontis eine erhöhte Wurmlast in der Thoraxhöhle von Mäusen etablieren. Es zeigte sich, dass der Einfluss von CCL17 auf CCR4+ Zellen in der Pleura-Höhle 10-30 Tage nach Infektion nur von geringer Bedeutung für die Immunabwehr von Filarien ist. CCL17 schien zudem keinen Einfluss auf die Zytokin-Ausschüttung von Zellen in der Pleura-Höhle zu haben. Zudem zeigte sich, dass sich in CCL17-defizienten Mäusen eine erhöhte Wurmlast unabhängig von CD4+CD25+ T-Zellen und dem anti-inflammatorischen Zytokin IL-10 etabliert. Somit wurde deutlich, dass die entscheidenden CCL17-abhängigen Immunreaktionen, die zu erhöhten Wurmzahlen in CCL17-defizienten Mäusen führen, zu einem früheren Zeitpunkt als der Etablierung der Würmer in der Pleura-Höhle stattfinden müssen. Natürlich infizierte L3 Larven konnten tendenziell besser durch die Haut von CCL17-defizienten Mäusen als von CCL17+/- Mäusen migrieren, doch lösten sie keine Lymphangiogenese in der Haut aus, die zu einer Expansion der Lymphgefäße hätte führen können. Es konnte jedoch in CCL17-defizienten Mäusen eine erhöhte vaskuläre Permeabilität 6h nach der Infektion mit L. sigmodontis beobachtet werden, die wahrscheinlich eine Erweiterung der Lymphgefäße hervorruft und eine erleichterte Migration von Larven durch die Haut ermöglichen kann. Es stellte sich heraus, dass nach einer natürlichen Infektion mit L. sigmodontis mehr Mastzellen in der Haut von CCL17-defizienten Mäusen akkumulierten und degranulierten. Die Stabilisierung der Mastzellen machte deutlich, dass die erhöhte vaskuläre Permeabilität und die Wurmlast bei CCL17-defizienten Mäusen von der Degranulation der Mastzellen abhängig war. Auch zeigte sich, dass die Wurmlast bei CCL17defizienten Mäusen von Histamin abhängig war. Histamin wird offenbar durch die erhöhte Degranulation der Mastzellen in CCL17-defizienten Mäusen in vermehrter Menge freigesetzt und kann durch seine vasodilatorischen Eigenschaften eine erhöhte vaskuläre Permeabilität induzieren, wodurch Larven wahrscheinlich einfacher durch Haut und Lymphgefäße migrieren können. Die Degranulation der Mastzellen und die damit verbundenen Reaktionen waren zudem von WolbachiaEndosymbionten abhängig und wurden auf eine TLR2-abhängige Weise ausgelöst. Zusammengefasst zeigt diese Arbeit, dass durch dendritische Zellen exprimiertes CCL17 in die Regulation der Mastzellakkumulation und -degranulation in der Haut und den damit verbundenen niedrigeren Wurmlasten involviert zu sein scheint. Während der frühen Immunreaktionen gegen eindringende Filarien exprimieren dendritische Zellen nach Stimulation mit Filarien-Antigen CCL17 und inhibieren damit die Mastzell-Degranulation in der Haut in einer TLR2-abhängigen Weise. Die Blockade der Degranulation führt zu einer Aufrechterhaltung der normalen vaskulären Permeabilität und behindert so die Migration der Larven durch die Haut und eine vermehrte Etablierung in der Thoraxhöhle. Summary 83 6 Summary Lymphatic filariasis and onchocerciasis are parasitic helminth diseases caused by filarial nematodes that constitute a serious global health problem. Parasites transmitted during the bloodmeal of arthropods reach the host’s skin, where most of the infective larvae are killed by the host’s immune response mechanisms during the first 48 hours after infection. These early defense mechanisms against filarial parasites are poorly documented. In particular, the role of chemokines has not been addressed. This thesis focuses on the investigation of the role of Thymus and activation-regulated chemokine (TARC/CCL17) in early immune responses against filarial infections using the murine model of filariasis Litomosoides sigmodontis. It has been observed, that filarial extract of L. sigmodontis activates dendritic cells in vitro and induces an upregulation of co-stimulatory molecules and the expression of pro-inflammatory cytokines and chemokines like CCL17. Naturally infected larvae also induced in vivo the expression of CCL17 by dendritic cells in the skin already 6h post infection and time-delayed in peripheral lymph nodes and the lung along their migratory pathway to the pleural cavity. After a natural infection with L. sigmodontis a higher worm load could be established in the pleural cavity of CCL17-deficient mice. It was seen, that the influence of CCL17 on CCR4+ cells in the pleural cavity 10-30 days pi is of minor importance for the immune response against filariae. CCL17 did also not affect the cytokine response of cells in the pleural cavity. Using neutralizing antibodies it was found, that a higher worm burden can be established in CCL17-deficient mice independently of CD4+CD25+ T-cells or of the anti-inflammatory cytokine IL-10. Apparently the critical CCL17dependent immune reactions that lead to increased worm numbers in CCL17-deficient mice have to take place earlier than the establishment of the worms in the pleural cavity. Naturally infected L3 larvae tended to migrate easier through the skin of CCL17-deficient mice compared to CCL17+/- mice but they had not induced lymphangiogenesis in the skin, which would have led to an expansion of the lymphatic vessels. But it could be observed a higher vascular permeability in the skin of CCL17-deficient mice 6h after a natural infection with L. sigmodontis. An increase in the vascular permeability could induce an expansion of the lymphatics leading to a facilitation of the larval migration through the skin. Even more mast cells accumulated in the skin of CCL17-deficient mice after a filarial infection and degranulated to a higher extent. The stabilization of mast cells showed that the observed increased vascular permeability and the higher worm burden in CCL17-deficient mice were dependent on the degranulation of mast cells. It was also shown, that the establishment of a higher worm burden in CCL17-deficient mice was dependent on histamine. Histamine appeared to be released in higher quantities by the increased number of degranulating mast cells in CCL17-deficient mice and induced due to its vasodilatory properties an increase in vascular permeability, which potentially facilitates the larval migration through the lymph vessels and the skin. The degranulation of mast cells and associated reactions were also dependent on Wolbachia endosymbionts and had been induced in a TLR2-dependent manner. In summary, this thesis shows that CCL17 expressed by dendritic cells is involved in the regulation of mast cell accumulation and degranulation in the skin and the associated lower worm burden. During the early immune responses against invading filarial worms dendritic cells express after stimulation with filarial antigen the chemokine CCL17 and thereby inhibit the degranulation of mast cells in the skin in a TLR2-dependent manner. The blockade of the degranulation maintains the normal vascular permeability and inhibits the migration of infective filarial larvae through the skin and an increased establishment in the thoracic cavity. Literaturverzeichnis 84 7 Literaturverzeichnis Abbas, A. K. and Lichtman, A. H. (2004). Basic Immunology - Functions and Disorders of the Immune System. Aderem, A. and Ulevitch, R. J. (2000). "Toll-like receptors in the induction of the innate immune response." Nature 406(6797): 782-787. Akira, S. and Takeda, K. (2004). "Toll-like receptor signalling." Nat Rev Immunol 4(7): 499-511. Akira, S., Takeda, K. and Kaisho, T. (2001). "Toll-like receptors: critical proteins linking innate and acquired immunity." Nat Immunol 2(8): 675-680. Al-Qaoud, K. M., Fleischer, B. and Hoerauf, A. (1998). "The Xid defect imparts susceptibility to experimental murine filariosis--association with a lack of antibody and IL-10 production by B cells in response to phosphorylcholine." Int Immunol 10(1): 17-25. Al-Qaoud, K. M., Pearlman, E., Hartung, T., Klukowski, J., Fleischer, B. and Hoerauf, A. (2000). "A new mechanism for IL-5-dependent helminth control: neutrophil accumulation and neutrophilmediated worm encapsulation in murine filariasis are abolished in the absence of IL-5." Int Immunol 12(6): 899-908. Al-Qaoud, K. M., Taubert, A., Zahner, H., Fleischer, B. and Hoerauf, A. (1997). "Infection of BALB/c mice with the filarial nematode Litomosoides sigmodontis: role of CD4+ T cells in controlling larval development." Infect Immun 65(6): 2457-2461. Alferink, J., Lieberam, I., Reindl, W., Behrens, A., Weiss, S., Huser, N., Gerauer, K., Ross, R., ReskeKunz, A. B., Ahmad-Nejad, P., Wagner, H. and Forster, I. (2003). "Compartmentalized production of CCL17 in vivo: strong inducibility in peripheral dendritic cells contrasts selective absence from the spleen." J Exp Med 197(5): 585-599. Artis, D. and Grencis, R. K. (2008). "The intestinal epithelium: sensors to effectors in nematode infection." Mucosal Immunol 1(4): 252-264. Attout, T., Hoerauf, A., Denece, G., Debrah, A. Y., Marfo-Debrekyei, Y., Boussinesq, M., Wanji, S., Martinez, V., Mand, S., Adjei, O., Bain, O., Specht, S. and Martin, C. (2009). "Lymphatic vascularisation and involvement of Lyve-1+ macrophages in the human onchocerca nodule." PLoS ONE 4(12): e8234. Babayan, S., Ungeheuer, M. N., Martin, C., Attout, T., Belnoue, E., Snounou, G., Renia, L., Korenaga, M. and Bain, O. (2003). "Resistance and susceptibility to filarial infection with Litomosoides sigmodontis are associated with early differences in parasite development and in localized immune reactions." Infect Immun 71(12): 6820-6829. Babayan, S. A., Attout, T., Vuong, P. N., Le Goff, L., Gantier, J. C. and Bain, O. (2005). "The subcutaneous movements of filarial infective larvae are impaired in vaccinated hosts in comparison to primary infected hosts." Filaria J 4: 3. Baluk, P., Fuxe, J., Hashizume, H., Romano, T., Lashnits, E., Butz, S., Vestweber, D., Corada, M., Molendini, C., Dejana, E. and McDonald, D. M. (2007). "Functionally specialized junctions between endothelial cells of lymphatic vessels." J Exp Med 204(10): 2349-2362. Basanez, M. G., Pion, S. D., Churcher, T. S., Breitling, L. P., Little, M. P. and Boussinesq, M. (2006). "River blindness: a success story under threat?" PLoS Med 3(9): e371. Behnke, J. M., Lowe, A., Clifford, S. and Wakelin, D. (2003). "Cellular and serological responses in resistant and susceptible mice exposed to repeated infection with Heligmosomoides polygyrus bakeri." Parasite Immunol 25(6): 333-340. Belkaid, Y., Kamhawi, S., Modi, G., Valenzuela, J., Noben-Trauth, N., Rowton, E., Ribeiro, J. and Sacks, D. L. (1998). "Development of a natural model of cutaneous leishmaniasis: powerful effects of vector saliva and saliva preexposure on the long-term outcome of Leishmania major infection in the mouse ear dermis." J Exp Med 188(10): 1941-1953. Bennuru, S. and Nutman, T. B. (2009). "Lymphangiogenesis and lymphatic remodeling induced by filarial parasites: implications for pathogenesis." PLoS Pathog 5(12): e1000688. Literaturverzeichnis 85 Bernardini, G., Hedrick, J., Sozzani, S., Luini, W., Spinetti, G., Weiss, M., Menon, S., Zlotnik, A., Mantovani, A., Santoni, A. and Napolitano, M. (1998). "Identification of the CC chemokines TARC and macrophage inflammatory protein-1 beta as novel functional ligands for the CCR8 receptor." Eur J Immunol 28(2): 582-588. Boesiger, J., Tsai, M., Maurer, M., Yamaguchi, M., Brown, L. F., Claffey, K. P., Dvorak, H. F. and Galli, S. J. (1998). "Mast cells can secrete vascular permeability factor/ vascular endothelial cell growth factor and exhibit enhanced release after immunoglobulin E-dependent upregulation of fc epsilon receptor I expression." J Exp Med 188(6): 1135-1145. Bonecchi, R., Bianchi, G., Bordignon, P. P., D'Ambrosio, D., Lang, R., Borsatti, A., Sozzani, S., Allavena, P., Gray, P. A., Mantovani, A. and Sinigaglia, F. (1998). "Differential expression of chemokine receptors and chemotactic responsiveness of type 1 T helper cells (Th1s) and Th2s." J Exp Med 187(1): 129-134. Bonecchi, R., Locati, M., Galliera, E., Vulcano, M., Sironi, M., Fra, A. M., Gobbi, M., Vecchi, A., Sozzani, S., Haribabu, B., Van Damme, J. and Mantovani, A. (2004). "Differential recognition and scavenging of native and truncated macrophage-derived chemokine (macrophage-derived chemokine/CC chemokine ligand 22) by the D6 decoy receptor." J Immunol 172(8): 49724976. Borchers, M. T., Ansay, T., DeSalle, R., Daugherty, B. L., Shen, H., Metzger, M., Lee, N. A. and Lee, J. J. (2002). "In vitro assessment of chemokine receptor-ligand interactions mediating mouse eosinophil migration." J Leukoc Biol 71(6): 1033-1041. Brattig, N. W., Bazzocchi, C., Kirschning, C. J., Reiling, N., Buttner, D. W., Ceciliani, F., Geisinger, F., Hochrein, H., Ernst, M., Wagner, H., Bandi, C. and Hoerauf, A. (2004). "The major surface protein of Wolbachia endosymbionts in filarial nematodes elicits immune responses through TLR2 and TLR4." J Immunol 173(1): 437-445. Brattig, N. W., Buttner, D. W. and Hoerauf, A. (2001). "Neutrophil accumulation around Onchocerca worms and chemotaxis of neutrophils are dependent on Wolbachia endobacteria." Microbes Infect 3(6): 439-446. Cacalano, G., Lee, J., Kikly, K., Ryan, A. M., Pitts-Meek, S., Hultgren, B., Wood, W. I. and Moore, M. W. (1994). "Neutrophil and B cell expansion in mice that lack the murine IL-8 receptor homolog." Science 265(5172): 682-684. Campbell, J. J., Haraldsen, G., Pan, J., Rottman, J., Qin, S., Ponath, P., Andrew, D. P., Warnke, R., Ruffing, N., Kassam, N., Wu, L. and Butcher, E. C. (1999). "The chemokine receptor CCR4 in vascular recognition by cutaneous but not intestinal memory T cells." Nature 400(6746): 776780. Campbell, J. J., O'Connell, D. J. and Wurbel, M. A. (2007). "Cutting Edge: Chemokine receptor CCR4 is necessary for antigen-driven cutaneous accumulation of CD4 T cells under physiological conditions." J Immunol 178(6): 3358-3362. Carmeliet, P., Ferreira, V., Breier, G., Pollefeyt, S., Kieckens, L., Gertsenstein, M., Fahrig, M., Vandenhoeck, A., Harpal, K., Eberhardt, C., Declercq, C., Pawling, J., Moons, L., Collen, D., Risau, W. and Nagy, A. (1996). "Abnormal blood vessel development and lethality in embryos lacking a single VEGF allele." Nature 380(6573): 435-439. Cella, M., Engering, A., Pinet, V., Pieters, J. and Lanzavecchia, A. (1997). "Inflammatory stimuli induce accumulation of MHC class II complexes on dendritic cells." Nature 388(6644): 782-787. Cheng, S. S., Lai, J. J., Lukacs, N. W. and Kunkel, S. L. (2001). "Granulocyte-macrophage colony stimulating factor up-regulates CCR1 in human neutrophils." J Immunol 166(2): 1178-1184. Chiu, B. C., Freeman, C. M., Stolberg, V. R., Komuniecki, E., Lincoln, P. M., Kunkel, S. L. and Chensue, S. W. (2003). "Cytokine-chemokine networks in experimental mycobacterial and schistosomal pulmonary granuloma formation." Am J Respir Cell Mol Biol 29(1): 106-116. Chvatchko, Y., Hoogewerf, A. J., Meyer, A., Alouani, S., Juillard, P., Buser, R., Conquet, F., Proudfoot, A. E., Wells, T. N. and Power, C. A. (2000). "A key role for CC chemokine receptor 4 in lipopolysaccharide-induced endotoxic shock." J Exp Med 191(10): 1755-1764. Literaturverzeichnis 86 Collin, N., Gomes, R., Teixeira, C., Cheng, L., Laughinghouse, A., Ward, J. M., Elnaiem, D. E., Fischer, L., Valenzuela, J. G. and Kamhawi, S. (2009). "Sand fly salivary proteins induce strong cellular immunity in a natural reservoir of visceral leishmaniasis with adverse consequences for Leishmania." PLoS Pathog 5(5): e1000441. Cook, G. C. and Zumla, A. I. (2009). Manson's Tropical Dieseases, 22nd Edition, Saunders Elsevier. Debrah, A. Y., Mand, S., Toliat, M. R., Marfo-Debrekyei, Y., Batsa, L., Nurnberg, P., Lawson, B., Adjei, O., Hoerauf, A. and Pfarr, K. (2007). "Plasma vascular endothelial growth Factor-A (VEGF-A) and VEGF-A gene polymorphism are associated with hydrocele development in lymphatic filariasis." Am J Trop Med Hyg 77(4): 601-608. Dejana, E., Orsenigo, F. and Lampugnani, M. G. (2008). "The role of adherens junctions and VEcadherin in the control of vascular permeability." J Cell Sci 121(Pt 13): 2115-2122. Delves, P. J. and Roitt, I. M. (2000). "The immune system. Second of two parts." N Engl J Med 343(2): 108-117. Demeure, C. E., Brahimi, K., Hacini, F., Marchand, F., Peronet, R., Huerre, M., St-Mezard, P., Nicolas, J. F., Brey, P., Delespesse, G. and Mecheri, S. (2005). "Anopheles mosquito bites activate cutaneous mast cells leading to a local inflammatory response and lymph node hyperplasia." J Immunol 174(7): 3932-3940. Detmar, M., Brown, L. F., Schon, M. P., Elicker, B. M., Velasco, P., Richard, L., Fukumura, D., Monsky, W., Claffey, K. P. and Jain, R. K. (1998). "Increased microvascular density and enhanced leukocyte rolling and adhesion in the skin of VEGF transgenic mice." J Invest Dermatol 111(1): 1-6. Dreyer, G., Medeiros, Z., Netto, M. J., Leal, N. C., de Castro, L. G. and Piessens, W. F. (1999). "Acute attacks in the extremities of persons living in an area endemic for bancroftian filariasis: differentiation of two syndromes." Trans R Soc Trop Med Hyg 93(4): 413-417. Dreyer, G., Noroes, J. and Addiss, D. (1997). "The silent burden of sexual disability associated with lymphatic filariasis." Acta Trop 63(1): 57-60. Dy, M. and Schneider, E. (2004). "Histamine-cytokine connection in immunity and hematopoiesis." Cytokine Growth Factor Rev 15(5): 393-410. Espitia, C. M., Zhao, W., Saldarriaga, O., Osorio, Y., Harrison, L. M., Cappello, M., Travi, B. L. and Melby, P. C. (2010). "Duplex real-time reverse transcriptase PCR to determine cytokine mRNA expression in a hamster model of New World cutaneous leishmaniasis." BMC Immunol 11: 31. Fallon, P. G., Teixeira, M. M., Neice, C. M., Williams, T. J., Hellewell, P. G. and Doenhoff, M. J. (1996). "Enhancement of Schistosoma mansoni infectivity by intradermal injections of larval extracts: a putative role for larval proteases." J Infect Dis 173(6): 1460-1466. Fendt, J., Hamm, D. M., Banla, M., Schulz-Key, H., Wolf, H., Helling-Giese, G., Heuschkel, C. and Soboslay, P. T. (2005). "Chemokines in onchocerciasis patients after a single dose of ivermectin." Clin Exp Immunol 142(2): 318-326. Ferrara, N., Carver-Moore, K., Chen, H., Dowd, M., Lu, L., O'Shea, K. S., Powell-Braxton, L., Hillan, K. J. and Moore, M. W. (1996). "Heterozygous embryonic lethality induced by targeted inactivation of the VEGF gene." Nature 380(6573): 439-442. Garlisi, C. G., Xiao, H., Tian, F., Hedrick, J. A., Billah, M. M., Egan, R. W. and Umland, S. P. (1999). "The assignment of chemokine-chemokine receptor pairs: TARC and MIP-1 beta are not ligands for human CC-chemokine receptor 8." Eur J Immunol 29(10): 3210-3215. Gerken, S. E., Vaz, N. M. and Mota-Santos, T. A. (1990). "Local anaphylactic reactions to the penetration of cercariae of Schistosoma mansoni." Braz J Med Biol Res 23(3-4): 275-281. Glik, A. and Douvdevani, A. (2006). "T lymphocytes: the "cellular" arm of acquired immunity in the peritoneum." Perit Dial Int 26(4): 438-448. Gombert, M., Dieu-Nosjean, M. C., Winterberg, F., Bunemann, E., Kubitza, R. C., Da Cunha, L., Haahtela, A., Lehtimaki, S., Muller, A., Rieker, J., Meller, S., Pivarcsi, A., Koreck, A., Fridman, W. H., Zentgraf, H. W., Pavenstadt, H., Amara, A., Caux, C., Kemeny, L., Alenius, H., Lauerma, A., Ruzicka, T., Zlotnik, A. and Homey, B. (2005). "CCL1-CCR8 interactions: an axis mediating Literaturverzeichnis 87 the recruitment of T cells and Langerhans-type dendritic cells to sites of atopic skin inflammation." J Immunol 174(8): 5082-5091. Gomez-Escobar, N., Gregory, W. F. and Maizels, R. M. (2000). "Identification of tgh-2, a filarial nematode homolog of Caenorhabditis elegans daf-7 and human transforming growth factor beta, expressed in microfilarial and adult stages of Brugia malayi." Infect Immun 68(11): 6402-6410. Gorski, K. S., Shin, T., Crafton, E., Otsuji, M., Rattis, F. M., Huang, X., Kelleher, E., Francisco, L., Pardoll, D. and Tsuchiya, H. (2003). "A set of genes selectively expressed in murine dendritic cells: utility of related cis-acting sequences for lentiviral gene transfer." Mol Immunol 40(1): 35-47. Gottar, M., Gobert, V., Michel, T., Belvin, M., Duyk, G., Hoffmann, J. A., Ferrandon, D. and Royet, J. (2002). "The Drosophila immune response against Gram-negative bacteria is mediated by a peptidoglycan recognition protein." Nature 416(6881): 640-644. Grencis, R. K., Else, K. J., Huntley, J. F. and Nishikawa, S. I. (1993). "The in vivo role of stem cell factor (c-kit ligand) on mastocytosis and host protective immunity to the intestinal nematode Trichinella spiralis in mice." Parasite Immunol 15(1): 55-59. Grouard, G., Rissoan, M. C., Filgueira, L., Durand, I., Banchereau, J. and Liu, Y. J. (1997). "The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40ligand." J Exp Med 185(6): 1101-1111. Guerrant, R. L., Walker, D. H. and Weller, P. F. (in Vorbereitung). Tropical Infectious Diseases: Principles, Pathogens and Practice 3rd edition. Halin, C., Tobler, N. E., Vigl, B., Brown, L. F. and Detmar, M. (2007). "VEGF-A produced by chronically inflamed tissue induces lymphangiogenesis in draining lymph nodes." Blood 110(9): 31583167. Harnett, W. and Harnett, M. M. (2006). "Molecular basis of worm-induced immunomodulation." Parasite Immunol 28(10): 535-543. Henz, B. M., Maurer, M., Lippert, U., Worm, M. and Babina, M. (2001). "Mast cells as initiators of immunity and host defense." Exp Dermatol 10(1): 1-10. Hirata, H., Arima, M., Cheng, G., Honda, K., Fukushima, F., Yoshida, N., Eda, F. and Fukuda, T. (2003). "Production of TARC and MDC by naive T cells in asthmatic patients." J Clin Immunol 23(1): 34-45. Hise, A. G., Daehnel, K., Gillette-Ferguson, I., Cho, E., McGarry, H. F., Taylor, M. J., Golenbock, D. T., Fitzgerald, K. A., Kazura, J. W. and Pearlman, E. (2007). "Innate immune responses to endosymbiotic Wolbachia bacteria in Brugia malayi and Onchocerca volvulus are dependent on TLR2, TLR6, MyD88, and Mal, but not TLR4, TRIF, or TRAM." J Immunol 178(2): 1068-1076. Hoerauf, A. and Brattig, N. (2002). "Resistance and susceptibility in human onchocerciasis--beyond Th1 vs. Th2." Trends Parasitol 18(1): 25-31. Hoerauf, A., Satoguina, J., Saeftel, M. and Specht, S. (2005). "Immunomodulation by filarial nematodes." Parasite Immunol 27(10-11): 417-429. Hoffmann, W., Petit, G., Schulz-Key, H., Taylor, D., Bain, O. and Le Goff, L. (2000). "Litomosoides sigmodontis in mice: reappraisal of an old model for filarial research." Parasitol Today 16(9): 387-389. Hoffmann, W. H., Pfaff, A. W., Schulz-Key, H. and Soboslay, P. T. (2001). "Determinants for resistance and susceptibility to microfilaraemia in Litomosoides sigmodontis filariasis." Parasitology 122(Pt 6): 641-649. Hong, Y. K., Shin, J. W. and Detmar, M. (2004). "Development of the lymphatic vascular system: a mystery unravels." Dev Dyn 231(3): 462-473. Horauf, A. and Fleischer, B. (1997). "Immune responses to filarial infection in laboratory mice." Med Microbiol Immunol 185(4): 207-215. Iellem, A., Mariani, M., Lang, R., Recalde, H., Panina-Bordignon, P., Sinigaglia, F. and D'Ambrosio, D. (2001). "Unique chemotactic response profile and specific expression of chemokine receptors CCR4 and CCR8 by CD4(+)CD25(+) regulatory T cells." J Exp Med 194(6): 847-853. Literaturverzeichnis 88 Imai, T., Baba, M., Nishimura, M., Kakizaki, M., Takagi, S. and Yoshie, O. (1997). "The T cell-directed CC chemokine TARC is a highly specific biological ligand for CC chemokine receptor 4." J Biol Chem 272(23): 15036-15042. Imai, T., Nagira, M., Takagi, S., Kakizaki, M., Nishimura, M., Wang, J., Gray, P. W., Matsushima, K. and Yoshie, O. (1999). "Selective recruitment of CCR4-bearing Th2 cells toward antigenpresenting cells by the CC chemokines thymus and activation-regulated chemokine and macrophage-derived chemokine." Int Immunol 11(1): 81-88. Imai, T., Yoshida, T., Baba, M., Nishimura, M., Kakizaki, M. and Yoshie, O. (1996). "Molecular cloning of a novel T cell-directed CC chemokine expressed in thymus by signal sequence trap using Epstein-Barr virus vector." J Biol Chem 271(35): 21514-21521. Inngjerdingen, M., Damaj, B. and Maghazachi, A. A. (2000). "Human NK cells express CC chemokine receptors 4 and 8 and respond to thymus and activation-regulated chemokine, macrophagederived chemokine, and I-309." J Immunol 164(8): 4048-4054. Jahnz-Rozyk, K., Targowski, T., Paluchowska, E., Owczarek, W. and Kucharczyk, A. (2005). "Serum thymus and activation-regulated chemokine, macrophage-derived chemokine and eotaxin as markers of severity of atopic dermatitis." Allergy 60(5): 685-688. Janeway, C. A., Jr. (1989). "Approaching the asymptote? Evolution and revolution in immunology." Cold Spring Harb Symp Quant Biol 54 Pt 1: 1-13. Janeway, C. A., Jr., P. Travers, M. Walport and M. J. Shlomchik, Ed. (2005). Immunobiology; the immune system in health and disease, Churchill Livingstone. Johansson, C., Ahlstedt, I., Furubacka, S., Johnsson, E., Agace, W. W. and Quiding-Jarbrink, M. (2005). "Differential expression of chemokine receptors on human IgA+ and IgG+ B cells." Clin Exp Immunol 141(2): 279-287. Jordan, M. S., Boesteanu, A., Reed, A. J., Petrone, A. L., Holenbeck, A. E., Lerman, M. A., Naji, A. and Caton, A. J. (2001). "Thymic selection of CD4+CD25+ regulatory T cells induced by an agonist self-peptide." Nat Immunol 2(4): 301-306. Juremalm, M., Olsson, N. and Nilsson, G. (2002). "Selective CCL5/RANTES-induced mast cell migration through interactions with chemokine receptors CCR1 and CCR4." Biochem Biophys Res Commun 297(3): 480-485. Juremalm, M., Olsson, N. and Nilsson, G. (2005). "CCL17 and CCL22 attenuate CCL5-induced mast cell migration." Clin Exp Allergy 35(6): 708-712. Kambayashi, T., Larosa, D. F., Silverman, M. A. and Koretzky, G. A. (2009). "Cooperation of adapter molecules in proximal signaling cascades during allergic inflammation." Immunol Rev 232(1): 99-114. Kapsenberg, M. L. (2003). "Dendritic-cell control of pathogen-driven T-cell polarization." Nat Rev Immunol 3(12): 984-993. Katakura, T., Miyazaki, M., Kobayashi, M., Herndon, D. N. and Suzuki, F. (2004). "CCL17 and IL-10 as effectors that enable alternatively activated macrophages to inhibit the generation of classically activated macrophages." J Immunol 172(3): 1407-1413. Knight, P. A., Wright, S. H., Lawrence, C. E., Paterson, Y. Y. and Miller, H. R. (2000). "Delayed expulsion of the nematode Trichinella spiralis in mice lacking the mucosal mast cell-specific granule chymase, mouse mast cell protease-1." J Exp Med 192(12): 1849-1856. Korten, S., Volkmann, L., Saeftel, M., Fischer, K., Taniguchi, M., Fleischer, B. and Hoerauf, A. (2002). "Expansion of NK cells with reduction of their inhibitory Ly-49A, Ly-49C, and Ly-49G2 receptor-expressing subsets in a murine helminth infection: contribution to parasite control." J Immunol 168(10): 5199-5206. Korten, S., Wildenburg, G., Darge, K. and Buttner, D. W. (1998). "Mast cells in onchocercomas from patients with hyperreactive onchocerciasis (sowda)." Acta Trop 70(2): 217-231. Kumkate, S., Jenkins, G. R., Paveley, R. A., Hogg, K. G. and Mountford, A. P. (2007). "CD207+ Langerhans cells constitute a minor population of skin-derived antigen-presenting cells in the draining lymph node following exposure to Schistosoma mansoni." Int J Parasitol 37(2): 209220. Literaturverzeichnis 89 Kurt-Jones, E. A., Mandell, L., Whitney, C., Padgett, A., Gosselin, K., Newburger, P. E. and Finberg, R. W. (2002). "Role of toll-like receptor 2 (TLR2) in neutrophil activation: GM-CSF enhances TLR2 expression and TLR2-mediated interleukin 8 responses in neutrophils." Blood 100(5): 1860-1868. Lawrence, R. A. (1996). "Lymphatic filariasis: what mice can tell us." Parasitol Today 12(7): 267-271. Le Goff, L., Lamb, T. J., Graham, A. L., Harcus, Y. and Allen, J. E. (2002). "IL-4 is required to prevent filarial nematode development in resistant but not susceptible strains of mice." Int J Parasitol 32(10): 1277-1284. Le Goff, L., Loke, P., Ali, H. F., Taylor, D. W. and Allen, J. E. (2000). "Interleukin-5 is essential for vaccine-mediated immunity but not innate resistance to a filarial parasite." Infect Immun 68(5): 2513-2517. Leak, L. V. and Burke, J. F. (1968). "Ultrastructural studies on the lymphatic anchoring filaments." J Cell Biol 36(1): 129-149. Lehto, M., Savinko, T., Wolff, H., Kvist, P. H., Kemp, K., Lauerma, A. and Alenius, H. (2010). "A murine model of epicutaneous protein sensitization is useful to study efficacies of topical drugs in atopic dermatitis." Int Immunopharmacol 10(4): 377-384. Leung, T. F., Wong, C. K., Lam, C. W., Li, A. M., Ip, W. K., Wong, G. W. and Fok, T. F. (2003). "Plasma TARC concentration may be a useful marker for asthmatic exacerbation in children." Eur Respir J 21(4): 616-620. Liu, L. Y., Bates, M. E., Jarjour, N. N., Busse, W. W., Bertics, P. J. and Kelly, E. A. (2007). "Generation of Th1 and Th2 chemokines by human eosinophils: evidence for a critical role of TNF-alpha." J Immunol 179(7): 4840-4848. Liu, Y. J. (2005). "IPC: professional type 1 interferon-producing cells and plasmacytoid dendritic cell precursors." Annu Rev Immunol 23: 275-306. Maizels, R. M., Gomez-Escobar, N., Gregory, W. F., Murray, J. and Zang, X. (2001). "Immune evasion genes from filarial nematodes." Int J Parasitol 31(9): 889-898. Marechal, P., Le Goff, L., Hoffman, W., Rapp, J., Oswald, I. P., Ombrouck, C., Taylor, D. W., Bain, O. and Petit, G. (1997). "Immune response to the filaria Litomosoides sigmodontis in susceptible and resistant mice." Parasite Immunol 19(6): 273-279. Marechal, P., Le Goff, L., Petit, G., Diagne, M., Taylor, D. W. and Bain, O. (1996). "The fate of the filaria Litomosoides sigmodontis in susceptible and naturally resistant mice." Parasite 3(1): 25-31. Marshall, J. S. (2004). "Mast-cell responses to pathogens." Nat Rev Immunol 4(10): 787-799. Marshall, J. S., McCurdy, J. D. and Olynych, T. (2003). "Toll-like receptor-mediated activation of mast cells: implications for allergic disease?" Int Arch Allergy Immunol 132(2): 87-97. Martin, C., Le Goff, L., Ungeheuer, M. N., Vuong, P. N. and Bain, O. (2000). "Drastic reduction of a filarial infection in eosinophilic interleukin-5 transgenic mice." Infect Immun 68(6): 36513656. Martin, C., Saeftel, M., Vuong, P. N., Babayan, S., Fischer, K., Bain, O. and Hoerauf, A. (2001). "B-cell deficiency suppresses vaccine-induced protection against murine filariasis but does not increase the recovery rate for primary infection." Infect Immun 69(11): 7067-7073. Maynard, C. L., Harrington, L. E., Janowski, K. M., Oliver, J. R., Zindl, C. L., Rudensky, A. Y. and Weaver, C. T. (2007). "Regulatory T cells expressing interleukin 10 develop from Foxp3+ and Foxp3precursor cells in the absence of interleukin 10." Nat Immunol 8(9): 931-941. McCurdy, J. D., Olynych, T. J., Maher, L. H. and Marshall, J. S. (2003). "Cutting edge: distinct Toll-like receptor 2 activators selectively induce different classes of mediator production from human mast cells." J Immunol 170(4): 1625-1629. McLaren, D. J., Worms, M. J., Laurence, B. R. and Simpson, M. G. (1975). "Micro-organisms in filarial larvae (Nematoda)." Trans R Soc Trop Med Hyg 69(5-6): 509-514. Medzhitov, R. and Janeway, C., Jr. (2000). "The Toll receptor family and microbial recognition." Trends Microbiol 8(10): 452-456. Literaturverzeichnis 90 Medzhitov, R. and Janeway, C. A., Jr. (1997). "Innate immunity: impact on the adaptive immune response." Curr Opin Immunol 9(1): 4-9. Melrose, W. D. (2002). "Lymphatic filariasis: new insights into an old disease." Int J Parasitol 32(8): 947-960. Meylan, E., Tschopp, J. and Karin, M. (2006). "Intracellular pattern recognition receptors in the host response." Nature 442(7098): 39-44. Mitre, E., Chien, D. and Nutman, T. B. (2008). "CD4(+) (and not CD25+) T cells are the predominant interleukin-10-producing cells in the circulation of filaria-infected patients." J Infect Dis 197(1): 94-101. Mitre, E., Taylor, R. T., Kubofcik, J. and Nutman, T. B. (2004). "Parasite antigen-driven basophils are a major source of IL-4 in human filarial infections." J Immunol 172(4): 2439-2445. Morimoto, M., Whitmire, J., Xiao, S., Anthony, R. M., Mirakami, H., Star, R. A., Urban, J. F., Jr. and Gause, W. C. (2004). "Peripheral CD4 T cells rapidly accumulate at the host: parasite interface during an inflammatory Th2 memory response." J Immunol 172(4): 2424-2430. Morris, R. V., Shoemaker, C. B., David, J. R., Lanzaro, G. C. and Titus, R. G. (2001). "Sandfly maxadilan exacerbates infection with Leishmania major and vaccinating against it protects against L. major infection." J Immunol 167(9): 5226-5230. Mukai, K., Obata, K., Tsujimura, Y. and Karasuyama, H. (2009). "New insights into the roles for basophils in acute and chronic allergy." Allergol Int 58(1): 11-19. Nagasawa, T., Hirota, S., Tachibana, K., Takakura, N., Nishikawa, S., Kitamura, Y., Yoshida, N., Kikutani, H. and Kishimoto, T. (1996). "Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1." Nature 382(6592): 635-638. Nibbs, R. J., Kriehuber, E., Ponath, P. D., Parent, D., Qin, S., Campbell, J. D., Henderson, A., Kerjaschki, D., Maurer, D., Graham, G. J. and Rot, A. (2001). "The beta-chemokine receptor D6 is expressed by lymphatic endothelium and a subset of vascular tumors." Am J Pathol 158(3): 867-877. O'Garra, A., Vieira, P. L., Vieira, P. and Goldfeld, A. E. (2004). "IL-10-producing and naturally occurring CD4+ Tregs: limiting collateral damage." J Clin Invest 114(10): 1372-1378. Oliveira, S. H. and Lukacs, N. W. (2001). "Stem cell factor and igE-stimulated murine mast cells produce chemokines (CCL2, CCL17, CCL22) and express chemokine receptors." Inflamm Res 50(3): 168-174. Oo, Y. H., Shetty, S. and Adams, D. H. (2010). "The role of chemokines in the recruitment of lymphocytes to the liver." Dig Dis 28(1): 31-44. Ottesen, E. A. (1992). "The Wellcome Trust Lecture. Infection and disease in lymphatic filariasis: an immunological perspective." Parasitology 104 Suppl: S71-79. Pepper, M. S. (2006). The lymphatic system. Microvascular Research, Elsevier Academic Press. 1: 523528. Perona-Wright, G., Jenkins, S. J. and MacDonald, A. S. (2006). "Dendritic cell activation and function in response to Schistosoma mansoni." Int J Parasitol 36(6): 711-721. Petit, G., Diagne, M., Marechal, P., Owen, D., Taylor, D. and Bain, O. (1992). "Maturation of the filaria Litomosoides sigmodontis in BALB/c mice; comparative susceptibility of nine other inbred strains." Ann Parasitol Hum Comp 67(5): 144-150. Pfarr, K. M., Debrah, A. Y., Specht, S. and Hoerauf, A. (2009). "Filariasis and lymphoedema." Parasite Immunol 31(11): 664-672. Qiao, H., Andrade, M. V., Lisboa, F. A., Morgan, K. and Beaven, M. A. (2006). "FcepsilonR1 and tolllike receptors mediate synergistic signals to markedly augment production of inflammatory cytokines in murine mast cells." Blood 107(2): 610-618. Rajan, T. V., Nelson, F. K., Killeen, N., Shultz, L. D., Yates, J. A., Bailis, J. M., Littman, D. R. and Greiner, D. L. (1994). "CD4+ T-lymphocytes are not required for murine resistance to the human filarial parasite, Brugia malayi." Exp Parasitol 78(4): 352-360. Rajan, T. V., Nelson, F. K., Shultz, L. D., Koller, B. H. and Greiner, D. L. (1992). "CD8+ T lymphocytes are not required for murine resistance to human filarial parasites." J Parasitol 78(4): 744-746. Literaturverzeichnis 91 Romagnani, S. (2002). "Cytokines and chemoattractants in allergic inflammation." Mol Immunol 38(12-13): 881-885. Romani, N., Holzmann, S., Tripp, C. H., Koch, F. and Stoitzner, P. (2003). "Langerhans cells - dendritic cells of the epidermis." APMIS 111(7-8): 725-740. Roncarolo, M. G., Gregori, S., Battaglia, M., Bacchetta, R., Fleischhauer, K. and Levings, M. K. (2006). "Interleukin-10-secreting type 1 regulatory T cells in rodents and humans." Immunol Rev 212: 28-50. Saeftel, M., Arndt, M., Specht, S., Volkmann, L. and Hoerauf, A. (2003). "Synergism of gamma interferon and interleukin-5 in the control of murine filariasis." Infect Immun 71(12): 69786985. Saeftel, M., Volkmann, L., Korten, S., Brattig, N., Al-Qaoud, K., Fleischer, B. and Hoerauf, A. (2001). "Lack of interferon-gamma confers impaired neutrophil granulocyte function and imparts prolonged survival of adult filarial worms in murine filariasis." Microbes Infect 3(3): 203-213. Sakaguchi, S., Ono, M., Setoguchi, R., Yagi, H., Hori, S., Fehervari, Z., Shimizu, J., Takahashi, T. and Nomura, T. (2006). "Foxp3+ CD25+ CD4+ natural regulatory T cells in dominant self-tolerance and autoimmune disease." Immunol Rev 212: 8-27. Schall, T. J., Bacon, K., Toy, K. J. and Goeddel, D. V. (1990). "Selective attraction of monocytes and T lymphocytes of the memory phenotype by cytokine RANTES." Nature 347(6294): 669-671. Schroder, N. W. and Maurer, M. (2007). "The role of innate immunity in asthma: leads and lessons from mouse models." Allergy 62(6): 579-590. Seder, R. A., Gazzinelli, R., Sher, A. and Paul, W. E. (1993). "Interleukin 12 acts directly on CD4+ T cells to enhance priming for interferon gamma production and diminishes interleukin 4 inhibition of such priming." Proc Natl Acad Sci U S A 90(21): 10188-10192. Sekiya, T., Miyamasu, M., Imanishi, M., Yamada, H., Nakajima, T., Yamaguchi, M., Fujisawa, T., Pawankar, R., Sano, Y., Ohta, K., Ishii, A., Morita, Y., Yamamoto, K., Matsushima, K., Yoshie, O. and Hirai, K. (2000). "Inducible expression of a Th2-type CC chemokine thymus- and activation-regulated chemokine by human bronchial epithelial cells." J Immunol 165(4): 2205-2213. Sekiya, T., Yamada, H., Yamaguchi, M., Yamamoto, K., Ishii, A., Yoshie, O., Sano, Y., Morita, A., Matsushima, K. and Hirai, K. (2002). "Increased levels of a TH2-type CC chemokine thymus and activation-regulated chemokine (TARC) in serum and induced sputum of asthmatics." Allergy 57(2): 173-177. Semmling, V., Lukacs-Kornek, V., Thaiss, C. A., Quast, T., Hochheiser, K., Panzer, U., Rossjohn, J., Perlmutter, P., Cao, J., Godfrey, D. I., Savage, P. B., Knolle, P. A., Kolanus, W., Forster, I. and Kurts, C. (2010). "Alternative cross-priming through CCL17-CCR4-mediated attraction of CTLs toward NKT cell-licensed DCs." Nat Immunol 11(4): 313-320. Semnani, R. T., Law, M., Kubofcik, J. and Nutman, T. B. (2004). "Filaria-induced immune evasion: suppression by the infective stage of Brugia malayi at the earliest host-parasite interface." J Immunol 172(10): 6229-6238. Semnani, R. T., Liu, A. Y., Sabzevari, H., Kubofcik, J., Zhou, J., Gilden, J. K. and Nutman, T. B. (2003). "Brugia malayi microfilariae induce cell death in human dendritic cells, inhibit their ability to make IL-12 and IL-10, and reduce their capacity to activate CD4+ T cells." J Immunol 171(4): 1950-1960. Shimada, Y., Hasegawa, M., Kaburagi, Y., Hamaguchi, Y., Komura, K., Saito, E., Takehara, K., Steeber, D. A., Tedder, T. F. and Sato, S. (2003). "L-selectin or ICAM-1 deficiency reduces an immediate-type hypersensitivity response by preventing mast cell recruitment in repeated elicitation of contact hypersensitivity." J Immunol 170(8): 4325-4334. Shortman, K. and Liu, Y. J. (2002). "Mouse and human dendritic cell subtypes." Nat Rev Immunol 2(3): 151-161. Shortman, K. and Naik, S. H. (2007). "Steady-state and inflammatory dendritic-cell development." Nat Rev Immunol 7(1): 19-30. Literaturverzeichnis 92 Specht, S., Saeftel, M., Arndt, M., Endl, E., Dubben, B., Lee, N. A., Lee, J. J. and Hoerauf, A. (2006). "Lack of eosinophil peroxidase or major basic protein impairs defense against murine filarial infection." Infect Immun 74(9): 5236-5243. Specht, S., Volkmann, L., Wynn, T. and Hoerauf, A. (2004). "Interleukin-10 (IL-10) counterregulates IL4-dependent effector mechanisms in Murine Filariasis." Infect Immun 72(11): 6287-6293. Stepek, G., Auchie, M., Tate, R., Watson, K., Russell, D. G., Devaney, E. and Harnett, W. (2002). "Expression of the filarial nematode phosphorylcholine-containing glycoprotein, ES62, is stage specific." Parasitology 125(Pt 2): 155-164. Stone, K. D., Prussin, C. and Metcalfe, D. D. (2010). "IgE, mast cells, basophils, and eosinophils." J Allergy Clin Immunol 125(2 Suppl 2): S73-80. Sueki, H., Whitaker, D., Buchsbaum, M. and Murphy, G. F. (1993). "Novel interactions between dermal dendrocytes and mast cells in human skin. Implications for hemostasis and matrix repair." Lab Invest 69(2): 160-172. Supajatura, V., Ushio, H., Nakao, A., Akira, S., Okumura, K., Ra, C. and Ogawa, H. (2002). "Differential responses of mast cell Toll-like receptors 2 and 4 in allergy and innate immunity." J Clin Invest 109(10): 1351-1359. Swain, S. L., Weinberg, A. D., English, M. and Huston, G. (1990). "IL-4 directs the development of Th2like helper effectors." J Immunol 145(11): 3796-3806. Takenaka, H., Ushio, H., Niyonsaba, F., Jayawardana, S. T., Hajime, S., Ikeda, S., Ogawa, H. and Okumura, K. (2010). "Synergistic augmentation of inflammatory cytokine productions from murine mast cells by monomeric IgE and toll-like receptor ligands." Biochem Biophys Res Commun 391(1): 471-476. Taub, D., Dastych, J., Inamura, N., Upton, J., Kelvin, D., Metcalfe, D. and Oppenheim, J. (1995). "Bone marrow-derived murine mast cells migrate, but do not degranulate, in response to chemokines." J Immunol 154(5): 2393-2402. Taylor, M. D., LeGoff, L., Harris, A., Malone, E., Allen, J. E. and Maizels, R. M. (2005). "Removal of regulatory T cell activity reverses hyporesponsiveness and leads to filarial parasite clearance in vivo." J Immunol 174(8): 4924-4933. Taylor, M. D., van der Werf, N., Harris, A., Graham, A. L., Bain, O., Allen, J. E. and Maizels, R. M. (2009). "Early recruitment of natural CD4+ Foxp3+ Treg cells by infective larvae determines the outcome of filarial infection." Eur J Immunol 39(1): 192-206. Taylor, M. J., Bandi, C. and Hoerauf, A. (2005). "Wolbachia bacterial endosymbionts of filarial nematodes." Adv Parasitol 60: 245-284. Taylor, M. J. and Hoerauf, A. (1999). "Wolbachia bacteria of filarial nematodes." Parasitol Today 15(11): 437-442. Taylor, M. J., Hoerauf, A. and Bockarie, M. (2010). "Lymphatic filariasis and onchocerciasis." Lancet 376(9747): 1175-1185. Theoharides, T. C., Wang, L., Pang, X., Letourneau, R., Culm, K. E., Basu, S., Wang, Y. and Correia, I. (2000). "Cloning and cellular localization of the rat mast cell 78-kDa protein phosphorylated in response to the mast cell "stabilizer" cromolyn." J Pharmacol Exp Ther 294(3): 810-821. Thylefors, B. and Alleman, M. (2006). "Towards the elimination of onchocerciasis." Ann Trop Med Parasitol 100(8): 733-746. Tripp, C. H., Haid, B., Flacher, V., Sixt, M., Peter, H., Farkas, J., Gschwentner, R., Sorokin, L., Romani, N. and Stoitzner, P. (2008). "The lymph vessel network in mouse skin visualised with antibodies against the hyaluronan receptor LYVE-1." Immunobiology 213(9-10): 715-728. Tsunemi, Y., Saeki, H., Nakamura, K., Nagakubo, D., Nakayama, T., Yoshie, O., Kagami, S., Shimazu, K., Kadono, T., Sugaya, M., Komine, M., Matsushima, K. and Tamaki, K. (2006). "CCL17 transgenic mice show an enhanced Th2-type response to both allergic and non-allergic stimuli." Eur J Immunol 36(8): 2116-2127. Turner, J. D., Langley, R. S., Johnston, K. L., Gentil, K., Ford, L., Wu, B., Graham, M., Sharpley, F., Slatko, B., Pearlman, E. and Taylor, M. J. (2009). "Wolbachia lipoprotein stimulates innate Literaturverzeichnis 93 and adaptive immunity through Toll-like receptors 2 and 6 to induce disease manifestations of filariasis." J Biol Chem 284(33): 22364-22378. Van Loveren, H., Kraeuter-Kops, S. and Askenase, P. W. (1984). "Different mechanisms of release of vasoactive amines by mast cells occur in T cell-dependent compared to IgE-dependent cutaneous hypersensitivity responses." Eur J Immunol 14(1): 40-47. Varadaradjalou, S., Feger, F., Thieblemont, N., Hamouda, N. B., Pleau, J. M., Dy, M. and Arock, M. (2003). "Toll-like receptor 2 (TLR2) and TLR4 differentially activate human mast cells." Eur J Immunol 33(4): 899-906. Vaughan, J. A., Scheller, L. F., Wirtz, R. A. and Azad, A. F. (1999). "Infectivity of Plasmodium berghei sporozoites delivered by intravenous inoculation versus mosquito bite: implications for sporozoite vaccine trials." Infect Immun 67(8): 4285-4289. Vestergaard, C., Yoneyama, H., Murai, M., Nakamura, K., Tamaki, K., Terashima, Y., Imai, T., Yoshie, O., Irimura, T., Mizutani, H. and Matsushima, K. (1999). "Overproduction of Th2-specific chemokines in NC/Nga mice exhibiting atopic dermatitis-like lesions." J Clin Invest 104(8): 1097-1105. Vickery, A. C., Vincent, A. L. and Sodeman, W. A., Jr. (1983). "Effect of immune reconstitution on resistance to Brugia pahangi in congenitally athymic nude mice." J Parasitol 69(3): 478-485. Volkmann, L., Bain, O., Saeftel, M., Specht, S., Fischer, K., Brombacher, F., Matthaei, K. I. and Hoerauf, A. (2003). "Murine filariasis: interleukin 4 and interleukin 5 lead to containment of different worm developmental stages." Med Microbiol Immunol 192(1): 23-31. Volkmann, L., Saeftel, M., Bain, O., Fischer, K., Fleischer, B. and Hoerauf, A. (2001). "Interleukin-4 is essential for the control of microfilariae in murine infection with the filaria Litomosoides sigmodontis." Infect Immun 69(5): 2950-2956. Vremec, D., Pooley, J., Hochrein, H., Wu, L. and Shortman, K. (2000). "CD4 and CD8 expression by dendritic cell subtypes in mouse thymus and spleen." J Immunol 164(6): 2978-2986. Weil, G. J., Ramzy, R. M., Chandrashekar, R., Gad, A. M., Lowrie, R. C., Jr. and Faris, R. (1996). "Parasite antigenemia without microfilaremia in bancroftian filariasis." Am J Trop Med Hyg 55(3): 333-337. Wenk, P. (1967). "[The invasion route of the metacyclical larvae of Litomosoides carinii Chandler 1931 (Filariidae)]." Z Parasitenkd 28(3): 240-263. Wenzel, J., Henze, S., Worenkamper, E., Basner-Tschakarjan, E., Sokolowska-Wojdylo, M., Steitz, J., Bieber, T. and Tuting, T. (2005). "Role of the chemokine receptor CCR4 and its ligand thymusand activation-regulated chemokine/CCL17 for lymphocyte recruitment in cutaneous lupus erythematosus." J Invest Dermatol 124(6): 1241-1248. WHO (1997). "Lymphatic filariasis: reasons for hope. Geneva." WHO. (2000). "Lymphatic filariasis, Fact sheet N°102." from http://www.who.int/mediacentre/factsheets/fs102/en/print.html. Wiethe, C., Debus, A., Mohrs, M., Steinkasserer, A., Lutz, M. and Gessner, A. (2008). "Dendritic cell differentiation state and their interaction with NKT cells determine Th1/Th2 differentiation in the murine model of Leishmania major infection." J Immunol 180(7): 4371-4381. Wildenburg, G., Korten, S. and Buttner, D. W. (1998). "Mast cell distribution in nodules of Onchocerca volvulus from untreated patients with generalized onchocerciasis." Parasitology 116 ( Pt 3): 257-268. Wildenburg, G., Plenge-Bonig, A., Renz, A., Fischer, P. and Buttner, D. W. (1997). "Distribution of mast cells and their correlation with inflammatory cells around Onchocerca gutturosa, O. tarsicola, O. ochengi, and O. flexuosa." Parasitol Res 83(2): 109-120. Xiao, T., Fujita, H., Saeki, H., Mitsui, H., Sugaya, M., Tada, Y., Kakinuma, T., Torii, H., Nakamura, K., Asahina, A. and Tamaki, K. (2003). "Thymus and activation-regulated chemokine (TARC/CCL17) produced by mouse epidermal Langerhans cells is upregulated by TNF-alpha and IL-4 and downregulated by IFN-gamma." Cytokine 23(4-5): 126-132. Xie, H., Bain, O. and Williams, S. A. (1994). "Molecular phylogenetic studies on filarial parasites based on 5S ribosomal spacer sequences." Parasite 1(2): 141-151. Literaturverzeichnis 94 Yamaguchi, J., Nakamura, F., Aihara, M., Yamashita, N., Usui, H., Hida, T., Takei, K., Nagashima, Y., Ikezawa, Z. and Goshima, Y. (2008). "Semaphorin3A alleviates skin lesions and scratching behavior in NC/Nga mice, an atopic dermatitis model." J Invest Dermatol 128(12): 28422849. Yousefi, S., Cooper, P. R., Potter, S. L., Mueck, B. and Jarai, G. (2001). "Cloning and expression analysis of a novel G-protein-coupled receptor selectively expressed on granulocytes." J Leukoc Biol 69(6): 1045-1052. Yu, B., Koga, T., Urabe, K., Moroi, Y., Maeda, S., Yanagihara, Y. and Furue, M. (2002). "Differential regulation of thymus- and activation-regulated chemokine induced by IL-4, IL-13, TNF-alpha and IFN-gamma in human keratinocyte and fibroblast." J Dermatol Sci 30(1): 29-36. Yung, R., Mo, R., Grolleau-Julius, A. and Hoeltzel, M. (2007). "The effect of aging and caloric restriction on murine CD8+ T cell chemokine receptor gene expression." Immun Ageing 4: 8. Zlotnik, A. and Yoshie, O. (2000). "Chemokines: a new classification system and their role in immunity." Immunity 12(2): 121-127. Abbildungsverzeichnis 95 Abbildungsverzeichnis Abbildung 1: Abbildung 2: Abbildung 3: Abbildung 4: Abbildung 5: Abbildung 6: Abbildung 7: Abbildung 8: Abbildung 9: Abbildung 10: Abbildung 11: Abbildung 12: Abbildung 13: Abbildung 14: Abbildung 15: Abbildung 16: Abbildung 17: Abbildung 18: Abbildung 19: Abbildung 20: Abbildung 21: Lebenszyklus von Litomosoides sigmodontis .............................................................. 16 BMDCs werden durch Stimulation mit LsAg aktiviert und exprimieren CCL17........... 37 Natürliche Infektion mit L. sigmodontis führt zur Expression von CCL17 in Haut, Lymphknoten und Lunge in CCL17+/- Reportermäusen. .............................................. 38 Erhöhte Parasitenlast bei CCL17-/- Mäusen und anti-CCL17 behandelten CCL17+/Mäusen im Vergleich zu unbehandelten CCL17+/- und Wildtyp-Mäusen nach natürlicher Infektion mit L. sigmodontis. .................................................................... 40 Leicht erhöhte Anzahl eosinophiler Granulozyten in CCL17-defizienten Mäusen 10, 20 und 30 Tage nach natürlicher Infektion. ................................................................ 42 Die Etablierung einer erhöhte Parasitenlast bei CCL17-Defizienz ist unabhängig von CD25+ Zellen. ............................................................................................................... 43 CCR4-Defizienz führt in Mäusen zu keiner erhöhten Wurmlast 10dpi. ...................... 44 IL-10-unabhängige Etablierung einer erhöhten Parasitenlast bei CCL17-Defizienz. ... 46 Vermehrte Auswanderung von L3 Larven aus der Haut von CCL17-defizienten Mäusen. ....................................................................................................................... 48 Erhöhte mRNA Expression von IL-12p35 und CCL5 in der Haut 6h nach natürlicher Infektion. ..................................................................................................................... 49 CCL17-Defizienz hat keinen Einfluss auf Lymphangiogenese-Faktoren bei Neugeborenen. ............................................................................................................ 50 Erhöhte mRNA-Expression von LYVE-1,VE-Cadherin und VEGF-A nach natürlicher Infektion. ..................................................................................................................... 51 Erhöhte vaskuläre Permeabilität bei CCL17-Defizienz nach natürlicher Infektion von L3 Larven und Injektion von LsAg oder L3 Larven. ...................................................... 53 Nicht-degranulierende und degranulierende Mastzellen. .......................................... 54 Erhöhte Anzahl nicht-degranulierender und degranulierender Mastzellen bei CCL17-Defizienz nach Infektion mit L. sigmodontis. ................................................... 55 Mastzell-Stabilisierung durch Cromolyn revertiert vaskuläre Permeabilität und Wurmlast ..................................................................................................................... 57 Erhöhte VEGF-A Level in Lymphknoten CCL17-defizienter Mäuse nach Injektion von LsAg und L3-Larven nicht aber nach natürlicher Infektion von L3 Larven. .......... 58 Kein Einfluss von VEGF-A auf die Parasitenlast nach Infektion mit L. sigmodontis. ... 60 Behandlung mit Histamin-Rezeptor-Antagonisten in vivo reduziert Etablierung von L. sigmodontis in der Pleura-Kavität von CCL17-/- Mäusen. .................................. 61 Mastzelldegranulation und vaskuläre Permeabilität sind Wolbachia-abhängig. ........ 62 Mastzelldegranulation, vaskuläre Permeabilität und Wurmlast nach Infektion mit L. sigmodontis sind TLR2-abhängig. ............................................................................ 64 Tabellenverzeichnis 96 Tabellenverzeichnis Tabelle 1: Tabelle 2: Tabelle 3: Tabelle 4: Akkumulation von T- und B-Lymphozyten und Antigen-präsentierenden Zellen in der Pleura-Höhle von C3H/HeN CCL17+/- und CCL17-/- 10, 20 und 30 Tage nach natürlicher Infektion mit L. sigmodontis (dargestellt als prozentualer Anteil aller lebenden Zellen). ......................................................................................................... 41 Prozentuale Anteile von CD4+ T-Zellen, CD8+ T-Zellen, B-Zellen, Makrophagen und DCs in der Pleura-Kavität von C57BL/6 CCL17+/- und CCL17-/- 30 Tage nach Infektion mit L. sigmodontis. ....................................................................................... 42 Prozentuale Anteile von CD4+ T-Zellen, CD8+ T-Zellen, CD4+CD25+ T-Zellen, B-Zellen und Makrophagen in der Pleura-Höhle von C57BL/6 CCR4-/- und Wildtypmäusen 10 Tage nach Infektion mit L. sigmodontis. ...................................... 45 Zytokin-Level (ng/ml) in der Pleura-Spülung von CCL17+/- und CCL17-/- Mäusen 10, 20 und 30 Tage nach natürlicher Infektion mit L. sigmodontis. ............................ 45 97 Danksagung Meinem Doktorvater Herrn Professor Dr. Achim Hörauf möchte ich herzlich dafür danken, dass er mir diese Arbeit am Institut für medizinische Mikrobiologie, Immunologie und Parasitologie in Bonn ermöglichte und mich über diese lange Zeit hinweg unterstützt und geleitet hat. Herrn Professor Dr. Waldemar Kolanus danke ich sehr für die Übernahme der Betreuung meiner Doktorarbeit. Mein Dank gilt auch Herrn Professor Dr. Gerhard von der Emde und Frau PD Dr. Gerhild van Echten-Deckert für ihre Teilnahme in der Prüfungskommission. Ich danke dem Sonderforschungsbereich 704 für die finanzielle und fachliche Unterstützung der Arbeit. Mein besonderer Dank gilt meiner Betreuerin Dr. Sabine Specht, die mir mit Rat und Tat zur Seite gestanden hat, mich stets unterstützte und mir ein erfolgreiches Ende der Arbeit ermöglicht hat. Mein Dank gilt auch Dr. Coralie Martin und Dr. Tarik Attout für ihre Unterstützung bei meiner Arbeit. Egal ob es sich um wissenschaftliche Fragestellungen handelte oder um einfach mal ein freundliches Gespräch, so möchte ich mich bei all meinen Kollegen bedanken, die mich während meiner Arbeit begleitet und unterstützt haben: besonders Sebastian, Kathrin, Susanne, Sandy, Daniel, Salem, Sridhar, Uta, Bettina, Sonja, Claudia, Laura, Özlem, Anna, Kim, Tomabu, Corinna, Alex, Ken, Judith, Katrin, Laura, Tobias, Theo und all den anderen… Und schließlich möchte ich mich hiermit noch einmal herzlich bei meinem Sven und meiner Familie bedanken! Danke Euch allen!