Hyperthermie – Hitzeschock für Tumoren
Werbung

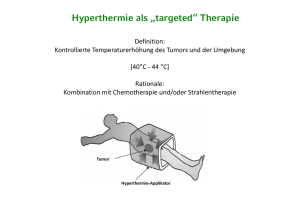
Forschung am Krankenbett Hyperthermie Hyperthermie – Hitzeschock für Tumoren Mit seinen Arbeiten zum Nutzen der regionalen Tiefenhyperthermie (RHT) für die Krebstherapie begann Prof. Rolf Issels, Leiter der Klinischen Kooperationsgruppe „Hyperthermie“ in der GSF, bereits Mitte der 80er Jahre. Seit 1993 wird die RHT als Behandlungsmethode im Rahmen eines Modellvorhabens von den Krankenkassen durchgeführt. 1999 wurde die KKG gegründet, deren Forschungsspektrum von der klinischen Forschung zur Tiefenhyperthermie bis hin zur biologischen Forschung auf dem Gebiet der Immunologie und der Zellbiologie reicht. rhöhte Körpertemperaturen versetzen Zellen in Stress, auch Tumorzellen: Werden diese mit Hilfe elektromagnetischer Wellen auf 40-44 Grad Celsius erwärmt, beginnt ab 42 Grad Celsius das kollektive Absterben der Zellen. Temperaturen über 40 Grad machen Tumorzellen angreifbarer für natürliche Abwehrprozesse und E 10 Strahlen- oder Chemotherapie. „Aufgrund des Abtransports von Wärme aus gut durchbluteten Stellen können wir den Tumor zwar nicht gleichmäßig erhitzen,“ erläutert Professor Rolf Issels, Leiter der Klinischen Kooperationsgruppe Hyperthermie. „Die durchbluteten Bereiche werden aber dafür von Zytostatika besonders gut erreicht.“ Forschung am Krankenbett Hyperthermie Symbiose von biologischer Forschung und Klinik Ganz im Sinne des translationalen Forschungsansatzes der GSF haben nicht nur die rein klinischen Untersuchungen, sondern auch zugehörige biologische Forschungsaspekte in der Klinischen Kooperationsgruppe „Hyperthermie“ einen hohen Stellenwert. Verschiedene Arbeitsgruppen konzentrieren sich vor allem auf zwei Bereiche: Den Einfluss von Hitzeschockproteinen auf das Immunsystem und die Liposomenforschung. Hitzeschockproteine – Aktivatoren des Immunsystems Biologisch bedeutet eine Behandlung mit Hyperthermie, dass im Tumor Hitzeschockproteine (HSP), auch Stressproteine genannt, induziert werden. Sie sind für die Krebsforschung interessant, weil sie auf verschiedene Weise in das körpereigene Immunsystem eingreifen. Unter anderem markieren sie Tumorzellen und machen sie für die Killerzellen des Immunsystems erkennbar. Zellen, die HSP bilden, können daher stärker von den Killerzellen zerstört werden und das Immunsystem kann den Tumor wirksamer bekämpfen. Issels und seine Mitarbeiter fanden bei ihren Untersuchungen, dass die Induktion des Proteins HSP 70 die Immunantwort gegen den Tumor auf zweierlei Weise verstärkt. Zum einen wirkt HSP 70 als Gefahrensignal für natürliche Killerzellen und für dendritische Zellen, wodurch deren Vermehrung und zytotoxische Aktivität verstärkt wird. Zusätzlich zu dieser Zytokin-Funktion konnte mit HSP 70 aus humanen Melanomzellen auch eine antigenspezifische T-Zellantwort erreicht werden: Werden HSP-Komplexe aus den Melanomzellen isoliert und auf dendritische Zellen gegeben, dann reifen diese aus zu Antigen-präsentierenden Zellen (APC), die Antigene so verarbeiten und auf ihrer Zelloberfläche vorführen, dass sie von den T-Zellen erkannt werden können. Die Untersuchungen zu den dendritischen Zellen wurden in enger Kooperation mit Dr. Elfriede Nössner vom GSF-Institut für Molekulare Immunologie durchgeführt. Liposomen als Fähren Das zweite wichtige Standbein der biologischen Forschung in der KKG „Hyperthermie“ sind Liposomen. Diese künstlichen Kügelchen aus Phospholipiden, in die Wirkstoffe eingebracht werden können, sind „höchst interessant“, schwärmt Issels. In Zusammenarbeit mit dem MPI für biophysikalische Chemie in Göttingen gelang es seinem Mitarbeiter Dr. Lars Lindner, thermoempfindliche Liposomen herzustellen, die sich bei ganz bestimmten Temperaturen (41-42°C) öffnen und ihren Inhalt freigeben. Der Therapie mit Hyperthermie eröffnen sich dadurch ungeahnte Möglichkeiten: Hochtoxische Zytostatika könnten mit den Liposomen zum Tumor gebracht und dort durch Erwärmung gezielt freigesetzt werden. Dies wird für die KKG-eigenen Liposomen am Modell des amelanotischen Melanoms beim syrischen Goldhamster untersucht. Am selben Modell wird neuerdings auch eine weitere Einsatzmöglichkeit für die Liposomen geprüft: Temperaturempfindliche Liposomen, die mit einem Kontrastmittel gefüllt sind, sollen die Temperaturkontrolle während der Hyperthermie-Behandlung vereinfachen. Wird das Kontrastmittel bei definierten Temperaturen freigesetzt und im Kernspin sichtbar, könnte die invasive Temperaturkontrolle über Sonden überflüssig werden. Dies wäre eine wesentliche Erleichterung für die Patienten, denn es würde „eine richtige nicht-invasive Temperaturmessung erlauben, nicht nur das Monitoring von Hot Spots“, blickt Issels in die Zukunft. Jüngst erhielt die Arbeitsgruppe von Lindner einen Preis beim Münchener Businessplan-Wettbewerb. Klinik und Labor befruchten sich „Mit den klinischen Untersuchungen und der gleichzeitigen Anbindung an die Grundlagenforschung ist die KKG ein ideales Instrument translationaler Forschung“ bilanziert Issels. „Ich glaube, dass gerade die Einrichtung dieser KKG für das Vorankommen einer neuen Behandlungstechnik mit allen Facetten der Forschung hier ganz entscheidend war.“ 11 Forschung am Krankenbett Hyperthermie Neue Form der Teilkörperbehandlung Prof. Rolf Issels, Leiter der Klinischen Kooperationsgruppe „Hyperthermie“ in der GSF, begann als einer der Pioniere auf seinem Gebiet erstmals 1986 mit Arbeiten zum Nutzen der regionalen Tiefenhyperthermie (RHT) für die Krebstherapie. Kontakt Prof. Dr. Rolf Issels GSF-Institut für Molekulare Immunologie KKG „Hyperthermie“ Tel.: 0 89/70 95-47 69 rolf.issels@ med.uni-muenchen.de 12 Issels begann als einer der Pioniere auf diesem Gebiet erstmals 1986 mit seinen Arbeiten zum Nutzen der regionalen Tiefenhyperthermie (RHT) für die Krebstherapie. Als Modelltumoren dienten Issels von Anfang an Weichteil- und Knochentumoren, die vom Binde- und Stützgewebe ausgehen und als Sarkome bezeichnet werden. Im klinischen Bereich interessierte Issels und seine Mitarbeiter besonders, wann ein bestimmtes Weichteilsarkom durch die Kombination von Hyperthermie mit anderen Therapiemethoden besser behandelbar ist. An HochrisikoWeichteilsarkom-Patienten wurde eine Phase-III-Studie begonnen, die zeigen soll, ob bei diesen tief lokalisierten, großen Tumoren die Kombination von Hyperthermie und Chemotherapie die Heilungschancen im Vergleich zu alleiniger Chemotherapie verbessert. Eine vorangegangene Phase-II-Studie brachte hierzu ermutigende Ergebnisse: Es zeigte sich, dass Patienten, die auf die Hyperthermiebehandlung ansprechen, eine signifikant höhere Chance haben, nach einem Zeitraum von fünf Jahren tumorfrei zu leben. Issels übertrug das bei den Sarkomen erworbene Wissen mittlerweile auch auf Dick- und Enddarmkrebs sowie zuletzt auf das Pankreaskarzinom im lokoregional fortgeschrittenen Stadium. Auch hier wird untersucht, ob die Kombination von Chemotherapie bzw. Radiochemotherapie und Hyperthermie den Therapieerfolg verbessert. Für diese im Bauch oder im Becken sitzenden Tumoren besitzt die KKG ein neuartiges Hybridsystem, das aus dem Hyperthermiegerät und einem Kernspintomographen besteht. Mit diesem System kann der gesamte Bereich vom Becken bis unterhalb der Lunge auf einmal erwärmt werden. Mit Hilfe des Kernspintomographen wird dabei gleichzeitig verhindert, dass in so genannten „Hot Spots“ gesundes Gewebe durch zu hohe Temperaturen geschädigt wird. „In Deutschland sind unsere KKG im Klinikum Großhadern und die Charité in Berlin die einzigen Zentren, die als Modellvorhaben die Teilkörperhyperthermie durchführen“, berichtet Issels stolz. Unter Leitung der GSF wurde zwischen beiden Zentren über den Impuls- und Vernetzungsfonds der Helmholtz-Gemeinschaft für vorerst drei Jahre ein „Virtuelles Institut der Exzellenz“ eingerichtet. Im SIGMA-EYE-MR-Applikator, einem Hybridsystem aus Hyperthermiegerät und Kernspintomograph, erhalten Tumorpatienten Teilkörperbehandlungen. Die GSF ist neben der Charité in Berlin die einzige Einrichtung, die diese erweiterte Methode zur Verfügung stellt.